Descubrimiento del MHC - Facultad de Medicina
Anuncio

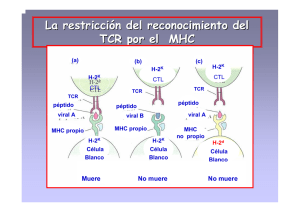
Cátedra de Bioquímica – Facultad de Medicina - UNNE COMPLEJO MAYOR DE HISTOCOMPATIBILIDAD Universidad Nacional del Nordeste Facultad de Medicina Cátedra de Bioquímica Brandan, Nora Profesora Titular. Cátedra de Bioquímica. Facultad de Medicina. UNNE. Aquino Esperanza, José Ayudante Alumno por Concurso. Cátedra de Bioquímica. Facultad de Medicina. UNNE. Fortuny, Lisandro Ayudante Alumno por Concurso. Cátedra de Bioquímica. Facultad de Medicina. UNNE. Descubrimiento del MHC – HLA Organización de los genes del MHC Estructura de las moléculas del MHC Propiedades de las moléculas del MHC Moléculas de clase I del MHC Molécula de clase II del MHC Características de la interacción entre el péptido y la molécula del MHC Expresión de las Moléculas del MHC Biología molecular del procesamiento de los antígenos Procesamiento de antígenos citoplasmáticos y asociación a moléculas de clase I Procesamiento de antígenos extracelulares y asociación a moléculas de clase II Cátedra de Bioquímica – Facultad de Medicina - UNNE Vía alterna de procesamiento de antígenos exógenos y asociación a moléculas de clase I. Aplicación clínica: Inmunología de los transplantes Bibliografía Descubrimiento del MHC – HLA El interés y la curiosidad respecto a este tema surgieron al observarse el rechazo a tejidos transplantados en ratones de laboratorio. En la década de 1940 George Snell y colaboradores realizaron estudios para analizar el rechazo a implantes entre ratones de distintas cepas y ratones de la misma cepa. Para realizar esto, primero debían crear cepas endogámicas, es decir, que posean la misma secuencia de ácidos nucleicos en todos los alelos del genoma, esto lo obtuvieron entrecruzando hermanos, y luego de veinte generaciones finalmente fue posible establecer cepas genéticamente idénticas. Cuando se transplanta un tejido o un órgano, pueden ocurrir dos cosas, que el sistema inmunitario reaccione en contra de este y lleve al rechazo, o que sea aceptado. En el experimento de Snell, cuando se realizaron injertos de piel entre las cepas endogámicas, el órgano fue aceptado. Mientras que en los injertos a las cepas distintas fueron rechazados. Este estudio nos lleva a la conclusión, que el reconocimiento de un tejido como propio o extraño es un carácter hereditario. Además que los genes encargados de esto varían de un individuo a otro. Esta idea seria atribuible al polimorfismo de los genes encargados del reconocimiento tisular. Cuando hablamos de polimorfismo, hacemos referencia al hecho que si bien, todos los ratones poseen los genes del reconocimiento de lo propio de lo extraño, existen variaciones entre cada cepa, es decir formas alternativas de expresarse, o variantes de una frecuencia estable dentro de una población. A este grupo de genes polimorficos, que determina la compatibilidad de tejidos entre individuos, se los denomino “genes de histocompatibilidad”. En estudios posteriores se trato de ubicar que gen era el encargado del rechazo a injertos, y se descubrió que no era solo uno, al contrario era un grupo de genes. A este sector del genoma, que contiene los genes del reconocimiento de tejido se los denomino “Complejo mayor de histocompatibilidad” (MHC major histocompatibility complex ). Cátedra de Bioquímica – Facultad de Medicina - UNNE Durante mas de 20 años, el único rol que se la asignaba al MHC era el de rechazo a injertos, esto era un problema para el entender de los inmunólogos, debido a que el transplante de tejidos no es un fenómeno natural, entonces, ¿para que el genoma se reservaría grandes segmentos génicos? Durante las decadas de 1960 y 1970 se descubrió la gran importancia de los genes del MHC en las respuesta inmunitaria frente a antígenos proteicos, los genes encargados de estas respuestas se ubican en el MHC. De hecho, el MHC codifica diferentes moléculas que difieren en su capacidad para interactuar con los péptidos extraños. En cuanto a los seres humanos, el descubrimiento del MHC humano, llamado HLA ( Human leukocyte antigen ), se llevo acabo a través de estudios de transfusiones sanguíneas y transplantes de órganos, ya que no se puede realizar en las personas los experimentos llevado a cabo con los ratones. Jean Dausset, Jan Van Rood y colaboradores demostraron que los pacientes que rechazan los transplantes de riñón presentan elevadas concentraciones de anticuerpos en el suero dirigidos hacia los leucocitos del donante. A este suero que reacciona en contra de células de individuos alogenéticos (expresión de alelos diferentes) se lo conoce como aloantisuero, y se dice que contiene aloanticuerpos que están dirigidos contra los aloantígenos. Se supuso que, al igual que en los ratones estos eran genes polimorficos que variaban de un individuo a otro. Así se estudiaron a familias completas en busca de armar el mapa del locus del HLA. Los primeros genes que se descubrieron, por técnicas exclusivamente serologícas, fueron HLA-A, HLA-B y HLA-C. Luego a través de técnicas de “Reacción leucocitaria mixta” (MLR) se vio que, los leucocitos del receptor reaccionaban frente a los leucocitos del donante. El primer gen que se identifico con esta técnica se encontraba adyacente al locus del HLA, por lo que se denomino HLA-D, luego se identifico a la molécula de este gen y se la bautizo HLA-DR (HLA-D related ). Finalmente se descubrieron dos genes más y se los llamaron HLA-DQ y HLA-DP. La nomenclatura internacional aceptada del MHC y de las proteínas que codifican se basa en la homología de la secuencia y la estructura, siendo aplicable a todos los vertebrados. Así los genes identificados en el rechazo a injertos en los ratones y los identificados serologicamente en humanos (HLA-A, HLA-B, HLAC) se los agrupa bajo el nombre de genes de clase I del MHC , en tanto los genes de la respuesta inmunitaria de los ratones y los genes humanos detectados por MLR (HLA-DP, HLA-DQ, HLA-DR) se conocen como genes de clase II Cátedra de Bioquímica – Facultad de Medicina - UNNE del MHC. Todos estos genes, se encuentran ubicados en el brazo corto del cromosoma 6 y se expresan de modo codominante. De esta manera amplia aun mas la diversidad. Actualmente se sabe que existen diferencias individuales respecto a los alelos del HLA y que son determinantes importantes de la reacción frente a tejidos extraños, así como en la activación linfocitaria. Organización de los genes del MHC En los seres humanos los genes del MHC se ubican en el brazo corto del cromosoma 6 y ocupan un segmento del ADN bastante extenso, alternando entre genes, segmentos de ADN no codificante (fig.1). Los genes de clase I del MHC, están ubicados en la posición más telomerica del HLA. Mientras que los genes de clase II son más centromericos. Entre los grupos Cátedra de Bioquímica – Facultad de Medicina - UNNE de genes de clase I y II se encuentran otro grupo que codifican ciertas proteínas del complemento y tres citoquinas estructuralmente relacionadas (TNFα, LTβ y LT), a este grupo se los denomino genes de clase III del MHC. Los genes clase I del MHC, HLA-A, HLA-B y HLA-C sintetizan las moléculas de clase I del MCH, (verse mas adelante la estructura completa de la molécula de clase I del MHC) encargadas de presentar a los antígenos peptídicos a los Linfocitos T CD8+. Dentro de la región I también encontramos otros genes de polimorfismo muy bajo o nulo conocidos como class I-like genes (HLA-F, HLAG, HLA-H, HLA-E, HLA-J y HLA-X). La función de estos class I-like genes no es conocido pero se cree que sirven como repertorio de secuencias de codificación, que pueden ser utilizadas para generar nuevas secuencias polimorficas en las moléculas de clase I y II por un proceso conocido como conversión génica . En este proceso una porción del ADN de un gen es reemplazado por una secuencia de otro de una manera no reciproca. De hecho el gran polimorfismo de los genes del MHC es debido a conversiones génicasy no a mutaciones . En cuanto al locus del MHC II, se encuentran los genes HLA-DP, HLA-DQ y HLA-DR, que sintetizan las moléculas de clase II del MHC cuya función consiste en presentar a los antígenos peptídicos a los Linfocitos T CD4+. Dentro del locus de la clase II se encuentran también genes que codifican varias proteínas encargadas del procesamiento del antígeno. Una de ellas es el heterodimero TAP (transportador asociado con el procesamiento del antígeno), encargado de transportar los péptidos desde el citosol al interior del retículo endoplasmico (estas funciones se verán mas adelante). Otros genes codifican subunidades del proteasoma. Y además de estos, ubicamos aquí en el locus del MHC II a un par de genes que codifican la proteína HLA-DM que esta involucrada en la unión del péptido a la molécula de clase II (ver mas adelante). Estructura de las moléculas del MHC Si bien las moléculas de clase I y II son funcionalmente diferentes, existen características estructurales similares que consideramos de gran importancia para comprender su unión al péptido y el reconocimiento por parte de los linfocitos T. Propiedades de las moléculas del MHC Cátedra de Bioquímica – Facultad de Medicina - UNNE • Todas las moléculas del MHC poseen 4 segmentos. Un segmento de unión al péptido o hendidura, un dominio tipo Inmunoglobulina (Ig), un segmento transmembrana y una porción citoplasmática carboxi-terminal. • El sector polimorfico de las moléculas del MHC se encuentran en la hendidura de unión a péptido. Esta se encuentra formada por dos segmentos en hélice α separados por un “piso” creado por una secuencia en lamina plegada β. Los aminoácidos que varían de un alelo a otro generando el polimorfismo que caracteriza al MHC se ubican alrededor de esta hendidura. Debido a esta gran variabilidad en la región de unión al péptido el MHC puede cubrir la amplia gama de antígenos a los que nos encontramos expuestos. • Los dominios tipo Ig no son polimorficos y participan en el reconocimiento del MHC por parte de los linfocitos T. Los dominios tipo Ig del MHC I son distintos a los del MHC II, ya que, son estos segmentos los cuales la molécula CD8 y CD4 reconocen respectivamente Moléculas de clase I del MHC La molécula de clase I esta constituida por dos cadenas polipeptídicas unida de forma no covalente. La cadena α ó cadena pesada, codificada por los genes de clase I del MHC y una cadena no codificada por el MHC, la β 2 -microglobolina o cadena liviana, cuyo gen se encuentra en el cromosoma 15 (fig 2). La cadena α posee tres segmentos que se numeran desde el extremo N-terminal, α1, α2, y α3. Los segmentos α1 y α2 interactúan separados por un segmento de en lamina plegada β para formar el sitio de unión al péptido. Este espacio creado es lo suficientemente grande para que quepan péptidos entre 8 a 11 aminoácidos. El segmento α3 se pliega para formar un dominio tipo Ig, este segmento contiene un bucle que sirve de unión a la molécula CD8. Cátedra de Bioquímica – Facultad de Medicina - UNNE La cadena liviana β 2 -microglobulina interactúa de modo no covalente con el segmento α3, y al igual que este se pliega en un dominio tipo Ig. La molécula de clase I completamente ensamblada es un heterotrimero, formado por la cadena α, la β 2 -microglobulina y el péptido. En esta conformación la molécula se encuentra estable en la membrana celular. Todo individuo normal heterocigoto expresa seis moléculas de clase I diferentes en cada célula, ya que contienen cadenas α derivadas de los seis alelos de los genes HLA-A, HLA-B y HLA-C. Tres alelos heredados de la madre y tres del padre. Molécula de clase II del MHC Las moléculas de clase II del MHC esta compuesta por dos cadenas asociadas de modo no covalente, la cadena α y la cadena β, a diferencia de las moléculas de clase I, son sintetizadas por genes del MHC. Cátedra de Bioquímica – Facultad de Medicina - UNNE La cadena α y la cadena β poseen segmentos que se nombran desde su extremo N-terminal en α1, α2 y β1, β2. En esta molécula los sitios de unión al péptido se encuentran entre los segmentos α1 y β1, el espacio que surge de esta relación de dos cadenas polipeptídicas distintas es mayor que el que forman los segmentos α1 y α2 del MHC I, esto trae como consecuencia que, los péptidos antigénicos que se unan al MHC II posean entre 10 a 30 residuos o incluso mas (fig 3). Las secuencias polimorficas de las moléculas de clase II se ubican alrededor de los segmentos α1 y β1 e inclusive entre ambos, pero se ha demostrado que existe mayor polimorfismo en los sectores β1. En tanto que los segmentos α2 y β2 se pliegan formando dominios tipo Ig. Los bucles formados por las secuencias β2 son el sitio de unión a la molécula CD4 de los Linfocitos T colaboradores. En similitud con las moléculas de clase I, el MHC II completamente ensamblado y estable es un heterotrimero, constituido por la cadena α, la cadena β y el péptido. Existen en un individuo normal heterocigoto, seis alelos para la cadena α y seis para la cadena β, lo que nos daría como resultado un total de doce posibles variantes en la molécula del MHC II, sin embargo existen cadenas α provenientes del alelo HLA-DQα que no necesariamente se aparean con las cadenas β del alelo HLA-DQβ, si no que pueden asociarse a cadenas β de otros alelos (HLA-DPβ, Cátedra de Bioquímica – Facultad de Medicina - UNNE HLA-DRβ, etc.). Este mecanismo permite la existencia de alrededor de 10 a 20 moléculas de clase II. Características de la interacción entre el péptido y la molécula del MHC • Las moléculas del MHC muestran una amplia especificidad para unirse a los péptidos. Esto no es una sorpresa ya que solo poseemos unas 6 moléculas de MHC I y de 10 a 20 moléculas de clase II, ambas encargadas de presentar a los linfocitos T a todos los antígenos a los cuales nos encontramos expuestos. De Cátedra de Bioquímica – Facultad de Medicina - UNNE hecho la especificidad de la unión la proporciona el TCR (receptor de las células T), es este quien proporciona especificidad y no el MHC. Recordemos que el TCR reconoce tanto al péptido como a la molécula del MHC. • El péptido que se una a la molécula del MHC presenta determinadas características que favorecen a la interacción. Una de ellas es el tamaño, los péptidos que interactúan con el MHC I deben estar compuestos por 8 a 11 residuos, mientras que los péptidos que sean presentados por el MHC II poseen de 10 a 20. Además de esto, los péptidos que se unen a una molécula del MHC en particular presentan secuencias de aminoácidos que permiten interacciones complementarias entre ambos. Otra característica de gran importancia respecto a la estructura del péptido, se refiere a que, para ser capaz de activar a un Linfocito T, además de poder encajar en la hendidura de la molécula del MHC y de poseer secuencias aminoacidicas que interaccionen con este, también debe contener secuencias que puedan ser reconocidas por el TCR. • La velocidad de asociación del péptido al MHC es muy baja, pero la velocidad de disociación es aun mas baja. En una solución los péptidos tardan entre 15 a 30 minutos en establecer una unión estable con la molécula del MHC, pero una vez unidos tardan horas e incluso días en disociarse, proporcionando el tiempo suficiente para que en el transcurso de disociación pueda interactuar con un linfocito T. Las asociaciones de los péptidos a las moléculas del MHC son saturables y de baja afinidad. • Otra característica de gran importancia de las moléculas del MHC es que pueden presentar tanto antígenos exógenos como propios. La presentación de antígenos propios por parte del MHC es de gran valor durante la maduración de linfocitos T en el timo, lugar en el que se realiza un proceso conocido como “selección positiva”, en donde los timocitos (Linfocitos T inmaduros) cuyos TCR reconozca con baja afinidad a los MHC unidos a péptidos propios son estimulados a continuar con su maduración, en tanto los timocitos que reconozcan con alta afinidad a los MHC unidos a los péptidos propios, y que reaccionen contra estos, son estimulados a la apoptosis. Este es un principio de gran trascendencia en la maduración de los Linfocitos T, ya que solo se permite la supervivencia de los que no reaccionen contra el organismo, de otra manera se generarían linfocitos T que reaccionen contra nuestro propio cuerpo. • Los péptidos se unen a las moléculas del MHC de forma no covalente. Estos poseen secuencias de “anclaje” que interactúan con “bolsillos” ubicados en el suelo de la hendidura creados por las secuencias en lámina plegada β. Pero no todos los péptidos poseen secuencias de anclaje, en especial los que se unen a las Cátedra de Bioquímica – Facultad de Medicina - UNNE moléculas de clase II, estos establecen enlaces tipo puente de hidrogeno con las hélices α (fig 4). Expresión de las Moléculas del MHC Las moléculas de clase I del MHC se expresan constitutivamente en todas las células nucleadas. Este patrón de expresión esta íntimamente relacionado con las funciones de los linfocitos T CD8+, quienes al reconocer a los péptidos presentados por las moléculas de clase I se activan y lisan a la célula que se encuentre infectada por un microorganismo endógeno (en este caso cuando decimos “endógeno” hacemos referencia a intracelular). Este es un mecanismo de defensa muy efectivo para las células nucleadas infectadas, ya que no pueden migrar como lo hacen las APC profesionales (verse mas adelante), por lo tanto la única manera de hacer saber al sistema inmunológico que se encuentran afectadas es esta. Las moléculas de clase II del MHC solo se expresan a un grupo celular denominado “células presentadoras de antígeno” (APC antigen presenting cells ). En este repertorio celular se encuentran los Linfocitos B, Macrófagos y principalmente las células Dendríticas (fig 5). Estas células son capaces de reconocer, fagocitar, procesar y luego presentar en su superficie celular a los péptidos exógenos unidos a las moléculas de clase II (este mecanismo se explica mas adelante). Las APC poseen además la capacidad de poder migrar de un tejido a otro en busca de los Linfocitos T CD4+, este es el caso de las células dendríticas, que pueden migrar desde la piel hasta los ganglios linfáticos y así poder activar a los CD4+. Otra forma de establecer el contacto entre las APC y los T CD4+, es que estos últimos migren al sitio afectado en donde los Macrófagos presentan el péptido y activan a las CD4+. El fin ultimo de las moléculas de clase II es poder presentar antígenos exógenos, mientras que las moléculas de clase I presentan a los antígenos endógenos. La expresión de las moléculas tanto de clase I como de clase II, se ven afectadas por las citoquinas secretadas tanto en la inmunidad innata como en la inmunidad adaptativa. Los INFα, β, y γ son secretados en la respuesta inmunitaria temprana frente a los virus, en tanto el TNF (factor de necrosis tumoral) y las LT (Linfotoxinas) se Cátedra de Bioquímica – Facultad de Medicina - UNNE liberan en las infecciones microbianas. Todas estas citoquinas aumentan significativamente la expresión de las moléculas de clase I. Este es un mecanismo en que la inmunidad innata estimula a la inmunidad adaptativa. Las moléculas de clase II son reguladas principalmente por el INFγ, esta citoquina es la mas importante activadora de macrófagos, y estos una ves activados aumentan la expresión de moléculas del MHC. Los Linfocitos B expresan constitutivamente MHC II, pero pueden aumentar la expresión bajo el estimulo de IL-4. Mientras que las células dendríticas aumentan la expresión a medida que maduran. El hecho que las APC expresen mayor o menor cantidad de moléculas se relaciona con la tasa de transcripción del MHC. Este efecto esta mediado por la unión de factores de transcripción, activados por citoquinas, a las secuencias promotoras de los genes del MHC. Varios factores de transcripción se ensamblan y luego se unen a una proteína denominada Activador de transcripción de clase II (CIITA class II transcriptor activator ), este complejo se une al promotor y así modula la transcripción. El CIITA es sintetizado en presencia de INFγ, de esta manera explicamos el fundamental rol del INFγ en la expresión del MHC II. El INFγ regula además de la expresión de las moléculas de clase II, a las moléculas de clase I, a la β 2 -microglobulina, a los genes que regulan la expresión de las proteínas TAP y los genes que codifican las subunidades del proteasoma. Cátedra de Bioquímica – Facultad de Medicina - UNNE Biología molecular del procesamiento de los antígenos Las vías de procesamiento de los antígenos convierten a proteínas extracelulares o citoplasmáticas en péptidos, que luego son unidos a las moléculas del MHC y presentados en la membrana celular. La vía celular de procesamiento de antígenos ha sido diseñada para generar péptidos que posean las características estructurales para unirse a las moléculas del MHC. Cabe señalar que la unión del péptido a las moléculas del MHC se realiza antes de que estas se expresen en membrana, debido que es esta la conformación estable de la molécula. Como se ha mencionado con anterioridad y se explicara con mas detalle a continuación, los péptidos exógenos son internalizados, procesados, expresados en la superficie celular unidos a moléculas de clase II del MHC y reconocidos por los Linfocitos T CD4+, mientras que los péptidos endógenos son presenentados unidos a moléculas de clase I a los Linfocitos T CD8+. Actualmente se ha observado que algunas moléculas de clase I se encuentran asociadas a péptidos exógenos y que los presentan a los CD8+. A esta nueva vía que permite que las moléculas de clase I expresen péptidos exógenos se la conoce como “Procesamiento alterno del MHC I”. Los detalles completos de esta nueva vía no se conocen aun, pero aquí mencionaremos los pasos hasta ahora Cátedra de Bioquímica – Facultad de Medicina - UNNE descriptos. Se pone en conocimiento del lector que esta es una vía que se halla en fase de estudio, descripción, y se encuentra sujeta a cambios. Procesamiento de antígenos citoplasmáticos y asociación a moléculas de clase I Las vías de procesamiento y presentación de antígenos por moléculas de clase I es útil para la defensa frente a virus, bacterias intracelulares y células tumorales. Estos péptidos asociados a moléculas de clase I son producidos por degradación citosólicas, luego transportadas al retículo endoplasmico donde se unen a las moléculas de clase I en formación y finalmente se expresan en la membrana (fig 6). A continuación se describen con detalles estos pasos. • Degradación proteolítica en el citoplasma Cátedra de Bioquímica – Facultad de Medicina - UNNE El mecanismo por el cual se generan la mayor cantidad de péptidos antigénicos citoplasmáticos es a través del proteasoma. Este un complejo multienzimatico, que reconoce a proteínas intracelulares, que hayan sido “marcadas” por un pequeño polipéptido denominado Ubiquitina. Luego de la Ubiquitinizacíon, las proteínas se despliegan e ingresan al proteasoma, quien las degrada a pequeños péptidos capaces de interactuar con las moléculas del MHC I. Existe amplia evidencia que demuestran la importancia de la degradación proteosomal de las proteínas para ingresar en la vía del MHC I. Inhibidores específicos de la función del proteasoma, bloquean la presentación de proteínas citoplasmáticas por el MHC I a Linfocitos T CD8+ específicos para el epítope del péptido de una proteína en particular, sin embargo también se ha demostrado, que si el péptido es sintetizado en el citoplasma y no obtenido por proteolisis, la inhibición del proteasoma no obstaculiza y el péptido puede ser presentado igual. Estos estudios resaltan la importancia del proteasoma para la fragmentación de proteínas en pequeños péptidos que luego se incorporan a las moléculas del MHC I, pero, en casos donde el péptido ya existes como tal, el rol del proteasoma no es vital para la vía. • Transporte de los péptidos del citoplasma al retículo endoplasmico Debido a que las moléculas de clase I son sintetizadas en retículo endoplasmico (ER) y los péptidos se encuentran en el citoplasma, debe existir un mecanismo que transporte estos péptidos al interior de ER. Esta función es suplida por las proteínas TAP (transportador asociado al procesamiento de antígeno). Estas proteínas son un heterodimero, cuyos genes, TAP 1 y TAP2, se ubican en la región II de los genes del MHC. Las proteínas TAP se ubican en la membrana del ER, donde median un transporte activo-ATP-dependiente, de los péptidos desde el citosol a la luz de ER. En su extremo luminal, las proteínas TAP se encuentran unidas de modo no covalente a las moléculas del MHCI nacientes, por una proteína denominada “tapasina”, de esta manera se mantienen espacialmente cerca, de modo que, cuando las TAP internalizan al péptido, automáticamente este se encuentre con las moléculas de clase I y puedan unirse. • Ensamblaje del péptido a las moléculas de clase I La síntesis y el ensamblaje de de las moléculas de clase I, es un proceso de múltiples etapas, en sonde la unión del péptido juega un papel crucial. Cátedra de Bioquímica – Facultad de Medicina - UNNE En el interior del ER se sintetizan la cadena α y la β2-microglobulina. También encontramos en el sector luminal del ER a proteínas chaperonas como la “calnexina” y la “calreticulina”, que se encargan del correcto plegamiento de las cadenas α. Una ves que el péptido ha ingresado vía TAP se une a la molécula del MHC I naciente, ahora este complejo péptido-MHC I se encuentra en una conformación estable que se libera de las tapasina y se encuentra disponible para expresarse en la membrana. Cabe plantearse la cuestión de: ¿Cómo es posible que el péptido que ingresa al ER no se una a las moléculas de clase II, que también están siendo sintetizadas en el ER? en caso de que estemos hablando de una APC. Esto no es posible por dos motivos: uno de ellos es que las moléculas de clase I se encuentran unidas a las TAP por las tapasinas, y de esta manera cuando el péptido ingrese ya toma contacto con el MHC I. Otro mecanismo, como se vera mas adelante, es que las moléculas de clase II mantienen cubierto su sitio de unión al péptido en el ER por una proteína denominada “cadena invariante” (Ii). • Expresión del complejo péptido-MHC I en la superficie celular. Como se ha mencionado, la conformación estable del MHC I, se logra cuando este se encuentra unido al péptido. Este complejo se vehiculiza a través del ER y el Golgi hasta llegar a la membrana celular por vesículas exocíticas. Una vez ubicados en la membrana la molécula del MHC I puede ser reconocida por los Linfocitos T CD8+. Procesamiento de antígenos extracelulares y asociación a moléculas de clase II El origen de los péptidos unidos a las moléculas de clase II incluye, la degradación de las proteínas internalizadas en vesículas y la unión de los péptidos a las moléculas de clase II dentro de estas (fig 7). Este mecanismo difiere en varios aspectos en referencia al procesamiento de los péptidos unidos a las moléculas de clase I, no solo por su mecanismo “vesicular” o “vacuolar”, si no además en la manera en que el péptido logra unirse a las moléculas de clase II • Captura de proteínas extracelulares en compartimientos vesiculares por las APC. Cátedra de Bioquímica – Facultad de Medicina - UNNE Las células dendríticas y los macrófagos poseen una variedad de receptores que, permiten reconocer estructuras compartidas por muchos tipos de microorganismos, e inducen la fagocitosis. Los macrófagos expresan “receptores de manosa”, quienes reconocen los residuos de manosa y fucosa de las glucoproteinas y glucolipidos bacterianos. Asimismo los “receptores de las porción Fc” de los anticuerpos, a través de los cuales pueden reconocer y fagocitar a los microorganismos o proteínas recubiertas de anticuerpos. Como también los “receptores para opsoninas”, por ejemplo, los receptores para el fragmento C3b del complemento. Los Linfocitos B pueden reconocer y fagocitar antígenos proteicos a través del “receptor de las células B” (IgM junto con las cadenas Igα e Igβ). Una vez que el antígeno fue reconocido, es internalizado en vesículas denominadas “endosomas”. Estos compartimientos intracelulares contienen un pH ácido y es rico en enzimas proteolíticas. La vía endosomal continua con la posterior unión del endosoma a un lisosoma, quien posee un contenido enzimático aun mayor. • Procesamiento de las proteínas en las vesículas endosómicas y lisosomicas. Las proteínas son degradadas enzimaticamente generando péptidos, muchos de los cuales poseen las características estructurales para poder interactuar con las moléculas de clase II. Esta lisis proteica es llevada a cabo por proteasas que actúan a pH ácido. La “catepsina”, es una proteasa de amplia especificidad de sustrato, y es la enzima endosomal y lisosomal mas abundante. • Biosíntesis y transporte de las moléculas del MHC II al endosoma. Cátedra de Bioquímica – Facultad de Medicina - UNNE Las cadenasα y las cadenas β, son sintetizadas por separadas y se asocian unas con otras en el ER, este proceso es facilitado por proteínas chaperonas residentes de esta orgenela, tales como la calnexina (al igual que en la vía del MHC I). La molécula de clase II ensamblada, aun continua siendo inestable, por lo que se une al sitio de unión al péptido, una proteína denominada “cadena invariable” (Ii). La Ii es una proteína no polimórfica compuesta por tres subunidades. Esta proteína se une a un heterodimero formado por las cadenas α y β, en su sitio de unión al péptido. De esta manera interfiere en la carga del péptido. Gracias a la Ii las moléculas de clase II se estabilizan por completo en el ER y mantiene ocupado el sitio de unión al péptido dentro de esta organela impidiendo que los péptidos propios del ER se unan a las moléculas nacientes. Las Ii también favorecen el correcto plegamiento y su posterior transporte a las vesículas endosómicas. Los segmentos de membrana del ER que contienen a las moléculas de MHC II, se separan del ER formando vesículas que son transportadas a la membrana celular. Pero durante este camino, las vesículas exociticas se unen con los Cátedra de Bioquímica – Facultad de Medicina - UNNE endosomas que contiene a los péptidos recién internalizados. El significado la esta vía vacuolar, consiste en que las moléculas de clase II se encuentren con los péptidos generados por proteolisis de las proteínas previamente fagocitadas. Se han identificado endosomas ricos en moléculas de clase II, a los que se los llamo “compartimiento de clase II del MHC” o “MIIC” (MHC class II compartment). Se debe destacar que estas vesículas contienen todos los componentes para la asociación péptido-moléculas de clase II, incluyendo las enzimas que degradan las proteínas, la Ii y una molécula denominada HLA-DM (ver mas adelante) • Asociación del péptido a las moléculas del MHC II en el MIIC Debido que la Ii se encuentra bloqueando el sitio de unión al péptido, debe ser removido para que el péptido se una a las moléculas de clase II. Este evento se realiza en dos pasos. Primero, las mismas catepsinas que degradaron las proteínas, clivan al Ii, dejando como resultado una molécula de 24 aminoácidos en el sitio de unión al péptido llamada CLIP (péptido de cadena invariable asociado a clase II). El segundo paso consiste en quitar al CLIP de la hendidura, esto es llevado a cabo por la molécula HLA-DM. Quien además facilita la entrada del péptido antigénico en su lugar. El gen que codifica la proteína HLA-DM se encuentra ubicado en la región II del MHC (fig 8) . • Expresión del complejo péptido-MHC II en la superficie celular. Cátedra de Bioquímica – Facultad de Medicina - UNNE Una vez que el péptido se ha unido a la molécula de clase II esta se estabiliza y puede ser presentada en la membrana celular. Finalmente en la membrana los complejos peptido-MHC II pueden interactuar con los Linfocitos T CD4+. Vía alterna de procesamiento de antígenos exógenos y asociación a moléculas de clase I. Tal y como hemos descrito con anterioridad, el clásico rol de las moléculas de clase I es, unir los péptidos endógenos durante su maduración biosintetica y luego transportarlos a la superficie celular para activar a los Linfocitos CD8+. En general los péptidos de origen exógeno se encuentran excluidos de esta vía. Sin embargo, acumulada evidencia nos ha demostrado que esta dicotomía en la presentación del antígeno de origen endógeno y exógeno no es absoluta. Se ha demostrado que la respuesta de los Linfocitos citotóxicos (CD8+) puede ser iniciada por antígenos exógenos, tanto in vitro como in vivo . Existen al menos dos vías diferentes en este procesamiento alterno de las moléculas del MHC I: una TAP dependiente o procesamiento alterno citoplasmático del MHC I y la otra TAP independiente o procesamiento alterno vacuolar del MHC I. La primera de ellas involucra al acceso de péptidos exógenos a la vía normal del MHC I. Es decir, se ha observado que de alguna manera no descripta aun, los péptidos exógenos ubicados en los endosomas, pueden “escaparse” de estos e ingresar al citosol. Una vez en este, las proteínas TAP internalizan al péptido exógeno al ER y lo unen al MHC I. La segunda vía involucra un mecanismo de procesamiento del antígeno exógeno en compartimientos vacuolares, sin que el péptido ingrese al citosol. Este mecanismo sugiere la unión del péptido a las moléculas del MHC I luego de que estas hayan abandonada el complejo de Golgi. En esta vía el péptido exógeno presumiblemente proviene de un endosoma o un lisosoma. El espacio intracelular donde el péptido se une a las moléculas del MHC I en la vía vacuolar, aun se desconoce. Se cree que pudiera ser en algún compartimiento intracelular donde el procesamiento del MHC I se lleva acabo, o luego del reciclaje de las moléculas del MHC I de membrana y su posterior exposición extracelular. Inicialmente se había pensado que las moléculas de clase I que participaban en esta vía se encontraban “vacías”, es decir que no se asociaban a ningún péptido, y por lo tanto un péptido exógeno podía ocupar la hendidura. Cátedra de Bioquímica – Facultad de Medicina - UNNE Actualmente se sabe que esto no es así, y que la vía vacuolar incluye una disociación del péptido endógeno y luego un cambio por el péptido exógeno, proceso conocido como “disociación/cambio del péptido” (peptide dissociation/exchange). Se ha observado que la disociación/cambio del péptido ocurre solo en medios ácidos tales como las vesículas post-Golgi de procesamiento de antígenos o los fagolisosomas. Pero ¿Cómo las moléculas de clase I, que contienen péptidos endógenos en su hendidura, puedan disociarse de esto e intercambiarlos por péptidos exógenos? Una de las explicaciones de este fenómeno es que durante algún momento del trafico vesicular que contenga moléculas de clase I, un grupo de estas se desvié de la ruta normal y se mezcle en la ruta del MHC II. De esta manera, al ingresar en las vesículas de procesamiento de antígenos post-Golgi, que poseen pH ácido y además a los antígenos exógenos, los péptidos endógenos unidos a las moléculas del MHC I, se disocian y este queda con su hendidura vacía en un medio donde abundan péptidos exógenos. Esto trae como consecuencia que algunos de los péptidos exógenos que cumpla con los requisitos previamente mencionados se una al MHC I vacío. La otra posible explicación nos habla del reciclaje, donde moléculas de clase I de superficie, son endocitadas, y estas vesículas endociticas son destinadas a su degradación. Pero existe un pequeño grupo, que intercepta la vía de procesamiento de moléculas de clase II. De esta forma las moléculas de clase I se disocian de los péptidos endógenos debido al pH ácido del endosoma y sigue una ruta similar a la previamente descripta. En conclusión, queremos dejar en claro que además de las clásicas vías de procesamiento de las moléculas de clase I y II, existe una vía alterna para el MHC I: una TAP dependiente, y otra donde las moléculas de clase I, ya sea que provengan de la superficie celular o del ER, interceptan a la vía del MHC II y experimentan un proceso conocido como disociación/cambio de péptidos, donde pierden al péptido endógeno y se unen a uno exógeno (TAP independiente). Este cambio solo se da en medios ácidos. Así también queremos que el lector sea conciente que es una vía en etapa de investigación y en permanentes cambios. Aplicación clínica: I nmunología de los transplantes Cátedra de Bioquímica – Facultad de Medicina - UNNE El transplante es el proceso de tomar células, tejidos u órganos, denominados “injertos”, de un individuo y colocarlos en un otro distinto. Al individuo que proporciona el tejido se lo conoce como “donante” y al que recibe “receptor o huésped”. Los injertos pueden ser del mismo individuo, de otro de la misma especie o incluso de individuos de distintas especies. A los primeros se los conoce comoinjerto autógeno , a los transplantes de individuos de la misma especie se los denomina injerto alogénico y a aquellos entre seres de distintas especies,injerto xenogénico . La mayor limitación respecto a los transplantes es la respuesta inmunitaria que desencadena el huésped frente a los tejidos del dónate, que lleva al fracaso del injerto por una reacción inflamatoria, a este fenómeno se lo conoce como rechazo. En este apartado, nuestro objetivo es describir básicamente las bases moleculares y celulares de los transplantes y del rechazo. Y tan solo exponer los fenómenos clínicos subsecuentes. Para poder ejemplificar los efectos del rechazo utilizaremos como modelo a un aloinjerto ( injerto alogénico ). Tal y como hemos explicado con anterioridad, el MHC es el responsable del reconocimiento de los tejidos extraños, y es por esto son los responsables de casi todas las reacciones de rechazo intensas. El MHC reconoce al injerto extraño de dos maneras, lo que no significa que sean mutuamente excluyentes. La primera llamada presentación directa , la cual implica el reconocimiento de una moléculas del MHC intacta ofrecida por APC del donante existentes en el injerto y se debe a la similitud entre la estructura de la molécula del MHC extraño (alomolécula) intacta y las moléculas del MHC propias. Por lo tanto la presentación directa es exclusiva de las moléculas del MHC extraño. La segunda vía denominada presentación indirecta , supone el procesamiento de las moléculas del MHC del donante por parte de las APC de receptor y de la presentación de los péptidos derivados de las alomoléculas del MHC asociadas a moléculas del MHC propio. En este caso las moléculas del MHC ajeno recibe el mismo procesamiento que cualquier antígeno proteico extraño. La mayoría de los órganos contienen células dendríticas residentes. El transplante de estos involucra el movimiento de las APC, dentro del receptor. Las APCs del donante migran a los ganglios linfáticos del huésped y entran en contacto con Cátedra de Bioquímica – Facultad de Medicina - UNNE células T (presentación directa) activándolas. A su vez las células dendríticas del huésped también migran hacia el injerto, donde capturan a los antígenos y los procesan como a cualquier otro, y luego se los presentan a las células T propias (presentación indirecta). En al ámbito clínico, los rechazos a los transplantes se clasifican según su tiempo de evolución en hiperagudos, agudos y crónicos. El rechazo hiperagudo se caracteriza por una oclusión trombotica de la vasculatura del injerto, que comienza a los minutos u horas de la anastomosis entre los vasos del donante y el huésped. Esta reacción esta mediada por anticuerpos preexistentes y la activación del complemento, que lleva a severos lesiones en las células endoteliales con la subsiguiente activación de la cascada de la coagulación. El cuadro agudo es mediado por las células T y B activas, que producen injuria parenquimatosa y vascular del injerto. Usualmente comienza a la semana del transplante, que es aproximadamente el tiempo que toma la inmunidad adaptativa en dar inicio a sus mecanismos efectores. En cuanto al rechazo crónico, es caracterizado por la fibrosis y alteraciones vasculares, con perdida de la función del injerto durante un periodo prolongado. La fibrosis del rechazo crónico puede deberse a reacciones inmunitaria y a la síntesis de citoquinas que estimulan a los fibroblastos. Como ha sido evidenciado el rechazo a los injertos y el fracaso a los transplantes se debe a una respuesta inmunitaria en su contra, debido a esto las estrategias utilizadas en la práctica clínica para evitar o retrasar el rechazo consiste en la inmunodepresión general, la reducción al mínimo de la intensidad de la aloreacción específica y la tolerancia especifica al aloinjerto. Bibliografía • Abbas, Abul K. Lichtman, Andrew. Cellular and Molecular Immunology . 5 ed. Editorial Saunders • Cotran, Kumar, Collins. Robins Patologia Estructural y Funcional . 6 ed. Editorial McGraw Hill interamericana. Cátedra de Bioquímica – Facultad de Medicina - UNNE • Subtle Conformational Changes Induces in Major Histocompatibility Complex Class II Molecules by Binding Peptides . PNAS 95:10094-10099. 1998. • Delivery of Exogenous Protein Antigens to Major Histocompatibility Complex Class I Pathway in Cytosol . The Journal of Infectious Disease 185:244-51. 2002. • Recycling MHC Class I Molecules and Endosomal Pepetide Loading. PNAS 96:10326-10331. 1999. • Early Phagosomes in Dendritic Cell Form a Cellular Compartment Sufficient for Cross Presentation of Exogenous Antigens . PNAS 100:12889-12894. 2003. • Processing of Exogenous Antigens for Presentation By Class I MHC Molecules Involve Post-Golgi Peptide Exchange Influenced By Peptide-MHC Complex Stability and Acidic pH. The Journal of Immunology 167:1274-1282. 2001 • An in vitro Study of the Dynamic features of the Major Histocompatibility Complex Class I Complex Relevant to Its Role as a Versatile Peptide-Receptive Molecule. PNAS 94:13826-13831. 1997.