anexo 2 - Sanidad Vegetal
Anuncio

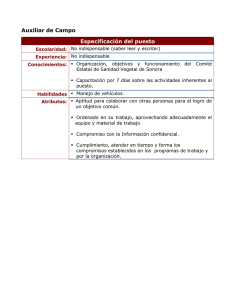
DIRECCIÓN GENERAL DE SANIDAD VEGETAL ANEXO 2 PROTOCOLO PARA LA DELIMITACIÓN ESPACIAL DE LA MOSCA DEL VINAGRE DE ALAS MANCHADAS (Drosophila suzukii Matsumura) Fecha: Noviembre de 2011 DIRECCIÓN GENERAL DE SANIDAD VEGETAL 1.- Antecedentes La mosca del vinagre de alas manchadas (Drosophila suzukii M.) fue observada por primera vez en Honshu, Japón en 1916. También se encuentra en algunas partes de China, India, Tailandia y Corea, y se ha establecido en Hawai desde 1980. Su presencia ha sido confirmada en Estados Unidos de América en los estados de Oregón, Columbia Británica, California, Washington (Bolda, 2009), en la Florida se encontró por primera vez a finales del 2009, después en julio en Carolina del Norte, Carolina del Sur y Virginia y en Michigan en Septiembre del 2010. En este país sido reportada afectando frutos de cerezas, frambuesas, zarzamoras, arándanos y fresa (Bolda, 2009; Dreves et al., 2009). En Japón, se ha reportado en uva, cereza, manzana, durazno, ciruela, caqui y Rubus spp. En la actualidad, también es una plaga en arándanos en Japón (Uchino, 2005). Los daños se producen cuando las hembras adultas, insertan su ovipositor cortando la piel de sus hospedantes para ovipositar en el fruto; el daño más importante es causado cuando las larvas emergen del huevo y comienzan a alimentarse de la pulpa del fruto; aproximadamente a los dos días se colapsa la parte de alrededor del fruto donde la larva se alimenta tornándose de color café. De la zona blanda (colapsada) sale un exudado, siendo estas zonas muy susceptibles a ser infectadas por hongos y bacterias que provocan infecciones secundarias, las cuales pueden contribuir a un daño mayor (Dreves et al., 2009; Caprile et al., 2010) En México se cultivan varios hospedantes de esta plaga entre los que destaca la vid para vino y de mesa con un total de 27,872.36 hectáreas distribuidas en ocho estados productores. Para el último ciclo agrícola 2009 el valor de la producción de uva (vino y mesa) alcanzó los 49 mil 143 millones 364 mil 900 pesos y la producción total alcanzó las 274,828.13 toneladas; los tres estados principales con mayor producción son: Sonora, Zacatecas y Baja California (SIAP, 2011). La fresa se tiene establecida en una superficie de 6,555.41 hectáreas, en 2010 la producción alcanzo un total de 226,657.28 toneladas con un valor de 21 millones 26 mil 779.20 de pesos, mientras que las frutillas (zarzamora y frambuesa) se cultivan en una superficie de 9,404.02 hectáreas, con una producción de 69,376.75 toneladas y un valor de 20 millones 908 mil 577 pesos (SIAP, 2011). 1.1 Biología e identificación de D. suzukii En condiciones optimas, en un año pueden ocurrir alrededor de 13 generaciones. El ciclo de vida puede durar de 8 a 14.5 días, la etapa de adulto dura entre 3 y 9 semanas, cada hembra puede depositar de 7 a 16 huevos por día y tiene una fecundidad de 384 huevos durante toda su vida; en cerezas por cada fruto ovipositan 2.7 huevos en promedio, y en ocasiones se han llegado a contabilizar hasta 65 adultos que emergen de una sola cereza; el estado de pupa se puede localizar dentro y fuera de las cerezas. Los adultos son más activos en los meses de abril a noviembre (Kanzawa, 1939; Isaacs et al., 2010). DIRECCIÓN GENERAL DE SANIDAD VEGETAL La temperatura mínima y máxima letal (LT50) para las hembras es de -1.6 °C y 32.6 °C mientras que para los machos las temperaturas son -0.1 °C y 32.6 °C, respectivamente. Las temperaturas óptimas de desarrollo se encuentra entre 16.5 a 25 °C el ciclo de vida se completa entre 21-25 días a una temperatura constante de 15 °C a 25 °C (Kanzawa, 1939), en California los adultos son más activos cuando las temperaturas son cercanas a los 20 °C y su actividad se ve reducida cuando las temperaturas llegan a los 32 °C (Caprile et al., 2010) Fig. 1. Ciclo de vida de D. suzukii (Créditos: Bev Gerdeman) Huevo Mide 0.6 mm de forma ovalada, recién ovipositados son de color blanco y traslucidos, luego se tornan café rojizos (Fig. 2), con dos filamentos blancos que corresponden a sus tubos respiratorios, estos filamentos alcanzan a medir de 0.6 a 0.18 mm de longitud (Walsh et al., 2011; Shearer y Steenwyk, 2011) y están localizados en el extremo los cuales sobresalen del epicarpio fuera de los frutos (Ministry of Agriculture, 2009). DIRECCIÓN GENERAL DE SANIDAD VEGETAL A) B) Fig. 2. A) Huevo recién ovipositado. B) huevos maduros. (Créditos: Ministry of Agriculture y B.H. Beers) Larva Las larvas son ápodas, típicas de dípteros, de color blanco (Fig. 3) (Ministry of Agriculture, 2009), El primer instar larvario mide aproximadamente 0.07 mm de longitud. El tercer y último instar llega a medir hasta 6 mm de longitud (Kanzawa, 1939, Walsh et al., 2011). Fig. 3. Larvas de D. suzukii (Créditos: Bev Gerdeman y University of California Cooperative Extension) Pupa Las pupas son de forma cilíndrica, color café-rojizo y miden de 2 a 3 mm de longitud, presentan dos pequeñas proyecciones en la parte caudal de las mismas que corresponden a los espiráculos (Fig. 4) (Kanzawa, 1936). DIRECCIÓN GENERAL DE SANIDAD VEGETAL Fig. 4. Pupas de D. suzukii (Créditos: M. Reitmajer) Adulto Los adultos miden aproximadamente de 2 a 3 mm de longitud, siendo la hembra un poco más grande que el macho, ojos de color rojo; el color del cuerpo es amarillo-marrón, presentan bandas obscuras en el abdomen. Los machos tienen una pequeña mancha oscura en cada una de las alas localizada entre la primera vena longitudinal y muy cerca de la segunda sin llegar a tocarla (Fig. 5 y 6), mientras que las hembras carecen de esta mancha. Los tarsos anteriores de cada pata presentan dos peines sexuales con setas que corren paralelas a lo largo de la pata. Las hembras presentan un inusual ovipositor alargado tipo sierra con dientes continuos y altamente melanizados y esclerotizados (Fig. 7) (Kanzawa, 1936). Fig. 5. Macho adulto de D. suzukii mostrando las manchas sobre la 2da vena longitudinal. (Créditos: G. Arakelian). DIRECCIÓN GENERAL DE SANIDAD VEGETAL Fig. 6. Mancha en el margen apical ubicada entre la primer vena longitudinal y muy cerca de la segunda vena sin llegar a tocarla. (Créditos: M. Hauser) a) b) c) Fig. 7. Características morfológicas básicas de la hembra de D. suzukii. a) Ala, b) hembra adulta, c) ovipositor (Créditos: G. Arakelian y M. Hauser) 2.- Delimitación del área a partir del foco de infestación. Para delimitar el área de infestación a partir de una captura inicial positiva se debe realizar la instalación de trampas en el cuadrante central de la detección y cuadrantes subsecuentes en donde se identifiquen todos aquellos predios u hospedantes de la mosca del vinagre de las manchadas y se procederá a delimitar la zona con presencia mediante trampeo, inspección y muestreo. El trampeo, la exploración y el muestreo para la delimitación de un foco de infestación es responsabilidad de los productores en coordinación con el Organismo Auxiliar de Sanidad DIRECCIÓN GENERAL DE SANIDAD VEGETAL Vegetal del Estado a través del Programa de Vigilancia Epidemiológica Fitosanitaria que opere en el Estado, según el riesgo y en función de los hospedantes cultivados o silvestres presentes en el Estado. La Delegación Estatal de la SAGARPA a través de la Jefatura de Programa de Sanidad Vegetal será la encargada de supervisar que las actividades se realicen conforme a lo establecido en el presente protocolo y a lo establecido en los lineamientos por los que se establecen las acciones fitosanitarias para el manejo y control de Drosophila suzukii en México. 2.1.- Metodología de trampeo inspección y muestreo. 2.1.1. Materiales. GPS Libreta de campo Alcohol al 70 % Bolsas de plástico con cierre hermético de más de 3 kg. de capacidad Frascos entomológicos Trampas amarillas pegajosas Alambre galvanizado Tijeras de podar Azúcar en grano Charolas o bandejas de plástico Navaja de campo estilo ejército suizo Trampas para D. suzukii Cámara digital Vinagre puro de manzana Marcador de tinta permanente Lupas de 30X 2.1.2 Metodología de trampeo La trampa para monitorear a D. suzukii consiste de un contenedor de plástico transparente con tapa con capacidad de 0.5 a 1 litro. Al frasco se le realizan de 5 a 10 perforaciones de 0.5 a 0.7 cm de diámetro en la parte superior cercanas a la tapa, que es por donde entran los insectos, es recomendable dejar un espacio libre de agujeros para facilitar el cambio del vinagre. A la trampa se le adicionan 200 ml vinagre de manzana como atrayente, de manera adicional se puede colocar una trampa amarilla pegajosa suspendida sobre el vinagre para asegurar que las moscas no escapen y queden atrapadas en ella, la trampa se sujetará los hospedantes usando alambre galvanizado (Fig 8). DIRECCIÓN GENERAL DE SANIDAD VEGETAL Fig. 8. Trampa para el monitoreo de D. suzukii (Créditos: García C.) En áreas establecidas con cultivos comerciales o en áreas urbanas, a partir del punto de infestación positivo se establecerá el trampeo mediante cuadrantes de 1km2, en una distancia de 3.5 km del punto de detección. El área comprendida dentro de este radio se dividirá en cuadrantes de 1 Km2 en el cuadrante central se establecerá una densidad de 2 trampas por cada 5 hectáreas; en el resto de los cuadrantes se colocara 1 trampa por cada 10 hectáreas, es decir 10 trampas por cuadrante (Fig. 9). Las trampas deberán ubicarse dentro de los predios seleccionados de manera uniforme a la altura del dosel de fructificación o a una altura de 1.5 a 2 metros y protegidas de la luz directa del sol. Las trampas se deberán de revisar cada 3 días durante las primeras 2 semanas, posteriormente las revisiones se realizarán de manera semanal. El cambio del atrayente se realizara una vez a la semana. El atrayente utilizado se concentrará en contenedores cerrados y se deberá desechar fuera de los predios establecidos con trampas, para desecharlo se debe enterrar a 50 cm de la superficie del suelo. Cada una de las trampas establecidas deberá estar identificada con una clave y un número consecutivo como se indica a continuación: MVC-Tx Donde: MVC: Mosca del vinagre de alas manchadas T: Trampa x: Número consecutivo para una correcta identificación. A cada trampa deberá colocarse una etiqueta con los datos correspondientes. DIRECCIÓN GENERAL DE SANIDAD VEGETAL 2 Fig. 9 Radio y cuadrantes (de 1 km ) de delimitación para áreas agrícolas con presencia de D. suzukii De manera adicional al trampeo en la zona agrícola se deberán establecer trampas en empaques y centros de distribución, se colocará una trampa por cada área que haya en el establecimiento, por ejemplo 1 trampa en el área de recepción, 1 trampa en el área del empaque, 1 trampa en el área de carga o bien si la instalación es pequeña se establecerá 1 2 de distribución, 2 2 2 1 trampa por empaque, bodega o1 centro en estos sitios las trampas deben 0 0 estar colocadas a una altura 2 de 1.5 2 a 22m. 2 2 2 2 0 0 Para reforzar las actividades, también en centros de abasto, 1 2 2 se 2 colocaran 2 trampas 2 distribución y acopio de frutas tales como interior 0 0 de mercados, fruterías, empaques, 1 2 2 2 1/5ha 2 2 industrializadoras, etc. 0 2 2 2 2 2 2 2 2 2 22 2 2 2 2 2 2 2 2 2 2 2 DIRECCIÓN GENERAL DE SANIDAD VEGETAL 2.2 Metodología de inspección y muestreo En áreas urbanas, silvestres y de cultivos comerciales, la inspección y muestreo se dirigirá preferentemente a los hospedantes enlistados en el cuadro 1 y de acuerdo al riesgo de infestación. Cuadro 1. Hospedantes de D. suzukii y su riesgo de infestación Riesgo alto Fresas Frambuesas Cerezas Arándanos Zarzamoras Uvas Riesgo medio Duraznos Manzanas Peras Ciruelas Chabacanos Riesgo bajo (hospederos alternativos) Sauco (Sambucus spp.) Hierba carmín o granilla (Phytolacca decandra) Bolitas de nieve (Symphoricarpus racemosus) (Fuente: C. Garcia 2011) Por cada cuadrante, en áreas de cultivos comerciales y/o urbanas se deberán inspeccionar árboles o arbustos, en busca de racimos o frutos con síntomas sospechosos al ataque de esta plaga. Durante la inspección se buscarán los daños y/o signos sospechosos a D. suzukii y se colectará de 0.5 a 1 kg de frutos por muestra, las cuales serán seleccionados al azar. En el cuadrante de la detección deberá colectarse una muestra por hectárea dependiendo a la existencia de hospederos y en los cuadrantes subsecuentes deberá colectarse una muestra cada 5 hectáreas. Para árboles como duraznos, manzanas, peras, chabacanos y ciruelos la muestra será de 1 kg, seleccionando de manera dirigida aquellos que presenten algún tipo de pudrición o deformación, cada uno de los frutos se diseccionara con ayuda de la navaja para buscar larvas o pupas sospechosas, las cuales se colocarán en un frasco con alcohol al 70%. Dentro del radio de acción, se ubicarán centros de abasto, distribución y acopio de frutas hospederas tales como mercados, fruterías, tiendas, empaques, industrializadoras, etc., se dirigirá el muestreo a frutos que presenten pudriciones, hundimientos, orificios pequeños de oviposición, tomando una muestra de entre 0.5 a 1 kg por cada hospedero disponible o 5 muestras si se tratase de bodegas o centros grandes de abasto. En frutos blandos (uva, cereza, fresa, zarzamora, etc.), una vez obtenidas las muestras se procederá a hacer la prueba de flotación (Fig.10) para la detección de larvas de la mosca, la cual consiste en sumergir las frutas en una solución azucarada, es un método rápido y eficiente para detectar larvas de Drosophila en frutas frescas. Permite separar las larvas de la pulpa por diferencia de peso. La fruta macerada se va al fondo de la bolsa y las larvas flotan en la superficie o en la parte media de la solución acuosa. DIRECCIÓN GENERAL DE SANIDAD VEGETAL Procedimiento: 1.- Colocar todos los frutos de una muestra dentro de la bolsa de 3 kg. 2.- Agregar 2 lt de agua o la suficiente para cubrir dos veces los frutos. 3.- Agregar dos cucharadas o ¼ de taza de azúcar y agitar la mezcla. 4.- Macerar todos los frutos completamente dentro de la bolsa, sin aplicar demasiada fuerza, de lo contrario las larvas se dañaran. 5.- Mezclar mediante agitación y dejar reposar por 5 minutos, Después de este tiempo y si hay presencia de larvas estas deberán flotar en la superficie de la mezcla. 6.- Para observar la presencia de larvas se debe observar la bolsa a contra luz y para su identificación se usara la una lupa de 30X. 7.- Separar las larvas sospechosas y colocarlas en frascos entomológicos con alcohol al 70%. Fig. 10 Método de flotación para la detección de larvas de D. suzukii (Créditos: A. Dreves) DIRECCIÓN GENERAL DE SANIDAD VEGETAL Cada punto o predio muestreado debe georreferenciarse con el GPS y se registraran en una libreta o bitácora de campo los datos de: fecha, coordenadas, estado, municipio, predio o nombre del productor, hospedante (nombre común y científico), variedad, edad y área del hospedante, así como un registro fotográfico de las actividades, de los daños y especímenes sospechosos. 3. Diagnóstico Todos los especímenes sospechosos deberán ser remitidos al laboratorio de entomología y acarología del Centro Nacional de Referencia Fitosanitaria anexando él formato de solicitud de diagnóstico debidamente llenado (Anexo 1) y se deberá de notificar a la Dirección General de Sanidad Vegetal. 4. Literatura citada Bolda, M. 2009. Update on the Cherry Vinegar Fly, Drosophila suzukii, Now Known as the Spotted Wing Drosophila. Agricultural and natural resourses. En línea: http://ucanr.org/blogs/strawberries_caneberries/index.cfm?tagname=sampling Fecha de consulta: 17 de marzo. Caprile, L. M. L. Flint., M. P. Bolda, W. W. Coates, A. A. Grant, F. G. Zalomon, R. Van Steenwyk. 2010. Spotted Wing Drosophila, Drosophila suzukii: A New Pest in California. Statewide IPM Program, Agriculture and Natural Resources, University of California. En línea: http://www.ipm.ucdavis.edu/EXOTIC/drosophila.html. Fecha de consulta marzo 17 de 2010. Dreves, A. J., V. Walton, and G. Fisher. 2009. A new pest attacking healthy ripening fruit in Oregon: Spotted Wing Drosophila, Drosophila suzukii (Matsumura). EM 8991. Oregon State University, Extension Service. Isaacs, R., N. Hahn, B. Tritten and C. Garcia. 2010. Spotted Wing Drosophila. A new invasive pest in Michigan fruit crops. MSU Extension Bulletin E-3140. MSU Extension Service. Kanzawa, T. 1936. Studies on Drosophila suzukii Mats (Abstract). Journal of Plant Protection 23 (1-3). Kanzawa, T. 1939. Studies on Drosophila suzukii Mats. (Abstract). Studies on Drosophila suzukii Mats. 49 pp. DIRECCIÓN GENERAL DE SANIDAD VEGETAL Ministry of Agriculture. 2009. Spotted Wing Drosophila (Fruit fly) pest alert. Brithis Columbia. En línea: http://www.agf.gov.bc.ca/cropprot/swd.htm fecha de consulta: marzo 18 de 2010. Uchino, K. 2005. Distribution and seasonal occurrence of cherry Drosophila, Drosophila suzukii (Diptera: Drosophilidae), injurious to blueberry in Chiba Prefecture. (Abstract) Annual report of the Kanto Tosan Plant Protection Society 52: 9597. Shearer, P. and V. Steenwyk B. 2011. Spotted Wing Drosophila (Drosophila suzukii) in the Southern Interior Valleys of British Columbia. B.C. Ministry of Agriculture Columbia. SIAP. 2011. Producción anual por cultivo. Anuarios Estadísticos de la Producción Agrícola en México. SAGARPA. Walsh, D.B., P. Bolda M., E. Goodhue R., J. Dreves A., J. Lee J., D. Bruck, M. Walton V., D. O'Neal S., Z. Frank G., 2011. Drosophila suzukii (Diptera: Drosophilidae): Invasive pest of ripening soft fruit expanding its geographic range and damage potential. Integrated Pest Management 106: 289-295. DIRECCIÓN GENERAL DE SANIDAD VEGETAL Anexo 1. Formato de solicitud de diagnóstico