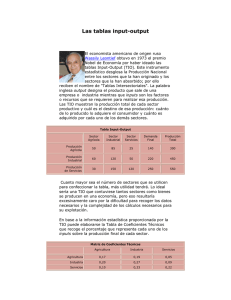
UNIVERSIDAD VERACRUZANA
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS QUIMICAS ZONA POZA RICA – TUXPAN “SÍNTESIS Y CARACTERIZACIÓN DE CATALIZADORES MIXTOS (FeTiO₃/TiO₂) PARA DEGRADACIONES FOTOCATALÍTICAS” TESIS PARA PRESENTAR EL EXAMEN DEMOSTRATIVO DE LA EXPERIENCIA EDUCATIVA DE EXPERIENCIA RECEPCIONAL DEL PROGRAMA EDUCATIVO DE INGENIERÍA QUÍMICA PRESENTA: CÉSAR MANUEL AGUILAR HERRERA ASESOR: DR. RAÚL ALEJANDRO LUNA SÁNCHEZ CO-ASESOR: M.C. RAÚL ENRIQUE CONTRERAS BERMÚDEZ POZA RICA DE HGO., VER. MARZO 2015 ÍNDICE ÍNDICE INTRODUCCIÓN I JUSTIFICACIÓN II OBJETIVOS III HIPÓTESIS III CAPÍTULO I ANTECEDENTES 1.1 Procesos Avanzados de Oxidación 1.1.1 Ventajas de los PAO´s sobre los métodos convencionales 1.2 Fotocatálisis 1 2 4 1.2.1 Procesos Fotocatalíticos 4 1.2.2 Fotocatálisis Heterogénea 7 1.2.3 Proceso Foto-Fentón 10 1.2.4 Parámetros que influyen en el proceso de fotocatálisis 11 1.2.5 Ventajas de la Fotocatálisis 14 1.2.6 Factores que afectan el proceso fotocatalítico 14 1.2.7 Fotocatalizadores 15 1.3 Método de Síntesis de Fotocatalizadores 15 1.3.1 Etapas del proceso sol-gel 18 1.3.1.1 Mezclado 21 1.3.1.2 Gelación 22 1.3.1.3 Envejecimiento 22 1.3.1.4 Secado 23 1.3.1.5 Sinterizado 24 ÍNDICE 1.4 Óxido de Titanio (TiO₂) 1.4.1 Fotocatálisis con TiO₂ 24 25 1.5 Titanato de Fierro (FeTiO₃) 26 1.6 Colorantes 27 CAPÍTULO II METODOLOGÍA 2.1 Método de síntesis del catalizador 31 2.2 Caracterización del catalizador 34 2.2.1 Espectroscopía de UV-vis con reflectancía difusa 34 2.2.2 Difracción de rayos 35 2.3 Pruebas de actividad del catalizador 36 2.3.1 Preparación de la solución madre de 100 ppm 36 2.3.2 Sistema de reacción 36 2.3.3 Análisis de las muestras de reacción 37 2.3.4 Espectroscopía 38 CAPÍTULO III RESULTADOS 3.1 Método de síntesis del catalizador 39 3.2 Caracterización del catalizador 39 3.3 Pruebas de actividad del catalizador 42 CONCLUSIONES V BIBLIOGRAFÍA VI ANEXOS VII ÍNDICE DE FIGURAS ÍNDICE DE FIGURAS FIGURA PÁGINA 1.1 Proceso Fotocatalítico 9 1.2 Reacción global de fotocatálisis heterogénea 9 1.3 Descripción gráfica de las etapas del proceso sol-gel 16 1.4 Idea fundamental de las etapas del proceso sol-gel 21 1.5 Maneras de obtener un xerogel o un aerogel 23 1.6 Estructura cristalina del TiO₂ 24 1.7 Grupos cromóforos 28 1.8 Atracciones iónicas 29 1.9 Puentes de hidrógeno 29 2.1 Cámara inerte 29 2.2 Equipo donde se realiza el procesos de síntesis 32 2.3 Proceso de hidrólisis 33 2.4 Gel obtenido 33 2.5 Mufla 33 2.6 Sistema donde se llevó a cabo la reacción 36 2.7 Espectrofotómetro JENWAY 7300 37 3.1 Punto de inflexión del catalizador 40 ÍNDICE DE FIGURAS 3.2 Patrones de difracción de rayos X de los catalizadores: 41 FeTiO₃/TiO₂ sintetizados por el método sol-gel 3.3 Barrido del colorante azul mezclilla 42 3.4 Correlación partes por millón contra tiempo de reacción sin 42 catalizador 3.5 Degradación del colorante azul mezclilla (40ppm) con 0.25 g 43 FeTiO₃/TiO₂ 3.6 Degradación del colorante azul mezclilla (40ppm) con 0.35 g 43 FeTiO₃/TiO₂ 3.7 Degradación del colorante azul mezclilla (40ppm) con 0.45 g 44 FeTiO₃/TiO₂ 3.8 Degradación del colorante azul mezclilla (40ppm) con 0.45 g 44 FeTiO₃/TiO₂ 3.9 Gráfico comparativo de todas las masas del catalizador FeTiO₃/TiO₂ 45 ÍNDICE DE TABLAS TABLA 1.1 PÁGINA Potencial de oxidación de diferentes oxidantes comparados con el 2 electrodo estándar de hidrógeno 1.2 Procesos Avanzados de Oxidación 3 JUSTIFICACIÓN JUSTIFICACIÓN La exorbitante contaminación que producen las fábricas y los seres humanos ha llevado a la tarea de investigar y dar posibles soluciones para la descontaminación del aire, tierra y agua. Debido a esto se han creado los PAO´S como se sabe son procesos de descontaminación muy útiles y la mayoría de bajo costo los cuales abarcan la fotocatálisis heterogénea. Mediante el método sol-gel se obtuvo el catalizador FeTiO₃/TiO₂ actuando como precursor butóxido de titanio por sus propiedades eléctricas y como dopante FeTiO₃. De un corto periodo de tiempo a la fecha, se ha visto que el TiO₂ actúa como un buen descontaminante de agua aunado al aditamento de ciertos dopantes para mejorar sus propiedades, se ha convertido en una excelente opción para su estudio y aplicación. II OBJETIVOS E HIPÓTESIS OBJETIVO GENERAL Sintetizar y caracterizar un catalizador del tipo FeTiO₃/TiO₂ mediante el método solgel. OBJETIVOS PARTICULARES Sintetizar un catalizador del tipo FeTiO₃/TiO₂ mediante el método sol-gel, utilizando Butóxido de Titánio como precursor y FeTiO₃ como dopante. Caracterizar el catalizador del FeTiO₃/TiO₂ mediante las técnicas de difracción de rayos X y reflectancia difusa. Probar la actividad fotocatalítica del catalizador FeTiO₃/TiO₂ en un sistema de reacción tipo lote. Determinar la masa óptima del catalizador en el sistema de reacción tipo lote. HIPÓTESIS Es posible sintetizar un catalizador del tipo FeTiO₃/TiO₂ que puede ser utilizado en procesos de degradación fotocatalítica. III INTRODUCCIÓN INTRODUCCIÓN A nivel mundial las nuevas tecnologías para mejorar los actuales métodos de purificación, buscan la sustentabilidad económica y ecológica así que utilizan filtros, energía solar, microorganismos, además de nuevos materiales. Debido al mal manejo de algunas sustancias ya sea por la poca conciencia de los dueños de las empresas y/o para evitar realizar un gasto más al tratar los contaminantes que producen, se han contaminado los tres elementos naturales (agua, aire y tierra). Por lo que ha sido necesario desarrollar procesos físicos, químicos y microbiológicos para el control de la contaminación en todo el planeta. Una gran parte de estos métodos no logran eliminar completamente las sustancias consideradas como tóxicas o si lo hacen requieren de mucho tiempo. La fotocatálisis heterogénea representa una alternativa adecuada para el tratamiento de purificación de muchas otras sustancias. La oxidación fotocatalítica es un método que elimina totalmente los contaminantes orgánicos presentes en el agua (1); es decir que a diferencia del tratamiento por carbón activado que solo promueve un cambio en la estructura de la materia y genera productos finales menos tóxicos que el contaminante inicial. En un proceso de degradación fotocatalítica, las moléculas orgánicas reaccionan con radicales hidroxilo y oxígeno (O₂) que se generan en la superficie húmeda de un semiconductor activado con luz UV de baja energía. El catalizador más utilizado para este tipo de procesos es el dióxido de titanio (TiO₂) Degussa P25, ya que tiene naturaleza bien definida y alta actividad fotocatalítica (1). La degradación de los gases contaminantes orgánicos en el agua, utilizando dispersiones irradiadas de dióxido de titanio, es un área de crecimiento tanto fundamental como de investigación aplicada. La creciente demanda de la sociedad para la descontaminación de aguas contaminadas de diversos orígenes, materializada en regulaciones cada vez más estrictas, ha impulsado, en la última década, al desarrollo de nuevas tecnologías de purificación. I INTRODUCCIÓN En la práctica, la aplicación de los métodos de tratamiento debe tener en cuenta fundamentalmente la naturaleza y las propiedades fisicoquímicas de las aguas o efluentes a tratar. Las aguas contaminadas por la actividad humana pueden, en general, ser procesadas eficientemente por plantas de tratamiento biológico, por adsorción con carbón activado u otros adsorbentes, o por tratamientos químicos convencionales (oxidación térmica, cloración, ozonización, permanganato de potasio, etc.). Sin embargo, en algunos casos estos procedimientos resultan inadecuados para alcanzar el grado de pureza requerido por ley o por el uso ulterior del efluente tratado. En estos casos y cada vez más crecientemente, se está recurriendo en los países industrializados al uso de las llamadas Tecnologías o Procesos Avanzados de Oxidación (TAO´s, PAO´s), muy poco aplicados y, peor aún, menos difundidos en los países de economías emergentes como los de América Latina. La mayoría de las TAO´s puede aplicarse a la remediación y destoxificación de aguas especiales, generalmente en pequeña o mediana escala. Los métodos pueden usarse solos o combinados entre ellos o con métodos convencionales, pudiendo ser aplicados también a contaminantes de aire y suelos. Permiten incluso la desinfección por inactivación de bacterias y virus. Las TAO´s se basan en procesos fisicoquímicos capaces de producir cambios profundos en la estructura química de los contaminantes. El concepto fue inicialmente establecido por Glaze y colaboradores, quienes definieron los PAO´s como procesos que involucran la generación y uso de especies transitorias poderosas, principalmente el radical hidroxilo (HO•). (2) A continuación se hará una explicación de los puntos a tratar en el siguiente trabajo: En el capítulo I se dan a conocer conceptos detalladamente que vamos a utilizar en este estudio. En el capítulo II se da a conocer la metodología que se va a aplicar para llegar al resultado deseado. En el capítulo III se dan los resultados obtenidos durante todo este trabajo. En las conclusiones se darán a conocer el objetivo alcanzado durante el desarrollo del presente trabajo y por último se hace mención de la bibliografía consultada para el desarrollo de esta tesis. ANTECEDENTES CAPÍTULO I ANTECEDENTES 1.1 Procesos Avanzados de Oxidación Los métodos convencionales de purificación de agua a menudo no son efectivos respecto a la eliminación de compuestos orgánicos, tales como los organoclorados que están disueltos a bajas concentraciones. Ejemplos de ello son los contaminantes del agua subterránea como el tricloroeteno (TCE) y el percloroeteno (PCE), los cuales son disolventes industriales que tienen una amplia aplicación. El método convencional para el tratamiento del agua que contiene estos contaminantes es la adsorción de los compuestos organoclorados sobre carbón activo; con ello se eliminan los compuestos, pero no los destruye. El agua residual procedente de papeleras, también contiene compuestos organoclorados que son resistentes a los tratamientos convencionales. Con el fin de limpiar el agua de estos compuestos orgánicos estables, se han desarrollado los denominados procesos avanzados de oxidación (PAO´s). El objetivo de estos procesos es el de mineralizar a los contaminantes, es decir, convertirlos completamente en CO₂, H₂O y ácidos minerales como HCl. (3) Los procesos avanzados de oxidación involucran la generación de especies altamente oxidantes que reaccionan rápidamente y que pueden degradar fácilmente sustancias orgánicas. Se ha descubierto que estas características se deben a su viabilidad termodinámica y que su oxidación va aumentando conforme se forman radicales libres. Una de las especies más oxidantes que se logran formar dentro de estas reacciones son los radicales hidroxilo (HO ) sólo menor al flúor en cuanto a su poder oxidativo y que son los que se busca formar dentro de este trabajo. Estos radicales pueden oxidar contaminantes orgánicos. En la tabla 1.1 se muestra el potencial de oxidación de diferentes oxidantes comparados con el electrodo estándar de hidrógeno. 1 ANTECEDENTES Tabla 1.1 Potencial de oxidación de diferentes oxidantes Comparados con el electrodo estándar de hidrogeno. Fuente: http://catarina.udlap.mx/u_dl_a/tales/documentos/lqu/martinez_d_gp/capitulo3.pdf Una ventaja de estos procesos oxidativos es que, a diferencia de otros, atacan directamente al contaminante alterando su estructura química y por tanto acabando con el problema de contaminación. Otros procesos como las tecnologías de absorción o extracción simplemente transportan el contaminante hacia otros medios sin resolver el problema en sí. (4) 1.1.1 Ventajas de los procesos avanzados de oxidación sobre los métodos convencionales. Transforman químicamente al contaminante Generalmente se consigue la mineralización Permiten la desinfección por inactivación de bacterias y virus. No generan lodos que a su vez requieren de un proceso de tratamiento. Útiles para tratar contaminantes a muy baja concentración. 2 ANTECEDENTES Permiten transformar contaminantes refractarios en productos tratables luego por métodos más económicos como el tratamiento biológico. (pre-tratamiento para elevar la biodegradabilidad) Elimina efectos sobre la salud de desinfectantes y oxidantes residuales como el cloro Generalmente, mejoran las propiedades organolépticas del agua tratada. En muchos casos, consumen mucha menos energía que otros métodos (por ejemplo, la incineración). Estas y otras ventajas hacen de estos procesos metodologías exitosas, que han permitido su comercialización en la desinfección del agua, así como en el tratamiento de efluentes de algunos procesos industriales. A continuación se muestra en la tabla 1.2 los PAO´S y su clasificación. Tabla 1.2 Procesos avanzados de oxidación (PAO) Procesos no fotoquímicos Procesos fotoquímicos Ozonización en medio alcalino O₃/OH· UV/peróxido de hidrógeno Ozonización con peróxido de hidrogeno O₃/H₂O₂ UV/O₃ Reacción Fentón (Fe²⁺/H₂O₂) Reacción Foto-Fentón Oxidación electroquímica Fotocatálisis heterogénea Fuente: US/EPA Handbook of Advanced Photochemical Oxidation Processes, EPA/625/R- 98/004 (1998) 3 ANTECEDENTES 1.2 Fotocatálisis La fotocatálisis se puede emplear para la oxidación de multitud de compuestos orgánicos e inorgánicos y para la reducción de compuestos inorgánicos lo que la convierte en una tecnología muy interesante para reducir la contaminación del aire y del agua. Las principales aplicaciones de la fotocatálisis son: 1) El tratamiento de aguas 2) Tratamiento de aire y desodorizacion 3) Limpieza de suelos contaminados 4) Superficies bactericidas, antivirales y fungicidas Consiste en poner en contacto la solución acuosa del compuesto a degradar con un sólido que actúa como catalizador, el cual tiene propiedades de semiconductor, este sólido se activa irradiándolo con luz visible o ultravioleta, una vez activado puede ser capaz de destruir los compuestos hasta su completa mineralización. Así mismo, presentan una reactividad no selectiva con la inmensa mayoría de compuestos orgánicos, especialmente interesante si se quiere evitar la presencia de subproductos potencialmente tóxicos procedentes de los contaminantes originales. El principal inconveniente de estos tratamientos es que tienen un coste mayor que los biológicos ya que utilizan reactivos más caros como catalizadores de las reacciones (dióxido de titanio, hierro, peróxido de hidrogeno), viéndose aumentado el coste económico de la fuente de luz utilizada provenientes de lámparas UV (frente al uso de la luz solar). 1.2.1 Procesos Fotocatalíticos Otra tecnología novedosa para el tratamiento de aguas residuales, involucra la irradiación de luz UV a un sólido semiconductor, como por ejemplo el TiO₂, que actúa como fotocatalizador en forma de pequeñas partículas que permanecen suspendidas en una disolución. 4 ANTECEDENTES Se escoge el dióxido de titanio como semiconductor en tales aplicaciones, ya que no es toxico, es muy , en la banda de conducción y “huecos positivos”, h⁺, en la banda de valencia del óxido metálico. Los huecos en la banda de valencia del semiconductor pueden reaccionar con iones hidróxido enlazados en la superficie o con moléculas de agua, produciendo radicales hidroxilo en ambos casos: (1.1) Agujero ión hidróxido radical hidroxilo (1.2) Los huecos pueden reaccionar, también directamente, con las moléculas de contaminantes adsorbidas, produciendo cationes radicales con los que inician reacciones subsiguientes de degradación. Normalmente, las moléculas de O₂ disueltas en el agua reaccionan con los electrones producidos en la superficie del semiconductor, que es un proceso que, en último término, produce más radicales libres reactivos, pero que son relativamente lentos en reaccionar. Si se añade peróxido de hidrogeno, entonces es esta la que reacciona con el electrón para formar el anión radical, que evoluciona para generar después un radical reactivo más rápido. Puesto que el electrón de más en el H₂O₂ ocupa un orbital molecular antienlazante, el enlace O – O ya de por sí débil de la molécula neutra aún se debilita más; así, el ion radical transitorio se disocia a radical hidroxilo y a ion hidróxido: (1.3) 5 ANTECEDENTES No siempre es necesario que la luz sea UV. La condición necesaria es que la luz tenga una energía superior a la banda prohibida del semiconductor. Para el TiO₂ se requiere luz UV, mientras que para los óxidos de hierro (III), por ejemplo, es suficiente luz visible. El coste de la energía eléctrica necesaria para generar la luz UV requerida es, habitualmente, el dispenso mayor asociado con los sistemas PAO. Los sistemas a base de TiO₂ son menos caros que los descritos previamente, ya que se necesita considerablemente más electricidad por molécula de contaminante destruida. En ese sentido, se puede utilizar luz solar para suministrar luz UV, pero sólo alrededor de un 3% de ésta se encuentra en el rango adecuado y es absorbido por el sólido. Otro problema con los procesos con TiO₂ es la dificultad de separar los diferentes reactivos y productos de las partículas de semiconductor, en el caso de que éste se utilice en la forma de polvos finos. Así pues, los sistemas de dióxido de titanio no pueden utilizarse, probablemente, para tratar grandes cantidades de agua residual. Algunos científicos han experimentado con TiO₂ inmovilizando en forma de una película delgada (1 micrómetro de espesor), sobre la superficie de un sólido como vidrio, sílice o alúmina. De hecho, se han utilizado baldosas recubiertas de TiO₂ en paredes y suelos en algunos edificios; el bajo nivel de luz UV de los tubos fluorescentes en las habitaciones es suficiente para permitir la destrucción de contaminantes gaseosos y en fase liquida que contactan con el óxido de las baldosas. Por ejemplo, los olores que liberan las personas están presentes normalmente en el aire a concentraciones de sólo unas 10 ppm; a estas concentraciones, la luz UV de fluorescentes normales es suficiente para destruir los contaminantes con fotocatalizadores a base de TiO₂. Las infecciones producidas por bacterias, tales como las que causan muchas infecciones secundarias en hospitales, también pueden eliminarse dispersando TiO₂ sobre las paredes y suelos (en habitaciones iluminadas con tubos fluorescentes). En fin, los fotocatalizadores son materiales silenciosos, discretos y purificadores. (3) 6 ANTECEDENTES 1.2.2 Fotocatálisis heterogénea La fotocatálisis heterogénea forma parte de los procesos avanzados de oxidación y ofrece una alternativa adecuada para el tratamiento de los contaminantes ya que produce un cambio en la estructura de la materia y genera productos finales menos tóxicos que el contaminante inicial, en la mayoría de los casos logra mineralizar completamente todos los compuestos orgánicos (5) La fotocatálisis heterogénea es un proceso que se basa en la absorción directa o indirecta de energía radiante (visible o UV) por un sólido (el fotocatalizador heterogéneo, que normalmente es un semiconductor de banda ancha). En la región interfacial entre el sólido excitado y la solución tienen lugar las reacciones de destrucción o de remoción de los contaminantes, sin que el catalizador sufra cambios químicos. La excitación del semiconductor puede tener lugar de dos formas: Por excitación directa del semiconductor, de manera que éste es el que absorbe los fotones usados en el proceso. Por excitación inicial de moléculas adsorbidas en la superficie del catalizador, las que a su vez son capaces de inyectar cargas (electrones) en el semiconductor. La fotocatálisis heterogénea puede realizarse en diferente medio: fase gaseosa, fases liquidas orgánicas puras o disoluciones acuosas. En cuanto a la catálisis heterogénea clásica, el proceso general puede descomponerse en cinco pasos independientes: 1) Transferencia de los reactivos de la fase del fluido a la superficie. 2) Adsorción de al menos uno de los reactivos 3) Reacción en la fase adsorbida 4) Desorción de los productos 7 ANTECEDENTES 5) Remoción de los productos de la región interfacial La única diferencia con la catálisis convencional es el modo de activación del catalizador, ya que la activación térmica es reemplazada por una activación fotónica. El modo de activación no tiene relación con los pasos 1, 2,4 y 5, aunque si existen la fotoadsorción y la fotodesorción de algunos reactivos, principalmente del oxígeno. El paso 3 contiene todos los procesos fotoelectrónicos y puede descomponerse de la siguiente manera: Absorción de los fotones por el sólido pero no por los reactivos. Creación de pares de electrón-hueco que se disocian en fotoelectrones y fotohuecos positivos (vacancias electrónicas) Reacciones de transferencia de electrones tales como ionisorción (en el caso del O₂, NO, etc), neutralización de cargas, formación de radicales, reacciones superficiales, etc. Utilizando como catalizador un semiconductor: Dióxido de titanio. En este caso la formación de los radicales oxidantes tiene lugar mediante las reacciones: e¯ (1.4) (1.5) (1.6) Donde H⁺ y e¯ son los huecos y electrones generados en el semiconductor al absorber la radiación ultravioleta. Los radicales tienen un poder oxidante que solo es superado por el del flúor. Los procesos químicos ocurren en una partícula de semiconductor cuando ésta es excitada con luz suficientemente energética. En estas condiciones, se crean pares electrón-hueco cuya vida media está en el rango de los nano segundos; en ese lapso deben migrar a la superficie y reaccionar con especies adsorbidas. Los pares electrón-hueco que no alcanzan a separarse y a reaccionar con especies en la superficie se recombinan y la energía se disipa. 8 ANTECEDENTES Esta recombinación puede tener lugar tanto en la superficie como en el seno de la partícula como se muestra en la figura 1.1, (procesos E y g, respectivamente). El proceso neto es la catálisis de la reacción entre el oxidante A y el reductor D (por ejemplo, O₂ y materia orgánica). Figura 1.1 Proceso Fotocatalítico Fuente: García Hernández Alfonso., 2008 Tesis de Maestría Facultad de Ciencias Químicas, Universidad Veracruzana. Los principales aspectos en la fotocatálisis son: la generación de pares electrónhueco por absorción de fotones y la distribución de estados electrónicos en la superficie. La posibilidad de la utilización de la radiación solar como fuente primaria de energía, le otorga un importante y significativo valor medioambiental; el proceso, constituye un claro ejemplo de tecnología sostenible. Figura 1.2 Reacción global de fotocatálisis heterogénea. 9 ANTECEDENTES 1.2.3 Proceso Foto-Fentón. La fotocatálisis homogénea utilizando como catalizador el Fe²⁺ (Foto-Fentón). En este caso los radicales son generados al reaccionar el Fe²⁺ con H₂O₂. El Fe³⁺ generado en presencia de luz ultravioleta puede dar lugar también a estos radicales : (1.7) (1.8) La aplicación de la Fotocatálisis Heterogénea al tratamiento de los residuos presenta, como principal ventaja, la posibilidad de recuperar el catalizador mediante procesos de filtración o decantación. De entre los PAO`s, aquellos que son capaces de aprovechar la radiación solar son de especial interés. Estos procesos son la fotocatálisis heterogénea con TiO₂ y la fotorreacción homogénea con Foto-Fentón. En esta tesis se habla de la primera. Como ya se mencionó, la fotocatálisis implica la combinación de la fotoquímica con la fotocatálisis. Ambos, la luz y catalizador, son necesarios para alcanzar o acelerar una reacción química. Así, la fotocatálisis puede ser definida como la aceleración de una fotorreacción mediante un catalizador. En el caso de la fotocatálisis heterogénea, se emplean semiconductores (sólidos en suspensión acuosa o gaseosa). Existen múltiples de estos fotosensibilizadores tales como: Al₂O₃, ZnO, Fe₂O₃ y TiO₂. Sin embargo, el más ampliamente usado en aplicaciones fotocatalíticas es el dióxido de titanio Degussa P25 en forma de anatasa 99% y en forma de rutilo 1%, ya que presenta una mayor actividad fotocatalítica, no es tóxico, es estable en soluciones acuosas y no es costoso , habiéndose evaluado diferentes estructuras del mismo. 10 ANTECEDENTES Cuando un semiconductor está en contacto con un electrolito conteniendo un par redox, la transferencia de cargas ocurre a través de la interface solido/liquido (heterogénea), como consecuencia de la diferencia de potencial entre las dos fases. En este caso, los electrones excitados son transferidos a especies reducibles (Ox₁) al mismo tiempo que el catalizador acepta electrones provenientes de especies oxidables (Red₂) que ocupan los huecos. En ambas direcciones, el flujo de electrones es nulo y el catalizador permanece inalterado. 1.2.4 Parámetros que influyen en el proceso de fotocatálisis. Los parámetros que afectan a los procesos fotocatalíticos en fase heterogénea, fundamentalmente son el oxígeno disuelto, el pH del medio, la concentración de catalizador, la intensidad de radiación y la temperatura a la que tiene lugar los procesos fotocatalíticos. (6) A continuación se exponen los fundamentos por lo que todas estas variables afectan de forma particular al uso de un catalizador semiconductor con el TiO₂ Longitud de onda e Intensidad de la Luz. El dióxido de titanio absorbe longitudes de onda inferiores a 400 nm, que corresponden al espectro ultravioleta. Cualquier radiación de estas características tendrá la capacidad de generar en el semiconductor, pares electrón-hueco. La distancia de penetración de los fotones dentro de la partícula de TiO₂ es más corta cuanto menor es la longitud de onda ya que son absorbidos por las moléculas del semiconductor con más fuerza. Debido a esto, el empleo de longitudes de ondas más corta (UVC) generan los pares electrón-hueco más cerca de la superficie, siendo menor el tiempo empleado para la migración de estos pares electrón-hueco hasta la superficie de la partícula y, por tanto, menores las posibilidades para que ocurra la recombinación de los mismos antes de que se produzca en la superficie de la partícula las reacciones con las especies químicas presentes en el agua. En conclusión, el aprovechamiento de la energía absorbida es mayor cuanto menor es la longitud de onda empleada. 11 ANTECEDENTES El Catalizador. Cuanto mayor sea la dosis del catalizador, mayor será en principio la eficiencia obtenida, si bien el efecto de la turbidez ocasionada por sus partículas también aumenta, dificultando la difusión de la luz ultravioleta. En lo que respecta a su disposición, el dióxido de titanio puede estar en suspensión o inmovilizado. La utilización de partículas de TiO₂ de las aguas tratadas antes de su vertido o reutilización, siendo este uno de los principales inconvenientes a la hora de aplicar esta tecnología debido a su reducido tamaño. Para su separación se pueden usar técnicas de filtración, que encarecerán el tratamiento. La aplicación de técnicas de decantación, dado el reducido peso y tamaño de las partículas a separar, obliga a tiempos de residencia excesivos para que el proceso resulte económico. Para solucionar este problema existen dos alternativas: aumentar el tamaño de las partículas o adherirlas a soportes (vidrio, policarbonato, estireno, etc.) de mayor tamaño para mejorar la decantación y evitar utilizar el catalizador en suspensión, depositándolos sobre las paredes iluminadas del fotorreactor o sobre materiales transparentes a la radiación. En general, son características ventajosas para un fotocatalizador una alta área superficial, una distribución de tamaño de partícula uniforme, forma definida de las partículas y una gran cantidad de porosidad interna. Normalmente se emplean polvos cuyas partículas tienen radios micrométricos. La anatasa parece ser la fase cristalina con mejores propiedades fotocatalíticas y esto ha sido atribuido, entre otras razones, a la mayor capacidad de fotoadsorción de la anatasa por oxígeno molecular y sus formas ionizadas y a su baja rapidez relativa de recombinación de pares huecoelectrón. Las partículas están formadas por cristales que, en general, presentan una amplia variedad de defectos que determinan de manera importante su reactividad química. Con el fin de aumentar su eficiencia fotocatalítica, el TiO₂ ha sido dopado con diversos iones metálicos, y también se ha intentado sensibilizar el catalizador a longitudes de onda mayores (luz visible), empleando tintes o colorantes tanto orgánicos como órganometálicos. 12 ANTECEDENTES El efecto de la turbidez ocasionada por el incremento de partículas también aumenta, dificultando la difusión de la luz ultravioleta. Es por esto la necesidad de soportar el dióxido de titanio. El dióxido de titanio producido por Degussa bajo el nombre comercial de P25, es el catalizador no soportado más empleado ya que hasta ahora ha mostrado una mayor efectividad. Sin embargo, posee un área superficial específica baja (50 m²/g), las dimensiones de partícula no son uniformes y cerca del 30% de su estructura cristalina es rutilo. Efecto del Oxígeno. Los huecos generados en la fotocatálisis producen radicales hidroxilo en la interface del semiconductor con el agua. Por otro lado, los electrones generados requieren una especie aceptadora de electrones, evitando de esta forma la recombinación de estos con los huecos. Así, el oxígeno molecular actúa como receptor de electrones generándose el radical superóxido, promotor de más radicales hidroxilos. La presencia de oxígeno es por tanto esencial para que se produzca una oxidación efectiva. Por otro lado, una aireación controlada permite la continua suspensión del catalizador en la disolución, favoreciendo una degradación más homogénea. El oxígeno es el oxidante más empleado ya que es el más barato y no compite con el sustrato en el proceso de adsorción. Se ha comprobado que cuando desaparece el oxígeno disuelto en el agua y no existe ninguna otra especie oxidante el proceso fotocatalítico, se detiene totalmente. Temperatura y pH. Normalmente el proceso de fotocatálisis es más eficiente en medio ácido con un pH de 3 a 5. 13 ANTECEDENTES El pH afecta las propiedades superficiales del catalizador y a la forma química del compuesto a degradar, y ello se manifiesta en alteraciones de la velocidad de degradación y en la tendencia a la floculación del catalizador. La velocidad de las reacciones fotocatalíticas no se modifica apreciablemente con la variación de la temperatura del sistema. Este comportamiento es típico de reacciones iniciadas fotoquímicamente, por absorción de un fotón. Aparentemente el pH no afecta notablemente este tratamiento ya que se han obtenido buenos resultados empleando TiO₂ a diferentes rangos de pH, pero también se ha comprobado que este afecta el tamaño de las partículas, la carga superficial y las posiciones de los máximos y mínimos de las bandas del TiO₂ debido a su carácter anfótero. Debe trabajarse a un pH diferente al punto isoeléctrico para el TiO₂ (pH₇), donde la superficie del óxido no está cargada. 1.2.5 Ventajas de la fotocatálisis El catalizador es barato e inocuo, y permanece inalterado durante el proceso, por lo que puede reutilizarse. El sólido puede ser fijado en distintas matrices. Esta metodología puede utilizarse en combinación con cualquier otra Presenta cierta sencillez de operación y mantenimiento. 1.2.6 Factores que afectan el proceso fotocatalítico. Cantidad y naturaleza del catalizador pH y concentración de la solución Tipo de compuesto a degradar Intensidad de la luz Configuración del reactor Concentración y tipo del aceptor de electrones 14 ANTECEDENTES 1.2.7 Fotocatalizadores Materiales que han mostrado propiedades fotocatalíticas: TiO2, ZnO, CdS, WO3, ZnS, óxidos de hierro, etc. Pueden excitarse con luz de no muy alta energía, lo que incrementa el interés para el aprovechamiento de la luz solar. Requisitos: actividad catalítica, estabilidad, regenerabilidad, resistencia al envenenamiento y que sea ambientalmente amigable. (7) 1 .3 Métodos de síntesis de fotocatalizadores. La manipulación de las condiciones de síntesis permite el control racional del tamaño y la forma de las partículas y provee los medios para adaptar las propiedades de los materiales a una aplicación específica. Se menciona los principales métodos de síntesis de nanomateriales (semiconductores) pero solo describe el método de solgel que es el que interesa. Existen diversos métodos que se utilizan para la síntesis de nanopartículas (semiconductores), los más empleados son aquellos que utilizan procedimientos químicos. Por lo general, inician con la reducción de los iones metálicos a átomos metálicos, seguido por la agregación controlada de estos átomos. El método químico es el más conveniente para la obtención de nanopartículas uniformes y pequeñas. Los métodos más representativos de esta aproximación son: El método coloidal Reducción fotoquímica y radioquímica Irradiación con microonda Utilización de dendrímeros Síntesis solvotermal 15 ANTECEDENTES Método sol – gel Un sol es una dispersión de partículas coloidales en fase líquida que son suficientemente pequeñas para permanecer suspendidas por movimiento Browniano. (12) Los procesos sol-gel proveen una metodología para dirigir y controlar la composición, homogeneidad, microestructura, tamaño de partícula, porosidad, área superficial y grado de dispersión de materiales cerámicos, vítreos y compuestos durante su síntesis a partir de precursores moleculares. El término “proceso sol-gel” se usa con el fin de describir la síntesis de una red polimérica inorgánica de óxidos metálicos a través de las reacciones químicas de hidrólisis (o hidroxilación) y condensación de precursores moleculares sintéticos, estas reacciones ocurren en solución y a baja temperatura. El método sol – gel es un proceso químico en fase húmeda ampliamente utilizado en la ciencia de los materiales. Este método se utiliza principalmente para la fabricación de nanomateriales (normalmente un óxido metálico). En la figura 1.3 se describen las etapas del proceso sol-gel. Figura 1.3 Descripción gráfica de las etapas del proceso sol-gel. Fuente:http://www.bdigital.unal.edu.co/24263/1/21399-72880-1-PB.pdf 16 ANTECEDENTES Se parte de una solución química o sol que activa como precursor de una red integrada ya sea de partículas discretas o de una red de polímeros. Los precursores típicos del proceso sol – gel son los alcóxidos metálicos y los cloruros metálicos, que sufren varias reacciones de hidrólisis y policondensación para formar una dispersión coloidal, que luego de una polimerización lenta forma un gel. En general, los alcóxidos son muy sensibles a la humedad (se descomponen muy fácilmente ante la presencia de ésta), es por ello que la hidrólisis para la formación del gel es llevada a cabo usando alcoholes como un solvente común para los diferentes líquidos inmiscibles. Un gel polimérico es una red macromolecular infinita, la cual esta hinchada por solvente. Un gel puede ser atrapado en la red de partículas y así la red polimérica no deja que el líquido se separe, mientras el líquido evita que el sólido colapse en una masa compacta, este colapso de la estructura del gel se debe a la distribución interna de las presiones capilares del líquido. La deshidratación parcial de un gel produce un residuo sólido elástico que se conoce como xerogel que es un gel secado por evaporación. Finalmente, este material es completamente deshidratado y eventualmente tratado térmicamente en flujo de gas para obtener el material estructurado final. El método sol – gel ha sido usado en los últimos años para preparar una amplia variedad de materiales nanoestructurados. El método es atractivo porque involucra procesos a baja temperatura. También la alta pureza y homogeneidad son atribuibles a su forma de preparación en sistemas multicomponente. Las dispersiones de nanopartículas son termodinámicamente metaestables, debido a su muy alta área superficial, lo que representa una contribución positiva a la entalpia libre del sistema. Si las energías de activación no son lo suficientemente altas, se produce una evolución de la dispersión de nanopartículas causando un aumento en el tamaño de las nanopartículas por un proceso de maduración de Ostwald. 17 ANTECEDENTES Por tanto, las nanopartículas altamente dispersas están estabilizadas solo cinéticamente y no pueden producirse en condiciones que superen un cierto umbral, por lo que se prefieren los métodos de la llamada “química suave”. Un método que se utiliza comúnmente para estabilizar las nanopartículas es depositarlas en un soporte, generalmente un óxido metálico, para impedir su sinterización, re-cristalización y agregación. Este tipo de materiales nanoestructurados soportados son de gran utilidad en áreas como la catálisis, aplicaciones ópticas, medicas, entre otras. Los métodos clásicos de depósito de nanopartículas en óxidos metálicos son: La Impregnación Adsorción iónica Depósito precipitación (DP) Depósito de coloides Depósito fotoquímico 1.3.1 Etapas del proceso sol - gel Un sol es una suspensión o dispersión coloidal de partículas, mientras el término gel se refiere al material semi rígido formado cuando las partículas coloidales se unen en un líquido para formar una red o sistema tridimensional. Los precursores del Sol-Gel consisten de metales o metaloides rodeados por varias ligaduras de las cuales las más ampliamente usadas son los metales alcóxidos. Aluminatos, titanatos, boratos y silicatos son solo algunos de los alcóxidos que pueden ser usados para crear un gel. La síntesis por Sol-Gel a bajas temperaturas de vidrios y materiales cerámicos ha recibido considerable interés tanto científico como tecnológico. Iniciando desde un precursor molecular líquido, es posible producir vía reacciones de hidrolisis-condensación, una gran variedad de inusuales materiales óxidos cerámicos 18 ANTECEDENTES multicatión, variando la composición química y estructura de la cual pueden ser adaptados por el diseño de los precursores moleculares y los parámetros de síntesis. Además la síntesis de Sol-Gel ofrece oportunidades de producir también polvos finos cerámicos con una alta área superficial y alta pureza; como lo pueden ser películas y recubrimientos con modificaciones químicas y propiedades físicas. El método Sol-Gel, consiste básicamente en la formación de redes compuestas por elementos inorgánicos, que se obtienen a partir de la hidrolisis del alcóxido, alcohol y agua (solución homogénea) llamada sol , que es una solución coloidal. El “sol” tiene un diámetro aproximado de 100 (Angstroms). En el sol se forman micelas suspendidas en el líquido, las cuales van aumentando de tamaño en función del tiempo y en un sistema de agitación constante, hasta la formación del gel , este es un sistema polimérico que tiene una apariencia gelatinosa y cuando se seca a una temperatura de aproximadamente 70º C, se forma un polvo que aún conserva las propiedades de un coloide. Hay un procedimiento donde se describen los pasos para realizar el método Sol-Gel: primeramente es necesario preparar una solución coloidal en fase liquida, la cual debe de contener iones metálicos disueltos. Surgen reacciones de hidrólisis que forman una solución organometálica o sol, la cual está compuesta por cadenas del tipo poliméricas, con iones metálicos y oxígeno. De la solución se forman partículas de óxido amorfo, las cuales producen una capa superficial del gel rígido. El proceso de gelación inicia con la formación de agregados fraccionados hasta formar por su unión una red tridimensional. Si las dimensiones más pequeñas del gel son más grandes que unos pocos milímetros, el objeto es generalmente llamado monolito. Alternativamente, la gelación puede ser producida por la evaporación rápida del solvente, como ocurre durante la preparación de películas o fibras. El gel es sometido a un proceso de secado y después es calcinado. 19 ANTECEDENTES Las temperaturas de sinterizado son por lo general bajas debido a que algunos polvos pueden ser altamente reactivos a la temperatura. Temperaturas de calcinado más elevadas permiten la producción de vidrios y vidrios cerámicos. Cuando se dan tratamientos térmicos entre 800 y 1000 ºC el xerogel, que es el gel secado a condiciones atmosféricas una vez eliminado el sol residual, cambia sus propiedades texturales (área, porosidad, tamaño de partícula, etc.) y se obtiene una cerámica. La formación de partículas uniformes, requiere de tiempos prolongados de envejecimiento y de un sistema estable para obtener un monolito. La inmersión de otro compuesto en el sol durante la reacción de hidrolisis da como producto una película delgada del solido sintetizado, esta película actúa comúnmente como membrana y tiene la capacidad de trabajar en condiciones extremas de acidez y basicidad o a temperaturas mayores de 500ºC. Cuando se dan tratamientos térmicos, la película delgada se vuelve más densa. En el proceso sol-gel consta de varios pasos: mezclado, gelificación, envejecimiento, secado y sinterizado. Cuando se utilizan alcóxidos como precursores (M(OR)), las reacciones químicas involucradas son la hidrólisis y la policondensación, estas reacciones se producen simultáneamente y pueden ser incompletas si la cantidad de agua no es la estequimétricamente necesaria, las reacciones se presentan a continuación: Hidrólisis -MOR + H2O -MOH + ROH (1.9) -MOR + HOM -MOM- + ROH (1.10) -MOH + HOM -MOM- + H₂O (1.11) Condensación: 20 ANTECEDENTES En seguida, en la figura 1.4 se muestran las etapas del método sol-gel de manera gráfica. Figura 1.4 Idea fundamental de las etapas del proceso sol-gel Fuente: http://www2.uca.es/grup-invest/geles/paginas/intro.html 1.3.1.1 Mezclado La posibilidad de diseñar materiales únicos es uno de los aspectos del proceso solgel que se consideran más importantes, especialmente cuando se hace por polimerización de un compuesto metalorgánico para formar un gel polimérico. La clave consiste en diseñar el monómero adecuado que polimerizará para formar las estructuras M-O-M. Los alcóxidos metálicos M(OR)n - donde M es el metal y R un radical alquilo - cumplen este requisito. El precursor de butóxido de titanio reacciona con el agua y se producen las reacciones de hidrólisis y policondensación, en presencia de un disolvente común (normalmente alcohol), dado que el agua y el alcóxido (Butóxido de Titanio) son inmiscibles. Estas reacciones se producen simultáneamente y generalmente quedan incompletas, pero el óxido que se desea se consigue.El resultado final de las reacciones es una dispersión coloidal de partículas extremadamente pequeñas (1-2 nm) que forman finalmente una red tridimensional enredada del óxido inorgánico correspondiente. 21 ANTECEDENTES La hidrólisis y la policondensación se pueden acelerar o frenar utilizando el catalizador ácido o base correspondiente. Para pH bajo las partículas se agregan para formar estructuras poliméricas, mientras que a pH alto las partículas aumentan de tamaño; este efecto se debe a la variación de la solubilidad con la curvatura de la superficie y con el pH. Dependiendo de la cantidad de agua presente, la reacción de hidrólisis puede completarse o detenerse cuando el metal está parcialmente hidrolizado. En el caso de que se utilicen diversos cationes para formar redes de óxidos mezclados, es necesario un paso inicial para formar el complejo mixto. 1.3.1.2 Gelación La etapa de gelación se caracteriza por la formación de una fase continua, compuesta por una matriz porosa interconectada extendida a todo el volumen de la dispersión coloidal, por lo cual retiene mecánicamente al solvente en su interior a través de fuerzas capilares e interacciones atractivas con la superficie. La matriz es el resultado de la asociación de las partículas primarias del sol a través de reacciones de condensación originadas por colisiones entre estas, formación de puentes de hidrógeno y fuerzas de atracción como las de Van der Waals y dipolo dipolo. La gelación requiere concentraciones relativamente altas de partículas coloidales en el sol, con el fin de incrementar apreciablemente la densidad de las interacciones.Se concluye que la estructura en el punto de gelificación es muy variable, dependiendo de factores como la concentración, el pH, la temperatura, lo que da lugar a diversas tendencias observadas, tales como racimos extensos, coloidal frente a polimérico, y fractal frente a una distribución homogénea de tamaños. 1.3.1.3 Envejecimiento Con forme pasa el tiempo de la gelación, la red sólida inmersa en el líquido continúa su evolución. Este proceso de envejecimiento consta de tres pasos: continuación de la polimerización, sinéresis y maduración. 22 ANTECEDENTES La polimerización de los grupos hidroxilo que no habían reaccionado aumenta la conectividad de la red; este proceso sucede a la vez que un cierto encogimiento. La sinéresis es el encogimiento espontáneo e irreversible de la red gelificada, es el resultado de la expulsión del líquido de los poros. Finalmente, la maduración se refiere al proceso de disolución y reprecipitación debido a las diferencias de solubilidad que hay entre superficies con distintas curvaturas. 1.3.1.4 Secado Uno de los principales problemas a la hora de preparar materiales masivos (monolíticos) es evitar la fractura del gel durante el secado, debido a las tensiones provocadas por las fuerzas capilares asociadas a las interfases líquido-vapor. La etapa de secado es crítica, especialmente cuando piezas monolíticas de gel seco son requeridas para la preparación de cúmulos de cristal, es importante reportar que el proceso de secado es muy importante para determinar la morfología del material, además de que es importante para influir en la eliminación del líquido contenido dentro de los poros del material, infiriendo directamente en el tamaño del poro (Fig. 1.5). Figura 1.5 Maneras de obtener un xerogel o un aerogel Fuente: http://www2.uca.es/grup-invest/geles/paginas/intro.html 23 ANTECEDENTES 1.3.1.5 Sinterizado Es un proceso de densificación de la red conducido por la energía interfacial. La red sólida se mueve por flujo viscoso o por difusión para eliminar la porosidad. En geles con gran superficie porosa, la fuerza que gobierna este proceso es suficientemente grande como para producir el sinterizado a temperaturas excepcionalmente bajas, donde los procesos de transporte son relativamente lentos. De hecho, la cinética de la densificación en los geles no es sencilla debido a los procesos de deshidroxilación y de relajación estructural. 1.4 Dióxido de Titanio (TiO₂) El TiO₂ utilizado en los procesos de fotocatálisis se encuentra en la naturaleza en forma de rutilo (estructura tetragonal), anatasa (estructura octaédrica) y brookita (estructura ortorrómbica). Una de sus grandes propiedades y por lo que es muy utilizado aparte de su bajo costo en comparación con otros es que no es tóxico y tiene buena dispersabilidad en soluciones orgánicas. Es un semiconductor sensible a la luz UV. Es anfótero, muy estable químicamente y no es atacado por la mayoría de los agentes orgánicos e inorgánicos. (8) A continuación en la figura 1.6 se expone la estructura cristalina del TiO₂. Figura 1.6 Estructura cristalina del TiO₂ Fuente: http://www2.uca.es/grup-invest/geles/paginas/intro.html 24 ANTECEDENTES El dióxido de titanio, TiO₂, puede prepararse también a partir de la ilmenita por la acción combinada del cloruro de hidrógeno y del cloro a una temperatura bastante elevada para volatilizar el cloruro férrico formado: (1.12) El dióxido es un importante pigmento blanco en pintura. También se usa para dar opacidad al papel, para producir un esmalte amarillo sobre la porcelana, y para teñir dientes artificiales. 1.4.1 Fotocatálisis con TiO₂ El tratamiento de las aguas residuales no biodegradables parece ser uno de los ámbitos de aplicación más alentadores de la detoxicación solar. Este proceso consiste en la limpieza de contaminantes mediante el uso de la energía solar. Según pruebas corporativas efectuadas, se ha demostrado que el TiO₂ es el material semiconductor más resistente a la corrosión; es, asimismo, una material seguro y de bajo costo y, debido a sus características propias, puede aprovechar los rayos ultravioleta naturales. El TiO₂ no es estable térmicamente y su área específica es muy baja (30-50 m²/g) la cual disminuye fuertemente a altas temperaturas debido a la transformación de fase y crecimiento del cristal. Para mejorar su estabilidad térmica, la síntesis de óxidos mixtos puede ser una alternativa. El TiO₂ como catalizador ha mostrado el mejor desempeño fotocatalítico con máximo rendimiento. Las propiedades que influencian esta actividad incluyen área específica, cristalinidad, tamaño de cristal y estructura cristalina. Por lo general, la actividad fotocatalítica de Titania amorfa es despreciable; la anatasa es la forma alotrópica más activa entre las diferentes formas disponibles. La adición de algunos óxidos en TiO₂, puede mejorar la estabilidad térmica y la fotoactividad. A pesar de que la parte del espectro solar que se aprovecha en el proceso de fotocatálisis con TiO2 es pequeño, este recurso natural es tan abundante y económico que, aun así, merece la pena utilizarlo. 25 ANTECEDENTES Al contrario que otras partículas semiconductoras que hacen uso de fracciones más grandes del espectro solar, el TiO₂ no se degrada en los ciclos catalíticos repetidos de los que constan las fotocatálisis heterogéneas. Por estas razones, las suspensiones irradiadas de TiO₂ son el proceso más prometedor que existe para llevar a cabo la degradación de los contaminantes orgánicos presentes en las aguas residuales. En los últimos años, la investigación y el desarrollo en este ámbito se han acelerado enormemente. Como puntos a destacar merecen citarse: Los compuestos orgánicos son destruidos en el mismo lugar en que se producen, eliminándose los problemas asociados a su recogida y transporte para posterior tratamiento. El TiO₂ es un producto limpio, fotoestable y barato sin repercusión negativa s obre el medio ambiente. Se produce realmente una destrucción de los compuestos tóxicos y no un trasvase de un medio a otro (del aire al sólido en el caso del carbón activo generándose un problema posterior con ese sólido, etc.) El sistema de tratamiento no se ve afectado negativamente por la humedad. La temperatura de trabajo está próxima a la ambiental. El consumo energético es bajo o inexistente en el caso de colectores solares. Un sistema fotocatalítico no genera óxidos de nitrógeno. 1.5 Titanáto de Fierro (FeTiO₃) Los cristales son normalmente tabulares, gruesos, con planos basales bien desarrollados y pequeñas truncaduras romboédricas. Frecuentemente aparecen en placas delgadas. Normalmente, el cristal es macizo, compacto; también se da en forma de granos o en arenas. Brillo metálico a submetálico. Color negro de hierro. Huella negra a rojo castaño. Puede ser magnético sin calentar, Opaco. 26 ANTECEDENTES Tiene una composición de Fe 36.8%, Ti 31.6%, O 31.6% para la fórmula estequiométrica FeTiO₃. La fórmula puede expresarse más realísticamente como (Fe,Mg,Mn) TiO₃ con sustitución limitada de Mg y Mn. La ilmenita puede contener cantidades limitadas de Fe₂O₃ (menos del 6% en peso) a temperaturas ordinarias. La ilmenita es un mineral accesorio común en rocas ígneas. Puede presentarse en grandes masas en gabros, dioritas y amortositas como un producto de segregación magmática, íntimamente asociado a la magnetita. También se encuentra en algunas pegmatitas y filones. Como constituyente de áreas negras está asociado a la magnetita, rutilo, zircón y monacita. Se halla en grandes cantidades de Krâgero y otros lugares de Noruega; en Finlandia; en cristales en Miask, en las montañas Ilmen, Rusia, CIS. Se explota en cantidades considerables de las arenas de las playas, principalmente en Australia, India y Brasil. En Estados Unidos se encuentra en Florida. Es la mayor fuente de titanio. Se emplea principalmente para la obtención de dióxido de titanio, que se usa cada vez más como pigmento en pintura, reemplazando viejos colores, especialmente compuestos de plomo, como metal y en aleaciones por su elevada relación resistencia/peso y su alta resistencia a la corrosión, el titanio se utiliza en construcciones aeronáuticas y espaciales tanto en estructuras como en motores. (9) La ilmenita es sin duda, el componente más importante de titanio; se calcula que más del 90% de los compuestos titaníferos de las rocas ígneas están formados por ilmenita. (10) 1.6 Colorantes Los colores dependen de la longitud de onda de la luz. La luz blanca es, en realidad, una mezcla de todas las longitudes de onda visibles. Al atravesar un prisma, la luz se refracta y se descompone en diferentes longitudes de onda, lo que da lugar a los diferentes colores. En definitiva, es lo mismo que ocurre cuando aparece el arcoíris. Muy pocos objetos refractan la luz que reciben a través de su superficie (la mayoría sólo la refleja). 27 ANTECEDENTES Si uno de ellos es iluminado con luz blanca pero se muestra rojo ante nuestros ojos, esto significa que las demás longitudes de onda no se reflejan. Las propiedades cuánticas de los electrones son los responsables de que esto suceda así: en función de su libertad de movimiento en las moléculas, los electrones pueden absorber fotones con la energía y, por lo tanto, con la longitud de onda apropiada. Observando la luz reflejada es posible deducir las propiedades químicas de los objetos, es decir, su composición. (12) Los compuestos que absorben una o más longitudes de onda de luz visible aparecen coloridos ante el ojo humano. La luz blanca posee todas las longitudes de onda de la luz visible. Cuando un haz de luz blanca alcanza una superficie colorida, ciertas longitudes de onda se absorben y otra se reflejan; Se ve lo que se refleja. Por ejemplo, si un objeto absorbe energía lumínica con longitudes de onda en la región azul/verde, el objeto se verá rojo, porque este color constituye las longitudes de onda restantes. Al contrario, si se absorbe luz roja, el objeto se verá azul/verde. Básicamente las características estructurales que causan que una molécula orgánica se vea colorida son dos: (1) el compuesto tiene por lo general un grupo cromóforo (grupo portador de color); o (2) hay una extensa red de enlaces sencillos y dobles que se alteran (conjugación), de la cual el cromóforo forma parte. Los que siguen son unos cuantos ejemplos de grupos cromóforos; los colorantes se suelen clasificar de acuerdo con el grupo cromóforo presente como se muestra en la figura 1.7. Figura 1.7 Grupos Cromóforos Fuente: S. BAILEY Philip Jr. Química Orgánica. México Editorial Pearson Education. 28 ANTECEDENTES Para que un compuesto sea un colorante, no solo debe mostrar color, también debe ser capaz de adherirse a una tela. Los grupos auxocromos son grupos ácidos o básicos que pueden hacer que un colorante se ligue a una tela por atracciones iónicas y puentes de hidrógeno. Básicos , (1.13) Ácidos (1.14) Por ejemplo, la lana y la seda son materiales proteínicos compuestos por aminoácidos (grupo amina y grupo ácido carboxílico) unidos por enlaces de amida. Estos grupos ácidos y básicos de las proteínas suelen existir en forma de sales, que tienen carga. Los grupos con carga de un colorante son atraídos hacia grupos con carga opuesta en una tela y el resultado es la unión. (Fig. 1.8) Las abundantes oportunidades para la formación de puentes de hidrógeno (Fig. 1.9) entre los grupos auxocromos y las fibras de lana y seda también permiten que los colorantes se adhieran a estas telas. Figura 1.8 Atracciones Iónicas Fuente: S. BAILEY Philip Jr. Química Orgánica. México Editorial Pearson Education. Figura 1.9 Puentes de Hidrógeno Fuente: S. BAILEY Philip Jr. Química Orgánica. México Editorial Pearson Education. 29 ANTECEDENTES Los colorantes se pueden clasificar de acuerdo con el método de aplicación a una tela. Los colorantes directos se aplican sumergiendo la tela en una solución acuosa del colorante; la adherencia se debe a interacciones ácido/base y formación de puentes de hidrógeno. Los colorantes dispersos son insolubles en agua pero “solubles” en la tela; se aplican a telas modernas como nylon y poliésteres en forma de partículas finamente divididas en dispersión coloidal en agua. Los colorantes mordientes se aplican a un tejido tratado con un mordiente (del latín mordere morder), el cual se puede unir tanto a la tela como al colorante; en este método, se puede aplicar un colorante con poca afinidad por un tejido pero gran afinidad por un mordiente. Los colorantes reactivos forman efectivamente enlaces covalentes con la fibra. Los grupos básicos de la fibra atacan los enlaces carbonocloro del colorante por sustitución nucleofílica para formar el enlace. Los colorantes en rama son colorantes insolubles en agua que se sintetizan dentro del tejido a partir de reactivos solubles en agua. Por lo común, el primer reactivo que se aplica tiene un auxocromo que le permite unirse a la tela; el segundo reactivo reacciona con el primero para formar el colorante. Los colorantes a la cuba son compuestos que son solubles en agua cuando se encuentran en una forma reducida incolora. Después de la aplicación, una oxidación (a veces simplemente al aire) convierte el colorante a la forma colorida insoluble en agua. (13) 30 METODOLOGÍA CAPÍTULO II METODOLOGÍA En este capítulo se describe la metodología experimental para la síntesis, caracterización y las pruebas de actividad del catalizador mixto FeTiO₃/TiO₂ que se sintetizó mediante el método sol-gel. 2.1 Método de Síntesis del Catalizador. Se sintetizará un catalizador mixto del tipo FeTiO₃/TiO₂ en proporción en peso 10% FeTiO₃ y 90% TiO₂. Para sintetizar 9 g del catalizador se realizaron los siguientes cálculos: En una cámara de acrílico se introducen los reactivos y aparatos necesarios para la síntesis del catalizador, la cámara se cierra y se llena con nitrógeno para tener una atmósfera inerte (Fig. 2.1) y evitar que el butóxido de titanio se hidrolice. Se pesan 38.83 g de butóxido de titanio IV, 97% (Aldrich) como precursor, 0.9 g de titanato de fierro como dopante y 36 mL de alcohol etílico. Los reactivos se mezclan en un matraz de tres bocas. 31 METODOLOGÍA Figura 2.1 Cámara inerte Se instala el dispositivo donde se continua el proceso de síntesis, el cual consiste de una parrilla de calentamiento, un baño de etilenglicol, 3 soportes universales, 4 pinzas universales, 1 embudo, 1 refrigerante con recirculación de agua, 1 agitador eléctrico con aspas, como se muestra en la figura 2.2. Figura 2.2 Equipo donde se realiza el proceso de síntesis 32 METODOLOGÍA El matraz de tres bocas se coloca en el dispositivo y se adiciona agua gota a gota para provocar la hidrólisis de la mezcla. Una vez que se llevó a cabo la hidrólisis se aumentó la temperatura a 65 ºC por dos horas en constante agitación hasta la formación del gel (Fig. 2.3). Figura 2.3 Proceso de hidrólisis Una vez obtenido el gel (Fig. 2.4), se dejó reposar durante 24 horas a temperatura ambiente, posteriormente el gel se secó en una estufa a 120 ºC por 4 horas para retirar cualquier rastro de humedad. Más tarde, el material se molió en un mortero. Para concluir, el material se calcinó en una mufla a 500 ºC por 3 horas (Fig. 2.5), se esperó a que el material se enfriara para molerlo nuevamente en el mortero, se pesó para obtener el rendimiento y se almacenó para su posterior caracterización. Figura 2.4 Gel obtenido Figura 2.5 Mufla 33 METODOLOGÍA 2.2 Caracterización del catalizador El catalizador mixto de FeTiO₃/TiO₂ se caracterizó mediante las técnicas de espectroscopía de UV-vis con una esfera de integración de sólidos reflectancia difusa y difracción de rayos X. 2.2.1 Espectroscopía de UV-vis con reflectancia difusa Los espectros de reflectancia difusa de ultravioleta-visible se utilizan para calcular el valor de la energía de la banda prohibida de cada catalizador. Esta técnica es muy utilizada en el estudio de sólidos inorgánicos, debido a que uno de los factores que influyen en las propiedades de los materiales semiconductores para ser utilizados como fotocatalizadores es la energía de banda prohibida (Eg). La cual es atribuida a la transición fundamental del semiconductor, ya que al pasar un electrón de la banda de valencia a la banda de conducción hay un ascenso rápido en la curva de absorbancia. Los espectros de absorción de radiación UV-vis se obtuvieron en un espectrofotómetro ultravioleta-visible marca Thermo Scientific modelo Evolution 600, equipado con una esfera de integración para el análisis de sólidos. Para este análisis es necesario colocar una cantidad adecuada de la muestra seca en el porta-muestra. El barrido se realiza desde 200 hasta 600 nm en modo de absorbancia con un intervalo de paso de 0.5 nm. El valor de la energía de banda prohibida (Eg) de los fotocatalizadores se calculó mediante el procedimiento propuesto por (Ibañez, 1991), que consiste en localizar el punto donde ocurre el cambio abrupto en la pendiente del espectro de absorción o reflectancia UV-vis contra la longitud de onda. La posición de este punto se localiza en la intersección de las dos líneas tangentes a la curva (λg). El valor de la energía de la banda prohibida (Eg) de estos materiales se calculó mediante la ecuación 2.1. (2.1) 34 METODOLOGÍA Dónde: = Energía de banda prohibida en eV = Longitud de onda (nm) obtenida de la intersección de la pendiente con el eje X ℎ= Representa la constante de Planck ( = Velocidad de la luz ( Dónde: 1 eV= J/s) m/s) J 2.2.2 Difracción de rayos X Los materiales sintetizados fueron caracterizados por medio de la técnica de difracción de rayos X para identificar las fases cristalinas en los sólidos. Los patrones de difracción constituyen una huella digital para cada compuesto cristalino. Las posiciones e intensidad de las reflexiones características de cada uno de los compuestos presentes dependen únicamente del tamaño, forma, naturaleza de los átomos y sus posiciones dentro de la celda unitaria. Los difractogramas se obtuvieron en un equipo de rayos X para polvos marca RIGAKU modelo Dmax 2000 operado en el modo de reflexión. El voltaje utilizado fue de 20 kV y la intensidad del filamento 25 mA. Se utilizó la radiación Kα de una fuente de cobre. El rango de análisis fue de 2 a 100° en 2θ con una velocidad de barrido de 0.6 °/min. Para el análisis se emplea una pequeña cantidad de muestra seca, no es necesario ningún tratamiento previo. En caso de que se disponga de una muy pequeña cantidad de muestra, se hace uso de grasa de silicón para fijar el polvo a la celda. Para identificar los componentes cristalinos de los catalizadores, los difractogramas se comparan con los estándares del centro internacional para datos de difracción (JCPDS, Joint Committe on Powder Diffraction Starndars). 35 METODOLOGÍA 2.3 Pruebas de actividad del catalizador Para probar la actividad del catalizador mixto FeTiO₃/TiO₂ se realizaron pruebas en un sistema de reacción tipo Batch, utilizando soluciones de un colorante comercial, las muestras de reacción se analizaron en un espectrofotómetro de UVvis para monitorear el avance de la reacción. 2.3.1 Preparación de la solución madre de 100 ppm Para preparar la solución madre de 100 ppm de un colorante azul mezclilla de la marca “mariposa” se pesó 0.1 g y en un matraz volumétrico de 1000 mL se aforó con agua destilada. Más tarde, se realizaron disoluciones de 40 ppm en un matraz volumétrico de 500 mL para realizar las pruebas del catalizador FeTiO₃/TiO₂. 2.3.2 Sistema de reacción Las pruebas de actividad del catalizador FeTiO₃/TiO₂ se realizaron en un sistema de reacción tipo Batch. El cual consta de una caja de madera cubierta de espejos en la parte interior para maximizar la cantidad de luz a la solución, una lámpara de luz UV, una placa de agitación, un vaso de precipitado, un agitador, fuentes para obtener muestra, la tapa tiene tres orificios para la toma de muestra, la colocación de la lámpara y el venteo de CO₂. Figura 2.6 Sistema dónde se llevó a cabo la reacción. 36 METODOLOGÍA El volumen de reacción fue de 500 mL de una solución del colorante azul mezclilla (40 ppm), la prueba preeliminar es el efecto fotoquímico sobre esta solución y posteriormente se probó el efecto fotocatalitico utilizando diferentes masas del catalizador FeTiO₃/TiO₂ desde 0.25 g hasta 0.55 g. Las muestras de reacción se tomaron en intervalos de tiempo y se centrifugaron en una centrifuga marca RUN WINDOWS por 40 minutos, las soluciones se almacenaron en viales ámbar para su posterior análisis. 2.3.3 Análisis de las muestras de reacción Durante las reacciones se tomaron muestras de 10 mL cada 10 minutos mientras transcurrieron los primeros 30 minutos, posteriormente a los 45, 60 y 90 minutos de reacción. Todas las muestras de reacción se analizaron en un espectrofotómetro de UV-vis Jenway 7305. (Figura 2.7) Primero se realizó un barrido de una muestras del colorante azul mezclilla desde 570 a 590 nm para obtener la longitud de onda del colorante para su análisis. Figura 2.7 Espectrofotómetro JENWAY 7300 Fuente: www.jenway.com/adminimages/Jenway_7300_7305_Spectro_Manual_LO%283%29.pdf 37 METODOLOGÍA 2.3.4 Espectrofotometría. La espectrofotometría se refiere a la medición de la intensidad de luz transmitida por una solución a diferentes longitudes de onda. Si los productos de una reacción química absorben en mayor o menor grado que los reactivos, entonces la reacción puede estudiarse espectrofotométricamente. (15) Es posible utilizar una variedad de técnicas para dar seguimiento a la concentración de un reactivo o producto durante una reacción. Los métodos espectroscópicos, los cuales se basan en la capacidad de las sustancias para absorber (o emitir) radiación electromagnética, son de los más útiles. Los estudios sobre cinética espectroscópica se realizan frecuentemente con la mezcla de reacción en el comportamiento de muestra del espectrómetro. El espectrómetro se calibra para medir la luz absorbida en una longitud de onda característica de uno de los reactivos o productos. Por ejemplo, en la descomposición de HI(g) en H₂(g) y I(g), tanto el HI como el H₂ son incoloros, mientras que el I₂ es violeta. Durante el curso de la reacción, la intensidad del color aumenta a medida que se forma I₂. Así, la luz visible de la longitud de onda adecuada puede utilizarse para dar seguimiento a la reacción. El espectrómetro mide la cantidad de luz absorbida por la muestra al comparar la intensidad de la luz emitida de la fuente de luz con la intensidad de la luz que surge de la muestra. Conforme aumenta la concentración de I₂ y su color se vuelve más intenso, aumenta la cantidad de luz absorbida por la mezcla de reacción, lo que ocasiona que menos luz llegue al detector. (14) 38 RESULTADOS CAPITULO III RESULTADOS En este capítulo se presentaran los resultados obtenidos de la síntesis, caracterización y pruebas de actividad del catalizador mixto FeTiO₃/TiO₂ en una solución acuosa de un colorante azul mezclilla en presencia de luz UV en un reactor tipo Batch. 3.1 Método de síntesis del catalizador A partir del método sol – gel se obtuvo un polvo fino color blanco grisáceo con una textura suave y tamaño uniforme. Se obtuvo un rendimiento de 8.38 g de este catalizador mixto FeTiO₃/TiO₂ 3.2 Caracterización del catalizador En la caracterización de los fotocatalizadores es muy importante determinar el valor de la energía de la banda prohibida que es la diferencia entre la energía de la banda de valencia y la banda de conducción. Para realizar el cálculo de la energía de banda prohibida, a partir de la técnica de reflectancia difusa, se obtiene el espectro de UV-vis del catalizador (Fig. 3.1). 39 RESULTADOS Figura 3.1 Punto de Inflexión del Catalizador Una vez que se tiene la curva de absorbancia contra la longitud de onda, se determina el punto en el cual ocurre un cambio abrupto en la pendiente de la curva y que corresponde al punto de activación del catalizador. Esta determinación se puede aproximar encontrando la intersección de las dos líneas tangentes de la curva. Una vez que se determina este valor, la energía de banda prohibida se calcula mediante la siguiente ecuación: (3.1) 40 RESULTADOS Dónde: = Longitud de onda (nm) = Energía de la banda prohibida (eV) = Constante de Planck = 6.626 10-34 (Js) = Velocidad de la luz en el vacío = 2.998 1017 (nm s-1) Al sustituir en la ecuacion se obtiene un valor de ancho de banda de: 2.6 eV En la figura 3.2 se presentan el difractograma del catalizador sintetizado por el método sol-gel y calcinado a una temperatura de 500ºC bajo atmósfera de aire. El patrón de DRX de la muestra de TiO2 calcinado a 500 ºC presenta los picos de difracción de la fase anatasa a 25.28º, 37.84º, 48.06º y 55.14º. Los parámetros de la estructura cristalina de la ilmenita pura fueron determinados por Rietveld utilizando el software Topaz. Estos resultados confirman que la ilmenita pura tiene una estructura romboédrica. Como era de FeTiO3 la intensidad de los picos característicos a 35.2º y 53.05º. Figura 3.2 Patrones de difracción de rayos X de los catalizadores: FeTiO₃/TiO₂ sintetizados por el método sol-gel 41 RESULTADOS 3.3 Pruebas de actividad del catalizador El barrido del colorante azul mezclilla de 570 a 590 nm se presenta en la figura 3.3, se puede observar claramente que la absorbancia máxima para este colorante es en la longitud de onda de 575 nm esta longitud de onda se utiliza para realizar todas las muestras de reacción de las pruebas de actividad del catalizador FeTiO₃/TiO₂. Figura 3.3 Barrido del colorante azul mezclilla Se realizó una prueba fotoquímica para observar el efecto de la luz UV en la solución del colorante azul mezclilla, se puede observar que no hay disminución de la concentración del contaminante en 90 minutos de reacción. (Fig.3.4) Figura 3.4 Correlación partes por millón contra tiempo de reacción sin catalizador 42 RESULTADOS En la figura 3.5 se presenta el perfil de degradación del colorante azul mezclilla (40 ppm) utilizando una masa de catalizador de 0.25 g de FeTiO₃/TiO₂. Figura 3.5 Degradación del colorante azul mezclilla (40ppm) con 0.25 g FeTiO₃/TiO₂ En la figura 3.6 se presenta el perfil de degradación del colorante azul mezclilla (40 ppm) utilizando una masa de catalizador de 0.35 g de FeTiO₃/TiO₂. Figura 3.6 Degradación del colorante azul mezclilla (40ppm) con 0.35 g FeTiO₃/TiO₂ 43 RESULTADOS En la figura 3.7 se presenta el perfil de degradación del colorante azul mezclilla (40 ppm) utilizando una masa de catalizador de 0.45 g de FeTiO₃/TiO₂. Figura 3.7 Degradación del colorante azul mezclilla (40ppm) con 0.45 g FeTiO₃/TiO₂ En la figura 3.8 se presenta el perfil de degradación del colorante azul mezclilla (40 ppm) utilizando una masa de catalizador de 0.55 g de FeTiO₃/TiO₂. Figura 3.8 Degradación del colorante azul mezclilla (40ppm) con 0.55 g FeTiO₃/TiO₂ 44 RESULTADOS En la gráfica siguiente se muestra el comparativo de todas las masas del catalizador FeTiO₃/TiO₂, dónde se logra apreciar los lapsos de degradación del colorante azul mezclilla con las diferentes masas que se utilizaron para cada reacción. Figura 3.9 Gráfico comparativo de todas las masas del catalizador FeTiO₃/TiO₂ 45 CONCLUSIONES CONCLUSIONES Se logró sintetizar un catalizador del tipo FeTiO₃/TiO₂ mediante el método sol-gel utilizando como precursor butóxido de titanio IV (90 %) y como dopante (FeTiO₃) (10%). El catalizador del tipo FeTiO₃/TiO₂ se caracterizó mediante difracción de rayos x y se comprobó la presencia de la fase anatasa en la estructura cristalina del catalizador. También se caracterizó mediante espectroscopia de Uv-vis acoplado a una esfera de integración de reflectancia difusa se determinó la longitud de onda a la cual absorbe el catalizador y corresponde a 465 nm, que indica que este material puede ser activado en presencia de luz ultravioleta. El catalizador se probó en un sistema de reacción tipo batch con una solución del colorante azúl mezclilla, en presencia de radiación ultravioleta, en el cual fue activo. Se probaron diferentes masas de catalizador (FeTiO₃/TiO₂) y se encontró que la masa óptima del catalizador es 0.55 g en 500 mL de solución. Se propone realizar modificaciones (efectuar rigurosamente cada paso del proceso ya que se puede alterar el tamaño de particula al no calcinar correctamente, por ejemplo.) al proceso de síntesis de catalizador (FeTiO₃/TiO₂) para mejorar sus propiedades fotocatalíticas y complementar las pruebas de caracterización (Difracción de rayos X y Espectroscopía de UV-vis con reflectancia difusa). Se sugiere tener mayor cuidado en la etapa de síntesis de catalizador, tratando de mejorar el equipo donde se llevó a cabo la hidrólisis, en particular el agitador porque fue complicado adaptarlo al sistema de mezclado. V BIBLIOGRAFÍA BIBLIOGRAFÍA 1. 2. I.N. Martyanov, E.N. Savinov, J. Photochem. Photobiol. A: Chem.2000 Doménech, X., Litter, M., Mansilla,H., Procesos Avanzados de Oxidación para la eliminación de contaminantes, en Blesa, M.A., Sánchez, B., editores, Eliminación de contaminantes por fotocatálisis heterogénea, Editorial CIEMAT, 2004. 3. Química Ambiental, Bird, Colin., Reverte, 2001. 4. Martínez,G. (2010) Procesos Avanzados de Oxidación.Fecha de consulta: 13 de Diciembre del 2014. URL:Catarina.udlap.mx/u_dl_a/tales/documentos/lqu/martinez_d_gp/capit ulo3.pdf De Lasa, H.; Serrano, B.; y Salaices, M. (2005). Photocatalytic Reaction 5. Engineering. USA:Springer. 6. Blanco-Gálvez,J. , Fernández-Ibáñez,P. and Malato-Rodríguez. (2007). Advances in Chemical Engineering:Photocatalytic Technologies. Houston: AP. 7. Hernández Ramírez, A.; Materiales fotocatalíticos y procesos fotoelectroquímicos para tratamientos de contaminantes de agua. Universidad Autónoma de Nuevo León. Facultad de Ciencias Químicas. 8. Quiminet.com., (Enero 30,2006). ¿Para qué se usa el Dióxido de Titanio?. 9. 24 de Septiembre del 2014, de Quiminet.com Sitio web: http://www.quiminet.com/articulos/para-que-se-usa-el-dioxido-detitanio-5346.htm S. Hurbult Cornelius; Klein C., (1997). Manual de Mineralogía Vol. II: Basado en la obra de J.D. Dana. España: Reverte. 10. Besoain E. (1985). Mineralogía de arcillas de suelos. San José, Costa Rica: IICA. 1216 p. – (IICA /Serie de libros y materiales educativos; no. 60). VI BIBLIOGRAFÍA 11. Ruíz F.; Martínez J.R.; Universidad Autónoma de San Luis. Biblioteca [en línea]. Actualizada: diciembre 2000. [Fecha de consulta: 25 octubre 2014].Disponible:www.fis.cinvestav.mx/~smcsyv/supyvac/11/sv110100.pdf 12. Hahn, Dr. Christoph. (2009). Ciencia y tecnología. España: Parragon. 13. Bailey, P.Jr., Bailey, Christina. (1995). Química Orgánica. México: Pearson Educación. Ibarz B., Química general moderna, Ed. Marìn. 14. 15. 16. R.A. Luna Sánchez, B.B. Zermeño-Reséndiz,E. Moctezuma, et al. Fotodegradación de omeprazol en solución acuosa utilizando TiO2 como catalizador. Revista mexicana de Ingeniería, Universidad Autónoma Metropolitana Unidad Iztapalapa, México, ISSN (Versión Impresa): 16652738 Latham J.L. (1980). Elementos de cinética de reacciones. México,df: El manual moderno. 17. Perry Robert H. y Green, Don W. (2012). Manual del ingeniero químico. España:Mc graw hill. 18. Braz J. Chem(2002).Brazilian Journal of chemical engineering. Evaluation of Nb₂O₅ and Ag Nb₂O₅ in the photocatalytic degradation of dyes from textile industries. 19. Paredes Vera, M. (2009). Degradación Fotocatalítica de Colorantes Comerciales. Tesis de licenciatura. Universidad Veracruzana, Facultad de Ciencias Químicas, México. 20. Lugo G., Claudio A.; García M, Edder J., Rondón C. Jairo J., Meléndez Q. Hildemaro J., Pérez D. Patricia, Del Castillo Héctor. Preparación y Caracterización de Óxidos Mixtos nanoestructurados soportados sobre MgO. Avances en Química, 5(1), 37-44 (2010). 21. Rosas, Javier. (2009). Diccionario de Química. México: Editores Mexicanos Unidos, S.A. ANEXOS = HOJA DE DATOS DE SEGURIDAD = FICHA DE DATOS DE SEGURIDAD DE MATERIALES (MSDS/FDS) = TiO₂= TiO₂-DIOXIDO DE TITANIO 1. IDENTIFICACION DE LA SUSTANCIA/PREPARADO DE LA EMPRESA 1.1 Identificación de la sustancia: 1.1.1 Nombre Comercial: DIÓXIDO DE TITANIO. 1.1.2 Nº CAS: 13463-67-7 1.1.3 EINECS: 236-675-5 1.2 Usos pertinentes identificados de la sustancia o de la mezcla y usos desaconsejados: Pigmentos y colorantes, inorgánicos. 2. IDENTIFICACIÓN DE PELIGROSIDAD 2.1 Clasificación de la sustancia o la mezcla: La sustancia no se ha clasificado como peligrosa de acuerdo con el Reglamento (CE) 1272/2008. La sustancia no se ha clasificado como peligrosa de acuerdo con la Directiva 67/548/EEC y sus enmiendas. 2.2 Elementos de la etiqueta: La sustancia no está clasificada como peligrosa, no tiene que llevar indicaciones de peligro, palabras de advertencia y/o consejos de prudencia en su etiquetado. 2.3 Otros peligros: Resultados PBT y mPmB: No aplica según Reglamento 1907/2006, anexo XIII Otros peligros: Este material se suministra en forma de polvo. Puede provocar irritación mecánica de vías respiratorias, piel y ojos. 3. COMPOSICIÓN/INFORMACIÓN SOBRE LOS COMPONENTES 3.1 Sustancia: Identificación química: Titanio (IV) óxido. Impurezas: No se conocen impurezas relevantes sometidas a clasificación como sustancias peligrosas 4. PRIMEROS AUXILIOS 4.1 Descripción de los primeros auxilios Contacto con los ojos: Lavar los ojos con agua abundante. Obtener atención médica si se produce irritación. Contacto con la piel: Lavar con agua y jabón. Acudir al médico, singularmente se produce irritación. Inhalación: Desplazar a la persona afectada desde la zona de exposición al exterior. Si tiene problemas para Respirar o se produce parada respiratoria, avisar a emergencias médicas de forma inmediata y Practicar primeros auxilios respiratorios. Ingestión: Sustancia inocua y no asimilable por el aparato digestivo. 4.2 Principales síntomas y efectos agudos retardados No existen datos relevantes disponibles 4.3 Indicación de toda atención médica y de los tratamientos especiales que deban dispensarse inmediatamente. No existen datos relevantes disponibles ANEXOS TiO₂-DIOXIDO DE TITANIO 5. MEDIDAS DE LUCHA CONTRA INCENDIOS 5.1 Medios de extinción Adecuados: En caso de incendio, use agua pulverizada (neblina), espuma, polvo químico seco o CO₂. No adecuados: No se conocen. 5.2 Peligros específicos derivados de la sustancia Riesgos especiales de la sustancia: No hay riesgo específico de fuego o explosión Productos de combustión peligrosos: No hay datos específicos. 5.3 Recomendaciones para el personal de lucha contra incendios Equipos de protección especial para los bomberos: Los bomberos deben llevar equipo de protección Apropiado y un equipo de respiración autónomo (SCBA) con máscara facial completa que opere en Modo de presión positiva. 6. MEDIDAS ANTE VERTIDOS ACCIDENTALES 6.1 Precauciones personales, equipo de protección y procedimientos o de emergencia: No debe realizarse acción alguna que suponga un riesgo personal o sin una formación adecuada. Mantener alejado al personal innecesario y sin protección. Proporcionar un riesgo personal o sin una formación adecuada. Use el equipo de protección personal. Peligro de resbalar sobre el producto derramado. 6.2 Precauciones relativas al medio ambiente: Evitar la dispersión del material derramado, su contacto con el suelo, los canales, desagües y las alcantarillas. Informar a las autoridades pertinentes si el producto ha causado contaminación medioambiental (alcantarillas, Canales , tierra o aire) 6.3 Métodos y material de contención y de limpieza Derrame pequeño: Mueva los contenedores del área del derrame. Aspire o barra el material y colóquelo en un envase de desperdicio etiquetado. Disponga su eliminación por medio de un contratista autorizado para su eliminación. Gran derrame: Mueva los contenedores del área del derrame. Impedir la entrada en alcantarillas, canales de agua, sótanos o áreas confinadas. Aspire o barra el material y colóquelo en un envase de desperdicio etiquetado. Disponga su eliminación por medio de un contratista autorizado para su eliminación. 7. MANIPULACION Y ALMACENAMIENTO 7.1 Precauciones para una manipulación segura: No se requieren medidas especiales. 7.2 Condiciones de almacenamiento seguro, incluidas posibles incompatibilidades: No se requieren medidas especiales. 7.3 Usos específicos finales. Recomendaciones: No se requieren medidas especiales. ANEXOS TiO₂-DIOXIDO DE TITANIO 8. CONTROLES DE EXPOSICION Y PROTECCION PERSONAL 8.1 Parámetros de control Valores límite de la Exposición: VLA-ED: No dispone. VLA-EC: No dispone. VLB: No dispone Niveles sin efecto derivado en los trabajadores Exposición a largo plazo – Efectos sistémicos Inhalación. DNEL (nivel sin efecto derivado): 10 mg/mᵌ Exposición a largo plazo – Efectos locales Inhalación. DNEL (nivel sin efecto derivado): 10 mg/mᵌ 8.2 Controles de la exposición 8.2.1 Medidas técnicas : No hay requisitos de ventilación especiales.Una buena ventilación general debería, ser suficiente para controlar la exposición de los trabajadores a contaminantes en el aire. 8.2.2 Medidas de protección personal: Protección respiratoria: Recomendado: Máscara de protección contra el polvo Protección de las manos: Recomendado: Guantes Protección de los ojos: Recomendado: Gafas de seguridad con protección lateral. Deben usarse gafas de seguridad que cumplan con las normas aprobadas, cuando una evaluación del riesgo indique que sea necesario, para evitar toda exposición a salpicaduras del líquido, llovizna, gases o polvos. Protección de la piel: Deben ser seleccionados equipos de protección personal para el cuerpo, basados en la tarea a ejecutar y los riesgos involucrados, y debe ser aprobado por un especialista antes de manipular este producto. Medidas de higiene: lávese las manos, antebrazos y cara completamente después de manejar productos químicos, antes de comer, fumar y usar el lavabo y al final del periodo de trabajo. Usar las técnicas apropiadas para eliminar la ropa contaminada. Lavar la ropa contaminada antes de reutilizar. Verifique que los equipos de lavaojos y duchas de seguridad están cerca de las zonas de trabajo. 8.2.3 Controles de la exposición del medio ambiente Medidas técnicas: Las emisiones de los equipos de ventilación o procesos de trabajo deben ser evaluados para verificar que cumplan con los requisitos de la legislación de protección del medio ambiente. En algunos casos, será necesario el uso de filtros de polvo o modificaciones del diseño del equipo del proceso, para reducir las emisiones a niveles aceptables. ANEXOS TiO₂-DIOXIDO DE TITANIO 9. PROPIEDADES FISICAS Y QUIMICAS 9.1 Información sobre propiedades físicas y químicas básicas Información general Apariencia Estado físico: Sólido. (Polvo) Color: Blanco. Olor: Inodoro. Información importante en relación con la salud, la seguridad y el medio ambiente pH: aprox. 7,0 a 20 ºC Punto de fusión:>1000ºC (P. Atm 1013hPa). Densidad: 4,1 kg/L (20ºC) Inflamabilidad: No inflamable Propiedad explosiva: Sustancia no explosiva Propiedad oxidante: Sustancia con propiedades no oxidantes 10. ESTABILIDAD Y REACTIVIDAD 10.1 Reactividad: No hay disponibles datos. 10.2 Estabilidad química: El producto es estable. 10.3 Posibilidad de reacciones peligrosas: En condiciones normales de almacenamiento y uso, no se producen reacciones peligrosas. 10.4 Condiciones que deben evitarse: Ningún dato específico. 10.5 Materiales incompatibles: Ningún dato específico. 10.6 Productos de descomposición peligrosos: En condiciones normales de almacenamiento y uso, no se deberían formar productos de descomposición. 11. INFORMACION ECOLOGICA El producto es inerte, insoluble en agua y biológicamente inactivo. Se separa en los procesos de filtración y sedimentación, eliminándose del agua. 12. INFORMACION SOBRE ELIMINACION 12.1 Métodos para el tratamiento de residuos 12.1.1 PRODUCTO ANEXOS Métodos de eliminación: Comprobar la posibilidad de reutilizar el producto. Los residuos de productos y los envases vacíos que contengan residuos se embalarán o cerrarán respectivamente, marcándose y disponiéndolos para su evacuación adecuada o su reutilización según las normativas nacionales y locales vigentes. Para la eliminación de grandes cantidades, hablar con el proveedor de residuos. Cuando se traspasan los envases vacíos sin limpiar, el destinatario debe ser advertido de los posibles peligros de los residuos. Para su eliminación dentro de la CE, se debe utilizar el código según la Lista de Residuos Europeos (LER). Es responsabilidad del generador asignar al residuo el código residual específico para los sectores y procesos industriales, según la LER. Residuos Peligrosos: Según los conocimientos actuales, este producto no es un residuo peligroso, en virtud de la Directiva 91/689/CE de la Unión Europea. 12.1.2 EMPAQUETADO Métodos de eliminación: Los envases o embalajes deben vaciarse de forma óptima, y deben ser reutilizados o reciclados, tras limpiarlos adecuadamente. Se debe evitar o minimizar la generación de desechos cuando sea posible. Sólo se deben contemplar la incineración o el enterramiento cuando el reciclaje no sea factible. Precauciones especiales: Elimínense los residuos del producto y sus recipientes con todas las precauciones posibles. Los envases o los revestimientos pueden retener residuos del producto. 13. INFORMACION REGLAMENTARIA 13.1 Reglamentación y legislación en materia de seguridad, salud y medio ambiente específica para la sustancia o la mezcla - Reglamento de la UE (CE) nº. 1907/2006 (REACH) Anexo XVII – Restricciones a la fabricación, la comercialización y el uso de determinadas sustancias, mezclas y artículos peligrosos: No aplicable. Directiva 67 /548 / EEC: No aplica 13.1.2 Evaluación de la seguridad química: No aplica ANEXOS = HOJA DE DATOS DE SEGURIDAD = FICHA DE DATOS DE SEGURIDAD DE MATERIALES (MSDS/FDS ) PRODUCTOS DE ARENA = Ilmenita= FeTiO₃-TITANATO DE FIERRO IDENTIFICACION Y COMPOSICION Nombre del producto: Moma Ilmenita Numero CSA: 98072-94-7 Clase y riesgo secundario: Ninguno asignado Código Hazchem: Ninguno asignado Lista de venenos: Ninguno asignado Usos: Materia prima para el dióxido de titanio, fabricación de pigmentos. Materia prima del rutilo sintético. También se utiliza en la barra de soldadura flujo y BOF hornos de fabricación de acero. DESCRIPCION FISICA / PROPIEDADES Solubilidad en agua: despreciable Gravedad especifica: 4.3 – 4.6 Otras Propiedades. pH: Neutral Densidad aparente: 2400 – 2700 kg/mᵌ Tamaño del grano (D50): 140 -160 micron Angulo de reposo: 32º Contenido de humedad: 0 – 1% EFECTOS SOBRE LA SALUD No toxico. No hay peligros conocidos resultantes de ingestión accidental como puede ocurrir durante la manipulación normal. La ingestión de una cantidad grande puede causar irritación en el sistema digestivo debido a la abrasividad. Ojo: Polvo sólido y puede ser moderadamente irritante debido a abrasividad. Piel: Bajo riesgo Inhalada: Normalmente considerado como polvo molesto general, pero puede ser irritante si se inhala en una alta concentración. PRECAUCIONES DE USO Normas de exposición: TWA inhalable generales polvo molesto – 10 mg /ᵌ (ocupacional), Sílice libre respirable TWA – 0,2 mg / mᵌ . Radiación (combinado alfa y gamma) la exposición debería ser tan bajo como sea razonablemente posible, (ALARA), pero no debe exceder un total de 100 mili-seiverts durante 5 años consecutivos. Controles de ingeniería: Los requisitos de ventilación dependerán en el manejo de métodos y la cantidad en uso, pero debe ser suficiente mantener los niveles de polvo por debajo de los límites de exposición. Puntos de la generación de polvo, como el transporte y la tolva descarga deberían estar equipados con un sistema de extracción eficaz. Protección personal: Gafas de seguridad, si el riesgo de inhalado el polvo este presente, use como mínimo un respirador aprobado (tipo desechable o cartucho) Fuego: No aplicable ANEXOS FeTiO₃-TITANATO DE FIERRO PRIMEROS AUXILIOS Ingerir: Es poco probable que se requiera de primeros auxilios, pero si enjuagarse la boca con suficiente agua, busque atención medica como precaución si se produce incomodidad. Ojos: Mantenga los parpados abiertos y lavar con abundante agua limpia, continuar durante al menos 15 minutos o hasta que se retire la arena, busque atención medica si el dolor o la irritación persiste. Piel: Retire con cuidado la ropa contaminada para evitar la generación de polvo, lavar el material de la piel, si de nuevo hace contacto y provoca irritación acuda al médico, lávese la ropa antes de volver a usarla. Inhalación: Salir al aire libre, sople la nariz para eliminar las partículas de los pasajes nasales, si sucede alguna reacción adversa acuda al médico. Instalaciones de primeros auxilios: las instalaciones de lavado de ojos. INFORMACION DE MANEJO DE SEGURIDAD Almacenamiento y transporte no está regulado, sin embargo los camiones deben estar cubiertos al transportar el producto a granel seco para evitar la creación de polvo. Las áreas de almacenamiento deben estar ventiladas y la generación de polvo minimiza al manejar. Derrames y Eliminación: Usar el equipo de seguridad para la normal manipulación. Evitar la generación de polvo. Aspirar lo más posible, de lo contrario barrer. Si el producto derramado no es adecuado para la reutilización, amortiguar, recoger y donde sea posible regresar al fabricante para su reprocesamiento. De otro modo enajenar a un vertedero autorizado y la cubierta con relleno limpio. Riesgo de incendio / explosión: No aplicable AVISAR AL DOCTOR, para tratar los síntomas. Crónica: La sílice de sílice es una causa conocida de la fibrosis pulmonar (silicosis). Se ha también clasificado como un ser carcinógeno. La arena de ilmenita contiene una pequeña cantidad de cuarzo libre, y se deben tomar precauciones para evitar la inhalación del polvo. Radiación: En común con muchos minerales, la ilmenita contiene niveles muy bajos de origen natural de los elementos radiactivos las series del uranio y el torio. La radiación principal del producto es la exposición interna a partículas de alfa emitidas por el polvo inhalado. La exposición prolongada a bajo nivel de radiación gamma en bolsas de ilmenita puede presentar un peligro externo menor. OTRA INFORMACION El material es poco probable que cause cualquier daño ambiental. Es insoluble en agua y es poco probable que contamine cursos de agua o las cadenas alimentarias. ANEXOS = MANUAL DE OPERACIÓN DEL ESPECTROFOTOMETRO = JENWAY 7305 Pantalla de Inicio. Mantenimiento de Rutina. Asegúrese de que las superficies externas de la unidad estén limpias y libres de polvo. El área de la muestra siempre debe mantenerse limpia y cualquier derrame accidental, debe eliminarse inmediatamente. Para dar mayor protección cuando no esté en uso, la unidad debe estar desconectada de la red eléctrica y se cubre con la cubierta de polvo opcional El único mantenimiento de rutina que tal vez se requiere es la sustitución de la fuente de luz que deben utilizarse los repuestos originales, ya que las lámparas similares pueden tener diferentes configuraciones de incandescencia o sea la longitud de onda limitada para su uso doméstico o comercial y dará errores si se utiliza. MEDICION DE LA ESPECTROFOTOMETRIA. Espectroscopia UV-visible es la medición de la absorbancia de luz a una longitud de onda específica en una muestra. Esto se utiliza para identificar la presencia y concentración de entidades moleculares dentro de la muestra. La ley de Beer-Lambert se utiliza para relacionar la absorción de la luz a las propiedades de la muestra. Esta ley muestra que la absorbancia es lineal a la concentración, pero esto solo es cierto para concentraciones bajas, para niveles de absorbancia por encima de la concentración de 3 comienza a alejarse de la relación lineal. Transmitancia es la proporción de la luz que pasa a través de la muestra ANEXOS JENWAY 7305 PAUTAS DE UNA BUENA PRACTICA Para un rendimiento óptimo todos los espectrofotómetros deberían estar situados en un ambiente libre de polvo, seco y limpio. La temperatura ambiente y el uso de los niveles debe mantenerse lo más constante posible. Para los procedimientos operativos estándar (SOP) y Buenas prácticas de laboratorio (BPL) deben ser controlados con un programa adecuado de control de calidad (QC) cheques y calibración regulares. La tapa de la cámara de la muestra debe estar completamente cerrada durante la medición y antes de cualquier lectura. La selección correcta de los contenedores de muestras es imprescindible para obtener resultados exactos y reproducibles: a) Comprobar que el material del recipiente de la muestra es compatible con las longitudes de onda que se utilizaran para la medición. En el vidrio en general sólo se puede utilizar hasta 360 nm o 320 nm en función de la calidad. Cubetas de plástico estándar pueden usarse hasta 320 nm. Versiones especiales UV pueden ser utilizados hasta 260 nm. Por debajo de este nivel se deben utilizar cubetas de cuarzo. b) Cubetas desechables de plástico solo deben usarse una vez. c) Las cubetas de vidrio deben limpiarse a fondo después de su uso. Deseche cuando rasguños se hacen evidentes en superficies ópticas. d) Se debe tener cuidado al seleccionar semi-micro o micro cubetas. La zona llena de muestra debe ser más ancha que la abertura en el soporte de muestra o la luz llegará al detector sin pasar a través de la muestra. e) Tubos de ensayo de vidrio y otros tubos de muestras se deben utilizar con cuidado. Siempre que sea posible la marca de índice en la posición correcta antes de realizar mediciones. f) Las cubetas de plástico no son compatibles con disolventes orgánicos. g) Todos los recipientes de las muestras deben manipularse con cuidado; solo por las superficies superior, inferior y no por los ópticos. La marca evidente de cualquier dedo debe ser eliminado por un proceso de limpieza adecuado. Las muestras y los estándares no deben almacenarse en cubetas o contenedores abiertos de lo contrario el resultado será la evaporación, cambia el valor y provoca manchas en las paredes que pueden ser irreversibles. Las muestras se deben permitir que se equilibren a temperatura ambiente antes de la medición (o depende de casos especiales). El cambio de temperatura durante la medida puede causar que se formen burbujas de aire en las paredes del recipiente de la muestra. Esta es una causa común que deriva durante la medición. Todas las medidas requieren una calibración de un espacio en blanco, para la próxima precisión este debe estar preparado con cuidado usando la misma agua desionizada o disolvente utilizado para disolver o diluir la muestra. ANEXOS Las desviaciones de la ley de Lambert-Beer pueden ocurrir en concentraciones altas y bajas que dan respuestas correctas durante las mediciones de concentración de la muestra. Para todos los nuevos métodos de un rango lineal debe ser definido por la preparación de una curva de calibración. Cubetas y soportes de muestra deben ser llenados a un nivel mínimo que cubra el trayecto de la luz. Todos los espectrofotómetros Jenway tienen una altura de haz de 15 mm. El instrumento debe ser calibrado a cero absorbancia/transmitancia del 100% antes de tomar lecturas.