Gases ideales: Leyes de Charles y de Boyle
Anuncio

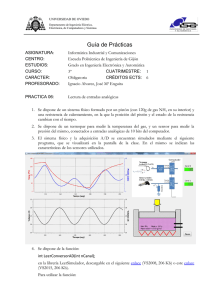
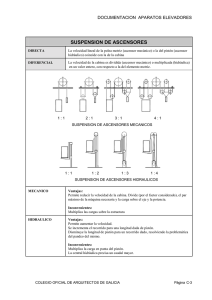
Lab. Termodinámica 12-13 Gases ideales: Leyes de Charles y de Boyle 1. Objetivo El objetivo de esta práctica consiste en estudiar el funcionamiento de un termómetro de gas, o de forma equivalente, del estudio de la ley de Charles y la Ley de Boyle. 2. Material Pistón. Depósito de aluminio. Vasos de precipitados. Tubos de conexión. Hielo picado. Sensor de presión Data-logger Mechero / Placa calefactora 3. Ley de Charles: Introducción Jacques Charles y Joseph-Louis Gay-Lussac, a comienzos de 1800, estudiaron con detalle qué relaciones existían entre la temperatura de los gases y el volumen que ocupaban. La moda de volar en globos aerostáticos fue un incentivo importante en sus investigaciones. La relación encontrada entre estas dos magnitudes es una simple proporcionalidad directa: Si la cantidad de gas y la presión a la que se encuentra se mantiene constante (por ejemplo realizando los experimentos a presión atmosférica y en un recipiente perfectamente cerrado) entonces podemos escribir: V = Vo (1 + a tC ) (1) en donde Vo es el volumen inicial y tC es la temperatura en la escala Celsius. Esta ley se conoce como Ley de Charles (1802). La ley de Charles, junto con las de Boyle y el principio de Avogadro conducen a la bien conocida ecuación de estado de los gases ideales: pV=nRT (2) en donde p es la presión del gas, V es su volumen, n es el número de moles, T es la temperatura absoluta y R es la constante de los gases ideales. Nuestro primer objetivo será comprobar la ley de Charles en el laboratorio. 1 Lab. Termodinámica 12-13 4. Procedimiento El montaje consiste en conectar el pistón al recipiente de aluminio, de forma que dejen perfectamente encerrado un volumen de gas con el que trabajaremos. Introduciremos el recipiente de gas en el baño termostático (un vaso de precipitados grande) para modificar la temperatura, tal y como aparece en el esquema de la figura: Al calentar el gas en el recipiente inmerso en el agua caliente, se dilatará y empujará el pistón. Leyendo sobre la escala graduada podremos saber el aumento de volumen experimentado por el gas. Es importante colocar el pistón horizontal sobre la mesa (ver figura) para que todo el gas se encuentre a la misma presión (la atmosférica). El procedimiento detallado es el siguiente: • Conectar mediante el tubo el pistón y el depósito de aluminio. • Cerrar la otra válvula del pistón o bien conectarla al sensor de presión (aunque no se utilice en la primera parte de la práctica) para que no haya fugas de aire. • Introducir el depósito de aluminio en un vaso de precipitados con agua y hielo. Cuando el sistema equilibre su temperatura, abrir una de las válvulas, ajustar la posición del pistón cerca del principio de su recorrido y volver a cerrarla. De este modo el volumen inicial de gas será el contenido exclusivamente en el depósito de aluminio (despreciando el que queda en los tubos) y la temperatura de 0ºC (Tomar medidas, no obstante, de la temperatura exacta a la que se encuentra la mezcla de hielo y agua). • Situar ahora el depósito de aluminio en un vaso de precipitados a temperatura ambiente. Anotar el aumento de volumen experimentado y la temperatura del agua. En este primer momento el gas está todo a la misma temperatura (suponiendo que el agua esté a la misma temperatura que el aire). • Introducir el depósito de aluminio en agua dentro de un vaso de precipitados y calentarlo. Construir una tabla de valores de temperaturas T y de los correspondientes desplazamientos del pistón Δl para luego calcular los incrementos de volumen respectivos ΔV. Tomar 10 valores hasta llegar a los 75 ºC. Siguiendo este procedimiento dispondremos de datos para construir un gráfico en el que se muestre la variación del volumen con la temperatura (ΔV frente a T). Si queremos trabajar con el volumen total (V), en vez de con ΔV, necesitamos estimar el volumen inicial de gas (cuando Δl = 0). Esto puede hacerse mediante un cálculo directo del volumen del recipiente de aluminio, o bien 2 Lab. Termodinámica 12-13 indirectamente mediante el siguiente argumento. Haciendo uso de la proporcionalidad entre volúmenes y temperaturas medidos a presión constante: V Vo = T To (3) y teniendo en cuenta que V = Vo + ΔV encontramos una ecuación en la que las únicas incógnitas son Vo y To. Es decir; V ΔV = o T − Vo (4) To 1) Con los datos obtenidos de ΔV (en realidad se miden desplazamientos del pistón, es decir, Δl) a cada temperatura T , mediante un ajuste lineal, se calculan Vo y To con sus errores correspondientes. 2) Comparar el valor de To obtenido con el medido (la temperatura cuando ΔV = 0). 3) Una vez calculado Vo ya podemos representar el volumen total del gas V frente a la temperatura T. Si extrapolamos la recta de ajuste, ¿A qué temperatura obtendríamos un volumen nulo? ¿Qué significado tiene esa temperatura de “volumen cero”? Puede que no sea posible interpretar los resultados obtenidos en el párrafo anterior debido al error implícito en el hecho de considerar que el volumen de gas encerrado se encuentra todo a la misma temperatura, cuando en realidad parte de él (el que está en el tubo y el que está en el pistón) están a temperatura inferior. 4) ¿Cómo se manifestará esa aproximación en los resultados anteriores? ¿Qué modificación sencilla crees que se puede hacer para corregir y comprobar que estamos en lo cierto? (sin repetir la práctica, por supuesto) ¿Qué resultados obtenéis para las preguntas del párrafo anterior con esta corrección? 5. Comprobación de la Ley de Boyle El segundo objetivo de esta práctica es realizar una comprobación de la Ley de Boyle: pV = po Vo Esta ley establece que el producto pV es constante para una cantidad de gas dada, siempre que la temperatura sea constante. Para comprobarlo, tomad el dispositivo anterior, poniendo ahora en pistón vertical, e id colocando sobre el émbolo masas crecientes anotando el volumen del pistón. No carguéis más de 70 g sobre el émbolo si su diámetro es de 15.9 mm, pues podríais dañar el mecanismo. Tomad un mínimo de 6 valores de masa. Hay que tener en cuenta que el sensor de presión sólo mide presiones relativas menores de 10 kPa. La presión del gas es la suma de dicha presión relativa y la presión atmosférica (101.3 kPa). 5) Como resultado, representad en una gráfica p frente a 1/V y comprobar si se obtiene la expresión esperada. Dad los valores de la pendiente y la ordenada en el origen con su error, e interpretad estos resultados. (Nota: V es suma de los volúmenes en el pistón y en el depósito de aluminio). 3