6301_Guia del Aula - Universidad de Buenos Aires
Anuncio
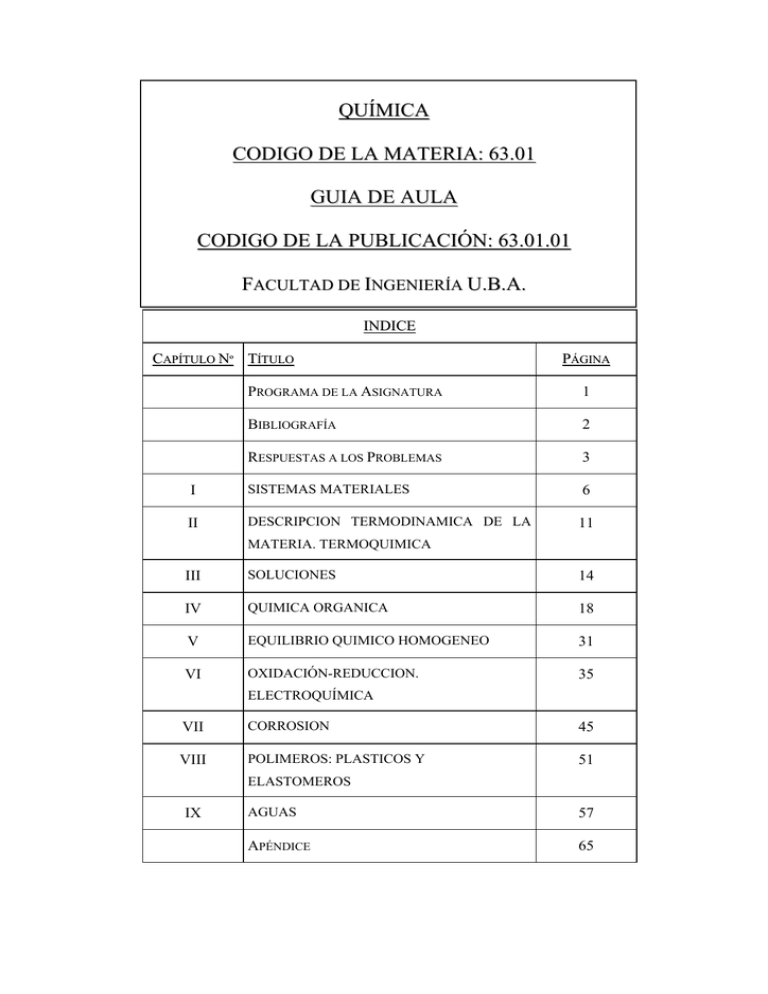
QUÍMICA CODIGO DE LA MATERIA: 63.01 GUIA DE AULA CODIGO DE LA PUBLICACIÓN: 63.01.01 FACULTAD DE INGENIERÍA U.B.A. INDICE CAPÍTULO Nº TÍTULO PÁGINA PROGRAMA DE LA ASIGNATURA 1 BIBLIOGRAFÍA 2 RESPUESTAS A LOS PROBLEMAS 3 I SISTEMAS MATERIALES 6 II DESCRIPCION TERMODINAMICA DE LA 11 MATERIA. TERMOQUIMICA III SOLUCIONES 14 IV QUIMICA ORGANICA 18 V EQUILIBRIO QUIMICO HOMOGENEO 31 VI OXIDACIÓN-REDUCCION. 35 ELECTROQUÍMICA VII CORROSION 45 VIII POLIMEROS: PLASTICOS Y 51 ELASTOMEROS IX AGUAS 57 APÉNDICE 65 (63.01) QUIMICA NUMERO DE CREDITOS: 6 Capítulo I - SISTEMAS MATERIALES Clasificación de sistemas materiales. Métodos de separación de fases y de fraccionamiento. Sistemas coloidales: soles, emulsiones, nieblas, humos, espumas, geles. Propiedades que los diferencian de las soluciones y de las dispersiones no coloidales: mecánicas, ópticas, eléctricas. Soles liófilos y liófobos. Estabilidad. Protección y desestabilización. Coagulación. Electroforesis: aplicaciones industriales. Gases, líquidos y sólidos. Descripción macro y submicroscópica. Cambios de estado. Líquidos: viscosidad, tensión interfacial, presión de vapor. Equilibrios de fases en sistemas de un sólo componente, diagramas de fases de sustancias puras. Metales y No Metales. Sólidos cristalinos y no cristalinos. Cristal, red cristalina, nodo, celda unitaria. Tipos de sólidos cristalinos: constitución, propiedades y ejemplos. Capítulo II – TERMODINÁMICA QUÍMICA. TERMOQUIMICA Sistema, medio, universo. Estado termodinámico de un sistema. Trabajo mecánico de expansióncompresión. Calor. Calor sensible y calor latente. Calor específico de sustancias puras. Sistema cerrado: primer principio de la termodinámica. Energía interna y entalpía. Funciones de estado y funciones de línea. Evoluciones a presión constante, a volumen constante, a temperatura constante y adiabáticas. Reacciones químicas exotérmicas y endotérmicas. Ecuación termoquímica. Entalpía de reacción. Capítulo III - SOLUCIONES Solubilidad ilimitada y limitada. Factores que determinan la magnitud de la solubilidad. Curvas de solubilidad. Estequiometría de las reacciones en solución acuosa. Reacciones de neutralización. Equivalente gramo de neutralización. Punto de equivalencia. Valoración volumétrica ácido-base. Titulación. Punto final. Capítulo IV - QUIMICA ORGANICA Generalidades. Función química. Isomería. Principales funciones de la Química Orgánica y reglas de nomenclatura. Hidrocarburos: alifáticos y aromáticos. Alcoholes. Eteres. Fenoles. Aldehídos. Cetonas. Acidos carboxílicos, disociación en solución acuosa. Esteres. Funciones nitrogenadas: aminas, amidas, nitrilos. Aminoácidos. La atracción intermolecular por puente de hidrógeno en compuestos orgánicos: su influencia en las temperaturas de ebullición y en la solubilidad. Capítulo V - EQUILIBRIO QUIMICO HOMOGENEO Conceptos generales. Reacciones químicas homogéneas. Reacciones completas e incompletas. Reacciones reversibles. Equilibrio químico: concepto y características. Desplazamiento: principio de Le Chatelier. Aplicaciones. Equilibrio químico molecular en fase gaseosa. Constantes de equilibrio Kp y Kc. Equilibrio iónico en solución acuosa. Disociación electrolítica del agua. Electrolitos débiles y fuertes. Grado de disociación electrolítica. Constantes de disociación electrolítica de ácidos y bases débiles. pH y pOH de soluciones de ácidos y bases fuertes y débiles: cálculos aplicando balances de masa y de carga. Objeto de estudio de la Cinética Química, diferencias fundamentales con el objeto de estudio del Equilibrio Químico. Capítulo VI - OXIDACION-REDUCCION ELECTROQUIMICA Generalidades sobre reacciones redox iónicas. Reacciones redox iónicas y no iónicas. Oxidantes y reductores. Constante de Faraday. Equivalente-gramo redox. Equivalente electroquímico. Diferencia entre reacciones de reactivos “en contacto” y de reactivos a distancia (pilas voltaicas y electrólisis). Conductores eléctricos de primera y segunda especie. Electroquímica. Electrodos. Potencial de electrodo. Determinación. Condiciones patrón. Tablas de potenciales patrón de electrodo. Condiciones no patrón: fórmula de Nernst. Aplicaciones. Determinación potenciométrica del punto final de una titulación de neutralización. Peachímetro. Reacción espontánea: descarga de pila voltaica. Predicción del sentido espontáneo de estas reacciones. Fuerza electromotriz. Pilas de interés práctico. Reacción no espontánea: electrólisis. Predicción de las reacciones en los electrodos. Electrólisis de interés industrial. 1 Capítulo VII - CORROSION Descripción del fenómeno. Corrosión química y corrosión electroquímica.. Corrosión según la forma: uniforme, en placas, por picado, intergranular y fisurante. Velocidad de corrosión. Polarización. Procedimientos de protección. Capítulo VIII - POLIMEROS: PLASTICOS Y ELASTOMEROS Concepto de macromolécula orgánica, polímero, monómero, ségmero. Homopolímero y copolímero. Polímero de adición 1-2 y 1-4. Polímero de condensación lineal y de condensación bi y tridimensional. Materiales termoplásticos, termorrígidos y elastómeros. Comportamiento mecánico de acuerdo a la intensidad de las atracciones intermoleculares. Polímeros vinílicos, poliésteres, siliconas, poliamidas y cauchos. Vulcanización. Capítulo IX - AGUAS Aguas naturales: sus impurezas. Agua para uso doméstico. Potabilización. Agua para uso industrial. Dureza. Ablandamiento. Desionización. TRABAJOS PRACTICOS DE LABORATORIO 1 - TÉCNICAS DE SEPARACIÓN EN SISTEMAS MATERIALES. 2 - REACCIONES DE DOBLE DESCOMPOSICIÓN CON FORMACIÓN DE UNA FASE SÓLIDA. 3 - DETERMINACIÓN DE LA MASA MOLAR DEL MAGNESIO. 4 - SOLUBILIDAD DEL CLORATO DE POTASIO. 5 - NEUTRALIZACIÓN Y TITULACIÓN ÁCIDO-BASE. 6 - REACCIONES REDOX. TITULACIÓN REDOX. 7 - PILA. ELECTRÓLISIS. 8 - CORROSIÓN 9 – TITULACIÓN DE DUREZA TOTAL DE AGUA. ABLANDAMIENTO DE AGUA POR INTERCAMBIO IÓNICO. BIBLIOGRAFIA -T.L. BROWN, H.E. LEMAY, B.E. BURSTEN. QUÍMICA, LA CIENCIA CENTRAL. PEARSON - PRENTICE HALL. -J.B. UMLAND, J.M. BELLAMA. QUÍMICA GENERAL. THOMSON. -K.W. WHITTEN, R.E. DAVIS. QUÍMICA GENERAL. MC GRAW HILL. -P.W. ATKINS. QUÍMICA GENERAL. ADDISON - WESLEY IBEROAMERICANA. -B.C. MAHAN, R.J. MYERS. CURSO DE QUÍMICA UNIVERSITARIO. ADDISON-WESLEY IBEROAMERICANA. -I.N. LEVINE. FISICOQUÍMICA. VOLUMEN 1. MCGRAW-HILL. -R.T. MORRISON, R.N. BOYD. QUÍMICA ORGÁNICA. FONDO EDUCATIVO INTERAMERICANO, ADDISONWESLEY IBEROAMERICANA. -H. HART, D.J. HART, L.E.CRAINE. QUÍMICA ORGÁNICA. MC GRAW HILL. -J. MC MURRY. QUÍMICA ORGÁNICA. GRUPO EDITORIAL IBEROAMERICANA. -C.R. NOLLER. QUÍMICA DE LOS COMPUESTOS ORGÁNICOS. ED. MÉDICO QUIRÚRGICA. BUENOS AIRES. -CRC. HANDBOOK OF CHEMISTRY AND PHYSICS. -P.W. ATKINS. FISICOQUÍMICA. -T. W. G. SOLOMONS. QUÍMICA ORGÁNICA. LIMUSA. -F. A. COTTON, G. WILKINSON. QUÍMICA INORGÁNICA BÁSICA. LIMUSA. 2 RESPUESTAS A LOS PROBLEMAS I - SISTEMAS MATERIALES Líquidos 12)0,0461 g 13)0,34 g (para pv= 80 mmHg) 14)980 g 15)a) 97,7ºC; b) 101,5ºC; c) 49,5ºC 17)78ºC 22) a) 4,840 l b) i) P= 298 mmHg nº de fases= 2 3,719 g en fase gaseosa y 2,281 g en fase líquida ii) P= 206 mmHg nº de fases= 1 6g en fase gaseosa Sólidos 10) 2 átomos 11) 389 pm o 3,89 A II - TERMODINÁMICA QUÍMICA. TERMOQUÍMICA 1) Qagua= 10 kcal; Qalcohol= 5 kcal; Qpetróleo= 5 kcal; Qplomo= 0,31 kcal 2) a) 270 cal; b) 2385 cal; d) 42,2 g 3) 540 kcal/kg 4) W1= -152 kJ; W2= -101,3 kJ; W3= -202,6 kJ Q1 = 917 kJ; Q2= 866,3 kJ; Q3= 967,6 kJ ∆UA-B= 765 kJ ∆HA-B= 1069 kJ 7) -11,6 kJ 8) a) ∆Hr= -405,8 kJ/mol; b) -811,6 kJ; c) -8,8 kJ/g 9) 15,64 g de glucosa 10) 7728,1 kg de carbón 11) –1370,7 kJ 12) b) ∆U= -101,4 kJ ∆H= -180 kJ Q= -180 kJ W= 78,6 kJ c) ∆U= -130,5 kJ ∆H= -180 kJ Q= -180 kJ W= 49,5 kJ 13) a) Q= 52 kJ W= -15 kJ ∆H= 52 kJ ∆U= 37 kJ b) Q= 38 kJ W= 0 ∆H= 52 kJ ∆U= 38 kJ 14) Q= -47 kJ W= 3 kJ ∆H= -47 kJ ∆U= -44 kJ 15) a) 118,25 m3 CNPT/h; b) 91997,4 kcal/h; c) 167 kg/h 16) a) 45,92 kg/día; 101 kg/mes 17) b) 61,4 l; c) pmín= 183 atm y pmáx= 221 atm; d) 2,57 cm 18) 1) 1729,8 l/día; 2) 30 l O2/h 19) a) 11,7%; c) 33,4 mol de CO2 y 38,4 mol de H2O 20) a) 81,8% de CH4 y 18,2% de C2H6 en volumen; b) 4235,44 g; c) 6,1 m3; d) 2286 kcal III - SOLUCIONES 1) a) 1)32,67 g 2) 85,7 g 3) 66,7 g b) 1) 30,61 2) 11,67 3) 15 2) a) 0,4 equivalente-gramo; 0,2 mol b) 0,4 equivalente-gramo ; 0,133 mol 3) a) 0,5 equivalente-gramo 1 equivalente-gramo 1,5 equivalente gramo 4) a) 37,8 g; b) 8,187 g 5) a) 4,653 N; b) 73,5 g 6) a) 2,122 equivalente-gramo; b) 1061 cm3; c) 424 cm3 3 7) 400 cm3 8) 62,72 g 9) a) 0,3 equivalente-gramo; b) 0,3 equivalente-gramo 10) 20 cm3 11) a) 0,03 equivalente-gramo de sal; b) 0,37 equivalente-gramo de ácido 12) b) solución de 0,37 g de KClO3 en 5 g de agua y 1,13 g de KClO3 en fase sólida 13) 325,56 g 14) 0,56 g 15) 259,25 cm3 16) a) 79733,3 l/día; b) 2240 l/día; c) 80 kg/día 17) a) 210 l/h; b) 10,7 kg/h 18) a) 32812 mg de glucosa/l agua, se generan 510,96 kJ/l agua b) 3 difusores-aereadores 19) a) 1,14 l/h; b) 7,98 l 20) 1) 0,55% m/m; 2) pH= 0,7 21) 5 M 22) a) 243,4 g de Ca3(PO4)2; 0,00504 mol de Ca+2/l 23) a) 625,39 l; b) 15ºC V - EQUILIBRIO QUIMICO HOMOGENEO 6) a) [A]= 1,854 mol/l [A2]= 3,573 mol/l Rendimiento= 38,2% 7) a) 0,18 mol de AB2/l, 0,04 mol de B2/l y 0,12 mol de AB3/l; Kp= 0,2175; b) 17,37 atm; c) -38,4 kcal 8) a) Kc= 0,0406 y Kp= 1,7405; b) 0,0466 mol de PCl3/l, 0,0466 mol de Cl2/l y 0,0534 mol de PCl5/l 12) a) 3; b) 7; c) 4,5; d) 6,3; e) 5; f) 9,4 13) 1) [H3O+]= 10-4 [HO-]= 10-10; + -4 2) [H3O ]= 3,2.10 [OH-]= 3,2.10-11 3) [H3O+]= 0,04.10-10 [OH-]= 2,5.10-4 14) a) pH= 1 y pOH= 13; b) pH= 3 y pOH= 11; c)pH= 1,52 y pOH= 12,5; d) pH= 2,7 y pOH= 11,3; e)pH= 13,2 y pOH= 0,8; f) pH= 11 y pOH= 3; g) pH= 13,3 y pOH= 0,7 16) pH= 1,3 17) pH= 2,2 18) a) 10-3 M; b) 10-3 N; c) 0,5.10-3 M; d) 10-3 M e) 5.10-3 g/cm3 19) b) [OH-]= 10-2 M; [Ba2+]= 0,5.10-2 M; c) 10-2 N; c) 0,5.10-2 M; d) 0,856 g 20) a) pH= 7; b) pH= 0,65 21) 24 cm3 22) 247 cm3 23) a) α= 0,115 b) Kb= 0,0013 24) a) pH= 2,41 0,47% de ionización b) pH= 2,91 1,47% de ionización 25) 5,555 mol de NH3; α= 0.0018 26) a) 1,7 b) 2 c) 1,52 d) 3,22 e) 10,78 4 VI - OXIDACION-REDUCCION. ELECTROQUÍMICA 1) a b c d -------------------------------------------Eq-gox (mol) 0,5 0,2 0,33 0,2 -------------------------------------------1 0,5 1 Eq-gred (mol) 1 2) a) 1F = 96500 C; b) qe = 1,6.10-19 C 4) V Cl2 = 12 dm3 8) a) E Fe2+/Fe = -0,49 V, E Fe/Fe2+ = 0,49 V; b) E H+/H2 = -0,03 V, E H2/H+ = 0,03 V; c) E Fe3+/Fe2+ = 0,83 V; E Fe2+/Fe3 = -0,83 V 9) 0,049 V 10) a) E Cd2+/Cd = 0,462 V; E Cl2/Cl- = 1,3 V; Epila= 1,76 V 11) e) Pb: n= 1,5 mol, PbO2 : n = -1,5 mol, H2SO4: n = -3 mol PbSO4 : n = 3 mol, H2O : n = 3 mol; f) 289500 C 13) d) 1,3 V 17) 31,8 g de Cu y 5,6 l de O2 en CNPT 18) a) 2,5 M; b) 2 M 19) CuSO4 H2O Cu O2 PbCl2 Cl2 Pb H2O H2 O2 --------|---------|-------|------|--------|--------|------|------|--------|--------|---------n (mol) -0,01 -0,01 0,01 0,005 -0,01 0,01 0,01 -0,01 0,01 0,005 20) 0,1 eq-g redox 21) a) 33,6 l; b) 67,2 l; 67,2 l 23) a) 50,36 kg de Al; b) 3357,5 g del ánodo de C 24) b) 81 A 26) b) Se requieren 12438 L de solución de NaCl; i = 55845 A; masa excedente de producto: 375 kg de Cl2 CNPT/día c) 560000 l de Cl2 CNPT/día y 560000 l de H2 CNPT/día 27) b) Epila= 1,3 V; 2,45 mol de Zn(NO3)2/L; e) 0,784 l de O2 CNPT 28) b) Volumen del tanque de O2 = 9,526 l; Volumen del tanque de H2 = 19,052 l; c) p O2 = 0,342 atm; p H2 = 0,171 atm 29) a) 148,8 kg de Cu de 99,8% de pureza/ciclo; b) 97%; c) 22279 W 30) a) 246,81 g de Cr(NO3)3; b) 0,995 l de solución/día; c) 69,5% 31) a) 89,7%; b) 0,140 mol/l 32) a)26930 toneladas de vidrio/año; c) 112,68 t H2/año; d) 175 líneas (para 360 días/año) 5 I - SISTEMAS MATERIALES CONCEPTOS A DESARROLLAR Clasificación de sistemas materiales. Métodos de separación de fases y de fraccionamiento. Sistemas coloidales: soles, emulsiones, nieblas, humos, espumas, geles. Propiedades que los diferencian de las soluciones y de las dispersiones no coloidales: mecánicas, ópticas, eléctricas. Soles liófilos y liófobos. Estabilidad. Protección y desestabilización. Coagulación. Electroforesis: aplicaciones industriales. Gases, líquidos y sólidos. Descripción macro y submicroscópica. Cambios de estado. Líquidos: viscosidad, tensión interfacial, presión de vapor. Equilibrios de fases en sistemas de un sólo componente, diagramas de fases de sustancias puras. Metales y No Metales. Sólidos cristalinos y no cristalinos. Cristal, red cristalina, nodo, celda unitaria. Tipos de sólidos cristalinos: constitución, propiedades y ejemplos. EJERCICIOS SISTEMAS COLOIDALES 1) Si se introduce humo de cigarrillo dentro de un tubo donde se ha establecido un fuerte campo eléctrico, se observan depósitos sólidos en las cercanías del cátodo. ¿Qué presunción se puede hacer sobre el humo del cigarrillo para explicar el fenómeno observado? 2) Las partículas dispersas de un sol hidrófobo migran al ánodo (+) en una electroforesis. Si hubiera igualdad de costos, cuál de las siguientes soluciones acuosas, todas de igual concentración, elegiría para flocular dicho sol: AlCl3, MgCl2 o NaCl. Fundamentar la respuesta. 3) Un modo de realizar el aislamiento eléctrico de conductores es recubrirlos con una delgada capa de caucho obtenida por electroforesis a partir de una dispersión coloidal de látex. a) Haga un esquema de un dispositivo para lograr este recubrimiento (el látex es un coloide negativo). b) ¿Por qué el recubrimiento obtenido de este modo es técnica y económicamente conveniente? 4) Cierto río es un sistema coloidal cuyas partículas de SiO2 (sílice) han adsorbido iones negativos. ¿Qué ocurrirá cuando dicha corriente fluvial se introduzca en el mar?. ¿A qué formaciones dará origen? 5) Las aguas del Río de La Plata deben su "color de león" (según el decir de un poeta) a las partículas coloidales de SiO2. Al2O3. xH2O dispersas. En el proceso de potabilización para clarificar el agua se agrega un sol de Al2O3. xH2O (las partículas de este sol adsorben iones positivos). Explicar por qué se clarifica el agua. LIQUIDOS 1) Definir tensión superficial ¿Cuál es la relación entre las fuerzas intermoleculares que existen en en líquido y la tensión superficial? 2) A pesar de que el acero inoxidable es mucho más denso que el agua, una navaja de afeitar puede flotar en el agua ¿Por qué? 3) Utilizar el agua y el mercurio como ejemplos para explicar la adhesión y la cohesión. Dibujar diagramas que muestren la acción capilar de: a) agua y b) mercurio. 4) ¿Qué es la viscosidad? ¿Cuál es la relación entre las fuerzas intermoleculares que existen en el líquido y su viscosidad? 5) ¿Por qué la viscosidad de un líquido disminuye al aumentar su temperatura? 6) Predecir que líquido tiene mayor tensión superficial, etanol (C2H5-OH) o éter dimetílico(CH3-OCH3). 7) Predecir la viscosidad del etilenglicol CH2-OH con respecto al etanol y a la glicerina. | CH2-OH 6 8) Las presiones de vapor de equilibrio líquido-vapor de una serie de sustancias son: Sustancia Pv a 20ºC (mm Hg) A 17,5 B 75,0 C 442,0 Justificar cual de las siguientes proposiciones es verdadera o falsa. a) En estado gaseoso, la sustancia más difícilmente licuable es la A. b) Las fuerzas intermoleculares en C son mayores que en las otras sustancias. c) El punto de ebullición de estas sustancias disminuye al aumentar la presión atmosférica. d) La presión de vapor de equilibrio de estas sustancias disminuye al aumentar el volumen del recipiente. e) Dibujar hipotéticas curvas de presión de vapor para c/u de estas sustancias sobre un mismo gráfico. 9) Cuál de las siguientes opciones indica fuerzas de atracción intermolecular extremadamente débiles en un líquido: b) una presión de vapor muy alta a) un punto de ebullición muy elevado d) un calor de vaporización muy alto c) una temperatura crítica muy alta e) ninguna de éstas. Fundamentar la respuesta y explicar brevemente cada una de las propiedades subrayadas. 10) El éter dietílico tiene un punto de ebullición de 34,5ºC y el 1-butanol de 117ºC: H H H H H H H H | | | | | | | | H-C-C-O-C-C-H H-C-C-C-C-OH | | | | | | | | HH H H HHH H éter dietílico 1-butanol Ambos compuestos tienen el mismo número y tipo de átomos. Explicar la diferencia en los puntos de ebullición. 11) Explicar en términos de fuerzas intermoleculares por qué: a) el NH3 tiene un punto de ebullición mayor que el CH4; el KCl tiene un punto de fusión mayor que el I2 y c) el naftaleno(C10 H8) es más soluble en benceno que el LiBr. 12) Se hace burbujear lentamente 2,0 l de aire a través de agua a 25°C. Estimar la disminución de la masa de agua que tiene lugar como consecuencia de la evaporación, suponiendo que el aire se satura. 13)Se hace burbujear lentamente 1,0 l de aire a través de benceno a 20°C. Estimar la disminución de la masa del benceno que tiene lugar como consecuencia de la evaporación, suponiendo que el aire se satura. 14)Qué masa de agua hay en el aire de un cuarto de baño de dimensiones 3m por 4m por 2m cuando se ha llenado la bañera con agua a 35°C. 15) Con los datos de la curva de presión de vapor estimar el punto de ebullición del agua cuando la presión externa es de: a)700 torr; b) 800 torr; c) 90 torr. Señalar sobre un gráfico. 16) Explicar porqué en Buenos Aires el agua hierve a 100ºC y en Salta a 90ºC. 17)Indicar el punto de ebullición del etanol en un día en que la presión atmosférica es de 751 Torr. 18)Utilizando los datos del diagrama de fases del agua predecir el estado de una muestra de agua bajo las siguientes condiciones: a)2 atm; 200°C; b) 600 mm Hg; 70°C; c) 3 torr; 0°C; d) 218 atm; 374°C. 19)Utilizando los datos del diagrama de fases del agua describir los cambios de fases que ocurren al aumentar gradualmente la presión desde 1,5 torr hasta 760 torr , cuando se mantiene una temperatura constante de: a) -5°C, b) 0°C, c) 70°C. Graficar. 7 20) Utilizando los datos del diagrama de fases del agua describir los cambios de fases que ocurren: a) cuando la temperatura se aumenta gradualmente a una presión constante de 0.2 atm, desde -12°C hasta 100°C (trazar sobre un gráfico) b)idem cuando la presión constante es de 10 atm. 21)Utilizando los datos del diagrama de fases del dióxido de carbono, indicar por lo menos dos estados (presión y temperatura) bajo los cuales se encuentra en estado: a) líquido, b) sólido, c) vapor. d)Indicar el punto triple. e)Indicar el punto crítico. Señalar sobre un gráfico. 22) El CS2 tiene una presión de vapor de 298 mmHg a 20 ºC. Se coloca en un matraz cerrado, a esta temperatura, una muestra de 6 g de CS2: a) ¿Cuál es el volumen máximo del recipiente para poder tener equilibrio líquido vapor en su interior? b) Si el matraz tuviese un volumen de: i) 3 litros ii) 7 litros ¿Cuál sería la presión del CS2?, ¿Cuántas fases tendría el sistema?, explicar. Calcular la masa de CS2 en cada fase. c) Ubicar sobre un hipotético diagrama de fases los puntos que representan al sistema de a), de b)i) y de b)ii). Nota: del Apéndice se pueden extraer datos de tablas de presión de vapor, para poder interpolar linealmente. También figuran tabulados datos de constantes críticas para algunas sustancias. SOLIDOS CONCEPTOS A DESARROLLAR (TEMARIO) Descripción general del estado sólido (comentarios generales). Sólidos cristalinos y amorfos (características, ejemplos). Cristal, red cristalina, nodos, celda unitaria (conceptos). Distintos tipos de sólidos cristalinos y propiedades resultantes: cristales atómicos o covalentes, moleculares, iónicos y metálicos.. Unidades elementales en nodos. Fuerzas de atracción entre unidades elementales existentes en los nodos. Propiedades características de cada tipo de cristal (físicas, mecánicas, eléctricas y térmicas). Ejemplos de cada tipo de sólido. Ejemplos de redes cristalinas: redes cúbicas de cuerpo centrado (hierro alfa) y de caras centradas (hierro gamma). Importancia de estas redes en los metales. Caso del cloruro de sodio. GLOSARIO DE TERMINOS Sólido: conglomerado compacto de unidades elementales (átomos, moléculas o iones) con reducidos movimientos vibratorios. Pequeños espacios libres entre ellas. Sólidos cristalinos: unidades elementales altamente organizadas en estructuras geométricas llamadas cristales; por ejemplo, sales inorgánicas, metales, gases solidificados. Sólidos amorfos: conglomerado compacto de átomos, moléculas o iones poco o nada ordenados; por ejemplo, vidrio, plásticos, caucho. Red espacial: conjunto total de unidades elementales en ordenamiento geométrico dentro del cristal. Puede ser lineal, plana o tridimensional. Celda unitaria: mínimo modelo, unidad fundamental de la red espacial, que se repite análogamente en todas las direcciones axiales del cristal. Encierra un número entero de moléculas, átomos o iones. Nodos: puntos de la red espacial que coinciden con el centro de las unidades elementales. Si ésta es un átomo o ión simple, el nodo coincide con su núcleo y si es una molécula o ión complejo, coincide con el centro de la estructura geométrica que los representa. Cristales atómicos no metálicos o covalentes: átomos no metálicos en los nodos, unidos por enlaces covalentes (pares de electrones de valencia localizados). Cristales moleculares: moléculas polares o no polares en los nodos, unidas por puentes de hidrógeno o fuerzas de van der Waals. Cristales iónicos: aniones y cationes alternados en nodos consecutivos, unidos por fuezas electrostáticas fuertes. Cristales metálicos: red espacial de cationes metálicos en los nodos, sumergida en “un mar móvil” de electrones de valencia deslocalizados. Enlace metálico: “resonancia” de los electrones deslocalizados, entre el catión de un nodo y los cationes vecinos. 8 PROPIEDADES DE LOS SOLIDOS CRISTALINOS Tipo Atómico no metálico o covalente Iónico Molecular Metálico Unidad en nodo átomo no metálico catión o anión Enlaces entre unidades que ocupan nodos covalente electrostático van der Waals de hidrógeno Características del enlace Muy fuerte Fuerte débil medianamente generalmente débil fuerte Propiedades P. fusión P. ebullición muy altos Altos bajos medianos físicas, Dureza muy duros Duros blandos medianamente variada duros mecánicas, Plasticidad frágil deformable, frágil poco frágil eléctricas y Conductividad aislante eléctrica térmicas Conductividad poco térmica conductor Ejemplos frágil Molécula como sólido: aislante aislante. Fundido o en solución: conductor. poco poco conductor conductor diamante, cloruro de carburo de sodio, cloruro silicio, de cesio dióxido de silicio 9 Catión aislante poco conductor gases hielo enfriados, “hielo seco”: CO2; o2, N2, Ne Metálico generalmente altos variada (plástico, elástico o frágil) conductor conductor cobre, hierro, magnesio EJERCICIOS 1) Explicar los conceptos de sólido, sólido cristalino, sólido amorfo, red cristalina, nodo y celda unitaria. 2) Indicar en la Tabla Periódica de los elementos: a) ocho elementos metálicos pertenecientes a ocho grupos diferentes; b) cuatro elementos no metálicos cuyas sustancias simples al estado sólido son cristales moleculares; c) tres elementos no metálicos cuyas sustancias simples al estado sólido son cristales covalentes. 3) En la tabla siguiente se indican diversos datos correspondientes a ciertas especies químicas al estado sólido. Completar en cada columna e hilera el espacio en blanco reservado para la respuesta. P.F. A P. Eb. Alto Propiedades mecánicas Conductividad eléctrica y térmica muy deformable B C Alto muy alto D E Alto Bajo alto bajo Tipo de enlace Tipo de cristal Ejemplo de sólido molecular CO2 iónico NaCl SO2 metálico mala aislante frágil muy duro Frágil mala F G H van der Waals covalente metálico mala Si Cu H2O 4) Se dispone de una muestra de un sólido cristalino. Describir algunas experiencias sencillas que se podrían efectuar para ayudar a decidir si los enlaces son o no esencialmente covalentes, iónicos, metálicos o de van der Waals. 5) Los elementos carbono y silicio forman óxidos con fórmulas similares: CO2 y SiO2. El dióxido de carbono sólido sublima a -78,5 ºC, mientras que el dióxido de silicio funde a aproximadamente 1700 ºC y hierve aproximadamente a 2200 ºC. a) En base a esta gran diferencia de temperatura hasta llegar al estado de vapor, deducir los tipos de sólidos correspondientes y el carácter del enlace entre nodos. b) Representar ambas especies químicas mediante fórmulas de Lewis (fórmulas electrónicas o “punteadas”). 6) Interpretar las siguientes propiedades de los metales: a) alta conductividad eléctrica y la disminución de ésta al aumentar la temperatura b) buena conductividad térmica c) plasticidad (maleabilidad y ductilidad) mayor que la de los sólidos iónicos. 7) Cuáles de los siguientes tipos de sólidos tienen los puntos de fusión más bajos (explicar porqué): a) aquellos que están compuestos por moléculas simétricas pequeñas b) aquellos compuestos por iones positivos y negativos pequeños c) aquellos compuestos por moléculas polares d) aquellos en los cuales los átomos están ligados por enlaces covalentes formando una red e) aquellos que están formados por iones positivos y electrones móviles. 8) Para c/u de las siguientes sustancias teniendo en cuenta la ubicación en la T. Periód., dar la fórmula mínima y la fórmula de Lewis: a) hidruro de magnesio; b) fluoruro de hidrógeno; c) sulfato(IV) de amonio; d) dióxido de azufre; e) dióxido de silicio; f) nitrito cúprico. Indicar para c/u de las anteriores a qué tipo de sólido dá lugar, fuerza de atracción entre nodos, propiedades del sólido. Nota: los estados de agregación a 15 ºC de las sustancias, son respectivamente (s), (l), (s), (g), (s) y (s). 10 9) Dibujar un fragmento de red cristalina y una celda unitaria de un cristal de: a) hierro alfa; b) cloruro de cesio; c) hierro gamma y d) cloruro de sodio (buscar en la bibliografía el tipo de celda correspondiente a cada uno). 10) El Sodio cristaliza en una red cúbica y la arista de la celda unitaria es de 4,3 A. La densidad del Sodio es 0,963 g/cm3 y su peso atómico 23,0. ¿Cuántos átomos de Sodio están contenidos en una celda unitaria? ¿Qué tipo de celda unitaria cúbica forma el Sodio? 11) El Paladio se cristaliza en una red cúbica centrada en las caras. La densidad del Paladio es 12,0 g/cm3 y su peso atómico 106.0 ¿Cuál es la longitud de la arista de la celda unitaria? II - TERMODINÁMICA QUÍMICA. TERMOQUÍMICA CONCEPTOS A DESARROLLAR Sistema, medio, universo. Estado termodinámico de un sistema. Trabajo mecánico de expansión compresión. Calor. Calor sensible y calor latente. Calor específico de sustancias puras. Sistema cerrado: primer principio de la termodinámica. Energía interna y entalpía. Funciones de estado y funciones de línea. Evoluciones a presión constante, a volumen constante, a temperatura constante y adiabáticas. Reacciones químicas exotérmicas y endotérmicas. Ecuación termoquímica. Entalpía de reacción. Sistema, medio, universo. Estado termodinámico de un sistema. Trabajo mecánico expansión compresión. Cálculos de calor, trabajo, energía interna y entalpía en reacciones químicas. EJERCICIOS 1) Calcular la cantidad de calor que hay que entregarle a 1 kilogramo de agua que se encuentra a 20 ºC para llevarla hasta una temperatura de 30 ºC, a presión de 1 atm. Compare con la cantidad de calor que hay que entregarle a 1 kilogramo de alcohol, 1kilogramo de petróleo, 1 kilogramo de plomo. Agua (líquida) Alcohol Petróleo Plomo (sólido) 1,00 0,50 0,50 0.031 Calor específico(kcal/kg.grado) 2) Se extrae un cubo de hielo del freezer, a una temperatura de -18 ºC. Sabiendo que la masa del cubo es de 30 g y que la presión se mantiene constante e igual a 1 atm, calcular: a)cantidad de calor que hay que entregarle al cubo de hielo para que llegue a la temperatura de fusión(0ºC). b) cantidad de calor que hay que entregarle al cubo que se encuentra a la temperatura de fusión para fundirlo totalmente. c) Dibujar la curva de calentamiento en forma cualitativa. d) Calcular la cantidad de agua líquida a 80 ºC que se debe poner en contacto con el cubo de hielo para que todo el sistema quede en 10 ºC. Suponer que no hay pérdidas con el medio. Datos: CpH2O(s)=0,5 cal/gºC hfusión=79,5 cal/g CpH2O(l)=1 cal/g ºC 3) Una pava contiene agua a 20 ºC y se la coloca sobre el mechero de gas encendido. Suponer que la potencia calorífica del mechero es constante y que durante toda la experiencia la presión se mantiene constante e igual a la normal. Se observa que el agua alcanza su temperatura de ebullición en 10 minutos y que 67,5 min después ha pasado totalmente al estado vapor, siendo la temperatura del vapor de 100 ºC. Calcular el calor de vaporización del agua. 4) Un kilogramo de N2 se encuentra a 1 atm de presión y ocupa 1 m3. Evoluciona hasta alcanzar un volumen de 2 m3 y una presión de 2 atm. En el diagrama siguiente se muestran diferentes evoluciones entre estos dos estados del sistema. Calcular Q, W, ∆H y ∆U para cada una de las evoluciones. Datos: Cv= 20,92 J.(mol.K)-1 Cp= 29,29 J.(mol.K)-1 11 5) Decir cuáles de las siguientes afirmaciones son verdaderas o falsas. Fundamentar. a) La entalpía del sistema disminuye si en él ocurre una reacción química exotérmica a presión constante. b) El ∆H de reacción tiene signo menos para las reacciones endotérmicas. c) La entalpía de los productos es mayor que la de los reactivos en las reacciones exotérmicas. d) Toda reacción exotérmica libera calor. 6) Al disolver cloruro de calcio en agua, se observa que la temperatura de todo el sistema se eleva. La reacción que tiene lugar es: CaCl2 (s) → Ca2+(ac) + 2 Cl-(ac) ¿Cómo será el ∆H de esta reacción, negativo o positivo?. ¿La reacción es exotérmica o endotérmica? 7) Observe la siguiente ecuación termoquímica y responda las preguntas fundamentando su respuesta. Fe(s) + Br2 (l) → FeBr2 (s) ∆H = - 249,8 kJ (a p = 1 atm) a)¿Cómo es la reacción exo o endotérmica?. ¿La entalpía de los productos es mayor o menor que la entalpía de los reactivos? b)Calcule la cantidad de calor intercambiada con el medio indicando si es calor absorbido por el sistema o cedido por el sistema al medio, cuando se forman 10 g de bromuro de hierro (II), en las condiciones correspondientes a la ecuación termoquímica. 8) El magnesio metálico reacciona con el dióxido de carbono gaseoso, dando como productos carbono sólido y óxido de magnesio sólido y liberando 16,7 kJ por gramo de Mg metálico que reacciona. a) Escriba la ecuación termoquímica correspondiente a dicha reacción. b) Calcule el ∆H cuando reaccionan 2 moles de Mg. c) Calcule la cantidad de calor que se desprende por cada gramo de productos. Problemas de Aplicación 9) El metabolismo de los alimentos es la fuente habitual de energía que se necesita para realizar el trabajo de mantener los sistemas biológicos. La oxidación completa del azúcar glucosa se puede representar con la siguiente ecuación termoquímica: C6H12O6(s) + 6 O2(g) → 6 CO2(g) + 6H2O(l) ∆Hº = -3725 cal/g glucosa Después de ingerir 1/2 kg de helado de base acuosa que se encuentra a 0ºC ¿Cuántos gramos de glucosa se deben oxidar, en el organismo, para igualar la temperatura al valor corporal de 37 ºC? Datos: hfusión=79,5 cal/g CpH2O(l)=1 cal/g ºC 1cal= 4,18 J 10) El nitrógeno que se emplea para inflar el airbag de un automóvil proviene de la reacción de la azida sódica: 2 Na+ [N3-] (s) → 2 Na (g) + 3 N2 (g) El airbag del conductor suele contener 95 g de azida sódica. a)Cuál será, a 25 ºC, el volumen del airbag que puede inflar este nitrógeno? b)Qué trabajo realiza el nitrógeno para inflar el airbag? 12 11) Calcular el cambio de entalpía estándar para la combustión completa de 1 mol de etanol (l). El calor estándar de reacción es la suma de los calores estándar de formación de los productos menos la suma de los calores estándar de formación de los reactivos: ∆HReacción = Σ nj . ∆H0fj (productos) - Σ mi . ∆H0fi (reactivos) siendo nj y mi los coeficientes estequiométricos de la reacción. Datos: ∆H0f,C2H5OH(l)=-277,7 kJ.mol-1 ∆H0f,CO2(g)=-393,5 kJ.mol-1 ∆H0f,H2O(l)=-287,1 kJ.mol-1 ∆H0f,O2(g)= 0 kJ.mol-1 12) Dada la síntesis del A3B2(s) a partir de A2(g) y B2(g): a) Escribir la ecuación termoquímica de la reacción (Keq→∝). b) Se colocan en un recipiente, a presión y temperatura constantes de 1 atm y 200ºC respectivamente, 12 mol de A2 y 12 mol de B2 hasta verificarse reacción completa. Calcular ∆U, ∆H, Q y W para la evolución (despreciar el volumen del sólido). c) Calcular ∆U, ∆H, Q y W, para la evolución, en condiciones estándard. Dato: ∆H= -15 kJ/mol A2 aproximadamente constante para el intervalo de temperatura considerado. 13) a) En un cilindro cerrado con un pistón móvil, se colocan 320 g de oxígeno que evolucionan a presión de oposición constante de 5 atm, desde 25 a 200ºC. Calcular Q, W, ∆H y ∆U para el sistema. b) Partiendo del mismo estado inicial calcular para la evolución a volumen constante, entre 25 y 200ºC, Q, W, ∆H y ∆U. c) Dibujar las evoluciones de a) y b) en un diagrama presión vs. volumen y sobre el mismo las isotermas de 25 y 200ºC. Datos: Cpoxígeno= 7,11 cal/mol.grado Cp-Cv= R= 1,99 cal/mol.grado 14) a) Se tiene un mol de agua en estado gaseoso a 110ºC y 1 atm de presión y se la lleva a 25ºC y 1 atm. Calcular W, Q, ∆U y ∆H. b) Indicar la transformación en el diagrama de fases. Datos: Cp, H2O(g)= 0,17 cal/g.grado Cp, H2O(l)= 1 cal/g.grado 15) Una caldera para generación de vapor se alimenta con 200 kg de fuel oil por día. Considerar al eicosano (C20H42) como hidrocarburo representativo del combustible. a) ¿Cuál es el caudal de aire requerido para dicha combustión en m3 CNPT/h?(Considerar que se introduce un exceso de aire respecto de los valores estequiométricos, del 23% en volumen, a fin de asegurar una buena combustión). b) ¿Cuál es el calor utilizable si las pérdidas por radiación son de 5%, y con los gases de chimenea se pierde un 3%? 13 c) ¿Cuál es la máxima producción de vapor de agua a 100 ºC y 1 atm en kg/h? Considerar que el agua entra a la caldera a la temperatura de 90 ºC. Datos: Cpagua líquida= 1kcal/kgºC; ∆Hvap. agua= 9,73 kcal/mol; ∆Hcomb. eicosano= -3384 kcal/mol 16) Un horno para obtención de cal procesa 100 kg/día de piedra caliza, con una pureza de 82% m/m en carbonato de calcio. a) ¿Cuál es la producción de cal viva en kg/día? b) ¿Cuál es el consumo mensual de combustible, expresado en kilogramos, para el proceso si debe preverse una pérdida de calor del 15%? Considerar al combustible como C18H38 ∆Hcomb= -3200 kcal/mol. Ecuación termoquímica de la calcinación: CaCO3(s) → CaO(s) + CO2(g) 14 ∆Hreac.= 43,75 kcal/mol III - SOLUCIONES CONCEPTOS A DESARROLLAR Equivalente gramo de un ácido, un hidróxido y una sal neutra en reacciones de neutralización. Normalidad de una solución; relación con su molaridad. Reacciones de neutralización entre soluciones de ácidos y bases. Relación V.N = V’.N’. Su empleo en valoraciones volumétricas ácido-base. Soluciones: saturada, no saturada, sobresaturada. Solubilidad. Soluciones de sólido en líquido: influencia de la temperatura; curvas de solubilidad; distintos tipos. Construcción de una curva. Significado de puntos en diversas zonas del gráfico. Cristalización. GLOSARIO DE TERMINOS Solución: sistema homogéneo del cual, por aplicación de alguno de los métodos de fraccionamiento, pueden obtenerse porciones con distintos valores para las propiedades intensivas. Composición de una solución: es la cantidad de soluto que contiene dicha solución en una cantidad dada de solución o en una cantidad dada de solvente. Puede expresarse de distintas formas, por ejemplo: gramos de soluto por 100 gramos de solución (% m/m o % p/p); gramos de soluto por litro de solución; gramos de soluto por 100 gramos de solvente, gramos de soluto por 100 cm 3de solvente. Nota: vulgarmente se denomina concentración a la composición de una solución, pero esta expresión se reserva en la actualidad para molaridad. Molaridad de una solución: es su composición expresada en moles de soluto por litro de solución. Equivalente gramo de un ácido: en reacciones de neutralización, es la masa de ácido que origina, por disociación electrolítica total , un mol de iones hidrógeno. Equivalente gramo de un hidróxido: en reacciones de neutralización, es la masa de hidróxido que origina, por disociación electrolítica total, un mol de iones hidróxido. Equivalente gramo de una sal neutra: en reacciones de neutralización, es la masa de sal que contiene un equivalente gramo del metal correspondiente. Por extensión, en las sales de amonio, un mol de iones amonio. 15 Normalidad de una solución: es su composición expresada en equivalentes gramo de soluto por litro de solución. Solución saturada: dada una solución constituida por un soluto A y un disolvente B, se dice que la solución esta saturada respecto de A, a una dada temperatura ( y a una dada presión parcial del soluto si éste es un gas) , cuando dicha solución se mantiene en equilibrio estable y dinámico, en presencia de A no disuelto. Solución no saturada, a una dada temperatura (y a una dada presión parcial del soluto si éste es un gas) es aquella en la cual la concentración del soluto es menor que en la solución saturada en esas condiciones. Solución sobresaturada, a una dada temperatura (y a una dada presión parcial del soluto si éste es un gas) es aquella en la cual la concentración de soluto es mayor que en la solución saturada en esas condiciones. Solubilidad de un soluto, en un disolvente dado a una dada temperatura (y a una dada presión parcial del soluto si este es un gas), es la composición de la solución saturada que ambos forman en esas condiciones. EJERCICIOS 1) Para reacciones de neutralización calcular: a) la masa de un equivalente gramo de cada uno de los siguientes compuestos y b) que número de equivalentes gramo contiene 1 kg de estas sustancias: 1- ácido ortofosfórico 2- 2- hidróxido de bario 3- 3- sulfato férrico 2) Calcular cuantos equivalentes gramo, cuántos moles y cuántos gramos de soluto están disueltos en: a) 2 l de una solución 0,2 N de sulfato de cúprico b) 2 l de una solución 0,2 N de ácido ortofosfórico. 3) a)Cúantos equivalentes gramo de soluto están disueltos en: - 1 l de solución 0,5 M de ácido clorhídrico - 1 l de solución 0,5 M de ácido sulfúrico - 1 l de solución 0,5 M de ácido ortofosfórico. b) Explicar el porque de la relación entre los valores obtenidos. 16 4) Calcular que masa de soluto se halla en cada una de las siguientes soluciones: a) 300 cm3 de solución 2 M de ácido nítrico b) 500 cm3 de solución 0,5 N de ácido ortofosfórico. 5) Calcular: a) la normalidad de una solución de ácido sulfúrico al 20% en masa (δ = 1,14 g/cm3) b) que masa de solución de ácido sulfúrico al 40% en masa se necesita para preparar 200 cm3 de solución 3 N de dicho ácido. 6) Un matraz contiene 200 cm3 de una solución de ácido sulfúrico cuya composición es 40 g de soluto/100 g de solución y cuya densidad es de 1,3 g/ cm3. Calcular: a) número de equivalentes gramo de ácido sulfúrico que contiene el matraz b) qué volumen de solución 2 N de ácido puede obtenerse diluyendo dicha solución con agua c) qué volumen de solución 5 N de hidróxido de sodio se necesitaría para neutralizar totalmente la solución original. Para neutralizar en forma similar la solución del punto b) el volumen de solución 5 N de hidróxido de sodio será igual o distinto? Explique porqué sin efectuar el cálculo. 7) Calcular el volumen de solución básica 0,3 N que se necesita para neutralizar totalmente el ácido ortofosfórico contenido en 200 cm3 de solución 0,2 M. 8) Un frasco contiene 500 cm3 de una solución de ácido sulfúrico; 5 cm3 de dicha solución fueron neutralizados por 6,4 cm3 de solución 2 N de hidróxido de sodio. Calcular la masa de ácido sulfúrico contenido en el frasco. 9) Sin usar masas atómicas calcular: a) cúantos equivalentes gramo de hidróxido de sodio se necesitan para neutralizar totalmente a 500 cm3 de solución 0,3 M de ácido sulfúrico b) cúantos equivalentes gramo de sal se forman por la reacción indicada en a). Fundamentar las respuestas. 10) Calcular que volumen de solución 0,2 N de ácido nítrico se necesita para neutralizar exactamente 148 mg de hidróxido de calcio. 11) Se mezclan 16 g de hidróxido de sodio con 100 cm3 de solución 0,3 M de ácido nítrico. Calcular: a) número de equivalentes gramo de sal formados b) número de equivalentes gramo de ácido o de base necesarios para neutralizar el exceso de base o de ácido presente en el sistema. 12) Utilizando la siguiente tabla de valores, construir en papel milimetrado la curva de solubilidad del clorato de potasio en agua: Temperatura (ºC) 0 Solubilidad (g st/100 g agua) 3,3 10 20 5,0 7,4 30 40 50 60 70 80 10,5 14,0 19,3 24,5 31,5 38,5 17 90 100 48,5 57,0 Se dispone de una solución que contiene 1,5g de clorato de potasio por 5g de agua y que se halla a 85ºC. a) Indicar sobre el gráfico qué ocurre cuando dicha solución se enfría hasta 20ºC. b) Calcular las masas de los componentes en cada fase del sistema a 20 ºC. 13) Una solución acuosa saturada de ioduro de potasio, a 10 ºC, contiene 57 g de soluto en 100 g de solución. Calcular la masa de ioduro de potasio que cristaliza cuándo se enfrían hasta 10 ºC, 2 kg de una solución acuosa de dicha sal que contiene, a 90 ºC, 64% en masa de ioduro de potasio. 14) Una muestra de masa desconocida mx de clorato de potasio se disolvió en 5cm3 de agua a 80ºC. Se dejó enfriar lentamente agitando con cuidado con un termómetro y se observó que la sal comenzaba a cristalizar a 32ºC. Empleando la curva de solubilidad obtenida en el problema 12), calcular el valor de mx. 15) Se desea obtener por cristalización al enfriar una solución de NH4I, entre 80ºCy 10ºC, 150 g de dicha sal. Qué volumen de solución saturada a 80ºC debe emplearse? δ80ºC sol sat. = 2,9 g/cm3 Solubilidad de NH4I a 80ºC: 228,8 g/100 g agua; Solubilidad de NH4I a 10ºC: 163,2 g/100 g agua 18 IV -QUIMICA ORGANICA CONCEPTOS A DESARROLLAR Generalidades. Función química. Isomería. Principales funciones de la Química Orgánica y reglas de nomenclatura. Hidrocarburos: alifáticos y aromáticos. Alcoholes. Eteres. Fenoles. Aldehídos. Cetonas. Acidos carboxílicos, disociación en solución acuosa. Esteres. Funciones nitrogenadas: aminas, amidas, nitrilos. Aminoácidos. La atracción intermolecular por puente de hidrógeno en compuestos orgánicos: su influencia en las temperaturas de ebullición y en la solubilidad. GENERALIDADES La Química Orgánica comprende el estudio de los compuestos del carbono (exceptuando CO, CO2 y carbonatos) , elemento que por su naturaleza particular, puede llegar a dar una variedad extraordinaria de sustancias diferentes, aún combinándolos con muy pocos otros elementos. Hay alrededor de dos millones y medio de compuestos orgánicos conocidos, entre naturales y sintéticos. El nombre orgánica deriva del hecho de que los primeros compuestos estudiados de este tipo fueron descubiertos en los seres vivos u organizados hasta que Wohler (l828) logró demostrar por medio de la síntesis de la urea que no había límite real entre compuestos orgánicos e inorgánicos, pues su formación y descomposición se rigen por los mismos principios y mecanismos que se estudian en la Química General. Por razones sistemáticas, dado su número y características comunes, los compuestos orgánicos se siguen estudiando en un capítulo aparte de la Química. El motivo fundamental de esta gran variedad y número se debe a la propiedad del átomo de carbono de unirse a otros átomos de carbono dando largas cadenas que, a causa de la tetravalencia del carbono, pueden además ramificarse en varias direcciones, lo que permite la posibilidad de obtener permanentemente, por reacciones adecuadas, nuevos compuestos "sintéticos" (polímeros, antibióticos, etc.). Esto es debido a la posición del carbono en la Tabla Periódica, con sus números de oxidación entre - 4 y + 4 y a que su electronegatividad ( 2,5), próxima a la del hidrógeno, le permiten formar con éste uniones covalentes estables y formar cadenas consigo mismo mediante uniones simples y múltiples tambien estables. Conviene tener presente que cuando el átomo de carbono está unido a otros cuatro átomos iguales (caso más sencillo: CH4) los ángulos de enlace son iguales entre sí y de l09o 28'. Decimos que la molécula de metano (CH4) es tetraédrica: los cuatro átomos de H se encuentran en los vértices de un imaginario tetraedro regular y el átomo de C en el centro del mismo. Ello se debe a que en el átomo de carbono los orbitales presentan , en este caso, hibridación sp3. Lo mismo ocurre siempre que esté unido por enlaces simples a otros cuatro átomos o grupos de átomos que pueden ser iguales o distintos entre sí. La hibridación o hibridización para un átomo en un compuesto dado es la reorganización de electrones de orbitales atómicos externos, con pequeña diferencia de energía entre ellos, para dar otros orbitales moleculares, equivalentes entre sí. La hibridación o hibridización sp3 del carbono en enlaces covalentes implica la reorganización de los electrones del orbital s y de los orbitales p externos disponibles del segundo nivel energético del átomo de carbono. Se forman así cuatro orbitales híbridos sp3, cada uno con un electrón del átomo de carbono. Estos orbitales híbridos se orientan hacia los vértices de un tetraedro en cuyo centro está el núcleo del átomo de C. Al formarse una molécula, se superponen parcialmente cada uno de estos orbitales híbridos sp3 con el orbital correspondiente del átomo con el cual se produce el enlace (Ej. 1 y 2). FUNCION QUIMICA El conjunto de propiedades comunes que presenta un determinado grupo de sustancias se debe a la presencia en todas ellas de determinadas asociaciones de átomos, llamadas grupos funcionales que determinan las funciones químicas que desempeñan las respectivas sustancias. Ej.: El grupo funcional carboxilo -CO.OH corresponde a la función química ácido carboxílico, que es la que determina el carácter de los ácidos, como el acético, componente del vinagre. 19 ISOMERIA Dos o más sustancias de igual fórmula molecular y distintas propiedades físicas y químicas se llaman isómeros. La fórmula no desarrollada es idéntica, pero existen varios compuestos con propiedades diferentes. Podemos agrupar las isomerías en dos tipos principales: l) Isomería con cambio de constitución (topológica) a) de posición b) de cadena c) funcional ll) Isomería sin cambio de constitución (estereoisomería) d) geométrica e) óptica a) Isomería de cadena: es la debida exclusivamente a cuál sea la cadena lineal o sus ramificadas de igual número de átomos de carbono e iguales enlaces que sirven de "esqueleto" a la molécula , por ej.: CH3-CH-CH3 ambos: C4H10 CH3-CH2-CH2-CH3 | CH3 n-butano metilpropano b) Isomería de posición: lo que varía es sólo la posición del grupo funcional en la misma cadena, por ej.: CH3-CH.OH-CH2-CH3 CH3-CH2-CH2-CH2.OH 1- butanol 2 - butanol c) Isomería funcional: los átomos están distribuídos de modo de dar diferentes grupos funcionales, por ej.: CH3-CH.OH-CH=O CH3-CH2-CO.OH ácido propanoico 2 - hidroxipropanal (alcohol y aldehído) d) Isomería geométrica: cuando en una molécula hay una doble ligadura y cada uno de los carbonos que intervienen en ella están unidos a dos sustituyentes distintos a y b, pueden formarse isómeros cis-trans donde: a-C-b distinto de a-C-b | | a-C-b b-C-a trans cis Cuando hay un tercer sustituyente d puede ocurrir también: a-C-b distinto de a-C-b | | a-C-d d-C-a trans cis La doble ligadura impide la rotación entre átomos de carbono. e) Isomería óptica: si la molécula posee un átomo de carbono unido a 4 grupos diferentes (C «asimétrico»), el hipotético tetraedro correspondiente a ese átomo de C no se puede superponer con su imagen en el espejo; son diferentes como lo son la mano derecha respecto de la izquierda. Cada una de las dos moléculas de estas características tiene la propiedad de desviar el plano de luz polarizada en un sentido o en el otro: el isómero dextrógiro hacia la derecha y el levógiro hacia la izquierda. 20 PRINCIPALES FUNCIONES DE LA QUIMICA ORGANICA HIDROCARBUROS: son los compuestos orgánicos constituídos únicamente por C e H. Su fuente más importante es el petróleo. Son el «esqueleto» fundamental del cual derivan todos los demás compuestos orgánicos. Los átomos de C que se hallan en el extremo de una cadena hidrocarbonada están unidos a un sólo átomo de carbono y se denominan carbonos primarios. Los átomos de C de una cadena unidos a otros dos átomos de C se llaman secundarios, aquellos unidos a otros 3 C se llaman terciarios y los unidos a 4 átomos de C son cuaternarios: H3C | H2C | HC-CH3 | H3C-C-CH3 | H3C Cprimario Csecundario Cterciario Ccuaternario CLASIFICACION DE LOS HIDROCARBUROS SEGUN SU ESTRUCTURA alcanos o parafínicos -C-C- saturados: Hidrocarburos alifáticos o de cadena abierta alquenos u olefínicos -C=Cno saturados alquinos o acetilénicos -C=Csaturados o ciclánico Ej. ciclopentano cíclicos o de cadena cerrada no aromáticos no saturados Ej. ciclohexeno aromáticos benceno, tolueno, xilenos HIDROCARBUROS ALIFATICOS O DE CADENA ABIERTA La palabra alifático (graso) se origina en que las grasas y aceites tienen cadenas abiertas de átomos de carbono en sus moléculas. ALCANOS Todos los átomos de carbono están unidos por enlaces covalentes simples, formando cadenas abiertas, ya sean «lineales» o ramificadas. El hecho de que todos los enlaces C-C sean simples, hace que sean hidrocarburos saturados, ya que no admiten la adición de ningún otro átomo, molécula o grupo funcional sobre dichos enlaces. 21 Los enlaces C-C son relativamente estables, sobre todo en cadenas cortas. A estos hidrocarburos también se los llama parafínicos (de poca «afinidad» o reactividad química) y su fórmula general es Cn H2n+2. Para que en su molécula pueda entrar otro átomo o grupo de átomos en lugar de un átomo de hidrógeno, éste debe separarse previamente, lo cual requiere una energía relativamente grande. Estas reacciones se llaman de sustitución. Reglas de nomenclatura para los alcanos a) Los cuatro primeros compuestos de cadena lineal de ésta serie tienen nombres particulares: metano, etano, propano y butano. Los siguientes se nombran de acuerdo con el número de átomos de carbono usando el prefijo numeral correspondiente y la terminación ano: pentano (C5H12), etc. b) Los alcanos de cadena ramificada se nombran como derivados de la cadena lineal más larga que se pueda encontrar en la molécula, llamada cadena principal. Los átomos de la cadena principal se numeran comenzando por el extremo más cercano a la primera ramificación. Los grupos funcionales laterales insertados en la cadena principal tienen fórmula general CnH2n+1 (ver grupos derivados: terminación en ilo) y su nombre se antepone al del hidrocarburo de la cadena principal, así como su ubicación en ésta y la cantidad de ellos cuando hay más de uno. ALQUENOS Son hidrocarburos no saturados ya que admiten la adición de moléculas sobre sus dobles enlaces C=C. Se llaman etilénicos por ser el etileno (nombre trivial del C2H4, cuyo nombre sistemático es eteno) su representante más simple, y también olefinas por el carácter oleoso de alguno de sus derivados, como por ejemplo el 1,2-dicloroetano ClCH2-CH2Cl, producto de la adición de cloro sobre el eteno. Cuando contiene un solo doble enlace y los demás enlaces carbono-carbono de su molécula son simples, su fórmula molecular es CnH2n. Nomenclatura de los alquenos con un solo doble enlace a) Se toma como cadena principal la de mayor número de átomos de carbono que contenga el enlace múltiple y se numeran los átomos de carbono a partir del extremo de la cadena más próximo al doble enlace. Respecto del correspondiente alcano, la terminación del nombre se cambia a eno y, si hiciera falta, se indica la posición del enlace múltiple. b) En cuanto a los grupos funcionales laterales insertados en la cadena principal, se procede como para los alcanos. DIALQUENOS O DIENOS Son los hidrocarburos que presentan dos dobles enlaces por molécula, el resto de los enlaces carbonocarbono son simples. Si los dos dobles enlaces están separados por una sola unión simple C-C, se los llama conjugados y sus reacciones de adición son de características especiales, debido a que hay cuatro átomos de carbono consecutivos de hibridización sp2. Esto da lugar a importantes derivados y, en particular por la llamada adición 1,4 , a los polimeros elastoméricos, de elevado peso molecular como los cauchos. Son ejemplos de estos dialquenos: 1,3-butadieno; metil-1,3-butadieno o «isopreno». ALQUINOS También son hidrocarburos alifáticos no saturados, pero con uno o más triples enlaces. Se los llama también acetilénicos por se el acetileno (nombre trivial del C2H2, cuyo nombre sistemático es etino) su primer representante. Cuando contienen un solo triple enlace y los demás enlaces carbono-carbono son simples, su fórmula molecular es CnH2n-2. Nomenclatura de los alquinos Se los nombra de manera similar a los alquenos, cambiando la terminación del nombre del hidrocarburo en ino. 22 HIDROCARBUROS DE CADENA CERRADA HIDROCARBUROS CICLICOS NO AROMATICOS En general, estos hidrocarburos tienen propiedades muy semejantes a los correspondientes hidrocarburos de cadena abierta. Su fórmula general es CnH2n para los saturados, CnH2n-2 para los que contienen un solo enlace C=C (siendo el resto C-C), etc. Al nombrarlos se antepone el prefijo ciclo al nombre del hidrocarburo alifático correspondiente . Ver ejemplos en el cuadro sinóptico de la pág. 18. HIDROCARBUROS AROMATICOS Entre otros, se llama aromáticos a los compuestos que contienen en su estructura uno o más ciclos bencénicos. El benceno C6H6 es el hidrocarburo aromático más sencillo y está formado por un hexágono o anillo de seis átomos de carbono, todos de hibridización sp2. Se lo solía, y aún suele, representar como trieno cíclico conjugado por cualquiera de las siguientes fórmulas: H C H C HC CH CH HC HC CH CH HC C H C H o, más simplemente La ↔ indica que se trata de un híbrido de resonancia en el que los 6 electrones p, uno por átomo de carbono, no involucrados en la hibridización sp2 forman un orbital molecular cuya forma es la de dos anillos de sección circular («salvavidas») ubicados por encima y por debajo del anillo de los 6 átomos de carbono. Esta aromaticidad se simboliza con una circunferencia en la representación del benceno más usada actualmente: GRUPOS DERIVADOS DE HIDROCARBUROS Como ya se mencionó, los nombres de los hidrocarburos ramificados se forman comenzando con los nombres de los grupos, a su vez derivados de hidrocarburos, que se insertan en la cadena principal o en el anillo sustituyendo un átomo de hidrógeno. Estos grupos derivados se nombran terminando en ilo la raiz del nombre del hidrocarburo del cual derivan. Los siguientes ejemplos ilustran lo anterior, al mismo tiempo que permiten deducir algunas reglas adicionales para casos no muy complicados: 23 CH4, metano alcanos H3C-CH3, etano H3C-H2C-CH3 , propano H2C=CH2 , eteno → −CH3 , metilo -CH2-CH3 , etilo → → → alquilos -CH2-CH2-CH3 , n-propilo CH3-CH-CH3 , metiletilo | dimetilmetilo (isopropilo ) → −CH=CH2 , etenilo (vinilo) alquenos alquenilos -HC=CH-CH3 , 1-propenilo H2C=CH-CH3 propeno (propileno) → alquino HC ≡CH etino (acetileno) hidroc. arom. benceno → C6H6 (nombre en desuso: feno) → H2C=C-CH3 metiletenilo (metilvinilo) H2C=CH-CH2-, 2-propenilo -C ≡ CH -C6H5 etinilo fenilo alquinilo arilo (Ejercicios 3 al 11) OTROS GRUPOS DERIVADOS Independientemente de que tengan otras funciones químicas que los diversos tipos de hidrocarburos y, por consiguiente sus nombres propios como alcoholes, aminas, etc., muchas sustancias pueden ser también nombradas como derivados de hidrocarburos. Así los derivados halogenados, alcoholes, derivados nitrados, etc., resultantes de la sustitución de átomos de hidrógeno, por grupos funcionales, ya sean ellos átomos (p.ej. Cl-) o grupos de átomos (p.ej. -OH), se pueden nombrar con reglas similares a las de los hidrocarburos de la cadena principal la ubicación del átomo o grupo funcional sustituyente y el nombre de éste. Son ejemplos de tales átomos o grupos sustituyentes: F- ; Cl- ; Br- ; I- : fluoro- ; cloro- ; bromo- ; iodoHO: hidroxi: aminoH2N: nitroO2NHO.OC: carboxi(Ejercicios 3 al 11) FUNCIONES OXIGENADAS ALCOHOLES Y FENOLES Los alcoholes son el producto de la sustitución de átomos de hidrógeno unidos a átomos de carbono de hidrocarburos alifáticos o de cíclicos no aromáticos, por grupos funcionales hidroxilo u oxhidrilo, HO-. Cuando el HO- sustituyente está unido a un átomo de carbono de un anillo aromático, se trata de un fenol. En ambos casos se trata de uniones covalentes C-O-H algo polares entre el átomo de oxígeno y el de hidrógeno y no debe confundirse el grupo hidroxilo con el ion hidróxido OH- 24 Según la nomenclatura sistemática para alcoholes, la cadena alifática más larga a la que va unido el HOes la principal. Los átomos de carbono de esta cadena se numeran de modo que resulte el número más pequeño para el átomo de carbono al cual está unido el grupo HO- . Tanto los alcoholes como los fenoles se denominan con la terminación ol agregada a la raíz del nombre del hidrocarburo. Otra denominación utilizada de un alcohol o un fenol se basa en el hidroxiderivado del hidrocarburo. H3C-CH2-CH3 propano H3C-CH2-CH2.OH HO-CH2-CH.OH-CH2-OH 1-propanol 1,2,3 - propanotriol 1- hidroxipropano 1,2,3 - trihidroxipropano «glicerol» «glicerina» OH OH 1 2 6 5 3 4 benceno OH fenol (prop. dicho) hidroxibenceno “ácido fénico” 1,4-dihidroxibenceno p-dihidroxibenceno “hidroquinona” (Ejercicios 12 y 13) En los alcoholes de baja masa molar predomina la influencia del grupo hidroxilo, tanto por su polaridad como por las atracciones por puente de hidrógeno que se establecen entre sus moléculas. Es decir, cuanto menor es el número de átomos de carbono, más se asemejan al agua en sus propiedades, a tal punto que el metanol, el etanol y los propanoles se disuelven mutuamente con el agua en cualquier proporción. A partir de los butanoles , la solubilidad recíproca con el agua ya es sólo parcial, debido a que la influencia del grupo hidrocarbonado aumenta gradualmente por sobre el grupo hidroxilo. Los alcoholes de alta masa molar tienen comportamiento semejante a los correspondientes hidrocarburos. El enlace O-H es más polar en los fenoles que en los alcoholes, de modo que se pueden obtener fenatos mediante reacciones como: OH + OH- = - O+HO 2 fenol (ácido débil) “ácido fénico” p. ej. de NaOH fenato p. ej. fenato de sodio (sal) fenóxido de sodio mientras que para obtener un alcoholato o alcóxido debe procederse así: 2 C2H5OH + 2 Na = 2 C2H5ONa + H2(g) etóxido de sodio Los fenatos son solubles y estables en agua, mientras que los alcoholatos se hidrolizan: C2H5ONa + H.OH → C2H5.OH + NaOH ALDEHIDOS Y CETONAS Los aldehidos y las cetonas se caracterizan por poseer el grupo funcional carbonilo C=O unido a átomos de hidrógeno y/o a grupos R derivados de hidrocarburos : alquilo, arilo, etc. En los aldehidos, el grupo carbonilo está unido a uno o dos átomos de hidrógeno: H H C=O C=O H H3 C etanal benzaldehído metanal formaldehído acetaldehído aldehído fórmico aldehído acético aldehído benzoico 25 En las cetonas, el grupo carbonilo está unido a dos grupos R: H3C H3C C=O H3C C=O H5C2 butanona metiletilcetona propanona dimetilcetona «acetona» (Ejercicio 14) ACIDOS CARBOXILICOS Son ácidos débiles cuyo grupo funcional es el carboxilo Con bases, los ácidos carboxílicos dan sales: H3C-CO.OH + NaOH → H3C-CO.ONa + H2O H3C-CO.OH + Na+ + HO- → H3C-CO.O- + Na+ + H2O H3C-CO.OH + CO.O- + H+ + NH3 NH3 → → H3C-CO.ONH4 H3C-CO.O- H3C- + NH4+ En la nomenclatura sistemática , los ácidos carboxílicos se denominan agregando al nombre del hidrocarburo la terminación oico o anteponiéndole el prefijo carboxi- o también comenzando con ácido y terminando con carboxílico, pero corrientemente, la mayoría de ellos llevan nombres tradicionales o triviales: H-CO.OH (ácido) metanoico o ácido «fórmico» (de las hormigas) H3C-CO.OH (ácido) etanoico o ácido «acético» (del vinagre) H35C17-CO.OH (ácido) octadecanoico o ácido «esteárico» (de la estearina) H5C6-CO.OH (ácido) bencenocarboxílico o ácido «benzoico» (del benjuí) Es común que el grupo funcional carboxilo no sea el único sustituyente en hidrocarburos alifáticos o aromáticos, sino que es corriente encontrarlo en el extremo de una cadena en la cual existen además otros grupos funcionales (hidroxilo, carbonilo, amino, etc.) y, finalmente puede estar en más de un extremo de una sola cadena lineal o ramificada, formando ácidos policarboxílicos. (Ejercicios 15 y 16) 26 ESTERES Los ésteres se forman por la reacción entre un alcohol y un ácido carboxílico, con pérdida de agua. La esterificación es una reacción reversible, la inversa es la hidrólisis. En el equilibrio coexisten alcohol, ácido carboxílico, éster y agua. O hidról. R-OH + OH-C-R’ O R-O-C-R’ + HOH esterif. Obsérvese que el grupo HO- del agua es aportado por el ácido carboxílico y no por el alcohol, contrariamente a lo que cabría esperar de acuerdo con el carácter ácido del primero. (Ejercicios 17 y 18). Los ésteres tienen gran importancia en la industria como disolventes de otras sustancias orgánicas y como poliésteres en la industria plástica. Una mención especial merecen los triésteres de la glicerina (1,2,3 - propanotriol) con ácidos carboxílicos lineales de número par y elevado de átomos de carbono (entre C12 y C20): son los llamados triglicéridos, constituyentes principales de los aceites y grasas vegetales y animales. La saponificación es la acción de los álcalis fuertes sobre los glicéridos; libera glicerina y forma las sales de los correspondientes ácidos carboxílicos, llamados jabones . Por ejemplo: H2C-O-CO-C17H35 | H C-O-CO-C17H35 | H2C-O-CO-C17H35 + 3 NaOH -----> H2C-OH | HC-OH | H2C-OH triestearato de glicerilo, un triglicérido (grasa) + 3 Na+ -O.OC-C17H35 estearato de sodio (jabón) 27 FUNCIONES NITROGENADAS AMINAS Las aminas derivan del amoníaco NH3 por sustitución de los átomos de hidrógeno por grupos hidrocarbonados. Según la cantidad de grupos alquílicos o arílicos unidos al átomo de nitrógeno, las aminas son primarias, secundarias o terciarias . Se nombran indicando los grupos unidos al átomo de nitrógeno con la terminación amina , o bien los grupos unidos al hidrocarburo: H5C2-NH2 H5C2-NH-C6H5 etilamina, aminoetano (amina primaria) H2N-(CH2)6-NH2 etilfenilamina (amina secundaria) 1,6 diaminohexano «hexametilendiamina» (una diamina) Tal como el amoníaco, las aminas son de caracter básico débil. (Ejercicio 19) AMIDAS Y NITRILOS O El grupo funcional amida es -C NRR' donde R ó R': H, alquilo, arilo Si se deshidrata una amida no sustituída -CO-NH2 se obtiene un nitrilo, cuyo grupo funcional es -C ≡N. Por reacción entre ácidos dicarboxílicos y diaminas se obtienen fibras «sintéticas» del tipo poliamida.(Ejercicio 20) AMINOACIDOS, PEPTIDOS Y PROTEINAS Aminoácidos son los compuestos que poseen a la vez la función ácido carboxílico y la función amina. Los aminoácidos más importantes son los naturales, que son todos α -aminoácidos; el átomo de carbono del grupo carboxilo recibe el número 1 y el grupo amino está unido al carbono número 2 ó α . Ejemplo: ácido 2-aminopropanoico, ácido α -aminopropanoico, ácido α -aminopropiónico, «alanina»: CH3 | CH.NH2 | CO.OH Forma «neutra» | CH3 | CH.NH3+ CO.OForma «iónica» (catión y anión a la vez) Cuando se forma una amida entre el grupo carboxilo de una molécula de aminoácido y el grupo amino de otra molécula de aminoácido se obtiene la unión peptídica: -H2O O H CH3 O H CH3 H2N-CH2-C + N-CH-CO.OH → H2N-CH2-C-N-CH-CO.OH OH H glicina alanina glicil-alanina, un dipéptido (Ejercicio 21) Mediante sucesivas uniones peptídicas se forman los tripéptidos, tetrapéptidos y, en general, los polipéptidos . Cuando la masa molecular relativa ( «peso molecular») de un polipéptido es elevado, por ej. mayor de 10000, se dice que se trata de una proteína: 28 Proteína Peso molecular (aprox.) Insulina 10.000 Hemoglobina 70.000 Fibrinógeno 300.000 Proteína del virus del tabaco 9.000.000 Las cadenas polipeptídicas de las proteínas adoptan forma de hélice, de hoja plegada, etc. EJERCICIOS 1) Explicar en que consisten las hibridizaciones de los orbitales del átomo de carbono cuando se une a otro átomo de carbono con enlaces covalentes simples, dobles o triples. Para ello representar la estructura electrónica del átomo de carbono no excitado y las hibridizaciones en la forma convencional y en casilleros cuánticos. 2) Representar las formas espaciales de las moléculas de etano, eteno y etino. 3) Completar el siguiente cuadro con información sobre las distintas series de hidrocarburos. De cadena Abierta Clasificación y nombre Alcanos de la serie o… Enlace característico entre átomos de C …o etilénicos …o… Saturados No saturados Aromáticos -C-C- Fórmula general (a) Ejemplo Cíclicos CnH2n Nombre Naftaleno Fórmula (a) con un solo enlace múltiple, cuando lo hay. 4) Usando los prefijos numerales Número 5 6 7 Prefijo Pent Hex Hep 8 Oct 9 Non 10 Dec 11 Undec 12 Dodec 13 Tridec 14 Tetradec a) nombrar los hidrocarburos parafínicos de C7 y C16, lineales, b) escribir las fórmulas moleculares de los mismos, c) escribir las fórmulas desarrolladas de los anteriores en la forma H3C-(CH2)n-CH3. 5) Escribir las fórmulas electrónicas de todos los hidrocarburos de fórmulas C2H6 , C2H4 y C3H6. Son 4 en total. Nombrarlos. 6) Escribir las fórmulas desarrolladas de los siguientes alcanos: 2, 3 - dimetilhexano 2, 2, 4 - trimetilpentano («isooctano»). ¿Cuál es la importancia de éste último? 7) Escribir las fórmulas desarrolladas de todos los isómeros de fórmula molecular C4H8 y nombrarlos. Son 6 en total incluyendo los isómeros geométricos. 8) Escribir las fórmulas desarrolladas y los nombres de todos los isómeros de fórmula molecular C3H4 (son 3) y C4H6 (son 8). 9) Escribir las fórmulas desarrolladas y los nombres de todos los isómeros de cadena abierta de fórmula molecular C5H10 (son 5). 29 10) Escribir las fórmulas desarrolladas de los dos dialquenos conjugados nombrados en la introducción teórica a éste capítulo. 11) a) Escribir las fórmulas con que habitualmente se representa el benceno. b)Representar en una de las formas empleadas en a), las fórmulas de los siguientes compuestos aromáticos. - metilbenceno o «tolueno» - etenilbenceno o fenileteno o «estireno» - 2, 4, 6-trinitrotolueno, TNT o «trotyl»; dar su nombre sistemático como derivado del benceno. -orto-, meta- y para-xileno; dar sus nombres sistemáticos como derivados del benceno. 12) Escribir las fómulas desarrolladas de: i) etanol, ii) fenol, iii) todos los isómeros del 1-butanol, aclarando si son primarios, secundarios o terciarios; son 5 isómeros en total, incluyendo los ópticos. 13) Escribir las fórmulas de todos los polioles de cadena abierta C2 y C3. Son en total 4. Nombrarlos en forma sistemática y averiguar sus nombres triviales. 14) a) En la introducción teórica correspondiente a aldehídos y cetonas se dio más de un mombre a cada una de las sustancias dadas como ejemplos. ¿Qué conclusiones se extraen sobre reglas de nomenclatura de estos compuestos al observar sus fórmulas y nombres? b) Escribir las fórmulas desarrolladas de: i) butiraldehído, ii) la cetona isómera del anterior; nombrarla. 15) Escribir las fórmulas y los nombres sistemáticos de los siguientes ácidos monocarboxílicos: - fórmico - acrílico - acético - metilacrílico o metacrílico - propiónico - benzoico -láctico 16) Escribir las fórmulas y los nombres sistemáticos de los siguientes ácidos policarboxílicos: - oxálico - ftálico - adípico - tereftálico - cítrico 17) a) Escribir la ecuación de formación del etanoato («acetato») de propilo, a partir del alcohol y del ácido correspondiente. b) Escribir la fórmula desarrollada de todos los ésteres isómeros del anterior. c) Hay un isómero de estos ésteres que sea un ácido carboxílico ? ¿Qué tipo de isomería sería? 18) a) ¿Qué característica debe tener la molécula de una sustancia para que actúe como emulsionante? b) Un volumen de aceite vegetal se emulsiona en agua por agregado de oleato de sodio. Cómo actúa el oleato de sodio para mantener estable la emulsión? Si se agrega CaCl2(ac) el sistema se separa en dos fases. Explique qué ocurrió. 19) a) Dar ejemplos (uno de cada clase) de aminas primarias, secundarias y terciarias de grupos alquílicos y arílicos. Escribir sus fórmulas y nombres. b) Los términos «primario», «secundario», etc., tienen el mismo significado cuando se trata de aminas que cuando se trata de alcoholes? c) Escribir la fórmula de la 1,6-hexanodiamina. ¿Qué otro nombre sistemático tiene? 30 20) La siguiente sustancia H3C-C ≡N se llama indistintamente, cianometano, acetonitrilo o cianuro de metilo. Deducir de ésto qué nombre se le puede dar a la sustancia H2C=CH-C ≡≡N ¿Cuáles son las amidas de las cuales se los puede considerar derivados por deshidratación? 21) a) Escribir la fórmula del ácido hexanodioico, del 1,6-diaminohexano y del ácido ξ- aminohexanoico. b) Escribir ecuaciones en que se formen uniones peptídicas entre ellos y entre moléculas de uno solo de ellos. c) Por que se prefiere usar el cloruro de adipilo en lugar del ácido hexanodioico en sus aplicaciones industriales. V - EQUILIBRIO QUIMICO HOMOGENEO CONCEPTOS A DESARROLLAR Equilibrio químico: concepto, representación y características (dinámico, composición invariable, combinación incompleta, alcanzable a partir de las sustancias indicadas en el primero o en el segundo miembro de la ecuación correspondiente, desplazable). Constantes de equilibrio en función de concentraciones (Kc) y en función de presiones parciales (Kp). Expresiones correspondientes. Desplazamiento del equilibrio: principio de Le Chatelier. Aplicación para explicar el desplazamiento del equilibrio al modificar las concentraciones, la temperatura o la presión. Electrolitos débiles y fuertes: concepto y ejemplos con sales (electrolitos fuertes en general), ácidos y bases. Electrolitos débiles: equilibrios de disociación electrolítica. Constante de disociación electrolítica (ej. con ácido acético). Grado de disociación electrolítica (α): concepto, valores que puede tomar, variación con el tipo de electrolito, la temperatura y la concentración. Equilibrio de disociación electrolítica del agua. Constante de disociación electrolítica. Producto iónico del agua: Kw= [H+].[HO-]. Explicación de su identidad con Kw=[H3O+].[HO-]. Su valor (1,0.10-14 a 25ºC). Concepto de pH y pOH. Deducción de la relación: pH + pOH = pKw ( = 14,0 a 25ºC). Cálculos de pH y pOH de ácidos y bases débiles y fuertes, aplicando balances de masa y carga. GLOSARIO DE TERMINOS Principio de Le Chatelier o del desplazamiento del equilibrio: si un sistema está en equilibrio y se modifica alguno de los factores del mismo, se produce espontáneamente un cambio en el punto de equilibrio en el sentido en el cual se tiende a contrarrestar la modificación producida. Factores de equilibrio: las concentraciones de las sustancias que intervienen, la temperatura y, en ciertos casos, la presión. Electrolito fuerte: aquel que en solución acuosa siempre está disociado en sus iones en forma total o prácticamente total. Electrolito débil: aquel que en solución acuosa no extremadamente diluída está poco disociado en sus iones. Grado de disociación electrolítica (α): de un electrolito en una solución de concentración dada y a una dada temperatura, es el número de moles disociados por cada mol de electrolito disuelto. Se calcula como el cociente entre el número de moles disociados del electrolito y el número total de moles del electrolito presentes en esa solución, a la temperatura dada. O sea α= Nº de moles disociados Nº total de moles disueltos pH o potencial de ion hidrógeno de una solución: es el logaritmo decimal del número inverso de la concentración de iones hidrógeno (o de iones oxonio) en dicha solución. O sea pH = log 1/[H+]. Ello equivale a: pH = -log [H+]. 31 pOH o potencial de ion hidróxido de una solución: es el logaritmo decimal del número inverso de la concentración de iones hidróxido en dicha solución. O sea pOH = log 1/[HO-]. Ello equivale a: pH = -log [HO-]. EJERCICIOS Nota: son datos las masas atómicas necesarias. 1) Explicar brevemente las características del equilibrio químico. 2) a) Indicar las expresiones de Kc y Kp para la síntesis del amoníaco (gas). b) Indicar las expresiones de Kc y Kp para el equilibrio correspondiente a la descomposición en fase gaseosa del trióxido de azufre en dióxido de azufre y oxígeno. 3) Calcular el valor de Kp a una temperatura dada para la síntesis del ioduro de hidrógeno sabiendo que al analizar el sistema en equilibrio a esa temperatura se encontraron 2,50 mol de iodo (g), 8,30 mol de ioduro de hidrógeno (g) y 0,55 mol de hidrógeno (g) en un recinto de volumen V. ¿Es necesario conocer en este caso el volumen del reactor?.¿ Porqué? 4) a) Enunciar el principio del desplazamiento del equilibrio (Le Chatelier). b) Aplicarlo para justificar todas las formas posibles de desplazar el equilibrio para obtener mayor cantidad de amoníaco, en la reacción de síntesis de esta sustancia en fase gaseosa (reacción que posee un ∆H<0). Tener en cuenta que esto significa buscar las condiciones más adecuadas para un alto rendimiento de la reacción. c) ¿Por qué se enfría la mezcla a la salida del reactor? (consultar de la bibliografía los puntos de ebullición de las sustancias presentes en la reacción). 5) Considerando la reacción: ∆Hº = -114,4 kJ 4 HCl (g) + O2 (g) → 2 H2O (g) + 2 Cl2 (g) Suponga que se ha alcanzado el equilibrio. Qué le sucederá al número de moles de O2 en el recipiente si se: a) añade algo de Cl2 b) añade algo de HCl c) remueve algo de H2O d) disminuye el volumen del recipiente e) aumenta la temperatura f) añade algo de helio g) añade un catalizador. 6) Teniendo en cuenta la reacción: 2 A(g) → A2 (g) ∆H = -32,8 kcal a) Se coloca en un recipiente de 2 l 6 mol de A y 6 mol de A2 a 150 ºC (Kp=0,03). Cuál será la concentración de c/u de las sustancias del sistema en el equilibrio y el rendimiento de la reacción. Si las condiciones iniciales fueran las siguientes, indicar si el rendimiento aumenta, se mantiene o disminuye respecto de a) para c/caso, explicando porqué (sin efectuar cálculos numéricos): b) 3 mol de A y 3 mol de A2 en un volumen de 1 l a 150 ºC c) 12 mol de A y 6 mol de A2 en un volumen de 2 l a 150 ºC d) 6 mol de A y 6 mol de A2 en un volumen de 4 l a 150 ºC e) 6 mol de A y 6 mol de A2 en un volumen de 2 l a 100 ºC 7) Dada la siguiente reacción: 2 AB2 (g) + B2 (g) → 2 AB3 (g) ∆H = -32 kcal a) Calcular la concentración de c/u de las sustancias del sistema en el equilibrio y el valor de la constante de equilibrio Kp, sabiendo que se parte de 6 mol de AB2 y 2 mol de B2 en un recipiente cerrado de 20 l a 350ºC y se forman 2,4 mol de producto. b) ¿Cuál será la presión final del sistema? c) Calcular el calor intercambiado, éste ¿es calor ganado o cedido por el entorno? d) ¿Qué factores de equilibrio modificaría y cómo, para desplazar el equilibrio a la derecha? Explicar. 32 8) Dada la reacción: PCl5 (g) → PCl3 (g) + Cl2 (g) a) A 250 ºC se coloca una muestra de PCl5 en un recipiente cerrado de 30 l y se deja que se establezca el equilibrio. En ese instante hay 1,847 mol de PCl5, 1,500 mol de PCl3 y 1,500 mol de Cl2. Calcular Kc y Kp a 250ºC. b) Si se introduce en en recipiente cerrado de 30 l previamente evacuado 3 mol de PCl3 y 3 mol de Cl2 (g). Calcular la concentración de c/u de las sustancias del sistema a 250ºC al establecerse el equilibrio. 9) Explicar los conceptos de: a) electrolito fuerte y electrolito débil c) producto iónico del agua b) grado de disociación electrolítica d) pH y pOH. 10) Indicar: a) de qué depende el valor del grado de disociación electrolítica b) cuál es su valor para un electrolito débil en solución infinitamente diluída. 11) Deducir la relación entre pH y pOH. 12) Calcular, para 25ºC, los valores de pH de las soluciones acuosas cuyas condiciones están definidas por los siguientes datos: a) [H3O+] = 1.10-3 mol/l b) [H3O+] = 1.10-7 mol/l + -5 c) [H3O ] = 3.10 mol/l d) [H3O+] = 5.10-7 mol/l e) [HO-] = 1.10-9 mol/l f) [HO-] = 2,5.10-5 mol/l En una primera instancia razonar entre que valores enteros consecutivos se halla cada valor; por ejemplo: 4 < pH < 5 10> pOH > 9 10-4 mol/l > [H3O+] = 3. 10-5 mol/l > 10-5 mol/l Decir en cada caso si se trata de medio neutro, ácido o básico. 13) Expresar la concentración de iones oxonio e hidróxido correspondiente a los siguientes valores de pH: 4,0 ; 3,5 ; 11,4. Decir en cada caso si se trata de medio neutro, ácido o básico. 14) Calcular, a 25 ºC, el pH y el pOH de las siguientes soluciones acuosas de : a) HCl 0,1 N b) HCl 10-3 M c) H2SO4 0,03 N d) H2SO4 10-3 M e) NaOH 0,15 N f) KOH 1. 10-3 N g) Ca(OH)2 0,1 M En todos estos casos se admite grado de disociación α = 1. 15) El ácido acético (CH3-COOH) y el hidróxido de amonio son dos electrolitos débiles. a) ¿Qué solución acuosa: NaOH 0,1 M ó NH4OH 0,1 M será más básica? b) ¿Qué solución acuosa: HCl 0,1 M ó CH3-COOH 0,1 M será más ácida? c) ¿Cuál de las soluciones indicadas en a) y b) tendrá menor pH y cual mayor pH? (sin efectuar cálculos, justificar su respuesta). Ordenarlas por orden creciente de pH. Nota: el llamado “hidróxido de amonio” realmente no existe como especie molecular. Usualmente se denomina así a la solución acuosa de NH3 debido a la presencia de iones HO- en la misma: NH3 + H2O → NH4+ + HO16) Se prepara una solución de HCl cuya composición es de 0,18 g de soluto por 100 cm3 de solución. Calcular el pH de dicha solución. 17) Calcular el pH de una solución de un ácido monoprótico débil a 25 ºC y en solución 3.10-2 M, sabiendo que en esas condiciones está disociado en un 12%. 18) Para una solución de SO4H2 (α = 1) cuyo pH = 3, calcular a 25 ºC: a) la molaridad de H3O+ b) la normalidad del ácido c) la molaridad del ácido d) la M del H+ e) los gramos de ácido cada 100 cm3 de solución. 33 19) Para una solución de Ba(OH)2 (α = 1) cuyo pH = 12: a) escribir la ecuación de disociación electrolítica. Calcular para 25 ºC: a) la molaridad de Ba2+ y de HOb) la normalidad de la base c) la molaridad de la base d) cuántos gramos de Ba(OH)2 tiene 1 litro de dicha solución. 20) I - Calcular el pH que tendrán las soluciones resultantes al mezclar a 25ºC: a) 200 cm3 de solución 0,05 M de ácido sulfúrico con 40 cm3 de solución 0,5 M de hidróxido de sodio b) 400 cm3 de solución 0,5 M de ácido sulfúrico con 600 cm3 de solución 0,3 M de hidróxido de sodio. Se supone α = 1 para todos los electrolitos presentes y que los volúmenes son aditivos. II - Escribir las ecuaciones químicas que representan las reacciones ocurridas en a) y b) respectivamente, en forma molecular y iónica. 21) Se tiene 0,5 l de una solución de HCl de pH = 3. Se requiere solución de pH = 2. ¿Qué volumen de solución de H2SO4 0,1 M habrá que agregar para alcanzar el pH deseado? Si se quiere disminuir el pH de 2 a 1, ¿se requerirá el mismo volumen o no?, ¿porqué? Nota: suponer α = 1 y volúmenes aditivos. 22) Se tiene 1,5 l de una solución de HCl de pH = 1. Se requiere solución de pH = 3. ¿Qué volumen de solución de Ca (OH)2 0,3 M habrá que agregar para alcanzar el pH deseado? Nota: suponer α = 1 y volúmenes aditivos. 23) Se prepara una solución disolviendo 0,52 mol de una base de fórmula MeOH desconocida en agua hasta obtener 6 l de solución. Con un peachímetro se determinó que el pH de la solución es de 12. a) Calcular el grado de disociación. Expresar el equilibrio de disociación de la base. b) ¿Cuál es el valor de la constante de disociación de la base? 24) El “ vinagre” común es una solución de ácido acético al 5% en m/m. a) Calcular el pH del mismo y el porcentaje de ionización. b) Dado que se diluye en los alimentos, suponiendo un caso de dilución volumétrica al 10%. ¿Cuál será el pH correspondiente y el porcentaje de ionización? c) Que tendencia se observa en el grado de ionización al producir una dilución. δsn = 1 kg/l Ka = 1,8.10-5 Ácido acético: CH3-CO.OH = HAc 25) Se prepara una solución disolviendo algo de NH3 en agua. Si el pH de la solución es 13 ¿Cuántos moles de amoníaco se disolvieron por litro? Calcular el grado de disociación (Importante: plantear ecuación de disociación correctamente). Dato: Kb=1,8.10-5. 26) Indicar ecuación de disociación o reacción y calcular el pH de la solución al mezclar: a) 2 l de HCl 0,03 M (α= 1) y 1 l de agua b) 2 l de HCl 0,03 M (α= 1) y 1 l de NaOH 0,03 M (α= 1) c) 2 l de H2SO4 0,03 M (α= 1) y 1 l de KOH 0,03 M (α= 1) d) 2 l de ácido acético 0,03 M (Ki= 1.8x10-5) y 1 l de agua e) 2 l de NH3 0,03 M (Ki= 1,8x10-5) y 1 l de agua. 34 VI - REACCIONES DE OXIDO-REDUCCION Y ELECTROQUIMICA CONCEPTOS A DESARROLLAR Clasificación de las reacciones químicas: sin cambio en números de oxidación y con cambio en números de oxidación. Reacciones de óxido-reducción. Oxidantes y reductores. Ecuaciones parciales de oxidación y de reducción. Conducción eléctrica de primera y segunda clase. Tipos de electrolitos. Mecanismo de conducción eléctrica en los electrolitos. Carga del electrón. Construcción y funcionamiento de electrodos. Notación. Concepto de potencial de electrodo: variables que afectan su valor. Ejemplos de reacciones de electrodo. Electrodos reversibles e irreversibles. Electrodo normal de hidrógeno. Serie de potenciales patrón de reducción. Convención de signos. Potenciales de oxidación. El Faraday: carga de un mol de electrones. Relación entre Faraday y equivalente-gramo redox. Potenciales de electrodo en condiciones no patrón: ecuación de Nernst. Pilas: proceso espontáneo. Construcción y funcionamiento de pilas reversibles e irreversibles. Dispositivos de vinculación de semipilas: puente salino, tabique poroso; casos en que estos dispositivos no son necesarios. Anodo, cátodo: proceso espontáneo en cada uno de ellos. Notación de pilas. Convención de signos. Fuerza electromotriz de pilas en condiciones patrón y no patrón. Aplicación de la ecuación de Nernst. Electrólisis: proceso no espontáneo. Necesidad de la aplicación de una fuerza electromotriz externa para su funcionamiento. Esquema descriptivo de la construcción y funcionamiento de cubas electrolíticas. Reacciones anódica y catódica. Deducción de acuerdo con la ubicación de los elementos en la serie de potenciales patrón y el carácter de los electrodos: reglas aplicables. Electrólisis de interés industrial: obtención de aluminio, refinación de cobre, proceso cloro-soda. Pilas electroquímicas: pila de Daniell, pila de cadmio-niquel y acumulador de plomo: constitución y reacciones químicas. GLOSARIO DE TERMINOS Oxidación. Reacción por la cual un elemento aumenta su número de oxidación. Frecuentemente el fenómeno incluye la pérdida de uno o más electrones por parte de la especie química que lo contiene o los contiene. Reducción. Reacción por la cual un elemento disminuye su número de oxidación. Frecuentemente el fenómeno incluye la captación de uno o más electrones por parte de la especie química que lo contiene o los contiene. Oxidante o agente oxidante en una reacción redox dada. Especie química que se reduce en dicha reacción. Reductor o agente reductor en una reacción redox dada. Especie química que se oxida en dicha reacción. Electroquímica. Vincula los fenómenos químicos con la corriente eléctrica. Fuerza electromotriz de una pila. Diferencia de potencial entre sus electrodos cuando no circula corriente. Potencial (de reducción) de electrodo es la fuerza electromotriz de la pila formada por dicho electrodo y un electrodo patrón de hidrógeno; su signo (+ ó -) es el de la polaridad del electrodo en dicha pila. Condiciones patrón ( es preferible no emplear el término “normales” para evitar confusiones con las condiciones normales para gases ideales). Temperatura= 25 ºC Concentraciones: 1 M para los iones Presión parcial= 1 atm para los gases que intervienen. Fuerza electromotriz normal, patrón o estándar de una pila. Es su fuerza electromotriz en condiciones patrón o estándar. Se la obtiene restando el potencial patrón de reducción del electrodo negativo (ánodo) al potencial patrón de reducción del electrodo positivo ( cátodo). 35 O sea, para la pila de Daniell: fem = E0red(Cu2+/Cu) - E0red(Zn2+/Zn) = 0,34 V - (-0,76 V) = 1,10 V La fuerza electromotriz de la pila es siempre positiva para el proceso espontáneo. Ecuación de Nernst (empleando potenciales de reducción) para condiciones no patrón. Ered = E0red - R .T . ln Qc,red n.F donde Ered es el potencial de reducción del electrodo en las condiciones dadas; E0red es el potencial de reducción del electrodo en condiciones patrón; n es la cantidad de electones transferidos según la semiecuación iónica redox, Qc,red es la expresión idéntica a la de la constante molar de equilibrio para la semireacción redox reversible en el sentido de la reducción (como en la tabla de la página 50). De esta expresión quedan excluídas las molaridades que son constantes, como son las del agua en solución diluída y las de las sustancias poco solubles (metales, óxidos). Ejemplos: a) para: Zn2+ + 2 e → Zn (s) Qc,red = 1 [ Zn2+] ; n=2 b) para: MnO4- + 8 H+ + 5 e Qc,red = [ Mn2+ ] [MnO4- ].[H+]8 ; → Mn2+ + 4 H2O n=5 R = 8,32 J. mol-1. K-1 T, en condiciones patrón = 298 K (t = 25ºC) Si el electrodo funciona a temperatura muy diferente de 298 K hay que tenerlo en cuenta. F: 96500 C . mol-1 = 96500 J. V-1. mol-1 ln x = 2,303. log x R .T . 2,303 = 8,32 J.mol-1. K -1. 298 K . 2,303 F 96500 J. V-1. mol-1 = 0,059 V R .T . ln Qc,red = 0,059 V . log Qc,red n.F n E puede calcularse a temperaturas próximas a 25ºC con la expresión : E = E0 - 0,059 V . log Qc,red n Nota: de acuerdo con la convención internacional se emplean estos potenciales de reducción, si bien conviene tener presente que la convención usual en EEUU, empleada en muchos textos corrientes en nuestro medio, utiliza potenciales de oxidación. E0red = - E0ox La fuerza electromotriz de la pila es siempre positiva. 36 POTENCIALES NORMALES DE REDUCCIÓN DE ALGUNOS SISTEMAS Semirreacción Eo(V) F2 + 2e 2F – Au+ + e Au + PbO2 + 4H + SO42- + 2e PbSO4 + 2H2O + 2+ MnO4 + 8H + 5e Mn + 4H2O Au3+ + 3e Au Cl2 + 2e 2Cl – + O2 + 4H + 4e 2H2O – Br2 (l) + 2e 2Br Au + 4Cl – AuCl4 – + 3e NO3 – + 4H+ + 3e NO + 2H2O + Ag + e Ag 3+ Fe + e Fe2+ I2 + 2e 2I – NiO2 + 2H2O + 2e Ni (OH)2 + 2OH – O2 + 2H2O + 4e 4OH – Cu2+ + 2e Cu SO42- + 4H+ + 2e SO2 + 2H2O HgO + H2O + 2e Hg + 2HO – 2H+ + 2e H2 2+ Pb + 2e Pb 2+ Sn + 2e Sn Hg2Cl2 + 2e 2Hg + 2Cl – Ni 2+ + 2e Ni 2+ Co + 2e Co Pb SO4 + 2e Pb + SO42Cd2+ + 2e Cd 2+ Fe + 2e Fe 2S + 2e S 2+ Zn + 2e Zn Cd (OH)2 + 2e Cd + 2OH – 2H2O + 2e H2 + 2OH – ZnO + H2O + 2e Zn + 2OH – Al3+ + 3e Al Mg2+ + 2e Mg Mg (OH)2 + 2e Mg + 2OH – + Na + e Na + K +e K Cu (OH)2 + 2e Cu + 2OH – Li+ + e Li 2,80 1,70 1,69 1,51 1,50 1,36 1,23 1,07 1,00 0,96 0,80 0,77 0,54 0,49 0,40 0,34 0,17 0,098 0,00 -0,13 -0,14 -0,24 -0,25 -0,28 -0,36 -0,40 -0,44 -0,48 -0,76 -0,81 -0,83 -1,25 -1,66 -2,37 -2,69 -2,71 -2,93 -3,03 -3,05 37 38 Electrólisis de soluciones acuosas En solución acuosa, los ácidos, bases y sales están disociados en sus iones, en mayor o menor grado. Cuando se produce el pasaje de una corriente eléctrica los iones se orientan según el signo de su carga y su comportamiento, en cada electrodo, depende de la naturaleza de los aniones, cationes y electrodos. Según dicha naturaleza pueden presentarse, con frecuencia, las siguientes situaciones: Cátodo (no atacable por la solución electrolítica por sí misma) Cu, Pt, C (grafito), etc. Los productos dependen de las características de los cationes que llegan al cátodo (reducción) y no de la naturaleza de éste. 1º) Si el catión proviene de un metal alcalino (grupo I), alcalino-térreo (grupo II) o del Al, se reduce el agua liberando H2 (g) y aumenta la basicidad de la zona catódica: 2 H2O + 2 e electrólisis H2 + 2 HOLos HO- y los cationes (Na+,K+,Al3+, etc.) forman los correspondientes hidróxidos y se mantienen disociados en iones en la solución o precipitan (de acuerdo con su solubilidad). 2º) Si el catión proviene de un metal que no sea ni alcalino, ni alcalino-térreo, ni aluminio,éste se reduce depositándose en el electrodo: Men+ + n e electrólisis Me0 Anodo: los productos dependen del material del ánodo y de las características de los aniones: A) Anodo inerte o inatacable: ej. Pt, C(grafito). Los productos dependen de las características de los aniones: 1º) Si los aniones son oxigenados, formados por un elemento con máximo número de oxidación, como SO42-, NO3- o PO44-, se oxida el agua liberando O2 (g) y aumenta la acidez de la zona anódica: 2 H2O → O2 + 4 H+ + 4 e 2º) Si el anión es más fácilmente oxidable que el agua, como los iones Cl-, Br-, I-, se forma la sustancia simple: Ej.: 2 Cl- → Cl2 + 2 e B) Anodo atacable o no inerte: ej.: Fe, Al, Cu (metales más fácilmente oxidables que el agua): El ánodo pasa a la solución como ion Ej.: Cu → Cu2+ + 2 e EJERCICIOS NOTA: son datos los valores de las masas atómicas relativas, los potenciales normales de electrodo y F = 96500 C. mol-1 NA = 6,02 . 1023 mol-1 las constantes: R = 0,082 l.atm (K.mol)-1 1) Equilibrar por el método de ion electrón las siguientes ecuaciones, indicando en cada caso cuál es el agente oxidante y cuál el agente reductor: a) cloruro de hierro(II) (ac) + cloro (g)-------- clururo de hierro(III) (ac) b) manganato(VII) de potasio (ac) + cloruro de hidrógeno (ac)----cloruro de manganeso(II) (ac) + cloro (g) + cloruro de potasio (ac) + agua (l) c) nitrato(V) de hidrógeno (ac) + cobre (s)----nitrato(V) de cobre(II) (ac) + monóxido de mononitrógeno (g) + agua (l) d) sulfato(VI) de hierro(II) (ac) + manganato(VII) de potasio (ac) + sulfato(VI) de hidrógeno (ac)---sulfato(VI) de hierro(III) (ac) + sulfato(VI) de manganeso(II) (ac) + sulfato(VI) de potasio (ac) + agua (l) En cada caso, indicar el valor del eq-g del oxidante y del reductor, expresado en moles. 2)a) ¿Qué cantidad de electricidad, en coulombs y en faradays, corresponden a un mol de electrones, un mol de iones cloruro y un mol de iones calcio? b) Calcular la carga eléctrica de un electrón en coulombs. 39 3) a) En forma esquemática, dibujar las semipilas que contienen: I- un electrodo metal-solución II- un electrodo de hidrógeno III- un electrodo inerte en una solución Fe3+; Fe2+ b) Escribir las semiecuaciones de reducción correspondientes a cada uno de los electrodos anteriores. c)Representar cada uno de los electrodos mediante la notación correspondiente. d) Enunciar las condiciones necesarias para que cada uno de estos electrodos pueda ser considerado “patrón” (normal o estándar). 4) Dada la siguiente ecuación: K2Cr2O7(ac) +HCl(ac) ----- KCl(ac) + CrCl3(ac) + Cl2(g) + H2O (l) a) Equilibrarla por el método de ion electrón. b) Calcular el volumen de gas desprendido a 20ºC y 380 mmHg cuando reaccionan 0,5 equivalentes gramo del oxidante. 5) Escribir las ecuaciones moleculares equilibradas e indicar con → las reacciones que se producen y con → las que no se producen, teniendo en cuenta la tabla de E0. Escribir las ecuaciones parciales de oxidación-reducción para las reacciones que se produzcan. a) ácido clorhídrico + zinc ------- cloruro de zinc + hidrógeno b) ácido clorhídrico + magnesio ------- cloruro de magnesio + hidrógeno c) ácido clorhídrico + cobre ------- cloruro de cobre (II) + hidrógeno d) ácido sulfúrico + aluminio ------- sulfato de aluminio + hidrógeno 6)a) A continuación se representa la notación de tres pilas. Para cada una de ellas indicar cuál de sus semipilas constituye el ánodo y cuál el cátodo, en condiciones patrón. Fundamentar las respuestas. Escribir la notación simbólica correcta. 1) Zn (s) / Zn2+ // H+ / H2 (g) / Pt 2) Cu (s) / Cu2+ // H+ / H2 (g) / Pt 3) Cu (s) / Cu2+ // Zn2+ / Zn (s) b) en forma esquemática, dibujar la segunda y la tercera de dichas pilas. 7) Las siguientes ecuaciones representan reacciones que ocurren espontáneamente en el sentido indicado por las flechas: 1) AgNO3(ac) + CaCl2(ac) → Ca(NO3)2 (ac) + AgCl (ac) 2) H2SO4(ac) + Al (s) → Al2(SO4)3(ac) + H2 (g) 3)KMnO4(ac)+H2SO4(ac) +FeSO4(ac) → Fe2(SO4)3(ac) + MnSO4(ac) +K2SO4(ac)+H2O(l) a) Equilibrar las ecuaciones utilizando el método de ion electrón, cuando sea posible. b) Deducir cuales de ellas pueden dar lugar a la construcción de pilas. Fundamentar la respuesta. c) Desdoblar las reacciones elegidas en b) en sus respectivas semiecuaciones de oxidación y de reducción. d) Para cada posible pila indicar qué reacción tiene mayor potencial normal de reducción (E0red). e) Representar las pilas posibles mediante la notación convencional. 8) Calcular el potencial de oxidación y de reducción de los siguientes eectrodos a 25ºC: a) Fe2+/ Fe, a una concentración 0,01 M de FeCl2 ; b) H+ /H2 /Pt a una concentración 0,1 M de HCl, pH2 = 10-1atm c) Pt / Fe3+, Fe2+ donde [FeSO4] = 0,1 M y [Fe2(SO4)3] = 0,5 M 9) Calcular la f.e.m. de una pila formada por un electrodo de plomo sumergido en una solución 10-4 M de Pb(NO3)2 y otro electrodo de Sn en solución 10-2 M de Sn(NO3)2. Simbolizar la pila correspondiente indicando ánodo y cátodo. 40 10) Se formó una pila entre un electrodo de Cd sumergido en una solución 10-2 M de Cd(NO3)2 y otro electrodo de platino sumergido en una solución 10-2 M de HCl a la que se hace llegar Cl2 (g) a 10-6 atm. a) Calcular el potencial de cada electrodo y la f.e.m. de la pila. b) Escribir las semiecuaciones iónicas redox que tienen lugar en cada electrodo. c) Escribir la notación convencional de la pila. 11) Sobre la base del conocimiento del acumulador de plomo: a) Nombrar los constituyentes de cada uno de sus electrodos. b) Describir dichos electrodos mediante la notación respectiva. c) Dscribir las ecuaciones electroquímicas de descarga y de carga. d) Dibujar un esquema que representa tanto la construcción del acumulador como el proceso de su descarga. Calcular para un proceso de descarga en que la masa de ácido sulfúrico (sulfato(VI) de hidrógeno) disminuye en 294 g : e) las variaciones en moles de las sustancias del sistema f) la cantidad de electricidad originada. 12) Se tiene la pila Fe/ Fe2+(1M )// H+(1M)/ H2(1atm)/Pt, a 25oC. Se desea aumentar su fuerza electromotriz, respecto de la que posee en condiciones patrón. ¿Podría hacerlo modificando las concentraciones de las soluciones electródicas? Fundamentar la respuesta. 13) Pila Cd-Ni : a) indicar cuáles son los componentes de los electrodos y cuál el electrolito en el que están sumergidos b) escribir las ecuaciones de las reacciones que tienen lugar en los respectivos electrodos c) representar la pila mediante la notación convencional d) calcular la f.e.m. en condiciones patrón. 14) Indicar qué se libera en el ánodo y en el cátodo, ambos inertes, durante la electrólisis de soluciones acuosas neutras que contienen, respectivamente: a) ortofosfato de sodio b) ioduro de cadmio c) sulfato de zinc d) cloruro de oro(III) 15) Escribir las ecuaciones de las reacciones anódica y catódica correspondientes a las electrólisis de soluciones acuosas de: a) cloruoro de sodio b) ioduro de potasio Sabiendo que la fenolftaleína da color rosado o rojo en medio básico, indicar como podría emplear estas reacciones para identificar el signo de los polos de una fuente de corriente contínua. Sabiendo que el almidón da color azul en presencia de iodo, mencionar otra posible forma de identificar dichos polos. 16) Dibujar los esquemas y escribir las ecuaciones químicas correspondientes a la obtención industrial de aluminio y a la refinación electrolítica del cobre. 17) Una solución de sulfato de cobre(II) se electroliza con electrodos inertes durante 5h 21min 40s con unas intensidad de 5 A. Calcular cuántos gramos de Cu y qué volumen de oxígeno en condiciones normales de presión y temperatura se obtienen. 18) Si circula 1 Faraday por un litro de una solución cuya concentración inicial es 2,5 M de sulfato de cobre(II), ¿cuál será la molaridad del sulfato de cobre(II) al cabo de este pasaje a)si el ánodo es de cobre? b)si el ánodo es de platino? Escribir las ecuaciones de las reacciones anódica y catódica que se producen en cada caso. 19) Una cierta instalación tiene conectados en serie tres voltámetros, todos ellos con electrodos de platino. Estos voltámetros contienen, respectivamente, los siguientes electrolitos en cantidades suficientes para la ejecución de la operación: 1º) Solución acuosa de sulfato(VI) de cobre(II) 2º) Cloruro de plomo(II) fundido 3º) Solución acuosa de ácido sulfúrico 41 a) Dibujar un esquema de la instalación, mostrando la marcha de electrones libres y de iones. b) Escribir las ecuaciones químicas correspondientes a cada voltámetro (semiecuaciones iónicas, ecuaciones iónicas y ecuaciones “moleculares”). c) Calcular la cantidad (en moles) de cada una de las sustancias consumidas y formadas durante el pasaje de 1930 C por el circuito. 20) Por una cuba electrolítica que contiene solución acuosa de cloruro de niquel(II) circulan 5A durante 1930 s. Calcular cuántos equivalentes-gramo de niquel se depositan; si la sal hubiese sido sulfato(VI) de niquel(II), ¿los resultados serían los mismos? 21) Qué volumen de cada uno de los siguiente gases, en condiciones normales de presión y temperatura, se liberará por el paso de 6 Faradays? b) Cl2 c) H2 Dar ejemplos de electrolitos que llevan a esa liberación. a) O2 22) Dibujar esquemáticamente un acumulador de plomo que alimenta la cuba electrolítica correspondiente al ejercicio 20). Señalar en dicho esquema: a) circulación de electrones b) circulación de iones c) ánodo y cátodo en el acumulador y en la cuba electrolítica d) polaridad de los electrodos en el acumulador y en la cuba. Problemas de Aplicación 23) En una instalación para la obtención de aluminio metálico circuló una corriente de intensidad 50000 A durante 3 horas. a) Cuántos kg de aluminio se obtuvieron en ese lapso? b) Si se supone que el 20% de la masa de oxígeno formado ataca al ánodo con formación de dióxido de carbono, ¿qué masa de éste se consumen en esas 3 horas? 24) Se desea realizar un baño de oro de 0,5 mm de espesor sobre una pieza de hierro de 205cm3 de superficie total. a) Dibuje un esquema del dispositivo que montaría para obtenerlo, mencionando todos los materiales y sustancias necesarias. b) Qué intensidad de corriente debería utilizar para que el proceso se logre en no más de 60min? El rendimiento de la operación es de 82%. δAu = 19300 kg/m3 25) Se desea obtener electrolíticamente como metales puros al aluminio , sodio, zinc y magnesio. Se cuenta para ello con NaCl, Al2O3, MgCl2 y ZnSO4. Indicar que electrolitos se utilizan en estado líquido y cuáles en solución acuosa. Porqué? Indicar reacciones anódica, catódica, iónica neta y molecular total correspondientes al sistema electrolítico necesario y/o más adecuado en cada caso. Esquema de la instalación de la celda electrolítica para el caso de obtención de Aluminio, tipo de electrodos, polaridad de los mismos, movimiento de iones y electrones, etc. 26) Se quiere producir en un mismo proceso electrolítico industrial como mínimo 2 t/día de NaOH y 1,4 t/día de Cl2, para abastecer una planta de tratamiento de pulpa de madera. a) ¿Qué sistema electrolítico se requiere? Escribir la ecuación anódica, catódica y molecular de la reacción. Esquema de una celda para este sistema. b) Calcular el volumen mínimo de solución 6 M de electrolito que se requiere suponiendo un rendimiento de 67%, la intensidad media de la corriente y la masa excedente de uno de los productos. c) Volúmenes de gases que se desprenden diariamente en CNPT. 27) La pila de cadmio-niquel cuya notación convencional se indica, alimenta una cuba electrolítica con electrodos inertes que contiene 1,5 L de solución acuosa de nitrato(V) de zinc 2,5 M. El sistema funciona durante 7,5 horas con una intensidad de corriente de 0,5 A. Cd (s)/ Cd(OH)2 (s) / KOH (1,3 M) / Ni(O2 (s) / Ni(OH)2 (s) a) Dibujar un esquema de la instalación. 42 b) Tanto para la pila como para la electrólisis, dar la ecuaciones químicas en cada electrodo y la ecuación química total. c) Calcular la f.e.m. de la pila a 25ºC para las concentraciones dadas. d) Calcular la molaridad final de la solución de nitrato(V) de zinc suponiendo que no hay variación de volumen. e) Calcularlos volúmenes de gases, en CNPT, que pudieran desprenderse en los electrodos de la cuba electrolítica. 28) Una sonda espacial alimenta sus circuitos eléctricos de procesamiento de imagenes para transmitir a la Tierra, con celdas de combustible en base a H2 y O2 (ver nota). La potencia del sistema es de 60 W. Se estima adecuada para el diseño de los reservorios el requerimiento de energía para un día. Las baterías son de 12 V. a) Completar el esquema: celdas, electrodos, movimiento de cargas eléctricas, considerando como electrolitos de la celda electrolítica y la pila al Ca(NO3)2 (ac) y al KOH (ac) respectivamente, dar ecuacuiones parciales en electrodos y totales en ambas celdas. b) Calcular el volumen de los tanques de O2 e H2 a 0ºC y 2000 mmHg. c) A qué presión parcial deben ser inyectados en los electrodos de la pila de combustible los gases O2 e H2 respectivamente, para que el potencial reversible de la celda sea de 1,2 V y la presión parcial del H2 sea el doble de la de O2. Nota: la energía solar incide sobre paneles con celdas fotovoltaicas, suministrando la corriente eléctrica que alimenta una celda electrolítica para descomposición del agua. Los gases productos almacenan la energía en forma química, que se transforma en eléctrica en la pila de combustible, cuando se produce agua. Peléctrica = I (A) . V (v) Potencia: P(W) = E (J) t (s) 29) Una instalación para electrorrefinación de cobre procesa 150 kg de cobre de 99% de pureza, por ciclo de 8 horas de funcionamiento. Los datos de operación son los siguientes: - diferencia de potencial aplicada = 0,23 volt/cuba - intensidad de corriente (media) = 16144 A - 6 cubas electrolíticas conectadas en serie a) ¿Cuál es la producción de cobre 99,8% (en kg/ciclo)? b) ¿Cuál es el rendimiento de la corriente? ¿En qué se transforma la energía eléctrica “perdida”? c) ¿Cuál es la potencia eléctrica consumida por la instalación? P(watt) = I (ampere) . V (volt) 43 30) Una planta de galvanoplastía procesa 50 m2 de superficie cromada por día (jornada de 8 horas), utilizando nitrato(V) de cromo(III) como electrolito y ánodo inerte. El recubrimiento es de 0,15 mm de espesor. La densidad del cromo depositado es de 7190 kg/m3. a) ¿Cuál es el consumo diario de nitrato(V) de cromo (III)? b) ¿Qué caudal de electrolito se debe utilizar, si la concentración de la sal de cromo en la solución es de 20% m/m? δsn = 1,24 kg/l. c) Si la intensidad media de corriente medida durante la electrólisis es de 15000 A: ¿con qué rendimiento de corriente trabaja la instalación? d) Hacer un esquema de una posible instalación para llevar a cabo este proceso. 31) Se realizó la electrólisis de 350 cm3 de solución acuosa 1 M de ioduro de potasio, haciendo circular 3 A durante 3 horas. Luego se titulo 10 cm3 de líquido catódico con ácido clorhídrico 0,5 N. Se gastó 17,2 cm3 de solución. a) ¿Cuál es el rendimiento de la electrólisis? b) ¿Cuál es la concentración final de ioduro de potasio? 44 VII - CORROSION CONCEPTOS A DESARROLLAR Conceptos generales. Estado natural de los metales. Metales nobles. Corrosión. Agentes o medios agresivos. Corrosión química y corrosión electroquímica. Características de cada una. Corrosión por formación de micropilas y por ataque electrolítico: causas, ejemplos, ecuaciones. Corrosión electroquímica del hierro. Velocidad de corrosión. Formas de expresarla. Intensidad de la corriente de corrosión: cálculo. Polarización. Polarización de concentración. Películas superficiales. Potenciales anódico y catódico. Procedimientos de protección. Características de películas protectoras. Protección del hierro. Protección no electroquímica y protección electroquímica. CONCEPTOS GENERALES La mayor parte de los elementos metálicos se encuentran en la corteza terrestre en forma de compuestos insolubles en agua (óxidos, silicatos, sulfuros, carbonatos, etc.): Fe2O3 (hematita), Al2O3.2SiO2.2H2O (caolinita), ZnS (galena), etc. Esto muestra que un compuesto insoluble en agua y con el elemento metálico en algún estado de oxidación positivo, p. ej. hierro (III) es una forma natural muy estable para dicho elemento. Sólo pocos elementos metálicos pueden encontrarse en la naturaleza al estado "nativo" (estado de oxidación cero): son los metales llamados nobles (Cu, Ag, Au, Pt, etc.), todos ellos con potenciales de reducción patrón positivos. La exposición de cuerpos metálicos a ciertos medios fluídos (líquidos o gaseosos) origina frecuentemente un deterioro de las propiedades de aquellos, acompañado por modificaciones químicas que se desarrollan con el tiempo. Tal fenómeno se llama corrosión. Se suele llamar agente o medio agresivo al que produce la corrosión; puede tratarse de agua de mar, aire húmedo, vapores ácidos, etc. Se habla de corrosión química cuando el fenómeno se debe a la reacción química entre el metal y el agente corrosivo (p. ej. el oxígeno del aire) en contacto directo. Por ejemplo, una pieza de hierro, digamos una chapa, calentada al aire seco, a alta temperatura, se oxida a apreciable velocidad según: 4 Fe (s) + 3 O2 (g) = 2 Fe2O3 (s) reacción análoga a una combustión. Otro ejemplo sería el ataque directo de un metal con un ácido, como en el caso: Mg (s) + 2 HCl (ac) = MgCl2 (ac) + H2 (g) Mg(s) + 2 H+ = Mg2+ + H2 (g) Se trata pues de una reacción de oxidación-reducción directa en la que no hay corrientes eléctricas que recorran el metal. En cambio, se habla de corrosión electroquímica o galvánica cuando hay circulación de iones en el medio agresivo y, simultáneamente, de electrones libres en el metal agredido (reacción "a distancia"). Este tipo de corrosión es de mayor complejidad y también de mayor frecuencia y de enorme implicancia técnico-económica. Ocurre cuando el agente agresivo actúa sobre ciertas zonas (comúnmente se emplea la palabra "áreas"), de un mismo cuerpo metálico que, en cierto momento, tengan menor potencial de reducción, o sea que sean más "anódicas" respecto de otras zonas del mismo cuerpo. En tal caso, las acciones fisicoquímicas y mecánicas van acompañadas de una corriente eléctrica dentro del metal (conducción metálica) y de circulación de iones (conducción electrolítica) en el medio líquido en contacto con el metal. Puede desempeñar el papel de medio agresivo líquido, la delgadísima e invisible película de humedad que casi inevitablemente recubre a todo cuerpo expuesto al aire atmosférico. Este tipo de corrosión es también una reacción de oxidación-reducción, de tipo iónico, tal como las que ocurren en las descargas de las pilas electroquímicas (pilas galvánicas) o en las electrólisis, a distancia, es decir sin que las sustancias actuantes estén en contacto directo. Así, por ejemplo, el medio agresivo constituído por oxígeno disuelto en agua actúa en la corrosión del hierro según: O2 (g) + 2 H2O (l) + 4 e = 4 HOPor consiguiente, estos procesos de corrosión electroquímica pueden ocurrir, ya sea: 45 a) porque el cuerpo metálico, aún cuando fuera perfectamente homogéneo, está en contacto (sumergido, enterrado, etc.) con un medio en el cual hay diferencias de potencial que generan la circulación de corrientes eléctricas, llamadas vagabundas, que pueden producir un ataque electrolítico; b) porque las diferencias de potencial propias de diferentes zonas o áreas de la superficie (microelectrodos) convierten al cuerpo metálico junto con el medio agresivo en un gran conjunto de micropilas electroquímicas o galvánicas. Las diferencias de potencial propias en un mismo cuerpo metálico pueden deberse a causas tan obvias como, por ejemplo, a la unión de sus partes mediante un material de soldadura de otra composición (p. ej. hierro con aleación estaño-plomo) o a la inserción de un tornillo de bronce (cobre-estaño) en una chapa de zinc. En cada uno de estos ejemplos se pueden reconocer fácilmente áreas de diferente potencial de electrodo (cupla o par) que, junto con un medio con el que ambas áreas estén simultáneamente en contacto, constituyen las respectivas pilas electroquímicas. Así en el caso de un tornillo de bronce insertado en una chapa de Zn y en presencia de aire húmedo ni siquiera muy ácido (a pH > 4,3) se formas los siguientes electrodos: a)Anodo: la chapa de Zn expuesta a un ambiente húmedo (película de humedad que la cubre y permite el movimiento de iones en ella). Reacción anódica: Zn (s) = Zn2+ + 2 e b)Cátodo: el tornillo de bronce (Cu-Sn) sumergido en aire húmedo (o película de humedad saturada de oxígeno). Reacción catódica: O2 (g) + 2 H2O (l) + 4 e = 4 HOE0 Zn2+/Zn = -0,76 V y E0 O2/HO- = 0,40 V, en que [HO-] = 1 mol/l, o sea pH = 14. Pero en zinc expuesto a una película de humedad en que [Zn2+]< 1 mol/l y con agua aireada (pO2 = 0,2 atm), pero a pH< 14, resultan: E0 Zn2+/Zn < -0,76 V y E0 O2/HO- > 0,40 V, potenciales calculables con la fórmula de Nernst y que originan una f.e.m. muy superior a 1,16 V. Dichos electrodos constituyen la pila de notación convencional: (-) Zn (s)/ Zn2+, H2O, O2 (ac), HO-/ O2 (g) / (Cu-Sn) (+) Como consecuencia, en la zona anódica se produce la corrosión del Zn con formación de iones Zn2+ y simultáneamente en la zona catódica (en presencia de O2) se incrementa la [HO-] aumentando el pH del medio agresivo. La movilidad de los iones Zn2+ e HO- así formados permite que ocurra la reacción secundaria: Zn2+ + 2 HO- = Zn(OH)2 (Ejercicio 1) al migrar ambos iones por la película superficial de humedad. Sin embargo, no es necesario que estén presentes dos metales distintos para que haya diferencias de potencial entre dos áreas, pues ello ocurre también en un cuerpo metálico, aparentemente homogéneo. Esas diferencias de potencial son debidas a las condiciones: a) de la superficie metálica y b) del medio agresivo con que está en contacto. Son ejemplo de lo primero inhomogeneidades de composición o diferencias de tensión mecánica o de orientación de la red cristalina respecto de la superficie aparente y, de lo segundo, diferencias de aireación (variaciones en la concentración de oxígeno disuelto en el agua). Por supuesto, la inmersión de un cuerpo metálico, aún perfectamente homogéneo, en un medio conductor iónico, sometido a una diferencia de potencial de origen externo, no propio del metal ( corrientes vagabundas) puede ocasionar su corrosión. (Ejercicio 2). Planteadas así las cosas, se comprende que es herramienta útil para la interpretación, predicción y prevención de casos de corrosión, el conocimiento de la serie de potenciales normales de reducción y el manejo de la ecuación de Nernst, ya que ésta permite calcular potenciales de electrodos que no se hallan en condiciones patrón. No hay dudas que estos conocimientos son fundamentales, pero deben ser completados con la evaluación de cada situación real. Esta última, en general, dista de ser la ideal para un cálculo y una 46 conclusión rápidos, como la que ofrecería un electrodo homogéneo de metal puro, de superficie libre de material extraño, sumergido en una solución de un sólo soluto iónico, etc., que son las condiciones en las cuales se podría aplicar directamente aquella información. Como consecuencia, en los estudios de corrosión, es de gran importancia la experimentación práctica que evolucionó desde tempranas observaciones empíricas hacia la investigación y el desarrollo que actualmente se realizan con rigor científico. La forma de corrosión más importante y estudiada es la de tipo electroquímico con "hierro", entendiéndose como tal principalmente a sus aleaciones que van desde hierro prácticamente puro hasta aceros y fundiciones. Nos referimos a continuación a la corrosión electroquímica del "hierro" en que esté, ya sea por diferencias de potencial propias o debidas a un origen externo, forma parte de una pila electroquímica. En un trozo de "hierro" la presencia de diferentes potenciales eléctricos en distintas regiones de su superficie puede deberse a alguna de las causas mencionadas anteriormente. Como se halla en contacto con un medio fluido que habitualmente consiste en una película acuosa y aire (oxígeno), el sistema total ("hierro" y medio agresivo) se comporta como un conjunto de micropilas electroquímicas localizadas en diversas regiones de la superficie metálica. En tales micropilas, las áreas de menor potencial de reducción (mayor potencial de oxidación) constituyen ánodos y son las que podrán ser corroídas con mayor facilidad; las otras áreas de mayor potencial de reducción son catódicas. En las áreas anódicas ocurren las reacciones de oxidación; en las catódicas, las de reducción; la corrosión del "hierro" puede interpretarse, pues, como un proceso redox iónico. En las áreas anódicas el hierro pierde electrones (1) y los iones hierro(II) se hidratan según(2): (1) Fe (s) = Fe2+ + 2e 2+ (2) Fe + n H2O (l) = [Fe(H2O)n]2+ (ac) Los electrones fluyen por el interior del metal hacia el área catódica y producen una reacción entre varias posibles. Cuál de ellas se ha de producir dependerá del pH de la solución y/o del grado de aereación de la superficie metálica. Así, a pH menor que 4,3 en un medio relativamente ácido y sin la presencia de oxígeno, la reacción catódica es la reducción del ion hidrógeno según: (3) 2 H+ + 2 e = H2 (g) En solución a pH mayor que 4,3 se requiere la presencia de oxígeno en las áreas catódicas, ya que el oxígeno será el que se reduzca con formación de iones hidróxido según la reacción: (4) O2 (g) + 2 H2O (l) + 4 e = 4 HOA pH menor que 4,3 y, además, en buenas condiciones de aireación ocurre: (5) 4 H+ + O2 (g) + 4 e = 2 H2O Consideremos el caso muy común de la corrosión electroquímica de "hierro" no protegido, por un medio agresivo de pH mayor que 4,3 y bien aireado. Su interpretación se realiza considerando las ecuaciones (1), (2) y (4). Los iones hierro (II) e hidróxido, generados en diferentes puntos de la superficie de contacto metalsolución acuosa, se desplazan en el medio líquido, y en las zonas en que ambas clases de iones se encuentran, forman óxido hidratado ("hidróxido"), de hierro (II): Fe2+ + 2 HO- = Fe(OH)2 (en realidad: FeO.nH2O) que se deposita en la superficie húmeda (Ejercicio 3 y 4). Así, pues, el oxígeno es indispensable para la corrosión del "hierro", salvo cuando el medio agresivo sea tan ácido que permita la formación de hidrógeno gaseoso y su desprendimiento en el cátodo (Ecuación 3). La corrosión se produce en las áreas en que el acceso de oxígeno es más limitado, ya que las más aireadas constituyen las zonas catódicas (Ecuaciones 4 ó 5). Las sustancias que, como el "hidróxido" de hierro (II), resultan de la primera de una serie de reacciones que comienzan con la combinación del catión con el anión disponible, se llaman productos inmediatos de la reacción anódica. En una oxidación ulterior, ajena al proceso de corrosión electroquímica en sí, es decir al consumo de hierro metálico, el "hidróxido" de hierro (II) se oxida a "hidróxido" de hierro (III). (Ejercicio 5). El depósito o mancha de "hidróxidos" y "carbonatos" se llama herrumbre. 47 Si el medio agresivo contiene otros aniones fuera del anión hidróxido, como por ejemplo cloruros o sulfatos (ambos se hallan en el agua de mar) se formarán preferentemente como productos inmediatos las correspondientes sales de hierro(II). Según el anión presente, los compuestos así formados serán más o menos solubles en agua, y el curso ulterior del ataque corrosivo al metal dependerá en gran parte del producto inmediato de la reacción anódica: si éste se disuelve o es insoluble. En este último caso depende de que la capa formada sea floja o porosa o bien adherente y protectora. Hablando de un modo muy general, los iones tales como el cloruro que generalmente originan productos inmediatos fácilmente solubles, tienden a penetrar en la película superficial sólida impidiendo su formación; los iones hidróxido pueden formar películas protectoras en algunos casos y los iones cromato y fosfato son aún mejores formadores de películas protectoras. Desafortunadamente, en el caso del "hierro" expuesto a humedad y oxígeno atmosférico, los "hidróxidos" así formados no dan superficies lo suficientemente protectoras como para evitar que las capas metálicas subyacentes sean corroídas sucesivamente, sino todo lo contrario. En efecto, la capa de herrumbre no logra aislar al metal de la película de humedad y, por otra parte, limita el acceso de oxígeno a la zona atacada con lo cual ésta se vuelve más anódica. En otros casos, por ejemplo con aluminio, zinc, cromo, etc., o algunas de sus aleaciones (acero "inoxidable" 74% Fe, 18% Cr, 8% Ni), la película sólida formada resulta realmente protectora. Velocidad de corrosión La velocidad de corrosión de un cuerpo metálico suele expresarse cuantitativamente de dos maneras: a) como la masa de metal corroída por unidad de tiempo de contacto con el medio corrosivo, m/t, p.ej. en g/año; b) como el espesor por unidad de tiempo, expresado como tal o como masa por unidad de superficie y unidad de tiempo: esp. , p.ej. en mm t año o bien m , p.ej. en g s.t m2.año en que: m = masa de metal corroído s = superficie expuesta t = duración de la exposición esp. = espesor promedio perdido por corrosión Conocida la reacción química que ocurre en el proceso de corrosión y la superficie expuesta, se puede estimar la intensidad de corriente con la velocidad de corrosión mediante sencillos cálculos estequiométricos (Ejercicio 6). Polarización El hecho de estar en contacto dos superficies metálicas diferentes, p. ej. zinc y cobre, o dos zonas de diferente potencial de electrodo de un mismo cuerpo metálico aparentemente homogéneo, no genera por sí mismo una corriente eléctrica. El movimiento de electrones sólo ocurre si la pila se completa poniendo el sistema metálico en contacto con un electrolito, es decir exponiéndolo a lo que ha de ser el agente de corrosión electroquímica. La diferencia de potenciales de electrodo existente antes de iniciarse el proceso de corrosión, llamados también potenciales de equilibrio o de circuito abierto, tiende rápidamente a cero a partir del momento en que la pila queda constituída. La diferencia preexistente o inicial de los potenciales de electrodo (E0C-E0A) es la que corresponde a la pila sin circulación de corriente (intensidad igual a cero) y representa el máximo valor posible de: E C - EA Una vez constituída la pila (cerrado el circuito) comienza a circular la corriente y, simultáneamente, comienzan a actuar resistencias del circuito que se oponen a tal circulación: a) la resistencia eléctrica propia del electrolito en su estado inicial (resistencia "interna" de la pila) b) la resistencia eléctrica propia del sistema metálico (resistencia "externa" de la pila) c)efectos, llamados de polarización, debidos a cambios que, como consecuencia del proceso electroquímico, se producen en las zonas cercanas a los electrodos (modificaciones en la composición del electrolito, depósitos sólidos o gaseosos, etc.) 48 Generalmente, las resistencias a) y b) son de pequeña magnitud en comparación con los efectos de polarización. Las causas de polarización son las siguientes: • Concentración iónica En los electrodos de una pila en funcionamiento pasan sustancias a iones o viceversa. A menos que la intensidad de la corriente sea prácticamente nula, ocurre un aumento local en la concentración de cationes en las cercanía del ánodo y una disminución local en la concentración de cationes en la región catódica, puesto que la difusión de iones en un medio líquido es lenta y no logra en cada momento homogeneizar la composición del electrolito cuando la intensidad de la corriente es apreciable. Esta es una contribución a la polarización: un enriquecimiento local en cationes en las inmediaciones del ánodo establece una fuerza "contraelectromotriz" interna en el electrolito con el efecto de que el potencial de reducción en el ánodo aumenta. En forma similar, el empobrecimiento local en cationes en las inmediaciones del cátodo hace que su potencial de reducción disminuya. Este fenómeno es conocido como polarización de concentración (Ejercicio 7). • Películas de superficie Cuando anteriormente se mencionó la resistencia propia del sistema metálico, se aludió al sistema con "superficie limpia", es decir libre de cualquier película de carácter no metálico que constituiría una resistencia eléctrica adicional, generalmente elevada. Tales películas superficiales pueden estar presentes desde antes del instante en que el metal y el medio se ponen en contacto, pero también pueden formarse posteriormente como productos de las reacciones de corrosión. Las sustancias que las constituyen pueden ser sólidas (por ejemplo un producto anódico insoluble, digamos un óxido) o gaseosas (por ejemplo películas o aún burbujas de hidrógeno o de oxígeno). Estas películas tienen el efecto de impedir o disminuir la difusión de iones, como también la de las sustancias sin carga que toman parte en la reacción de corrosión (por ejemplo la llegada de gas oxígeno o el desprendimiento de gas hidrógeno). En esta forma, por aumento de la resistencia del circuito, las películas de superficie reducen la intensidad de la corriente de corrosión. Las películas de superficie que más generalmente se forman son las del óxido del respectivo metal anódico. Cuando estas películas son adherentes y no porosas, las áreas anódicas correspondientes adquieren un mayor potencial de reducción, dado que el óxido es siempre "más noble" que el mismo metal. Si el electrodo se recubre completamente por una película de este tipo, la corrosión ya no puede producirse y entonces se dice que el metal está pasivado. Las diferentes causas de polarización actúan en general simultáneamente y la contribución individual de cada una de ellas no es siempre fácil de estimar. Procedimientos de protección Como se mencionó anteriormente, la capa de herrumbre que se forma habitualmente en forma espontánea en la superficie del "hierro" no protegido, expuesto al aire húmedo o agua que contenga oxígeno disuelto, no es realmente pasivante, sino floja y porosa. Para que una película tal sea realmente protectora, deberá satisfacer ciertas condiciones: • ser contínua • estar adherida firmemente al metal • ocupar sustancialmente el mismo volumen que ocupaba la porción de metal que la originó • poder restablecerse por sí misma, de manera que en caso de eventual daño la película protectora pueda reconstituirse. Estas condiciones no se cumplen por sí mismas en el caso del hierro más o menos puro o en los aceros al carbono expuestos a oxígeno y humedad y, de no emplearse algún procedimiento de protección, la corrosión avanzaría rápidamente (Ejercicio 8). Protección catódica y protección anódica a) Para el hierro enterrado en suelo húmedo, sumergido en agua, etc. se puede adoptar la denominada protección catódica en la cual toda la superficie del hierro, incluídas sus áreas anódicas se 49 transforman en catódicas. Esto se logra conectando eléctricamente al hierro a proteger a un cuerpo metálico de menor potencial de electrodo a la reducción (metal menos noble que el hierro, como ser magnesio, zinc, etc.) expuesto al mismo medio agresivo. Este cuerpo metálico es entonces un electrodo que actúa como ánodo y debe ser renovado cada vez que está por consumirse totalmente. Se lo denomina ánodo de sacrificio. Otra forma de aplicar protección catódica consiste en conectar al hierro en forma permanente al polo negativo de una fuente de corriente contínua de voltaje adecuado. Este es un recurso frecuentemente aplicado a ductos enterrados (Ejercicio 9). b) Se puede recurrir a la protección anódica: a partir de la formación de Fe2+, el metal se protegerá al generarse una película pasivante de óxido de hierro (II) u otros compuestos insolubles. Una forma de llevar a cabo esta protección anódica consiste en la formación en el mismo lugar de capas pasivantes de silicato, cromato o fosfato de hierro, lo que se logra adicionando un silicato, un fosfato o un cromato, por ejemplo cromato de sodio, al agua que circula por cañerías que, de lo contrario, se corroerían rápidamente. Existen muchos otros inhibidores de corrosión, tanto orgánicos como inorgánicos. El recurso más empleado para prevenir la corrosión es el que consiste en la aplicación de capas adherentes impermeables sobre el metal a proteger, con el objeto de aislarlo del medio ambiente. Estos recubrimientos varían desde la aplicación de una capa permanente de otro metal, tal como el zinc, hasta una película fácilmente eliminable como la de un aceite mineral (protector temporario). Ejemplos comunes de aplicación de capa son: • zinc sobre hierro (hierro galvanizado) • estaño sobre hierro (hojalata) • cromo sobre hierro (hierro cromado por deposición electrolítica) • cubiertas orgánicas ("pinturas") • cubiertas cerámicas o vítreas. Obsérvese que tanto el zinc como el cromo tienen menor potencial de reducción patrón que el hierro, pero que no sufren corrosión al aire húmedo por la formación de capas de óxidos pasivantes. Estos casos de recubrimiento con zinc, cromo o estaño son pues otros ejemplos de protección electroquímica, mientras que la aplicación de capas de pintura no es de carácter electroquímico. A menos que el pH del medio agresivo sea inferior a 4,3 , se requiere oxígeno gaseoso disuelto y humedad para corroer al hierro. Por consiguiente, también se da protección al hierro cuando: a) se reduce el contenido de oxígeno disuelto en el agua que circula en cañerías de hierro, mediante el agregado de compuestos reductores solubles, por ejemplo sulfito de sodio; b) se colocan cartuchos con agentes desecantes, por ejemplo gel de sílice en el interior de gabinetes de instrumentos, etc. valiosos. (Ejercicio 10). EJERCICIOS 1)a.- Dados los metales cobre y zinc, formando electrodos en condiciones patrón: • averiguar los correspondientes potenciales de reducción; • cuál de estos materiales se oxida más fácilmente y cuál de los respectivos iones se reduce más fácilmente; • asignar a cada uno de ello, en forma comparativa, las calificaciones de "más noble" y "menos noble". b.- Mediante un esquema representar: • el funcionamiento de una pila de zinc y cobre sumergidos en agua que contiene oxígeno disuelto; • la corrosión de una chapa de zinc en la que se ha colocado un tornillo de bronce. c.- Sabiendo que la solución de fenolftaleína (incolora en medio ácido o neutro) vira al rojo violáceo en medio básico, ¿cómo podría reconocer la reacción producida?; ¿se reconocerían así productos de la reacción anódica o de la reacción catódica? 2)Mediante un esquema mostrar la corrosión de una pieza de hierro enterrada en suelo húmedo, por el que circulan corrientes vagabundas. 3) Se observó en laboratorio el fenómeno de corrosión rápida de hierro por formación de un par hierro-cobre sumergido en agua salina que contiene oxígeno disuelto. Se empleó un alambre de hierro arrollado alrededor de una varilla de cobre. a) Escribir las ecuaciones de las reacciones anódica y catódica. 50 b) Explicar cómo pueden reconocerse los iones producidos en el ánodo y el cátodo, empleando soluciones de fenolftaleína y de hexacianoferrato (III) de potasio. c) Escribir la ecuación iónica de la reacción producida con el último reactivo mencionado en b). 4)a.- Mediante un esquema mostrar la corrosión de un objeto de hierro en un medio agresivo de pH mayor que 4,3 y en el cual se presentan diferencias de aireación. b.-Indicar la circulación de electrones y de iones y escribir las ecuaciones de las reacciones anódica y catódica. c.- Explicar cómo se podrían reconocer los iones formados en el ánodo y cátodo. 5) Escribir las ecuaciones con que se representa la formación de herrumbre. 6) Una chapa de hierro de 1 m2 (suma de la superficie de ambas caras) sumergida en agua de mar ha sufrido una pérdida promedio de su espesor de 1 mm por cara al cabo de dos año de exposición. Calcular la masa de hierro perdida por corrosión y la intensidad media de la corriente de corrosión. La densidad del hierro es 8 g/cm3. Se supone que no ocurre otra reacción de corrosión que la oxidación de hierro metálico a hierro (II). 7) Mediante un esquema mostrar el efecto de polarización por concentración iónica. 8)Enumerar las condiciones que debe reunir la película de óxido de un metal para que resulte protectora. 9) Mediante esquemas ilustrar instalaciones de protección catódica: a) por conexión con ánodo de sacrificio b) por aplicación de una fuente de corriente. 10)Mediante un cuadro sinóptico presentar esquemáticamente los diferentes métodos de protección contra la corrosión del "hierro". NOTA: Son datos las masas atómicas relativas necesarias y F=96500 C.mol-1 VIII - POLIMEROS: PLASTICOS Y ELASTOMEROS POLIMEROS Son macromoléculas formadas, en el caso más sencillo, por la repetición de una unidad estructural llamada ségmero. El proceso de formación del polímero, polimerización, se efectúa a partir de moléculas llamadas monómeros, de las cuales deriva el ségmero. POLIMEROS DE ADICION 1,2 Una reacción característica de los alquenos es la adición. Sus dobles enlaces tanto permiten la adición de moléculas sencillas (H2 , Cl2, HBr, etc.) como también la unión entre sucesivas moléculas de alquenos. Así, a temperaturas y presiones bien controladas, mayores que las ambientales, el eteno o etileno experimenta una polimerización de adición 1, 2 . En esta reacción las moléculas de etileno se unen entre sí y producen alcanos de cadena larga. Estas macromoléculas constituyen el polietileno(Ejercicio 1) Lo que hace la industria plástica en este caso es elaborar objetos de la forma definitiva deseada, por ej. tubos flexibles, a partir de pequeños trozos de material sin ya modificar químicamente el polímero en forma sustancial. Debido a que el polietileno es mecánicamente resistente, insoluble en muchos líquidos comunes y no es alterado por muchos agentes químicos, reemplaza con frecuencia a materiales inorgánicos como el vidrio y el aluminio. Es común su uso como material para envases y empaque. Las propiedades físicas del polietileno y de los otros polímeros varían con la longitud de la cadena de átomos de carbono y, por consiguiente, con su «peso molecular» o masa molecular relativa. Este se puede regular bien en el proceso de fabricación, de modo que, si bien no todas las moléculas de un mismo lote de fabricación pueden tener exactamente el mismo número de átomos de carbono, por ejemplo 5.000, su masa molecular individual no diferirá en mucho de un valor promedio prefijado, digamos 70.000. Las propiedades físicas dependen, además, de la disposición en el espacio de las moléculas de polímero. 51 En la siguiente tabla se enumeran diferentes polímeros de adición 1, 2 que se pueden considerar emparentados con el polietileno, ya que sus monómeros son derivados del etileno, por sustitución parcial o total de los átomos de hidrógeno de éste por otros átomos o grupos. EJEMPLOS DE POLIMEROS DE ADICION 1-2 ( *marcas comerciales) Polímero Monómero Propiedades Ejemplos de aplicación Polietileno (PE) Etileno (eteno) resistente, flexible, poco denso, termoplástico Recipientes, tubos flexibles, sogas, películas Polipropileno (PP) Propileno (propeno) Policloruro de vinilo* (PVC) Cloruro de vinilo (cloroeteno) Más resistente al calor que el polietileno Resistente, algo elástico, poco desgastable Recipientes, tubos flexibles, sogas, rafias para bolsas tejidas, zunchos Revestimiento de suelos, paredes y tanques. Caños. Juntas Poliestireno (PS) Estireno (fenileteno) Transparente, rígido Acrilonitrilo (cianoeteno) Fuerte, fácil de teñir, puede hilarse Fibras textiles Tetrafluoroeteno Muy inerte, no adhesivo, autolubricante Juntas, bujes, revestimiento de utensilios de cocina Poliacrilonitrilo (PAN) (Orlon, Cashmilon, Dralon, Courtelle)(*) Politetrafluoroeteno (PTFE) (Teflón, Fluon) (*) Polimetilacrilato de metilo (PMAM) Metilacrilato de metilo Rígido, transparente Piezas termoformadas (envases desechables, interiores de heladeras), aislaciones (expandido) Planchas (tabiques divisorios, etc.) Objetos decorativos no planos (muebles) POLIMEROS DE CONDENSACION Como se mencionó anteriormente, en las reacciones de adición en que se producen los polímeros de los alquenos, el único producto de la reacción es el polímero. También se dijo que existen otros y muy importantes materiales sintéticos a los que se les da también el nombre de polímeros. Se trata de los polímeros llamados de condensación. Estos se caracterizan porque la reacción química que forma el polímero produce a la vez una molécula sencilla como la del agua, el cloruro de hidrógeno, etc. Esta clase de polímeros puede formarse: a) Con una sola sustancia que posea dos grupos funcionales en la misma molécula: H2N-(CH2)5-CO.OH + H2N-(CH2)5-CO.OH + H2N-(CH2)5-CO.OH + etc → ácido 6-aminohexanoico ségmero ségmero ségmero → --- HN-(CH2)5-CO-HN-(CH2)5-CO-HN-(CH2)5-CO-.... + (n-1) H2O Nylon 6 n= cantidad de ségmeros por macromolécula b) Con una sóla sustancia que posea dos veces el mismo grupo funcional en su molécula: Por ejemplo, por polimerización del dimetilsilanodiol se obtiene un polímero que pertenece al grupo de las siliconas (ver Siliconas). Estas se diferencian de los otros polímeros del cuadro en que su «columna 52 vertebral» en lugar de ser una cadena de átomos de carbono es una secuencia de átomos de silicio y oxígeno, tal como ocurre en los silicatos inorgánicos. De esto resulta su propiedad de ser poco combustibles. c) Con dos sustancias, cada una de las cuales tiene dos veces el mismo grupo funcional en su molécula: H2N-(CH2)6-NH2 + HO.OC-(CH2)4-CO.OH + H2N-(CH2)6-NH2 + etc. → "hexametilendamina" ácido adípico "hexametilendiamina" (1,6-diaminohexano) (1,6-hexanodicarboxílico) ségmero ségmero →...-HN-(CH2)6-NH-OC-(CH2)4-CO-HN-(CH2)6-NH-OC-(CH2)4-CO-... +(2n-1) H2O Nylon 66 n= cantidad de ségmeros por macromolécula Las materias primas son, por ejemplo: -alcoholes, fenoles o silanoles con su grupo funcional -OH, hidroxilo -aminas, con su grupo funcional -NH2, amino -ácidos carboxílicos, con su grupo funcional -CO.OH, carboxilo -cloruros de ácidos carboxílicos, con su grupo funcional -COCl, clorocarboxilo. El Ejercicio 3 consiste en deducir las estructuras de los fragmentos o segmentos característicos («ségmeros») de las cadenas de algunos de los polímeros de condensación lineal del cuadro siguiente, en base al conocimiento de las fórmulas de sus materias primas: EJEMPLOS DE POLÍMEROS DE CONDENSACIÓN LINEAL Ejemplo Tipo “Nylon 66” Poliamida “Nylon 6” Polietilentereftalato (PET) “Dacron” “Terylene” “Trevira” Polidimetilsiloxano (PDMS) Materias Primas Propiedades 1,6-hexanodiamina Tenaz, de baja y cloruro de absorción de agua, adipilo hilable, autolubricante Ejemplos de aplicación Fibras textiles, sogas, bujes, cojinetes, engranajes. ácido 6-aminohexanoico Poliéster 1,2-etanodiol (“etilenglicol”) y ácido tereftálico Silicona Dimetilxilanodiol Resistente al calor. Fibras y películas fuertes, repelente del agua, poco permeable a los gases Botellas para bebida. Fibras textiles. Sogas. Resistente al calor, repelente del agua, no adherente. Aceites lubricantes resistentes al calor,componentes de productos repelentes del agua, desmoldantes. Los polímeros de condensación mostrados hasta ahora son todos lineales, es decir que su macromolécula se extiende a lo largo de una gran cadena de átomos de C, Si, O, N con sólo átomos o grupos pequeños de átomos insertados en dicha cadena. Existen también polímeros de condensación con uniones cruzadas, es decir con cadenas de átomos como las anteriores pero vinculados entre ellas mediante «puentes» formados por grupos de átomos. Daremos sólo un ejemplo con cierto detalle: el de las resinas moldeables de fenol-formaldehído («bakelitas»). Existe un gran número de resinas fenol-formaldehído que encuentran una variedad de 53 usos como adhesivos dispersables («solubles») en agua, adhesivos para laminados, resinas para barnices y lacas y, como se mencionó, polvos de moldeo para la elaboración de plásticos termoestables. Estos polvos de moldeo contienen, además de carga (por ej. aserrín), colorantes y lubricantes, una resina de fenol-formaldehído. La naturaleza de una resina de fenol-formaldehído depende de varios factores y principalmente de la proporción entre fenol y formaldehído. Si hay fenol en exceso se forma preferentemente un polímero lineal. OH OH CH OH 2 + H C=O 2 OH OH OH CH OH CH OH CH OH 2 2 OH OH CH 2 OH CH 2 2 Este polímero lineal es de bajo punto de fusión, soluble en solventes orgánicos. Si hay exceso de formaldehído, por el mismo mecanismo se producen reacciones cruzadas, con liberación de agua, que dan lugar a puentes -CH2-, en todas direcciones, entre las anteriores estructuras lineales. Un fragmento, en realidad no plano sino tridimensional, podría ser el siguiente: CH CH 2 2 OH CH CH 2 CH 2 OH CH 2 OH CH 2 2 OH CH CH 2 CH 2 OH CH 2 CH 2 2 Se forma así una resina infusible e insoluble. No se la puede ablandar más por el calor, es termorrígida (Ejercicio 4). Son otros productos de condensación con uniones cruzadas los siguientes tipos de resinas termorrígidas: - resinas de urea-formaldehído - resinas de melamina-formaldehído - resinas de poliéster (gliptales) - resinas fenólicas, carboxílicas, etc. de intercambio iónico (mencionadas en el capítulo dedicado a tratamiento de aguas) - siliconas termorrígidas. Ejercicio 5. ELASTÓMEROS Los elastómeros artificiales son polímeros lineales que tienen elasticidad y otras propiedades similares a las del caucho (elastómero natural). 54 Sus monómeros son moléculas orgánicas con dos enlaces dobles que se encuentran separados por un enlace C-C simple. Se dice que los dos enlaces dobles están «conjugados». Las reacciones de adición de las moléculas de doble enlaces conjugados son muy particulares, ya que dicha adición es predominantemente 1-4. Los polímeros así resultantes tendrán la mitad del total de dobles enlaces que contenían los monómeros que los formaron. El Ejercicio 6 consiste en deducir las estructuras de los fragmentos característicos («ségmeros») de algunos de los elastómeros del cuadro siguiente, sobre la base del conocimiento de las fórmulas de sus monómeros. EJEMPLOS DE ELASTÓMEROS DE ADICIÓN 1-4 Polímero Materias Primas Propiedades (*) Aplicaciones Caucho natural (poliisopreno) Isopreno Muy elástico, flexible, resistente a la tracción, aislante eléctrico, permeable a los gases, atacable por aceites. Neumáticos Policloropreno (Neopreno) Cloropreno Como caucho natural, pero además resistente a hidrocarburos y a la luz solar. Mangueras. Vainas para cable. Neumáticos Butadieno-estireno (caucho BS o SBR) Butadieno y estireno Resistente a la abrasión, a la luz solar y al ozono. Butadieno-acrilonitrilo (caucho BA o ABR) butadieno y acrilonitrilo Similar al SBR, pero más resistente a los aceites. Juntas. Mangueras p/combustible. (*) Como productos terminados, después de su vulcanización. El proceso que lleva al caucho natural hasta un producto terminado por ej. un neumático de automóvil se compone de varias etapas: a) La principal fuente de caucho natural es un árbol llamado Hevea brasiliensis (parecido al gomero que se usa en nuestra zona con fines decorativos). La Hevea se cultiva en plantaciones en Brasil, en la península Malaya, etc. Se practican incisiones en el tronco y las ramas y se recoge una secreción de aspecto lechoso llamada látex. Esta es una emulsión que contiene aproximadamente 35% de caucho en forma de pequeñas gotas de 0,5 a 3 micrones de diámetro, que no se unen con otras debido a la presencia de proteínas estabilizantes de la emulsión. b) La emulsión se rompe por la acción de enzimas sobre el coloide protector o por la adición de sustancias coagulantes. c) El coágulo así obtenido se separa del agua y se pasa por rodillos para exprimirle más agua y se convierte en goma «crepe». Este caucho crudo está compuesto por polímeros lineales que contienen 3000 moléculas de monómero cada una. Como tal, es blando y pegajoso a la temperatura de verano y muy duro a bajas temperaturas, no tiene mayor resistencia y pierde rápidamente su elasticidad. d) En 1839 se corrigieron por primera vez esos defectos, pues en ese año Charles Goodyear descubrió que si calienta el caucho crudo en presencia de azufre, se vuelve más duro y resistente y soporta mejor el calor. Este proceso, en el que los átomos de azufre constituyen puentes de entrecruzamiento entre polímeros lineales paralelos vecinos, se llama vulcanización. Se emplea tanto con el caucho natural como con los cauchos artificiales. (Ejercicio 7). e) Cuando se fabrican artículos de caucho, a la goma crepe se le da primeramente un tratamiento de amasado en el cual el caucho se estira y se «mastica»; los polímeros lineales se orientan (se mejora el paralelismo entre ellos) y se los acorta. 55 f) El material se vuelve más plástico. Se agregan plastificantes (lubricantes internos), junto con resinas y materiales de relleno o «carga», tales como negro de humo y arcilla, antioxidantes, azufre y aceleradores de vulcanización. Todos ellos se incorporan cuidadosamente a la masa de caucho en un mezclador. Las propiedades destacables del caucho natural son su elasticidad, su resistencia a la tracción y su capacidad de resistir repetidas flexiones sin calentarse excesivamente. Esta última propiedad es muy importante ya que las paredes laterales de un neumático se flexionan en cada vuelta de rueda. SILICONAS El silicio es el segundo elemento del grupo 14 de la Tabla Periódica y tiene algunas propiedades semejantes al elemento carbono. Puede formar cadenas consigo mismo, aunque estas son relativamente cortas (máximo Si4 en compuestos estables): SiH4 silano, Si2 H6 disilano, etc. La sustitución de los átomos de hidrógeno de los silanos por grupos alquilo origina los alquilsilanos. Por ejemplo: CH3 CH3 | | H- Si-H H-Si-H H CH3 monometilsilano dimetilsilano La sustitución de los átomos unidos al átomo de silicio por grupos hidroxilo permite pasar de silanos, ya sean ellos dihidroxidialquilsilanos o trihidroxialquilsilanos a «siloxanos»: R R | | HO-Si-OH HO-Si-OH | | R OH Por reacciones de condensación con pérdida de agua, los siloxanos forman los polixilosanos o «siliconas». Así por ej.: R R R R R | | | | | (2n-1)H2O ... + HO-Si-OH + HO-Si-OH + HO-Si-OH → H -O-Si-O-Si - O-H | | | | | R R R R R n 2n moléculas de siloxano Silicona 2n moléculas de dihidroxidialquilsilano Variando los monómeros y la longitud de la cadena ... -O-Si-O-Si-.. se logran siliconas de propiedades muy diversas. Las siliconas líquidas son poco combustibles, resistentes al calor, repelen el agua, son buenos aisladores eléctricos y permanecen fluidas a bajas temperaturas. Las siliconas sólidas, por ejemplo los cauchos de silicona, son resistentes al ozono. Todas estas propiedades explican sus muy variadas aplicaciones (en impermeabilizantes, aislantes, lubricantes, fluidos hidráulicos, sustitutos del caucho, etc.) (Ejercicio 8). EJERCICIOS 1) Escribir las ecuaciones químicas correspondientes a las reacciones: b) de polimerización de adición 1, 2 del etileno a) de etileno con Cl2 2) Escribir las fórmulas químicas correspondientes a los monómeros y polímeros del cuadro «Ejemplos de polímeros de adición 1, 2». 3) Deducir la estructura del fragmento o segmento característico («ségmero») del poliéster formado entre «glicol» (1,2-etanodiol) y ácido tereftálico. 56 4) Mediante las fórmulas de fragmentos característicos de su estructuta, mostrar la constitución de: a) una resina de fenol-formaldehído lineal; b) una bakelita, con uniones cruzadas. 5) Una vez leído en su totalidad el tema Polímeros, construir un cuadro sinóptico clasificando los diferentes ejemplos de polímeros vistos en el Curso, teniendo en cuenta sus propiedades, según el tipo de material. 6) Deducir la estructura de los fragmentos o segmentos característicos («ségmeros») de las cadenas de caucho natural, Neopreno, Buna S y Buna N. 7) Mediante la fórmula de un fragmento característico de su estructura, mostrar la constitución de un caucho vulcanizado. 8) En el listado de productos de condensación con uniones cruzadas se mencionan: a) poliéster ; b)siliconas; que ya habían aparecido en el cuadro «Ejemplos de polímeros de condensación lineal». Mostrar que esto no es una contradicción, para lo cual se sugiere pensar como monómeros en: a) un triol (el más sencillo de ellos) y un ácido dibásico como el ftálico; b) un siloxano adecuado. Responder mediante la escritura de las correspondientes estructuras. IX – AGUAS CONCEPTOS A DESARROLLAR Aguas naturales. Impurezas que contienen, origen de algunas de ellas. Agua para uso doméstico. Propiedades requeridas. Obtención (Potabilización). Agua para uso industrial. Propiedades requeridas. Dureza: iones que la producen, fenómenos que origina. Tipos de dureza (temporaria y permanente). Formas de expresarla y de valorarla. Ablandamiento por intercambio iónico y por el empleo de agentes complejantes. Desionización o desmineralización del agua. CONCEPTOS GENERALES Su alto contenido en células animales y vegetales, hace que el agua sea un constituyente vital de todos los seres. También es un material de primera importancia en Ingeniería pues sirve como solvente, medio de suspensión y transporte, agente de transmisión del calor, agente de extinción de incendios, fuente de energía en los estados líquido y de vapor y como reactivo químico. Aguas naturales. Impurezas El agua nunca es pura por naturaleza. El agua recogida al final de una lluvia abundante en una zona rural es la forma más pura del agua natural. Pero lluvia, rocío y nieve - las «aguas destiladas de la Naturaleza» - contienen impurezas tales como gases disueltos, sales y suspensiones de polvo, polen y esporas de la atmósfera. Las aguas de ríos y lagos contienen cantidades mayores de sustancias extrañas que el agua de lluvia. Si el suelo de una región contiene yeso (CaSO4 . 2H2O), su agua natural contendrá una concentración de iones Ca2+ mucho mayor que un agua de zona donde las rocas subyacentes son ígneas ( por ej. feldespato). Las aguas de regiones pantanosas o de suelos donde se está descomponiendo materia orgánica contendrán una cantidad de ácidos orgánicos y dióxido de carbono y tendrán así pH bajo. Las aguas que contienen dióxido de carbono, ya sea de origen atmosférico o disuelto, durante su pasaje por el suelo atacan a los carbonatos, tales como las calizas, la dolomita o el carbonato de hierro (II) formando hidrógenocarbonatos («bicarbonatos») solubles. También actúan sobre el feldespato de modo de formar una solución de carbonato de potasio, un sólido soluble: «sílice» (SiO2) y, además, arcilla, que a menudo queda en suspensión causando turbidez (Ejercicios 1, 2 y 3). El agua de pozos -generalmente los más profundos- puede contener altas concentraciones de sales, principalmente cloruro de sodio. El agua de mar contiene aproximadamente 30 g de sales por litro, de las cuales el 80% es cloruro de sodio. La utilidad de un agua natural depende de la naturaleza y concentración de las sustancias disueltas y en suspensión y el uso al cual se las quiere destinar. 57 En algunos casos, el agua natural puede ser utilizada con fines domésticos o industriales sin ningún tratamiento. En otros casos, si el agua se ha de emplear para generar vapor de alta presión o para la fabricación de tubos de televisión, se requiere la eliminación completa de las sustancias disueltas y suspendidas. Los requisitos, y por consiguiente, el tratamiento del agua para uso alimenticio difieren marcadamente de la calidad y del acondicionamiento necesario para aguas de diferentes usos industriales. Aguas para uso doméstico y su obtención (potabilización): El agua «potable» debe ser: a) libre de material en suspensión b) incolora c) inodora d) libre de microorganismos patógenos e) de sabor aceptable: esto incluye el ser «dulce», término que se usa para indicar ausencia de sabor salado (cloruro de sodio) o amargo (sulfatos). f) «blanda» esto significa no «cortar» el jabón ni producir incrustaciones en diversos utensilios o equipos calefactores de agua, más allá de límites tolerables. La potabilización requiere un «diseño» que debe tener en cuenta las condiciones en que se halla el agua disponible. En el Gran Buenos Aires se dispone del agua del Río de la Plata y de aguas de napas subterráneas. En el caso de aguas como las del Río de la Plata: 1) se capta el agua por bombeo de tomas con rejas que impiden la entrada de cuerpos extraños grandes, por ej. : ramas 2) se desarena, eliminando partículas como granos de arena y semejantes por sedimentacióndecantación. 3) las partículas más pequeñas, principalmente arcilla con algún contenido en hierro (III), dispersas coloidalmente y cargadas negativamente, se eliminan por coagulación; esta consiste en producir una suspensión de partículas coloidales de «hidróxido» de aluminio (en realidad, óxido de aluminio hidratado) que cumplen dos funciones: neutralizan eléctricamente las partículas suspendidas y precipitan juntamente con éstas; (Ejercicios 4 y 5). 4) Los «barros» así producidos se separan, ya sea por sedimentación, decantación o por filtración o por ambas operaciones 5) eliminados los «barros», se produce una cloración, que tiene por finalidad la de dejar el agua prácticamente libre de microorganismos banales, y, en forma absoluta, libre de microorganismos patógenos. Se pretende que el agua salga de la planta potabilizadora con una concentración de cloro residual (Cl2) como para que pueda actuar sobre microorganismos contaminantes que encuentre en su recorrido hasta el punto de consumo. Una concentración efectiva de cloro para ello es de, digamos, 0,5 a 1 ppm ( 1 parte por millón = 1 mg por litro), pero en estas condiciones se obtendría un sabor muy desagradable. Este último se evita convirtiendo el cloro en compuestos igualmente oxidantes, llamados cloraminas, que no imparten sabor al agua. Para ello se adiciona no sólo cloro, sino también amoníaco al agua.(Ejerc. 6). En el caso en que el agua se capte de pozos, de segunda napa o más profundos, no es necesario coagular ni filtrarla, pero se suele efectuar una cloración preventiva.Estas aguas normalmente no se encuentran contaminadas por microorganismos, pero suelen tener un contenido salino alto, que puede limitar su utilización. Ver gráfico al final de este capítulo. Agua para uso industrial y su obtención (tratamiento o acondicionamiento) Para algunas finalidades industriales o ingenieriles, las aguas naturales, aún el agua de mar, se usan sin tratamiento alguno. En otros casos, el agua debe cumplir especificaciones aún mucho más estrictas que las que corresponden al agua para uso alimenticio. Por ejemplo, en la fabricación de tubos de televisión y de transistores, se requiere agua de extrema pureza lo mismo ocurre con el agua empleada como refrigerante en reactores nucleares o en calderas y turbinas que operan a muy altas temperaturas y presiones. Desde hace mucho tiempo, el agua empleada en intercambiadores de calor y en calderas se trata o «acondiciona» para prevenir la formación de depósitos o incrustaciones («sarro»). Tanto la formación de éstos depósitos como también el «cortado» del jabón se deben a la «dureza» del agua. Un agua es «dura» cuando su contenido en iones disueltos Ca2+ y Mg2+ no es tolerable para todos los diferentes usos a que se destina el agua. Se comprende, pues, que no hay un único valor del máximo contenido de Ca2+ + Mg2+ tolerable para todos los diferentes usos a que se destina el agua. 58 Límites aceptables de dureza: AGUAS blandas medias duras muy duras DUREZA TOTAL (contenido en mg/l) menos de 50 entre 50 y 150 entre 150 y 200 --------------- límite de potabilidad más de 200 a) Cómo se manifiesta la dureza 1) «Cortando el jabón» El jabón común es una sal de sodio de un ácido graso superior (generalmente de 16 a 18 átomos de carbono por molécula).Estos jabones son dispersables coloidalmente, en agua y se caracterizan por la formación de espuma. En cambio, las sales («jabones») de los cationes Ca2+, Mg2+ y otros son insolubles en agua. Se dice que el agua dura corta el jabón, ya que sólo mediante un gran agregado de éste (superando la cantidad estequiométricamente necesaria para precipitar todo el Ca2+ y Mg2+), se logra una espuma permanente. (Ejercicio 7). 2) Formando depósitos Los hidrógenocarbonatos («bicarbonatos») de calcio y de magnesio, solubles en agua, se descomponen por calentamiento: se elimina el dióxido de carbono y precipitan los correspondientes carbonatos, que son insolubles y se incrustan en las superficies calefactoras. Esta dureza de «bicarbonatos» desaparece así del agua y por ello se llama temporaria. Por el contrario no es eliminable por calentamiento y por lo tanto se llama permanente a la dureza debida a otras sales de calcio y magnesio (cloruros, sulfatos, etc.) Las incrustaciones debidas a la dureza permanente son originadas principalmente por el sulfato de calcio, ya que otras sales como: CaCl2, Ca(NO3)2, MgCl2, y MgSO4 son muy solubles en agua. El sulfato de calcio es medianamente soluble, 2,0 g por litro a 20ºC, pero sólo 1,6 g por litro a 100ºC. Por eso, cuando el agua de una caldera se calienta, y, además se convierte en gran parte en vapor, se deposita sulfato de calcio en forma compacta, de modo que su redisolución con agua es prácticamente imposible (Ejercicios 8 al 12). b) Como se expresa la dureza Como sales, un mol de cualquiera de las siguientes sustancias: CaSO4, CaCl2, Ca(HCO3)2, MgSO4, MgCl2, Mg(HCO3)2 contiene 2 equivalentes-gramo, como también ocurre con el mol de CaCO3. Las primeras seis sales nombradas, son lo suficientemente solubles como para ser causantes de dureza, el carbonato de calcio no lo es. No obstante, se suele expresar la dureza de un agua en términos de concentración de carbonato de calcio, por ej.: un mol de MgSO4, cuya masa es de 120 g, es equivalente a un mol de CaCO3 de masa igual a 100 g, pues, de ser soluble el carbonato de calcio, 100 g del mismo cortarían la misma cantidad de jabón de sodio o de potasio (2 moles) que 120 g de MgSO4. La razón de la elección del carbonato de calcio como sustancia de referencia es que su masa molar es exactamente 100 g, lo que facilita los cálculos. Expresión de la dureza D = una unidad de dureza = 1 mg de CaCO3 = 1 p. p.m. de CaCO3 litro de agua (Ejercicio l3) c) Como se mide la dureza Un método clásico, no muy preciso, consiste en titular el agua con una solución de jabón de concentración conocida. Se trata de una reacción de doble descomposición: eq-g a eq-g (Ejercicio 7). El indicador es la propia espuma del jabón, que sólo se forma cuando toda la dureza se ha consumido con un volumen de solución de jabón que se lee en la bureta. El método más empleado actualmente es una titulación con un reactivo orgánico que se denomina EDTA, o similares, los cuales proporcionan resultados más precisos que el anterior. d) Como se elimina la dureza Puesto que la dureza es debida a iones Ca2+ y Mg2+ en solución acuosa, los métodos de eliminación (ablandamiento) se basan en lograr uno u otro de los siguientes objetivos: 59 1) Producir, de los iones mencionados, compuestos escasamente solubles, o sea prácticamente insolubles. 2) Mantener en solución a los iones de Ca y Mg , con pérdida de su carácter iónico por formación de un ion complejo, como en el caso del EDTA. 1) Intercambio iónico Existen varios sílico-aluminatos naturales y artificiales cuyas fórmulas de óxido son, aproximadamente: nSiO2. Al2O3. Na2O (abreviadamente Na2Z) nSiO2. Al2O3. CaO (abreviadamente CaZ) nSiO2. Al2O3. MgO (abreviadamente MgZ) en que n = 5 a 13. Son materiales de tipo pétreo aunque porosos, e insolubles en agua y se los emplea en trozos de unos pocos milímetros de diámetro. Con ellos se forman lechos, en el interior de tanques cilíndricos («columnas»), soportados sobre capas de grava o arena y el líquido a tratar, en nuestro caso, agua dura, pasa a través de ellos. Químicamente, constituyen macro-aniones fijos que forman el esqueleto o matriz del material, neutralizados eléctricamente con cationes como Na+, Ca2+, Mg2+, etc. que se sustituyen entre sí con relativa facilidad. Dicho de modo algo diferente, se puede imaginar cada fragmento de estos materiales como una red espacial formada por un número x grande de unidades elementales. [(nSiO2. Al2O3. 0)2-]x o en forma abreviada [Z2-]x es decir un macroanión con muchísimos lugares en que se puede unir de forma electrovalente cationes iguales o diferentes entre sí, pero sumando un total de 2x cargas positivas. Al pasar un agua dura (solución acuosa que contiene iones Ca2+, Mg2+) por un lecho de estos intercambios iónicos al estado sódico, ocurre la reacción de doble descomposición: + Ca2+(ac) CaZ (s) + 2Na+(ac) Na2Z (s) intercambiador agua intercambiador agua sódico dura agotado blanda La reacción puede hacerse total gracias a que el agua atraviesa un lecho de cierto espesor, encontrándose paso a paso con sílico-aluminato cada vez más sódico y, al final de su recorrido, puramente sódico. Naturalmente, una vez convertida la mayor parte del sílico-aluminato en cálcico o magnésico ya deja de ser efectivo y comienza a aparecer dureza en el agua tratada. Se dice entonces que el lecho intercambiador está agotado y hay que proceder a regenerarlo. Para ello, se hace pasar a continuación a través del lecho, sin sacar la resina de la columna, una solución concentrada de una sal de sodio. El cloruro de sodio es, habitualmente, la sal elegida, pues es la sal de sodio más barata por equivalentegramo. Ocurrirá entonces: Na2Z(s) + Ca2+(ac) CaZ(s) + 2Na+ (ac) intercambiador salmuera intercambiador efluente agotado regenerado que se desecha o sea la reacción inversa a la de ablandamiento (Ejercicio 14). Los sílico-aluminatos naturales, intercambiadores de iones, se llaman zeolitas. Los artificiales reciben nombres comerciales, como por ejemplo el muy significativo «permutitas». Un tratamiento de carbón con ácido sulfúrico crea productos sulfonados, insolubles, intercambiadores de cationes, cuyo macroanión es un trozo pequeño de carbón muñido de una cantidad enorme de grupos sulfónicos: OOO| | | O← S → O O←S → O O←S → O | | | --C -------------- C----------------Ccapaces de formar compuestos iónicos insolubles con Na+, Ca2+, Mg2+, etc. Actúan y pueden ser regenerados del mismo modo que las zeolitas. La tecnología química ha logrado producir intercambiadores de iones totalmente artificiales («sintéticos») de macroiones orgánicos. Se trata de resinas con, por ejemplo, un macroión muñido de grupos reactivos: 60 sulfónicos O| O←S → O | R O| O←S → O | O- como en los sulfatos OO| | o carboxílicos C =O como en los acetatos C =O | | CH3 R1 que sirve para el intercambio de cationes, por ej. el ablandamiento de agua, R y R'son restos orgánicos ( el resto de la macromolécula de resina). También se han fabricado resinas intercambiadoras de aniones. En éste caso el macroión es un catión y los grupos reactivos son por ej.: H + H + | | R-N-H como en el amonio H-N-H | | H H (Ejercicio 15) 2) Con complejantes Algunas sustancias tienen la propiedad de reducir las concentraciones de iones positivos policargados, por ejemplo Ca2+, Mg2+, Fe3+, etc. a valores muy bajos, lo que equivale a un ablandamiento sin convertirlos para ello en productos insolubles. Un complejante de tipo orgánico es la sal sódica del EDTA («versene», «sequestrene», etc.) ya mencionada anteriormente. El EDTA y sus sales son sustancias muy caras, de modo que se aplican sólo en casos muy justificados, por ejemplo shampoo y otros productos cosméticos y, por supuesto, para realizar valoraciones de dureza. Desionización o desmineralización del agua Gracias a la existencia de resinas intercambiadores catiónicas y aniónicas también se pueden eliminar completamente los solutos iónicos de un agua, es decir los cationes y los aniones respectivos. Una forma de efectuar esta operación consiste en : a) Pasar primeramente el agua por un lecho de resina catiónica sulfónica al estado de ácido: Na+ (ac) cationes del agua, por ej. Na+ del NaCl H+ (ac) acidez del agua efluente sin otros cationes , por ej. H+ del HCl b) Pasar a continuación el agua «descationizada» por un segundo lecho de resina aniónica al estado de hidróxilo (resina neutralizadora). + R-SO3H(s) resina catiónica ácida R'-NH3.OH(s) resina aniónica como hidróxido + R-SO3Na(s) + resina catiónica agotada H+ (ac) + Cl- (ac) agua con acidez R'-NH3Cl(s) + resina aniónica agotada H.OH con lo que el agua queda desionizada o desmineralizada.Esta agua desionizada sustituye al agua destilada en muchas de sus aplicaciones. La regeneración de las resinas agotadas se efectúa con soluciones acuosas de ácidos e hidróxidos, según la columna, percoladas a través de lechos sin sacar la resina de las respectivas columnas (Ejercicio 16). 61 EJERCICIOS 1)La ecuación que representa la acción del agua que contiene CO2 disuelto sobre feldespato es: 2 KAlSi3O8 + CO2 + 2 H2O = Al2Si2O7. 2 H2O + 4 SiO2 + K2CO3 feldespato caolinita(arcilla) sílice Completar la ecuación indicando el estado de agregación para cada caso y describir las fases de éste sistema, teniendo en cuenta el estado en que se encuentran sus componentes . 2)Eliminación de arcilla suspendida coloidalmente en el agua. a)Escribir la ecuación iónica en que se muestra la formación de "hidróxido" de aluminio (Al2O3. xH2O) a partir de sulfato de aluminio. b)Representar las miscelas de arcilla y de "hidróxido" de aluminio. c)Explicar el fenómeno de coagulación. 3)Escribir las ecuaciones que representan la acción del agua que contiene CO2 disuelto sobre: a)caliza (carbonato de calcio) b)dolomita (carbonato de calcio y magnesio). 4)Dada la siguiente expresión: "En medio ácido el carbonato de calcio se solubiliza por formación de ........", escribir las ecuaciones, iónica y molecular, que la ilustran. 5)Nombrar las etapas que corresponden a la potabilización del agua del Río de La Plata, indicar su finalidad y describir brevemente cada una de ellas. 6)Escribir las ecuaciones correspondientes a las reacciones de cloro con amoníaco formando monocloramina y dicloramina. Indicar que son reacciones reversibles. 7)a) Escribir la ecuación que representa el "cortado" del jabón. b) ¿Qué aspecto tiene el jabón cortado? 8)Dadas las muestras de agua que contienen los siguientes iones: 1)K+, Ca2+, SO42-, NO22)Cl-, HCO3-, Na+, K+ 3)Mg2+, K+, HCO3-. Indicar: a)Si podría tratarse de un agua dura o no. b)En caso de ser agua dura, qué tipo o tipos de dureza contiene. 9)Fundamentando en cada caso, nombrar sales que disueltas en agua: a)originen dureza permanente b)no otorguen dureza c)produzcan dureza temporaria d)indicar los iones que se hallarían presentes en cada caso. Fundamentar cada respuesta. 10)Escribir las ecuaciones "moleculares" y iónicas correspondientes a la descomposición de los hidrógenocarbonatos de calcio y de magnesio por el calor. Relacionar estas ecuaciones con las del Ej. 3. 11)¿Cuáles son los inconvenientes que causan las incrustaciones en los tubos de calderas? 12)¿Puede considerarse método industrial de eliminación de dureza temporaria al calentamiento de un agua que la contiene? 13)Un agua contiene 4 mg de Ca2+ y 1,2 mg de Mg2+ en 100 cm3. Expresar su dureza en las siguientes formas: b)dureza en mg de CaCO3 por litro de agua. a)milimoles de iones Ca2+ y Mg2+ por litro de agua Respuesta a) 1,5 mmol (Ca2+ + Mg2+)/l agua b) 150 p.p.m. CaCO3 14)Representar esquemáticamente el funcionamiento (servicio y regeneración) de una columna ablandadora de agua. 62 15)En el texto se han representado las resinas intercambiadoras catiónicas y aniónicas mediante fórmulas estructurales con rayas y flechas. Representarlas también mediante fórmulas "electrónicas" (punteadas). 16)Representar esquemáticamente el funcionamiento (servicio y regeneración) de una instalación desionizadora de agua. En ella indicar las correspondientes ecuaciones químicas. Problemas de Aplicación 17) Se tiene como efluente de un proceso de galvanoplastía un caudal de 90 l/h de agua que contiene disuelto 150 mg/l de cromato (VI) de niquel. Se debe abatir el cromato(VI) de niquel, ya que son tóxicos tanto su anion como su catión, de este efluente acuoso. Se propone el uso de una resina de intercambio carboxílica en estado ácido (capacidad de intercambio: 950 meq-g/l de resina) y una resina amoniacal en estado alcalino (capacidad de intercambio: 1150 meq-g/l de resina) con una carrera de columna de 100 horas. a) Indicar ecuaciones de intercambio de iones y un esquema de la instalación. b) Calcular los volúmenes de resina necesarios. c) Se debe regenerar las resinas agotadas. Se dispone para ello de soluciones de NaOH 8M y HCl 6M. Calcular los volúmenes de soluciones regenerantes que se deben consumir. Indicar ecuaciones de intercambio de iones y esquema de la instalación, correspondientes al ciclo de regeneración de las resinas. Respuesta: b) 16 l de resina de intercambio de cationes y 13 l de resina de intercambio de aniones. c) 1,932 l de NaOH 8M y 2,576 l de HCl 6M 18) En el análisis de 50,0 cm3 de una muestra de agua, que contiene calcio como única especie catiónica y cloruro como única especie aniónica, se gastan 10,0 cm3 de solución de quelón (EDTA) 0,010 M. a) Calcular la dureza en p.p.m. de CaCO3 ( mg de CaCO3/l de agua). b) Calcular la masa de carbonato de sodio requerida para tratar 1,0 m3 de esa agua por el método de la cal-soda. a) 200 p.p.m. de CaCO3 b) 212 g Respuesta: 19) Se determina experimentalmente el contenido en sales de un agua: -en 50,0 cm3 de muestra hay 12,5 mg de hidrógeno carbonato (IV) de magnesio, 7,5 mg de sulfato (VI) de calcio, 9,5 mg de MgCl2 y 15 mg de nitrato (V) de sodio. Se somete a ebullición este agua para posterior tratamiento, una vez enfriada. Calcular: a) los diferentes tipos de dureza del agua, antes de la ebullición, en p.p.m. de CaCO3 ( mg de CaCO3/l de agua) b) los diferentes tipos de dureza del agua, después de la ebullición, en p.p.m. de CaCO3 c) la masa de cada uno de los reactivos, por m3 de agua a procesar, que se requieren si se lleva a cabo el tratamiento por el método de la cal-soda (después de la ebullición indicada en el enunciado). Respuesta: a) Dureza total: 481 p.p.m. de CaCO3 Dureza temporaria: 171 p.p.m. de CaCO3 Dureza permanente: 310 p.p.m. de CaCO3 c) 328 g Na2CO3 y 229 g Ca(OH)2 b) Dureza total: 310 p.p.m. de CaCO3 Dureza temporaria: 0 p.p.m. de CaCO3 Dureza permanente: 310 p.p.m. de CaCO3 Nota: el método de la cal-soda utiliza como reactivos solución acuosa de hidróxido de calcio y solución acuosa de carbonato(IV) de sodio. Tiene como objetivo precipitar la dureza temporaria y permanente del agua como carbonato de calcio y/ o hidróxido de magnesio insolubles. 63 64 APENDICE BATERÍA DE ACUMULADORES DE PLOMO ESQUEMA DE UN ACUMULADOR Reacción anódica: Pb (s) + SO4 2- descarga PbSO4 (s) + 2 e carga Reacción catódica: 2 e + PbO2(s)+ 4H++ SO42Pb (s) + PbO2(s)+ 4H++2 SO42- PbSO4 (s) + 2 H2O (l) 2 PbSO4 (s) + 2 H2O (l) 65 Diagrama de la Pila de Gravedad: una versión especial de la Pila de Daniell PILA DE CD-NI Reacción anódica: Cd (s) + 2 HO- descarga Cd(OH)2 (s) + 2 e carga Reacción catódica: 2 e + NiO2(s)+ 2 H2O (l)2Cd (s) + NiO2(s)+ 2 H2O (l) Ni(OH)2 (s) + 2 HOCd(OH)2 (s) + Ni(OH)2 (s) 66 Metodo Hall: obtención de Aluminio por reducción de Alúmina (Al2O3) MATERIAS PRIMAS Criolita: Na3AlF6 (fundente) PF= 980ºC purificación Bauxita: Al2O3.Fe2O3.SiO2 → Al2O3 (Alúmina) PF= 2050ºC Cuba electrolítica: baño a 960ºC Reacción catódica: Reacción anódica: 2 Al3+ + 3 e 3 O2- → Al (l) → ½ O2 (g) + 2 e electrólisis 2 Al3+ + 3 O2- → 2 Al (l) + 3/2 O2 (g) Al2O3 (l) → 2 Al (l) + 3/2 O2 (g) Reacció secundaria: C(ánodo)+ O2(g) → 2 CO2 (g) 67 68 CELDA ELECTROLÍTICA PARA REFINAR COBRE METÁLICO electrólisis Reacción anódica: Reacción catódica: Cu Cu (s) 2+ → Cu2+ + 2 e electrólisis + 2e → Cu (s) 69 Pila de Daniell alimentando a una cuba electrolítica y circuitos de Medición 70 Diagrama de fases del agua Equilibrio sólido-líquido-vapor 800 700 600 G P resión de Vapor / mmHg 500 400 L 300 S 200 100 0 -100 -20 0 20 40 60 temperatura / ºC 71 80 100 120 72 73 74 75 76 77 CONSTANTES DE DISOCIACIÓN PARA ALGUNAS BASES DÉBILES BASE ÁCIDO CONJUGADO REACCIÓN DE EQUILIBRIO Amoniaco (NH3) NH4+ NH3 + H2O Hidracina NH2NH2 Anilina C6H5NH2 Piridina (C5H5N) Hidroxilamina (H2NOH) Metilamina (NH2CH3) Etilamina NH4+ + OH- NH2NH3+ + HO – NH2NH2 + H2O C6H5NH3+ + HO – C6H5NH2 + H2O C5H5NH+ + OH- 1.8 x 10-5 3,0.10-6 4,2.10-10 C5H5NH+ C5H5N + H2O H3NOH+ H2NOH + H2O H3NOH+ + OH- 1.1 x 10-8 NH3CH3+ NH2CH3 + H2O NH3CH3+ + OH- 4.4 x 10-4 C2H5NH3+ + HO – C2H5NH2 + H2O C2H5NH2 Ion bisulfuro (HS-) Ion carbonato (CO32-) Ion hipoclorito (ClO-) Kb H2S + OH- 1.7 x 10-9 4,3.10-4 H2S HS- + H2O 1.8 x 10-7 HCO3- CO32- + H2O HCO3- + OH- 1.8 x 10-4 HClO ClO- + H2O HClO + OH- 3.3 x 10-7 Valores de [H+] y del pH correspondientes a algunas soluciones [H+] 100 10-1 pH 0 1 10-2 2 10-3 3 10-4 10-5 10-6 4 5 6 10-7 7 10-8 10-9 8 9 10-10 10-11 10 11 -12 10 10-13 10-14 Solución HCl 1 molar Aguas volcánicas Jugo gástrico Jugo de limón Vinagre, bebidas “cola” Jugo de naranja Vino Tomates Café negro Orina Agua de lluvia Saliva Agua pura Sangre Agua de mar Lagos alcalinos Soluciones de jabón Amoníaco para uso doméstico 12 13 14 NaOH 1 molar 78 TABLA DE MASAS ATOMICAS RELATIVAS Y NUMEROS ATOMICOS Elemento Símbolo Actinio Aluminio Americio Antimonio Argón Arsénico Astato Azufre Bario Berkelio Berilio Bismuto Boro Bromo Cadmio Calcio Californio Carbono Cerio Cesio Cinc Circonio Cloro Cobalto Cobre Cromo Curio Disprosio Einstenio Erbio Escandio Estaño Estroncio Europio Fermio Flúor Fósforo Francio Gadolinio Galio Germanio Hafnio Helio Hidrógeno Hierro Holmio Indio Iodo Iridio Iterbio Itrio Kriptón Lantano Ac Al Am Sb Ar As At S Ba Bk Be Bi B Br Cd Ca Cf C Ce Cs Zn Zr Cl Co Cu Cr Cm Dy Es Er Sc Sn Sr Eu Fm F P Fr Gd Ga Ge Hf He H Fe Ho In I Ir Yb Y Kr La Número Atómico 89 13 95 51 18 33 85 16 56 97 4 83 5 35 48 20 98 6 58 55 30 40 17 27 29 24 96 66 99 68 21 50 38 63 100 9 15 87 64 31 32 72 2 1 26 67 49 53 77 70 39 36 57 Masa Atómica Relativa 227,0278 26,98154 (243) 121,75 39,948 74,9216 (210) 32,06 137,33 (247) 9,01218 208,9804 10,81 79,904 112,41 40,08 (251) 12,011 140,12 132,9054 65,38 91,22 35,453 58,9332 63,546 51,996 (247) 162,50 (252) 167,26 44,9559 118,69 87,62 151,96 (257) 18,998403 30.97376 (223) 157,25 69,72 72,59 178,49 4,00260 1,0079 55,847 164,9304 114,82 126,9045 192,22 173,04 88,9059 83,80 138,9055 Elemento Símbolo Laurencio Litio Lutecio Magnesio Manganeso Mendelevio Mercurio Molibdeno Neodimio Neón Neptunio Níquel Niobio Nitrógeno Nobelio Oro Osmio Oxígeno Paladio Plata Platino Plomo Plutonio Polonio Potasio Praseodimio Promecio Protactinio Radio Radón Renio Rodio Rubidio Rutenio Samario Selenio Silicio Sodio Talio Tantalio Tecnecio Telurio Terbio Titanio Torio Tulio Tungsteno (Unnilhexium) (Unnilpentium) (Unnilquadium) Uranio Vanadio Xenón Lw Li Lu Mg Mn Md Hg Mo Nd Ne Np Ni Nb N No Au Os O Pd Ag Pt Pb Pu Po K Pr Pm Pa Ra Rn Re Rh Rb Ru Sm Se Si Na Tl Ta Tc Te Tb Ti Th Tm W (Unh) (Unp) (Unq) U V Xe 79 Número Atómico 103 3 71 12 25 101 80 42 60 10 93 28 41 7 102 79 76 8 46 47 78 82 94 84 19 59 61 91 88 86 75 45 37 44 62 34 14 11 81 73 43 52 65 22 90 69 74 106 105 104 92 23 54 Masa Atómica Relativa (260) 6,941 174,967 24,30 54,9380 (258) 200,59 95,94 144,24 20,179 237,0482 58,70 92,9064 14,0067 (259) 196,9665 190,2 15,9994 106,4 107,868 195,09 207,2 (244) (209) 39,0983 140,9077 (145) 231,0359 226,0254 (222) 186,207 102,9055 85,4678 101,07 150,4 78,96 28,0855 22,98977 204,37 180,9479 (98) 127,60 158,9254 47,90 232,0381 168,9342 183,85 (263) (262) (261) 238,029 50,9415 131,30 NOMENCLATURA QUIMICA – EJEMPLOS NOMBRE BÁSICO A UTILIZAR OTROS NOMBRES EN EL CURSO N2 nitrógeno HCl cloruro de hidrógeno ácido clorhídrico (si está en solución acuosa) FeCl2 cloruro de hierro (II) cloruro ferroso dicloruro de hierro Ca (ClO)2 clorato (I) de calcio monoxoclorato de calcio hipoclorito de calcio CaH2 hidruro de calcio Na2O óxido de sodio Fe2O3 óxido de hierro (III) óxido férrico trióxido de dihierro N2O5 óxido de nitrógeno (V) pentóxido de nitrógeno pentóxido de dinitrógeno CO monóxido de carbono Cu (OH)2 hidróxido de cobre (II) hidróxido cúprico HClO3 clorato (V) de hidrógeno ácido clórico trioxoclorato de hidrógeno CuSO4 sulfato (VI) de cobre (II) sulfato cúprico tetraoxosulfato de cobre H3PO4 ortofosfato (V) de hidrógeno ácido ortofosfórico tetraoxofosfato (V) de hidrógeno Ca3(PO4)2 ortofosfato (V) de calcio tetraoxofosfato (V) de calcio ortofosfato de calcio “fosfato tricálcico” (nombre comercial) Na2HPO4 hidrógeno ortofosfato (V) de sodio ortofosfato monoácido de sodio hidrógeno tetraoxofosfato (V) de sodio “fosfato disódico” (nombre comercial) NaH2PO4 dihidrógeno ortofosfato (V) de sodio ortofosfato diácido de sodio dihidrógeno tetraoxofosfato (V) de sodio Ca (PO3)2 metafosfato (V) de calcio trioxofosfato (V) de calcio metafosfato de calcio H4P2O7 difosfato (V) de hidrógeno ácido difosfórico ácido pirofosfórico heptaoxodifosfato (V) de hidrógeno 80 UNIDADES S.I. DERIVADAS CON NOMBRES ESPECIALES QUE SE EMPLEAN EN ESTE CURSO Unidad Magnitud Unidades SI Unidades SI derivadas de base Nombre Símbolo Nombre Símbolo Fuerza F newton N Presión p pascal Pa N/m2 kg/s2.m E, W W, A q joule J N.m m2kg/s2 P watt W 1W = 1J/s kg.m2/s3 coulomb C C A.s volt V 1V = 1W/A kg.m2/s3.A Ω 1Ω = 1V/A kg.m2/s2A2 N.m kg.m2/s2 Energía Trabajo Calor Potencia Flujo energético Cantidad de electricidad m.kg/s2 Q Potencial eléctrico V, ϕ Diferencia de potencial U, V Fuerza electromotriz E Resistencia eléctrica R ohm Momento de una fuerza M Newton.metro 81 ENERGÍA Energía de un sistema es la capacidad del mismo para realizar trabajo. La energía puede adoptar diferentes formas, tales como: -energía potencial mecánica (o de posición de masa) -energía cinética (o de movimiento): de traslación, rotación o vibración -energía térmica -energía potencial eléctrica (o de posición de carga eléctrica) -energía electromagnética (o de radiación) -energía química (o de enlace) Bajo ciertas condiciones, las distintas formas de energía pueden transformarse unas en otras. Es decir, son equivalentes. FACTORES DE CONVERSIÓN ENTRE LAS DIFERENTES UNIDADES DE ENERGÍA eV kW . h (*) Joule L . atm kcal eV 1 4,45.10-26 1,60.10-19 1,58.10-21 3,83.10-23 kW . h 2,24.1025 1 3,60.106 3,55.104 0,861.103 (*) Joule 0,625.1019 2,78.10-7 1 0,987.10-2 2,39.10-4 L. atm 0,632.1021 2,82.10-5 1,01.102 1 2,42.10-2 kcal 2,61.1022 1,116.10-3 4,19.103 4,13.10 1 (*) Unidad del Sistema Internacional (S.I.) y del SIMELA R ≅ 2 cal/mol.K ≅ 8,32 J/mol.K ≅ 8,21.10-2 L.atm/mol.K 82






