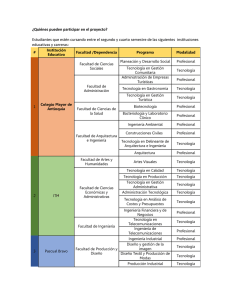
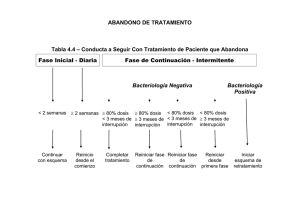
capítulo i - Biblioteca Virtual del ICAP
Anuncio

INSTITUTO CENTROAMERICANO DE ADMINISTRACION PÚBLICA ICAP PROGRAMA DE MAESTRÍA EN GERENCIA DE LA CALIDAD DESARROLLO DE UN SISTEMA DE GARANTÍA DE LA CALIDAD EN LA SECCIÓN DE BACTERIOLOGÍA EN EL HOSPITAL LOS CHILES DIANA ACEVEDO CAMPOS DENIS MÉNDEZ BRICEÑO San José, Costa Rica Mes, año i Agradecimientos A todas aquellas personas que de alguna u otra forma nos apoyaron con sus palabras de aliento, las cuales estaban llenas de sabiduría y fueron la fuerza que nos impulsaron a ser mejor cada día. A los microbiólogos del Hospital Los Chiles, que con tanta generosidad nos brindaron sus conocimientos y su tiempo e hicieron posible que este trabajo final de graduación se llevara a cabo de la mejor forma posible. A ustedes, muchas gracias. Diana Acevedo Campos. Denis Méndez Briceño. iii Dedicatoria Cuando uno llega al final de un camino, vuelve la mirada hacia atrás para observar el trayecto recorrido y palpar los logros obtenidos. Nuestros primeros pensamientos más que de satisfacción, son de un profundo agradecimiento hacia aquellas personas que sin ninguna duda, nos han entregado lo mejor de sí, para que culminara nuestra meta. Al presentar nuestro trabajo final de graduación, deseamos que hoy tengan un lugar especial y un reconocimiento público por su incondicional ayuda, entrega y amor que nos brindaron. A nuestros padres, quienes fueron nuestra primera escuela y que con sus ejemplos y acciones, nos dieron los valores más altos a los que un ser humano puede aspirar. Porque en los momentos de salud y enfermedad estuvieron a nuestro lado, y sobre todo, por su incondicional apoyo para que realizáramos lo que deseábamos. iv Resumen Ejecutivo El Hospital de Los Chiles es una institución de índole pública perteneciente a la Caja Costarricense de Seguro Social. Fue inaugurado en el año 1983, está ubicado a 7 km al sur de la frontera con Nicaragua en la región Huetar Norte. Este centro de salud posee la categoría de hospital periférico y da atención al primero y segundo nivel. El laboratorio clínico del Hospital Los Chiles cuenta con cinco secciones: hematología, química clínica, serología, parasitología y bacteriología. En la sección de bacteriología se procesan mayoritariamente muestras de urocultivo, coprocultivo, hemocultivos, secreciones vaginales y baciloscopías por BK. A pesar de la relevancia clínica que tiene el procesamiento de las muestras antes citadas, en la sección de bacteriología se realizan escasos controles de calidad a los equipos, medios de cultivo y reactivos en general. Debido a esto, se diseñó una propuesta para un sistema de garantía de la calidad en la sección de bacteriología, que incluyó la calibración de equipos tales como incubadoras, refrigeradoras, autoclaves, sistema Vitek, entre otros. También el control de calidad de los reactivos como la catalasa, coagulasa, oxidasa, reactivo de indol, así como los medios de cultivo más frecuentemente utilizados en la sección de bacteriología. Además, se diseñó el control de calidad de los colorantes utilizados en la tinción de gram y Ziehl-Neelsen respectivamente. Como parte del diseño, se anexó el control de calidad de los cinco tipos de muestras mayormente recibidas en el laboratorio clínico, junto con los criterios de selección de las mismas. Por otra parte, se definió los parámetros que debe incluir el reporte de resultados de bacteriología. Se definió la confección de un plan de educación continua para la sección de bacteriología. v Para llevar a cabo el sistema de garantía de calidad, se determinó la factibilidad del mismo teniendo en cuenta la infraestructura, los recursos materiales y el recurso humano necesario. Por ser ésta una propuesta, la implementación propiamente dicha, es resorte directo tanto de la jefatura del hospital como del laboratorio mismo, por lo cual, se procedió a confeccionar una serie de matrices con el fin de ser utilizadas como herramientas de trabajo en el quehacer diario del control de calidad. Finalmente, la evaluación propuesta de este sistema de garantía de calidad involucra dos aspectos; el interno que está constituido primeramente por las auditorías internas programadas que realizará la jefatura del laboratorio y por un segundo control que realiza diariamente un profesional ajeno a la ejecución misma del control de calidad. La evaluación externa del control de calidad, será responsabilidad en primera instancia del centro de referencia nacional de bacteriología, ubicado en el Instituto Nacional Costarricense de Investigación, Enseñanza, Nutrición en Salud (INCIENSA) y en segundo lugar por la compañía Tecnodiagnóstica, la cual es la suplidora del sistema automatizado de identificación bacteriana y prueba de sensibilidad a los antibióticos. Los datos obtenidos en este estudio fueron recopilados de las entrevistas hechas al personal de laboratorio y de las hojas de cotejo aplicadas en este lugar y posteriormente fueron analizadas para una mayor comprensión. Los resultados revelan que existe un número importante de carencias en el recurso material, humano y de infraestructura, las cuales no permiten el aseguramiento completo de la calidad, sin embargo, se encontraron aspectos aislados de ejecución de un control de calidad y una posición positiva y proactiva de los funcionarios encargados de tomar decisiones en el sentido de promover la calidad. vi Para que este sistema de garantía de la calidad sea implementado, se recomienda como primer punto, iniciar con aquellas acciones que no requieran ningún tipo de desembolso económico como podrían ser: los registros de actividades, manejo adecuado de la documentación, utilización de criterios de rechazo y aceptación de muestras clínicas, capacitación interna, entre otros. Por otro lado, en una segunda etapa se sugiere la compra de todos aquellos equipos, reactivos y materiales que sean necesarios. Así como la gestión de una nueva plaza, para dar apoyo técnico al microbiólogo encargado de la sección de bacteriología. vii TABLA DE CONTENIDOS Agradecimientos ................................................................................................................... iii Dedicatoria .............................................................................................................................iv Resumen Ejecutivo ................................................................................................................. v TABLA DE CONTENIDOS .............................................................................................. viii Tabla de cuadros y figuras ...................................................................................................... x INTRODUCCIÓN .................................................................................................................. 1 CAPÍTULO I .......................................................................................................................... 4 1. Marco contextual ............................................................................................................ 4 1.1 Antecedentes del Problema ........................................................................................... 4 1.1.1 Antecedentes Internacionales ................................................................................ 4 1.1.2 Antecedentes Nacionales ....................................................................................... 8 1.1.3 Antecedentes Locales ............................................................................................ 9 1.2 Justificación del Problema .......................................................................................... 12 1.3 Problema de Investigación .......................................................................................... 13 1.4 Objetivos de la Investigación ..................................................................................... 13 1.4.1. Objetivo General ..................................................................................................... 13 1.4.2. Objetivos Específicos ............................................................................................. 13 CAPÍTULO II ....................................................................................................................... 16 2. Marco teórico ............................................................................................................. 16 2.1 Marco Teórico......................................................................................................... 16 CAPÍTULO III ...................................................................................................................... 55 3. Marco Metodológico..................................................................................................... 55 3.1 Tipo de estudio........................................................................................................ 55 3.2 Área de Estudio ....................................................................................................... 55 3.3 Objeto de Estudio.................................................................................................... 56 3.4 Población de estudio y muestra .............................................................................. 56 3.5 Fuentes de Información .......................................................................................... 56 3.6 Operalización de las variables ................................................................................ 57 3.7 Diseño de técnicas e instrumentos .......................................................................... 57 CAPÍTULO IV ..................................................................................................................... 64 4. Análisis de la Información ............................................................................................ 64 CAPITULO V ....................................................................................................................... 71 Propuesta del sistema de garantía de la calidad ................................................................ 71 CAPÍTULO VI ................................................................................................................... 101 5. Conclusiones y Recomendaciones .............................................................................. 101 5.1 Conclusiones ......................................................................................................... 101 5.2 Recomendaciones ................................................................................................. 103 BIBLIOGRAFÍA ................................................................................................................ 107 APÉNDICES ...................................................................................................................... 109 Apéndice Nº 1 ..................................................................................................................... 110 Apéndice Nº 2 ..................................................................................................................... 111 Apéndice Nº 3 ..................................................................................................................... 112 Apéndice Nº 4 ..................................................................................................................... 113 viii Apéndice Nº 5 ..................................................................................................................... 117 Apéndice Nº 6 ..................................................................................................................... 119 Apéndice Nº 7 ..................................................................................................................... 120 Apéndice Nº 8 ..................................................................................................................... 121 Apéndice Nº 9 ..................................................................................................................... 122 Apéndice Nº 10 ................................................................................................................... 123 Apéndice Nº 11 ................................................................................................................... 124 Apéndice Nº 12 ................................................................................................................... 125 Apéndice Nº 13 ................................................................................................................... 126 Apéndice Nº 14 ................................................................................................................... 127 Apéndice Nº 15 ................................................................................................................... 128 Apéndice Nº 16 ................................................................................................................... 128 Apéndice Nº 17 ................................................................................................................... 129 Apéndice Nº 18 ................................................................................................................... 129 Apéndice Nº 19 ................................................................................................................... 130 Apéndice Nº 20 ................................................................................................................... 131 Apéndice Nº 21 ................................................................................................................... 132 Apéndice Nº 22 ................................................................................................................... 133 Apéndice Nº 23 ................................................................................................................... 134 ANEXOS ............................................................................................................................ 135 Anexo Nº 1.......................................................................................................................... 136 Anexo Nº 2.......................................................................................................................... 152 Anexo Nº 3.......................................................................................................................... 156 Anexo Nº 4.......................................................................................................................... 157 Anexo Nº 5.......................................................................................................................... 158 Anexo Nº 6.......................................................................................................................... 159 Anexo Nº 7.......................................................................................................................... 160 ix Tabla de cuadros y figuras Cuadro Nº 1.Diseño del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles 59 Cuadro Nº2. Factibilidad del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles 60 Cuadro Nº3. Implementación del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles 61 Cuadro Nº4. Evaluación del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles 62 Figura 1. Diagrama de flujo del Sistema de Garantía de Calidad, Hospital Los Chiles 70 Cuadro 5. Patrones de crecimiento de Cepas ATCC en diferentes medios de cultivo 78 . Cuadro 6. Diagrama de actividades para el procesamiento de urocultivo 81 Figura 2. Flujograma de procesamiento de urocultivos 82 Cuadro 7. Diagrama de actividades para el procesamiento de coprocultivos 84 Figura 3. Flujograma de procesamiento de coprocultivos 85 x Cuadro 8. Diagrama de actividades para el procesamiento de hemocultivos 87 Figura 4. Flujograma de procesamiento de hemocultivos 88 Cuadro 9. Diagrama de actividades para el procesamiento de secreción vaginal 90 Figura 5. Flujograma de procesamiento de secreción vaginal 91 Cuadro 10. Diagrama de actividades para el de baciloscopía 93 Figura 6. Flujograma de procesamiento de baciloscopías 94 xi 1 INTRODUCCIÓN En los últimos diez años, se han presentado diferentes procesos de reforma del sector salud, que incluían cambios estructurales, financieros y funcionales de los sistemas de salud y se empezó a dar prioridad a la atención de las personas bajo una política de calidad, con la idea de mejorar las diferentes prácticas de la salud pública. La participación de los servicios de laboratorio clínico juega un rol fundamental en la prevención y control de las enfermedades, salud materno-infantil, vigilancia epidemiológica, salud ambiental, respuestas a las situaciones de emergencia, en general, en todo el ámbito de la salud pública. La importancia de los servicios de laboratorios dentro de la salud pública, requiere de la definición clara de la misión y visión de la misma, con el fin último de impactar en la atención que reciben los usuarios. Para el fortalecimiento de los laboratorios, se requiere la implementación de un sistema de garantía de calidad en la red, la redacción y difusión de normas y procedimientos estandarizados, la capacitación continua del personal tanto en aspectos técnicos, médicos como gerenciales, así como la voluntad expresa por parte de la dirección médica, para apoyar la gestión del control de calidad. Las aperturas de los mercados internacionales y la adopción de principios de competencia, satisfacción tanto para el cliente externo como para el interno, el desarrollo de estrictas prácticas de control de garantía de calidad, así como de métodos modernos y eficientes de producción libre de errores y defectos, hacen que los laboratorios clínicos estén sujetos a operar bajo principios de responsabilidad ética, legal y moral. En Costa Rica existe una falta de experiencia y de medios para llevar un servicio de laboratorio clínico en condiciones óptimas. Lo anterior unido a los problemas 2 económicos por los que atraviesa el sector salud, no permiten contar con el capital para remodelar la infraestructura de los laboratorios, así como subsanar las deficiencias en equipamiento y de suministros; además de la escasez de personal con formación en el campo de la calidad y la bacteriología, lo que en muchas ocasiones genera, que no se garantice un verdadero programa de calidad en los centros de trabajo. Este estudio tuvo como objetivo presentar una propuesta de un sistema de garantía de calidad adecuado a la sección de bacteriología del Hospital Los Chiles, con el fin de garantizar la validez de los reportes originados en ésta sección. Esta idea se plantea producto de que en la sección de bacteriología, se carece de un verdadero sistema de control de calidad, evidenciado por problemas de aislamiento del microorganismo, así como reproceso de muestras y fallas en el desempeño de reactivos y medios de cultivo vitales para la identificación de los mismos. Dado a lo anterior, el problema de investigación radicó en la ausencia de un sistema de garantía de calidad en la sección de bacteriología del Hospital Los Chiles, para ello, se definió como objetivo general, desarrollar un sistema de garantía de calidad, lo que involucró su diseño, su factibilidad, implementación, evaluación y recomendaciones. 3 CAPÍTULO I MARCO CONTEXTUAL 4 CAPÍTULO I 1. Marco contextual 1.1 Antecedentes del Problema 1.1.1 Antecedentes Internacionales Los sistemas de garantía de la calidad, constituyen una medida eficaz para mantener el nivel de rendimiento de los laboratorios de diagnóstico en todo el mundo, así como para mejorarlo, en caso de que sea necesario. Por lo general, se considera que la calidad de una prueba de laboratorio depende directamente de su fiabilidad (exactitud) y de su reproducibilidad (precisión). Pero en microbiología, la calidad no solo depende de la perfección técnica, sino también de la rapidez, los costos y la utilidad o pertinencia clínica de la prueba. (Organización Mundial de la Salud, 1993). El manual anterior hace referencia a que existen dos tipos de garantía de la calidad; el interno, llamado también control de calidad, el cual consiste en que el laboratorio cuente con un programa para comprobar la calidad de sus propias pruebas y el externo, conocido también como evaluación de la calidad, el cual implica que un organismo externo compruebe el funcionamiento del laboratorio. (Organización Mundial de la Salud, 1993) Autores refieren que para el correcto funcionamiento de la sección de bacteriología, se debe diseñar un sistema de calidad a través del cual se persiga un control adecuado y constante sobre todas las etapas del análisis microbiológico, las que contemplan el recibo, el manejo y el reporte de especímenes clínicos; además, el monitoreo de los medios de cultivos utilizados en el laboratorio clínico, reactivos, instrumentos, procedimientos y el personal, para asegurar una adecuada práctica en el aislamiento, identificación y caracterización de agentes etiológicos y su correspondiente prueba de susceptibilidad como una guía terapéutica. (Caballero, 2008) 5 Un sistema de control de calidad debe incluir al menos los siguientes elementos: (Caballero, 2008) 1. Las pruebas y los procedimientos. 2. Calidad de la muestra 3. Verificación y validación de las diferentes pruebas diagnósticas. 4. Manual de procedimientos. 5. Mantenimiento de reportes y libros de registros. 6. Evaluación del personal. 7. Controles externos. 8. Monitoreo de los equipos e instrumentos instalados El control de la calidad en la preparación y evaluación de los medios de cultivo, es considerado como una esencial y buena práctica de laboratorio, necesaria para mantener el nivel y la ejecución de cualquier técnica microbiológica. Este es un proceso continuo que se extiende desde las materias primas, a través del productor, hasta el producto final utilizado en la mesa de trabajo. Por esta razón, se le confiere una gran importancia y está considerado como uno de los puntos críticos de control en el análisis microbiológico, del cual depende la seguridad de los resultados que emiten los laboratorios clínicos. (Caballero, 2008) La ejecución de pruebas microbiológicas con calidad exige también de reactivos y colorantes de calidad, así como de medios de cultivo y patrones de referencia óptimos. Para lograr resultados satisfactorios y deseados en el campo de la investigación, es necesario disponer de microorganismos que sean capaces de facilitar y garantizar la calidad en el desarrollo del trabajo. (Guerrero) En Cuba, se realizó un control de calidad de medios de cultivo, con empleo de cepas bacterianas autóctonas como patrones secundarios de referencia, en el Departamento de Microbiología Sanitaria 7, en un octubre de 2000 a noviembre de 2001. (Weng, 2001) período que abarca desde 6 Los medios de cultivo que se utilizaron para este estudio eran aquellos como el agar McConkey, el agar Salmonella-Shigella, el agar verde brillante, el agar hierro de Kligler, el agar citrato de Simmons, el caldo triptona para la producción de indol y caldo rojo de metilo-Voges Proskauer, para lo cual se utilizaron las técnicas de Miles y Misra (modificadas) e inoculación directa, según los procedimientos de trabajo establecidos para este fin. No se encontraron diferencias en las respuestas obtenidas de los cultivos ensayados durante su verificación en los medios de cultivo, lo que demuestra que las cepas pueden ser útiles en la práctica diaria como patrones secundarios de referencia en el aseguramiento de la calidad microbiológica. (Weng, 2001) Los procedimientos incluidos para implementar un sistema de aseguramiento de la calidad son: la preservación de aislamientos de cepas tipo ATCC, la esterilización y almacenamiento de los medios de cultivo comerciales y preparados caseramente, pruebas de esterilidad de sangre de cordero-caballo, adecuado funcionamiento del analizador VITEK, así como las pruebas de sensibilidad a los antibióticos entre otras. (Canadá, 2001) La “Guía para la acreditación de laboratorios que realizan análisis microbiológicos” considera que los análisis microbiológicos incluyen pruebas de esterilidad, detección, aislamiento, recuento e identificación de microorganismos (virus, bacterias, hongos y protozoos) y sus metabolitos en diferentes materiales y productos, o cualquier tipo de ensayo en el que se utilicen microorganismos como parte de un sistema de detección, así como la utilización de microorganismos para ensayos ecológicos. De ahí se deduce que algunas de las directrices contenidas en este documento, como las referentes a la bioseguridad de los laboratorios, tendrán que ser interpretadas en consecuencia y a la vez pueden servir de orientación para los laboratorios que utilizan técnicas en áreas relacionadas con la microbiología como bioquímica, biología molecular y cultivos celulares. (España, 2002 y European co-operation for accreditation, 2002) 7 Continuando con la Guía del ENAC, se debe considerar que por la naturaleza de los análisis microbiológicos, estos se enmarcan en la categoría de los ensayos que no permiten realizar un cálculo riguroso, metrológica y estadísticamente válido de la incertidumbre de la medida. En general, puede ser apropiado basar la estimación de la incertidumbre en datos sobre la repitibilidad y la reproducibilidad exclusivamente, aunque lo ideal es incluir los sesgos. Los distintos componentes individuales de la incertidumbre deben identificarse y demostrar que están bajo control y evaluar su contribución a la variabilidad de los resultados. Algunos componentes tales como los efectos del pipeteado, el pesado y las diluciones pueden medirse directamente y evaluarse fácilmente, para demostrar que realizan una contribución insignificante a la incertidumbre global. Otros componentes como la estabilidad y preparación de muestras, no pueden medirse directamente y su contribución tampoco puede evaluarse por métodos estadísticos, pero su importancia en la variabilidad de los resultados, debe ser también considerada. (España, 2002 y European co-operation for accreditation, 2002) El Centro de Control para Enfermedades (CDC) y la Organización Mundial de la Salud (OMS), hacen referencia a que cada laboratorio debe asegurar adecuadamente el control de los medios de cultivo y reactivos que se utilizan. El control de calidad incluye la selección correcta de los reactivos, la preparación de los medios de acuerdo con las formulaciones aprobadas o con las instrucciones específicas del fabricante y el uso de las cepas de referencia bien caracterizadas para controlar el medio preparado. (Organización Mundial de la Salud, 2004) La OMS estimula la participación de los laboratorios centrales de salud pública en por lo menos tres valoraciones al año, mediante encuestas de control de calidad externas. Para los laboratorios de referencia esto puede incluir un esquema internacional de prueba. Los laboratorios nacionales, centrales o de referencia, deben trabajar para estandarizar los procedimientos de los laboratorios locales, regionales y los de ellos mismos, de manera que las observaciones puedan ser interpretadas de la misma manera en todos los lugares. (Organización Mundial de la Salud, 2004) 8 1.1.2 Antecedentes Nacionales La Facultad de Microbiología establece de manera general, algunos aspectos sobre el control de calidad de bacteriología, que contiene recomendaciones básicas de almacenamiento de medios de cultivos deshidratados, así como de su hidratación o reconstitución. También dicta los parámetros a seguir para la calidad en función a la esterilidad y el almacenamiento del medio preparado y listo para utilizar y el uso de cepas conocidas para asegurar la calidad de las tinciones y las pruebas de identificación bacteriana. (Guerrero) El Centro Nacional de Referencia en Bacteriología del Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud (INCIENSA) como parte de sus funciones, realiza rondas de calidad externa en los diferentes laboratorios afiliados a la red nacional de laboratorios, llamado “Evaluación externa del desempeño en la identificación bacteriana y prueba de sensibilidad a los antibióticos” en la cual se incluyen 8 muestras incógnitas con cepas pertenecientes al Centro. Además, como parte del Programa de Vigilancia Epidemiológica, los laboratorios nacionales, regionales y locales envían cepas aisladas al centro de referencia para su confirmación diagnóstica, donde lo más frecuente son los agentes causantes de diarrea, así mismo, microorganismos causantes de meningitis, infecciones respiratorias de origen bacteriano y recientemente se agregan a estas, la Influenza estacional para su correspondiente ratificación y posterior envío al Centro de Control y Prevención de Enfermedades (CDC) en Atlanta, como aporte en el desarrollo de cepas vacunales. En el INCIENSA y según políticas del Centro Nacional de Tuberculosis, se lleva a cabo un programa de control de calidad externo que incluye tres pilares como lo son, las visitas y evaluaciones a los laboratorios locales, donde se evalúan aspectos tales como infraestructura, recurso humano calificado, recursos materiales y equipamiento, como segundo punto, está el envío de láminas incógnitas positivas y negativas que deben ser analizadas y reportadas según 9 metodología establecida en el manual, además, se ejecuta una supervisión indirecta de las baciloscopías efectuadas por el laboratorio local, para lo cual deben enviarse todas las láminas positivas y el 5% de las negativas al Centro Nacional de Referencia de Tuberculosis para su posterior evaluación, donde se valora aspectos como calidad de la muestra, calidad del extendido, calidad de la tinción y concordancia cualitativa y cuantitativa. (INCIENSA, MS, CCSS. 1999) Por último, con la llegada de los analizadores automatizados VITEK® a los laboratorios clínicos de la CCSS, se incorporan algunas pruebas puntuales de control de calidad, como lo son el envío de cepas control conocidas rutinariamente para su análisis, a manera de control interno de los reactivos e insumos que utiliza el analizador. 1.1.3 Antecedentes Locales El laboratorio clínico del Hospital Los Chiles, en sus inicios sólo realizaba algunas pruebas para identificación de microorganismos y prueba de sensibilidad a los antibióticos, en la sección de bacteriología, con el uso de técnicas manuales. Posteriormente, se introdujeron técnicas miniaturizadas no automatizadas que además aumentan la capacidad resolutiva y de identificación de las diferentes especies bacterianas, sin embargo, ellas presentan el inconveniente de realizarse manualmente, ser engorrosas y de largo tiempo de respuesta. Entre los inconvenientes se encuentra la subjetividad en la preparación de suspensiones de trabajo de la cepa bacteriana en estudio, ya que se utiliza un patrón de Mac Farland el cual se corrobora visualmente, lo que puede introducir un error sistemático, además, estas técnicas requieren de un alto nivel de pericia por parte del operador a la hora de la inoculación de los diferentes pocillos de reacción bioquímica. 10 Conjuntamente en este período, solo se contaba con un stock de 15 antibióticos para realizar la prueba de sensibilidad a los antibióticos, lo que disminuye las opciones terapéuticas para el paciente. A partir de octubre del 2006, se instaló un analizador automatizado VITEK®, el cual representa un avance muy importante con respecto a las metodologías anteriores que disminuyen el tiempo de reporte de 24 horas con técnicas manuales hasta 8 horas. Así como el aumento de la precisión y la exactitud del diagnóstico microbiológico, debido a la amplia base de datos con el que cuenta el analizador para comparar patrones de identificación bioquímica bacteriana y patrones de susceptibilidad a los antibióticos. Por otro lado, en la preparación de las suspensiones bacterianas en esta nueva metodología, se utiliza un instrumento de medición con lo cual se elimina el componente subjetivo en este paso del proceso. A pesar del avance tecnológico experimentado en la sección de bacteriología, esta carece de un verdadero sistema de calidad, lo cual desencadena problemas de aislamiento del microorganismo, así como reproceso de muestras y fallas en el desempeño de reactivos y medios de cultivo vitales para la identificación de los mismos. Lo anterior se evidencia en la fase de aislamiento de microorganismos, principalmente en las discordancias que se dan en el crecimiento bacteriano de gram positivos entre medios de cultivo selectivos y no selectivos. En promedio al mes se aíslan alrededor de quince cocos gram positivos, de los cuales al menos cinco de ellos no crecen adecuadamente ni con sus características típicas en el medio de cultivo selectivo, por lo cual, se debe recurrir a otras opciones alternativas para realizar el diagnóstico y desembocar en un tiempo de respuesta mayor al establecido anteriormente. De igual manera, existe un 30% de las tinciones de gram con un resultado positivo pero con cultivo negativo. 11 En los registros de repetición de tarjetas de identificación tanto para microorganismos gram negativos como gram positivos, se demuestra que aproximadamente por semana, se reprocesan cuatro de las quince identificaciones que se procesan en la sección de bacteriología del Hospital Los Chiles, lo que significan en números relativos un 27 %. El Centro de Referencia de Bacteriología ubicado en el INCIENSA, reportó en el último año incongruencias en al menos cuatro casos de los veinticinco enviados para corroboración especializada de identificación bacteriana. Por último, el Centro Nacional de Referencia de Tuberculosis al cual se envía el 5% de las láminas negativas de las baciloscopías realizadas al mes, se registra en un apartado de comentarios las irregularidades que se presentan en las tinciones realizadas en la sección de bacteriología, en donde lo más frecuente es encontrar que los colorantes deben de ser filtrados, las láminas presentan mucho precipitado y tinción con coloración violácea no adecuada para su observación. La sección de bacteriología no cuenta con un microbiólogo especialista en bacteriología, como sería deseable y tampoco cuenta con personal de apoyo calificado a tiempo completo, por lo cual se hace indispensable contar con una formación constante tanto para profesionales como para el personal de apoyo. En el 2007 el profesional a cargo de la sección de bacteriología realizó una pasantía en el Hospital México, sin embargo, estas capacitaciones se deben extender a todas las personas involucrados en los procesos que se realizan en dicha sección. Por las razones anteriormente expuestas es que se necesita un verdadero sistema de garantía de calidad en la sección de bacteriología del Hospital Los Chiles, el cual contemple aspectos tales como la apropiada selección, colección y transporte de las muestras clínicas, tanto como el análisis propiamente dicho y un reporte oportuno y de utilidad clínica, factores que hasta la fecha no se han logrado controlar adecuadamente. Además, se requiere de un sistema de evaluación constante en referencia a las incógnitas bacterianas y de estudios basiloscópicos. 12 1.2 Justificación del Problema El control de calidad en el laboratorio clínico tiene como objetivo primordial, que el producto final del trabajo tenga un alto grado de seguridad, en cuanto a la composición de la muestra, la utilización de los medios de cultivos y reactivos para el procesamiento de la muestra y la validez y oportunidad del resultado obtenido, de conformidad con los límites establecidos. Debido a que la mayoría de los resultados en microbiología es producto de interpretaciones y evaluaciones de reacciones bioquímicas de seres vivos, donde la capacidad y experiencia del evaluador tienen un gran valor, los cálculos de coeficientes de variación y desviaciones estándares que son parte de funciones analíticas, tienen poca aplicación en el laboratorio de microbiología. El propósito de este estudio, es ofrecer una propuesta de un sistema de garantía de calidad adecuado a la Sección de Bacteriología del Hospital Los Chiles, con el fin de garantizar la validez de los reportes originados en ésta sección. Al mismo tiempo, podría servir como modelo para la recolección y procesamiento de los datos para futuras investigaciones, que a la postre, permitan una estandarización de un programa de garantía de la calidad en otras secciones de bacteriología dentro de la Caja Costarricense de Seguro Social. El desarrollar un sistema de la garantía de calidad en la sección de Bacteriología del laboratorio clínico del Hospital Los Chiles, permitirá incrementar la asertividad, así como la oportunidad del diagnóstico, con el fin último de aumentar la calidad de vida de los pacientes infectados con algún microorganismo. Asimismo, puede disminuir costos financieros al Estado y la Caja Costarricense de Seguro Social, ya que se disminuirían las estancias hospitalarias por pacientes que requieren su internamiento para darles el tratamiento. Su relevancia social está en el hecho, de que el aseguramiento de la calidad en la sección de bacteriología del laboratorio clínico del Hospital Los Chiles, permitirá a la población de este cantón contar con un diagnóstico oportuno y de calidad. 13 La motivación para realizar este estudio, radica en el hecho de que en Costa Rica, a pesar de que existen algunos instrumentos para el aseguramiento de la calidad en laboratorios clínicos, todavía no existe un sistema de garantía de calidad en la sección de bacteriología del Hospital Los Chiles. El proyecto se considera viable ya que cuenta con el permiso y la colaboración del personal del Hospital Los Chiles; además, lo que pretende es determinar los factores que se requieren implementar para diseñar un programa de la garantía de calidad en la sección de bacteriología para julio del 2009, para aumentar la correcta identificación de los microorganismos y prueba de sensibilidad a los antibióticos. 1.3 Problema de Investigación Ausencia de un sistema de garantía de calidad en la sección de bacteriología en el Hospital Los Chiles 1.4 Objetivos de la Investigación 1.4.1. Objetivo General Desarrollar un sistema de garantía de la calidad en la sección de bacteriología en el Hospital Los Chiles para julio del 2009. 1.4.2. Objetivos Específicos 1. Diseñar un sistema de garantía de la calidad en la sección de bacteriología en el Hospital Los Chiles. 2. Determinar la factibilidad de implementación de un sistema de garantía de la calidad en la sección de bacteriología en el Hospital Los Chiles para julio del 2009. 14 3. Implementar el sistema de garantía de calidad para la sección de bacteriología en el Hospital Los Chiles para julio del 2009. 4. Evaluar el sistema de garantía de calidad implementado en la sección de bacteriología en el Hospital Los Chiles. 5. Recomendar acciones para apoyar la implementación del sistema de calidad en la sección de bacteriología del Hospital Los Chiles. 15 CAPÍTULO II MARCO TEÓRICO 16 CAPÍTULO II 2. Marco teórico 2.1 Marco Teórico Es difícil definir el término de control de calidad ya que existen diferentes definiciones, sin embargo si se basa en los dos términos que la componen, a saber control y calidad, se puede llegar a importantes conclusiones. Desde el punto de vista de un proceso, se considera que control, es el conjunto de actividades que se realizan sobre un proceso o producto con el fin de verificar que éste se encuentre dentro de los límites fijados por un patrón previamente establecido, donde los límites son los que marcan el intervalo de comportamiento del proceso o producto, y que en control de calidad se les conoce como normas o especificaciones. (Acuña, 2002) Por otro lado, la calidad es definida por el cliente o el usuario en términos del uso que dé al producto y del nivel de satisfacción logrado por el mismo. A raíz de esta definición es que se hace necesario establecer que la calidad hay que considerarla desde dos ángulos, el del productor y el del consumidor. Es así como nacen los conceptos de calidad absoluta o de concordancia y calidad relativa o de diseño. (Acuña, 2002) La calidad absoluta es el grado en que un proceso es capaz de reproducir un diseño, es decir, que existe una concordancia entre el producto y su diseño. En cambio, la calidad relativa es el grado en que un producto cumple con el fin para el cual fue creado, es decir, que se satisfacen las necesidades o requerimientos del consumidor o cliente. (Acuña, 2002) Asociada con la calidad relativa está la disponibilidad, que es la acción mediante la cual el cliente utiliza el producto y este cumple con la función requerida, y el servicio donde se presenta el conjunto de beneficios que se le otorga al cliente, 17 con el fin de garantizar un adecuado funcionamiento del producto durante el período de garantía. (Acuña, 2002) El control de calidad ha tomado en el pasado diversas formas, en un principio este se enfocaba únicamente en la simple inspección final del producto, por lo tanto, sólo se revisaba al final de las líneas de producción las unidades producidas para evitar que el producto defectuoso saliera del mercado, dicha acción tenía poco aporte a la mejora de la calidad, pues se dedicaba a separar el producto bueno del malo. (Acuña, 2002) Luego se pasó a una etapa de inspección del proceso, en la cual se hacía un diseño para detectar los problemas de calidad en el lugar y en el tiempo que ocurre, permitiendo una acción preventiva, ya que se buscaba e identificaba las causas y los efectos de los problemas de calidad. (Acuña, 2002) Por último, se llegó a lo que se conoce como control de calidad, control total de la calidad y aseguramiento de la calidad. En este nivel se busca la verificación de que el producto se fabrica de acuerdo con el diseño planteado, diseño que es el resultado de la interpretación técnica de las necesidades del consumidor, y que por lo tanto, satisface sus expectativas. (Acuña, 2002) En general, el control total de calidad es el conjunto de esfuerzos efectivos de los diferentes grupos de la organización, para la integración del desarrollo, del mantenimiento y de la superación de la calidad del producto, con el fin de hacer posible fabricación y servicio, a satisfacción completa del consumidor y en un nivel más económico. (Acuña, 2002) Otro término muy relacionado es el de aseguramiento de la calidad, el cual es el conjunto de acciones y actividades que tienen como objetivo brindar los medios técnicos y humanos que garanticen la aplicación y el éxito de los programas de calidad total. Esto incluye personal profesional, técnico, análisis científico de decisiones y herramientas adecuadas de análisis y control. (Acuña, 2002) 18 También forma parte del control de calidad el mejoramiento continuo de la calidad, donde se da un conjunto de actividades administrativas e ingenieriles llevadas a cabo, con el fin de lograr un mejoramiento continuo del nivel de calidad de los productos y servicios. (Acuña, 2002) Producto de la nueva concepción de calidad como una responsabilidad de todas las funciones de una empresa u organización, es que se hace necesario establecer un sistema de calidad, éste va ser el mecanismo que se encargará de planear, ejecutar, coordinar y controlar todas las actividades cuya realización tiene como fin último entregar al cliente un producto con la calidad requerida por él. (Acuña, 2002) Uno de los pilares del sistema de calidad es el establecimiento de políticas claras de calidad, que perfilen los lineamientos por seguir y que muestran las intenciones de los niveles jerárquicos de dar prioridad a proyectos y actividades que tengan como principal fin la conservación y mejora de la calidad del producto. (Acuña, 2002) La implementación de un sistema de control de calidad puede visualizarse de diversas formas, sin embargo, todas ellas convergen en que el sistema está compuesto por cuatro subsistemas, a saber, el diseño de producto, el mercado de proveedores, el proceso y el mercado de consumidores. (Acuña, 2002) El subsistema de diseño de producto, hace referencia a que la intención aquí es diseñar un producto acorde con las necesidades del consumidor y con las limitaciones de fabricación y no simplemente con los gustos e inventiva del diseñador. (Acuña, 2002) El subsistema de mercado de proveedores es necesario para la adquisición de materiales que cumplan con las condiciones adecuadas de fabricación. (Acuña, 2002) 19 El subsistema de proceso, es donde debe llevarse a cabo un control de cada proceso para no reducir la calidad de los materiales de entrada. Este control debe ejecutarse a lo largo de todas las etapas de producción y no al final, ya que esta actividad debe ser preventiva y no correctiva. El control preventivo es el que brinda las oportunidades de mejorar, detectar fallas en el momento en que ocurren, evitar altos volúmenes de producción defectuosa o no conforme con los requerimientos. (Acuña, 2002) Subsistema mercado de consumidores, es necesario para conocer y estudiar las necesidades del consumidor y retroalimentar al sistema acerca de la efectividad del producto, para cumplir con esas necesidades. (Acuña, 2002) Para diseñar un sistema de control de calidad, se recomienda en primer lugar, tener como marco de referencia alguna norma como la serie de normas ISO-9000, la cual permite establecer las áreas sobre las cuales debe centrarse la atención. El sistema debe organizarse de acuerdo con las cuatro áreas de la calidad total, a saber, diseño, materiales, procesos y producto. Para realizar esto, se propone un procedimiento de once etapas, las que pueden ejecutarse haciendo uso de una norma o aplicando un instrumento propio. (Acuña, 2002) 1. Análisis de la estructura organizacional de la empresa. Para ello es importante conocer las fortalezas y debilidades de la organización, para poder explotar las primeras y buscar alguna estrategia que permita atacar las debilidades. A través de este análisis, se determinará el modelo que mejor se ajuste a las características de la empresa. 2. Definición del alcance del sistema. Aquí se define la relación entre la función de calidad y las demás funciones de la organización, y dejar en claro si se van a diseñar los cuatro subsistemas y por cuál de ellos se va a empezar. 3. Establecimiento o revisión de la política de calidad. En este paso se debe revisar la política o redactar si no existe. Es primordial, para el éxito 20 del sistema, el compromiso de la dirección de dar apoyo a todo tipo de iniciativas que conlleven a lograr los objetivos del sistema. 4. Realización de un diagnóstico. No es aconsejable iniciar las actividades de diseño del sistema, sin antes conocer a fondo, qué esfuerzos se están realizando en la actualidad en la organización, para conservar aquellos que sean útiles para el desarrollo del sistema, sin embargo, si este es nuevo, el diagnóstico se sustituye por una investigación acerca del funcionamiento de sistemas similares. En este último caso en particular, la norma y su instrumento, son importantes. 5. Elaboración de un anteproyecto. Una vez que se tenga definidos el alcance del proyecto y se conoce las actividades que se realizan actualmente, se debe redactar un anteproyecto, que desglose de manera general, el modelo que va ser aplicado, las justificaciones y beneficios de su implementación, las actividades que se deben ejecutar para el diseño de cada subsistema, el tiempo estimado de desarrollo y la estimación inicial de costo. 6. Presentación del anteproyecto a la gerencia. Se presenta a la gerencia con el fin de obtener el visto bueno para el mismo y se debe convencer que el sistema se hace necesario para la organización. 7. Desarrollo del proyecto. Consta de cinco etapas: a. Planeación del estudio: se desglosa todas las actividades y se asignan tiempos y recursos a cada una de ellas. b. Desarrollo del modelo: en este paso se separa cada una de las actividades planeadas, esta parte se diseña por separado para los cuatro subsistemas y se debe considerar el desarrollo de manuales, además, se incluye el desglose de actividades para el desarrollo del subsistema de costos de calidad y las correspondientes a las pruebas necesarias para verificar la propuesta. Al final se establecen las actividades que permitirán el nexo entre los subsistemas. 21 c. Planificación de la inspección: se debe diseñar todo el plan de inspección que establezca entre otras cosas, tipo de inspección, puestos de inspección, instrumentación y criterios de aceptación y rechazo de lotes de productos. La mejor forma de poner lo anterior por escrito, es a través de manuales de inspección. d. Revisión del sistema: una vez terminado el desarrollo del sistema se efectúa una revisión total con el propósito de detectar omisiones y errores. e. Desarrollo de la propuesta de organización: se pretende desarrollar una propuesta que identifique el tipo de organización que puede hacer frente al sistema propuesto. Es indispensable dejar claro las funciones y responsabilidades de todos los miembros de la organización en la consecución de los objetivos del modelo. 8. Presentación a la gerencia. Se pretende en este paso hacer la presentación del proyecto a la gerencia para obtener su aval y por supuesto el respectivo financiamiento. 9. Desarrollo e implementación de un programa de capacitación y motivación al personal. Esto con el fin de facilitar la resistencia al cambio y de evitar errores en la implementación del sistema por desconocimiento, se propone el desarrollo de un programa de capacitación. Este programa debe incluir una explicación general de las partes del sistema, a todos los miembros de la organización y una explicación detallada de cada parte a aquellos que están directamente relacionados con su puesta en marcha. 10. Implementación del sistema. Se pone en marcha cada una de las actividades desglosadas en el proyecto, se hacen las mejoras y ajustes que ameriten. 11. Retroalimentación y cambios al modelo. Con base en los resultados de la implementación del sistema, se hacen los cambios necesarios al modelo. 22 Para detectar errores pueden realizarse auditorías de calidad, a través de la cual se verifica si lo que se aplica obedece a ciencia cierta a lo establecido en el proyecto del sistema. El seguimiento de esta serie de pasos permitirá el diseño de un sistema adecuado de control de calidad, el cual garantiza el cumplimiento de los requisitos de calidad fijados por el consumidor. El desarrollo de un sistema de calidad de un laboratorio debe tener un marco de referencia de alguna norma, para que ésta facilite el seguimiento de los once pasos mencionados en párrafos anteriores. Debido a la naturaleza del estudio se tomará algunos apartados de la Norma Internacional ISO 17025, “Requisitos generales para la competencia de laboratorios de ensayo y calibración”, como marco de referencia para la elaboración de la propuesta del sistema calidad de la sección de bacteriología del Hospital Los Chiles. (Ver anexo Nº1) Contemplando todo lo anterior para desarrollar un sistema de control de calidad en la sección de bacteriología del Hospital Los Chiles es imprescindible considerar los siguientes puntos: 1. Criterios para la obtención, transporte y rechazo de muestras clínicas Independientemente del hecho de que algunos tipos de muestras requieren metodologías de colección muy especiales, se puede enumerar algunos aspectos generales que deben ser tenidos en cuenta al coleccionar las muestras clínicas: (Caballero, 2008) • La muestra debe ser representativa del proceso infeccioso. • Es importante evitar la contaminación con microorganismos saprófitos del área, ya que la flora normal puede interferir con la interpretación del cultivo y enmascarar la presencia del verdadero agente etiológico de la enfermedad. 23 • Seleccionar el tipo anatómico correcto donde se obtendrá el espécimen, y utilizar la técnica apropiada y los instrumentos o elementos adecuados para su obtención. • En el caso de investigar microorganismos anaeróbicos, la biopsia y el aspirado con aguja, son las muestras de elección. Los hisopos y sistemas tipo Culturette son los menos deseables para este fin. • Nunca se debe refrigerar una muestra por anaerobios. • Coleccionar un volumen apropiado de muestra. • Identificar cada muestra con el nombre del paciente, número de identificación personal (número de seguro social o cédula de identidad personal), procedencia, tipo de muestra, fecha de colección e iniciales del funcionario que tomó la muestra. • Colocar la muestra en un receptáculo adecuado para su transporte con el fin de asegurar la sobrevivencia del posible agente infeccioso, evitar derrames del espécimen y mantener las medidas de bioseguridad apropiadas. • Ordenar siempre un frotis por gram para los especímenes que proceden de cavidades asépticas, y anote su interés en determinado microorganismo. Transporte de la muestra La mayoría de las especies bacterianas son vulnerables a demoras en su procesamiento, cambios de temperatura, humedad, etc. Durante el transporte, las bacterias de rápido crecimiento, pueden crecer sobre los patógenos más fastidiosos y de crecimiento lento o con requerimientos especiales, por lo que es vital, en el éxito del cultivo, que la muestra sea transportada y procesada con la celeridad necesaria. (Caballero, 2008) • Todas las muestras deben ser enviadas inmediatamente al laboratorio después de colectadas. Se debe instruir al personal médico, de enfermería y mensajeros en la importancia de un transporte expedito de las muestras clínicas. 24 • En los casos en que el transporte o el procesamiento pudieran demorar, se establecen a continuación las condiciones de temperatura para algunos tipos de muestras: mantenimiento a 4ºC tenemos los tejidos de autopsia, lavado bronquial, catéter i.v, biopsia de pulmón, líquido pericárdico, esputo, orina, quemaduras, oído externo. Mantenimiento a temperatura ambiente encontramos la muestras de LCR, líquido sinovial, abdominal y amniótico, bilis, Cul-de-Sac, aspirado de pulmón, lesión, placenta, nasal, aspirado transtraqueal, orina suprapúbica, raspado corneal, sangre, humor vítreo, médula ósea, cérvix, conjuntiva, heces, nasofaríngeo, tracto respiratorio superior, heridas, cultivos por anaerobios, ocular, genital y oído interno. Siempre que sea posible, las muestras deben ser enviadas directamente y en forma inmediata al laboratorio de microbiología, sin utilizar las áreas de recibo central u otros departamentos del laboratorio. (Caballero, 2008) Criterios de rechazo de una muestra clínica El laboratorio debe poner en ejecución una política estricta de aceptabilidad y rechazo de muestras clínicas, porque las muestras deben representar la causa probable de infección, de lo contrario, el procesamiento y reporte de muestras no adecuadas pueden proveer información equivocada, la cual puede llevar a un mal diagnóstico y por consiguiente fallas en el tratamiento que pueden poner en peligro la vida del paciente. (Caballero, 2008) Causales de rechazo de muestras clínicas: • Muestras no rotuladas o sin identificar. • Discrepancia en la identificación del paciente y la muestra. • Envase inapropiado o medio de transporte inadecuado. • Demora prolongada en enviar la muestra al laboratorio. • Duplicación de muestra del mismo paciente dentro de 24h, excepto sangre. • No indicar tipo de muestra o procedencia. • No indicar tipo de examen en la orden. 25 • Muestra en preservativos. • Muestra derramada o rotura del envase. • Hisopos secos. • Una sola muestra para cultivo con múltiples órdenes. • Muestra para anaerobios en envase inapropiado. • Cultivo por anaerobios de muestras con flora anaeróbica normal. • Frotis de Gram por Neisseria gonorrhoeae de muestras de cérvix, vagina y cripta anal, ya que pueden haber Neisserias saprófitas en el área. • Cultivo por anaerobios de orina colectada por vaciado directo. • Orina colectada de la bolsa de catéter. • Saliva. • Frotis directo por Gram de hisopos. • Volumen inadecuado. • Contaminación obvia de la muestra. El rechazo de una muestra debe estar acompañado de la solicitud de un nuevo espécimen. Es conveniente notificarlo directamente al médico solicitante. Muestras desaprobadas debido a su cuestionable información clínica: • Hisopo superficial oral. • Hisopo de úlcera de decúbito. • Hisopo de úlceras varicosas. • Hisopo de lesión superficial gangrenosa. • Vómito. • Punta de catéter Foley. • Descarga de colostomía. • Loquios. • Aspirado gástrico de recién nacido. • Hisopado faríngeo, nasal, orina o heces. Muestras no adecuadas para cultivo por anaerobios: • Lavado bronquioalveolar desprotegido. 26 • Hisopo cervical. • Aspirado endotraqueal. • Loquios. • Hisopo nasofaríngeo / Secreción faríngea. • Líquido seminal o prostático. • Esputo por expectoración o inducido. • Heces o muestra rectal. • Secreción uretral / hisopo vaginal o vulvar. • Orina por vaciado directo o catéter. 2. Control de calidad de los medios de cultivo Los medios de cultivo deshidratados son higroscópicos y la absorción de agua del exterior, así como la formación de agua dentro de la botella como consecuencia de las fluctuaciones de temperatura en el ambiente, favorece el crecimiento bacteriano. Esto puede conducir al consumo de nutrientes, variaciones de Ph y cambios en el color del medio. Además la exposición a la luz puede llevar a importantes alteraciones en los constituyentes del medio de cultivo. (Caballero, 2008) Teniendo en cuenta los factores antes señalados, los medios de cultivo deshidratados deben almacenarse siempre en lugares frescos, a temperatura ambiente y protegidos contra la humedad y la luz. La mayoría de los suplementos se guardan en refrigeración. Utilizando condiciones de almacenamiento adecuadas, los medios elaborados en polvo, tienen una vida útil de al menos 3 años. El material que ha sufrido cambios substanciales, tales como hidratación, endurecimiento y cambio de color, deben descartarse. (Caballero, 2008) Se debe mantener un registro de cada frasco de medio de cultivo deshidratado, con el nombre del producto, nombre y número telefónico de la casa proveedora, número de control del frasco, fecha de recibo, fecha de expiración, número de lote y fecha en que se abrió el frasco. (Caballero, 2008) 27 El grado de disolución de un medio deshidratado, así como la eficacia del mismo ya preparado, depende en gran medida, del procedimiento empleado en la rehidratación. Se recomienda utilizar agua recién destilada o completamente desmineralizada y un erlenmeyer con capacidad del doble del medio que se quiere preparar. Si el medio va a distribuirse en tubos, debe agitarse constantemente para asegurar una adecuada homogenización al momento de servirlos. (Caballero, 2008) Cuando se va a esterilizar, debe asegurarse en seguir las instrucciones de tiempo, presión y temperatura para la obtención de medios de cultivo óptimos. (Caballero, 2008) Una temperatura de 121 °C, presión de 15 libras y un tiempo de esterilización de 15 minutos, son suficientes para la mayoría de los medios. El medio esterilizado debe ser enfriado a 45°-60°C en un baño maría, para evitar la formación de agua de condensación. Al ser vertidos en las placas Petri, evitar la formación de burbujas y coágulos. (Caballero, 2008) Durante el proceso de servida, debe tomarse una muestra del medio para realizar el control de calidad por esterilidad y eficiencia. (Caballero, 2008) El medio de cultivo reconstituido tiene una vida útil limitada. Si no se emplea de inmediato, debe almacenarse bajo condiciones apropiadas para garantizar su utilidad durante un período. El almacenamiento a 4°C es el mejor para la mayoría de los medios. Sin embargo, aquellos que contienen Tioglicolato, deben guardarse a temperatura ambiente. (Caballero, 2008) Los medios deben mantenerse preferiblemente en sitios oscuros, ya que la luz puede afectar algunos de sus componentes. Para evitar la desecación, se aconseja que se guarden en bolsas plásticas bien cerradas. Los platos Petri almacenados así, deben mantenerse con el fondo hacia arriba. (Caballero, 2008) Dado que los medios almacenados en refrigeración, cuando pasan a temperatura ambiente, tienden a formar agua de condensación en la superficie, se recomienda 28 poner los platos Petri en la incubadora a 35°C por 2 horas, colocándolos con el fondo hacia arriba para obtener una superficie seca. Esto es particularmente importante, para que el agua no afecte la individualidad de las colonias en el aislamiento o en los casos de pruebas de sensibilidad a los antibióticos en los que el exceso de agua puede afectar la dilución de las colonias y por ende, la lectura del halo de inhibición. (Caballero, 2008) Cada lote preparado de medio de cultivo se prueba antes de su uso rutinario, por eficiencia o calidad, mediante la inoculación de microorganismos cuyo comportamiento conocemos, tanto para reacciones positivas como negativas. (Caballero, 2008) Puede utilizarse para ello cepas bacterianas domésticas o cepas control comerciales (ATCC).Se debe guardar un libro de registro de los resultados obtenidos. (Caballero, 2008) Evite el congelamiento de los medios preparados o la sangre de carnero. (Caballero, 2008) Al colocar en la refrigeradora los medios preparados, los de más reciente preparación deben ir al fondo y los más viejos adelante. (Caballero, 2008) Rotular todos los medios preparados, tanto en platos Petri como en tubos, indicar además, la fecha de preparación y expiración. (Caballero, 2008) Pruebas básicas de control de calidad de medios preparados: (Caballero, 2008) a. Ph. b. Esterilidad. c. Capacidad de crecimiento y reacción. d. Estabilidad. 29 Criterios de calidad de los medios preparados: (Caballero, 2008) a. Rajadura del plato o envase. b. Rajadura en la superficie del medio. c. Variaciones en el volumen del medio. d. Hemólisis. e. Cristales en el medio. f. Presencia de burbujas. g. Presencia de coágulos. h. Cambio de color normal. i. Contaminación. j. Falla en la inhibición de microorganismos saprófitos. Fallas y causas en la preparación de medios de cultivo (Caballero, 2008) 1. Valor de Ph incorrecto: • Medir el Ph por encima de los 25°C. • Sobrecalentamiento en la esterilización, vuelta a fundir o calentamiento prolongado a 50°C. • Solución incompleta del medio. • Mala calidad del agua. • Recipiente mal lavado o con residuos químicos. • Mala conservación del medio deshidratado o vencido. 2. Turbidez o precipitación: • Mala calidad del agua. • Sobrecalentamiento. • Ph incorrecto. • Solución incompleta. 3. Oscurecimiento: • Sobrecalentamiento. 30 • Solución incompleta. • Alteración del Ph. 4. Gel blando: • Bajo porcentaje de agar en el medio. • Errores en la pesada del medio deshidratado o en los suplementos. • Sobrecalentamiento. • Mala homogenización del medio. • Exceso de agua. 5. Crecimiento bacteriano pobre: • Exceso de calentamiento. • Substancias inhibidoras en el agua o en el recipiente. • Alteración en el Ph. Evaluación de la eficiencia de los medios de cultivo preparados: (Caballero, 2008) Medio de cultivo, organismo control y reacción esperada TSI Escherichia coli ácido/ácido TSI Shigella flexnerii alcalino/ácido TSI Pseudomona aeruginosa alcalino/no cambio SIM Proteus mirabilis movilidad positiva SIM Klebsiella pneumoniae movilidad negativa Citrato de Simmons Klebsiella pneumoniae color azul. Crece Citrato de Simmons Escherichia coli color verde. No crece. Caldo de urea Proteus mirabilis color rojo-morado. Positivo. Caldo de urea Escherichia coli color naranja. Negativo. 31 Agar sangre Streptococcus Betahemolítico. Grupo B Crece. Betahemólisis. Agar sangre Streptococcus pneumoniae Crece. Alfahemólisis. Agar sangre Klebsiella pneumoniae Crece. No hemolítico. McConkey Escherichia coli Crece. Colonias moradas. McConkey Proteus sp Crece. Colonias claras. McConkey Staphylococcus. No crece. Manitol Sal Staphylococcus aureus Colonias amarillas Manitol Sal Escherichia coli No crece. SS agar Salmonella sp Crece. Colonias claras con H2S SS agar Escherichia coli No crece. Thayer-Martin N. gonorrhoeae. Crece. Thayer-Martin Escherichia coli No crece. Sabouraud-Dextrosa agar Levaduras Crece Sabouraud-Dextrosa agar Dermatofitos Crece Sabouraud-Dextrosa agar Staphylococcus Crece Mycosel agar Levaduras Crece Tioglicolato Flora mixta Crece 3. Control de calidad de reactivos Un elemento fundamental en el trabajo diario del laboratorio, lo constituyen los reactivos, tanto comerciales como de preparación doméstica, que son utilizados en la caracterización de microorganismos. Estos reactivos merecen una especial atención, toda vez que fallas en su funcionamiento, pueden generar en identificaciones equivocadas. (Caballero, 2008) 32 Por ello, se recomienda correr controles diarios con las bacterias tipo y seguir estrictamente las indicaciones en cuanto almacenamiento de los reactivos, metodología de la prueba y tiempo de lectura. (Caballero, 2008) Es recomendable que los reactivos comerciales sean examinados inmediatamente cuando se abre un nuevo lote o vial y llevar un registro de su funcionamiento. (Caballero, 2008) Reactivo, organismo control y reacción esperada. (Caballero, 2008) Coagulasa Staphylococcus aureus Coágulo. Coagulasa positiva Coagulasa Staphylococcus epidermidis Inerte. Coagulasa negativa Oxidasa Pseudomona aeruginosa Color morado. Oxidasa positiva Oxidasa Escherichia coli Inerte. Oxidasa negativa Catalasa Staphylococcus sp Burbujas. Catalasa positiva Catalasa Streptococcus sp Inerte. Catalasa negativa Optoquina Streptococcus pneumoniae Halo de inhibición > o = 12 mm Ehrlich. Escherichia coli. Anillo rojo. Indol positivo Ehrlich Klebsiella pneumoniae Incoloro. Indol negativo 4. Control de calidad de los colorantes La clasificación correcta de las bacterias de acuerdo con las reacciones bioquímicas, dependen de la pureza, reactividad y estabilidad de los reactivos. La concentración de las soluciones por efecto de la evaporación de los solventes o las variaciones introducidas en los métodos recomendados, puede afectar los resultados de modo adverso. Este es el caso de las tinciones para diferenciar bacterias por su reacción al Gram y la morfología bacteriana, tintes para cápsulas, esporas, etc. (Caballero, 2008) 33 El control de calidad de estos tintes debe realizarse primero con cada nuevo lote preparado; luego basta con un control cada semana para mantener un grado de seguridad apropiado en su uso. (Caballero, 2008) En el caso de la tinción de Gram, sin lugar a dudas una de las herramientas más importantes del microbiólogo, se recomienda tener especial cuidado con la mezcla de alcohol-acetona para decolorar la placa. Posiblemente este reactivo es el que produce mayores problemas ya sea por decoloración excesiva o por débil decoloración de los microorganismos. Es también la etapa de la tinción de Gram en la que el tiempo de exposición es más determinante. (Caballero, 2008) Para facilitar el control de los tintes, se recomienda preparar placas con microorganismos aislados en el trabajo rutinario, utilizar cepas frescas, teniendo en cuenta aquellos que pudieran ser más útiles según la tinción a evaluar. (Caballero, 2008) Tinción, organismo control y reacción esperada (Caballero, 2008) Gram Staphylococcus sp Color morado. Gram-Positivo. Gram Escherichia coli Color rosado. Gram-Negativo. Gram Mezcla de ambos Mezcla de ambas colores. Zielh-Neelsen. Mycobacterium sp Color rosado. BAAR positivo Zielh-Neelsen Escherichia coli Color azul. BAAR negativas. Algunas causas de error durante la tinción: (Caballero, 2008) • El cristal violeta tiende a hacer precipitación, lo cual puede ser causa de observación de estructuras ficticias en el frotis. Si se observa precipitación, proceda a filtrar el tinte. 34 • La evaporación puede ser causa de mal funcionamiento de los tintes. • Las láminas que no han sido previamente limpiadas o con restos de grasa, pueden ser causa de mala fijación y tinción de la muestra. • Sobrecalentamiento de la lámina durante la fijación. El exceso de calor provoca un daño físico en la pared celular de las bacterias que puede afectar la retención de los colorantes. • Lavado muy fuerte de la lámina durante la tinción. • Proporción no adecuada de los componentes de la tinción. • Algunos tintes como safranina y fucsina básica pueden contaminarse. Si se sospecha esto, cultive 1 ml en Tioglicolato, o descarte el tinte. • La tinción de Zielh-Neelsen tiene sus limitaciones en cuanto a no ser específica para micobacterias y su baja sensibilidad, ya que el nivel de detección es de 5,000 a 10,000 bacilos por mililitro de esputo. Esto debe ser tenido en cuenta al evaluar una lámina. Una cepa control positiva, debe ser teñida cada vez que un nuevo lote de tintes para Zielh-Neelsen es preparado y cuando se reciba un nuevo pedido de tintes y reactivos. Se puede utilizar la cepa de Mycobacterium tuberculosis ATCC 25177 como control positivo. 5. Control de calidad de antisueros El mundo de la microbiología ha sido inundado cada vez más por productos comerciales, hechos con el objetivo de detectar agentes etiológicos de enfermedades, en el menor tiempo posible, con el mayor grado de especificidad, sensibilidad y algunos de ellos, con la intención de eliminar el cultivo bacteriano como única forma diagnóstica. Estos sistemas actúan algunos con solo la muestra del paciente y otros requieren de la cepa aislada o detectan sus metabolitos. Estos sistemas se han convertido en un arma imprescindible para el microbiólogo y en muchos casos dan confianza en la seguridad del diagnóstico y en otras se utilizan en la detección de microorganismos difíciles de cultivar. (Caballero, 2008) 35 Estos productos para la detección directa del espécimen o la cepa bacteriana, son considerados exámenes bacterianos y no test serológicos. En forma general estos kit deben ser probados cada vez que se recibe un nuevo lote y cada vez que se utilicen, se le deben correr sus controles positivo y negativo que vienen con cada kit. (Caballero, 2008) Consideraciones generales en el uso de antisueros: (Caballero, 2008) • Los sistemas son para uso exclusivo de diagnóstico in vitro. • Conservar todos los reactivos en refrigeración. • Anotar la fecha en que se abre el kit. • No congelar los reactivos. • No utilizar los reactivos si se sospecha deterioro de los mismos, tales como si se observa cambio de color, autoaglutinación en el envase, no producen la reacción esperada con los controles respectivos, reactivos contaminados o con signos de evaporación. • El personal de laboratorio calificado, debe utilizar las técnicas asépticas y las precauciones habituales para protegerse de los agentes infecciosos. • Nunca pipetear con la boca las muestras y/o los reactivos. • No utilizar reactivos de lotes diferentes. • No utilizar los reactivos después de la fecha de caducidad. • Después de sacar los reactivos de la refrigeradora, dejarlos a temperatura ambiente antes de utilizar. • Todos los productos inoculados deben ser considerados como potencialmente infecciosos. • No volver a utilizar las tarjetas desechables, después de haber sido utilizadas. • Algunas pruebas deben estar precedidas por su apropiado cultivo, aislamiento y pruebas bioquímicas preliminares, antes de realizar métodos serológicos y una identificación final. 36 • Al terminar la prueba, todo el material sucio y productos inoculados deben ser sometidos a esterilización por autoclave, incinerada o sumergida en un desinfectante germicida adecuado, antes de su eliminación. • La interpretación de los resultados debe ser hecha por personal calificado, que tendrá en cuenta el contexto clínico, el origen de la muestra, los aspectos macro y microscópico y su experiencia. 6. Control de calidad de la prueba de sensibilidad a los antibióticos mediante disco El método de difusión simple en agar es sin lugar a dudas el sistema de mayor uso para la realización de la sensibilidad bacteriana. Hay que tener en cuenta el gran valor de esta prueba en la detección temprana de multiresistencia, escogencia y valoración de un antibiótico frente a un microorganismo patógeno, protección de infección, estudios epidemiológicos, etc. (Caballero, 2008) La prueba de sensibilidad a los antibióticos consta de varios elementos que deben ser tenidos en cuenta: el medio de cultivo, el inóculo, la incubación, la lectura, la interpretación y el reporte. (Caballero, 2008) a. Control de calidad del medio de cultivo: (Caballero, 2008) • Utilizar agar de Mueller-Hinton. • La calidad del agua es determinante, ya que la misma debe estar libre de iones metálicos. Las variaciones de cationes divalentes, principalmente calcio y magnesio, afectará los resultados con aminoglicósidos, tetraciclina y colistina, cuando se prueban ante cepas de Pseudomonas aeruginosa. Un contenido excesivo en catión, reducirá la zona de inhibición, mientras que un escaso contenido en catión, puede dar un inaceptable aumento en el tamaño de la zona. 37 • Servir en platos Petri grandes de 150 x 15 mm preferiblemente o 100 x 15 mm, con una profundidad de 4 a 5 mm • Aproximadamente se utilizan 25 cc para platos de 100 mm y 60 cc para platos de 150 mm. • Volúmenes mayores de medio provocan disminución en el tamaño del halo de inhibición, y volúmenes menores, halos más pequeños. • Se deben seguir las normas generales establecidas para el almacenamiento del medio de cultivo. • Los platos Petri deben ser colocados en la incubadora para secarlos de los restos de agua producto de la condensación, antes de ser utilizados para no diluir el inóculo bacteriano. b. Control de calidad de los discos de sensibilidad Las metas de un programa de control de calidad van destinadas a monitorear, la precisión y exactitud del procedimiento de la prueba de susceptibilidad, el comportamiento de los reactivos utilizados en la prueba y la actuación de las personas que llevan a cabo las pruebas y sus resultados. (Caballero, 2008) • Los discos deben ser almacenados a un temperatura entre –20 y +8°C. Algunos discos, especialmente los de antibióticos ß-lactámicos deben guardarse congelados a -20°C. Solo los viales en uso deben mantenerse a temperatura de refrigeración. • Al sacarlos de la refrigeradora para su uso, espere a que los viales alcancen la temperatura ambiente por 1 a 2 horas. • Siempre utilice primero los viales con fecha de caducidad más próxima. • Siempre que un cartucho ha sido extraído del paquete, debe guardarse en un desecador que cierre perfectamente. 38 • Cuando se utilice el aparato dispensador que contiene los discos deberá mantenerse siempre refrigerado. • Los discos son colocados en el medio a una distancia de más de 24 mm del centro de uno al centro del otro. En todo caso no colocar más de 12 discos en una placa de 150 mm, ni más de 5 discos sobre la placa de 100 mm. • Procurar no colocar discos de antibióticos bactericidas (Ej. penicilina, cefalosporinas, aminoglicósidos, vancomicina) al lado de antibióticos bacteriostáticos (Ej. cloranfenicol, tetraciclina, sulfonamidas) para evitar el antagonismo antibiótico. • Colocar las placas en la incubadora dentro de los 15 primeros minutos después de su aplicación. • Para verificar el estado de los discos de sensibilidad, utilice cepas control ATCC, las cuales son seleccionadas por su estabilidad genética y por su utilidad en el método utilizado. Estas cepas se corren como una muestra más y se correlaciona el tamaño de los halos de inhibición con las medidas expresadas en los Manuales Clinical and Laboratory Standards Institute (CLSI, 2002). Entre las cepas ATCC (American Type Culture Collection) recomendadas están: Streptococcus pneumoniae ATCC 49619 Haemophilus influenzae ATCC 49247 y 49766 Neisseria gonorrhoeae ATCC 49226 Escherichia coli ATCC 25922 y 35218 La Escherichia coli 35218 como organismo de control para combinaciones con inhibidor de betalactamasa, como aquellos que contienen ácido clavulánico, sulbactam o tazobactam. Staphylococcus aureus ATCC 25923 y 29213 39 Pseudomona aeruginosa ATCC 27853 Enterococcus faecalis ATCC 29212 (Para ser utilizado con discos de alto contenido de Aminoglicósidos). c. Habituales causas de error en la prueba con disco: (Caballero, 2008) • Error administrativo en la transcripción de los datos del control de calidad. • Lectura errónea al medir el diámetro de la zona. • Contaminación u otros cambios en la cepa control. • Suspensión del inóculo demasiado fuerte o demasiado débil. • Incorrecta temperatura, tiempo o atmósfera de incubación. • Pérdida de la potencia del disco durante su transporte, su manejo o su almacenaje en el laboratorio. d. Control de calidad de la lectura e interpretación Cuando se va a determinar la sensibilidad del S. pneumoniae a la penicilina, utilizar un disco de oxacilina de 1 µg. Las cepas de S. pneumoniae con zonas de oxacilina de >/- a 20 mm son susceptibles a penicilina (CIM </- 0.06 µg/ml). (Caballero, 2008) Se recomienda utilizar un disco de oxacilina de 1 µg para probar resistencia a oxacilina y meticilina de los Staphylococcus. Esto se debe a que la oxacilina es más resistente a la degradación durante el almacenaje y porque es más probable que detecte a las cepas heteroresistentes de Staphylococcus. (Caballero, 2008) Las pruebas para detectar Staphylococcus Meticilina Resistentes (MRSA), deben incubarse a 35° C por 24 horas exactas. Los Estafilococos meticilina resistentes deberán informarse como resistentes a todos los cefems y otros betalactámicos, así como ampicilina/ácido clavulánico, ampicilina/sulbactam, ticarcilina/ácido clavulánico, piperacicilina/tazobactam e imipenem, resultados in vitro con dichos agentes. (Caballero, 2008) independiente de los 40 Los Enterococos pueden ser resistentes a penicilina y a ampicilina debido al desarrollo de poca afinidad de las proteínas fijadoras de penicilina (PBP’s) o a la producción de betalactamasa. Las pruebas de difusión en disco pueden detectar con exactitud los aislamientos que poseen alteradas las PBP’s, pero no detectarán con fiabilidad las cepas productoras de betalactamasa. Estas últimas han de detectarse con pruebas directas de betalactamasa (Ej. cefinasa).Las placas han de leerse con luz transmitida para visualizar cualquier pequeña colonia dentro del halo, que haría la cepa resistente. (Caballero, 2008) Todo caso de Estafilococo resistente a la vancomicina, debe ser confirmado, enviado a un laboratorio de referencia e informar a las Autoridades de Salud Pública. (Caballero, 2008) Cuando se trata de sulfonamidas, los microorganismos deben desarrollarse por varias generaciones antes de que ocurra inhibición, por lo que se hace caso omiso del crecimiento leve, al igual que de un vestigio de proliferación dentro del halo de inhibición. (Caballero, 2008) Si se observan colonias dentro de un halo de inhibición, deberá confirmarse la pureza de la cepa y repetir la prueba. (Caballero, 2008) La difusión (" swarming ") de los Proteus sp no es inhibida por todos los antibióticos, por lo que no se tiene en cuenta. (Caballero, 2008) Ocasionalmente se pueden observar varias colonias esparcidas por una zona de inhibición. Este fenómeno es constante para la Serratia sp y la polimixina. Las colonias se considerarán significativas y la cepa resistente. (Caballero, 2008) Solo es necesario probar una tetraciclina y sus resultados son equivalentes a la tetraciclina, minociclina, doxiciclina. (Caballero, 2008) Los resultados obtenidos con al polimixina, pueden aplicarse a la colimicina. Su halo es pequeño debido a su pobre difusión en agar. (Caballero, 2008) 41 Se ha informado que algunas cepas de Providencia sp dan resultados de sensibilidad falsos con discos de cefprozil, las cepas de este género no deben analizarse ni informarse con este disco. (Caballero, 2008) Los Staphylococcus resistentes a la meticilina, oxacilina o nafcilina, también pueden ser informados como resistentes a la penicilina, cefalosporinas, carbapenem y combinaciones de inhibidores de betalactamasa, a pesar de su aparente sensibilidad in vitro, lo cual no se refleja in vivo. (Caballero, 2008) La cefalotina puede utilizarse para representar cefalotina, Cefradina, cefaclor y cefadroxil. (Caballero, 2008) Los datos de sensibilidad al ácido nalidíxico, nitrofurantoina, norfloxacina, sulfonamidas y trimethoprim, se aplican solamente a cepas aisladas de infecciones urinarias. (Caballero, 2008) El disco de sulfisoxazol puede ser usado para representar cualquiera de las sulfonamidas disponibles. (Caballero, 2008) En cepas de Salmonella y Shigella, solo ampicilina, una quinolona y trimethoprim/sulfametoxazol deben ser probados e informados de rutina en heces. Además el cloranfenicol y una cefalosporina de tercera generación deben ser probados e informados en cepas de Salmonella sp extraintestinal. (Caballero, 2008) En cepas de Salmonella sp y Shigella sp, los aminoglicósidos y las cefalosporinas de primera y segunda generación, pueden aparecer como activos in vitro, pero no son efectivos clínicamente y no deben ser informados como susceptibles. (Caballero, 2008) La prueba de la betalactamasa predice la resistencia a la penicilina, ampicilina y amoxicilina. (Caballero, 2008) 42 Las cefalosporinas pueden aparecer activas in vitro contra Listeria sp, pero no son efectivas clínicamente y no deben ser informadas como susceptibles. (Caballero, 2008) Los Enterococos sp las cefalosporinas, los aminoglicósidos (excepto por resistencia de nivel alto), trimethoprim/sulfametoxazole y la clindamycina, pueden aparecer activos in vitro, pero no son efectivos clínicamente y estas cepas no deben informarse como susceptibles. (Caballero, 2008) La susceptibilidad y resistencia a azitromicina, claritromicina y diritromicina puede ser interferida por la prueba de eritromicina. (Caballero, 2008) Solo los resultados de las pruebas de ampicilina, una cefalosporina de tercera generación, el cloranfenicol y meropenem deben ser informados de rutina en todas las cepas aisladas de Haemophilus influenzae aisladas de sangre y LCR de pacientes con infecciones severas. (Caballero, 2008) Los resultados de las pruebas de susceptibilidad con penicilina, cefotaxime o ceftriaxone, meropenem y vancomicina, deben ser informados de rutina en cepas de Streptococcus pneumoniae aisladas de sangre y LCR de pacientes con infecciones severas como meningitis y bacteremia. (Caballero, 2008) e. Verificación de antibiogramas atípicos: (Caballero, 2008) • Examinar primero por errores de trascripción. • Reexaminar el plato de sensibilidad. • Evaluar reportes previos del paciente para observar su patrón de sensibilidad anterior. • Repetir los test de identificación y sensibilidad a los antibióticos. f. Condiciones sugeridas que requieren verificación del resultado de sensibilidad a los antibióticos: (Caballero, 2008) • Staphylococcus aureus resistente a oxacilina. 43 • Streptococcus pneumoniae resistente a penicilina. • Cefalosporinas de amplio espectro (cefotaxime, ceftriaxone) resistente a Streptococcus pneumoniae. • Streptococcus viridans penicilina resistente o intermedio, aislados de áreas estériles del cuerpo. • Staphylococcus o Enterococcus resistentes a la penicilina o intermedio. • Enterococcus con altos niveles de resistencia a la gentamicina aislados de áreas estériles del cuerpo. • Klebsiella sp o Escherichia coli con potencial espectro de betalactamasa. (Ej. resistente a ceftazidime). • Bacilos Gram negativos no fastidiosos resistentes a gentamicinatobramicina-amikacina. • Stenotrophomonas maltophilia resistente a trimethoprim-sulfametoxazole. • Haemophilus influenzae ampicilina resistente y betalactamasa negativa. • Un aislamiento para el cual el antibiograma es atípico para la especie. • Ampicilina y/o cefalotina susceptible para Enterobacter sp, citrobacter freundii, Serratia marcescen y Pseudomonas aeruginosa. • Klebsiella sp sensible a ampicilina. • Bacilos Gram negativos Imipenem resistentes o intermedio, excepto Stenotrophomonas maltophilia. • Bacilos Gram negativos ciprofloxacina resistente, excepto Stenotrophomonas maltophilia o Burcaholderia cepacia. 7. Control de calidad de la sensibilidad a los antibióticos en los sistemas computarizados Los laboratorios de microbiología modernos tienen a su alcance una creciente gama de sistemas computarizados para la identificación de los microorganismos y su susceptibilidad a los antibióticos. Algunos de estos sistemas traen consigo programas de computadora para ayudar a evaluar el control de calidad de los 44 mismos. En algunos casos, la computadora hace un control periódico de su funcionamiento mediante comandos u órdenes preestablecidas. (Caballero, 2008) El Sistema Vitek utiliza una determinación turbidimétrica de la rapidez de crecimiento del microorganismo, en presencia de agentes antimicrobianos para obtener un análisis de regresión lineal y posteriormente determinar un algoritmo derivado de la concentración inhibitoria mínima ( CIM ). (Caballero, 2008) Al hacer el control de calidad de las tarjetas de sensibilidad a los antibióticos, se recomienda utilizar cepas ATCC con CIM conocidas. Estas pruebas se pueden realizar una vez al mes durante 10 días seguidos, en los cuales se aceptan no más de 2 valores de CIM para cada combinación de antibiótico/organismo fuera del rango establecido. (Caballero, 2008) Si se diera el caso se deben correr controles de calidad con cepas ATCC durante 30 días consecutivos, en los cuales no se aceptan más de 3 valores fuera de rango, si los hay se debe llamar al departamento de servicio técnico para el chequeo correspondiente. (Caballero, 2008) Para realizar los controles se recomiendan las siguientes cepas ATCC para las tarjetas respectivas: (Caballero, 2008) TARJETA CEPAS ATCC GNS Escherichia coli ATCC 25922 / Pseudomonas aeruginosa ATCC 27853 Enterococcus faecalis ATCC 29212 GNS-PA Escherichia coli ATCC 25922 / Pseudomonas aeruginosa ATCC 27853 TARJETA CEPAS ATCC GNS-GD Escherichia coli ATCC 25922 / Pseudomonas aeruginosa ATCC 27853 Escherichia coli ATCC 35218 / Enterococcus faecalis ATCC 29212 GNS-OP Escherichia coli ATCC 25922 / Pseudomonas aeruginosa ATCC 27853 45 E. coli ATCC 35218 / Enterococcus faecalis ATCC 29212 GPS-SA Enterococcus faecalis ATCC 29212 / Staphylococcus aureus ATCC 29213 Escherichia coli ATCC 35218 GPS-TA Enterococcus faecalis ATCC 29212 / Staphylococcus aureus ATCC 29213 Consideraciones generales Se debe tener especial cuidado en la preparación del inóculo. Fallas en su preparación, tienen efecto sobre el funcionamiento de todo el instrumento. (Caballero, 2008) Siempre tener presente que el sistema no puede examinar todos los grupos relevantes de bacterias. (Caballero, 2008) El uso de colonias absolutamente aisladas es clave en el aprovechamiento de los sistemas computarizados. (Caballero, 2008) Algunos de los organismos sugeridos por el fabricante para control de calidad, podrían no detectar deterioro en el instrumento o la calidad de los reactivos. (Caballero, 2008) Es relevante utilizar métodos alternos de sensibilidad a los antibióticos en aquellos casos en que la literatura que acompaña las tarjetas indique que el sistema falla en detectar resistencia. (Caballero, 2008) Se han reportado casos de falsa sensibilidad o resistencia, particularmente debido al lector del instrumento o a un corto periodo de incubación durante la prueba de sensibilidad. Un periodo de 3.5 a 6 horas podría no ser adecuado para expresar todos los mecanismos de resistencia de las bacterias. (Caballero, 2008) 46 Tal es el caso de algunos bacilos Gram negativos que inducen resistencia mediada por ß-lactamasa a algunos antimicrobianos enzimáticamente lábiles a la ß-lactamasa, como ocurre con el Citrobacter freundii, Enterobacter sp, Serratia sp, Morganella morganii, Providencia sp y Pseudomonas aeruginosa. (Caballero, 2008) Se ha observado una falsa resistencia a aztreonam, especialmente por Proteus y Morganella sp por problemas de detección fotométrica del crecimiento. (Caballero, 2008) Se han reportado falsa resistencia a imipenem para varias especies en periodos largos y cortos de incubación. Esto no es común y se debe a la degradación del antibiótico o la concentración de Zinc en el medio. (Caballero, 2008) Un bajo o moderado nivel de resistencia a la vancomicina frente a Enterococcus sp se ha detectado, especialmente del tipo VanB, ya que podría no ser detectado en periodos cortos de incubación. (Caballero, 2008) Se han observado problemas en la detección de resistencia a altos niveles de gentamicina o estreptomicina frente a Enterococcus sp en incubaciones largas y cortas. (Caballero, 2008) Tener presente en colocar las marcas externas en la tarjeta, antes de meterla a la incubadora/lector. (Caballero, 2008) No deje pasar más de 15 minutos después de preparar el inóculo, para llenar las tarjetas y colocarla en la incubadora. (Caballero, 2008) Chequear la solución salina por esterilidad. Para ello inocule en caldo de cultivo e incube a 35°C por 24 horas. (Caballero, 2008) Con cada lote de preparación de inóculo, estandarizar primero el colorímetro. (Caballero, 2008) 47 Haga que el departamento de servicio técnico de Vitek revise periódicamente el lector del aparato para calibrarlo. (Caballero, 2008) Lleve un récord de cualquier discrepancia en la identificación de cepas estándar de control. Igualmente el tipo de tarjeta, lote, fecha de expiración, etc. (Caballero, 2008) 8. Control de calidad de equipos y materiales de trabajo Todos los instrumentos utilizados en el laboratorio clínico, deben estar amparados por un programa de control de calidad y de mantenimiento preventivo, basados en las instrucciones del fabricante y los procedimientos establecidos. (Caballero, 2008) a) Incubadoras: • Controlar diariamente la temperatura de las incubadoras, antes de sacar los platos y anotar el resultado en una hoja control. • Observar el termorregulador por cualquier alteración en su posición preestablecida. • Colocar las muestras, platos y tubos, en una posición segura. • Colocar un papel de filtro humedecido con agua en el fondo de la incubadora, para mantener la humedad requerida. • Medir el nivel de gas en las incubadoras de CO2 diariamente. • Notificar al jefe de sección cuando una incubadora falla en mantener el rango de temperatura aceptable. • Revisar macroscópicamente los platos Petri para observar desecación. • En incubadoras de CO2, se puede colocar un cultivo de N. Gonorrhoeae ATCC 43069, subcultivándola cada día, para observar su óptimo crecimiento, ya que es un microorganismo que necesariamente requiere CO2 para crecer. • Limpiar mensualmente y llevar un récord de mantenimiento preventivo. 48 b) Autoclaves: • Examinar la temperatura y la presión. • Utilizar indicadores de esterilización. • Registrar el uso, la fecha, las temperaturas y la presión. • Chequear el nivel de agua. • Usar indicadores biológicos de esterilidad. • Chequear la válvula de seguridad. • Limpiar el interior y exterior. • Limpiar la pantalla de temperatura • Limpiar el drenaje y los sellos c) Cámaras de seguridad: • Apagar la lámpara Ultravioleta antes de comenzar a trabajar. • Encender el flujo laminar 15 minutos antes de utilizar. • Observar que no se obstruya el flujo de aire. • Limpiar dentro de la cabina si hubo derrames con un desinfectante apropiado, manteniendo apagada la cabina. • Evitar el uso de mecheros de flama dentro de la cabina. • Llevar un control de la medida del flujo de aire. • Llevar un control de la calibración del flujo de aire. • Llevar un control del remplazo de los filtros. • Comprobar los sistemas de alarma de funcionamiento. • Cultivar semanalmente la superficie interior de la mesa de trabajo de la cabina, para detectar contaminación. • Desinfectar la cabina antes y después de utilizarla. • No utilizar las cabinas biológicas para hacer mezclas de sustancias químicas y viceversa. • Evitar la entrada brusca de aire y el uso innecesario de las puertas del área, cuando esté trabajando en la cabina. 49 d) Incinerador: • En condiciones normales el incinerador logra la temperatura óptima de esterilización (815°C) 10 minutos después de haber sido encendido. • Bastan 5 segundos para lograr la destrucción de bacterias, hongos y micobacterias. • No es necesario observar incandescencia en el asa para lograr la esterilización. • Inspeccionar la cerámica del incinerador por rajaduras. • Alejar el incinerador de elementos que puedan incendiarse por el calor generado. e) Microscopios: • Apagar la fuente de luz. • Colocar un cobertor contra el polvo. • Limpiar los oculares, los objetivos, el condensador y el diafragma con un líquido de limpieza de lentes. • Limpiar y ajustar el sistema óptico. • Limpiar y ajustar el sistema lumínico. • Limpiar y lubricar el sistema mecánico. f) Sistema Vitek: El control de calidad, es un subsistema del Vitek, que examina la seguridad de sus tarjetas. El control de calidad opera similarmente a la evaluación de exámenes clínicos. El test clínico identifica el organismo, el examen de control de calidad valida el test. • El programa de control de calidad evalúa el kit del Vitek y los organismos de control de calidad listados en el paquete. 50 • Las tarjetas de control de calidad utilizan 7 dígitos, compuestos de 2 partes: los primeros 6 dígitos identifican el tipo de tarjeta y un organismo ATCC y el séptimo dígito identifica el número de lote. • Cada número predefinido de referencia en el control de calidad significa un tipo de test y un organismo. Un número de referencia de control de calidad es más que un número de identificación de tarjeta. Cada uno de estos números significa la paridad de un tipo de tarjeta con un organismo. Así por ejemplo, el número de referencia 900101 corresponde al Proteus mirabilis (ATCC 7002) y el 900102 a la Pseudomonas aeruginosa (ATCC 27853). • Un campo para control de calidad demográfico está accesible para la información del lote de la tarjeta. • El control de calidad provee su propio set especial de reporte. • El flujo de operación del control de calidad es idéntico al flujo de una muestra clínica. • Los resultados de control de calidad se transfieren de la incubadora/lector a la base de datos, si la opción de transferir la tarjeta finalizada está activa. • Todos los resultados se mueven a través del manejador de desviaciones del control de calidad, el cual compara los resultados actuales con los conocidos. • El programa de control de calidad Vitek permite ver los resultados del control en pantalla, los cuales aparecen en 3 diferentes formatos: resultado de la identificación, resultado de la sensibilidad a los antibióticos y resultado de la identificación de urocultivos. La pantalla nos indica: la identificación del organismo esperado (ATCC), el resultado de la identificación actual, el lote de la tarjeta, la fecha del test, la fecha de expiración de la tarjeta, las reacciones bioquímicas esperadas y de la prueba actual. Cada uno de los test bioquímicos son señalados tanto en lo esperado como en el resultado actual, y se genera una lista de los test que se han desviado del resultado esperado, igual patrón al anterior muestra la tarjeta de sensibilidad a los antibióticos y todos los resultados de control de calidad pueden ser imprimidos para guardar en un libro récord. 51 • La base de datos de los equipos de identificación computarizados, deben ser frecuentemente revisados para actualizarlo en lo referente a los cambios taxonómicos que ocurran. Igualmente se debe prestar atención a la información proveniente de la casa manufacturera acerca del producto y las investigaciones que con el equipo aparezcan en la literatura especializada. • El sistema Vitek también cuenta con un programa que ayuda a evaluar los resultados, minimizando los errores de interpretación. Se trata del bioMérieux Vitek Expert System, un programa que usa la lógica proposicional, es decir llega a ofrece ciertas conclusiones basado en la información formulada. • El programa puede detectar: identificaciones que son inconsistente con los resultados de sensibilidad, errores técnicos, fenotipos raros o improbables, expresiones de resistencia incompleta y resistencia cruzada. • El sistema también permite la adición de reglas (CAR) en la que se establecen parámetros que debe cumplir el reporte antes de su impresión. 9. Capacitación del Personal El personal es el factor más importante en la calidad del trabajo en el laboratorio de microbiología. Este personal debe tener una dedicación y actitud positiva hacia el trabajo, capacidad académica, actualización constante y contar con los elementos indispensables para su labor. (Caballero, 2008) a. Evaluación del personal La competencia del personal de microbiología, debe ser certificada por la revisión de su hoja de trabajo, la interpretación de muestras desconocidas, su habilidad técnica y exámenes escritos anuales. Se debe llevar un registro profesional acerca de su evaluación académica, reporte sobre su capacidad de trabajo, asistencia a programas de educación continuada, responsabilidad, asistencia, trabajos de 52 investigación, charlas, conferencias y su evaluación profesional anual. (Caballero, 2008) Todo nuevo empleado que se adicione a la plantilla de la sección, debe ser documentado, evaluado y certificado, incluyendo las fases pre-analíticas, analíticas y post-analíticas de funcionamiento del laboratorio. (Caballero, 2008) b. Programa de docencia Un elemento fundamental en el mantenimiento apropiado de la competencia del personal es el programa de educación continuada. Este programa mantiene al personal informado en los avances en la detección e identificación de agentes etiológicos, nuevos test, equipos, cambios en la taxonomía bacteriana y la evaluación correcta de las pruebas de sensibilidad a los antibióticos. (Caballero, 2008) Este programa puede incluir charlas, mesas redondas, lecturas de artículos de interés, discusión de casos clínicos, evaluación de nuevos test o equipos, revisión de la literatura sobre temas específicos, trabajos de investigación, etc. Se debe llevar un control sobre la participación individual del personal en el programa, su asistencia y actividad, lo cual formará parte de su evaluación anual. (Caballero, 2008) Finalmente uno de los factores más importantes a tomar en cuenta en el desarrollo de un sistema de calidad, es el resultado final de la evaluación de un espécimen clínico, luego de cumplir con todas las etapas de investigación, es el informe final que implica una identificación etiológica, si la hubiera, y su correspondiente sensibilidad a los antibióticos. (Caballero, 2008) Para llegar a este resultado, el laboratorio de microbiología debe haber agotado todos los elementos diagnósticos de que dispone y hacer un juicio respecto a la posibilidad de que dicho informe represente el potencial agente infeccioso, 53 teniendo en cuenta los factores que están involucrados tales como el tipo de muestra, microorganismo aislado, edad del paciente, procedencia, informes previos, frotis directo y el patrón de comportamiento frente a los antibióticos, entre otros. (Caballero, 2008) En todo informe final debe prevalecer el concepto de rapidez y seguridad diagnóstica. Es recomendable y así está establecido en manuales foráneos, que los resultados sean evaluados antes de su envío por el jefe del laboratorio de microbiología o en su defecto por un supervisor con experiencia y capacidad demostrada, con el fin de minimizar potenciales errores, omisiones o interpretaciones del informe final, teniendo en cuenta el valor que este reporte tendrá en la evaluación, tratamiento y la salud del paciente. (Caballero, 2008) Es importante en esta etapa establecer los " Valores de Alerta " en microbiología, los cuales son aquellos resultados de mayor preponderancia, ya sea por el tipo de microorganismo involucrado o por su significado en el control de enfermedades de notificación obligatoria. (Caballero, 2008) 54 CAPÍTULO III MARCO METODOLÓGICO 55 CAPÍTULO III 3. Marco Metodológico 3.1 Tipo de estudio Existen varias clases de estudios para ubicar el tipo de investigación, estas clasificaciones no son excluyentes, más bien cada investigación contiene una combinación de elementos propios de las diferentes categorías. Según Barrantes Echavarría, en su libro “Investigación: un camino al conocimiento un enfoque cualitativo y cuantitativo”; el presente estudio es de carácter cuantitativo porque se fundamenta en los aspectos observables y susceptibles de cuantificar, por lo tanto, hace uso de técnicas de contar, de medir y de razonamiento abstracto que producen datos sólidos, repetibles y fiables. Utiliza la metodología empírico-analítica y se sirve de la estadística para el análisis de los datos, además según su profundidad u objetivo es descriptivo ya que estudia los fenómenos tal y como aparecen en el presente, en el momento de realizar la investigación ya que su objetivo central es la descripción de fenómenos y se sitúa en un primer nivel del conocimiento científico; utiliza la observación, estudios correlacionales y de desarrollo. 3.2 Área de Estudio El laboratorio clínico del Hospital Los Chiles, trabaja los siete días de la semana, las 24 horas del día, en tres turnos, distribuyéndose de la siguiente manera: en el primer turno laboran un microbiólogo 4, director del laboratorio clínico, dos microbiólogos 1, encargado de bacterias y banco de sangre respectivamente, un diplomado en microbiología, encargado de química clínica, dos técnicas 3 en ciencias médicas, que procesan las muestras de hematología, parasitología y 56 serología y dos técnicas 1 en ciencias médicas, responsables de la toma de muestra y lavado de material. En el segundo turno se cuenta con un Microbiólogo 2 encargado y un flebotomista y en el tercer turno únicamente con un Microbiólogo 2. Los fines de semanas se labora las 24 horas del día, para solventar la demanda de exámenes de los servicios de hospitalizados y urgencias, así como la atención del banco de sangre y la sección de bacteriología. La sección de bacteriología del laboratorio clínico del Hospital Los Chiles realiza diferentes procedimientos dentro de los cuales lo más frecuente son el procesamiento de muestras clínicas para cultivo, elaboración de medios de cultivo, diagnóstico, control y seguimiento de pacientes tuberculosos, manejo de desechos bioinfecciosos y realización de informes a las diferentes comisiones y de reportes de pacientes. 3.3 Objeto de Estudio Desarrollo de un sistema de garantía de calidad en la sección de bacteriología en el Hospital Los Chiles. 3.4 Población de estudio y muestra No existe población ni muestra por la naturaleza del estudio de investigación, esto porque el objetivo de la misma es implementar acciones para desarrollar un sistema de calidad y no valorar un grupo poblacional en particular para conocer su comportamiento. 3.5 Fuentes de Información 3.5.1 Fuentes primarias: a. Entrevistas al personal del laboratorio clínico del Hospital Los Chiles . b. Observaciones realizadas por los investigadores 57 3.5.2 Fuentes secundarias: Consulta bibliográfica de libros, documentos oficiales y revisiones de páginas de Internet, sobre sistemas de garantía de calidad. 3.6 Operalización de las variables Para poder desarrollar un sistema de garantía de la calidad en la sección de bacteriología en el Hospital Los Chiles, es necesario que se diseñe primero el sistema como tal, el cual debe incluir los equipos, los reactivos, las pruebas y la capacitación del personal. (Ver cuadro Nº1). Luego de lo anterior es fundamental determinar la factibilidad del sistema de garantía de calidad con relación a la infraestructura, los recursos materiales, humanos y económicos existentes y necesarios en la sección de bacteriología. (Ver cuadro Nº2). Una vez analizado los diferentes recursos citados, se implementa el sistema de garantía de la calidad, indicando las funciones, acciones y responsables. (Ver cuadro Nº3). Para conocer si el sistema de garantía de la calidad en la sección de bacteriología en el Hospital Los Chiles, está funcionando correctamente y cumpliendo con lo establecido en él, se debe hacer un cronograma de evaluación para los equipos, reactivos, pruebas y programas de capacitación. (Ver cuadro Nº4). 3.7 Diseño de técnicas e instrumentos Debido a que la investigación es de carácter cuantitativo y descriptivo se utilizarán como instrumentos de medición y recolección de datos: Observación: es la inspección y estudio realizado por el investigador, mediante el empleo de sus propios sentidos con o sin ayuda de aparatos técnicos, por lo tanto la observación se traduce en un registro visual de lo que ocurre en el mundo real. 58 Este instrumento será aplicado al momento de diseñar, desarrollar, ejecutar y evaluar el sistema de calidad. Entrevista: consiste en un diálogo entablado entre dos o más personas, la cual permite recabar información en forma verbal a través de preguntas entre el entrevistador y el entrevistado. La misma será aplicada a la Jefatura del Laboratorio para conocer su anuencia a la hora de desarrollar el sistema de calidad. Hoja de cotejo: es una matriz de doble entrada en la que se anotan en las filas los conceptos o aspectos que voy a observar y en las columnas la calificación que otorgo a esa observación. El instrumento se aplicará al momento de diseñar, desarrollar, ejecutar y evaluar el sistema de calidad. Cuestionario: es un conjunto de preguntas formuladas con base en una o más variables a medir, donde se utiliza un formulario impreso estandarizado de preguntas en el cual el participante contesta por sí mismo las preguntas. Este se utilizará en la etapa de desarrollo del sistema de calidad. Los instrumentos mencionados se utilizarán para la recolección confiable y válida de los datos necesarios para responder a los objetivos. Con los datos recopilados se va a construir una base de datos en Excel y posteriormente se van a organizar en tablas o cuadros estadísticos; además, se procederá a hacer representaciones gráficas, que permitan la fácil visualización de los resultados obtenidos. 59 Cuadro Nº 1.Diseño del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles Objetivo Variable Específico Diseñar un sistema de garantía de la calidad en la sección de bacteriología Definición Dimensión Conceptual Diseño Diseño: descripción hecha con palabras, delineación de un objeto, un edificio o un sistema, etc. Sistema de Garantía de Calidad para Equipos Definición Definición Definición Conceptual Operacional Instrumental Equipo: Utilizado para realizar los diferentes procesos y preparación de muestras. Disponibilidad instrumentos para evaluar el control de calidad. Hoja de Cotejo y Observación. Sistema de Garantía de Calidad para Reactivos Reactivos: sustancias químicas que se sabe que reacciona en forma específica. Se utilizan para detectar o sintetizar otra sustancia en una reacción química. Sistema de Garantía de Calidad para Pruebas Pruebas: cantidad pequeña de un conjunto que se destina para un examen o análisis Sistema de Garantía de Calidad para Capacitación Capacitación: actividades de educación en servicio, tanto teóricas como prácticas y que tienen como fin mantener al personal actualizado Disponibilidad de sustancias químicas necesarias para control de calidad. Contar con manual de procedimientos por prueba. Programa de educación continua tanto para profesionales como para técnicos. Hoja de Cotejo y Observación. Hoja de Cotejo y Observación. Hoja de Cotejo y Cuestionario. 60 Cuadro Nº2. Factibilidad del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles Objetivo Variable Específico Determinar la factibilidad de desarrollar un sistema de garantía de la calidad en la sección de bacteriología Definición Dimensión Conceptual Factibilidad Factibilidad: algo que se puede hacer Infraestructura Recurso Material. Recurso Humano Recurso Económico Definición Definición Definición Conceptual Operacional Instrumental Infraestructura: se refiere al espacio y distribución para llevar a cabo las diversas operaciones del MQC. Contar con espacio físico adecuado para el funcionamiento de la sección de bacteriología. Hoja de Cotejo y Observación. Recurso Material Son todas aquellas máquinas, instrumentos y reactivos necesarios para llevar a cabo las funciones básicas. Máquinas, instrumentos y reactivos necesarios para llevar a cabo el control de calidad Recurso Humano: Es el que desempeña un papel trascendental en cualquier tipo de actividad productiva y está calificado para llevar a cabo diferentes actividades Recurso Económico: conjunto de elementos monetarios disponibles para resolver una necesidad a cabo en una empresa Existe el recurso humano que cumpla con el nivel de capacitación requerido para laborar en bacteriología. Presupuesto requerido para implementar el sistema de control de calidad /Total de presupuesto asignado al laboratorio anualmente. Hoja de Cotejo y Observación. Hoja de Cotejo y Cuestionario Hoja de Cotejo y Cuestionario 61 Cuadro Nº3. Implementación del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles Objetivo Variable Específico Implementar un sistema de garantía de calidad para la sección de bacteriología Definición Dimensión Conceptual Implementación Implementación: poner en funcionamiento, aplicar métodos, medidas, etc., para llevar algo acabo. Definición Definición Definición Conceptual Operacional Instrumental Divulgación: dar a conocer el sistema de control de calidad Hoja de Cotejo y Cuestionario. Divulgación Divulgación: Acción de hacer del conocimiento a los demás de algo en particular. Pruebas Prueba: análisis médico. Ejecución Ejecución: que se puede hacer o realizar una obra. Capacitación Capacitación: Acción de capacitar, o sea hacer apto o habilitar algo o a alguien para una cosa. Prueba: Evidencia física y registros de las acciones que forman parte del sistema de control de calidad. Ejecución: poner en práctica el sistema de control de calidad Capacitación: actualizar al personal que labora en bacteriología. Hoja de Cotejo y Observación. Hoja de Cotejo y Cuestionario. Hoja de Cotejo y Cuestionario. 62 Cuadro Nº4. Evaluación del sistema de garantía de la calidad en la sección de bacteriología del Hospital Los Chiles Objetivo Variable Específico Evaluar el sistema de garantía de calidad implementado en la sección de bacteriología Evaluación Definición Dimensión Definición Definición Definición Conceptual Conceptual Operacional Instrumental Evaluación: actividad sistemática y continua, integrada dentro de un proceso que tiene como objeto proporcionar la máxima información para mejorar dicho proceso, reajustándolo a sus objetivos Equipo: Utilizado para realizar los diferentes procesos y preparación de muestras. Nº de equipos con registro de control de calidad /Total de equipos instalados. Hoja de Cotejo y Observación. Reactivos: sustancias químicas que se sabe que reaccionan en forma específica. Se utilizan para detectar o sintetizar otra sustancia en una reacción química Nº de reactivos con registro de control de calidad /Total de reactivos utilizados. Hoja de Cotejo y Observación. Contar con manual de procedimientos por prueba, validado y revisado periódicamente. Hoja de Cotejo y Observación. Nº de funcionarios capacitados /Total de funcionarios que trabajan en el laboratorio. Hoja de Cotejo y Observación. Equipos Reactivos Pruebas Capacitación Pruebas: cantidad pequeña de un conjunto que se destina para un examen o análisis Capacitación: actividades de educación en servicio, tanto teóricas como prácticas y que tienen como fin mantener al personal actualizado 63 CAPÍTULO IV ANÁLISIS DE LA INFORMACIÓN 64 CAPÍTULO IV 4. Análisis de la Información El laboratorio clínico del Hospital Los Chiles cuenta con once colaboradores, cinco microbiólogos y seis técnicos, tiene un horario de 24 horas los siete días de la semana y realiza giras a las comunidades con menos facilidades de acceso al hospital. Los departamentos de química clínica, bacteriología y hematología están automatizados. Dentro de las fortalezas del hospital se encontró, que a pesar de estar en una zona rural con una elevada población migrante, no existen listas de espera para realizarse exámenes de laboratorio, cuenta con cuatro médicos especialistas a saber, un anestesiólogo, un cirujano, un internista y un pediatra. Además, el apoyo de la red interinstitucional y del Ministerio de Salud permite la recepción de solicitudes de exámenes especiales. La asignación de una plaza de Microbiólogo Químico Clínico (MQC) para el departamento de bacteriología permitió tener un profesional exclusivo para esta sección. Sin embargo, se encontró como debilidades, escaso apoyo de transporte hacia el hospital de referencia más cercano, ubicado a unos 100 Km del Cantón de Los Chiles, insuficiente apoyo técnico y secretarial para el MQC y no existen programas de mantenimiento para los equipos que no están en contrato de licitación. A pesar de la vital importancia que tiene los sistemas de calidad en toda organización, por el tipo y nivel de complejidad del laboratorio clínico del Hospital Los Chiles, el estudio se concentró en cinco procesos de análisis bacteriológicos, a saber, urocultivos, coprocultivos, hemocultivos, secreción cérvico vaginal y baciloscopías, dicha escogencia se realizó con base en las estadísticas de producción para los años 2007 y 2008. ( Ver apéndice 6) 65 Producto de la importancia de los resultados obtenidos en la sección de bacteriología, se pretende desarrollar este sistema de calidad en función de la política de calidad general para el laboratorio clínico. La literatura recomienda que el desarrollo e implementación de un sistema de calidad, use como marco de referencia algún tipo de norma para el laboratorio clínico, sin embargo, hasta la fecha, la sección de bacteriología no cuenta con dicho sistema, por lo que para su inicialización se debe enfocar en aquellos aspectos de la norma que sean aplicables y realizables, según el recurso humano, financiero y material con el que cuenta cada lugar de trabajo. Como toda institución pública, el laboratorio clínico del Hospital Los Chiles tiene sus limitaciones para desarrollar un sistema de calidad, por lo tanto, este trabajo de investigación se basó en los puntos críticos factibles de ejecutar y evaluar, a saber: existencia de equipo, mobiliario, infraestructura, medios de cultivo, cepas ATCC, reactivos y tinciones. Para ello se utilizó la hoja de cotejo y el cuestionario, ambas aplicadas a los microbiólogos químicos clínicos que laboran en la sección de bacteriología y a la jefatura del laboratorio clínico del Hospital Los Chiles. Posterior a su aplicación, se procedió a hacer un consolidado de las respuestas para determinar cuáles eran los recursos físicos, materiales, económicos y humanos que se requerían en la sección para poder ejecutar y evaluar el sistema de garantía de calidad. Existencia de equipo, mobiliario e infraestructura en la sección de bacteriología del Hospital Los Chiles. Para poder implementar un sistema de garantía de la calidad en una organización, es preciso mantener una infraestructura adecuada que incluya edificios y espacios de trabajo cómodos, además, equipos para los procesos (hardware y software) y diferentes recursos materiales. (Gutiérrez, 2005) Como se pone de manifiesto en el apéndice Nº1, la sección de bacteriología del Hospital Los Chiles cuenta con equipo informático automatizado, con 66 refrigeradoras, autoclaves, incinerador, microscopio, anaqueles, armarios, pipetas calibradas, lámpara de luz ultravioleta, además, con un sistema de identificación bacteriana y sistema óptico de preparación de suspensiones bacterianas. Sin embargo, carece de pH metro, termómetros calibrados y cámara de flujo laminar. A pesar de que en el hospital existe un espacio físico destinado exclusivamente para la sección de bacteriología, el mismo es muy reducido, lo que provoca que en una misma mesa de trabajo se realice el procesamiento de las muestras y la validación de exámenes. Además, las funciones de autoclavado de medios de cultivo y disposición de desechos sólidos se ejecutan en la misma área. (apéndice Nº1). Existencia de medios de cultivo y cepas ATCC en la sección de bacteriología del Hospital Los Chiles. Con el fin de poder aislar e identificar un microorganismo de una muestra clínica, es necesario la utilización de diferentes medios de cultivo según sea la procedencia de la muestra (tracto urinario, tracto digestivo, tracto respiratorio inferior, entre otros). Por otro lado, para asegurarse que los medios de cultivo, reactivos y tinciones comprados en el laboratorio clínico para la sección de bacteriología, cumplan con las especificaciones técnicas indicadas en el producto se debe utilizar diferentes cepas de referencia ATCC. Se evidencia en el apéndice Nº2, que la sección de bacteriología cuenta con la mayoría de los medios de cultivo necesarios para procesar las muestras de rutina, pero carece de agar Chocolate y de Thayer Martin. Por otro lado posee cinco cepas de referencia ATCC, las cuales permiten verificar la especificidad y funcionabilidad de todos los medios de cultivos, reactivos y tinciones. 67 Existencia de reactivos y tinciones en la sección de bacteriología del Hospital Los Chiles. Si bien es cierto que la automatización de los laboratorios clínicos ha venido a aumentar la exactitud, la reproducibilidad y la precisión de los análisis clínicos, no hay que perder de vista que en la sección de bacteriología es fundamental la ejecución de diversas técnicas manuales utilizado reactivos y tinciones para identificar el microorganismo aislado de una muestra clínica. Del apéndice Nº3 se extrae, que la sección de bacteriología, dispone de las tinciones para poder clasificar los microorganismos aislados en gram positivos y gram negativos o bacilos alcohol ácido resistente, según sus características tintoriales. Además, cuenta con reactivos para conocer si los microorganismos son catalasa, indol, oxidasa o coagulasa positiva o negativa. Por último, tienen indicadores químicos y biológicos utilizados en el control de las autoclaves. Disponibilidad del personal del laboratorio clínico del Hospital Los Chiles para implementar y ejecutar el sistema de garantía de calidad en la sección de bacteriología del Hospital Los Chiles. De acuerdo con los cuestionarios aplicados al personal del Hospital Los Chiles, se determina que en la sección de bacteriología no existe un verdadero sistema de garantía de calidad y lo que se realiza son controles aislados. (Ver apéndice Nº4 y Nº5) La persona encargada de la sección de bacteriología, no ha presentado a la jefatura del laboratorio un sistema de garantía de calidad, por lo tanto el mismo no está incluido en el presupuesto del laboratorio. (Ver apéndice Nº4 y Nº5) Actualmente la sección de bacteriología no cuenta con el suficiente recurso humano, material, económico ni físico para implementar un sistema de garantía de la calidad. (Ver apéndice Nº 4 y Nº5) 68 CAPÍTULO V PROPUESTA DEL SISTEMA DE GARANTÍA DE LA CALIDAD 69 Propuesta de un sistema de garantía de calidad. Esta propuesta de sistema de garantía de calidad tiene cuatro grandes componentes; en primer lugar está el cliente externo, el cual corresponde a todos aquellos pacientes que reciben servicios de parte del laboratorio clínico y que proceden de los servicios ambulatorios del Área de Salud y del Hospital Los Chiles (hospitalizados, urgencias, consulta externa). En segundo lugar, se ubica el cliente interno, el cual va ser el proveedor de la materia prima para trabajar en el laboratorio, mediante la solicitud de análisis bacteriológicos. El tercer componente del sistema es el control interno de los equipos, reactivos, tintes, medios de cultivo, elaboración del reporte final y el programa de capacitación, para ello se brindará diferentes herramientas que tienen como fin verificar la funcionabilidad de la sección de bacteriología El microbiólogo químico clínico, encargado de la sección de bacteriología será el responsable de registrar y ejecutar todas aquellas actividades definidas previamente en el diseño del sistema de garantía de la calidad. Así como de dar alerta de cualquier desviación que se genere en el mismo y de implementar acciones correctivas en conjunto con la dirección del laboratorio, para ello tendrá hojas de registro en las cuales anotará el resultado obtenido del control de calidad junto a su nombre.(Ver apéndices 7-19) Otro elemento que se incluye en esta propuesta, es la evaluación del sistema mismo; la cual está integrada por auditorías internas, donde la jefatura del laboratorio será el responsable de tomar en cuenta los registros, anotaciones y observaciones originados del propio sistema de calidad, y también evaluará el cumplimientos de los programas de capacitación, entre otras cosas que se detallan en la propuesta misma. Además se tienen las evaluaciones externas de la calidad llevadas a cabo por organismos ajenos a la institución y por último un control cruzado que tiene como objetivo fiscalizar día a día las acciones concretas que se proponen en el sistema de calidad y su responsabilidad recae en un profesional externo a la sección de bacteriología.( Ver figura Nº1) 70 Sistema de Garantía de Calidad Auditoría Interna Usuario Interno SISTEMA DE GARANTÍA DE CALIDAD SECCIÓN DE BACTERIOLOGÍA LABORATORIO CLÍNICO HOSPITAL LOS CHILES Figura 1. Diagrama de flujo del Sistema de Garantía de Calidad, Hospital Los Chiles Evaluación Externa de la Calidad Tecnodiagnóstica Personal de INCIENSA y Evaluación Externa de la Calidad INCIENSA Elaboración de reporte final de análisis bacteriológicos Programa de Capacitación Evaluación Interna Tecnodiagnóstica Microbiólogo encargado de la sección de bacteriología Control de calidad de reactivos, medios de cultivo y colorantes Usuario Externo Personal de laboratorio Control de calidad de los equipos 71 CAPITULO V Propuesta del sistema de garantía de la calidad De manera detallada la propuesta de calidad está constituida en primera instancia por el diseño, el cual incluye el control de calidad de los equipos, de los reactivos, de las tinciones, de las muestras clínicas, el reporte de análisis y el plan de educación continua. Unido a lo anterior está la determinación de la factibilidad de la propuesta misma en cuanto a la disponibilidad de infraestructura, de recurso material, humano y económico. Como tercer punto se tiene la implementación del sistema de garantía de calidad, en el cual se proporcionan una serie de instrumentos y herramientas que tienen como objetivo poner en práctica y facilitar la ejecución del sistema, dentro de las cuales existen matrices para evaluar y registrar aspectos que tienen que ver con el desempeño de los equipos, de los reactivos, de las tinciones, de los antisueros, de los medios de cultivo, entre otros. (Ver apéndices 7-19) Por último se ubica la evaluación del sistema de garantía de calidad, el cual persigue que los procedimientos realizados en la sección de bacteriología entren en el ciclo de mejora continua. En los párrafos siguientes se detallan de manera puntual los objetivos de la propuesta del sistema de garantía de la calidad para la sección de bacteriología del Hospital Los Chiles. 72 5.1 Diseño del sistema de garantía de la calidad en la sección de bacteriología A. CONTROL DE CALIDAD DE EQUIPOS: Autoclave • Limpiar diariamente con hipoclorito de sodio al 1% las partes internas y externas de la autoclave. • Anotar en una bitácora el registro de uso de la autoclave con la fecha, la temperatura, el tiempo de esterilización, la presión y el nombre del operador. • Chequear el nivel de agua de la autoclave. • Utilizar tiras químicas indicadoras de temperatura de esterilización en cada carga. • Colocar indicadores biológicos de esterilidad en diferentes puntos de la carga. • Revisar la permeabilidad de la válvula de seguridad. • Limpiar el drenaje y los sellos. • Bitácora de mantenimiento preventivo y correctivo mensual. Microscopio • Limpiar diariamente con un paño húmedo las partes externas del microscopio. • Limpiar diariamente el lente ocular, los objetivos, el condensador y el diafragma con un líquido de limpieza para lentes. • Bitácora de mantenimiento preventivo y correctivo mensual. 73 • Sistema Vitek • Limpiar diariamente con un paño húmedo las superficies externas del analizador automatizado Vitek. • Cambiar diariamente el casete de actualización de base de datos. • Calibrar en cada corrida de muestra el colorímetro al 0% y al 100% de transmitancia. • Verificar la esterilidad de la solución de trabajo cada semana, colocando una muestra de la misma en un caldo de tioglicolato e incubarlo a 37° C por 48 horas. • Correr mensualmente dos cepas ATCC una de Escherichia coli (ATCC 25922) y Staphylococcus aureus (ATCC 29213) en sus correspondientes tarjetas de identificación y sensibilidad, verificando la concordancia con el suplidor del servicio. • Bitácora de mantenimiento preventivo y correctivo del analizador Vitek. Incubadora de 37 °C • Limpiar mensualmente con un hipoclorito de sodio al 1% las superficies externas e internas del incubador. • Registrar la temperatura del incubador dos veces al día. • Cambiar diariamente el contenedor de agua bidestilada. • Revisar macroscópicamente los platos Petri para observar desecación • Bitácora de mantenimiento preventivo y correctivo de la incubadora. Refrigeradora • Limpiar semanalmente las superficies externas de la refrigeradora con un paño húmedo. • Limpiar mensualmente las superficies internas de la refrigeradora con paño húmedo. • Controlar la temperatura diariamente dos veces. • Abrir la puerta de la refrigeradora únicamente dos veces al día 74 • Descongelar una vez al mes el congelador • Bitácora de mantenimiento preventivo y correctivo de la refrigeradora Cámara de Bioseguridad tipo I • Limpiar la cámara de bioseguridad con hipoclorito de sodio antes y después de cada uso. • Registrar las horas de uso del filtro HEPA • Bitácora de mantenimiento preventivo y correctivo de la cámara de bioseguridad. Pipetas • Limpiar las pipetas con paño húmedo una vez por semana • Revisar que no existan obstrucciones en el conducto de succión cuando amerite realizar limpieza desarmando el sistema. • Calibrar las pipetas una vez al año. Incineradores • Limpiar con hipoclorito de sodio una vez por semana • Revisar el enchufe y el cable eléctrico. • Inspeccionar frecuentemente la estructura del incinerador por rajaduras. • Bitácora de mantenimiento preventivo y correctivo del incinerador. Lámpara Ultravioleta • Limpiar las superficie del fluorescente con un paño seco • Registrar las horas de uso • Cambiar el fluorescente UV, según especificaciones del fabricante. 75 Balanza Granataria • Limpiar con paño húmedo y luego con alcohol de 70% posterior a cada uso las superficies. • Registrar la calibración de la balanza con pesos conocidos una vez al mes. pH • Realizar cotización para su compra B. CONTROL DE CALIDAD DE LOS REACTIVOS: Catalasa 10% • Revisar fecha de caducidad • Observar diariamente que el reactivo no presente signos de deterioro (turbidez, cambio de color y precipitación) • Utilizar una cepa control positivo de Staphylococcus aureus proveniente de Agar Mueller Hinton para evidenciar la formación de burbujas, semanalmente. • Utilizar una cepa control negativo de Enterococcus faecalis proveniente de Agar Mueller Hinton para evidenciar la no formación de burbujas, semanalmente. Oxidasa • Revisar fecha de caducidad • Observar diariamente que el reactivo no presente signos de deterioro (cambio de color) • Utilizar una cepa control positivo de Pseudomona aeruginosa proveniente de Agar Mueller Hinton para evidenciar la formación de un color violeta a los 10 segundos de colocado el inóculo, semanalmente. 76 • Utilizar una cepa control negativo de Escherichia coli proveniente de Agar Mueller Hinton para evidenciar el no viraje de la tira reactiva, semanalmente. Coagulasa • Revisar fecha de caducidad • Observar diariamente que el reactivo no presente signos de deterioro (turbidez, cambio de color y precipitación) • Utilizar una cepa control positivo de Staphylococcus aureus proveniente de Agar Mueller Hinton para evidenciar la floculación del reactivo, semanalmente. • Utilizar una cepa control negativo de Staphylococcus epidermidis proveniente de Agar Mueller Hinton para evidenciar la no floculación del reactivo, semanalmente. Antisueros • Revisar fecha de caducidad del juego de antisueros utilizados para tipear Salmonella sp, Shigella flexnerii, Shigella sonnei, Shigella boydii Shigella disenteriae y Shigella flexneri. • Revisar que no exista evidencia de turbidez, precipitación ni cambios de color. • Montar las cepas control correspondiente a cada antisuero supracitados como control positivo de reacción, cada apertura de lote. • Seguir las instrucciones del fabricante Medios de cultivo deshidratado • Revisar fecha de caducidad de medios de cultivo deshidratados previo a su preparación • Observar que no exista evidencia de hidratación o condensación del frasco que contiene el medio de cultivo. 77 • Mantener los medios de cultivo deshidratados en lugares frescos, a temperatura ambiente y protegidos contra la humedad y la luz. • Almacenar los suplementos como antibióticos y vitaminas a 4° C. • Registrar el nombre del producto, nombre y número telefónico de la casa proveedora, número de control del frasco, fecha de recibo, fecha de expiración, número de lote y fecha en que se abrió el frasco. • Utilizar únicamente agua recién destilada o completamente desmineralizada. • Medir mensualmente la resistencia eléctrica del agua destilada la cual debe ser igual o mayora 10 megaohms. • Seguir rigurosamente las instrucciones del fabricante para la preparación del medio de cultivo (peso, volumen de agua, pH, condiciones de esterilización). • Evitar la condensación al momento de dispensar los medios en las placas de petri, la formación de burbujas y coágulos. • Reservar el 5% de las placas preparadas para realizar el control de calidad por esterilidad y eficiencia. • Reservar una placa de cada tipo de medio para realizar el control final de pH. • Almacenar el medio de cultivo preparado el tiempo máximo indicado por cada fabricante, de manera invertida, bajo protección de la luz y a temperatura adecuada en bolsas plásticas. • Anotar fecha de preparación del medio de cultivo en las bolsas. • Incubar una placa de cada medio preparado a 37°C por 48 horas y revisar por crecimiento bacteriano. • Inocular cepas control para evaluar capacidad de crecimiento y reacción de los medios de cultivo.(Ver cuadro Nº 5) • Antes de inocular los medios, observar que los mismos carezcan de rajaduras en la superficie del medio, variaciones en el volumen del 78 medio, hemólisis, cristales en el medio, presencia de burbujas, presencia de coágulos, cambio de color normal, contaminación y falla en la inhibición de microorganismos saprófitos. Cuadro Nº 5. Patrones de crecimiento de Cepas ATCC en diferentes medios de cultivo . Medio de Cultivo Cepa Control Agar Sangre Streptococcus Crecimiento y Reacción Beta Positivo. Betahemólisis hemolítico Agar Sangre Streptococcus pneumoniae Positivo. Alfahemólisis Agar Sangre Klebsiella pneumoniae Positivo. No hemolítico McConkey Escherichia coli Positivo. Colonias Moradas McConkey Proteus sp Positivo. Colonias claras McConkey Staphylococcus aureus Negativo Manitol Sal Staphylococcus aureus Positivo. Colonias amarillas Manitol Sal Escherichia coli Negativo Salmonella-Shigella Salmonella sp Salmonella-Shigella XLD Escherichia coli Salmonella sp XLD Escherichia coli TCBS Vibrio cholerae Positivo. Colonias claras H2S + Negativo Positivo Colonias Transparentes H2S + Positivo. Colonias Amarillas Positivo Colonias amarillas TCBS Vibrio mimicus Positivo Colonias verdes TCBS Escherichia coli Negativo Mueller Hinton Flora Mixta Positivo Tioglicolato Flora Mixta Positivo Fuente: Bacteriología Diagnóstica: tinciones, medios de cultivo y pruebas diagnósticas Prueba de Indol • Revisar fecha de caducidad del Ehrlich. • Revisar que no exista evidencia de turbidez, precipitación ni cambios de calor. 79 • Montar una vez a la semana una cepa control positivo de Escherichia coli y otro negativo de Enterobacter sp. C. CONTROL DE CALIDAD DE TINCIONES: Tinción de Gram • Revisar fecha de caducidad del juego de colorantes utilizados en la tinción de gram. • Filtrar el cristal violeta y la safranina una vez a la semana • Observar que no existan precipitados en los frascos que contienen los colorantes. • Teñir un caldo mixto de Staphylococcus aureus y Escherichia coli, proveniente de un caldo de tioglicolato inoculado con una asada de cada microorganismo e incubado previamente por 18 horas una vez a la semana y cada vez que se cambie el lote. Tinción de Zielh Neelsen • Revisar fecha de caducidad del juego de colorantes utilizados en la tinción de Zielh Neelsen. • Filtrar la fucsina fenicada y el azul de metileno cada vez que se vaya utilizar. • Teñir una lámina positiva que contenga Bacilos Alcohol Ácido Resistente e inactivados enviados por el INCIENSA cada vez que se tiñan muestras. D. CONTROL DE CALIDAD DE LAS MUESTRAS: Urocultivos • Dar instrucciones verbales y por escrito a cada paciente. ( Ver anexo 3) 80 • Verificar que la solicitud indique nombre, número de identificación, lugar de prescripción, fecha, diagnóstico y nombre del médico. Además, debe incluir el tipo de muestra enviado (orina cateterizada, orina con técnica, punción vesical). • Confirmar que la identificación de la muestra solicitada concuerde con los demográficos de la solicitud. • Observar el recipiente por derrames y volumen mínimo necesario, aproximadamente 20 cc para adultos y 10 cc para menores de 1 año. • Recibir solo aquellas muestras contenidas en recipientes estériles. • Una vez recibida la muestra, no debe de transcurrir más de dos horas sin refrigerar para su procesamiento. • En los casos en que el transporte o el procesamiento pudieran demorar, se recomienda mantener la muestra a 4ºC por un tiempo máximo de 24 horas. • No se recomienda las siguientes muestras para análisis de urocultivo, punta de catéter Foley, frotis de orina y orina colectada de la bolsa del catéter. • No se procesará muestras del mismo paciente dentro de 24h. (Ver cuadro Nº 6 y figura Nº 2) 81 Cuadro Nº 6. Diagrama de actividades para el procesamiento de urocultivos DIAGRAMA DE ACTIVIDADES Proceso : Procesamiento de Urocultivo Cód: CCSS Procedimiento: Recepción de solicitudes de análisis y muestras Cód: RYTM-1 ACM-2 T-1 HLCH LCB Elaborado por: DAC-DMB RESPONSABLES T Aprox Descripción Código R-1 Saludo inicial 20 Seg R-2 Recepción y registro de hora de Solicitud 30 Seg R-3 Verificación de datos demográficos y clínicos 30 Seg R-5 Observación macroscópica de las condiciones de la muestra T-2 Necesario para documentar sistemas de información y procesamiento técnico de la muestra Para determinar la admisibilidad de la muestra. 30 seg Recepción de muestras de orina Observaciones Mejorar la calidez de la atención Si la muestra no viene en las condiciones indicadas previamente se le solicitará una nueva muestra al paciente NO R-6 MQC-2 SÍ 60 seg R-7 Pasar muestra a la sección de bacteriología 30 seg Muestra en frasco correcto y sin derrames R-8 Se le da un número consecutivo y se anota en el libro de registro de bacteriología 30 seg Para correlacionar número de muestra y paciente R-9 Registro de muestra al sistema Vitek 30 seg TOTAL: 4,3 min FIN Para su posterior identificación bacteriana y registro digital de los datos 82 Proveedor Solicitud de urocultivo Entrada Procesos Recepción de solicitud de Urocultivo Salidas Entrega de muestra de urocultivo a la sección de bacteriología Recepción de boletas en ventanilla del laboratorio clínico Revisión de datos demográficos Revisión de las condiciones de la muestra Traslado a la sección de bacteriología Registro de solicitud en libro diario Ingreso de demográficos en sistema Vitek Figura Nº 2. Flujograma de procesamiento de urocultivos Clientes Microbiólogo químico clínico encargado de bacteriología 83 Coprocultivos • Dar instrucciones verbales y por escrito a cada paciente. ( Ver anexos 4) • Verificar que la solicitud indique nombre, número de identificación, lugar de prescripción, fecha, diagnóstico y nombre del médico. • Confirmar que la identificación de la muestra solicitada concuerde con los demográficos de la solicitud. • Observar el recipiente por derrames. • Recibir solo aquellas muestras contenidas en recipientes estériles y adecuados. No se tramitarán muestras que vengan en contenedores de cartón o papel o sin tapa. • Una vez recibida la muestra no debe de transcurrir más de cuatro horas sin refrigerar para su procesamiento. • La muestra debe ser llevada al laboratorio clínico una vez recolectada, de lo contrario debe utilizarse un medio de transporte adecuado como Carey-Blair. • No se procesarán heces formadas, excepto para estudio de portador de Salmonella sp. Tampoco muestras en hisopos de algodón ni en pañales.(Ver cuadro Nº 7 y figura Nº 3) 84 Cuadro Nº 7. Diagrama de actividades para el procesamiento de coprocultivos DIAGRAMA DE ACTIVIDADES Proceso : Procesamiento de Coprocultivo Cód: CCSS Procedimiento: Recepción de solicitudes de análisis y muestras Cód: RYTM-1 HLCH LCB Elaborado por: DAC-DMB RESPONSABLES T Aprox Código Descripción R-1 Saludo inicial 20 Seg R-2 Recepción y registro de hora de Solicitud 30 Seg R-3 Verificación de datos demográficos y clínicos 30 Seg R-5 Observación macroscópica de las condiciones de la muestra R-6 ACM-2 T-1 T-2 MQC-2 Observaciones Mejorar la calidez de la atención Necesario para documentar sistemas de información y procesamiento técnico de la muestra Para determinar la admisibilidad de la muestra. 30 seg Si la muestra no viene en las condiciones indicadas previamente se le solicitará una nueva muestra al paciente NO Recepción de muestras de heces SÍ 60 seg R-7 Pasar muestra a la sección de bacteriología 30 seg Muestra en frasco correcto y sin derrames R-8 Se le da un número consecutivo y se anota en el libro de registro de bacteriología 30 seg Para correlacionar número de muestra y paciente 30 seg Para su posterior identificación bacteriana y registro digital de los datos R-9 Registro de muestra al sistema Vitek FIN TOTAL: 4,3 Min 85 Proveedor Solicitud de coprocultivo Entrada Procesos Recepción de solicitud de coprocultivo Salidas Entrega de muestra de coprocultivo a la sección de bacteriología Recepción de boletas en ventanilla del laboratorio clínico Revisión de datos demográficos Revisión de las condiciones de la muestra Traslado a la sección de bacteriología Registro de solicitud en libro diario Ingreso de demográficos en sistema Vitek Figura Nº 3. Flujograma de procesamiento de coprocultivos Clientes Microbiólogo químico clínico encargado de bacteriología 86 Hemocultivos • El laboratorio proveerá al menos dos frascos por paciente de medio de cultivo para la inoculación de la sangre, los mismos deben estar libres de turbidez, cambio de color, precipitación, coágulos y formación de gas. • Los hemocultivos serán tomados únicamente por el médico tratante, con técnica aséptica (Ver anexo 5). • Verificar que la solicitud indique nombre, número de identificación, lugar de prescripción, fecha, diagnóstico, temperatura del paciente y nombre del médico. • Confirmar que la identificación de la muestra solicitada concuerde con los demográficos de la solicitud. • La muestra debe ser inoculada una vez que el frasco de cultivo haya alcanzado la temperatura ambiente (25°C). • Verificar que la solicitud indique nombre, número de identificación, lugar de prescripción, fecha, diagnóstico y nombre del médico. • Confirmar que la identificación de la muestra solicitada concuerde con los demográficos de la solicitud. • Los hemocultivos deben ser transportados inmediatamente al laboratorio una vez inoculada la muestra e incubados en el acto a 35°C.(Ver cuadro Nº 8 y figura Nº 4) 87 Cuadro Nº 8. Diagrama de actividades para el procesamiento de hemocultivos DIAGRAMA DE ACTIVIDADES Proceso : Procesamiento de Hemocultivo Cód: CCSS-ASG-LCL-AC Procedimiento: Recepción de solicitudes de análisis y muestras Cód: RYTM-1 ACM-2 T-1 Descripción Código T Aprox R-1 Saludo inicial 20 Seg R-2 Recepción y registro de hora de Solicitud 30 Seg R-3 Verificación de datos demográficos y clínicos 30 Seg R-5 Observación macroscópica del frasco de hemocultivo T-2 Elaborado por: DACDMB MQC-2 Observaciones Mejorar la calidez de la atención Necesario para documentar sistemas de información y procesamiento técnico de la muestra Para determinar la admisibilidad de la muestra. 30 seg Recepción de muestras de frasco de hemocultivo LCB RESPONSABLES Si el medio de cultivo presenta signos de turbidez, precipitación, gas o derrames, se debe solicitar nueva muestra al médico NO R-6 HLCH SÍ 60 seg R-7 Pasar muestra a la sección de bacteriología 30 seg Incubar inmediatamente a 37 º C R-8 Se le da un número consecutivo y se anota en el libro de registro de bacteriología 30 seg Para correlacionar número de muestra y paciente R-9 Registro de muestra al sistema Vitek 30 seg Para su posterior identificación bacteriana y registro digital de los datos TOTAL: 4,3 min FIN 88 Proveedor Solicitud de hemocultivo Entrada Procesos Recepción de solicitud de hemocultivo Salidas Entrega de muestra de hemocultivo a la sección de bacteriología Recepción de boletas en ventanilla del laboratorio clínico Revisión de datos demográficos Revisión de las condiciones de la muestra Traslado a la sección de bacteriología Registro de solicitud en libro diario Ingreso de demográficos en sistema Vitek Figura Nº 4. Flujograma de procesamiento de hemocultivos Clientes Microbiólogo químico clínico encargado de bacteriología 89 Vaginales • Los vaginales serán tomados únicamente por el médico tratante, con técnica adecuada (Ver anexo 6). • Verificar que la solicitud indique nombre, número de identificación, lugar de prescripción, fecha, diagnóstico, edad de la paciente, estado de gravidez y nombre del médico. • Se revisará que la muestra conste de dos aplicadores en diferentes tubos, uno con solución salina estéril a 0.9 % y el otro seco. • La muestra debe ser transportada inmediatamente después de tomada y en posición vertical. • Una vez recibida la muestra se le debe indicar al microbiólogo químico clínico encargado, para su procesamiento inmediato. (Ver cuadro Nº 9 y figura y figura Nº 5) 90 Cuadro Nº 9. Diagrama de actividades para el procesamiento de secreción vaginal DIAGRAMA DE ACTIVIDADES Proceso : Procesamiento de Secreción Vaginal Cod: CCSS-ASG-LCL-AC Procedimiento: Recepción de solicitudes de análisis y muestras Cod: RYTM-1 ACM-2 T-1 Descripción Código T Aprox R-1 Saludo inicial 20 Seg R-2 Recepción y registro de hora de Solicitud 30 Seg R-3 Verificación de datos demográficos y clínicos 30 Seg R-5 Observación macroscópica de las condiciones de la muestra T-2 Elaborado por: DAC-DMB MQC-2 Observaciones Mejorar la calidez de la atención Necesario para documentar sistemas de información y procesamiento técnico de la muestra La muestra debe venir en dos tubos independientes, para determinar la admisibilidad de la muestra. 30 seg Recepción de muestras de secreción vaginal LCB RESPONSABLES Si la muestra no viene en dos tubos diferentes se le solicitará una nueva muestra al médico NO R-6 HLCH SÍ 60 seg R-7 Pasar muestra a la sección de bacteriología 30 seg Muestra en posición vertical R-8 Se le da un número consecutivo y se anota en el libro de registro de bacteriología 30 seg Para correlacionar número de muestra y paciente R-9 Registro de muestra al sistema Vitek 30 seg Para su posterior identificación bacteriana y registro digital de los datos TOTAL: 4,3 min FIN 91 Proveedor Solicitud de secreción vaginal Entrada Procesos Recepción de solicitud de secreción vaginal Salidas Entrega de muestra de secreción vaginal a la sección de bacteriología Recepción de boletas en ventanilla del laboratorio clínico Revisión de datos demográficos Revisión de las condiciones de la muestra Traslado a la sección de bacteriología Registro de solicitud en libro diario Ingreso de demográficos en sistema Vitek Figura Nº 5. Flujograma de procesamiento de secreción vaginal Clientes Microbiólogo químico clínico encargado de bacteriología 92 Baciloscopías • Dar instrucciones verbales y por escrito a cada paciente (Ver anexo 7) • El laboratorio proveerá tres frascos estériles de boca ancha y tapa de rosca a cada paciente. de boca ancha y cierre hermético. • Se recibirá únicamente aquellas muestras que estén correctamente identificadas con los datos del paciente, el número de muestra y tipo de muestra. • Las muestras deberán ser entregadas al laboratorio clínico en tres días diferentes sin que pasen más de una semana entre una y otra. • Observar que el recipiente no presente derrames, de lo contrario la muestra se descartará y se solicitará una nueva muestra. • Una vez recibidas las muestras deben almacenarse en refrigeración a 4° C y ser procesadas en un lapso máximo de 48 horas.( Ver cuadro Nº 10 y figura Nº 6) • Se le debe realizar una valoración a la muestra de acuerdo con los siguientes parámetros de calidad: saliva (+), saliva con estrías purulentas (++), muestra purulenta (+++), purulenta con estrías de sangre (++++) y anotarla en el libro de registro de baciloscopías. (Ministerio de salud, INCIENSA, CCSS, 1999) 93 Cuadro Nº 10. Diagrama de actividades para el procesamiento de baciloscopías DIAGRAMA DE ACTIVIDADES Proceso : Procesamiento de Esputos por BK Cód: CCSS-ASG-LCL-AC Procedimiento: Recepción de solicitudes de análisis y muestras Cód: RYTM-1 Descripción Código T Aprox R-1 Saludo inicial 20 Seg R-2 Recepción y registro de hora de Solicitud 30 Seg R-3 Verificación de datos demográficos y clínicos 30 Seg R-5 Observación macroscópica de las condiciones de la muestra ACM-2 T-1 T-2 Elaborado por: DACDMB MQC-2 Observaciones Mejorar la calidez de la atención Necesario para documentar sistemas de información y procesamiento técnico de la muestra Para determinar la admisibilidad de la muestra. 30 seg Recepción de muestras de esputo LCB RESPONSABLES Si la muestra viene derramada entregar otro frasco al paciente para que expectore nuevamente NO R-6 HLCH SÍ 60 seg R-7 Pasar muestra a la sección de bacteriología 30 seg Muestra debe ser refrigerada a 4ª C inmediatamente R-8 Se le da un número consecutivo y se anota en el libro de registro de baciloscopías 30 seg Para correlacionar número de muestra y paciente R-9 Procesar en un tiempo no mayor a 48 horas 48 H TOTAL: 4,3 min FIN 94 Proveedor Solicitud de esputo por BK Entrada Procesos Recepción de solicitud de esputo por BK Salidas Entrega de muestra de esputo a la sección de bacteriología Recepción de boletas en ventanilla del laboratorio clínico Revisión de datos demográficos Revisión de las condiciones de la muestra Traslado a la sección de bacteriología Registro de solicitud en libro diario Registro de solicitud en libro de registro de baciloscopías Figura Nº 6. Flujograma de procesamiento de baciloscopías Clientes Microbiólogo químico clínico encargado de bacteriología 95 E. Reporte de Análisis El propósito de los análisis bacteriológicos es generar un informe final de la muestra biológica recibida en el laboratorio, indicando el agente etiológico y su correspondiente prueba de sensibilidad a los antibióticos, para ello es necesario estandarizar las características básicas que debe incluir este reporte, a saber: • Nombre de la institución, del hospital, del departamento y la sección. • Nombre completo del paciente. • Número de identificación del paciente. • Fecha de recepción de la muestra. • Fecha de reporte de la muestra. • Lugar de prescripción. • Sitio anatómico. • Tipo de muestra. • Microorganismo aislado si lo hubiere. • Reporte de prueba de sensibilidad a los antibióticos. • Observaciones y recomendaciones. • Nombre completo, firma y código del microbiólogo responsable. F. Plan de Educación Continua • El microbiólogo químico clínico encargado de la sección de bacteriología deberá realizar una selección de temas de interés. • Confeccionar un cronograma de actividades de educación en servicio, tanto teóricas como prácticas, para mantener al personal del laboratorio actualizado. • Proponer la formación de un especialista en bacteriología médica. 96 • Llevar registro físico y digital de las capacitaciones asistidas de acuerdo con el cronograma, así como las justificaciones en el caso de que la capacitación no se realizará. 5.2 Determinar la factibilidad de desarrollar un sistema de garantía de la calidad en la sección de Bacteriología. A. Infraestructura: La sección de bacteriología carece de un espacio físico exclusivo para la preparación de medios de cultivo y su esterilización. En este momento, estas actividades se realizan en dos áreas diferentes, sin embargo, ambas no cuentan con los requisitos mínimos de asepsia, ya que en una, se procesan muestras de heces y se autoclavan desechos sólidos y en la otra, se procesan diversos tipos de muestras clínicas. Así mismo, no existe un plan a corto plazo de la construcción de un nuevo laboratorio que incluya una sección de bacteriología con espacio adecuado para llevar a cabo todas las funciones. B. Recurso Material Referente al recurso material, se hace necesario la compra de un medidor de pH, para determinar el punto final de pH en los medios de cultivos. Además, con relación a la disponibilidad de cepas de referencia, únicamente se cuenta con las entregadas por la Compañía Tecnodiagnóstica representante de la Casa Biomeriux y las restantes se obtendrán de los aislamientos de rutina de la sección de bacteriología, las cuales se utilizaran para corroborar la funcionabilidad de los diferentes tintes, medios de cultivo y reactivos. Es necesaria la adquisición de cuatro termómetros digitales y calibrados para llevar a cabo el control de temperatura de los diferentes equipos instalados en la sección. 97 C. Recurso Humano Se requiere un técnico en ciencias médicas 1, ocho horas diarias con el fin de dar apoyo a la sección de bacteriología de manera permanente. D. Recurso Económico La literatura sugiere que una de las tareas claves de la economía de la calidad es la cuantificación de los costos de la misma. El costo de implementación de un sistema de garantía de calidad está compuesto por tres rubros a saber: costos de mano de obra, costo de materia prima, equipamiento e insumos y costos indirectos. (Gutiérrez, 2005) En los costos de mano de obra, se debe incluir el salario del técnico en ciencias médicas 1, el cual será el que le dará apoyo técnico al microbiólogo en las diferentes actividades para ejecutar el control de calidad en la sección. Con relación a los costos de materia prima, equipamiento e insumos se debe cotizar en ellos todos los recursos materiales faltantes en la sección y que son indispensables para cumplir con el objetivo de ejecutar el control de calidad. Dentro de los recursos materiales se incluyen los montos correspondientes a: cuatro termómetros calibrados, un pH metro, una cámara de flujo laminar, mesas de trabajo, agar chocolate, agar Thayer Martin, cepas ATCC de Streptococcus pneumoniae y Shigella sp. (Ver apéndice Nº 1 y Nº 2) Por otro lado, se debe solicitar a la administración del hospital la inclusión en el presupuesto del hospital, la construcción de un anexo del laboratorio que este destinado al área de esterilización y preparación de medios de cultivo. (Ver apéndice Nº 1). En lo referido a los costos indirectos se debe utilizar los mismos costos calculados para las otras áreas del laboratorio. 5.3 Implementar un sistema de garantía de calidad para la sección de bacteriología. La siguiente propuesta de aseguramiento de la calidad para la sección de bacteriología del Hospital Los Chiles, tiene como propósito dar a conocer a la 98 dirección del laboratorio y la dirección médica, los beneficios de implementar un sistema de calidad continuo que llegue amalgamar los esfuerzos que se han venido realizando. Dentro de los beneficios que plantea esta propuesta, se tiene que llevar un control diario, semanal y mensual de equipos, así como el control de reactivos, medios de cultivos y colorantes, lo que va a redundar en una mayor confianza en los reportes de bacteriología y por ende, una mayor satisfacción de los usuarios tanto internos como externos. Dentro del ciclo de mejoramiento continuo (DMAIC), este estudio se encuentra en la fase de análisis de datos, ya que anteriormente se definió por medio de las visitas a la sección de bacteriología del Hospital Los Chiles, que éste cuenta con algunas herramientas de control de calidad aisladas pero que carecía de un sistema estructurado. Se midió cuáles eran los recursos materiales, humanos, y financieros que se requieren para la implementación del sistema de calidad. Finalmente para que esta propuesta se concrete se requiere de un verdadero compromiso de las partes involucradas: la dirección médica, la dirección del laboratorio clínico y el microbiólogo químico clínico encargado de la sección de bacteriología del Hospital Los Chiles. 5.4 Evaluación el sistema de garantía de calidad implementado en la sección de bacteriología. Las evaluaciones del sistema de calidad estarán divididas en dos partes las internas y las externas. Dentro de las internas se propone una verificación diaria del control de calidad de los diferentes equipos, reactivos y tinciones utilizados en la sección de bacteriología con el fin de corroborar que se esté realizando y anotará en una bitácora de registro sus iniciales que indica que el control fue llevado a cabo de la manera sugerida en la propuesta, de no ser así el microbiólogo del segundo turno, deberá indicarle al encargado de la sección de bacteriología que se acuerde de ejecutar el control de calidad. El 99 microbiólogo anotará en una hoja de control cruzado de calidad la siguiente codificación: D, S o M para indicar que el control de calidad diario, semanal o mensual de los equipos, tinciones y reactivos, se ejecutó de manera efectiva. (Ver apéndices 20-23) Por otra parte, el director del laboratorio clínico realizará, según cronograma auditorías internas, que evalúen el sistema de aseguramiento de la calidad implementado, las cuales deben incluir revisión de registros y documentación respectivos. Además, debe corroborar el cumplimiento del cronograma de capacitación del personal y debe cotejar que las visitas de mantenimiento preventivo y correctivo correspondan a lo estipulado en los contratos. El sistema de garantía de calidad propuesto incluye las evaluaciones externas del desempeño impartido por el INCIENSA y la Compañía Tecnodiagnóstica, ellas tiene como fin valorar de manera integral, los procesos que se llevan a cabo en la sección de bacteriología. El INCIENSA con sus centros nacionales de referencia en tuberculosis y bacteriología, presentan un plan de evaluación que incluye lo siguiente: visitas de evaluadores programadas a los centros de trabajo, envío de incógnitas para ser procesadas como muestras dos veces al año, recepción de muestras, aislamientos y láminas para confirmación diagnóstica tanto positivas como negativas cuando amerite. De igual manera, la Compañía Tecnodiagnóstica como proveedora del servicio de identificación bacteriana automatizada (Vitek), ofrece un control externo de calidad, el cual consta del envío de cepas ATCC conocidas para verificar la concordancia tanto en la identificación como en la sensibilidad a los antibióticos. Estos datos quedan incluidos en el subsistema de calidad del analizador y se puede revisar rutinariamente los históricos del control. 100 CAPÍTULO VI CONCLUSIONES Y RECOMENDACIONES 101 CAPÍTULO VI 5. Conclusiones y Recomendaciones 5.1 Conclusiones Después de analizar los datos obtenidos por medio de los cuestionarios aplicados al personal del laboratorio clínico del Hospital Los Chiles, encargado del procesamiento de muestras de bacteriología, y al director del laboratorio clínico y por medio de las observaciones realizadas en el lugar de trabajo, se puede realizar las siguientes conclusiones. • La sección de bacteriología del Hospital Los Chiles no cuenta con termómetros calibrados para llevar diariamente el control de las temperaturas de los diferentes equipos que lo ameritan. Tampoco cuenta con peachímetro para realizar la preparación adecuada de los medios de cultivo. Si bien es cierto, se cuenta con una cabina de seguridad para procesar los esputos por Bk, la misma no es idónea para este realizar cultivos por micobacterias. • Con referencia al espacio físico existente en la sección de bacteriología, el encargado de la sección refiere, que no existe un lugar destinado específicamente para la preparación de medios de cultivo. Parte de este proceso se realiza en la misma zona donde se disponen los desechos sólidos contaminados y además, ambos procesos se realizan utilizando la misma autoclave. Aunado, a lo anterior no se dispone de un espacio físico separado para realizar labores de procesamiento de muestras y labores administrativas. Además, de la entrevista realizada a la directora del laboratorio, se desprende que a pesar de existir un proyecto para la construcción de un laboratorio nuevo, el mismo está archivado de momento por no existir presupuesto. 102 • Con relación a los medios de cultivo, se observa en las hojas de cotejo que se mantiene en existencia la mayoría de los medios de cultivo necesarios para la rutina diaria, sin embargo, existe un faltante ocasional de Agar Chocolate y Agar Thayer Martin, los cuales se adquieren preparados comercialmente, lo anterior debido a que no siempre lo compran. • La sección de bacteriología cuenta con la mayoría de reactivos y colorantes necesarios para la identificación bacteriana, sin embargo, no se le realiza un control rutinario de su desempeño, porque no existe un sistema de control de calidad implementado para tales fines, según datos suministrados por la jefatura del laboratorio y el encargado de bacteriología. • En la entrevista de la jefatura de laboratorio, se indica que en el Plan Anual Operacional, no se ha contemplado un contenido presupuestario definido para llevar a cabo la implementación de un control de calidad sistemático en la sección de bacteriología. • Si bien es cierto, que la dirección médica del Hospital Los Chiles, siempre ha estado anuente a apoyar las iniciativas de calidad en pro del usuario interno y externo, específicamente no se le ha propuesto un sistema de garantía de calidad al momento. • El profesional encargado de la sección, refiere que no cuenta con personal de apoyo técnico que realice funciones asistenciales en la misma, generando una gran cantidad de carga laboral, aunado a la participación del microbiólogo en diferentes comisiones relacionadas con la naturaleza de su puesto, tales como vigilancia epidemiológica e infecciones intrahospitalarias. • Datos brindados por el personal del laboratorio indican que al momento del estudio, tanto el titular como el sustituto de la sección de bacteriología, se encuentran realizando estudios de formación en el área de gerencia de la calidad. 103 • No existe un plan estructurado para educación continua en el área de calidad. • En la sección de bacteriología, se lleva a cabo un control de calidad externa evaluado por el INCIENSA mediante el envío de cepas incógnitas, el cual incluye la identificación bacteriana y su respectiva prueba de sensibilidad a los antibióticos, la cual nos permite valorar de manera indirecta la calidad de los medios de cultivos, los reactivos, los colorantes y el sistema VITEK. • La sección de bacteriología envían cepas de difícil identificación al Centro Nacional de Referencia en Bacteriología en el INCIENSA y al Hospital México (bacteriología), para su confirmación diagnóstica y como retroalimentación del laboratorio clínico del Hospital Los Chiles. • Aproximadamente cada seis meses, se reciben cepas de referencia tipo ATCC por parte de la compañía suplidora del analizador automatizado de identificación bacteriana, para controlar el funcionamiento adecuado del mismo. • Los resultados revelan que existe un número importante de carencias en el recurso material, humano y de infraestructura, las cuales no permiten el aseguramiento completo de la calidad, sin embargo, se encontraron aspectos aislados de ejecución de un control de calidad y una posición positiva y proactiva de los funcionarios encargados de tomar decisiones en el sentido de promover la calidad. 5.2 Recomendaciones Después de analizar las conclusiones obtenidas de las entrevistas y hojas de cotejo se recomienda: • Que la jefatura del laboratorio clínico realice un estudio de mercado y solicite la cotización de cuatro termómetros digitales calibrados, de un peachímetro y de una cámara de bioseguridad tipo II. 104 • Que debido a la carencia de un espacio físico exclusivo para la preparación de medios de cultivo y disposición de desechos sólidos, se sugiere como medida temporal, llevar a cabo una descontaminación escrupulosa con hipoclorito de sodio de las partes internas y externas de la autoclave posterior a cada utilización de la misma. De igual manera, se recomienda que, luego del procesamiento de muestras, se descontamine la superficie de trabajo previo a la validación de los reportes. Como medida definitiva, se insta a la jefatura a realizar las gestiones necesarias para solicitar un cuarto exclusivo para la preparación de medios y su esterilización. • La jefatura del laboratorio en conjunto con el encargado de la sección de bacteriología, debe estar pendiente de la adquisición regular de agar chocolate y de Thayer-Martin. • El encargado de bacteriología destine tiempo de su jornada laboral para realizar las actividades propias de control de calidad del desempeño de reactivos y colorantes, para ello, deberá utilizar las cepas de referencia enviadas por la casa comercial suplidora del servicio automatizado de identificación bacteriana o cepas aisladas y tipificadas en el laboratorio clínico a nivel local. • Ya que existe una propuesta de implementación de un sistema de garantía de la calidad, se invita a la jefatura del laboratorio clínico a que incluya en el Plan Anual Operacional, el contenido presupuestario para realizar todas aquellas actividades propuestas en el mismo. • La jefatura del laboratorio clínico revise, evalúe y divulgue la propuesta del sistema de garantía de la calidad a la dirección médica y a la administración del hospital • La jefatura del laboratorio justifique la necesidad de un técnico en ciencias médicas, que dé apoyo al microbiólogo químico clínico encargado de la sección de bacteriología, para que realice medios de cultivo, procese muestras de esputo y montaje de muestras. 105 • Debido a que el microbiólogo químico clínico, encargado de la sección de bacteriología, actualmente no tiene formación en calidad, se sugiere que la jefe del laboratorio imparta capacitación continua en aspectos de calidad, ya que la misma está capacitada a nivel de maestría. • En el Hospital Los Chiles existe una comisión de educación permanente, en la cual, sus miembros solicitan a los servicios de apoyo del hospital que incluyan en qué temas quieren ser capacitados. Es importante que en los mismos se incorporen tópicos de control de calidad en bacteriología. • El encargado de la sección de bacteriología debe continuar participando en las rondas de control de calidad externo y además realizar el envío de los resultados de las cepas incógnitas al centro nacional de referencia en bacteriología en el INCIENSA de manera oportuna. • Es importante que el microbiólogo encargado de la sección de bacteriología, envíe cada vez que sea necesario cepas de difícil identificación o con antibiogramas incongruentes a los centros de referencia. • El microbiólogo químico clínico encargado de la sección de bacteriología, debe realizar el control de calidad de las cepas de referencia tipo ATCC enviadas por la compañía suplidora del analizador automatizado de identificación bacteriana según, por lo menos 2 veces al año. • Para que este sistema de garantía de la calidad sea implementado, se recomienda como primer punto, iniciar con aquellas acciones que no requieran ningún tipo de desembolso económico como podrían ser: los registros de actividades, manejo adecuado de la documentación, utilización de criterios de rechazo y aceptación de muestras clínicas, capacitación interna, entre otros. Por otro lado en una segunda etapa se sugiera la compra de todos aquellos equipos, reactivos, materiales que sean necesarios. Así como la gestión de una nueva plaza para dar apoyo técnico al microbiólogo encargado de la sección de bacteriología. 106 BIBLIOGRAFIA 107 BIBLIOGRAFÍA Citada Acuña Acuña, J. (2002). Control de Calidad Un Enfoque Integral y Estadístico. Costa Rica: Editorial tecnológica de Costa Rica. Barrantes Echavarría, R. (2002). Un camino al conocimiento. Un enfoque cuantitativo y cualitativo. San José, Costa Rica Editorial EUNED. Caballero, E. Manual de control de calidad en microbiología clínica. Consultado 11 de noviembre 2008, de http://www.monografias.com/trabajos/mmbiologia/mmbiologia.shtml Clinical and Laboratory Standards Institute (2002). Perfomance Standards for Antimicobial Susceptibility. Testing; eigteenth informational supplement. Pennsylvania, USA. Entidad nacional de acreditación. (2002). Guía para la acreditación de laboratorios que realizan análisis microbiológicos. Consultado 20 de octubre 2008, de www.enac.es/docs/documentos/G-ENAC-04%20Rev.%203.pdf European co-operation for accreditation. (2002). Accreditation for microbiologicals laboratories.. EA-04/10. Consultado 20 de octubre 2008, de www.sinal.it/docs/EA-4-10rev02.pdf Guerrero F., Gamboa M., Mora J., Rodríguez E. Bacteriología Diagnóstica: tinciones, medios de cultivo y pruebas diagnósticas. Costa Rica: Oficina de Publicaciones, Facultad de Microbiología, Universidad de Costa Rica. Gutiérrez Pulido, H. (2005). Calidad Total y Productividad. México DF, México: Editorial McGraw-Hill Interamericana. Ministerio de Salud., Instituto Costarricense de Investigación y Enseñanza en Nutrición y Salud., Caja Costarricense de Seguro Social. (1999). Manual de Normas y Procedimientos Técnicos para el Diagnóstico Bacteriológico de la Tuberculosis. San José, Costa Rica: MS. Organización Mundial de la Salud. (1993). Manual Métodos básicos de laboratorio en bacteriología clínica. Ginebra, Suiza: OMS. Organización Mundial de la Salud-Center for Disease Control and Prevention. (2004). Manual de Laboratorio para la identificación y Prueba de Susceptibilidad a los Antimicrobianos de Patógenos Bacterianos de Importancia para la Salud Pública en el Mundo en Desarrollo. Ginebra, Suiza: OMS. 108 Sáenz Sánchez, L., Acevedo Campos, D., Méndez Briceño, D. Rivas Martínez, R.(2009). Patrones de suscepitibilidad de aislamientos bacterianos en muestras urinarias de la población que consulto en el Hospital y Área de Salud Los Chiles, CCSS, 2007-2008. Revista del colegio de microbiólogos y químicos clínicos de Costa Rica. 15 (3). Toronto Medical Laboratories \ Mount Sinai Hospital Microbiology Department. (2003). Quality Control Manual. Consultado 11 de noviembre 2008, de http://microbiology.mtsinai.on.ca/manual/qc/mi_qc.pdf Weng Alemán, Z., Iglesias Hernández, B., Abreu Orta, M., Beltran Diaz, J. (2004). Control de medios de cultivo con empleo de cepas bacterianas autóctonas como patrones secundarios de referencia. Revista Cubana Higiene y epid; 42 (1) Consultada Bernal, César A. (2000) Antología del curso de Metodología de la Investigación para Administración y Economía. Colombia: Editorial Prentice Hall. Bulgarelli, I. (2008). Antología del curso de Seminario de la calidad y mejora continua. San José, Costa Rica: Instituto Centroamericano de Administración Pública 1997. Diccionario Enciclopédico Océano Uno Color. México D.F., México: Editorial Océano. 1994. Diccionario de Medicina Océano Mosby. Barcelona, España: Editorial Océano. Gamboa, O., Bulgarelli, I. (2009). Antología del curso de Evaluación de calidad y mejora continua. San José, Costa Rica: Instituto Centroamericano de Administración Pública Henderson García, A., Zúñiga, C. (2008). Antología del curso de Gestión de procesos. San José, Costa Rica: Instituto Centroamericano de Administración Pública Gutiérrez Brenes, M. (2008). Antología del curso de Métodos y técnicas de investigación. San José, Costa Rica: Instituto Centroamericano de Administración Pública Gutiérrez Brenes, M. (2008). Antología del curso de Taller de Tesis. San José, Costa Rica: Instituto Centroamericano de Administración Pública. Salas Cerdas, L. (2008). Antología del curso de Sistemas de gestión de la calidad. San José, Costa Rica: Instituto Centroamericano de Administración Pública. 109 APÉNDICES 110 Apéndice Nº 1 CUESTIONARIO DE EVALUACIÓN PARA EXISTENCIA DE EQUIPO, MOBILIARIO E INFRAESTRUCTURA EN LA SECCIÓN DE BACTERIOLOGÍA DEL HOSPITAL LOS CHILES HOJA DE COTEJO EQUIPO, INFRAESTRUCTURA Y MOBILIARIO SI EXISTE 1. Cuenta la sección de bacteriología con equipo informático. X 2. Cuenta la sección de bacteriología con una refrigeradora. X 3. Cuenta la sección de bacteriología con autoclaves. X 4. Cuenta la sección de bacteriología con algún sistema de identificación y sensibilidad bacteriana. X 5. Cuenta la sección de bacteriología con un incinerador de asas. X NO EXISTE 6. Cuenta la sección de bacteriología con un pH metro. X 7. Cuenta la sección de bacteriología con los termómetros calibrados y en cantidad suficiente para llevar a cabo el control de calidad X 8. Cuenta la sección de bacteriología con algún sistema óptico para la preparación de suspensiones bacterianas. X 9. Cuenta la sección de bacteriología con un microscopio con resolución óptica 100X. X X 10. Tiene la sección de bacteriología una cámara de flujo laminar para manejo de agentes infecciosos. 11. Tiene la sección de bacteriología una lámpara de luz ultravioleta desinfectante. X 12. Tiene la sección de bacteriología un lugar específico para la disposición adecuada de desechos sólidos bioinfecciosos. X 13. Posee el laboratorio clínico del Hospital Los Chiles un espacio físico para ejecutar las funciones diarias por separado de la sección de bacteriología. X 14. Posee la sección de bacteriología mesas de trabajo en cantidad necesaria para el trabajo diario. X 15. Posee la sección de bacteriología anaqueles y armarios para almacenamiento. X X 16. Tiene la sección de bacteriología un lugar específico para la preparación de medios de cultivo. 17. Cuenta la sección de bacteriología con pipetas calibradas. X Total del Puntaje 10 7 111 Apéndice Nº 2 CUESTIONARIO DE EVALUACIÓN PARA EXISTENCIA DE MEDIOS DE CULTIVO Y CEPAS ATCC EN LA SECCIÓN DE BACTERIOLOGÍA DEL HOSPITAL LOS CHILES HOJA DE COTEJO MEDIOS DE CULTIVO Y CEPAS ATCC SI EXISTE 1. Tiene la sección de bacteriología Agar Sangre. X 2. Tiene la sección de bacteriología Agar McConkey. X 3. Tiene la sección de bacteriología Agar Manitol Sal X NO EXISTE 4 Tiene la sección de bacteriología Agar Chocolate. X 5. Tiene la sección de bacteriología Agar Thayer Martin. X 6. Tiene la sección de bacteriología Agar XLD. X 7. Tiene la sección de bacteriología Agar TCBS X 8. Tiene la sección de bacteriología Agar SS. X 9. Tiene la sección de bacteriología Agar Sabouraud. X 10 Tiene la sección de bacteriología Agar Mycosel. X 11. Tiene la sección de bacteriología Caldo de Tioglicolato. X 12. Tiene la sección de bacteriología cepas ATCC de Streptococcus pyogenes. X* X 13 Tiene la sección de bacteriología cepas ATCC de Streptococcus pneumoniae 14. Tiene la sección de bacteriología cepas ATCC de Klebsiella pneumoniae X 15.Tiene la sección de bacteriología cepas ATCC de Escherichia coli X X 16.Tiene la sección de bacteriología cepas ATCC de Shigella sp. 17.Tiene la sección de bacteriología cepas ATCC de Proteus sp X* 18.Tiene la sección de bacteriología cepas ATCC de Staphylococcus aureus X 19.Tiene la sección de bacteriología cepas ATCC de Salmonella X Total del Puntaje 15 * Si ocasionalmente 4 112 Apéndice Nº 3 CUESTIONARIO DE EVALUACIÓN PARA EXISTENCIA DE REACTIVOS Y TINCIONES EN LA SECCIÓN DE BACTERIOLOGÍA DEL HOSPITAL LOS CHILES HOJA DE COTEJO REACTIVOS Y TINCIONES SI CUMPLE 1 Tiene la sección de bacteriología reactivo de catalasa. X 2. Tiene la sección de bacteriología reactivo de Ehrlich. X 3. Tiene la sección de bacteriología reactivo de oxidasa. X 4. Tiene la sección de bacteriología reactivo de coagulasa. X 5. Tiene la sección de bacteriología el set de antisueros para Salmonella y Shigella. X 6. Tiene la sección de bacteriología el set de tinción de Alcohol Ácido Resistente. X 7. Tiene la sección de bacteriología el set de tinción de Gram. X 8. Tiene la sección de bacteriología indicadores biológicos de esterilidad para autoclaves al vapor. X 9. Tiene la sección de bacteriología tiras térmicas reactivas para autoclaves al vapor. X 10. Tiene la sección de bacteriología papel para autoclavar. X Total del Puntaje 10 NO CUMPLE 0 113 Apéndice Nº 4 Cuestionario de Diagnóstico para la Jefatura del Laboratorio Clínico Hospital Los Chiles ¿Cuenta el laboratorio clínico del Hospital Los Chiles con algún sistema de la garantía de calidad? Explique NO, no cuenta con un sistema completo de la garantía de la calidad, se hacen cosas aisladas nada más. Recuerde que esto implica, decir lo que se hace, hacer lo que se dice, registrar lo que se hace y evaluar lo que se ha hecho, lo más importante es actuar sobre las diferencias. Cuando se solicita un manual de calidad, la gente tiende a copiar lo que se realiza en otros lados, y eso resulta un error, porque de antemano se sabe que no se va a poder cumplir, uno debe evaluar lo que se tiene para dejar establecido como se va a trabajar, y registrar. La mayoría del personal no le gusta registrar lo que hace, así haga un simple Gram, no lo anota, para saber qué se le hizo a ese cultivo y menos que vaya a buscar bacterias Gram Positivas o Gram Negativas como control, mucho menos va abrir una botella y le va a poner la fecha de apertura o fijarse si está vencido y hacerle control de calidad para saber si se puede utilizar por cuánto tiempo más. No cuenta con sistema de calidad, porque no hay recurso humano exclusivo para cada sección. Eso requiere toda una inversión que muy difícilmente el Hospital pueda financiar. Hay participación en los controles de calidad externo como por ejemplo, en bacterias cuando enviaban las incógnitas que hacía el INCIENSA, en química el control de calidad, o en parasitología cuando envían láminas pero eso no es suficiente. La Caja Costarricense de Seguro Social tiene una política de calidad total, pero no se ha pensado en los laboratorios clínicos ya que eso requiere inversión de personal y tiempo. ¿Se presupuesta anualmente recursos económicos para llevar a cabo control de calidad en la sección de bacteriología? 114 Si se presupuesta todo aquello que se detecta que haga falta, otra cosa es que se le asignen los recursos económicos. No hay una persona exclusivamente en bacteriología o que haya presentado a la dirección un sistema de control de calidad para que se implante. Falta de personal exclusivo de bacteriología, no se hace. Si el encargado de bacteriología solicita controles, estos se pueden comprar o conseguir. ¿Cuenta el laboratorio clínico con apoyo de la dirección médica del Hospital Los Chiles para aspectos de control de calidad? Quienes deben decidir si contratan un sistema de gestión de la calidad debe ser la Junta Directiva quien apoyará para que la Gerencia de los Recursos lo implante. De hecho, en los contratos de compra de reactivos se ha incluido control de calidad, control de calidad interno y en los contratos se ha pedido que las empresas den control de calidad externo. Pero esto es caro, encarece los reactivos, etc. Existe un manual técnico y administrativo de procedimientos que incluye una sección de calidad. Creo que si el laboratorio hace una propuesta para comprar reactivos o medios, o cepas para control de calidad, la Institución le da el dinero para comprar los reactivos. El problema es que no se plantea. ¿Cree usted que el laboratorio cuenta con recursos humanos, materiales, equipos e infraestructura suficientes para implementar un sistema de control de calidad? NO, definitivamente no en estos momentos. Aunque todo mundo habla de sistema de control de calidad, en realidad no se hace, no hay un análisis profundo para ver el comportamiento de las muestras, se diría que ni siquiera para tomar una decisión y decir, bueno revisemos qué pasó con este equipo, por qué esta prueba se comporta así, etc. Se ha gestionado la construcción de un nuevo laboratorio clínico para poder contar con los espacios físicos adecuados para cada sección, pero en este momento no hay presupuesto para tal fin. 115 ¿De ser su respuesta anterior negativa, qué recursos cree usted que necesita para implementar el control de calidad? Contratar una asesoría que no tenga nada que ver con el trabajo operativo, y junto con el personal operativo, puedan irse mejorando procesos. Esto no se hace de la noche a la mañana, ni se implanta tan rápido es toda una cultura. Luego de que se establece, tener una persona solamente en bacteriología para que pueda montar todas las pruebas con los controles, haga control de esterilidad, control de crecimiento en los medios, controles de temperatura en los equipos, etc. ¿En la sección de bacteriología, específicamente qué procedimientos se realizan en función del control de calidad? Ninguno, porque aunque están las cepas controles como las Escherichia coli, Pseudomonas, Staphylococcus aureus, no se montan sistemáticamente en el VITEK. Cuando las pruebas bioquímicas se hacían manuales, nos enseñaron en la universidad cuáles cepas se podían usar como control positivo y negativo, pero en la práctica eso no se realiza. En tuberculosis se envían las láminas al INCIENSA, y ellos colaboran en ver si las láminas están bien realizadas en cantidad y calidad de muestra, en tinción y en resultados. ¿Está el personal encargado de la sección de bacteriología capacitado en calidad? La educación universitaria en microbiología es buena, y siempre hablaba de montar un control, lo que pasa es que en la práctica las personas se olvidan de hacerlo o no hay tiempo Para lo que no está capacitado es para montar un sistema de gestión de la calidad que incluya un programa de aseguramiento de la calidad. ¿Existe un programa de educación continua que incluya tópicos de calidad? 116 Existen una especialidad en calidad en la UCR y una maestría en calidad del ICAP ¿Estaría dispuesta a valorar una propuesta de implementación para el control de calidad de la sección de bacteriología? Sí, todo aquello que sea para mejorar el servicio. Siempre y cuando se haga aterrizada en el departamento y con los recursos que se tiene allí, no se copie de ningún otro hospital, porque la sección de bacteriología no cuenta con el mismo recurso humano. 117 Apéndice Nº 5 Cuestionario de Diagnóstico para el Microbiólogo encargado de la Sección de Bacteriología Laboratorio Clínico Hospital Los Chiles ¿Cuenta la sección de bacteriología con algún sistema de la garantía de calidad? Explique Actualmente se realiza: Control de esterilidad medios de cultivo por incubación a 37°C. Control con indicadores químicos en cada corrida de esterilización de medios de cultivo. Control ocasional con bioindicadores en la esterilización de medios de cultivo Aún queda por implementar: Control de calidad de medios de cultivo (pH, control de crecimiento positivo) Control de calidad de reactivos. Control de calidad de identificación bacteriana con cepas de la ATCC y pruebas de sensibilidad de antibióticos. ¿Cuenta la sección de bacteriología con apoyo de la jefatura del laboratorio para realizar control de calidad? No se han manifestado acciones concretas que se puedan tomar para corregir la ausencia de un control de calidad integral. Es posible que con diálogo y voluntad se pueda comenzar a implementar controles básicos. ¿Cuenta la sección de bacteriología con recursos humanos, material y de equipos suficientes para implementar un sistema de control de calidad? No, usualmente el microbiólogo de la plaza de bacteriología debe reforzar otras secciones con mayor flujo de trabajo y tampoco hay ayuda técnica para aligerar 118 la carga de trabajo, además, debe asistir a las reuniones de diferentes comisiones. ¿De ser su respuesta anterior negativa, qué recursos cree usted que necesita para implementar el control de calidad? Al menos un microbiólogo dedicado exclusivamente a la sección de bacteriología, presupuesto para compra de cepas de la ATCC, controles y calibradores de peachímetro y bioindicadores de esterilidad. ¿En la sección de bacteriología, específicamente qué procedimientos se realizan en función del control de calidad? Control de esterilidad medios de cultivo por incubación a 37°C. Control con indicadores químicos en cada corrida de esterilización de medios de cultivo. Control ocasional con bioindicadores en la esterilización de medios de cultivo. ¿Ha recibido usted capacitación en control de calidad? No. ¿Existe un programa de educación continua que incluya tópicos de calidad? No. ¿Estaría dispuesto a valorar una propuesta de implementación para el control de calidad de la sección de bacteriología? Si. 119 Apéndice Nº 6 En el período comprendido entre enero del 2007 y diciembre del 2008, se procesaron un total de 2739 muestras, distribuidas de la siguiente manera (ver figura). Figura 7. Distribución de muestras recibidas en la sección de bacteriología del Hospital Los Chiles, de enero del 2007 a diciembre del 2008. Cuadro 7. Distribución de muestras recibidas en la sección de bacteriología del Hospital Los Chiles, de enero del 2007 a diciembre del 2008. Porcentaje Tipo de Total de Muestras de muestra muestras positivas positividad Urocultivos 2039 494 24,2 Coprocultivos 319 35 11,0 Hemocultivos 27 2 7,4 Secreciones 354 164 46,3 TOTAL 2739 695 25,4 Fuente: Libro de registro de muestras de bacteriología, Hospital Los Chiles, año 20072008 120 Apéndice Nº 7 Hoja de Registro Diario Microscopio Limpieza Externa 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Limpieza Oculares Limpieza de Objetivos Limpieza de Diafragma Mes Limpieza de Condensador Año Responsable 121 Apéndice Nº 8 Hoja de Registro Diario Sistema Vitek Limpieza Externa Cambio de Casete Calibración de Colorímetro 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 * Escherichia coli (ATCC 25922) *Staphylococcus aureus (ATCC 29213) Esterilidad de Sol. Trabajo Semanal Mes ATCC 25922* Mensual ATCC 29213* Mensual Año Responsable 122 Apéndice Nº 9 Hoja de Registro Diario Incubador 37°C Limpieza Externa Semanal 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Limpieza Interna Semanal Temperatura Mañana Temperatura Vespertina Mes Cambio de Agua Revisar Desecación Año Responsable 123 Apéndice Nº 10 Hoja de Registro Diario Refrigerador 4°C Limpieza Externa Semanal 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Limpieza Interna Mensual Temperatura Mañana Temperatura Vespertina Mes Año Descongelar Mensual Responsable 124 Apéndice Nº 11 Hoja de Registro Diario de Cámara de Bioseguridad tipo I Mes Año Limpieza Externa 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Limpieza Interna Registro de Horas de Filtro Responsable 125 Apéndice Nº 12 Hoja de Registro Diario de Pipetas Limpieza Externa 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Limpieza Interna Semanal Mes Año Revisión de conducto de succión Responsable 126 Apéndice Nº 13 Hoja de Registro Diario de Incineradores Limpieza Externa 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Revisión de enchufe y cable eléctrico Mes Revisión por rajaduras Año Responsable 127 Apéndice Nº 14 Hoja de Registro Diario de Lámpara Ultravioleta Limpieza Externa de Fluorescente UV 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Registro de Horas de Uso Mes Cambio de Fluorescente, cuando amerite. Año Responsable 128 Apéndice Nº 15 Hoja de Registro Semanal de los Reactivos Oxidasa Coagulasa Catalasa Mes Indol Año Responsable Fecha N° Lote Fecha de Caducidad Aspecto Físico* Control positivo Control Negativo * T Turbidez, P Precipitación, C Cambio de Color, SC Sin Cambios Apéndice Nº 16 Hoja de Registro Semanal de los Antisueros Tinción de Zielh Neelsen Tinción Shigella Shigella de disenteriae boydii Gram N° Lote Fecha de Caducidad Aspecto Físico* Control positivo Control Negativo * T Turbidez, P Precipitación, C Cambio de Color, SC Sin Cambios Mes Salmonella polivalente Año Responsable Fecha 129 Apéndice Nº 17 Hoja de Registro de preparación de Medios de Cultivos Agar Sangre Agar McConkey Agar Manitol Sal Agar SalmonellaShigella Mes Agar XLD Año Agar TCBC Agar Muller Hinton Caldo Tioglicolato N° Lote Fecha de Caducidad Fecha de Preparación Aspecto Físico del Medio Deshidratado* Aspecto Físico del Medio Preparado* pH Resistencia Agua Destilada. Esterilidad Responsable * H Hidratado, C Condensación, CC Cambio de Color, H Hemolisis, D Desecado, Co Coagulado Apéndice Nº 18 Hoja de Registro de Eficiencia de Medios de Cultivos Agar Sangre Streptococcus pyogenes Streptococcus pneumoniae Klebsiella pneumoniae Escherichia coli Proteus sp Staphylococcus aureus Salmonella sp Flora Mixta Vibrio cholerae Agar McConkey Agar Manitol Sal Agar SalmonellaShigella Mes Agar XLD Año Agar TCBS Agar Muller Hinton Caldo Tioglicolato 130 Apéndice Nº 19 Hoja de Registro Semanal de los Colorantes Tinción de Tinción de Zielh Neelsen Gram N° Lote Fecha de Caducidad Aspecto Físico* Control positivo Control Negativo * T Turbidez, P Precipitación, C Cambio de Color, SC Sin Cambios Mes Responsable Año Fecha 131 Apéndice Nº 20 Hoja de Registro de verificación de control de calidad de equipos. Mes Año Equipos Autoclave Microscopio Vitek Incineradores Incubador 01 02 03 04 05 06 07 08 09 10 12 13 14 15 * D Mantenimiento diario, S Mantenimiento semanal, M Mantenimiento mensual Refrigerador Pipetas Luz UV Cabina Responsable 132 Apéndice Nº 21 Hoja de Registro de verificación de control de calidad de equipos. Mes Año Equipos Autoclave Microscopio Vitek Incineradores Incubador 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 * D Mantenimiento diario, S Mantenimiento semanal, M Mantenimiento mensual Refrigerador Pipetas Luz UV Cabina Responsable 133 Apéndice Nº 22 Hoja de Registro de verificación de control de calidad de reactivos y tinciones. Mes Año Reactivos y Tinciones Catalasa Oxidasa Indol Coagulasa S. boydii S. flexnerii 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 * S Control de calidad semanal, A Apertura de nuevo lote S. disenteriae S. sonnei Salmonella T. Gram T. Acido Resistente Responsable 134 Apéndice Nº 23 Hoja de Registro de verificación de control de calidad de reactivos y tinciones. Mes Año Reactivos y Tinciones Catalasa Oxidasa Indol Coagulasa S. boydii 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 * S Control de calidad semanal, A Apertura de nuevo lote S. flexnerii S. disenteriae S. sonnei Salmonella T. Gram T. Acido Resistente Responsable 135 ANEXOS 136 Anexo Nº 1 Norma Internacional ISO 17025 Requisitos generales para la competencia de Laboratorios de ensayo y calibración. PERSONAL ISO 17025, apartado 5.2 1 Los análisis microbiológicos deben ser realizados o supervisados por una persona con experiencia y con titulación superior en microbiología o equivalente. Se admitirán otras titulaciones siempre que el personal tenga una amplia experiencia relacionada con el alcance de acreditación del laboratorio. El personal debe tener la necesaria experiencia profesional práctica para que se le permita realizar sin supervisión trabajos cubiertos por el alcance de la acreditación o se considere que tiene experiencia suficiente como para supervisar el trabajo acreditado. Algunas disposiciones específicas de la legislación nacional pueden sobrepasar las directrices contenidas en este documento. 2 Si el laboratorio incluye opiniones e interpretaciones de los resultados de los ensayos en sus informes, éstas deben ser realizadas por personal autorizado con experiencia suficiente y con conocimientos relacionados con la aplicación específica, incluyendo, por ejemplo, requisitos legislativos y tecnológicos y criterios de aceptabilidad. 3 La dirección del laboratorio debe asegurar que todo el personal haya recibido formación adecuada para que sean competentes en la realización de los ensayos y en el manejo de los equipos. Dicha formación incluirá entrenamiento en técnicas básicas, como preparación de placas, recuento de colonias, técnicas asépticas, etc., y la aceptabilidad se determinará aplicando criterios objetivos. El personal sólo podrá realizar análisis de muestras cuando se haya reconocido su competencia para hacerlo, o cuando lo haga bajo la supervisión adecuada. Se comprobará con criterios objetivos que el personal sigue siendo 137 competente y se proporcionará de nuevo formación siempre que sea necesario. Cuando un método o técnica no se utilice de manera regular, puede que sea necesario verificar la competencia del personal antes de realizar el ensayo. Se establecerá y documentará el intervalo crítico entre la realización de sucesivos ensayos. La interpretación de los resultados de los ensayos para la identificación y verificación de microorganismos depende en gran medida de la experiencia del analista que realiza el ensayo y debe vigilarse periódicamente con cada analista. 4 En algunos casos, puede que sea más apropiado relacionar la competencia con una técnica o instrumento en particular, más que con métodos. EQUIPOS – MANTENIMIENTO, CALIBRACIÓN Y VERIFICACIÓN DE SU FUNCIONAMIENTO ISO 17025, apartado 5.5 Como parte de su sistema de calidad, el laboratorio debe documentar e implantar un programa de mantenimiento, calibración y verificación del funcionamiento de sus equipos. 1 Mantenimiento (En la norma ISO 7218 se facilitan directrices sobre el mantenimiento de los equipos). 1.1 El mantenimiento de los equipos esenciales debe realizarse a los intervalos especificados dependiendo de factores tales como la frecuencia de uso. Se mantendrá un registro detallado de todas las operaciones realizadas. 1.2 El laboratorio debe adoptar medidas para evitar la contaminación cruzada causada por los equipos, como las siguientes: • el material desechable debe estar limpio o estéril, en función de su uso. 138 • el material de vidrio reutilizable debe estar debidamente limpio o estéril, en función de su uso. • lo ideal es que los laboratorios dispongan de una autoclave específica para descontaminación. No obstante, se podrá utilizar un único autoclave siempre que se tomen las debidas precauciones para separar las cargas de descontaminación y esterilización, y siempre que exista un programa documentado de limpieza para controlar las condiciones ambientales tanto internas como externas del autoclave. 1.2 En general, el mantenimiento de los siguientes equipos consistirá en limpieza y revisión, inspección de daños, verificación general y, si procede, esterilización: • equipos de uso general – aparatos de filtración, recipientes de vidrio o plástico (matraces, tubos de ensayo), placas Petri de cristal o plástico, instrumentos de muestreo, asas de siembra de platino, níquel/cromo o material de plástico desechable. • baños termostáticos, estufas, cabinas de seguridad microbiológica, autoclaves, homogeneizadores, refrigeradores y congeladores. • material volumétrico, como pipetas, dispensadores automáticos, y sembradores en espiral. • instrumentos de medida, como termómetros, cronómetros, balanzas, pH metros y contadores de colonias. 2 Calibración y verificación de equipos 2.1 El laboratorio debe establecer un programa de calibración y verificación de los equipos que puedan influir directamente en los resultados de los ensayos. La frecuencia de esas calibraciones y verificaciones se establecerá en función de la experiencia documentada y dependerá del uso, el tipo y el funcionamiento previo de los equipos. Los intervalos entre sucesivas calibraciones y verificaciones serán más cortos que el período de tiempo durante el cual se han observado desviaciones de los equipos fuera de los límites aceptables. 139 2.2 Equipos para medir la temperatura (a) Cuando la temperatura tenga un efecto directo en el resultado de un análisis o sea crítica para el correcto funcionamiento de un equipo, los equipos utilizados para medir la temperatura, como termómetros de columna líquida, termopares y termómetros de resistencia de platino (TRP) utilizados en estufas y autoclaves, tendrán que ser de una calidad apropiada para conseguir la precisión requerida. (b) La calibración de estos equipos debe ser trazable a patrones nacionales o internacionales de temperatura. Cuando la precisión lo permita, podrán utilizarse instrumentos que puedan demostrar el cumplimiento de especificaciones de fabricación apropiadas y aceptadas en el ámbito nacional o internacional (por ejemplo la norma ISO 1770 para los termómetros de columna líquida). Estos instrumentos pueden utilizarse, por ejemplo, para controlar la temperatura de frigoríficos y congeladores, y también de estufas y baños termostáticos cuando lo permita la tolerancia admitida en torno a la temperatura definida. El laboratorio debe verificar el correcto funcionamiento de estos instrumentos. 2.3 Incubadoras, baños termostáticos, estufas El laboratorio debe establecer inicialmente y documentar la estabilidad de la temperatura, la uniformidad de su distribución y el tiempo necesario para conseguir las condiciones de equilibrio en incubadores, baños termostáticos, estufas y salas con temperatura controlada, en particular con respecto a los usos típicos (por ejemplo, posición, espacio entre y altura de las pilas de placas Petri). La constancia de las características registradas en la validación inicial de los equipos debe verificarse y registrarse después de cualquier reparación o modificación importante. Los laboratorios deben controlar la temperatura de funcionamiento de este tipo de equipos y conservar registros. 140 2.4 Autoclaves, incluidos los preparadores de medios A continuación se resume el procedimiento más habitual para la calibración, verificación inicial y control del funcionamiento de estos equipos. No obstante, se reconoce que los análisis cuantitativos de materiales y especímenes procesados en el autoclave capaces de demostrar una variación aceptable dentro de un lote y entre diferentes lotes pueden proporcionar una garantía de calidad equivalente. (a) Las autoclaves deben cumplir las tolerancias de tiempo y temperatura especificadas. No es aceptable la utilización de autoclaves provistas sólo de un manómetro. Los sensores utilizados para controlar o vigilar los ciclos tienen que ser calibrados, además de verificar el correcto funcionamiento de los cronómetros. (b) La validación inicial debe incluir estudios de funcionamiento (estudios de la distribución espacial de la temperatura) para los distintos ciclos y las distintas configuraciones de la carga que se utilicen en la práctica. Este proceso tiene que repetirse después de cada reparación o modificación importantes (como sustitución del termostato o programador, disposición de la carga, ciclo de operación) o cuando así lo indiquen los resultados de los controles de calidad realizados a los medios. Debe colocarse un número suficiente de sensores de temperatura dentro de la carga (p. ej., en recipientes llenos de líquido o medio) para poder demostrar diferencias según la colocación. En el caso de preparadores de medios, cuando no se pueda demostrar un calentamiento uniforme de otra manera, en general es necesario utilizar dos sensores, uno colocado al lado del sensor de temperatura y el otro lejos de él. Tanto en la validación inicial como en las validaciones posteriores debe considerarse la idoneidad de los tiempos de subida y bajada de la temperatura, así como el tiempo que se mantiene la temperatura de esterilización. (c) El laboratorio debe establecer instrucciones claras de funcionamiento basándose en los perfiles de calentamiento determinados para los usos típicos durante la validación inicial y las posteriores. Debe establecer criterios de 141 aceptación/rechazo y mantener un registro de las operaciones del autoclave, incluida la temperatura y el tiempo, para cada ciclo. (d) El control puede realizarse mediante una de las siguientes formas: (i) utilizando un termopar y un aparato registrador para obtener un gráfico impreso. (ii) por observación directa y registro de la temperatura máxima alcanzada y el tiempo que se mantiene esa temperatura. Además de controlar directamente la temperatura del autoclave, puede comprobarse la eficacia de su funcionamiento durante cada ciclo mediante la utilización de indicadores químicos o biológicos para fines de esterilización y descontaminación. La cinta de autoclave o las tiras indicadoras deben utilizarse sólo para distinguir que una carga ha sido procesada, pero no para demostrar que ha finalizado un ciclo aceptable. 2.5 Pesas y balanzas Las pesas y balanzas deben calibrarse a intervalos regulares, demostrando su trazabilidad (de acuerdo al uso previsto). 2.6 Material volumétrico (a) Los laboratorios de microbiología pueden utilizar material volumétrico como dispensadores automáticos, dispensadores/diluidores, pipetas manuales o automáticas y pipetas desechables. Los laboratorios deben realizar una verificación inicial del material volumétrico y, a partir de ahí, controles periódicos para garantizar que los equipos cumplen en todo momento las especificaciones requeridas. Dicha verificación no será necesaria con el material de vidrio que haya sido certificado para una tolerancia específica. En los equipos se verificará la exactitud del volumen dispensado frente al volumen prefijado (para varios volúmenes cuando se trate de instrumentos de volumen variable) y se determinará la precisión de los volúmenes dispensados repetidas veces. 142 (b) Es conveniente que el material volumétrico desechable ‘de un solo uso’ sea suministrado por empresas con un sistema de calidad reconocido y relevante. Después de la validación inicial de la idoneidad del material, se recomienda realizar controles aleatorios de su exactitud. Si la empresa proveedora no tiene un sistema de calidad reconocido, el laboratorio debe verificar cada lote de material. 2.7 Otros equipos Los conductivímetros, los medidores de oxígeno, los pH-metros y otros instrumentos similares deben verificarse periódicamente o antes de cada uso. Los tampones utilizados en estas verificaciones deben conservarse en condiciones apropiadas y marcarse con la fecha de caducidad. Si la humedad influye en el resultado del ensayo, los higrómetros deberán calibrarse, siendo la calibración trazable a patrones nacionales o internacionales. Los cronómetros, incluido los de las autoclaves, deben verificarse utilizando un cronómetro calibrado o la señal horaria nacional. Cuando se utilizan centrifugas en los procedimientos de ensayo, debe evaluarse si la fuerza centrífuga se puede considerar crítica. En el caso de que sea crítica, la centrifugadora tendrá que ser calibrada. REACTIVOS Y MEDIOS DE CULTIVO ISO 17025, apartados 4.6 y 5.5 1 Reactivos El laboratorio debe asegurarse de que la calidad de los reactivos utilizados sea apropiada para los ensayos realizados. Debe verificar la idoneidad de cada uno 143 de los lotes de reactivos críticos para el ensayo, al inicio y durante su período de validez, utilizando microorganismos de control positivo y negativo que sean trazables a colecciones de cultivos nacionales o internacionales reconocidas. 2 Medios preparados internamente 2.1 Siempre que sea necesario, se verificará que los medios de cultivo, diluyentes y otras suspensiones preparadas internamente tengan las características adecuadas con respecto a: • recuperación o supervivencia de los microorganismos de interés. • inhibición o supresión de los microorganismos no deseados. • propiedades bioquímicas (diferenciales y diagnósticas). • propiedades físicas (por ejemplo, pH, volumen y esterilidad). Para la evaluación de la recuperación o la supervivencia son preferibles los procedimientos cuantitativos (Norma ISO 11133 Partes 1 y 2). 2.2 Los materiales de partida (tanto formulaciones comerciales deshidratadas como los componentes individuales) deben conservarse en las condiciones apropiadas; por ejemplo, en un lugar fresco, seco y oscuro. Todos los recipientes, especialmente los que contengan medios deshidratados, deben estar herméticamente cerrados. No deben utilizarse medios deshidratados que presenten apelmazamiento o un cambio de color. Para la preparación de medios debe utilizarse agua destilada, desionizada o de ósmosis inversa, libre de substancias bactericidas, inhibidoras o interferentes, salvo que el método del ensayo especifique otra cosa. 2.3 Debe determinarse y verificarse el período de validez de los medios preparados en las condiciones de conservación especificadas. 3 Medios listos para su uso 3.1 Todos los medios (y diluyentes y otras suspensiones) que se suministren en una forma directamente utilizable o parcialmente completa deben ser 144 validados antes de su utilización. La evaluación de su efecto en la recuperación o supervivencia de los microorganismos de interés y la inhibición o supresión de los microorganismos no deseados tiene que ser plenamente cuantitativa; los atributos (por ejemplo, propiedades físicas y bioquímicas) deben evaluarse utilizando criterios objetivos. 3.2 Como parte de la validación, el laboratorio tiene que estar debidamente informado de las especificaciones de calidad del fabricante, que como mínimo incluirán lo siguiente: • Nombre de los medios y lista de componentes, incluido cualquier suplemento. • Período de validez y criterios de aceptabilidad aplicados. • Condiciones de conservación. • Plan y frecuencia de muestreo. • Control de esterilidad. • Control del crecimiento de los microorganismos de interés y de los microorganismos no deseados (con referencias a sus colecciones de cultivos) y criterios de aceptabilidad. • Controles físicos y criterios de aceptabilidad aplicados. • Fecha de emisión de las especificaciones 3.3 Los lotes de medios deben estar debidamente identificados. Cada lote recibido debe ir acompañado de evidencias del cumplimiento de las especificaciones de calidad. El laboratorio debe asegurarse de que el fabricante notifique cualquier cambio en las especificaciones de calidad. 3.4 Cuando el fabricante del medio suministrado en una forma directamente utilizable o parcialmente completa disponga de un sistema de calidad reconocido (por ejemplo, certificación según ISO 9000), el laboratorio podrá verificar en la validación inicial que el material suministrado cumple las especificaciones establecidas, partiendo del supuesto de que dicho material es homogéneo. En otras circunstancias, será necesario realizar controles adecuados de cada lote recibido. 145 4 Etiquetado El laboratorio debe asegurarse de que todos los reactivos incluidas las soluciones de reserva, medios, diluyentes y otras suspensiones estén debidamente etiquetados, indicando, según sea apropiado, identidad, concentración, condiciones de conservación, fecha de preparación, fecha de caducidad validada y/o períodos recomendados de almacenamiento. Asimismo, los registros deben permitir la identificación de la persona responsable de la preparación. MATERIALES DE REFERENCIA Y CEPAS DE REFERENCIA ISO 17025, apartado 5.6.3 1 Materiales de referencia Los materiales de referencia y los materiales de referencia certificados proporcionan la trazabilidad esencial en las mediciones y son utilizados, por ejemplo, para • demostrar la exactitud de los resultados. • calibrar equipos. • controlar la calidad del laboratorio. • validar métodos. • permitir la comparación de métodos. Siempre que sea posible, los materiales de referencia deben utilizarse con matrices apropiadas. 2 Cepas de referencia 2.1 Las cepas de referencia son necesarias para demostrar que los medios (incluidos los kits de análisis) poseen unas características aceptables, para validar métodos y para controlar que se mantienen sus características. La 146 trazabilidad es necesaria, por ejemplo, al establecer las características de los medios utilizados en kits de análisis y validaciones de métodos. Para demostrar la trazabilidad, el laboratorio debe utilizar cepas de referencia de microorganismos obtenidos directamente de una colección nacional o internacional reconocida, cuando exista alguna. Alternativamente también podrían utilizarse cepas comerciales siempre que el laboratorio pueda demostrar en el momento de su uso que todas las propiedades relevantes son equivalentes. 2.2 Según establecen las directrices contenidas en la norma ISO 11133-1, las cepas de referencia podrán ser subcultivadas una vez para obtener cepas de reserva, realizando en paralelo los controles de pureza y ensayos bioquímicos que sean necesarios. Se recomienda conservar las cepas de reserva en alícuotas ultracongeladas o liofilizadas. Si las cepas de reserva se han descongelado, no deben volver a congelarse y reutilizarse. 2.3 Las cepas de trabajo no deben ser subcultivadas salvo que así se requiera y se defina en un método normalizado o que el laboratorio pueda aportar evidencias documentadas de que no se ha producido ningún cambio en ninguna propiedad importante. Las cepas de trabajo no deben ser subcultivadas para sustituir las cepas de reserva. Los derivados comerciales de las cepas de referencia pueden utilizarse sólo como cepas de trabajo. MUESTREO ISO 17025, apartado 5.7 1 En muchos casos, los laboratorios de ensayo no son responsables del muestreo inicial para obtener los especímenes del ensayo. En el caso de que lo sean, es muy recomendable que el muestreo esté cubierto por un sistema de aseguramiento de la calidad, e idealmente, por una acreditación. 2 El transporte y conservación de las muestras deben hacerse en unas condiciones apropiadas para mantener su integridad (por ejemplo, refrigeradas 147 o congeladas, según sea necesario). Dichas condiciones deben ser controladas, manteniendo un registro de las mismas. Cuando sea apropiado, se documentará claramente quién es el responsable del transporte, la conservación de las muestras entre el muestreo y su entrega al laboratorio de ensayo. Una vez obtenidas, las muestras se analizarán lo antes posible. 3 El muestreo debe ser realizado únicamente por personal debidamente cualificado. El muestreo se efectuará en condiciones asépticas utilizando material estéril. Cuando sea aplicable, las condiciones ambientales, como la contaminación atmosférica y la temperatura, se vigilarán y registrarán en el lugar del muestreo. Asimismo, se registrará la hora en que se realiza el muestreo. MANIPULACIÓN E IDENTIFICACIÓN DE MUESTRAS ISO 17025, apartados 5.7 y 5.8 1 Hay que tener en cuenta que la flora microbiana puede ser sensible a factores tales como temperatura o duración del almacenamiento y transporte, por lo que es importante verificar y registrar el estado de la muestra cuando se recibe en el laboratorio. 2 El laboratorio debe disponer de procedimientos para la entrega e identificación de muestras. Si la muestra es insuficiente o se encuentra en mal estado por deterioro físico, temperatura inapropiada, envase roto o etiquetado defectuoso, el laboratorio debe consultar con el cliente antes de decidir si analiza o rechaza la muestra. En cualquier caso, debe indicar su estado en el informe del ensayo. 3 El laboratorio debe registrar toda la información relevante y, en particular, lo siguiente: (a) fecha y cuando sea oportuno, hora de la llegada de la muestra. (b) estado de la muestra en el momento de su entrega y cuando sea necesario, temperatura. 148 (c) características de la operación de muestreo (fecha de muestreo, condiciones de muestreo, etc.). 4 Las muestras que se encuentren a la espera de ser analizadas deben almacenarse en condiciones adecuadas para reducir al mínimo cualquier modificación en la población microbiana presente. El laboratorio debe definir y registrar dichas condiciones de conservación. 5 El envase y etiquetado de las muestras puede estar altamente contaminado, las muestras deben manipularse y almacenarse con precaución para evitar que se propague la contaminación. 6 El submuestreo realizado por el laboratorio inmediatamente antes del ensayo se considera parte del método de ensayo y debe efectuarse conforme a normas nacionales o internacionales, si es que existen, o a métodos internos validados. Los procedimientos de submuestreo deben diseñarse teniendo en cuenta la distribución heterogénea de los microorganismos (en ISO 6887 y ISO 7218 pueden encontrarse directrices generales). 7 Debe existir un procedimiento documentado para la conservación y eliminación de muestras. Las muestras deben conservarse hasta que se hayan obtenido los resultados del ensayo, o más tiempo según sea necesario. Cuando se sepa que algunas porciones de muestras de ensayo del laboratorio están altamente contaminadas, deben descontaminarse antes de su eliminación. ELIMINACIÓN DE RESIDUOS CONTAMINADOS La correcta eliminación de materiales contaminados puede no afectar directamente a la calidad de los análisis de las muestras, aunque los procedimientos deben diseñarse para reducir al mínimo la posibilidad de contaminación del lugar donde se realiza el ensayo o los materiales utilizados en el mismo. No obstante, es un aspecto de la correcta gestión de un 149 laboratorio y debe respetarse la legislación nacional e internacionales sobre medio ambiente, salud y seguridad (Norma ISO 7218). ASEGURAMIENTO DE LA CALIDAD DE LOS RESULTADOS/CONTROL DE CALIDAD ISO 17025, apartado 5.9 1 Control de calidad interno 1.1 El control de calidad interno consiste en todos los procedimientos realizados por un laboratorio para la evaluación continua de su trabajo. El principal objetivo es asegurar la coherencia de los resultados obtenidos diariamente y el cumplimiento de los criterios establecidos. 1.2 Un programa de controles periódicos es necesario para demostrar que controla la variabilidad (por ejemplo, entre analistas y entre equipos o materiales, etc.). Dicho programa debe abarcar todos los ensayos incluidos en el alcance de acreditación del laboratorio. El programa puede incluir: • el uso de muestras inoculadas. • el uso de materiales de referencia (incluidos los materiales utilizados en ensayos de aptitud). • uso de replicados. • recuentos cruzados entre analistas. El intervalo entre estos controles dependerá del diseño del programa y del número de ensayos realizados. Es recomendable que, en la medida de lo posible, los ensayos incluyan controles para evaluar sus resultados. 1.3 En circunstancias especiales, un laboratorio puede estar acreditado para realizar un ensayo que rara vez se demanda. Se reconoce que, en tales casos, un programa continuo de control interno de la calidad no siempre será apropiado, siendo preferible un sistema que se realice en paralelo al ensayo y que demuestre que los resultados son satisfactorios. 150 1 Control de calidad externo (ensayos de aptitud) 2.1 Los laboratorios deben participar regularmente en ensayos de aptitud relacionados con el alcance de su acreditación, y dar preferencia a los programas de ensayos de aptitud que utilicen matrices apropiadas. En algunos casos concretos, esta participación puede ser obligatoria. 2.2 Los laboratorios deben utilizar el control externo de la calidad no sólo para detectar desviaciones en los resultados obtenidos, sino también para verificar la validez de todo el sistema de calidad. INFORMES DE LOS ENSAYOS ISO 17025, apartado 5.10 1 Si el resultado del recuento es negativo, debe expresarse como “no detectado para una unidad definida” o “por debajo del límite de detección para una unidad definida”. El resultado no debe expresarse como “cero para una unidad definida” salvo que sea un requisito reglamentario. Los resultados de los análisis cualitativos deben expresarse como “detectado/no detectado en una cantidad o volumen definidos”. También pueden expresarse como “por debajo de un número especificado de microorganismos para una unidad definida”, cuando el número especificado de microorganismos sobrepase el límite de detección del método y así se haya acordado con el cliente. 2 Cuando en el informe de un ensayo se exprese una estimación de la incertidumbre, tendrá que indicarse claramente al cliente cualquier limitación existente (especialmente si la estimación no incluye la contribución de la distribución de microorganismos dentro de la muestra). En general un control de calidad en microbiología debe ser capaz de identificar, monitorear, evaluar y aprobar metodologías relativas al cuidado del paciente, bajo esta premisa es que se hace imprescindible el monitoreo de los medios de cultivos, reactivos, instrumentos, procedimientos y el personal, para 151 asegurar una adecuada práctica en el aislamiento, identificación y caracterización de agentes etiológicos y su correspondiente prueba de susceptibilidad como una guía de la terapia. Por otro lado, el aseguramiento de la calidad, es un concepto un tanto más difícil de cuantificar que el control de calidad, ya que su foco es el impacto de las pruebas de laboratorio en el cuidado del paciente. Este control nos indica qué tan bueno es nuestro trabajo y establece mecanismos para asegurar la generación de información de utilidad clínica rápida y segura. Este concepto incluye entrenamiento y calificación del personal, evaluación de los reportes, rapidez y seguridad diagnóstica, certificación de los laboratorios, controles externos, etc. El Control de Calidad y el Aseguramiento de la Calidad son similares en sus propósitos, aunque su significado y su manera de funcionar sean diferentes; sin embargo, ambos conceptos deben desarrollarse interactivamente durante un sistema de control de calidad. 152 Anexo Nº 2 Glosario Agentes etiológicos: Agente infeccioso. Un organismo (virus, bacteria, hongo, protozoo, helminto) o proteína (prion) que tiene la capacidad de producir una infección o enfermedad infecciosa. Infectividad expresa la habilidad de dicho organismo para entrar, sobrevivir y multiplicarse en el hospedero. Aislamiento: En relación con los enfermos, consiste en la separación de personas y animales infectados del resto, durante el periodo de transmisibilidad de la enfermedad, en lugares y condiciones que eviten o limiten la transmisión directa o indirecta del agente infeccioso a huéspedes susceptibles o que puedan transmitir la enfermedad a otros. Baciloscopía: Metodología diagnóstica que utiliza la tinción de ácido- resistencia en tres muestras seriadas de esputo (flema) para la observación del bacilo tuberculoso. Bacteria: Cualquier microorganismo unicelular de la clase de los esquizomicetos. Bacteriología: Ciencia que estudia las bacterias. Biología Molecular: Rama de la biología que estudia la fisiología al nivel de las moléculas. Bioquímica: Parte de la biología que estudia la constitución química de los organismos vivos y los procesos vitales. Cepa: Organismo que presenta un fenotipo característico reproducible de una generación a la otra. 153 Cocos de gram positivos: Bacteria de forma esférica, redondeada u oval que se colorea azul en la tinción Gram. Control de calidad externo: Es la comparación de los resultados obtenidos por los diferentes grupos participantes en una misma muestra. Control de calidad interno: Son todas aquellas actividades que se realizan internamente para asegurar la validez de los resultados. Diagnóstico médico: Identificación de una enfermedad o trastorno. Esterilidad: Se entiende por esterilidad la ausencia total de microorganismos viables. Exactitud: Se refiere a qué tan cerca del valor real se encuentra el valor medido. En términos estadístico, la exactitud está relacionada con el sesgo de una estimación. Cuanto menor es el sesgo más exacta es una estimación. Extendido: Capa fina de cualquier muestra clínica sobre lámina de vidrio para su observación. Medio de cultivo: Solución que cuenta con los nutrientes necesarios para recuperar, multiplicar, aislar e identificar los microorganismos (bajo condiciones favorables de temperatura y pH), así como efectuar pruebas de susceptibilidad. Generalmente se presentan desecados en forma de polvo fino o granular antes de ser preparados, o en estado sólido, semisólido y líquido. Medio de cultivo selectivo: son aquellos medios sólidos y que están diseñados para el aislamiento de microorganismos específicos. Medio de cultivo no selectivo: Son aquellos medios sólidos o líquidos diseñados para el aislamiento primario de cualquier bacteria. Microbiología: Rama de la biología que estudia los microorganismos, incluyendo las algas, bacterias, virus, hongos, protozoos y rikettsias. 154 Microbiólogo: Especialista en microbiología. Microorganismo: Cualquier organismo diminuto, habitualmente microscópico, capaz de realizar los procesos vitales. Puede ser patógeno. Entre los cuales se incluyen bacterias, hongos, virus y protozoos. Muestras incógnitas: Muestras que contienen microorganismos desconocidos y que se utilizan como parte del control externo de la calidad. Patrón de McFarland: Soluciones de sulfato de bario a diferentes concentraciones que se utilizan para preparar suspensiones bacterianas por el método de comparación Patrones de susceptibilidad a los antibióticos: Perfil de sensibilidad o resistencia de las bacterias cuando se enfrentan a diversos antibióticos in vitro. Precisión: Se refiere a la dispersión del conjunto de valores obtenidos de mediciones repetidas de una magnitud. Cuanto menor es la dispersión mayor la precisión. Una medida común de la variabilidad es la desviación estándar de las mediciones y la precisión se puede estimar como una función de ella. Programa de Vigilancia Epidemiológica: Es el conjunto de acciones y responsables de observar el comportamiento de las enfermedades en cuanto a incidencia, distribución y etiología. Pruebas de identificación bacteriana: Metodologías utilizadas en la identificación de las diferentes especies bacterianas. Prueba de sensibilidad a los antibióticos: Metodologías utilizadas para determinar los diferentes perfiles de sensibilidad o resistencia de las bacterias a los antibióticos en el laboratorio. 155 Sistemas de control de calidad: Es el engranaje que se encarga de planear, ejecutar, coordinar y controlar todas las actividades que tienen como fin último entregar al cliente un producto de la calidad requerida por él. Suspensión bacteriana: Se refiere a una cantidad determinada de bacterias suspendidas en un medio líquido. Tarjetas de identificación: Dispositivo plástico que contiene las diferentes pruebas bioquímicas miniaturizadas, para la identificación bacteriana en equipos automatizados. Técnicas miniaturizadas: Metodologías de identificación bacteriana manuales que utilizan volúmenes de reacción reducidos en comparación con métodos tradicionales. Tinción: Pigmento, contraste o sustancia que se utiliza para imprimir color a los tejidos u objetos microscópicos a fin de facilitar su observación, exploración e identificación. Tinción de acido-resistencia: Tinción utilizada en bacteriología para diferenciar microorganismos que resisten la decoloración con alcohol-ácido. Tinción de Gram: Tinción utilizada en bacteriología para clasificar a las bacterias como Gram positivas (azules) y Gram negativas (rojas). Validez: Que es válido o capaz de producir su efecto. 156 Anexo Nº 3 Indicaciones para toma de muestra de urocultivo Utilizar frasco estéril suplido por el laboratorio clínico. Recoger la primera orina de la mañana o retener la orina durante tres horas como mínimo. Lavar los genitales con agua y jabón y enjuagar con abundante agua. Mujeres: Separar los labios mayores vulvares para tomar la muestra. Descarte la primera porción de la micción (primer chorro). Recoja la segunda porción de orina en el frasco estéril. No es necesario llenar más de la mitad del frasco. Cerrar bien el frasco de inmediato. Varones: En pacientes no circuncidados retraiga el prepucio para tomar la muestra. Descarte la primera porción de la micción (primer chorro). Recoja la segunda porción de orina en el frasco estéril. No es necesario llenar más de la mitad del frasco. Cerrar bien el frasco de inmediato. 157 Anexo Nº 4 Indicaciones para toma de muestra de coprocultivo Utilizar un recipiente de boca ancha para recoger las heces, no es necesario que esté estéril, solo es preciso que esté limpio, el mismo no debe contener restos de jabones, detergentes, desinfectantes o iones metálicos. Si la persona no puede colectar la muestra de heces directamente en el frasco, se deberá recoger con espátula o bajalenguas de un bidé. La cantidad mínima necesaria en el caso de heces pastosas es del tamaño de un frijol y si son heces líquidas entre 5 y 10 ml, aproximadamente el volumen equivalente a dos cucharadas. 158 Anexo Nº 5 Indicaciones para toma de muestra de hemocultivo El procedimiento de extracción de sangre para la realización de hemocultivos se debe llevarse a cabo, cumpliendo las máximas precauciones de asepsia. 1. Lavarse las manos. 2. Colocar torniquete y campo estéril. 3. Palpar la vena a puncionar. 4. Realizar antisepsia con alcohol 70% en una zona de piel de unos 10 cm de diámetro alrededor del sitio de punción. Se comenzará por el centro y se irán haciendo círculos concéntricos hacia el exterior. 5. Repetir el procedimiento utilizando Yodo povidona al 10%. 6. Dejar actuar 1-2 minutos, esto es: hasta que se seque el antiséptico sobre la piel. 7. Mientras actúa el iodóforo, desinfectar el tapón de goma del frasco de hemocultivo con alcohol 70%. 8. Colocarse los guantes estériles. 9. Extraer la sangre sin tocar en ningún momento el campo desinfectado. Si fuera necesario palpar nuevamente la vena se cambiará los guantes estériles y se realizará nueva antisepsia de piel. 10. Inyectar directamente la sangre en el frasco. No es necesario cambiar de aguja. 11. Mover los frascos para que la sangre y el medio de cultivo se mezclen. 12. La cantidad de sangre a introducir en cada botella es de 10 ml en el caso de pacientes adultos y en caso de neonatos y niños pequeños de 1-5 ml por frasco. 13. Se debe inocular dos frascos de hemocultivos por paciente, previos al tratamiento antimicrobiano. El intervalo entre las extracciones es suficiente con una hora, pero cuando exista una gran urgencia en iniciar el tratamiento, este intervalo puede acortarse hasta 15 minutos o se pueden extraer dos muestras simultáneas de diferentes sitios de punción. 159 Anexo Nº 6 Indicaciones para toma de muestra de secreción vaginal Se le debe indicar a la paciente que no utilice soluciones antisépticas vaginales, óvulos ni pomadas en los días previos a la recolección de la muestra, además, no debe mantener relaciones sexuales 48 hs antes de la toma de muestra. La paciente debe colocarse en posición ginecológica para que se le pueda introducir un espéculo “sin lubricante” (si fuera necesario lubricar, utilizar solo agua tibia) El médico recogerá la muestra, bajo visión directa con un hisopo de dacrón, del fondo del saco vaginal posterior y repetirá la operación con un segundo hisopo, el cual se colocará en un tubo con suero fisiológico estéril. Cuando el médico sospeche de infección por Neisseria gonorrhoeae, deberá enviarse muestra endocervical, para lo cual deberá recolectar exudado endocervical de la siguiente manera: limpiar el exocérvix de secreciones vaginales, con una torunda seca de dacrón y bajo visión directa comprimir cuidadosamente el cérvix con palas del espéculo e introducir un hisopo en el canal endocervical con un suave movimiento de rotación. 160 Anexo Nº 7 Indicaciones para toma de muestra de esputo por BK Recolección de esputos Utilizar frasco estéril de boca ancha y hermético suplido por el laboratorio clínico. El paciente debe recoger 3 muestras en 3 días sucesivos. Indicarle al paciente que debe enjuagarse la boca con agua y obtener el esputo tras una expectoración profunda luego de un esfuerzo de tos, preferentemente matinal. El paciente debe de recoger un mínimo de 2cc de flema Debe llevar la muestra lo más pronto posible al laboratorio de lo contrario se debe mantener en un lugar fresco y ventilado no más de 24 horas y empacado en una bolsa plástica cerrada. Si el paciente no puede recoger el esputo de forma espontánea, se le debe indicar al personal de salud para que ellos recolecten la muestra por medio de inducciones con nebulizaciones de suero fisiológico estéril tibio (15 ml durante 10 minutos), siendo útil además realizar un drenaje postural o fisioterapia respiratoria. Si no se obtiene muestra representativa del tracto respiratorio inferior, es inútil insistir con esta técnica diagnóstica.