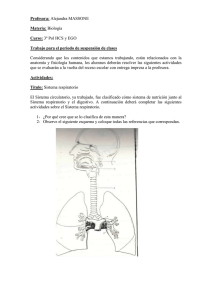
fisiología respiratoria
Anuncio

El enfermo crítico 2. Respiratorio FISIOLOGÍA RESPIRATORIA INTRODUCCIÓN El aparato respiratorio es el encargado de la respiración, es decir del conjunto de mecanismos por los cuales las células toman oxígeno (O2) y eliminan el dióxido de carbono (CO2) que producen. Está formado por: Vía aérea. Circulación menor o pulmonar. Esqueleto torácico y músculos toracoabdominales. SNC con vías aferentes y eferentes. VÍA AÉREA Es el conjunto de conductos por donde va a circular el aire desde el medio ambiente hasta los pulmones. Se van a clasificar de acuerdo a su ubicación en (figura 1): Vías aéreas superiores: desde las narinas hasta los bronquios principales. Vías aéreas inferiores: desde los bronquios principales hasta los bronquiolos terminales. 04. Fisiología respiratoria 1 - 53 El enfermo crítico 2. Respiratorio Figura 1: anatomía del aparato respiratorio. La vía aérea se inicia en la nariz, que acondiciona el aire inspirado humidificándolo y calentándolo a 37°C, gracias a la gran vascularización de su mucosa. Además, constituye una primera barrera física para el paso de partículas (con el moco y los pelos). Estas defensas mecánicas son complementadas por el reflejo del estornudo y la presencia de tejido linfoideo y anticuerpos. Continúa con la faringe, donde se une la cavidad oral, conformando una entrada alternativa para el aire cuando hay obstrucción nasal y/o cuando se necesita aumentar la ventilación. La laringe es el órgano muscular y cartilaginoso encargado de la fonación y está situada en una encrucijada importante entre las vías respiratoria y digestiva. Un complejo mecanismo que termina en el cierre de la epiglotis, protege al aparato respiratorio de la entrada de elementos extraños durante la deglución o el vómito. Si este mecanismo se altera, pueden producirse lesiones respiratorias graves por broncoaspiración. La laringe participa también en el reflejo defensivo de la tos. Las vías respiratorias infralaríngeas adoptan forma de árbol, cuyo tronco es la tráquea con un trayecto de 12 a 15 cm, y situada en la línea media de cuello y de tórax. Su estabilidad está asegurada por los anillos traqueales de cartílago, con forma de C abierta en su cara posterior. El árbol bronquial está tapizado por mucosa ciliada que, en combinación con las glándulas mucosas, constituye el sistema mucociliar, actuando como una cinta transportadora de mucus, a una velocidad constante de 20 mm/min, que atrapa por adherencia las partículas que han sobrepasado la barrera nasal para expulsarlas. Al llegar a la faringe, el mucus se deglute imperceptiblemente. A la altura de la articulación del apéndice xifoides con el esternón, la tráquea termina en la carina, donde se divide en los dos bronquios principales, derecho e izquierdo. Hay que tener en cuenta que el bronquio derecho se desvía menos del eje de la tráquea, por lo que es más frecuente que los cuerpos extraños aspirados se desvíen hacia él. Por sucesivas divisiones de los bronquios principales, se van formando los diferentes bronquios lobares, bronquios segmentarios y bronquios subsegmentarios, que se caracterizan por presentar placas de cartílago incompletas, más escasas a medida que se avanza hacia la periferia. Hasta llegar a los bronquiolos terminales, que constituyen el final de las vías exclusivamente de conducción. Los bronquiolos siguientes se denominan respiratorios, por presentar en sus paredes alvéolos. El conjunto de bronquios, vasos y nervios que entran o salen del pulmón lo hace por la parte media de la cara mediastínica, formando una especie de tallo denominado hilio, identificable en rayos X. Cada pulmón presenta una gran fisura oblicua (cisura mayor) que se dirige desde la parte alta de la cara posterior a la parte anterior del borde inferior. Esta fisura es profunda y llega hasta cerca del hilio, dividiendo el pulmón en un lóbulo superior y otro inferior. El pulmón derecho presenta otra fisura (cisura menor) que parte del plano medial a la altura del 4° cartílago costal y se dirige horizontalmente hasta terminar en la cisura oblicua, separándose así un tercer lóbulo, llamado medio. La pleura visceral envuelve casi completamente cada lóbulo, penetrando hasta el fondo de las cisuras. 04. Fisiología respiratoria 2 - 53 El enfermo crítico 2. Respiratorio ALVÉOLOS Constituyen el lugar donde se realiza el intercambio aéreo, es decir el punto final donde llega el O2 antes de pasar a la sangre. Son unas estructuras huecas, hemisféricas, de aproximadamente 0’25 mm de diámetro, cuyo contenido aéreo está en permanente renovación y en el espesor de cuyas paredes circula sangre a través de una densa malla capilar. El número total de alvéolos oscila entre 200 y 500 millones, y su superficie total entre 40 y 100 m2, dependiendo, entre otros factores, de la talla corporal. Comienzan a aparecer en la vía aérea después de los bronquiolos terminales, constituyendo en primer término los bronquiolos respiratorios, luego los sacos alveolares y, finalmente, los alvéolos propiamente dichos (figura 2). La cavidad alveolar está tapizada por 2 tipos de células: Neumocitos tipo I: a pesar de ser escasas en número, estas células cubren más del 90% de la superficie alveolar, debido a que son muy planas y alargadas. Cuando los neumocitos I contactan con los capilares de la pared alveolar, su membrana basal se fusiona con la del endotelio, de manera que los gases sólo tienen que atravesar el citoplasma del neumocito, las membranas basales fusionadas y el citoplasma del endotelio capilar. Neumocitos tipo II: son células cuboideas, más numerosas que las anteriores y que sintetizan el surfactante pulmonar. Éste disminuye la tensión superficial de la capa de líquido que recubre la superficie interna de los alvéolos, impidiendo el colapso alveolar. Cuando los neumocitos I son destruidos en algunas enfermedades, son los neumocitos II los que proliferan para reparar los daños. Aparte de estas células estructurales, dentro del alvéolo y en el espesor de los tabiques se encuentran células con un rol defensivo, especialmente macrófagos, que fagocitan las partículas extrañas y bacterias que llegan al alvéolo. 04. Fisiología respiratoria 3 - 53 El enfermo crítico 2. Respiratorio Figura 2: estructura alveolar. CIRCULACIÓN MENOR La perfusión sanguínea de los alvéolos proviene de la circulación pulmonar o menor, que difiere de la circulación sistémica en múltiples características hemodinámicas y funcionales. El circuito pulmonar empieza en la aurícula derecha, a donde llega prácticamente toda la sangre venosa (con alto contenido de CO2) del organismo, pasa al ventrículo derecho y desde allí es impulsada al territorio alveolar a través de la arteria pulmonar, que termina en una extensa red capilar que envuelve a los alvéolos. Una vez oxigenada, la sangre es llevada por las venas pulmonares a la aurícula izquierda, donde se incorpora a la circulación mayor o sistémica (figura 3). 04. Fisiología respiratoria 4 - 53 El enfermo crítico 2. Respiratorio Figura 3: circulación alveolar. FUNCIONES Intercambio gaseoso (o hematosis), siendo la función principal del aparato respiratorio. Filtración de células sanguíneas envejecidas, microcoágulos, células adiposas, células placentarias… Nutrición del parénquima pulmonar. Producción de sustancias humorales: el pulmón es el único órgano, aparte del corazón, que recibe la totalidad del gasto cardíaco, por lo que resulta adecuado para regular la calidad y la cantidad de algunas sustancias circulantes a través de las células del endotelio capilar, como por ejemplo, la conversión de la angiotensina I en angiotensina II. Presiones pulmonares Las presiones en el circuito pulmonar son aproximadamente seis veces menores que las del circuito sistémico: la presión media en la aorta es de 100 mmHg, mientras que en la arteria pulmonar es de sólo 15 mmHg. En concordancia, las paredes de las arterias 04. Fisiología respiratoria 5 - 53 El enfermo crítico 2. Respiratorio pulmonares son muy delgadas y están provistas de muy escasa musculatura lisa, confundiéndose fácilmente con venas de diámetro similar. Resistencias vasculares pulmonares El flujo de sangre a través del circuito pulmonar está determinado por la diferencia de presiones entre el tronco de la arteria pulmonar y la aurícula izquierda. A este flujo se opone una resistencia vascular que depende de la longitud del vaso (l), de la viscosidad de la sangre (µ) y del radio (r), lo que determina la Ecuación de Poiseuille: R = (8·l·μ) / (π·r4) En esta fórmula, el factor más importante es el calibre del vaso, debido a que la resistencia es inversamente proporcional a su radio elevado a la cuarta potencia. De esta forma, una disminución de un 50% en el radio de un vaso, como puede ocurrir por vasoconstricción, aumenta su resistencia 16 veces. Esta fórmula se aplica de forma rigurosa en tubos rígidos perfundidos por un líquido homogéneo que fluye de manera laminar y continua, pero los vasos sanguíneos son distensibles, están perfundidos por sangre que no es homogénea y con un flujo pulsátil, así que su aplicación en la clínica permite sólo resultados aproximados. Por lo que en la práctica clínica la RVP se calcula de acuerdo a la ley de Ohm: RVP = diferencia de presiones / flujo sanguíneo = ΔP / ΔQ La diferencia de presiones es la que se produce entre la arteria pulmonar (presión media de arteria pulmonar, PAP) y la aurícula izquierda (presión de enclavamiento o de capilar pulmonar, PCP) y el flujo sanguíneo es el gasto cardíaco (Qt). Suponiendo, en un hombre normal, una presión media de arteria pulmonar de 15 mmHg, una presión de enclavamiento de 8 mmHg con un gasto cardíaco de 5 L/min, la RVP de acuerdo a la fórmula sería: (15 – 8) / 5 = 1’4 mmHg / L / min Así, obtenemos que las RVP son una décima parte de la RVS (resistencias vasculares sistémicas). En condiciones normales, las arterias pulmonares de pequeño calibre y los capilares son los vasos que ofrecen la mayor resistencia al flujo sanguíneo, a diferencia de la circulación sistémica, donde la mayor resistencia se encuentra al nivel de las arteriolas. Si bien la resistencia vascular pulmonar en reposo es baja, puede disminuir aún más si aumenta el flujo en los vasos pulmonares, como ocurre durante el ejercicio: A medida que la presión sube, comienzan a abrirse capilares que, en reposo, estaban cerrados o con muy escaso flujo, es decir, se reclutan nuevos vasos bajando la resistencia. Aumento de la distensión de los vasos, con aumento de su calibre, lo que provoca una caída de resistencia. 04. Fisiología respiratoria 6 - 53 El enfermo crítico 2. Respiratorio SISTEMA MUSCULO-ESQUELÉTICO La caja torácica, formada por la columna vertebral (parte del segmento cervical y el segmento dorsal en su totalidad), las clavículas, 12 costillas en cada hemitórax y el esternón; actúa como un elemento de sostén para el pulmón y trabaja sincrónicamente con los músculos respiratorios para facilitar la entrada y salida de aire de los pulmones. Los músculos (figura 4), están divididos según su función en: Inspiratorios: diafragma, escalenos, trapecio, esternocleidomastoideo, músculos del ala de la nariz, intercostales externos y músculos paraesternales. Espiratorios: músculos de la pared abdominal, triangular del esternón e intercostales internos. Figura 4: musculatura respiratoria. REGULACIÓN DE LA RESPIRACIÓN La inspiración comienza con la activación de las neuronas inspiratorias, que envían impulsos a la musculatura inspiratoria (básicamente el diafragma), cada 5 segundos en el adulto. Durante la respiración normal en reposo, la musculatura espiratoria casi no participa, ya que la espiración es un evento pasivo debido a la retracción elástica del pulmón. Los 04. Fisiología respiratoria 7 - 53 El enfermo crítico 2. Respiratorio músculos espiratorios sólo son estimulados cuando aumenta la demanda ventilatoria en forma importante. Regulación humoral (CO2) Los principales moduladores humorales de la ventilación son los niveles arteriales de O 2 y de CO2. La capacidad para responder ante niveles anormales de PaCO2 (presión arterial de CO2) con cambios en la ventilación es fundamental para la homeostasis ácido-base, siendo un mecanismo muy sensible: un aumento de PaCO2 de 40 a 50 mmHg, aumenta la ventilación a 30 litros/min. Existen dos tipos de receptores para el CO2: Centrales: son los más sensibles e importantes. Sus células receptoras están ubicadas en el bulbo raquídeo. Sus neuronas son diferentes de las inspiratorias y espiratorias, a las cuales envían su información. Periféricos: aunque son básicamente sensores de hipoxemia, también responden a los cambios de pH y PaCO2. Están ubicados en los senos carotídeos y, en menor cantidad, en los cuerpos aórticos. Su información es transmitida a los centros respiratorios a través de los IX y X pares craneales. Regulación humoral (O2) Los principales receptores periféricos son los carotídeos, situados en la bifurcación de la carótida. Se activan con: La disminución de la PaO2: su descenso no estimula estos receptores, lo que explica la escasa respuesta ventilatoria que se observa en reposo en la anemia y en la intoxicación por CO. La disminución del flujo sanguíneo: este factor actuaría a través de los cambios locales de pH que se producen debido a una menor remoción de metabolitos. Los quimiorreceptores no modifican su frecuencia de descarga hasta que la PaO 2 baja hasta 50-70 mmHg, y su efecto máximo es escaso, pues aumentan la ventilación alveolar sólo en un 68% como máximo. Estos receptores periféricos tienen la importante característica de que no se inhiben frente a una serie de condiciones que deprimen los receptores bulbares, como son la propia hipoxemia, la hipercapnia, los hipnóticos, los anestésicos, etc. En estas circunstancias la respiración del paciente pasa a depender exclusivamente de la actividad de los receptores periféricos. Regulación neurológica Control central voluntario: la actividad respiratoria puede ser modificada de manera voluntaria por corteza cerebral, pero sólo temporalmente, ya que los cambios fisiológicos secundarios a la modificación ventilatoria terminan por imponer el control automático. Control central involuntario: el centro respiratorio está compuesto por un grupo de neuronas localizadas en el bulbo y en la protuberancia, divididas en 3 grupos principales: dorsal, ventral y neumotáxico. Están encargadas de la 04. Fisiología respiratoria 8 - 53 El enfermo crítico 2. Respiratorio regulación vegetativa de la respiración y de sus modificaciones en respuesta a las necesidades de cada momento. Reflejos pulmonares: o De distensión: activados por la elongación de los músculos lisos en inspiración. Son de adaptación lenta. Uno de los efectos de la vía refleja en la que participan es la frenación de la inspiración (reflejo de HeringBreuer) que presentan los recién nacidos. o De irritación: fin defensivo, por lo que son de respuesta rápida. Activados por gases irritantes, estímulos mecánicos, histamina, reacciones alérgicas… Provocan broncoconstricción, constricción laríngea y tos. o Receptores J o yuxtacapilares: receptores localizados en el intersticio alveolar, cerca de los capilares. Se estimulan por procesos que comprometen esta área, tales como el edema intersticial y la acción de irritantes químicos. Como curiosidad, son los encargados de iniciar el bostezo, mecanismo de reclutamiento de alvéolos. INTERCAMBIO GASEOSO O HEMATOSIS El intercambio gaseoso es la función fundamental del aparato respiratorio, y para que éste se produzca de manera adecuada, se deben de integrar perfectamente los siguientes procesos: Ventilación. Difusión alvéolo-capilar de gases. Perfusión sanguínea alveolar. Relación ventilación/perfusión (VA/Q). Transporte de gases. Ventilación Se denomina ventilación pulmonar a la cantidad de aire que entra o sale del pulmón cada minuto. Si conocemos la cantidad de aire que entra en el pulmón en cada respiración (el volumen corriente) y lo multiplicamos por la frecuencia respiratoria, tendremos el volumen minuto: Volumen minuto = Volumen corriente x Frecuencia respiratoria Dado que el objetivo funcional principal del sistema respiratorio es el intercambio gaseoso, el pulmón debe facilitar la incorporación del O 2 desde el exterior hasta el capilar pulmonar y la eliminación del CO2 de la sangre venosa hasta el exterior. El desplazamiento de los gases a lo largo del árbol bronquial y, finalmente, a través de la interfase alvéolo-capilar se desarrolla por difusión pasiva desde una zona de presión parcial superior a otra inferior; de forma que el aire entra en el pulmón durante la inspiración porque dentro de los alvéolos se crea una presión inferior a la presión barométrica, por lo que el aire se desplaza de las zonas de mayor presión hacia las zonas de menor presión. Durante la espiración, el aire sale del pulmón porque se crea una presión superior a la atmosférica. 04. Fisiología respiratoria 9 - 53 El enfermo crítico 2. Respiratorio Pero de todo el aire que entra en los pulmones en cada respiración, solo una parte llega a los alvéolos. Si consideramos que el volumen corriente (Vc) en una persona sana es de alrededor de 500 cc, llegarán a los alvéolos aproximadamente 350 cc y 150 cc se quedarán ocupando las vías aéreas. Al aire que llega a los alvéolos se le denomina ventilación alveolar o eficaz, y es el que realmente toma parte en el intercambio gaseoso. Al aire que se queda en las vías aéreas se le denomina ventilación del espacio muerto, ya que no participa en el intercambio gaseoso. El espacio muerto se divide en: Espacio muerto anatómico: comprende desde las fosas nasales y la boca, hasta el bronquiolo terminal. Su volumen es de unos 150 cc. Espacio muerto fisiológico: en el sujeto normal equivale al anatómico. En condiciones patológicas (enfisema, etc.) aumenta, ya que comprende también los alvéolos que están hiperinsuflados y los que están ventilados, pero no perfundidos. Espacio muerto mecánico: es aquel espacio que se añade al anatómico, por las conexiones de los equipos de ventilación mecánica. Así, el aire que puede alojarse en los pulmones se ha subdividido en 4 volúmenes y en 4 capacidades diferentes, en función del momento del ciclo respiratorio en que nos encontremos o de la capacidad del sistema: Volumen corriente (Vc) o volumen tidal (Vt): es el volumen de aire inspirado o espirado en cada ciclo respiratorio. Su valor normal oscila entre 500-600 cc en el varón adulto (Vt = 5-8 cc X kg de peso del sujeto). Volumen de reserva inspiratoria (Vri): volumen de aire máximo que puede ser inspirado después de una inspiración normal. Volumen de reserva expiratoria (Vre): volumen de aire máximo que puede ser espirado en espiración forzada después del final de una espiración normal. Volumen residual (Vr): volumen de aire que permanece en el pulmón después de una espiración máxima. Capacidad vital (Cv): equivale a la suma de Vri + Vt + Vre. Capacidad inspiratoria (Ci): es la suma de Vt + Vri. Es la cantidad de aire que una persona puede respirar comenzando en el nivel de espiración normal y distendiendo sus pulmones a máxima capacidad. Capacidad funcional residual (Cfr): equivale al Vre + Vr. Es la cantidad de aire que permanece en los pulmones al final de una espiración normal. Capacidad pulmonar total (Cpt): es el volumen máximo que pueden alcanzar los pulmones con el mayor esfuerzo inspiratorio posible. Es igual a Cv + Vr. Además de todo esto, hay que tener en cuenta que la ventilación alveolar sufre irregularidades en su distribución entre las distintas zonas pulmonares debido a la acción de la gravedad, que provoca que el peso del órgano recaiga sobre sus porciones basales, condicionando una disminución de la presión negativa intrapleural, lo que hace que alvéolos de las bases estén disminuidos de tamaño. 04. Fisiología respiratoria 10 - 53 El enfermo crítico 2. Respiratorio Difusión alvéolo-capilar de gases (figura 5) Es el mecanismo principal de transporte de O 2 y de CO2 entre el organismo y el exterior y se realiza a través de la membrana alvéolo-capilar o respiratoria (que es la unidad funcional respiratoria) desde las zonas de mayor concentración de gases a las de menor de manera pasiva (por lo que no se produce gasto energético), siguiendo la Ley de Fick (el flujo difusivo que atraviesa una superficie es directamente proporcional al gradiente de concentración): J = D · (Δc/δ) Donde Δc es la diferencia de concentraciones y δ el espesor de la membrana. Además, el proceso de difusión está favorecido por las características del tejido pulmonar: El capilar está en íntimo contacto con la pared alveolar reduciendo al mínimo el tejido intersticial. Los capilares forman una red muy amplia que rodea totalmente el alvéolo. El paso de la sangre por la pared alveolar dura el tiempo necesario para que la transferencia de gases resulte efectiva. La membrana respiratoria es tan delgada que puede ser atravesada por los gases fácilmente, de hecho los glóbulos rojos a su paso por la zona del capilar en contacto con el alvéolo lo hacen de uno en uno debido a la extrema delgadez del capilar, y antes de que hayan recorrido el primer tercio ya se ha realizado el intercambio gaseoso. Pero aunque el tejido pulmonar esté diseñado para favorecer la difusión de gases, existen otros factores que la afectan y modifican: Espesor de la membrana: puede ser modificado por la presencia de líquido (edema) en el espacio alveolar o en el intersticial, fibrosis pulmonar… De manera que la rapidez de la difusión a través de la membrana será inversamente proporcional al espesor de la misma. Superficie de la membrana: puede estar disminuida como ocurre en el enfisema, donde la ruptura de tabiques alveolares condicionan bullas que se comportan como grandes cavidades mucho más amplia que los alvéolos, pero con reducción del área de membrana. Coeficiente de difusión del gas: depende de la solubilidad de cada gas y de su peso molecular. Así, la capacidad de difusión de la membrana respiratoria es similar a la del agua, por tanto el CO2 es 20 veces más difusible que el O2. Gradiente de presiones entre los gases existentes a ambos lados de la membrana: la presión parcial está determinada por el número de moléculas que chocan contra la superficie de la membrana a ambos lados de ella, lo que significa la tendencia de cada gas de atravesar la membrana, de forma que los gases se trasladarán de la zona de mayor presión a la de menor presión. 04. Fisiología respiratoria 11 - 53 El enfermo crítico 2. Respiratorio Figura 5: intercambio gaseoso. Perfusión sanguínea alveolar En condiciones normales, el ventrículo derecho sólo necesita bajas presiones para expulsar un gran volumen de sangre a corta distancia, lo que hace que la distribución de la perfusión alveolar no sea uniforme, sino que varíe con la posición del sujeto, el volumen minuto del ventrículo derecho y la resistencia que pueden ofrecer los vasos. Así, cuando el individuo está en bipedestación, las presiones en los ápex pulmonares son menores, por lo que la perfusión está disminuida. Sin embargo, en las zonas medias (en los hilios pulmonares) la sangre llega a los capilares con la misma presión que tiene en la arteria pulmonar. Y en las bases ocurre un fenómeno inverso al de las zonas apicales, pues la presión de la arteria pulmonar, se ve potencializada por la acción de la gravedad y sus efectos se suman, aumentando la perfusión en la parte baja del pulmón. Relación ventilación/perfusión (VA/Q) Para lograr una buena oxigenación de los tejidos, no basta con que la ventilación (VA) y la perfusión (Q) de lo alvéolos sea buena, sino que ambas deben estar relacionadas de manera que los alvéolos bien ventilados también estén bien perfundidos, y viceversa. En condiciones ideales en las que no existiera diferencia entre VA y Q (es decir, todos los alvéolos fueran equitativamente ventilados y perfundidos), la relación VA/Q sería igual a 1, pero esto no ocurre en la realidad, sino que existen unos determinantes físicos y anatómicos que provocan variaciones en esta relación, haciendo que el valor global basal de VA/Q sea considerado igual a 0’8: Ápex pulmonares: ya hemos visto que la presión media de la sangre es menor en los ápices que en la arteria pulmonar, provocando que el riego sanguíneo en esta zona sea menor. Pero estos alvéolos son precisamente los más ventilados. Estas dos circunstancias, condicionan que una parte del aire alveolar no entre en contacto con el capilar pulmonar, creándose un incremento del espacio muerto fisiológico. Aquí la VA/Q será > 1. Zona media pulmonar: aquí se logra el equilibrio más perfecto de VA/Q, pues en ella el intercambio gaseoso es normal (los alvéolos son tan bien ventilados como perfundidos) y la relación VA/Q = 1. 04. Fisiología respiratoria 12 - 53 El enfermo crítico 2. Respiratorio Segmentos basales: presentan mayor aporte de sangre y por efecto de la gravedad, mayor presión sanguínea. Los alvéolos, en cambio, aunque están algo más ventilados que en el resto del pulmón, por el juego de presiones intrapleurales son más pequeños, lo que condiciona que estén ventilados en menor medid. Por tanto, la relación VA/Q será < 1, por lo que la ventilación de los alvéolos basales es insuficiente para el volumen de sangre que atraviesan sus capilares y por este motivo, parte de ella queda sin intercambiar gases con el aire alveolar. A este fenómeno se le denomina shunt intrapulmonar o cortocircuito pulmonar, es decir, en condiciones normales una pequeña parte de la sangre que llega a la aurícula izquierda después de haber atravesado los pulmones, no va totalmente saturada de O2. Transporte de gases El consumo de O2 en reposo de un individuo normal es de alrededor 250 ml/min y en ejercicio intenso puede aumentar > 10 veces. El O2 atmosférico es el utilizado en las mitocondrias y llega a los alvéolos por efecto de la ventilación. De allí, difunde a la sangre del capilar pulmonar y es transportado a las células por el sistema circulatorio. Aunque el O2 se disuelve en el plasma, más del 99% es transportado por la hemoglobina (hb) de los glóbulos rojos. Conceptos Presión parcial de oxígeno (PO2): el O2 disuelto en la sangre ejerce presión y se expresa en milímetros de mercurio (mmHg). En la sangre capilar pulmonar, la presión de oxígeno (PcO2) está determinada por la presión alveolar de oxígeno (PAO2). En la sangre arterial, la presión arterial de oxígeno (PaO2) es más baja que en el capilar pulmonar. Como en las arterias no hay intercambio gaseoso, la presión de oxígeno es la misma en todas las arterias y su valor es un índice del estado de la función captadora de oxígeno del pulmón. En el territorio venoso, la presión de oxígeno (PvO2) cae por el paso de O2 de los capilares a los tejidos. Contenido de O2: es el volumen de O2 contenido en un decilitro (dl) de sangre. En un individuo sano es de 16-20 ml/dl en sangre arterial. De ellos, solo 0’3 ml se encuentran disueltos, estando el resto ligado a la hemoglobina. Está determinado por PO2 y por la cantidad de hemoglobina (Hb) de la sangre e indica la eficacia con que la sangre cumple su rol transportador. Capacidad de O2: es la máxima cantidad de O2 que puede ser transportada en 100 ml de sangre expuesta directamente al aire ambiental, fuera del organismo. Saturación de O2: es el contenido de O2 de una muestra de sangre expresado como porcentaje de su capacidad. Normalmente, con una PAO 2 de 80-90 mmHg la saturación arterial de oxígeno (SaO2) es de 94-97%. El pequeño porcentaje de Hb no saturada se explica porque la Hb se satura al 100% sólo por encima de 240 mmHg de PAO2. En reposo, los valores gasométricos en sangre venosa, oscilan alrededor de 40 mmHg para la PO2, de 70% para la SaO2 y de 14 ml/dl para el contenido de O2. 04. Fisiología respiratoria 13 - 53 El enfermo crítico 2. Respiratorio Transporte de O2 disuelto en plasma El O2 disuelto constituye una pequeña fracción del contenido total de O 2 de la sangre y está en directa relación con la PO2 (ley de Henry): por cada mmHg de PO2, se disuelven 0,003 ml de O2 en cada 100 ml de sangre. Por ello, en condiciones normales, con una PaO2 cercana a 100 mmHg, esta cantidad es de 0’3 ml/100 ml sangre. Sin embargo, el O2 disuelto tiene una importancia considerable, ya que su presión es la que determina la SaO2, la difusión y el movimiento de O2 desde la sangre a los tejidos. Transporte de O2 asociado a la hemoglobina La hb actúa como vehículo transportador de O2 entre los capilares pulmonares y los tejidos. Cada molécula de hb transporta 4 moléculas de O2, en forma de oxihemoglobina. La curva de disociación de la hb (figura 7), que expresa la relación entre ésta y el O 2, se construye sometiendo muestras de sangre a PO2 crecientes manteniendo constantes la temperatura (a 37ºC) y la PaCO2 (en 40 mmHg). Luego, se mide la cantidad de O2 unida a la hb y se dibuja en un gráfico. Tiene forma de S itálica, en la que se distingue una porción de pendiente pronunciada que corresponde a las PO2 más bajas (< 60 mmHg), y una zona aplanada en relación con las PO2 más altas (> 70 mmHg). Entre estas dos zonas, existe un punto de inflexión en 60 mmHg de PO2. Esta forma de la curva es de gran importancia: en la porción casi vertical, pequeños cambios de la PaO2 causan cambios importantes en la SaO 2 y, por lo tanto, en el contenido de O2. El intercambio de O2 tisular se realiza en esta porción, ya la hb al encontrar bajas presiones tisulares de O2, entrega grandes cantidades de O2. Ciertos factores modifican la unión entre la hb y el O 2: la temperatura, la PCO2 y la concentración de hidrogeniones (iones H+, que correspondería a un descenso de pH). El aumento de cualquiera desplaza la curva hacia la derecha y abajo, es decir, disminuye la afinidad de la hb por el O2, por lo que la entrega de O2 es más fácil. A nivel pulmonar ocurre la situación opuesta, es decir, el desplazamiento de la curva es hacia la izquierda, lo que permite captar más oxígeno (Efecto Bohr, figura 6). Los glóbulos rojos poseen una sustancia, el 2-3 difosfoglicerato (2-3 DPG), que disminuye la afinidad de la hb por el O2, aumentando la entrega de O2 a los tejidos. Su concentración es variable: aumenta con el ejercicio prolongado, con la altura y en enfermedades que determinan menos aporte de O 2 a las células. En cambio, disminuye en la sangre conservada en banco varios días, lo que tiene importancia en la transfusión sanguínea. 04. Fisiología respiratoria 14 - 53 El enfermo crítico 2. Respiratorio Figura 6: curva de disociación de la hb. Efecto Bohr. Transporte de CO2 El CO2 se produce en las mitocondrias, como producto final del metabolismo celular. Desde las mitocondrias, pasa a la sangre de los capilares tisulares y es llevado por la sangre hasta los alvéolos, desde donde se elimina a la atmósfera gracias a la ventilación alveolar. El CO2 es transportado en la sangre, tanto combinado con los hematíes como en solución: Una parte se mantiene disuelto en el plasma, dependiendo de la PCO 2 y de su solubilidad. Otra parte forma compuestos con las proteínas plasmáticas. Una pequeña cantidad reacciona con el agua plasmática para formar ácido carbónico e implicarse en el equilibrio ácido-base. Una pequeña fracción permanece disuelta en el líquido dentro del glóbulo rojo. Otra parte del CO2 se combina con los grupos amino de la hemoglobina para formar compuestos carbamínicos. La mayor parte del CO2 que penetra en el glóbulo rojo es transformado por la anhidrasa carbónica en bicarbonato, que se disocia en H+ y HCO 3-. Los H+ son captados por la hemoglobina y los grupos HCO3- salen hacia el plasma, donde su concentración es menor. 04. Fisiología respiratoria 15 - 53 El enfermo crítico 2. Respiratorio Aunque el CO2 es un residuo del metabolismo para eliminar, es un determinante muy importante en el control de la ventilación y del equilibrio ácido-base 04. Fisiología respiratoria 16 - 53 El enfermo crítico 2. Respiratorio INSUFICIENCIA RESPIRATORIA AGUDA CONCEPTOS La insuficiencia respiratoria (IR) se define como la incapacidad del aparato respiratorio para mantener los niveles arteriales de oxígeno (O2) y/o de dióxido de carbono (CO2) adecuados para las demandas del metabolismo celular, por fallo de las funciones del aparato respiratorio1. Puede presentarse como una emergencia ante la cual el médico debe saber actuar. La función principal del aparato respiratorio es el intercambio gaseoso entre el paciente y el ambiente exterior, por lo que la IR, al ir determinada por su fracaso, provoca en la práctica clínica: Disminución de la oxigenación: lo que provoca un descenso de la presión arterial de oxígeno (PaO2) por debajo de 60 mmHg (tabla 12), hipoxemia. Posible disminución de la eliminación de CO2 asociada: produciéndose un aumento de la presión arterial de CO2 (PaCO2) por encima de 45 mmHg, hipercapnia. 04. Fisiología respiratoria 17 - 53 El enfermo crítico 2. Respiratorio El valor de PaO2 (60 mmHg, correspondiente a una SaO2 de 90%) que se utiliza para definir la IR es relativamente arbitrario, y se escogió por encontrarse cerca del punto de inflexión a partir del cual la curva de disociación de la oxihemoglobina adquiere mayor pendiente, de manera que pequeños cambios en la PaO2 provocan cambios importantes en la saturación de la hemoglobina y, por consiguiente, en el contenido de O 2 de la sangre (figura 1). Figura 1: curva de disociación de la hemoglobina. FISIOPATOLOGÍA Hipoxia Un concepto importante relacionado con la IR es el de hipoxia2, situación en la que existe una oxigenación inadecuada para atender los requerimientos oxidativos de los tejidos. Hipoxia: disminución del aporte de O2 a las células por debajo de sus requerimientos. Hipoxemia: disminución de la PaO2 (parámetro evaluador de la función pulmonar). La cantidad de oxígeno que llega a los tejidos (aporte de O2) depende del gasto cardíaco (QT) y del contenido de oxígeno de la sangre arterial (CaO2), de acuerdo con la siguiente fórmula: Aporte de O2 (DO2) (ml/min) = QT (l/min) x CaO2 (ml/100 ml) 04. Fisiología respiratoria 18 - 53 El enfermo crítico 2. Respiratorio El contenido de O2 de la sangre arterial viene determinado, fundamentalmente, por la concentración de hemoglobina (hb, gr/100 ml) disponible y por su porcentaje de saturación (SaO2), teniendo en cuenta que la cantidad de O2 disuelto en sangre es despreciable: CaO2 = (Hb x 1’34) + (PaO2 x 0’003) DO2 = QT x (Hb x 1’34) x (SaO2/100) Así, esta fórmula identifica a los tres sistemas que participan en la oxigenación tisular: La circulación sistémica: que determina el gasto cardíaco y el flujo sanguíneo. La eritropoyesis: que determina la masa de glóbulos rojos en la sangre y la concentración de hemoglobina. El sistema respiratorio: que determina la saturación de la hemoglobina en función de la PaO2, de acuerdo con la relación definida por la curva de disociación de la oxihemoglobina. De acuerdo con esto, la hipoxia puede deberse a (tabla 2): La reducción del suministro de sangre (hipoxia circulatoria). La disminución de la capacidad de transporte de oxígeno (hipoxia anémica). Alteraciones de la función cardiopulmonar, que se asocian a una disminución de la PaO2 (hipoxia hipoxémica). Toxicidad en los tejidos (hipoxia hística). Hipoxemia Tabla 2: causas de hipoxemia Puede deberse a varios mecanismos: Disminución de la PaO2: que, a su vez, puede ser secundario a: o Disminución de la presión barométrica (“mal de altura”). o Disminución de la fracción de O2 en el aire ambiental. 04. Fisiología respiratoria 19 - 53 El enfermo crítico 2. Respiratorio o Desplazamiento del O2 por gases inertes (sobre todo, en minas). Problemas pulmonares. o Hipoventilación alveolar: sucede cuando la cantidad de aire movilizada es insuficiente para proporcionar la cantidad de O2 necesaria. Los ejemplos clínicos más importantes son: las alteraciones de la ventilación asociadas a disfunción de los centros respiratorios, las enfermedades neuromusculares y las deformidades de la pared torácica. o Alteración de la relación VA/Q: es el mecanismo productor de hipoxemia más importante y que está presente en la mayoría de las ocasiones. Se caracteriza porque coinciden en el pulmón áreas bien ventiladas, pero inadecuadamente perfundidas; con áreas bien perfundidas, pero mal ventiladas. Los desequilibrios VA/Q están presentes en todos los procesos que afectan a las vías aéreas de pequeño calibre y al parénquima pulmonar. o Problemas en la difusión de gases: aparecen cuando aumenta el grosor de la membrana alvéolo-capilar o cuando disminuye el área de intercambio gaseoso. Son importantes en las neumopatías intersticiales difusas. o Shunts intrapulmonares: cuando determinadas áreas del pulmón tienen unidades alveolares que no se ventilan, pero que sí se perfunden. Esto ocurre en las enfermedades que cursan con una ocupación completa del espacio alveolar (EAP, hemorragia alveolar, neumonía…). Shunts circulatorios derecha-izquierda: como fístulas arteriovenosas, comunicaciones intracardiacas (CIA…). Aunque son causa de hipoxemia, no son estrictamente causa de IR. Fisiopatología de la IR Los mecanismos fisiopatológicos que pueden desencadenar una IR aguda, bien de manera aislada o bien asociándose, son prácticamente superponibles a los de la hipoxemia, aunque su grado de participación varía en dependencia de la patología de base (tabla 3): Disminución en la presión de O2 en el aire inspirado. Hipoventilación alveolar. Alteración en difusión alvéolo-capilar. Desequilibrio en la relación VA/Q. Shunt intrapulmonar. 04. Fisiología respiratoria 20 - 53 El enfermo crítico 2. Respiratorio Tabla 3: mecanismos fisiopatológicos de la IR. Figura 2: fisiopatología de la IR aguda. CLASIFICACIONES Gasométrica (fisiopatológica) De estas alteraciones gasométricas, se desprende la primera clasificación de la IR en función de qué gases están comprometidos (midiendo siempre sus presiones parciales pa- en sangre arterial): Insuficiencia respiratoria global (o hipercápnica o tipo I): o Es la que compromete tanto los valores de O2, como los de CO2. o PaO2 < 60 mmHg y PaCO2 > 45 mmHg. o Se observa en enfermedades con hipoventilación alveolar generalizada y en trastornos ventilación/perfusión (V/Q) extensos que no se pueden compensar. 04. Fisiología respiratoria 21 - 53 El enfermo crítico 2. Respiratorio Insuficiencia respiratoria parcial (o no hipercápnica o tipo II): o Es en la que se comprometen las cifras de O2. o PaO2 < 60 mmHg con PaCO2 normal o baja. o Es causada por alteraciones de la relación V/Q y por trastornos de la difusión de gases. Por la instauración Según la velocidad con que aparece la IR y la condición previa del aparato respiratorio, se distinguen tres formas: Insuficiencia respiratoria aguda: o Instauración rápida, generalmente en un pulmón previamente sano, por lo que las reservas funcionales del órgano están intactas. o A veces, es de tan rápido desarrollo que el pulmón no tiene tiempo suficiente para desarrollar todos los mecanismos de adaptación y de compensación, generando una urgencia vital. Insuficiencia respiratoria crónica: o En ésta, existe una enfermedad causal de base que produce una pérdida paulatina de la función respiratoria, por lo que el organismo tiene tiempo para poner en juego mecanismos de adaptación. Con éstos, establece una nueva normalidad, bien tolerada por un tiempo, que puede ser prolongado. o Reserva funcional pulmonar disminuida o agotada, lo que dificulta soportar exigencias o enfermedades concomitantes. Insuficiencia respiratoria crónica reagudizada: o Es la mezcla de las dos anteriores: se presenta en el enfermo crónico, que es bruscamente sacado de su normalidad por un factor agudo sobreañadido, contando con nulas o escasas reservas para enfrentar la nueva situación. 04. Fisiología respiratoria 22 - 53 El enfermo crítico 2. Respiratorio ETIOLOGÍA Figura 3: clasificación etiológica de la IR. 04. Fisiología respiratoria 23 - 53 El enfermo crítico 2. Respiratorio Tabla 4: Etiología de la IR. La IR aguda no es una enfermedad en sí misma, sino la consecuencia final de una gran variedad de procesos, respiratorios en su mayor parte, pero también cardiológicos, neurológicos y secundarios a tóxicos o a traumatismos. MANIFESTACIONES CLÍNICAS La valoración de los síntomas que aparecen en el curso de una IR aguda es muy útil para orientar el diagnóstico etiológico, ya que las manifestaciones clínicas más llamativas suelen ser las que dependen de la enfermedad causal, al ser las debidas a hipoxemia o a hipercapnia inespecíficas. Es importante considerar la rapidez de instauración y el curso inicial del proceso, con el fin de poder anticipar la aparición de complicaciones. La exploración física es fundamental para valorar la gravedad de la IR, porque nos hará ver los signos de fracaso de la musculatura respiratoria que preceden al fallo ventilatorio. Los principales signos de gravedad son: Taquipnea creciente (> 25 respiraciones/minuto). Obnubilación. Ortopnea. Incordinación toracoabdominal y uso de musculatura accesoria. Disminución de la amplitud de la respiración. Aparición de apnea. Taquicardia Cianosis. Inestabilidad hemodinámica. La exploración debe ser general, ordenada y sistemática, concentrándose en la evaluación del sistema cardiorrespiratorio. Clínica dependiente de la hipoxemia Se relaciona fundamentalmente con la aparición de alteraciones del SNC y del sistema cardiovascular (figura 5): Alteraciones SNC: incoordinación con agitación e inquietud, somnoliencia, depresión de los centros respiratorios hasta el coma. Clínica cardiovascular: taquicardia y HTA de manera inicial. En fases más avanzadas, con PaO2 más reducidas, aparecen bradicardia, depresión miocárdica y shock. Cianosis: aparece cuando la hb reducida es > 5 g/dl. Palidez, sudoración, frialdad, piloerección. Clínica dependiente de la hipercapnia Alteraciones SNC: desorientación, somnoliencia y obnubilación hasta el coma y la muerte. 04. Fisiología respiratoria 24 - 53 El enfermo crítico 2. Respiratorio Manifestaciones cardiovasculares: dependen de la vasoconstricción secundaria a la activación del sistema vegetativo simpático y de la vasodilatación producida por la acumulación del CO2, por lo que son muy variables (figura 5). Piel caliente, eritematosa y sudorosa. Figura 5: clínica de la IR. Clínica dependiente de la enfermedad causal Desde una perspectiva etiológica, es importante conocer los antecedentes personales del enfermo (asma, EPOC, alteración neuromuscular, neumopatía intersticial, enfermedad cardiovascular, consumo de fármacos, etc.) y el tratamiento que ha utilizado hasta ese momento. Deben investigarse los factores de riesgo que se asocian con la hipotética enfermedad causal y que pueden influir en la evolución de la insuficiencia respiratoria aguda (tabaquismo, hipertensión arterial, tóxicos, etc.). Por último, hay que tener en cuenta la existencia de posibles factores desencadenantes (inmovilización, traumatismos, intervenciones quirúrgicas, inhalación de gases tóxicos, etc.). Algunos datos clínicos propios de la enfermedad de base pueden facilitar el diagnóstico. Por ejemplo: Si previamente el paciente ha presentado sensación distérmica, escalofríos, dolor torácico, tos o expectoración mucopurulenta o herrumbrosa: neumonía. Si refiere un dolor de aparición brusca con disnea intensa: neumotórax o tromboembolismo pulmonar. Si cuenta ortopnea, oliguria y la auscultación rebela crepitantes bilaterales: insuficiencia cardíaca. Si existe antecedente de traumatismo torácico: contusión o hemorragia pulmonar. 04. Fisiología respiratoria 25 - 53 El enfermo crítico 2. Respiratorio DIAGNÓSTICO Figura 6: aproximación diagnóstica de la IR. 04. Fisiología respiratoria 26 - 53 El enfermo crítico 2. Respiratorio En un paciente con IR aguda es importante intentar determinar con la mayor rapidez la causa, la gravedad y la cronicidad del proceso, para lo que es necesario comenzar realizando una anamnesis y una exploración física detalladas 13. Además, complementaremos esta primera aproximación con una serie de pruebas complementarias que nos ayudarán a catalogar el tipo de IR y, en algunos casos, conocer su etiología: Pulsioximetría. Gasometría de sangre arterial. Radiografía de tórax. Exploraciones complementarias. Anamnesis y exploración física Para el diagnóstico de la IR es importante una anamnesis al enfermo y/o a su familia, para averiguar las posibles enfermedades previas y comorbilidades, los factores de riesgo cardiovascular, de enfermedad tromboembólica… Conocer el tratamiento habitual del paciente para orientar una posible causa toxicológica y se debe preguntar por las causas desencadenantes y averiguar el tiempo de instauración. La exploración puede aportar datos que orienten a la enfermedad causal: fiebre, tos, sibilancias... Es importante saber reconocer los signos de alarma del proceso: somnolencia y alteración de conciencia importante, taquipnea progresiva, disminución de la amplitud de la respiración e incoordinación toracoabdominal son signos ominosos, pues anuncian fracaso ventilatorio agudo14. Pulsioximetría Con ella se mide exclusivamente la saturación de O2 de la sangre, resultando útil para descartar la existencia de IR en un primer momento, para valorar rápidamente a los pacientes más graves y, sobre todo, para monitorizar de forma continua y no invasiva la saturación transcutánea de O2 para realizar el seguimiento del paciente y su respuesta a las medidas terapéuticas instauradas4. Se basa en la espectrofotometría por transiluminación, que determina la diferencia que existe en la absorción de una luz, con una longitud de onda específica, de la hemoglobina oxidada y de la reducida, en relación con el pulso arterial10. Pero, a pesar de ser rápida y no invasiva, presenta unos inconvenientes 4: No proporciona información sobre la PaCO2 ni sobre el pH plasmático. Su fiabilidad disminuye cuando la saturación de O 2 está por debajo del 70%, y cuando existe hipoperfusión periférica grave, anemia extrema, hipotermia, hipercarboxi/metahemoglobinemia o ictericia. Debe utilizarse con precaución en los pacientes en los que se sospeche hipoventilación alveolar, porque una hipercapnia importante puede asociarse con una hipoxemia que discreta. En condiciones normales, una saturación de O2 del 90% se corresponde con una PaO2 de 60 mmHg. Para interpretar correctamente las equivalencias entre ambos parámetros debe tenerse en cuenta que la curva de saturación de la hemoglobina tiene una morfología sigmoidea y que se desvía a la derecha en condiciones de hipertermia, 04. Fisiología respiratoria 27 - 53 El enfermo crítico 2. Respiratorio hipercapnia, acidosis o aumento del 2,3-difosfoglicerato, con lo que disminuye la afinidad de la hb por el O2 para facilitar su liberación a los tejidos, como mecanismo de adaptación ante la hipoxemia. En estos casos, la saturación de O2 obtenida no sería valorable. Con todo esto, la pulsioximetría es un buen medidor de la saturación de O 2, siempre que se tenga presenta que puede ser imprecisa y que no aporta datos importantes adicionales a los que obtienen con la gasometría, por lo que su uso se restringe a confirmar la hipoxemia cuando se sospechen errores en la gasometría o para evaluar la respuesta al tratamiento, para evitar repetir la gasometría... Gasometría de sangre arterial Figura 7: indicaciones de gasometría arterial. Imprescindible para confirmar la sospecha de IR y siempre que sea posible se debe efectuar en condiciones basales, salvo que interfiera con maniobras terapéuticas. En ella se determinan de manera directa la PaO2, la PaCO2 y el pH; los restantes parámetros se derivan de los anteriores. Obteniendo datos que nos orientarán hacia cuál es la situación del paciente: Normoxemia: PaO2 entre 80-100 mmHg. Hiperoxemia: PaO2 >100 mmHg. 04. Fisiología respiratoria 28 - 53 El enfermo crítico 2. Respiratorio Hipoxemia: PaO2 < 80 mmHg: o Leve: PaO2 entre 71-80 mmHg. o Moderada: PaO2 entre 61-70 mmHg. o Grave: PaO2 entre 45-60 mmHg. o Muy grave: PaO2 < 45 mmHg. Normocapnia: PaCO2 35-45 mmHg. Hipercapnia: PaCO2 > 45 mmHg. Hipocapnia: PaCO2 < 35 mmHg. El pH informa de la situación del equilibrio ácido-base y también puede indicar la necesidad de su corrección inmediata ante situaciones graves (tabla 5): o Alcalosis: pH > 7’45. Figura 8: interpretación de la gasometría arterial. AcM: acidosis metabólica; AcR: acidosis respiratoria; AlcM: alcalosis metabólica; AlcR: alcalosis respiratoria; IRA: insuficiencia respiratoria aguda; IRC: insuficiencia respiratoria crónica; IRCA: insuficiencia respiratoria crónica agudizada. Acidosis: pH < 7’35. Así, la acidosis respiratoria con un pH < 7’27 se asocia a un aumento de la moralidad por IR con fallo ventilatorio. Del mismo modo, de las cifras de pH y de bicarbonato podemos determinar el grado de compensación de la acidosis, lo que ayuda a distinguir un episodio agudo de uno crónico, ya que un pH normalizado con una alcalosis metabólica compensadora sugiere cronicidad. 04. Fisiología respiratoria 29 - 53 El enfermo crítico 2. Respiratorio Situación aguda, crónica o crónica agudizada. Tabla 5: ejemplos de los tipos de IR en función de los valores gasométricos. De la misma manera, podemos estimar el gradiente alvéolo-arterial de O2 (AaPO2), ya que es un excelente indicador de la eficacia del parénquima pulmonar como intercambiador de O2-CO2: Gradiente Aa=PAO2- PaO2 Siendo la PAO2 la presión alveolar de O2: PAO2=(FiO2 x (presión barométrica – presión del vapor de agua)) – (PaCO2/R*) *Donde R es un cociente respiratorio resultante de la relación entre el CO2 eliminado y el consumo de O2. En el individuo sano, el AaPO2 se mantiene entre 10-15 mmHg, alcanzando los 20 mmHg en el anciano. Cualquier enfermedad pulmonar que modifique el intercambio de gases causará una elevación del AaPO2, más importante cuanto más grave sea. Por el contrario, si existe IR de origen extrapulmonar, el AaPO2 se normalizará. Dado que el cálculo del AaPO2 precisa de la FiO2, resulta útil para monitorizar la evolución de un paciente tratado con O2 a bajos flujos, ya que si la evolución es correcta, el AaPO2 se normalizará. Sin embargo, si la FiO2 requerida en el tratamiento es > 40%, el AaPO 2 pierde exactitud. Por lo que cuando se requiera FiO2 elevada, es preferible sustituir el 04. Fisiología respiratoria 30 - 53 El enfermo crítico 2. Respiratorio AaPO2 por el cociente PaO2/FiO2 (normal si > 300). Un cociente PaO2/FiO2 < 200 mmHg es uno de los criterios diagnósticos de SDRA. Figura 9: interpretación de la gasometría alveolar con gradiente AaO2. Para finalizar, no debemos olvidar tener siempre en cuenta cómo ha sido el procedimiento de obtención y análisis de la muestra, ya que debe seguir las recomendaciones establecidas. Los principales problemas técnicos que originan errores en la interpretación son: Punción venosa: la adición de una décima parte de sangre venosa a la muestra extraída origina un descenso del 25% en la PaO2. Burbujas en la muestra. Hiperventilación por punción dolorosa. Desconocimiento de la FiO2 con la que se obtuvo la muestra. Exceso de heparina en la jeringa. Muestra en contacto con el aire. Demora superior a 10-15 minutos desde la extracción hasta el análisis. Deficiente mantenimiento del gasómetro. Leucocitosis > 50.000/mm3. 04. Fisiología respiratoria 31 - 53 El enfermo crítico 2. Respiratorio Radiografía de tórax Figura10: patrones radiológicos en la IR. Es imprescindible en la valoración inicial de toda IR, siempre que el estado del paciente lo permita. Los patrones radiológicos encontrados son variados (incluso pueden no presentarse alteraciones, lo que no descarta patología subyacente), pero algunos de ellos permiten identificar claramente la enfermedad subyacente que está provocando la IR. Así, el patrón radiológico puede orientar el diagnóstico de la enfermedad causal: Atrapamiento aéreo: asma, EPOC agudizada… Infiltrados parenquimatosos difusos: EAP… Opacidades pulmonares localizadas: atelectasia, neumonía. Trastornos extrapulmonares: neumotórax, deformidades de la caja torácica. 04. Fisiología respiratoria 32 - 53 El enfermo crítico 2. Respiratorio Igualmente, es importante valorar la radiografía de tórax conjuntamente con los resultados de la gasometría arterial. Figura 11: patrón de atrapamiento aéreo. En la radiografía de tórax se puede observar que el pulmón es más radiotransparente, debido a su hiperinsuflación, los diafragmas están aplanados y las costillas estás más separadas de lo habitual, todo ello signos de atrapamiento aéreo intrapulmonar. Figura 12: patrón infiltrativo difuso. Habitualmente, se debe a aumentos difusos de la trama intersticial o a ocupación del espacio alveolar de forma generalizada (infiltrados algonosos) por agua, pus o sangre. 04. Fisiología respiratoria 33 - 53 El enfermo crítico 2. Respiratorio Figura 13: patrón infiltrativo localizado. Se denomina consolidación alveolar a la ocupación del espacio alveolar de una zona determinada del pulmón, por afectación localizada de ésta. Suele ser de distribución lobar. Genera el signo de la silueta con el corazón o con la pared torácica y suele presentar broncograma aéreo (si los bronquios están respetados). Figura 14: trastornos extrapulmonares, neumotórax derecho. Se observa la hiperclaridad18 del campo derecho y el pulmón derecho colapsado contra el hilio. 04. Fisiología respiratoria 34 - 53 El enfermo crítico 2. Respiratorio Exploraciones complementarias Análisis de orina: permite la evaluación rápida de la existencia de tóxicos que nos orienten el diagnóstico, así como analizar la composición iónica de la orina. Electrocardiograma (ECG): permite detectar arritmias, signos de sobrecarga derecha, patrones de cardiopatía isquémica o alteraciones compatibles con un TEP. Es una prueba rápida, no invasiva y barata que puede aportar mucha información, por lo que es obligatorio realizarla en todo paciente con IR. Otras pruebas complementarias: se debe solicitar cualquier prueba complementaria que nos ayude a confirmar o descartar un posible diagnóstico etiológico de la IR. Así, por ejemplo, se deberá realizar una tomografía computarizada (TC) con contraste si se sospecha un TEP, pruebas microbiológicas (hemocultivos, cultivos de esputo…) si se sospecha un cuadro infeccioso… TRATAMIENTO Los objetivos principales del tratamiento serán garantizar la ventilación y la oxigenación, así como recuperar la función respiratoria y tratar la causa desencadenante. Medidas generales al ingreso en IR aguda 1. Reposo en cama y toma de constantes. 2. Garantizar la permeabilidad de la vía aérea, resolviendo situaciones de obstrucción de la misma o asegurando su protección, incluso con la intubación orotraqueal si fuera necesaria. 3. Administración adecuada de O2, al menor flujo que requiera el paciente para mantener niveles adecuados de saturación de O2. 4. Control del incremento de CO2. 5. Canalización de vía venosa periférica e inicio de fluidoterapia apropiada. 6. Valorar cuidadosamente y de forma individual la administración de fármacos sedantes y depresores del SNC. 7. Profilaxis de trombosis venosa profunda y de úlceras digestivas por stress, si el paciente va a permanecer hospitalizado o presenta riesgo elevado para sufrirlos. Medidas generales al alta hospitalaria o en IR crónica 1. Abandono del hábito tabáquico: la medida de mayor valor y que ha demostrado ser más eficaz. La EPOC, prácticamente siempre es debida al tabaquismo y es la causa de insuficiencia respiratoria crónica más frecuente en nuestro medio. Dejar de fumar siempre es beneficioso, ya que decelera la progresión de la enfermedad y aumenta la supervivencia. 2. Disminución de la exposición a factores ambientales: cuando estos son los causantes directos (como, por ejemplo, en las alveolitis extrínsecas). 3. Rehabilitación respiratoria: importante, ya que se ha visto que disminuye los síntomas y la pérdida de capacidad pulmonar. 04. Fisiología respiratoria 35 - 53 El enfermo crítico 2. Respiratorio 4. Vacunaciones antigripal y antineumocócica. 5. Valorar la oxigenoterapia crónica domiciliaria. Tratamiento etiológico Siempre que sea posible y desde el momento más precoz posible, ya que su éxito asegurará el control de la IR. Para poder iniciarlo, hay que conocer la enfermedad subyacente que está provocando la IR, ya que dependerá de ésta. Por ejemplo: TEP: anticoagulación sistémica y, en algunos casos, fibrinólisis intrarterial. Neumotórax a tensión: toracocentesis descompresiva. Neumonía: antibioterapia, empírica en un principio y dirigida tras recibir antibiogramas. Crisis asmática: broncodilatadores y corticoides. EAP cardiogénico: diuréticos y vasodilatadores. Etc. Oxigenoterapia Su objetivo es lograr una adecuada oxigenación de los tejidos. Para ello, se debe superar el umbral crítico de hipoxemia, que es cuando la PaO 2 es < 60 mmHg y lograr una saturación de O2 del 90% o superior. Se debe intentar obtener la primera gasometría arterial antes de iniciar la oxigenoterapia y repetirla a los 30 minutos de iniciarla para valorar la respuesta al tratamiento. En los pacientes sin patología respiratoria de base, en principio no existe limitación en la dosis de O2 a administrar para alcanzar una PaO2 > 60 mmHg. En cambio, en los pacientes diagnosticados de EPOC y que retienen CO2, la administración de FiO2 elevadas puede deprimir la ventilación mitigando el impulso respiratorio y fomentando la hipercapnia, dando lugar a una situación de mayor retención de CO2 que debemos evitar. Broncodilatadores Los broncodilatadores son sustancias, generalmente fármacos, que provocan dilatación de los bronquios y los bronquiolos por relajación de su musculatura, lo que se traduce en una disminución en la resistencia aérea y, por lo tanto, en una mejoría en el flujo de aire. Son utilizados en el tratamiento de enfermedades que producen obstrucción al flujo aéreo, como asma, EPOC… Se dividen en : Broncodilatadores de acción corta: fármacos eficaces en el control rápido de los síntomas y en pacientes con síntomas ocasionales, el tratamiento con broncodilatadores de acción corta reduce los síntomas y mejora la tolerancia al esfuerzo. Estos fármacos, añadidos al tratamiento de la enfermedad de base, son de elección para el tratamiento de los síntomas a demanda, sea cual sea el nivel de gravedad de la enfermedad que provoca la IR. 04. Fisiología respiratoria 36 - 53 El enfermo crítico 2. Respiratorio o Anticolinérgicos: bromuro de ipratropio. o Agonistas β2-adrenérgicos de acción corta: salbutamol y terbutalina. Broncodilatadores de larga duración: se utilizan como primer escalón en el tratamiento de los pacientes con síntomas permanentes que precisan tratamiento de forma regular, porque permiten un mayor control de los síntomas y mejoran tanto la calidad de vida como la función pulmonar. o Anticolinérgicos: bromuro de tiotropio. o Agonistas β2-adrenérgicos de acción larga: salmeterol, formoterol indacaterol. e Habitualmente, los broncodilatadores son bien tolerados y presentan escasos efectos adversos. No obstante, se deben tener en cuenta los siguientes: o Temblor fino de extremidades. o Calambres musculares. o Taquicardia. o Hipertensión arterial. o Vasodilatación periférica. o Cefalea. o Hiperglucemia. o Hipocalemia. o Dispepsia. o Tos y broncoespasmo. o Irritación orofaríngea. En este apartado, hay que mencionar el grupo de las metil-xantinas (teofilinas), que son fármacos broncodilatadores débiles por lo que aparecen en tercera línea de tratamiento, pero que presentan efectos aditivos con los broncodilatadores habituales: Aumentan la fuerza del diafragma. Aumentan el rendimiento de los músculos respiratorios. Disminución del atrapamiento aéreo. Mejoría del aclaramiento mucociliar. Efectos antiinflamatorios. La toxicidad de la teofilina es dosis-dependiente. Su uso incrementa el riesgo de náuseas, diarrea, dolor de cabeza, irritabilidad y, en dosis elevadas puede producir arritmias cardíacas, convulsiones, taquicardia e hipopotasemia. De esta manera, en episodios de IR aguda secundarios a crisis de asma o agudizaciones de EPOC, el primer fármaco a administrar es un agonista β2-adrenérgicos de acción corta, al que se puede añadir un anticolinérgico, cuando el primer broncodilatador no tiene todo el efecto deseado. 04. Fisiología respiratoria 37 - 53 El enfermo crítico 2. Respiratorio Tabla 6: broncodilatadores. Corticoesteroides Los corticoesteroides actúan sobre la liberación de mediadores inflamatorios, disminuyen la activación y el reclutamiento de células inflamatorias, reducen la producción de moco y disminuyen la permeabilidad capilar. Forman parte del tratamiento en la IR aguda secundaria a algunas enfermedades como la EPOC, el asma bronquial, el SDRA en fases tardías y en la neumonía por Pneumocystis jirovecii con disfunción pulmonar moderada-grave, pero no deben ser incluidos rutinariamente en el tratamiento de la IRA. Las formas de administración son: Corticoesteroides inhalados: o Utilizados en pacientes que presentan frecuentes agudizaciones pese a realizar un tratamiento broncodilatador óptimo, ya que disminuyen de manera significativa el número de agudizaciones y mejoran la calidad de vida, aunque no han demostrado una mejoría en la mortalidad. o Budesonida, beclometasona, fluticasona, flunisolida, triamcinolona… Corticoesteroides sistémicos: o Han demostrado acelerar la recuperación de los síntomas, mejorar la función pulmonar y disminuir los fracasos terapéuticos. En las agudizaciones, tanto moderadas como graves, del asma y del EPOC deberá emplearse una tanda corta de corticoides sistémicos durante 7-10 días. También se valorará el uso de estos fármacos en los pacientes con agudizaciones leves que no responden satisfactoriamente al tratamiento inicial. o Hidrocortisona, prednisona, metilprednisona… Tabla 7: corticoesteroides sistémicos más empleados. 04. Fisiología respiratoria 38 - 53 El enfermo crítico 2. Respiratorio Antibióticos Los antibióticos no son un tratamiento de rutina en pacientes con IR aguda, sino que deben reservarse para aquellos casos con evidencia de infección bacteriana: Condensación radiológica. Cultivos positivos. Clínica compatible con clínica infecciosa: sinusitis, esputo purulento, tos, fiebre, escalofríos, dolor pleurítico… Teniendo en cuenta que la etiología polimicrobiana aparece en el 40% de los casos, los gérmenes más frecuentemente implicados son: Agudizaciones de EPOC: S. pneumoniae, H. influenzae y M. catarralis. Las enterobacterias y el grupo de Pseudomona spp ganan importancia en pacientes con enfermedad avanzada y/o bronquiectasias. Neumonía comunitaria: S. pneumoniae, S. aureus y H. influenzae. Neumonía nosocomial: P. aeruginosa y S. aureus meticilín resistente. Neumonía asociada a ventilación mecánica: P. aeruginosa, S. aureus meticilín resistente, Acinetobacter spp y Enterobacterias spp. Los antibióticos más utilizados, de manera empírica son: Tratamiento ambulatorio: o Moxifloxacino o levofloxacino, en monoterapia. o Amoxicilina/ácido clavulánico o cefditoren a macrólido (azitromicina o claritromicina). Tratamiento con ingreso hospitalario: o Cefalosporina de 3ª generación (ceftriaxona o amoxicilina/ácido clavulánico asociados a macrólido claritromicina). o Levofloxacino en monoterapia. Cefalosporina no antipseudomónica (ceftriaxona o cefotaxima) asociada a macrólido (azitromicina o claritromicina) o a levofloxacino. Sospecha de aspiración: o o o Tratamiento con ingreso en UCI: o cefotaxima) (azitromicina Amoxicilina/ácido clavulánico o ertapenem o clindamicina. Sospecha de infección por P. aeruginosa: o Piperacilina/tazobactam o cefepima o carbapenem antipseudomónico (imipenem o meropenem) asociados a ciprofloxacino o a levofloxacino o aminoglucósido (tobramicina o amikacina). 04. Fisiología respiratoria 39 - 53 El enfermo crítico 2. Respiratorio Siempre hay que tener en cuenta que hay que ajustar la antibioterapia en función de los resultados de los cultivos y de los antibiogramas Otros fármacos Heparina: usada, además de para prevenir la trombosis venosa profunda, para tratamiento de la IR aguda secundaria a TEP. Diuréticos: utilizados para eliminar el EAP cardiogénico. Usar con precaución los fármacos sedantes y depresores del SNC. COMPLICACIONES La morbimortalidad de los pacientes que presentan IR aguda depende de diversos factores como la edad, las enfermedades subyacentes, la comorbilidad previa... Pueden presentarse complicaciones pulmonares como: TEP: favorecido por el reposo en cama, la deshidratación, la edad avanzada… Infecciones nosocomiales pulmonares: secundarias a broncoaspiración. Barotrauma: secundario a la ventilación mecánica en paciente con distensibilidad pulmonar disminuida. Puede manifestarse como neumotórax, enfisema intersticial… Las complicaciones extrapulmonares más habituales incluyen las anomalías hidroelectrolíticas, la insuficiencia renal aguda, las alteraciones cardiacas y las gastrointestinales. 04. Fisiología respiratoria 40 - 53 El enfermo crítico 2. Respiratorio OXIGENOTERAPIA CONCEPTO La oxigenoterapia es una medida terapéutica consistente en la administración de oxígeno (O2) a concentraciones mayores que las ambientales, con la intención de tratar o prevenir la hipoxemia. Tabla 1: valores de referencia de los principales gases ambientales. De esta forma, el O2 utilizado es considerado un fármaco en forma gaseosa, por lo que debe ser dosificado con precaución y teniendo en cuenta sus efectos adversos. La oxigenoterapia se puede emplear en situaciones de hipoxemia aguda (de la que hablaremos) o crónica (oxigenoterapia crónica domiciliaria). Recordemos: -Hipoxemia: disminución de la PaO2 en sangre arterial < 80 mmHg. -Hipoxia: disminución de la difusión de O2 a los tejidos. OBJETIVOS El objetivo principal de la oxigenoterapia es mantener unos niveles de oxigenación adecuados que eviten la hipoxia tisular. Esto se consigue cuando la PaO2 en sangre arterial alcanza valores > 60 mmHg, lo que corresponde a una saturación del 90%, aproximadamente. 04. Fisiología respiratoria 41 - 53 El enfermo crítico 2. Respiratorio Para lograr estos objetivos, además de una PaO2 adecuada, se requieren unos niveles de hemoglobina normales y que el gasto cardiaco esté conservado. De manera secundaria, al mejorar la hipoxemia, la oxigenoterapia logrará: Disminuir el trabajo respiratorio. Disminuir el trabajo miocárdico y el riesgo de aparición de arritmias. Disminuir el metabolismo anaerobio. Mejorar las funciones cerebrales. Reducir la hipertensión pulmonar y mejorar la función del ventrículo derecho. Efectos hemodinámicas del O2 Disminuye la frecuencia cardiaca. Disminuye el gasto cardiaco. Disminuye el trabajo sistólico del ventrículo derecho. No varía el trabajo sistólico del ventrículo izquierdo. Los efectos sobre la tensión arterial son variables, puede aumentarla o disminuirla, según el origen del trastorno. Disminuye la hipertensión pulmonar por disminución de las resistencias pulmonares. Aumenta la presión venosa central. Aumentan las resistencias sistémicas periféricas. INDICACIONES EN INSUFICIENCIA RESPIRATORIA AGUDA Como prevención ante un posible desarrollo de hipoxemia en pacientes con enfermedades de base respiratorias, cardiacas… En hipoxemia instaurada cuando: o PaO2 55-60 mmHg (Saturación de O2 < 85-89%) en pacientes agudos. o PaO2 < 50 mmHg (Saturación de O2 < 80%) en pacientes crónicos agudizados. Se vaya a realizar un procedimiento que conlleve un riesgo de hipoxemia: broncoscopio, intubación orotraqueal, aspiración de secreciones bronquiales… Otras: anemia, parada cardiorrespiratoria. 04. Fisiología respiratoria 42 - 53 El enfermo crítico 2. Respiratorio SISTEMAS DE ADMINISTRACIÓN DE OXÍGENO Es importante conocer el mecanismo fisiopatológico que está produciendo la hipoxia o la hipoxemia al paciente antes de iniciar el tratamiento para elegir el más adecuado y para poder anticipar la respuesta al mismo. Los sistemas de oxigenoterapia se dividen en: Sistemas cerrados: ventilación mecánica. Sistemas abiertos (los que trataremos en este tema): sistemas de administración de O2 para introducir dicho gas en la vía aérea. Existen varios tipos, distinguiéndose según su complejidad, coste y precisión en el aporte de O 2. En general, se clasifican en dos grandes grupos, según la posibilidad de garantizar una FiO2 más o menos constante en cada respiración: o Sistemas de bajo flujo. o Sistemas de alto flujo. Sistemas de bajo flujo La FiO2 que aportan al paciente es variable, dependiendo de la situación ventilatoria del propio paciente y del flujo de O2 suministrado. Además, no aportan la totalidad del gas inspirado, sino que una parte la toma el paciente del aire ambiental. Los criterios para su uso son: Volumen tidal del paciente conservado: 300-700 ml. Ausencia de taquipnea: < 25 respiraciones/minuto. Ventilación del paciente constante y uniforme. Si no se cumplen estos criterios, se deben utilizar los sistemas de alto flujo. Cánula nasal o gafas nasales: o Dispositivo confortable para el paciente ya que le permite comer, beber y hablar sin necesidad de ser retirada, por lo que suele ser bien tolerada; además, puede ser utilizada con sistemas de humidificación del aire. o Como desventajas, no permite conocer con exactitud la concentración de O 2 en el aire inspirado, ya que depende de la demanda inspiratoria del paciente y se debe limitar el flujo de aire a < 5 l/min., porque flujos mayores secan la mucosa nasal, provocan irritación y no consiguen aumentar más la FiO 2. En algunas ocasiones, puede producir heridas por decúbito en la nariz y en el pabellón auricular. o Como norma general, para conocer la FiO2 aportada, se calcula: FiO2 = 20% + (4 x flujo en litros) 04. Fisiología respiratoria 43 - 53 El enfermo crítico 2. Respiratorio Tabla 2: FiO2 aproximada con gafas nasales. Figura 1: gafas nasales. Mascarilla simple: o Dispositivo que carece de válvulas y de reservorio y que sólo dispone de unos agujeros laterales para la salida del aire espirado por el paciente. Acoplable a traqueostomías. o Permiten llegar hasta FiO2 del 40%-50% con flujos bajos de O2 (6-8 l/min) y se pueden acoplar a humidificadores. o Interfieren con actividades del paciente como expectorar y comer. Existe riesgo de aumentar la retención de CO2, ya que resulta difícil aportar menos FiO2. 04. Fisiología respiratoria 44 - 53 El enfermo crítico 2. Respiratorio Figura 2: mascarilla simple. Figura 3: mascarilla de traqueostomía. Mascarilla con reservorio (de reinhalación parcial o de no reinhalación): o Es el dispositivo que permite aportar mayor FiO 2, pudiendo llegar al 60%, pero puede provocar una situación de reinhalación parcial del aire espirado si el flujo aportado es insuficiente (para evitar esta situación, se han diseñado unas válvulas unidireccionales, que al colocarse entre la mascarilla y el reservorio, permiten que el paciente inhale el gas aportado, pero obliga al aire espirado a escapar por la válvula espiratoria). o La función del reservorio es la de almacenar el gas proveniente de la fuente, así al inspirar, la mayor parte del aire inhalado se obtendrá del reservorio y no del ambiente. o Poco tolerada por algunos pacientes, ya que dificulta la expectoración y produce sequedad y/o irritación ocular. 04. Fisiología respiratoria 45 - 53 El enfermo crítico 2. Respiratorio Figura 4: mascarilla reservorio. Figura 5: sistemas de no reinhalación y de reinhalación parcial. 04. Fisiología respiratoria 46 - 53 El enfermo crítico 2. Respiratorio Figura 6: sistemas de no reinhalación y de reinhalación parcial. Sistemas de alto flujo Proporcionan al paciente el requerimiento inspiratorio que necesita, es decir, el paciente únicamente respira el gas que la aporta el dispositivo. La FiO2 aportada es independiente del patrón ventilatorio del paciente y se mantiene constante en cada respiración. Mascarilla tipo Venturi: o Sistema que permite la administración de una concentración exacta de O2, proporcionando niveles de FiO2 entre 24-50%. o Estas máscaras contienen válvulas de Venturi que utilizan el principio de Bernoulli: cuando el O2 pasa por un orificio estrecho se produce una corriente de alta velocidad que arrastra una proporción prefijada de aire ambiente. La entrada de aire depende de la velocidad del chorro del aire (flujo) y el tamaño de apertura de la válvula. La reinspiración de aire espirado no constituye un problema porque las altas tasas de flujo que se tienen que aportar permiten la renovación del aire de la mascarilla. o Al igual que todos los sistemas de mascarilla, hay que tener presente que puede ser mal tolerada, impedir una correcta expectoración o producir sequedad mucocutánea. 04. Fisiología respiratoria 47 - 53 El enfermo crítico 2. Respiratorio Tabla 3: flujos máximos con mascarilla Venturi. Figura 7: mascarilla Venturi. Tienda, cámara o campana facial: o Se trata de un cilindro de plástico colocado sobre cabeza y cuello que permite la administración de una FiO2 constantes a alta concentración, con flujos de O 2 de 5-8 L/min, mediante un sistema Venturi. o Se utiliza, sobre todo, para oxigenoterapia en niños, en pacientes que no toleran las mascarillas faciales o en pacientes que han sufrido un traumatismo craneoencefálico importante. o Importante aplicarla asociada a humidificadores, llegando a un 80% de humedad en recién nacidos. o Puede provocar sensación de calor y de confinamiento, limita los movimientos del paciente y, debido a la alta humidificación que necesita, es necesario ventilar el circuito cada dos horas para evitar la condensación. 04. Fisiología respiratoria 48 - 53 El enfermo crítico 2. Respiratorio Figura 8: campana facial. Tener en cuenta… Ya se ha visto anteriormente que se debe obtener la primera gasometría de sangre arterial lo antes posible y, si la situación del paciente lo permite, antes de comenzar la oxigenoterapia. Tras el inicio del tratamiento con O2, se debe repetir a los treinta minutos para valorar la mejoría del paciente. Y también debemos recordar, que en los pacientes que no tienen patología respiratoria de base no existe limitación en la dosis de O2 a administrar, pero en los pacientes EPOC, la administración de FiO2 elevadas puede deprimir la ventilación y el impulso respiratorio, lo que fomenta la hipercapnia. En la IR aguda la oxigenoterapia deberá ser continua y nunca se comenzará bruscamente, ya que esto agravaría la hipoxemia antes de que la ventilación mejorase; así, se iniciará con flujos bajos que se irán elevando progresivamente según la mejoría (o la ausencia de ésta) de la PaO2. Este método, además, intenta evitar la supresión del centro respiratorio (que en situación de IR depende de la hipoxia, no de la hipercapnia), para no producir una retención de CO2 secundaria a la oxigenoterapia. Toda administración de O2, para que sea correcta, debe ser: Continua, evitando cualquier tipo de interrupción o de fluctuación. Inicio y cese graduales. De hecho, tras la supresión de la oxigenoterapia, las cifras de PaO2 se van estabilizando en los días sucesivos. Dosificada acorde a las necesidades del paciente. Acondicionada, con niveles de humedad y temperatura adecuados. Además, debemos conocer que igual que se pueden acoplar sistemas de humidificación a las distintas mascarillas de oxigenoterapia, también podemos asociarles nebulizadores para poder administrar medicamentos por vía inhalatoria. 04. Fisiología respiratoria 49 - 53 El enfermo crítico 2. Respiratorio Figura 9: humidificador. Figura 10: mascarilla nebulizadora. ELECCIÓN DE LA TERAPIA CON O2 En dependencia de la situación clínica el paciente y de la causa de la hipoxemia, se elegirá el tipo de terapia a aplicar: Pacientes con IR aguda no hipercápnica: generalmente, el principal mecanismo fisiopatológico es el shunt intrapulmonar. Se debe iniciar la oxigenoterapia con sistemas de alto flujo tipo Venturi con FiO 2 ajustada al nivel más bajo posible que permita obtener valores de PaO 2 > 60 mmHg. Si no es suficiente se requerirán sistemas de bajo flujo con bolsa reservorio. Pacientes con IR aguda hipercápnica: el ejemplo típico es la exacerbación de la EPOC (cuyo mecanismo principal de hipoxemia es la alteración de la relación ventilación/perfusión). Se recomienda la oxigenoterapia con sistemas tipo Venturi a baja concentración (FiO2 24-28%) y, si no se puede mantener la PaO2 > 60 mmHg, se aumentará la FiO2 controlando el posible incremento de la hipercapnia y de la acidosis respiratoria secundarias. Además, puesto que en pacientes con hipercapnia crónica el principal estímulo ventilatorio es la hipoxia, el empleo de concentraciones de O 2 superiores puede causar una depresión mayor del centro respiratorio. MONITORIZACIÓN DE LA OXIGENOTERAPIA Para poder controlar la evolución del paciente y la corrección de la hipoxemia, observando la normalización de los niveles de PaO2, se utilizan diferentes métodos más o menos invasivos: 04. Fisiología respiratoria 50 - 53 El enfermo crítico 2. Respiratorio Gasometrías de sangre arterial seriadas: obteniendo la primera tras 30 minutos de tratamiento. Es el procedimiento más clásico, pero puede producir molestias para los pacientes. Respuesta clínica al tratamiento: se debe observar la evolución clínica del paciente, destacando el estado de conciencia, la función de los músculos respiratorios y la mecánica respiratoria. Pulsioximetría: procedimiento no invasivo y válido basado en técnicas espectrofotométricas, que cuantifica la cantidad de luz que absorbe la oxihemoglobina, de manera que se usan dos longitudes de onda determinadas para poder diferenciar la concentración de oxihemoglobina de la de otras dishemoglobinas (metahemoglobina…). Hay que tener en cuenta unas limitaciones: o Existe una estimación de error en las tomas de ± 4% en la saturación de O2. o Su mayor limitación es que monitoriza la saturación de O2, no la PaO2. o Pueden producirse errores en las tomas en presencia de carboxihemoglobina, metahemoglobina, pigmentación de piel oscura o de las uñas, ictericia, alteraciones de la luz ambiental, saturación de O2 < 75% Por ello, a pesar de su utilidad, no debe ser usada como única medida para la monitorización de los enfermos con fallo respiratorio. Capnografía: monitorización respiratoria que registra de forma continua y gráfica las concentraciones de CO2 en el gas espirado. Para medir estas concentraciones se usa el capnómetro, aparato que calcula la absorción de un haz de luz infrarroja a una longitud de onda determinada que emite el propio dispositivo y que representa en una curva continua la concentración de CO 2 a lo largo del tiempo. Para hacer llegar el aire espirado al capnómetro se utiliza un catéter, que se puede colocar en el circuito de gases de respirador o adaptar a unas gafas nasales. Procedimientos transcutáneos de monitorización de la PtO 2 y la PtCO2: de especial interés en neonatos y en situaciones de inestabilidad. Se coloca un electrodo pegado a la piel, que la calienta hasta los 43-45 ºC, vaporizando el O2/CO2 capilar en el tejido subcutáneo, para medirlo a través de un emisor-lector de luz infrarroja a una determinada longitud de onda, que es absorbida por los gases vaporizados del tejido. Estas medidas se leen en un monitor de lectura contínua conectado al electrodo. Presentan buena correlación con las PaCO 2 y PaO2 y es un método superior al pulsioxímetro para detectar episodios de hipoventilación, ya que las PtCO2/PtCO2 se alteran de forma más precoz que la saturación de O2. Monitorización de la PACO2 (presión de CO2 en el aire espirado): con ella se obtiene indirectamente la PaCO2. Ocasionalmente, se requiere monitorización hemodinámica invasiva por medio de cateterización arterial, venosa central o incluso de la arteria pulmonar (catéter de Swan-Ganz). 04. Fisiología respiratoria 51 - 53 El enfermo crítico 2. Respiratorio EFECTOS ADVERSOS DE LA OXIGENOTERAPIA Secado de secreciones y de mucosas. Acidosis respiratoria. Inversión de la vasocontricción hipóxica compensadora. Descenso de la concentración de nitrógeno en el aire inspirado, desplazado por el aumento de O2, lo que puede provocar inestabilidad alveolar y microatelectasias. Citotoxicidad por aumento de los radicales libres con destrucción de los neumocitos tipo I, que conlleva edema intersticial y proliferación de los neumocitos tipo II y de los fibroblastos. Contaminación bacteriana, con riesgo de infección respiratoria secundaria, de los circuitos y de los sistemas de humidificación acoplados. Retinopatía por formación de neovasos retinianos en recién nacidos prematuros, si se administra la suficiente FiO2 para mantener PaO2 > 80 mmHg de manera continua. Toxicidad pulmonar directa cuando se administra a altas concentraciones (FiO 2 > 60%), produciendo una reacción inflamatoria alveolar con alteración del surfactante por degeneración de los neumocitos tipo II. Por esto, es importante manejar el concepto de FiO2 óptima, que se considera como la menor concentración de O2 que consiga una saturación de O2 alrededor del 90%, siendo relativamente segura una FiO2 < 60%. Depresión respiratoria y retención de CO2.: la hipoxia supone un estímulo para la ventilación en aquellos pacientes con tendencia a la hipercapnia, a través del estímulo de los receptores aórticos y de los carotídeos. Por otra parte, la administración de O2 puede empeorar la relación ventilación-perfusión por vasodilatación de territorios no bien ventilados y también puede producir una mayor dificultad para el transporte en la sangre del CO2. Incluso puede tener un efecto depresor del volumen minuto cardiaco por cierto efecto vagal. Intoxicación por O2: que se traduce en un cuadro inespecífico de náuseas, mareos, vértigo, desorientación, confusión… OXIGENOTERAPIA CRÓNICA DOMICILIARIA (OCD) Es la forma de tratamiento de la insuficiencia respiratoria crónica, suponiendo un gran adelanto en el abordaje de la EPOC, sobre todo. Su objetivo es corregir los efectos de la hipoxemia crónica, para lo que se debe lograr una Pa O2 > 60 mmHg ajustando la FiO2 necesaria. La instauración de este tratamiento debe estar basada en un juicio clínico cuidadoso y apoyado por la medición de los gases en sangre arterial. Sus indicaciones son: 04. Fisiología respiratoria 52 - 53 El enfermo crítico 2. Respiratorio EPOC estable u otra patología causante de hipoxemia crónica con PaO 2 < 55 mmHg (respirando aire ambiente). EPOC estable u otra patología causante de hipoxemia crónica con PaO2 55-60 mmHg (respirando aire ambiente) y que, además presentan alguna de las siguientes situaciones: o Hipertensión arterial pulmonar (HTP). o Poliglobulia con hematocrito > 55%. o Cor pulmonale crónico. o Trastornos del ritmo cardiaco. Excepcionalmente, como tratamiento de la disnea en paciente terminales. Pacientes que presenten: o Hipoxemia nocturna (saturación de O2 < 85%). o Síndrome de apnea-hipopnea del sueño con desaturación nocturna que no se corrige con CPAP o BiPAP. o Desaturación en la realización de actividad física de la vida cotidiana. Los beneficios que la OCD aporta son: Corrección de la hipoxemia sin inducir acidosis respiratoria ni hipercapnia. Aumento de la superviviencia: única medida terapéutica conocida que disminuye la mortalidad en el paciente EPOC (a excepción de la deshabituación tabáquica). Mejoría del cor pulmonale. Mejoría de la función cardiaca. Disminución de la poliglobulia. Disminución de la hipertensión pulmonar. Mejoría de la calidad de vida. Mejoría de la calidad del sueño. Mejoría de la capacidad para el ejercicio. Hay que tener en cuenta que: La indicación de OCD no se considera definitiva hasta al menos haber mantenido tres meses de tratamiento consecutivos. La FiO2 administrada será la mínima necesaria para garantizar PaO2 > 60 mmHg o saturación de O2 > 92-93%. La duración del tratamiento será > 15 horas/día. 04. Fisiología respiratoria 53 - 53