c) Sintetizar el modelo atómico de Bohr.
Anuncio

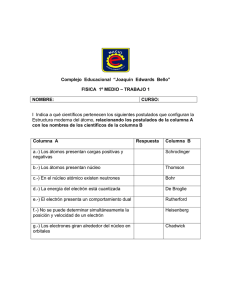
Sesión 6 Tema: ESTRUCTURA ATÓMICA I. Objetivos de la sesión Después de comple tar el estudio de este capítulo Ud. debe ser capaz de: a) b) Resumir el modelo atómico de Dalton. Explicar mediante el modelo atómico de Dalton la le y de la conservació n de la masa y la ley de la composició n constante. c) Sintetizar el modelo atómico de Bohr. d) e) f) Describir y dar eje mplos del concepto de cuantizació n. Sintetizar y discutir la s implicancia s del modelo mecánico cuántico del átomo. Definir y describir los diversos números cuánticos que definen a un electrón en un átomo. II. Temas Modelos del átomo. El uso de modelos en ciencia. La ciencia es una serie de esquemas conceptuale s o modelos acerca de algunos aspectos del universo físico. Existen diferentes tipos de modelo s, incluyendo, modelos verbales, modelos mecánicos o pictóricos y modelos matemáticos. Por ejemplo , un modelo pictórico puede ser suficie nte para describir una manzana cayendo al suelo. Pero para proveernos de una descripció n más exacta y para predecir donde estará la manzana en cualq uier momento dado, necesitaremos usar una ecuación matemática de movimiento. Muchos modelos científicos para lo s mundos microscópicos y supermacro no son tan simples como los modelos del macro mundo. En ciencia frecuentemente tratamos de describ ir o dib uja r como alg o trabaja , como por ejemplo , un átomo o un electrón, que no podemos ver o experimentar directamente. En efecto, estamos tratando de describ ir qué hay en el interior de una caja negra que nunca podremos abrir completamente. Podemos agitarla, calentarla , colocarle magnetos para ver si contiene metales magnéticos y realizar una serie de experimentos para tener una idea de su contenid o. Pero como nunca la podremos abrir, sólo podemos formular modelos que son útile s para explicar sus propiedades. Por ejemplo, dividamos en dos una pie za de metal. Luego cortemos una mitad por la mitad y repitamos este proceso una y otra vez. ¿Podremos teóricamente seguir dividiendo el material para siempre o alcanzaremos alguna unidad básica de materia no más divisible? La cie ncia ha ido gradualmente desarrolla ndo y refinando una serie de modelos de la materia, como compuesta de bloques básicos llamados átomos, los cuales a su vez, tienen una estructura interna. El desarrollo de este esquema conceptual se resume en la Fig. 6.1 Primeros modelos griegos del átomo. Los filósofos griegos fueron aparentemente los primeros que desarrollaron el concepto de átomo. Entre el 450 y el 380 a.C., Leucip o y su discípulo Demócrito crearon la escuela atómica de filosofía natural. Ellos mantenían que si se divid ía repetid amente la materia, eventualmente se alcanzarían unidades de matera pequeñas, duras, permanentes invisib les e indivisibles, de forma y ta maño definid os. Demócrito usó la palabra átomos que significa indivisib le para describ ir el último bloque de la materia. Como los griegos no tenían ni los instrumentos ni la inclin ació n a probar estas ideas con experimentación, su modelo fue filosófico, basado en el razonamiento y en experimentos mentale s hipotéticos. Pero otros filósofos griegos, Platón y su discípulo Aristóteles, creían que la materia era más bie n contin ua que atomística y su opinió n prevaleció y como la estimación de su pensamiento era mayor, la idea atomística no fue revitalizada hasta 2.200 años más tarde. El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Fig.6.1. Evolución de los modelos del átomo El modelo atómico de Dalton. A princip ios del siglo 19, un maestro inglé s, John Dalton, revitalizó el concepto de átomo y lo usó para explicar ciertos aspectos de las reaccio nes químicas. Su modelo, conocid o como la teoría atómica, se puede resumir: 1. Toda la materia consiste de pequeñísimas partículas lla madas átomos. 2. Los átomos no pueden crearse, destruirse, subdivid irse o convertirse de un tipo en otro. 3. Los átomos de un ele mento particula r tienen todos las mismas propie dades. 4. Atomos de diferentes elementos tienen diferentes propiedades. 5. Los átomos se combinan en relación de números enteros sencillo s. 6. Un cambio químico implica la unió n, separació n o reordenamiento de lo s átomos. La hipótesis origin al de Dalton se convirtió en una teoría amplia mente aceptada porque él la usó para explicar dos leyes conocid as, la ley de la conservación de la masa y la ley de la composición constante, y para formular una nueva ley, la ley de las proporcio nes múltiples. Dalton usó la hipótesis que la materia consistía de átomos indestructible s para explicar la ley de la conservación de la masa de Lavoisier. Si los átomos no pueden destruirse ni crearse, entonces una reacción química es solamente un reordenamiento de átomos, análo gos a los bloques de construcció n infantiles, que pueden ser usados para construir un puente, y luego reordenados para construir una casa. La masa total de los productos tiene que ser la misma que la masa de los reactantes, porque ningún átomo puede ser creado o destruido durante la reacción. Nuevamente Dalton usó su hip ótesis para explicar la ley de la composición constante, llamada también ley de las proporciones definidas, de Proust. Si un compuesto como el agua está compuesto de billo nes y billones de moléculas idénticas, conteniendo cada una un átomo de oxígeno y dos átomos de hidrógeno, entonces la relación de las masas de lo s átomos de hidrógeno y de oxígeno en una simple molécula o en una gran cole cción de moléculas idénticas debe ser fija. Partículas sub atómicas. El próximo avance significativo en la evolució n de la teoría atómica se produjo cerca de 100 años después. Dalton veía a los átomos como duros e indivisible s. Sin embargo, se empezó a acumular evid encia que la materia tenía una estructura interna. Entre los hechos experimentales que contribuyeron podemos indicar el descubrimiento de los rayos catódicos (electrones) por William Crookes en 1879, a partir de los cuale s más tarde se desarrollaría la TV, y experimentos realizados con ellos por Thomson y por Goldstein, los que lle varon a lo s científicos al convencimiento que la materia contenía material cargado positiva y negativamente, Thomson en 1903 propuso el primer modelo de estructura in terna del átomo. El se El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. imaginaba al átomo como una esfera sólid a de materia cargada positivamente con electrones cargados negativamente incrustados en ella , como pasas en un kuchen (Fig 6.2). Fig. 6.2. El modelo nuclear de Rutherford. Entre 1895 y 1910, se realizaron un importante número de descubrimientos. Estos incluyeron el descubrimiento accid ental de los rayos X en 1895 por Wilhelm Roentgen y de la radioactivid ad espontánea (la emisión de radia ción penetrante por la materia, sin que se deba proveer energía) en el uranio por Henri Becquerel en 1896. Rutherford entonces, empezó a utilizar la radioactividad como una herramienta para estudiar la estructura de la materia . El bombardeó película s muy delg adas de oro con partículas alfa de un elemento radioactivo y estudió las formas en que eran desvia das. Para explicar los resultados obtenid os, Rutherford desarrolló un nuevo modelo de la estructura in terna del átomo. El concluyó que los átomos debían ser en gran medida espacios vacíos. El razonó que toda la masa del átomo de oro estaba concentrada en una muy pequeña regió n central o núcleo. También razonó que el núcleo debía estar cargado positivamente. Rutherford fue incluso capaz de usar estas medidas para estimar que el tamaño de un núcle o debía ser cerca de 10.000 veces más pequeño que el átomo mismo. Medidas más precisas hoy, indican que el núcle o promedio es casi 100.000 veces más pequeño que un átomo típico. Algunas propiedades de los elementos sugerían que debía existir una masa perdida si el núcle o contenía sólo protones. Esto llevó a Rutherford a predecir que eventualmente se descubriría otra partícula de carga neutral que explicaría esta masa perdida. Recién en 1932 el físico inglés James Chadwick descubrió el neutrón, sin carga eléctrica y que tiene una masa casi igual a la del protón. Así, en el modelo de Rutherford el átomo continúa consistiendo de un número igual de protones cargados positivamente y electrones cargados negativamente, como en el modelo de Thomson, pero los protones están en el interio r del núcleo, con los electrones de alg una manera distrib uid os en el relativamente amplio volu men del resto del átomo. ¿Dónde están los electrones?. Este nuevo modelo aún deja muchas cuestio nes sin responder. Desde esa época se han descubie rto más de 100 partícula s elementale s, bombardeando núcle os con partículas de cada vez más alta energía. No está claro si la mayoría de estas partícula s realmente existen en el núcleo o se forman por reacciones que se efectúan entre un pequeño número de constituyentes nucleares básicos. En cualquie r caso, el modelo simplificado neutrón-protón del núcle o explica satisfactoriamente los fenómenos discutidos a este nivel introductorio. Desde 1911 a la fecha, la búsqueda de un modelo del átomo se ha desarrollado en dos vías diferentes. Una implica indagar en los misterios de la estructura nucle ar, más cercana a la física, mientras que la otra se ocupa de la estructura de los electrones, que interesa más a los químicos, ya que de ella parece depender la reactividad química de los ele mentos y compuestos. El modelo de Bohr. La primera explicació n satisfactoria de lo que pasaba con lo s electrones al interio r de los átomos provino del físico danés Nie ls Bohr, en 1913. El hizo la proposición extraordin aria que lo s electrones en lo s átomos estaban cuantizados, esto es, que lo s electrones no podían tener cualq uie r energía, sino sólo ciertos valores específicos de energía. La idea que la energía es discontinua o aparece en paquetes había sido propuesta en 1900 por el físico alemán Max Planck, quié n sugirió que la luz era emitida en paquetes o haces discontin uos y discretos de energía llamados quanta. De acuerdo con el sentido común o nuestra lógica del macromundo, ésta pareció una idea descabella da e inicialmente la mayoría de los científicos ignoraron la hipótesis cuántica de Planck. Bohr, sin embargo, aplicó esta hip ótesis a los ele ctrones en lo s átomos. El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Si los electrones estaban cuantizados, habrá una secuencia discontin ua de niveles de energía permitidos o valores de energía potencia l en un átomo, tales como los que se encuentran en escale ras, estanterías y repisas (Fig . 6.3) La energía potencial es la energía de posición en un campo de fuerzas - gravitacional, eléctrico o magnético, por ejemplo. Como un lib ro o cualq uie r otro obje to es atraído por la fuerza de gravedad de la tierra, cada escalón o estante representa un nivel distintivo de energía potencial, conocid o como nivel de energía. Los electrones cargados negativamente en los átomos tienen energía potencial por la atracció n que ejercen sobre ellos los protones cargados negativamente en el núcleo. Fig. 6.3 Ejemplos de cuantizació n de la energía. En escaleras y estanterías los nivele s de energía están, en general, igualmente espaciados. En un lib rero con repisas ajustables podemos tener niveles de energía distintamente espacia dos. Por eje mplo, las enciclopedias se pueden colocar en la repisa inferior y lo s espaciamientos ir decreciendo para acomodar lib ros más pequeños hacia arrib a. En cada uno de estos ejemplos, el número cuántico n, se puede usar para designar los nivele s de energía princip ale s permitidos o las repisas o escalones y sólo pueden tener los valo res enteros n = 1, 2, 3, 4,..... Bohr razonó que si los electrones en el átomo se encuentran sólo en ciertas órbitas circula res permitidas, o nivele s de energía, entonces un ele ctrón puede ser exitado (lle vado más arriba o afuera) o volver a un set de niveles de energía fijos. La idea que los ele ctrones giran alrededor del núcle o sólo en ciertas órbitas permitidas, como un sistema solar en miniatura, explica también por qué los ele ctrones no caen en el núcleo. La velocid ad a la que giran lo s electrones en estas órbitas permitidas genera una fuerza centrífuga que compensa la atracció n eléctrica, generando un estado energético u órbita estable. En resumen, los prin cipales postulados del modelo de Bohr son: 1. Los electrones cargados negativamente se mueven en órbitas circula res alrededor del núcleo cargado positivamente. 2. Sólo ciertas órbitas o niveles energéticos están permitidos. 3. Un electrón que se mueve en una órbita alrededor del núcleo no irradia energía (De otra forma el electrón caería en espiral en el núcle o a medid a que gradualmente pie rde energía). 4. Cuando un ele ctrón es excitado a un nivel superio r u órbita, se absorben cantid ades de energía o cuantos específicos, los que se emiten cuando el electrón vuelve al nivel u órbita inferior. El modelo de Bohr - Sommerfeld. En 1916, el físico ale mán Arnold Sommerfeld modificó el modelo de Bohr en el sentido que las órbitas permitidas para los electrones debían ser elípticas más que circula res. El modelo de Bohr - Sommerfeld es un buen ejemplo de un tipo de evolu ción de las teorías científicas: un modelo antiguo es modificado para incorporar y explicar datos nuevos. El modelo mecánico cuántico. La teoría de Bohr - So mmerfeld fue una pieza maestra de simplicidad, belleza y elegancia , que explicó satisfactoria mente el espectro del hid rógeno. Sin embargo, tenía una contradicción fatal: funcionaba sólo con átomos de hidrógeno y iones que contenían sólo un electrón. El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. Sin duda, Bohr hizo una contribución, significativa para la comprensión de los átomos y su sugerencia que la energía de un electrón en un átomo está cuantizada permanece inalterada. Pero su teoría no proporciona una descrip ción completa del comportamiento electrónico en lo s átomos. Cuando los cie ntíficos se die ron cuenta de esto, empezaron a buscar una ecuació n fundamental que pudie ra describir el comportamiento y la energía de partículas submicroscópicas, en general, una ecuació n análoga a las le yes de movimiento de Newton para los objetos macroscópicos. En 1926 Erwin Schröedinger, utilizando una técnica matemática complicada, formuló la tan buscada ecuació n, La ecuación de Schrödin ger requiere cálculo s avanzados para ser resuelta, los que no se analizarán aquí. Sin embargo, es importante destacar que esta ecuació n in corpora ambos comportamientos, en términos de masa m, y ondulatorio, en términos de una función de onda Ψ (psi) que depende de la posició n del sistema en el espacio (como la de un electrón en un átomo). La funció n de onda en sí misma no tiene significado físico real directo. Sin embargo, el cuadrado de la función de la onda, Ψ2 , está relacionado con la probabilidad de encontrar al electrón en cierta regió n del espacio, y podemos graficar esa probabilidad. La ecuación de Schrödin ger inició una nueva era para la Física y la Química, porque abrió un nuevo campo, la mecánica cuántica (también lla mada mecánica ondula toria). El desarrollo de la teoría cuántica de 1913 − el tie mpo en que Bohr presentó su análisis del átomo de hid rógeno − a 1926 se refie re ahora como "la vie ja teoría cuántica". Un hecho sustantivo de este nuevo modelo atómico, es que ya no podemos seguir hablando acerca de la lo calización exacta de un electrón. En lu gar de la certeza asociada a la posición de un electrón sie mpre via jando en una órbita elíptica prescrita, como en un sistema solar en miniatura, sólo podemos habla r en términos de la probabilidad de encontrar al ele ctrón en un punto dado del espacio en un tiempo dado. Aunque el modelo mecánico cuántico es estrictamente matemático, podemos producir un modelo pseudo pictórico graficando los valo res de la probabilidad de lo calizar al electrón en varios puntos. El resultado para un átomo de hidrógeno parece una nube esférica difusa con el núcle o en su centro. Existe una muy baja probabilidad de encontrar el electrón en la vecindad del núcle o. A medida que nos alejamos. la probabilidad aumenta hasta un máximo, cerca de 1 A para luego caer a distancia s mayores. La regió n en la cual hay una gran probabilidad (generalmente 90 a 95 %) de encontrar un electrón dado, se llama un orbital. Fig. 6.4. Comparació n de los modelo s de Bohr-Sommerfeld y mecánico cuántico para el átomo de hidrógeno. Otra gran diferencia entre el modelo de Bohr - Sommerfeld y el mecánico cuántico es que la s órbitas sucesivas del electrón son elípticas en el primero, mientras que los gráficos de densid ad probabilística de los orbitales para átomos con El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. múltiples electrones tienen varias formas diferentes. Los cuatro tipos básicos de orbitale s se conocen como orbitales s, p, d, y f. Los orbitale s d y f tienen formas comple jas que van más allá del nivel de este curso introductorio , pero el orbital s (ig ual al del átomo de hidrógeno) es esférico y los orbitale s p consisten de dos lóbulos como se muestra en la figura 2.17. En la presencia de un campo magnético hay tres posible s orie ntaciones de los orbitales p, cada uno alineado a lo la rgo del eje mayor y conocid os como los orbitales p x, py y p z. 3.18 Formas de lo s gráficos de densid ad probabilística para electrones en orbitale s s y p, según lo predice el modelo mecánico cuántico. Así, aunque el modelo de Bohr Sommerfeld y el mecánico cuántico predicen diferentes posicio nes o localizacio nes probables de un electrón en un átomo, ambos muestran que el electrón puede existir sólo en ciertos niveles permitidos de energía. Aunque ambos modelos rinden nivele s de energía cuantizados, hay dos importantes diferencia s. Mientras que en el modelo de Bohr la id ea de la cuantización de la energía se asume como un postula do básico para desarrollar la teoría, en el modelo mecánico cuántico resulta naturalmente de resolver las ecuacio nes matemáticas del modelo. Números cuánticos. Las expresio nes matemáticas de la mecánica ondulatoria indican que el estado de energía de un electrón en un átomo se puede describ ir por medio de un set de cuatro números, llamados números cuánticos. Estos números describen el orbital espacia l en el que el electrón se mueve en términos de (1) su posición con respecto al núcle o, (2) su forma, (3) su orientación espacial y (4) la direcció n del spin (giro alrededor del propio eje) del electrón en el orbital. El número cuántico principal, simbolizado por n, indica la distancia promedio del ele ctrón desde el núcleo. Es una integral positiva, con valores 1, 2, 3, 4,...... y es la designación del nivel de energía prin cipal de un orbital. El primer nivel de energía es más cercano al núcle o y los otros se encuentran a distancias crecientes. Los electrones del primer nivel de energía tienen las energías más bajas, mientras que los de los niveles más altos tienen niveles de energía crecie ntes. En algunos textos, los nivele s de energía se designan por las letras K, L, M, N, etc. El número cuántico orbital, indica la forma del orbital en el que se mueve el electrón. El número de posib les formas es igual al valor del número cuántico prin cipal n. En el enésimo nivel de energía hay orbitale s de n formas posibles. En el primer nivel es posible un orbital de una sola forma, en el segundo son posib les de dos formas, en el tercero de tres, etc.. Como ya se indicó las designacio nes de lo s cuatro primeros números cuánticos orbitales es s, p, d, y f. Están escritos en orden de energía creciente. Así, para un nivel de energía particular, el orbital s tiene menor energía que el p, el p menor que el d y el d menor que el f. El número cuántico magnético in dica la orientación del orbital, cuya forma está dada por el número cuántico orbital, en relació n a los tres ejes del espacio , en un campo magnético. Hay sólo una orie ntació n para un orbital s, mientras que hay tres para el orbital p, cinco para el orbital d y siete para el f. El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. El número cuántico de spin indica la dirección de giro sobre su eje del electrón. El electrón gira sobre su eje como lo hace la tierra. Hay dos posibilidades de spin , en la direcció n de giro de lo s punteros del reloj o en contra. Así, cada uno de los orbitales orientados en el espacio, descritos por los tres primeros números cuánticos puede ser ocupado sólo por dos electrones, y éstos deben tener spin opuesto. Por lo tanto, en un átomo no pueden existir dos electrones con los mismos números cuánticos. Esto se correlacio na con la observació n que no existen dos ele ctrones con exactamente la misma energía en un átomo. Relació n de los números cuánticos en la estructura atómica. Nivel Energético Tipo de Orbital 1 s s p s p d s p d f 2 3 4 en adelante Nº de Orientaciones Magnéticas 1 1 3 1 3 5 1 3 5 7 Nº electrones en orbitales 2 2 6 2 6 10 2 6 10 14 Cuestionario. 1) Sintetice el modelo atómico de Dalton. 2) ¿Cómo explica el modelo de Dalton a) la ley de conservació n de la masa; b) la le y de la composición constante? 3) Critique la afirmació n que como existen partícula s subatómicas, el átomo no es la unid ad fundamental de la materia. 4) ¿Cuále s fueron los proble mas con el modelo de Bohr que llevaron al modelo de Bohr - Sommerfeld? ¿Cuále s fueron los problemas con el modelo de Bohr - Sommerfeld que resolvió el modelo mecánico cuántico? 5) Compare los modelos de Bohr - Sommerfeld y mecánico cuántico en términos de a) la localización del electrón y b) la energía potencia l del ele ctrón. 6) Expliq ue y resuma la evid encia que nos lleva a aceptar como razonable la idea que: a) Los átomos existen. b) Los átomos contienen un núcleo pequeño, con carga positiva y que contie ne la mayor parte de la masa del átomo. c) Los átomos contienen ele ctrones. d) Los ele ctrones en un átomo sólo pueden existir en ciertos nivele s permitidos de energía. 7) ¿Qué es cuantización? De algunos ejemplos comunes además de los ya in dicados en el texto. 8) Describa los cuatro números cuánticos usados para caracterizar un ele ctrón en un átomo. III. Actividad previa. Syllabus sesión 5 IV Metodología de la sesión. Clase expositiva, de debate y con ejercicios prácticos El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento. V. Lectura post-sesión. Por definir El usuario solo podrá utilizar la información entregada para su uso personal y no comercial y, en consecuencia, le queda prohibido ceder, comercializar y/o utilizar la información para fines NO académicos. La Universidad conservará en el más amplio sentido la propiedad de la información contenida. Cualquier reproducción de parte o totalidad de la información, por cualquier medio, existirá la obligación de citar que su fuente es "Universidad Santo Tomás" con indicación La Universidad se reserva el derecho a cambiar estos términos y condiciones de la información en cualquier momento.