Química Propedéutico para Bachillerato OBJETIVO
Anuncio

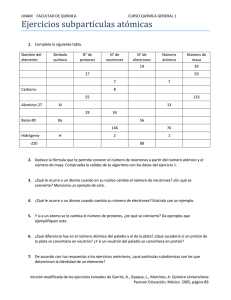
Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato Química Propedéutico para Bachillerato Actividad 1 Estructura Atómica OBJETIVO Describir y revisar la estructura del átomo, así como los conceptos de número atómico, masa atómica e isótopo. 2 D.R. © Universidad TecMilenio 1 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato INTRODUCCIÓN En esta primera actividad estudiaremos las aportaciones de los científicos que revelaron importante información acerca de los átomos, lo cual llevó al descubrimiento de las subpartículas atómicas que son los protones, los neutrones y los electrones. Los protones y neutrones se encuentran en el núcleo, mientras que los electrones están girando en las órbitas. Existen varias características que nos permiten distinguirlos, entre ellas podríamos mencionar las cargas eléctricas que presentan, así como el tamaño. Por otro lado, se realizará una breve revisión de estos conceptos, así como también de las definiciones de número atómico (el cual se refiere al número de protones que tiene el átomo) y la masa atómica (la cual representa la suma de protones y neutrones). 4 D.R. © Universidad TecMilenio 2 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato EL ÁTOMO Las primeras ideas de la materia se remontan a los griegos. La duda era si un pedazo de materia podría subdividirse infinitamente, o llegaría un momento en que un pedazo sería ya indivisible. Demócrito (siglo V a.C.), se inclinó por la segunda propuesta y para describir la partícula más pequeña de la materia, usó la palabra “átomo”, que significa que no puede ser dividido. Obviamente, Demócrito localizó un átomo, sin embargo planteó el concepto que por muchos años fue también investigado por otros científicos en épocas posteriores. MODELOS ATÓMICOS Modelo de Dalton Propuso su modelo atómico como una esfera compacta, sin hacer distinción de subpartículas. D.R. © Universidad TecMilenio 3 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato Modelo de Thomson J.J.Thompson fabricó un tubo de rayos catódicos que le permitió el descubrimiento de unas partículas de carga negativa a las cuales se les llamó electrones; como resultado de ello propuso su modelo atómico y lo diseñó agregando a una esfera partículas, es decir, pequeños puntos que representaban a los electrones. A este modelo se le llamo Budín con pasas. 7 Modelo de Rutherford En el modelo atómico propuesto por Rutherford se señala la existencia de un núcleo central cargado positivamente, con electrones girando alrededor de él. Modelo de Bhor Bhor propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos. 8 D.R. © Universidad TecMilenio 4 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato El ÁTOMO El átomo es la partícula más pequeña de la cual se forma la materia. La estructura del átomo está formada por dos partes fundamentales: el núcleo y los orbitales. EL ÁTOMO En el núcleo podemos encontrar dos subpartículas que son los neutrones (con carga neutra) y los protones (con carga positiva). En los orbitales se encuentran los electrones (carga negativa), que giran alrededor del núcleo. D.R. © Universidad TecMilenio 5 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato Números atómicos El número atómico es el número de protones que hay en el núcleo de un átomo. Ejemplos de Números atómicos Masa atómica La masa atómica, conocida también como peso atómico, se puede definir como la suma de protones y neutrones que se encuentra en el núcleo del átomo. D.R. © Universidad TecMilenio 6 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato En el ejemplo que elemento Cloro, su masa atómica corresponde a 35.45; esto quiere decir que la suma de protones y neutrones de su núcleo es esa cantidad. Hay que señalar que en un átomo neutro, la cantidad de electrones es igual a la de protones, es decir, si su numero atómico es 11, tiene 11 electrones y 11 protones. En cuanto a la cantidad de neutrones ésta se puede obtener al restarle al numero másico el numero atómico. Por ejemplo: Na número atómico 11 y número másico 23 Con estos datos podemos identificar que tiene 11 electrones,11 protones y 12 neutrones (23-11 = 12) D.R. © Universidad TecMilenio 7 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato ISÓTOPOS Los Isótopos son átomos de un mismo elemento con diferente cantidad de neutrones. Hay que recordar que en los elementos los átomos son exactamente iguales, pero se pueden presentar algunas excepciones. Un ejemplo de un elemento que presenta isótopos es el Hidrógeno; el más abundante de ellos es el que no tiene ningún neutrón. También hay un isótopo del hidrógeno llamado DEUTERIO, con un neutrón existente en una mínima cantidad y otro que es sumamente escaso es el TRITIO, con dos neutrones. Hidrógeno D.R. © Universidad TecMilenio Deuterio Tritio 8 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato EJERCICIO PRESENCIAL Contesta las siguientes preguntas: 1.-¿Cuáles son las dos partes que forman la estructura de un átomo? 2.- ¿Qué tipo de carga tienen los protones, neutrones y electrones? 3.- Explica qué es un Isótopo. 4.- Utilizando la tabla periódica, completa la siguiente tabla: Elemento Símbolo Numero atómico Masa atómica Número neutrones Número protones Número electrones Antimonio I Bario 25 12 32 D.R. © Universidad TecMilenio 17 9 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato 5.-Relaciona las siguientes preguntas a.- La carga del núcleo es: ( ) Neutro b.- Es la suma de protones y electrones que se localizan en el núcleo ( ) Positiva c.- Átomos con el mismo número de protones pero diferente numero de neutrones ( ) Negativa d.- Número de protones en el núcleo de un átomo atómico ( ) Número e.- Un átomo tiene la misma cantidad de protones masa y electrones por lo tanto es eléctricamente ( ) Número de ( ) Isótopos f.- La carga del electrón es 6.- Describe con tus palabras, la distribución de las partículas atómicas dentro del átomo. Entrega el desarrollo de tu actividad en forma de reporte. 19 CIERRE En esta actividad viste que el átomo es la partícula más pequeña de toda la materia, y que a su vez está formada por subpartículas que son los protones, neutrones y los electrones; que la cantidad de protones se llama número atómico, y que a la suma de protones y neutrones también se le conoce con el nombre de peso o masa atómica. También aprendiste que el término isótopo es utilizado para los elementos en los cuales existe una diferencia en el número de neutrones que se encuentran en sus átomos. Asimismo, es importante que conozcas que los isótopos tienen aplicación en el mundo de la medicina, como es el diagnóstico y tratamiento de enfermedades como el cáncer. D.R. © Universidad TecMilenio 10 Universidad Tec Milenio: Profesional Química Propedéutico para Bachillerato BIBLIOGRAFÍA Burns, Ralph A. Fundamentos de química. 4a ed. México: Pearson Educación de México. 2003. ISBN: 970-26-0281-5. Créditos Diseño de contenido: Q.F.B Karina W. Vázquez Cisneros, MA Coordinador académico del área: Lic. José de Jesús Romero Álvarez, MC y MED Edición de contenido: Lic. Yolanda Domínguez Medina, MTE Edición de texto: Lic. Jimena Morales Andrade D.R. © Universidad TecMilenio 11