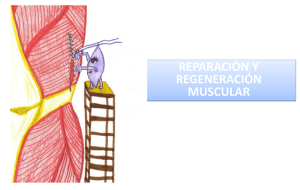
Modelo dermoepidermico autologo
Anuncio

Servicios de Cirugía Plástica, Unidad de criobiología banco de tejidos, laboratorio de investigación y de cirugía experimental , servicio de anatomía patológica del C.H.U. A Coruña OBTENCION DE UN MODELO DERMOEPIDERMICO AUTOLOGO ARTIFICIAL Memoria presentada por Don Eduardo Núñez Orduña, licenciado en medicina por la Universidad de Valladolid, para optar al título de máster de medicina cosmética y del envejecimiento . 1 ABREVIATURAS 3T3: línea alimentadora. Células de ratón albino suizo, European Collection of Animal Cell Culture 85022108. D-MEM: Dulbecco’s modified minimal essential Medium. DMSO: dimetil sulfóxido. EDTA: ácido etilendiaminotetracético. EGF: epidermal growth factor. GAG: glicosaminoglicanos. HAM-F 12: medio de cultivo. HE: hematoxilina-eosina. QC: medio de cultivo de queratinocitos, con EGF. QN: medio de cultivo de queratinocitos, sin EGF. SBF: suero bovino fetal. T/E: tripsina/EDTA (ethylene diaminetetraacetic acid ). tPA: activador tisular de plasminógeno. 2 1. INTRODUCCIÓN ………………………………………………………. 4 1.1. Estructura de la piel ………………………………………………………………….. 7 1.2. Estado actual de la reparación cutánea …………………………………………. 10 1.3. Cultivo de células cutáneas como cobertura definitiva ……………………… 12 1.3.1. Desarrollo histórico del cultivo de células cutáneas …………… 12 1.3.2. Cultivo clásico de queratinocitos …………………………………… 14 1.4. Necesidad de un componente dérmico ………………………………………….. 16 2. JUSTIFICACIÓN, HIPÓTESIS Y OBJETIVOS ………………………… 19 3. MATERIAL Y MÉTODOS ……………………………………………………………. 20 3.1. Obtención y cultivo primario de células ………………………………… 20 3.1.1. Obtención de células a partir de biopsias de piel ……….. 20 3.1.2. Cultivo primario y congelación de queratinocitos ………………… 21 3.1.3. Cultivo primario y congelación de fibroblastos ……………………. 22 3.2. Preparación de piel artificial basada en plasma humano …………………….. 23 3.2.1. Obtención de plasma humano ……………………………………….. 23 3.2.2. Medición de fibrinógeno ……………………………………………….. 24 3.2.3. Preparación de la dermis artificial basada en plasma humano.....................................………………………………. 24 3.2.4. Cultivo secundario de queratinocitos sobre la dermis artificial ……………………………………………………………… 25 3.3. Trasplante de la piel artificial …………………………………………………… 26 3.3.1. Preparación de la piel para trasplante …………………………. 26 3.3.2. Trasplante experimental ………………………………………….. 27 3.4. Estudio histológico ……………………………………………………………… 4. RESULTADOS..................................................................................... .......... 29 31 4.1. Cultivos primarios ...................................................................……… 31 4.2. Piel artificial basada en plasma humano ………………………. 33 4.2.1. Dermis basada en plasma humano ………………… 33 4.3. Trasplante experimental ................... ………………………….. 35 4.4. Estudios histológicos ................................................................. 35 5. DISCUSIÓN 4.4.1. Histología preinjerto...................................................... 35 4.4.2. Histología tras el trasplante experimental ............................. 37 ..................................................................................... .......... 42 5.1. Desarrollo del prototipo de piel ............................................................... 6.CONCLUSIONES 7. REFERENCIAS ..................................................................................... .......... ..................................................................................... .......... 3 42 52 53 1. INTRODUCCION Desde hace muchos años uno de los principales retos de la medicina ha sido el hecho de poder restaurar o mejorar la función de órganos y tejidos dañados. La cirugía de trasplantes a partir de órganos y tejidos extraídos de donantes es parte de esta medicina reparadora. Otra importante , se basa en la posibilidad de “fabricar” nuevos órganos y tejidos a partir de los restos sanos del tejido dañado. Ingeniería Tisular es la denominación actual de la tecnología que nos acerca a ese objetivo, ya que nos permite, a partir de un pequeño fragmento de tejido, recuperar la funcionalidad global del tejido u órgano dañado. La ingeniería tisular es la tecnología de la futura medicina reparadora. Conviene reseñar que la posibilidad actual de la ingeniería tisular es la recuperación de la función perdida, ya que la formación de órganos y tejidos similares a los naturales (por ejemplo piel con estructuras glandulares), todavía está dentro de la ciencia ficción. En el diseño de un tejido mediante Ingeniería Tisular se tienen que revisar dos puntos críticos: 1.- Las células que componen este tejido. 2.- La matriz extracelular que envuelve al componente celular. Las células son el elemento fundamental de un tejido, son la parte viva del mismo y se encargan de todas las funciones biológicas. Para desarrollar un tejido mediante técnicas de ingeniería tisular hay que obtener un número suficiente de células en las mejores condiciones posibles. Dado que normalmente se parte de pequeños fragmentos de tejido, el número inicial de células es muy pequeño por lo que resulta necesario un período de expansión celular. Esto se logra mediante las técnicas de cultivo celular. Hay que tener presente, que estas técnicas de expansión celular podrían conllevar una desdiferenciación de las células cultivadas, corriendo el riesgo de no ser funcionales ni ser fenotípicamente iguales a las extraídas del tejido. Para evitar este tipo de problemas es necesario el conocimiento de la biología celular y de los factores de crecimiento y diferenciación de la estirpe celular que nos ocupe. 4 Se pueden obtener células a partir de un fragmento de tejido adulto, para así desarrollar un tejido semejante. Es el caso de los cultivos de queratinocitos y condrocitos, los cuales se obtienen a partir de la piel y cartílago respectivamente. Otra opción consiste en desarrollar cualquier tipo de tejido partir de células embrionarias pluripotenciales. Una fuente de células que ofrece nuevas alternativas a la ingeniería tisular, son las células madre multipotentes presentes en algunos tejidos adultos, las cuales podrían diferenciarse hacia varias estirpes celulares. Es el caso de las células de médula ósea o la grasa subcutánea , ya que a partir de ellas podemos aislar células con capacidad para diferenciarse a hepatocitos , células del sistema nervioso , osteocitos, condorcitos, adipocitos , células musculares , etc. La presencia de células multipotenciales en tejidos adultos, abre un número de posibilidades ilimitado en el campo de la reparación tisular. El segundo punto crítico en el diseño de una estrategia de ingeniería tisular es la matriz extracelular. Ésta es una estructura que hay que facilitar a las células para que adopten una disposición tridimensional. Las células han de ser capaces de crecer en esta matriz y desarrollar sus funciones fisiológicas, han de degradar la matriz aportada y sintetizar las proteínas que conformen una matriz extracelular similar a la del tejido natural. Esto se logra normalmente una vez que el tejido sintetizado in vitro es trasplantado, ya que en la degradación de la matriz intervienen no sólo las células cultivadas e introducidas en ella, sino que también lo hace el sistema inmunitario del receptor. Existen otros puntos a tener en cuenta en el desarrollo de una estrategia de ingeniería tisular como son: La condiciones de cultivo a las que se someten los tejidos ingenierizados durante el período de crecimiento ex vivo. Una vez que las células expandidas in vitro son integradas en la matriz extracelular aportada, el conjunto requiere de un período de maduración. Esto se logra en condiciones que imitan las 5 fisiológicas (37º C, tensión de CO2, humedad, factores de crecimiento y diferenciación, etc.). La manejabilidad quirúrgica del prototipo diseñado. Para desarrollar un tejido mediante ingeniería tisular no basta sólo con “fabricar” un modelo que imite lo más posible al tejido natural, sino que hay que considerar aspectos tales como su transporte al quirófano y la facilidad en el manejo del prototipo. De nada sirve un tejido sintetizado mediante técnicas de ingeniería tisular, si éste no puede ser manejado convenientemente en quirófano para su trasplante, o pierde viabilidad durante la manipulación y transporte. La complejidad de estos procesos hace que la Ingeniería Tisular sea un campo multidisciplinar donde biólogos, químicos, cirujanos, etc., intervengan para hacer posible el desarrollo de nuevos prototipos de tejidos. La piel ha sido el primer órgano en ser producido mediante técnicas de ingeniería tisular. La posibilidad de fabricar in vitro grandes cantidades de piel a partir de una pequeña muestra del paciente, ha revolucionado parcialmente las expectativas terapéuticas. En este trabajo se describe una aproximación a la ingeniería tisular de la piel. En él se revisan los puntos críticos previamente descritos: La obtención de células a partir de pequeñas biopsias de piel. La expansión de los dos tipos de celulares predominantes en la piel (fibroblastos y queratinocitos). Los resultados obtenidos mediante el cultivo de células de epitelio humano, sobre una matriz dérmica basada en plasma y fibroblastos humanos. El resultado del trasplante experimental de este modelo. 6 1.1 ESTRUCTURA DE LA PIEL Anatómicamente la piel se divide en tres grandes capas: la epidermis, la dermis y la hipodermis o tejido celular subcutáneo (Fig. 1). Fig. 1. Representación cutánea esquemática. LA EPIDERMIS. La epidermis (Fig. 1-1) es un epitelio plano, estratificado y queratinizado. Los queratinocitos sufren una permanente evolución morfológica desde la profundidad hacia la superficie y permite distinguir cuatro estratos superpuestos: Estrato basal o germinativo. Los queratinocitos de este estrato reposan sobre la lámina basal que separa la epidermis de la dermis, a ella se unen mediante hemidesmosomas. 7 La lámina basal es una lámina de matriz extracelular fina, aunque resistente. Esta lámina está unida al tejido conectivo subyacente mediante fibras especializadas de anclaje, formadas por colágeno tipo VII. La lámina basal es sintetizada por las células a las cuales está asociada, y está constituida en gran parte por un tipo de colágeno especializado (colágeno tipo IV), proteoglicanos ricos en heparansulfato y por laminina, la cual proporciona sitios de unión a las moléculas integrinas de la membrana plasmática de las células basales epiteliales. La membrana basal no sólo desempeña funciones estructurales, sino que también determina la polaridad de las células, influencia el metabolismo celular, organiza las proteínas de membrana de las células adyacente, induce la diferenciación celular y sirve como sustrato para la migración de las células. Estrato espinoso. Los queratinocitos de este estrato se disponen en varias filas, adoptan forma poliédrica, ligeramente aplanada y paralela a la superficie. Existen prolongaciones celulares cortas que, mediante desmosomas , se adhieren a las prolongaciones de los queratinocitos vecinos, lo que hace que al microscopio óptico parezcan puentes intercelulares. Estrato granuloso. Este estrato está constituido por 3-5 capas de queratinocitos aplanados con el eje longitudinal paralelo a la superficie de la piel. En el citoplasma aparecen abundantes gránulos de queratohialina. Estrato córneo. Está formado por un número variable de capas de células totalmente queratinizadas o células córneas. Estas células están totalmente aplanadas, su membrana plasmática se vuelve muy densa con modificaciones de los desmosomas. El núcleo y los orgánulos citoplasmáticos desaparecen completamente, estando el citoplasma ocupado solamente por los haces de fibras de queratina. LA DERMIS. La dermis es una capa de tejido conjuntivo de espesor variable según las regiones de la piel. Está separada de la epidermis por la lámina basal. La unión dermoepidérmica habitualmente es muy contorneada, dibujando las crestas epidérmicas y las papilas dérmicas. 8 En la dermis se distinguen dos capas: la capa papilar, más superficial y formada por tejido conjuntivo laxo; y la capa reticular, formada por tejido conjuntivo denso con abundantes fibras elásticas. Las células que se encuentran con mayor frecuencia en la dermis son fibroblastos y macrófagos. Además existen abundantes vasos sanguíneos y linfáticos (Fig. 1-5). En la dermis también abundan nervios y terminaciones nerviosas (Fig. 1-6). En esta capa se encuentran células musculares (Fig. 1-9) lisas (areolas, escroto, pene , perineo) y células musculares estriadas (en particular en la cara). Existen diversos anejos cutáneos derivados de la epidermis y que penetran en la dermis, tales como folículos pilosos (Fig. 1-4), glándulas sebáceas (Fig. 1-7) y glándulas sudoríparas (Fig. 1-3). Estas estructuras epiteliales situadas en la profundidad de la dermis, tienen gran importancia en el proceso de reparación de las heridas. LA HIPODERMIS O TEJIDO CELULAR SUBCUTÁNEO (Fig. 1-8). Esta capa está formada por tejido conjuntivo laxo que, según las condiciones de nutrición y las regiones de la piel, contiene más o menos tejido adiposo. Finalmente, es importante reseñar como peculiaridad de la piel, que sólo el componente epidérmico genera rechazo inmunológico. El componente dérmico de la piel es una estructura poco celular y en general bien tolerada. 9 1.2. ESTADO ACTUAL DE LA REPARACIÓN CUTÁNEA Actualmente la piel se considera un órgano muy importante debido a sus múltiples funciones vitales (la tabla 1.1 resume estas funciones). Un fallo masivo en este órgano es incompatible con la vida y por ello, cualquier tipo de lesión debe ser tratada con rapidez. La reparación de las lesiones cutáneas es una parte importante de la terapéutica médico-quirúrgica. En su restauración no sólo se busca el restablecimiento general de sus funciones, sino que además se pretende recuperar sus características estéticas . Ante una agresión externa, la piel responde con la puesta en marcha de los mecanismos de reparación que tienden a cerrar la herida producida. Este es un proceso dinámico en el que intervienen células sanguíneas, mediadores solubles, matriz extracelular y células del tejido conectivo . Este proceso no produce una reparación completa, ya que el tejido formado es levemente distinto al original y el resultado es la producción de una cicatriz. Tabla 1.1. Funciones de la piel. Contra las fuerzas mecánicas (fricción, estiramiento…) Contra factores químicos (cáusticos, humedad, sequedad…) Contra la radiación (rayos ultravioleta) Contra los cambios de temperatura (el cuerpo humano debe PROTECTORA mantener una temperatura constante) Contra los microorganismo (es una barrera física y “un campo de batalla” inmunológico) METABÓLICA NERVIOSA Manifiesta signos y síntomas de enfermedades sistémicas Lugar de síntesis de Vitamina D Lugar de depósito de grasa (combustible de reserva) Vía de eliminación de desechos y fármacos Contribuye al equilibrio hidroelectrolítico Secuestra tóxicos, reduciendo su concentración en sangre Asiento de receptores nerviosos (tacto, temperatura, presión, dolor, etc.) PSICOLÓGICA Expresión de emociones Contacto afectivo Autoimagen Cosmética 10 La reparación cutánea es llevada a cabo de diferentes formas: si la herida es pequeña puede cicatrizar con facilidad desde las células del borde de la misma. Cuando la herida es más amplia su reparación se lleva a cabo desde las células epiteliales contenidas en los anejos cutáneos. Si la herida es amplia y profunda afectando a la totalidad de la dermis, por ejemplo en quemaduras profundas o grandes extirpaciones, no podrá ser reparada espontáneamente , esto es debido a que no existen células ejecutoras de la respuesta reparadora... queratinocitos y fibroblastos. Estas células son totalmente eliminadas en las lesiones o extirpaciones quirúrgicas profundas. Si bien los fibroblastos pueden ser reclutados y llegar al lecho de la herida , esta propiedad no está descrita para los queratinocitos. Por tanto es imprescindible aportar estas células a la herida, ya que el cierre definitivo, es decir el restablecimiento de la función barrera frente al medio externo, sólo se realiza cuando una capa de células epiteliales autólogas se desarrolla sobre esa herida. El epitelio autólogo se trasplanta sobre el lecho de la herida para proporcionar la cobertura definitiva de la misma. Ésta es la técnica clásica de autoinjertos, donde se toma piel de una zona sana y de forma directa o tras un sistema de mallado que permite aumentar su superficie, se coloca en las zonas lesionadas. Existen casos en los que la extensión del área cruenta es tan importante que no existe suficiente epitelio autólogo para su cobertura. Es el caso de los grandes quemados. Este problema hizo que desde hace mucho tiempo se investigase en técnicas que permitan conseguir grandes proporciones de epitelio autólogo partiendo de una pequeña porción de piel sana. Esto se consiguió llevar a cabo tras la descripción del cultivo in vitro de queratinocitos, desarrollado por Rheinwald y Green en 1975. 11 1.3.Cultivo de células cutáneas como cobertura definitiva 1.3.1. Desarrollo histórico del cultivo de células cutáneas Históricamente el desarrollo de los cultivos celulares de la piel siguió diversos caminos. Uno de los descubrimientos más importantes fue el de Ljunggren, en 1998 , el cual vio que pequeños fragmentos de piel o explantes, podían mantenerse viables durante un prolongado período de tiempo en líquido ascítico y podían ser retrasplantados con éxito a los donantes. El medio utilizado en estos primeros experimentos consistía simplemente en soluciones salinas con o sin glucosa, enriquecidas con fluidos biológicos como suero o líquido ascítico, los cuales parecían ser necesarios para el mantenimiento de la viabilidad de los fragmentos. Medawar fue el primero en cultivar con éxito células epiteliales . A partir de pequeños explantes de epitelio colocados sobre un lecho dérmico, los queratinocitos podían migrar sobre la dermis de alrededor y cubrir zonas inicialmente carentes de epitelio. De esta manera el lecho dérmico utilizado estaba a los pocos días cubierto de epitelio. Además, fue capaz de demostrar que los queratinocitos cultivados según esta técnica, podían ser retrasplantados al donante original con éxito. Los cultivos de explantes sirvieron para demostrar que el crecimiento epitelial a partir de fragmentos de piel, depende en gran medida de la migración de los queratinocitos, que estas células tienden a formar membranas consistentes o cadenas de células y que el crecimiento epidérmico se ve influido positivamente por la presencia de un sustrato dérmico. Estos experimentos también demostraron que el crecimiento epitelial está solamente mediado por las células del estrato basal, mientras que esta capacidad desaparece en las capas más diferenciadas del epitelio. Desgraciadamente, la técnica de cultivo de explantes no era capaz de proporcionar la superficie de epitelio necesaria para atender las necesidades de grandes áreas cruentas. Las técnicas de explantes no permitían el establecimiento de subcultivos (a partir de las partes epitelizadas por migración de queratinocitos repetir el experimento para reepitelizar zonas mucho más extensas). Además, el sobrecrecimiento de los fibroblastos respecto a los queratinocitos limitaba el período de cultivo , por lo 12 que la utilidad terapéutica de estos cultivos era muy baja y su uso se vio limitado a la investigación dermatológica . En 1952, Billingham y Reynolds fueron capaces de demostrar que los queratinocitos aislados con tripsina mantenían su viabilidad y podían ser utilizados para cultivo celular. La diferenciación de los queratinocitos, la cual puede verse por la poliestratificación de los mismos y mediante la aparición de marcadores de diferenciación epidérmica, hace que sea imposible multiplicar la población celular mediante sucesivos pases . Bajo la asunción de que la matriz dérmica es la responsable del prendimiento permanente de la lámina epitelial, el siguiente paso que se dio fue utilizar piel de cerdo como soporte para obtener epidermis trasplantable (Freeman AE et al, 1976). Aunque esta técnica no ha sido muy utilizada, debe ser considerada como la base de los recientes avances en el campo del desarrollo de dermis artificiales . Una mejora en el cultivo de queratinocitos aislados mediante tripsina se llevó a cabo cuando pudieron cultivar estas células sobre geles de colágeno (Karasek MA, 1983). Este hecho aumentó considerablemente el pool de queratinocitos con capacidad proliferativa, los cuales fueron entonces capaces de alcanzar la confluencia y pudieron ser subcultivados entre dos y tres veces . Estos resultados fueron entonces modestos, pero dieron lugar a la asunción de que son necesarios determinados elementos dérmicos para el desarrollo de los cultivos epiteliales. Un hecho importante en el desarrollo de las técnicas de cultivo de células epiteliales fue el descubrimiento de los diversos factores que influyen en el crecimiento epitelial, en especial el del Factor de Crecimiento Epidérmico (EGF) . Finalmente, la búsqueda de un soporte adecuado para el crecimiento de los queratinocitos, tras probar varios sustratos posibles, dio como resultado la utilización de fibroblastos de ratón letalmente irradiados, también conocidos como células 3T3, las cuales demostraron ser beneficiosas para el crecimiento de los queratinocitos, mientras que al mismo tiempo inhibían el crecimiento de los fibroblastos. La técnica publicada en 1975 por Rheinwald y Green permitía 13 el cultivo y subcultivo con éxito de queratinocitos, sobre una capa alimentadora de fibroblastos de ratón letalmente irradiados . El trabajo pionero de Rheinwald y Green abrió el camino a un posible uso clínico. Gracias a esto se hizo posible multiplicar queratinocitos hasta un número clínicamente relevante y utilizarlos con fines terapéuticos. Debido a la importancia de esta técnica y al hecho de ser utilizada aún en casi todos los laboratorios de cultivo de queratinocitos, la describiremos a continuación. La posibilidad de multiplicar rápidamente un gran número de células epiteliales bajo condiciones de cultivo controladas, con intervalos de multiplicación menores de 24 horas, ofrece la oportunidad de sintetizar la epidermis equivalente a toda la superficie corporal en un período de tiempo comprendido entre tres y cuatro semanas a partir de una pequeña biopsia de piel completa. 1.3.2. CULTIVO CLÁSICO DE QUERATINOCITOS La técnica descrita por Rheinwald y Green en 1975 (figura 2) consta de las siguientes fases: Se parte de una biopsia de piel que contenga epidermis, dermis y tejido celular subcutáneo, de dimensiones variables (entre 1 y 8 cm2). La biopsia se recoge en condiciones de esterilidad, se introduce en medio de cultivo a 4ºC y se envía rápidamente al laboratorio. Una vez recibida la muestra, se elimina el tejido celular subcutáneo y se fragmenta la biopsia con ayuda de unas tijeras. Los fragmentos resultantes se digieren enzimáticamente con tripsina/EDTA (T/E). Las células aisladas mediante T/E se cultivan junto a 3T3 (fibroblastos de ratón) irradiados a 6000 Rads. Entre el 1% y el 3% de los queratinocitos formarán pequeñas colonias y por crecimiento excéntrico llenarán poco a poco la superficie del frasco de cultivo desplazando a los 3T3. Aproximadamente a los 9 días del inicio del cultivo primario, los queratinocitos son tratados con T/E (es un enzima proteolítico que rompe las 14 uniones proteicas que existen entre las células y la superficie del frasco, individualizándolos). Los queratinocitos obtenidos son sembrados de nuevo en presencia de nuevas células 3T3. De este modo, a partir de un solo frasco de cultivo primario se pueden sembrar entre 20 y 30 frascos de cultivo secundario, que alcanzarán la confluencia en 10-11 días. Por tanto, después de 21-24 días del inicio del cultivo, se puede obtener una gran superficie de piel cultivada partiendo de una pequeña biopsia. Se pueden llegar a conseguir hasta 10.000 cm2 partiendo de 1 cm2 en un plazo de 3-4 semanas . Cuando el cultivo secundario es confluente se despega del fondo del frasco, empleando para ello dispasa II (enzima proteolítico que rompe las uniones entre las células y el soporte plástico, sin romper las uniones intercelulares). Para transportar la lámina de queratinocitos hay que fijarla a un soporte sólido (generalmente una gasa). Fig. 2. Esquema del cultivo clásico de queratinocitos. 15 1.4.LA NECESIDAD DE UN COMPONENTE DÉRMICO La contrastada experiencia en la utilización clínica de las láminas de queratinocitos humanos, ha puesto de manifiesto sus principales limitaciones. La primera de ellas es que la lámina de tejido que se obtiene es demasiado fina y frágil, lo que dificulta su manejo y da lugar a pérdidas de superficie tanto en la preparación de la lámina para el trasplante, como en el transporte a quirófano e implante de la misma (inicialmente se pierde entre un 20-25% de la superficie sembrada al fijar la lámina sobre un soporte sólido). La adhesión de los queratinocitos al frasco de cultivo, hace que sea necesario un proceso de digestión enzimática para su separación, lo que dificulta la creación de una membrana basal adecuada una vez injertado el tejido. Los queratinocitos trasplantados al lecho de la herida deben ser capaces de generar una nueva membrana basal, semejante a la unión dermoepidérmica normal y así, cubrir permanentemente esta superficie . Para que los queratinocitos lleguen a prender, es imprescindible que se genere una fuerte unión dermoepidérmica. Esta es una estructura compleja en cuya génesis influyen tanto los queratinocitos trasplantados como los fibroblastos de la dermis . La síntesis de las proteínas de la membrana basal (laminina y colágeno IV) corresponde a los queratinocitos , pero el otro componente de la membrana basal, las fibrillas de anclaje (colágeno tipo VII), no se sintetizan en ausencia de los fibroblastos de la dermis. Las relaciones entre las células epiteliales y su soporte conjuntivo son esenciales para alcanzar el desarrollo normal del tejido. Por tanto, la falta de estructura dérmica parece ser una de las grandes limitaciones. El resultado final es la pérdida tardía de regiones epitelizadas mediante este tipo de cultivos y la formación de lesiones ampollosas de muy difícil corrección . La fragilidad de las láminas las hace muy sensibles a los pequeños traumatismos que inevitablemente sufre un paciente quemado . El estrés mecánico tiene que ser evitado en las zonas injertadas. Aunque no hay ninguna parte del cuerpo predominante que haya sido injertada con estos cultivos de epitelio con éxito, estas láminas no son adecuadas para superficies 16 posteriores, cara, manos o articulaciones, ya que son zonas que soportan mucho estrés mecánico. Las láminas de queratinocitos cultivados son muy susceptibles tanto a la infección de los lechos, como al uso de antisépticos tópicos . La infección de la herida es la principal causa de fallo de los injertos. En los primeros días tras el trasplante, el frágil epitelio no queratinizado y la débil unión dermoepidérmica de estas láminas cultivadas, hacen que sean mucho más susceptibles de sufrir contaminación bacteriana que los autoinjertos convencionales. Otro de los inconvenientes son los pobres resultados clínicos que se obtienen tras su trasplante . Incluso diversos estudios manifiestan la incapacidad de las láminas de queratinocitos cultivados para reducir, no sólo la mortalidad de los pacientes tratados, sino también la estancia hospitalaria de los mismos (Munster AM et, al 1990; Rue LW et al, 1993). Para evitar la fragilidad de las láminas, la ausencia de componente dérmico (2,5) y mejorar los primeros resultados obtenidos mediante el cultivo de queratinocitos, se han seguido tres vías diferentes (2,3): 1.- Continuar con el empleo del cultivo de queratinocitos, asociado al trasplante previo de un componente dérmico, por ejemplo aloinjertos de cadáver o imitadores dérmicos(6,7,8) . 2.- Cultivar los queratinocitos sobre un soporte. 3.- Cultivar los queratinocitos sobre una dermis artificial o equivalente dérmico. 1).- Respecto al primer punto, la asociación sistemática de aloinjertos de cadáver (Cuono C et al, 1986; Hickerson WL et al, 1994) o imitadores dérmicos (Hansbrough FJ et al, 1998; Hansen SL et al, 2001), con cultivo de queratinocitos, mejoró el índice de prendimiento y redujo las complicaciones a largo plazo de los cultivos. Aunque los problemas inherentes a la técnica de cultivo siguieron persistiendo (pérdida de superficie durante la preparación de las láminas, daño causado por la dispasa a las proteínas de la membrana basal, etc.). 17 Los otros dos puntos fueron objeto de posteriores desarrollos y aún hoy en día siguen apareciendo nuevos modelos tanto de soportes de cultivo como de dermis artificiales. 2).- La segunda vía que se utiliza, soportes sobre los que cultivar los queratinocitos consiste en asociar el cultivo de la lámina de queratinocitos a una base que le confiera solidez y facilite el transporte y el trasplante. Algunos de los soportes empleados son: Colágeno (Horiguchi Y et al, 1994) Colágeno asociado a glicosaminoglicanos (GAG) (Yanas IV et al, 1982; Boyce ST et al, 1988-A; Boyce ST et al, 1988-B; Buttler CE et al, 1999). Integra® (Kremer M et al, 2000). Dermis acelular humana (Lam PK et al, 2000; Herson MR et al, 2001) o su versión comercial: Alloderm® (Izumi K et al, 1999). Dermis acelular de cerdo (Matouskova E et al, 1997). Gel de fibrina (Ronfard V et al, 1991; Pellegrini G et al, 1999). Membranas derivadas del ácido hialurónico, como Laserkin® (FIDIS advanced Biopolymer, Italy) (Lobmann R et al, 2003). 3).- La tercera vía utilizada para solventar los problemas de cultivo clásico de queratinocitos (cultivo de queratinocitos sobre una dermis artificial o equivalente dérmico) consiste en obtener como producto final una estructura que contiene los dos componentes de la piel (dermis y epidermis) (1), por lo que se le puede denominar PIEL ARTIFICIAL COMPLETA. Se trata de cultivar conjuntamente la lámina de queratinocitos sobre una superficie que imite y funcione como una auténtica dermis humana. Entre los diversos modelos descritos se encuentran: Gel de colágeno + fibroblastos humanos (Otto WR et al, 1995). Gel de colágeno y GAG + fibroblastos humanos (Cooper ML et al, 1993). Dermagraft® (Rennekampff HO et al, 1996). Gel de fibrina + fibroblastos humanos (Meana A et al, 1998; Camblor L et al, 2003; Camblor LA et al, 2003; Llames S et al, 2004). 18 2. JUSTIFICACIÓN, HIPÓTESIS Y OBJETIVOS El desarrollo de un programa de Ingeniería Tisular está justificado, ya que puede proporcionar alternativas terapéuticas que reduzcan la morbilidad de un gran número de pacientes. Partimos de una experiencia y de un modelo previamente desarrollado que ha demostrado grandes ventajas sobre otros modelos de piel artificial previamente descritos. La fibrina es una de las mejores fuentes de matriz extracelular en el desarrollo de una piel ingenierizada. Sin embargo, el uso de crioprecipitados planea ciertos inconvenientes que han sido comentados anteriormente. El plasma obtenido por un simple fraccionamiento de la sangre total, es un producto más barato y seguro que la fibrina de crioprecipitados, por lo que nos planteamos la hipótesis que el plasma pueda ser una fuente alternativa de fibrina, que resuelva los problemas que plantea el uso de crioprecipitados en la terapéutica. El objetivo general de este trabajo fue desarrollar un modelo de piel artificial basado en plasma humano como fuente de matriz dérmica, que permita implantar un programa clínico de Ingeniería Tisular de la piel. Para ello se siguieron estos puntos: 1.- Valorar como fuente de fibrina el uso del derivado más sencillo, el plasma humano obtenido mediante simple fraccionamiento primario de la sangre. 2.- Estudiar la posible sustitución de todas las proteínas exógenas utilizadas en el modelo de piel artificial previamente descrito. 3.- Optimizar el método de procesamiento de la biopsia, con el fin de obtener el mayor número de células posible y reducir el período entre la toma de la biopsia y el trasplante de la piel producida mediante Ingeniería Tisular. 4.- Analizar el comportamiento del nuevo modelo de piel artificial en un modelo de trasplante experimental, como paso previo a su utilización en la clínica. 19 MATERIAL Y METODOS 3.1 OBTENCIÓN Y CULTIVO PRIMARIO DE CÉLULAS 3.1.1. OBTENCIÓN DE CÉLULAS A PARTIR DE BIOPSIAS DE PIEL El objetivo es disponer del máximo número de células recogidas en las mejores condiciones posibles. Se utiliza para la técnica un fragmento de piel de dimensiones variables (entre 1 y 8 cm2) que contenga epidermis, dermis y tejido celular subcutáneo, recogido de forma estéril. Es conveniente, previo a la toma de la muestra, la desinfección de la piel con antisépticos. Una vez obtenida se recomienda limpiar bien las muestras con suero fisiológico para eliminar todo resto de antiséptico que podría interferir el posterior cultivo de las células. Esta biopsia de piel se recoge en medio de cultivo estéril (MEM, DMEM, RPMI) o incluso para muy cortos períodos de tiempo es válido el suero fisiológico. El medio, preferentemente, debe estar complementado con antibióticos (penicilina, estreptomicina +/- anfotericina B), a la dosis estándar empleada en los cultivos celulares (100 U/ml. de penicilina, 100 μg/ml de estreptomicina). La biopsia deberá ser trasladada cuanto antes a una temperatura aproximada de 4ºC al laboratorio. Un buen sistema es un contenedor isotermo con hielo. La biopsia se envía en un recipiente estéril herméticamente cerrado, envuelta en gasas y dentro de un segundo recipiente (tipo duquesa de plástico) rodeado de hielo. - Una vez recibida la biopsia se retira del medio de transporte, se introduce 23 segundos en alcohol 70º estéril (opcional) y posteriormente se coloca en una placa de Petri y se lava la muestra con T/E estéril. Con la ayuda de tijeras se elimina el tejido graso subcutáneo hasta dejar expuesta la capa de dermis y la epidermis. Se lava nuevamente la biopsia con T/E y se pasa a una nueva placa de Petri. Se cubre con T/E y se trocea con las tijeras estériles hasta obtener pequeños fragmentos de piel. Con la ayuda de una pipeta, previamente empapada en T/E, se pasa la piel a un frasco con agitador magnético (previamente esterilizado).Se añaden unos 25-50 ml. de T/E al frasco y se incuba a 37ºC, en agitación constante 20 durante 30 min. Posteriormente se agita la piel con la ayuda de una pipeta previamente empapada en T/E, se dejan decantar los fragmentos . Con cuidado, se recoge la tripsina y se pasa a un cónico de 50 ml. Añadimos T/E fresca al frasco agitador que contiene todos los fragmentos de piel y la muestra se incuba nuevamente durante 30 minutos a 37ºC. La T/E recogida se neutraliza con igual cantidad de medio de cultivo de queratinocitos (sin EGF, QN) y se centrifuga durante 10 minutos a 1400 r.p.m. El pellet obtenido se disuelve en 2-3 ml de medio de QN y se cuentan las células obtenidas en cada incubación. El procedimiento de recogida de la T/E se repite hasta que no se obtengan células de la biopsia. Cuando ya no se obtengan más células, la tripsina se retira completamente y los restos de la biopsia se introducen en solución de colagenasa tipo I (Sigma) 2 mg/ml disueltos en DMEM (aproximadamente 25-50 ml de solución). La colagenasa se coloca en el baño con agitación a 37ºC hasta la completa disolución de los restos (entre 6 y 12 horas). Al finalizar la incubación la colagenasa se filtra a través de un filtro de células de 60 micras (Falcon ,Beckton-Dikinson, San Jose, CA), se centrifuga y se retira el sobrenadante. El pellet se resuspendió en 2-3 ml de medio de cultivo para fibroblastos y se contaron las células obtenidas. 3.1.2 CULTIVO PRIMARIO Y CONGELACIÓN DE QUERATINOCITOS Para el cultivo primario de queratinocitos se sembró un frasco de 75 cm2 de superficie por cada 2 x 106 células obtenidas tras la digestión de la biopsia con T/E, en presencia de 8 x 106 células 3T3 irradiadas. Como medio de cultivo se utilizó DMEM y Ham-F 12 (Biochrom AG), en una proporción 3:1, suplementado con 10% de SBF (Life Technologies), insulina (5 μg/ml, Sigma), hidrocortisona (0.4 μg/ml, Sigma), triiodotironina (1.3 ng/ml, Sigma) y adenina (24 μg/ml, Sigma). A este medio lo denominamos QN. El medio se cambió cada tres días y al final del primer cambio se le añadió al medio de cultivo factor de crecimiento epidérmico (EGF 10 ng/ml, Austral Biologicals). Este medio se denominó QC (medio QN suplementado con EGF). Cuando los cultivos fueron confluentes se procedió a congelar las células, para ello los queratinocitos se trataron durante media hora aproximadamente con T/E para despegarlos de la superficie del frasco de cultivo. Se neutralizó la 21 tripsina con igual cantidad de medio de cultivo suplementado con un 10% de SBF y se centrifugaron las células a 1400 r.p.m. durante 10 minutos. Tras esto las células se mantuvieron sobre hielo y se resuspendieron en medio de congelación para queratinocitos (10% glicerol, 15% SBF y 75% D-MEM). Se mantuvieron a – 60ºC durante 24 horas, transcurrido ese tiempo se pasaron al tanque de nitrógeno líquido. Generalmente, los queratinocitos fueron congelados a una densidad 1/10, esto significa que con un frasco de cultivo celular de 75 cm2 se preparan 10 crioviales para congelar. Cada uno de estos crioviales servirá más adelante para sembrar un frasco de cultivo de 75 cm2. 3.1.3 CULTIVO PRIMARIO Y CONGELACIÓN DE FIBROBLASTOS. Para el cultivo primario de fibroblastos se sembraron 7 x 106 células obtenidas tras el procesamiento de la biopsia con colagenasa, en un frasco de cultivo celular de 75 cm2, en ausencia de 3T3 irradiados, utilizando como medio de cultivo DMEM suplementado con un 10% de SBF. Las células se siembran en una concentración aproximada de 100.000 células/cm2 .Los cultivos se mantuvieron en un incubador a 37ºC con un 5% de CO2. Cuando en el frasco de cultivo comienzan a crecer abundantes células de aspecto fibroblástico, el frasco se lava dos veces con T/E y se incuba entre 2 y 5 minutos con T/E a 37ºC. Se recogen las células obtenidas y se neutralizan añadiendo la misma cantidad de medio de cultivo que de T/E. Se centrifugan 10 minutos a 1400 r.p.m y se siembran las células en una superficie entre dos y tres veces mayor que la inicial. Cuando se considera que hay un número suficiente de fibroblastos para montar la superficie necesaria para el trasplante, los fibroblastos son nuevamente tripsinizados, se cuentan y se resuspenden en 10 ml del mismo medio hasta su utilización. En algunos casos los fibroblastos fueron congelados para ser utilizados posteriormente. El método de congelación es similar al utilizado en queratinocitos. El medio de congelación para fibroblastos fue: 10% DMSO, 10% SBF, y 80% D-MEM, utilizando dos crioviales por cada frasco de 75 cm2 confluente. 22 Fig. 3. Cultivos Primarios. 3.2 PREPARACIÓN DE PIEL ARTIFICIAL BASADA EN PLASMA HUMANO 3.2.1 OBTENCIÓN DEL PLASMA HUMANO El plasma fresco se obtiene a partir del fraccionamiento primario de sangre completa de donantes del Banco de Sangre, según las normas y recomendaciones de la Asociación Americana de Bancos de Sangre (American Asociation of Blood Banks, 1990). Las extracciones se realizaron usando bolsas de sangre de 450 ml de capacidad, conteniendo una solución anticoagulante (citrato sódico). Una vez extraída, la sangre total se centrifugó a 3000 r.p.m. durante 10 minutos. Terminada la centrifugación se separó el plasma resultante mediante el fraccionamiento normal de la bolsa de sangre. 23 3.2.2 MEDICIÓN DE FIBRINÓGENO La concentración de fibrinógeno presente en el plasma fue medida mediante coagulómetro, Multifibrén® (Dade-Behring). 3.2.3 PREPARACIÓN DE LA DERMIS ARTIFICIAL BASADA EN PLASMA HUMANO. Un gel de plasma para un frasco de cultivo celular de 75 cm2 se prepara con: 5-12 ml de plasma (20-25 mg de fibrinógeno por lámina); entre 800-1200 fibroblastos/cm2; CaCl 2 (2 ml al 1% en suero fisiológico); Acido tranexamico (Amchafibrin® 200 μl) y se completa con suero fisiológico hasta un volumen total de 25 ml. Se deja en la estufa a 37ºC hasta que el gel quede completamente solidificado (entre 30 y 60 minutos). Se cubre con 10-20 ml de QN y se espera un mínimo de 2 horas antes de sembrar los queratinocitos en su superficie (habitualmente se deja hasta el día siguiente). Fig. 4. Fibroblastos en la matriz de plasma. 24 3.2.4 CULTIVO SECUNDARIO DE QUERATINOCITOS SOBRE LA DERMIS ARTIFICIAL. Los viales de queratinocitos se descongelaron en el baño a 37ºC, las células se resuspendieron en un volumen apropiado de QN y se sembraron sobre los geles de fibrina y fibroblastos. Esta fase del cultivo secundario se realizó 24 h después de haber preparado los geles. Los queratinocitos obtenidos a partir de un cultivo primario se siembran sobre los geles de plasma y fibroblastos para obtener la superficie de cultivo deseada; normalmente se siembran con una densidad 1/10-1/35, es decir, con un frasco de cultivo primario se siembran 10 frascos de cultivo secundario. Como norma general no es conveniente realizar expansiones superiores a 1/35. El medio de cultivo empleado es similar al utilizado en los cultivos primarios de queratinocitos. El seguimiento del cultivo se realiza mediante el microscopio invertido. Fig. 5. Colonia de queratinocitos sobre la dermis basada en plasma humano. 25 Fig. 6. Resumen del procedimiento empleado. 3.3. TRASPLANTE DE LA PIEL ARTIFICIAL 3.3.1 PREPARACIÓN DE LA PIEL PARA EL TRASPLANTE Cuando los queratinocitos sembrados sobre la dermis alcanzaron la confluencia, entre 10 y 12 días, se preparó la lámina para el trasplante. Este proceso consta de las siguientes etapas: Se retiró el último medio de cultivo empleado y se abrió el frasco de cultivo, con ayuda de un alambre al rojo que fundía el plástico. A continuación, el gel se cubrió con un tul estéril de forma que éste ocupara toda la superficie del gel (figura 7). Una vez efectuada esta operación, el tul se fijó a la superficie superior del gel, en la cual están los queratinocitos, mediante el empleo de un pegamento inorgánico (Cyanocrylato, Histoacryl®, Braun u otro de similares características). El cyanoacrylato se empleó aplicando pequeñas gotas del mismo a los bordes del gel. Una vez seco el pegamento se procedió a despegar el gel del frasco de cultivo. 26 A continuación se levanta con cuidado la lámina unida al tul. Tras despegarla se cubrió con medio de cultivo para facilitar su manipulación, se enrolló sobre sí misma y se introdujo en un tubo cónico conteniendo medio de cultivo para su transporte (figura 7). Fig. 7. 3.3.2 TRASPLANTE EXPERIMENTAL Los trasplantes experimentales (13) fueron llevados a cabo en condiciones de esterilidad, usando para ello 12 ratones macho inmunodeprimidos BALCnude. Los ratones fueron mantenidos en condiciones libres de patógenos durante veintiún días. Las láminas de piel artificial fueron trasplantadas en el dorso del animal como se describe a continuación: Se desinfectó la zona a trasplantar con betadine®. A continuación realizamos una escisión con bisturí de una superficie de 1,5 cm2 de la piel murina dorsal. La piel del ratón se congeló y descongeló tres veces en PBS estéril con el fin de desvitalizarla. En lugar de la piel del ratón se colocó la piel cultivada, retirando el tul que servía para el montaje (figura 8).La piel desvitalizada se colocó encima de la zona injertada para proteger el injerto, suturándose con Prolene® 7/0 a los bordes de la herida (figura 8). A los 21 días se sacrifica el animal y se hacen estudios histológicos (hematoxilina-eosina y tricromico de Masson ) e inmunohistoquímicos. 27 28 Fig. 8. 3.4 ESTUDIOS HISTOLÓGICOS Se realizaron estudios histológicos de las siguientes muestras: Piel cultivada tras su procesamiento para trasplante. Piel regenerada ( a los 21 días), tras el trasplante a ratón atímico. 29 Las muestras fueron fijadas en formaldehído al 10% e incluidas en parafina. Tras la desparafinización de las muestras se procedió a la tinción convencional o a los estudios inmunohistoquímicos mediante la aplicación de la técnica de la inmunoperoxidasa. Para el estudio de la histología convencional de las muestras de piel, se utilizaron técnicas convencionales de tinción: hematoxilina-eosina y tricrómico de Masson. Para el estudio inmunohistoquímico se analizaron diversas proteínas de interés, para el estudio de la maduración y diferenciación de la piel. Los anticuerpos empleados y las diluciones utilizadas se pueden ver en la tabla 1. Los estudios realizados con anticuerpos antiqueratina 5 se revelaron mediante técnicas de fluorescencia usando como marcadores los fluorocromos Texas Red y FITC. ANTICUERPO CLON DILUCIÓN MARCAJE S100 4C4.9 Vimentina (BioGenex) V9 1:50 Fibroblastos dérmicos Keratina 5 (BabCo) AF138 1:600 Epitelio basal Citokeratina AE1/AE3 (Chemicon AE1/AE3 1:100 Queratinas epidérmicas Melanocitos Tabla 1. anticuerpos utilizados para el estudio inmunohistoquímico. 30 4.RESULTADOS 4.1. CULTIVOS PRIMARIOS Con las biopsias procesadas para realizar la parte experimental de nuestro trabajo obtuvimos células que fueron capaces, a los 3-4 días de iniciado el cultivo primario, de generar colonias típicamente epiteliales entre la capa de células alimentadoras 3T3 irradiadas . Conforme avanzaba el tiempo de cultivo se apreciaba cómo las colonias de queratinocitos iban creciendo y desplazando a las células 3T3 irradiadas de la superficie del frasco de cultivo. Los queratinocitos alcanzaron la confluencia entre el 10º y el 12º día de cultivo, momento en el que no se apreciaban 3T3. Fig.9. Confluencia completa de queratinocitos humanos en monocapa (100x) 31 Durante los primeros días de cultivo primario de fibroblastos, pudieron observarse numerosas células de aspecto epitelial (flecha en figura 10). Tras el pase que se les dio a los 5-6 días de iniciarse el cultivo, las células de aspecto fibroblástico comenzaron a crecer hasta representar la mayoría de la población celular. Tras 9-12 días de iniciarse el cultivo primario de fibroblastos, éstos estuvieron listos para su uso en la dermis artificial. Fig. 10. Fibroblastos Fig. 11. Fibroblastos. 32 4.2 PIEL ARTIFICIAL BASADA EN PLASMA HUMANO 4.2.1 DERMIS BASADA EN PLASMA HUMANO. Los geles realizados a partir de plasma solidificaron y no sufrieron roturas durante el período de cultivo. Los frascos de cultivo que contenían el prototipo se pudieron manejar y realizar los cambios de medios necesarios para el crecimiento celular. Los fibroblastos sembrados en el interior del gel de plasma fueron capaces de adherirse a las proteínas de esta matriz artificial, observándose a las pocas horas la emisión de prolongaciones en su membrana y la adquisición de su morfología típica. Durante el seguimiento del cultivo se pudo observar al microscopio invertido el aumento progresivo del número de fibroblastos presentes en la dermis (figura 12). Fig. 12. Fibroblastos en la matriz de plasma. 33 Los queratinocitos sembrados a la densidad habitual (1/10) sobre el gel de plasma (figura 13) formaban colonias y alcanzaban la confluencia al cabo de 10 ó 12 días de cultivo. En los casos en que se ensayó expansión superior (densidad de cultivo: 1/20, 1/30 y 1/60) la confluencia se alcanzó entre 15 y 18 días como máximo. Fig. 13. Colonia de queratinocitos sobre la dermis basada en plasma humano. El tiempo aproximado para obtener el prototipo de piel artificial completa osciló entre 24 y 30 días. Este período comprende desde la recepción y el procesamiento de la biopsia hasta la confluencia del cultivo de queratinocitos sobre la dermis de plasma y fibroblastos y su preparación para el trasplante. En ninguno de los cultivos realizados sobre gel de plasma se pudo apreciar retracción significativa del tejido, de tal manera que la superficie inicialmente cultivada era la obtenida como piel artificial completa. 34 4.3 TRASPLANTE EXPERIMENTAL Todos los injertos realizados a ratón prendieron en el lecho de la herida. En los primeros 15 días tras el injerto, la piel de ratón desvitalizada, utilizada como cobertura, se desprendió, dejando visible la piel humana injertada. Los injertos mostraban finas arrugas y señales clínicas de hiperqueratosis, características típicas de la piel humana. El origen humano de los queratinocitos de las zonas injertadas se confirmó posteriormente mediante el análisis histológico. Aunque existía una ligera retracción en la zona de la cicatriz, la piel humana regenerada en el dorso del ratón atímico era de consistencia similar a la del ratón y no estaba adherida a planos profundos, se podía elevar y mover la fascia dorsal. 4.4. ESTUDIOS HISTOLÓGICOS 4.4.1 HISTOLOGÍA PREINJERTO Previo al trasplante, mediante la tinción convencional con hematoxilina-eosina se pudo observar la existencia de una capa continúa de células epiteliales, unida firmemente al tejido subyacente (figura 14). Fig. 14. Estudio histológico de láminas de piel cultivada previo al injerto, teñidas con hematoxilina-eosina . En muchas zonas características fibroblásticas. En otras zonas se puede diferenciar perfectamente la formación de un epitelio claramente estratificado. 35 Los estudios inmunohistoquímicos preinjerto mostraron la presencia de una delgada lámina de matriz, poblada de células vimentin positivas (flechas en figura 15). Los filamentos de vimentina son los filamentos intermedios más abundantes de las células de origen mesenquimal, tales como los fibroblastos dérmicos. Sobre esta lámina se observaba una capa de células epiteliales mono o biestratificadas que reaccionaron con los anticuerpos antiqueratinas AE1/AE3.El anticuerpo AE1 reconoce la mayor parte de las citoqueratinas de la subfamilia ácida; el anticuerpo AE3 reconoce a todos los miembros de la subfamilia básica. Al igual que los filamentos de viementina, los filamentos de queratina tienen la función de conferir apoyo mecánico a las células. Fig. 15. Estudios inmunohistoquímicos 36 4.4.1 HISTOLOGÍA TRAS EL TRASPLANTE EXPERIMENTAL. Tras el injerto a ratón atimico , los geles de piel artificial humana fueron capaces de restaurar el fenotipo epidérmico, incluyendo la síntesis de proteínas estructurales ( citoqueratinas). La arquitectura del tejido , veintiún días después del trasplante experimental era semejante a la epidermis humana. La tinción con Hematoxilina de Verhoeff ( Fig. 18), puso de manifiesto la ausencia de fibras elásticas tanto en la dermis murina como en la cultivada. Con Masson Modificado ( Fig. 23), se puso de relieve las fibras de colágeno de la dermis del ratón y de nuestro modelo humano , así como el echo de presentar este ultimo una incipiente neoangiogenesis dérmica. La inmunodeteccion de proteínas humanas en las zonas injertadas (Vimentina) revelo la barrera entre el tejido humano injertado y el de ratón demostrando la persistencia tanto de células epiteliales como de fibroblastos humanos en la piel regenerada ( Fig. 22) . Estos últimos presentaron una disposición de tendencia lineal a nivel de la unión dermoepidermica. El estudio inmunohistoquimico de las citoqueratinas epiteliales mostró una capa de células cuboidales que se marcaban con el anticuerpo antiqueratina k5 ( Fig. 21) .A partir de dicho estrato las células mostraban una tendencia progresiva a adquirir formas aplanadas y a reproducir la morfología normal del epitelio humano. Los anticuerpos anticitoqueratina AE1 –AE3 tiñeron la epidermis del ratón de manera menos intensa que la humana. ( Figs. 16 y 19) Un hallazgo no previsto al utilizar los anticuerpos S-100 fue la aparición de melanocitos en la capa basal de nuestro modelo de piel artificial injertado( Fig. 20). Fig. 16. Tinción con anticuerpos anticitoqueratina AE1 –AE3, interfase entre piel murina y humana. 37 Fig. 17. Tinción con Hematoxilina – Eosina Fig. 18. Tinción con Hematoxilina de Verhoeff 38 Fig. 19. Tinción con anticuerpos anticitoqueratina AE1 –AE3 Fig. 20. Tinción con anticuerpos S-100 39 Fig. 21. Tinción con anticuerpos antiqueratina 5 Fig. 22. Tinción con anticuerpos antivimentina 40 Fig. 23. Tinción con Masson Modificado Fig. 24. 41 5. DISCUSIÓN 5.1 DESARROLLO DEL PROTOTIPO DE PIEL ARTIFICIAL Ante una lesión epitelial o extirpación quirúrgica, la única forma de lograr el cierre definitivo de las heridas es mediante la aportación de epitelio autólogo. Esta aportación puede realizarse mediante dos técnicas: autoinjertos y cultivos celulares. Los autoinjertos son la mejor cobertura definitiva que existe, siempre y cuando existan suficientes zonas donantes, pues en pacientes con más del 30-40% de la superficie corporal dañada la toma de autoinjertos implica la creación de nuevas heridas que amplían la superficie de piel total dañada y pueden provocar un aumento en la tasa de mortalidad. Los autoinjertos pueden utilizarse de forma laminar o mallados. Los laminares tienen un mejor resultado estético, aunque sí son muy gruesos pueden tener dificultades para prender en el lecho de la herida y presentan hematomas con más frecuencia. Los autoinjertos mallados tienen la ventaja de poder cubrir mayor superficie y presentar pocos hematomas al permitir el drenaje, pero el principal inconveniente que tienen es el hecho de no funcionar como barrera hasta que no se produzca la epitelización de los orificios que deja malla y el peor resultado estético al sufrir mayores retracciones. Con la descripción del cultivo in vitro de queratinocitos en 1975 (Rheinwald JG et al, 1975), se puso de manifiesto la posibilidad de conseguir grandes proporciones de epitelio autólogo partiendo de una mínima biopsia de piel sana. En un período de tiempo comprendido entre tres y cuatro semanas se puede obtener la cantidad de epitelio cultivado equivalente a toda la superficie corporal. El cultivo clásico de queratinocitos representó un avance muy importante en el desarrollo de la ingeniería tisular de la piel. Uno de los inconvenientes que tiene este método es la utilización de fibroblastos de ratón letalmente irradiados como soporte para la proliferación y diferenciación de las células epiteliales. Los fibroblastos 3T3 a través de modificaciones que introducen en el medio de cultivo, favorecen el desarrollo de los queratinocitos en cultivo de una forma parecida a su 42 desarrollo in vivo. Este método de cultivo está ampliamente aceptado en la bibliografía, difundiéndose su uso incluso en la práctica clínica (Gallico G et al, 1984; López Gutiérrez JC et al, 1995), pero aún hay algunos equipos (Lauer G, 1994; Labsky J et al, 2003) que intentan obtener sistemas alternativos que no impliquen el uso de células heterólogas cuya genética ha sido alterada, por la posibilidad de que estas alteraciones interfieran en el control de la replicación celular de los queratinocitos. La amplia experiencia que en este momento existe con este tipo de cultivos descarta esta posibilidad, puesto que no se recoge ninguna referencia a este tipo de alteraciones. En el momento en que los queratinocitos forman una capa continua y están listos para subcultivar, ya no existen fibroblastos. Por otra parte, los estudios realizados con otros sistemas de cultivo, en ausencia de 3T3 irradiadas, demuestran que no es posible obtener una adecuada formación de colonias y la diferenciación de los queratinocitos obtenidos es menor que con células cebadoras. Por otro lado, la experiencia en el trasplante de las láminas de queratinocitos cultivados ha puesto de manifiesto las limitaciones que presenta este tejido para su utilización clínica: En primer lugar el tejido así obtenido es muy frágil y por tanto difícil de manipular sin que se produzcan roturas. La utilización de dispasa para separar la lámina de queratinocitos de la superficie del frasco de cultivo, provoca la alteración de las proteínas de la membrana basal, lo que conlleva una pobre tasa de prendimiento de los injertos. A medio plazo, tras ser utilizado como injerto, se observa la formación de extensas ampollas ante traumatismo mínimos, debido a una reconstitución anormal de las fibrillas de anclaje Otro inconveniente es el pobre resultado clínico que se obtiene tras su trasplante. En los primeros días tras el trasplante son contaminación mucho bacteriana más que susceptibles los de autoinjertos. sufrir Incluso diversos estudios manifiestan la incapacidad de las láminas de queratinocitos cultivados para reducir, no sólo la mortalidad de los pacientes tratados, sino también la estancia hospitalaria de los mismos. 43 Para finalizar, su elevado coste ha limitado mucho su uso. La aportación innegable de los cultivos de queratinocitos ha sido el hecho de abrir un amplio abanico de posibilidades en el mundo de la cobertura cutánea al desarrollarse una tecnología que, posiblemente, será la base de la cobertura definitiva futura. Las técnicas de cultivo celular son, de momento, la única posibilidad de obtener abundante tejido autólogo de cobertura, por lo tanto se ha seguido investigando para su mejora. Estos conocimientos han puesto de manifiesto la necesidad de dotar a los cultivos de queratinocitos humanos, no solamente de un soporte físico que les confiera solidez, sino de un tejido subyacente vivo, en el que se incluyan fibroblastos que permitan el mejor crecimiento y diferenciación de la capa de células epiteliales (10) . Las mejoras desarrolladas se basan en general en la reparación dérmica asociada al aporte de los queratinocitos cultivados. Para la reparación definitiva de la piel, no basta sólo con la reposición de la epidermis, sino que también es necesario reponer la dermis dañada. Se han seguido diversas alternativas para proporcionarle a la lámina de epitelio una base dérmica, con distinta valoración según los resultados obtenidos tras su utilización y el coste del tratamiento: Utilización de aloinjertos previos al trasplante de la lámina de queratinocitos. La experiencia clínica con pacientes quemados demuestra que la excisión temprana de las heridas y la cobertura temporal con piel de cadáver que prende temporalmente en el lecho de la herida, mantienen la herida limpia y vascularizada, lo cual aumenta las posibilidades de prendimiento queratinocitos que se va a de la injertar. lámina Este de proceso proporciona una remodelación de la herida más natural y gracias a él se han logrado éxitos prometedores, aunque el problema en este tipo de tratamientos es que se precisa tanto de la unidad de cultivo de queratinocitos como de un banco de piel que suministre los aloinjertos. Utilización de imitadores dérmicos previos al trasplante de la lámina de queratinocitos. Varios autores han trasplantado el cultivo de queratinocitos sobre imitadores 44 dérmicos sintéticos (Alloderm®, Dermagraft®, Integra®), aunque los resultados han sido variables y sin una clara mejoría frente a los aloinjertos de cadáver(18,21). Cultivo de queratinocitos sobre dermis de cadáver. El injerto de queratinocitos cultivados sobre dermis de cadáver congelada o liofilizada ha proporcionado mejores resultados. No obstante, las importantes necesidades de procesamiento y almacenamiento de este tipo de tejido, unido a lo impredecible que es la disponibilidad por la dependencia de donantes, hace que sea inviable su utilización generalizada. Cultivo de queratinocitos sobre soportes comerciales, tales como fibrina comercial o membranas semisintéticas derivadas del ácido hialurónico (Laserkin®) .Estos soportes biodegradables permiten la proliferación de células epiteliales, facilitan el transporte de las láminas y aumentan la resistencia de las mismas cuando son trasplantadas. La alternativa más novedosa es la piel artificial completa. Entendemos por piel artificial completa aquella que incluye tanto el cultivo del epitelio, como el cultivo del componente dérmico, es decir la matriz extracelular que confiera una estructura tridimensional con fibroblastos humanos en su interior . En estudios previos donde se emplea piel artificial completa en la cobertura de grandes áreas, como los realizados por Hansbrough , comenzaban a vislumbrarse las principales ventajas de estas pieles completas: menor fragilidad, escasa retracción, mejores porcentajes de prendimiento (Hansbrough JF et al, 1998). El objetivo inicial para la consecución de esa piel cultivada completa es el desarrollo de una base dérmica (compuesta por una matriz extracelular conteniendo fibroblastos dérmicos) sobre la que el cultivo clásico de queratinocitos consiga gran expansión, diferenciación completa y posibilidades de éxito tras el trasplante (10-13,16,20). La mayoría de esta pseudodermis se basan en la mezcla de los componentes básicos de la auténtica dermis. Es sabido que secuencias específicas de determinadas proteínas de la matriz 45 extracelular pueden promover la adhesión, proliferación y diferenciación de las células epiteliales(25). De estas proteínas, una de las que mayor influencia tienen es el colágeno tipo I, la proteína más abundante de la dermis. En este camino están los estudios que utilizan los geles de colágeno. También se utiliza el colágeno combinado con glicosaminoglicanos, para sintetizar la matriz extracelular. Otro tipo de piel artificial consiste en cultivar los queratinocitos sobre un equivalente dérmico compuesto por láminas de fibroblastos apiladas. También se utilizan polímeros biodegradables como fuente de matriz extracelular, por ejemplo: ácido poliglicólico, mayas de poliglactina o ambos polímeros juntos en su versión comercial Dermagraft® . En nuestro laboratorio hemos utilizado fibrina como fuente de matriz extracelular. La fibrina es una proteína derivada del fibrinógeno sanguíneo. Aunque no es un componente natural de la dermis, es la base de la reparación de heridas, ya que actúa como hemostático y en un primer momento es la matriz extracelular provisional necesaria para las células que inician el proceso reparador; asociada a fibroblastos se utiliza como dermis artificial (Meana A et al, 1998; Camblor LA et al, 2003; Camblor L et al, 2003; Llames S et al, 2004). Por otro lado, se ha demostrado que en el interior de los geles de fibrina, los fibroblastos son capaces de realizar sus funciones fisiológicas(10), sintetizando múltiples factores de crecimiento, similares a los que segregan los fibroblastos in vivo y el gel mismo de fibrina podría servir como reservorio de otras sustancias (factores de crecimiento, antibióticos, etc.) que favorecieran la correcta cicatrización de la herida donde se aplican. Este modelo de dermis no sólo aporta las proteínas estructurales del gel (red tridimensional de fibrina) sino que también aporta las proteínas de adhesión (fibronectina plasmática) necesarias para que las células dérmicas pueden fijarse al gel e iniciar sus funciones fisiológicas. Recientes estudios sobre la revascularizacion de los injertos cutáneos , ponen de manifiesto que la estructura fibrilar de la neodermis elaborada con un gel de fibrina , podría guiar la neoangeogenesis desde el lecho cruento. 46 Existen varias fuentes de fibrina humana: la fibrina obtenida a partir de crioprecipitados de donantes y la fibrina comercial de los pegamentos tisulares (Tissucol®, Baxter-Inmuno). La fibrina de crioprecipitados es un producto de un banco de sangre y se obtiene a partir de donaciones individuales. Uno de los problemas derivados del empleo de esta fibrina es la necesidad de emplear múltiples unidades de crioprecipitados, con lo cual el riesgo de transmisión de enfermedades víricas aumenta. Las fibrinas comerciales se obtienen a partir de un gran pool de donantes tras precipitación del fibrinógeno soluble por etanol. Estas fibrinas son objeto de un tratamiento de inactivación viral por calor, que reduce la posibilidad de transmisión de virus convencionales, pero ningún proceso puede asegurar la absoluta destrucción de todos los agentes infecciosos y mucho menos de los de naturaleza priónica. Ambos tipos de fibrina dependen de la adicción de productos procoagulantes (trombina) de origen humano o bovino, y para su estabilidad es necesario añadir un antifibrinolítico. Este producto es más necesario cuando se utilizan células (fibroblastos, queratinocitos) ya que tienden a degradar aún más rápido el gel de fibrina. En este trabajo hemos utilizado como fuente de fibrina y origen de la matriz dérmica, el plasma obtenido mediante fraccionamiento directo (centrifugación) de sangre completa. Este modelo parece poseer las mismas cualidades que los geles realizados a partir de concentrados de fibrinógeno, es decir: Tanto los fibroblastos como los queratinocitos son capaces de crecer en este gel con una alta capacidad de expansión. Las láminas así cultivadas son trasplantables, pueden manipularse y extraerse del frasco de cultivo manteniendo su integridad, condición necesaria para ser utilizadas en un trasplante. 47 Además, el uso de plasma como fuente de fibrina para la dermis artificial presenta unas características claramente ventajosas frente al modelo de geles realizados a partir de concentrados de fibrinógeno: El empleo como agente coagulante de la trombina endógena presente en el plasma. La posibilidad de sustituir el antifibrinolítico de origen bovino por otros de origen sintético. La posibilidad de realizar una gran superficie de dermis a partir de una simple y única donación. El bajo volumen de plasma necesario para la realización del gel (10 ml para 75 cm2) hace que se puedan preparar hasta 2.500 cm2 de piel artificial a partir de un solo donante. Esta pequeña cantidad de plasma hace que, en algunos casos, se pueda utilizar la sangre del propio paciente, obtenida mediante una simple venopunción, como origen de la dermis artificial, con lo que el riesgo de transmisión de enfermedades infecciosas se anula. Si a esto añadimos que podemos obtener los fibroblastos y queratinocitos procedentes de la misma biopsia, este sistema abre la posibilidad de desarrollar grandes superficies de piel artificial utilizando exclusivamente material del propio paciente. Es decir, piel artificial completamente autóloga. En nuestro laboratorio se ha demostrado que utilizando plasma como fuente de dermis artificial, se puede conseguir un alto nivel de expansión celular no demostrado por otras sustancias. Esta alta capacidad de expansión, unida a la utilización de colagenasa para optimizar la obtención de células de las biopsias, es de gran utilidad cuando se piensa en utilizar este prototipo de piel artificial en la clínica. Sobre todo cuando hablamos de grandes lesiones epiteliales para las cuales no existe suficiente cobertura autóloga. Uno de los objetivos planteados para este trabajo fue confirmar la posibilidad de sustituir de las proteínas exógenas utilizadas para sintetizar la dermis artificial. Esta proteínas (trombina y aprotinina) son de origen bovino y 48 conllevan el riesgo de transmitir infecciones que salten la barrera interespecífica (encefalopatía espongiforme bovina). En los geles realizados a partir de plasma humano se consiguió eliminar la trombina bovina y provocar la coagulación activando la protrombina endógena mediante la adicción de CaCl2. La recogida de la sangre total de donante se suele realizar en presencia de citrato sódico. El citrato sódico secuestra el calcio presente en la sangre e impide la coagulación, este ion es fundamental para el desarrollo completo del proceso. La concentración de cloruro cálcico deber de ser la adecuada para neutralizar a los agentes quelantes. Nuestros resultados indican que no es posible prescindir del antifibrinolítico, ya que el cultivo de queratinocitos sobre la dermis de plasma y fibroblastos humanos, no llegó a término en ausencia de esta sustancia. Es sabido que durante la reparación cutánea se activan proteasas que digerirán las proteínas de la matriz extracelular y permitirán la migración de las células. Estas proteasas se dividen básicamente en dos tipos: metaloproteasas y serin proteasas. Las metaloproteasas son necesarias para la migración de los queratinocitos, pero las serin proteasas han de ser inhibidas. Los queratinocitos tienen la capacidad de sintetizar altas cantidades de activador tisular del plasminógeno (tAP) (serin proteasa), el cual activará el plasminógeno (serin proteasa) y éste, a su vez, a las plasmina que actuará digiriendo los coágulos de fibrina. La aprotinina es un inhibidor inespecífico de las serin proteasas y no tiene ninguna acción específica sobre el tPA. Por el contrario el ácido aminocaproico a concentraciones altas actúa inhibiendo a la plasmina y a los activadores del plasminógeno, a concentraciones más bajas actúa exclusivamente sobre estos últimos. El estudio de proliferación de los queratinocitos, previo al trasplante experimental, mostró que el epitelio continúa proliferando a pesar de haber alcanzado la confluencia. La proliferación epitelial tras haber alcanzado la confluencia probablemente indique que los fenómenos de diferenciación y estratificación del epitelio están presentes en el prototipo en el momento de ser preparadas las láminas para el trasplante. Lo que indica la capacidad de generar un epitelio totalmente diferenciado, tal y como muestran los 49 resultados tras el trasplante experimental. También se puede observar proliferación en los fibroblastos presentes en el interior del gel de plasma. Con el trasplante experimental del prototipo se demostró que el modelo de piel artificial desarrollado es válido para su manejo quirúrgico. Se decidió proteger el injerto durante los primeros días con la piel del prototipo animal desvitalizada, este sistema de trasplante permite proteger el injerto sin aplicación de ningún apósito que comprima la zona trasplantada. Tras el desprendimiento espontáneo de la piel desvitalizada, se pudo ver un epitelio de características morfológicas diferentes a las del animal. A las 3 semanas del injerto el análisis histológico de la piel trasplantada mostró la existencia de un estrato córneo completo, imprescindible para que la piel realice su importante función de barrera frente al medio externo. Este prototipo era capaz de reconstruir la morfología normal del epitelio. Todas estas observaciones tienen gran importancia si consideramos que partimos de un gel de fibrina poblado por fibroblastos sobre el que están presentes células epiteliales mono o biestratificadas y que se desarrolla un epitelio estratificado, con estrato córneo incluido, sobre una dermis formada mayoritariamente por colágeno y fibroblastos, vascularizada mediante pequeños capilares . Mediante anticuerpos específicos humanos se confirmó el origen humano de las células que epitelizaban la zona de la herida. El trasplante permaneció estable. Si consideramos que el epitelio humano se renueva en unos 15-30 días según la zona del cuerpo(17,18), la permanencia del epitelio en el modelo experimental indica la presencia, en el injerto, de células madre (13,16,20) capaces de mantener la renovación del epitelio(19). Tras 3 semanas de trasplante, se vio el programa completo de diferenciación de los queratinocitos, al observarse el desarrollo del estrato córneo. Este programa de diferenciación fue normal, según la expresión de las citoqueratinas estudiadas: la citoqueratina K5 se expresó en el estrato basal . En la piel cada estrato epidérmico expresa un tipo distinto de queratina, en el estrato basal los filamentos de queratina contienen dos proteínas bien diferenciadas denominadas K5 y K14; en el estrato espinoso predominan las queratinas K1 y K10.Un hallazgo imprevisto fue la constatación de que en la 50 capa basal se positivizaban células con S-100, demostrando la existencia de melanocitos a dicho nivel. El estudio histológico de la dermis trasplantada muestra varios puntos de interés: 1. La persistencia en el lecho de la herida de los fibroblastos humanos marcados con vimentina y una tendencia de los mismos a desplazarse hacia la unión dermoepidermica . 2. Sustitución de las fibras de fibrina por otras de colágeno sintetizadas de novo (Tricomico de Masson) 3. Presencia de abundantes estructuras neoangeogenicas. En resumen , los resultados del trasplante experimental nos indican que nuestro prototipo de piel artificial es perfectamente trasplantable , epiteliza permanentemente las heridas , desarrolla correctamente el programa de diferenciación de los queratinocitos y proporciona una base dérmica estable a la herida . 51 6. CONCLUSIONES Las conclusiones de este trabajo son: 1.- El plasma humano puede ser utilizado como fuente de matriz dérmica en el desarrollo de un programa de ingeniería tisular de la piel. 2.- La utilización de plasma como dermis artificial permite la eliminación de sustancias de origen animal en la fabricación de la dermis. Abre la posibilidad de fabricar una piel artificial completamente autóloga. 3.- Este modelo de piel artificial fue capaz de epitelizar permanentemente heridas en un modelo experimental . 4.- No se objetivaron pérdidas tardías de la epitelización, ni la aparición de lesiones ampollosas, típicas en otros modelos de piel cultivada.. 52 7. REFERENCIAS 1. Barret JP, Wolf SE, Desai MH, et al. Cost-efficacy of cultured epidermal autografts in massive pediatric burns. Ann Surg 2000; 231: 869. [Context Link] 2. Hickerson WL, Compton C, Fletchall S, et al. Cultured epidermal autografts and allodermis combination for permanent burn wound coverage. Burns 1994; 20: S52. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 3. Rennekampff HO, Kiessig V, Griffey S, et al. Acellular human dermis promotes cultured keratinocyte engraftment. J Burn Care Rehabil 1997; 18: 535. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 4. Cuono C, Langdon R, Mc Guire J. Use of cultured epidermal autografts and dermal allografts as skin replacement after burn injury. Lancet 1986; 1: 1124. [Context Link] 5. Archambault M, Yaar M, Gilcherst BA. Keratinocytes and fibroblasts in a human skin equivalent model enhance melanocyte survival and melanin synthesis after ultraviolet irradiation. J Invest Dermatol 1995; 104: 859. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 6. Sheridan RL, Tomkins RG. Skin substitutes in burns. Burns 1999; 25: 97. [Context Link] 7. Hansbrough JF, Boyce ST, Cooper ML, et al. Burn wound closure with cultured autologous keratinocytes and fibroblasts attached to a collagenglycosaminoglycan substrate. JAMA 1989; 262: 2125. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 8. Kim BM, Suzuki S, Nishimura Y, et al. Cellular artificial skin substitute produced by short period simultaneous culture of fibroblasts and keratinocytes. Br J Plast Surg 1999; 52: 573. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 9. Kremer M, Lang E, Berger AC. Evaluation of dermal-epidermal skin equivalents (“composite-skin”) of human keratinocytes in a collagen- glycosaminoglycan matrix (Integra artificial skin). Br J Plast Surg 2000; 53: 459. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 53 10. Meana A, Iglesias J, Del Rio M, et al. Large surface of cultured human epithelium obtained on a dermal matrix based on live fibroblast-containing fibrin gels. Burns 1998; 24: 621. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 11. Rio MD, Larcher F, Meana A, et al. Nonviral transfer of genes to pig primary keratinocytes. Induction of angiogenesis by composite grafts of modified keratinocytes overexpressing VEGF driven by a keratin promoter. Gene Ther 1999; 6 ( 10): 1734. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 12. Larcher F, Del Rio M, Serrano F, et al. A cutaneous gene therapy approach to human leptin deficiencies: correction of the murine ob/ob phenotype using leptin-targeted keratinocyte grafts. FASEB J 2001; 15 ( 9): 1529. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 13. Del Rio M, Larcher F, Serrano F, et al. A preclinical model for the analysis of genetically modified human skin in vivo. Hum Gene Ther 2002; 13: 959. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 14. Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell 1975; 6: 331. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 15. Walker RH. Technical Manual [ ed. 10 ]. Bethesda, MD: American Association of Blood Banks, 1990, p 46. [Context Link] 16. Pellegrini G, Ranno R, Stracuzzi G, et al. The control of epidermal stem cells (holoclones) in the treatment of massive full-thickness burns with autologous keratinocytes cultured on fibrin. Transplantation 1999; 68: 868. Texto Completo OVID Catalogos Biblioteca Bibliographic Links [Context Link] 17. Dover R, Wright NA. Epidermal cell kinetics. In: Fitzpatrick T, and Freedberg I, eds. Dermatology in general medicine. London: McGraw-Hill, 1999, pp. 160–171. [Context Link] 18. Potten CS, Booth C. Keratinocyte stem cells: a commentary. J Invest Dermatol. 2002; 119: 888. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 19. Compton CC, Nadire KB, Regauer S, et al. Cultured human sole-derived keratinocyte grafts re-express site-specific differentiation after transplantation. 54 Differentiation 1998; 64: 45. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 20. Ronfard V, Rives JM, Neveux Y, et al. Long-term regeneration of human epidermis on third degree burns transplanted with autologous cultured epithelium grown on a fibrin matrix. Transplantation 2000; 70 ( 11): 1588. Texto Completo OVID Catalogos Biblioteca Bibliographic Links [Context Link] 21. Chakrabarty KH, Dawson RA, Harris P, et al. Development of autologous human dermal-epidermal composites based on sterilized human allodermis for clinical use. Br J Dermatol 1999; 141: 811. Texto Completo OVID Catalogos Biblioteca Bibliographic Links [Context Link] 22. Bell E, Ehrlich HP, Buttle DJ, et al. Living tissue formed in vitro and accepted as skin equivalent tissue of full thickness. Science 1981; 211: 1052. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 23. Buttler CE, Yannas IV, Compton C, et al. Comparison of cultured keratinocytes seeded into a collagen GAG matrix for skin replacements. Br J Plast Surg 1999; 52: 127. [Context Link] 24. Beumer GJ, van Blitterswijk CA, Bakker D, et al. Cell-seeding and in vitro biocompatibility evaluation of polymeric matrices of PEO/PBT copolymers and PLLA. Biomaterials 1993; 14: 598. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 25. Marx RE, Carlson ER, Eichstaedt RM, et al. Platelet rich plasma, growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998; 85: 638. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 26. Svensjo T, Yao F, Pomahac B, et al. Cultured autologous fibroblasts augment epidermal repair. Transplantation 2002; 73: 1033. Texto Completo OVID Catalogos Biblioteca Bibliographic Links [Context Link] 27. Ferguson PC, Boynton EL, Wunder JS, et al. Intradermal injection of autologous dermal fibroblasts improves wound healing in irradiated skin. J Surg Res 1999; 85: 331. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 28. Caruso DM, Schuh WH, Al-Kasspooles MF, et al. Cultured composite autografts as coverage for an extensive body surface area burn: case report and review of the technology. Burns 1999; 25: 771. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 55 29. Lamme EN, Van Leeuwen RT, Brandsma K, et al. Higher numbers of autologous fibroblasts in an artificial dermal substitute improve tissue regeneration and modulate scar tissue formation. J Pathol 2000; 190: 595. Catalogos Biblioteca Solicitud de Documentos Bibliographic Links [Context Link] 30.Llames, Sara G.1; Del Rio, Marcela2; Larcher, Fernando2; García, Eva1; García, Marta2; José Escamez, María2; Jorcano, Jose L.2; Holguín, Purificación3; Meana, Alvaro Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin.Transplantation 77(3),350-355,2004. 56 57