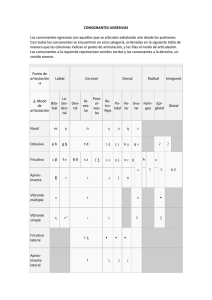
Anexo I Relación de los nombres del medicamento, formas
Anuncio

Anexo I
Relación de los nombres del medicamento, formas farmacéuticas, dosis,
vías de administración, titulares de la autorización de comercialización en
los estados miembros
1
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
5 mg/ml
UE/EEE
Austria
Austria
Austria
Bélgica
Novartis Pharma GmbH
Sandostatin LAR 10 mg -
Stella-Klein-Löw-Weg 17
Pulver und Lösungsmittel
para suspensión
1020 Wien
zur Herstellung einer
inyectable
Austria
Injektionssuspension
Novartis Pharma GmbH
Sandostatin LAR 20 mg -
Stella-Klein-Löw-Weg 17
Pulver und Lösungsmittel
1020 Wien
zur Herstellung einer
Austria
Injektionssuspension
Novartis Pharma GmbH
Sandostatin LAR 30 mg -
10 mg
Polvo y disolvente
20 mg
Polvo y disolvente
para suspensión
inyectable
Inyección
10 mg/ml
30 mg
Polvo y disolvente
Inyección
15 mg/ml
Inyección
4 mg/ml
Inyección
8 mg/ml
Inyección
12 mg/ml
Inyección
10 mg/ml
Stella-Klein-Löw-Weg 17
Pulver und Lösungsmittel
para suspensión
1020 Wien
zur Herstellung einer
inyectable
Austria
Injektionssuspension
N.V. Novartis Pharma S.A.
Sandostatine Long Acting
Medialaan 40,
Repeatable
10 mg
Polvo y disolvente
para suspensión
1800 Vilvoorde
inyectable
Belgium
Bélgica
N.V. Novartis Pharma S.A.
Sandostatine Long Acting
Medialaan 40,
Repeatable
20 mg
Polvo y disolvente
para suspensión
1800 Vilvoorde
inyectable
Belgium
Bélgica
N.V. Novartis Pharma S.A.
Sandostatine Long Acting
Medialaan 40,
Repeatable
30 mg
Polvo y disolvente
para suspensión
1800 Vilvoorde
inyectable
Belgium
Bulgaria
Novartis Pharma GmbH
Sandostatin LAR
20 mg
Polvo y disolvente
Roonstrasse 25, 90429
para suspensión
Nuremberg
inyectable
Germany
2
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
15 mg/ml
Inyección
4 mg/ml
Inyección
8 mg/ml
Inyección
12 mg/ml
Vía intramuscular
10 mg/ml
UE/EEE
Bulgaria
Novartis Pharma GmbH
Sandostatin LAR
30 mg
Polvo y disolvente
Roonstrasse 25, 90429
para suspensión
Nuremberg
inyectable
Germany
Chipre
Novartis Pharmaceuticals
Sandostatin LAR
10 mg
Polvo y disolvente
UNITED KINGDOM Ltd
para suspensión
Frimley Business Park
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Chipre
Novartis Pharmaceuticals
Sandostatin LAR
20 mg
Polvo y disolvente
UNITED KINGDOM Ltd
para suspensión
Frimley Business Park
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Chipre
Novartis Pharmaceuticals
Sandostatin LAR
30 mg
Polvo y disolvente
UNITED KINGDOM Ltd
para suspensión
Frimley Business Park
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
República
Novartis s.r.o.
Checa
Na Pankráci 1724/129
SANDOSTATIN LAR 20 MG
20 mg
para suspensión
140 00 Praha 4 - Nusle
inyectable
Czech Republic
3
Polvo y disolvente
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Vía intramuscular
15 mg/ml
Inyección
4 mg/ml
Inyección
8 mg/ml
Inyección
12 mg/ml
Vía intramuscular
5 mg/ml
Vía intramuscular
10 mg/ml
Vía intramuscular
15 mg/ml
UE/EEE
República
Novartis s.r.o.
Checa
Na Pankráci 1724/129
SANDOSTATIN LAR 30 MG
30 mg
Polvo y disolvente
para suspensión
140 00 Praha 4 - Nusle
inyectable
Czech Republic
Dinamarca
Novartis Healthcare A/S
Sandostatin LAR
10 mg
Polvo y disolvente
Edvard Thomsens Vej 14
para suspensión
2300 Copenhagen S
inyectable
Denmark
Dinamarca
Novartis Healthcare A/S
Sandostatin LAR
20 mg
Polvo y disolvente
Edvard Thomsens Vej 14
para suspensión
2300 Copenhagen S
inyectable
Denmark
Dinamarca
Novartis Healthcare A/S
Sandostatin LAR
30 mg
Polvo y disolvente
Edvard Thomsens Vej 14
para suspensión
2300 Copenhagen S
inyectable
Denmark
Estonia
Novartis Finland OY
Sandostatin LAR
10 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
Finland
Estonia
Novartis Finland OY
Sandostatin LAR
20 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
Finland
Estonia
Novartis Finland OY
Sandostatin LAR
30 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
Finland
4
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Vía intramuscular
5 mg/ml
Vía intramuscular
10 mg/ml
Vía intramuscular
15 mg/ml
Vía intramuscular
4 mg/ml
Vía intramuscular
8 mg/ml
Vía intramuscular
12 mg/ml
UE/EEE
Finlandia
Novartis Finland OY
Sandostatin LAR
10 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
Finland
Finlandia
Novartis Finland OY
Sandostatin LAR
20 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
Finland
Finlandia
Novartis Finland OY
Sandostatin LAR
30 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
Finland
Francia
Novartis Pharma S.A.S.
Sandostatine LP
10 mg
Polvo y disolvente en
2- 4, rue Lionel Terray
jeringas precargadas
92500 RUEIL-MALMAISON,
para suspensión de
France
liberación prolongada
para inyección (i.m)
Francia
Novartis Pharma S.A.S.
Sandostatine LP
20 mg
Polvo y disolvente en
2- 4, rue Lionel Terray
jeringas precargadas
92500 RUEIL-MALMAISON,
para suspensión de
France
liberación prolongada
para inyección (i.m)
Francia
Novartis Pharma S.A.S.
Sandostatine LP
30 mg
Polvo y disolvente en
2- 4, rue Lionel Terray
jeringas precargadas
92500 RUEIL-MALMAISON,
para suspensión de
France
liberación prolongada
para inyección (i.m)
5
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
Vía intramuscular
4 mg/ml
Vía intramuscular
8 mg/ml
UE/EEE
Alemania
Novartis Pharma GmbH
Sandostatin LAR-
Roonstrasse 25
Monatsdepot 10 mg
10 mg/2 ml
Polvo y disolvente
para suspensión
90429 Nürnberg
inyectable
Germany
Alemania
Novartis Pharma GmbH
Sandostatin LAR-
20 mg/2 ml
Polvo y disolvente
Roonstrasse 25
Monatsdepot
para suspensión
90429 Nürnberg
20 mg
inyectable
Germany
Alemania
Novartis Pharma GmbH
Sandostatin LAR-
30 mg/2 ml
Polvo y disolvente
Roonstrasse 25
Monatsdepot
para suspensión
90429 Nürnberg
30 mg
inyectable
Germany
Grecia
Novartis (Hellas) S.A.C.I.
Sandostatin LAR
10 mg
Polvo y disolvente
National Road No. 1 (12th
para suspensión
Km)
inyectable
Metamorphosis
144 51 Athens
Greece
Grecia
Novartis (Hellas) S.A.C.I.
Sandostatin LAR
20 mg
Polvo y disolvente
National Road No. 1 (12th
para suspensión
Km)
inyectable
Metamorphosis
144 51 Athens
Greece
6
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Vía intramuscular
12 mg/ml
Vía intramuscular
5 mg/ml
Vía intramuscular
10 mg/ml
Vía intramuscular
15 mg/ml
Vía intramuscular
5mg/ml
Vía intramuscular
10mg/ml
UE/EEE
Grecia
Novartis (Hellas) S.A.C.I.
Sandostatin LAR
30 mg
Polvo y disolvente
National Road No. 1 (12th
para suspensión
Km)
inyectable
Metamorphosis
144 51 Athens
Greece
Hungría
Novartis Hungária Kft.
Sandostatin LAR 10 mg por
10 mg
Polvo y disolvente
(Pharma részlege)
és oldószer szuszpenziós
para suspensión
Bartók Béla út 43-47
injekcióhoz
inyectable
1114 Budapest
Hungary
Hungría
Novartis Hungária Kft.
Sandostatin LAR 20 mg por
(Pharma részlege)
és oldószer szuszpenziós
20 mg
Polvo y disolvente
para suspensión
Bartók Béla út 43-47
injekcióhoz
inyectable
1114 Budapest
Hungary
Hungría
Novartis Hungária Kft.
Sandostatin LAR 30 mg por
30 mg
Polvo y disolvente
(Pharma részlege)
és oldószer szuszpenziós
para suspensión
Bartók Béla út 43-47
injekcióhoz
inyectable
1114 Budapest
Hungary
Islandia
Novartis Healthcare A/S
Sandostatin LAR
10 mg
Polvo y disolvente
Edvard Thomsens Vej 14
para suspensión
2300 Copenhagen S
inyectable
Denmark
Islandia
Novartis Healthcare A/S
Sandostatin LAR
20 mg
Polvo y disolvente
Edvard Thomsens Vej 14
para suspensión
2300 Copenhagen S
inyectable
Denmark
7
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Vía intramuscular
15ml/mg
Inyección
5 ml/mg
Inyección
10 ml/mg
Inyección
15 ml/mg
Inyección
4 mg/ml
UE/EEE
Islandia
Novartis Healthcare A/S
Sandostatin LAR
30 mg
Polvo y disolvente
Edvard Thomsens Vej 14
para suspensión
2300 Copenhagen S
inyectable
Denmark
Irlanda
Novartis Pharmaceuticals
Sandostatin LAR
10 mg
Polvo y disolvente
UNITED KINGDOM Ltd
para suspensión
Frimley Business Park
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Irlanda
Novartis Pharmaceuticals
Sandostatin LAR
20 mg
Polvo y disolvente
UNITED KINGDOM Ltd
para suspensión
Frimley Business Park
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Irlanda
Novartis Pharmaceuticals
Sandostatin LAR
30 mg
Polvo y disolvente
UNITED KINGDOM Ltd
para suspensión
Frimley Business Park
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Italia
Novartis Farma S.p.A.
Sandostatina LAR
10 mg
Polvo y disolvente
Largo Umberto Boccioni 1
para suspensión
21040 Origgio
inyectable
Italy
8
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
8 mg/ml
Inyección
12 mg/ml
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
Vía intramuscular
5 mg/ml;
UE/EEE
Italia
Novartis Farma S.p.A.
Sandostatina LAR
20 mg
Polvo y disolvente
Largo Umberto Boccioni 1
para suspensión
21040 Origgio
inyectable
Italy
Italia
Novartis Farma S.p.A.
Sandostatina LAR
30 mg
Polvo y disolvente
Largo Umberto Boccioni 1
para suspensión
21040 Origgio
inyectable
Italy
Letonia
Letonia
Letonia
Lituania
Novartis Finland OY
Sandostatin LAR 10 mg
10 mg
Metsänneidonkuja 10
pulveris un šķīdinātājs
para suspensión
02130 Espoo
injekciju suspensijas
inyectable
Finland
pagatavošanai
Novartis Finland OY
Sandostatin LAR 20 mg
Metsänneidonkuja 10
pulveris un šķīdinātājs
para suspensión
02130 Espoo
injekciju suspensijas
inyectable
Finland
pagatavošanai
Novartis Finland OY
Sandostatin LAR 30 mg
Metsänneidonkuja 10
pulveris un šķīdinātājs
para suspensión
02130 Espoo
injekciju suspensijas
inyectable
Finland
pagatavošanai
Novartis Finland Oy
Sandostatin LAR
20 mg
30 mg
10 mg
Polvo y disolvente
Polvo y disolvente
Polvo y disolvente
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
4 mg/ml
Finland
Lituania
Novartis Finland Oy
Sandostatin LAR
20 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
Finland
9
Vía intramuscular
10 mg/ml;
8 mg/ml
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Vía intramuscular
15 mg/ml;
UE/EEE
Lituania
Novartis Finland Oy
Sandostatin LAR
30 mg
Polvo y disolvente
Metsänneidonkuja 10
para suspensión
02130 Espoo
inyectable
12 mg/ml
Finland
Luxemburgo
Novartis Pharma GmbH
Sandostatin Long Acting
Roonstrasse 25
Repeatable
10 mg
Polvo y disolvente
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
Inyección
5 mg/ml
Inyección
10 mg/ml
para suspensión
D-90429 Nürnberg
inyectable
Germany
Luxemburgo
Novartis Pharma GmbH
Sandostatin Long Acting
Roonstrasse 25
Repeatable
20 mg
Polvo y disolvente
para suspensión
D-90429 Nürnberg
inyectable
Germany
Luxemburgo
Novartis Pharma GmbH
Sandostatin Long Acting
Roonstrasse 25
Repeatable
30 mg
Polvo y disolvente
para suspensión
D-90429 Nürnberg
inyectable
Germany
Malta
Novartis Pharmaceuticals
Sandostatin LAR 10 mg
UNITED KINGDOM Ltd
Powder and solvent for
10 mg
Polvo y disolvente
para suspensión
Frimley Business Park
suspension for injection
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Malta
Novartis Pharmaceuticals
Sandostatin LAR 20 mg
UNITED KINGDOM Ltd
Powder and solvent for
20 mg
para suspensión
Frimley Business Park
suspension for injection
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
10
Polvo y disolvente
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
15 mg/ml
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
Inyección
5 mg/ml
Inyección
10 mg/ml
UE/EEE
Malta
Novartis Pharmaceuticals
Sandostatin LAR 30 mg
UNITED KINGDOM Ltd
Powder and solvent for
30 mg
Polvo y disolvente
para suspensión
Frimley Business Park
suspension for injection
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Países Bajos
Países Bajos
Países Bajos
Noruega
Novartis Pharma B.V.
Sandostatine LAR 10 mg,
10 mg
Raapopseweg 1
poeder en oplosmiddel
para suspensión
6824 DP Arnhem
voor suspensie voor
inyectable
The Netherlands
injectie
Novartis Pharma B.V.
Sandostatine LAR 20 mg,
Raapopseweg 1
poeder en oplosmiddel
para suspensión
6824 DP Arnhem
voor suspensie voor
inyectable
The Netherlands
injectie
Novartis Pharma B.V.
Sandostatine LAR 30 mg,
Raapopseweg 1
poeder en oplosmiddel
para suspensión
6824 DP Arnhem
voor suspensie voor
inyectable
The Netherlands
injectie
Novartis Norge AS
Sandostatin LAR
20 mg
30 mg
10 mg
Polvo y disolvente
Polvo y disolvente
Polvo y disolvente
Polvo y disolvente
Postboks 4284 Nydalen,
para suspensión
0401 Oslo
inyectable
Norway
Noruega
Novartis Norge AS
Sandostatin LAR
20 mg
Polvo y disolvente
Postboks 4284 Nydalen,
para suspensión
0401 Oslo
inyectable
Norway
11
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
15 mg/ml
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
Vía intramuscular
5 mg/ml
UE/EEE
Noruega
Novartis Norge AS
Sandostatin LAR
30 mg
Polvo y disolvente
Postboks 4284 Nydalen,
para suspensión
0401 Oslo
inyectable
Norway
Polonia
Novartis Pharma GmbH
Sandostatin LAR
10 mg
Polvo y disolvente
Roonstrasse 25
para suspensión
90429 Nürnberg
inyectable
Germany
Polonia
Novartis Pharma GmbH
Sandostatin LAR
20 mg
Polvo y disolvente
Roonstrasse 25
para suspensión
90429 Nürnberg
inyectable
Germany
Polonia
Novartis Pharma GmbH
Sandostatin LAR
30 mg
Polvo y disolvente
Roonstrasse 25
para suspensión
90429 Nürnberg
inyectable
Germany
Portugal
Novartis Farma - Produtos
Sandostatina LAR
10 mg/2 ml
Polvo y disolvente
Farmacêuticos S.A.
para suspensión
Av. Professor Doutor Cavaco
inyectable
Silva, 10 E
Taguspark
2740-255 Porto Salvo
Portugal
12
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Vía intramuscular
10 mg/ml
Vía intramuscular
15 mg/ml
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
UE/EEE
Portugal
Novartis Farma - Produtos
Sandostatina LAR
20 mg/2 ml
Polvo y disolvente
Farmacêuticos S.A.
para suspensión
Av. Professor Doutor Cavaco
inyectable
Silva, 10 E
Taguspark
2740-255 Porto Salvo
Portugal
Portugal
Novartis Farma - Produtos
Sandostatina LAR
30 mg/2 ml
Polvo y disolvente
Farmacêuticos S.A.
para suspensión
Av. Professor Doutor Cavaco
inyectable
Silva, 10 E
Taguspark
2740-255 Porto Salvo
Portugal
Rumanía
Rumanía
Novartis Pharma GmbH
SANDOSTATIN LAR
10 mg
Roonstrasse 25
10 mg pulbere și solvent
para suspensión
90429 Nürnberg
pentru suspensie
inyectable
Germany
injectabilă
Novartis Pharma GmbH
SANDOSTATIN LAR 20 mg
Roonstrasse 25
pulbere și solvent pentru
para suspensión
90429 Nürnberg
suspensie injectabilă
inyectable
20 mg
Polvo y disolvente
Polvo y disolvente
Germany
Rumanía
Novartis Pharma GmbH
SANDOSTATIN LAR 30 mg
Roonstrasse 25
pulbere și solvent pentru
30 mg
para suspensión
90429 Nürnberg
suspensie injectabilă
inyectable
Germany
13
Polvo y disolvente
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
5 mg/ml
UE/EEE
República
Novartis s.r.o.
Checa
Na Pankrá ci 1724/129
Sandostatin LAR
10 mg
Polvo y disolvente
para suspensión
140 00 Praha 4 – Nusle
inyectable
4 mg/ml
Czech Republic
República
Novartis s.r.o.
Sandostatin LAR
20 mg
Polvo y disolvente
Checa
Na Pankráci 1724/129
para suspensión
140 00 Praha 4 – Nusle
inyectable
Inyección
10 mg/ml
8 mg/ml
Czech Republic
República
Novartis s.r.o.
Sandostatin LAR
30 mg
Polvo y disolvente
Checa
Na Pankráci 1724/129
para suspensión
140 00 Praha 4 – Nusle
inyectable
Inyección
15 mg/ml
12 mg/ml
Czech Republic
Eslovenia
Novartis Pharma GmbH
Sandostatin LAR 10 mg
10 mg
Polvo y disolvente
Roonstrasse 25
prašek in vehikel za
para suspensión
90429 Nürnberg
suspenzijo za injiciranje
inyectable
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
Vía intramuscular
5 mg/ml
Germany
Eslovenia
Novartis Pharma GmbH
Sandostatin LAR 20 mg
Roonstrasse 25
prašek in vehikel za
20 mg
Polvo y disolvente
para suspensión
90429 Nürnberg
suspenzijo za injiciranje
inyectable
Germany
Eslovenia
Novartis Pharma GmbH
Sandostatin LAR 30 mg
Roonstrasse 25
prašek in vehikel za
30 mg
Polvo y disolvente
para suspensión
90429 Nürnberg
suspenzijo za injiciranje
inyectable
Germany
España
Novartis Farmacéutica S.A.
Sandostatin LAR 10 mg
10 mg
Gran Via de les Corts
polvo para suspensión
para suspensión
Catalanes, 764
inyectable
inyectable
08013 Barcelona
Spain
14
Polvo y disolvente
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Vía intramuscular
10 mg/ml
Vía intramuscular
15 mg/ml
Inyección
5 mg/ml
Inyección
10 mg/ml
Inyección
15 mg/ml
Inyección
5 mg/ml
UE/EEE
España
Novartis Farmacéutica S.A.
Sandostatin LAR 20 mg
Gran Via de les Corts
polvo para suspensión
20 mg
Polvo y disolvente
para suspensión
Catalanes, 764
inyectable
inyectable
08013 Barcelona
Spain
España
Novartis Farmacéutica S.A.
Sandostatin LAR 30 mg
Gran Via de les Corts
polvo para suspensión
30 mg
Polvo y disolvente
para suspensión
Catalanes, 764
inyectable
inyectable
08013 Barcelona
Spain
Suecia
Novartis Sverige AB
Sandostatin LAR
10 mg
Polvo y disolvente
Kemistvägen 1B / Box 1150
para suspensión
183 11 Täby
inyectable
Sweden
Suecia
Novartis Sverige AB
Sandostatin LAR
20 mg
Polvo y disolvente
Kemistvägen 1B / Box 1150
para suspensión
183 11 Täby
inyectable
Sweden
Suecia
Novartis Sverige AB
Sandostatin LAR
30 mg
Polvo y disolvente
Kemistvägen 1B / Box 1150
para suspensión
183 11 Täby
inyectable
Sweden
Reino Unido
Novartis Pharmaceuticals UK
Sandostatin LAR 10mg
Ltd
powder and solvent for
10 mg
para suspensión
Frimley Business Park
suspension for injection
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
15
Polvo y disolvente
Estado
Titular de la autorización
miembro
de comercialización
Marca de fantasía
Dosis
Forma farmacéutica
Vía de
Contenido
administración
(Concentración)
Inyección
10 mg/ml
Inyección
15 mg/ml
UE/EEE
Reino Unido
Novartis Pharmaceuticals UK
Sandostatin LAR 20mg
Ltd
powder and solvent for
20 mg
Polvo y disolvente
para suspensión
Frimley Business Park
suspension for injection
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
Reino Unido
Novartis Pharmaceuticals UK
Sandostatin LAR 30mg
30 mg
Ltd
powder and solvent for
para suspensión
Frimley Business Park
suspension for injection
inyectable
Frimley, Camberley
Surrey GU16 7SR
United Kingdom
16
Polvo y disolvente
Anexo II
Conclusiones científicas y motivos para la modificación de los términos de la
autorización de comercialización
17
Conclusiones científicas
Resumen general de la evaluación científica de Sandostatin LAR y denominaciones asociadas
(ver anexo I)
Sandostatin (acetato de octreotida) es un octapéptido sintético análogo de la somatostatina, u hormona
inhibidora de la liberación de somatotropina, que ha demostrado tener propiedades farmacológicas
similares a la hormona natural. Octreotida es un potente agonista específico del receptor tipo 2 de la
somatostatina.
Sandostatin LAR es una formulación de Sandostatin con un sistema de liberación del fármaco de acción
prolongada, administrada por vía intramuscular (i.m.) una vez cada 4 semanas, desarrollada para
pacientes que necesitan un tratamiento con octreotida de larga duración. Consiste en microesferas de
acetato de octreotida; la liberación del fármaco se realiza de forma lenta, ya que el polímero se
descompone principalmente por hidrólisis.
Sandostatin LAR se registró por primera vez en Francia el 23 de junio de 1995. El actual titular de la
autorización de comercialización (TAC) de Sandostatin LAR es Novartis en 94 países de todo el mundo. En
la Unión Europea (UE) y el Espacio Económico Europeo (EEE), Sandostatin LAR está registrado mediante
procedimientos nacionales. No están registradas todas las concentraciones y formas farmacéuticas en
todos los países.
Debido a las decisiones nacionales divergentes tomadas por los Estados miembros con respecto a la
autorización de Sandostatin LAR y denominaciones asociadas, la Comisión Europea notificó a la EMA el
establecimiento de un procedimiento de arbitraje conforme al artículo 30 de la Directiva 2001/83/CE con
el fin de solucionar las diferencias en las informaciones sobre el producto (IP) autorizadas por
procedimientos nacionales para los productos arriba mencionados y, así, armonizar sus distintas IP en la
UE.
Ficha técnica o resumen de las características del producto (RCP)
Sección 4.1 - Indicaciones terapéuticas
Acromegalia
La indicación en la acromegalia está aprobada actualmente en todos los Estados miembros de la UE,
respaldada por un cierto número de ensayos clínicos realizados para evaluar la farmacocinética,
farmacodinámica, tolerabilidad (en respuesta a dosis únicas y repetidas), seguridad y eficacia de
Sandostatin LAR.
Tratamiento de pacientes con síntomas asociados a tumores funcionales del sistema endocrino
gastroenteropancreático (GEP)
El programa de ensayos clínicos de Sandostatin LAR en tumores GEP consistió en un estudio clínico
controlado para el registro, realizado en pacientes con síndrome carcinoide maligno. El estudio demostró
que Sandostatin era eficaz para controlar los síntomas en pacientes con síndrome carcinoide maligno. Las
directrices de la European Neuroendocrine Tumour Society (ENETS) sobre el tratamiento de los tumores
neuroendocrinos pancreáticos funcionales señalan que los análogos de la somatostatina son eficaces para
el control de los síntomas, especialmente en pacientes con vipomas, tumores productores de GRF y
glucagonomas. Los resultados de un análisis de la literatura científica indican que Sandostatin LAR es
también una opción terapéutica importante para subgrupos de pacientes con gastrinoma/síndrome de
Zollinger-Ellison, cuyas opciones son limitadas.
Como en el caso de Sandostatin, se ha mantenido en esta sección una amplia indicación GEP, aunque los
resultados y conclusiones respecto a la seguridad y eficacia de Sandostatin en los tumores GEP arriba
mencionados se exponen en el texto armonizado propuesto de la sección 5.1 (Propiedades
farmacodinámicas) del RCP.
18
Tratamiento de pacientes con tumores neuroendocrinos (TNE) avanzados del intestino medio
Conforme a los resultados publicados del estudio PROMID 1 y las revisiones de Novartis, el CHMP consideró
que la indicación para el tratamiento de TNE avanzados del intestino medio es aceptable. Dado que en el
estudio PROMID, como parte de los criterios de inclusión, se descartaron las localizaciones primarias en el
tórax, el páncreas u otros sitios y se excluyeron mediante TAC o RMN, el redactado de la indicación
propuesta descarta otras localizaciones primarias distintas del intestino medio para los TNE de origen
desconocido.
Tratamiento de adenomas hipofisarios secretores de hormona estimulante del tiroides (TSH)
El TAC ha presentado 1 estudio prospectivo y abierto que evaluaba la eficacia y seguridad de Sandostatin
LAR en pacientes con adenomas hipofisarios secretores de TSH para respaldar esta indicación. Se
demostró que Sandostatin LAR era seguro y bien tolerado en pacientes con tumores productores de TSH.
Otra bibliografía científica complementaria presentada también destacaba el beneficio de Sandostatin LAR
para reducir la secreción de TSH por los adenomas hipofisarios secretores de TSH, con una reducción de
los niveles de hormonas tiroideas. En algunos casos también se ha notificado una reducción del tamaño
del tumor.
La indicación propuesta aceptada por el CHMP incluyó el uso de Sandostatin LAR en diferentes contextos
de la práctica clínica; es decir, cuando no se ha normalizado la secreción tras la cirugía y/o la
radioterapia, en pacientes en los que no está indicada la cirugía y en pacientes irradiados hasta que la
radioterapia resulte efectiva.
Sección 4.2 - Posología y forma de administración
Se ha propuesto recomendaciones posológicas para cada una de las indicaciones armonizadas presentadas
más arriba, que han sido aceptadas por el CHMP.
No se han recomendado ajustes de la dosis en pacientes de edad avanzada. El texto armonizado
propuesto para el uso en niños sigue el redactado acordado basado en el informe de evaluación final para
los estudios pediátricos presentados de acuerdo con el artículo 45 del Reglamento (CE) nº 1901/2006. En
pacientes con cirrosis hepática, la semivida del fármaco puede aumentar, por lo que se requerirían ajustes
para el mantenimiento posológico. No se consideraron necesarios ajustes posológicos de Sandostatin
basados en la función renal.
Como se indica en el RCP, se recomienda la inyección intramuscular como método de administración.
Sección 4.3 - Contraindicaciones
La única contraindicación propuesta fue la hipersensibilidad a octreotida o a alguno de los excipientes, lo
cual fue aceptado por el CHMP.
Sección 4.4 - Advertencias y precauciones especiales de empleo
Se han señalado, con los encabezados pertinentes, advertencias relativas a bradicardia, reducción de la
contractilidad de la vesícula biliar y formación de cálculos biliares, efectos sobre la regulación de la
glucosa y alteraciones de la absorción de grasas de la dieta y los niveles de vitamina B12.
También se han incluido en esta sección declaraciones sobre la restauración de la fertilidad tras el
tratamiento con octreotida en pacientes de sexo femenino con acromegalia y sobre la necesidad de
utilizar un método anticonceptivo adecuado en las mujeres en edad fértil, así como de vigilar las
1
Rinke A, Muller H-H, Schade-Brittinger C et al (2009). Placebo-controlled, double-blind, prospective, randomized
study of the effect of Octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut
tumors: A report from the PROMID study group. J Clin Oncol; 27:4656-4663.
19
funciones hepática y tiroidea y de hacer un seguimiento general en caso de tumores hipofisarios
secretores de hormona del crecimiento (GH).
Sección 4.5 - Interacción con otros medicamentos y otras formas de interacción
Octreotida reduce la absorción intestinal de ciclosporina y retarda la de cimetidina. La administración
concomitante de octreotida y bromocriptina aumenta la biodisponibilidad de la bromocriptina. Ciertos
datos publicados indican que los análogos de somatostatina podrían disminuir el aclaramiento metabólico
de las sustancias que se sabe se metabolizan mediante las enzimas del citocromo P450.
También se ha incluido la necesidad de ajustar las dosis de medicamentos antidiabéticos (tanto insulina
como fármacos hipoglucemiantes para la diabetes tipo II), betabloqueantes, antagonistas del calcio o
agentes para controlar el equilibrio de líquidos y electrolitos, cuando se coadministran con octreotida.
Sección 4.6 - Fertilidad, embarazo y lactancia
Se han modificado las recomendaciones sobre el uso de octreotida durante el embarazo, de acuerdo con
el anexo I de la Directriz del CHMP relativa a la evaluación de los riesgos de los medicamentos sobre la
reproducción humana y la lactancia: desde los datos hasta el etiquetado (EMEA/CHMP/203927/2005).
Se han incluido datos relativos a la exposición a octreotida durante el embarazo, tras una búsqueda en la
base de datos de Novartis. También se ha añadido en esta sección un párrafo relativo a «Fertilidad».
Sección 4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de octreotida sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Sin embargo, no puede descartarse que alguna de las reacciones adversas del fármaco pueda, en ciertos
casos, aumentar el riesgo de accidentes de circulación o de accidentes al utilizar máquinas. Esto ha
quedado adecuadamente reflejado en la esta sección del RCP.
Sección 4.8 – Reacciones adversas
Las reacciones adversas notificadas con más frecuencia son trastornos gastrointestinales (que disminuyen
al continuar con el tratamiento), trastornos del sistema nerviosos, trastornos hepatobiliares y trastornos
del metabolismo y la nutrición.
Las reacciones adversas más frecuentes notificadas durante el tratamiento con octreotida en los ensayos
clínicos fueron diarrea, dolor abdominal, náuseas, flatulencia, cefaleas, colelitiasis, hiperglucemia,
estreñimiento y reacciones en el lugar de la inyección (como dolor, quemazón, enrojecimiento,
hematoma, hemorragia, picor o hinchazón).
Otras reacciones adversas notificadas con frecuencia fueron mareos, dolor localizado, barro biliar,
disfunción tiroidea, heces blandas, alteración de la tolerancia a la glucosa, vómitos, astenia e
hipoglucemia.
También se han incluido las reacciones adversas notificadas de forma espontánea tras la
comercialización.
Sección 4.9 – Sobredosis
El único acontecimiento adverso notificado tras un número limitado de casos de sobredosis accidentales
con Sandostatin LAR fue sofocos. En los pacientes oncológicos que reciben dosis más altas de las
recomendadas, se han notificado con frecuencia los siguientes acontecimientos adversos: problemas de
micción, fatiga, depresión, ansiedad y falta de concentración. El tratamiento de las sobredosis debe ser
sintomático.
20
Sección 5.1 - Propiedades farmacodinámicas
El redactado propuesto en relación con la indicación de acromegalia se consideró aceptable añadiendo un
texto para señalar la necesidad de no retrasar la intervención quirúrgica en pacientes con adenomas
hipofisarios secretores de GH operables.
La información relativa a los tumores GEP se ha presentado y agrupado según los distintos tipos de
tumores: tumores carcinoides, vipomas, glucagonomas, gastrinomas/síndrome de Zollinger-Ellison e
insulinomas, para el control preoperatorio de la hipoglucemia. Se ha actualizado el texto propuesto en
relación con los gastrinomas/síndrome de Zollinger-Ellison, en línea con el texto utilizado para
Sandostatin.
Se ha eliminado de esta sección del RCP la información relativa a los tumores productores de GRF, ya que
no hay pruebas suficientes que respalden el uso de Sandostatin LAR en este tipo de tumores.
Se consideró aceptable el texto propuesto en el estudio PROMID, incluyendo el diseño del estudio, el
análisis de los datos y los resultados que demuestran que Sandostatin LAR inhibe el crecimiento del
tumor en pacientes con tumores neuroendocrinos avanzados del intestino medio.
También se consideró aceptable la información sobre las pruebas que respaldan el uso de Sandostatin
LAR en el tratamiento de adenomas hipofisarios secretores de TSH.
Sección 5.2 - Propiedades farmacocinéticas
El perfil farmacocinético de octreotida tras la inyección de Sandostatin LAR refleja el perfil de liberación a
partir de la matriz de polímero y su biodegradación. Una vez liberada en el torrente sanguíneo, octreotida
se distribuye según sus conocidas propiedades farmacocinéticas, tal como se describen para la
administración subcutánea.
También se detallan en esta sección las concentraciones séricas de octreotida tras una sola inyección y
múltiples inyecciones i.m. (en la acromegalia y los tumores carcinoides).
Sección 5.3 – Datos preclínicos sobre seguridad
Los estudios de toxicidad aguda y por dosis repetidas, genotoxicidad, carcinogénesis y toxicidad para la
reproducción en animales no han mostrado ningún problema de seguridad específico para los seres
humanos. Los estudios de reproducción en animales no han revelado efectos teratógenos, embriofetales o
de otro tipo debidos a octreotida, aunque se observó cierto retraso en el crecimiento fisiológico de las
crías de rata, que fue pasajero y atribuido a la inhibición de la GH.
Prospecto
Cuando los cambios en el RCP son importantes para el usuario, se han reflejado también en el prospecto
y cuentan con el visto bueno del CHMP.
Los resultados de la comprobación de la legibilidad para el público por lo que se refiere a Sandostatin se
han utilizado como base para Sandostatin LAR.
Motivos para la modificación de los términos de las autorizaciones de comercialización
Considerando que
•
el Comité ha examinado el arbitraje de conformidad con el artículo 30 de la Directiva
2001/83/CE;
•
el Comité ha estudiado las divergencias encontradas para Sandostatin LAR y denominaciones
asociadas respecto a las indicaciones terapéuticas, posología y forma de administración, así como
en las restantes secciones del RCP;
21
•
el Comité ha revisado la información presentada por el TAC, procedente de estudios clínicos,
artículos publicados en la literatura médica y experiencia acumulada sobre la seguridad con
Sandostatin LAR comunicada por el propio TAC, para justificar la armonización de la información
sobre el producto propuesta;
•
el Comité está de acuerdo en la armonización del resumen de las características del producto, el
etiquetado y el prospecto, propuesta y debatida por el titular de la autorización de
comercialización.
El CHMP ha recomendado la modificación de los términos de las autorizaciones de comercialización, a
cuyo efecto se incluyen en el anexo III el resumen de las características del producto, el etiquetado y el
prospecto para Sandostatin y denominaciones asociadas (ver anexo I).
22
Anexo III
Ficha técnica o resumen de las características del producto,
etiquetado y prospecto
Nota:
Esta Ficha Técnica o Resumen de las Características del Producto, etiquetado y prospecto es el resultado
del procedimiento de arbitraje al que se refiere esta decisión de la Comisión.
Esta información del producto puede ser actualizada posteriormente por las autoridades competentes del
Estado Miembro, en colaboración con el Estado Miembro de Referencia, cuando corresponda, de acuerdo
con los procedimientos establecidos en el Capítulo 4 del Título III de la Directiva CE/2001/83.
23
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
24
1.
NOMBRE DEL MEDICAMENTO
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 10 mg polvo y disolvente para suspensión
inyectable
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 20 mg polvo y disolvente para suspensión
inyectable
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 30 mg polvo y disolvente para suspensión
inyectable
[Ver Anexo I – Para completar a nivel nacional]
2.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Para consultar la lista completa de excipientes ver sección 6.1.
[Para completar a nivel nacional]
3.
FORMA FARMACÉUTICA
[Para completar a nivel nacional]
4.
DATOS CLÍNICOS
4.1
Indicaciones terapéuticas
Tratamiento de pacientes con acromegalia para los que la cirugía no es adecuada o no es eficaz, o en el
periodo intermedio hasta que la radioterapia sea completamente eficaz (ver sección 4.2).
Tratamiento de pacientes con síntomas asociados con tumores gastroenteropancreáticos funcionales p.ej.
tumores carcinoides con características del síndrome carcinoide (ver sección 5.1).
Tratamiento de pacientes con tumores neourendocrinos avanzados del intestino o tumor primario de origen
desconocido donde se han excluido los lugares de origen no intestinal.
Tratamiento de adenomas de la pituitaria secretores de TSH:
•
cuando la secreción no se ha normalizado después de la cirugía y/o la radioterapia;
•
en pacientes para los que la cirugía no es adecuada;
•
en pacientes irradiados, hasta que la radioterapia sea eficaz.
4.2
Posología y forma de administración
Posología
Acromegalia
Se recomienda iniciar el tratamiento con la administración de 20 mg de Sandostatin LAR a intervalos de
4 semanas durante 3 meses. Los pacientes en tratamiento con Sandostatin s.c. pueden iniciar el tratamiento
con Sandostatin LAR el día después de la última dosis de Sandostatin s.c.. El posterior ajuste de dosis se
debe basar en las concentraciones séricas de la hormona de crecimiento (GH) y del factor de crecimiento I
tipo insulina/somatomedina C (IGF-1) y en los síntomas clínicos.
Para los pacientes que, durante este periodo de 3 meses, los síntomas clínicos y los parámetros bioquímicos
(GH; IGF-1) no estén totalmente controlados (concentraciones de GH todavía por encima de
2,5 microgramos/L), se puede aumentar la dosis a 30 mg cada 4 semanas. Si después de 3 meses, GH, IGF-1,
25
y/o los síntomas no están adecuadamente controlados a una dosis de 30 mg, se puede aumentar la dosis a
40 mg cada 4 semanas.
Los pacientes con concentraciones de GH por debajo de 1 microgramo/L de forma continuada, con
concentraciones séricas de IGF-1 normalizadas, y en los que la mayoría de signos/síntomas reversibles de la
acromegalia hayan desaparecido después de 3 meses de tratamiento con 20 mg, se puede administrar 10 mg
de Sandostatin LAR cada 4 semanas. Sin embargo, especialmente en este grupo de pacientes, es
recomendable controlar estrechamente las concentraciones séricas de GH e IGF-1, y los signos/síntomas
clínicos a esta dosis baja de Sandostatin LAR.
Para pacientes en una dosis estable de Sandostatin LAR, se debe realizar una evaluación de GH e IGF-1
cada 6 meses.
Tumores endocrinos gastroenteropancreaticos
Tratamiento de pacientes con síntomas asociados con tumores neuroendocrinos gastroenteropancreaticos
funcionales
Se recomienda iniciar el tratamiento con la administración de 20 mg de Sandostatin LAR a intervalos de
4 semanas. Los pacientes en tratamiento con Sandostatin s.c. deben continuar con la dosis efectiva
previamente durante 2 semanas después de la primera inyección de Sandostatin LAR.
En pacientes en los que los síntomas y los marcadores biológicos están bien controlados después de 3 meses
de tratamiento, se puede reducir la dosis a 10 mg de Sandostatin LAR cada 4 semanas.
En pacientes en los que los síntomas están controlados sólo parcialmente después de 3 meses de tratamiento,
se puede aumentar la dosis a 30 mg de Sandostatin LAR cada 4 semanas.
Para los días en los que los síntomas asociados con tumores gastroenteropancreaticos pueden aumentar
durante el tratamiento con Sandostatin LAR, se recomienda la administración adicional de Sandostatin s.c. a
la dosis anterior al tratamiento con Sandostatin LAR. Esto puede suceder principalmente los primeros
2 meses del tratamiento hasta que se alcancen las concentraciones terapéuticas de octreotida.
Tratamiento de pacientes con tumores neuroendocrinos avanzados del intestino o de origen primario
desconocido en que se han excluido los lugares de origen no intestinal
La dosis recomendada de Sandostatin LAR es de 30 mg administrados cada 4 semanas (ver sección 5.1). El
tratamiento con Sandostatin LAR para el control del tumor se debe continuar en ausencia de progresión del
tumor.
Tratamiento de adenomas secretores de TSH
El tratamiento con Sandostatin LAR se debe iniciar a la dosis de 20 mg a intervalos de 4 semanas durante
3 meses antes de considerar un ajuste de dosis. Después se ajusta la dosis en base a la TSH y la respuesta de
la hormona tiroidea.
Uso en pacientes con insuficiencia renal
La insuficiencia renal no afectó la exposición total (AUC) a octreotida cuando se administró como
Sandostatin s.c.. Por lo tanto, no es necesario un ajuste de dosis con Sandostatin LAR.
Uso en pacientes con insuficiencia hepática
En un estudio con Sandostatin administrado por vía s.c. e i.v. se demostró que la capacidad de eliminación
puede verse reducida en pacientes con cirrosis hepática, pero no en pacientes con enfermedad hepática
grasa. En algunos casos los pacientes con insuficiencia hepática pueden requerir un ajuste de dosis.
Uso en pacientes de edad avanzada
En un estudio con Sandostatin administrado s.c., no fue necesario un ajuste de dosis en pacientes de
≥65 años. Por tanto, no es necesario un ajuste de dosis en este grupo de pacientes con Sandostatin LAR.
26
Uso en niños
Existe una experiencia limitada con el uso de Sandostatin LAR en niños.
Forma de administración
Sandostatin LAR sólo se puede administrar por inyección intramuscular profunda. Se debe alternar el lugar
de inyecciones intramusculares repetidas entre el músculo glúteo izquierdo y derecho (ver sección 6.6).
4.3
Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4
Advertencias y precauciones especiales de empleo
General
Debido a que los tumores pituitarios secretores de GH pueden, en algunas ocasiones, expandirse
produciendo graves complicaciones (p.ej. defectos del campo visual), es esencial que todos los pacientes
sean controlados cuidadosamente. Si aparece evidencia de expansión del tumor, son aconsejables
procedimientos alternativos.
En mujeres con acromegalia los beneficios terapéuticos de una reducción en los niveles de la hormona del
crecimiento (GH) y de la normalización del factor de crecimiento 1 tipo insulina (IGF-1) pueden
potencialmente restaurar la fertilidad. Se debe advertir a las pacientes con posibilidad de quedarse
embarazadas que tomen las medidas anticonceptivas necesarias durante el tratamiento con octreotida (ver
sección 4.6).
En pacientes que reciben un tratamiento prolongado con octreotida se deberá controlar la función tiroidea.
Durante el tratamiento con octreotida se deberá controlar la función hepática.
Efectos cardiovasculares
Se han notificado casos frecuentes de bradicardia. Puede ser necesario ajustar la dosis de medicamentos
como beta-bloqueantes, bloqueantes de canales de calcio, o agentes para controlar el equilibrio de líquidos y
electrolitos (ver sección 4.5).
Vesícula biliar y efectos relacionados
Octreotida inhibe la secreción de colecistocinina, lo que supone una contractibilidad reducida de la vesicular
biliar y un aumento del riesgo de sedimento y de formación de cálculos. Se ha notificado el desarrollo de
cálculos biliares en un 15 a 30% de pacientes en tratamiento a largo plazo con Sandostatin s.c. La
prevalencia en la población general (de 40 a 60 años) es de alrededor del 5 al 20%. La exposición a largo
plazo a Sandostatin LAR de pacientes con acromegalia o tumores endocrinos gastroenteropancreaticos
sugiere que el tratamiento con Sandostatin LAR no aumenta la incidencia de formación de cálculos biliares,
comparado con el tratamiento s.c.. Por lo tanto, se recomienda un examen ecográfico de la vesícula biliar
antes y a intervalos de 6 meses durante el tratamiento con Sandostatin LAR. Si aparecen cálculos biliares,
estos son normalmente asintomáticos; los cálculos sintomáticos se deben tratar o bien con terapia de
disolución con ácidos biliares o con cirugía.
Metabolismo de la glucosa
Debido a su acción inhibidora sobre la hormona del crecimiento, glucagón e insulina, Sandostatin LAR
puede afectar la regulación de la glucosa. Se puede alterar la tolerancia a la glucosa postprandial. Al igual
que se ha notificado en pacientes tratados con Sandostatin s.c., en algunos casos,como consecuencia de la
administración crónica, se puede inducir un estado de hiperglucemia persistente. También se han notificado
27
casos de hipoglucemia.
En pacientes con diabetes mellitus Tipo I concomitante, es probable que Sandostatin LAR afecte la
regulación de glucosa, y se pueden reducir los requisitos de insulina. En pacientes no diabéticos y en
pacientes diabéticos de tipo II con reservas de insulina intactas, la administración de Sandostatin s.c. puede
suponer un aumento de la glucemia postprandial. Por lo tanto, se recomienda controlar la tolerancia a la
glucosa y el tratamiento antidiabético.
En pacientes con insulinomas, octreotida puede aumentar la intensidad y prolongar la duración de la
hipoglucemia, debido a su potencia superior relativa para inhibir la secreción de GH y glucagón con
respecto a insulina, y debido a la duración de acción más corta de su acción inhibitoria sobre la insulina. Se
debe controlar estrechamente a estos pacientes.
Nutrición
Octreotida puede alterar la absorción de las grasas de la dieta en algunos pacientes.
En algunos pacientes que reciben tratamiento con octreotida se ha observado una reducción del nivel de
vitamina B12 y resultados anormales en el test de Schilling. Se recomienda controlar los niveles de vitamina
B12 durante el tratamiento con Sandostatin LAR en pacientes con antecedentes de déficit de vitamina B12.
4.5
Interacciones con otros medicamentos y otras formas de interacción
Pueden ser necesarios ajustes de dosis de medicamentos como beta bloqueantes, antagonistas de canales de
calcio, o agentes que controlan el equilibrio de líquidos y electrolitos, cuando se administran de forma
concomitante con Sandostatin LAR (ver sección 4.4).
Pueden ser necesarios ajustes de dosis de insulina y medicamentos antidiabéticos cuando se administra
Sandostatin LAR de forma concomitante (ver sección 4.4).
Se ha observado que octreotida reduce la absorción intestinal de ciclosporina y retrasa la de cimetidina.
La administración concomitante de octreotida y bromocriptina aumenta la biodisponibilidad de
bromocriptina.
Datos publicados limitados indican que los análogos de somatostatina podrían disminuir el aclaramiento
metabólico de las sustancias que se sabe que se metabolizan mediante los enzimas del citocromo P450, que
puede ser debido a la supresión de la hormona del crecimiento. Dado que no se puede excluir que octreotida
pueda tener este efecto, se deben utilizar con precaución otros fármacos metabolizados principalmente por
CYP3A4 y que tienen un bajo índice terapéutico (p.ej. quinidina, terfenadina).
4.6
Fertilidad, embarazo y lactancia
Embarazo
Hay datos limitados (datos en menos de 300 embarazos) relativos al uso de octreotida en mujeres
embarazadas, y en aproximadamente un tercio de los casos se desconoce el desenlace del embarazo. La
mayoría de las notificaciones se recibieron después del uso post-comercialización de octreotida y más de un
50% de embarazos expuestos se notificaron en pacientes con acromegalia. La mayoría de mujeres se
expusieron a octreotida durante el primer trimestre del embarazo a dosis que oscilaban entre
100-1.200 microgramos/día de Sandostatin por vía s.c. o 10-40 mg/mes de Sandostatin LAR. Se notificaron
anomalías congénitas en aproximadamente un 4% de casos de embarazo, de los cuales se conoce el
desenlace. No se sospecha una relación con octreotida para estos casos.
Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad
para la reproducción (ver sección 5.3).
28
Como medida de precaución, es preferible evitar el uso de Sandostatin LAR durante el embarazo (ver
sección 4.4).
Lactancia
Se desconoce si octreotida se excreta en la leche materna. Los estudios en animales muestran que octreotida
se excreta en la leche. Las pacientes no deben amamantar durante el tratamiento con Sandostatin LAR.
Fertilidad
Se desconoce si octreotida tiene algún efecto sobre la fertilidad humana. Se observó un retraso en el
descenso de los testículos para las crías macho de madres tratadas durante la gestación y la lactancia. Sin
embargo, octreotida no alteró la fertilidad en ratas machos y hembras a dosis de hasta 1 mg/kg de peso
corporal por día (ver sección 5.3).
4.7
Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Sandostatin LAR sobre la capacidad para conducir y utilizar máquinas es nula o
insignificante. Se debe advertir a los pacientes que tengan precaución al conducir o utilizar máquinas si
presentan mareo, astenia/fatiga, o cefalea durante el tratamiento con Sandostatin LAR.
4.8
Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes notificadas durante el tratamiento con octreotida incluyen
alteraciones gastrointestinales, alteraciones del sistema nervioso, alteraciones hepatobiliares y alteraciones
del metabolismo y la nutrición.
Las reacciones adversas notificadas de forma más frecuente en los ensayos clínicos con administración de
octreotida fueron diarrea, dolor abdominal, náuseas, flatulencia, cefalea, colelitiasis, hiperglucemia y
estreñimiento. Otras reacciones adversas notificadas de forma frecuente fueron mareo, dolor localizado,
sedimento biliar, alteración tiroidea (p.ej. disminución de la hormona estimulante del tiroides [TSH],
disminución de T4 total, y disminución de T4 libre), heces líquidas, tolerancia a la glucosa alterada,
vómitos, astenia e hipoglucemia.
Lista tabulada de reacciones adversas
Las siguientes reacciones adversas, listadas en la Tabla 1, se han recogido de los ensayos clínicos con
octreotida:
Las reacciones adversas (Tabla 1) se presentan agrupadas por frecuencias, la más frecuente primero,
utilizando la siguiente convención: muy frecuentes (≥1/10); frecuentes (≥1/100, <1/10); poco frecuentes
(≥1/1.000, <1/100); raras (≥1/10.000, <1/1.000) muy raras (<1/10.000), incluyendo casos aislados. Dentro
de cada frecuencia, se ordenan las reacciones adversas en orden decreciente de gravedad.
Tabla 1
Reacciones adversas notificadas en los ensayos clínicos
Trastornos gastrointestinales
Muy frecuentes:
Frecuentes:
Trastornos del sistema nervioso
Muy frecuentes:
Frecuentes:
Diarrea, dolor abdominal, náuseas, estreñimiento, flatulencia.
Dispepsia, vómitos, hinchazón abdominal, esteatorrea, deposiciones
líquidas, coloración de las heces.
Cefalea.
Mareo.
29
Trastornos endocrinos
Frecuentes:
Hipotiroidismo, disfunción tiroidea (p.ej. disminución de TSH,
disminución de T4 total, y disminución de T4 libre).
Trastornos hepatobiliares
Muy frecuentes:
Colelitiasis.
Frecuentes:
Colecistitis, depósitos biliares, hiperbilirubinemia.
Trastornos del metabolismo y de la nutrición
Muy frecuentes:
Hiperglucemia.
Frecuentes:
Hipoglucemia, tolerancia alterada a la glucosa, anorexia.
Poco frecuentes:
Deshidratación.
Trastornos generales y alteraciones en el lugar de administración
Muy frecuentes:
Reacciones en el lugar de inyección.
Frecuentes:
Astenia.
Exploraciones complementarias
Frecuentes:
Niveles elevados de transaminasas.
Trastornos de la piel y del tejido subcutáneo
Frecuentes:
Prurito, exantema, alopecia.
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes:
Disnea.
Trastornos cardiacos
Frecuentes:
Bradicardia.
Poco frecuentes:
Taquicardia.
Postcomercialización
Las reacciones adversas notificadas de forma espontánea, presentadas en la Tabla 2, se notifican
voluntariamente y no siempre es posible establecer de forma fiable la frecuencia o la relación causal con la
exposición al fármaco.
Tabla 2
Reacciones adversas derivadas de notificaciones espontáneas
Trastornos del sistema inmunológico
Anafilaxis, alergia/reacciones de hipersensibilidad.
Trastornos de la piel y del tejido subcutáneo
Urticaria
Trastornos hepatobiliares
Pancreatitis aguda, hepatitis aguda sin colestasis, hepatitis colestásica, colestasis, ictericia, ictericia
colestásica.
Trastornos cardiacos
Arritmias.
Exploraciones complementarias
Aumento del nivel de fosfatasa alcalina, aumento del nivel de gama glutamil transferasa.
Descripción de reacciones adversas seleccionadas
Trastornos gastrointestinales
En raras ocasiones, las reacciones adversas gastrointestinales pueden parecer una obstrucción intestinal
aguda con distensión abdominal progresiva, dolor epigástrico intenso, sensibilidad abdominal y resistencia.
Se sabe que la frecuencia de las reacciones adversas gastrointestinales disminuye a lo largo del tiempo con
el tratamiento adecuado.
Reacciones en el lugar de inyección
Se notificaron de forma frecuente reacciones asociadas al lugar de inyección que incluyen dolor, quemazón,
enrojecimiento, hematoma, hemorragia, prurito o hinchazón en pacientes que reciben Sandostatin LAR; sin
30
embargo, estos efectos no requirieron ninguna intervención clínica en la mayoría de los casos.
Trastornos del metabolismo y de la nutrición
Aunque puede aumentar la excreción medible de la grasa fecal, no existe evidencia hasta la fecha de que el
tratamiento a largo plazo con octreotida produzca una deficiencia nutricional debida a una malabsorción.
Enzimas pancreáticas
En casos muy raros, se ha notificado pancreatitis aguda durante las primeras horas o días del tratamiento con
Sandostatin s.c. y revirtieron con la retirada del fármaco. Además, se ha descrito pancreatitis inducida por
colelitiasis en pacientes en tratamiento prolongado con Sandostatin s.c..
Trastornos cardiacos
En pacientes acromegálicos y en pacientes con síndrome carcinoide se han observado cambios en el ECG
como prolongación del intervalo QT, desviaciones de los ejes, repolarización precoz, voltaje bajo, transición
R/S, progresión precoz de la onda R, cambios no específicos de la onda ST-T. No se ha establecido la
relación de estos acontecimientos con octreotida acetato, debido a que muchos de estos pacientes tienen
enfermedades cardiacas subyacentes (ver sección 4.4).
4.9
Sobredosis
Se han notificado un número limitado de casos de sobredosis accidentales de Sandostatin LAR. Las dosis
oscilaron entre 100 mg y 163 mg/mes de Sandostatin LAR. El único efecto adverso notificado fueron
sofocos.
Se han notificado casos de pacientes con cáncer que recibieron dosis de Sandostatin LAR de hasta
60 mg/mes y de hasta 90 mg/2 semanas. Estas dosis fueron en general bien toleradas; sin embargo se
notificaron las siguientes reacciones adversas: micción frecuente, fatiga, depresión, ansiedad, y falta de
concentración.
El tratamiento de la sobredosis es sintomático.
5.
PROPIEDADES FARMACOLÓGICAS
5.1
Propiedades farmacodinámicas
Grupo farmacoterapéutico: Somatostatina y análogos, código ATC: H01CB02
Octreotida es un octapéptido sintético derivado de la somatostatina de origen natural con efectos
farmacológicos similares, pero con una duración de acción considerablemente superior. Inhibe la secreción
aumentada patológicamente de la hormona de crecimiento (GH) y de los péptidos y la serotonina producidos
en el sistema endocrino GEP.
En animales, octreotida es un inhibidor más potente de la liberación de GH, glucagón e insulina que la
somatostatina, con una mayor selectividad para la supresión de GH y glucagón.
En individuos sanos, octreotida, como somatostatina, ha mostrado inhibición de:
•
liberación de GH estimulada por arginina, ejercicio e hipoglucemia inducida por insulina,
•
liberación postprandial de insulina, glucagón, gastrina, otros péptidos del sistema endocrino GEP, y
liberación de insulina y glucagón,
•
respuesta de la hormona estimulante del tiroides (TSH) inducida por la hormona liberadora de la
tirotropina (TRH).
A diferencia de la somatostatina, octreotida inhibe la secreción de GH preferentemente sobre la insulina y su
administración no está seguida por una hipersecreción de hormonas de rebote (p.ej. GH en pacientes con
acromegalia).
31
En pacientes con acromegalia, Sandostatin LAR, una formulación galénica de octreotida adecuada para la
administración repetida a intervalos de 4 semanas, libera concentraciones séricas de octreotida constantes y
terapéuticas, disminuyendo de forma consistente la GH y normalizando las concentraciones séricas IGF 1
en la mayoría de pacientes. En la mayoría de pacientes, Sandostatin LAR reduce notablemente los síntomas
clínicos de la enfermedad, como cefalea, transpiración, parestesia, fatiga, osteoartralgia y síndrome del túnel
carpiano. En pacientes con acromegalia no tratados previamente con adenoma pituitario secretor de GH, el
tratamiento con Sandostatin LAR supuso una reducción del volumen del tumor de >20% en una proporción
significativa (50%) de pacientes.
En pacientes individuales con adenoma pituitario secretor de GH, se ha notificado que Sandostatin LAR
condujo a una disminución del tamaño del tumor (antes de la cirugía). Sin embargo, no se debe retrasar la
cirugía.
En pacientes con tumores funcionales del sistema endocrino gastroenteropancreatico, el tratamiento con
Sandostatin LAR aporta un control continuado de los síntomas relacionados con la enfermedad subyacente.
El efecto de octreotida en diferentes tipos de tumores gastroenteropancreaticos es el siguiente:
Tumores carcinoides
La administración de octreotida puede producir una mejoría de los síntomas, especialmente de los sofocos y
la diarrea. En muchos casos, esto está acompañado por una disminución en la serotonina plasmática y una
reducción de la excreción urinaria de ácido 5-hidroxiindol acético.
VIPomas
La característica bioquímica de estos tumores es la sobreproducción de péptido intestinal vasoactivo (VIP).
En la mayoría de casos, la administración de octreotida produce un alivio de la diarrea secretora grave típica
de esta situación, con la consiguiente mejoría en la calidad de vida. Esto va acompañado por una mejoría de
las alteraciones electrolíticas asociadas, p.ej. hipocalemia, permitiendo la retirada de líquidos enterales y
parenterales y suplementos de electrolitos. En algunos pacientes, la tomografía computerizada sugiere un
retraso o una parada en la progresión del tumor o incluso una reducción del tumor, particularmente de las
metástasis hepáticas. La mejoría clínica normalmente está acompañada por una reducción en los niveles
plasmáticos de VIP, que pueden descender hasta los valores de referencia normales.
Glucagonomas
La administración de octreotida produce en la mayoría de los casos una mejoría relevante de la urticaria
migratoria necrolítica que es característica de esta situación. El efecto de octreotida sobre el estado de la
diabetes mellitus moderada que frecuentemente aparece, no es muy marcada y, en general, no supone una
reducción de los requisitos de insulina o de agentes antidiabéticos orales. Octreotida produce una mejoría de
la diarrea, y por tanto aumento de peso, en los pacientes afectados. Aunque la administración de Sandostatin
produce frecuentemente una reducción inmediata en los niveles de glucagón plasmático, esta disminución no
se mantiene generalmente durante un periodo prolongado de administración, a pesar de la mejoría
sintomática continuada.
Gastrinomas/síndrome Zollinger-Ellison
El tratamiento con inhibidores de la bomba de protones o con agentes bloqueantes del receptor H2
generalmente controla la hipersecreción ácida gástrica. Sin embargo, la diarrea, que es un síntoma
importante, puede que no se alivie adecuadamente con inhibidores de la bomba de protones o agentes que
bloquean receptores H2. Sandostatin LAR puede ayudar en la reducción mayor de la hipersecreción ácida
gástrica y mejorar los síntomas, incluyendo diarrea, ya que supone una supresión de niveles de gastrina
elevados, en algunos pacientes.
32
Insulinomas
La administración de octreotida produce una disminución de la insulina inmunoreactiva circulante. En
pacientes con tumores operables, octreotida puede ayudar a restaurar y mantener la normoglucemia precirugía. En pacientes con tumores benignos o malignos no operables, se puede mejorar el control glucémico
sin una reducción concomitante sostenida en los niveles de insulina circulante.
Tumores neuroendocrinos avanzados del intestino o de origen primario desconocido donde se han excluido
los lugares de origen que no son del intestino.
Un estudio de Fase III, aleatorizado, doble ciego, controlado con placebo (PROMID) demostró que
Sandostatin LAR inhibe el crecimiento del tumor en pacientes con tumores neuroendocrinos avanzados del
intestino.
Se aleatorizaron 85 pacientes para recibir tratamiento con Sandostatin LAR 30 mg cada 4 semanas (n=42) o
placebo (n=43) durante 18 meses, o hasta la progresión del tumor o muerte.
Los principales criterios de inclusión fueron: no haber recibido tratamiento previo; confirmación
histológica; localmente inoperable o metastásico bien diferenciado; tumores/carcinomas neuroendocrinos
activos funcionalmente o inactivos; con tumor primario localizado en el intestino o de origen desconocido
que se cree que pueda ser de origen intestinal si se ha excluido un tumor primario en el páncreas, el tórax o
en alguna otra localización.
La variable principal fue tiempo hasta la progresión del tumor o muerte relacionada con el tumor (TTP).
En la población de análisis por intención de tratar (ITT) (todos los pacientes aleatorizados), se observaron
26 y 41 muertes por progresión o relacionadas con el tumor en los grupos de Sandostatin LAR y placebo,
respectivamente (HR = 0,32; IC95% , 0,19 a 0,55; valor p =0,000015).
En la población de análisis por ITT conservador (ITTc) en la que 3 pacientes fueron censurados en la
aleatorización, se observaron 26 y 40 muertes por progresión o relacionadas con el tumor en los grupos de
Sandostatin LAR y placebo, respectivamente (HR= 0,34; IC95%, 0,20 a 0.59; valor p=0,000072; Fig 1). La
mediana de tiempo hasta la progresión del tumor fue de 14,3 meses (IC95%, 11,0 a 28,8 meses) en el grupo
de Sandostatin LAR y 6,0 meses (IC95%, 3,7 a 9,4 meses) en el grupo de placebo.
En la población de análisis por protocolo (PP) en el que se censuraron pacientes adicionales al final del
tratamiento del ensayo, se observaron muertes por progresión de tumor o relacionadas con el tumor en 19 y 38
pacientes que recibían Sandostatin LAR y placebo, respectivamente (HR = 0,24; IC95% , 0,13 a 0,45; valor p
=0,0000036).
33
Figura 1
Valores Kaplan-Meier estimados de TTP comparando Sandostatin LAR con placebo
(población ITT conservadora)
Proporción de pacientes
Placebo: 40 eventos
Mediana 6,0 meses
Octreotida LAR 26 eventos
Mediana 14,3 meses
Tiempo desde la aleatorización (meses)
Pacientes
a riesgo
Test Logrank estratificado por actividad funcional: p=0,000072, HR= 0,34 [IC95%: 0,20-0,59]
Tabla 3
Resultados TTP por poblaciones de análisis
Eventos TTP
ITT
Sandostatin
LAR
26
Mediana de meses TTP [I.C. 95%
]
Placebo
41
Sandostatin
LAR
NR
HR [I.C. 95%]
Valor p *
Placebo
NR
0,32
[95% CI, 0,19 a
0,55] P=0,000015
cITT
26
40
14.3
6.0
0,34
[IC95%, 11,0
[IC95%, 3,7 a
[IC95%, 0,20 a 0,59]
a 28,8]
9,4]
P=0,000072
PP
19
38
NR
NR
0,24
[IC95%, 0,13 a 0,45]
P=0,0000036
NR=no reportado; HR=hazard ratio; TTP=tiempo hasta la progresión del tumor; ITT=intención
de tratar; cITT=ITT conservador; PP=por protocolo
*Test Logrank estratificado por actividad funcional
El efecto del tratamiento fue similar en pacientes con tumores activos funcionalmente (HR = 0,23; IC95%,
0,09 a 0,57) y con tumores inactivos (HR = 0,25; IC95%, 0,10 a 0,59).
Después de 6 meses de tratamiento, se observó enfermedad estable en un 66% de pacientes en el grupo de
Sandostatin LAR y 37% de pacientes en el grupo de placebo.
En base al beneficio clínico significativo de Sandostatin LAR observado en este análisis intermedio
preestablecido se interrumpió el reclutamiento.
La seguridad de Sandostatin LAR en este ensayo fue consistente con el perfil de seguridad ya establecido.
34
Tratamiento de adenomas pituitarios secretores de TSH
Sandostatin LAR, en inyección i.m. cada 4 semanas, ha mostrado que suprime las hormonas tiroideas
elevadas, para normalizar la TSH y para mejorar los signos y síntomas clínicos del hipertiroidismo en
pacientes con adenomas secretores de TSH. Los efectos del tratamiento de Sandostatin LAR consiguieron
significación estadística respecto al valor basal después de 28 días y un beneficio del tratamiento continuado
durante hasta 6 meses.
5.2
Propiedades farmacocinéticas
Después de inyecciones i.m. únicas de Sandostatin LAR, las concentraciones plasmáticas de octreotida
alcanzan un pico inicial transitorio 1 hora después de la administración, seguido de una disminución
progresiva hasta un nivel de octreotida indetectable al cabo de 24 horas. Después de este pico inicial en el
día 1, octreotida se mantiene en niveles subterapéuticos en la mayoría de pacientes durante los 7 días
siguientes. Posteriormente, las concentraciones de octreotida aumentan de nuevo, y alcanzan un nivel meseta
alrededor del día 14 y se mantienen relativamente constantes durante 3 a 4 semanas. El nivel del pico
durante el día 1 es inferior a los niveles durante la fase meseta y durante el día 1 no se produce más del 0,5%
de la liberación total del fármaco. Después del día 42 aproximadamente, las concentraciones de octreotida
disminuyen lentamente, coincidiendo con la fase de degradación terminal de la matriz del polímero de la
forma farmacéutica.
En pacientes con acromegalia, las concentraciones meseta después de dosis únicas de 10 mg, 20 mg y 30 mg
de Sandostatin LAR alcanzan 358 ng/L, 926 ng/L, y 1.710 ng/L, respectivamente. Las concentraciones
séricas de octreotida en estado estacionario, tras 3 inyecciones a intervalos de 4 semanas, son superiores en
un factor de aproximadamente 1,6 a 1,8 y suponen 1.557 ng/L y 2.384 ng/L después de inyecciones
múltiples de 20 mg y 30 mg de Sandostatin LAR, respectivamente.
En pacientes con tumores carcinoides, la media (y mediana) de las concentraciones séricas de octreotida en
el estado estacionario después de inyecciones múltiples de 10 mg, 20 mg y 30 mg de Sandostatin LAR
administradas a intervalos de 4 semanas también aumentaron linealmente con la dosis y fueron
1.231 (894) ng/L, 2.620 (2.270) ng/L y 3.928 (3,010) ng/L, respectivamente.
No se produjo acumulación de octreotida fuera de lo esperado de los perfiles de liberación superpuestos
durante un periodo de hasta 28 inyecciones mensuales de Sandostatin LAR.
El perfil farmacocinético de la octreotida después de la inyección de Sandostatin LAR refleja el perfil de
liberación de la matriz del polímero y su biodegradación. Una vez liberada en la circulación sistémica, la
octreotida se distribuye de acuerdo con sus propiedades farmacocinéticas conocidas, como se han descrito
para la administración subcutánea. El volumen de distribución de la octreotida en estado estacionario es de
0,27 l/kg y el aclaramiento total de 160 ml/min. La unión a proteínas plasmáticas asciende al 65% y
fundamentalmente no hay fármaco unido a las células sanguíneas.
En pacientes pediátricos, de 7 a 17 años de edad, con obesidad hipotalámica que recibían Sandostatin LAR
40 mg una vez al mes, se obtuvieron datos farmacocinéticos a partir de la extracción limitada de muestras de
sangre que mostraron medias de las concentraciones plasmáticas valle de octreotida de 1395 ng/L tras la
primera inyección y de 2973 ng/L en el estado estacionario. Se observó una elevada variabilidad
interindividual.
Las concentraciones plasmáticas valle en el estado estacionario no correlacionaban con la edad y con el
IMC, pero si correlacionaron moderadamente con el peso corporal (52,3–133 kg) y fueron
significativamente diferentes entre hombres y mujeres, es decir aproximadamente un 17% superiores para la
población de pacientes femenina.
35
5.3
Datos preclínicos sobre seguridad
Estudios en animales de toxicología aguda y de dosis repetidas, de genotoxicidad, carcinogenicidad y
toxicología de la reproducción revelaron que no existe ningún tema de seguridad específico para humanos.
Los estudios de reproducción en animales no revelaron ninguna evidencia de efectos teratogénicos,
embriofetales u otros efectos sobre la reproducción debidos a octreotida a dosis en los progenitores de hasta
1 mg/kg/día. Se observó algún retraso en el crecimiento fisiológico de las crías de las ratas que fue
transitorio y atribuible a la inhibición de GH originada por un exceso de actividad farmacodinámica (ver
sección 4.6).
No se llevaron a cabo estudios específicos en ratas jóvenes. En los estudios de desarrollo pre y post natal, se
observó una reducción en el crecimiento y la maduración en las crías F1 de madres a las que se administró
octreotida durante el embarazo completo y el periodo de lactancia. Se observó un retraso en el descenso de
los testículos para las crías F1 macho, pero se mantuvo normal la fertilidad de las crías F1 macho afectadas.
Por tanto, las observaciones mencionadas anteriormente fueron transitorias y se consideraron consecuencia
de una inhibición de la GH.
6.
DATOS FARMACÉUTICOS
6.1
Lista de excipientes
[Para completar a nivel nacional]
6.2
Incompatibilidades
[Para completar a nivel nacional]
6.3
Periodo de validez
[Para completar a nivel nacional]
6.4
Precauciones especiales de conservación
[Para completar a nivel nacional]
6.5
Naturaleza y contenido del envase
[Para completar a nivel nacional]
6.6
Precauciones especiales de eliminación <y otras manipulaciones>
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él,
se realizará de acuerdo con la normativa local.
[Para completar a nivel nacional]
7.
TITULAR DE LA AUTORIACIÓN DE COMERCIALIZACIÓN
[Ver Anexo I – Para completar a nivel nacional]
36
8.
NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN)
[Para completar a nivel nacional]
9.
FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
[Para completar a nivel nacional]
10.
FECHA DE LA REVISIÓN DEL TEXTO
[Para completar a nivel nacional]
La información detallada de este medicamento está disponible en la página web de {nombre del Estado
Miembro/Agencia}
37
ETIQUETADO
38
INFORMACIÓN QUE DEBE FIGURAR EN < EL EMBALAJE EXTERIOR > <Y> <EL
ACONDICIONAMIENTO PRIMARIO >
{NATURALEZA/TIPO}
1.
NOMBRE DEL MEDICAMENTO
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 10 mg polvo y disolvente para suspensión
inyectable.
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 20 mg polvo y disolvente para suspensión
inyectable.
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 30 mg polvo y disolvente para suspensión
inyectable.
[Ver Anexo I – Para completar a nivel nacional]
Octreotida
2.
PRINCIPIO(S) ACTIVO(S)
3.
LISTA DE EXCIPIENTES
[Para completar a nivel nacional]
4.
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
[Para completar a nivel nacional]
5.
FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
6.
ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA
DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7.
OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8.
FECHA DE CADUCIDAD
CAD
39
9.
CONDICIONES ESPECIALES DE CONSERVACIÓN
[Para completar a nivel nacional]
10.
PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO
CORRESPONDA)
11.
NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE
COMERCIALIZACIÓN
[Ver Anexo I – Para completar a nivel nacional]
12.
NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
[Para completar a nivel nacional]
13.
NÚMERO DE LOTE
Lote
14.
CONDICIONES GENERALES DE DISPENSACIÓN
[Para completar a nivel nacional]
15.
INSTRUCCIONES DE USO
[Para completar a nivel nacional]
16.
INFORMACIÓN EN BRAILLE
[Para completar a nivel nacional]
40
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS
PRIMARIOS
{NATURALEZA/TIPO}
1.
NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
{(Denominación (de fantasía) dosis forma farmacéutica}
[Ver Anexo I – Para completar a nivel nacional]
Octreotida
Vía intramuscular
2.
FORMA DE ADMINISTRACIÓN
3.
FECHA DE CADUCIDAD
CAD
4.
NÚMERO DE LOTE
Lote
5.
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
[Para completar a nivel nacional]
6.
OTROS
41
PROSPECTO
42
Prospecto: información para el paciente
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 10 mg polvo y disolvente para
suspensión inyectable
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 20 mg polvo y disolvente para
suspensión inyectable
SANDOSTATIN LAR y denominaciones asociadas (ver Anexo I) 30 mg polvo y disolvente para
suspensión inyectable
[Ver Anexo I – Para completar a nivel nacional]
Octreotida
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene
información importante para usted.
Conserve este prospecto, ya que puede tener que volver a leerlo.
Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque
tengan los mismos síntomas que usted, ya que puede perjudicarles.
Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata
de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1.
Qué es Sandostatin LAR y para qué se utiliza
2.
Qué necesita saber antes de empezar a usar Sandostatin LAR
3.
Cómo usar Sandostatin LAR
4.
Posibles efectos adversos
5.
Conservación de Sandostatin LAR
6.
Contenido del envase e información adicional
1.
Qué es Sandostatin LAR y para qué se utiliza
Sandostatin LAR es un compuesto sintético derivado de la somatostatina. La somatostatina se encuentra
normalmente en el cuerpo humano, donde inhibe la liberación de algunas hormonas como la hormona del
crecimiento. Las ventajas de Sandostatin LAR respecto a somatostatina son que es más potente y sus efectos
son más duraderos.
Sandostatin LAR se utiliza
•
para tratar la acromegalia,
La acromegalia es una enfermedad en la que el cuerpo produce demasiada hormona del crecimiento.
Normalmente la hormona del crecimiento controla el crecimiento de los tejidos, los órganos y los huesos.
Un exceso de hormona del crecimiento supone un aumento en el tamaño de los huesos y los tejidos,
especialmente en las manos y los pies. Sandostatin LAR reduce notablemente los síntomas de la
acromegalia, que incluyen dolor de cabeza, exceso de sudoración, adormecimiento de las manos y los pies,
cansancio y dolor en las articulaciones. En la mayoría de los casos, la sobreproducción de hormona del
crecimiento está causada por aumento del tamaño de la glándula pituitaria (adenoma pituitario); el
tratamiento con Sandostatin LAR puede reducir el tamaño del adenoma.
Sandostatin LAR se utiliza para tratar personas que sufren acromegalia:
cuando otros tipos de tratamiento para la acromegalia (cirugía o radioterapia) no son adecuados o no
han funcionado correctamente;
después de la radioterapia, para cubrir el periodo de tiempo intermedio hasta que la radioterapia es
completamente eficaz.
•
para aliviar los síntomas asociados con la sobreproducción de algunas hormonas específicas y otras
43
sustancias relacionadas en el estómago, intestino o páncreas.
La sobre producción de unas hormonas específicas y de otras sustancias naturales relacionadas puede estar
causada por algunas alteraciones raras del estómago, intestino o páncreas. Esto altera el equilibrio hormonal
natural y provoca una serie de síntomas como sofocos, diarrea, baja tensión arterial, erupción cutánea y
pérdida de peso. El tratamiento con Sandostatin LAR ayuda a controlar estos síntomas.
•
para tratar tumores neuroendocrinos localizados en el intestino (p.ej. apéndice, intestino delgado o
colon)
Los tumores neuroendocrinos son tumores raros que se pueden encontrar en diferentes partes del cuerpo.
Sandostatin LAR también se utiliza para controlar el crecimiento de estos tumores, cuando están localizados
en el intestino (p.ej. apéndice, intestino delgado o colon)
•
para tratar tumores pituitarios que producen demasiada hormona estimulante del tiroides (TSH).
Un exceso de hormona estimulante del tiroides (TSH) provoca hipertiroidismo. Sandostatin LAR se utiliza
para tratar personas con tumores pituitarios que producen demasiada hormona estimulante del tiroides
(TSH):
cuando otros tipos de tratamiento (cirugía o radioterapia) no son adecuados o no han funcionado;
después de la radioterapia, para cubrir el periodo hasta que la radioterapia es completamente efectiva.
2.
Qué necesita saber antes de empezar a usar Sandostatin LAR
Siga todas las instrucciones que le dé su médico cuidadosamente. Pueden ser diferentes de la información
contenida en este prospecto.
Lea las siguientes indicaciones antes de utilizar Sandostatin LAR.
No use Sandostatin LAR:
si es alérgico a octreotida o a cualquiera de los demás componentes de este medicamento (incluidos
en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Sandostatin LAR:
si sabe que tiene actualmente cálculos en la vesícula biliar, o los ha tenido en el pasado; informe a su
médico, pues el uso prolongado de Sandostatin LAR puede provocar la formación de cálculos biliares.
Su médico prodría querer controlar su vesícula biliar periódicamente.
si sabe que tiene diabetes, ya que Sandostatin LAR puede afectar los niveles de azúcar en la sangre. Si
es diabético, debe controlar regularmente sus niveles de azúcar.
si tiene antecedentes de deficiencia de vitamina B12 su médico puede controlar el nivel de B12
periodicamente.
Análisis y controles
Si recibe tratamiento con Sandostatin LAR durante un periodo prolongado de tiempo, su médico puede
controlar su función tiroidea periódicamente.
Su médico controlará la función de su hígado.
Niños
Existe poca experiencia con el uso de Sandostatin LAR en niños.
Uso de Sandostatin LAR con otros medicamentos
Comunique a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar
cualquier otro medicamento.
Normalmente puede continuar tomando otros medicamentos mientes esté en tratamiento con Sandostatin
LAR. Sin embargo, se han notificado que algunos medicamentos como cimetidina, ciclosporina,
44
bromocriptina, quinidina y terfenadina se ven afectados por Sandostatin LAR.
Si está tomando un medicamento para controlar la presión arterial (p.ej. un beta bloqueante o un antagonista
de los canales del calcio) o un agente para controlar el equilibrio de líquidos y electrolitos, su médico puede
necesitar ajustar la dosis.
Si es diabético, su médico puede necesitar ajustar su dosis de insulina.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de
quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Sólo se debe utilizar Sandostatin LAR durante el embarazo si es estrictamente necesario.
Las mujeres en edad fértil deben utilizar un método anticonceptivo eficaz durante el tratamiento.
No debe dar lactancia durante el tratamiento con Sandostatin LAR. Se desconoce si Sandostatin LAR pasa a
la leche materna.
Conducción y uso de máquinas
Sandostatin LAR no tiene efectos o éstos son insignificantes sobre la capacidad de conducir o utilizar
máquinas. Sin embargo algunos de estos efectos adversos que puede sufrir durante el tratamiento con
Sandostatin LAR, como dolor de cabeza y cansancio, pueden reducir su capacidad para conducir y utilizar
máquinas de forma segura.
3.
Cómo usar Sandostatin LAR
Sandostatin LAR se debe administrar siempre como una inyección en el músculo de los glúteos. Con la
administración repetida, se debe utilizar el glúteo derecho e izquierdo alternativamente.
Si usa más Sandostatin LAR del que debe
No se han notificado reacciones adversas que suponen una amenaza vital después de una sobredosis con
Sandostatin LAR.
Los síntomas de sobredosis son: sofocos, micciones frecuentes, cansancio, depresión, ansiedad y falta de
concentración.
Si piensa que ha sufrido una sobredosis y presenta alguno de estos síntomas, informe a su médico
inmediatamente.
Si olvidó usar Sandostatin LAR
Si ha olvidado su inyección, se recomienda que se la administren tan pronto como se acuerde, y después
continuar con la pauta habitual. No va a provocarle ningún daño el hecho de recibir una dosis unos días más
tarde, pero pueden reaparecer temporalmente los síntomas hasta que vuelva a la pauta habitual de
tratamiento.
Si interrumpe el tratamiento con Sandostatin LAR
Si interrumpe su tratamiento con Sandostatin LAR pueden reaparecer sus síntomas. Por tanto, no interrumpa
el tratamiento con Sandostatin LAR a menos que se lo indique su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, enfermero o
farmacéutico.
45
4.
Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas
las personas los sufran.
Algunas reacciones adversas podrían ser graves. Informe a su médico inmediatamente si sufre alguno
de los siguientes:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
•
Cálculos biliares, que conllevan dolor de espalda repentino.
•
Demasiado azúcar en la sangre.
Frecuentes (pueden afectar hasta 1 de cada 10 personas:
•
Disminución de la actividad de la glándula tiroidea (hipotiroidismo) que causa cambios en el ritmo del
corazón, el apetito o el peso; cansancio, sensación de frío, o hinchazón en la parte de delante del
cuello.
•
Cambios en los análisis de la función tiroidea.
•
Inflamación de la vesícula biliar (colecistitis); los síntomas pueden incluir dolor en la parte superior
derecha del abdomen, fiebre, náuseas, coloración amarilla de la piel y los ojos (ictericia).
•
Muy poco azúcar en la sangre.
•
Alteración de la tolerancia a la glucosa.
•
Latido del corazón lento.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
•
Sed, baja eliminación de orina, color oscuro en la orina, piel seca enrojecida.
•
Latido del corazón rápido.
Otras reacciones adversas graves
•
Reacciones de hipersensibilidad (alérgicas) incluyendo urticaria en la piel.
•
Un tipo de reacción alérgica (anafilaxis) que causa dificultad en la respiración o mareo.
•
Una inflamación de la glándula del páncreas (pancreatitis); los síntomas pueden incluir dolor
repentino en la parte superior del abdomen, náuseas, vómitos, diarrea.
•
Inflamación del hígado (hepatitis); síntomas que pueden incluir color amarillento de la piel y los ojos
(ictericia), náuseas, vómitos, pérdida de apetito, sensación general de malestar, picor, orina
ligeramente coloreada.
•
Latido del corazón irregular.
Informe a su médico inmediatamente si nota alguno de las reacciones adversas anteriores.
Otros efectos adversos:
Informe a su médico, farmacéutico o enfermero si nota alguno de los efectos adversos enumerados a
continuación. Normalmente son leves y tienden a desaparecer al avanzar el tratamiento.
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
•
Diarrea.
•
Dolor abdominal.
•
Náuseas.
•
Estreñimiento.
•
Flatulencia (gases).
•
Dolor de cabeza.
•
Dolor local en el lugar de inyección.
Frecuentes (puede afectar hasta 1 de cada 10 personas):
•
Molestia en el estómago después de comer (dispepsia).
46
•
•
•
•
•
•
•
•
•
•
•
Vómitos.
Sensación de tener el estómago lleno.
Heces grasas.
Heces líquidas.
Cambio de color de las heces.
Mareo.
Pérdida de apetito.
Cambios en los análisis sobre la función del hígado.
Pérdida de pelo.
Dificultad para respirar.
Debilidad.
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, enfermero o farmacéutico.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de
posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a
través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos
adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento
5.
Conservación de Sandostatin LAR
[Para completar a nivel nacional]
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en <la etiqueta> <la caja> <el
frasco> <…> <envase> <después de {abreviatura de la fecha de caducidad}.> <La fecha de caducidad es el
último día del mes que se indica.>
<No utilice este medicamento si observa{descripción de signos visibles de deterioro}.>
<Los medicamentos no se deben tirar por los desagües <ni a la basura>. Pregunte a su farmacéutico cómo
deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el
medio ambiente.>
6.
Contenido del envase e información adicional
Composición de Sandostatin LAR
El(los) principio activo(s) es (son)…
Los demás componenetes <(excipientes)> son...
[Para completar a nivel nacional]
Aspecto de Sandostatin LAR y contenido del envase
[Para completar a nivel nacional]
Titular de la autorización de comercialización y responsable de la fabricación
[Ver Anexo I - Para completar a nivel nacional]
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los
siguientes nombres:
[Ver Anexo I – Para completar a nivel nacional]
47
Fecha de la última revisión de este prospecto: <{MM/AAAA}.
[Para completar a nivel nacional]
Esta información está destinada únicamente a profesionales del sector sanitario:
Cuánto Sandostatin LAR se debe utilizar
Acromegalia
Se recomienda iniciar el tratamiento con la administración de 20 mg de Sandostatin LAR a intervalos de
4 semanas durante 3 meses. Los pacientes en tratamiento con Sandostatin s.c. pueden iniciar el tratamiento
con Sandostatin LAR el día después de la última dosis de Sandostatin s.c.. El ajuste de dosis subsiguiente se
debe basar en las concentraciones séricas de la hormona del crecimiento (GH) y el factor de crecimiento 1
de tipo insulina/somatomedina C (IGF-1) y los síntomas clínicos.
Para los pacientes en los que no están controlados completamente los síntomas clínicos y los parámetros
bioquímicos (GH; IGF-1) en un periodo de 3 meses (concentraciones de GH todavía por encima de
2,5 microgramos/L), se puede aumentar la dosis a 30 mg cada 4 semanas. Si después de 3 meses, no están
controlados adecuadamente GH, IGF-1, y/o los síntomas a la dosis de 30 mg, la dosis se puede aumentar a
40 mg cada 4 semanas.
Para pacientes con concentraciones de GH que se encuentran de forma constante por debajo de
1 microgramo/L, y con concentraciones séricas de IGF-1 normalizadas, y en los cuales la mayoría de los
signos/síntomas reversibles de acromegalia han desaparecido después de 3 meses de tratamiento con 20 mg,
se pueden administrar 10 mg de Sandostatin LAR cada 4 semanas. Sin embargo, especialmente en este
grupo de pacientes, se recomienda controlar estrechamente las concentraciones séricas de GH e IGF-1, y los
signos/síntomas a esta dosis baja de Sandostatin LAR.
Para pacientes que están tratados con una dosis estable de Sandostatin LAR, la valoración de GH e IGF-1 se
debe realizar cada 6 meses.
Tumores endocrinos gastroenteropancreaticos
•
Tratamiento de pacientes con síntomas asociados con tumores neuroendocrinos
gastroenteropancreaticos funcionales
Se recomienda iniciar el tratamiento con la administración de 20 mg de Sandostatin LAR a intervalos de
4 semanas. Los pacientes en tratamiento con Sandostatin s.c. deben continuar a la dosis previamente efectiva
durante 2 semanas después de la primera inyección de Sandostatin LAR.
Para pacientes en los que los síntomas y los marcadores biológicos están bien controlados después de
3 meses de tratamiento, se puede reducir la dosis a 10 mg de Sandostatin LAR cada 4 semanas.
Para pacientes en los que los síntomas están sólo parcialmente controlados después de 3 meses de
tratamiento, se puede aumentar la dosis a 30 mg de Sandostatin LAR cada 4 semanas.
Para los días en que pueden aumentar los síntomas asociados con tumores gastroenteropancreáticos durante
el tratamiento con Sandostatin LAR, se recomienda la administración adicional de Sandostatin s.c. a la dosis
utilizada antes del tratamiento con Sandostatin LAR. Esto puede aparecer principalmente en los 2 primeros
meses de tratamiento hasta que se alcancen las concentraciones terapéuticas de octreotida.
•
Tratamiento de pacientes con Tumores Neuroendocrinos avanzados del intestino o de origen
desconocido donde se ha excluido los lugares de origen que no sean del intestino
La dosis recomendada de Sandostatin LAR es de 30 mg administrado cada 4 semanas. El tratamiento con
Sandostatin LAR para controlar el tumor se debe continuar en ausencia de progresión del tumor.
48
Tratamiento de adenomas secretores de TSH
El tratamiento con Sandostatin LAR se debe iniciar a la dosis de 20 mg a intervalos de 4 semanas durante
3 meses antes de considerar un ajuste de dosis. Después la dosis se ajusta en base de la TSH y de la
respuesta de la hormona tiroidea.
Instrucciones para administrar Sandostatin LAR
[Para completar a nivel nacional]
49