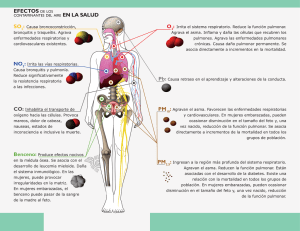
Diciembre 1999 - Archivos de Bronconeumología
Anuncio

Órgano oficial de la Sociedad Española de Neumología y Cirugía Torácica. SEPAR. Volumen 35, Número 11, Diciembre 1999 Sumario Editorial Hipoxemia arterial y hepatopatía: un reto neumológico para el próximo milenio. G.P. Martínez v R. Rodríguez Roisin Originales Análisis descriptivo (características clínicas y funcionales) de la población asmática de un área sanitaria. M..I. Espinosa di' los Monteros. A. González. /•'. Rodríguez. R. Gabriel y .1. Ancochea Utilidad de la 1'ihrobroncoscopia en el paciente crítico pediátrico. E. García García, E. Pérez Ruiz, L. Quesada Rodríguez, G. Milano Manso,./. Pérez Frías. C. Calvo Macías v A. Martínez Valverde Asma en urgencias: ¿podemos disminuir la tasa de reingresos tras el alta'.' A. Campo, .1.8. Galdiz, M. Irilierii. I. Pasca/ \ V. Sobradillo Tratamiento del tabaquismo con nebuli/ador nasal de nicotina. Resultados de un estudio multicénirico. C.A. Jiménez K t l i z , S. Florez Martín. A. Ramos Pineda. J..I. Lorza. M.A. Hernáiidez.-Mezqnita, S. Solano Reina \ M. Barrueco Ferrero Estudio comparativo de pacientes con enfermedad pulmonar obstructiva crónica con y sin síndrome de apneas obstructivas durante el sueño E. Calderón-Osuna. C. Carmena Bemol. M. Arenas Gordilio, M.A. Fuentes Pradera, A. Sánchez Armennol y F. Capote Gil Artículo especial La trampa de la gestión en medicina. Introducción a una discusión necesaria. ¡).0. Rodenstein Revisión Toxicidad pulmonar por fármacos. F. Carriol] Valoro Y .1. Marín Pardo Notas clínicas Insuficiencia respiratoria aguda como primera manifestación de lesiones del tronco cerebral. G. Juan, M. Runión. M.A. Ciscar. B. García, T. l.loret. M.A. Cen-ello v J . Marín Leiomiomatosis pulmonar benigna metaslatizantc. A propósito de tres casos. R. Pifarré, .]. ízanierdo, A. Calatrava, C. Martínez, ,/. Ruiz v./. Morera Mutación 2021 OG/A del gen de la protrombina en un paciente con trombosis venosa profunda y embolia pulmonar sin otros tactores de riesgo trombótico. P. de la Cuadra, M.D. Nauffal, A. Vaya Montana, M.A. Martínez y M. Papilla Cartas al director Quilotórax por fractura de húmero y resolución tras tratamiento conservador. /•- González Lorenzo, R- Alvarez-Sala y B. Ortega Tumor neuroectodérmico periférico de mediastino posterior en un paciente anciano. ,/. Torné. M. Castro v M.T. Peñarruhia Edema pulmonar neurogcnico tras crisis epiléptica /-). García, A. Pereira y R. Ayerlie Broncospasmo y eosinofilia en relación con la administración de fosinopril. A.B. Gómez. L. Martínez v E. Fernandez índices 1999 EDITORIAL Hipoxemia arterial y hepatopatía: un reto neumológico para el próximo milenio G.P. Martínez" y R. Rodríguez Roisin b Servéis d'"Anestesio]ogia y Reanimació i ''Pneumologia i AMérgia Respiratoria. Instituí Clínic de Pneumologia i Cirugia Torácica. Departaments de Medicina i Cirurgia. Instituí d'Investigacions Biomédiques August Pi i Sunyer (IDIBAPS). Hospital Clínic. Universitat de Barcelona. Barcelona. Cuando uno de nosotros, en 1982, se planteó junto con otros colaboradores el estudio de los mecanismos de la hipoxemia arterial del paciente cirrótico', un capítulo que no había quedado cerrado en la década anterior, nadie hubiera podido imaginar entonces que se reabría la página de la investigación de la fisiopatología cardiopulmonar de la hepatopatía crónica, línea de trabajo que atrajo también a otros equipos. Pero, sobre todo, ignorábamos que se estaban sentando los cimientos de lo que hoy en día se conoce como síndrome hepatopulmonar (SHP) y que se iban a desarrollar, además, nuevas perspectivas clínico-terapéuticas y patogenéticas acerca de las anomalías de la circulación pulmonar de la hepatopatía crónica, incluyendo la hipertensión portopulmonar, de reciente denominación. Se entiende por SHP la alteración del intercambio pulmonar de gases secundaria a una vasodilatación intrapulmonar generalizada, en el contexto de una enfermedad hepática de curso preferentemente crónico23. Un clínico alemán, Flückiger4, fue el primero en describir en 1884 el caso de una mujer joven afectada de cimosis hepática, cianosis y acropaquía digital. Desde entonces, numerosas publicaciones han tratado sobre pacientes similares en un intento de esclarecer, en primer lugar, la fisiopatología y, en segundo lugar, la patogenia de esta compleja entidad. En 1977, Kennedy y Knudson5 sugirieron el empleo de este término por primera vez, sin apenas éxito en su intento como análogo del síndrome hepatorrenal, para referirse a la presencia de hipoxemia arterial en la cirrosis hepática. A finales de la década de los ochenta, Sheila Sherlock6 lo retomó para definir llanamente la problemática de la hipoxemia arterial en la enfermedad hepática crónica. Sin embargo, la hipoxemia arterial atribuible a otros trastornos respiratorios, como el derrame pleural, la obstrucción al flujo aéreo o Subvencionado por el Fondo de Investigación Sanitaria (FIS 95/0752) y por el comissionat per a Universitats i Recerca de la Generalitat de Catalunya (1997SGR 00086). Correspondencia: Dr. R. Rodríguez Roisin. Servei de Pneumologia i AMérgia Respiratoria. Hospital Clínic. Villarroel, 170. 08036 Barcelona. Correo electrónico: [email protected] Recibido: 7-9-99; aceptado para su publicación: 7-9-99. (Arch Bronconeumol 1999; 35: 515-517) 13 la disminución de volumen pulmonar relativamente frecuentes en el enfermo hepático avanzado que suele asociar ascitis, no estaría contemplada dentro del concepto actual de SHP. En 1992, se propusieron los criterios diagnósticos2 que incluían una tríada clínica caracterizada por la presencia de una hepatopatía crónica, anomalías del intercambio pulmonar de gases (hipoxemia arterial y/o aumento del gradiente alveoloarterial de oxígeno -AaPO^-) y una ecocardiografía de contraste positiva o una gammagrafía de perfusión con captación extrapulmonar de partículas radioactivas sugestivas de vasodilatación intrapulmonar generalizada, en ausencia de enfermedad cardiopulmonar intrínseca. Otros autores3-7 han postulado, sin embargo, que el SHP podría coexistir con otros procesos respiratorios crónicos no ligados directamente a la propia hepatopatía. En este sentido, hemos sido testigos de 5 casos de SHP8 asociados a enfermedad pulmonar obstructiva crónica (EPOC), fibrosis pulmonar intersticial o miocardiopatía crónica. El estudio de los cocientes ventilación-perfusión (\^/Q) demostró que el patrón de intercambio gaseoso y hemodinámico pulmonar del síndrome se mantenía de forma característica, al margen de la coexistencia de la neumopatía o cardiopatía crónicas. En dicho contexto, la tomografía axial computarizada (TAC) torácica, sin utilidad diagnóstica en el SHP, tendría interés para ayudar a establecer la coexistencia de un proceso pulmonar intrínseco. De este modo podría establecerse la reversibilidad potencial de la hipoxemia tras el trasplante hepático, hasta ahora la única opción terapéutica que se ha demostrado realmente eficaz en pacientes con SHP9. De hecho, la asociación de hipoxemia arterial importante secundaria a un mecanismo de cortocircuito shunt intrapulmonar aumentado, con presión arterial pulmonar conservada o reducida, de curso lento, en el contexto de una hepatopatía crónica, se erige en un modelo sindrómico único en neumología. Desde el punto de vista físiopatológico pulmonar, las entidades más próximas señan la enfermedad de Rendu-Osler o telangiectasia hemorrágica hereditaria-angiopatía congénita, de presentación clínica muy característica, en la que destacarían las telangiectasias en piel y mucosas, la diátesis hemorrágica y las fístulas arteriovenosas pulmonares -y el síndrome del distrés respira515 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NÚM. 11, 1999 torio agudo (ARDS)-, cuadro de insuficiencia respiratoria aguda, catastrófica, que cursa con hipertensión pulmonar moderada o grave, cuyo difícil manejo y complejo tratamiento quedan circunscritos exclusivamente a la medicina crítica. El paciente cirrótico con SHP se caracteriza por un estado circulatorio hiperdinámico sistémico, con gasto cardíaco elevado y resistencia vascular sistémica reducida, y con una presión arterial pulmonar (PAP) normal o disminuida2, compatible con la vasodilatación generalizada de la red capilar pulmonar, cuyo diámetro es muy superior (hasta 25 veces) a los límites normalmente establecidos (entre 5 y 15 u.m). En algunos casos pueden observarse valores algo más elevados de PAP, entre 20 y 25 mmHg, atribuibles tan sólo a un aflujo sanguíneo (gasto cardíaco) aumentado, confirmado por el cálculo de la resistencia vascular pulmonar que, en cualquier caso, nunca superaría las cifras de 120 din • s • cnr5 o 1,5 mmHg/1/min. Estos hallazgos hemodinámicos no deben ser confundidos con los observados en pacientes con insuficiencia hepática avanzada e hipertensión portal que asocian una presión arterial y resistencia vascular pulmonares elevadas. Esta última situación, con implicaciones clínicas diferentes al SHP, que se acompaña de normohipoxemia o hipoxemia arterial leve, corresponde a una entidad todavía poco conocida denominada hipertensión portopulmonarlí, que se situaría en el extremo opuesto del espectro de las anomalías vasculares pulmonares ligadas al enfermo hepatópata crónico. Debe destacarse, también, que si bien la problemática respiratoria del SHP aparece casi siempre en el transcurso de una hepatopatía ya avanzada, en algunas ocasiones el síndrome puede preceder en gravedad a la clínica de la hepatopatía10, lo que dificulta el diagnóstico. A pesar de los numerosos estudios realizados, la patogenia del SHP sigue siendo una incógnita. En general, se acepta que existe un desequilibrio entre la producción o eliminación de sustancias vasoconstrictoras y vasodilatadoras y/o entre factores hepáticos que inhiben o estimulan la proliferación vascular pulmonar2'3'12. En los últimos años, las investigaciones clínicas y experimentales se han centrado en el papel del óxido nítrico (NO), molécula con potente acción vasodilatadora13'15. Se ha demostrado que, en presencia de disfunción hepática, existiría un incremento de la producción endógena de NO que se relacionaría con los hallazgos hemodinámicos propios del SHP y sus anomalías del intercambio de gases13-14. La hipótesis de que el NO desempeña un papel fundamental en el desarrollo patogénico del SHP ha sido recientemente reforzada por Rolla et al'4, que observaron, en 5 pacientes con SHP, una correlación significativa entre la disminución de la concentración de NO exhalado y la mejoría de la oxigenación arterial tras practicar un trasplante hepático. La prevalencia actual del SHP sigue siendo desconocida, principalmente debido a la limitación y heterogeneidad de los criterios diagnósticos utilizados y, también, a la escasez de estudios prospectivos. Mientras que la presencia de hipoxemia moderada (PaO^ entre 60 y 80 mmHg) es relativamente común en los pacientes con enfermedad hepática avanzada10'16, la hipoxemia arterial 516 marcada (PaO^ < 60 mmHg) es menos frecuente y mucho más sugestiva de SHP. Por lo que respecta a la PaCOy lo usual es encontrar unos valores reducidos por la hiperventilación alveolar frecuentemente asociada. De ahí la recomendación de incluir siempre el cálculo del AaPO¡, variable que queda corregida por el valor de la PaCO^ y de la fracción inspiratoria de oxígeno, comportándose, por tanto, como un parámetro más sensible que la propia PaO, para estimar el grado de oxigenación arterial en el SHP. Tanto la hiperventilación alveolar, como el aumento del gasto cardíaco, característicos del SHP, optimizan (elevan) los valores de PaOy por lo que ejercen un efecto protector sobre la hipoxemia arterial al minimizar su impacto sistémico. Por lo tanto, la ausencia de hipoxemia no debería excluir la sospecha de SHP. De hecho, un AaPO¡ elevado (> 15 mmHg) junto a una ecocardiografía de contraste sugestiva de vasodilatación intrapulmonar17 pueden considerarse criterios suficientes para establecer el diagnóstico de SHP. En función de ello, hemos comprobado recientemente una incidencia elevada de SHP, del 17,5%, en un centenar aproximado de candidatos a trasplante hepático estudiados prospectivamente a lo largo de dos años consecutivos'6. Investigaciones previas''2'10'18 habían ya demostrado que la hipoxemia arterial del SHP es atribuible a un desequilibrio de las relaciones V^/Q debido a la presencia de unidades alveolares con ventilación preservada pero con perfusión aumentada, que provoca el desarrollo de áreas con cocientes \/Q reducidos, y de algunas comunicaciones arteriovenosas pulmonares con aumento del cortocircuito shunt intrapulmonar. El estudio de las relaciones Y/Q llevado a cabo en estos pacientes16, con o sin hipoxemia arterial acompañante, indica que existiría un amplio abanico de anomalías del intercambio de gases. La presencia de unidades alveolares con cociente VA/Q reducido tendría un mayor protagonismo en el SHP moderado, con poca expresividad clínica, en el que sólo destacaría un AaPO^ elevado con hipoxemia mínima o moderada, mientras que la presencia de un cortocircuito intrapulmonar aumentado sería el mayor determinante de la alteración gasométrica en aquellos casos más avanzados, agravado por la coexistencia de una limitación de la difusión alveolocapilar de oxígeno''18. Este último hallazgo no consistiría exclusivamente en un trastorno de la difusión propiamente dicho, sino de lo que se denomina "defecto de difusión-perfusión" pulmonar, ya descrito en 1976 por Genovesi et al19. Este concepto, poco conocido y retomado posteriormente20, plantea que el aumento del diámetro capilar pulmonar junto a la disminución del tiempo de tránsito del hematíe en su travesía capilar, debido al elevado gasto cardíaco, comprometerían la difusión de las moléculas de oxígeno en su recorrido desde el alvéolo hasta el vaso. Ello se traduciría predominantemente en el desarrollo de áreas con cocientes \^/Q reducidos, con limitación de la difusión alveolocapilar de oxígeno. Las anomalías gasométricas del SHP contrastan con la presencia de un funcionalismo pulmonar convencional (espirometría y volúmenes pulmonares) totalmente conservado o muy poco alterado, pero con una capacidad de difusión pulmonar de monóxido de carbono G.P. MARTÍNEZ Y R. RODRÍGUEZ ROISIN- HIPOXEMIA ARTERIAL Y HEPATOPATÍA: UN RETO NEUMOLÓGICO PARA EL PRÓXIMO MILENIO (CO) (DL^y) siempre fuertemente reducida8. Sin embargo, este hallazgo fisiopatológico plantea varias incógnitas. Por un lado, no parece muy compatible una reducción de la DL(,Q con una vasodilatación pulmonar generalizada subyacente, que debería provocar precisamente el efecto contrario, de aumento de dicha variable. Por otro, en pacientes con SHP a los cuales se les ha practicado un trasplante hepático la DL^o permanece inamovible, lo que contrasta con el resto de anomalías gasométricas y hemodinámicas, cuya restitución funcional tras la intervención quirúrgica es completa21. En un caso necrópsico publicado hace ya años, compatible con lo que hoy denominaríamos SHP22, destacó la presencia de vasodilatación intraacinar y anastomosis arteriovenosas precapilares en la circulación pulmonar. Ello se complementaba, a nivel ultramicroscópico, con un engrosamiento parietal capilar y venoso de tejido colágeno, que provocaba un aumento de casi el doble de lo normal de la distancia entre el alvéolo y el capilar. Si estos cambios estructurales fueran comunes al pulmón de todo SHP, la irreversibilidad de la caída de la DL^ observada tras el trasplante hepático podría quedar tal vez explicada. La historia natural del SHP se caracteriza por un empeoramiento progresivo del intercambio pulmonar de gases, que puede llegar a ser muy invalidante por la disnea extrema, asociado a una elevada mortalidad estimada en 4-5 años desde el inicio de la sintomatología respiratoria2'3'12. Hasta ahora, y como ya se ha comentado, el único abordaje terapéutico eficaz ha sido el trasplante hepático que haría involucionar el síndrome en una mayoría de pacientes con SHP23. En un metaanálisis realizado sobre 81 pacientes diagnosticados de SHP y sometidos a trasplante hepático se observó una restitución parcial o total en el 82% de los casos9. Así, en la actualidad, la hipoxemia arterial secundaria al SHP no sólo no debe considerarse una contraindicación formal al trasplante hepático sino que, por el contrario, constituiría en una proporción de casos una indicación electiva del mismo23. En suma, el SHP combina una sintomatología hepático-pulmonar singular, de curso crónico, con anomalías hemodinámicas y gasométricas muy características. Este modelo clínico y fisiopatológico es prácticamente único en medicina. Si ello se une a una incidencia elevada en los pacientes con hepatopatía avanzada, un curso progresivo con pronóstico reservado y una reversibilidad total o parcial de las manifestaciones clínicas tras el éxito del trasplante hepático, coincidiremos en admitir que el SHP es una entidad compleja, pero sumamente atractiva e interesante, que representa todo un reto para la neumología. Sin duda alguna, el futuro esclarecimiento de las incógnitas mecanicísticas y las dudas diagnósticas todavía vigentes deberán resolverse con la participación activa de los neumólogos. Otro importante desafío que nuestra especialidad deberá afrontar en el próximo milenio, una cita que está tan sólo a la vuelta de la esquina... 15 BIBLIOGRAFÍA 1 . Rodríguez-Roisin R, Roca J, Agustí AGN, Mastai R, Wagner PD, Bosch J. Gas exchange and pulmonary vascular reactivity in patients with liver cirrhosis. Am Rev Respir Dis 1987; 135: 1.085-1.092. 2. Rodríguez-Roisin R, Agustí AGN, Roca J. The hepatopulmonary syndrome: new ñame, oíd complexities [editorial]. Thorax 1992; 47:897-902. 3. Lange PA, Stoller JK. The hepatopulmonary syndrome. Ann InternMed 1995; 122:521-529. 4. Flückiger M. Vorkommen von trommeischágel-fórmigen fingerendphalangen onhe chronische Veránderungen an den Lungen oder am Herzen. Wien Med Wochenschr 1884; 34: 1.457. Kennedy TC, Knudson RJ. Exercise-aggravated hypoxemia and orthodeoxia in cirrhosis. Chest 1977; 72: 305-309. Sherlock S. Disorders fo the liver and the biliary system (8.a ed.). Oxford: Blackweil Scientifíc Publications, 1989; 82-86. Krowka MJ, Córtese DA. Hepatopulmonary syndrome: current concepts in diagnosis and therapeutic considerations. Chest 1994; 105: 1.528-1.537. Martínez-Pallí G, Barbera JA, Navasa M, Roca J, Visa J, Rodríguez-Roisin R. Hepatopulmonary syndrome associated with cardiorrespiratory disease. J Hepatol 1999; 30: 882-889. Krowka MJ, Porayko MK, Plevak DJ, Pappas C, Steers JL, Krom RAF et al. Hepatopulmonary syndrome with progressive hypoxemia as an indication for liver transplantation: case reports and literature review. Mayo Clin Proc 1997; 72: 44-53. Rodríguez-Roisin R, Roca J. Hepatopulmonary syndrome: the paradigm of liver-induced hypoxaemia. Bailliére's Clinical Gastroenterology 1997; 11: 387-406. 1 1 . Mandell MS, Groves BM. Pulmonary hypertension in chronic liver disease. Clin Chest Med 1996;17:17-33. 12. Hervé P, Lebrec D, Brenot F, Simonneau G, Humbert M, Sitbon O, Doroux P. Pulmonary vascular disorders in portal hypertension. Eur Respir J 1998; 11: 1.153-1.166. 13. Cremona G, Higenbottam T, Mayoral V, Alexander G, Demoncheaux E, Borland C et al. Elevated exhaled NO in patients with hepatopulmonary syndrome. Eur Respir J 1995; 8: 1.8831.885. 14. Rolla G, Brussino L, Colagrande P, Scappaticci E, Morello M, Bergerone S et al. Exhaled nitric oxide and impaired oxygenation in cirrhotic patients befare and after liver transplantation. Ann InternMed 1998; 129:375-378. Rodríguez-Roisin R, Barbera JA. Hepatopulmonary syndrome: is NO the right answer? [editorial]. Gastroenterology 1997; 113: 682-684. 17. 20. 21. 22. 23. Rodríguez-Roisin R, Martínez-Pallí G, Barbera JA, Balust J, Visa J, Cirera I et al. Hepatopulmonary syndrome: variations in pulmonary gas exchange with supine position [resumen]. Am J Resp Crit Care Med 1997; 155 (Supi): A909. Abrams GA, Jaffe CC, Hoffer PB, Binder HJ, Fallón MB. Diagnostic utility of contrast echocardiography and lung perfusión sean in patients with hepatopulmonary syndrome. Gastroenterology 1995; 109: 1.283-1.288. Hedenstiema G, Sóderman C, Eriksson LS, Wahren J. Ventilation-perfusion inequality in patients with non-alcoholic liver cirrhosis. Eur Respir J 1991;4:711-717. Genovesi MG, Tierney DF, Tapian GV, Eisenberg H. An intravenous radionuclide method to evalúate hypoxemia caused by abnormal alveolar vesseis: limitation of conventional techniques. Am Rev Respir Dis 1976; 114: 59-65. Krowka MJ, Córtese DA. Pulmonary aspects of chronic liver disease and liver transplantation. Mayo Clin Proc 1987; 62: 164-173. Battaglia SE, Pretto JJ, Irving LB, Jones RM, Angus PW. Resolution of gas exchange abnormalities and intrapulmonary shunting following liver transplantation. Hepatology 1997; 25: 1.228-1.232. Stanley NN, Williams AJ, Dewar CA, Blendis LM, Reid L. Hypoxia and hydrothoraces in a case of liver cirrhosis: correlation of physiological radiographic, scintigraphic, and pathological findings. Thorax 1977; 32: 457-471. Rodríguez-Roisin R, Krowka MJ. Is severe arterial hypoxaemia due to hepatic disease and indication for liver transplantation? A new therapeutic approach [editorial]. Eur Respir J 1994; 7: 839-842. 517 ORIGINALES Análisis descriptivo (características clínicas y funcionales) de la población asmática de un área sanitaria M.J. Espinosa de los Monteros***, A. González**, E Rodríguez*, R. Gabriel* y J. Ancochea Servicio de Neumología y *Unidad de Epidemiología del Hospital Universitario de la Princesa de Madrid. **Atención Primaria del área 2 de Madrid. ***Clínica Ruber. Madrid. OBJETIVO: Determinar las características sociodemográficas, clínicas y funcionales de la enfermedad en la población asmática del área 2 de Madrid. DISEÑO: Fase transversal (visita inicial) de un estudio de intervención comunitario en atención primaria (AP). La población diana del estudio está constituida por todos los asmáticos, pertenecientes al área 2 de Madrid y registrados en 10 centros de salud, mayor de 14 años y con síntomas de su enfermedad en el último año. La selección de los pacientes para el estudio fue sistemática (no probabilística) con reclutamiento consecutivo de los asmáticos que acudían y/o citados entre los registrados. Tasa de participación: 96,6% de los registrados. Se recogieron variables sociodemográficas, clínicas y funcionales, así como estudio alérgico, antecedentes familiares de asma y/o atopia y tipo de régimen terapéutico. RESULTADOS: Se estudiaron 650 pacientes con una media de edad de 45 ± 28,1 años y FEV,% de 87,2% ± 26; 238 (36,7%) eran varones y 412 (63,3%) mujeres. La media de evolución de la enfermedad fue de 16 ± 14,6 años, con edad de comienzo de 26 ± 20 años. El 34% tenía antecedentes familiares de asma y el 21% de atopia; el 50% tenía como factor asociado una rinitis alérgica, siendo los factores desencadenantes más importantes las infecciones respiratorias (62,4%), seguidas del polen (25,3%) y la exposición al humo del tabaco (20%). El 9,1% eran fumadores activos, siendo ex fumadores el 21,6%. El 64% de los pacientes utilizaban los fármacos betaadrenérgicos de corta duración a demanda, a diferencia del empleo diario tanto para los beta 2 de larga duración (83,2%) como para los esferoides inhalados (77%). El estudio establecido según grados de severidad determinó diferencias significativas en relación a la edad de los pacientes, edad de comienzo y predominio de asma perenne (siendo mayores en el grupo de asma grave). CONCLUSIONES: a) La mayoría de los asmáticos sintomáticos son leves, y b) se debe incidir en una pauta farmacológica correcta ajustada a un diseño terapéutico racional y escalonado, según el grado de severidad de la enfermedad. Palabras clave: Análisis descriptivo. Morbilidad del asma. Medicación de control del asma. Descriptive analysis (clinical and functional features) of an asthmatic population in a health care district OBJETIVE: To determine the social, demographic, clinical and lung function characteristics of the population of asthmatics living in Health Care District 2 of Madrid. STUDY DESIGN: Transversal (initial visit) phase of a primary care community intervention study. The target population consisted of all asthmatics in District 2 of Madrid who were registered at the public health clinics, were oider than 14 and had experienced asthma symptoms within the past year. The selection of patients for the study was systematic (not probabilistic), such that all registered asthmatics seeking care and/or scheduled for check-ups were enrolled. Participation was 96.6% of those on file. We recorded social, demographic, clinical, and lung function variables as well as results of allergy studies, family histories of asthma and/or atopy and type of treatment. RESULTS: Six hundred fifty patients were enrolled, 238 men (36.7%) and 412 women (63.3%). Mean age was 45 ± 28.1 yr, mean FEV|% was 87.2 ± 26%. Mean course ofdisease was 16 ± 14.6 yr and age of onset was 26 ± 20 yr. Family history of asthma was present in 34% of cases and a family history of atopy was reported by 21%. Half had allergic rhinitis as an associated factor, with respiratory infections (62.4%) being the most common trigger, followed by pollen (25.3%) and exposure to tobáceo smoke (20%). Active smokers accounted for 9.1 % of the group, and ex-smokers for 21.6%. Short-term beta-adrenergic drugs on demand were used by 64% of patients, whereas 83.2% reported daily and long-term use of beta-2 drugs and 77% used inhaled steroids. Severity of disease differed significantly by age of patient, age at onset and predominance of perennial asthma (with oider age and age of onset and greater seasonality observed among severely asthmatic patients). CONCLUSIONS: a) Most symptomatic asthmatic ha ve mild disease. b) Rationally adjusted, appropriate drug treatment shouid be graded according to level of disease severity Key words: Descriptive analysis. Asthma symptoms. Medical control of asthma. {Arch Bronconeumol 1999; 35: 518-524) Correspondencia: Dr. J. Ancochea. Jefe de Sección de Neumología del Hospital Universitario de la Princesa. Diego de León, 62. 28006 Madrid. Recibido: 23-2-99; aceptado para su publicación; 7-9-99, 518 Introducción El asma es una enfermedad inflamatoria crónica de las vías aéreas que suele cursar con exacerbaciones agudas (crisis) y que afecta a personas de todas las edades. 16 M.J. ESPINOSA DE LOS MONTEROS ET AL- ANÁLISIS DESCRIPTIVO (CARACTERÍSTICAS CLÍNICAS Y FUNCIONALES) DE LA POBLACIÓN ASMÁTICA DE UN ÁREA SANITARIA pudiendo ser severa y a veces fatal. En individuos susceptibles, esta inflamación causa síntomas que están usualmente relacionados con una obstrucción difusa y variable de las vías aéreas, que es frecuentemente reversible de forma espontánea o con tratamiento, y que se asocia a una hiperrespuesta frente a estímulos diversos'. En muchos países, la morbilidad y mortalidad por asma va en aumento por razones no del todo aclaradas, aunque el infradiagnóstico y el tratamiento inadecuado parecen ser los factores principales2. Una clasificación basada en la gravedad del asma, definida por criterios clínicos, necesidades terapéuticas y mediciones objetivas de la obstrucción, ha permitido establecer recientemente un diseño terapéutico racional y escalonado por etapas'. Son escasos los datos clinicopatológicos del asma disponibles en España. Así, por ejemplo, apenas se conocen aspectos fundamentales de la enfermedad, como son las características clínicas, funcionales y la morbilidad asociada en la población que demanda asistencia sanitaria. Por otra parte, a pesar de que el papel de la medicación de control en el asma ha quedado bien establecido con la publicación del Consenso Internacional de Diagnóstico y Tratamiento del Asma3, es evidente la dificultad de trasladar esta teoría a la práctica diaria del paciente, sobre todo cuando éste está prácticamente asintomático. Uno de los campos de aplicación para la salud de indudable interés en el actual sistema sanitario lo constituye la educación de los pacientes. Ello implica la incorporación del paciente como sujeto activo en el conocimiento y control de la enfermedad, siendo de gran importancia conocer en qué aspectos concretos debe centrarse al respecto la educación del mismo4. Por todo ello, nuestro grupo ha puesto en marcha un programa de atención comunitaria en el asma, cuyos principales objetivos son determinar la factibilidad de instaurar un programa de intervención en autocuidados del asma en la estructura del Sistema Nacional de Salud, en el ámbito de un área sanitaria, y comprobar si el programa es más efectivo que en los cuidados habituales en términos de mejora en calidad de vida, reducción de la demanda de asistencia sanitaria y racionalización del consumo farmacológico. Los objetivos de este artículo son describir las características sociodemográficas, clínicas y funcionales de los pacientes asmáticos incluidos en el programa, así como determinar el grado de cumplimiento terapéutico de la medicación prescrita y el grado de conocimiento y habilidades en autocuidados en condiciones básales en dichos pacientes. Material y métodos El presente trabajo se enmarca dentro del mencionado estudio de intervención comunitaria (casi experimental) en el marco de la atención primaria de salud. Se refiere a la descripción inicial (en condiciones básales) de la cohorte de pacientes asmáticos participantes en el mencionado ensayo de intervención, reclutados en los centros de atención primaria del área sanitaria 2 de Madrid. La población diana del estudio está constituida por todos los asmáticos conocidos mayores de 14 años de edad, de ambos sexos, y con cualquier grado de evolución de la enfermedad pertenecientes al área 2 de Madrid y registrados en 10 centros de salud, incluyendo tanto la 17 zona urbana como la periurbana, prestando cobertura a una población total de 167.513 habitantes. La población adscrita al área sanitaria 2 de Madrid incluye, según el censo municipal de 1992, a un total de 417.900 personas distribuidas en los distritos de Coslada (116.156), Chamartín (145.662) y Salamanca (156.082). Además, se presta cobertura a pacientes de otras áreas sanitarias, siendo la población total asignada al Hospital de la Princesa de 521.793 personas. Si asumimos un 5% de prevalencia de asma en la población general, se puede estimar que el número total de teóricos asmáticos seria de 26.089 casos prevalentes. Fueron candidatos para ser incluidos en el estudio todos aquellos pacientes con síntomas de la enfermedad durante el último año. El diagnóstico de asma se fundamentó en la historia clínica, en los datos de la exploración funcional respiratoria y en la información que le proporcionaron las pruebas alérgicas (determinación del prick-test, mediante una lanceta con una punta de 1 mm a través de la cual se introduce el alérgeno, considerando la prueba positiva cuando el diámetro del habón es igual o superior a 3 mm) y de la IgE específica, a través de diferentes métodos como RAST o ELISA5'6. La historia clínica es fundamental para el diagnóstico de asma. Los datos que merecen una atención prioritaria se refieren a la existencia de tos irritativa, expectoración mucosa difícil de obtener, disnea de esfuerzo y sibilancias ocasionales. La mejoría de los parámetros espirométricos es otro elemento que se valoró, ya que la reversibilidad de la obstrucción es un factor característico definida como un incremento del FEV, o de la FCV superior a 200 mi y mayor del 12% con respecto al valor teórico del paciente7. Desde un punto de vista operativo, fueron considerados casos de asma y candidatos de estudio todos aquellos pacientes en que existía sospecha clínica de asma a partir de los datos de la historia clínica (aunque el individuo pudiera encontrarse en periodo asintomático), y en los que la espirometría ofrece un patrón típico de obstrucción con disminución del FEV[ (VEMS) y de la relación FEV]/FVC. En los que la prueba broncodilatadora fue negativa se indicó una prueba de hiperrespuesta de las vías aéreas8. Como únicos criterios de exclusión se consideraron: la concurrencia de EPOC no distinguible de asma, el asma en fase inestable o no compensada y la concomitancia con otras enfermedades graves o invalidantes (p. ej., insuficiencia cardíaca, cáncer, etc.). En total 650 pacientes, de los 673 inicialmente registrados (96,6%) en los 10 centros de salud a fecha de 30 de abril de 1994, cumplían los criterios de definición de caso para el estudio, y los 23 pacientes restantes presentaban uno o más criterios de exclusión o no se pudo contactar con ellos. La selección de pacientes para el estudio se llevó a cabo durante 6 meses y fue sistemática (no probabilística) con reclutamiento consecutivo de todos los asmáticos que acudían espontáneamente y/o citados, mediante llamada telefónica, entre los registrados. El presente análisis se trata de un estudio transversal descriptivo de las características básales de la población de pacientes en el marco de un proyecto coordinado (atención primaria especializada) con el objetivo de contribuir a la mejora global del cuidado del paciente asmático. A todos los pacientes incluidos en el estudio se les realizó una entrevista personal estandarizada en la que, tras confirmar la existencia de criterios de inclusión, se registraban variables sociodemográficas (edad, sexo, nivel social y cultural, estado civil, ocupación) relacionadas con la enfermedad (antecedentes personales de asma y/o atopia, hábito tabáquico, años de evolución con asma, etc.), clínicas funcionales (FEV p FVC, relación FEV|/FVC, y prueba broncodilatadora tras inhalación de salbutamol)7. Igualmente, se indagaron el tipo de régimen terapéutico, frecuencia y modo de administración (empleo de medidores de pico flujo y de cámaras de inhalación) en el momento de efectuarse la entrevista, criterios cronológicos (años de evolución con asma, edad de comienzo, 519 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NUM. 11, 1999 etc.) y morbilidad ocasionada por la enfermedad y referida siempre al año previo a la entrevista, como frecuencia de las crisis de asma. Sobre la base de esta información y de acuerdo con las recomendaciones del Intemational Consensus Report on Diagnosis and Treatment of Asthma, la gravedad del asma de cada paciente fue clasificada en leve, moderada o severa'. Para evaluar el grado de conocimiento y uso apropiado de las pautas terapéuticas de manera objetiva, se le pedía al paciente que realizara delante del entrevistador una prueba objetiva de utilización de los dispositivos y del medidor de PEF, empleando para ello el mismo material que tenía prescrito. Al mismo tiempo, se le hacían una serie de preguntas en relación al grado de cumplimiento y de conocimientos en el manejo de la medicación. Cada tipo de dispositivo era supervisado con arreglo a los pasos que se indican en el informe Global Initiative for Asthma (GINA)9. TABLA I Datos clínicos y exploraciones complementarias de los pacientes incluidos en el estudio Disnea y sibilancias En cualquier época Sólo en primavera En relación con infecciones En relación con ejercicio Antecedentes familiares Asma Alergia Duración Perenne Estacional Espirometría Patrón obstructivo (PBD+) Análisis estadístico Las variables cuantitativas se han descrito mediante el índice de centralización media aritmética, acompañado siempre de su desviación estándar o típica. En aquellos casos en que la dispersión era muy grande se utilizó la mediana. La hipótesis de normalidad de los datos se comprobó mediante el test de Kolmogorov-Smirnov para todas las variables estudiadas. Dado que la hipótesis de distribución normal fue rechazada para una gran parte de las variables, se decidió utilizar técnicas no paramétricas: test de Mann Withney para comparaciones de variables cuantitativas en dos submuestras, y test de Kruskall-WaIlis para más de dos subgrupos. Igualmente, se utilizaron tablas de contingencia para las variables cualitativas. Los resultados de las variables categóricas fueron comparados mediante el test de la '/ 2 . Para todos los análisis estadísticos se utilizó el paquete SPSS-PC + V6.04 (SPSS Inc., Chicago I 11). En todos los tests de hipótesis se rechazó la hipótesis nula cuando el valor de la p era menor de 0,05. Resultados Características sociodemográficas Se estudiaron 650 pacientes cuya edad media era de 45,2 ± 28,1 años (rango: 14-82), 238 (36,7%) eran varones y 412 (65,3%) mujeres, de los cuales el 63,5% pertenecía al grupo de asma leve, el 20,1 % al de moderada y el 16,3% al grave. La media de años de evolución de la enfermedad fue de 16,4 ± 14,6, presentando una edad de comienzo de 26 ± 20 años. El 34% tenían antecedentes familiares de asma y el 21% de atopia, el 50% tenía como factor asociado una rinitis alérgica, siendo los factores identificables desencadenantes más importantes de su sintomatología las infecciones respiratorias (62,4%), seguidas del polen (25,3%) y la exposición al humo del tabaco (20%). El 9,1 % eran fumadores activos, siendo ex fumadores el 21,6%. El análisis pormenorizado de las características sociodemográficas y clínicas, según niveles de gravedad, determinó diferencias significativas entre los distintos grupos respecto a la edad del paciente (siendo la media de 60 años en el grupo de asma grave y de 38 años en el leve), edad de comienzo (48 años en el grupo de asma grave y 21 en el leve) y predominio de asma perenne (93% para el grupo de asma grave y 56% para el leve). El 69% de los pacientes tenían tests cutáneos de hipersensibilidad inmediata (prick-test) positivos y/o presencia de inmunoglobulina E (IgE) específica a 520 PEF < 80% (PBD+) Presente (%) N." de pacientes 90,7 74 24 84,1 63,3 581 508 508 508 512 34 20,9 508 417 64,6 35,4 531 531 69,9 63,1 47,6 42,9 539 244 168 100 68,9 488 Tests cutáneos (+) y/o IgE específica (neumoalergenos) TABLA II Distribución de los parámetros de función pulmonar en el conjunto de la muestra de estudio (N = 350) Media FEV|% Tiff% PEF(l/min) PEF% 87,2 76,3 338 82,9 DE Mínimo Mediana Máximo 24.6 32 153 28,3 15 17 90 20 89 76 300 86 188 133 750 144 FEV|; volumen espiratorio máximo en el primer .segundo; PEF: pico flujo espiratorio; Tiff: índice de Tiffeneau; DE: desviación estándar. neumoalergenos frecuentes (pólenes, ácaros, epitelios de animales)6. De acuerdo con una clasificación convencional del asma, la etiología era extrínseca en un 53,4% e intrínseca en un 46,5%. Cuando se producía una crisis de asma, el 51,3% de los pacientes la presentaban con más frecuencia en primavera, el 31% en invierno, el 10,8% en otoño y el 6,8% en verano. Estos resultados se reflejan en la tabla I. Se analizaron también determinados parámetros de función pulmonar, objetivándose un FEV| medio de 87,2 ± 24,6%, un índice de Tiffeneau de 76,3 ± 32% y un PEF medio de 338 ± 153 1/min (tabla II). En la tabla III se expone la distribución de la población obtenida según la clasificación clínica realizada mediante las recomendaciones establecidas en el Consenso Internacional. En la misma, se recogen también los resultados de la función pulmonar según niveles de gravedad. Se encontraron diferencias estadísticamente significativas entre los tres grupos en referencia a la edad (mayor en los asmáticos graves), la edad de comienzo (mayor para los graves) y el FEV]% (a favor de los leves). Empleo de fármacos El 64,6% de los pacientes utilizaban los fármacos betaadrenérgicos de corta duración como medicación de rescate, siendo el más empleado el salbutamol, a diferencia del empleo diario, tanto para los beta 2 de laru.i 18 M.J. ESPINOSA DE LOS MONTEROS ET AL- ANÁLISIS DESCRIPTIVO (CARACTERÍSTICAS CLÍNICAS Y FUNCIONALES) DE LA POBLACIÓN ASMÁTICA DE UN .ÁREA SANITARIA TABLA III Datos clínicos y de función pulmonar por grupos de gravedad N." Razón (mujervarón) Edad Tiempo evolución (meses) Edad de comienzo FEV,% Asma perenne (%) Todos Asma leve Asma moderada Asma grave 650 1,7 45,2 192 26 87,2 64,6 265(63,5%) 1,44 37,7(24)* 66 21,7* 102,7(31)* 55,8* 84(20,1%) 1,48 55,1(25)* 125 36,3* 68,5(7,3)* 73,5* 68(16,3%) 2,14 59,6(20,5)* 136,5 48,6* 46,1(11,2)* 93* Valores expresados en medias y desviación típica entre paréntesis; *p < 0,05 respecto a los otros dos grupos duración (83,2% de los pacientes) como para los esferoides inhalados (77% de los pacientes). No se registró ningún caso de tratamiento con betaadrenérgicos por vía oral. El control del tratamiento se realizaba de forma preferente por el médico de atención primaria (67,1%), seguido del alergólogo (43,4%). Los resultados de los parámetros evaluados se recogen en la tabla IV. Datos de morbilidad El 44,6% de los pacientes habían presentado al menos un ataque de asma en el último año, siendo el número medio de ataques/año de 1,71 ± 4 (mediana de 0), requiriendo atención médica el 46,7% de los mismos. Esta se prestaba preferentemente por el centro de salud (al que acudieron el 77,2%) con una media de visitas en el último año de 1,95 ± 3,2 (mediana de 1), seguida de la atención a domicilio (30,1%) con una media de 1,62 ± 5 (mediana de 0), urgencias consultorio (servicio de urgencias en el centro de salud que funciona 12 h en los urbanos y 24 h en los pertúrbanos) (42,2%) y urgencias hospitalarias (63,8%), con un número medio de visitas de 1,30 ± 3,3 (mediana de 0) y 1,35 ± 2,5 (mediana de 1), respectivamente, durante el año previo. Un 13,9% de los pacientes faltaron al trabajo en el último año, siendo la media de absentismo laboral de 3,6 ± 1,9 días. De igual modo, un 18,4% de los pacientes en edad escolar faltaron al colegio en el último año, siendo la media de absentismo escolar de 1,72 ± 5,9 días. 1. De los pacientes que precisaron visitar los servicios de urgencias hospitalarios, el 63% la efectuaron en una ocasión; por el contrario, un 6,6% precisaron acudir 5 o más veces. 2. De los pacientes cuya crisis asmática es atendida por el centro de salud, el 41,7% lo precisa en una única ocasión, mientras que el 7,6% lo requiere en 5 o más ocasiones. 3. De los pacientes que sufrieron ataques de asma en el último año, el 34,2% lo presentaron en una única ocasión. Los resultados de los parámetros de morbilidad evaluados se recogen en la tabla V para cada grupo de gravedad. Medicación antiasmática: dispositivos, técnicas de inhalación y cumplimiento por parte del paciente Otro de los objetivos iniciales del estudio fue conocer el grado de cumplimiento en la medicación de control del asma, así como valorar el nivel de conocimien19 tos de los pacientes acerca de la enfermedad. Se realizó un análisis comparativo entre los pacientes que eran atendidos exclusivamente en el nivel primario de Salud y de los seguidos en la consulta especializada de asma, en el mismo período de tiempo (tabla VI). - Pacientes controlados en AP. La medicación de control del asma era usada diariamente, por el 81,8% de los pacientes, empleada de forma parcialmente correcta por el 15,2% y totalmente inadecuada por el 3%. No se encontraron diferencias significativas en relación al valor del PEF según el grado de cumplimiento. Sobre el uso que hacían de la cámara de inhalación, sólo el 20,4% del total de pacientes la utilizaban, no encontrándose diferencias significativas en cuanto a la función pulmonar respecto a los que no la usaban. El 27% de los enfermos utilizaban el medidor de PEF en su domicilio, siguiendo un plan de autotratamiento pautado por el médico, y sólo realizaban la medida correctamente el 36,8%, siendo un 64,5% el porcentaje de pacientes que afirmaba haber recibido previamente instrucciones orales al respecto. Por último, únicamente el 47,5% de los pacientes se les había explicado por qué debían tener la TABLA IV Medicación de control en el asma Tipo de tratamiento Beta 2 de corta duración Beta 2 de larga duración Corticoides inhalados Corticoides sistémicos Teofilinas Bromuro de ipratropio Nedocromil Cromoglicato Otros A diario Pauta de tratamiento A demanda N." de pacientes que toman la medicación 34,6 83,2 77,3 32,8 82,3 80 73,2 64,4 67,2 64,6 16,1 22,1 67,2 17,7 20 26,8 35,6 31 460 161 344 58 79 20 71 45 24 Técnica/supervisión ¿Utiliza cámara? ¿Utiliza el medidor de PEE? ¿Quién controla el tratamiento? Atención primaria Neumólogo Alergólogo Nadie o usted mismo Sí No 20,4 79,5 547 27 73 520 67,1 19,9 43,4 3,39 32,8 80 56,5 96,6 648 648 648 648 521 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NÚM. 11, 1999 TABLA V Morbilidad ocasionada por el asma (según grupos de gravedad). Valores referidos al año previo al estudio Absentismo laboral (%) Absentismo escolar (%) Pacientes con ataques de asma en el último año (%) Pacientes cuya crisis precisó atención médica (%) Atención médica prestada por: Centro de salud (%) Urgencias consultorio Urgencias hospitalarias Domicilio Porcentaje de pacientes controlados por médicos de atención primaria Porcentaje de pacientes atendidos por alergólogo Porcentaje de pacientes atendidos por neumólogo Asma leve Asma moderada Asma grave Significación estadística 14,8 22,8 14,7 25 35,7 0 0,02 (a, b) 0,4 38,7 55,3 63,7 0,0003 (a) 27,8 30,3 44,8 0,06 75,5 38,4 57,5 25 74 41,6 73,3 36,3 80,7 57,1 80 80 0,6 0,6 0,04 (a) 0,1 62,5 68 67,6 0,4 52,6 37,5 24,6 0,003 (a) 19,4 23,6 35,5 0,03 (a) Valores expresados en porcentajes; a: entre leve y grave; b: entre moderado y grave medicación diariamente aunque se encontraran bien, diferenciando con ellos los fármacos aliviadores de los reguladores. - Pacientes controlados en AE. La técnica de inhalación era correcta en un 74,5%. El 84,4% de los pacientes realizaban un cumplimiento correcto, parcialmente correcto el 10,4% y totalmente inadecuado el 5,2%. Un 78,3% de los pacientes había recibido instrucciones acerca de la medición correcta del PER Existía correlaTABLA VI Análisis comparativo de los distintos dispositivos empleados, uso del PEF y cumplimiento por parte del paciente en atención primaria y especializada Medicación de control del asma Turbuhaler® Aerosol sin cámara Aerosol con cámara Accuhaler Otros Cumplimiento Correcto Parcialmente correcto Inadecuado Uso de cámara de inhalación PEF Pacientes que utilizan PEF (plan de autotratamiento) Medicación correcta Se les ha explicado la necesidad de medicación diaria 522 Atención Atención primaria (%) especializada (%) (n = 95) (n = 95) Significación estadística (p) 25,8 80,5 17,9 2,87 1,43 60 89,3 10,6 6,6 1,3 0,00001 0,09 0,15 0,33 0,58 81,8 84,4 0,64 15,2 3 10,4 5 0,35 0,7 20,4 23,2 0,7 27 42,3 * 0,02 36,8 51,9 0,03 47,5 38,5 0,23 A "' ción entre el cumplimiento y el valor de PER Sólo al 38,5% se le había explicado por qué debían tomar la medicación diariamente. El 53,8% de los pacientes conocía la utilidad del PER y el 51,9% realizaba correctamente su medida, pero sólo lo utilizaba el 42,3%, según un plan de autotratamiento prescrito por el médico. En ambos grupos, el tipo de dispositivo empleado no guardó correlación con las medidas de función pulmonar, a diferencia de lo que sucedió en el grupo de AE entre el grado de cumplimiento por parte del paciente y el valor de PEE, de manera que los pacientes que empleaban la medicación de control diariamente presentaban unos valores de PER significativamente más bajos (PEE = 360 ± 148 1/min) que los que no lo hacían (PER = 390 + 150 1/min). Por otra parte, se encontraron diferencias significativas entre ambos grupos de estudio en relación al empleo del dispositivo en polvo seco Turbuhaler® y al registro correcto del PER, así como en lo que respecta a la información recibida acerca de la necesidad de uso de medicación diaria (aunque el paciente estuviera asintomático), siempre a favor del grupo de AE. Las diferencias entre el uso de los distintos dispositivos, grado de cumplimento, empleo de cámara de inhalación y PEE en ambos grupos de estudio AP/AE quedan reflejadas en la tabla VI. Discusión En nuestro estudio, dado que es una muestra registrada en AP, no es sorprendente que la mayoría de los asmáticos sean leves (63,5%). Las características clínicas de nuestros pacientes son superponibles a las de otros trabajos publicados10. Eran previsibles los resultados obtenidos en relación a la evaluación de los parámetros de morbilidad en función de la gravedad del asma, presentando índices más elevados los del grupo de mayor gravedad clínica, alcanzando incluso significación estadística para valores como el porcentaje de pacientes con absentismo laboral; el porcentaje de pacientes con ata20 M.J. ESPINOSA DE LOS MONTEROS ET AL- ANÁLISIS DESCRIPTIVO (CARACTERÍSTICAS CLÍNICAS Y FUNCIONALES) DE LA POBLACIÓN ASMÁTICA DE UN ÁREA SANITARIA ques de asma en el último año y el de aquellos cuyos ataques de asma fueron atendidos por los servicios de urgencias hospitalarios. Sin embargo, consideramos importante reseñar varias circunstancias claves: a) el hecho de observar similares índices de absentismo laboral para el grupo de asma leve y moderado (14,7%), así como la ausencia de absentismo escolar en el grupo de asma grave; b) la elevada asistencia por parte de los pacientes asmáticos a los servicios de urgencias hospitalarias (63,8%) ante la presentación de una crisis; c) el papel primordial de los médicos de atención primaria en el control de los pacientes tanto estables (67,1%) como agudizados (77,2%), y d) no constatarse diferencias en cuanto a la necesidad de acudir a los servicios de urgencias hospitalarias ni en referencia al número de pacientes con ataques en el último año que precisaron atención médica entre los grupos de asma moderado y grave. Por otro lado, con la publicación del Consenso Internacional de 1992, queda claro que el tratamiento del asma debe hacerse para revertir y, sobre todo, prevenir los síntomas asmáticos. La medicación de control, tomada a diario y a largo plazo, conseguirá mantener el asma bajo control. Un punto importante es saber en qué proporción los pacientes cumplen la medicación prescrita". La necesidad de realizar la medicación diariamente, aun estando asintomáticos, se les explicó a los pacientes, en el caso de atención especializada en un 52%, y en el caso de atención primaria en un 37%; sin embargo, un porcentaje mayor (el 84,4% de los pacientes) afirma tomar diariamente la medicación. Por otra parte, no hubo diferencias estadísticamente significativas en los parámetros estimativos de función pulmonar entre los pacientes que usaban un tipo, otro, o varios dispositivos; a diferencia de lo que ocurría (en el grupo de atención especializada) con el grado de cumplimiento, en el que los pacientes que usaban la medicación de control diariamente presentaban unos valores de pico flujo (PEF) significativamente más bajos (PEF = 360 ± 148) que los que no lo hacían (PEF = 390 ± 150). Al mismo tiempo, encontramos diferencias estadísticamente significativas en relación al empleo del PEF (tanto en su uso adecuado, como en su correcto manejo). En cuanto al empleo de los dispositivos, se acepta que la vía inhalatoria es la ideal para la medicación asmática12, puesto que permite el depósito directo en la vía aérea, con efectos secundarios mínimos' 3 . A la vista de nuestros resultados, cabe afirmar que el grado de cumplimiento de la medicación no está en relación con el tipo de dispositivo empleado. Además, el inhalador de polvo seco Turbuhaler® es utilizado preferentemente por los médicos de atención especializada, siendo el dispositivo Accuhaler el menos empleado tanto en primaria como en especializada. Respecto al bajo porcentaje observado de enfermos que empleaban cámara de inhalación (20%), hay que precisar que nuestro estudio no diferenció a los pacientes que utilizaban los esferoides inhalados en polvo seco de los que los recibían por aerosoles presurizados, por lo que teniendo en cuenta el alto empleo del dispositivo Turbuhaler® (60%) en pacientes de atención especializada, la cifra esperada de pacientes que debieran emplear la cámara de inhalación 21 es inferior. Por tanto, es importante reforzar mucho más la educación respecto al asma 1415 , con una estrategia educacional y de compromiso mutuo que permita potenciar parámetros tales como la formación del paciente en aspectos básicos de la enfermedad"' e identificación y eliminación de posibles factores externos desencadenantes 17 . Además, debemos promover la adhesión al tratamiento 1819 (nuestros resultados apuntan un cumplimiento no adecuado en un 18,2%) y potenciar un uso adecuado de la medicación con un correcto entrenamiento y control de la técnica inhalatoria. Encontramos que la realización de la técnica inhalatoria era correcta en un 74,5%. En el grupo de atención primaria la cámara era utilizada únicamente por el 20,4% de los pacientes y el medidor de pico flujo por el 27%, de los cuales únicamente el 37% lo empleaba de forma correcta (tabla VI). Por último, es básico establecer un plan de actuación pactado que incluya: a) actuación precoz ante la crisis, y b) uso adecuado de los distintos niveles del sistema sanitario (atención primaria, atención especializada y hospitalaria, y servicios de urgencias). Nuestros resultados establecen un alto índice de frecuentación de los servicios de urgencias (hospitalarios: 63,8% y urgencias consultorios: 42,2%), así como no evidencia de control de la enfermedad en un 3,4% de los pacientes. Se constata un índice de visitas a los médicos de atención primaria similar en los tres grupos de gravedad de asma, encontrando diferencias respecto a los médicos de atención especializada en los que para los neumólogos el índice de visitas era mayor en función de la gravedad. En resumen, nuestro estudio ha demostrado que, bajo los criterios establecidos por el Consenso Internacional de 1992, la mayoría de los asmáticos con sintomatología activa durante el pasado año pertenecen al grupo de asma leve, los cuales presentan unos altos índices de morbilidad (absentismo laboral, escolar y crisis de asma que precisan atención médica), aunque éstos son siempre más acusados en relación a la gravedad. Al mismo tiempo, debemos incidir en la necesidad de instrucción sobre el uso del medidor del PEF, así como promover la adhesión al tratamiento por parte de nuestros pacientes. En conclusión, la mayoría de los asmáticos sintomáticos son leves. Asimismo, se debe incidir en una pauta farmacológica correcta ajustada a un diseño racional y escalonado, según el grado de gravedad de la enfermedad. Agradecimientos Este trabajo ha sido financiado parcialmente con las becas FIS (95/0059), beca de ampliación de estudios (FIS 97/5014 y 98/5025) y premio FEPAR,1997. BIBLIOGRAFÍA 1. International Consensus Report on Diagnosis and Management of Asthma. National Heart, Lung and Blood Institute. National Institutes of Health. NIH publication n.° 92-3091, Bethesda MD, U.S. Department of Health and Human Services, 1992. 2. Anonymous. Management of asthma in the community. Lancet 1989:2: 199-200. 3. Guidelines for the diagnosis and management of asthma. National Heart, Lung and Blood Institute, National Institutes of Health. 523 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NUM. 11, 1999 4. 5. 6. 7. 8. 9. 10. HIH publication n." 94-3042 A. Bethesda MD, U.S. Department ofHealth and Human Services, 1994Clark NM. Asthma self-management education. Research and implications forclinical practice. Chest 1989; 95: 1.110-1.131. Casan P, Benlloch E, Duce F, Perpiñá M, Picado C, Sanchís J et al. Diagnóstico de asma: lo fundamental y lo accesorio. Arch Bronconeumol 1993; 29 (Supi 2): 1-7. Subcomité de pruebas cutáneas de la Academia Europea de Alergología e Inmunología Clínica. En: Dreborg, editor. Pruebas cutáneas utilizadas en el diagnóstico de la alergia tipo I [Artículo de opinión]. Allergy 1989. Quanjer Ph H, Tammeling GJ, Cotes JE, Pedersen OF, Peslin R, Yemault J-C. Lung volumes and forced ventilatory flows-report working party-standardization of lung function tests- European CommunityforSteelandCoal.EurRespirJ 1993;6(Supl 16): 5-40. Valencia A, Casan P, Díaz M, Perpiñá M, Sebastian MD. Normativa de los tests de provocación bronquial inespecífica. Arch Bronconeumol 1991; 27: 353-361. Global Initiative for Asthma (GINA). National Heart, Lung and Blood Institute. National Institutes for Health. NIH publication n." 95-3659. Bethesda MD, U.S. Department of Health and Human Services, 1995. Plaza V, Serra-Battes J, Morejón E, Cornelia A, Brugués J. Características clínicas y morbilidad del asma estable. Análisis descriptivo del asma en una comunidad mediterránea. Arch Bronconeumol 1997;33:457-461. 524 1 1 . Entrenas LM, Cosano PJ, León ME, Adame ML, Cosano PA. Medicación de control en el asma: dispositivos, técnicas de inhalación y cumplimiento. Neumosur 1996; 8: 138-145. 12. Newhouse MT, Dolovich MB: Control of asthma by aerosols. N Engí J Med 1986; 315: 870-874. 13. Toogood JH. Complications of topical steroid therapy for asthma. Am Rev Respir Dis 1990; 141:589-596. 14. Parker SR, Mellins RB, Song DD. NHLBI Workshop summary. Asthma education: a national strategy. Am Rev Respir Dis 1989; 140:848-853. 15. Dirección General de Prevención y Promoción de la Salud (Comunidad Autónoma de Madrid). Guía para el diagnóstico y tratamiento del asma. Documentos Técnicos de Salud Pública, julio de 1992. 16. Alonso E, Ancochea J, Baos V, De Barrio E, Bueno R, Cienfuegos I et al. Guía de autocuidados para el asma. Dirección General de Prevención y Promoción de la Salud (Comunidad Autónoma de Madrid). Dirección Provincial de Madrid (Insalud). Documentos Técnicos de Salud Pública, 1994. 17. Oswait CE. Expensive health care. A solvable problem? Arch IntemMed 1990; 150: 1 . 1 6 5 - 1 . 1 6 6 . 18. Anonymous. Are you taiking the medicine? Lancet 1990; 335: 262-263. 19. Rand CS, Wise RA, Nides M, Simmons MS, Bleecker ER, Kusek JW et al. Metered-dose inhaler adherence in a clinical trial. Am Rev Respir Dis 1992; 146: 1.559-1.564. 22 ORIGINALES Utilidad de la fíbrobroncoscopia en el paciente crítico pediátrico E. García García, E. Pérez Ruiz", L. Quesada Rodríguez, G. Milano Mansob, J. Pérez Frías", C. Calvo Macíasb y A. Martínez Valverde •'Sección de Neumología Infantil y ''Unidad de Cuidados Intensivos Pediátricos. Departamento de Pediatría. Hospital Maternoinfantil Carlos Haya. Málaga. La fíbrobroncoscopia (FB) es una técnica diagnóstica y terapéutica con un campo de aplicación creciente en pediatría. OBJETIVO: Analizar la contribución de la FB al diagnóstico y tratamiento de la patología respiratoria en los pacientes ingresados en una Unidad de Cuidados Intensivos Pediátricos (UCIP). PACIENTES y MÉTODOS: Se revisan las FB realizadas entre enero de 1989 y octubre de 1998 en los pacientes ingresados en la UCIP, utilizando fibrobroncoscopios de 3,5 y 2,2 mm de diámetro externo. Se analiza la patología de base de los pacientes, la finalidad e indicación de la FB, la vía de entrada, los hallazgos de la inspección de las vías aéreas y del lavado broncoalveolar (LBA), las complicaciones y la contribución de la técnica al manejo del enfermo. RESULTADOS: Se revisan un total de 51 procedimientos en 47 pacientes de edades comprendidas entre 10 días y 12 años. Veintiún niños (41%) eran menores de 1 año. La indicación inicial de la FB fue diagnóstica (73%) y terapéutica (27%). La inspección de las vías aéreas fue anormal en el 65% de los casos. Se hizo LBA en 18 casos, obteniendo hallazgos microbiológicos en 8/18. En el 75% de los procedimientos, los pacientes se beneficiaron directamente de esta técnica. CONCLUSIÓN: La FB es una técnica útil y, en general, bien tolerada, en el diagnóstico y tratamiento de los pacientes ingresados en la UCIP Palabras clave: Fibrobroncoscopia. Niños. Cuidados intensivos. The usefulness of fiberoptic bronchoscopy in pediatric critical care Fiberoptic bronchoscopy (FB) is being applied increasingly in pediatrics as a therapeutic and diagnostic technique. OBJECTIVE: To analyze the contribution of FB to the diagnosis and treatment of respiratory disease in patients admitted to the pediatric intensivo care unit (PICU). PATIENTS AND METHOD: We reviewed FB performed with 3.5 and 2.2 mm external diameter instruments between January 1989 and October 1998 in patients admitted to the PICU. Underiying disease and purpose of and indications for FB were analyzed. We aiso analyzed route of insertion, findings of airway inspection and bronco-alveolar lavage (BAL), complications and the contribution of FB to patient management. RESULTS: A total of 51 procedures in 47 patients aged between ten days and 12 years oíd were perdormed. Twentyone children (41%) were under one year oíd. The initial indications for FB were diagnostic in 73% and therapeutic in 27%. Airway inspection showed abnormality in 65%. BAL was performed in 18 cases, with microbiological findings in 8 of the 18. The patients benefited directly from the technique in 75% oteases. CONCLUSIONS: FB is useful diagnostic and therapeutic procedure in PICU patients and is generally well tolerated. Key words: Fiberoptic bronchoscopy. Children. Intensivo care. (Arch Bronconeumol 1999; 35: 525-528) Introducción Desde la introducción de la FB en 1969, su uso se está generalizando y ganando terreno. Actualmente la gran mayoría de las broncoscopias en pediatría se realizan con el broncoscopio de fibra óptica o fibrobroncoscopio (FBC)'-2. Sus principales ventajas sobre el rígido son un mayor alcance periférico y una mayor facilidad Correspondencia: Dr. E. García García. Manuel Altolaguirre, 29, 3.° 12. 29720 La Cala del Moral. Málaga. Correo electrónico: [email protected] Recibido: 23-2-99; aceptado para su publicación: 27-7-99. 25 de uso, al no precisar anestesia general y poder llevarse a cabo en la cabecera del enfermo. La realización de procedimientos como la extracción de cuerpos extraños y la biopsia transbronquial, tradicionalmente asociados a la broncoscopia rígida, comienzan a ser factibles también con la FB3. Además de su indicación como procedimiento diagnóstico y terapéutico en numerosas enfermedades, es de utilidad en pacientes con vía aérea artificial (en intubaciones difíciles o para la comprobación de la colocación de tubos endotraqueales). Con la aparición de los nuevos modelos ultrafinos de fibrobroncoscopios (1,8 mm de diámetro), se suman nuevas aplicaciones a esta técnica, como son la exploración 525 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NÚM. 11, 1999 de neonatos y lactantes y la exploración a través de tubos endotraqueales pequeños o tubos de traqueostomía4. El objetivo de nuestro trabajo es analizar la contribución de esta técnica al diagnóstico y tratamiento de un grupo de pacientes, niños que precisan cuidados intensivos y que con frecuencia presentan patología respiratoria. Pacientes y métodos Se revisan las FB realizadas a los pacientes ingresados en la UCIP de nuestro centro, un hospital de tercer nivel, en el período comprendido entre enero de 1989 y octubre de 1998. Las FB se realizaron en la cabecera del enfermo en la propia UCIP. Se utilizó en pacientes con respiración espontánea la pauta de premedicación publicada previamente por nuestro grupo5'6: atropina subcutánea (0,01 mg/kg) 20 min antes del procedimiento, con objeto de disminuir secreciones y minimizar reacciones vagales, y sedación intravenosa con diazepam (0,03 mg/kg) o midazolam (0,2 mg/kg) y ketamina (1-2 mg/kg). Además, se administró anestesia tópica con lidocaína al 2% nebulizada previa a la introducción del FBC en las vías aéreas y a través del canal instrumental una vez introducido. En pacientes con ventilación mecánica se mantuvo la pauta de sedación y relajación muscular que venían recibiendo. Se monitorizaron la frecuencia cardíaca y la saturación de O-, por pulsioximetría. En pacientes con respiración espontánea se dispuso de una fuente de oxígeno suplementario, a un flujo variable en función de la saturación de oxígeno. En los niños con ventilación mecánica se estableció una FÍO, del 100% y se disminuyó la presión positiva al final de la espiración (PEEP) a O o al mínimo tolerado. Se empleó en la mayoría de los casos el FBC pediátrico estándar (Pentax-FB-lOX) con 3,5 mm de diámetro externo y canal de trabajo de 1,2 mm. En niños intubados con tubos endotraqueales de 3,5 mm de diámetro interno se utilizó el FBC Storz de 2,2 mm de diámetro externo y 0,9 mm de canal de trabajo. La inspección de la vía aérea incluyó la búsqueda de anomalías morfológicas y un estudio dinámico. El LBA se realizó según indicación clínica introduciendo el fibrobroncoscopio en el segmento pulmonar más afectado o enclavándolo en el lóbulo medio o língula en los casos de afectación difusa. Se lavó con 1-3 ml/kg de suero fisiológico repartido en cantidades alícuotas de 5 o 10 mi, según fueran pacientes de menos o más de 5 kg de peso, respectivamente, y se procedió a su aspirado. Los primeros 5 mi eran desechados. Se procesaron muestras para citología y microbiología. Se consideró citología normal aquella con menos de 250.000 células/mi y con el siguiente recuento diferencial: macrófagos 81,2 ± 12,7%, neutrófilos < 6% (excepto en niños menores de 8 años, donde puede haber proporcionalmente más), linfocitos < 18% y eosinófilos < 0,5%7. TABLA I Patología de base de los pacientes Bronconeumonia Leucemia 6 4 2 3 3 3 3 Infección por VIH Postoperatorio de hernia diafragmática Fibrosis quistica Tuberculosis pulmonar Sarcoidosis Gran quemado Laringotraqueítis Encefalopatía Displasia broncopulmonar Cardiopatía congénita Síndromes polimalformativos Inmunodeficiencia primaria Enfermedad meningocócica Postoperatorio cardiovascular Pausas de apnea Aspiración pulmonar 3 Reflujo gastroesofágico 1 2 Epiglotitis Meningitis tuberculosa 1 1 Miopatía Trauma torácico 1 1 2 2 2 2 1 1 1 1 1 23 procedimientos (45%). El tubo endotraqueal se utilizó como vía de acceso en 21 casos (41%). En 4 casos se empleó el FBC ultrafíno (de 2,2 mm de diámetro externo), al tratarse de tubos endotraqueales de 3,5 mm. La cánula de traqueostomía sirvió de entrada a 7 procedimientos (14%). La tabla II recoge las indicaciones de las FB, agrupadas según su finalidad en diagnósticas y terapéuticas. Las indicaciones más frecuentes fueron atelectasias persistentes o recidivantes (25%), neumonías en inmunodeprimidos (16%), complicaciones en pacientes traqueostomizados (14%) y neumonías de mala evolución (12%). En el grupo de pacientes menores de un año también fueron las indicaciones más frecuentes las atelectasias persistentes (9/21 casos) y las neumonías en inmunodeprimidos (4/21). Hallazgos de inspección de vías aéreas Los hallazgos de la inspección de la vía aérea se exponen en la tabla III. En general, se encontraron anormalidades en el 65% de las exploraciones, con la incidencia más alta en pacientes con complicaciones de la intubación, obstrucción de vías aéreas superiores (OVAS) y estridor, en los que todas las FB aportaron datos anormales a la inspección. En los niños menores de un año, la inspección fue anormal en 13/21 procedimientos, con especial interés en el diagnóstico de malformaciones congénitas. Hallazgos del lavado broncoalveolar (LBA) Resultados Se realizaron un total de 51 FB en 47 pacientes, 33 varones (70%) y 14 mujeres (30%). De ellos, 45 pacientes se exploraron una vez, uno lo precisó en dos ocasiones y otro en cuatro. Las edades estaban comprendidas entre 10 días y 12 años. Veintiún niños (41%) eran menores de un año. La patología de base de los pacientes se recoge en la tabla I, comprendiendo un amplio espectro de situaciones clínicas. La vía de entrada fue la nasal en 526 Se realizó en 18 niños (35%), siete de ellos menores de un año, con hallazgos microbiológicos en ocho. Su principal indicación radica en las neumonías en inmunodeprimidos. La citología fue anormal en 6 de estos 8 pacientes. Cinco presentaron sólo hipercelularidad (3 de predominio linfocítico y 2 neutrofílico) y en un caso se llegó al diagnóstico etiológico, observándose quistes de P. carinii. Se obtuvieron hallazgos microbiológicos en 6 casos: 3 inmunofluorescencias directas positivas para P. carinii (confirmados con tinción de metenamina 26 E. GARCÍA GARCÍA ET AL.- UTILIDAD DE LA F1BROBRONCOSCOPIA EN EL PACIENTE CRÍTICO PEDIÁTRICO TABLA II Indicaciones de la fibrobroncoscopia Diagnóstica Neumonía en inmunodeprimidos Complicaciones de la traqueostomía Neumonía de mala evolución Obstrucción de las vías aéreas superiores (OVAS) OVAS postextubación Estridor Dificultad de extubación Quemadura de las vías aéreas Sospecha de fístula traqueoesofágica Sospecha de cuerpo extraño Sospecha de fístula broncopleural Terapéutica Resolución atelectasia persistente Toilette bronquial N % 37 8 7 6 73 16 14 12 4 3 3 2 1 1 1 1 14 13 1 8 6 6 4 2 7 2 2 27 25 2 TABLA III Hallazgos de la inspección de la vía aérea Vías aéreas superiores Granulomas por vías aéreas artificiales Parálisis de las cuerdas vocales Edema laríngeo Laringotraqueítis purulenta Membrana subglótica congénita Lesiones por quemaduras Vías aéreas inferiores Traqueomalacia Compresión bronquial vascular Compresión bronquial adenopática Bronquio accesorio Broncomalacia Granuloma bronquial Cuerpo extraño intrabronquial Compresión bronquial por absceso Hemorragia pulmonar argéntica), un antígeno de virus respiratorio sincitial (VRS), un aislamiento de P. aeruginosa y otro de hongos del género Mucor, que confirmó el diagnóstico de mucormicosis pulmonar. En los otros grupos de pacientes no hubo hallazgos importantes. Cuatro casos presentaron hipercelularidad inespecífica. En uno de ellos, una neumonía de mala evolución, se aislaron pseudomonas y estreptococo. En un fibrótico quístico se aisló P. aeruginosa, cuya colonización ya se conocía. Rendimiento de la técnica Contribuyeron al diagnóstico o al tratamiento de nuestros pacientes 38 exploraciones (75%), haciéndolo de las siguientes formas: 1. Aportaron fm diagnóstico difícil de obtener por otros medios a través de la inspección de la vía aérea en 24 casos (47% del total) y del LBA en 5 pacientes (10% del total de FB, 28% de las veces que se realizó LBA). 2. Fueron terapéuticas en 6 ocasiones (12% del total de exploraciones, 43% de las exploraciones hechas con este fin). 27 3. Excluyeron la patología sospechada haciendo innecesarias otras exploraciones en 5 pacientes (10%). 4. Seleccionaron el antibiótico adecuado y evitaron la administración de otros en un enfermo (2%). Complicaciones En dos pacientes la realización de la FB se acompañó de hipoxemia moderada requiriendo aporte de oxígeno suplementario a través de gafas nasales, en un caso, y aumento de la asistencia ventilatoria en otro que se hallaba con ventilación mecánica. En un niño se produjo un laringoespasmo reversible con adrenalina aerosolizada. Como complicaciones graves se recogieron 2 casos: un lactante de 3 meses con cardiopatía congénita e insuficiencia cardíaca descompensada por una broconeumonía presentó una bradicardia severa que impidió completar la exploración requiriendo intubación y reanimación cardiopulmonar, y otro lactante de 2 meses que cursaba una neumonía grave sufrió un empeoramiento de su insuficiencia respiratoria que requirió intubación 7 h después de la exploración. Discusión El espectro clínico de los pacientes críticos pediátricos sometidos a fibrobroncoscopia con finalidad diagnóstica o terapéutica es amplio. Las series publicadas de FB en niños son diversas en cuanto a la importancia relativa de las indicaciones, y varían en función de la edad de los pacientes, la experiencia del grupo y la fecha de publicación. En un estudio que recopilaba la casuística de 51 centros europeos, la indicación más frecuente fue la neumonía de mala evolución8. En una serie de 95 pacientes pediátricos las más frecuentes fueron según este orden: estridor, neumonía de mala evolución y complicaciones de la traqueostomía9. En otra serie de 50 niños fueron: atelectasias y neumonía en inmunodeprimidos3. Esta última es una indicación cada vez más frecuente'. Centrándonos en las publicaciones sobre pacientes críticos, en una serie de 71 FB realizadas en intesivos pediátricos10 y en otra de 409 en adultos" la indicación más frecuente fue, como en la nuestra, la atelectasia persistente. La FB es el mejor método para el diagnóstico de las complicaciones de la intubación. El 87% de los pacientes intubados más de 24 h sufren patología laríngea en el período postextubación inmediato, y el 8% padece anomalías traqueobronquiales a largo plazo12. Los granulomas, la estenosis subglótica y la traqueomalacia son las más frecuentes'3. La sospecha de aspiración de cuerpo extraño (CE) en nuestra casuística está escasamente representado, al no ser habitualmente motivo de ingreso en Intensivos. La mejora de la técnica de la FB está permitiendo su extracción con éxito en algunos casos, así como descartar su presencia evitando una anestesia general. En 2 series publicadas, la FB descartó la presencia de CE en el 84' y el 92%14 de pacientes con sospecha de aspiración. Con respecto al LBA, los estudios sobre valores citológicos normales en niños sanos son escasos, coin527 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NUM. cidiendo con los del adulto sólo en los mayores de 8 años7-'5. En niños menores de esta edad el valor absoluto y relativo de granulocitos se encuentra elevado en condiciones normales' 6 . De forma comparable a nuestra experiencia, en la bibliografía los hallazgos citológicos suelen ser inespecíficos'. Cualquier infección bacteriana o fúngica produce un aumento del porcentaje de neutrófilos' 7 . Por otra parte, la detección de patógenos oportunistas en inmunodeprimidos suele ser rentable. Así, en dos series de 11 pacientes con sospecha de infección oportunista se encontraron 7 y 6 agentes infecciosos, respectivamente3'18 y en otra de 27 pacientes se encontraron 1519. En este último trabajo referido, al comparar los resultados del LBA con los de la necropsia y la biopsia pulmonar abierta, se demostró para aquella técnica una sensibilidad del 75% y una especificidad del 100%19. Con respecto a la contribución de la FB al diagnóstico de patología respiratoria pediátrica, en una serie extensa de 1.000 niños se obtuvo un diagnóstico endoscópico relevante en el 76% de ellas sólo por inspección 14 , cifra que sube al 86, 87 y 90% en otras series si se utiliza LBA'•3-2". El papel terapéutico de la FB se ejerce sobre todo en los pacientes con atelectasias21. En una serie de pacientes críticos pediátricos se logró efecto terapéutico en el 40% de las FB 10 . La presencia de broncopatía crónica, que conlleva cierto grado de malacia bronquial, actúa como factor negativo para el éxito de esta operación de limpieza". Las complicaciones mayores son raras en los trabajos publicados. Se menciona la parada respiratoria3'22 y la parada cardíaca10. Otras menores se observan en un 210% de los pacientes3'9. Dentro de éstas, es de especial importancia el espasmo de glotis 22 y el broncoespasmo. Leves y autolimitadas suelen ser la hipoxia durante el procedimiento, las epistaxis 22 y las reacciones febriles". En el paciente sometido a ventilación mecánica se ha de tener en cuenta que la exploración produce disminución del volumen por minuto, a causa de las fugas inevitables a través del canal de aspiración, aumento de las resistencias al flujo aéreo y aumento de la PEEP". Como consecuencia, se producen disminuciones de la saturación de oxígeno arterial hasta en un 20% de los pacientes de UC1 21 . Nuestros datos apoyan la buena tolerancia, en general, a esta técnica, tal como se describe en la bibliografía. No existen contraindicaciones absolutas para su realización, aunque algunos pacientes habituales de UCIP, como aquellos con obstrucción aérea severa, hipertensión pulmonar, coagulopatías, hipoxemia profunda y alta auto-PEEP (> 15 cm H,0) tienen un riesgo mayor y hemos de valorar minuciosamente la indicación de FB 2122 . Consideramos que la FB es una técnica útil en el diagnóstico y tratamiento de la mayoría de los pacientes 528 1999 críticos pediátricos con patología respiratoria. El campo de esta técnica es amplio y variado y dada su buena tolerancia, a pesar de tratarse de pacientes de alto riesgo, su empleo va aumentando en el ámbito de la UCIP. BIBLIOGRAFÍA 1 . Godfrey S, Avital A. Maayan C, Rotschild M, Springer C. Yield form flexible bronchoscopy in children. Pediatr Pulmonol 1997; 23: 261-269. 2. Liñán S. Broncol'ibroscopia en neumología pediátrica. An Esp Pediatr 1998:49: 1 1 3 - 1 1 5 . Raine J, Warner JO. Fibreoptic bronchoscopy without general anaesthetic. Arch Dis Child 1 9 9 1 : 66: 481-484. Wood RE. Clinical applications of ultrathin flexible bronchoscopes. Pediatr Pulmonol 1985: 1 : 244-248. Pérez J, Pérez E. Duran I, Milano G, Martínez A. Fibrobroncoscopia en el paciente pediátrico, sin anestesia general. An Esp Pediatr 1992; 37:42-46. Pérez J, Pérez E. González B. Picazo B, Martínez A. Fibrobroncoscopia infantil. Adaptación a los consensos de la American Thoracic Society. Arch Bronconeumol 1993: 29: 73-76. Ratjen F. Bredendiek M. Brendel M, MeItzerJ, Costabel U. Differential cytology of bronchoalveolar lavage fluid in normal children. Eur Respir J 1994:7: 1.865-1.870. Barbato A. Magarotto M, Crivellaro M, Novello A, Cracco A, De Blic J et al. Use ofthe paediatric bronchoscope. flexible and rigid. i n 5 1 European centres. Eur Respir J 1997; 10: 1 . 7 6 1 - 1 . 7 6 6 . Fitzpalrick SB. Marsh B, Stokes D, Wang KP. Indieations for flexible fiberoptic bronchoscopy in pediatric patients. Am J Dis Child 1983; 137:595-597. 10. Ramos MV. Matute JA, Sánchez JI. Gómez P, Romero Y, Mar F. Broncoscopia en la unidad de cuidados intensivos pediátricos. XXVII Congreso de la Asociación Española de Pediatría. Oviedo, 1997. 1 1 . Marín A. Xaubet A, Estopa R. La fibrobroncoscopia en cuidados intensivos. Arch Bronconeumol 1982: 1 8 : 319-325. 12. Thomas R. Kumar EV, Kameswaran M. Shamim A, Al Ghamdi S, Mummigatty AP et al. Post intubation laryngeal sequelae in an intcnsive care unit. J Laryng Otol 1995: 109: 3 - 13-316. 1 3 . Denoyelle F. Garabedian EN. Tracheobronchial complications of assistcd ventilation in children. Rev Malad Respir 1996: 1 3 : 259264. 14. Wood RE. The diagnostic effectiveness of the flexible bronchoscope in children. Pedialr Pulmonol 1 9 8 5 : 1 : 1 8 8 - 1 9 2 . 15. Riedler J. Grigg J. Stone C. Tauro G. Robertson CF. Bronchoalveolar lavage cellularitv in healthv children. Am J Respir Crit CareMed 1995: 152: 1 6 3 - 1 6 8 . 16. Ratjen F. Costahel U. Bronchoalveolar lavage in childhood: technical aspects and rclerence valúes. Pneumologie 1997: 5 1 : 93-98. 1 7 . Ratjen F. Costahel U. Havers W. Differential cytology of bronchoalveolar lavage fluid in immunosuppressed children with pulinonary infiltrates. Arch Dis Child 1996: 74: 507-51 1 . 1 8 . Riedler J. Grigg J. Robertson CF. Role of bronchoalveolar lavage in children wilh lung disease. Eur Respir J 1995: 8: 1 . 7 2 5 - 1 . 7 3 0 . 19. McCubbin NM. Trigg ME. Hendricker CM. Wagener JS. Broncoscopy with bronchoalveolar lavage in the evaluation of pulmonarv complications oí' hone marrow transplantation in children. Pediatr Pulmonol 1992: 12:43-47. 20. Andrés A. Pineda M. Fernández J. Fibrobroncoscopia pediátrica. Nuestra experiencia. Arch Bronconeumol 1995: 3 1 : 519-525. 2 1 . Rasidakis A, Orphanidou D, Jordanoglou J. Fibreoplie bronchoscopy in mechanically ventilatcd patients. Eur Respir Mon 1998: 8: 224-245. 22. Bautista A. Estévez E. Buznego R. Rodríguez E. Cabanas R. Várela R. Fibrobroncoscopia pediátrica. A propósito de 55 niños explorados. An Fsp Pediatr 1993: 39: 313-316. 28 ORIGINALES Asma en urgencias: ¿podemos disminuir la tasa de reingresos tras el alta? A. Campo, J.B. Galdiz, M. Iriberri, I. Pascal y V. Sobradillo Unidad de Patología Respiratoria. Hospital de Cruces. Baracaldo. Vizcaya. Existe una tasa variable de reingresos en pacientes que acuden al servicio de urgencias por crisis asmática. En nuestro medio encontramos en el año 1991 una tasa de reingresos tras el alta de urgencias de un 9%. Las recomendaciones para el alta en urgencias hospitalarias se basan en estudios sobre el número de reingresos o la solicitud de asistencia médica. No existen trabajos que valoren la estabilidad posterior al alta y los factores relacionados con ella. OBJETIVOS: Valorar la evolución, estabilidad clínica, de los pacientes en el período inmediato tras el alta de urgencias. Valorar si existe algún parámetro predictivo de dicha estabilidad. Valorar la tasa de reingresos en el período de un mes después del alta tras la aplicación de un protocolo de tratamiento, decisión de alta y control posterior en 72 h. MATERIAL Y MÉTODOS: Estudio prospectivo, descriptivo con control a las 72 h y al mes del alta. Lugar: servicio de urgencias y neumología de un hospital general. Período de 6 meses. Pacientes: 82 pacientes asmáticos dados de alta del servicio de urgencias. RESULTADOS: Reingresaron 2 pacientes (2,43%). En un primer control (72 h) fueron visitados 81 pacientes (98,78%), y en un segundo control, 66 pacientes (80,5%). Se observó estabilidad en el 70,3% de los pacientes a las 72 h y en el 86,4% al cabo de un mes. En el primer control existían diferencias en cuanto a la estabilidad si el PEF al alta había sido mayor o menor del 70% (76,92 frente a 46,66%) (p < 0,05). No se encontraron otros signos clínicos, epidemiológicos o de tratamiento al alta que influyeran en la posterior estabilidad. CONCLUSIONES: a) una alta proporción de pacientes se encuentran inestables a las 72 h tras el alta; b) un PEF al alta superior al 70% incrementa de manera significativa la estabilidad a las 72 h; c) nuestra tasa de reingresos, un mes posterior tras el alta ha sido muy baja (2,43%), y d) no se observan diferencias en la estabilidad según hubieran recibido o no corticoides orales al alta. INTRODUCTION: The rate of readmission among asthmatic emergency patients varíes. In 1991 we observed a 9% rate of readmission following emergency room reléase. Studies of the number of readmissions or request for medical care are used as the basis for recommendations for releasing patients from hospital emergency care. No studies have assessed disease stability following reléase or factors related to stability. OBJECTIVES: To assess the course of disease and clinical stability of patients in the period immediately following reléase from emergency room care. To determine factors that might predict such stability. To determine the rate of readmission in the month following reléase after appiying a treatment protocol and reléase criteria, with follow-up examination 72 h later. MATERIAL AND METHODS: Prospective, descriptive study with follow-up 72 h and one month after reléase. Setting: Emergency and pneumology departments of a general hospital. Period: six months. Patients: 82 asthmatic patients released from the emergency room. RESULTS: Two patients (2,43% were readmitted. At the first follow-up visit (72 h) 81 patients (98.78%) were seen. At the scond visit, 66 patients (80.5%) were examinated. We observed stability in 70.3% of patients at 72 h and in 86.4% after on month. Stability was statistically related to whether peak expiratory flow greater or less than 70% (76.92% stable versus 46.66% unstable) (p < 0.05). No other clinical, epidemiological or treatment variables recorded upon reléase were found to influence stability. CONCLUSIONS: 1) A large proportion of patients are in stable conditfon 72 h after reléase. 2) When peak expiratory flow upon reléase is > 70%, stability is significantly increased 72 h later. 3) Our 2.43% rate of readmission one month after reléase is very low. 4) No differences in stability were seen to be related to oral corticoid prescription upon reléase. Palabras clave: Reingresos. Asma agudo. Peak-Flow. Key words: Readmission. Acute asthma. Peak flow. Asthma emergencies: can we lower the rate of readmission after reléase? (Arch Bronconeumol 1999; 35: 529-534) Introducción Es conocido que una alta proporción de pacientes que acuden al servicio de urgencias hospitalarias por Correspondencia: Dra. A. Campo. Unidad de Patología Respiratoria. Hospital de Cruces Pl. de Cruces, s/n. 48903 Baracaldo. Vizcaya. Recibido: 16-3-99; aceptado para su publicación: 29-6-99. 31 una crisis asmática reingresan en el período posterior inmediato al alta, oscilando las cifras según las series entre un 4,06 y un 25 %'- 2 . Existen diversas guías de tratamiento4'8 que han buscado minimizar este porcentaje de reingresos mediante criterios de valoración de alta empleando el VEMS o pico flujo espiratorio (PEE) con la instauración de tratamientos consensuados, sin que exista actualmente una529 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NUM. 1 1, 1999 nimidad respecto a qué límites de estos parámetros emplear. Algunas de estas guíass indican de manera concreta la necesidad de un control en un período de 48-72 h tras el alta, sin que existan trabajos que hayan valorado el porcentaje de pacientes que presentan inestabilidad en este período de tiempo. Los pacientes que sufren una reagudización asmática presentan los días posteriores aumento de labilidad bronquial así como persistencia de los síntomas, que puede deberse bien a un tratamiento insuficiente o a las características de la propia crisis11'1". Esta inestabilidad clínica y funcional se ha valorado escasamente en los estudios de seguimiento. En 1991", realizamos un análisis del porcentaje de reingresos de los pacientes asmáticos dados de alta en el servicio de urgencias obteniendo una tasa de reingresos del 9%. Pacientes y métodos Diseño Estudio prospectivo longitudinal y descriptivo. Población Estudio llevado a cabo en los servicios de urgencias y neumología del Hospital de Cruces (Baracaldo, Vizcaya), un hospital general de 1.000 camas que cubre un área de población de 360.000 habitantes. bulizaciones cada 20 min y posteriormente horarias en función de la evolución e incremento del PEE. Recibieron corticoides i.v. u orales (0,7-1 mg/kg) los pacientes con datos clínicos de gravedad o PEE inicial inferior al 40%. Los criterios al alta eran los recomendados por la SEPAR5, un PEE superior al 70% o entre el 50 y el 70% cuando no existían criterios de gravedad al alta. El tiempo máximo en urgencias era de 6 h. Seguimiento A los pacientes se les prescribió tratamiento al alta según criterio del neumólogo que lo atendía. Se inició monitorización domiciliaria del PEE matinal y nocturno, facilitándose al paciente un aparato de medición de las mismas características que el empleado en urgencias. Fue valorado en el servicio de neumología al cabo de 3 días. Se consideraron clínicamente estables aquellos pacientes que precisaban beta 2 de rescate en número inferior a cuatro veces al día, ausencia de síntomas nocturnos y con una variabilidad del PEE (PEE matutino PEE nocturno/PEF máximo al día) menor del 20%. Aquellos pacientes que no cumplían alguno de estos criterios se les modificó el tratamiento según criterio del neumólogo. Los pacientes fueron citados para un segundo control al cabo de un mes con evaluación de la estabilidad clínica de forma similar. Se consideró reingreso cuando alguno de los pacientes necesitó acudir al servicio de urgencias durante el período de seguimiento. Se confirmó que los pacientes no habían reingresado en otros centros de nuestro ámbito geográfico mediante contacto telefónico. Análisis estadístico Período Durante 9 meses se incluyeron pacientes mayores de 14 años que acudieron a urgencias por rcagudi/.ación asmática, siempre que hubiera algún neumólogo de guardia en dicho servicio. Criterios de inclusión Pacientes de edad superior a 14 años con diagnóstico de asma según criterios de la ATS' con reagudización entendida como disnea y hroncospasmo. Se excluyeron los pacientes con historia sugestiva o diagnóstico de EPOC. neumonía, neumotorax o insuficiencia cardíaca, así como ingreso en urgencias en el último mes. Método Se recogieron las características referentes a la edad, sexo, ingresos previos en urgencias, planta o UCI y seguimiento previo por el especialista. Se reseñaron los datos relacionados con las crisis: tactores precipitantes, duración de los síntomas, exploración física (frecuencia cardíaca y respiratoria, cianosis. uso de musculatura accesoria y auscultación). Se registró el valor de PEE. Se denominó crisis moderada grave si presentaban signos clínicos de gravedad (presencia de taquipnea mayor a 24 rpm o uso de musculatura accesoria) y/o PEF al ingreso inferior al 40%. La medición del PEE se realizó mediante aparato Minibell, tomándose los valores porcentuales respecto al teórico en función de la edad y la talla según los valores normales de Gregg y Nunn' 2 '". En los pacientes que presentaban crisis moderadas graves se realizó gasometría, hematimetría y radiografía de tórax. Pauta de tratamiento Tras la valoración de la crisis se inició tratamiento según las recomendaciones de la SEPARS. Se administraban inicialmente 2,5 mg de salbutamol nebulizado, seguidos por otras 2 ne530 Se analizaron las diferencias en la evolución clínica de los pacientes en relación a parámetros como edad. antecedente de ingresos previos, signos clínicos de gravedad, valor de PEF al ingreso y al alta. Se valoró la influencia de los diferentes tratamientos en el curso evolutivo. Se utilizó el test de ^ para comparar datos cualitativos o de rango numérico y el test de la t de Student para variables cuantitativas. Se consideraron estadísticamente significativos valores de p < 0,05. Los datos se presentan como media ± desviación típica. Resultados Características de los pudentes Se incluyeron inicialmente 93 pacientes que acudieron a urgencias, cuyas características se exponen en la tabla I. Como datos más reseñables se observa que el 88% (82/93) de los pacientes fueron dados de alta. De los ingresados, 10 lo hicieron en planta y uno en la UCI. La edad de los pacientes dados de alta era significativamente inferior (p < 0,05). y el PEE al ingreso significativamente superior (p < 0,001) respecto a los pacientes ingresados. Características clínica y funcionales ( P E F ) de los pacientes dados de alta El valor de PEE al alta fue superior al 70% en 65/81 (80,24%), y en 15/81 (18.5%) se encontraba entre el 50 y el 70%. Exceptuando un paciente, todos los dados de alta habían presentado una mejoría superior a un 20% del PEE respecto al valor del ingreso. Un paciente presentó un PEE al alta inferior al 50%, pero se consideró que rea- A. CAMPO ET AL- ASMA EN URGENCIAS: ¿PODEMOS DISMINUIR LA TASA DE REINGRESOS TRAS EL ALTA? Fig. 1. Porcentaje de pacientes estables en el pril ler control, a las 72 h, en función del PEF al ingreso en urgencias. Fig. 2. Porcentaje de pacientes estables en el primer control, a las 72 h, en función del PKF al alta. lizaba incorrectamente la maniobra y fue excluido del análisis estadístico. Este paciente se mantuvo clínicamente estable durante todo el período de seguimiento. la estabilidad en función del PEE al alta. Así, los pacientes con un PEE > 70% presentaban un mayor porcentaje de estabilidad (72,92%) respecto a los pacientes con PEF al alta entre 50 y 70% (46,66%) (p < 0,05). Si tomamos como valor de PEE al alta un valor superior al 80% únicamente el 12% se encontraban inestables. Se valoró si el PEE < 40% al ingreso o los signos de gravedad en la urgencia influyeron en la posterior evolución tras el alta, observándose una estabilidad inferior aunque no significativa. En las figuras 1 y 2 se observan los porcentajes de estabilidad en relación con los percentiles del valor de PEE al ingreso y al alta. No existían diferencias respecto a la edad o a antecedentes epidemiológicos. No se encontró relación significativa entre estabilidad clínica y factores como la administración previa de corticoides o el antecedente de corticodependencia. Tampoco existían diferencias significativas en cuanto al tratamiento pautado al alta. De los pacientes con PEE al alta entre 50 y 70%, un 87%' (13/15) recibieron corticoides. Este porcentaje había sido del 46% (30/65) en el grupo de PEE > 70%. No se observaron diferencias significativas de estabilidad en el primer control en función de dicho tratamiento (fig. 3). Primer control (72 h) En el primer control fueron visitados 81/82 pacientes dados de alta (98,38%) ya que un paciente reingresó en los primeros 3 días. Se encontraban inestables 23/81 (28%). Existían diferencias significativas (p < 0,05) en TABLA 1 Características clínicas epidemiológicas y de función pulmonar (PEF) de los pacientes en función de la decisión médica tomada en urgencias, ingreso o alta Característica Número de pacientes Edad (media) (años) Sexo(V/M) Ingreso previo en urgencias Ingreso previo en planta Ingreso previo en la UCI PEF al ingreso (1/m) PEF % al ingreso/PEF teórico Control especialista Datos clínicos al ingreso Frecuencia respiratoria Frecuencia cardíaca 33 Ingresos Alia p 11 47,1 ± 2 2 4/6 X2 26,7 ± 15,2 < 0.05 40/42 NS 7 (70%) 28(34,1%) < 0,05 6 (60%) 19(23,17%) <0,05 1 (10%) 162±83 4 (4,87%) NS 284 ± 1 0 1 < 0.001 32,2 ± 13 3/11 55.54± 19 < 0,001 52/82 NS 31 ±4,6 104,7 ±23 23,8 ±7,21 <0,01 96 ± 17 NS Segundo control (un mes tras el alta) Fueron visitados 66 pacientes de los cuales se encontraban inestables nueve (13,6%). No encontramos relación entre estabilidad en este control y parámetros generales de los pacientes, como edad o antecedentes de ingresos previos en urgencias. Un paciente con datos de 531 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NUM. 11, 1999 Fig. 3. Evolución de los pacientes desde el alta hasta el primer control. Se indican los pacientes que reingresaron, los que se encontraban estables en este primer control y el número de los que habían recibido corticoides orales al alta. *p < 0,05, entre ambos grupos. inestabilidad en el primer control requirió ingreso en el hospital dos días más tarde pese al cambio realizado en su tratamiento al alta de urgencias, lo que hace que la tasa global de reingresos sea del 2,43%. Catorce pacientes no acudieron a este segundo control aunque existe constancia de que no acudieron a urgencias de nuestro hospital ni de otros hospitales de nuestra área. Las características de estos 14 pacientes en cuando a edad, PEF al ingreso, alta y a las 72 h, así como el porcentaje de pacientes inestables en el primer control eran similares a los controlados (tabla II). De los 9 pacientes inestables en este control, siete se habían encontrado estables en el primer control, existiendo dos pacientes con criterios de inestabilidad en los dos controles. Discusión Son abundantes los trabajos14'17 que valoran los factores que pueden predecir los reingresos en un servicio de urgencias después de una crisis aguda de asma. Sin embargo, son escasos10'17'18 los que han tenido en cuenta TABLA II Comparación de las características de edad, valores del PEF y estabilidad entre los pacientes controlados y los que no acudieron al segundo control, un mes tras el alta Característica Edad PEF al ingreso PEF % al ingreso PEP al alta PEF % al alta PEF 72 h PEP%72h Estabilidad 72 h 532 Pacientes controlados (n=65) Pacientes perdidos (n = 14) (t Student) 27,01 ± 16,49 288,09 ±102,2 56,38 ± 19,05 406,3 ± 98,29 79,35 ± 15,34 430,15 ± 89,36 85,19 ±16,82 49/65(73,8%) 26,42 ±9,17 275 ±102,71 54,12 ± 20,28 398,57 ± 71,98 78,29 ± 12,36 438,57 ± 98,76 85,93 ± 17,39 8/14(57,14%) NS NS NS NS NS NS NS NS la persistencia de síntomas o la estabilidad funcional en el período inmediato tras el alta. Los estudios de seguimiento de los pacientes dados de alta por crisis aguda de asma se han limitado en su mayoría a un control de reingresos o solicitud de asistencia médica o bien a un seguimiento telefónico, en ocasiones con pérdida de un número importante de pacientes. En nuestro medio. Castillo' valoró el ingreso del paciente asmático en el servicio de urgencias hospitalario de tercer nivel y observó una frecuencia de reingresos de un 4,06%, lo que representa una cifra baja comparada con otros autores2'16, que presentan cifras entre un 4,75 y un 25%. Sin embargo, su tasa de ingresos desde urgencias era muy alta (36,47%), claramente superior a la cifra observada tanto en el trabajo de Real6 como en el nuestro, donde fue del 12%. Castillo concluye que sus datos sugieren una relación entre un mayor número de ingresos y una menor tasa posterior de recaídas. Nuestra experiencia previa en 1991", en el seguimiento de 142 pacientes tras ser dados de alta y con control en el plazo de un mes, nos presentaba un porcentaje de reingresos de un 9%, probablemente inferior al real porque en dicho trabajo no se realizó control de ingresos en otros hospitales, lo que hace que esta cifra sea un valor mínimo pudiendo asumirse que la tasa real fuera mayor. Esta tasa del 9% se puede considerar baja en comparación con otras series, pudiendo justificarse por la existencia de una jerarquización ya consolidada por esas fechas, lo que conlleva un mejor control ambulatorio del paciente. La tasa actual del 2,43% es claramente inferior. Perdimos 14 pacientes en el segundo control pero tenemos constancia de que solamente dos pacientes, uno de ellos antes de los tres días del primer control y otro en el plazo del mes tras el alta, debieron acudir de nuevo a urgencias, lo que sugiere que con el protocolo actual se consigue un descenso en el número de reingresos, siendo este porcentaje inferior, asimismo, al de otras series2'16'23'28. 34 A. CAMPO ET AL- ASMA EN URGENCIAS: ¿PODEMOS DISMINUIR LA TASA DE REINGRESOS TRAS EL ALTA? Existen trabajos9-10 habitualmente diseñados para valorar la importancia del tratamiento con corticoides orales en la evolución tras el alta en urgencias, que han controlado el número de reingresos tras dicho alta, pero no con la metodología empleada por nosotros. Littenberg9 realizó un estudio con administración aleatorizada de metilprednisolona en urgencias y seguimiento posterior mediante contacto telefónico, y encontró un 42% de recaídas, cifra muy superior a la obtenida en nuestro trabajo. Stein10 no encontró beneficios en la administración temprana de esferoides en urgencias pero sí observó que una rápida mejoría en urgencias marcaba una posterior evolución favorable, tras controlar a los 2 y 7 días a 77 pacientes asmáticos mediante contacto telefónico. Rose et al20 realizaron un seguimiento telefónico de 107 pacientes dados de alta tras una crisis aguda de asma. Consideraron recaídas las visitas no programadas al médico o reingresos en urgencias y observaron un índice de recaídas de un 14% en un período de 10 días tras el alta. Sin embargo, en este trabajo se habían excluido 26 pacientes por falta de datos y 25 por no tener teléfono. Los valores absolutos del PEF al alta no eran diferentes en los pacientes que recaían o no. Por todas estas razones, el objetivo de nuestro trabajo ha sido no sólo cuantificar la tasa de reingresos sino también evaluar clínica y funcional mente la evolución de la crisis en un plazo de 72 h y un mes. De esta manera podremos predecir cuáles son los pacientes susceptibles de control médico en un período corto de tiempo y en quiénes se puede obviar dicho control o al menos su indicación no debe ser tan estricta. Tuvimos en cuenta la persistencia de síntomas, la necesidad de medicación y la variabilidad diurna del PEF, que son criterios más sensibles que la necesidad de acudir de nuevo a urgencias. Todos los pacientes de nuestro estudio habían recibido un tratamiento consensuado en urgencias y fueron visitados en el primer control realizado a los 3 días tras el alta. Por otro lado, y pese a que el valor del PEF como criterio del alta es reconocido en los diversos consensos, el porcentaje del PEF aconsejado como indicativo de estabilidad clínica tras una crisis continúa siendo un punto de divergencia. El valor tomado como referencia varía de un 50 hasta un 75% del teórico según las distintas guías; así, Gina 4 considera un 70%, Separ5, un 70%, International Consensus6 un 70%, British Thoracic Society7, un 75% y Hargreaves un 50%. Otros autores proponen el 70% como cifra más oportuna, basándose en diversos trabajos de Nannini 2 ', Kelsen 22 y Brenner23. En nuestro trabajo el valor del PEF obtenido por el paciente para ser dado de alta ha sido el 70% del teórico pero ampliando dicho valor al 50-70% cuando no existían criterios clínicos que desaconsejaran dicha alta, según recomendaciones de la SEPAR5. Se observó que en ese segundo grupo existía una tasa de estabilidad en el primer control significativamente inferior a los primeros. Estas diferencias no se explicarían por otros factores como un tratamiento al alta diferente, en concreto a la administración o no de corticoides, ya que prácticamente la totalidad de los pacientes con un PEF al alta entre un 50 y un 70% en el 87,5% lo habían recibido y un 35 46% de los pacientes con un PEF superior al 70%, no existiendo diferencias entre los que habían sido medicados y los que no. La importancia de los corticoides en la evolución tras el alta es un tema controvertido y hay trabajos a favor24 y en contra25-26. En general, se acepta el efecto beneficioso de dicho tratamiento27 en la disminución de la tasa de reingresos. La mayor parte de los trabajos que valoran dicha efectividad hacen mención al número de reingresos en un período de tiempo superior a 10 días y se refieren a la totalidad de los pacientes independientemente de los valores del PEF que presentaran al alta de urgencias. No observamos diferencias en los pacientes tratados con o sin corticoides, si bien no se pautaron de forma aleatorizada. El 94,5% (35/37) de los pacientes que no recibieron corticoides tenían un valor de PEF al alta superior al 70%, lo que no nos permite definir el papel protector de los corticoides en los pacientes con un grado mayor de severidad asmática frente a los que no los recibieron. Otro factor valorado fue la relación entre la estabilidad de los pacientes y los valores de PEF que presentaban cuando acudían inicialmente al servicio de urgencias. No se observó una relación entre peor PEF inicial y mayor inestabilidad si los pacientes mejoraban lo suficiente para alcanzar al menos el 70% de su PEF teórico. Esto concuerda con otros estudios como el de Nowak' 8 - 19 , que realizó una valoración a las 48 h del alta de urgencias mediante un cuestionario de síntomas. De los 70 pacientes dados de alta 20 (28,57%) continuaban con síntomas a las 48 h y los otros 50 se encontraban asintomáticos, con lo que las cifras son muy similares a las que encontramos en nuestro trabajo. En el trabajo de Nowak los pacientes inestables en 48 h presentaban un PEF al alta de urgencias significativamente menor (216,7 1/m, 52,2%) que los estables (322,7 1/m, 71,7%). El tratamiento de urgencias no había sido consensuado ni se evaluó la influencia del tratamiento con corticoides. Con todos estos datos parece concluirse que la cifra de un .70% del PEF teórico al alta es adecuada, si bien en nuestro caso si dicha cifra se eleva al 80% sólo el 12% de los pacientes se encontraban inestables en el primer control. En valores inferiores al 70% se observa una persistencia importante de síntomas o labilidad de flujos que ha de tenerse en cuenta, asegurando cuando se decide el alta un control a corto plazo y una necesidad de cumplimiento terapéutico. No acudieron al segundo control 14 de los 81 pacientes vistos en el primer control pero tenemos constancia de que sólo dos de ellos debieron acudir de nuevo a urgencias durante el período del estudio, no existiendo constancia de ingresos en otros hospitales de nuestra área. Las características de estos pacientes en que sólo ha existido un control (tabla II) no diferían en cuanto a gravedad, edad o valores del PEF de aquellos que concluyeron todo el seguimiento del estudio. Existe un porcentaje de pacientes (13,6%) que continúan inestables al mes del alta a pesar de haber realizado un primer control a las 72 h. Es por tanto deseable un control médico de estos pacientes tanto en el período inmediato tras el alta como a corto plazo, ya que es fre533 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NÚM. cuente la necesidad de ajuste del tratamiento, confirmándose la necesidad en algunos pacientes de un período prolongado de tiempo para conseguir la estabilidad clínica tras una crisis aguda asmática. Conclusiones Pode mos resumirlas en cuatro puntos: 1. Existe una alta proporción de pacientes con criterios de inestabilidad a las 72 h del alta. 2. Un PEF al alta > 70% incrementa de manera significativa la estabilidad a las 72 h. 3. La tasa de reingresos en el mes posterior al alta ha sido muy baja (2,43). 4. No se observan diferencias en la estabilidad según los pacientes hubieran recibido o no corticoides al alta. BIBLIOGRAFÍA 1 . Castillo A. Frecuentación del paciente con asma agudizada a la Urgencia hospitalaria de tercer nivel. Rev Clin Esp 1994; 194: 325-329. 2. Emerman CL; Cydulka RK. Factors associated with relapse after emergency department treatment for acute asthma. Ann Emerg Med 1995; 26: 6-11. 3. American Thoracic Society. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease (COPD) and asthma. Am Rev RespirDis 1987; 136: 225-244. 4. Global strategy for asthma management and prevention. NHILBI AVHO workshop report, 1995. NHLBI Publication n.° 96-3659B. 5. De Diego A, Casan P, Duce F, Gáldiz JB, López Viña A, Manresa F et al. Recomendaciones para el tratamiento de la agudización asmática. Arch Bronconeumol 1996; 32 (Supi I): 1-7. 6. Sheffer AL. International consensus report on diagnosis and treatment of asthma. EurRespirJ 1992; 5: 601-641. 7. British Thoracic Society, Research Unit of College of Physicians of London, King's Fund Centre National Asthma Campaign. Guidelines on the management of asthma in adults II. Acute severe asthma. Br Med J 1990; 301: 797-800. 8. Hargreave FE, Dolovich J, Newhouse MT. The as.sessment and treatment of asthma: a conference report. J Allergy Clin Immunol 1990; 85: 1.098-1.111. 9. Littenberg B, Gluck EH. A controlled trial of methylprednisolone in the emergency treatment of acute asthma. N Engí J Med 1986; 314:150-152. 10. Stein LM, Colé RP. Early administration of corticosteroids in emergency room treatment of acute asthma. Ann Intern Med 1990; 112:822-827. 534 1999 1 1 . Morell F, Sobradillo V. Ponencias. Tratamiento del asma en Urgencias. Reunión de Invierno del Área de Asma e Hiperreactividad Bronquial SEPAR. Toledo, 1991. 12. Gregg I, Nunn AJ. Peak expiratory flow in normal subjects. Br MedJ 1973; 3: 282-284. 13. Nunn AJ, Gregg I. New regression equations for predicting PEF in adults. Br Med J 1989; 298: 1.068-1.070. 14. Fischi MA, Pitchenik A, Gardner LB. An Índex predicting relapse and need for hospitalization in patients with acute bronchial asthma. N Engí J Med 1 9 8 1 ; 305: 283-289. 15. Centor RM, Yarbrough B, Wood JP. Inability to predict relapse in acute asthma. N Engí J Med 1984; 310: 577-580. 16. Rea HH, Garret JE, Mulder J, Chapman KR, White JG, Rebuck AS. Emergency room care of asthmatics: a comparison between Auckiand and Toronto. Ann Allergy 1991; 66: 48-52. 17. Janson C, Herala M. Blood eosinophil count as a risk factor for relapse in acute asthma. Respir Med 1992; 86: 101-104. 18. Nowak RM, Tomianovich MC, Sarkar DD, Kvale PA, Anderson JA. Arterial blood gases and pulmonary function testing in acute bronchial asthma. Predicting patient outcomes. JAMA 1983; 249: 2.043-2.046. 19. Nowak RM, Pensler ML, Sarkar DD, Anderson JA, Kvale PA, Ortiz AE et al. Comparison of peak expiratory flow and FEV1 admission criteria for acute bronchial asthma. Ann Emerg Med 1982; 11:64-69. 20. Rose CC, Murphy JG, Sanford J. Performance of an Índex predicting the response of patients with acute bronchial asthma to intensive emergency department treatment. N Engí J Med 1984; 310: 573-577. 21. Nannini U. Which PEF Valué is the Be.st? Chest 1995; 107: 1.475-1.476. 22. Kelsen SG, Kelsen DP, Fleeger BF, Jones AC, Rodman T. Emergency room assessment and treatment of patients with acute asthma. Am J Med 1978; 64: 622-628. 23. Brenner B, Martin S. The acute asthmatic patient in the ED: to admit to discharge. Am J Emerg Med 1998; 16: 69-75. 24. Chapman KR, Verbeek PR, White JG, Rebuck AS. Effect of a short course of prednisone in the prevention of early relapse after the emergency room treatment of acute asthma. N Engí J Med 1991:324:788-794. 25. Rodrigo C, Rodrigo G. Early administration of hydrocortisone in the emergency room treatment of acute asthma controlled clinical trial. Resp Med 1994; 88: 755-761. 26. Engel T, Heini JH. Glucocorticosteroid therapy in acute severe asthma, a critical review. Eur Resp J 1991; 4: 881-889. 27. Rowe BH, Keller JIL, Oxman AD. Effectiveness of steroid therapy in acute exacerbations of asthma: a meta-analysis. Am J Emerg Med 1992; 10:301-310. 28. McCarren M, McDermott MF, Zalenski R, Jovanovic B, Marder D, Murphy DG et al. Prediction of relapse within eight weeks after an acute asthma exacerbation in adults. J Clin Epidemiol 1998; 51:107-118. 36 ORIGINALES Tratamiento del tabaquismo con nebulizador nasal de nicotina. Resultados de un estudio multicéntrico C.A. Jiménez Ruiz, S. Fiórez Martín, A. Ramos Pineda, J.J. Lorza, M.A. Hernández-Mezquita, S. Solano Reina y M. Barrueco Perrero Grupo de Trabajo Tratamiento del Tabaquismo. Área de Tabaquismo. Sociedad Española de Neumologfa y Cirugía Torácica. SEPAR. Hemos realizado un estudio multicéntrico abierto de seguimiento con el objetivo de mostrar la eficacia de un tratamiento de tabaquismo que combina el apoyo psicológico más la utilización de nebulizador nasal de nicotina. Se han estudiado un total de 57 sujetos (37 varones, 20 mujeres) con edad media de 40,3 ± 15,7, fumadores de 37,4 ± 4,7 cigarrillos/día y con puntuación media en el test de Fagerstrom de 8,9 ± 1,1. Fueron tratados con apoyo psicológico mínimo y nebulizador nasal de nicotina a una dosis recomendada de 1-2 mg/h, mientras el sujeto estuviera despierto, durante un período de 3 meses reduciendo la dosis progresivamente. Los sujetos fueron visitados en 6 ocasiones (primer día de consulta y a la primera, segunda y sexta semana después del día de abandono, y al tercero y sexto mes). Al tercer mes de seguimiento 22 pacientes (39%) permanecían abstinentes, y al sexto mes no fumaban sólo 20 (35%), de los 57 que habían sido incluidos. Aunque la mayoría de los sujetos (más del 90% en los primeros 15 días, y más del 50% a los 3 meses) utilizaron el tratamiento, sólo un escaso porcentaje de ellos (3%) lo hacían a las dosis adecuadas en los primeros 15 días, y el 31% a los 3 meses de seguimiento. La puntuación media de la valoración del síndrome de abstinencia se triplicó con respecto a la basal en las primeras 6 semanas de seguimiento. Más de las tres cuartas partes de los sujetos sufrieron efectos adversos producidos por el nebulizador, siendo los más frecuentes la irritación nasal, la rinorrea y el lagrimeo; 5 pacientes (8,7% del total) abandonaron el estudio por intolerancia a la medicación. En conclusión, nuestro estudio señala un 35% de éxitos en la abstinencia a los 6 meses de seguimiento, una infrautilización de la medicación prescrita, un incremento de la intensidad del síndrome de abstinencia y una alta prevalencia de reacciones adversas en los primeros días de tratamiento. We have carried out an open multicenter follow-up study of the efficacy of a smoking cessation therapy that combined psychological support with use of a nicotine nasal spray. Fifty-seven subjects (37 men, 20 women) with a mean age of 40.3 ± 15.7 yr and smoking 37.4 ± 4.7 cigarettes per day were enrolled. The mean Fagerstrom test score was 8.9 ± 1.1. Patients received minimal psychological support and were prescribed a nicotine nasal spray at the recommended dose of 1 to mg/h for use while awake for a period of three months, with gradual reduction of dose. Subjects were seen on six occasions (on the first day of consultation; 1, 2 and 6 weeks after quitting; 3 and 6 months after quitting). After three months of follow-up, 22 patients (39%) were abstinent; six months after first trying to quit, oniy 20 of the 57 enrolled had suceeded (35%). Although most subjects (over 90% in the first 15 days, and over 50% at three months) used the treatment, oniy a small percentage (3%) followed the appropriate doses in the first 15 days and 31% reported doing so at the three-month checkup. The mean score reflecting withdrawai syndrome tripled over baseline level during the first six weeks of follow-up. Over theree quarters of the subjects suffered side effects caused by the spray, the most common being nasal irritation, rhinorrhea and tearing. Five patients (87%) lefthe study because of intolerance to medication. In conclusión, our study found a rate of success of 35% after six months of follow-up. Use of the prescribed medication was inadequate; withdrawai syndrome was more intense and the prevalence of side effects increased during the early treatment period. Palabras clave: Tabaquismo. Nicotina. Tratamiento. Key words: Smoking cessation. Nicotine. Treatment. Nasal nicotine spray treatment for smokers. Results from a multicenter study (Arch Bronconeumol 1999: 35: 535-538) Introducción La terapia sustitutiva con nicotina combinada con apoyo psicológico mínimo es una forma de tratamiento Correspondencia: Dr. C.A. Jiméne/. Unidad de Tabaquismo. Servicio de Neumologfa. Hospital Universitario de la Princesa. Diego de León, 62. 28006 Madrid. Correo electrónico: Cjimenez C^hup.es Recibido; 13-4-99; aceptado para su publicación: 22-6-99. 39 del tabaquismo que ha resultado eficaz en estudios aleatorizados a doble ciego y controlados con placebo'-2. Existen dos tipos de sistemas de liberación de nicotina, unos lentos, con los que se alcanzan concentraciones plasmáticas con efecto terapéutico al cabo de las 6-8 h de ser utilizados, y otros rápidos, con los que esas concentraciones son alcanzadas en los primeros 30 min después de su utilización 3 . Prototipo de los primeros es el parche y de los segundos el chicle y el nebulizador 535 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NÚM. 11, 1999 nasal. Pero, sin duda, es este último el sistema con el que más rápidamente se alcanzan valores terapéuticos de nicotina en plasma sanguíneo4. La eficacia del nebulizador nasal de nicotina utilizado durante un año a dosis progresivamente decrecientes ha sido probada tanto a corto como a largo plazo. Diversos estudios han señalado un índice de abstinencia al tercer mes de seguimiento que oscilaba entre el 46 y el 39% en el grupo activo y el 17-19% en el placebo (p < 0,001). A los 6 meses estas cifras fueron 35-29% frente a 18-12% (p < 0,001). Los resultados a un año fueron 27-24% frente a 9-7% (p < 0,001)5-7. Más recientemente, se ha publicado un estudio que arroja un índice de abstinencia a los 3 años y medio de seguimiento del 15% para nebulizador activo frente al 6% para el placebo8. En otro estudio, en el que además se utilizaron parches de nicotina durante 5 meses, se realizó un seguimiento de 6 años y al cabo de este tiempo las cifras fueron de 16 frente a 9%9. Los estudios realizados con nebulizador sugieren que ésta es la forma idónea para tratar a los fumadores con alto grado de dependencia física por la nicotina y con altos valores de cotinina sanguínea7. Sin duda, el mayor inconveniente de este tipo de terapia es la elevada frecuencia con que se producen efectos adversos locales durante los primeros días de tratamiento que facilitan que muchos fumadores lo abandonen precipitadamente antes de sentir los beneficios que de él pueden obtener5'7. El nebulizador nasal de nicotina ha sido introducido recientemente en nuestro país. El grupo de trabajo de tratamiento del Área de Tabaquismo de la Sociedad Española de Neumología y Cirugía Torácica ha realizado un estudio multicéntrico abierto de seguimiento en el que un grupo de fumadores con alta dependencia física por la nicotina han sido tratados con nebulizador nasal durante 3 meses. Los objetivos primordiales de este estudio han sido valorar la eficacia del nebulizador nasal como forma de tratamiento del tabaquismo, así como los efectos adversos que se asocian a su utilización. Presentamos en este artículo los resultados y conclusiones de este estudio, el primero de estas características que se realiza en nuestro país. Metodología Sujetos estudiados El estudio ha sido realizado en cuatro centros hospitalarios del estado español y los sujetos fueron incluidos mediante anuncios locales. Un total de 57 individuos fueron admitidos. De ellos, 37 eran varones y 20 mujeres. Su edad media fue 40,3 ± 15,7 años. Todos cumplían con los criterios de inclusión y exclusión que están reseñados en la tabla I. Tratamiento Todos los sujetos recibieron tratamiento combinado consistente en apoyo psicológico y nebulizador nasal de nicotina. El apoyo psicológico fue similar para todos los casos y se realizó por cuatro médicos neumólogos, uno por cada centro hospitalario, con experiencia en tratamiento del tabaquismo. Consis536 TABLA I Criterios de inclusión y exclusión Criterios de inclusión Fumar 30 cigarrillos al día desde hace 3 o más años Tener entre 18 y 70 años de edad Estar en buen estado de salud Estar en fase de preparación Tener 7 o más puntos en el test de Fagerstróm Criterios de exclusión Sufrir enfermedad cardiovascular Hipertensión Alergia severa Otras drogodependencias Enfermedad psiquiátrica Embarazo. Lactancia Enfermedad aguda o crónica de las fosas nasales tió en dar consejos de tipo conductual a cada fumador y proporcionarle una guía práctica y el decálogo para dejar de fumar realizados por el Área de Tabaquismo de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)10. Se utilizó nebulizador nasal de nicotina facilitado por PharmaciaUpjohn, Consuer Health Care, Barcelona, España. El nebulizador consiste en una botella de pequeño tamaño equipada con un mecanismo de multidosificación apto para adaptarse a las fosas nasales. Dicha botella contiene una solución acuosa isotónica a pH neutro de nicotina en una concentración de 10 mg por cada mi de solución. Una dosis de medicación consiste en la administración de una instilación de nebulizador en cada fosa nasal. Cada "puff" libera 50 (ll de solución que contienen 0,5 mg de nicotina. Luego cada Üosis proporcionará 1 mg de nicotina 4 . Los sujetos fueron animados a elegir un día para dejar de fumar (día D) y a partir de ese momento utilizar nebulizador tantas veces como ellos necesitasen, sin sobrepasar una dosis total de 5 mg a la hora o 40 mg al día. La dosis recomendada fue de 1 -2 mg cada hora, mientras que el sujeto estuviera despierto. El nebulizador debía usarse a lo largo de 3 meses reduciendo progresivamente la dosis en aproximadamente 12 semanas a razón de un 25% menos cada mes. No estaba permitido el uso del nebulizador más allá de 16 semanas. Vista basal Tenía lugar el día de la primera consulta y en ella se realizaban las siguientes exploraciones: historia clínica de tabaquismo, test de Fagerstróm", valoración del síndrome de abstinencia (un total de 8 síntomas eran controlados: deseo de fumar, irritabilidad, inquietud, dificultad de concentración, ansiedad, disforia, insomnio y aumento del apetito, en una escala de O a 4, donde O correspondía a la ausencia del síntoma y 4 a la presencia severa del mismo) y se determinaron las concentraciones de monóxido de carbono (CO) en aire espirado'2. Seguimiento Los sujetos fueron seguidos durante un período de 6 meses. En este tiempo acudieron a consulta en cinco ocasiones (primera, segunda y sexta semanas después del día D y tercer y sexto mes después del día D). En estas visitas de seguimiento cuya duración era de aproximadamente 3-5 min se investigaba el estado de tabaquismo, se valoraba el síndrome de abstinencia y los efectos adversos. Se investigaba, además, la utilización del nebulizador, se realizada cooximetría y se prestaba mínimo apoyo psicológico'3. 40 C.A. JIMÉNEZ RUIZ ET AL.- TRATAMIENTO DEL TABAQUISMO CON NEBULIZADOR NASAL DE NICOTINA. RESULTADOS DE UN ESTUDIO MULT1CÉNTRICO TABLA II Características demográficas y de tabaquismo N Sexo (V/M) Edad NCD TF CO IA 57 37(65)20(35) 40,3 ±15,7 37,4 ±4,7 8,9 ± 1 , 1 27,4 ± 5,6 3,4 ±1,2 Las cifras expresan media ± DE. Entre paréntesis figura el tanto por ciento. N: número; V: varón; M: mujer. NCD: número de cigarrillos diarios; TF; puntuación en el test de Fagerstróm; CO: niveles de monóxido de carbono en aire espirado en ppm; IA: número de intentos previos de abandono. Criterios de éxito Se consideró éxito en la abstinencia a todo sujeto que declaró no fumar ni un solo cigarrillo a partir de la segunda visita de seguimiento (14 días después del día D), siempre y cuando esta declaración verbal de abstinencia se confirmara con valores de CO en aire espirado inferiores a 10 ppm 12 ' 3 . Los sujetos que no acudieron a las visitas de seguimiento fueron considerados como fracasos. Resultados Características demográficas y de tabaquismo La tabla II recoge las características del grupo de fumadores estudiado. Destaca que son fumadores con alta dependencia física por la nicotina y que han intentado dejar de fumar en varias ocasiones. índice de abstinencia A las 6 semanas de seguimiento, 36 sujetos permanecían abstinentes (63%). Esta cifra se redujo a 22 (39%) TABLA III índice de abstinencia 2.a semana 6.a semana 3." mes 6." mes 46 (81) 36 (63) 22 (39) 20 (35) Se representa el número de sujetos abstinentes en las distintas visitas de seguimiento. Entre paréntesis figura el tanto por ciento con respecto al total de sujetos incluidos en el estudio (57) fumadores. TABLA IV Valoración del síndrome de abstinencia Basal I." semana 2.a semana 6.a semana 3.^ mes 6." mes 6,5(1,4) 18.9(4,3) 19,3(4,2) 15,9(5,4) 7,7(2,1) 4,9(1,8) Valores en media (DE) TABLA V Efectos adversos 6.a semana l.a sein ana 1 II III IV -> -> -> -> V VI VII VIII -> -> -> -> 53(93) 52(91) 45 (79) 8! (14) 6(10) 4(7) 2(3) 3(5) 1 11 III VI -> 11(35) -^ 10(32) -> 5(16) ^ 2(6) 3." mes Valoración del síndrome de abstinencia En la tabla IV se representa la puntuación media ± DE del síndrome de abstinencia obtenida en cada una de las visitas de seguimiento. Teniendo en cuenta que esta puntuación puede oscilar entre un mínimo de O y un máximo de 32, destaca que durante la primeras 6 semanas de tratamiento se triplica la puntuación basal. Cumplimiento del tratamiento En la segunda semana, de los 46 pacientes que permanecían abstinentes 42 (91%) utilizaban el nebulizador. En la sexta semana, de los 36 abstinentes lo utilizaban 31 (87%), y al tercer mes 12 (54,5%) de los 22 abstinentes lo seguían utilizando. Siete pacientes (4% del total) continuaron usando nebulizador más allá del tercer mes y suspendieron su utilización entre el quinto y sexto mes de seguimiento. De los 42 sujetos que utilizaban nebulizador en la segunda semana, sólo 3 (7,1%) lo hacían a las dosis recomendadas. De los 36 de la sexta semana, sólo 10 (27,7%) lo hacían según la pauta de tratamiento prescrita. De los 22 sujetos del tercer mes, sólo 7 (31,5%) lo utilizaban de la forma prescrita. Estos 7 pacientes fueron los que continuaron usándolo hasta el quinto o sexto mes. Efectos adversos La tabla V indica cuáles fueron los efectos adversos más comunes en aquellos sujetos que utilizaron el tratamiento. Es de destacar la elevada frecuencia con que se detectaron estos efectos en las primeras semanas de tratamiento. De los 11 fumadores que recayeron en la primera semana de seguimiento, cinco de ellos lo hicieron por irritación nasal, rinorrea y lagrimeo intensos. I ^ 1(8) Las cifras representan el número de sujetos que sufrieron cada uno de los efectos adversos controlados. Entre paréntesis figura el tanto por ciento con respecto al número de sujetos que utilizaban el tratamiento en cada una de las visitas reseñadas. I: irritación nasal; II: rinorrea; III: lagrimeo; IV: tos; V; irritación orofaríngc;i: VI: cefalea; VII: marco; VIII: palpitaciones. 41 a los 3 meses, y a 20 (35%) a los 6 meses de seguimiento (tabla III). Es de destacar que en los cuatro centros hospitalarios que se realizó el estudio, se obtuvieron índices de abstinencia por separado en torno al 30-40%. Discusión De acuerdo a los resultados de nuestro estudio, el 35% de los fumadores que recibieron apoyo psicológico y tratamiento con nebulizador nasal de nicotina permanecieron abstinentes a los 6 meses de seguimiento. Ésta es una cifra que concuerda con las publicadas por otros autores5 7. No obstante, es de destacar que nosotros utilizamos nebulizador sólo durante 3 meses, y que 7 de los 20 fumadores que alcanzaron con éxito el tercer mes 537 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NUM. 11, 1999 de seguimiento continuaron utilizándolo hasta más allá del quinto mes. Aunque nuestros pacientes todavía no han sido seguidos durante un año es de esperar que algunos de ellos recaigan con el abandono definitivo del tratamiento8'9. Conviene destacar que los índices de éxitos en la abstinencia que se obtienen en pacientes de similares características a los que aquí se presentan, utilizando otras formas de TSN o sólo tratamiento psicológico, son sensiblemente inferiores al 35% obtenido en este estudio'-2. Un aspecto importante de este trabajo es que el grupo de sujetos estudiados estaba formado por fumadores de un elevado número de cigarrillos diarios, con alta dependencia física y que estaban en fase de preparación. El nebulizador nasal de nicotina parece ser la forma de tratamiento más adecuada para estos casos3'5'7-10. Si bien es cierto que todavía no existe en una indicación claramente establecida a este respecto. Aunque un alto porcentaje de los fumadores que permanecían abstinentes utilizaban el tratamiento durante las primeras semanas, bien es cierto que la mayoría de ellos lo hacían a dosis inferiores de las recomendadas. Este hecho puede explicar que la puntuación media del síndrome de abstinencia se triplicara en este tiempo. Este aspecto de infrautilización del nebulizador nasal ya ha sido reseñado por otros autores destacando qué ocurre fundamentalmente en los primeros días de tratamiento y siendo debido a la alta frecuencia con que aparecen efectos adversos3 9. Es digno de reseñar que más de las 3/4 partes de nuestros pacientes sufrieron irritación nasal, rinorrea y lagrimeo de intensidad moderada-grave durante la primera semana de tratamiento, y que en cinco de ellos estas molestias fueron tan intensas que les obligaron a abandonarlo. Sin duda, es éste el aspecto más negativo de este tipo de terapia sustitutiva. No obstante, hay que destacar que la frecuencia de aparición de estos efectos adversos disminuye dramáticamente más allá de la primera semana de utilización de la terapia. Nosotros recomendamos que se utilice nebulizador nasal en aquellos fumadores en los que esté indicado pero, sobre todo, que estén altamente motivados para dejar de serlo y a quienes se les halla explicado detenidamente tanto la forma correcta de utilización como la necesidad de persistir en su uso a pesar de las molestias, sobre todo nasales y conjuntivales, que aparezcan en los primeros días3'10. En conclusión, hemos encontrado que el 35% de nuestros fumadores permanecían abstinentes a los 6 meses de seguimiento, que aunque muchos de ellos utilizaban el nebulizador, la dosis a la que lo hacían era casi 538 siempre inferior a la recomendada. Probablemente, esta infrautilización de la medicación explique la alta puntuación de la valoración del síndrome de abstinencia que hemos observado y, casi con seguridad, sea debida a la alta frecuencia de aparición de efectos adversos durante los primeros días de uso del nebulizador. Agradecimiento A Pharmacia-Upjohn, España, por suministrar gratuitamente la medicación utilizada en el estudio. BIBLIOGRAFÍA 1 . Law M, Tang L, Waid N. An analysis of the effectiveness of interventions intended to help people to stop smoking. Arch Intern Med 1995; 155: 1.993-2.041. 2. Silagy C, Mant D, Fowler G, Lodge M. Meta-analysis of efficacy of nicotine therapies in smoking cessation. Lanet 1994; 343: 139142. 3. Jiménez Ruiz CA. Terapia sustitutiva con nicotina. Aspectos prácticos. Rev Clin Esp 1998; 1 8 1 - 1 8 5 . 4. Schneider MG, Lunell E, Olmstead RE, Fagerstrom KO. Clinical pharmacokinetics of nasal nicotine delivery: a review and comparison to other nicotine systems. Clin Pharmacokinet 1996; 3 1 : 65-80. 5. Sutherland G, Stapleton JA, Russell MAH, Jarvis M, Hajek P, Belcher M et al. Randomised controlled trial of nasal nicotine spray in smoking cessation. Lancet 1992; 340: 324-329. 6. Hjalmarson A, Franzon M, We.stin A, Wikiund O. Effect of nicotine nasal spray on smoking cessation: a randomised, placebo-controlled, double-blind study. Arch Intern Med 1994; 154: 2.5672.572. 7. Blondal T, Franzon M, Westin Á. A double-blind randomized trial of nicotine nasal spray as an aid in smoking cessation. Eur Respir J 1997; 10: 1.585-1.590. 8. Stapleton JA, Sutherland G, Russell MAH. How much does relap,se after one year erode effectiveness of smoking cessations treatments? Long-term follow-up of randomized trial of nicotine nasal spray. BMJ 1998; 3 1 6 : 830-831. 9. Blondal T, Gudmundsson LJ, Olafsdottir 1, Gustarsson G, Westin A. Nicotine nasal spray with nicotine patch for smoking cessation: randomised trial with six year follow up. BMJ 1999; 3 1 8 : 285289. 10. Jiménez Ruiz CA, Solano S, González JM, Ruiz MJ, Fiórez S, Ramos A et al. Normativa sobre el tratamiento del tabaquismo. Grupo de Trabajo del Área de Tabaquismo. Sociedad Española de Neumología y Cirugía Torácica. (En prensa). Arch Bronconeumol 1999. 1 1 . Fagerstrom KO, Schneider N. Measuring nicotine dependence: a review of the Fagerstrom Tolerane Nicotine Questionaire. J Behav Med 1989; 12: 1 5 9 - 1 8 2 . 12. Jarvis MJ, Russell MAH, Salojee Y. Expired air carbón monoxide: a simple breath test of tobáceo smoke intake. BMJ 1980; 2 8 1 : 484-485. 13. Jiménez Ruiz CA, González JM, Escudero C. García A, Roca J, Solano S et al. Manuales SEPAR: Tabaquismo. Madrid: Grupo Aula Médica, 1995; 15-23. 42 ORIGINALES Estudio comparativo de pacientes con enfermedad pulmonar obstructiva crónica con y sin síndrome de apneas obstructivas durante el sueño E. Calderón-Osuna, C. Carmona Bernal, M. Arenas Gordillo, M.A. Fuentes Pradera, A. Sánchez Armengol y F. Capote Gil Unidad Médico-Quirúrgica de Enfermedades Respiratorias. Servicio de Neumología. Hospital Universitario Virgen del Rocío. Sevilla. Nos hemos planteado estudiar si la existencia de un síndrome de apneas obstructivas durante el sueño (SAOS) en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) implica diferencias en lo referente a la sintomatología clínica, el intercambio gaseoso durante la vigilia y el sueño, y la mecánica respiratoria, respecto a aquellos enfermos con una EPOC aislada. Hemos estudiado a 48 enfermos con EPOC, en 26 de los cuales (54,1%) se descartó la existencia de un SAOS (grupo EPOC-no SAOS) mediante polisomnografía, y en 22 (45,8%) se diagnosticó un SAOS asociado (grupo EPOC-SAOS). Los pacientes del grupo EPOC-SAOS presentaron mayor somnolencia diurna y un menor grado de disnea. No hubo diferencias en el índice de masa corporal. En el grupo EPOC-SAOS la PaO; diurna fue significativamente menor que en el grupo EPOC-no SAOS (66,4 ± 10,4 frente a 75,5 ± 11,2 mmHg; p = 0,01), y no existieron diferencias en cuanto a la PaCO,. En el grupo EPOC-SAOS la presión inspiratoria máxima (P.m,,) fue de 70,6 ± 23,8 cmH,0, significativamente menor que la del grupo EPOC-no SAOS (P,^, de 90,5 ± 26,1 cmHjO; p = 0,04). Los pacientes del grupo EPOC-no SAOS presentaron una mayor duración del sueño REM. Los parámetros de saturación nocturna se encontraron significativamente más alterados en el grupo con SAOS. Concluimos que los pacientes con EPOC y SAOS presentaron alteraciones oximétricas no sólo durante el sueño sino también en vigilia más marcadas que aquellos que sólo tienen EPOC. En dichas alteraciones, podría desempeñar un papel importante la existencia de un deterioro de las presiones musculares respiratorias en este grupo de pacientes. Ambos grupos también presentan diferencias en la intensidad de algunos síntomas, como el grado de somnolencia diurna y la disnea. We aimed to study whether the presence of obstructive sieep apnea syndrome (OSAS) in patints with chronic obstructive pulmonary disease (COPD) led to differences in clinical picture, gas exchange during awake and sieep states and mechanical ventilation, in comparison with patients with COPD alone. We enrolled 48 COPD patients. In 26 (54.1%), OSAS was ruled out (non-OSAS COPD group) by polysomnography, and in 22 (45.8%) associated OSAS was diagnosed (OSAS COPD group). Patients in the OSAS COPD group experienced greater daytime sieepiness and less dyspnea. Body mass Índex was not significantly difference. The OSAS COPD group had significantly lower daytime PaO, (66.4 ± 10.4 mmHg in the OSAS COPD group and 75.5 ± 11.2 mmHg in the non-OSAS COPD group; p = 0.01); there were no differenes in PaCO,. Pi^, in the OSASCOPD group was 70.6 ± 23.8 cmH^O, a level that was significantly lower than in the non-OSAS COPD group (Pi^, 90.5 ± 26.1 cmH,0; p = 0.04). Patients in the non-OSAS COPD group experienced longer periods of REM sieep. Nighttime saturation parameters were significantly different in the group with OSAS. We conclude that patients with both OSAS and COPD experience greather oximetric changes than those without OSAS, during both sieep and awake states. The deterioration of respiratory muscle pressures in such patients may play an important role in the changes. The groups aiso present differences in the intensity of some symptoms, such as degree of daytyme sieepiness and dyspnea. Palabras clave: SAOS. EPOC. Sueño. Key words: COPD. Sieep. SAS. Comparison of patients with chronic obstructive pulmonary disease with and without obstructive sieep apnea (Arch Bronconeumol 1999; 35: 539-543) Introducción En aquellos pacientes en los que se asocian un síndrome de apneas obstructivas durante el sueño (SAOS) y una enfermedad obstructiva crónica (EPOC), asociación Correspondencia: Dr. E. Calderón Osuna. Torneo, 35-36, 3." D. Sevilla. Recibido: 4-5-99; aceptado para su publicación: 7-9-99. 45 por otra parte frecuente dada la prevalencia de ambas entidades, pueden aparecer las desaturaciones mantenidas durante la fase REM, típicas del paciente con EPOC, junto con el trazado irregular, en "dientes de sierra", fruto de las constantes oscilaciones de la saturación de oxígeno arterial (Sa0¡) producidas por las frecuentes apneas. Hay datos a favor de que la coexistencia de estas dos enfermedades puede ocasionar una Pa0¡ diurna más baja, una PaCO^ más alta y mayor incidencia de hiper539 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NÚM. 11, 1999 tensión pulmonar que en los pacientes que sólo presentan un SAOS sin obstrucción al flujo aéreo''4. Sin embargo, no está claro si la coexistencia de ambas entidades supone un mayor deterioro del intercambio gaseoso que la existencia de una EPOC aislada, ya que aunque numerosos estudios han comparado pacientes con EPOC y SAOS con pacientes sólo con SAOS, no hemos encontrado en la bibliografía ningún estudio comparativo entre pacientes con EPOC con y sin SAOS (MEDLINE, 1980-1998; palabras clave: COPD, sieep). El presente estudio intenta establecer si la coexistencia de un SAOS en pacientes con EPOC implica alteraciones en la sintomatología clínica, los parámetros de saturación nocturna, la gasometría diurna y la función respiratoria, respecto a aquellos enfermos que presentan una EPOC aislada. Pacientes y métodos Entre agosto de 1990 y enero de 1997 fueron estudiados 48 pacientes varones diagnosticados de EPOC en el Servicio de Neumología del Hospital Virgen del Rocío de Sevilla, en los que se sospechó la existencia de un SAOS asociado. La sospecha de SAOS se estableció en aquellos pacientes roncadores habituales que presentaban también pausas respiratorias durante el sueño, observadas por su pareja, y/o hipersomnolencia diurna. El diagnóstico de 'EPOC se realizó según los criterios de la European Respiratory Society (ERS)5. Todos los pacientes incluidos en este estudio tenían un índice FEV|/FVC menor o igual al 65% del valor teórico para su peso, edad y altura. A todos se les realizó: historia clínica, espirografía, pletismografía corporal, gasometría arterial y medida de la presión inspiratoria máxima (P,m^), una radiografía simple de tórax y electrocardiograma. Para la realización de la espirometría se utilizó un espirómetro Masterlab v4.0 (Jaeger) y para el cálculo de los volúmenes estáticos un pletismógrafo Masterlab (Jaeger). Después de suspender la medicación broncodilatadora con betaagonistas y bromuro de ipratropio al menos 12 h antes, se realizó una espirometría según el procedimiento estandarizado por la ATS6. El cálculo de la P,,^ se realizó mediante un manómetro Sibelmed 163, realizando la maniobra inspiratoria máxima desde capacidad residual funcional, eligiendo la mejor prueba tras conseguir tres que fueran reproducibles (variabilidad < 5 %). La gasometría se realizó de forma inmediata tras extraer la muestra de la arteria radial (IL1610 Blood Gas System gasometer, Instrumentation Laboratory, Italia). El grado de disnea se estableció según la clasificación de la New York Heart Association, valorando el esfuerzo necesario para su aparición: a) grado O, no disnea; b) grado 1, grandes esfuerzos; c) grado 2, esfuerzos moderados; d) grado 3, esfuerzos mínimos, y e} grado 4, en reposo. La hipersomnolencia diurna se clasificó de forma subjetiva, según la International Classification of Sieep Disorders7, de la siguiente forma: O, no existía hipersomnolencia diurna; 1, si aparecía en situaciones pasivas (ver la televisión, viajar como pasajero); 2, si ocurría en situaciones activas pero monótonas sin riesgo (leer, trabajos repetitivos), y 3, aquella que aparecía en situaciones activas no monótonas o con riesgo (hablar, comer, conducir). Para la realización del estudio polisomnográfico se utilizó un polisomnógrafo Sieep Lab (Jaeger), monitorizándose los siguientes parámetros: electroencefalograma (EEG: C3-A2 y C4-A1), electrooculograma (EOG: FP4-A2 Y FP2-A1), electromiograma submentoniano, electrocardiograma, movimientos toracoabdominales con bandas, flujo aéreo nasal con termístor y oximetría con pulsioxímetro digital Pulsox-7. Los 540 estadios del sueño fueron definidos según criterios estándares8. El registro del sueño fue supervisado por personal de enfermería entrenado. Se realizaron los siguientes análisis: tiempo de registro en cama, tiempo total de sueño, eficacia del sueño, porcentajes del tiempo de sueño no REM y REM respecto al tiempo total de sueño, índice de apnea-hipopnea, Sa0¡ basal y mínima, y porcentaje del tiempo total de sueño con saturación por debajo del 90%. Todos los pacientes incluidos en este estudio tenían una saturación basal, calculada durante el estudio polisomnográfico como la media de los 3 min de vigilia previos al inicio del sueño, mayor de 90%. El diagnóstico de SAOS se estableció cuando el índice apneahipopnea fue mayor o igual a 10 en el estudio polisomnográfico. Se consideró que había una desaturación cuando se producía una disminución de la SaO; igual o mayor del 4% respecto a la Sa0¡ basal. Se definió la apnea como la ausencia del flujo aéreo durante al menos 10 s, y la hipopnea como un descenso del flujo del 50% o mayor respecto al basal, seguido de una desaturación. Se realizó una comparación global entre los pacientes con EPOC y SAOS, y aquellos con EPOC y sin SAOS. Para la comparación de variables cuantitativas, se utilizó un test de ANOVA en aquellos casos en que las variables seguían una distribución normal, así como una H de Kruskal-WaIlis para aquellas variables que no tenían una distribución normal. En el caso de variables cualitativas se empleó el test de Fisher. Se consideró estadísticamente significativa una p < 0,05. Los valores se encuentran expresados como media ± desviación estándar de la media. Se utilizó la base de datos EPI INFO 6.0, y para el cálculo estadístico el programa SPSS. Resultados La edad media de los pacientes estudiados fue de 58 ± 8,8 años y su índice de masa corporal (IMC) medio de 33,8 ± 5,7 kg/irr. En 22 pacientes (45,8%) se estableció el diagnóstico de SAOS (grupo EPOC-SAOS). En los restantes 26 pacientes (54,1%) se descartó la existencia de un SAOS mediante un estudio polisomnográfico completo (grupo EPOC-no SAOS). Al comparar el grupo EPOC-SAOS con el grupo EPOC-no SAOS no existieron diferencias en cuanto a edad e IMC (tabla I). TABLA 1 Datos antropométricos, síntomas clínicos, factores de riesgo y número de ingresos previos por exacerbaciones respiratorias de los pacientes con EPOC con y sin SAOS EPOC-SAOS (N = 22) Edad (años) 59 ± 8,8 IMC(kg/m 2 ) 33,3 ±4,7 Somnolencia diurna* 2,1 ±0,6 Disnea** 1.5 ±0,7 N." de ingresos previos 0,5 ± 0,7 Despertares nocturnos 14 Cefaleas matutinas 7 Hipertensión arterial 8 Tabaquismo 12 Alcohol 9 Hipnóticos O EPOC-No SAOS (N = 26) 57,1 ±8,9 34,2 ±6,5 1,4 ±0,9 2,1 ±0,7 0,1 ± 0,3 17 11 12 12 10 2 P NS NS 0,005 0,02 NS NS NS NS NS NS NS *(): no existe somnolencia diurna; I : situaciones pasivas; 2: situaciones activas monótonas y sin riesgo: 3: situaciones activas no monótonas y/o con riesgo. ''^Clasificación de la NYHA: O, no disnea; I , disnea a esfuerzos grandes; 2. disnea a esfuerzos moderados; 3, disnea a esfuerzos mínimos; 4, disnea de reposo. IMC: índice de masa corporal; NS: sin significación estadística. 46 E. CALDERÓN-OSUNA ET AL.- ESTUDIO COMPARATIVO DE PACIENTES CON ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA CON Y SIN SÍNDROME DE APNEAS OBSTRUCTIVAS DURANTE EL SUEÑO TABLA II Parámetros de función pulmonar de los pacientes con EPOC con y sin SAOS EPOC-SAOS ( N = 22) FEV|/FVC% FVC FRC TLC RV Raw, cmLLO/1/s ?„„„, cmH¡0 PaO,, mmHg PaCO;, mmHg EPOC-No SAOS ( N = 26) Media DE Media DE 53,6 72,9 138,9 113,4 174,5 3,3 70,6 66,4 46 10,4 16,1 26,6 16,3 47,3 1,6 23,8 10,4 7,8 55.5 72.1 145.4 113.8 185,1 3.2 90,5 75,5 42,7 9,6 21,2 35,7 21,9 57,2 1,3 26,1 11,2 5,8 P NS NS NS NS NS NS 0,04 0,01 NS FEV|/FVC%: % del volumen espiratorio forzado en el primer segundo respecto la capacidad vital forzada; FVC: % de la capacidad vital forzada respecto al valor teórico; FRC: % de la capacidad residual funcional respecto al valor teórico; TLC: % de la capacidad pulmonar total respecto a los valores teóricos; RV = % volumen residual respecto a los valores teóricos; Raw: resistencia en la vía aérea, Pimd^ presión inspiratoria máxima. TABLA III Parámetros polisomnográficos de los pacientes con EPOC con y sin SAOS EPOC -SAOS ( N = 22) Media Tiempo de registro (min) 263,4 TTS(min) 226,1 IAH 49,7 Eficacia (tiempo de registro/TTS) 86,7 Sueño no REM 1-2 (%TTS) 65 Sueño no REM 3-4 (%TTS) 11,2 Duración sueño REM (%TTS) 12,7 Saturación basal 92,5 Saturación mínima 69,8 Tiempo con SaO, < 90% (min) ' 99 EPOC-FS>lo SAOS ( N = 26) p DE DE Media 117,5 124,5 26 290 234,5 0,8 13,5 80 14,1 0,05 23,4 51,5 15,5 NS 20,6 11,8 12,4 NS 14,7 2,9 16,6 23,1 92,8 82,3 18 2,1 10,1 0,03 NS 0,001 108,3 29,3 54,8 0,001 Discusión 98,5 NS 99,3 NS 1 <0,01 TTS: tiempo total de sueño. La duración de los estadios 1 y 2, 3 y 4, y REM del sueño se expresan en porcentaje del tiempo total de sueño. Todos los pacientes de ambos grupos eran roncadores habituales. Los pacientes EPOC-no SAOS presentaban una menor somnolencia y un mayor grado de disnea. No hubo diferencias en cuanto a la incidencia de despertares nocturnos recogidos de forma subjetiva por el paciente, cefalea matutina, número de ingresos en los 2 años previos relacionados con patología respiratoria, ni incidencia de tabaquismo, etilismo e hipertensión arterial sistémica (tabla I). Dos pacientes del grupo EPOC-SAOS tenían una fibrilación auricular. Ningún paciente de los dos grupos presentaba un cor pulmonale, ni recibía oxigenoterapia domiciliaria continua. Estos datos fueron recogidos en la entrevista clínica con el paciente. Tampoco hubo diferencias entre los dos grupos al comparar los parámetros en función pulmonar, tanto espirométricos como pletismográficos, aunque el grupo EPOC-no SAOS presentó mayores valores medios de 47 FRC y RV, aunque sin significación estadística (tabla II). En el grupo EPOC-SAOS la P,,^ fue de 70,6 ± 23,8 cmHyO, significativamente menor que la del grupo EPOC-no SAOS (P . de 90,5 ± 26,1 cmH?; p = 0,04) (tabla II). El grupo EPOC-SAOS presentó un mayor deterioro del intercambio gaseoso diurno, con una Pa0¡ diurna significativamente menor (66,4 ± 10,4 frente a 75,5 ± 11,2 mmHg en el grupo EPOC-no SAOS; p = 0,01). Aunque no hubo diferencias en la PaCO^, la tendencia era que ésta fuera mayor en el grupo EPOC-SAOS (46 ± 7,8 frente a 42,7 ± 5,8 mmHg en el grupo EPOC-no SAOS). Al comparar los resultados del estudio polisomnográfico entre los grupos EPOC-SAOS y EPOC-no SAOS (tabla III), encontramos que la eficacia del sueño fue mayor en el primer grupo (86,7 ± 13,5 frente a 80 ± 14,1%), con una diferencia cercana a la significación estadística (p = 0,05). La duración del sueño REM fue significativamente mayor en el grupo no SAOS (12,7 ± 14,7 frente a 23,1 ± 18%), no existiendo diferencias en la duración del sueño no REM. Los parámetros de saturación nocturna estaban significativamente más alterados en el grupo SAOS (tabla III). La prevalencia del SAOS en los pacientes con EPOC es muy similar a la de la población general9-10. La alta frecuencia de SAOS (45,8%) en nuestra población de EPOC se halla sesgada por la selección de ésta, ya que los pacientes en los que se realizó una polisomnografía presentaban síntomas compatibles con un trastorno respiratorio durante el sueño. Estudios previos parecen demostrar que las desaturaciones nocturnas en la EPOC son más frecuentes e intensas en los pacientes con bronquitis crónica que en los que tienen un enfisema predominante9". Los pacientes con bronquitis crónica son frecuentemente obesos, lo que también suele concurrir en el SAOS. En nuestro estudio no han existido diferencias en el grado de obesidad entre los pacientes con y sin SAOS, presentando ambos grupos un IMC mayor de 30 kg/m2. Hemos incluido únicamente a los pacientes con una saturación basal por encima del 90%, ya que en aquellos pacientes que presentan una hipoxemia importante durante la vigilia, las desaturaciones durante el sueño posiblemente representen pequeños cambios en la Pa0¡, puesto que su relación PaO^/Sa^O se encuentra en la zona inclinada de la curva de disociación de la hemoglobina. Como consecuencia de que la principal indicación de la polisomnografía fue la presencia de una sintomatología compatible con un SAOS, la existencia de síntomas propios de esta enfermedad en el grupo EPOC-no SAOS fue muy elevada. A pesar de ello, el grado de somnolencia diurna fue mayor en el grupo EPOC-SAOS. Por otra parte, los pacientes del grupo EPOC-no SAOS tenían una mayor sensación de disnea que los del grupo EPOCSAOS (p < 0,05). Aunque en el presente trabajo no hemos determinado la respuesta ventilatoria hipercápnica que presentaban los pacientes con SAOS12'13. 541 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NÚM. 11, 1999 Guilleminault et al encontraron un mayor deterioro del intercambio gaseoso en aquellos pacientes con EPOC y SAOS, que en EPOC aislada14, aunque su trabajo careció de grupo control y las diferencias no fueron significativas. Nosotros también hemos encontrado que los primeros presentan una menor Pa0¡ (66,4 ± 10,4 frente a 75,5 ± 11,2 mmHg) y que esta diferencia es significativa (p = 0,01). También la PaCO^ se encuentra algo más elevada en los pacientes con SAOS (46 ± 7,8 frente a 42,7 ± 5,8 mmHg), si bien no existe significación estadística. Así pues, la alteración de la PaO, en vigilia es más intensa en los pacientes con EPOC y SAOS que en aquellos con EPOC sola, lo que podría deberse a varios factores: la alteración de la mecánica respiratoria en relación con la EPOC, la obesidad y/o la hipoventilación durante el sueño. El deterioro gasométrico no parece relacionarse con diferencias en el grado de alteración de los volúmenes pulmonares o de los flujos espiratorios forzados. Aunque no hubo diferencias significativas en ninguno de estos parámetros entre los dos grupos, los pacientes con EPOC aislada (con gases arteriales diurnos menos alterados) tenían mayor hiperinsuflación (mayores RV y FRC) que los pacientes con EPOC y SAOS. El grado de obesidad tampoco establecía diferencias, aunque podría existir una obesidad más central (troncular) en los pacientes con SAOS. Los pacientes con EPOC y SAOS, que además de apneas tengan períodos de hipoventilación mantenida durante el sueño causados por el aumento de las resistencias de las vías aéreas superiores, podrían sufrir una "anestesia" del centro respiratorio, que al prolongarse al período de vigilia causase una alteración gasométrica diurna15. La alteración de la respuesta ventilatoria al C0¡ en el SAOS, puesta de manifiesto en algunos trabajos'2 '3, puede reflejar también dicha "anestesia" del centro respiratorio. De esta manera, el efecto de la CPAP sobre los gases arteriales diurnos podría explicarse por este mecanismo. El hecho de que la P,^^ sea menor en los pacientes con EPOC y SAOS que en aquellos con EPOC aislada (70 frente a 90 cmH^O) tampoco puede deberse a que los primeros estén más insuflados, ya que, aunque sin significación estadística, ocurre todo lo contrario. Aunque podría plantearse que en los pacientes con SAOS existiera un aumento del trabajo respiratorio durante el sueño, que se produciría como consecuencia de la sobrecarga que supone la inspiración contra una vía aérea superior cerrada, y fuera responsable de un deterioro de la función muscular respiratoria, resulta poco probable, ya que en estos pacientes no se ha demostrado la existencia de una fatiga crónica de los músculos respiratorios'6. También una hipoxemia más marcada podría desempeñar un papel adicional en este sentido, ya que estudios previos parecen demostrar la existencia de una alteración de la contractilidad secundaria'7. En el trabajo de Vázquez et al'8, se encuentra una mejoría de la Pimáx en los pacientes con EPOC y SAOS tras el tratamiento con CPAP, lo cual podría explicarse por varios motivos: mejoría de la función muscular por descanso de la misma, lo que supondría la existencia de una fati542 ga crónica previa que, como ya hemos comentado anteriormente, no parece existir en estos pacientes; la mejoría de la hipoxemia tras el tratamiento con CPAP, que también podría contribuir a una mejor función muscular, y el descenso del RV, la FRC y la TLC que se produce en pacientes con EPOC y SAOS tras el tratamiento con CPAP'9. Coincidiendo con otros trabajos"'14'20'22, los parámetros de SaO^ durante el sueño estaban más alterados en el grupo EPOC-SAOS, lo que reflejaría la suma de las frecuentes desaturaciones que siguen a las apneas en el SAOS y la caída de la SaO, en la fase REM, que presentan los pacientes con EPOC. En conclusión, los pacientes con EPOC y SAOS presentan alteraciones oximétricas, no sólo durante el sueño sino también en vigilia, más intensas que aquellos que sólo tienen una EPOC. En dichas alteraciones, podría desempeñar un papel importante la existencia de un deterioro de las presiones musculares respiratorias. Ambos grupos se diferencian también en la intensidad de algunos síntomas, siendo la disnea mayor en los pacientes con EPOC aislada y la hipersomnolencia diurna en los pacientes con un SAOS asociado. BIBLIOGRAFÍA 1 . Fletcher EC, SchaffJM, Miller J, Fletcher JG. Long-term cardiopulmonary sequelae in patients with sieep apnea and chronic lung disease. Am Rev Respir Dis 1987; 135: 525-533. 2. Weitzenblum E, Krieger J, Apprill M, Vallée E, Ehrhart M, Ratamaharo J, Oswaid M, Kurtz D. Daytime pulmonary hipertensión in patients with obstructive sieep apnea syndrome. Am Rev Respir Dis 1988; 138:345-349. 3. Krieger J, Sforza E, Aprill J, Lampert E, Weitzenblum E, Ratamaharo J. Pulmonary hypertension, hypoxemia and hypercapnia in obstructive sieep apnea patients. Chest 1989; 96: 729-737. 4. Chaouat A, Weitzenblum E, Krieger J, Ifoundza T, Oswaid M, Kessier R. Association of chronic obstructive pulmonary disease and sieep apnea syndrome. Am J Respir Crit Care Med 1995; 1 5 1 : 82-86. 5. Siafakas NM, Vermeire P, Pride NB, Paoletti P, Gibson J. Optimal assessment and management of chronic obstructive pulmonary disease (COPD). ERS-Consensus statement. Eur Respir J 1995; 8: 1.398-1.420. 6. American Thoracic Society. Standarization of spirometry. Am Rev Respir Dis 1987; 136: 1.285-1.298. 7. International Classification of Sieep Disorders. Diagnostic and coding manual 1990; 342: 52-58. 8. Rechtschaffen A, Kales A. A manual of standardized terminology, techniques and scoring system for sieep states human subjects. Bethesda: National In.stitute of Neurological Disease and Blindness, NIH Publication n." 204, 1968. 9. Catterall JR, Douglas NJ, Calverley PMA, Shapiro CM, Brezinova V, Brash et al. Transient hypoxemia during sieep in chronic obstructive pulmonary disease is not a sieep apnea syndrome. Am Rev Respir Dis 1983; 128: 24-29. 10. Young T, Palta M, Dempsey J, Skatraud J, Weber S, Badr S. The occurrence of sieep-disordered breathing among middied-aged adults. N Engí J Med 1993; 328: 1.230-1.235. 11. Dardes N, Moscatelli B, Re MA, Pellicciotti L, Vulterini S. Screening study of nocturnal hypoxia in COPD patients with different clinical features. Eur Respir J 1990; (Supi 2): 546-548. 12. Soto JG, Cano S, Fernández J, Sánchez MA, Capote F, Castillo F. Estimulación hipercápnica y respuesta ventilatoria en el síndrome de apnea obstructiva durante el sueño. Comparación de reinhalación y estado-estable. Arch Bronconeumol 1996; 32: 341-347. 13. Gold AR, Schwartz AR, Wise RA, Smith PL. Pulmonary function and respiratory chemosensivity in moderately obese patients with sieep apnea. Chest 1993; 103: 1.325-1.329. 48 E. CALDERÓN-OSUNA ET AL.- ESTUDIO COMPARATIVO DE PACIENTES CON ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA CON Y SIN SÍNDROME DE APNEAS OBSTRUCTIVAS DURANTE EL SUEÑO 14. Guilleminault C, Cummiskey J, Motta J. Chronic obstructive airflow disease and sieep studies. Am Rev Respir Dis 1980; 122: 397-406. 15. Sullivan C, Grunstein R, Marrone O, Berthon-Jones M. Sieep apnea-pathophysiology: upper airway and control breathing. Obstructive sieep apnea syndrome. Clinical research and treatment. Nueva York: Raven Press, 1990; 49-69. 16. Griggs G, Findiey L, Suratt M, Esau W, Wilhoit S, Rochester D. Prolonged relaxation rate oí inspiratory muscles in patients with sieep apnea. Am Rev Respir Dis 1989; 140: 706-710. 17. Jardim J, Farkas G, Prefaut C, Thomas D, Mackiem PT, Roussos C. The failing inspiratory muscles under normoxic and hypoxic conditions. Am Rev Respir Dis 1981; 124: 274-279. 18. Vázquez R, Cano S, Capote F, Sánchez MA, Carmona C, Castillo J. Efectos de la presión positiva continua nasal (CPAPn) sobre la 49 19. 20. 21. 22. función pulmonar en pacientes con síndrome de apnea obstructiva del sueño. Arch Bronconeumol 1995; 31: 18-22. Young IH, Mihalyka M, Costas I, Sullivan CE. Long term lung functions changes in patients with obstructive sieep apnea during treatment with nasal continuous positive airway pressure. Thorax 1987:42:722. Alford NJ, Fletcher EC, Nickeson D. Acute oxygen in patients with sieep apnea and COPD. Chest 1986; 89: 30-38. Goldstein RS, Ramcharan V, Bowes G, McNicholas WT, Bradley D, Phillipson EA. Effect of supplemental nocturnal oxygen on gas exchange in patients with severe obstructive lung disease. N Engí JMed 1984; 310: 425-429. Pépin JL, Lévy P, Lepaulle B, Brambilla C, Guilleminault C. Does oximetry contribute to the detection of apneic events? Chest 1991;99: 1.151-1.157. 543 ARTICULO ESPECIAL La trampa de la gestión en medicina. Introducción a una discusión necesaria D.O. Rodenstein Service de Pneumologie. Cliniques Universitaires Saint- Lúe. Université Catholique de Louvain. Bruselas. Bélgica. Entre las muchas y variadas características de la personalidad del médico figuran dos que son como las dos caras de una moneda. Son indisolubles, y no se puede tener la una sin la otra. Me refiero al deseo de curar por un lado, y al deseo de dominación por el otro. El deseo de curar está (o debiera estar) en la base del deseo de ejercer la medicina; es una motivación altruista poderosa y benéfica. En contrapartida de la promesa de curación, el médico espera del enfermo gratitud y estima, tal vez antes y más aún que la retribución monetaria por su trabajo. Por medio de esa gratitud y estima, el enfermo coloca al médico en una situación de superioridad, y reconoce así que el médico es quien tiene el poder de cambiar el curso de la enfermedad, evitar su persistencia, su agravación y tal vez la muerte. En cierto modo, el enfermo reconoce el poder y el dominio que sobre él tiene el médico. Los médicos han sido siempre conscientes del poder que ejercen, al menos en tanto que poder de dañar, al punto de moderarlo en uno de los más importantes aforismos médicos: primum non naceré. El enfermo, que reconoce y hasta cierto punto consagra el poder del médico, reacciona ante este poder con una mezcla de sumisión y desconfianza (lo que constituye una reacción general ante todo poder). La desconfianza ante el médico tiene testimonios literarios en muchas lenguas y culturas, de Luis de Góngora a Frankenstein, pasando por Moliere. La relación entre médico y paciente ha sido tradicionalmente una relación entre dos personas. Por parte del enfermo, la relación podía estar basada en la confianza, o en el pavor. Por parte del médico, en el altruismo o en el afán de poder. Independientemente de las motivaciones más o menos conscientes, la relación era entre dos. Uno de los símbolos míticos de esta relación entre dos es la noción de secreto médico, que se encuentra explícitamente en todos les textos sagrados de la historia médica occidental: un secreto compartido entre dos y sólo dos personas; aquella que posee el secreto, y aquella a quien ésta lo confía'' 2 . Correspondencia: Prof. D.O. Rodenstein. Service de Pneumologie. Cliniques Universitaires Saint-Luc. Av. Hippocrate. 10.1200 Bruxelles. Belgique. Correo electrónico: [email protected] Recibido: 1S-5-99: aceptado para su publicación: 1-6-99. (Arch Bronconeumol 1999; 35: 544-549) 544 El dinero también ha formado parte desde siempre de esta relación entre dos, como elemento material del intercambio entre médico y enfermo. Por el lado del enfermo, su fortuna podía determinar la calidad, el renombre o la experiencia del médico consultado. Por el lado del médico, el pago reclamado (el honorario, o tributo debido a aquel a quien se debe honrar) debía ajustarse no sólo al servicio rendido, sino también a la capacidad económica del enfermo, que el médico debía apreciar con prudencia y honestidad. Los textos sagrados ya mencionados son explícitos en recordar al médico que su arte debe ponerse al servicio del enfermo, rico o pobre, amo o esclavo (pero el hecho que hubiera que recordar este principio básico puede interpretarse como evidencia de su falta de aplicación). De todas maneras, el honorario sella materialmente la relación enfermomédico. De estos principios básicos de la relación médico-enfermo poco queda hoy día. La transformación se está produciendo aceleradamente, hoy mismo, delante nuestro, y no es nada seguro que el resultado vaya a ser mejor que la situación actual. Este esquema interpersonal, con sus motivaciones y reglas particulares, comenzó a resquebrajarse por los avances tecnológicos de la medicina, y ahora está siendo despedazado por los vientos huracanados de la macroeconomía. Los avances tecnológicos distorsionaron la relación "de a dos" enfermo-médico, introduciendo en ella una multitud de terceras personas. Un paciente con cáncer de pulmón será visto por un médico y, además, por dos o tres técnicos radiólogos, uno o dos técnicos de medicina nuclear, una o dos enfermeras endoscopistas, un técnico de espirometría, un cierto número de enfermeras de planta,... Todo esto sólo para terminar un proceso de diagnóstico y estadiaje. Ya ni hablemos del tratamiento. La noción de secreto médico se esfuma rápidamente cuando hay tantas personas involucradas. Y hay que hacer muchos esfuerzos, en tales condiciones, para mantener la noción de la relación interpersonal. La aparición (bienvenida evidentemente) de los sistemas sociales de protección y seguro de salud en Europa occidental constituyeron un enorme avance en la medicina, pues permitieron que cualquier individuo pudiera tener acceso a cuidados médicos de la mejor calidad disponible sin importar su fortuna personal o su situación social. Al mismo tiempo, introdujeron la noción 50 D.O. RODF-NSTEIN- LA TRAMPA DE LA GESTIÓN EN MEDICINA. INTRODUCCIÓN A UNA DISCUSIÓN NECESARIA macroeconómica de presupuesto de salud en lo que habían sido hasta ese momento una multitud de pequeñas y simples transacciones microeconómicas de poca monta. La aparición del concepto de presupuesto se acompaña naturalmente de la aparición de las personas que gestionan y administran dicho presupuesto, los gestionarlos de salud. Aunque organizados de manera dispar de un país a otro, todos los sistemas de seguro social funcionaron en Europa con una base solidaria (todos pagan para cubrir los gastos de algunos), y permitieron ofrecer servicios médicos a la casi totalidad de la población. En los últimos 25 años, estos sistemas permitieron la revaluación tecnológica que hemos conocido, desde la incorporación masiva de los nuevos instrumentos de radiología e imágenes hasta la diseminación de tratamientos de tecnología avanzada. En el tema que nos interesa en este texto, el sistema de seguro social implica un efecto no deseado pero inevitable: en la relación interpersonal entre el enfermo y el médico aparece una tercera persona, que es quien paga el honorario. Quien honora (quien honra) ya no es el enfermo, sino un ente impersonal y abstracto, el "seguro", con lo que se distorsiona la relación simbólica tradicional representada por el honorario médico. El médico ya ni siquiera puede decidir no cobrar por sus servicios a un paciente de bajos recursos económicos (con lo que el "pago" en gratitud y estima se devalúa paralelamente) En la medida en que el pagador final de estos servicios médicos es un organismo estatal o paraestatal, los presupuestos globales (ya no micro sino macroeconómicos) fueron mejor evaluados por los gestionarlos de estos organismos. El poder político autorizó sucesivamente los incrementos de presupuesto necesarios para incorporar los avances tecnológicos, y asegurar la difusión de los beneficios a todas las zonas geográficas de cada país. Independientemente de la riqueza de cada país, la mayoría alcanzó un grado similar de avance en la salud pública y en la evolución de los indicadores de salud. Así, por ejemplo, la mortalidad infantil ha decaído entre 1960 y 1996 de alrededor de 25 por 1.000 nacimientos a alrededor de 6 por 1.000 nacimientos en los países de la Unión Europea (las cifras para España son 43,7 y 5,0, respectivamente). La esperan/a de vida aumentó en el mismo lapso de poco menos de 70 (69,9 para España) a poco menos de 80 años (76.8 para España). Estas mejoras se consiguieron con aumentos muy modestos del gasto, considerado en porcentaje del producto bruto interno de cada país. En la Unión Europea. el gasto total en salud pasó de alrededor de 4% del PBI en 1960 a alrededor del 8% del PBI en 1997. Las cifras para España son del 1,5 en 1960, 3.7 en 1970, 5,6 en 1980, 6,9 en 1990 y 7,4 en 1997, respectivamente. Estos datos están tomados de la publicación Eco-sanidad 98 de la Organización para la Cooperación y el Desarrollo Económico'. La situación no es la misma en la economía dominante de este fin de siglo. En los Estados Unidos, alrededor del 20% de la población carece de todo seguro de salud. Además, el gasto público representa menos del 50% del total (contra alrededor del 80% en los países de la Unión Europea), lo que significa que la mayor parte 51 del gasto viene directamente del enfermo, sin participación solidaria. Por si esto fuera poco, el nivel de gasto es exorbitante comparado con el modesto 8% antes señalado: en 1960 el gasto en salud representaba el 5,2% del PBI, y en 1997 esta cifra subió al 14% del PBI. Y pese a este nivel enorme de gasto, los resultados no son los de esperar. La mortalidad infantil, que era menor a la europea en 1960 (26 por 100.000) bajó a niveles mayores a los europeos en 1996 (7,8 por 100.000). La esperanza de vida es apenas similar a la europea3. Como una buena parte de las suscripciones a los seguros de salud de los empleados y obreros nortamericanos proviene de los empleadores, el nivel de aumento del gasto comenzó a pesar en los resultados financieros de las empresas. Los círculos empresarios influyentes (cámaras de comercio, grandes empresas, uniones industriales) comenzaron a reclamar una reforma que disminuyera drásticamente el coste de la salud 4 ' 5 . Esta posición parece totalmente lógica y justificada, habida cuenta del exceso de gasto, y de los pobres resultados del sistema, comparados con países de nivel de vida similar (los norteamaricanos pueden fácilmente compararse con Canadá, que tiene un sistema de salud de tipo europeo occidental). Y aquí interviene lo que aparece como una deriva esquizofrénica: el discurso sobre el coste excesivo de la salud, y sobre la necesidad de reducirlo rápidamente (discurso, repitámoslo, justificado en el contexto norteamericano), se extendió a los círculos económicos internacionales, independientemente del contexto específico de cada país. Nos enfrentamos así a un discurso desconectado de la realidad, a un discurso "de principios". En todos los países de Europa occidental, en los organismos internacionales de crédito (Fondo Monetario Internacional, Banco Mundial) y de análisis económico (Organización para la Cooperación y el Desarrollo Económico) la reducción del coste de la salud forma parte del discurso oficial automático, curiosamente desligado de un análisis objetivo de la eficiencia comparativa de cada situación particular. Es como si se hubiera decidido que las prioridades han cambiado, que es necesario liberar recursos financieros del sistema de salud para dedicarlos a otros sectores, sin tener en cuenta si dichos recursos están bien o mal invertidos, si su existencia se justifica o no, ni qué consecuencias tendrá la reducción. Es así que las políticas de contención y reducción del coste de salud forman parte hoy día de la actitud cotidiana de todos los gobiernos, tanto de aquellos cuyo gasto en salud es del 6,8%' del PBI (como Luxemburgo) como de otros cuyo gasto es del 7,4% (España), 7.8% (Bélgica), 9,8%; (Francia) o 10,5%; (Alemania). Repitámoslo, ésta es una actitud global, "de principio", de tipo a priori, y no deriva de un análisis racional de la situación particular de cada sistema6. Veamos ahora cuáles son los mecanismos propuestos para ejercer concretamente este control del gasto. No me referiré a mecanismos estrictamente financieros o contables (tales como la noción de presupuesto global, o de restricción del acceso a determinados tratamientos), sino a la metodología que tiende a desplazar al médico cíe toda participación en las decisiones de polí545 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35. NÚM. I I , 1999 tica médica. Sin pretender ser exhaustivo, se pueden citar el "efecto cuestionario (o efecto calidad de vida)", el "efecto randomised triáis", el "efecto coste-beneficio", el "efecto tendencia hacia la media", el "efecto enfermera de referencia", completados por el "efecto aunque no estemos seguros", que pasaremos a ver en cierto detalle. Cabe aclarar que lo que sigue es una visión muy personal de una situación cambiante y muy dinámica. El efecto "cuestionario" puede definirse como la intención de dar una apariencia de objetividad cuantificable a los síntomas referidos por el paciente. El objetivo no es clínico, sino epidemiológico (poder comparar grupos de individuos), e, intencionalmente o no, escamotea la figura del médico. En lugar de un individuo (el médico) que, con mayor o menor grado de empatia, intenta saber cómo se siente otro individuo (el paciente) con preguntas como "¿qué tal se siente hoy?", "¿le ha disminuido el dolor?", "¿cómo anda del ahogo cuando sube las escaleras?" nos encontramos con un individuo (el paciente) ennegreciendo cuadraditos en una hoja de papel, o atribuyendo números a sus sensaciones. Las preguntas son formuladas objetivamente por escrito, y en el caso en que deban ser leídas por una tercera persona, deberán serlo con voz monótona y estudiada para no influir en las respuestas. Existen cuestionarios globales, destinados a descubrir el grado de felicidad de un individuo; cuestionarios específicos para saber cómo influye una enfermedad (o un síntoma) en la salud, o en las actividades diarias, o en la felicidad general. Existen, asimismo, cuestionarios para evaluar los resultados de un cambio (sea por un tratamiento, o espontáneo). Además, existen cuestionarios para saber no sólo cómo se siente el enfermo, sino qué valor le atribuye éste a la pérdida de vitalidad (o de felicidad, o de posibilidad de limpiar su casa). Y, claro está, qué valor le atribuiría (o cuánto estaría dispuesto a pagar) por la recuperación virtual de un estado ideal de salud (o de reducción de la enfermedad, o del síntoma). Todos estos cuestionarios deben ser diseñados científicamente usando muestras adecuadas de pacientes con determinada patología, validados en muestras independientes, estratificados en muestras con niveles específicos de gravedad, traducidos a otras lenguas teniendo en cuenta las especifidades culturales y sociológicas y recurriendo como control a la retraducción al original. La reproducibilidad debe ser conocida, y todos los cuestionarios deben incluir preguntas duplicadas, en forma explícita y/o escondida, para evaluar la fiabilidad de los resultados 7 . Todo esto no merecería crítica alguna, a no ser porque existe la tendencia a aplicar estas metodologías a la clínica, no a la epidemiología clínica, y porque existe la tendencia a creer que porque los síntomas son "cuantificados" (es decir, puestos en cifras) son más objetivos, más serios, más "presentables". Con lo que se crea el riesgo de la situación absurda siguiente: que la frase escrita de mano del médico "fulano está mejor" tenga menor valor que la frase siguiente escrita de mano de la enfermera: "fulano subió 2 puntos en la dimensión emocional, y 1 en la física. No hubo cambios en la dimensión afectiva". El ridículo llega al colmo en las evaluaciones terapéuticas. Es así que podría decidirse un día no lejano que tal 546 tratamiento es mejor que tal otro (y por lo tanto el segundo no puede ya aplicarse) porque mientras que el primero permite una ganacia de 4 puntos en el cuestionario de calidad de vida, el segundo sólo permite una ganacia de 3 puntos. Con lo que se aplicarán conclusiones epidemiológicas a casos individuales. Este peligro no es imaginario, sino bien real. Hoy día, como lo saben todas las empresas farmacéuticas, se hace casi imposible obtener la autorización para un nuevo fármaco si no se ha procedido, además de demostrar que el fármaco es activo biológica y fisiológicamente, a demostrar qué ganancia ofrece en calidad de vida con respecto a los fármacos existentes. Lo que lleva a seudoestudios en los que se trata de encontrar la quinta pata al gato, a usar métodos estadísticos cada vez más sofisticados y difíciles de entender, para llegar a conclusiones favorables. Ya no se trata de demostrar que el producto X es efectivo en tal y cuál medida en el asma. sino de demostrar que es un 2,5% mejor que el producto Y del laboratorio situado en la vereda de enfrente. Un excelente ejemplo de esto puede verse en el artículo (realizado con el apoyo financiero de la firma productora de uno de los fármacos administrados en el estudio) "Oral Montelukast, Inhaled Beclomethasone. and Placebo for chronic asthma", cuyos autores son K. Malmstrom, G. Rodríguez-Gómez, J. Guerra. C. Villaran, A. Piñeiro, L. X. Wei, B. C. Seidenberg y T. E. Reiss. publicado en Ai-inals of Inte nuil Medicine, en 1999. volumen 130, páginas 487-495 (artículo que me servirá de ejemplo en varios párrafos de este texto y al que me referiré como "artículo-ejemplo"). Vale la pena leer la sección "Measurements", párrafos 2 y 3. Pero recordemos que, desde mi punto de vista, lo esencial es la noción que el médico es incapaz de evaluar correctamente el estado de su enfermo, y que hay que corregir su evaluación, demasiado empalica y subjetiva, por otra objetiva, distante y fríamente científica. Los ensayos clínicos, ya sea de métodos diagnósticos (p. ej., qué hacer con una sospecha de embolia pulmonar en un paciente sin o con factores de riesgo), de tratamientos (p. ej.. el uso de inhibidores de leucotrienos en el asma) o de actitudes clínicas (p. ej.. cada cuánto debe un paciente hipertenso controlarse la tensión arterial para garantizar el mejor resultado) deben responder a los últimos criterios de la moda, es decir, deben ser controlados por placebo, a doble ciego, aleatorizados, y cruzadoss. Los elementos a evaluar deben ser fijados de antemano; el número de participantes debe ser calculado exactamente para evitar errores estadísticos de tipo beta o alfa (quienquiera comprenda una sola línea de la sección "Statistical Analysis" del "artículo-ejemplo" merecería recibir la medalla "Field" de la Asociación Matemática Americana); todos los participantes deben aceptar libremente la participación en el estudio, luego de haber sido informados de manera completa, exhaustiva y detallada de acuerdo a un protocolo aprobado por una comisión de ética oficialmente reconocida por las autoridades9. Nada habría de criticable en estos elementos. a no ser porque en la realidad de todos los días reina una gran dosis de hipocresía en torno a estos elementos. La mayoría de los folletos de información y libre 52 D.O. RODENSTEIN- LA TRAMPA DE LA GESTIÓN EN MEDICINA. INTRODUCCIÓN A UNA DISCUSIÓN NECESARIA consentimiento están escritos en un lenguaje que un especialista avezado apenas comprende, y dan un exceso de información que frisa el absurdo para la gran mayoría de los ciudadanos que sufren de alguna enfermedad'"'". El respeto (aunque más no fuera de forma) de estas normas introduce costes enormes, que, en el caso de ensayos terapéuticos, se verán reflejados en el precio final del nuevo producto. Además, en la mayoría de las ocasiones, este nivel de exigencia científica aparece desmesurado en relación al valor intrínseco del producto o de la actitud diagnóstica o clínica que se está evaluando. Por último, pareciera que el no respetar estas normas quita toda validez a la observación de los hechos por parte del médico, y una vez más reduce el papel del mismo al de un individuo indigno de fe, del que conviene desconfiar. El tratamiento de pacientes afectados por un síndrome de apneas del sueño por presión positiva continua por vía nasal durante el sueño es un buen ejemplo de este efecto "randomised triáis". Para cualquiera que haya utilizado este tratamiento en pacientes, los cambios fisiológicos y clínicos son tan tajantes y concordantes que no queda mucho lugar para la duda en cuanto a su valor clínico. Sin embargo, Wright señaló que tal tratamiento carecía de valor, puesto que nadie había demostrado su valor de acuerdo a los últimos criterios de la moda l2 . A partir de ese momento, varios centenares de pacientes han sido incluidos en estudios controlados por placebo, doble ciego, cruzados, y repartidos al azar. Como cualquier clínico podía esperar, los primeros resultados señalan que el tratamiento activo es mejor que el placebo, que existe un efecto placebo, y que los pacientes suelen preferir el tratamiento activo al placebo. Una dosis enorme de esfuerzo, ingenio y tenacidad está siendo necesaria para demostrar que, como ya lo sabíamos, el tratamiento por presión positiva continua por vía nasal es útil en pacientes con síndrome de apneas del sueño. Un número elevado de pacientes han tenido que privarse temporalmente de un tratamiento eficaz, y someterse a un tratamiento placebo ineficaz, para contentar a Wright, que sólo cree en los ensayos doble ciego controlados, etc. Porque los pagadores creen en Wright. Ciegamente. Para volver al "artículo-ejemplo", la lectura de la sección "Protocol" es una demostración sin par de lenguaje opaco e incomprensible. Además, en este estudio 237 (sí, ¡doscientos treinta y siete!) pacientes con asma fueron tratados con un placebo durante 3 meses. ¿Puede justificarse hoy día privar de tratamiento a 237 pacientes con asma? Los muchos y muy diversos comités de ética dijeron que sí. Veamos ahora el efecto "coste-beneficio". El paso a la macroeconomía y la centralización de los organismos de pago ha llevado naturalmente a emplear la lógica macroeconómica a los flujos financieros relacionados con la salud. Por ende, a tratar de maximizar los beneficios, minimizar los costes y aumentar la eficiencia económica del sistema. El hecho que definir los términos beneficios, costes, o eficiencia sea algo más complejo cuando se trata de salud que cuando se trata de productos industriales (o incluso financieros) no ha sido obstáculo para la extensión de dichas nociones al campo de la salud. El administrador quiere saber qué está com53 prando, es decir, qué se le está vendiendo por su dinero, y si puede obtener el mismo "producto" por un precio menor, o si un precio bastante menor permitiría obtener un producto de calidad un poquito menor, pero aún aceptable, y en qué punto la baja de calidad produciría una disminución de rentabilidad, o de qué manera por el mismo precio se puede obtener un producto mejor, aumentando así la rentabilidad de la inversión. Así, por ejemplo, se podría saber si la diferencia de precio global entre una dilatación coronaria percutánea y una revascularización quirúrgica de miocardio se justifica en términos de las diferencias obtenidas en calidad de vida (evaluada por los cuestionarios ya mencionados), ajustadas al número de años de vida restante de la población estudiada. No es lo mismo obtener una mejoría de 4 puntos en calidad de vida cuando sólo quedan 4 años de vida, que cuando se puede aprovechar esa mejora durante 12 años: el coste por año será el triple, puesto que se deberá amortizar en un tiempo menor. Y ni hablemos si la mejora es de 2 puntos con 4 años de vida residual, comparado con una mejora de 4 puntos con 12 años de vida residual: ¡el coste por punto y por año será 6 veces mayor! Una diferencia del 600%, o como se dice hoy día, ¡un odds ratio de 6! De la misma manera, se puede hacer una encuesta para saber si el valor monetario imaginario atribuido por un grupo de pacientes potenciales (pero personas sanas actualmente) a determinado tratamiento que ofrece la posibilidad de mejorar en un 42% los síntomas de una enfermedad, si dicho valor pues es superior o inferior al precio real de dicho tratamiento actualmente. Así se podrían favorecer los tratamientos cuyo coste real es menor al valor monetario que los potenciales beneficiarios le atribuirían, y desfavorecer o suprimir aquellos cuyo coste real excede el valor que la gente estaría dispuesta a pagar por el beneficio prometido. Otro ejemplo está dado por el cálculo que permite determinar cuántas vidas pueden ser salvadas aplicando determinada estrategia diagnóstica con respecto a otra que tenga distintos niveles de sensibilidad y especificidad. A partir de este dato, y conociendo el coste de las dos estrategias, se puede calcular el coste por vida suplementaria salvada, que nuevamente puede ajustarse a la vida residual, para conocer el coste por año suplementario de vida suplementaria salvada, que, a su vez, debe ajustarse con respecto a la desvalorización esperada del dinero (puesto que el gasto se hará en un momento dado y el beneficio será obtenido durante los años ulteriores). Esto se consigue aplicando una determinada tasa de descuento. Y a partir de estos datos podría decidirse que usando determinada estrategia diagnóstica cara (p. ej., para una sospecha de embolia pulmonar) se salvarán 10 vidas más por 100.000 sospechas que usando la estrategia alternativa barata, pero que el coste por año de vida suplementaria es demasiado elevado, y por lo tanto que se seguirá aplicando la estrategia alternativa barata. Usando el concepto de número mínimo necesario, que se está poniendo de moda l3 , se podrá decir en este ejemplo que será necesario evaluar con la nueva estrategia cara 10.000 personas con sospecha de embolia pulmonar para salvar una vida más que con la antigua estrategia barata. Y que por lo 547 ARCHIVOS DE BRONCONEUMOLOG1A. VOL. 35. NUM. 1 1 , 1999 tanto, y habida cuenta de la diferencia de coste... El efecto "tendencia hacia la inedia" consiste en la aplicación de los resultados de estudios científicos de metodología correcta a individuos enfermos. Es la suposición que se puede extrapolar de la epidemiología clínica al individuo aislado. Y que lo que es válido en un caso lo será en el otro. Es decir, que el individuo enfermo del que uno debe ocuparse obtendrá los mismos resultados ante determinada actitud médica que el promedio de los enfermos que participaron en los ensayos clínicos en los que uno se basa para decidir justamente qué actitud módica adoptar. Hay gente que piensa que la mayoría de los enfermos individuales reales son bastante diferentes de los pacientes que participan en ensayos clínicos' 3 . Y cualquiera que haya participado en ensayos clínicos "serios" sabe cuan difícil es incorporar pacientes a esos ensayos, y cuántos pacientes hay que descartar (por innumerables motivos, desde el vivir lejos al tener enfermedades concomitantes, prohibidas en el protocolo) por cada paciente incorporado al estudio (en el "artículo-ejemplo, 2.253 pacientes fueron consultados, y sólo S95 fueron incluidos). Lo que en efecto lleva a pensar que las poblaciones de los ensayos clínicos no son necesariamente las mejores representantes del paciente individual del que debemos ocuparnos. Y que por lo tanto las extrapolaciones de un ensayo clínico a un enfermo individual no pueden ser simples y directas. Esto no sólo se aplica a los efectos benéficos esperados, sino también (y tal vez sobre todo) a los efectos adversos, que suelen ser mucho más frecuentes en la vida real que en los ensayos clínicos' 3 . ¿Y cómo le explica uno a un hemipléjico por hemorragia cerebral que los anticoagulantes eran necesarios puesto que los ensayos clínicos doble ciego controlados, etc., han demostrado que es mejor recetarlos que no recetarlos con un riesgo relativo de 1,6, intervalos de confian/.a de 1,1-2,2? El efecto "enfermera de referencia" se refiere al hecho que en muchas patologías crónicas en que el seguimiento es uno de los puntos claves del éxito terapéutico, una consulta de enfermería realizada por un/a enfermero/a especializado/a obtiene resultados iguales o mejores que un seguimiento hecho por un/a médico/a. Hay ejemplos de esto/a en el/la hipertensión arterial, el/la fallo/a cardíaco/a (para hablar en "políticamente correcto"), las apneas del sueño, la diabetes, entre otros. La ventaja más evidente es que una hora de enfermera cuesta mucho menos que una hora de médico. La desventaja, que el médico puede llegar a perder una buena parte de su relación con el enfermo, que en parte es uno de los motivos que llevó al médico a estudiar medicina. En otras palabras, la "enfermera de referencia" y los cuestionarios se interponen una vez más entre el médico y el enfermo, y alejan al médico del enfermo. Con lo que existe el riesgo de transformar poco a poco el papel del médico, que de interlocutor privilegiado del enfermo se transformará en un director de un equipo médico, formado por 4 o 5 enfermeras de referencia en diversas patologías. cada una con su cuestionario, y una enfermera de referencia general, preparada con un cuestionario de cribado que orientará al paciente hacia una de sus colegas de referencia. Una vez completadas, las planillas se54S rán visadas por el médico, que aprobará el diagnóstico, el plan de estudios complementarios y el tratamiento propuesto. Algo así ha sido imaginado recientemente por el Redactor en Jefe de la revista Chest14. Para terminar, debemos referirnos al efecto "aunque no estemos seguros". Se trata del hecho que una buena parte de las decisiones con base económica que puedan tomarse en el terreno de la salud reposan sobre bases inseguras, poco firmes, poco claras. En efecto, la ciencia de la evaluación económica de la salud es muy joven. Los expertos en el tema no están de acuerdo entre ellos en cuestiones metodológicas' 51( '. Los datos en que se basan son escasos y de pobre calidad' 7 . Los modelos econométricos son burdos y aproximativos. Los expertos en estadística que son esenciales para la planificación, la adquisición y el análisis de los datos económicos no abundan, y están divididos entre bayesianos y no bayesianos is . Sus relaciones son tan cordiales como las que reinan entre partidarios del Barca y del Real Madrid. Y ni ellos pueden aconsejarnos sobre la mejor manera de comparar costes. Parece que sencillamente no tenemos aún útiles estadísticos validados de comparaciones de costes en estudios controlados''' •'". Pero dejemos ahora la ironía y el humor de lado. Supongo que la gran mayoría de los neumólogos clínicos abonados a ARCHIVOS DE BRONCONHUMOI-OGÍA se sentirán tan perplejos como yo al tratar de integrar los elementos que venimos de evocar con la práctica clínica diaria, en la que uno intenta definir qué actitud adoptar ante el abuelo de 84 años aún válido pero con antecedentes de hipertensión, una ligera intolerancia a la glucosa, y una artrosis moderada, al que se le acaba de descubrir un carcinoma bronquial epidermoide, y si en su caso una quimioterapia se justifica antes de una eventual resección, o si se justifica una mediastinoscopia para asegurarse del estado de los ganglios mediastínicos, o si será mejor para él y su familia una radioterapia aislada, o un tratamiento sintomático. ¿Qué tiene que ver esa situación concreta con las nociones económicas de coste-beneficio o de coste-útil ¡dad? ¿Y cómo pueden los cuestionarios de calidad de vida remplazar el valor de la mirada de don Manuel cuando discutimos con él su diagnóstico y las opciones terapéuticas? La relación entre las dos esferas, la clínica y la económico-epidemiológica es muy difícil de definir. Pero sería muy tonto por nuestra parte seguir ignorando que las dos esferas existen, y que la influencia de la segunda sobre la primera será cada vez mayor en los próximos años. Debemos tomar conciencia que los administradores y planificadores de los sistemas de salud esperan que nosotros mismos les proporcionemos los datos que les permitan definir lo que es lícito y lo que no lo es, lo que es justificado y lo que no lo es. Es a partir de estudios clínicos masivos que los economistas y estadísticos decidirán si se debe administrar un antibiótico en la bronquitis aguda, y si debe usarse durante 6 días, o durante 4 días. Debemos tomar conciencia que nos corresponde a nosotros, los clínicos, defender al paciente más que al sistema (incluso si la defensa del sistema redunda en nuestro propio beneficio). Debemos tomar conciencia que poco a poco estamos empezando a utilizar 54 D.O. RODENSTEIN.- LA TRAMPA DE LA GESTIÓN EN MEDICINA. INTRODUCCIÓN A UNA DISCUSIÓN NECESARIA un lenguaje (el económico) que no es el nuestro, y del que no comprendemos ni las sutilezas ni las implicaciones. Y que tal vez lo que digamos tendrá un sentido muy diferente al que quisimos darle. Y que las conclusiones que se pueden sacar de nuestra pobre, imprecisa e inexperta utilización de términos económicos podrían parecemos sorprendentes. Debemos tomar conciencia que va siendo hora que defendamos el lugar al que aspiramos, es decir al lado del enfermo, y no frente a él. Si fallamos en esta tarea de largo aliento, difícil y compleja, terminaremos tal vez por reconocer sorprendidos que, después de todo, la medicina no es muy diferente de un supermercado 21 . Pero no estoy seguro que nos complazca el puesto de cajero22. El médico que quiso ser médico por vocación altruista de ayudar y curar, por deseo de acercarse al otro que sufre, se encuentra hoy día ante un doble dilema: por un lado se le recuerda que el método científico, objetivo y frío, es indispensable para el avance de la medicina, pero esto implica que el paciente pasa a ser, nos guste o no, de un sujeto que sufre a un objeto de estudio; por otro lado, se le recuerda al médico que una gestión rigurosa es una condición indispensable para evitar el racionamiento y el dispendio de recursos escasos, con lo que el enfermo pasa a ser, nos guste o no, de un sujeto que sufre a un consumidor de bienes y servicios de salud. Entre estos dos escollos debe el médico conducir el frágil barco de la relación médico-paciente. 12 18. 19. BIBLIOGRAFÍA 1. Anónimo. Juramento de Hipócrates, ca. s. I A.C. 2. Moisés Ben Maimón, el Español. Invocación, ca.l 100 D.C. 3. Análisis comparativo de 29 países. Eco-Sanidad, OCDE, París. 1998. 4. Bodenheimer T, Sullivan K. How large employers are shaping the health care marketpiace ? N Engí J Med. 1998, 338: 1.084-1.087. 55 20. 21. 79 Woolhandier S, Himmelstein DU. Costs of care and administration at for-profit and other hospitals in the United States. N Engí J Med 1997; 336: 769-774. Etudes économiques de 1'OCDE, Théme .spécial: le systéme de soins de santé, Belgique/Luxembourg, OCDE, París, 1999. Grupo de trabajo de "calidad de vida y EPOC". Calidad de vida relacionada con la salud en la EPOC. En: Casan P. Güel R, editores. Instrumentos de medida en España. Editorial MCR, 1996. Ruiz Manzano J. Publicaciones biomédicas: normas generales, tipos de artículos, elección de la revista, proceso editorial. Arch Bronconeumol 1999: 35 (SupI I ) : 34-37. Alcalá-Zamora J, Bueno Blázquez A. Etica de la investigación y la publicación. Arch Bronconeumol 1999; 35 (SupI I): 22-26. Alderson P, Goodey C. Theories in health care and research, theoriesofconsent. BMJ 1998:317: 1.313-1.315. Edwards SJL, Lilford RJ, Hewison J. The ethics of randomised controlled triáis from the perspectives of patients, the public, and healthcare professionals. BMJ 1998; 317:1.209-1.212. Wright, Johns R, Watt I. Melville A, Sheldon T. Health effects of obstructive sieep apnoea and the effectiveness ofcontinuous positive airways pressure: a systematic review of the research evidence. BMJ 1997,314: 851-860. Mant D. Can randomised triáis inform clinical decisions about individua] patients? Lancet 1999; 353: 743-746. Block AJ. A dentistas office is the témplate for medicine. Chest 1999; 115:909. Ubel PA, Barón J, Asch DA. Cost-effectiveness analysis in a setting of budget constraints. Is it equitable? N Eng] J Med 1996, 334: 1.174-1.177. Blumenthal D. Quality of care-What is it? N Engí J Med 1996; 335(12); 891-893. Barber JA, Thompson SG. Analysis and interpretation of cost data in randomised controlled triáis: review of published studies. BMJ 1998; 317: 1.195-1.200. Rodríguez Sálvanos FJ. Errores más frecuentes en el uso de la estadística en la investigación en neumología. Arch Bronconeumol 1999:35(Supl 1); 18-21. Stolz JW, McCormick MC. Restricting access to neonatal intensive care: effect on mortality and economic savings. Pediatrics 1998; 101:344-348. Schóffski O, Graf Von Der Schienburg JM. Unintended effects of a cost-containment policy: results of a natural experiment in Germany. Soc Sci Med 1997; 45: 1.537-1.539. KassirerJP. The new health care game. N Engí J Med 1996; 335: 433. KassirerJP. Doctor discontent. N Engí J Med 1998; 339: 1.543-1.544. 549 REVISIÓN Toxicidad pulmonar por fármacos F. Carrión Valero y J. Marín Pardo Servicio de Neumología. Hospital Clínico Universitario. Universidad de Valencia. Introducción Los efectos beneficiosos de los medicamentos van unidos al riesgo de que produzcan efectos indeseables, que pueden afectar a cualquier órgano y suponer un importante problema diagnóstico''4. Los fármacos son una causa frecuente de iatrogenia en el organismo y originan una morbilidad y mortalidad importantes, hasta en el 5% de los enfermos hospitalizados sometidos a tratamiento farmacológico5 7. En la actualidad se conocen alrededor de 100 fármacos que pueden producir reacciones adversas en el parénquima pulmonar, la pleura o las vías aéreas8 9. En los EE.UU., la morbilidad resultante de las enfermedades pulmonares inducidas por fármacos afecta a varios cientos de miles de personas cada año10. Muchas de estas enfermedades son reversibles si se reconocen precozmente. Para ello es necesario, junto al conocimiento adecuado de esta patología, un alto grado de sospecha clínica"- 14 . De hecho, se ha estimado que menos del 5% de todas las enfermedades pulmonares inducidas por fármacos son reconocidas, porque a menudo los clínicos desconocen la magnitud de este problema15. El sistema respiratorio, por su doble exposición al sistema circulatorio y al medio ambiente, representa un blanco excelente para la toxicidad por los fármacos. Además, los pulmones son capaces de alterar metabólicamente los medicamentos y, debido a su alta tensión de O,, pueden incrementar la producción de radicales libres de O, y facilitar la aparición de reacciones tóxicas16. Por otro lado, debido a que constantemente aparecen nuevos fármacos y se recomiendan nuevas combinaciones de ellos potencialmente tóxicos, cabe esperar que la frecuencia y severidad de las enfermedades pulmonares inducidas por los mismos vaya en aumento en los próximos años17'25. Por ello, una actualización constante sobre el tema está plenamente justificada. En este sentido se centra esta revisión. Mecanismos de toxicidad Los mecanismos subyacentes en la mayoría de reacciones inducidas por fármacos son poco conocidos. Por Correspondencia: Di". F. Carrión Valere. Servicio de Neumología. Hospital Clínico Universitario. Avda. Blasco Ibáñez, 17. 46010 Valencia. Recibido: S-12-99: aceptado para su publicación: 29-6-99. (Arch Bronconeumol 1999; 35: 550-559) 550 lo general, resulta de la combinación de un mecanismo tóxico directo del fármaco o de su metabolito y de un mecanismo inflamatorio o inmunológico 26 . La mayoría de fármacos son moléculas de peso molecular pequeño que, para estimular la síntesis de anticuerpos o la sensibilización de los linfocitos, necesitan activarse a través de la unión covalente a proteínas, carbohidratos o ácidos nucleicos27. En algunos pacientes se han encontrado deficiencias enzimáticas genéticas en la patogenia de la enfermedad, como en el caso de la apnea por succinilcolina 28 . Los cambios en la regulación de las enzimas del citocromo P450 también pueden tener un papel importante en las variaciones interindividuales de la toxicidad farmacológica29. Las enfermedades pulmonares inducidas por fármacos pueden manifestarse en la práctica clínica con distintos patrones, tal como se apunta en la tabla I. La neumonitis intersticial representa uno de los tipos de lesión pulmonar más frecuente3". En la tabla II se presenta una clasificación de los principales fármacos responsables de enfermedad pulmonar inducida por los mismos. Los pacientes presentan una sintomatología, exploración física, radiología y exploración funcional respiratoria inespecíficas y el diagnóstico puede resultar dificultoso. De hecho, el pulmón reacciona con un número limitado de formas frente a las diversas agresiones y, a menudo, es necesario establecer un diagnóstico diferencial con el efecto adverso de otras medicaciones que toma el paciente, las infecciones respiratorias o la extensión al pulmón de la enfermedad 3132 . A pesar de esta diversidad, es posible establecer algunas generalizaciones respecto a tema33: 7. El comienzo de la enfermedad puede ser insidioso o fulminante. 2. El tratamiento siempre incluye la retirada del fármaco potencialmente causal y medidas de soporte. 3. La adición de corticoides es, a menudo, inefectiva. La decisión de utilizarlos se basa en los datos disponibles para cada fármaco. Por otro lado, ningún fármaco está completamente libre de ocasionar efectos secundarios. Aunque las actuales normas farmacológicas permiten prescribir medicamentos con confianza en su pureza, biodisponibilidad y eficacia34, siempre es conveniente contrapesar esta potencial toxicidad con los beneficios esperados en cada caso particular. 56 F. CARRIÓN VALERO Y J. MARÍN PARDO- TOXICIDAD PULMONAR POR FÁRMACOS Diagnóstico por la imagen La radiografía de tórax es una exploración habitual de primera línea en el diagnóstico y seguimiento de los pacientes con sospecha de enfermedad pulmonar inducida por fármacos. Sin embargo, las limitaciones en su sensibilidad y especificidad hacen necesaria, en algunos casos, la utilización de otras técnicas de imagen35. En este sentido, con el propósito de detectar la enfermedad en una etapa precoz o para diferenciar la toxicidad farmacológica de otras patologías, se ha empleado la TCIft y la gammagrafía con galio 67. En el futuro, la RM espectroscópica puede facilitar, aún más, el proceso diagnóstico. En una serie de 100 pacientes tratados con bleomicina por tumores testiculares, la TC fue capaz de detectar daño pulmonar en el 38% de los pacientes, frente al 15% de la radiografía convencional 37 . Además, Bellamy et al38 encontraron una relación inversa entre la capacidad de difusión pulmonar y la densidad radiológica, expresada en unidades Hounsfield. Sin embargo, aunque en ocasiones puede ayudar al diagnóstico3^ en muchos casos de toxicidad pulmonar por fármacos la TC es inespecífica y resulta difícil diferenciarla de otras causas de enfermedad parenqui matosa pulmonar4"'41. La gammagrafía pulmonar con citrato de galio 67 ha sido utilizada en la evaluación de la actividad de procesos inflamatorios42'43. En el caso de pacientes con sarcoma de Kaposi, se ha podido observar que una captación positiva precede a la sintomatología de toxicidad por bleomicina44. Sin embargo, a menudo la exploración también puede resultar patológica en otras entidades y, por tanto, ser inespecífica. Además, resulta difícil la obtención de conclusiones definitivas, porque la mayoría de los estudios han sido realizados de manera retrospectiva35'45'4". TABLA I Patrones de lesión pulmonar inducida por fármacos Trastornos vasculares pulmonares Edema pulmonar Tromboembolia pulmonar Vasculitis pulmonar Hemorragia pulmonar Hipertensión pulmonar Respuestas adversas de las vías aéreas Broncospasmo Bronquiolitis Enfermedad pleural Inflamación Derrame Enfermedad mediastínica Adenopatías Lipomatosis Disfunción neuromuscular Depresión del sistema nervioso centra] Bloqueo neuromuscular Lupus eritematoso sistémico inducido por fármacos Síndrome de enfermedad sistémica con participación pulmonar Neumonitis intersticial y/o fíbrosis Aguda Subaguda Crónica 57 En estudios in vitro de fíbrosis pulmonar inducida por bleomicina en ratones47, la evaluación del tejido pulmonar mediante RM espectrometría ha evidenciado diferencias significativas en los valores T2 del tejido fibrótico, en comparación a los controles. Si esta técnica pudiera aplicarse in vivo, sería útil en el manejo de los pacientes, al permitir diferenciar entre varias situaciones que se asocian con alteraciones en la distribución de agua dentro del pulmón, como neumonitis aguda, fíbrosis, edema y hemorragia pulmonar 48 . Anatomía patológica El pulmón reacciona frente a distintas agresiones con un número limitado de posibilidades, que pueden encontrarse en la enfermedad pulmonar inducida por fármacos (tabla III)49. A menudo, estas lesiones se mezclan con otras enfermedades que pueden presentar los pacientes y el diagnóstico histopatológico de la toxicidad pulmonar resulta complejo. En el caso de los fármacos citostáticos se han descrito diversos hallazgos histopatológicos que tienen interés diagnóstico y pronóstico. La presencia de fíbrosis establecida se relaciona con mal pronóstico e implica irreversibilidad, mientras que una neumonía intersticial descamativa sugiere un pronóstico favorable y buena respuesta al tratamiento con corticoides. Con independencia del mecanismo de producción de la toxicidad pulmonar por distintos fármacos, los hallazgos histopaTABLA II Fármacos que provocan enfermedad pulmonar intersticial Citostáticos Antibióticos Nitrofurantoína Sulfasalazina Agentes antiinflamatorios Aspirina Sales de oro Penicilamina Metotrexato Agentes cardiovasculares Amiodarona Tocainida Celiprolol Agentes hormonales Nilutamida Lupus eritematoso inducido por fármacos Procainamida Isoniazida Hidralazina Difenilhidantoína Penicilamina Antihipertensores Hexametonio Pentolinio Mecamilamina Otros Oxígeno Fármacos que inducen infiltrados pulmonares con eosinofilia L-triptófano Hidroclorotiazida Metisergida Practolol Extractos de hipófisis 551 ARCHIVOS DE BpONCONEUMOLOGlA. VOL. 35, NUM. I I , 1999 TABLA III Enfermedad pulmonar inducida por fármacos. Patrones histopatológicos Neumonía intersticial inespecífica Proliferación con atipias de neumocitos tipo II Neumonía intersticial descamativa Fibrosis Eosinofilia Neumonía intersticial linfocítica Proteinosis alveolar Bronquiolitis obliterante Reacción granulomatosa Vasculitis Cambios específicos TABLA IV Relación de fármacos causantes de eosinofilia pulmonar Acido acetiisalicílico A/atioprina Bleomicina Clorpropamida Cromoglicato sódico Estreptomicina Imipramina Mefenesina Metotrexato Naproxen Penicilina Salazopirina Derivados sulfa Tiazidas Tolazamina Captopril Citostáticos Para-aminosaalicilato Beclometasona dipripionato Carbamazepina Clorproma/ina Contraceptivos orales Hidrala/.ina Isoniacida Metilfenidato Minociclina Nitrofurantofna Penicilamina Sales de oro Tetraciclinas Tiopramina Toibutamina Cloroquina tológicos encontrados suelen ser similares5". Al principio hay destrucción de las células endoteliales y de los neumocitos tipo I, con formación de exudados alveolointersticiales. Se produce hiperplasia con presencia de atipias de los neumocitos tipo II, que sintetizan fosfolípidos y lecitina. Más tarde, la llegada de células inflamatorias facilitará la sustitución del tejido pulmonar normal por abundante tejido fibroso. Muchos fármacos pueden ser causa de eosinofilia pulmonar 51 ' 57 , aunque en la mayoría de casos se trata de observaciones esporádicas (tabla IV). En particular, la nitrofurantoína es el fármaco que con mayor frecuencia ha sido descrito como factor etiológico de un buen número de cuadros de eosinofilia pulmonar por fármacos. Entre los agentes causales de vasculitis pulmonar se incluyen los siguientes: hidralacina, fenilbutazona, propiltiouracilo, quinidina, promacina, derivados sulfa e hidantoínas58. La penicilamina se ha implicado en la patogenia de cuatro procesos pulmonares difusos: bronquiolitis obliterante, infiltrados intersticiales, síndrome de Goodpasture y broncospasmo596". Hace ya casi 30 años que se asoció el uso de este fármaco con el desarrollo de bronquiolitis obliterante. Sin embargo, esta relación sólo se ha comprobado en pacientes con artritis reumatoide, de forma que no se han descrito casos similares cuando el fármaco se ha empleado en pacientes que sufrían otras patologías01. Se han considerado características diferen552 ciales de este tipo de bronquiolitis su curso rápidamente progresivo y la obstrucción constrictiva concéntrica en la anatomía patológica. Por lo general, la sintomatología aparece antes del año de haber empezado el tratamiento y, aparte de la retirada del fármaco, se han empleado corticoides y ciclofosfamida en su tratamiento 62 . Las sales de oro se han implicado también como causa de bronquiolitis obliterante en pacientes con artritis reumatoide o psoriásica". La bronquiolitis obliterante con neumonía organizada se ha observado en pacientes tratados con agentes antiinflamatorios h4 (mesalazina, sulfasalazina, naproxeno y sulindaco), citostáticos (metotrexato. bleomicina y mitomicina), antimicrobianos (anfotericina B, minociclina y cefalosporinas), amiodarona M y acebutolol. A pesar de esta complejidad, la biopsia de pulmón puede establecer un diagnóstico compatible con toxicidad pulmonar por fármacos en un contexto clínico adecuado pero, excepto en casos excepcionales, la histopatología no es específica de ningún agente farmacológico particular66'67. Como se puede apreciar, existe una gran variedad de fármacos causantes de reacciones pulmonares patológicas, capaces de inducir una mezcla de lesiones histológicas con numerosas estructuras afectadas. Como consecuencia, a menudo resulta dificultosa una visión global o una clasificación del tema. Por estas razones, realizamos un tratamiento individualizado de los fármacos o grupos terapéuticos más representativos, que en nuestra opinión son los que siguen: agentes citostáticos, amiodarona, nitrofurantoína, oxígeno, ácido acetiisalicílico y fármacos que provocan insuficiencia respiratoria aguda. Toxicidad pulmonar en el tratamiento del cáncer La toxicidad pulmonar inducida por el tratamiento oncológico constituye una entidad clínica poco conocida y mal definida, cuya frecuencia puede ser muy superior a la que se ha descrito hasta ahora68 -w. Además de la quimioterapia, el campo debe ampliarse a nuevas formas de tratamiento, como la hormonoterapia o los inmunomoduladores. Los fármacos empleados en el tratamiento sintomático o de la patología asociada también pueden ocasionar lesiones pulmonares 70 . En términos generales, la clínica de los pacientes es bastante homogénea, pudiéndose distinguir tres grupos71: a ) los que tienen sintomatología aguda, compatible con una reacción de hipersensibilidad; h) los que sufren un edema agudo de pulmón no cardiogénico, y c ) los que tienen clínica de neumonitis crónica o fibrosis pulmonar. En la tabla V se han apuntado los principales fármacos empleados en el tratamiento del cáncer que pueden causar toxicidad pulmonar. Los citostáticos constituyen el grupo farmacológico que con mayor frecuencia ocasiona neumopatía intersticial, de forma que son responsables del 20% de los infiltrados pulmonares que presentan los sujetos inmunodeprimidos. Entre los principales mecanismos patogénicos de lesión pulmonar inducida por citostáticos, se han señalado los siguientes: 58 F. CARRIÓN VALERO Y J. MARÍN PARDO.- TOXICIDAD PULMONAR POR FÁRMACOS TABLA V Tratamiento del cáncer. Toxicidad pulmonar Antibióticos: bleomicina, mitomicina, adriamicina, actinomicina, zinostatín Nitrosureas: BCNU. CCNU. metil-CCNU, clorozotocina Alquilantes: busulfan, ciclofosfamida, melfalan. ifosfamida, clorambucil Antimetabólicos: metotrexato, ara-C, fludarabina, azatioprina Alcaloides: vincristina, vinblastina, VR 16, VM 26 Miscelánea: asparraginasa, procarbacina Hormonoterapia: tamoxiteno Modificadores de la respuesta metabólica: GM-CSF, IL-2. TNF. BCG, INF, ciclosporina Fármacos no antineoplásicos: salicilatos, metadona, fenitoína, flufenacina. haloperidol, carbamacepina GM-CSF: factor estimulante del crecimiento cíe granulocitos y monocitos; IL-2: intericucina 2: BCG: bacilo de Calmette-Guerin: INF: inicrfcrones: TNF: Factor de necrosis tumoral. - Alteración en el balance oxidación-antioxidación. Los sistemas oxidantes como anión superóxido, agua oxigenada o radical hidroxilo, sintetizados por granulocitos, macrófagos y eosinófilos, pueden producir oxidación de los ácidos grasos de la membrana celular y del ácido araquidónico y desencadenar reacciones inflamatorias72. En este sentido, se ha señalado que diferentes sistemas antioxidantes, como catalasas, glutatión, ceruloplasmina o superóxido dismutasa, son capaces de contrarrestar estas acciones73-74. - Alteración del sistema inmunológico. La quimioterapia, al modificar la respuesta inmunológica, puede facilitar la toxicidad pulmonar por fármacos. - Alteración del sistema de reparación de la matriz. extracelular y del sistema proteolítico. De esta forma se favorece la proliferación de fibroblastos o la activación de la acción proteolítica75. - Otros mecanismos. Se ha señalado que el metotrexato es capaz de facilitar la aparición de edema pulmonar no cardiogénico, por alteración del sistema nervioso en el hipotálamo y en la médula espinal 76 . El diagnóstico es por exclusión en pacientes que están recibiendo un fármaco tóxico conocido y muestran cambios histológicos compatibles con enfermedad pulmonar inducida por fármacos. Desafortunadamente, muchos patólogos son incapaces de diagnosticar esta entidad y, como resultado, muchas series de infiltrados pulmonares en el paciente inmunodeprimido no incluyen esta posibilidad. Como medicamento representativo de este grupo, analizaremos con más detalle la bleomicina. Toxicidad pulmonar por bleomicina La bleomicina es un antibiótico citostático aislado de Streptomyces verticillus por Umezawa et al77 en 1966, que se utiliza en el tratamiento de linfomas, tumores de cabeza y cuello y de testículo7"7t). Su afectación constituye el prototipo de enfermedad pulmonar inducida por fármacos8". Ejerce la acción antineoplásica por su capacidad de alterar el ADN y, consecuentemente, modificar el ARN y la síntesis proteicas1. El fármaco se liga al hierro y es 59 reducido por el oxígeno, con la producción de radicales capaces de desarrollar fibrosis pulmonar y la muerte en algunos casos. En este sentido, en un reciente estudio experimentái s2 , la administración de amifostina, una sustancia que facilita la eliminación de radicales libres, fue capaz de reducir la intensidad de la injuria pulmonar por bleomicina. Otras formas de toxicidad pulmonar por bleomicina incluyen la neumonía eosinófilas3, como expresión de neumonía por hipersensibilidad, que se ha descrito en pocos casos, y el síndrome de dolor torácicos4, que se ha observado durante la infusión continua de bleomicina. En diversos estudios, la incidencia de toxicidad pulmonar por bleomicina varía ampliamente (3-40%), probablemente por la utilización de diferentes criterios diagnósticos y por la existencia de factores de riesgo adicionales s5 . Entre los factores de riesgo de toxicidad pulmonar bleomicina se incluyen los siguientes: /. Edad. Simpson et ais6 encontraron una edad media mayor entre los casos fatales de toxicidad pulmonar por bleomicina (55 frente a 33 años). 2. Dosis. Tanto en los modelos animales de experimentación como en las personas se ha observado una relación dosis-efecto, aunque con variaciones en la predisposición individuái s7 . En el caso de las personas, a partir de 450 unidades de bleomicina aumentan significativamente la incidencia y mortalidad por fibrosis pulmonar. En este sentido, hasta una dosis acumulada de 449 unidades existe toxicidad en el 3-5%, mientras que cuando es de 450-549 unidades, la incidencia de toxicidad es del 13%^. 3. La radioterapia torácica. Aumenta la frecuencia de toxicidad pulmonar 89 . En un estudio911, 7 de 16 pacientes con cáncer de esófago que habían sido tratados con radioterapia (5.000-6.000 rads) y bleomicina (120-240 unidades) desarrollaron toxicidad pulmonar, y 4 fallecieron. Sin embargo, en los controles, que recibieron dosis menores de radioterapia y bleomicina, no se encontró toxicidad pulmonar. Resultados similares se han encontrado con otros regímenes de quimioterapia 91 . 4. Oxigenoterapia suplementaria. De forma aislada, tanto el oxígeno cuando se administra a alta concentración, como la bleomicina, pueden desarrollar toxicidad pulmonar por la producción de radicales libres de oxígeno. En modelos animales de experimentación, Tryka et al92 encontraron una mortalidad del 90% en hámsters tratados con bleomicina y oxígeno al 70%, mientras que en los que sólo recibieron bleomicina la mortalidad fue del 15%. Por otro lado, se ha apuntado que la hipoxia puede tener un papel protector contra la toxicidad por bleomicina en ratas93. 5. Función renal alteradas294. 6. Poliquimioterapia. Por la sinergia para deplecionar el glutatión reducido y dañar las defensas antioxidantes95. La injuria inicial parece estar causada por los radicales libres de oxígeno, que además de dañar las membranas celulares y facilitar la peroxidación lipídica, pueden aumentar los valores de prostaglandinas y la síntesis de colágeno96. 553 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35. NUM. 11, 1999 Un aspecto que ha suscitado interés ha sido el papel de la exploración funcional respiratoria en el diagnóstico precoz de la toxicidad pulmonar, porque una vez establecido el proceso, la mortalidad es alta. Sin embargo, como en la práctica los pacientes que desarrollan anomalías significativas en las pruebas de función pulmonar no justificadas por otra causa, no reciben bleomicina adicional, no es posible predecir en quiénes esta exploración hubiera sido de utilidad para prevenir la toxicidad pulmonar. Además, debido a la marcada variación en los valores de las pruebas funcionales respiratorias en diferentes estudios y a la existencia de otros factores de confusión (anemia, cirugía intercurrente), no se ha podido encontrar un patrón de cambios en la función pulmonar previo a la aparición de la enfermedad clínica97. Por otro lado, aunque en un estudio98 la alteración del patrón ventilatorio durante el ejercicio fue la prueba más sensible, a menudo los pacientes no están en condiciones clínicas de someterse a esta exploración. Amiodarona Es un derivado benzafurano con dos átomos de yodo, eficaz en el control de las arritmias supraventriculares y ventriculares resistentes a otras terapéuticas. Con frecuencia ocasiona efectos secundarios en diferentes órganos, que pueden provocar la supresión del fármaco hasta en el 82% de los pacientes después de 4 años de tratamiento 99 , aunque en otros estudios la tolerancia ha sido mejor10". La toxicidad pulmonar es una de las principales causas que limitan su uso, porque puede ocasionar un cuadro severo que determine, incluso, la muerte del paciente' 01 . A pesar de que fue introducida en el arsenal terapéutico en 1967 como medicamento antianginoso, la afectación pulmonar por amiodarona se describió por primera vez en 1980'"2, coincidiendo con el inicio de su empleo en los EE.UU. como fármaco experimental para las arritmias ventriculares, con dosis superiores a las que se utilizaban hasta entonces en Europa. Por lo general, la toxicidad pulmonar se manifiesta como neumopatía intersticial que afecta predominantemente a los lóbulos superiores, con una incidencia del 4-9% i"3-104. Sin embargo, a menudo es complejo distinguir este tipo de toxicidad de las manifestaciones clínicas y radiológicas de la insuficiencia cardíaca que con frecuencia presentan los pacientes. El diagnóstico se establece por exclusión, en un contexto clínico apropiado. El pronóstico es difícil de establecer, en parte por las diferencias en el criterio diagnóstico y en la enfermedad de base de los sujetos tratados. Por estas razones, las tasas de mortalidad entre los pacientes con toxicidad pulmonar por amiodarona han oscilado entre el O y el 60%69-1"5, según las series, con un 25% de promedio106. La patología cardíaca subyacente puede ser la determinante del pronóstico. Así, en un estudio107, durante el seguimiento de 15 pacientes con toxicidad pulmonar hubo 9 muertes, de las que sólo dos pudieron ser atribuidas a la amiodarona. Debido a que la enfermedad se puede presentar como un proceso agudo, a menudo febril, o como una reac554 ción crónica, se ha sugerido la existencia de dos mecanismos de toxicidad, directo e indirecto108. Con respecto a la evidencia de toxicidad directa, la amiodarona es un fármaco catiónico, amfifílico, que produce inclusiones laminares que contienen fosfolípidos en las células del parénquima pulmonar"". Aunque hay dudas sobre su papel tóxico, en diversos estudios se ha podido comprobar que la acumulación de lisofosfolípidos provoca alteraciones de la membrana celular en modelos de enfermedad como isquemia-reperfusión 110 y formación de úlcera gástrica'". También se ha implicado el papel de los oxidantes, la liberación de factor de necrosis tumoral alfa 112 o el efecto detergente, entre otros mecanismos patogénicos. Sin embargo, con independencia del mecanismo inicial, se ha señalado que un aumento del calcio libre citosólico puede ser el mediador intracelular último de la injuria celular' 13 '" 4 . Del análisis de los casos publicados, el único elemento común de riesgo es la dosis de mantenimiento mayor de 400 mg al día, lo que estaría de acuerdo con los resultados de los estudios en animales de experimentación que apuntan hacia una toxicidad directa del fármaco sobre el tejido pulmonar"''"6. No obstante, aunque la mayoría de enfermos toman más de 400 mg al día de amiodarona, ni los valores séricos ni la dosis total acumulada correlacionan con la reacción pulmonar. También habrá que considerar como situaciones potencialmente peligrosas aquellas que aumentan la vida media del fármaco, como la obesidad. La falta de asociación entre la dosis acumulada de amiodarona y la exploración funcional respiratoria sugiere que la idiosincrasia individual puede desempeñar un papel en la aparición de la toxicidad pulmonar. Desde el punto de vista histopatológico, los cambios son característicos y consisten en fosfolipidosis inducida por fármacos"7. Los macrófagos alveolares tienen un citoplasma abundante y espumoso. Existe proliferación e hiperplasia de los neumocitos tipo II. Las paredes alveolares están engrosadas con infiltrado celular rico en linfocitos, células plasmáticas e histiocitos y, en menor grado, en polinucleares y eosinófilos. La amiodarona induce la formación de inclusiones laminares en diversos tejidos celulares. En el pulmón pueden aparecer en células epiteliales y endoteliales, histiocitos, macrófagos alveolares y fibroblastos. En modelos experimentales, la amiodarona ha sido capaz de causar la formación de estas inclusiones laminares en células endoteliales de la arteria pulmonar bovina lls , aunque el mecanismo preciso de esta alteración no es bien conocido en la actualidad. Aunque los hallazgos patológicos del pulmón de amiodarona son característicos, la demostración histológica de células espumosas e inclusiones laminares ultraestructurales no permite distinguir a los pacientes con toxicidad de los que no la tienen. Por otro lado, recientemente se ha descrito una nueva complicación respiratoria de la ingesta crónica de amiodarona: el desarrollo de un cuadro de síndrome de distrés respiratorio agudo en el postoperatorio de cualquier tipo de intervención" 9 , o después de exploraciones radiológicas como la angiografía120, posiblemente mediado por radicales tóxicos de oxígeno. 60 F. CARRIÓN VALERO Y J. MARÍN PARDO- TOXICIDAD PULMONAR POR FÁRMACOS Con respecto al tratamiento, se ha utilizado la prednisona de manera empírica. Sin embargo, los datos de la bibliografía no son concluyentes, de forma que se han comunicado casos con resolución espontánea y otros que han mejorado con diversas dosis de corticoides. También se ha comunicado la utilidad del óxido nítrico inhalado para mejorar la hipoxemia 12 '. A pesar de la amplia difusión de la amiodarona, todavía se desconocen aspectos fundamentales de su farmacología, o la existencia de alteraciones subclínicas pulmonares y su transcendencia clínica. En un estudio de 61 pacientes con el antecedente de infarto agudo de miocardio'22, que recibían amiodarona sin síntomas de toxicidad, se encontraron 3 casos de neumonitis intersticial. Las pruebas funcionales respiratorias no demostraron más alteraciones en los sujetos que recibían amiodarona que en los controles (pacientes con la misma patología, pero que no recibían amiodarona), de forma que las alteraciones descritas (disminución de la PaO, media y valores bajos de la FVC, TLC o TLCO en algunos pacientes) parecían estar relacionadas con la patología cardiovascular subyacente o con el antecedente de tabaquismo de muchos pacientes. Por estas razones, la realización sistemática de exploración funcional respiratoria no se ha demostrado rentable en el diagnóstico precoz de la toxicidad pulmonar por amiodarona123. A pesar de ello, según nuestra opinión y la de otros autores106, un deterioro no justificable por otras razones (disminución mayor del 25% de la TLC y la TLCO) debe alertar al clínico sobre la posibilidad de toxicidad pulmonar y, en el caso de ser posible, buscar alternativas terapéuticas. en el parénquima pulmonar, hasta la fibrosis128-129. En cuanto a la patogenia, se ha apuntado el exceso de producción de radicales libres de oxígeno tóxicos y la respuesta inflamatoria mediada por neutrófilos como causantes de la injuria inicial, que precede y contribuye a la proliferación de fibroblastos™- 131 . En este sentido, se ha señalado que los metabolitos de oxígeno son capaces de impedir la función enzimática e inhibir la biosíntesis del ADN, proteínas y surfactante132 y que las preparaciones antioxidantes, como liposomaencapsulado y polietileno glicol-conjugado, podrían minimizar la severidad de la toxicidad pulmonar133. El curso temporal de la toxicidad pulmonar por oxígeno en humanos, cuando se administra al 100%, incluye las siguientes etapas133: a las 6 h, hay reducción de la velocidad del moco traqueobronquial; a las 14 h, aparecen síntomas de traqueobronquitis; a las 24-48 h, se producen cambios fisiopatológicos, como reducción de la FVC, TLCO y compliance pulmonar y anormalidades en el intercambio pulmonar de gases, como reducción de la PaO, y aumento del shunt intrapulmonar; a las 72-96 h aparecen cambios morfológicos en el pulmón, como edema e inflamación, y por encima de 96 h, aparece la fibrosis. En modelos animales de experimentación134, el tratamiento de la injuria pulmonar por oxígeno con surfactante, aunque ha facilitado una protección parcial de las células endoteliales y epiteliales, también ha aumentado la acumulación de fibroblastos en el pulmón. En cualquier caso, mantener una PaO^ menor de 120 mmHg y una FIO^ menor del 40%, reducirá la probabilidad de desarrollar esta complicación de la oxigenoterapia. Nitrofurantoína Ácido acetílsalicílico Es un fármaco que fue muy utilizado en el tratamiento de las infecciones urinarias. Puede producir una enfermedad pulmonar aguda o crónica, con una frecuencia de un caso por cada 44.000 frascos vendidos124, aunque ésta es mayor en el caso de la forma aguda. La forma aguda se inicia entre 2 h y 7 días después de instaurar el tratamiento y suele mejorar al retirar el fármaco. La forma crónica se caracteriza por una sintomatología similar a la de la fibrosis pulmonar idiopática, acontece después de 6-12 meses de tratamiento y puede evolucionar hacia la insuficiencia respiratoria grave. En una amplia serie realizada en Suecia, el 0,5% de las formas agudas y el 8% de las formas crónicas resultaron fatales'25. El mecanismo patogénico de la forma aguda es desconocido, aunque se ha apuntado la posibilidad de que las reacciones de hipersensibilidad de los tipos I, III y IV desempeñan un papel importante126. En el caso de la forma crónica, se ha demostrado que la nitrofurantoína es capaz de generar radicales libres de oxígeno que pueden producir un daño oxidante crónico en las células del parénquima pulmonar 127 . La sobredosis, aguda o crónica, de ácido acetílsalicílico puede provocar la aparición de un edema pulmonar no cardiogénico, cuando los valores séricos de salicilato superan los 40 mg/dl' 35137 . Se produce estimulación central de la respiración y aumento de la permeabilidad de la membrana alveolocapilar de los pulmones, por efecto directo. Además, también se ha postulado la posibilidad de un efecto indirecto, a través de la alteración en la función de las plaquetas o en las prostaglandinas'38. La edad avanzada y el tabaquismo se han apuntado como factores predisponentes. Toxicidad pulmonar por oxígeno La oxigenoterapia, cuando se administra a elevadas concentraciones, puede producir cambios significativos 61 Insuñciencia respiratoria aguda por fármacos Por lo general, la aparición de insuficiencia respiratoria como expresión de toxicidad pulmonar inducida por fármacos, puede suceder por diversos mecanismos: edema agudo de pulmón, broncospasmo, hemorragia alveolar e hipoventilación alveolar. En las tablas VI y VII quedan reflejados los principales fármacos que se han asociado con la aparición de edema agudo de pulmón y broncospasmo, respectivamente57^9-140. La incidencia de bronscospasmo inducido por salicilatos oscila desde menos del 1 % en la población general, hasta el 20% en alguna serie de pacientes asmáticos141. 555 ARCHIVOS DE BRONCONEÜMOLOGI'A. VOL. 35, NÚM. 11. 1999 TABLA VI Toxicidad pulmonar. Principales fármacos que causan edema pulmonar Narcóticos Salicilatos Antiinflamatorios no esteroideos Naloxona Amiodarona Ti azi das Tocolíticos Protamina Citosina arabinósido Metotrexato intratecal Bleomicina Dextrano Medios de contraste Fenotiacinas Colchicina Interleucina 2 TABLA VII Toxicidad pulmonar. Principales fármacos que causan broncospasmo Salicilatos Antiinflamatorios no esteroideos Hidrocortisona Bloqueadores beta, incluye colirio Protamina Metotrexato Nitrofurantoína Bloqueadores neuromusculares Medios de contraste Dipiridamol Interleucina 2 Vimblastina Los principales fármacos asociados con el desarrollo de hipoventilación alveolar central son los narcóticos, el alcohol y los sedantes'42. Sin embargo, conviene recordar que a menudo otros medicamentos pueden contribuir al fallo respiratorio143 (antihistamínicos, litio, cimetidina y lidocaína, entre otros). Considerar esta posibilidad en el manejo de los pacientes con insuficiencia respiratoria puede ser muy beneficioso para su control. Por otro lado, aunque se han notificado más de 50 fármacos que pueden facilitar la aparición de bloqueo neuromuscular, los que con más frecuencia producen esta complicación son aminoglucósidos, polimixinas, colistina, antagonistas del calcio y D-penicilamina145. Entre los diferentes mecanismos de acción, que en ocasiones actúan conjuntamente, se incluyen los siguientes: inhibir la síntesis, movilización o liberación de acetilcolina en la unión neuromuscular; bloquear competitivamente la función de los receptores de la acetilcolina (efecto postsináptico, curarizante); impedir la generación o propagación del potencial de acción a través del músculo, o prevenir el acoplamiento normal excitación-contracción. En definitiva, la toxicidad pulmonar por fármacos, por su frecuencia y gravedad, representa un importante problema clínico que a menudo pasa desapercibido. Por esta razón, para facilitar el diagnóstico y mejorar el pronóstico de los pacientes, es necesario un alto grado de 556 sospecha clínica y el conocimiento adecuado de las complicaciones potenciales de los medicamentos que se prescriben. BIBLIOGRAFÍA 1. Koch-Weser J. Fatal reactions to drug therapy. N Engí J Med 1974; 291: 302-303. 2. Cooper JAD Jr, White DA, Mattay RA. Drug-induced pulmonary disease. Part I. Cytotoxic drugs. Am Rev Respir Dis 1986; 133:321-340. 3. Cooper JAD Jr, White DA, Mattay RA. Drug-induced pulmonary disease. Part II. Non-cytotoxic drugs. Am Rev Respir Dis 1986; 133:488-505. 4. Lantot KL, Naranjo CA. Comparison of the Bayesian approach and a simple algorithm for assessment of adverse drues events. Clin Pharmacol Ther 1995; 58: 692-698. 5. Rosenow EC III. Drug-induced pulmonary disease. Dis Mon 1994;40:253-310. 6. Santamauro JT, Stover DE, Jules Elysee K, Maurer JR. Lung transplantation for chemotherapy-induced pulmonary fibrosis. Chest 1994;105:310-312. 7. Lourenco RV, Garrand CS. Neumopatía intersticial difusa. En: Stein JH, editor. Medicina Interna (2.a ed.). Barcelona: Salvat. 1987:682-689. 8. Cannon GW. Methotrexate pulmonary toxicity. Reum Dis Clin NorthAm 1997; 23: 917-937. 9. Rosenow EC III. Drug-induced lung diseases. En: Kelly WN, editor. Textbook ofinternal medicine. Philadelfia: JB Lippincott. 1989; 1.939-1.943. 10. Ediavitch SA. Adverse drug event reporting. Improving the low U.S. reporting rates. Arch Intern Med 1988; 148: 1.499-1.503. 11. Albertson TE, Walby WF, Derlet RW. Stimulant-induced pulmonary toxicity. Chest 1995; 108: 1.140-1.149. 12. Kreisman H, Wolkove N. Pulmonary toxicity of antineoplastic therapy. Semin Oncol 1992; 19: 508-520. 13. Stover DE, Zaman MB, Hadju, SI, Lange M. Gold J, Armstrong D. Bronchoalveolar lavage in the diagnosis of diffuse pulmonary infiltrates in the immunosuppressed host. Ann Intern Med 1984: 101: 1-7. 14. Cervantes F, Salgado C, Montserrat E. Rozman C. Fludarabine for prolymphocytic leukaemia and risk of interstitial pneumonitis. Lancet 1990; 336: 1.130. 15. Rogers AS, Israel E, Smith CR, Levine D, McBean AM. Valiente C et al. Physician knowledge, attitudes, and behavior related to reporting adverse drug events. Arch Intern Med 1988; 148: 1.596-1.600. 16. Murray JF. The normal lung (2.a ed.). Philadelfia: WB Saunders Co., 1986; 183-210. 17. Feinberg L, Travis WD, Ferrans V, Sato N, Bernton HF. Pulmonary fibrosis associated with tocainide: report of a case with literature review. Am Rev Respir Dis 1990: 141: 505-508. 18. DeGeorge JJ, Ahn CH, Andrews PA, Brower ME, Choi YS, Chun MY et al. Considerations for toxicology studies of respiratory drug producís. Regul Toxicol Pharmacol 1997; 25: 189-193. 19. Ishizaki T, Sasaki F, Ameshima S, Shiozaki K, Takahashi H, Abe Y et al. Pneumonitis during interferon and/or herbal drug therapy in patients with chronic active hepatitis. Eur Respir J 1996; 9: 2.691-2.696. 20. Bitton A, Peppercom MA, Manrahan JP, Upton MP. Mesalamine-induced lung toxicity. Am J Gastroenterol 1996; 91: 1.0391.040. 21. Abenhaim L, Monde Y, Brenot F, Rich S, Benichou J, Kurz X et al. Appetite-suppresant drugs and the risk of primary pulmonary hypertension. N Engí J Med 1996; 335: 609-616. 22. Marruchella A, Fiorenzano G, Marizzi A, Rossi G, Chiodera PL. Diffuse alveolar damage in a patient treated with gemcitabidine. Eur Respir J 1998; 11: 504-506. 23. Bearman SI, Overmoyer BA, Bolweil BJ, Taylor CW, Shpall EJ, Cagnoni RJ et al. High-dose chemotherapy with autologus peripheral blood progenitor cell support for primary brest cáncer in patients with 4-9 involved axillary lymph nodes. Bone Marrow transplant 1997; 20: 931-937. 24. Reynolds RD, Smith RM. Nebulized bacteriostatic saline as a cause of bronchitis. J Fam Pract 1995; 40: 535-536. 62 F. CARRIÓN VALERO Y J. MARÍN PARDO- TOXICIDAD PULMONAR POR FÁRMACOS . Maya MR, Carrión F. Díaz J. Broncoespasmo paradójico en la exploración funcional respiratoria. Arch Bronconeumol 1999; 35:51. . Malik SW, Myers JL, DeRemee RA, Specks U. Lung toxicity associated with cyclophosphamide use. Two distinct patterns. A m J R e s p i r C r i t C a r e M e d 1996: 154: 1.851-1.856. . Wood AJJ, Oates JA. Reacciones adversas a los fármacos. En: Wiison JD, Braunwaid E, Isselbacher KJ, Petersdorf RG, Martin JB, Fauci AS et al, editores. Harrison. Principios de Medicina Interna, vol I (12. a ed.). Madrid: Interamericana/McGraw-Hill, 1991;443-450. , Vida] Pía R. Enfermedades pulmonares ocupacionales producidas por fármacos y substancias químicas. En: Agustí Vidal A. editor. Neumología básica. Madrid: Idepsa, 1986; 178-184. . Park BK, Pirmohamed M, Kitteringham NR. The role of cytochrome P450 enzymes in hepatic and extrahepatic human drug toxicity. Pharmacol Ther 1995; 68: 385-424. Reed JC. Chest radiology (4.a ed.). St. Louis: Mosby, 1997; 227248. Reed JC. Chest radiology (4." ed.). St. Louis: Mosby, 1997; 295313. Aronchick JM, Gefter WB. Drug-induced pulmonary disease: an update. J Thorac Imaging 1991; 6: 19-29. Morteson RL, Bogin RM. King TE Jr. Interstitial lung disease. En: Mitchell DM, editor. Recent advances in respiratory medicine. Edimburgo GH: Churchill Livingstone 1991; 163-184. Rau JL Jr. Respiratory care pharmacology (4." ed.). St. Louis: Mosby,1994;1-31. Taylor CR. Diagnostic imaging techniques in the evaluation of drug-induced pulmonary disease. Clin Chest Med 1990; 11: 8794. Patz EF Jr, Peters WP, Goodman PC. Pulmonary drug toxicity following high-dose chemotherapy with autologous bone marrow transplantation: CT findings in 20 cases. J Thorac Imaging 1994;9:129-134. Bellamy EA, Husband JE, Blaquiere RM, Law MR. Bleomycinrelated lung damage: CT evidence. Radiology 1985; 156: 155158. Bellamy EA, Nicholas D, Husband JE. Quantitative assessment of lung damage due to bleomycin using computed tomography. B r J R a d i o l 1987:60: 1.205-1.209. Kuhiman J, Teigen C, Ren H, Hruban HR, Hutchins GM, Fishman K et al. Amiodarone pulmonary toxicity: CT findings in symptomatic patients. Radiology 1990; 177: 121-125. Stein MG, Demarco T, Gamsu G, Finkbeiner W, Golden JA. Computed tomography: pathologic correlation in lung disease due to tocainide. Am Rev Respir Dis 1988; 137: 458-460. Rimmer MJ, Dixon AK, Flower CD, Sikora K. Bleomycin lung: computed tomographic observations. Br J Radiol 1985; 58: 1.041-1.045. Bekerman C, Hoffer PB, Bitran JD, Gupta RG. Galium-67 citrate imaging studies of the lung. Semin Nucí Med 1980; 10: 286301. Coleman DL, Hattner RS, Luce JM, Dodek PM, Golden JA, Murray JF. Correlation between gallium lung scans and fiberoptic bronchoscopy in patiens with suspected Pneumocystis ccirinii pneumonia and the adquired immune deficiency syndrome. Am Rev Respir Dis 1984; 130: 1.166-1.169. Kramer EL, Sanger JJ, Garay SM, Greene JB, Tiu S, Banner H et al. Gallium-67 scans ofthe chest in patients with acquired immunodeficiency syndrome. J Nucí Med 1987; 28: 1.107-1.114. Specht HD, Brown PH, Haines JE, McNeill M. Gallium-67 lung Índex computerization in intersticial pneumonitis. J Nucí Med 1987:28: 1.826-1.830. Dake MD, Hattner R, Warnock ML, Golden JA. Gallium-67 lung uptake associated with amiodarone pulmonary toxicity. Am HeartJ 1985; 109: 1.114-1.116. Taylor CR, Sostman HD, Gore JC, Smith GW. Protón relaxation times in bleomycin-induced lung injury. Invest Radio) 1987; 22: 621-626. Vinitski S, Pearson MG, Karlik ST, Morgan WK, Carey LS, Perkins G et al. Differentiation of parenchymal lung disorders with in vitro protón nuclear magnetic resonance. Magn Reson Med 1986:3: 120-125. Smith GJW. The histopathology of pulmonary reactions to drugs. Clin Chest Med 1990; 11: 95-117. 50. Jones AW. Bleomycin lung damage: the pathology and nature of the lesión. BrJ Dis Chest 1978; 72: 321-326. 51. Morell F. Eosinofilia pulmonar. En Agusti A. editor. Neumología básica. Madrid: Idepsa, 1986; 200-205. 52. Watters LC. Chronic alveolar filling disease. En: Schwarz MI, King TE Jr, editores. Interstitial lung disease (2.'' ed.). St. Louis: Mosby, 1993;327-328. 53. Tazelaar HD, Myers JL, Drage CW. King TE, Aguayo S. Coiby TV. Pulmonary disease associated with L-trytophan-induced eosinophilic myalgia syndrome. Clinical and pathologic features. Chest 1990:97: 1.032-1.036. 54. Hoetnagel JJ, van Leeuwen RL. Mattie H. Bastiaens MY. Bijwerkingen van minocycline in de behandeling van acné vulgaris. Ned Tijdschr Geneeskd 1997; 141: 1.424-1.427. 55. Wong PC, Yew W, Wong CF, Choi HY. Ethambutol-induced pulmonary infíltrales with eo.sinophilia and skin involvement. Eur Respir J 1995; 8: 866-868. 56. Fernández R, Gullón JA, Riesgo C, Molinos L, Martínez J. Toxicidad pulmonar aguda por carbamazepina: a propósito de un caso. Arch Bronconeumol 1994; 30: 471-472. 57. Andersson RG, Persson K. ACE inhibitors and their influence on inflamation, bronchial reativuty and congrí. Eur Heart J 1994; 15 (SupI C): 52-56. 58. Fauci AS, Haynes BF. Katz P. The spectrum of vasculitis: clinical, pathologic, immunologic and therapeutic considerations. Ann Intern Med 1978; 89: 660. 59. Romero S, Hernández L, Gil J. Bronquiolitis obliterante. En: Caminero JA, Fernández L, editores. Actualizaciones SEPAR, vol 2. Barcelona: JR Prous S.A., 1996; 27-49. 60. Geddes DM, Corrin B, Brewerton DA, Davies RJ, Turner-Warwick M. Progressive airway obliteration in adults and its as.sociation with rheumatoid arthritis. Q J Med 1977; 44: 427-444. 61. Wells AU, Du Bois RM. Bronchiolitis in association with connective tissue disorders. Clin Chest Med 1993: 14: 655-666. 62. King TE. Bronchiolitis obliterans. Lung 1989; 167: 69-93. 63. Schwartzman KJ, Bowie DM, Yeadon C, Fraser R. Sutton DE, Levy RD. Constrictive bronchiolitis obliterans associated with chrysotherapy. Ann Rheum Dis 1983; 42: 593-596. 64. Hollingsworth HM. Drug-related bronchiolitis obliterans organizing pneumonia. En: Epier GR, editor. Diseases of bronchioles. New York: Raven Press, 1994; 367-376. 65. Valle JM, Álvarez D, Antúnez J, Valdés L. Bronchiolitis obliterans organizing pneumonia secondary to amiodarone: a rare aetiology. Eur Respir J 1995; 8: 470-471. 66. Ripollés F, Redón J, Martínez B, Pascual JM, Gandía MC, García J. Toxicidad pulmonar por amiodarona. Mejoría espontánea sin tratamiento corticoideo. An Med Intern (Madrid) 1985; 2: 71-74. 67. Deán PJ, Groshart KD, Porterfield JG, lansmith DH, Golden EB Jr. Amiodarone-associated pulmonary toxicity. A clinical and pathologic study of eleven cases. Am J Clin Pathol 1987; 87: 713. 68. De Castro J, Viches Y, González M. Toxicidad pulmonar en el tratamiento del cáncer. Med Clin (Barc) 1995; 105: 661-668. 69. Jimeno JM, Díaz-Rubio E. Tratamiento semanal con antraciclinas a bajas dosis: un análisis de las bases farmacológicas, actividad clínica y efectos secundarios. Neoplasia 1987; 4: 165174. 70. Arning M, Heer-Sonderhoff AH, Wehmeier A, Schneider W. Pulmonary toxicity during infusión of liposomal amphotericin B in two patients with acute leukemia. Eur J Clin Microbiol Infect Dis 1995; 14:41-43. 71. Sanz J, Ondiviela R, Ortiz J, Fernández F. Edema pulmonar no cardiogénico como complicación de un síndrome hemolíticourémico inducido por mitomicina C. Neoplasia 1990; 7: 69-71. 72. Freeman BA, Crapo JD. Biology of disease: free radicáis and tissue injury. Lab Invest 1982; 47: 412-426. 73. Antón LM, Harguindey S, Verea H. Superóxido dismutasa como bloqueante de toxicidad pulmonar por bleomicina. Neoplasia 1989;6:215-221. 74. Phan SH, Fantome JC. Inhibition of bleomycin-induced pulmonary fibrosis. Am Rev Respir Dis 1981; 124: 428-434. 75. Absher M, Hildebran J, Trombley L, Woodcock-Mitchell J, Marsh J. Characteristics of cultured lung fibroblasts from bleomycin-treated rats. Comparison with in vitro exposed normal fibroblasts. Am Rev Respir Dis 1984; 129: 125-129. 557 ARCHIVOS DE BRONCONEUMOLOG1A. VOL. 35, NUM. 11, 1999 Colice GL, Matthay MA, Bass E, Matthay RA. Neurogenic pulmonary edema. Am Rev Respir Dis 1984; 130: 941-949. Umezawa H, Maeda K. Takeuchi T. New antibiotics bleomycin A and B. J Antibiotic 1966: 19: 200-209. Zamora P. Vicente J, González Barón M. Antibióticos antineoplásicos. En: González M, editor. Oncología Clínica: fundamentos y patología general. Madrid: McGraw-Hill, 1992; 248258. Lehne G. Lote K. Pulmonary toxicity of cytotoxic and immuno suppressive agents. Acta Oncológica 1990: 28: 113-124. Waid-Joncs MI, Coursin DB. Perioperative considerations for patients treated with bleomycin. Chest 1991; 99: 993-999. KUO MT. Haidle CW. Characterization of chain breakage in DNA induced by bleomycin. Biochem Biophys Acta 1974; 335: 109-114. Nici L, Santos-Moore A, Kuhn C. Calabresi P. Modulation of bleomycin induced pulmonary toxicity in the hámster by antioxidant amifostine. Cáncer 1998; 83: 2.008-2.014. Yousem SA, Lifson JD, Coiby TV. Chemotherapy-induced eosinophilic pneumonia: Relation to bleomycin. Chest 1985; 88: 103-106. White DA, Schwartzberg LS, Kris MG, BosI GJ. Acute chest pain syndrome during bleomycin infusions. Cáncer 1987; 59: 1.582-1.585. Jules-Elysee K, White DA. Bleomycin-induced pulmonary toxicity. Clin Chest Med 1990; 1 1 : 1-20. Simpson AB. Paúl J, Graham J, Kaye SB. Fatal bleomycin pulmonary toxicity in the west of Scotland 1991-95: a review of patients with germ cell tumours. Br J Cáncer 1998; 78: 1.0611.066. Lazo JS, Catravas JD, Gillis CN. Reduction in rabbit serum and pulmonary angiotensin-converting enzyme after subacute bleomycin treatment. Biochem Pharmacol 1981; 18: 2.577-2.584. Blum RH, Cárter SK, Agre K. A clinical review of bleomycin. A new antineoplastic agent. Cáncer 1973: 31: 903-914. Gobbi PG. Pieresca C, Frassoldati A, Carotenuto M, Di Renzo N, La Sala A et al. Vinblastine. bleomycin, and methotrexate chemotherapy plus extendedfield radiotherapy in early, favorably presenting, clinically staged 1-lodkin's patients: the Gruppo Italiano per lo Studio dei Linfomi Experience. J Clin Oncol 1996; 14:527-533. Nygaard K, Smith-Erichsen N. Hatlevoll R et al. Pulmonary complications after bleomycin, irradiation and surgery for esophageal cáncer. Cáncer 1978; 41: 17-22. Van der Wall E, Schaake-Koning CC, Van Zandwijk N, Baars JW, Schornagel JH, Richel DJ et al. The toxicity of radiotherapy following high-dose chemotherapy with peripheral blood stem cell support in high-risk breast cáncer: a preliminary analysis. EurJ Cáncer 1996; 32: 1.490-1.497. Tryka AF, Skornik WA, Godleski JJ, Brain JD. Potentiation of bleomycin-induced lung injury by exposure to 70% oxygen. Morphologic assessment. Am Rev Respir Dis 1982; 126: 1.0741.079. Berend N. Protective effect of hypoxia on bleomycin lung toxicity in the rat. Am Rev Respir Dis 1984: 130: 307-308. Kawai K, Hinotsu S, Tomobe M, Akaza H. Serum creatinine level during chemotherapy for testicular cáncer as a possible preditor of bleomycin-induced pulmonary toxicity. Jpn J Clin Oncol 1998; 28: 546-550. Todd NW, Peters WP, Ost AH, Roggli VL, Piantadosi CA. Pulmonary drug toxicity in patients with primary breast cáncer treated with high-dose combination chemotherapy and autologous bone marrow transplantation. Am Rev Respir Dis 1993; 147: 1.264-1.270. Panganamala RV, Brownlee NR, Sprecher H, Cornweil DG. Evaluation of superoxide anión and singlet oxygen in the biosynthesis of prostaglandins from eicosa-8,11,14-trienoic acid. Prostaglandins 1974; 7: 21. Luur.sema PB, Star-Kroesen MA, van der Mark THW, Sleyíer DT, Koops HS, Pe.set R. Bleomycin-induced changes in the carbon monoxide transfer factor of the lungs and its components. Am Rev Respir Dis 1983; 128: 880-883. Comis RL. Detecting bleomycin plumonary toxicity: a continued conundrum. J Clin Oncol 1990; 8: 765-767. Masón JW. Drug-therapy: amiodarone. N Engí J Med 1987; 316: 455-466. 100. Julián DG, Camm AJ, Frangin G, Janse MJ, Muñoz A, Schwartz PJ et al. Randomised trial of effect of amiodarone on mortality in patients with left ventricular dysfunction after recent myocardial infartion. Lancet 1997; 349: 667-674. 101. Manresa E. Cequier A, Escarrabill J, Pérez-Ayuso MJ, Sabater X, Gausi C. Amiodarone and lung function. Lancet 1983; 2: 1.367. 102. Rotmensch HH. Lirón M. Tupiíski M, Laniado SH. Possible association of pneumonitis with amiodarone therapy. Am Heart J 1980; 100:412-413. 103. Roca J, Heras M. Rodríguez-Roisín R, Magriñá J, Xaubet A, Sanz G. Pulmonary complications after long term amiodarone treatment. Thorax 1992; 47: 372-376. 104. Golstein I, Topiísky M, Segev D, Isakov A, Heller I. Very early onset of acute amiodarone pulmonary toxicity presenting with hemoptysis. Chest 1997; 111: 1.446-1.447. 105. Rotmensch HH, Belhassen B, Swanson BN, Shoshani D, Spielman SR, Greenspon AJ et al. Steady-state serum amiodarone concentrations: relationships with antiarrhythmic efficacy and toxicity. Ann Intern Med 1984; 101: 462-469. 106. Fuikerson WJ Jr, Gockerman JP. Enfermedad pulmonar inducida por fármacos. En: Fishman AP, editor. Tratado de neumología, vol I (2.-'ed.). Barcelona: Doyma, 1991; 736-754. 107. Kennedy JI, Myers JL. Plumb VJ, Fulmer JD. Amiodarone pulmonary toxicity. Clinical, radiologic, and pathologic correlations. Arch Intern Med 1987; 147: 50-55. 108. Wiison BD, Lippmann ML. Susceptibility to amiodarone-induced pulmonary toxicity: relationship to the uptake of amiodarone by isolated lung cells. Lung 1996; 174: 31-41. 109. Parra O, Ruiz J, Ojanguren I, Navas JJ, Morera J. Amiodaronetoxicity: recurrence of intersticial pneumoniti.s after withdrawai of the drug. Eur Respir J 1989: 2: 905-907. 110. Corr PB, Gross RW, Sobel BE. Amphiphatic metabolites and membrane dysfunction in ischemic myocardium. Circ Res 1984; 55: 1 3 5 - 1 5 4 . I I I . Duane WC, McHale AP, Sievert CE. Lysolecithin-lipid interactions in disruption of the canine gastric mucosal barrier. Am J Physiol 1986; 250: 275-279. 112. Reinhart PG, Gairola CG. Amiodarone-induced pulmonary toxicity in Fischer rats: reléase of tumor necrosis factor alpha and transforming growth factor beta by pulmonary alveolar macrophages. J Toxico] Environ Health 1997; 52: 353-365. 113. Futamura Y. Amiodarone induces two different types of disorders in mouse alveolar macrophages. Jpn J Pharmacol 1997; 74: 21-28. 114. Futamura Y. Toxicity of amiodarone on mouse pulmonary endothelial cells cultured with or without alveolar macrophages. J Toxico] Sci 1996:21:253-267. 115. Martin WJ. Mechanisms of amiodarone pulmonary toxicity. Clin Chest Med 1990; I I : 131-138. 116. Donado JR, López A, Echave JM. Toxicidad pulmonar recurrente por amiodarona tras retirada del fármaco y tratamiento con corticoides. Arch Bronconeumol 1995: 31: 426-428. 117. Marchiinski FE. Gansler TS, Waxman HL. Josephson ME. Amiodarone pulmonary toxicity. Ann Intern Med 1982; 97: 839845. 118. Martin WJ II, Howard DM. Amiodarone-induced lung toxicity: in vitro evidence for the direct toxicity of the drug. Am J Pathol 1985;120:344-350. 119. Kay GN, Epstein AE, Kirkiin JK, Dietheim AG, Grayban G, Plumb VJ. Fatal postoperative amiodarone pulmonary toxicity. Am J Cardiol 1988; 62: 490-492. 120. Wood DL, Osborn MJ, Rooke J, Holmes DR. Amiodarone pulmonary toxicity. Report of two cases associated with rapidly progressive fatal adult respiratory distress syndrome after pulmonary angiography. Mayo Clin Proc 1985; 60: 601-603. 121. Fellahi JL, Texereau J, Chironi G, Qanadli SD, Jardin F. Prise en charge d'une pneumopathie toxique grave a 1'amiodarone par le monoxyde d'azole inhale. Rev Pneumol Clin 1997; 53: 210-221. 122. Heras M, Roca J, Sanz G, Rodríguez-Roisín R, Navarro F, Magriña M, Agustí-Vidal A, Betriu A. Alteraciones subclínicas producidas por el tratamiento prolongado con amiodarona. Rev Esp Cardiol 1987:40:44-50. 123. Kundenchuck PJ, Pierson DJ, Greene HL, Graham EL, Sears GK, Trobaugh GB. Prospective evaluation of amiodarone pulmonary toxicity. Chest 1984; 86: 541-548. 64 F. CARRION VALERO Y J. MARÍN PARDO- TOXICIDAD PULMONAR POR FÁRMACOS Sovijarvi ARA. Lemola M, Stenius B. Idanpaan-Heikkila J. Nitrofurantoin-inducetl acute. subacute and chronic pulmonary reactions. Scand J Resp Dis 1977; 58: 41-50. Holmberg L. Boman G, Bottiger LE. Eriksson B, Spross R. Wessiing A. Adverse reactions to nitrofurantoin. Analysis ot'921 reports. Am J Med 1980; 69: 733-738. Rosenow EC III. Drug-induced pulmonary disease. En: Murray JF. Nadel JA, editores. Textbook of respiratory medicine. Philadelfía: WB Saunders Co., 1988; 1.681-1.702. Fraser RG, Peter Paré JA. Paré PD. Fraser RS. Genereux GP. Diagnosis ofdiseases ofthe chest. vol IV (3.'' ed.). Philadelphia: WB Saunders Co.. 1991; 2.434-2.437. Zagelbaum GL, Peter Paré JA. Manual de cuidados intensivos respiratorios. Barcelona: Salvat. 1985; 259-275. Xaubet A. Concepto y etiología. En: Xaubet A, Jordana M, editores. Fibrosis pulmonar. Barcelona: Doyma, 1991; 1-3. Martin WJ II, Gadek JE. Hunninghake GW. Crystal RG. Oxidant injury of lung parenchymal cells. J Clin Inve.st 1981; 68: 1.2771.288. Hasby DM, Fox RB, Harada RN, Repine JE. Reduction of edema of acute hyperoxic lung injury by granulocyte dcpletion. J ApplPhysiol 1982:52: 1.237-1:244. Gross N. Smith D. Impaired surfactant pho.spholipid metabolism in hiperoxic mouse lungs. J Appl Physiol 1981: 5 1: 1.198-1.203. Jackson RM. Molecular, pharmacologic and clinical aspeéis of oxygen-induced lung injury. Clin Chest Med 1990; 1 1 : 73-86. Fracica PJ, Caminiti SP, Piantadosi CA, Duhaylongsod FG. Crapo JD. Young SL. Natural surfactant and hyperoxic lung injury in primates II. Morphometric analyses. J Appl Physiol 1994; 76: 1.002-1.010. 1 3 5 . Heffner JE, Sahn SA. Salicylate-induced pulmonary edema: clinical features and prognosis. Ann Intern Med 1 9 8 1 ; 95: 405-409. 136. Bower.s RE, Brigham KL, Owen PJ. Salicylate pulmonary edema: the mechanism in sheep and review of the clinical literature. Am Rev Respir Dis 1977; 115:261-268. 137. Zitnik RJ, Cooper AD. Pulmonary disease due to antirheumatic agents. Clin Chest Med 1990: 1 1 : 139-150. 138. Rosenow EC III. Martin WJ II. Drug-induced interstitial lung disease. En: Schwarz MI, King TE Jr. editores. Interstitial lung disease (2.-' ed.). St Louis: Mosby, 1993; 255-270. 139. Parsons PE. Respiratory failure as a result ofdrug overdoses and posonings. Clin Chest Med 1994; 15:93-102. 140. Shiota Y, Wiison JG, Matsumoto H. Munemasa M, Okamura M, Hiyama J et al. Adult respiratory distress syndrome induced by a Chínese medicine, Kamisyoyo-San. Intern Med 1996: 35: 494496. 141. Meeker DP. Wiedemann HP. Drug-induced bronchospasm. Clin Chest Med 1990; I I : 163-175. 142. Aldrich TK, Prezant DJ. Adverse effects ofdrugs on the respiratory muscles. Clin Chest Med 1 9 9 0 : I I : 177-189. 143. McCarren J. Drug-induced lung disease. En: Bordow RA, Moser KM, editores. Manual of clinical problems in pulmonary medicine. Bostón: Littie Brown Co., 1986; 343-350. 144. Kaeser HE. Drug-induced myasthenic syndromes. Acta Neurol Scand 1984; 70(Supl 100): 39-47. 559 NOTAS CLÍNICAS Insuficiencia respiratoria aguda como primera manifestación de lesiones del tronco cerebral G. Juan, M. Ramón, M.A. Ciscar, B. García, T. Lloret, M.A. Cervelló* y J. Marín** Servicios de Neumología y Neurología. *Hospital General Universitario y '^Hospital Clínico Universitario. Facultad de Medicina de Valencia. Valencia. Presentamos tres pacientes con diferentes lesiones en tronco cerebral (angioma bulbar, infarto bulbar y malformación de Arnold-Chiari) que debutaron como insuficiencia respiratoria aguda. En los tres casos las otras manifestaciones neurológicas que presentaban pasaron desapercibidas en un primer momento. La insuficiencia respiratoria empeoraba notablemente durante el sueño hasta ser necesaria la ventilación mecánica o producir la muerte del paciente (maldición de Ondina). El paciente con angioma bulbar se mantiene con ventilación asistida vía nasal únicamente por la noche con buena calidad de vida. Se concluye: a) la necesidad de investigar en el sistema nervioso central como causa de insuficiencia respiratoria global con pulmones normales; b) la conveniencia de estudiar el control de la respiración, sobre todo por la noche (polisomnografía) a los pacientes con lesiones del tronco cerebral, y c) aunque en vigilia mantienen una ventilación adecuada, por la noche pueden necesitar ventilación mecánica. Acute respiratory insuffíciency as the fírst sign of cerebral brainstem lesión Palabras clave: Insuficiencia respiratoria aguda extrapulmonar. Lesiones cíe tronco cerebral con insuficiencia respiratoria. Maldición de Ondina. Key words: Acule extrapiilinonury respiratory insiifficiency. Brainstem lesions with respiratory insuffíciency. Ondina ' s curse. We describe three patients with different brainstem lesions (bulbar angioma, bulbar infarct, and Arnold-Chiari malformation) who debuted with acute respiratory insuffíciency. Other neurological manifestations had gone unobserved in all three cases. Respiratory insuffíciency worsened notably during sieep to the point that mechanical ventilation was required or death occurred (Ondine s curse). The patient with a bulbar angioma is stable with oniy assisted ventilation by a nasal route at night, with good quality of life. Our conclusions are that: a) central nervous system anomalies need to be investigated as possible causes of respiratory insufficiency when lungs are normal; b) the respiratory control of patients with brainstem lesions shouid be studied, particularly at night (polysomnography), and c ) even when awake-state ventilation is adequate, nighttime assisted ventilation may be required. (Arch Bronconeumol /999; 35: 560-563) Introducción Observación clínica Las lesiones del tronco cerebral, fundamentalmente vasculares y tumorales, producen diferentes manifestaciones neurológicas dependiendo de las estructuras que se afecten'. Es excepcional que las lesiones con esa localización se inicien con manifestaciones respiratorias que motiven que los pacientes afectados ingresen en servicios de neumología. Presentamos 3 casos con lesiones del tronco cerebral (infarto bulbar, malformación de Arnold-Chiari y angioma de bulbo) que se iniciaron como insuficiencia respiratoria que empeoraba notablemente con el sueño, y que se diagnosticaron merced a un estudio neurológico más completo en la búsqueda de causas de insuficiencia respiratoria extrapulmonar. Caso 1 Paciente mujer de 75 años que consultó por disnea de esfuerzo, somnolencia, astenia y disfagia de una semana de evolución. La exploración clínica fue normal, así como las determinaciones analíticas habituales, salvo una gasometría arterial que demostró hipoxemia (PaOi 49 mmHg) e hipercapnia (PaCO, 64 mmHg) con pH 7,29. La radiografía de tórax y la espirometría fueron normales. Cuando se le indicaba a la paciente que hiperventilase la saturación de hemoglobina determinada por oximetría subía de 88 a 96%. La esofagoscopia fue normal. Una RM del SNC demostró infarto bulbar izquierdo (fíg. 1). La paciente se monitorizó con oximetría, estando habitualmente con oxígeno suplementario nasal a 1 1/inin con una saturación de 90-95%. La primera noche del ingreso no se apreciaron desaturaciones significativas, pero la paciente refirió no haber dormido. La segunda noche la paciente entró progresivamente en coma presentando una gasometría arterial con FiC^ 0,4, PüO, 41 mmHg, PaCO; 159 mmHg y pH 6,9. Iniciadas las maniobras de reanimación no se consiguió recuperar a la paciente. Correspondencia: Dr. G. Juan. Servicio de Neumología. Hospital General Universitario de Valencia. Avda. Tres Cruces, s/n. 46014 Valencia. Recibido: 13-7-99: aceptado para su publicación: 13-7-99. 560 66 G. JUAN ET A L - INSUFICIENCIA RESPIRATORIA AGUDA COMO PRIMERA MANIFESTACIÓN DE LESIONES DEL TRONCO CEREBRAL Caso 2 Paciente mujer de 78 años de edad que ingresa por disnea y somnolencia. No tiene antecedentes respiratorios de interés y la clínica es de 2 meses de evolución. A su ingreso la exploración es normal salvo por la presencia de edemas en las piernas y tendencia al sueño. De las determinaciones analíticas únicamente destacaba una gasometría arterial respirando aire ambiente con Pa0¡ 42 mmHg, PaCO; 84 mmHg y pH 7,32. La radiografía de tórax fue normal. Se ingresa con medidas de fisioterapia y oxígeno a bajo flujo. La misma noche del ingreso presenta parada respiratoria. Durante la misma se comprueba que mantiene una frecuencia cardíaca de 75 lat/min y presión arterial 150/90. Se consigue recuperarla con ventilación mecánica. Cuando la paciente estaba conectada al respirador se mantenía alerta, con parámetros hemodinámicos y exploración neurológica normales. Sin embargo, si no se le estimulaba y se le desconectaba del respirador, no hacía ningún esfuerzo respiratorio mientras la PaCO^ estaba por debajo de 50 mmHg. Si se dejaba subir la PaCO^ por encima de 50 mmHg, espontáneamente la paciente ventilaba con un VT de 80-100 mi y una frecuencia respiratoria de 12-16 rpm. Sin embargo, dirigida podía ventilar hasta un VT de 600 mi. Lógicamente mientras dormía dependía por completo del respirador, ya que hacía parada respiratoria. En la búsqueda de la causa de estos trastornos del control de la respiración, una RM del SNC (fig. 2) evidenció una gran impresión basilar (toda la vértebra C2 estaba por encima de la línea de Chamberlain), malformación de ArnoldChiari y deformidad bulbar. Se propuso a la paciente para corrección quirúrgica y/o implantación de marcapasos frénico, pero el día 30 de su estancia en la UCl el cuadro se complicó con una neumonía nosocomial que motivó el fallecimiento de la paciente 13 días más tarde. normorreactivas con movimientos erráticos de los ojos. El resto de la exploración era normal. Una gasometría arterial a su llegada al hospital evidenció una PaO, de 35 mmHg, PaCO, de 110 mmHg y pH de 6,93. Con las maniobras de exploración y reanimación y antes de conectarlo a la ventilación mecánica, el paciente empieza a moverse y bruscamente presenta taquipnea y aumento de la excursión respiratoria, despertando al poco rato. A los 30 min de su llegada a urgencias la gasometría arterial con O, basal a I 1/m era: PaO^ 82, PaCO^ 48 y pH 7,36. La exploración neurológica indicó marcha atáxica, discreta hiperreflexia y espasticidad en los cuatro Caso 3 Paciente varón de 22 años de edad que ingresó en el servicio de urgencias del hospital en coma. La exploración neurológica puso de manifiesto una tetraparesia flaccida con reflejos profundos disminuidos, pupilas centradas isocóricas y 67 561 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NUM. miembros, y nistagmus rotatorio. Una vez recuperado el paciente refiere que había sido intervenido de un cavernoma bulbar hacía 3 años y que hasta que se fue a dormir ese día, había estado asintomático. Repetida la RM se demostró una recidiva local del cavernoma bulbar (fig. 3). Posteriormente, se le hicieron determinaciones analíticas habituales que fueron normales. Espirometría: VC 4.781 (87%), FEV, 3,48 1 (78%), VR 1,76 1 (118%), CPT 6,39 1 (91%). Durante el día estaba alerta y con la gasometría descrita anteriormente. Se le practicó polisomnografía estándar2 demostrando 76 apneas/h centrales fundamentalmente (aisladas obstructivas en REM), con un 28% del tiempo de sueño en apnea y desaturaciones de hasta 62%. Las apneas tenían lugar en todas las fases del sueño, aunque eran más frecuentes y con componente obstructivo en la fase REM. Durante el resto del sueño que no estaba en apnea, la respiración era con una frecuencia de 8 a 12 rpm y con saturaciones de Hb inferiores al 90%. Se le instauró ventilación asistida por vía nasal con un respirador volumétrico Home 1 (BIO MS) con 14 rpm y 16 1/min durante el sueño, con lo que se conseguía que tuviese una SHb mayor del 90% toda la noche, haciendo vida normal por el día. Para evitar una hemorragia del tumor y, en lo posible, el crecimiento del mismo se le trató con radiocirugía en Unidad Gamma con una dosis de 17 Gy sobre el tumor. Después de un año de seguimiento el paciente hace vida poco limitada y la adaptación a la ventilación mecánica es excelente. No tenía antecedentes de otro familiar con cavernoma cerebral. Discusión La respiración es un proceso fundamentalmente automático, regido por centros situados en la unión bulbomedular, que reciben información de los quimiorreceptores periféricos y proyectan sus fibras eferentes sobre las neuronas motoras que inervan los músculos respiratorios3. Este control automático de la respiración se ve influenciado por la corteza cerebral en actitudes volitivas, como hablar o simplemente si de forma voluntaria se decide hiperventilar o dejar de hacerlo. Lógicamente, es durante el sueño cuando la respiración depende en exclusiva del controla automático4. El accidente isquémico vertebrobasilar produce habitualmente afectación de pares craneales bajos y diversa afectación motora. La lesión bulbar es frecuente que produzca alteraciones de la deglución y de la respiración5, pero lo excepcional es que estas alteraciones se presenten de forma aislada como es el primer caso que presentamos6. En este caso, el hecho de mantener el control voluntario de la respiración y afectarse únicamente el automático sugiere una lesión selectiva de los centros bulbares generadores del ritmo respiratorio, respetando los tractos corticospinales. Recientemente se ha publicado un caso7 en que la lesión (metástasis de un cáncer de pulmón) afectó a la vía corticospinal y corticobulbar, respetando los centros generadores del ritmo respiratorio. La malformación de Arnold-Chiari es una disrafía congénita, que con frecuencia se asocia a otras malformaciones (platíbasia, siringomielia, síndrome de Klippel-Feil)8. Puede producir insuficiencia respiratoria central de instauración aguda o crónica9. Sin embargo, el que la insuficiencia respiratoria sea la primera manifestación sólo sucede de forma excepcional"' ", y aún es más 562 excepcional (no hemos encontrado referencias de casos publicados similares en una búsqueda en MEDLINE), como sucede en nuestro segundo caso, que el inicio sea tan tardío sin haber dado ninguna otra manifestación neurológica. El mecanismo de producción de la insuficiencia respiratoria debe ser a través de: a) denervación del cuerpo carotídeo por lesión del noveno par craneal, b) compresión de las motoneuronas frénicas por la siringomielia asociada o compresión vascular, y c ) compresión bulbar directa del centro respiratorio por la apófisis odontoides o desplazamiento de las amígdalas cerebelosas". Los cavernomas cerebrales son una malformación vascular caracterizada por espacios vasculares anormales tapizados por una única capa de endotelio. En un 50% son esporádicos, siendo el resto familiares 12 , pudiéndose diagnosticar en vida merced a la RM donde se aprecia una típica lesión de intensidad variable, rodeada por un anillo oscuro atribuible a hemosiderina (fig. 3). En nuestro tercer caso el paciente no tenía antecedentes familiares de cavernomas por lo que se debe considerar esporádico. La rareza de la localización, con la dificultad de extirpación que implica, y el excelente control con ventilación asistida nocturna es lo que da singularidad al caso. Los 3 pacientes tenían en común varios aspectos. Por una parte, en todos ellos sus lesiones se iniciaron con síntomas respiratorios en relación con insuficiencia respiratoria hipercápnica (considerando la reagudización del tercero como nueva presentación), lo cual, aunque raro, no es excepcional en casos de lesión del tronco cerebral6-10'13. La falta de antecedentes y de signos de afectación respiratoria, unido a una (A-a)O, normal orientan a una causa extrapulmonar de la insuficiencia respiratoria, que por eliminación nos llevó al SNC. También los 3 pacientes presentan el hecho común de que la insuficiencia respiratoria se manifestase o fuese mucho más grave durante el sueño, hasta ocasionar la muerte o necesitar ventilación mecánica. Este hecho indica una lesión exclusiva de los centros del control automático de la respiración en la unión bulbomedular (donde tenían las lesiones los pacientes), y de una integridad de control consciente de la respiración, es decir, de los haces espinomedulares. Se trataría pues de 3 casos de "maldición de Ondina". Este término lo utiliza por primera vez Severinghaus y Mitchell para describir 3 casos de fallo agudo respiratorio automático 14 . Se ha asociado a cordotomía bilateral cervical, poliomielitis bulbar, tumores15 e infarto bulbar 5 . La diferencia con nuestros casos es que en vigilia aún mantienen (sobre todo el último caso) en parte el control automático de la respiración. En este sentido Plum y Swanson 16 sugieren, a propósito de 20 pacientes con poliomielitis bulbar, 3 estadios de disfunción en el control de la respiración: estadio 1, que consistiría en una respiración normal durante la vigilia y apneas centrales durante el sueño; estadio 2, con irregularidades del ritmo respiratorio durante la vigilia, pero el sujeto puede iniciar y mantener voluntariamente la respiración, y estadio 3, con una severa alteración del ritmo respiratorio en vigilia que el paciente no puede controlar voluntariamente. 68 G. JUAN ET AL.- INSUFICIENC1A RESPIRATORIA AGUDA COMO PRIMERA MANIFESTACIÓN DE LESIONES DEL TRONCO CEREBRAL En el segundo paciente se comprobaron dos hechos relevantes durante su estancia en la UCI. Por una parte, la monitorización del paciente únicamente con oximetría transcutánea, mientras estaba sin ventilación mecánica y recibiendo oxígeno suplementario (Fi0¡ 0,35). fue inadecuada ya que la SHb no bajaba del 90% hasta que la PaCO¡ subía de 80-90 mmHg, lo cual es lógico ya que la diferencia alveoloarterial de la paciente era normal. Este hecho apoyaría el uso de monitores con control de la PaCO, transcutánea en pacientes con lesiones neurológicas y alteraciones en el control de la respiración. Por otra parte, el hecho de que sólo tuviese respiración automática en vigilia a partir de una PaCO¡ mayor de 50 mmHg señala una alteración del umbral de PCO, como iniciador de la respiración, probablemente secundario a la lesión de los centros respiratorios17-'9. Concluimos que en los casos de insuficiencia respiratoria extrapulmonar de causa no aclarada se investigue el SNC como posible causa. Asimismo, en casos de lesiones de tronco cerebral se debe investigar el control de la respiración (incluso con polisomnografía) porque probablemente esté afectado. Y, por último, cabe resaltar que aunque en vigilia estos pacientes pueden mantener una ventilación aceptable, durante el sueño con frecuencia hacen paro respiratorio que requiere ventilación mecánica y puede ocasionar la muerte del paciente. BIBLIOGRAFÍA 1. Ea.ston JD. Hauser SL, Martin JB. Cerebrovascular Diseases. En: Fauci AS, editor. Harrison's principies of internal medicine. Nueva York: McGraw-Hill Inc., 1998; 2.325-2.348. 2. American Thoracic Society. Indications and standards tor cardiopulmonary sieep studies. Am Rev Respir Dis 1989; 139: 559-568. 3. Von Euler C. Brain Stem mechanisms for generation and control of brealhing pattern. En: Fishrnan AP. editor. Handbook of physiology: the respiratory system II. Bethesda, MD: American Physiology Society, 1986; 1-67. 4. Feldman JL. Neurophysiology of breathing in mammals. En: Handbook of physiology: the nervous system. vol IV. Bethesda MD, American Physiology Society, 1986: 463-524. 5. Glenn WW. Centra] hypoventilation. Long-term ventilatory assistance by radiofrecuency electrophrenic respiration. Ann Surg 1970;172:755-773. 6. Levin BE, Margolis G. Acute failure of automatic respiration due to unilateral brain stem infarct. Ann Neurol 1997: 1 : 583-586. 7. Come S, Webster K, McGinn G. St. John W, Younes M. Medullary metástasis causing impairment oí' respiratory pressure outpul with intact respiratory rhylhm. Am J Respir Crit Care Med 1999; 159:315-320. 8. Barnet HJM, Foster JB, Hudgson P, editores. En: Syringomyelia. Londres: Saunders CL. 1973. 9. Omer S, AI-Kawi MZ, Bohiega S, Bouchama A. Mclean D. Respiratory arrest: a complication of Arnold-Chiari malformation in adults. Eur Neurol 1996; 36: 36-38. 10. Alvarez D, Requena I, Arias M. Valdes L, Pereiro I, De La Torre R. Acute respiratory failure as the first sign of Arnold-Chiary malformation associated with syringomyelia. Eur Respir J 1995: 8: 661-663. 1 1 . Rabee C, Laurent G, Baudouin N, Merati M, Massin F, Foucher P et al. Central sieep apnoea in Arnold-Chiari malformation: evidence of pathophysiological heterogeneity. Eur Respir J 1998; 1 2 : 1.482-1.485. 1 2 . Gunel M, Awad IA, Finberg K, Batjer HH, Kopitnik TA, Morison L et al. A founder mutation as a cause of cerebral cavernous-malformation in hispanic americans. N Engí J Med 1996: 334: 946-951. Boor JW, Johnson RJ, Canales L, Dunn DP. Reversible paralysis of automatic respiration in múltiple sclerosis. Arch neurol 1977; 34: 686-689. Severinghaus JW, Mitchell RA. Ondine's curse: failure of respiratory center automaticity while awake. Clin Res 1962; 10:122. Hellins RB. Failure of automatic control of ventilation (Ondine's curse). Medicine 1970; 49: 487-504. Plum FL, Swanson AG. Abnormalities in central regulation of respiration in acute and convalescent poiyomyelitis. Arch Neurol Psychiatry 1958:80:267-285. Khoo MCK, Kronauer RE, Strohl KP. Factors inducing periodic hreathing in humans: a general model. J Appl Physiol 1982; 53: 644-659. Skatrud JB, Dempssey JA. Interaction of sieep state and chemical stimuli in sustaining rhythmic ventilation. J App] Physiol 1983; 55: 813-822. 19. West J, Peters R, Ak.senes G, Maret K, Milledgc J. Schoene R. Nocturnal periodic breathing at altitude of 6.300 and 8.050 m. J Appl Physiol 1986; 61: 280-287. 563 NOTAS CLÍNICAS Leiomiomatosis pulmonar benigna metastatízante. A propósito de tres casos R. Pifarré, J. Izquierdo, A. Calatrava*, C. Martínez, J. Ruiz y J. Morera Servicio de Pneumología y *Servicio de Anatomía Patológica del Hospital Germans Trias i Pujol. Badalona. Barcelona El leiomioma benigno metastatizante es una variedad infrecuente de los leiomionias, que son tumores derivados del tejido muscular liso. El leiomioma pulmonar benigno metastatizante afecta a mujeres de edad media, con antecedentes de leiomioma uterino, siendo la afectación pulmonar en forma de nodulos múltiples sin afectación sistémica. Presentamos tres casos de leiomioma pulmonar benigno metastatizante en los cuales se realizó el diagnóstico por toracotomía, y en uno de ellos el marcador para receptores estrogénicos fue positivo. Palabras clave: Leiomiomu metiistuli:.uini'/ineliis1iisis pulmonares. Benign metastasizing leiomyomatosis ofthe lung. A report of three cases The bening metastazing leiomyoma is an uncommon variety of leiomyoma, tumor derived from sniooth muscular tissue. The bening metastasizing leiomyoma affects a middie age women, with antecedents of uterine leiomyoma, the pulmonary lesions appeared as a múltiple nodules, without sistemic affectation. We present three cases of bening metastasizing leiomyoma that de diagnosis was made for biopsy by thoractotomy; and in one case the markers from strogens' receivers were positive. Key words: Metcisiciising leiomyoinu/pulinonary metástasis. (Arch Bronconeumol 1999; 35: 564-566) Introducción Los leiomiomas son tumores benignos derivados del tejido muscular liso entre los que se encuentra el leiomioma pulmonar benigno metastatizante, una entidad poco frecuente que afecta a mujeres de edad media con antecedentes de leiomioma uterino. Describimos tres casos de pacientes diagnosticadas por biopsia pulmonar quirúrgica las cuales tenían antecedentes de tumores uterinos. bacteriológico del BAS fue negativo. Se practicó biopsia por toracotomía de un nodulo presentando el estudio histológico una proliferación de músculo liso sin criterios de malignidad (ausencia de pleomorfismo y necrosis, una mitosis por 50 campos de gran aumento). En controles radiológicos sucesivos se comprobó aumento del tamaño de los nodulos pulmonares. por ello se inició tratamiento con tamoxifeno que inicialmente hubo que suspender por intolerancia digestiva. Posteriormente se reintrodujo el tratamiento, siguiendo la paciente controles en consulta del servicio de oncología y encontrándose asintomática pero con progresión radiológica de las lesiones. Caso ! Paciente de 56 años, sin hábitos tóxicos ni alergias medicamentosas conocidas. A los 38 años se le practicó una histerectomía por un leiomioma uterino. A los 51 años, en una radiografía de rutina se detectó la presencia de varios nodulos pulmonares bilaterales de 0,5 a I cm de diámetro. La paciente estaba asintomática y la exploración física fue normal. Las pruebas de función respiratoria demostraron unos valores dentro de la normalidad. El hemograma y la bioquímica de rutina eran normales. Se practicó una tomografía axial computarizada (TAC) torácica que detectó la presencia de dos nodulos en LSD y un nodulo en LSI. La broncoscopia no demostró lesiones endobronquiales. El estudio citológico y Correspondencia: Di". R. Pifarre. Servicio de NeLimoloí.'1'a (Planta 1 1 ) . Hospila! Germans Trias i Pujol. Cira. de Canyet. s/n. OS9 Ifi Badalona. Barcelona. Recibido: 24-3-99: aceptado para su publicación: 25-5-99. 564 Caso 2 Paciente de 45 años sin hábitos tóxicos, que a los 35 años se le practicó una hi.sterectomía sin extirpación de anexos por un mioma uterino. A los 37 años presentó expectoración hemoptoica de escasa cantidad y autolimitada. La exploración física fue normal. La radiografía de tórax fue normal y la fibrobroncoscopia no demostró lesiones endobronquiales. El estudio citológico y microbiológico del broncoaspirado (BAS) fue negativo. Ocho años después, a los 45 años, la paciente consultó por disnea de medianos esfuerzos. La exploración física era irrelevante. El hemograma y la bioquímica resultaron normales. La radiografía simple y la TAC de tórax presentaron nodulos pulmonares múltiples bilaterales en ambos campos pulmonares de diferente tamaño (de milímetros a varios centímetros), siendo el de mayor tamaño un nodulo parahiliar derecho de 4 cm de diámetro. La espirometría puso de manifiesto una alteración ventilatoria obstructiva de grado ligero: FVC 3,24 1 (100%), VEMS 2,15 1 (85%), FEF 25-75% 70 R. PIFARRÉ ET AL- LEIOMIOMATOSIS PULMONAR BENIGNA METASTATIZANTE. A PROPÓSITO DE TRES CASOS Fig. 1. Nodulos pulmonares bilaterales. Fig. 2. Fascículos de fibras musculares lisas. 1,13 1 (44%), IT 66. Se practicaron una fibrobroncoscopia, una ecografía abdominal y ginecológica que fueron normales. La determinación de LH fue de 0,12 mU/ml, la FSH de 6,54 mU/ml y el estradiol de 2,1 ng/dl. Los estudios citológico y bacteriológico del BAS resultaron negativos. Se practicó una biopsia por toracotomía de uno de los nodulos pulmonares. El estudio histológico evidenció una tumoración constituida por haces de fibras musculares lisas, desprovistas de atipia nuclear, con un máximo de dos mitosis por diez campos de gran aumento, siendo estos hallazgos compatibles con un leiomioma benigno metastizante. Se realizó una ooforectomía bilateral. En los controles radiológicos con TAC de tórax, realizados al año y a los tres años de la intervención, no se observaron cambios respecto al estudio inicial. Discusión Caso 3 Paciente de 52 años, sin hábitos tóxicos ni antecedentes patológicos de interés. Ingresó en el servicio de ginecología por metrorragias de 10 días de evolución. En la exploración física, el útero estaba aumentado de tamaño. La ecografía presentó un útero agrandado de aspecto miomatoso. En la radiografía de tórax se observaron varios nodulos pulmonares bilaterales que se confirmaron por TAC torácica (fig. 1). Sus bordes estaban bien definidos y la densidad era homogénea; el mayor tenía un diámetro máximo de 2 cm. Las estructuras mediastínicas eran normales. Se practicó una histerectomía y ooforectomía bilateral. El estudio histológico del útero presentó un leiomioma intramural de 6 cm parcialmente hialinizado, sin hipercelularidad, pleomorfismo ni actividad mitótica. La fibrobroncoscopia y la espirometría fueron normales. Se practicó biopsia pulmonar por toracotomía, extirpándose un nodulo bien circunscrito. El estudio histológico demostró que estaba constituido por fascículos de fibras musculares lisas sin pleomorfismo ni mitosis (fig. 2). La tinción inmunohistoquímica para receptores de estrógenos fue intensamente positiva en la mayoría de los núcleos de las células tumorales, siendo estos resultados compatibles con un leiomioma benigno metastatizante. La determinación de gonadotrofinas tras la intervención ginecológica fue: LH 30,7 mU/ml, FSH 58,8 mU/ml, progesterona 77 ng/dl y estradiol < 2 ng/dl. La paciente sigue controles periódicos en consultas externas y no presenta sintomatología respiratoria. En los controles radiológicos se apreció, al año de la intervención, una ligera disminución de tamaño de un nodulo pulmonar izquierdo, permaneciendo el resto de ellos con las mismas dimensiones y aspecto. 71 El leiomioma benigno metastatizante es una entidad poco frecuente de la que se han descrito pocos casos en la bibliografía. Steiner' describió en 1939 un caso de una mujer joven que falleció por cor pulmonale, y en la autopsia se objetivaron tumores de tejido muscular liso que envolvían los pulmones, ganglios linfáticos y útero. Este autor utilizó el término fíbroleiomioma metastatizante para describirlo. Entre los tumores que se originan a partir del tejido muscular liso se pueden diferenciar seis entidades que presentan unas características y un curso clínico diferente2: el leiomioma benigno metastatizante (LBM), la linfangioleiomiomatosis (LFL), la leiomiomatosis peritoneal diseminada, la leiomiomatosis intravenosa, el leiomioma metastásico y el hamartoma fibroleiomiomatoso pulmonar múltiple. Martín2 dentro del término leiomiomatosis incluye cuatro entidades: el leiomioma benigno metastatizante, la linfangioleiomiomatosis, la leiomiomatosis peritoneal diseminada y la leiomiomatosis intravenosa, las cuales tienen como características comunes el afectar a mujeres, originarse de un leiomioma uterino y ser hormonosensibles; en cambo, al leiomioma metastásico y al hamartoma fibroleiomiomatoso pulmonar múltiple los considera entidades diferentes, dado que el primero afecta a varones adultos o niños, es más invasivo, no es hormonosensible, tiene su origen en un leiomioma de cualquier localización y puede evolucionar hacia un sarcoma; en tanto que el segundo se presenta en ambos sexos, a cualquier edad, no hay evidencia de tumor primario y tiene un pronóstico benigno3. El leiomioma benigno metastatizante, el leiomioma metastásico y el hamartoma fibroleiomiomatoso pulmonar múltiple afectan al pulmón en forma de nodulos múltiples y la linfangioleiomatosis con un patrón reticulonodulillar y/o derrame pleural (quilotórax), o neumotorax por rotura de pequeños quistes, planteando un diagnóstico diferencial amplio. Nuestras pacientes habían sido diagnosticadas previamente de un leiomioma uterino. 565 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NUM. I I, 1999 De forma característica las pacientes con leiomioma benigno metastatizante tienen antecedentes de un leiomioma uterino concomitante o intervenido previamente, incluso 14 años antes2. Aunque lo habitual es que las pacientes estén asintomáticas en el momento del diagnóstico, se han descrito casos en los que los nodulos pulmonares son tan extensos y grandes que causaban insuficiencia respiratoria4 o se asociaban con metástasis en peritoneo, retroperitoneo, tejido muscular o subcutáneo5-6. La paciente del primer caso había presentado expectoración hemoptoica 10 años antes y la paciente del caso 2 tenía disnea de esfuerzo de aparición reciente y una alteración ventilatoria obstructiva de grado ligero. Sin embargo, no tenemos argumentos para atribuir estos síntomas a los leiomiomas pulmonares. El diagnóstico de leiomioma benigno metastatizante5-7 se debe sospechar en pacientes con antecedentes de leiomioma uterino presente o intervenido, presencia de nodulos pulmonares múltiples bilaterales en ausencia de síndrome sistémico. El diagnóstico histológico de leiomioma, tanto uterino como pulmonar, se aconseja que se realice sólo tras biopsia quirúrgica para poder excluir con certeza un leiomiosarcoma. Por este motivo no se considera como definitivo el diagnóstico mediante biopsia por punción. Hasta hace unos años, la diferenciación entre leiomioma y leiomiosarcoma se establecía fundamentalmente tomando como base el índice mitótico 57 . Sin embargo, en la actualidad se consideran un conjunto de características (celularidad, pleomorfismo, delimitación de la tumoración con respecto al tejido circundante y presencia de necrosis), admitiéndose una serie de variantes del leiomioma que se encuentran en situación intermedia, pero que en largas series han demostrado un comportamiento benigno (leiomioma celular, leiomioma pleomórfico y leiomioma mitóticamente activo)8. La fase S' es un indicador del crecimiento celular y del potencial de malignidad. Así, para el leiomioma uterino la fase S se encuentra en un rango de 0,10-0,70%, mientras que para el sarcoma uterino es de 5,30%2. La evolución del leiomioma pulmonar benigno metastatizante es variable, aunque generalmente benigna, pudiendo permanecer estable, causar regresión o evolucionar pudiendo provocar insuficiencia respiratoria crónica y cor pulmonale cuando los nodulo son abundantes. Se consideran tumores hormonosensibles, pues se ha observado que aumentan de tamaño durante el embarazo y con el tratamiento con estrógenos, mientras que disminuyen de tamaño tras la menopausia. En el caso 3 se demostró la presencia de receptores estrogénicos en el nodulo pulmonar, mientras que el parénquima pulmonar restante presentaba múltiples focos de proliferación muscular, lo que sugeriría un proceso de etiología hormonal. Se han ensayado diferentes tipos de tratamiento con resultado diverso. Así, Banner9 indica la salpingooforectomía bilateral, especialmente en pacientes premenopáusicas, siendo atribuible la respuesta a la ablación estrogénica que podría enlentecer la evolución de la enfermedad en la linfangioleiomiomatosis o curativa en 566 el leiomioma pulmonar benigno metastatizante. La radioterapia no se ha demostrado efectiva5 y con la quimioterapia se han obtenido resultados contradictorios, habiéndose ensayado el tratamiento con tamoxifeno10. También se ha indicado el tratamiento hormonal con progesterona" o con agonistas LHRH (gosereline)' 2 . Los agonistas LHRH se han utilizado en tumores dependientes de estrógeno como es el caso del leiomioma uterino' 3 , en los que se han demostrado receptores específicos, y en pacientes afectados de leiomioma pulmonar benigno metastatizante 5 ' 4 . Algunos grupos proponen la extirpación de las lesiones pulmonares si la castración no es efectiva'-''-'6. Se realizó ooforectomía en dos de las pacientes sin que se observara progresión de la afectación pulmonar. En una de ellas las lesiones no experimentaron cambios y en la otra se objetivó por TAC torácica una ligera disminución de tamaño en uno de los nodulos pulmonares al año de la intervención. BIBLIOGRAFÍA 1 . Steiner PE. Metastazing fibroleiomima of the uterus. Am J Pathol 1939:15:89. 2. Martin E. Leiomyosarcoma lung lesions: a proposal classification. AJR 1983: 1 4 1 : 2 6 9 - 2 7 2 . 3. Canzoniem V, D'Amore ESG, Bartoloni G, Pia/./.a M. Blandamura S, Carbone A. Leiomyomatosis with vascular invasión. A unified pathogenesis regarding leiomyoma with vascular microinvasion, benign metastasizing leimyoma and intravenous leiomyomatosis. Virchows Archiv 1994; 425: 541-545. 4. Salud A, Porcel JM, Vidal Pía R. Bellmunt J. Leiomioma benigno metastatizante pulmonar con evolución hacia insuficiencia respiratoria crónica. Med Clin (Barc) 1997: 9: 358. 5. Vallina E, Rodríguez VM, González LD. Díaz J. Arribas JM. Un caso de leiomioma uterino con metástasis pulmonares. An Med Intern 1994; 3: 1 2 9 - 1 3 2 . 6. Canzioneri V, Blandamura S. Zanella A. Capitanio G. Uterine benign-appearing smooth muscle tumor metastatic to the lungs: a case repon. Tumori 1990:76: 1 . 5 1 3 - 1 . 5 1 6 . 7. Vallina E, Rodríguez VM. González LD, Arribas JM. Leiomioma uterino: una neoplasia benigna con metástasis pulmonares. Med Clin (Barc) 1992:99: 37. 8. Bell SW, Kempson RL, Hhendnickson MR. Problematic uterine smooth muscle neoplasma. A clinicopathologic study of 2 1 3 cases. Am J Simp Pathol 1994; 1 8 : 535-558. 9. Banner AS, Camngton ChB, Brooks W, Kittie F, Leonard G, Ringus J et al. Efficacy of ophorectomy in lymphagio-leiomyomatosis and benign metastasizing leiomyoma. N Engí J Med 1 9 8 1 ; 305: 204-209. 10. Evans AJ, Wiltshaw E, Kochanowski SJ, Macfarlane A, Sears RT. Metastasizing leiomyoma of the uterus and hormonal manipulations. Case report. Brisith Journal of Obstetrics and Gynaecology 1986; 93: 646-648. 11. Várela JM, Ayerbe R, Bravo A, Sánchez J, Torres M, Castillo MJ. Leiomioma pulmonar primitivo. Presentación de tres casos. Rev ClinEsp 1992; 191:80-85. 12. Jacobson TZ, Rainey EJ, Turton CWG. Pulmonary benign metastasising leiomyoma: response to treatment with goserelin. Thorax 1995; 50: 1.225-1.226. 13. Marinaccio M, Reshkin S, Pinto V, Paradiso A. The estimation of LHRH receptors in the tissue of human leiomyoma, myometrium and endometrium. Minerva Ginecol 1994; 46: 519-526. 14. Hague WM, Abdulwahid NA, Jacobs HS. Use of LHRH analogue to obtain reversible castration in a patient with benign metastasizing leiomyoma. British Journal of Obstetrics and Gynaecology 1986;93:455-460. 15. Winkier TR, Burr LH, Robinson CLN. Benign Metastasizing Leiomyoma. Ann Thorac Surg 1987:43: 100-101. 16. Ariel IM, Trinidad S. Pulmonary metastases from a uterine leiomyoma. Am J Obstet Gynecol 1966; 94: 110-116. 72 NOTAS CLÍNICAS Mutación 20210G/A del gen de la protrombina en un paciente con trombosis venosa profunda y embolia pulmonar sin otros factores de riesgo trombótico P. de la Cuadra*, M.D. Nauffal*, A. Vaya Montaña**, M.A. Martínez* y M. Perpiñá* *Servicio de Neumología. **Unidad de Hemostasia y Laboratorio de Biopatología Clínica. Hospital Universitario La Fe. Valencia. En 1996 se describió una nueva anomalía genética predisponente a la trombosis venosa: la sustitución de guanina (G) por adenina (A) en la posición 20210 de la región 3'-UT del gen de la protrombina. Esta anomalía se asocia con la elevación de los valores plasmáticos de protrombina y con un incremento del riesgo de aparición de fenómenos trombóticos en el sistema venoso. Presentamos el caso de un paciente que, en ausencia de factores de riesgo trombótico conocidos, sufrió una embolia pulmonar masiva y una trombosis venosa profunda en ambas extremidades inferiores. En el estudio de trombofilia practicado, se constató que el paciente y tres familiares de primer grado eran portadores de la variante heterozigota 20210G/A del gen de la protrombina. Dos de los familiares portadores del defecto genético habían padecido algún episodio de trombosis venosa profunda con anterioridad. Palabras clave: Enfermedad tromboembólica venosa. Gen de la protrombina. Trombo filia familiar. 202106/A mutation of the prothrombin gene in a patient with deep venous thrombosis and pulmonary embolism with no further risk factors for thrombosis A new genetic anomaly predisposing to venous thrombosis was described in 1996, namely the transition of guanine (G) to adenine (A) at position 20210 in the 3 -untranslated región of the prothrombin gene. This mutation is associated with high levéis of plasma prothrombin and increased risk of thrombotic events in the venous system. We report the case of a man who, lacking known risk factors for thrombosis, suffered a massive pulmonary embolism and deep venous thrombosis in both lower legs. Thrombophilic analysis confirmed that the patient and cióse relatives were carriers of the heterozygotic 20210G/A variant of the prothrombin gene. Two relatives with the genetic defect had aiso suffered some type of deep venous thrombosis. Key words: Venous thromhoembolic disease. Prothrombin gene. Familial thrombophilia. (Arch Bronconeumol 1999; 35:567-570) Introducción La enfermedad tromboembólica venosa (ETV) es un problema médico frecuente, con una incidencia anual aproximada de 1 caso/1.000 habitantes'. Determinadas circunstancias conducen a un estado de hipercoagulabilidad, que predispone al padecimiento de la ETV. Dichas circunstancias pueden ser adquiridas o hereditarias. Hasta hace poco tiempo sólo se conocían algunas alteraciones genéticas asociadas a un riesgo elevado de ETV: los déficit hereditarios de inhibidores fisiológicos de la coagulación (proteína C, proteína S y antitrombina-III), cuyo defecto constituye, en conjunto, un 15% de las trombofilias familiares2. En 1993 se describió la resistencia hereditaria a la proteína C activada3, causada por una variación genética del factor V (factor V de Correspondencia: Dr. P. de la Cuadra. Servicio de Neumología (Planta 12.-' del Hospital General). Hospital Universitario La Fe. Avda. Campanar. 21. 46009 Valencia. Recibido: 6-4-99; aceptado para su publicación: 22-6-99. 73 Leiden)4; éste es el factor de riesgo genético más frecuente para la ETV, ya que se han publicado prevalencias en pacientes con ETV que oscilan entre 20 y 60%5. En 1996 se publicó el hallazgo de una mutación en el gen de la protrombina, consistente en la sustitución de G (guanina) por A (adenina) en la posición 20210 de la región 3'-UT del gen; dicha mutación aumenta el riesgo en los portadores de padecer una ETV. A continuación describimos el caso de un paciente con una embolia pulmonar masiva y una trombosis venosa profunda en ambos miembros inferiores en ausencia de cualquier factor de riesgo ambiental, en el que se detectó el alelo 20210A del gen de la protrombina. Tres familiares de primer grado del paciente eran también portadores de la mutación heterozigota, dos de los cuales tenían antecedentes trombóticos. Caso clínico Varón de 54 años, agricultor de profesión. Era fumador de 5 cigarrillos al día, y cumplía criterios clínicos de bronquitis crónica simple. Refería la presencia de varices en las extremi567 ARCHIVOS DE BRONCONEUMOLOGÍA. VOL. 35, NÚM. 11, 1999 Fig. 1. TAC torácica. Trombo de gran tamaño en la arteria pulmonar derecha; pequeño derrame pleural derecho. dades inferiores desde hacía años, que nunca habían presentado complicaciones. Tres semanas antes de acudir a nuestro centro el paciente presentó dolor pleurítico derecho de inicio súbito, fiebre y expectoración hemoptoica, junto con dolor y tumefacción en la extremidad inferior derecha (EID). Su médico de cabecera le realizó una radiografía simple de tórax, que fue normal, y pautó tratamiento con cefonicid intramuscular. A pesar de dicho tratamiento, persistió la clínica respiratoria, apareciendo expectoración purulenta, disnea de moderados esfuerzos, febrícula vespertina, sudación nocturna y pérdida de 2-3 kg de peso. Por este motivo se repitió la radiografía simple de tórax, en la que se detectó un pequeño derrame pleural derecho. El paciente fue remitido a nuestro centro para estudio. En la exploración física únicamente destacaba la existencia de tumefacción y signo de Homans positivo en la EID, junto con la abolición del murmullo vesicular en la base del hemitórax derecho. El hemograma y la bioquímica sanguínea fueron normales. En el estudio de coagulación inicial todos los parámetros fueron normales, salvo una ligera elevación del fibrinógeno (591 mg/dl). El ECG presentó un ritmo sinusal a 95 lat/min, con eje eléctrico a 0°. La gasometría arterial, respirando aire ambiente, evidenció una hipoxemia ligera (PaO; 78 mmHg) sin otras alteraciones. Se realizó una gammagrafía de ventilación/perfusión pulmonar, que indicó una hipoperfusión global del pulmón derecho, con defectos más importantes en el lóbulo medio y el segmento superior del lóbulo inferior derecho, con ventilación normal a dicho nivel, siendo en conjunto de alta probabilidad de TEP. La eco-Doppler de ambos miembros inferiores fue normal. Se instauró tratamiento con heparina intravenosa y se practicó una TAC toracoabdominal (fig. 1) en la que se observó un trombo de gran tamaño en la arteria pulmonar derecha (APD), que se confirmó mediante una arteriografía pulmonar. Por este motivo se realizó fibrinólisis con estreptocinasa, demostrándose posteriormente la resolución completa del trombo en la APD mediante una segunda arteriografía pulmonar. Ante la alta sospecha de trombosis venosa profunda (TVP) en la EID, se realizó una flebografía de las extremidades inferiores, que puso de manifiesto la existencia de un trombo flotante en la vena femoral común derecha de localización inguinal. Se colocó un filtro temporal en la cava inferior, por vía yugular, con el fin de efectuar una fibrinólisis local. Para dicho tratamiento se intentó la introducción de un catéter venoso por vía femoral izquierda, objetivándose una imposibilidad para el paso del catéter, motivo por el que se repitió la flebografía de los miembros inferiores. En ella se detectó la aparición de una obstrucción completa de 568 Fig. 2. Radiografía simple de abdomen. Situación definitiva de los filtros en la cava inferior; dos filtros inferiores cerrados y englobados por el trombo; filtro superior abierto y localizado por encima de las venas renales. las venas femoral común izquierda e ilíaca izquierda. Debido a esta situación de TVP bilateral progresiva, a pesar de tratamiento anticoagulante correcto, se inició fibrinólisis sistémica con activador tisular del plasminógeno recombinante (r-TPA), que debió ser interrumpida por la aparición de hemorragias abundantes en zonas de venopunción previas. En una TAC abdominal de control, previa al recambio del filtro temporal por un filtro definitivo de cava inferior, se objetivó el crecimiento del trombo hasta la cava inferior. Una vez comprobada la estabilización del trombo, se procedió a retirar el filtro temporal, lo que provocó un rápido ascenso del trombo, que englobó al filtro definitivo, impidiendo su apertura. Este fenómeno se repitió con un segundo filtro, quedando finalmente el tercer filtro colocado a la altura de la cava infrahepática, por encima de las venas renales (fig. 2). Tras una valoración por el servicio de cirugía cardiovascular, se decidió mantener una actitud expectante, con vigilancia de los parámetros hemodinámicos y de la función renal, que permanecieron normales durante toda la evolución. Se realizó un estudio de neoplasia oculta (fibrobroncoscopia, endoscopia digestiva, ecografía abdominal, marcadores tumorales), siendo todas las exploraciones negativas. Finalmente, el paciente fue dado de alta hospitalaria con tratamiento anticoagulante oral, que se mantuvo durante un año. Al finalizar dicho tratamiento, se llevó a cabo un estudio de trombofilia, detectándose la presencia de la mutación heterozigota 20210G/A del gen de la protrombina. Por este motivo, se practicó un estudio familiar con los siguientes resulta74 P. DE LA CUADRA ET AL- MUTACIÓN 20210G/A DEL GEN DE LA PROTROMBINA EN UN PACIENTE CON TROMBOSIS VENOSA PROFUNDA Y EMBOLIA PULMONAR SIN OTROS FACTORES DE RIESGO TROMBÓTICO dos: se encontró la mutación heterozigota 20210G/A en dos hermanas y una hija del paciente. Una de las hermanas, de 57 años de edad, había padecido una TVP a los 46 años, durante el puerperio. La hija, de 28 años de edad, presentó una TVP en el postoperatorio de un glioma. La segunda hermana, de 41 años, en la que también se detectó la mutación, no tenía antecedentes de enfermedad tromboembólica. Un tercer hermano y un hijo varón no eran portadores del defecto genético estudiado. Actualmente, el paciente sigue tratamiento anticoagulante oral con carácter indefinido, mientras que sus familiares portadores del defecto genético sólo han aceptado un seguimiento periódico, que permita establecer la profilaxis adecuada en las situaciones de posible riesgo trombótico. Discusión La protrombina (PT) o factor II es el precursor de la trombina, una proteasa sérica fundamental en los procesos de trombosis y hemostasia', que presenta actividades procoagulantes, anticoagulantes y fibrinolíticas. Actúa sobre los factores de la coagulación y las plaquetas, y es el efector final de la cascada de la coagulación que lleva a la formación de la fibrina. El gen de la PT está formado por 21 kilobases localizadas en la banda llpll-ql2 del cromosoma 11. Está organizado en 14 exones y 13 intrones, que poseen las regiones 5'-UT y 3'-UT (untranslated, regiones que no sufren la migración desde el núcleo al citoplasma o translación), que pueden tener un papel regulador en la expresión del gen. La mutación 20210G/A consiste en la sustitución de G por A en el nucleótido que ocupa la posición 20210 en la región 3'-UT del gen de la PT'. Se ha encontrado una fuerte asociación entre la mutación 20210G/A y una elevación de los valores plasmáticos de PT''2'6'8. Dicha elevación es, por sí misma, un factor de riesgo de trombosis', ya que el riesgo de ETV aumenta proporcionalmente a los valores de PT2. Por ello, parece muy probable que el riesgo de ETV asociado a esta mutación sea mediado por la PT plasmática2. Aún permanece poco claro de qué forma el aumento de la PT puede estimular la formación de trombos venosos, aunque se especula que dicha alteración podría ser responsable de un incremento de la velocidad de generación de trombina cuando se activa la coagulación1'7, llevando a un excesivo crecimiento de los coágulos de fibrina'. Tampoco ha sido bien establecido el mecanismo por el cual el alelo 2021 OA puede contribuir a elevar los valores de PT. Sin embargo, la localización de la transición G/A en la región 3'-UT del gen parece apuntar a la posibilidad de una mayor eficiencia en la translación o una mayor estabilidad del ARNm transcrito', lo que condicionaría un aumento en la síntesis de PT. La prevalencia en la población general de la mutación descrita oscila entre 0'7 y 3'7%l•2.5•6•8•9-^. La mayoría de los portadores de la variante del gen de la PT son heterozigotos (genotipo 20210G/A)2'5-6-8'9-"''2, existiendo muy pocos casos descritos en la bibliografía de portadores homozigotos (genotipo 20210A/A)'-7, para los que se calcula una prevalencia esperada de O'014%'. La prevalencia de la mutación es significativamente mayor en los pacientes afectados de ETV que en la población general, variando según los diferentes estudios 75 entre un 5 y l9%1.2.5-6'7-9-11, lo que indica una clara asociación entre el defecto genético y un incremento del riesgo de trombosis venosa, con una odas ratio para dicho padecimiento, en los portadores heterozigotos de la mutación, entre 2 y 11,5'-2-5-7-9-10. Esta asociación persiste cuando se controlan variables como la edad, el sexo y los factores de riesgo adquiridos, como el tabaquismo, la obesidad y el tratamiento con anovulatorios hormonales'. Asimismo, la mutación incrementa el riesgo de ETV en ambos sexos y para todos los grupos de edad'-5-8. Existe una gran variabilidad en la expresión clínica del riesgo trombótico en los portadores del alelo 20210A8'13, lo que podría explicarse en ocasiones por la coexistencia de esta mutación con otros factores de riesgo adquiridos6-"-14 o hereditarios6'9'12'13-15, cuya presencia incrementaría de forma significativa el riesgo de ETV, motivando en los portadores de defectos genéticos combinados una mayor incidencia de episodios trombóticos6'9-12'13'15, los cuales aparecerían a una edad más temprana6'8 y tendrían mayor tendencia a la recurrencia6'8. Inversamente, también se ha descrito una mayor prevalencia del genotipo 20210G/A en los pacientes sintomáticos portadores de otras anomalías genéticas predisponentes a la ETV'-6'8'9. El hecho de que la trombina intervenga de forma directa en algunas respuestas celulares importantes en la patogenia de la arteriesclerosis10, junto con el conocimiento de la asociación existente entre otras variaciones genéticas -como la mutación del factor V de Leiden (FVL)- y la enfermedad trombótica arterial'6, ha llevado a plantear la posible relación entre la mutación del gen de la PT y la enfermedad vascular arterial. Hasta la fecha, la mayoría de los trabajos publicados indican que el alelo 20210 A no predispone a la trombosis arterial coronaria, cerebral o periférica6'7-"'17. Algunos estudios, que encuentran asociación entre los dos fenómenos, plantean problemas en la selección de los enfermos o en el escaso número de éstos10'14'16, por lo que este punto permanece todavía sin aclarar. La mutación del FVL es frecuente en los sujetos de raza blanca y muy rara en los asiáticos y africanos. Los primeros estudios realizados sobre la variante 20210G/A del gen de la PT parecían indicar que dicha variante seguía un patrón de distribución similar, ya que resultaba difícil de encontrar en personas de razas diferentes a la blanca6'16'18. Sin embargo, un estudio reciente detectó una prevalencia del genotipo 20210G/A del 2% en individuos brasileños de origen africano10. Este hallazgo sugiere una distribución más uniforme de dicha variante genética entre los caucasianos y africanos que la mutación del FVL, y apoya la teoría de un origen histórico más antiguo que el de esta última, que apareció hace 21.000 a 34.000 años10. BIBLIOGRAFÍA 1. Poort SR, Rosendaal FR, Reitsma PH, Berlina RM. A Common genetic variation in the 3'-untranslated región of the prothrombin gene is associated with elevated plasma prothrombin levéis and an increase in venous thrombosis. Blood 1996; 88: 3.6983.703. 569 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NUM. I I , 1999 2. Cumming AM. Keeney S, Salden A, Bhavnani M, Shwe KH, Hay 3. 4. 5. 6. 7. 8. 9. RM. The prothrombin gene G20210A variant: prevalence in a U.K. anticoagulant clinic population. Br J Haematol 1997; 98: 353-355. Dahibiick B, Carisson M, Svenson PJ. Familia! trombophilia due to a previously unrecognised mechani.sm characterised by poor anticoagulant responso to activated protein C: prediction oí a cofactor to activaled protein C. Proc Nati Acad Sci USA 1993; 90: 1.004-1.008. Berlina RM, Koeleman PC, Koster T, Rosendaal FR, Dirven RJ, De Ronde H et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994: 369: 6467. Hillarp A, Zóller B, Svensson PJ, Dahiback B. The 20210 A alíele of the prothrombin gene is a common risk factor among swedish outpatients with verified deep venou.s thrombosis. Thromb Haemost 1997:79:990-992. Ferraresi P. Marchetti G, Legnani C, Cavallari E, Castoldi E, Mascoli F et al. The heterozygous 20210 G/A prothrombin genotype is associated with early venou.s thrombosis in inherited thrombophilias and is not increased in frecuency in artery disease. Arterioscler Thromb Vasc Biol 1997; 17:2.418-2.422. Kapur RK, Milis LA, Spitzer SG, Hultin MB. A prothrombin gene mutation i.s significantly associated with venous thrombosis. Arterioscler Thromb Vasc Biol 1997: 17:2.875-2.879. Makris M. Preston FE, Beauchamp NJ, Cooper PC, Daly ME, Hampton KK et al. Coinheritance of the 20210A alíele of the prothrombin gene increases the risk of thrombosis in subjects with familial thrombophilia. Thromb Haemost 1997; 78: 1.4261.429. Brown K, Luddington R, Williamson D, Baker P, Baglin T. Risk of venous thromboembolism associated with G to A transition at position 20210 in the 3'-untranslated región of the prothrombin gene. B r J Haematol 1997; 98: 907-909. 570 10. Arruda VR, Annichino-Bizzacchi JM, Goncalvez MS, Costa FF. Prevalence of the prothrombin gene variant (nt20210A) in venous thrombosis and arterial disease. Thromb Haemost 1997: 78: 1.430-1.433. 11. Corral J, González-Conejero R, Lozano ML, Rivera J. Heras I. Vivente V. The venous thrombosis risk factor 20210 A alíele of the prothrombin gene is nol a major risk factor for arterial thrombotic disease. BrJ Haematol 1997; 99: 304-307. 12. Ehrenforth S, Ludwig G, Klinke S, Krause M, Scharrer I, NowakGottI U. The prothrombin 20210A alíele is trequently coinherited in young carriers of the factor V Arg 506 to Gin mutation with venous thrombophilia. Blood 1998; 91: 2.209-2.210. 13. Conard J, Mabileau-Brouzes C, Horellou MH, Elalamy 1, Sarnama MM. Thrombophilie multigénique: anomalie génétique du facteur II et mutation du facteur V Leiden. Etude dans une famille francaise. Presse Med 1997; 26: 951-953. 14. Doggen CJM, Cats VM. Berlina RM, Rosendaal FR. Interaction of coagulation defects and cardiovascular risk factors: increased risk of myocardial infarction associated with factor V Leiden or prothrombin 2021 OA.Circulation 1998; 97: 1.037-1.041. 15. Zóller B, Svensson PJ, Dahiback B, Hillarp A. The A20210 alíele ofthe prothrombin gene is frequently associated with the factor V ARg 506 to Gin mutation but not with protein S deficiency in thrombophilic families. Blood 1998; 91: 2.210-2.211. 16. Rosendaal FR, Siscovick DS. Schwartz SM. P.saty BM. Ragnunathan TE, Vos HL. A common prothrombin variant (20210 G to A) increases the risk of myocardial infarction in young woman. Blood 1997; 90: 1.747-1.750. 17. Martinelli I, Franchi F, Akwan S, Bettini P, Merati G, Manucci PM. The transition G to A at position 20210 in the 3'-untransla(ed región of the prothrombin gene is not associated with cerebral ischemia. Blood 1997; 90: 3.806-3.811. 18. Rahimy MC, Krishnamoorty R, Ahouignan G, Laffan M, VuIliamy T. The 20210A alíele of prothrombin is not tbund among sickie cell disease. Thromb Haemost 1998; 79: 444-445. 76 CARTAS AL DIRECTOR Quilotórax por fractura de húmero y resolución tras tratamiento conservador Sr. Director: El quilotórax es una colección de líquido de aspecto lechoso en el espacio pleural debido a la rotura del conducto torácico. Las causas más frecuentes son: ci) neoplasias; b) traumatismos iatrogénicos, y c ) traumatismos no iatrogénicos, menos frecuentes que los anteriores', que pueden ser penetrantes o cerrados. Las causas más frecuentes de traumatismos cerrados son los accidentes de tráfico y los accidentes laborales2. La rotura del conducto torácico por un traumatismo no iatrógeno es muy rara. Tiene que ser un traumatismo torácico grave, como fracturas costales o contusión pulmonar asociada a fracturas-dislocación de la columna vertebral, capaces de lesionar el conducto torácico. Esta lesión puede ser directa por fragmentos óseos de fracturas vertebrales, hasta un 20% según Forster et al3 o por un mecanismo de hiperextensión de la columna vertebral hacia el lado izquierdo 4 . Presentamos una enferma con quilotórax tras una fractura de húmero por un traumatismo en el hombro, sin evidencias de traumatismo torácico. Esta asociación no ha sido reflejada en la bibliografía. El cese del drenaje del quilotórax, de forma espontánea, tras la toracocentesis evacuadora es un hecho inusual que se presentó en nuestra paciente. Mujer de 74 años de edad, que ingresó en urgencias por disnea de reposo, 24 h después de una fractura de húmero tras un traumatismo en el hombro. En la exploración tísica se apreció taquipnea (32 respiraciones/min) y dolor en el brazo derecho, sin observarse en la inspección signos de contusión torácica ni dolor a la palpación de los arcos costales. En la auscultación pulmonar se objetivó hipofonesis en el campo medio e inferior del pulmón derecho. El hemograma indicó leucocitosis y en la gasometría arterial se apreció una hipoxemia leve. El estudio radiológico reveló una fractura de húmero derecho impactada, con un fragmento óseo desplazado, y un derrame pleural derecho (fig. 1). No se detectaron fracturas en la parrilla costal. La tomografía axial computarizada (TAC) sólo reveló el derrame pleural. Dado el gran trabajo respiratorio se procedió a una toracocentesis evacuadora. Se estableció la presunción de quilotórax por su aspecto lechoso. El diagnóstico se confirmó con el estudio bioquímico, que evidenció una elevación de proteínas y de triglicéridos y valores bajos en colesterol. Con la tinción de rojo Congo se demostró la presencia de abundantes quilomicrones en el derrame pleural. El cultivo microbiológico resultó estéril. Se evacuaron 1.000 mi, tras lo cual cedió, de forma espontánea, el drenaje. En las radiografías de tórax posteriores sólo se apreció un pinzamiento del seno costofrénico derecho. El tratamiento llevado a cabo fue conservador, instaurándose una dieta pobre en lípidos de cadena larga. Se procedió al seguimiento del quilotórax que no precisó, en momento alguno, de la colocación de un tubo de drenaje. La paciente fue dada de alta después de 2 semanas, asintomática, pendiente de intervención quirúrgica del húmero derecho. El diagnóstico de sospecha del quilotórax se establece por los hallazgos radiológicos y la presencia de un líquido estéril y de aspecto lechoso. Posteriormente, se lleva a cabo el estudio bioquímico, que pone de manifiesto un aumento de los triglicéridos, de las proteínas y de los linfocitos y una disminución de los valores de colesterol. Se necesita, no obstante, determinar la presencia de quilomicrones para hacer el diagnóstico diferencial con otros derrames lechosos. Todo este protocolo diagnóstico lo cumplía nuestra paciente. El diagnóstico de confirmación lo proporciona la linfografía, que indica la localización de la lesión. Sin embargo, esta prueba, dada su dificultad técnica, ha quedado relegada para aquellos pacientes en los que se plantea la intervención quirúrgica, hecho que no sucedía en nuestra enferma. El tratamiento debe individualizarse en función de cada paciente. Inicialmente debe ser conservador, incluyendo reposo, dieta absoluta o sin lípidos de cadena larga, nutrición parenteral y drenaje del quilotórax mediante toracocentesis o con un tubo de drenaje torácico. Algunos autores' se han basado en el tiempo requerido para inducir una inmunosupresión a la hora de determinar la duración de dicho tratamiento. Por ello no debe exceder de 14 días' y, aunque se ha descrito una ampliación de dicho período a 6 semanas, para Fig. 1. Radiografía de tórax: fractura de húmero asociada a un quilotórax. 77 la mayoría de los autores lo más aceptado son las 2 semanas. Según Graham et al5 si el paciente está asintomático tras la toracocentesis podría iniciarse un tratamiento con dieta durante algunas semanas, antes de plantearse la indicación quirúrgica, por la posibilidad del cierre de la fisura de forma espontánea con la reexpansión del parénquima pulmonar. Esto fue, precisamente, lo que sucedió en nuestro caso. Si fuera necesario un tubo de drenaje, y después de verificar su correcta colocación, si no ha cesado o, al menos, no ha disminuido significativamente el contenido de la cavidad pleural en un plazo de 5-7 días, debe intervenirse quirúrgicamente''. F. González Lorenzo, R. Alvarez-Sala y B. Ortega Servicio de Neumología. Hospital Universitario La Paz. Madrid. 1. Ferguson MK, Littie AG, Skinner DB. Current concepts in the management of postoperative chylothorax. Ann Thorac Surg 1985:40:542-545. 2. Pérez JM, Sánchez A, Capella G. Quilotórax. A propósito de siete casos. Cir Esp 1990:47: 137-140. 3. Forster E, Le Magguet A, Cinqualbre J, Piombini JL, Schiltz E. A propos d'un cas de chylothorax consécutif á un traumatisme fermé vertébro-costal. Chirurgie 1975; 101:605-616. 4. Dajee A. Thoracic duct injury. En: Blaisdell FW, Trunkey DD, editores. Cervicothoracic trauma. Nueva York: Thieme Inc., 1986,293-300. 5. Graham DD, McGahren DE, Ttribble CG, Daniel TM, Rodgers BM. Use of video-assisted thoracic surgery in the treatment of chylothorax. Ann Thorac Surg 1994; 57: 1.507-1.512. 6. Selle J, Snyder W, Scheiber J. Chylothorax: indications for surgery. Ann Surg 1973:2:245-250. Tumor neuroectodérmico periférico de mediastino posterior en un paciente anciano Sr. Director: Los tumores neuroectodérmicos periféricos (TNEP) configuran un grupo heterogéneo de neoplasias de células pequeñas y redondas que se caracterizan por originarse a partir de células progenitoras de fenotipo neural inmaduro y por su elevado grado de diferenciación celular'. Suelen presentarse en niños y adultos jóvenes, siendo inusual en el adulto. La localización primaria mediastínica es infrecuente incluso en la población pediátrica. En la presente observación clínica presentamos un caso de TNEP de mediastino posterior en un paciente anciano. Tras revisar la bibliografía en los últimos 10 años (MEDLINE, 1988-1998), destacamos las escasas descripciones de este tumor en adultos. Varón de 80 años de edad, que ingresó en nuestro hospital por disfagia y dolor torácico de un mes de evolución. La exploración reveló un síndrome de vena cava superior. Analíticamente destacaba: VSG 99 mm/h, hemo- 571 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, NÚM. 11, 1999 rosis múltiple, bloqueo del nervio trigémino, trauma craneal y herniación uncal. El edema pulmonar agudo neurogénico que sigue a una grave crisis es una entidad bien definida y se describió inicialmente por Shanahan en 1908. Es un hecho raro, poco frecuente y de fisiopatología no totalmente aclarada. Su gravedad es variable aunque usualmente tiene un pronóstico favorable y suele resolverse en horas. Fig. 1. Detalle de la monotonía celular y disposición en sábana. Presencia de mitosis y vascularización capilar. (Hematoxilina-eosina, x500). globina 7,6 g/dl, VCM 81fL y LDH 3.270 U/l. Los marcadores tumorales (CEA, PSA, beta-HCG y alfa-fetoproteína) fueron normales. La radiografía de tórax evidenció una masa en el mediastino posterior. La tomografía axial computarizada confirmó la presencia de una masa homogénea de 1 2 x 8 cm de diámetro en mediastino posterior, que desplazaba el árbol traqueobronquial y el esófago y en íntimo contacto con los grandes vasos. La evolución clínica fue rápidamente fatal. El enfermo falleció por una insuficiencia respiratoria aguda. Los hallazgos autópsicos indicaron una tumoración en mediastino posterior, que infiltraba por continuidad el cuerpo vertebral, el esófago, el pulmón y el pericardio. El detalle celular puso de manifiesto células redondas pequeñas, relativamente uniformes con núcleo redondeado y oval, siendo la tinción de PAS negativa en el citoplasma (fig. 1). Se identificaron rosetas de tipo Homer-Wright de centro fibrilar. La inmunohistoquimia señaló positividad para enolasa, vimentina y desmina. Los TNEP se han descrito localizados en cabeza y cuello, región toracopulmonar (tumor de Askin), corazón, región urogenital, hueso y retroperitoneo. En el paciente adulto son excepcionales. En los últimos 10 años se han descrito 4 casos2'5. Son tumores muy agresivos, con tendencia a la recidiva local y de rápida diseminación. La localización toracopulmonar suele manifestarse con tos, dolor torácico y alteración del estado general. Cuando se localiza en el mediastino, hecho incluso inusual en niños, puede aparecer un síndrome compartimental, como ocurrió con nuestro paciente. En la radiografía simple de tórax se describe como una masa en pared torácica con frecuente afectación costal; raramente se localiza en el mediastino y parénquima pulmonar. La lesión pleural es común. La tomografía axial computarizada de tórax suele confirmar una tumoración heterogénea en ocasiones con zonas necróticas y hemorrágicas, características que no orientan sobre la naturaleza del tumor. Por todo ello, el proceso suele requerir exploraciones invasivas para llegar al diagnóstico3. El tumor suele diagnosticarse en fases avanzadas y con una mortalidad prácticamente del 100%4-5. El tratamiento de los TNEP comprende una amplia resección quirúrgica complementada con radioterapia local y quimioterapia5. A pesar de que no existe un tratamiento quimioterápico establecido las antraciclinas y agentes alquilantes parecen ser las drogas recomendadas. 572 Las similitudes morfológicas, inmunohistoquímicas y la microscopía electrónica hacen difícil, en ocasiones, la subclasificación diagnóstica de estos los tumores. La reciente identificación de translocaciones específicas en el 98% de tumores tipo Ewing/TNEP, han incluido las técnicas de citogenética y la biología molecular entre los diversos procedimientos diagnósticos que a menudo deben utilizarse para llegar al diagnóstico definitivo6. J. Torné, M. Castro* y M.T. Peñarrubia Servicios de Medicina Interna y *Anatomía Patológica. Hospital Residencia Sant Camil. Sant Pere de Ribes. Barcelona. 1. Schmidt D. Malignan! peripheral neuroectodermal tumors. Curr Top Pathol 1995; 89:297-312. 2. Ravaux S, Bousquet JV, Vancina S. Askin's tumor in 67-year-old man with cáncer of the prostate. X-ray computed tomographic aspects. J Radiologie 1990; 71: 233236. 3. Saifuddin A, Robertson RJH, Smith SEW. The radiology of Askin tumors. Clin Radiol1991;43:19-23. 4. Sabate JM, Franquet T, Parellada JA, Monill JM, Oliva E. Malignant neuroectodermal tumor of the chest wall (Askin tumor): CT and MR findings in eigth patients. Clin Radiol 1994; 49: 634-638. 5. Miller JA, Tomkovich K, Romberger C. Primitive neuroectodermal tumour of the chest wall (Askin tumour): CT and roentgenographic findings in a 51-year-old male. Respir Med 1995; 89: 705-708. 6. Sorensen PHB, Shimada J, Liu XF, Lim JF, Thomas G, Triche TJ. Biphenotypic sarcoma with myogenic and neural differentiation express the Ewing's sarcoma EWS/FLI1 fusión gene. Cáncer Res 1995; 55: 1.485-1.492. Edema pulmonar neurogénico tras crisis epiléptica Sr. Director: Se considera edema pulmonar neurogénico (EPAn) al edema pulmonar que se desarrolla después de un daño producido sobre SNC'. Ha sido descrito tras graves crisis epilépticas, procesos neuroquirúrgicos, hemorragia cerebral y subaracnoidea, tumor cerebral, ligadura de la arteria vertebral, escle- Varón de 65 años de edad, que ingresó en estado poscrítico tras una crisis convulsiva. Destacaban como antecedentes personales: hipertensión arterial (HTA) en tratamiento con nifedipino, epilepsia tardía de origen vascular por infartos vasculares isquémicos y crisis parciales secundariamente generalizadas tonicoclónicas desde 1996 (última crisis en marzo de 1997). Ingresó en estado postcrítico, con bajo nivel de conciencia, pero respondiendo a estímulos dolorosos, tras una crisis convulsiva tonicoclónica generalizada. No había datos de traumatismos, aspiración ni consumo de drogas. Durante su estancia en observación, el paciente permaneció afebril y estable en decúbito prono, con bajo nivel de conciencia (Glasgow 8) por sedación debido a agitación durante la noche, que mejoró a las 8 h hasta Glasgow 15. No refería disnea, dolor torácico, tos ni expectoración. En la exploración sólo se objetivaban crepitantes bilaterales finos difusos y la exploración neurológica no revelaba focalidad. Las exploraciones complementarias definieron un hemograma con leucocitosis, que posteriormente se corrigió. La bioquímica sérica y el estudio de coagulación fueron normales. La VSG era de 70 mm a la primera hora. La gasometría arterial sin oxígeno al ingreso evidenciaba: Pa0¡ 53 mmHg, PaCO, 40 mmHg y pH 7,41; se mantuvo la insuficiencia respiratoria parcial durante toda la estancia hospitalaria. Los valores al alta fueron: Pa0¡ 78 mmHg, PaCO, 35 mmHg y pH 7,32. La serología de bacterias atípicas era negativa. El ECG y la punción lumbar fueron normales. La TAC craneal confirmaba un infarto occipital antiguo. La radiografía de tórax objetivaba un infiltrado alveolar izquierdo basal, que posteriormente se hizo difuso y bilateral (fig. 1), con posterior predominio derecho y finalmente izquierdo, ocurriendo todo esto en un período de horas-días. A lo largo de toda su estancia hospitalaria el paciente se mantuvo asintomático, salvo por una "ligera" sensación disneica, afebril y estable, tolerando el decúbito. La espirometría realizada indicó un patrón restrictivo de grado moderado severo. El EPAn es poco frecuente, describiéndose en un solo caso de 45 sujetos a los que se les realizó una radiografía de tórax tras una grave crisis epiléptica2. Paradójicamente, se encuentra con frecuencia superior al 80% en las autopsias de los pacientes epilépticos que mueren inexplicablemente 3 . La causa de esta discrepancia es desconocida aunque podría estar en relación con la infrecuente realización de radiografías de tórax tras una crisis epiléptica, con lo que no se diagnosticarían los EPAn subclínicos. El mecanismo y la fisiopatología del EPAn son desconocidos4. El edema puede ser unilateral o bilateral. En nuestro caso, inicialmente las lesiones radiológicas eran unilaterales, convirtiéndose posteriormente en bilaterales. Asimismo, se describen casos de recidiva en un mismo 78 CARTAS AL DIRECTOR Fig. 1. Radiografía de tórax. paciente, argumentándose en este caso la posibilidad de una predisposición individual 5 . Suele presentarse con disnea aguda, tos y, ocasionalmente, hemoptisis. En nuestro caso el paciente presentó tos y discreta disnea. La gravedad es muy variable, aunque usualmente tiene un pronóstico favorable y suele resolverse en horas, con muy escasas manifestaciones clínicas, por lo que puede pasar desapercibido. Sin embargo, también puede ocasionar una muerte súbita inexplicada en un paciente epiléptico6. Nuestro paciente presentó escasas manifestaciones clínicas, que contrastaban con la afectación gasométrica y radiológica. Puede presentarse en dos formas distintas: la más frecuente, como ocurrió en nuestro caso, de una forma precoz, en minutos o escasas horas tras el daño neurológico, o bien, de una forma tardía, una vez pasadas 12 o 72 h. Para el diagnóstico del EPAn es importante, además del antecedente del daño del SNC, que no se encuentre evidencia de aspiración gástrica, infección pulmonar o enfermedad cardíaca o respiratoria previa. En nuestro paciente, la clínica, la exploración física, la afectación gasométrica, la radiografía de tórax y el estudio funcional respiratorio eran concordantes con un edema pulmonar y existía el antecedente de una crisis epiléptica. Asimismo, no había antecedente de aspiración gástrica y la evolución radiológica, con aparición inmediata del infiltrado, los cambios observados en su distribución y la rápida resolución apoyan el diagnóstico de EPAn en contra del de una neumonía por aspiración. Por otra parte, el paciente no tenía antecedentes cardiorrespiratorios y era manifiesta la ausencia de signos de disfunción ventricular izquierda. Respecto al tratamiento, además del manejo de la causa, y muy ocasionalmente la necesidad de ventilación mecánica, la rápida resolución espontánea, en la mayoría de los casos, justifica una actitud conservadora, como fue la nuestra. D. García, A. Pereira y R. Ayerbe Sección de Neumología. Hospital Juan Ramón Jiménez. Huelva. 1. Eric, Pacht, Columbus, Ohio. Postictal pulmonary edema and hemoptysis. Journal of the national association 1988; 80: 337-340. 79 2. Jeffrey C, Darnell. Stephen J. Jay. Recurrente postictal pulmonary edema: a case repon and review of the literature. Epilepsia 1982;23:71-83. 3. Eamest MP, Thomas GE et al. The sudden unexplained death syndrome in epilepsy: Demographic, clinical and postmotem features. Epilepsia 1992; 33: 310-316. 4. Johnston SC, Darranh TM, Simón RP. Postictal pulmonary edema requires pulmonary vascular pressure increases. Epilepsia 1996;37:428-432. 5. Archibaid RB, Armstrong JA. Recurren! postictal pulmonary edema. Posgrad Med 1978:63:210-213. 6. Terrence CF, Rao GR, Perper JA. Neurogenic pulmonary edema in unexpected, unexplained death of epileptic patients. Ann Neurol 1981; 9: 458-464. Broncospasmo y eosinofília en relación con la administración de fosinopril Sr. Director: Los inhibidores de la enzima de conversión de angiotensina (IECA) son derivados peptídicos ampliamente utilizados para el tratamiento de la hipertensión arterial y de la insuficiencia cardíaca o para la reducción de la morbimortalidad tras un infarto de miocardio. Entre las reacciones adversas asociadas a este grupo de fármacos se han descrito diversas manifestaciones pulmonares que, en ocasiones, obligan a retirar el tratamiento, siendo la tos la más frecuente. Otros efectos más raros son el broncospasmo o el desarrollo de un síndrome de infiltrados pulmonares y eosinofilia. El fosinopril es un éster profármaco que pertenece al grupo farmacológico de los IECA. Existen estudios que señalan una menor incidencia de reacciones adversas de este fármaco comparándolo con otros del mismo grupo' o, incluso, la desaparición de la tos con el cambio de otro IECA por fosinopril2. A pesar de su aparente mayor inocuidad, describimos el caso de una paciente que desarrolló un cuadro de broncospasmo y eosinofilia asociados a la toma de fosinopril. Mujer de 68 años, con antecedentes de hipertensión arterial, que acudió a urgencias por un cuadro progresivo de dos semanas de evolución con disnea y sibilantes. No tenía antecedentes de enfermedad pulmonar previa. Trabajaba como ama de casa y negaba hábitos tóxicos o "hobbies". Carecía de antecedentes familiares de asma. Un mes antes de su ingreso había comenzado tratamiento con fosinopril a dosis de 10 mg/día. Previamente controlaba su tensión arterial con diuréticos. La exploración física revelaba cianosis periférica, frecuencia cardíaca 110 lat/min, 32 respiraciones/min, presión arterial 140/90 mmHg y temperatura 36,5 °C. En la auscultación pulmonar destacaban sibilantes bilaterales y espiración alargada. La bioquímica y la coagulación séricas fueron normales. En el hemograma había una eosinofilia periférica del 23% (total 3.800 eosinófilos/mm3), siendo el resto de las series normales. La gasometría arterial basal fue: PaO, 53 mmHg, PaCO, 42 mmHg, pH 7,43 saturación O, 83%, diferencia alveoloarterial de oxígeno 44,5 mmHg. La radiografía de tórax no señaló condensaciones ni otros hallazgos patológicos. El coprocultivo, el estudio de parásitos en heces y la serología hidatídica fueron negativos. El "prick" cutáneo a neumoalergenos fue negativo. La IgE sérica fue 30 U/l. El "RAST" frente a Aspergillus también fue negativo. La TAC torácica de alta resolución no presentó hallazgos patológicos. Durante la hospitalización fue retirado el fosinopril y se inició tratamiento con oxigenoterapia, broncodilatadores y corticoides. El broncospasmo cedió gradualmente, y a los 5 días del ingreso se habían normalizado el hemograma y la gasometría arterial. La paciente fue dada de alta sin reintroducir el fármaco y 2 meses después continuaba asintomática, con estudio funcional respiratorio normal (FEV, 1,61 1 [84%], FVC 1,92 I [101%],FEV,/FVC84%). Las alteraciones pulmonares inducidas por fármacos pueden presentarse como manifestaciones bronquiales (tos, asma, broncospasmo), parenquimatosas (infiltrados pulmonares, alveolitis difusa fibrosante), de la vascularización pulmonar (vasculitis) y de la pleura (pleuritis o fibrosis pleural). La mayoría de las enfermedades pulmonares inducidas por fármacos son reversibles con su retirada, como ocurrió en el caso expuesto, pero en ocasiones pueden ser irreversibles o incluso progresivas. Entre las reacciones adversas pulmonares secundarias a los IECA, la tos es la más habitual, pudiendo aparecer hasta en el 10%3 de los pacientes con los que representa el 75%4 de los casos declarados de tos iatrogénica. Con menor frecuencia aparece el broncospasmo, que puede explicarse por la acumulación pulmonar de bradicinina y sustancia P, que en condiciones normales son degradadas por la ECA5. Estas manifestaciones iatrógenas no tienen relación con la edad, el sexo, la dosis ni los antecedentes respiratorios de los pacientes6. Pueden aparecer al inicio del tratamiento o bien al cabo de meses o incluso años3. Los IECA también se han relacionado con enfermedad parenquimatosa, como el síndrome de infiltrados pulmonares y eosinofilia 7 . La asociación de eosinofilia y manifestaciones clínicas pul573 ARCHIVOS DE BRONCONEUMOLOG1A. VOL. 35, NÚM. 1 1 , 1999 monare.s plantea el diagnóstico diferencial entre las reacciones a fármacos, infecciones parasitarias y vasculitis pulmonares, como causas más frecuentes. Puesto que los IECA se han asociado recientemente a la eosinofília pulmonar, algunos autores piensan que deberían incluirse en el diagnóstico diferencial de los fármacos capaces de inducir una neumonía eosinófila 7 . Como se ha comentado previamente, el fosinopril es un fármaco de la familia de los IECA que presumiblemente presenta menos efectos adversos pulmonares. Sin embargo, describimos la aparición de una eosinofilia, con broncospasmo grave e insuficiencia respiratoria aguda en una paciente sin antecedentes de enfermedad pulmonar, tras un mes de tratamiento con fosinopril. Con la retirada del fármaco y el tratamiento del broncospasmo, el cuadro se resolvió por completo. Destacamos que la paciente no presentó tos per- 574 sistente ni condensaciones pulmonares. Con la comunicación de nuestro caso, pretendemos ampliar el conocimiento de las reacciones adversas debidas a este grupo de fármacos. A.B. Gómez, E. Martínez*, y E. Fernández* *Unidad de Neumología. Servicio de Medicina Interna. Hospital de Sagunto. Valencia 1. Martín LC, Velasco Cornejo IF, Franco RJ. Treatment of mild and modérate hypertension with fosinopril. Comparison of adverse effects with other antihypertensive agents. Arq Bras Cardiol 1994; 62: 369374. 2. Sharif MN, Evans BL, Pylypchuk GB. Cough induced by quinapril with resolution after changing to fosinopril. Ann Pharmacother 1994; 28: 720-722. 3. Overlack A. ACE inhibitor-induced cough and bronchospasm. Incidence, mechanisms and management. Drug Saf 1996; 15: 72-78. 4. Cottin V, Cortier JF. latrogenic drug-induced bronchospasm, cough, and bronchiolitis. Etiologic and physiopathologic aspects. Rev Mal Respir 1996; 13: 339-360. 5. Dicpinigaitis PV, Dobkin JB. Effect of angiotensin-converting enzyme on bronchial responsiveness. J Clin Pharmacol 1996; 36: 361-364. 6. Wood R. Bronchospasm and cough and adverse reactions to the ACE inhibitors captopril, enalapril and lisinopril. A controlled retrospective cohort study. Br J Clin Pharmacol 1995;39:265-270. 7. Benzaquen-Forner H, Doumovo P, Tandjaoui-Lambiotte H, Sullerot A, Mahé C, Bonin A et al. Hypoxic eosinophilic pneumonia in two patients treated with ACE inhibitors. Rev Mal Respir 1998; 15: 804-810. 80 índice de autores Acereda Ridruejo, A.l., 27 Aguar, M.C., 280, 471 Aguilar, X., 245, 248, 250 Agiistí, A.G.N., 33 Alba García Baquero, P., 411 Alberola, A., 324 Alcaide Megías, J., 267 Alfageme Michavila, I., 357, 367 Alfonso Aguirán, E.R., 379 AIkiza, M.E., 488 Almar, E., 223 Altet Gómez, M.N., 267 Alvarez Gutiérrez, F.J., 317 Álvarez Sala, J.L., 312 Alvarez Sala, R., 242, 305, 507,510,513,571 Ancochea, J., 518 Amelo, C., 339 Antó, J.M., 20, 223 Antolín García, M.T., 302 Aran, X., 440 Arenas Gordillo, M., 329, 539 Arenas Linares, C.J., 9 Arnau, A.,324 Arnedillo Muñoz, A., 60 Arriero, J.M., 422, 464 Ai-rondo, J., 461 Asensio Sánchez, S., 301, 411 Ayerbe, R., 572 Baamonde, C., 334 Badorrey, I., I 13, 219 Ballester, R, 20 Baquero,R, 339 Barbé, R, 33 Barreiro, E., 280 Barros Tizón, J.C., 446 Barrot Cortés, E., 513 Barrueco Perrero, M., 187, 499,535 Batista Hernández, J., 79 Bauza, R, 33 Berruete Ivelti, M., 179 Blanco Alonso, R., 248 Blanco García, J.J., 465 Blanco Orozco, A.l., 257 Blasco, E., 297, 483, 512 Bonet Papell, M.G., 248 Borro, J.M., 97, 129,334, 360 Bosch, M., 33 Bou, R., 488 Boyero Uranga, A., 179 Bravo, C., 334 Bretcha, P., 183 Briones Gómez, A., 299, 455 81 Brito Jardim, J.R., 385 Broquetas, J.M., 280, 440, 471 Buitrago, J., 294 Bustamante, A., 446 Cabeza Sánchez, R., 179 Cabriada, V., 189 Cafarena, J.M., 129 Calatrava, A., 564 Calderón, R.,461 Calderón Osuna, E., 317, 539 Calderón Seoane, E., 194 Callol Sánchez, L.. 395 Calvo,V., 129,297,483 Calvo Bonachera, J., 54, 143 Calvo Macías, C., 525 Cal vo Medina, V., 477, 512 Caminero Luna, J.A., 5 Camino, J., 189 Campo, A., 189,529 Cande] Calderón, M.,412 Cantó, A.,324, 512 Cañizares, M.A., 324 Capote Gil, E, 539 Carballal Regidor, J.M., 410 Carmena Bernal, C., 539 Carreño, M.C., 334 Carrera, M., 33 Carretero Gracia, J.A., 27 Carrión Pareja, J.C., 412 Carrión Valero, E, 39, 51, 145,499,550 Casanova Hernández, C., 79 Casanova Macario, C., 79 Casanova Viudez, J., 417 Casas, E, 446 Cases, E., 108,455,463 Castillo, D., 317 Castillo, J., 435 Castillo, P., 317 Castillo Arévalo, E, 15 Castillo Gómez, J., 202, 275, 317,404 Castro, M., 571 Castro Esnal, E., 179 Cejudo,?., 117 Cervelló, M.A., 560 Chiner, E., 422 Cimas, J.E., 15 Ciscar, M.A,, 560 Cobos, N., 339 Collard, P., 143 Coloma Navarro, R., 55 Colomer, E.J., 245 Conesa Bernal, C., 54 Congregado Loscertales, M., 9,51 Cordero, P.J., 108, 196,299 Cordero Guevara, J., 208 Córdoba Doña, J.A,, 60 Corominas, J., 143 Cremades, M.J., 167 Cruz Morón, 1., 357, 367 Cuadra, P., 567 Cuesta, C., 71 Cueto Ladrón Guevara, A., 84, 197 Cueat,E., 179 Dapena Fernández, F.J., 275 Delgado, L., 71 Deu, M., 300 Díaz Cañaveral, L., 513 Díaz Hellín Gude, V., 390 Díaz Lobato, S., 249, 464, 467 Díaz López, J., 51 Díaz Nuevo, G., 299, 465 Diez Pina, J.M., 84, 197 Digon, J., 329 Doménech Ciar, R., 455 Domingo, Ch., 122,428 Domingo, M.L., 233 Domingo Morera, J.A., 51 Doménech, R., 360 Duce, E, 345, 435 Duran Cantolla, J., 100 Duran Tauleria, E., 428 Elias Hernández, M.T, 117, 261,275 Emparanza Knórr, J., 179 Enrique, E., 248 Escudero, C., 446 España, P.P., 446 Esparcía, A., 464 Espinosa, M.J., 518 Estada, J., 334 Fagerstrom, K.O., 229 Félez,M.A.,440,471 Fernández, E., 573 Fernández Berni, J.J., 60 Fernández Fau, L., 1, 152, 159 Fernández Gómez, J.A., 379 Fernández Liesa, J.L, 461 Fernández Vázquez, E., 101 Ferrando, D., 108 Ferrer,A., 122 Ferrer, J., 105 Ferreras Fuente, A.M., 302 Fidalgo, I.,461 Fleming Torrinha, J.A., 71 Elórez Martín, S., 499, 535 Fraj Lázaro, J., 345 Franco, E., 407 Freixinet, J., 140, 144,494 Fuentes, I., 422 Fuentes Pradera, M.A., 407, 513,539 Fullana, J.J., 167,360 Gabriel, R., 152, 159,518 Galán, G., 129,477 Galán González Serna, J.M., 202 Galbis.J.M.,214 Galdiz, J.B., 529 Galera Mendoza, L., 458 García, B., 560 García, D., 572 García, J.E, 312 García Arroyo, I., 208 García Barajas, S., 390 García Bermejo, P.A., 360 García Díaz, E, 9 García García, E., 525 García González, A., 136 García González, L., 48 García López, E, 334 García Pardo, G., 250 García Peiró, 1., 167 García Polo, C., 357, 367 García Río, E, 242 García Santué, J.L., 100 García Zarza, A,, 297, 483 Gea,J., 143,280,440,471 Gilabert, M.J., 167 Gimeno Peribáñez, M.J., 379 Ginel Cañamaque, A., 257 Girón Arjona, J.C., 9 Gómez, A.B., 573 Gómez Domínguez, E, 275 Gómez Pastrana Duran, D., 413 Gómez Stern Aguilar, C., 242 Gómez Terreros Caro, F.J., 242,463 Gómez Terreros Sánchez, F.J., 395, 507 Goncette, L., 143 González, A., 518 González, C., 312 González Lorenzo, E, 249, 464, 571 González Moraleja, J., 312 González Moya, J.E., 194 González Vázquez Prada, I., 15 575 ARCHIVOS DE BRONCONEUMOLOGIA. VOL. 35, N U M . 11, 1999 González Vega, J.M., 499 Gregorio, M.A., 233, 379 Grupo Cooperativo Trasplante, 97 Grupo Español Estudio Europeo Asma, 223 Grupo Trabajo Tratamiento Tabaquismo Área Tabaquismo, 499 Grupo Trasplante Pulmonar Valencia, 129 Guallar Segarra, J., 287 Guerrero, T, 173 Gutiérrez Vicente, M., 365 López Campos Bodineau, J.L.,404,510 López Casanova, C., 194 López Encuentra, A., 301 López Espinosa, E, 267 López Mejías, J., 511 López Milena, G., 458 López Prieto, M.D., 413 Lorente, P., 167 Lores Obradors, L., 219 Lorza, J.J., 535 Loscertales, J., 9, 51 Lozano, C., 129 Luque Sánchez, E, 102 Haro Estarriol, M., 55 Hermida Gutiérrez, J.A., 465 Hernández Borge, J., 48 Hernández Gracia, M.C., 79 Hernández Hazañas, M., 367 Hernández Mezquita, M.A., Madariaga, B., 379 Maestre, J., 334 Magarolas, R., 245, 248 Maiz, L., 339 Maldonado Díaz Losada, J., 535 Hernández Ortiz, C., 179 Herrera, J.M., 64 Herrera, M., 379 Hostalet, E, 324 Hoyuela, C., 183 Hurtado Ayuso, J.E., 194, 329 Hussein, M., 140,494 Iriberri, M., 529 Isaba Senosiain, L., 179 Izquierdo, J., 365, 564 Izquierdo Ayuso, G., 9 Izquierdo Elena, J.M., 179 Izquierdo Patrón, M., 55 Jaén, A., 122 Jardí, R., 446 Jiménez, C.A., 152, 159 Jiménez Castro, D., 299, 465 Jiménez Fuentes, M.A., 471 Jiménez Merchán, R., 9, 51 Jiménez Ruiz, C.A., 39, 229, 415,499,535 Juan, G., 512, 560 Lama, R., 334 Larrú Cabrero, E., 390 Larumbe Sola, Y., 27 Laserna Martínez, E., 404 Lecuona Fernández, M., 79 León Jiménez, A., 60, 100 Light, R.W., 105 Llanes Ruiz, E, 202 Llatjós, M., 113 Lloret, T, 560 Llórela, J., 471 López, M.E., 312 López Añalejo, A., 494 576 267 Manresa, E, 435 MarchAyuela, P., 136 Marco, C., 183 Marco, J., 422 Marín, A., 122,428 Marín, J., 20, 560 Marín Ferrer, M.D., 464 Marín Pardo, J., 145, 550 Marinan Gorospe, M., 417 Marrón Fernández, C., 390 Martín, E., 324 Martín Arroyo Caballero, J.A., 48 Martín Nicolás Serrahima, J.L., 390 Martín Vivaldi Martínez, E, 101 Martínez, C., 564 Martínez, E., 573 Martínez, G.P, 515 Martínez, J., 435 Martínez, M.A., 108, 567 Martínez, M.T., 446 Martínez Casan, P., 477 Martínez García, M.A., 463 Martínez González Río, J., 470 Martínez Gutiérrez, M.A., 27 Martínez Moratalla, J., 223 Martínez Parra, C., 9 Martínez Pérez, E., 413 Martínez Valverde, A., 525 Masa, J.E, 152, 159 Maté, M., 513 Mateu Navarro, M., 183 Maya Martínez, M.R., 51 Mayayo, E., 245 Mayoralas Alises, S., 249 McNeil, K., 64 Medina Benítez, A., 458 Medina Cruz, M.V, 5 Medrano Peña, J., 379 Melchor R., 363 Mena, M.J., 363 Mendieta, J.M., 461 Merelles, T, 20 Miguel Diez, J., 100,465 Milano Manso, G., 525 Minguella, J., 471 MiraFornés,Y.,413 Miravitlles, M., 152, 159, 173, 446 Moggi Zafferani, V, 192 Molina, J.C., 245 Molins, L., 294 Monedero, M., 329 Monsó,E., 113,219 Montalvá, E., 324 Montemayor Rubio, T, 117, 261,275 Montero Martínez, C., 410 Montserrat Canal, J.M., 100 Morales, P., 97, 334, 339, 360 Morales, R., 329 Morant, R, 129, 334 Morcillo, A., 129,297,477 Morell, E, 334 Moreno Balsalobre, R., 1 Moreno Vega, A.L., 103 Morera, J., 113,564 Mosquera, J.A., 308 MouraSá.J.,71 Muñoz Cabrera, L., 510 Muñoz Lucena,E, 357 Muñoz Méndez, J., 367 Murió, C., 173 Nauffal Manzur, D., 299, 413, 567 Nebreda Mayoral, T, 27 Nicoiau Pastrie, E, 192 Oliva Fernández, C., 79 Orcastegui, J.L., 412 Ormaza, I., 122 Oromí, J., 488 Orozco Levi, M., 280, 440 Ortega, B., 571 Ortega, E, 117 Ortega Herrera, R., 458 Ortega Ruiz, E, 261, 275, 407 Ortiz Saracho, J., 103 Ortiz Tardío, J., 413 Oteo Lozano, M., 390 Otero Candelera, R., 194, 261,329,407 Pablo, A., 334 Padilla, J., 297, 483, 512 Palenciano Ballesteros, L., 195,362 Pallas, O., 143 Panadero, A., 461 París, E, 129,477,483 Pascal, I., 189, 529 Pascual Lledó, E, 54, 143 Pascual Torramadé, J., 267 Pastor, J., 297, 483 Pastor Ferrer, Y, 194 Payo Losa, E, 195,223,362 Pellicer,C., 167,360 Peñalver, J., 300 Peñai-rubia, M.T, 571 Pereira, A., 223, 572 Pérez, A., 324 Pérez, D., 385 Pérez Antón, J.A., 390 Pérez Frías, J., 339, 525 Pérez Hoyos, S., 20 Pérez Llano, L.A., 248, 361 Pérez Petit, M., 317 Pérez Rodríguez, E., 299, 465 Pérez Ruiz, E., 525 Perpiñá, M., 108, 167, 199, 435,567 Pifarré.R., 113,564 Pijoan Zibizarreta, J.L, 417 Plaza, V, 372 Prados, C., 242, 507, 510 Prats Bardají, M.S., 248 Pueyo, F.J., 214 Pueyo, J., 214 Quesada Rodríguez, L., 525 Rabaza Espigares, M.J., 458 Rami Porta, R., 179 Ramírez, T., 507, 510 Ramis Bisellach, P, 192 Ramón, J.M., 488 Ramón, M., 512, 560 Ramos, E, 97, 129 Ramos, J., 223 Ramos, P, 357 Ramos Pineda, A., 535 Ramos Pinedo, A., 499 Ramos Seisdedos, G., 103 Redondo, E., 140 Remírez Molina, A., 52 Ribas, A., 308 Ribeiro, S.A., 385 Richart, C., 245 Ríos Martín, J.J., 511 Rivas Andrés, J.J., 300 Rivera, M.L., 20 Rodenstein, D.O., 544 Rodrigo Garzón, M., 301 Rodríguez, E, 518 Rodríguez, M., 513 Rodríguez, P, 140, 144 Rodríguez Becerra, E., 202, 404,510 Rodríguez Castro, E, 140, 253 Rodríguez Nieto, M.J., 363 Rodríguez Pascual, L., 208 Rodríguez Roisin, R., 515 82 ÍNDICE DE AUTORES Rodríguez Suárez, R, 494 Rojas, J.L., 357 Román, A., 334 Romea, S., 488 Romero Plaza, A., 192 Rosado Martín, M., 202 Rosano Romero, A., 60 RoseIl,A., 113,219 Rosillo Fernández, R, 103 Rubiato Aragón, R., 143 Rué.M., 122,428 Ruiz, J., 564 Ruiz,L.A., 189 Ruiz Ávalos, A., 48 Ruiz Borrego, M., 103 Ruiz Manzano, J., 248 Ruiz Pardo, M.L, 499 Ruiz Zafra, J., 84, 102, 197 SáezRoca.G., 101 Sales, G., 97, 129 Salieras Sanmartí, Ll., 267, 488 Saltó, E., 488 Salvatierra, A., 334 Sampablo Lauro, I., 219 Sánchez,H., 117 Sánchez Armengol, A., 539 83 Sánchez Cos Escuín, J., 94 Sánchez Gil, R., 261 Sánchez Gómez, J., 317 Sánchez Navarro, J.M., 257 Sánchez Falencia Ramos, A., 84,102 Sánchez Riera, H., 261, 275 Sánchez Varilla, J.M., 511 Sanchis, E, 108 Sanchis, J., 372 Sanchis, J.L., 108,455,463 Sancho Chinesta, J., 145 Sans Torres, J., 428 Santana,N., 140, 144,494 Santos, R, 334 Sapage,J.M.,71 Sauleda, J., 33, 280, 440 SauretValet,J.,91 Segú.J.L., 173 Serrano, J., 372 Serrano Iglesias, J.A., 100 Serrano Peña, M.S., 463 Sesma, P., 312 Sierra López, A., 79 Signes Costa, J., 422, 464 Sobradillo, V., 57, 152, 159, 417,435,529 Soilán Cerro, J.L., 361 Solano Reina, S., 499, 535 Solé, A., 196, 334 Soriano, J.B., 20 Soto Campos, G., 317 Sunyer, S., 223 Tarrazona Hervás, V., 97, 129, 477 Tenías, J.M., 20 Terán Santos, J., 208 Tierno Sanquirico, C., 27 Togores, B., 33 Toledo González, J., 390 Toral Marín, J., 117 Torné,;.,571 Torre, W., 214 Torres Cansino, M., 257 Torres Luna, A., 79 Vellisco García, A., 317 Veloso, S., 250 Ventura Huañe, I., 179 Vera, R, 196 VereaHernandeo.H.,410 Veres Racamonde, A., 361 Vicente, R., 97, 129 Vidal, G., 294 Vidal, R., 446 Viejo, J.L., 152, 159,435 Villamor León, J., 242, 305, 463,507 Villasante, C., 152, 159,435 Villena.V, 149,411 Wallwork, J., 64 Wells, R, 64 Weynand, B.,143 Winck,J.C.,71 Ussetti, P, 334 Yagüe Zapatero, E., 103 Valencia, A., 435 Vara Cuadrado, R, 147 Várela, A., 334 Vaya, A., 567 Vázquez, C., 339 Vega Gómez, A., 195, 362 Zabala López, S., 52 Zalacain, R., 189 Zuazua Verde, RL, 417 Zugasti García, K., 179 índice de materias Absceso cerebral, 407 - pulmonar, 360 Ácido nítrico, 145 Adenocarcinoma colon, 52 Adenosindesaminasa normal, 250 Amiloidosis primaria, 464 Amplificación genética, 79 Aneurisma aórtico, 511 - arteriosclerótico gigante, 458 Apnea postoperatoria, 412 Archivos Bronconeumología, 287 Asma, 122, 167,248,435,529 - bronquial, 308 - estudio Europeo, 223 - evitación alergénica, 345 - factores pronósticos, 372 Aspergilosis pulmonar, 197 -- invasiva, 513 Azoospermia primaria, 510 Bambuterol, 412 Broncospasmo, 573 - paradójico, 51 Bronquiolitis obliterante, 55 - - neumonía organizada, 301 - - - organizada, enfermedad Crohn, 411 Bronquitis crónica, 122 - - tratamiento, 173 Calidad vida, I 17, 261,428 Cámara pleural residual, 294 Cáncer colorrectal, 183 - pulmón, 512 - - diagnóstico precoz, 395 - - tratamiento, 470 Carcinoma adenoide quístico, 257 - broncogénico, 297, 301, 483 - broncopulmonar, 94 Chronic Respiratory Disease Questionnaire, 428 Ciclofosfamida, 196 Cirugía videotoracoscópica, 477, 494 Clasificación TNM, 94 Conductancia específica (SGaw), 195 Consentimiento informado, 367 Consumo tabaco, 229, 488 Corticoides inhalados, 365 Crisis epiléptica, 572 Criterios clasificación, 248 - diagnósticos, 248 Cuerpos asbesto, 113 Déficit alfa-1 -antitripsina, 446 Densidad capilar, 471 Derivación ventriculoperitoneal, 249 578 Derrame pleural, 249, 464 --diagnóstico, 149 - - metaneumónico, 108 Deshabituación tabáquica, 415 Diagnóstico imagen, 233 Dióxido nitrógeno, 101 Discinesia ciliar primaria, 510 Disnea, 261 Diuréticos, 248 Docencia, 305 Hipercoagulabilidad patológica. 329 Hipoglucemia, 102 Hipoxemia arterial, 515 Edema pulmonar, 101, 194, 513 - - neurogénico, 572 Eficiencia asistencia! neumológica, 202 Embolia pulmonar, 464 Embolismo pulmonar masivo, 413 Enfermedad pulmonar obstructiva crónica, 539 - - - crónica, reingresos, 465 - tromboembólica venosa, 329 Enfisema congénito, 446 Engrosamiento pleural, 108 EPOC, 152 - trasplante pulmonar, 334 - tratamiento, 57, 173 Esclerosis lateral amiotrófica, 48 Estadificación cáncer, 390 Exploración quirúrgica, 390 Leiomiomatosis pulmonar benigna, 564 Liposarcoma mediastínico, 144, 189 Factor V Leiden, 413 Fibrobroncoscopia, 525 Fibrosis pulmonar idiopática, 363, 404, 510 - quística, 275, 339 Fiebre Q, 299 Fisioterapia respiratoria, 275 Fístula arteriovenosa pulmonar familiar, 407 - colopleural, 52 Fosinopril, 573 Fuga aérea persistente, 294 Función diafragmática, 280 Gestión medicina, 544 Granulomatosis Wegener, 100 Hábito tabáquico, 219 Hemoptisis amenazante, 379 - coital, 463 Hemosiderosis pulmonar idiopática, 507 Heridas torácicas, 84 Hidatídosis pulmonar bilateral, 300 Hidroneumotórax secundario, 360 Hidrotórax tardío, 143 IBERPOC, 159 Infecciones respiratorias, 510 Insuficiencia respiratoria aguda. 560 Internet, I Invasión diafragmática, 297 Melanoma maligno. 455 Mesotelioma fibroso, 143 --pleural, 102 Metástasis pulmonares, 183,455 Miastenia grave, 5, 9 Micobacterias ambientales, 5 Mieloma múltiple, 54 Miopatía periférica, 143 Músculo intercostal externo, 471 Músculos periféricos, I 17 — respiratorios, 440 M\cohacteriiim kansusii, 410 Nebulizador nasal nicotina, 535 Neoplasia primaria múltiple pulmonar sincrónica, 245 Neumoconiosis, 103 Neumología, 305, 467 Neumonectomía, 197,512 Neumonía adquirida comunidad, 27 - necrotizante, 511 - varicelosa, 357, 465 Neumonías, 312 - adquiridas, normativas, 253 - - tratamiento, 253 Neumotorax bilateral, 363 - espontáneo idiopático, 179 Nodulos pulmonares solitarios, 214 Obstrucción flujo aéreo, 122 Osteólisis costal, 458 Oxigenoterapia domiciliaria, 33 - líquida, 60 Pacientes asmáticos, 435 Papilomatosis pulmonar, 299 - traqueal, 299 Patrón miliar, 55 Pericardiectomía, 512 84 Í N D I C E DE M A T E R I A S Pickwick, 9 1 , 5 1 1 Pleuritis tuberculosa, 105 Plinio,91,511 Población asmática, 518 Presión positiva, 208 Prótesis endobronquial, 360 Publicidad deshonesta, 187 Quilotórax, 571 Quiste hidatídico, 51 Reducción volumen, 512 Registro Nacional, 446 Remodelado vías aéreas asma, 199 Ritodrina, 513 Seudohemoptisis, 194 Seudoquilotórax tuberculoso, 250 Sevoflurano, 194 85 Síndrome apnea obstructiva sueno, 208, 539 - apneas-hipoapneas durante sueño, tratamiento, 100 - hiperestimulación ovárica, 192 - Kartagener, 242 - vena cava superior. 461 - Young, 361 Suberosis, 71 Succinilcolina, 412 Tabaquismo, 385, 535 - escolar, 317 - pasivo, 39 Técnica inhalación, 15 Test provocación bronquial inespecífíca, 362 - somnolencia Epworth, 422 Timomas, 140, 324 Tomografía emisión positrones, 103 Toracotomía anterior transesternal, 300 Toxicidad pulmonar, 145, 196 - - fármacos, 550 Transfusión perioperatoria, 417 Trasplante bipulmonar secuencia!, 129 - pulmonar, 64 - unipulmonar, 97 Tratamiento directamente observado tuberculosis, 267 - tabaquismo, 499 Trombosis venosa profunda, embolia, 567 Tronco cerebral, 560 Tuberculosis, enfermedad pulmonar, 302 - epidemiología, 136 - pulmonar multirresistente, 413 Tumor células pequeñas pulmón, 103 - neuroectodérmico, 571 Urgencias hospitalarias, 20 VEMS, 195 Videotoracoscopia, 214 579 AB3DVOSDE BMMIMIOGIA Órgano Oficial de la Sociedad Española de Neumología y Cirugía Torácica SEPAR Volumen 35, Suplemento 2, Mayo 1999 Índice de Autores XXXII Congreso Nacional de la Sociedad Española de Neumología y Cirugía Torácica Barcelona, 15-18 de mayo de 1999 Fe de errores Por un error informático, el Índice de Autores de este número se ha reproducido incompleto. Repetimos este Índice en forma de separata para subsanar el error. Igualmente por error figura como sede del Congreso Madrid, cuando la sede del mismo es Barcelona. índice de autores Abad, J., 2, 109 Abad Santamaría, N., 116 Aba], J., 48 Abejón, D., 91,92, 93 Abellán Martínez, M.C., 21 Abilleira, S., 247 Abós.R.. 15 Abreu, J., 48, 70 Acilona, V., 232 Acosta.O., 18, 114 Acosta González, C., 97 Adrián, M.J., 235 Afonso, O., 44, 50 Aguar, M.C., 50, 70 Agüero, R., 49 Aguilar, J., 36 Aguilar, M., 32 Aguilar, X., 12 Aguilera, J.M., 231, 232, 233, 248 Aguirre, I., 90 Aguirre, J.J., 241 Aguirrebengoa, K., 47, 100 Agustí,C.,31,36,46,54,59,65 AgustíG.N.,A., 1 , 3 , 5 , 8 , 2 1 Agustín. B.D., 94 Aicart, M.D., 20 Aizpuru, P., 24 Alamar, J., 4 Alarcón, A., 53, 54 Alba, P., 24 Albarracín, A., 82 Albiach, J.M., 28, 90 Alcaide, J., 44 Alcántara, R., 33 Alcázar, J., 19, 33, 53, 55 Alcázar,?., 19,53,55 Alegre, M., 251 Alemani, M., 246, 253 Alemany, M., 235, 245, 253, 254,255 Alemany Rodríguez, M.J., 115 Alfageme Michavila, 1., 56 Alfonso, E.R., 33, 37 AlgarAlgar,J.,69,76,91,94 Alix, A., 32, 78 Almar, E., 80 Almonacid, C., 59, 60, 82, 83, 88, 89 Alonso, E., 69,114 Alonso, G., 75 Alonso, J., 1, 10, 12 Alonso, M., 18, 19,49,53,244 Alonso, M.A., 67 Alonso, S., 60, 67, 82, 83, 88, 89 Alonso Álvarez, M.L., 24 Alonso Mediavilla, C., 24 AIsina.J., 109 Altet, M.N., 44 Altuzarra Corral, A., 248 Álvarez, A., 48 130 Álvarez, F., 67 Álvarez, L., 95 Álvarez, M., 70, 73, 246 Álvarez, M.R., 32 Álvarez,R., 235 Álvarez Gutiérrez, F.J., 3, 54, 88, 89 Álvarez Kindelán, A., 69, 76, 91, , 94 Álvarez Llaneza, E., 46 Álvarez Sabín, J., 247 Álvarez Sala, R., 40, 104. 105, 110 Alvaro Álvarez, D., 62, 105, 110 Alves, C., 46 Amaro, A., 2 Amilibia, J., 27 Anciones, B., 244 Ancochea, J., 59, 60, 61, 67, 73, 82,83, 104, 106 Andreo,F.,30,41 Andrés, I., 45 Andrés, M.T., 235 Andueza Orduna, J., 53, 55 Aneiros, A., 238, 247, 252 Angrill, J., 46, 54 Amelo, C., 104 Antó, J.M., 3, 5, 80, 96 Antolín García, M.T., 80, 83 Antón, A., 14, 16, 26 Antona.J.M., 18,25 Antuñana, J.M., 83, 84 Aracil.C., 29,41 Aragón, A.,87 Aragoneses, F.G., 75 Aramendia, J.M., 75 Arancibia, F.,6 Aranda, 1., 113 Arbizu,J.,251 Arbizu,T., 232 Arboix, A., 24 Arcaya, J., 250 Arenas Gordillo, M., 81 Arenas Linares, C., 35, 77 Arévalo, M., 16, 80 Ariño, 1., 33 Aristizábal, D., 20, 26 Aristu, J., 75 Arjona,A.,231,248,250 Armengol, M., 34 Armengol, S., 81 Arnal, C., 247 Arnau Obrer, A., 78 Arnedillo, A., 36 Arpa, J., 241,243 Arrabal, R., 70, 73, 79 Arranz, M.L, 94 Arribas, J., 63 Arriero, J.M., 14, 15,22 Arroyo, R., 244 Artalejo, A.L., 30, 78 Arzola, M., 79 Asensio, O., 31 Aspa, J., 43, 45, 55 Astudillo, J., 74 Asunción Escolar, M.A., 109 Atance, J.C., 82, 83 Atxotegi, V., 57 Ausina,V.,47,50,51,98 Aviles, M.J.,32, 81 Avisbal.N., 19,33 Ayarra, J., 36, 77 Ayerbe García, R., 36, 58 Ayllón, E., 61 Aymerich, N., 234 Ayuso, M.C., 36 Ayuso, T., 234,243 Ayuso Peralta, L., 240 Baamonde Laborda, C., 69, 76, 91,94 Badia, J.R., 6, 97, 22, 25 Badia, R., 23 Badorrey,M.I.,29,41,47 Baiges, J., 236 Baldó, X., 9, 29, 40, 74 Balibrea, A.J., 72 Ballabriga, J., 256 Ballester,E.,3,22,23,31, 102 Balsalobre Aznar,., 233 Balust,J., 101 Bango, A., 67 Baranda, F., 57 Barbé, F., 3, 21 Barbeito, L., 55 Barbera, J.A., 1,6,9, 10,59,65, 96, 101,102 Barbeta, J., 23 Barcena, I., 47, 99, 100 Barcenilla, B., 240 Barcia Salorio, J., 249 Bardagi, S., 3 Baré, M.L., 68 Barquero, M.S., 250 Barranco, L.C.. 7, 71 Barreiro, E., 5, 10,65 Barreiros, E., 111 Barrios, I., 104 Barrón, J., 47 Barroso, E., 72, 107, 113 Barrot.E., 15 Barrueco, M., 84, 86, 87, 90 Basart, E., 236 Bastida, M.T., 54 Batista, J.J., 18. 114 Batle, S., 5 Batlle, J., 255 Bauer, T.T., 6, 54, 57 Bechich, S., 24 Belda,J., 16,29,40,74 Belenguer Aparicio, J.L., 66 Bello, M.D., 114 Belloch,A.,59,61,66 Bengoechea, O., 70 Benito, J., 235, 245, 253 Benito, N., 46 Benito León, J., 233, 238, 241, 246,253 Berbel, A., 233, 235, 237, 238. 241,246,252,253,255 Berbel García, A., 254 Berciano, J., 250 Bereciartua, E., 47 Bermejo Pareja, F., 252 Bernabeu,R., 110 Bernal Rosique, M.S., 17 Berrojalbiz, A., 57 Bilbao, T., 45 Blanc, A., 99 Blanca, C.P., 103 Blanca, M., 242 Blanco, J., 48, 85 Blanco, L., 7 Blanco, M., 48, 55, 69, 114 Blanco, M.L., 7 Blanco Aparicio, M., 66, 114 Blanco Orozco, A., 35 Blanquer, J., 43 Blanquer, R., 12,51 Blanquer Olivas. R., 29, 90 Blasco, D., 78 Blasco, M., 43 Blasco, M.L., 16 Blasco Armengod, E., 77 Blesa, E., 106 Blesa, R., 246 Bofill, J.M., 48 Bolarín López, J., 21 Bolívar, I., 3 Bolos, C., 7, 71 Bonet,G.,41,47 Bonfill.X.,41 Borderías, L., 52 Bordes, V., 249 Borro, J.M.,91 Bosch,J.,81 Bosque, M., 31 Botebol Benhamou, G., 2, 21 Botella, J., 23 Boto Bueis, A., 58 Bravo, C., 91,92, 93 Bravo, P., 94 Bravo Bravo, J.L., 32 Bravo Santervás, J.M., 94 Bretón Lesmes, I., 4 Briones, A., 58, 65, 106 Briones, M.. 43 Briones Gómez. A.. 38, 101 Briz, E., 49, 53 ÍNDICE DE AUTORES Broquetas, J., I, 7, 65 Broquetas, J.M., 7, 12, 71 Brotons Brotons, B.. 66 Bruet, M., 92 Brufal,M.,39,71 Brugal, M.T., 44 Buendía, B., 55 Buendía, J., 11 Buendia, M.J., 11 Buendfa, R.M.J., 8 Bueno, M.J.. 96 Bugarin, R., 238 Bugés.J.,54,81 Buitrago, J., 7, 74 Bujalance, J., 19,33,53,55 Bujanda, M., 234 Burgos, F., 65, 96 Burgos, P., 114 Burgués, C., 39,71,98 Busquéis, X., 1,5, 8 Cabadés, F., 78 Caballero, P., 73 Cabanela, D., 57 Cabello, M., 49 Cabezas, C., 238, 239 Cabezas, O., 1 Cabrera, P., 44, 50, 73 Cabrera Navarro, P., 17, 18, 107 Cabriada, V., 8, 27, 47, 52, 102, Cacabelos, P., 238, 239, 245, 247,252 Cacho, J., 250 Cadenas, A., 28, 30 Cadenas Álvarez, A., 42, 106 Calar, N., 98, 99 Calatrava, A., 51 Calderón Osuna, E., 3, 54, 88, 89 Callejas, M.A., 29, 40, 74 Callejo, M.A., 69, 114 Callen, M., 109 Callol, L., 40 Galopa, M., 245 Calpena, M.. 99 Calvo,:., 115 Calvo, J.M.,241 Calvo, V., 41, 91 Calvo Bonachera, J., 17 Calvo Medina, V., 77 Calzada, M.D., 20 Camacho.A.,234,240,251, 253,255 Camarena, J.J., 51 Camargo, R., 33 Caminero, J.A., 44, 50 Camino, J., 111 Campo, A., 8, 10,45,47,84, 102,111 Campo, F., 25, 69, 114 Campos, S., 236 Campos Herrero, M.L, 44, 50 Canalís, E., 9, 29, 40, 74 Cañas, I., 20 Candela, A., 72 Canela, M., 92 Canela Cardona, M., 31 Cañete, C., 62 Cano, S., 22 Cano Gómez, S., 21 Cañón, J., 38 Cantó Armengod, A., 78 Cantón, R., 236 Capelastegui, A., 49, 50 Capitán, A., 98 Capote, F., 22, 23 Capote Gil. F., 2, 21 Carascal, C., 25 Carazo, L., 46 Carballal, J., 49, 57, 69, 114 Carballal Regidor, J.M., 39 Carballo, M.J., 88 Carbó,R.,51 Cardona, P.J., 50 Carmena, C., 22 Carmena, M.A., I , 7 Carmona Bernal, C., 2, 21 Carneado, J., 252 Carpió, V., 101 Carpió Muñoz, V., 81 Carpizo.R., 18, 19 Carrascosa, I., 8, I I I Carreño, C., 94 Carreño, M., 93, 101 Carreño, M.C., 35, 92 Carretero, J.L., 69, 114 Carrillo Arias, F., 14 Carrillo Padilla, F., 243, 255 Carrión, F., 40 Carrión, M., 31 Carrión, M.T., 59 Carrizo, S.J., 12 Carvajal, A.F., 30 Casado, A., 232 Casado, M.E., 13,80, 106 Casal, M., 34 Casáis, C., 95 Casan, P., 96, 98, 99, 109, 1 1 1 Casanova, M.C., 114 Casanova Hernández, C., 18 Casanova Macario, C., 18 Casanova Viudez, J., 83 Casas, I., 47 Cascante, J.A., 46 Cascante Rodrigo, J.A., 94 Cascón, A., 72 Cases, E., 106 Cases Viedma, E., 38 Casimiro, E., 103 Casolivé, V., 15 Cassini.L., 115 Cassini, L.F., 20, 57, 82 Castañar, A., 1 8 , 2 5 , 3 4 , 8 9 Castañón, C., 26 Castaños, M.L., 81 Castedo, E., 69, 76 Castejón, 1., 69 Castelao, J., 60, 67 Castelao Naval, J., 14 Castell, E., 55 Castella,J.,39,71,98 Castellanos, J.M.,237 Castells,E., 19,33,53 Castillo, D., 89 Castillo, J., 1,242 Castillo, M.J., 32 Castillo, P., 88 Castillo Diéguez Adame, P., 89 Castillo Gómez, J., 3, 21, 28, 31, 32,37,38,39,54,61,88,89 Castillo Olivares, J.L., 95 Castillo Otero, D., 3, 54, 88 Castillón, G., 90 Castro, A., 242, 245 Castro, F.J., 72, 84, 90 Castro, J., 77 Catalán, M., 29, 40. 74 Caylá, J.A., 44, 52 Cebrián, J.J., 79, 104 Cebrian García, J.J., 104 Cejudo, P., 1 Celis, R., 54 Celli.B., 12 Celorrio,N., 14, 15,84 Centelles, M., 74 Cerda, R.,56 Ceresuela, L., 62 Cerezo Madueño, F., 69, 76, 91 Cervera.A., 12 Cervera,C.,241 Cervera Juan, A., 29 Chacón, J., 246 Checa, J.M., 34 Chic, S., 84 Chillón, M.J.,35, 40 Chinchón, I., 240 Chiner.E., 14, 15,22 Chiva, L.M., 75 Cienfuegos Agustín, M.L, 13 Cifrián, J.M., 18, 19 Ciruelos, E., 57 Cisneros, C., 59, 88, 89, 106 Clavería, L.E., 238, 239, 256 Clemente, L., 87 Cobiella, J., 69, 76 Codina, A.,241 Codina, E., 98, 99, 111 Codina Jane, C., 53 Colas, C., 63 Coll, P., 39, 54 Coloma Navarro, R., 80 Comet, R., 68 Compte.L., 15,23,56,58,59, 60, 65, 66, 67, 96 Conde, A., 63 Conget,F., 107 Congregado Loscertales, M., 6, 35,77 Contessotto, C., 32 Contreras, M.A., 249 Cordero, P., 25, 43, 44 Cordero, P.J., 81, 106 Cordero Guevara, J., 24 Cordero Rodríguez, P.J., 38 Córdoba, M., 32, 39, 75 Cordovilla, R., 72, 86, 87 Cornudella, R., 37 Corrales, M., 26 Cortada, A., 102 Cortés, C.M., 103 Costán, J., 63 Costell,J.E.,81 Cremades, M.J., 43 Cruz,G., 57 Cruz, J.L., 79 Cruz, M.J., 48, 63, 113 Cruz Martínez, A., 241, 243 Cruz Morón, I., 56 Cuadra, P., 43 Cuadra García, P., 38 Cuadrado, N., 252 Cuaresma, J., 36, 77 Guanero, E., 231, 232, 233, 239, 248 Cubillo, J.M., 11 Cucurull. J., 236 Cuenca. E., 26 Cueto Ladrón Guevara, A., 76 Curull.V.,7,65,71 Czaika.G., 10 Dambrava, P., 12 Danés, C., 46 Dapena, D., 242 Dapena, M.D.,238 Delgado, F., 22 Delgado, G., 234 Delgado, J.M., 28 Delgado, M., 20, 57, 115 Díaz, F., 50, 73, 235 Díaz, G., 30 Díaz, J.,4 Díaz, J.R., 20 Díaz Atauri, M.J., 13,24,80 Díaz Cabanela, D., 49 Díaz Cañaveral, L., 28, 31, 39 Díaz Hellín Gude, V., 78 Díaz Lobato, S., 62, 104 Díaz López, F., 17 Díaz Nuevo, G., 28, 42, 106 Díaz Otero, F., 243 Diego, A.,23, 54, 58, 59, 61, 65, 66, 67, 88, 96 Diego, C., 67 Diego, J., 252 Diego Damiá, A., 60 Diego Fernández, R.M., 98 Diez, F., 57, 82, 115 Diez, I., 52 Diez, L.F., 20 Diez, R., 49 Disdier C., 25, 70 Disdier Vicente, C., 71 Doménech, R., 15 Domingo, CH., 7, 31,56, 68 Domingo, J., 236 Domínguez, J,, 47 Domínguez, J.R., 96 Domínguez, M., 250 Domínguez Reboiras, S., 38 Drakulovic, M.B., 57 Duarte, J., 238, 239, 256 Duce, F., 63 Dueñas, Y., 45,108 Dueñas Pareja, Y., 17 Duran, C., 241 Duran, J,, 24, 27 Echave Sustaeta, J., 13, 24, 80, 106 Echazarreta, A.L., 59, 65 Echebarria, S.G., 242, 249 Egido, J.A., 235 Eguía,M., 15 Eguia,P., 100,99 Elias Hernández, M.T., 61 Encabo Montiño, A., 1 1 1 Escalante, C., 99, 100 Escamilla, F., 240, 244, 247 Escamilla Sevilla, F., 248 Escarrabill, J., 14, 15,84 Escobar, H., 104 Escobar, I., 74 Escobar, J., 115 Escobar, J.A., 28, 88, 90 131 A R C H I V O S DE BRONCONEUMOLOGÍA. VOL. 35, SUPLEMENTO 2, 1999 Escolar Castellón, J.D., 109 Escribano, L., 94 Escudero, C.,46 España, P., 50 Espin, E., 34 Espinal, J.B., 252 Espino, A., 256 Espino, R., 231,250 Espinosa Monteros, M.J., 59, 60, 61,67,73 Estada, J., 35, 93, 94, 101 Esteban, J., 15 Esteve, M., 47 Estirado, C., 17,24,27 Estrada, G., 30 Ewig, S., 9 Faba. O., 246 Fabra, J., 58, 64 Fabra, J.M., 64 Parré, A., 14 Parré, R., 22, 23, 25 Farrero.E., 14, 15,84 Feijoo Carnero, C., 77 Feixas, T., 98, 99 Félez.M., 1,7, 12,65 Fernández, A.. 6, 19, 25, 27, 70, 97 Fernández, A.J., 19 Fernández, C., 16.72,107,235 Fernández, D., 240 Fernández, E., 20 Fernández, F., 2 Fernández, J., 33 Fernández, J.A., 33, 37 Fernández, J.L., 72, 79 Fernández, L., 26 Fernández, M., 247 Fernández, M.D., 247 Fernández, M.F., 244 Fernández, M.J., 26 Fernández, O., 74, 232, 239,242 Fernández, R., 48,70 Fernández, S., 18, 19 Fernández Barreiro, A., 249 Fernández Bedoya, A., 27 Fernández Berni, J.J., 36 Fernández Bolaños, R., 233 Fernández Borque, J., 113 Fernández Crehuet, N., 97 Fernández Fabrellas, E., 29, 40 Fernández Fau, L., 35, 37, 38 Fernández Fernández, M., 248 Fernández Infante, B., 49, 53 Fernández Lorente, F., 241 Fernández Martínez Septiem, C., 24 Fernández Morata, J.C., 64 Fernández Ordóñez, R., 256 Fernández Pérez, M.D., 244, 248 Fernández Pérez, M.L., 114 Fernández Rodríguez, A., 71 Fernández Rozas, S., 49 Fernández Sola, A., 102 Ferrando, D., 43, 44, 81,96 Ferrando, M.C., 49 Ferreiro, M., 93, 101 Ferreiro, M.J., 35, 92, 94 Ferrer, A., 10, 12,48,93, 1 1 1 Ferrer, I., 245, 252 Ferrer, J., 13,40 132 Ferrer, M., 6, 23, 57 Perreras Fuente, A.M., 80, 83 Perrero, M., 52, 238, 239, 256 Ferris, G., 4 Fidalgo, J., 74 Figuerola, A., 236 Figuerola, J.A., 107 Filella, X., 9 Findiey, L., 3 Fiz.J.A.,2,65, 109 Flandes,J.,29,38,41,45 Floriach, C., 235, 245 Floriach.M.,251,253,255 Floriach Robert, M., 246, 253 Fogué, L., 94 Polqué Gómez, E., 75 Fontán, I.. 57 Fontán, L., 39, 49 Pomas, C., 6, 97 Forniés, E., 43, 45, 55, 106 Fort. J.M., 34 Fraga P.. 101,93 Fragoso, M., 252 Framis, D., 44 Francisco, G., 30, 106 Franco, J., 51 Franco Serrano, J., 90 Freixinet. J., 30, 76, 78, 107, 115 Frutos, J., 25, 114 Frutos.J.F., 69 Fuente, S.. 43, 45, 55. 59, 60, 61, 67,73.88,89, 106 Fuentes, F., 18,25.34,89 Fuentes,!., 14, 15,22 Fuentes, M., 58, 64 Fuentes, M.A., 22, 23 Fuentes Pradera, M.A., 21 Gabriel, R., 236, 252 Gahete,C.,241 Galán, J., 233, 248 Galán, L., 234, 238, 240, 245, 246,251,254 Galán Dávila, L., 253 Galán Gil, G., 41 Galarza, A., 52 Galbis, J., 75 Galbis, J.M., 74 Gáldiz, B., 8 Gáldiz.J.B., 10, 1 1 1 Galdós Tangüis, H., 44, 52 Galed, 1., 34 Galí, N., 47 Gallardo Carrasco, J., 14 Gallardo Vigil, M.A., 86 Gallego, B., 12 Gallego, J., 234 Gallego, V., 28, 90, 115 Gamboa, F., 51 Camero, M.A., 232 Gámez.C.,251 Gamez,J.,241 Gámez, P., 35, 69, 76, 93, 95 Gando, J., 94 García, A.,48, 91 García, E., 23, 39 García, F., 46 García, G., 59, 65 García, I., 44 García, J., 83, 108 García, J.J., 29, 41,45 García, J.M., 79, 104 García, M., 73. 98 García, M.D.. 98 García, M.L., 26 García, M.T., 238. 239, 256 García, P., 23 García, R., 52, 107,250 García, T., 240. 244, 247 García Alonso, M., 72 García Aymerich, J.. 5 García Barajas, S., 78 García Bunguer, B., 240 García Cabrera, M., 17, 18, 107 García Casa, O., 66 García Cosío, F.B.. 13 García Díaz, F., 35, 77 García Eróles. L., 24 García Fernández, A., 32 García Foncillas, J., 251 García Fontán, E., 75 García García, J.E., 104 García Jiménez, D., 58 García Jiménez, J.A., 36 García Jiménez, J.M., 104 García López, J., 17 García López, P., 2, 21 García March, G., 249 García Medina, J., 34 García Miguel, M., 98 García Morales. 1.. 234, 237, 238,240,245,251,253,254 García Moreno, J.M., 232, 246 García Olalla, P., 44. 52 García Pérez, J., 20, 82, 83 García Peris, P., 4 García Planells, J., 243 García Puche, M.J., 81 García Quero, C., 110 García Rayo, S., 74 García Río, F., 62, 104, 110 García Salmones. M., 11, 38, 94 García Sánchez, F., 97 García Solis, D., 37 García Talayera, I., 18, 114 García Zarza, A., 77 Garfias, M., 57 Garmendia, A., 109 Garrapiz, J., 52 Garrido, A., 97 Garrido, E., 86, 87 Garrido, M.,7,71 Garrigues, V., 65 Gascón, J.M., 12 Gasía Rocha, R., 109 Gaspar, M.. 99 Gatell, J.M., 46 Gaudó, J., 38, 94 Gaudó Navarro, J., 11 Gavaldá.J.,91,93 Cávela, E., 23 Gavela.J.E., 102 Gea,J.,7, 10, 12,65, 1 1 1 , 1 Gil, D., 30, 42 Gil, E., 236 Gil,J., 113 Gil, L., 60, 67 Gil, M., 96 Gil Fortuno, F., 50 Gil Zarzosa, L.F., 62 Giménez, E., 253 Giménez, I., 81 Gimeno, A., 89 Gimeno, M.J., 33, 37 Gimferrer,J.M.,29,40,74 Giner,J.,96,99, 109 Giró, E., 14 Girón, R., 45, 82, 83, 104, 106 Girón Arjona, J.C., 35 Gisbert, R., 9 Gispert, X., 62 Gispert Nicoiau, F.J., 86 Godoy, R., 8 Golpe, R., 18, 19,49,53 Gómez, A., 45, 57, 72, 84, 102 Gómez, E., 16 Gómez, F., 72, 77 Gómez, F.J., 92 Gómez, G., 30 Gómez, I., 104 Gómez, J.F., 93 Gómez, J.M., 36 Gómez, M., 29, 41,45, 108 Gómez, M.T., 18 Gómez Camello, A., 248 Gómez Carrera, L., 62 Gómez Entrena, M., 36 Gómez Escalonilla, C., 240, 251, 253,254 Gómez Escalonilla, C.L, 253, 254,255 Gómez Izquierdo, L., 32 Gómez Mendieta, M.A., 62, 104, 110 Gómez Nieto, J., 91 Gómez Rosado, J.C., 36, 77 Gómez Santos, D., 116 Gómez Terreros Caro, J., 62, 104 Gómez Terreros, F.J., 35, 40 Goñi, J., 2 González, A., 59,60, 61,67 González, C., 250 González, E., 12, 102 González, F., 50, 62, 105, 110 González, G., 80 González, I., 48 González, I.J., 70 González, J., 2. 9, 29, 46. 54, 74 González, J.A., 249 González, J.L., 235 González, L., 26 González, M., 98, 99 González, M.A., 73 González, M.C.. 4 González, M.G., 16 González, M.T., 84, 90 González, S., 88, 90 González, V., 110 González Buitrago, J.M., 250 González Constan, E., 29 González Delgado, F.J., 243, 255 González Gómez, A., 80 González Mangado, N., 26, 111, 114 González Molina, A., 106 González Ruiz, J.M., 72, 84 González Suso, J.M., 1, 10 Gorordo, I., 49, 50 Gorostiza, A.. 8 Gracia, J.. 48 Granda, J.L, 28, 88, 90. 115 Grande, M.A.. 246 Grassino, A., 10 Graus, F., 244 Grávalos Guzmán, J., 36 ÍNDICE DE AUTORES Gregorio, M.A., 33, 37 Grupo Estudio Carcinoma Broncogénico, 72 Grupo Estudio Carcinoma Broncopulmonar, 71 Grupo Estudio Nedices, 252 Grupo Trabajo Neumomadrid Fibrosis Quística, 105 Grupo Trasplante Pulmonar. 94 Guallar, J., 20 Gíiell.R., 10, 14, 16,97, 111 Guerra, J.M., 24 Guerrero, M., 242 Guerrero, P., 238, 239, 256 Guerrero, R., 242 Guerrero, T., 9 Guillaumet, B., 255 Guillen, D., 90 Guillen, M., 234 Guillermo Rodríguez, M.L., 31 Gullón, J.A., 48, 70 Gutiérrez, M., 67 Gutiérrez, T., 28, 88, 90, 115 Gutiérrez Maire Richard, E., 80, 83 Hamad, I., 48, 92. 102 Haro, J., 64 Haro,M., 16,28,42,56 Haro Estarriol, M., 80 Hayot.M., 10 Henry,B., 105 Hernández, A., 12,47,98 Hernández, C., 6, 48, 97 Hernández, D., 56 Hernández, G., 104 Hernández, J.M., 25 Hernández, L., 22, 3, 23, 25, 107,113 Hernández, M.A., 242 Hernández, M.C., 70 Hernández, N.,10 Hernández Flix, S., 13 Hernández Gracia, M.C., 18 Hernández Martínez, J., 21, 66 Hernández Mezquita, M.A., 86, 87,90 Hernández Rey, I., 86 Hernández Rodríguez, H., 32 Hernández Valle, M., 71 Hernando, F., 72 Herrera, A., 28, 88, 90 Herrera Rosa, A., 115 Herrero, J., 249 Herrero, M.T., 6, 97 Hervás, M., 232, 239 Hidalgo, M., 58 Homs, A., 65 Huerta, M., 236 Huertas Cifredo, M., 36 Hurtado Ayuso, J.E., 101 Hussein, M., 30, 78 Hussein Hussein, M., 115 Iglesias, A., 34 Iglesias, C., 26, 239, 255 Inchaurraga, I., 12 Inchaurraga Álvarez, I., 29 Indakoetxea, B., 247, 252 Infante, J., 250 Iñigo,?., 18,25,34,89 Iriarte, L.M., 233 Iribarren, J.L., 53 Iriberri, M., 8 Irima,P.,251 lrimia,P.,251 Isasia,T., 83 lscar,M.; 13,48 Izquierdo, G., 232 Izquierdo, J., 62, 65 Izquierdo, J.L., 60, 67 Izquierdo Alonso, J.L., 14 Izquierdo Patrón, M., 80, 83 Jaca, C., 45, 47, 84, 102 Jane, R., 2,65 Jansá, J.M., 44, 52 Jara Chinarro, B., 116 Jarauta, F., 243 Jardí, R.,9 Jareño, J., 35, 40 Jato, M., 232 Jaumá, S., 245 Jerez, F.R., 14, 16 Jiménez, A., 18, 19,49,53 Jiménez, C., 86, 89 Jiménez, D., 30 Jiménez, F., 243 Jiménez, F.N., 16 Jiménez, J., 28, 42, 56, 80 Jiménez, J.R., 115 Jiménez, M., 82 Jiménez, M.A., 44 Jiménez, M.D., 231, 232, 233, 239,248 Jiménez, M.F., 75 Jiménez, M.J., 9 Jiménez, N., 56, 80 Jiménez, R., 89, 91,92, 93 Jiménez Castro, D., 28, 42, 106 Jiménez Jiménez, F.J., 240 Jiménez López, J., 80 Jiménez Merchán, R., 6, 35, 77 Jiménez Ortiz, C., 252 Jiménez Ruiz, C.A., 86, 87, 88, 89 Joan, M., 3 Juan, M., 58, 64 Julia Serdá, G., 17, 18,50 Julián Gómez, E., 51 Julve,R., 40 Juretschke Moragues, M.A., 116 Kraemer, C., 96 Lacruz, F., 234 Laiglesia, M., 243 Láinez, J.M., 237 Láinz, J.M., 237 Lama Martínez, R., 91, 94 Lámela, J., 48, 52, 55 Larrauri, B., 27 Larrú Cabrero, E., 78 Laserna Martínez, E., 2, 21, 37 Lasierra, P., 107 Latorre, M., 4 Laynez, F., 20,115 Lázaro, M., 92, 93, 101 Lázaro, M.T., 35 Lázaro, T., 94 Leiva.J., 19,33,53,55 Lema, M., 238, 242, 245 Lema, R., 57 León, A.,36 León.B., 18 León, C., 30, 232 León, M.,23,66,88 León, T., 236 León Atance, P., 75 León Fábregas, M., 60 León Guerrero, M.J., 86 León Medina, D., 75 Lesmes, A., 232 Levy, G., 20,92 Light, R.W., 40 Lillo, A.. 70 Lizán García, M., 80 Lloberes, P., 20, 26 Llórente, J.L., 27 Lloret.T., 103 Lobo, J.L., 17 Lobo.V., 1 5 Lonca, J., 50 López, A., 57, 73, 115 López,C., 114 López, F., 57 López, J., 236 López, J.A., 24 López J.L., 54 López, L., 75, 97 López, M., 96 López, M.J., 239, 247, 255 López,?., 54, 103 López, R., 91 López, S., 19,70,80,97 López Artalejo, A., 115 López Campos Bodineau, J.L., 38, 73 López Castro, P., 74 López Encuentra, A., 13, 80, 84, 106 López Ferrer, A., 7, 71 López Gómez, A.M., 28 López Laso, E., 254 López Munain, A., 247, 252 López Muñoz, J.A., 86 López Péñate, A., 17, 18, 107 López Pujol, F.J.,69, 76, 91 López Sañudo, S., 94 Lores, L., 43, 65, 85 Losada, C., 43, 45, 59. 83, 88, 89,106 Loscertales, J., 6, 35, 77 Lozano, C., 115 Lozano, E., 240 Luburich, P., 36 Lucas, C., 249 Lucas, M., 232 Lucas, P., 15 Lucas Ramos, P., 4 Lujan, M., 7, 31,56 Luna, M.,46 Luque, G., 242 Luque,P., 19,53,55 Luquin,M.R., 251 Luquín, M.R., 245 Luquin Fernández, M., 51 Macián, V., 15.23,56,65,96 Macías, A., 75 Madariaga, B., 33, 37 Madariaga, J.R.. 33 Maestre, J.. 91.92, 93, 240, 244 Maestre, J.A., 92 Maestre Alcacer, J.A., 31 Maestro, M.L., 72 Magarolas, R., 12 Magro, R., 60, 67 Magro Perteguer, R., 62 Mairal, P., 52 Maíz.L., 11,38,94, 104 Majó,J., 113 Maldonado, A., 6 Maldonado, D., 12 Maldonado Pérez, J.A., 36, 58 Mañas Bonet, N., 31 Manaut Gil, E., 254 Mancebo, J., 16 Mancini.M., 16, 102 Mañero, M., 94 Manes, N.,78 Manresa, F., 84 Manterola,J.M.,47,50,51 Marco, A., 243 Marco, J., 15,22 Marco, J.M., 14,22 Marco, M.T., 31 Marcos, P., 48 Marcos, R., 101 Marenco, J.L., 239 Mari, B., 56 Marín, A., 7, 68 Marín, B., 49, 53 Marín, J., 4, 16,43,249 Marín, J.M., 12 Marín, M., 70 Marín González, M., 29 Marín Royo, M., 50 Marinan, M., 10 Marinan Gorospe, M., 83 Mariscal, D., 56 Márquez, F.J., 89 Márquez, F.L., 34 Márquez Várela, F., 6 Marrades, R., 36 Marrades, R.M., 1,5,6, 10,97 Marrón, R., 87 Marrón Fernández, C., 78 Martí, S., 13,26 Martí Massó, J.F., 247 Martín, C., 107 Martín, E., 6, 97, 241 Martín, M., 62 Martín, M.D., 57, 82 Martín, M.J., 19, 25, 27 Martín, P., 25 Martín, R., 8, 11,90 Martín, T., 250 Martín, V., 4 Martín Baranera, M., 86 Martín Escribano, P., 5, 13, 24, 80 Martín Fernández, J.J., 249 Martín García, M., 111 Martín Juan, J., 28, 31,32, 38, 39 Mac Nee, W., 5 Machengs, I., 74 Machín, M.A., 87 Martín Nicolás, J.L., 78, 84 Martín Palanca, A., 33 Martín Vivaldi, L., 17 MartíneVila,E.,251 133 A R C H I V O S DE BRONCONEUMOLOGIA. VOL. 35, SUPLEMENTO 2. 1999 Martínez, A., 237. 245 Martínez. C.. 1 2 . 5 1 , 104, 109, 113, 115 Martínez. E.. 44. 58, 81.88 Martínez. I.. 78 Martínez, J.. 46 Martínez. M.. 60, 99. 100,247 Martínez, M.A.. 15,54,56,67, 96 Martínez, M.T., 104 Martínez, N.,244 Martínez Abad, Y., 8, I I Martínez Albiach, J.M., 1 15 Martínez Arroyo, M., 94 Martínez Berganza, A., 107 Martínez Francés, M.E., 66 Martínez García, M.A., 38. 101 Martínez Gil. A., 252 Martínez González. Moro, I., 110 Martínez Heras, P., 13 Martínez Iposada, A.. 235 Martínez Lage, J.M., 251 Martínez Moragón, E., 40, 59, 66 Martínez Moratalla, J., 16. 80 Martínez Pal I í, G.. 101 Martínez Parra, D., 36 Martínez Puente, V., 6 Martínez Riaza, M.. 16 Martínez Salió. A.. 233, 234, 235,241,253.254 Martínez Vallina. P., 78 Martínez Vila, E., 245, 251 Martínez Zabaleta. M., 252 Martínez Zorzano, V.S., 77 Más, A., 90 Masa,J.F., 19,25,27.70 Masana, L., 13 Masbout, G., 249 Masjuan, J., 232 Matas, L., 47 Matas Andreu, L., 51 Mateo buque, D., 97 Mateos, F., 234 Mayol. J., 2 Mayordomo, C., 48 Mayorga, C., 242 Mayos, M.,14, 109 Medina, A., 114 Medina. M.. 232 Medina, V.. 44, 50, 73 Medina Cruz, M.V.. 107 Medina Cruz, V., 17. 18 Medina Goncalvez, A., 18 Medranda, M.A.,81 Medrano, J., 33, 37 Melchor. G., 17 Melchor. R., 108 Mena,M.J..29,41 Mena Rodríguez, M.J., 17, 26, 108. 1 1 1 Méndez, F., 34 Méndez Martínez. P., 21 Mendiola, A.. 27 Mendoza, A., 238. 239,256 Mendoza, D., 234 Mendoza Grimón, D., 1 15 Menéndez, R., 43, 44, 54,81 Menéndez Villanueva, R., 101 Mesejo, A., 43 Mezquita, P., 63 Migue] Diez, J., 20, 116 Miguélez, C.. 32, 39, 75 134 Milá, C.. 44 Milla, J., 46 Mingo, M.. 72 Mingúela, A., 32 Mínguez. A..247 Mintegui.J.. 109 Mira Fornés. Y.. 101 Miralda. R., 98, 99 Miralles.C., 1 , 5 , 8 Miralles, J.C., 98 Miralles, M.T., 51 Miralles López, J.C., 21 Miravet. L., 78 Miravitlles, M., 9, 45, 48 Miret.C.,54,81 Miró, J.M.,46 Molina, C., 247 Molina. F., 49. 57, 114 Molinos. L., 46 Molins. L., 7, 74 Monferrer, R., 70 Monforte. C., 236 Montbrte, V., 91, 92, 93 Monsó,E.,5,29,41,47 Monsó.R., 12 Montaner, L., 28, 30 Montaner Cáceres, L., 42, 106 Montañés. C., 87 Montemayor, T., 1 Montero, C.. 29, 34, 69, 74, 101, 114 Montero. C.S., 66 Montero. M.C., 39 Montes Suárez, E., 53 Montoliu. M.A.. I 10 Montón, C.. 56, 68 Montori, M., 232 Montserrat, J.M., 3, 6, 22, 23, 24, 25, 97 Monzón, M.J., 237 Monzón, M .J., 237 Mora, F.. 250 Mora, H., 49 Mora Sambricio, A.M., 86 Morales, J.M., 252 Morales, P., 91,92 Morales. R., 101 Moranta, F., 256 Moraza, J., 49, 50 Morcillo Aixelá, A., 41, 77 Morell.F.,9. 13,20,26,48.63, 91,92,93, 113 Moreno. A., 1, 10,46 Moreno, C., 39, 54 Moreno, F., 247, 252 Moreno Balsalobre, R., 35, 37, 38 Moreno Iribas, C., 53, 55 Moreno Mata, N., 75 Moreno Muñoz, R., 50 Moreno Vega, B., 72 Morera, J., 2, 12.29.30.41,47, 51,65. 102, 109 Morillas, C., 12 Morillas. J.. 30 Morillo Velarde, E., 17 Mostacero, E., 236 Mosteiro, M., 34 Mota,S., 10,96, 109, 1 1 1 Muchart, J., 30 Mullol, J., 58, 64 Muñiz Girón, J., 80, 83 Muñoz. A., 3 , 2 1 , 2 6 Muñoz. C., 43 Muñoz. F., 16,28,42 Muñoz. L., 239 Muñoz. M.J., 99, 100 Muñoz. V.,33 Muñoz, X.. 13.26 Muñoz Lucena, F., 56 Muñoz Méndez, J.. 56 Muñoz Torres. M., 63 Munteis, E., 254 Murcia, I., 28, 42 Murió, C., 9 Nadal, C., 236 Nadal, M.J., 60, 67 Nadal Blanco. M.J.. 62 Naranjo Gómez, J.M.. 75 Nauffal.D., 15.56 Nauffal Manzur, D.. 101 Navajas, D., 22. 23, 25 Navalón, R., 82, 83 Navarro, L., 35 Navarro, M., 68 Navarro, R., 103 Navio, P., 38, 94 Navio Martín, P.. 1 1 Neira.M.A., 104 Nerín, I., 90 Nicolás, J.M.. 46, 57 Nieto, B.. 55 Nieto, M.A.. 13.24 Nieto, M.B.. 43. 45 Nieto, M.L., 65 Nieto Barbero. A.. 13 Noé.E.,245,251 Nogué, S., 57 Nogueira, J.M., 51 Noguera, A.,5 Nogués Ramia, E., 115 Nonell, F., 54 Novo, C., 66 Novoa, N., 75,82 Noya, M.,242,247.252 Nualart, L., 13 Núñez.A.,2, 11,28,42,56.80 Núñez López, R., 233 Ojanguren, I., 29. 41 Ojea, M., 239 Ojea, T., 232,239 Olea González. A., 110 Olivera, M.J., 73 Oliveros Cid, A., 251 Ollier, J., 243 Olveira.C., 104 Ornar, F., 247 Ornbuena, J.V., 99 Ontañón, J., 32 Orfao, A., 94 OrozcoLevi, M.. 10. 12 Orriols.R., 13, 113 Ortega, F.. I Ortega, M., 114 Ortega, M.D.. 247 Ortega Cuesta, B., 110 Ortego, N., 63 Orti, A., 236 Ortiz, I., 57 Orts.D.,72, 113 Orusco Palomino, E., 75 Osorio, A., 239, 255 Oteo Lozano, M., 78 Oterino, A., 250 Otero, !„ 34, 39, 66, 69, 114 Otero Candelera, R., 101 Ovejero, L., 13 Pablo, A., 35, 92, 93, 94, 101 Pac Ferrer, J., 83 Pacheco, A., 38, 94 Pacheco Galván, A., I I Padilla, E., 50 Padilla Alarcón, J., 77 Padró, L.L., 247 Páez, F., 79 Pagés, C., 79 Pagés Navarrete, C., 70, 73 Pahissa,A.,91,93 Palacios.;., 10,26,99 Paiau, A., 243 Palau. F., 243 Palenciano, L., 110. 113 Pallissa, E., 92 Palma, M.A., 63 Palomeque, J., I Panadero,A., 74 Paradas, C., 231,233, 248 Paradis, A., 78 Pardellas, H., 238, 245, 247 Pardo, J., 238, 239 Pardo Moreno, J., 244 Pardo Serrano, F., 50 Paredes, C., 25, 69, 114 Paredes, T., 88 Paricio, P., 81 París Romeu, F., 41,77 Parra, O., 24 Parrilla, G., 234, 235, 240, 251, 253,255 Parrilla, J.L., 232 Pascual, G., 72 Pascual, I.. 87 Pascual, L.F.. 236 Pascual, M., 49, 255 Pascual Calvet, J.. 254 Pascual Lledó. F., 17 Pastó, M., 1 , 7 Pastor Guillen. J., 77 Pastrana, M.. 93, 101 Pavón. J., 44, 48 Payo, F., 26 Paz.L., 103 Paz González, M.L., 4 Peces Barba, G., 17.26, 114 Pedraza,S..241 Pedresa, M., 63 Pedroso, P.. 47 Peinado, V.L. 6 Peleteiro, M.. 239. 245. 255 Pellisé. A.. 255 Peña. J.M.. 102 Pena, M.J..44. 50 Peña, N., 15 Peña, T., 88, 90 Peña García, I., 98 Peñafiel, M., 73 Pereira Vega, A., 36, 58 Perelló. M.. 99 Perelló,0.,59,60,61,67,73, 88,89, 106 ÍNDICE DE AUTORES Perendreu, J., 30 Pérez A.M., 18,25,34, 89 Pérez, B., 255 Pérez, D.A., 237 Pérez, E., 63, 104 Pérez, J., 92 Pérez, L., 114 Pérez, M., 64 Pérez, P., 2, 8, I I Pérez, V., 24, 106 Pérez Aguirre, E., 72 Pérez Amor, E., 82 Pérez Antón, J.A., 78 Pérez Blanco, M.T., 113 Pérez Chica, G., 97 Pérez Fragero, R., 83 Pérez Frías, J., 104 Pérez García, I., 1 1 1 Pérez Martínez, D., 234 Pérez Martínez, D.A., 233, 235, 238,240,253,254 Pérez Martínez, DM.D., 234 Pérez Negrín, L.M., 18 Pérez Oteyza, C., 115 Pérez Péñate, G., 17, 18,73 Pérez Rodríguez, E., 28, 30, 42, 106 Pérez Trullén, A., 53, 55, 87, 107 Pérez Vélez.J., 31 Pérez Yarza, E., 109 Pericas,;., 3, 21 Peris Cardells, R., 66 Perpiñá, C., 240 Perpiñá, M., 4, 15, 23, 44, 54, 56,58,59,60,61,65,66,67, 81,88,96,99, 106 Perpiñá Tordera, M., 38, 101 Pérula Torres, L.A., 231 Picado, C., 31, 58, 61, 64 Picerno, D., 31 Pifarré,R.,29,41 Piñeiro, L., 34 Pino García, J.M., 62, 110 Planas, A., 91,92, 93 Plata Pulido, I., 97 Platas, D., 39 Plaza, V., 58, 61, 66, 109 Plaza Valía, P., 90 Polo, J.M., 250 Pomares, E., 245 Pondal, M., 252 Pons, A.R., 5 Ponseti, J.M., 34 Porta Etessam, J., 233, 234, 235, 237,238,240,241,246,253 Portóles, M., 236 Posada, 1., 238 Pou, A.,232 Pou,L.,45,91 Poyato, B., 79 Prados, C., 62, 104, 105 Prat, J., 245 Prats, E., 14, 15,84 Prats, M.S., 30 Prats Gracia, E., 116 Prieto, E., 43, 45, 55 Prieto, J.A., 49 Prieto, J.M., 242 Prieto Vicente, J., 35, 37, 38 Prieto Yaya, E., 28 Puente, L., 2, 8, 11 Puente Muñoz, A.L, 238 Puerto, M.J., 84, 90 Pujols, L., 58, 64 Pujols, M., 64 Pumarola, T., 46 Pun, Y.W., 35, 37,;38 Puyo, M.,69, 114 Puzo,C.,39,71,98 Querol,R.,241 Quesada, M.M., 246 Quintó, LL., 3 Rajas, O., 43, 55, 59, 60, 61, 67, 73,88,89, 106 Ramírez, J., 6 Ramírez, J.M., 232, 241 Ramírez, E., 97 Ramírez, T., 104 Ramírez Prieto, M.T., 62, 110 Ramo, C., 232, 236 Ramón, J.M., 84 Ramos, A., 111, 235, 237, 253, 254 Ramos, F., 91 Ramos, R., 236 Ramos, S., 67 Rano, A.,46, 54, 102 Recober, A., 256 Redondo, M.J., 5 Redondo Euque, E., 76 Regalado, J., 96 Rego.G., 113, 115 Regueiro Mira, F., 78 Reinares, C., 88 Relova, J.L., 255 Renedo.A., 110 Represa, C., 69 Revilla. M., 246 Reyes, E., 93, 113 Reyes, N.,56 Ribas, J., 9, 102 Riesco, J.A., 97 Rimóla, A., 101 Río Borreguero, T., 60, 62, 67 Ríos, A., 96 RÍOS, C., 236 Ríos, M., 81 Ripollés, F., 40 Rivas,F.,29,41 Rivas, J.J., 32, 39, 75 Rivas, J.P., 84, 90 Rivas, P., 86, 87 Rivera, A., 90 Robleda, G., 97 Robles, A., 252 Roca, A., 20,26 Roca,J., 1,6,9, 10, 16,23,36, 59,65,96, 101, 102 Roca, M.J., 78 Roca Ferrer, J., 64 Rochera, M., 93 Roda, J., 69, 76 Rodero, A., 28, 90, 115 Rodés, G., 96 Rodrigo, M.J., 48, 63, 113 Rodríguez, B., 110 Rodríguez, E., 13, 34, 45, 54. 81 Rodríguez, F., 238, 239, 256 Rodríguez, J.R., 2 Rodríguez, M.C., 77 Rodríguez, M.D., 3,21 Rodríguez, M.J., 6, 23, 57 Rodríguez, P., 30, 76, 78 Rodríguez, S., 102 Rodríguez Becerra, E., 37 Rodríguez Campello, A., 254 Rodríguez Castro, F., 44, 73 Rodríguez Frías, F., 9 Rodríguez Fuertes, F., 20 Rodríguez González Moro, J.M., 4 Rodríguez Matute, C., 37, 81 Rodríguez Nieto, M.J., 17, 26, 45J08, 111 Rodríguez Panadero, F., 28, 31, 32,38,39 Rodríguez Pascual, E., 24 Rodríguez Roisin, R., 1, 6, 9, 10, 16,36,59,65,96,97, 101, 102 Rodríguez Sálvanos, F., 43 Rodríguez Sálvanos, J., 45 Rodríguez Suárez, J.R., 5 Rodríguez Suárez, P., 107, 115 Rogado, M.C., 20,57,82 Roger, A.,26 Roig, F., 40 Roig D'Cunha Kamath, V., 66 Rojas Boix, J.E., 56 Rojo Marcos, R., 83 Roldan, J., 40 Roldan, J.P., 77 Roldan, P., 249 Román, A., 91,92, 93 Román, P., 4 Romero, J., 73 Romero, M., 232, 239, 248 Romero, S., 5, 72, 107, 113 Romero Contreras, J.A., 37, 81 Romero Palacios, F.J., 86 Romero Romero, B., 2, 28, 31, 38, 39 Roques Escolar, M., 109 Rosa, M.D., 237 Rosales, M., 19,33,53,55 Rosell.A.,41,47 Rossell, M., 6, 97 Rossi, A., 16 Rotellar, F., 74, 75 Rotger, M., 22, 23 Rovira,A., 241 Rovira, E., 40 Rovira, M., 46 Rovira, R., 247 Royo, J.A., 50, 70 Royo, R., 12 Ruano, M.E.F., 95 Rubinos, G., 48, 70 Rubio, E.. 87, 237 Rubio, M., 19,27,29,40,74 Rubio, M.E., 114 Rubio, P., 37 Rubio, R., 24, 27 Rubio Félix, S., 52 Rué, M., 7 Rueda, C., 19,33,53,55 Ruiz,A.,55, 105 Ruiz.C.,37, 107 Ruiz, G., 238 Ruiz,J..2,41, 102,245 Ruiz, M.A., 54 Ruiz, M.J., 51 Ruiz, T., 25, 69, 114 Ruiz Manzano, J., 30, 50, 51 Ruiz Martínez, J., 247 Ruiz Morales, J., 233, 253, 255 Ruiz Pardo. M.J., 86 Ruiz Zafra, J., 76 Rumbero, J.C., 10 Rumbero Sánchez, J.C., 83 Sabadell,C.,41,51 Sabín,P.,91 Sáez,R.,28, 88,90, 115 Sáez Royuela, A., 70 Sagalés, M.T., 20 Saiz, A., 244 Saiz Díaz, R., 234, 237, 238, 240,246 Saiz Díaz, R., 253 Saiz Díaz, R., 254 Saiz Díaz, R.A., 238 Saiz Díaz, R.A., 254 Sala, E., I , 102 Sala,F., 10 Sala,J., 13 Sala, M., 56 Salama Benoniel, R., 13 Salas, J., 82 Salavert, M., 54 Salazar, J.A., 232, 239 Salcedo, A., 83, 104 Saldaña, D., 94 Salinas, C., 49, 50 Salmones, M.G., 94 Salvatella, D., 2, 65 Salvatierra, A., 69 Salvatierra Velázquez, A., 76, 91,94 Sampablo, I., 43, 85 Sampol.G., 13,20,26 Sánchez, A., 22, 23, 245 Sánchez, A.M., 19,27,70 Sánchez, C., 244 Sánchez, E., 82 Sánchez, F., 79, 239, 248 Sánchez, G., 104 Sánchez, H., 1 Sánchez, 1., 60, 67 Sánchez, J., 30, 73 Sánchez, J.C., 247 Sánchez, E.,4 Sánchez, M.J., 244 Sánchez, R., 16 Sánchez, T., 81 Sánchez Álvarez, J.C., 248 Sánchez Armengol, A., 21 Sánchez Blanco, J.M., 36 Sánchez Caballero, F., 232 Sánchez Caro, M.D., 21 Sánchez Cifuentes, M.V., I 14 Sánchez Cos Escuín, J., 71 Sánchez Cos, J., 70 Sánchez Gascón, F., 21, 32, 98, 110 Sánchez Gil, R., 61 Sánchez Gómez, J., 3, 54, 88, 89 Sánchez Gómez, J.F., 3 Sánchez Guerra, M., 250 Sánchez Hernández, A.M., 71 Sánchez Hernández, I., 14 Sánchez Hernández, I.M., 62 Sánchez Eloret, J., 29, 74 Sánchez Falencia Ramos, A., 76 135 A R C H I V O S DE BRONCONEUMOLOGÍA. VOL. 35. SUPLEMENTO 2, 1999 Sánchez Ramos, J.L., 58 Sánchez Román, J., 32 Sánchez Simón Talero, R., 80 Sánchez Toril López, F., 66 Sánchez Valle, R., 246 Sánchez Yagüe, J., 77 Sanchis, F., 106 Sanchis, J., 16,58,61,96,98, 99, 111 Sanchis, J.L., 106 Sanchis Aldas, J.L., 38 Sancho, J., 16 Sangenís, M., 1 1 1 Sanjuás, C., 65, 71 Sanpablo, 1., 68 Sans Torres, J., 7 Santacruz,A., 8, 11 Santacruz Siminiani, A., 4 Santamarina, J., 59, 67 Santana, N., 30, 78 Santana Rodríguez, N., 107, 115 Santiago, S., 243 Santos,C., 8 Santos, M., 95 Santos, S., 6, 102, 236 Santos Luna, F., 91,94 Sanz, A.,52 Sanz, I., 30 Sanz, M.L., 2, 8, 11 Sanz, P., 2 , 8 , 1 1 Saracibar, N., 252 Sarria, J., 243 Sauleda, J., 1, 5 Sauri, F., 99 Sebastián, A., 63 Secades, J.J., 237 Segú, J.L., 9 Sempere, A.P., 239 Sequeiros, A., 104 Ser, T., 236, 252 Serra, J., 68 Serra, M., 29, 40, 74 Serra Batlles, J., 66 Serrado, A., 62 Serrano, C., 256 Serrano, J., 61 Serrano, S., 62, 71, 101, 104, 105 Serrano Iglesias, J.A., 116 Servera, E., 4, 16 Sesar, A., 252 Sevilla, J.C., 13 Sevillano, D., 238, 239, 256 Signes Costa, J., 14, 15,22 Sigrit/,N.,3,21 Siguero. J.P.L., 104 Silvente, T., 98 Simón Heras, R., 254 Sirera,R., 106 Sobradillo, V., 5, 45, 57, 84 Sobradillo Peña, V., 83 Sobrido, F., 32, 39, 75 Sobrino, J., 235 Sojo, M.A., 19 Sojo González, M.A., 71 136 Sola, J., 2 Solanes.I.,39,71,98 Solano, S., 88, 89 Solans, M., 3 Solé, A., 91 Solé. J., 93 Solé, J., 92 Solé, T., 31 Solé Montserrat. J., 31 Soler, A., 19,53,55 Soler, J.J.,4 Soler, M.J., 72 Soler, N., 9 Soler. R., 243 Soler, X., 30 Sopeña, J.J., 24 Sopeña, N.,47 Soriano, G., 234, 243 Soriano.M.J.,81 Soto Campos, G., 3, 54, 88, 89 Soto Campos, J.G., 3 Souza, M.L., 44, 45, 92 Soy Muner. D., 53 Suárez, F.J., 107 Suárez, J., 2 Suárez Pinilla, F.J., 53 Suárez Sola, M.L., 243, 255 Sueiro, A., 30, 38, 94 Sueiro Bendito, A., 11,28 Sunyer, J., 96 Tábara, J., 52, 55 Tabernero, C., 238, 239, 256 Tabernero, E., 96 Tabernero Hughet, E., 3 Talamantes, F., 249 Tallón Barranco, A., 240 Tamayo, J.A., 232 Tamborero, S., 20 Tarrazona Hervás, V., 41 Tárrega.J., 14, 16, 109 Tatay, E., 2, 8, 1 I Teixidó.A., 13 Teixidor, J., 92 Teixidor Sureda, J., 31 TejeirO., 240 Tejero, C., 236 Tellado, J.M., 4 Téllez, J.C., 69, 76 Temes, E., 48 Tenorio, L., 93 Terán Santos, J., 24 Togores, B., 8 Toledo, M., 233, 234, 235, 238, 251,254 Toledo González, J., 78 Toledo Heras, M., 238, 253 Tomás, L., 17,24,27 Tomás, R., 13 Toral, A., 32 Toral, J., 73 Toral Marín, J., 1 Torella, M., 23 Tornero,A., 28, 42 Torre, M.. 39, 75 Torre, W., 74. 75 Torrecillas, M.D., 231, 232, 233, 248 Torrego, A., 31 Torrego Ballester, A.. 25 Torrejón, M., 99 Torres, A.. 6, 9, 46, 53, 54, 57 Torres, A.J., 72 Torres, J., 32, 39, 79. 104 Torres, M., 54, 81,235 Torres, M.L, 44 Torres, M.J., 49 Toubes, E., 48 Toubes, M.E., 52, 55 Traveria, J., 40 Trigo, G.R., 58 Trujillo, J.L., 114 Trujillo Castilla, J.L.. 18 Tudurí, I., 252 Tura, J.M., 40 Ugarte, J., 69, 76 Urcelay, M.L, 52 Uresandi, F.. 84. 102 Ureta, E., 34 Urra, E., 45 Urrestarazu, E., 251 Urrutia, I., 49, 50 Urtasun, M., 252 Usseti,P.,91 Ussetti, P., 92, 93, 94, 101 Vadillo, F.J., 245, 247 Vadillo, J., 255 Vadillo, M., 43 Val, P., 52 Valencia, A., 5, 79, 104 Valencia, M., 26 Valiño, F., 95 Valiño, P., 69 Valles, J.M., 44, 81 Valles Tarazona, J.M., 38 Valls Solé, J.. 246 Vara, E., 35 Várela, A., 35. 69, 76, 91,93, 95 Várela, G., 70, 75, 82 Várela, M., 47 Várela Seijas, E., 235, 243, 250 Vargas,T., 8, 1 1 Vargas González, R., 28, 31, 38, Velázquez, A., 69 Velicia,M.R.,241 Vellisco García, A., 88, 89 Vendrell, M., 48 Ventosa, E., 88 Verano Rodríguez. A.. 81, 101 Verde,C., 98 Verea, H., 34, 39, 49, 57, 66, 69 Verea Hernando, H., 114 Vergara, P., 16 Vicente, P., 19,33,53,55 Vicente, R., 91 Vicioso Recio. L., 70, 73 Vidal. G., 7. 74 Vidal, R., 9, 45, 92, 102 Viejo, J.L., 5 Vila, J.. 3 Vilá, S., 9, 40 Vila, V., 67 Vilalta, J., 237 Vilamor,J., 105 Vilas, A., 2 Vilches, R.M., 240 Villa Asensi, J.R., 20 Villacampa Aubá, J.M., 110 Villagómez, R., 1 Villagra. A.. 242 Villamor.J., 104, 110 Villanueva, J.A., 234 Villar, F., 34 Villarino, M.A., 40 Villasante, C., 62, 104, 110 Villaie,J.L,52 Villaverde, J.M., 5 Villaverde, R., 249 Villegas, F., 35, 40 Villegas, I., 232 Villena, V.. 80, 106 Viñuela, A., 252 Vivancos, J., 236 Vizcaya, M., 28, 42, 56 Wagner, P.D., 1, 10 Whipp, B., 8 Xaubet,A.,9,31,36,46,58,64, 102 Yagüe Frías, A.. 13 Yélamos.F., 115 39 Vaya Montaña, A., 1 0 1 Vázquez, A.V., 243 Vázquez, N., 7 1 , 9 8 Vázquez, O.,52 Zalacain, R., 45, 47. 99. 100 Zamarrón, C., 2 Zambrana, J.L.. 20, 57, 82, 115 Zamora, E., 55, 82, 83 Vecchi, A.A., 20 Zavala, E., 1 6 Vega, A.,26 Zenner, G.. 232 Zorrilla. V., 17.24,27 Zuil. M., 35 Zurdo. M.. 240 Vega, M.T., 86, 87 Vega, S., 252 Velayos. A., 88, 97 ÍNDICE DE AUTORES Perendreu, J., 30 Pérez A.M., 18,25,34,89 Pérez, B., 255 Pérez, D.A., 237 Pérez, E., 63, 104 Pérez,J., 92 Pérez, L., 114 Pérez, M., 64 Pérez. P., 2, 8, 11 Pérez, V., 24, 106 Pérez Aguirre, E., 72 Pérez Amor, E., 82 Pérez Antón, J.A., 78 Pérez Blanco, M.T., 113 Pérez Chica, G., 97 Pérez Fragero, R., 83 Pérez Frías, J., 104 Pérez García, I., 1 1 1 Pérez Martínez, D., 234 Pérez Martínez, D.A., 233, 235, 238,240,253,254 Pérez Martínez, DM.D., 234 Pérez Negrín, L.M., 18 Pérez Oteyza, C., 115 Pérez Péñate, G., 17, 18,73 Pérez Rodríguez, E., 28, 30, 42, 106 Pérez Trullén, A., 53, 55, 87, 107 Pérez Vélez.J., 31 Pérez Yarxa. E., 109 Pericas, J., 3, 21 Peris Cardells, R., 66 Perpiñá, C., 240 Perpiñá, M., 4, 15.23,44,54. 56,58,59,60,61,65,66,67, 81,88,96,99, 106 Perpiñá Tordera, M., 38. 101 Férula Torres, L.A., 231 Picado, C., 31,58, 61,64 Picerno, D., 31 Pifarré,R.,29,41 Piñeiro, L., 34 Pino García, J.M., 62. 110 Planas, A., 91, 92, 93 Plata Pulido, I., 97 Platas, D., 39 Plaza, V., 58, 61,66. 109 Plaza Valía, P., 90 Polo, J.M., 250 Pomares, E., 245 Pondal, M., 252 Pons, A.R., 5 Ponseti, J.M., 34 Porta Etessam, J., 233, 234, 235, 237, 238, 240,241,246.253 Portóles, M., 236 Posada, I., 238 Pou, A.,232 Pou,L.,45,91 Poyato, B., 79 Prados, C., 62. 104, 105 Prat, J., 245 Prats.E., 14, 15,84 Prats, M.S., 30 Prats Gracia, E., 116 Prieto, E., 43, 45, 55 Prieto, J.A., 49 Prieto, J.M.,242 Prieto Vicente, J., 35, 37, 38 Prieto Yaya, E., 28 Puente, L., 2, 8, 11 Puente Muñoz, A.L, 238 Puerto, M.J., 84, 90 Pujols, L., 58. 64 Pujols, M., 64 Pumarola, T., 46 Pun, Y.W., 35, 37, 38 Puyo, M.,69,114 Puzo.C.,39,71,98 Querol.R.,241 Quesada, M.M., 246 Quintó, LL., 3 Rajas, O., 43, 55, 59, 60, 61. 67. 73,88,89, 106 Ramírez, J., 6 Ramíre/.,J.M.,232,241 Ramírez, L., 97 Ramírez, T., 104 Ramírez Prieto, M.T., 62, 110 Ramo, C., 232, 236 Ramón, J.M., 84 Ramos, A., 1 1 1 , 235, 237, 253, 254 Ramos, F.,91 Ramos, R., 236 Ramos, S., 67 Rano, A., 46, 54, 102 Recober, A., 256 Redondo, M.J., 5 Redondo Luque, E., 76 Regalado, J.. 96 Rego.G., 113, 115 Regueiro Mira, F., 78 Reinares, C.. 88 Relova, J.L., 255 Renedo.A., 110 Represa, C., 69 Revilla, M., 246 Reyes, L., 93,113 Reyes, N.,56 Ribas, J., 9, 102 Riesco, J.A., 97 Rimóla, A., 101 Río Borreguero, T., 60, 62, 67 Ríos, A., 96 RÍOS, C.,236 Ríos, M., 81 Ripollés, F., 40 Rivas, F., 29, 41 Rivas, J.J., 32, 39, 75 Rivas, J.P., 84, 90 Rivas, P., 86, 87 Rivera, A., 90 Robleda, G., 97 Robles, A., 252 Roca, A., 20, 26 Roca.J., 1,6,9, 10, 16,23,36. 59,65,96, 101, 102 Roca, M.J., 78 Roca Ferrer, J., 64 Rochera, M., 93 Roda, J., 69, 76 Rodero, A., 28, 90, 115 Rodés, G., 96 Rodrigo, M.J.,48, 63, 113 Rodríguez, B.. 110 Rodríguez, E., 13, 34, 45, 54, 81 Rodríguez, F., 238, 239, 256 Rodríguez, J.R., 2 Rodríguez, M.C, 77 Rodríguez, M.D.,3,21 Rodríguez, M.J., 6, 23, 57 Rodrigue/.. P., 30, 76, 78 Rodríguez, S., 102 Rodríguez Becerra, E., 37 Rodríguez Campello, A., 254 Rodríguez Castro, F., 44, 73 Rodríguez Frías, F., 9 Rodríguez Fuertes, F., 20 Rodríguez González Moro, J.M., 4 Rodríguez Matute, C., 37, 81 Rodríguez Nieto, M.J., 17, 26, 45,108,111 Rodríguez Panadero, F., 28, 31, 32,38, 39 Rodríguez Pascual, L., 24 Rodríguez Roisin, R., 1, 6, 9, 10, 16,36,59,65,96,97, 101, 102 Rodríguez Sálvanos, P., 43 Rodríguez Sálvanos, J., 45 Rodríguez Suárez, J.R., 5 Rodríguez Suárez, P., 107, 115 Rogado, M.C., 20, 57, 82 Roger, A., 26 Roig, F., 40 Roig D'Cunha Kamath, V., 66 Rojas Boix, J.L., 56 Rojo Marcos, R., 83 Roldan, J., 40 Roldan, J.P., 77 Roldan, P., 249 Román, A., 91, 92, 93 Román, P., 4 Romero, J., 73 Romero, M., 232, 239, 248 Romero, S., 5, 72, 107, 113 Romero Contreras, J.A., 37, 81 Romero Palacios, F.J., 86 Romero Romero, B., 2, 28, 31, 38,39 Roques Escolar, M., 109 Rosa, M.D., 237 Rosales, M., 19,33,53,55 Rosell.A.,41,47 Rossell, M., 6, 97 Rossi,A., 16 Rotellar, F., 74, 75 Rotger, M., 22, 23 Rovira, A., 241 Rovira, E., 40 Rovira, M., 46 Rovira, R., 247 Royo, J.A., 50, 70 Royo, R., 12 Ruano, M.L.F., 95 Rubinos, G.. 48, 70 Rubio, E., 87, 237 Rubio. M., 19,27,29,40,74 Rubio. M.L., 114 Rubio, P., 37 Rubio, R., 24, 27 Rubio Félix, S., 52 Rué, M., 7 Rueda, C., 19,33,53,55 Rui/, A., 55, 105 Ruiz,C.,37. 107 Ruiz, G., 238 Ruiz.J.,2,41, 102,245 Rui/, M.A., 54 Ruiz, M.J., 51 Ruiz, T., 25, 69, 114 Ruiz Manzano, J., 30, 50, 51 Ruiz Martínez. J., 247 Ruiz Morales, J., 233, 253, 255 Ruiz Pardo, M.J., 86 Ruiz Zafra. J., 76 Rumbero. J.C., 10 Rumbero Sánchez, J.C., 83 Sabadell.C.,41.51 Sabín,P.,91 Sáez,R..28. 88,90, 115 Sáez Royuela, A., 70 Sagalés, M.T.. 20 Saiz, A.. 244 Saiz Díaz. R.. 234, 237, 238, 240,246 Saiz Díaz. R., 253 Saiz Díaz, R., 254 Saiz Díaz, R.A., 238 Saiz Díaz. R.A.. 254 Sala, E.. 1. 102 Sala,F.. 10 Sala,J.. 13 Sala, M.. 56 Salama Benoniel, R., 13 Salas,J., 82 Salavert. M.. 54 Salazar, J.A.. 232, 239 Salcedo, A.. 83, 104 Saldaña, D., 94 Salinas, C., 49. 50 Salmones. M.G., 94 Salvatella, D., 2, 65 Salvatierra. A., 69 Salvatierra Velázquez, A., 76, 91,94 Sampablo. I.. 43. 85 Sampol.G., 13.20,26 Sánchez. A.. 22, 23, 245 Sánchez, A.M., 19,27,70 Sánchez, C., 244 Sánchez. E., 82 Sánchez, F.. 79, 239, 248 Sánchez, G., 104 Sánchez, H . , 1 Sánchez. I., 60, 67 Sánchez, J., 30, 73 Sánchez, J.C.,247 Sánchez, L.,4 Sánchez. M.J.. 244 Sánchez. R.. 16 Sánchez, T., 81 Sánchez Álvarez, J.C., 248 Sánchez Armengol, A., 21 Sánchez Blanco, J.M., 36 Sánchez Caballero, F., 232 Sánchez Caro, M.D., 21 Sánchez Cifuentes, M.V., 114 Sánchez. Cos Escuín, J., 71 Sánchez Cos, J., 70 Sánchez Gascón, F., 21, 32, 98, 110 Sánchez Gil, R., 61 Sánchez Gómez, J., 3, 54, 88, 89 Sánchez Gómez, J.F., 3 Sánchez Guerra, M., 250 Sánchez Hernández, A.M., 71 Sánchez Hernández, I., 14 Sánchez Hernández, I.M., 62 Sánchez Lloret, J., 29, 74 Sánchez Falencia Ramos, A., 76 135 A R C H I V O S DE BRONCONEUMOLOGIA. VOL. 3'i, SUPLEMENTO 2. 1999 Sánchez Ramos, J.L., 58 Sánchez. Román, J., 32 Sánchez Simón Talero, R., 80 Sánchez Toril López. F., 66 Sánchez Valle, R.. 246 Sánchez Yagüe, J., 77 Sanchis,F., 106 Sanchis.J., 16.58,61,96,98, 99, 1 1 1 Sanchis, J.L.. 106 Sanchis Aldas, J.L., 38 Sancho, J., 16 Sangenís. M.. 1 1 1 Sanjuás, C., 65. 71 Sanpablo. I.. 68 Sans Torres, J., 7 Santacruz, A., 8, I I Santacru/ Siminiani, A., 4 Santamarina, J.. 59, 67 Santana, N., 30. 78 Santana Rodríguez, N., 107, 115 Santiago, S., 243 Santos, C., 8 Santos, M., 95 Santos, S., 6, 102,236 Santos Luna, F., 91,94 Sanz, A.,52 Sanz, I., 30 Sanz, M.L., 2, 8, I I San/, P., 2, 8, 11 Saracibar, N., 252 Sarria, J., 243 Sauleda.J., 1 , 5 Sauri, F., 99 Sebastián, A., 63 Secades,J.J., 237 Segú, J.L.. 9 Sempere, A.P., 239 Sequeiros, A., 104 Ser, T., 236, 252 Serra, J., 68 Serra, M., 29, 40, 74 Serra Batlles, J.. 66 Serrado, A., 62 Serrano, C., 256 Serrano, J., 61 Serrano, S., 62, 71, 101, 104, 105 Serrano Iglesias, J.A., I 16 Servera, E., 4, 16 Sesar, A., 252 Sevilla, J.C., 13 Sevillano, D., 238, 239, 256 Signes Costa, J., 14, 15, 22 Sigritz,N.,3,21 Siguero,J.P.L., 104 Silvente, T., 98 Simón Heras, R.. 254 Sirera, R., 106 Sobradillo, V., 5, 45, 57, 84 Sobradillo Peña, V., 83 Sobrido, F., 32, 39, 75 Sobrino, J., 235 Sojo.M.A.. 19 Sojo González, M.A.,71 136 Sola, J., 2 Solanes,L.39,71,98 Solano, S., 88, 89 Solans. M., 3 Solé, A., 91 Solé, J., 93 Solé, J., 92 Solé, T., 31 Solé Montserrat, J., 31 Soler, A.. 19,53,55 Soler, J.J.. 4 Soler, M.J., 72 Soler. N., 9 Soler, R.. 243 Soler. X., 30 Sopeña. J.J., 24 Sopeña. N., 47 Soriano, G., 234, 243 Soriano. M.J.. 81 Soto Campos. G., 3. 54, 88, 89 Soto Campos. J.G.. 3 Souza, M.L., 44, 45, 92 Soy Muner, D., 53 Suárez. F.J., 107 Suáre/, J., 2 Suárez Pinilla, F.J., 53 Suárez Sola, M.L., 243, 255 Sueiro, A., 30. 38, 94 Sueiro Bendito. A.. 11, 28 Sunyer, J., 96 Tábara, J.. 52. 55 Tabernero, C., 238, 239, 256 Tabernero,E., 96 Tabernero Hughet, E., 3 Talamantes, F., 249 Tallón Barranco, A., 240 Tamayo, J.A.. 232 Tamborero, S., 20 Tarra/.ona Hervás, V., 41 Tárrega.J.. 14, 16. 109 Tatay. E., 2, 8. 11 Teixidó.A., 13 Teixidor, J., 92 Teixidor Sureda, J.. 31 TejeirO.. 240 Tejero, C., 236 Tellado.J.M.,4 Téllez. J.C., 69. 76 Temes, E.. 48 Tenorio, L., 93 Terán Santos, J., 24 Togores, B., 8 Toledo, M., 233, 234, 235, 238, 251,254 Toledo González, J., 78 Toledo Heras, M., 238, 253 Tomás, L.. 17, 24, 27 Tomás, R., 13 Toral, A., 32 Toral, J., 73 Tora] Marín, J., 1 Torella, M., 23 Tornero. A., 28, 42 Torre, M.. 39. 75 Torre, W.. 74. 75 Torrecillas. M.D.. 231, 232. 233, 248 Torrego, A., 31 Torrego Ballester, A.. 25 Torrejón, M.. 99 Torres, A., 6, 9, 46, 53. 54. 57 Torres, A.J., 72 Torres, J.. 32. 39. 79. 104 Torres. M.. 54. 81.235 Torres, M.L, 44 Torres, M.J.. 49 Toubes, E., 48 Toubes, M.E., 52, 55 Traveria, J.. 40 Trigo, G.R.. 58 Trujillo, J.L., 114 Trujillo Castilla, J.L.. 18 Tudurí. I.. 252 Tura, J.M., 40 Ligarte. J., 69, 76 Urcelay, M.L, 52 Uresandi. F.. 84, 102 Ureta, E.. 34 Urra, E.. 45 Urrestara/u. E.. 251 Urrutia, I..49. 50 Urtasun, M.. 252 Usseti,P.,91 Ussetti, P., 92. 93, 94, 101 Vadillo, F.J., 245. 247 Vadillo. J., 255 Vadillo. M.. 43 Val, P., 52 Valencia. A.. 5. 79. 104 Valencia, M.. 26 Valiño, F., 95 Valiño, P.. 69 Valles, J.M.,44. 81 Valles Tarazona, J.M.. 38 Valls Solé. J., 246 Vara, E., 35 Várela, A.. 35. 69. 76. 91. 93. 95 Várela. G.. 70. 75. 82 Várela. M.. 47 Várela Seijas. E., 235, 243. 250 Vargas, T., 8. 1 1 Vargas González, R., 28, 31. 38, Velázquez, A., 69 Velicia.M.R.,241 Vellisco García. A.. 88. 89 Vendrell, M., 48 Ventosa, E., 88 Verano Rodríguez. A.. 81, 101 Verde,C., 98 Verea, H., 34, 39, 49, 57, 66. 69 Verea Hernando, H., 114 Vergara, P., 16 Vicente, P., 19, 33, 53. 55 Vicente, R., 91 Vicioso Recio, L.. 70, 73 Vidal, G., 7, 74 Vidal, R., 9, 45, 92, 102 Viejo, J.L., 5 Vila, J., 3 Vila, S., 9, 40 Vila, V., 67 Vilalta, J., 237 Vilamor.J., 105 Vilas, A., 2 Vilches, R.M., 240 Villa Asensi.J.R., 20 Villacampa Aubá, J.M., 110 Villagómez, R., I Villagra, A., 242 Villamor.J., 104, 110 Villanueva.J.A.,234 Villar, F., 34 Villarino, M.A., 40 Villasante, C., 62, 104, 110 Villate.J.I.,52 Villaverde, J.M., 5 Villaverde, R., 249 Villegas, F., 35, 40 Villegas, L, 232 Villena, V., 80, 106 Viñuela. A., 252 Vivancos, J., 236 Vizcaya, M., 28, 42, 56 Wagner,P.D., I, 10 Whipp, B., 8 Xaubet, A., 9.31, 36, 46, 58, 64, 102 Yagüe Frías, A., 13 Yélamos.F., 115 39 Vaya Montaña, A., 101 Vázquez, A.V.. 243 Vázquez, N., 71,98 Vázquez, O., 52 Vecchi, A.A.. 20 Vega, A., 26 Vega, M.T.. 86. 87 Vega,S., 252 Velayos. A., 88, 97 Zalacain, R., 45, 47, 99, 100 Zamarrón, C., 2 Zambrana, J.L., 20, 57, 82, 115 Zamora, E., 55. 82. 83 Zavala, E., 16 Zenner. G., 232 Zorrilla, V., 17.24,27 Zuil.M.,35 Zurdo, M., 240