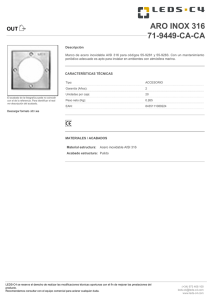
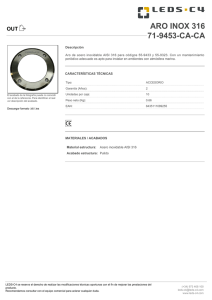
universidad central del ecuador facultad de ingeniería química
Anuncio

UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE INGENIERÍA QUÍMICA CARRERA DE INGENIERÍA QUÍMICA EVALUACIÓN DE SULFATO DE AMONIO COMO AGENTE SULFINIZANTE EN ACEROS AISI 4130 Y AISI 4340. TRABAJO DE TITULACIÓN, MODALIDAD PROYECTO DE INVESTIGACIÓN PARA LA OBTENCIÓN DEL TITULO DE INGENIERA QUÍMICA AUTOR: SHILIAN ESTEFANI INCLÁN LUNA TUTOR: ING. MARCO VINICIO ROSERO ESPÍN QUITO 2016 APROBACIÓN DEL TUTOR Yo, Marco Vinicio Rosero Espín en calidad de tutor del trabajo de titulación, modalidad proyecto de investigación “EVALUACIÓN DE SULFATO DE AMONIO COMO AGENTE SULFINIZANTE EN ACEROS AISI 4130 Y AISI 4340”, elaborado por el estudiante Shilian Estefani Inclán Luna de la Carrera de Ingeniería Química Facultad de Ingeniería Química de la Universidad Central del Ecuador, considero que el mismo reúne los requisitos y méritos necesarios en el ámbito metodológico y el campo epistemológico, para ser sometido a la evaluación por parte del jurado examinador que se designe, por lo que lo APRUEBO, a fin de que el trabajo investigativo sea habilitado para continuar con el proceso de titulación determinado por la Universidad Central del Ecuador. En la ciudad de Quito, a los ocho días del mes de Abril del 2016. Firma del Tutor. Marco Vinicio Rosero Espín CC: 0801997545 i ©DERECHOS DE AUTOR Yo, SHILIAN ESTEFANI INCLÁN LUNA, en calidad de autor del trabajo de titulación, modalidad proyecto de investigación: EVALUACIÓN DE SULFATO DE AMONIO COMO AGENTE SULFINIZANTE EN ACEROS AISI 4130 Y AISI 4340, autorizo a la UNIVERSIDAD CENTRAL DEL ECUADOR, hacer uso de todos los contenidos que me pertenecen o de parte de los que contiene esta obra, con fines estrictamente académicos o de investigación. Los derechos que como autor me corresponden, con excepción de la presente autorización, seguirán vigentes a mi favor, de conformidad con lo establecido en los artículos 5, 6, 8, 19 y demás pertinentes de la Ley de Propiedad Intelectual y su Reglamento. Asimismo autorizó a la Universidad Central del Ecuador para que realice la digitalición y publicación de este trabajo de investigación en el repositorio virtual, de conformidad a lo dispuesto en el Art, 144 de la Ley Orgánica de Educación Superior. Quito, 02 de Mayo de 2016. _________________________ Shilian Estefani Inclán Luna CC: 172285065-6 [email protected] ii AGRADECIMIENTOS El autor expresa sus agradecimientos a: Marco Rosero, Ingeniero Químico y profesor de la Facultad de Ingeniería Química por su valiosa orientación. Diego Flores, Ingeniero Químico y profesor de la Facultad de Ingeniería Química, por su apoyo en la realización del presente trabajo. A la Universidad Central del Ecuador, la Facultad de Ingeniería Química y al Laboratorio de Catálisis. iii CONTENIDO Pág. LISTA DE TABLAS ...................................................................................................... vii LISTA DE FIGURAS ..................................................................................................... ix LISTA DE ANEXOS ....................................................................................................... x LISTA DE ABREVIATURAS Y SÍMBOLOS .............................................................. xi RESUMEN .................................................................................................................... xiii ABSTRACT .................................................................................................................. xiv INTRODUCCIÓN ............................................................................................................ 1 1. MARCO TEÓRICO .................................................................................................. 3 1.1. Tratamientos de los metales ..................................................................................... 3 1.1.1. Tratamientos Térmicos. ......................................................................................... 3 1.1.2. Tratamientos Termoquímicos. ............................................................................... 3 1.1.3. Tratamientos Superficiales. ................................................................................... 3 1.2. Acero ........................................................................................................................ 4 1.2.1. Estados alotrópicos del hierro. .............................................................................. 4 1.2.2. Estados del acero. .................................................................................................. 5 1.3. Aceros para sulfinización ......................................................................................... 5 1.3.1. Acero AISI 4340. .................................................................................................... 5 1.3.2. Acero AISI 4130. .................................................................................................... 6 1.4. Sulfinización. ............................................................................................................ 6 1.4.1. Diagrama de fases hierro-azufre. ........................................................................... 8 1.4.2 Ventajas de los aceros sulfinizados. ....................................................................... 9 iv 1.5. Dureza...................................................................................................................... 10 1.6. Velocidad de Corrosión ........................................................................................... 10 2. METODOLOGÍA EXPERIMENTAL ...................................................................... 11 2.1. Materiales y equipos. .............................................................................................. 11 2.2. Sustancias y reactivos. ............................................................................................ 11 2.3. Diseño experimental. .............................................................................................. 12 2.3.1. Codificación. ....................................................................................................... 12 2.3.2. Diagrama de Flujo. .............................................................................................. 13 2.4. Procedimiento. ........................................................................................................ 14 2.4.1. Preparación superficial. ....................................................................................... 14 2.4.2. Sulfinización de aceros A y C. ............................................................................ 14 2.4.3. Verificación de la composición del recubrimiento .............................................. 15 2.4.4. Verificación de la presencia de azufre en el recubrimiento................................. 15 2.4.5. Cuantificación de consumo de azufre. ................................................................. 16 2.4.6. Cuantificación de consumo de nitrógeno. ........................................................... 17 2.4.7. Ensayo de dureza superficial. .............................................................................. 19 2.4.8. Ensayo de corrosión. ........................................................................................... 20 2.4.9. Medición del espesor de la capa obtenida por sulfinización. .............................. 20 2.5. Datos Experimentales ............................................................................................. 21 2.5.1. Temperatura del proceso. .................................................................................... 21 2.5.2. Medición de sulfatos............................................................................................. 21 2.5.3. Medición de amonio. ............................................................................................ 23 2.5.4. Áreas de corrosión. ............................................................................................... 24 3. CÁLCULOS Y RESULTADOS ................................................................................ 25 3.1. Cuantificación de sulfatos. ..................................................................................... 25 3.1.1. Obtención de la ecuación de la curva de calibración de sulfatos. ....................... 25 v 3.1.2. Obtención de la concentración de azufre en las muestras. .................................. 26 3.2. Cuantificación de amonio. ...................................................................................... 27 3.2.1. Obtención de la ecuación de la curva de calibración de amonio. ........................ 27 3.2.2. Obtención de la concentración de nitrógeno en las muestras de baño ................ 28 3.2.3. Obtención de la velocidad de reacción referente al nitrógeno. ............................ 29 3.3. Cálculo de la velocidad de corrosión. ..................................................................... 30 3.4. Disminución de la velocidad de corrosión. ............................................................ 31 3.5. Análisis estadístico. ................................................................................................ 31 3.6. Resultados............................................................................................................... 32 3.6.1. Resultados de evaluación de composición del recubrimiento por FTIR.....……..32 3.6.2. Resultados de evaluación de composición del recubrimiento por XRF .............. 33 3.6.3. Resultados obtenidos para la cinética de reacción de consumo de nitrógeno. .... 34 3.6.4. Resultados obtenidos para la cinética de reacción de consumo de azufre........... 36 3.6.5. Valores de dureza obtenidos para los aceros AISI 4130 y 4340. ........................ 39 3.6.6. Velocidad de corrosión de aceros tratados (A y C) y sin tratamiento (B y D). ... 39 3.6.7. Espesores de las capas obtenidas sulfinización ................................................... 40 3.6.8. Resumen de variables. .......................................................................................... 40 3.6.9. Análisis estadístico. ............................................................................................. 41 4. DISCUSIÓN .............................................................................................................. 43 5. CONCLUSIONES ..................................................................................................... 45 6. RECOMENDACIONES ........................................................................................... 48 7. CITAS BIBLIOGRÁFICAS ...................................................................................... 49 BIBLIOGRAFÍA ............................................................................................................ 50 ANEXOS ........................................................................................................................ 51 vi LISTA DE TABLAS Pág. Tabla 1. Nomenclatura de aleantes para los aceros AISI. ................................................ 4 Tabla 2. Composición química del acero AISI 4340........................................................ 5 Tabla 3. Composición química del acero AISI 4130........................................................ 6 Tabla 4. Codificación para acero AISI 4130 .................................................................. 12 Tabla 5. Codificación para acero AISI 4340 .................................................................. 12 Tabla 6. Construcción de la curva de calibración para sulfatos. .................................... 17 Tabla 7. Construcción de la curva de calibración para amonio. ..................................... 18 Tabla 8. Temperatura de sulfinización registrada para el acero AISI 4130. .................. 21 Tabla 9. Temperatura de sulfinización registrada para el acero AISI 4340. .................. 21 Tabla 10. Valores de absorbancia para calibración de sulfatos. ..................................... 22 Tabla 11. Valores de absorbancia de sulfatos del baño de acero AISI 4130. ................. 22 Tabla 12. Valores de absorbancia de sulfatos del baño de acero AISI 4340. ................. 22 Tabla 13. Valores de absorbancia para calibración de amonio. ..................................... 23 Tabla 14. Valores de absorbancia de amonio del baño de acero AISI 4130. ................. 23 Tabla 15. Valores de absorbancia de amonio del baño de acero AISI 4340. ................. 24 Tabla 16. Valores de área corroída obtenidos para el acero AISI 4130. ........................ 24 Tabla 17. Valores de área corroída obtenidos para el acero AISI 4340. ........................ 24 Tabla 18. Concentración de nitrógeno en función del tiempo para A1-1 ...................... 29 Tabla 19. Áreas corroídas de la muestra A1 ................................................................... 30 Tabla 20. Composición elemental del acero AISI 4130 ................................................. 33 Tabla 21. Composición elemental del acero AISI 4340 ................................................. 34 Tabla 22. Concentración de nitrógeno en el baño del acero AISI 4130. ........................ 35 Tabla 23. Concentración de nitrógeno el baño del acero AISI 4340. ............................. 35 Tabla 24. Velocidad de reacción obtenida para consumo de nitrógeno. ........................ 36 Tabla 25. Concentración de azufre en el baño del acero AISI 4130. ............................. 37 vii Tabla 26. Concentración de azufre en el baño del acero AISI 4340. ............................. 37 Tabla 27. Valores mínimos de azufre alcanzados en el baño de sulfinización. ............. 38 Tabla 28. Valores de dureza de aceros tratados (A y C) y sin tratamiento (B y D). ...... 39 Tabla 29. Velocidad de corrosión de los aceros A, B, C, D. .......................................... 40 Tabla 30. Espesores de las capas de sulfuros obtenidas. ................................................ 40 Tabla 31. Resumen de resultados. .................................................................................. 41 Tabla 32. Análisis estadístico de la velocidad de reacción respecto al nitrógeno. ......... 41 Tabla 33. Análisis estadístico de datos de dureza del acero AISI 4130. ........................ 41 Tabla 34. Análisis estadístico de datos de dureza del acero AISI 4340. ........................ 42 Tabla 35. Análisis estadístico de la velocidad de corrosión del acero AISI 4130. ......... 42 Tabla 36. Análisis estadístico de la velocidad de corrosión del acero AISI 4340. ......... 42 viii LISTA DE FIGURAS Pág. Figura 1. Configuración indicativa de una capa de acero sulfinizada ............................. 7 Figura 2. Microfotografía (× 200) de la estructura de la sección transversal .................. 7 Figura 3. Diagrama de fases Fe-S ..................................................................................... 8 Figura 4. Diagrama de flujo de la metodología experimental. ....................................... 13 Figura 5. Curva de calibración para medición de sulfatos. ............................................ 25 Figura 6. Curva de calibración para medición de amonio. ............................................. 27 Figura 7. Velocidad de reacción de A1-1 ....................................................................... 29 Figura 8. Velocidad de corrosión-área de A1 ................................................................. 30 Figura 9. Ensayo de FTIR para AISI 4130 .................................................................... 32 Figura 10. Ensayo de FTIR para AISI 4340 .................................................................. 33 Figura 11. Comparación de la concentración de azufre en las muestras ........................ 34 Figura 12. Cinética de consumo de nitrógeno para el acero AISI 4130. ........................ 35 Figura 13. Cinética de consumo de nitrógeno para el acero AISI 4340. ........................ 36 Figura 14. Cinética de consumo de azufre para el acero AISI 4130. ............................. 37 Figura 15. Cinética de consumo de azufre para el acero AISI 4340. ............................. 38 Figura 16. Comparación de dureza obtenida por los aceros . ......................................... 39 ix LISTA DE ANEXOS Pág. ANEXO A. Análisis de difracción de rayos X de muestra patrón. ................................ 52 ANEXO B. Proceso de sulfinización ............................................................................. 53 ANEXO C. Ensayos de composición ............................................................................. 54 ANEXO D. Análisis de cinética de reacción. ................................................................. 55 ANEXO E. Evaluación de propiedades del recubrimiento ............................................ 56 ANEXO F. Ensayo de Microscopia. .............................................................................. 58 x LISTA DE ABREVIATURAS Y SÍMBOLOS HB Dureza Brinell FTIR Espectroscopia Infrarroja con Transformadas de Fourier XRF Fluorescencia de rayos X ABS Absorbancia a 420 nm. CSO−2 4 Concentración de sulfato en mg/L CS Concentración de azufre en la muestra, mg/g fd Factor de dilución de muestra para medición de sulfatos PMs Peso molecular del azufre, g/m-mol. PMSO−2 4 Peso molecular del sulfato, mg/m-mol. gm Peso de la muestra, g CNH+4 Concentración de amonio en mg/L ABS´ Absorbancia a 425 nm. CN Concentración de nitrógeno en la muestra, mg/g fd´ Factor de dilución de muestra para medición de amonio. PMN Peso molecular del nitrógeno, mg/m-mol. PMNH+4 Peso molecular del amonio, mg/m-mol. gm Peso de la muestra, g. t Tiempo, min υr Velocidad de reacción. m Pendiente de la recta CN= f(t) Ac Área corroída, mm2 Vc Velocidad de corrosión referente al área, mm2/min VCT Velocidad de corrosión del material tratado, mm2/año %DV Porcentaje de disminución de la velocidad de corrosión. HV Dureza Vickers xi HR30N Dureza superficial Rockwell carga de 30 kgf- penetrador cónico Fs Estadístico para la distribución F sa2 Varianza para la variable a sb2 Varianza para la variable b Ha Hipótesis alternativa S Significación del análisis de varianza. H0 Hipótesis nula xii EVALUACIÓN DE SULFATO DE AMONIO COMO AGENTE SULFINIZANTE EN ACEROS AISI 4130 Y AISI 4340 RESUMEN Evaluación del sulfato de amonio como un agente sulfinizante alternativo en aceros AISI 4130 y AISI 4340. Tres probetas de los aceros se sumergieron por 100 minutos en baños de sal fundida, en presencia de calentamiento, hasta alcanzar una temperatura de 570 ± 7 °C. Las piezas enfriadas y lavadas son analizadas químicamente mediante Espectroscopia Infrarroja, Fluorescencia y Difracción de Rayos X, para verificar el proceso de sulfinización, mediante la identificación de azufre. Se determinó la cinética de la reacción química, mediante la cuantificación por Espectrofotometría del azufre y nitrógeno consumidos. Se evaluaron las propiedades de las muestras sulfinizadas: Resistencia a la corrosión y dureza superficial; con relación a las muestras testigo. Se concluye que el sulfato de amonio es un buen proveedor de azufre para los dos aceros, que mejora significativamente las propiedades anticorrosivas del material disminuyendo la velocidad de corrosión referida al área aproximadamente en un 75% y que incrementa la dureza de los mismos en un 3 %. PALABRAS CLAVES: /SULFINIZACIÓN/ SULFATO DE AMONIO/ ACEROS/ AISI 4130/ AISI 4340 / DUREZA/ CORROSIÓN/. xiii EVALUATION OF AMMONIUM SULFATE AS A SULFURIZING AGENT IN AISI 4130 AND AISI 4340 STEELS ABSTRACT Ammonium sulfate was evaluated as an alternative sulfurizing agent in AISI 4130 and AISI 4340 steels. The three samples of each steel was immerse for 100 minutes in molten salt baths, on heat presence, until a temperature of 570 ± 7°C was reached. The cooled down and cleaned pieces were chemically analyzed through Infrared Spectroscopy, Fluorescence and X Rays Diffraction, to verify the process of sulfurization, through the identification of sulfur. It was determinate the chemical reaction kinetics through the quantification of the consumed sulfur and nitrogen Spectrophotometric. The properties of the sulfurizing samples were evaluated: Corrosion resistance and superficial hardness; with the reference of the witness sample. In conclusion the ammonium sulfate is a good sulfur provider for both steels, it significantly improves the anticorrosive properties of the material by decreasing the corrosion speed in approximately 75% and by increasing the hardness by 3% KEYWORDS: /SULFURIZING/ AMMONIUM SULFATE/ STEEL/ AISI 4130/ AISI 4340/ HARDNESS/ CORROSION. xiv INTRODUCCIÓN La Corrosión es la causa general de la destrucción de la mayor parte de los materiales naturales o fabricados por el hombre. Si bien esta fuerza destructiva ha existido siempre, no se le ha prestado atención hasta los tiempos modernos, con el avance de la tecnología. El desarrollo de la industria y el uso de combustibles, en especial el petróleo, han cambiado la composición de la atmósfera de los centros industriales y grandes conglomerados urbanos, tornándola más corrosiva. La producción de acero y las mejoras de sus propiedades mecánicas han hecho de él un material muy útil, junto con estas mejoras, se está pagando un tributo muy grande a la corrosión, ya que el 25% de la producción mundial anual del acero es destruida por la corrosión. [1] En la actualidad se busca distintas maneras de mejorar el rendimiento de equipos utilizados en la exploración de pozos petrolíferos, piezas automovilísticas y demás, aumentando su vida útil y mejorando su desempeño mecánico, con el objetivo de satisfacer necesidades de seguridad, desempeño y equilibrando la variable económica se han desarrollado métodos a través de los cuales se mejoran las propiedades de los aceros a través de tratamientos mecánicos, termoquímicos y superficiales, los cuales mejoran la dureza superficial de los aceros, resistencia a la fatiga y a la corrosión. Entre los tratamientos termoquímicos conocidos y aplicados actualmente se encuentra la cementación, nitruración, sulfinización y cianuración, los cuales se diferencian por el elemento que incorporan en la matriz del acero, y las propiedades que estos nuevos compuestos proveen al material; en el caso de la sulfinización se incorpora principalmente azufre en la superficie del acero y nitrógeno como elemento secundario mediante la exposición del mismo a una mezcla de dos sales proveedoras de los elementos mencionados, cianuro de sodio y potasio como proveedor de nitrógeno y sulfato de sodio como proveedor de azufre, existen formas alternativas de incorporar azufre y nitrógeno en la superficie del acero, mediante corrientes gaseosas de azufre, descomposición de amoniaco y nitrógeno molecular, estos métodos mencionados 1 requieren de inversiones económicas elevadas, por lo que algunas industrias optan por trabajar con una sulfinización en baño de sales que es más económica pero a su vez menos amigable con el medio ambiente ya que en el proceso se liberan gases altamente contaminantes. El presente trabajo propone aplicar una sal alternativa a las convencionales como lo es el sulfato de amonio el mismo que presenta una descomposición térmica similar a al sulfato de sodio y cianuros siendo su valor de adquisición menor comparado con el compuesto comúnmente aplicado para este fin. Para lo cual se elaboraron muestras de cada acero AISI 4340 y AISI 4130 las mismas que fueron sometidas a procedimientos de preparación superficial manual y limpieza química; las muestras de los dos aceros se sometieron al mismo proceso de sulfinización, en el cual se llevó a cabo la descomposición del sulfato de amonio a 235 °C, al alcanzar esta temperatura se introdujo al baño de sal las muestras por separado, calentando el baño hasta una temperatura que bordea los 570 °C donde permanecieron por 100 minutos para posteriormente ser sacadas, enfriadas al aire y en agua y finalmente lavadas en agua por inmersión. La verificación de la composición de la capa obtenida se llevó a cabo mediante Espectroscopia de Infrarrojo; la presencia de azufre elemental se determinó mediante Fluorescencia de Rayos X y la caracterización estructural de la capa por medio de Difracción de Rayos X. Se determinó una cinética de reacción relacionada con el tratamiento, a partir de la cuantificación de azufre y nitrógeno remanente en el baño en el transcurso del tiempo a través del registro de absorbancia de la solución en un Espectrofotómetro UV-VIS. Se evaluó la dureza Rockwell superficial y la resistencia a la corrosión a través de un ataque químico de las muestras sulfinizadas y los testigos Los resultados obtenidos por difracción de rayos X verifican la presencia de sulfuros en la matriz de hierro, como Pirrotita (Fe1-xS), este resultado se verifica por el análisis de fluorescencia de rayos X, donde se evidencia la presencia de azufre. En función del porcentaje de azufre adquirido el acero AISI 4130 recepta mejor el azufre en su matriz (8,11% en promedio) que el acero AISI 4340 (7,25% en promedio), sin embargo el acero AISI 4340 desarrolló un mejoramiento en su dureza superficial (3,5%) mayor al compararlo con la muestra sin tratamiento del mismo acero, mayor que el acero AISI 4130 (2,7%), por lo tanto el contenido de azufre no se ve reflejado en esta variable ni en la velocidad de corrosión la cual fue menor para el acero AISI 4340 sulfinizado que en el acero AISI 4130 sulfinizado. 2 1. MARCO TEÓRICO 1.1. Tratamientos de los metales 1.1.1. Tratamientos Térmicos. Los tratamientos térmicos consisten en someter al acero a procesos de calentamiento y enfriamiento, mediante los cuales se consigue mejorar propiedades mecánicas de los materiales tales como la dureza, por ejemplo, cuando se requiere aumentar la dureza de un material existen dos opciones, someterlo a un tratamiento térmico como lo es el temple que mejora el grado de dureza, o alearlo con otros metales que proporcionen mejores propiedades al acero. Esto se debe a que las propiedades mecánicas de un acero dependen de la composición química del mismo y de la estructura cristalina, ya que algunos materiales presentan polimorfismo que es la capacidad de poseer distinta estructura cristalina con una misma composición química. Algunos tratamientos térmicos son el temple, revenido, recocido y normalizado. 1.1.2. Tratamientos Termoquímicos. Los tratamientos termoquímicos a diferencia de los tratamientos térmicos mejoran las propiedades del acero a través de calentamiento y enfriamiento del mismo combinado con un cambio en la composición química del material. Dentro de los tratamientos termoquímicos se encuentran la cementación, que incrementa la concentración de carbono en la aleación, la nitruración, que incorpora nitrógeno al material, sulfinización, la cual penetra azufre en la composición del acero y finalmente la cianuración que incorpora carbono y nitrógeno dentro de la composición química del acero. 1.1.3. Tratamientos Superficiales. Estos tratamientos se realizan sobre la superficie de los metales con el fin de mejorar sus propiedades de resistencia a la corrosión y desgaste, este tipo de tratamientos actúan como un recubrimiento donde la capa externa protege al metal base ya que posee mejores propiedades, dentro de estos procedimientos se encuentra el cromado y el galvanizado. [2] 3 1.2. Acero El acero constituye una combinación de hierro con carbono en distintas proporciones, el cual a diferentes temperaturas y concentraciones de carbono presenta estados alotrópicos diferentes. La norma AISI (American Iron and Steel Institute) clasifica a los aceros y materiales no ferrosos mediante cuatro números, el primero especifica la aleación principal, el segundo indica el porcentaje aproximado del elemento principal y con los dos últimos dígitos se conoce la cantidad de carbono presente en la aleación; los números correspondientes a la aleación principal son los siguientes. Tabla 1. Nomenclatura de aleantes para los aceros AISI. Número Aleación principal 1 Manganeso 2 Níquel 3 Níquel-cromo 4 Molibdeno 5 Cromo 6 Cromo- vanadio 7 Níquel- cromo- molibdeno, principal aleante molibdeno 8 Níquel- cromo- molibdeno, principal aleante níquel 1.2.1. Estados alotrópicos del hierro. El hierro en estado sólido presenta 4 estados alotrópicos. Fase α (alpha): Se presenta por debajo de los 768 °C, temperatura a la cual se produce el cambio de estado alotrópico, y se lo conoce como ferrita. Fase β (beta): Se presenta entre los 768 °C y 910 °C. Fase γ (gamma): Se conoce como austenita y tiene lugar entre 911 °C y 1390 °C, es capaz de disolver hasta el 2% de carbono en su estructura. Fase δ (delta): Se forma a una temperatura de 1400 °C y 1539 °C en esta fase el hierro es débilmente magnético. 4 1.2.2. Estados del acero. El acero presenta distintos estados polimorfos dependiendo de la temperatura y concentración de carbono. Ferrita: Está conformada por la fase α del hierro casi puro y se forma hasta los 768 °C y es de los elementos más blandos de los cuales se puede componer el acero. Cementita (Fe3C): Se forma cuando se excede el límite de solubilidad del carbono en la ferrita por debajo de los 727 °C, es una capa dura y frágil. Perlita: Está constituida por ferrita y cementita con un contenido de 0,89% de carbono, sus propiedades están asociadas a su composición. Martensita: Es una solución sólida de Fe3C en hierro γ, puede contener de 0 a 0,2 % de carbono, siendo estable a temperaturas elevadas 730 °C y 1500 °C dependiendo del contenido de carbono. [3] 1.3. Aceros para sulfinización Los aceros aptos para someterse a tratamientos termoquímicos en general son los aceros de bajo y medio carbono, es decir con un contenido máximo de carbono de 0,4%, presentando mayores ventajas dichos aceros que se someten a tratamientos de sulfinización en comparación a los de mayor contenido de carbono debido a la migración del carbono al límite de grano dejando zonas descarburadas que provocan la fragilización de las capas. 1.3.1. Acero AISI 4340. Se conoce como un acero bonificado para maquinaria, es un acero al molibdeno más cromo y níquel. El cromo aumenta la dureza y resistencia del acero a altas temperaturas al igual que el níquel alcanzando valores de dureza que van desde 270 a 330 HB (Dureza Brinell). Presenta tratamientos térmicos de recocido, temple, alivio de tensiones y revenido. [4] Tabla 2. Composición química del acero AISI 4340 AISI %C %Si %Mn %Mo %S %Ni %Cr %V 0,35-0,40 0,20-0,35 0,60-0,80 0,20-0,30 0,04 1,65-2,00 0,70-0,90 0,20-0,30 4340 5 1.3.2. Acero AISI 4130. Los aceros de la serie 41xx son aceros aleados principalmente con cromo y molibdeno, el acero AISI 4130 es un acero de medio carbono su uso está dirigido a aplicaciones donde se requiere dureza y tenacidad ya que alcanza durezas de hasta 460 HB. Presenta tratamientos térmicos de normalizado, recocido, endurecido y revenido. [5] Tabla 3. Composición química del acero AISI 4130 AISI %C %Si %Mn %Mo %S %Ni %Cr %V 0,28-0,33 0,15-0,35 0,40-0,60 0,15-0,25 0,04 - 0,80-1,10 - 4340 1.4. Sulfinización. La sulfinización forma parte de los tratamientos termoquímicos a los cuales puede someterse el acero, consiste en la incorporación de sulfuro de hierro en la estructura del mismo con el fin de mejorar sus propiedades. Los métodos convencionales de sulfuración o sulfinización de un material de hierro fundido, para formar una capa sulfurada (compuesta principalmente de sulfuro de hierro) en su superficie, incluyen (a) una alta temperatura en el procedimiento de sulfuración en el que el material se calienta a aproximadamente 570 ° C utilizando una adecuado combinación de, por ejemplo, cianuro de sodio (NaCN), ferrocianuro de potasio [K4Fe(CN)6], sulfito de sodio (Na2SO3), tiosulfato de sodio (Na2S2O3), y sulfato de sodio ( Na2SO4), y (b) un procedimiento de baja temperatura de sulfuración en el que la sulfuración se lleva a cabo a aproximadamente 150 ° C. Sin embargo, los productos de ambos de estos procedimientos tiene solamente una delgada (espesor inferior a 10 micras) capa de sulfuro o una capa que contiene tanto un sulfuro y un nitruro. Esta capa no se forma homogéneamente sobre la superficie del material pero provee al mismo mayor dureza, resistencia al desgaste y a la corrosión. Cuando el azufre reacciona con la superficie metálica forma una capa como se muestra en la fig. 1, compuesta principalmente de sulfuros y un gradiente de dicho elemento el cual se forma desde la superficie hacia el interior próximo del material. [6] 6 Sustrato Zona de difusión de azufre Solución sólida hierro- azufre y sulfuros. Sulfuros Figura 1. Configuración indicativa de una capa de acero sulfinizada. (Wang, 2014) Figura 2. Microfotografía (× 200) de la estructura de la sección transversal de la superficie de un material sometido a un tratamiento de sulfinización. (Wang, 2014) 7 1.4.1. Diagrama de fases hierro-azufre. El azufre monoclínico funde a 119,25 °C y hierve a 444,6 °C. Sin embargo, el azufre y el hierro son miscibles, y la investigación ha demostrado que el sistema binario Fe-S en una atmósfera de presión forma un líquido a temperaturas tan altas como 1800 °C, muy por encima del punto de ebullición del azufre solo. Las fases de este sistema han sido estudiadas extensamente. La figura 1 muestra el diagrama de fases del sistema Fe-S a una atmósfera de presión. [7] Figura 3. Diagrama de fases Fe-S Troilite (FeS): El nombre troilita se aplica sólo al polimorfo de FeS estequiométrico que es estable por debajo de 140 ° C. Mackinawita (FeS 1-x ): El nombre del mineral es mackinawita tetragonal relativamente rara de casi FeS de composición. Se encuentra, ya sea con troilita o con pirrotita de baja temperatura Pirrotita: Del grupo de los sulfuros. La pirrotina o pirrotita es un mineral del grupo II (sulfuros), según la clasificación de Strunz, poco frecuente cuya composición es sulfuro de hierro (II) no estequiométrico con un contenido variable de hierro: Fe(1-x)S (x = 0 - 0,2). La pirrotina es un mineral opaco, también llamada pirita magnética porque su color es similar a la pirita y es débilmente magnética. Entre su 8 temperatura máxima de fusión en el diagrama Fe-S de 1190 ° C y 308 ° C, toda la anchura del campo de fase pirrotita está ocupado por una solución sólida única, Fe l-x S. [8] 1.4.2 Ventajas de los aceros sulfinizados. La sulfinización provee al material un mejoramiento de la dureza superficial ya que a su vez la presencia de azufre incrementa la resistencia al desgaste por fricción, la cual se ha comprobado que es mayor que en otros procesos termoquímicos, esta propiedad adquirida por el acero le permite soportar mayor fricción en seco en temperaturas de hasta 1000 °C. Los aceros después de sulfinizados resisten mejor a la acción corrosiva del agua dulce, agua salada, vapor o atmósferas húmedas que los aceros ordinarios, y por esto que este proceso es adecuado para las piezas que deben de sufrir la acción de ciertos agentes corrosivos. Como el tratamiento de sulfinización no requiere de enfriar las piezas rápidamente, desde alta temperatura, en agua o aceite, se evitan los graves inconvenientes de los enfriamientos rápidos, que pueden dar origen a deformaciones importantes. Durante el proceso de sulfinización se pueden proteger perfectamente las superficies de las piezas que no se desea endurecer, aunque sean de formas complicadas o irregulares, dejando libres para sulfinizar exclusivamente las zonas que deben quedar duras. [9] 1.4.3. Generalidades del sulfato de amonio. El sulfato de amonio es una sal cristalina de color blanco hasta ligeramente amarillento que se produce a partir de ácido sulfúrico concentrado pulverizado que se mezcla con una corriente de amoniaco, obteniéndose la sal por precipitación. Su producción se la realiza enfocada en dos sectores industriales, como floculante de proteínas y mayormente como fertilizante en procedimientos agrícolas. NH3 + H2SO4 (NH4)2SO4 9 1 El sulfato de amonio no tiene un punto de fusión ya que se descompone antes de fundir a 235 °C dando como productos de descomposición amoniaco, óxidos de azufre y óxidos de nitrógeno. [10] (NH4)2SO4 NH4 + SOX + NOX 2 1.5. Dureza La dureza de un material se define como la Resistencia que opone el mismo a ser deformado, y cuando esta se asocia a metales está relacionada con las propiedades de resistencia al desgaste del material. Para obtener el valor de dureza se realiza un ensayo no destructivo que consiste en medir la huella que deja un penetrador determinado sobre el material al aplicarle una carga de valor conocido. 1.6. Velocidad de Corrosión Los sistemas que sufren un ataque corrosivo no se encuentra en equilibrio termodinámico, ya que experimentan una diferencia de potencial entre las zonas anódicas y catódicas que determinan el flujo de electrones en el sistema y por ende el flujo de masa que se produce con el mismo, bajo este fundamente ante una celda galvánica el ánodo (material menos noble, de menor potencial de reducción estándar) experimenta una pérdida de peso, deterioro, en función del tiempo, mientras que el cátodo permanece intacto; razón por la cual la velocidad de corrosión se define como la cantidad de material que se pierde producto de la reacción de oxidación ocurrida en el ánodo. [11] 10 2. METODOLOGÍA EXPERIMENTAL 2.1. Materiales y equipos. Vasos de precipitación (R: 0-100 mL) (A±20mL), (R: 0-250 mL) (A±100 mL) Lija #100 Soporte Universal Capsula de porcelana de 120 ml Multímetro, ProsKit MT-1233C Termocupla (R: -4 a 750 °C) (A±1.5 °C) Mechero Bunsen Pinzas Malla de amianto Estufa (R: 5rdx0- 270 ᵒC), Memmert GmbH+Corp. FTIR, Perkin Elmer Spectrum Two Analizador de XRF, Niton XL3t Espectrofotómetro, Agilent Cary 60 UV-Vis Probeta (R: 0-500 mL) (A±1 mL), (R: 0-100 mL) (A±1 mL) Pipeta (R: 0-10 mL) (A±0,1 mL), (R: 0-2 mL) (A±0,02 mL) Balanza Analítica, Boeco (R: 0-200 g) (A±0,0001g) Balones aforados (R: 0-50 mL) (A±50 mL), (R: 0-100 mL) (A±100 mL), (R: 01000 mL) (A±1000 mL) Equipo de Wheel testing. Microscopio, Olympus CX21 Cámara para microscopio, Ken-a-vision 7890UM 2.2. Sustancias y reactivos. Agua destilada, H2 O Hidróxido de sodio, NaOH, solución al 10% 11 Acero AISI 4130 Acero AISI 4340 Sulfato de amonio, (NH4)2SO4(S) Bromuro de potasio, (KBr) Sulfato de sodio, (Na2SO4) Ácido clorhídrico concentrado, (HCl) Alcohol isopropílico, (CH3CH2OHCH3) Glicerol Cloruro de sodio, (NaCl) Cloruro de bario, (BaCl) Cloruro de amonio, (NH4Cl) Tartrato de sodio y potasio tetra hidratado, (KNaC4H4O6·4H2O) Reactivo de Nessler, (K2(HgI4) / KOH) 2.3. Diseño experimental. 2.3.1. Codificación. Tabla 4. Codificación para acero AISI 4130 Acero Tratamiento A Sulfinización AISI 4130 B Ninguno Muestra Codificación 1 2 3 1 2 3 A1 A2 A3 B1 B2 B3 Tabla 5. Codificación para acero AISI 4340 Acero Tratamiento C Sulfinización AISI 4340 D Ninguno 12 Muestra Codificación 1 2 3 1 2 3 C1 C2 C3 D1 D2 D3 2.3.2. Diagrama de Flujo. Figura 4. Diagrama de flujo de la metodología experimental. 13 2.4. Procedimiento. 2.4.1. Preparación superficial. La preparación superficial debe realizarse tanto en las piezas que se someterán al proceso de sulfinización (A, C) como en los aceros al desnudo (B, D) que se someterán a los ensayos de comparación. El procedimiento de limpieza que debe realizarse para una preparación superficial es el siguiente. a) Se realiza una remoción de calamina, pintura, óxidos etc. mediante una limpieza manual utilizando una lija #100 según dictan los procedimientos de limpieza manual de la norma SSPC-SP2. b) Se efectúa una limpieza química de grasas, aceites y sales para lo cual se realiza una inmersión en una solución alcalina de hidróxido de sodio al 10% y posterior lavado con agua fresca para eliminar interferencias, según la norma de preparación superficial SSPC (Society for protective coating) SP 1 para limpieza química. c) Secar las piezas en una estufa a 50 ° C. 2.4.2. Sulfinización de aceros A y C. Con el fin de obtener la capa sulfinizada en los aceros A y C se somete a estos a calentamiento en un baño de sulfato de amonio como medio proveedor de los elementos que caracterizan el proceso. a) Pesar 120g de sulfato de amonio y colocar en una cápsula de porcelana. b) Se somete el sulfato de amonio a calentamiento mediante un mechero, con combustión completa, hasta obtener la fundición del mismo, indicio de la reacción de descomposición de la sal, lo cual se evidencia mediante el control de la temperatura con una termocupla conectada a un multímetro, dicha descomposición térmica tiene lugar a partir de los 230 °C. c) Una vez registrada la fundición de la sal se procede a colocar la muestra en el baño fundido, se realiza únicamente una muestra por procedimiento. d) Se controla la temperatura del proceso cada 15 minutos, con el fin de estabilizar el sistema a la temperatura de sulfinización la cual es de 570 °C. 14 e) Se deja la muestra en el baño de sulfato de amonio por 1 hora y 40 minutos, según los procedimientos de sulfinización revisados en bibliografía donde el tiempo de sulfinización no debe exceder las 2 horas. f) Una vez culminado el tiempo de tratamiento se saca la muestra del baño con la ayuda de una pinza metálica y se deja enfriar al aire hasta 200 °C y luego se realiza un enfriamiento y lavado en agua por inmersión donde se retira el exceso de residuos remanentes en la muestra de acero tratada. g) Se seca la muestra en una estufa a una temperatura de 50 ° C y se guarda en un lugar libre de humedad para posteriores ensayos. h) Este procedimiento se repite con las muestras A1, A2, A3, C1, C2 y C3. 2.4.3. Verificación de la composición del recubrimiento mediante ensayo de FTIR (Espectroscopia Infrarroja con Transformada de Fourier). Con el fin de verificar la presencia de nitruros y sulfuros de hierro en la capa obtenida tras el tratamiento se realiza la determinación del espectro en fase sólida del recubrimiento. a) Se toma una muestra de la capa sulfinizada y se la homogeniza. b) Se realiza una mezcla homogénea entre la muestra de la capa obtenida y bromuro de potasio en una proporción de 1 a 100. c) Se introduce la mezcla homogénea obtenida en la prensa para realización de la pastilla de KBr. d) Se realiza un background en el equipo. e) Una vez que la pastilla prensada presente una transparencia relativa, está lista para ser ingresada al porta muestras del equipo. f) Se realiza la lectura del espectro emitido por la muestra. g) Se elimina las interferencias generadas por el ruido. h) Se obtienen un espectro característico de los compuestos presentes en la muestra, los cuales serán comparados con la bibliografía de los compuestos característicos formados en el proceso de sulfinización. 2.4.4. Verificación de la presencia de azufre en el recubrimiento mediante ensayo de XRF (Fluorescencia de rayos X). Para este propósito se utiliza un analizador de fluorescencia de rayos X, el cual nos permite obtener un análisis elemental de la 15 muestra, por emisión de rayos X secundarios (o fluorescencia) característica de un material que ha sido excitado con rayos X de alta energía. a) Se limpia la superficie a ser expuesta al analizador. b) Se verifica en el software del equipo que este cargado el azufre dentro del paquete que se va analizar. c) Se carga el tiempo de muestreo. d) Debe colocarse la muestra en una superficie horizontal con el propósito de que el tubo de rayos x del analizador quede perpendicular a la muestra. e) Se realiza la emisión de rayos x, y al trascurrir el tiempo de muestreo se obtiene la composición elemental de la muestra en porcentaje de los elementos detectables en este método. 2.4.5. Cuantificación de consumo de azufre. En el transcurso de la sulfinización, la sal aplicada para este propósito, sulfato de amonio, se agota en función del tiempo, por lo que es necesario evaluar la concentración de azufre en el baño para establecer una cinética química en el proceso, la medición de azufre en el baño se realiza como sulfato (SO42-) en disolución acuosa el cual en contacto con bario forma una suspensión de cristales proporcional a la concentración de sulfatos por lo tanto se puede medir espectrofotométricamente. Construcción de la curva de calibración para medición de sulfatos: a) Se prepara una solución patrón de sulfato a partir de 0,7395g de sulfato de sodio anhidro (Na2SO4) aforándola hasta 1000 ml en un matraz, esta solución contiene 500 mg SO42-/ L. b) Preparar una solución acondicionadora para sulfatos mezclando los siguientes reactivos en el siguiente orden: 30 ml de ácido clorhídrico concentrado (HCl), 300 ml de agua, 100 ml de alcohol isopropílico (CH3CH2OHCH3) y 75 g de cloruro de sodio (NaCl). Finalmente se añade 50 ml de glicerol, se mezcla todo y se lleva a un volumen final de 500 ml con agua. c) Se obtienen volúmenes crecientes de la solución patrón y se afora con agua destilada hasta 20 ml. 16 Tabla 6. Construcción de la curva de calibración para sulfatos. Concentración, mg/L Volumen de la solución patrón, μl 0 0 8 320 16 640 24 960 32 1280 40 1600 d) Se coloca a cada patrón 1 ml de la solución acondicionadora y 1,3 g de cloruro de bario (BaCl). e) Antes de los 5 minutos se miden las soluciones patrones en el espectrofotómetro a 420 nm, obteniéndose la absorbancia de cada solución para construcción de la curva de calibración. Para registrar el contenido de sulfatos en el baño durante la sulfinización, una vez introducida la muestra de acero en el baño se toman muestras del baño con ayuda de una cuchara metálica en un intervalo de tiempo de 20 minutos. a) Se toman 100 mg de las muestras del baño recolectadas en el transcurso de la sulfinización, se la diluye hasta 100 ml, de esta solución se toma 1 ml y se diluye a 50 ml. b) Se toman 20 ml de la solución obtenida finalmente, se añade 1 ml de la solución acondicionadora, 1,3 g de cloruro de bario y se agita vigorosamente. f) Antes de los 5 minutos se miden la muestra en el espectrofotómetro a 420 nm, obteniéndose la absorbancia de cada solución. c) Con la ecuación de la curva de calibración para sulfatos obtenida anteriormente se transforma el valor de absorbancia obtenido a concentración. 2.4.6. Cuantificación de consumo de nitrógeno. En el transcurso de la sulfinización, la sal aplicada para este propósito, sulfato de amonio, se agota en función del tiempo, por lo que es necesario evaluar la concentración de nitrógeno en el baño para establecer una cinética química en el proceso, la medición de nitrógeno en el baño se realiza como 17 amonio (NH4+) en disolución acuosa el cual en contacto con el reactivo de Nessler se descompone formando yoduro de dimercuramonio que permite la determinación colorimétrica de los iones de amonio. Construcción de la curva de calibración para medición de amonio: a) Se prepara una solución madre de cloruro de amonio (NH4Cl) a partir de 3,819g de cloruro de amonio anhidro aforándola hasta 1000 ml en un matraz con agua destilada, esta solución contiene 1290 ppm de NH4+. b) Para preparar la solución patrón de amonio se diluyen 10 ml de la solución madre a 1000 ml con agua destilada, esta solución contiene 12,9 ppm de NH4+. c) Se prepara una solución estabilizadora para amonio conocida como Sal de Rochelle disolviendo 50g de tartrato de sodio y potasio tetra hidratado en 100 ml de agua, se hierve la solución hasta perder 30 ml de agua, se enfría y se afora a 100 ml nuevamente. d) Se obtienen volúmenes crecientes de la solución patrón y se afora con agua destilada hasta 50 ml. Tabla 7. Construcción de la curva de calibración para amonio. Concentración, mg/L Volumen de la solución patrón, ml 0 0 0,3 1,2 0,9 3,5 1,5 5,8 2 7,8 2,5 9,7 e) Se coloca a cada patrón 2 gotas de la Sal de Rochelle y 8 gotas del reactivo de Nessler. f) Se miden el color desarrollado en un espectrofotómetro a 425 nm, obteniéndose la absorbancia de cada solución para construcción de la curva de calibración. 18 Para registrar el contenido de sulfatos en el baño durante la sulfinización, una vez introducida la muestra de acero en el baño se toman muestras del baño con ayuda de una cuchara metálica en un intervalo de tiempo de 20 minutos (mismas muestras que se les realiza la medición de sulfatos). a) Se toman 100 mg de las muestras del baño recolectadas en el transcurso de la sulfinización, se la diluye hasta 50 ml, de esta solución se toma 1 ml y se diluye a 50 ml, finalmente se toma 1 ml de la última solución y se diluye hasta 20 ml. b) Se añade 1 gota de la solución estabilizadora y 4 gotas del reactivo de Nessler agitando la mezcla hasta estabilizar el color. c) Se miden el color desarrollado en un espectrofotómetro a 425 nm, obteniéndose la absorbancia de cada solución. d) Con la ecuación de la curva de calibración para el amonio realizada anteriormente se transforma el valor de absorbancia obtenido a concentración. 2.4.7. Ensayo de dureza superficial. Cuando se somete a un acero a un tratamiento de sulfinización la dureza superficial del mismo tiende a incrementar, debido al cambio de composición superficial, por lo cual se determina la dureza Rockwell superficial según la norma INEN 1053 (Instituto Ecuatoriano de Normalización) a las los grupos de muestras A, B, C, D. a) Se elige el penetrador a usar, dependiendo de la superficie a evaluar, para el caso de un acero sometido a un tratamiento termoquímico lo adecuado es la aplicación de un penetrador cónico correspondiente a la escala N, según la norma INEN 1053. b) Se coloca la muestra en el soporte el cual deberá estar limpio y libre de materias extrañas. c) Se coloca el penetrador en contacto con la superficie de ensayo, perpendicularmente a ésta. d) Se aplica la carga inicial la cual es de 3 ± 0,06 Kgf. e) Se ajusta el indicador de profundidad de penetración a la posición inicial de la escala y se aumenta paulatinamente la carga, en un intervalo de tiempo de 2 a 8s, esto se realiza sucesivamente hasta que el valor de la carga final se mantiene por dos lecturas sucesivas. 19 2.4.8. Ensayo de corrosión. En la corrosión química un material se disuelve en un medio corrosivo líquido, por formación de una celda galvánica en la superficie del material y este se seguirá disolviendo hasta que se consuma totalmente o se sature el líquido y depende entre otros factores de la naturaleza del electrolito en contacto y la temperatura. Razón por la cual se diseñó el presente ensayo en el cual se somete las muestras de acero A, B, C, D a un mismo electrolito y temperatura, para evaluar su desempeño en función del tiempo, según la norma Nace 1D182 para evaluación de corrosión mediante el ensayo de Wheel Test, que corresponde a una corrosión química acelerada. a) Se realiza una limpieza superficial química con desengrasante, con el fin de remover residuos y suciedad que puedan actuar como pasivantes en el proceso corrosivo. b) Se secan las piezas a una temperatura de 50 °C. c) Se prepara una solución corrosiva de cloruro de sodio al 3,5% (35000 ppm). d) Se precalienta el equipo de Wheel testing, usado para evaluar inhibidores de corrosión, hasta una temperatura de 50 °C, temperatura a la cual se llevará a cabo el ensayo. e) Se introduce las muestras A1 y B1 simultáneamente en los porta muestras con l00 ml de la solución de NaCl cada una. f) Se realiza un registro fotográfico de las superficies expuestas de cada pieza en un intervalo de 10 minutos hasta completar los 40 minutos de exposición de las piezas al medio corrosivo. g) Finalizada la experimentación se lava y seca las muestras evaluadas. h) Este procedimiento se repite con las muestras sucesivas A2-B2, A3-B3, C1-D1, C2D2, C3-D3 hasta completar la población de muestras. i) Las imágenes obtenidas mediante este tratamiento se trabajan en el software Imagej, el cual nos permite cuantificar el área corroída tras el procedimiento aplicado previamente. 2.4.9. Medición del espesor de la capa obtenida por sulfinización. El proceso de sulfinización genera una capa externa compuesta principalmente por sulfuros, la cual es visible microscópicamente. a) Se realiza un corte transversal en las muestras sulfinizada (A, B). 20 b) Se aplica luz perpendicular a la muestra, la cual se coloca en el portaobjetos de un microscopio. c) Se toma una micrografía con la mejor resolución de lente obtenida tras el enfoque del corte transversal. d) Con la ayuda del software Ken-a-visión de la cámara para microscopio se realiza la lectura del espesor de la capa, según la escala del lente aplicado. 2.5. Datos Experimentales 2.5.1. Temperatura del proceso. La sulfinización se lleva a cabo a una temperatura que bordea los 570 °C; por lo cual es necesario controlar la temperatura durante el procedimiento, con el fin de no sobrepasar los límites del tratamiento. A continuación se detalla el registro de la temperatura en las sulfinización de los aceros evaluados en el transcurso del tiempo. Tabla 8. Temperatura de sulfinización registrada para el acero AISI 4130. tiempo, min/ Muestra 0 20 40 60 80 100 Temperatura, °C A1 A2 A3 337 345 350 424 460 445 507 470 500 555 530 560 586 582 588 590 593 585 Tabla 9. Temperatura de sulfinización registrada para el acero AISI 4340. tiempo, min/ Muestra 0 20 40 60 80 100 Temperatura, °C C1 C2 C3 320 367 348 458 475 440 506 537 500 586 590 582 590 585 622 587 581 585 2.5.2. Medición de sulfatos. La medición de sulfatos en el baño sulfinizante, permite determinar indirectamente el consumo de azufre en el baño. 21 Valores de absorbancia obtenidos para la curva de calibración. La curva de calibración para medir sulfatos se construye a partir de la absorbancia registrada en un espectrofotómetro a 420 nm por varias soluciones preparadas de concentración conocida de sulfatos. Tabla 10. Valores de absorbancia para calibración de sulfatos. Absorbancia420nm 0,5102 0,5909 0,7549 0,8558 1,0455 1,1727 Sulfatos, mg/L 0,00 8,00 16,00 24,00 32,00 40,00 Valores de absorbancia obtenidos en las muestras analizadas. Se registró la absorbancia de las muestras tomadas del baño de sulfinización en el transcurso del tiempo del mismo en un espectrofotómetro a 420 nm mediante reacción con cloruro de bario. Tabla 11. Valores de absorbancia de sulfatos del baño de acero AISI 4130. Tiempo, min/ muestra A1-1 A1-2 0 20 40 60 80 100 0,6767 0,6731 0,6081 0,6322 0,6482 0,6571 0,6789 0,6754 0,6132 0,6387 0,6538 0,648 A1-3 Absorbancia420nm A2-1 A2-2 A3-3 A3-1 A3-2 A3-3 0,6778 0,6709 0,6098 0,6342 0,6471 0,6502 0,6857 0,6821 0,6171 0,6412 0,6572 0,6661 0,6679 0,6644 0,6022 0,6277 0,6428 0,637 0,6671 0,6021 0,6262 0,6422 0,6511 0,6421 0,6717 0,6681 0,6031 0,6272 0,6432 0,6521 0,6819 0,6784 0,6162 0,6417 0,6568 0,651 0,6829 0,6794 0,6172 0,6427 0,6578 0,652 Tabla 12. Valores de absorbancia de sulfatos del baño de acero AISI 4340. tiempo, min/ muestra C1-1 C1-2 0 20 40 60 80 100 0,6704 0,6688 0,6162 0,596 0,6093 0,632 0,669 0,6713 0,6131 0,6009 0,6129 0,6327 C1-3 Absorbancia420nm C2-1 C2-2 C2-3 C3-1 C3-2 C3-3 0,6746 0,6651 0,617 0,5991 0,6107 0,6308 0,6774 0,6627 0,6332 0,613 0,6263 0,649 0,6694 0,6577 0,6152 0,595 0,6106 0,631 0,6671 0,6564 0,6101 0,5979 0,6099 0,6297 0,6686 0,6641 0,605 0,5871 0,6087 0,6188 22 0,6791 0,6704 0,6251 0,6129 0,6249 0,6447 0,6786 0,6724 0,637 0,6191 0,6307 0,6508 2.5.3. Medición de amonio. La medición de amonio en el baño sulfinizante, permite determinar indirectamente el consumo de nitrógeno en el baño. Valores de absorbancia obtenidos para la curva de calibración. La curva de calibración para medir amonio se construye a partir de la absorbancia registrada en un espectrofotómetro a 425 nm por varias soluciones preparadas de concentración conocida de amonio. Tabla 13. Valores de absorbancia para calibración de amonio. Absorbancia425nm Amonio, mg/L 0,149 0,5765 0,8077 1,238 1,5024 1,8778 0 0,3 0,9 1,5 2 2,5 Valores de absorbancia obtenidos en las muestras analizadas. Se registró la absorbancia de las muestras tomadas del baño de sulfinización en el transcurso del tiempo del mismo en un espectrofotómetro a 425 nm según el método aplicado por reacción con el reactivo de Nessler. Tabla 14. Valores de absorbancia de amonio del baño de acero AISI 4130. tiempo, min/ Muestra A1-1 A1-2 A1-3 Absorbancia425nm A2-1 A2-2 A2-3 0 20 40 60 80 100 0,6167 0,5733 0,5605 0,4948 0,4736 0,4219 0,6082 0,5802 0,568 0,5003 0,4712 0,4456 0,6203 0,5701 0,5702 0,4933 0,4701 0,4467 0,5927 0,5778 0,5224 0,4708 0,4496 0,3979 23 0,5892 0,5724 0,5301 0,4813 0,4522 0,4266 0,5993 0,5803 0,5249 0,4723 0,4491 0,4257 A3-1 A3-2 A3-3 0,6157 0,6008 0,5154 0,4938 0,4726 0,3909 0,5982 0,5814 0,5131 0,4903 0,4612 0,4056 0,6006 0,5816 0,5162 0,4736 0,4504 0,3827 Tabla 15. Valores de absorbancia de amonio del baño de acero AISI 4340. tiempo, min/ Muestra B1-1 B1-2 B1-3 Absorbancia425nm B2-1 B2-2 B2-3 0 20 40 60 80 100 0,5963 0,5441 0,5067 0,4869 0,4380 0,4347 0,5951 0,5486 0,5044 0,4876 0,4450 0,4324 0,5947 0,5505 0,5084 0,4880 0,4506 0,4358 0,5724 0,5367 0,4928 0,4798 0,4406 0,4269 0,6045 0,5286 0,4895 0,4678 0,4397 0,4234 0,5739 0,5379 0,4931 0,4693 0,4456 0,4179 B3-1 B3-2 B3-3 0,6036 0,5226 0,4862 0,4618 0,4226 0,4089 0,6098 0,5180 0,4831 0,4558 0,4277 0,4114 0,5876 0,5138 0,4797 0,4493 0,4256 0,3979 2.5.4. Áreas de corrosión. En las siguientes tablas se especifica las áreas corroídas obtenidas para cada muestra en el transcurso del tiempo al someterse estas a un sistema corrosivo constituido por una solución de cloruro de sodio, temperatura y agitación. Tabla 16. Valores de área corroída obtenidos para el acero AISI 4130. tiempo, min/ muestra 0 10 20 30 40 A1 0,0000 0,3880 15,5640 21,3040 32,0170 A2 Área, mm2 A3 B1 B2 B3 0,0000 0,0000 0,0000 0,0000 0,0000 17,1930 2,8700 156,3540 60,9050 28,7960 29,1070 39,7170 216,8520 145,3280 81,2430 66,7080 50,7690 265,4070 202,4520 147,4610 96,4380 70,4430 311,5500 229,4260 222,7800 Tabla 17. Valores de área corroída obtenidos para el acero AISI 4340. Área, mm2 C3 D1 tiempo, min/ C1 C2 D2 D3 Muestra 0 0,0000 0,0000 0,0000 0,0000 0,0000 0,0000 10 1,0000 7,3430 5,1120 5,3410 1,7920 1,0510 20 1,8470 15,6970 18,6030 19,0870 21,9030 94,2040 30 11,7420 20,9330 39,5170 41,9100 82,6830 140,9600 40 13,8180 23,0210 75,7460 95,0270 96,9550 162,5810 24 3. CÁLCULOS Y RESULTADOS 3.1. Cuantificación de sulfatos. Para la cuantificación de sulfatos se realiza una transformación de absorbancia (ABS) a concentración por medio de la ecuación correspondiente a la curva de calibración. 3.1.1. Obtención de la ecuación de la curva de calibración de sulfatos. 45,00 C(SO4-2) = 58,04(ABS) - 27,691 R² = 0,9903 40,00 Sulfatos, mg /L 35,00 30,00 25,00 20,00 15,00 10,00 5,00 0,00 0,00 0,50 1,00 1,50 Absorbancia Figura 5. Curva de calibración para medición de sulfatos. De la regresión lineal de los datos obtenidos se obtiene la siguiente ecuación: CSO−2 = 58,0400(ABS) − 27,6910 4 Siendo: CSO−2 = Concentración de sulfato en mg/L 4 ABS =Absorbancia de la solución a 420 nm. 25 (1) 3.1.2. Obtención de la concentración de azufre en las muestras del baño para aceros A y C. Se realiza una conversión de concentración de sulfatos a azufre para determinar el consumo de dicho elemento en el baño de sulfinización. Calculo modelo para A1-1 CSO−2 = 58,0400(0,6767) − 27,6910 4 CSO−2 = 6,1711 mg/L 4 Eliminación del factor de dilución aplicado el cual es 5 y conversión a azufre. PMs ) PM −2 SO4 (CSO−2 )∗fd∗( CS = 4 gm Siendo: CS = Concentración de azufre en la muestra, mg/g CSO−2 4 = Concentración de sulfato en mg/L fd = Factor de dilución, L. PMs = Peso molecular del azufre, mg/m-mol. PMSO−2 = Peso molecular del sulfato, mg/m-mol. 4 gm = Peso de la muestra, g. CS = 32 (6,1711) ∗ 5 ∗ (96) 0,1 CS = 102,8511 mg/g 26 (2) 3.2. Cuantificación de amonio. Para la cuantificación de amonio se realiza una transformación de la absorbancia (ABS) obtenida de las muestras analizadas del baño sulfinizante a concentración por medio de la ecuación correspondiente a la curva de calibración, mediante relación estequiométrica se transforma dicha concentración de amonio a nitrógeno. 3.2.1. Obtención de la ecuación de la curva de calibración de amonio. 3 C(NH4+) = 1,5248(ABS) - 0,3633 R² = 0,9849 Amonio, mg/L 2,5 2 1,5 1 0,5 0 0 0,5 1 1,5 2 Absorbancia Figura 6. Curva de calibración para medición de amonio. De la regresión lineal de los datos obtenidos se obtiene la siguiente ecuación: CNH+4 = 1,5248(ABS′) − 0,3633 Siendo: CNH+4 = Concentración de amonio en mg/L ABS′ = Absorbancia de la solución a 425 nm. 27 (3) 3.2.2. Obtención de la concentración de nitrógeno en las muestras del baño para aceros A y C. Calculo modelo para A1-1 CNH+4 = 1,5248(0,6167) − 0,3633 CNH+4 = 0,5770 mg/L Eliminación del factor de dilución aplicado el cual es 50 y conversión a nitrógeno. PMN ) PM + NH4 (CNH+ )∗fd´∗( CN = 4 gm Siendo: CN = Concentración de nitrógeno en la muestra, mg/g CNH+4 = Concentración de amonio en mg/L fd´ = Factor de dilución, L. PMN = Peso molecular del nitrógeno, mg/m-mol. PMNH+4 = Peso molecular del amonio, mg/m-mol. Gm = Peso de la muestra, g. CN = 14 (0,5770) ∗ 50 ∗ (18) 0,1 CN = 224,4001 mg/g 28 (4) 3.2.3. Obtención de la velocidad de reacción referente al nitrógeno. Tabla 18. Concentración de nitrógeno en función del tiempo para A1-1 A1-1 tiempo, min CN, mg/g 0 20 40 60 80 100 224,4061 198,6708 191,0807 152,1221 139,5509 108,8940 250 CN = -1,1341t + 225,83 R² = 0,9784 Nitrógeno, mg/g 200 150 100 50 0 0 20 40 60 80 100 120 Tiempo, min Figura 7. Velocidad de reacción de A1-1 υr = − m=− dCN dt dCN dt = υr Siendo: CN = Concentración de azufre en la muestra, mg/g t = Tiempo, min υr = Velocidad de reacción. M = Pendiente de la recta CN= f(t) υr = -1,1341 mg/gmin 29 (5) (6) 3.3. Cálculo de la velocidad de corrosión. En función de las áreas obtenidas mediante el programa Imagenj respecto al tiempo de exposición de las muestras a la solución de NaCl y del peso perdido por las mismas, se obtiene una curva característica para la velocidad de corrosión de cada material. Cálculo modelo para A1 Tabla 19. Áreas corroídas de la muestra A1 A1 tiempo, min Área, mm2 0 0 10 0,388 20 15,564 30 21,304 40 32,017 35 y = 0,8495x - 3,1354 R² = 0,9476 Area de corroida, mm2 30 25 20 15 10 5 0 0 -5 10 20 30 40 50 tiempo, min Figura 8. Velocidad de corrosión-área de A1 De la regresión lineal de la gráfica se obtiene la ecuación de la curva. Ac = 0,8495t − 3,1354 30 (7) Siendo: Ac = Área corroída, mm2 t = Tiempo, min En donde la velocidad de corrosión corresponde a la pendiente de la curva Vc = dAc dt (8) Siendo: Vc = Velocidad de corrosión referente al área de corrosión, mm2/min Vc = 0,8495 mm2 /min 3.4. Cálculo de la disminución de la velocidad de corrosión. Se determina mediante la diferencia entre la velocidad de corrosión del material sin tratamiento y la velocidad de corrosión del material tratado. %Dv = Vc−VCT VC 𝑥100 (9) Siendo: %DV = Porcentaje de disminución de la velocidad de corrosión VC = Velocidad de corrosión del material sin tratamiento VCT = Velocidad de corrosión del material tratado 3.5. Análisis estadístico. El análisis estadístico se efectuó mediante el programa estadístico SSPS, en el cual se realizó el análisis de la varianza con un factor (ANOVA), el mismo que se basa en las siguientes expresiones lógicas. Fs = 31 T′ E (10) H0 : sa2 = sb2 Ha : sa2 ≠ sb2 (11) Si S > 0.05 se acepta H0 ; Si S ≤ 0.05 se acepta Ha (12) Siendo: Fs = Estadístico para la distribución F sa2 = Varianza para la variable a sb2 = Varianza para la variable b H0 = Hipótesis nula (producción de enzima significativamente semejante para los distintos experimentos) Ha = Hipótesis alternativa (producción de enzima no es significativamente semejante para los distintos experimentos) S = Significación del análisis de varianza. 3.6. Resultados 3.6.1. Resultados de evaluación de composición del recubrimiento mediante espectroscopia infrarroja. En las figuras 9 y 10 se presenta una comparación de los espectros obtenidos para el recubrimiento de las muestras A y C con un patrón de recubrimiento de Boheler. Ensayo de FTIR, para acero AISI 4130 240 220 Intensidad U.A. 200 180 160 140 120 100 80 2000 1800 1600 1400 1200 1000 800 600 400 Longitud de onda (nm) Figura 9. Ensayo de FTIR para AISI 4130 ( A1, A2, A3, PATRÓN) 32 Ensayo de FTIR, para acero AISI 4340 300 280 260 Intensidad U.A. 240 220 200 180 160 140 120 100 80 2000 1800 1600 1400 1200 1000 800 600 400 Longitud de onda (nm) Figura 10. Ensayo de FTIR para AISI 4340 ( C1, 3.6.2. C2, C3, PATRÓN) Resultados de evaluación de composición del recubrimiento mediante análisis de fluorescencia de rayos X. El ensayo de fluorescencia de rayos X permite obtener una composición elemental según el rango de detección del equipo de los elementos presentes en la aleación. En las siguientes tablas se presenta la concentración porcentual de las distintas muestras de acero analizadas. Ensayo de XRF, para acero AISI 4130 Tabla 20. Composición elemental del acero AISI 4130 Elemento/ Muestra Fe Cr Cu Si Mn Ni Mo S Ti Pb A1 A2 Porcentaje, % A3 B1 B2 B3 88,4900 87,9500 93,3900 97,8500 97,6700 97,9200 0,8060 0,7530 0,9610 0,9070 0,8850 0,8010 0,0000 0,0420 0,0000 0,0000 0,0530 0,0550 0,0000 0,4170 0,2630 0,1800 0,3040 0,3170 0,4320 0,4690 0,5200 0,4790 0,5060 0,7170 0,0000 0,0000 0,0000 0,0000 0,0000 0,0000 0,1460 0,1460 0,1630 0,1650 0,1700 0,0060 9,8500 9,9500 4,5300 0,0000 0,0000 0,0000 0,0150 0,0500 0,0240 0,0000 0,0000 0,0000 0,0920 0,1070 0,0900 0,0620 0,0980 0,0680 33 Ensayo de XRF, para acero AISI 4340. Tabla 21. Composición elemental del acero AISI 4340 Elemento/ Muestra Fe Cr Cu Si Mn Ni Mo S Ti Pb A1 A2 Porcentaje, % A3 B1 B2 B3 88,4700 91,8700 88,3100 96,1300 96,1000 95,7900 0,8860 0,9660 0,8660 0,9180 0,8940 0,9010 0,1580 0,1620 0,1350 0,1580 0,1360 0,1710 0,3150 0,2220 0,1760 0,4670 0,6430 0,4970 0,6560 0,6920 0,6960 0,7590 0,6990 0,6920 0,5910 0,7100 0,7170 0,8110 0,8010 0,7850 0,1610 0,1790 0,1670 0,1870 0,1950 0,1920 7,8900 5,0400 8,8200 0,0000 0,0000 0,0000 0,0180 0,0220 0,0190 0,0000 0,0000 0,0000 0,0810 0,1210 0,0860 0,1020 0,0860 0,0880 12 10 % Azufre 8 6 4 2 0 A1 A2 A3 Muestras Figura 11. Comparación de la concentración de azufre en las muestras A, B, C, D, las muestras A y muestras C Los grupos de muestras B y D no aparecen en la figura 11 ya que el contenido de azufre es 0%, por lo tanto se observa la incorporación de azufre a la composición del acero posterior al tratamiento (A, C). 3.6.3. Resultados obtenidos para la cinética de reacción de consumo de nitrógeno. En función de la concentración de nitrógeno obtenida en el transcurso del proceso se representa la respectiva cinética de consumo de nitrógeno en el tratamiento 34 termoquímico para cada muestra analizada y con ello la correspondiente velocidad de reacción. Tabla 22. Concentración de nitrógeno en el baño del acero AISI 4130. Concentración Nitrógeno, mg/g A1-3 A2-1 A2-2 A2-3 A3-1 tiempo, min/ Muestra A1-1 A1-2 0 224,4061 219,3658 226,5408 210,1746 208,0992 214,0882 20 198,6708 202,7624 196,7733 201,3392 198,1371 202,8217 40 191,0807 195,5280 196,8326 168,4883 173,0542 60 152,1221 155,3834 151,2326 137,8906 80 139,5509 138,1278 137,4755 125,3195 100 108,8940 122,9476 123,5998 94,6625 A3-2 A3-3 223,8131 213,4360 214,8591 214,9777 203,4739 203,5925 169,9707 164,3374 162,9736 164,8118 144,1169 138,7801 151,5291 149,4537 139,5509 126,8612 125,0230 138,9580 132,1980 125,7939 111,6810 111,1473 90,5117 99,2285 85,6493 Concentración N, mg/g 250 200 150 100 50 0 0 50 100 150 Tiempo, min CN(A1) = -1,0706t + 224,71 R2 = 0,9717 CN (A2) = -1,1145t + 214,7 CN(A3) = -1,2431t + 222,11 R2 = 0,9831 R2 = 0,9709 Figura 12. Cinética de consumo de nitrógeno para el acero AISI 4130. Tabla 23. Concentración de nitrógeno el baño del acero AISI 4340. tiempo, min/ Muestra C1-1 C1-2 Concentración Nitrógeno, mg/g C1-3 C2-1 C2-2 C2-3 C3-1 C3-2 C3-3 0 212,3333 211,5944 211,3611 198,1371 217,1717 199,0266 216,6381 220,3145 207,1504 20 181,3389 184,0093 185,1759 176,9678 172,1647 177,6794 168,6069 165,8792 163,3886 40 159,1852 157,8241 160,1574 150,9361 148,9793 151,1140 147,0225 145,1842 143,1681 60 147,4537 147,8426 148,1019 143,2274 136,1117 137,0011 132,5538 128,9959 125,1416 80 118,4167 122,5648 125,9352 119,9827 119,4490 122,9476 109,3091 112,3333 111,0880 100 116,4722 115,1111 117,1204 111,8589 109,7835 106,5221 101,1853 102,6677 94,6625 35 Concentración N, mg/g 250 200 150 100 50 0 0 50 100 150 Tiempo, min CN (C1) = -0,9607t + 204,81 R2 = 0,9707 CN(C2)= -0,9328t + 196,59 R2 = 0,9691 CN(C3)= -1,0819x + 198,28 R2 = 0,9328 Figura 13. Cinética de consumo de nitrógeno para el acero AISI 4340. Tabla 24. Velocidad de reacción obtenida para consumo de nitrógeno. Acero A A1-1 A1-2 A1-3 A2-1 A2-2 A2-3 A3-1 A3-2 A3-3 Vr, mg/g min -1,1341 -1,0231 -1,0546 -1,1946 -1,0355 -1,1133 -1,2962 -1,1406 -1,2924 Acero C Vr, mg/g min C1-1 -0,9711 C1-2 -0,9668 C1-3 -0,9443 C2-1 -0,8715 C2-2 -1,0114 C2-3 -0,9155 C3-1 -1,099 C3-2 -1,0929 C3-3 -1,0534 3.6.4. Resultados obtenidos para la cinética de reacción de consumo de azufre. En función de la concentración de azufre obtenida en el transcurso del proceso se representa la respectiva cinética de consumo de azufre en el tratamiento termoquímico para cada muestra analizada. 36 Tabla 25. Concentración de azufre en el baño del acero AISI 4130. Azufre, mg/g muestra Tiempo, min/ Muestra A1-1 A1-2 A1-3 A2-1 A2-2 A3-3 A3-1 A3-2 A3-3 0 102,8511 104,6859 103,7685 110,3571 107,1879 108,0219 95,5119 94,8447 98,6811 20 99,8487 101,7669 98,0139 107,3547 104,2689 105,1029 92,5929 40,6347 95,6787 40 45,6387 49,8921 47,0565 53,1447 52,3941 53,2281 40,7181 60,7341 41,4687 60 65,7381 71,1591 67,4061 73,2441 73,6611 74,4951 61,9851 74,0781 61,5681 80 79,0821 83,7525 78,1647 86,5881 86,2545 87,0885 74,5785 81,5007 74,9121 100 86,5047 78,9153 80,7501 94,0107 81,4173 82,2513 69,7413 73,9947 82,3347 140 120 Azufre, mg/g 100 80 60 40 20 0 0 50 100 150 Tiempo, min R² = 0,8542 R² = 0,8533 R² = 0,9222 Figura 14. Cinética de consumo de azufre para el acero AISI 4130. Tabla 26. Concentración de azufre en el baño del acero AISI 4340. Azufre, mg/g muestra Tiempo, min/ Muestra C1-1 C1-2 C1-3 C2-1 C2-2 C2-3 C3-1 C3-2 C3-3 0 97,5969 96,4293 101,0997 103,4349 104,8527 104,4357 96,7629 94,8447 96,0957 20 96,2625 98,3475 93,1767 91,1751 97,5969 99,2649 87,0051 85,9209 92,3427 40 52,3941 49,8087 53,0613 66,5721 59,8167 69,7413 51,5601 47,3067 43,0533 60 35,5473 39,6339 38,1327 49,7253 49,6419 54,8127 34,7133 37,1319 28,1247 80 46,6395 49,6419 47,8071 60,8175 59,6499 64,4871 47,7237 47,1399 46,1391 100 65,5713 66,1551 64,5705 79,7493 76,1631 81,2505 64,7373 63,6531 54,5625 37 120 Azufre, mg/g 100 80 60 40 20 0 0 50 100 150 Tiempo, min R² = 0,9946 R² = 0,9999 R² = 0,9987 Figura 15. Cinética de consumo de azufre para el acero AISI 4340. De las figuras 14 y 15 se puede determinar el punto mínimo de cada cinética de reacción de consumo de azufre, los cuales se expresan en la siguiente tabla tanto en concentración de azufre como tiempo de sulfinización para las muestras sometidas al tratamiento. Tabla 27. Valores mínimos de azufre alcanzados en el baño de sulfinización. Muestra A1-1 A1-2 A1-3 A2-1 A2-2 A2-3 A3-1 A3-2 A3-3 PUNTO MÍNIMO Tiempo, min Cs, mg/g 40 45,6387 40 48,8921 40 47,0565 40 53,1447 40 52,3941 40 53,2281 40 40,7181 20 40,6347 40 41,4687 38 Muestra C1-1 C1-2 C1-3 C2-1 C2-2 C2-3 C3-1 C3-2 C3-3 PUNTO MÍNIMO Tiempo, Cs, min mg/g 60 35,5473 60 39,6339 60 38,1327 60 49,7253 60 49,6419 60 54,8127 60 34,7133 60 37,1319 60 28,1247 3.6.5. Valores de dureza obtenidos para los aceros AISI 4130 y 4340. En la siguiente tabla se presenta el promedio de dureza obtenida tanto para los aceros tratados como para los sin tratamiento, la dureza se expresa en dureza Rockwell superficial (HR30N) y dureza Vickers (HV). Tabla 28. Valores de dureza de aceros tratados (A y C) y sin tratamiento (B y D). Mediciones en escala Rockwell Superficial 30 N, HR30N PROMEDIO Muestra Medición Medición Medición Medición Medición HR30N Dureza 1 2 3 4 5 Vickers, HV A1 44,0000 43,0000 44,0000 43,5000 44,5000 43,8000 251,0000 A2 42,0000 43,0000 42,0000 42,5000 43,0000 42,5000 244,0000 A3 43,0000 43,0000 43,0000 43,0000 43,0000 43,0000 247,0000 B1 41,0000 43,0000 42,0000 43,0000 42,0000 42,2000 242,0000 B2 42,5000 42,0000 42,5000 41,0000 42,0000 42,0000 241,0000 B3 42,0000 41,0000 42,0000 42,0000 41,0000 41,6000 239,0000 C1 57,5000 57,5000 57,0000 57,0000 56,5000 57,1000 367,0000 C2 56,5000 57,5000 56,0000 57,5000 57,5000 57,0000 365,0000 C3 58,0000 58,5000 58,5000 58,5000 58,5000 58,4000 381,0000 D1 56,5000 55,0000 57,0000 56,0000 56,5000 56,2000 357,0000 D2 56,0000 56,5000 55,5000 57,0000 56,0000 56,2000 357,0000 D3 56,5000 56,5000 56,5000 56,5000 56,5000 56,5000 360,0000 450 400 Dureza, HV 350 300 250 200 150 100 50 0 1 2 3 Ensayo Figura 16. Comparación de dureza obtenida por los aceros posteriores al tratamiento muestras A, B, Cy D. 3.6.6. Velocidad de corrosión de aceros tratados (A y C) y sin tratamiento (B y D). En la siguiente tabla se presentan los valores encontrados para la velocidad de corrosión (Vc) obtenida para las muestras sulfinizadas y las muestras sin tratamiento, tras analizar 39 el área corroída en el ensayo de corrosión, donde se observa una gran disminución de esta variable en las muestras sulfinizadas. Tabla 29. Velocidad de corrosión de los aceros A, B, C, D. Muestras sulfinizadas A1 A2 A3 C1 C2 C3 3.6.7. Vc, mm2/año 0,8495 2,4239 1,8879 0,3838 0,5963 1,1590 t1/2, días Sin tratamiento 58,1126 67,7459 62,2543 380,3267 378,9834 374.2167 B1 B2 B3 D1 D2 D3 Vc, mm2/año 7,3215 6,0040 5,6423 2,3062 2,5880 4,4207 t1/2, días 37,7651 33,8269 35,3790 259,9346 263,9821 274,2156 Espesores de las capas obtenidas sulfinización. En la siguiente tabla se presenta el espesor del recubrimiento medido mediante una microscopía de 10X para las muestras sometidas al tratamiento termoquímico. Tabla 30. Espesores de las capas de sulfuros obtenidas. Muestra Espesor, µm Muestra A1-1 A1-2 A1-3 A2-1 A2-2 A2-3 A3-1 A3-2 A3-3 1,0460 0,7550 0,9010 1,0290 1,1850 1,1570 1,3200 1,3980 1,2610 C1-1 C1-2 C1-3 C2-1 C2-2 C2-3 C3-1 C3-2 C3-3 Espesor, µm 0,7500 0,6700 0,6290 1,9740 1,8750 2,0750 0,7980 0,9170 0,8400 3.6.8. Resumen de variables. En la siguiente tabla se presenta una comparación de las variables evaluadas de los aceros sulfinizados y los aceros sin tratamiento, presentándose el contenido de azufre, espesor de la capa sulfinizada, dureza en escala Vickers (HV) y la velocidad de corrosión. 40 Tabla 31. Resumen de resultados. Muestra A1 %S Espesor, µm Sulfinización 9,8500 0,9007 HV 251,0000 Vc, mm2/año 0,8495 A2 9,9500 1,1237 244,0000 2,4239 A3 4,5300 1,3263 247,0000 1,8879 0,0000 0,0000 242,0000 7,3215 B2 0,0000 0,0000 241,0000 6,0000 B3 0,0000 0,0000 239,0000 5,6423 C1 Sulfinización 7,8900 0,6830 367,0000 0,3838 C2 5,0400 1,9747 365,0000 0,5963 C3 8,8200 0,8517 381,0000 1,1590 0,0000 0,0000 357,0000 2,3062 D2 0,0000 0,0000 357,0000 2,5880 D3 0,0000 0,0000 360,0000 4,4207 B1 D1 3.6.9. Tratamiento Ninguno Ninguno Análisis estadístico. En las siguientes tablas se presentan los resultados obtenidos para el análisis estadístico de los resultados, presentándose en las tablas siguientes: la suma de cuadrados, los grados de libertad, la media cuadrática, el factor de Fisher (F) y la significancia (Sig). Tabla 32. Análisis estadístico de la velocidad de reacción respecto al nitrógeno. ANOVA Suma de cuadrados gl Media cuadrática F Sig. Inter-grupos Intra-grupos Total 0,1884 0,0468 0,2352 5,0000 12,0000 17,0000 0,0377 0,0039 9,6523 0,0007 Tabla 33. Análisis estadístico de datos de dureza del acero AISI 4130. ANOVA Suma de cuadrados Gl Media cuadrática F Sig. Inter-grupos Intra-grupos Total 15,4417 7,8000 23,2417 5,0000 24,0000 29,0000 3,0883 0,3250 9,5026 0,0000 41 Tabla 34. Análisis estadístico de datos de dureza del acero AISI 4340. ANOVA Suma de cuadrados gl Media cuadrática F Sig. Inter-grupos Intra-grupos Total 17,2000 6,5000 23,7000 5,0000 24,0000 29,0000 3,4400 0,2708 12,7015 0,0000 Tabla 35. Análisis estadístico de la velocidad de corrosión del acero AISI 4340. ANOVA Suma de cuadrados gl Media cuadrática F Sig. Inter-grupos Intra-grupos Total 31,7699 2,8436 34,6135 1,0000 4,0000 5,0000 31,7699 0,7109 44,6905 0,0026 Tabla 36. Análisis estadístico de la velocidad de corrosión del acero AISI 4130. ANOVA Suma de cuadrados gl Media cuadrática F Sig. Inter-grupos Intra-grupos Total 8,5820 2,9573 11,5394 1,0000 4,0000 5,0000 8,5820 0,7393 11,6077 0,0271 42 4. DISCUSIÓN En los datos obtenidos para la composición del acero mediante fluorescencia de rayos X (XRF) se encuentra una tendencia en las muestras analizadas a excepción de la muestra A3 de acero AISI 4130 sometido a sulfinización, la cual contiene cerca de la mitad del contenido de azufre presente en su estructura comparada con las muestras A2 y A1 correspondientes al mismo acero y sometidas a iguales condiciones de tratamiento, a diferencia de la etapa de enfriamiento en agua, donde se observó que la muestra presentó un debilitamiento del recubrimiento evidenciado por la pérdida de color del mismo, esto se debió a un error cometido en la temperatura de ingreso de la muestra al agua, es decir que no se alcanzó la correspondiente temperatura de enfriamiento al aire, la misma que con los recursos de experimentación no se pude controlar del todo. No se pudo determinar la velocidad de consumo de azufre como sulfatos en el baño de sulfinización, debido al modelo obtenido para la cinética (Figura 10 y 11); en el cual, el azufre en el tratamiento termoquímico al trascurrir un determinado tiempo, en los dos casos de aceros evaluados, que corresponde a un tiempo entre los 40 y 60 minutos de reacción comienza a regenerarse en el baño, lo cual se evidencia por un incremento gradual de la concentración del mismo; esto se puede deber a un tiempo óptimo de sulfinización que depende de la sal evaluada en el presente trabajo para este procedimiento (sulfato de amonio) y de las muestras sometidas al proceso, ya que el incremento de azufre en el baño puede atribuirse a un consumo del recubrimiento generado, es decir un desprendimiento de los sulfuros producidos en el material en una primera instancia del procedimiento. La corrosión en las muestras sulfinizadas A y C son producto del corte transversal realizado a las mismas, ya que el lugar del corte queda expuesto 43 dando paso a la formación de una celda galvánica producto de la diferencia de potencial en las dos partes del material, provocando una reacción de oxidación en la parte anódica del mismo, particularmente los límites entre la capa sulfinizada y el acero expuesto. Este corte transversal fue realizado por un ajuste del tamaño de las muestras al procedimiento aplicado. Los resultados obtenidos para el espesor de la capa sulfinizada presentan una gran varianza entre muestras analizadas, por causa del método aplicado para la medición del mismo ya que se hizo uso de un microscopio para muestras observadas mediante transparencia, ajustándolo con luz perpendicular para lograr observar el corte transversal del recubrimiento, en lugar de un microscopio electrónico para metales el cual es el apropiado para este fin. Dentro de los compuestos característicos de la sulfinización se encuentra principalmente la pirita (FeS2), como es el caso de la sulfinización con azufre gaseoso, en la experimentación realizada en el presente trabajo se obtuvo pirrotita (Fe(1-x)S), en lugar de pirita, por lo tanto la relación de azufre/hierro obtenida fue menor que por otros métodos aplicados para este fin ya que existe menor cantidad de azufre por cada átomo de hierro (Pirrotita: 36%-42%, Pirita: 54%). 44 5. CONCLUSIONES Verificación de presencia de sulfuros. Los resultados obtenidos por difracción de rayos X (Anexo A) verifican la presencia de sulfuros en la matriz de hierro, como pirrotita (Fe1-xS), que forma parte de los compuesto característico de la sulfinización como sulfuro de hierro, por lo tanto el porcentaje de azufre con relación al hierro a la temperatura de trabajo, debió ser de 38% aproximadamente para obtener dicho compuesto, según el diagrama de fases Fe-S. Este resultado se verifica por el análisis de fluorescencia de rayos X, donde se evidencia la presencia de azufre en las muestras sulfinizadas en comparación a las muestras sin tratamiento, las cuales no presentan azufre en su composición. Los espectros infrarrojos obtenidos de la capa sulfinizada de ambos aceros permiten establecer una similitud con la composición química de los aceros sometidos al tratamiento comercialmente, los cuales se aplicaron como patrón comparativo en la experimentación realizada. Cinética de reacción del tratamiento termoquímico. La cinética obtenida en el proceso para consumo de azufre presenta un valor mínimo de concentración de azufre a un tiempo determinado para cada acero, y posterior a esto la concentración del mismo incrementa nuevamente, lo cual indica que la capa obtenida en el acero en una primera instancia del proceso se consume al transcurrir un determinado tiempo de tratamiento; por lo tanto se establece a partir de este ensayo un tiempo óptimo de sulfinización para cada acero siendo de 40 y 60 minutos para el acero AISI 4130 y AISI 4340 respectivamente. 45 El consumo de nitrógeno, medido como amoniaco, en el baño sulfinizante, fue evaluado a través de una cinética de reacción ajustándose a un modelo lineal, es decir una reacción de orden cero, donde las velocidades de reacción de consumo de nitrógeno al compararse entre los aceros analizados (AISI 4130 y AISI 4340) mediante el factor de Fisher el cual fue mayor que 1, lo cual rechaza la hipótesis nula de que las velocidades de reacción para ambos aceros es igual, por lo tanto la velocidad de reacción en el proceso de sulfinización para el acero AISI 4130 es mayor en promedio (1,1427 mg/gmin) que la correspondiente al acero AISI 4340 la cual en promedio es de (0,9917 mg/gmin). Evaluación de la dureza y resistencia a la corrosión. La dureza superficial de los aceros sometidos a sulfinización con sulfato de amonio presentaron una mejora de esta propiedad con un incremento en promedio del 2,7% y 3,5% para el acero AISI 4130 y 4340 respectivamente en comparación a los aceros sin tratamiento, como lo establece el estadístico F donde se acepta la hipótesis alterna, la cual indica que la sulfinización mejora la dureza del material, encontrándose además que en el caso del acero AISI 4340 existe una relación directa entre el contenido de azufre en el material y la dureza superficial adquirida por el mismo. La resistencia a la corrosión de los aceros al someterse al tratamiento de sulfinización con sulfato de amonio mejoró notablemente, evidenciándose a través de la velocidad de corrosión la cual fue mayor en los aceros sin tratamiento, en función del estadístico de Fisher (F= 44,7 para AISI 4340 y F=11,6 para AISI 4130) se puede deducir que el mejoramiento de la resistencia a la corrosión del acero AISI 4340 fue mayor que la del acero AISI 4130. Influencia del tipo de acero en la formación y eficacia de la capa sulfinizada. En función del porcentaje de azufre adquirido por los materiales analizados se puede concluir que el acero AISI 4130 recepta mejor el azufre en su matriz (8,11% en promedio) que el acero AISI 4340 (7,25% en promedio), debido a que presenta un menor contenido de carbono. 46 El acero AISI 4340 desarrolló un mejoramiento en su dureza superficial (3,5%) al compararlo con la muestra sin tratamiento del mismo acero, mayor que el acero AISI 4130 (2,7%), por lo tanto el contenido de azufre no se ve reflejado en esta variable. El acero AISI 4130 sulfinizado (Vc=1,72 mm2/min) desarrolló un mejoramiento en su resistencia a la corrosión, al compararlo con la muestra sin tratamiento del mismo acero alcanzando un incremento de su vida útil del 75,13%, mayor que el acero AISI 4340 sulfinizado (Vc= 0,7130 mm2/min) el cual incremento su tiempo de vida útil en un 43,14% por lo tanto la incidencia del contenido de azufre en el metal no se refleja en esta variable. 47 6. RECOMENDACIONES La preparación superficial previa a la sulfinización tiene incidencia en la formación de la capa sulfinizada, por lo que se recomienda analizar la eficiencia del procedimiento al incorporar una limpieza superficial con ácido nítrico, el cual según bibliografía activa la superficie facilitando el proceso de sulfinización. En función de la cinética obtenida para el consumo de azufre en el proceso se recomienda hacer la evaluación de las propiedades adquiridas por el material al disminuir el tiempo de reacción en el baño de sulfinización, para inhibir el consumo de la capa de sulfuros obtenida. La incorporación del uso de un microscopio de barrido electrónico en el presente estudio nos permitiría la caracterización superficial del recubrimiento obtenido y el uso de un microscopio electrónico de transmisión (TEM) permitiría analizar la incidencia del contenido de azufre en el espesor de la capa formada. 48 7. CITAS BIBLIOGRÁFICAS [1] JUVERT A. La corrosión un problema económico y de seguridad. [En línea]. Buenos Aires: Facultad de Ingeniería, Universidad Nacional de la Plata, 2010. [Fecha de consulta: 18 Marzo 2016]. Disponible en: <http://www.ing.unlp.edu.ar/quimica/.>. [2] VELEZ Moreno, Ligia. Materiales Industriales. Editorial iTM, Medellín, 2008. pp. 145-146. [3] DOMINGUEZ, Esteban y FERRER, Julian. Mecanizado básico. Editorial Editex, Madrid, 2010. pp. 146-147 [4] FERRERO, Lisandro, Procesos Termoquímicos de Endurecimiento Superficial, Editorial Laruti, Buenos Aires, 2012. pp. 23-24. [5] Loc. Cit. [6] MIKIO, Obayashi y NAOYOSHI, Watanabe. Method for sulfurizing cast iron. US 4,230,507A (Cl. C22C), 28 Oct. 1980. Appl. 06/041,309, 22 May. 1978. 8 p. [7] LOBDILL, Jerry. Some Physical Chemistry Aspects of Thermite, Thermate, IronAluminium-Rich Microspheres the Eutectic, and the Iron-Sulfur System as Appplied to the Demise of Three World Trade Center Buildings. [En línea]. New York: Vanguard News Networks, 2007. [Fecha de consulta: 10 marzo 2016]. Disponible en: <http://vnnforum.com/showthread.php?t=143205>. [8] KLEIN,Cornelis y HURBULT, Cornelius. Manual de Minerología. Editorial Reverté, Barcelona, 2003. pp. 395-396 [9] GÉMEZ, Thomás y AGUEDA, Eduardo. Mecanizado básico para electromecánicca. Editorial Paraninfo, Madrid, 2011. p. 88 [10] BROWN, Theodore y LEMAN, Eugene. Química. Novena Edición. Editorial Pearson, México, 2004. p. 105 [11] GÓMEZ, Félix, Manual básico de corrosión para ingenieros. Editorial Servicio de publicaciones. Universidad de Murcia, Murcia, 2004. p.51 49 BIBLIOGRAFÍA BRUHL, S. et al. Nitruración iónica de aceros inoxidables endurecidos por precipitación. Revista Latinoamericana de Metalurgia y Materiales, S1 (4): 15591565, julio 2009. CORREA, Fabel et al. Mejoramiento de la resistencia a la corrosión del acero AISI 4140 utilizando multicapas de titanio/nitruro de titanio. Rev. Facultad de Ing. Univ. de Antioquia, (46): 7-14, diciembre 2008. CUBERO, Luna. Tratamientos termoquímicos. Revista digital para profesionales de la enseñanza, (14): 2-10, mayo 2011. DOMINGUEZ, Esteban y FERRER, Julian. Mecanizado básico. Editorial Editex, Madrid, 2010. MIKIO, Obayashi y NAOYOSHI, Watanabe. Method for sulfurizing cast iron. US 4,230,507A (Cl. C22C), 28 Oct. 1980. Appl. 06/041,309, 22 May. 1978. 8 p. NORMA INEN, Determinación de la dureza Rockwell superficial. NTE INEN 1053. SÁNCHEZ, Jesús. Estudio del comportamiento al desgaste de un acero inoxidable AISI 416 nitrurizado para aplicación en obturadores de válvulas. Trabajo de Grado. Ingeniero Mecánico. Instituto Politécnico Nacional. Facultad de Ingeniería Mecánica. México D.F. 2010. SEVERICHE, Carlos et al. Manual de métodos analíticos para la determinación de parámetros fisicoquímicos básicos en aguas. Editorial Fundación Universitaria Andaluza Inca Garcilaso, Cartagena de Indias, 2013. 50 ANEXOS 51 ANEXO A. Análisis de difracción de rayos X de muestra patrón. Figura A 1. Análisis de rayos X de acero sulfinizada, entregado por la empresa PROINSTRA S.A. Difractograma de la muestra , modelación del difractograma en función de minerales identificados , diferencia entre el difractograma y la modelación , Pirrotita , Magnetita , Nitracina 52 ANEXO B. Proceso de sulfinización Figura B1. Baño de sulfinización 53 ANEXO C. Ensayos de composición Figura C1. Espectrómetro infrarrojo (FTIR). Figura C2. Materiales para formar la pastilla de KBr. Figura C3. Pistola de Fluorescencia de rayos X. 54 ANEXO D. Análisis de cinética de reacción. Figura D1. Muestras del baño de sulfinización en el tiempo del acero AISI 4130. Figura D2. Espectrofotómetro UV-VIS. 55 ANEXO E. Evaluación de propiedades del recubrimiento Figura E1. Durómetro Rockwell Figura E2. Equipo de Wheel test. 56 Figura E3. Muestras de acero AISI 4130 previo al ensayo de corrosión. Figura E4. Muestras de acero AISI 4130 posterior al ensayo de corrosión. Figura E5. Muestras de acero AISI 4340 antes y después del ensayo de corrosión. 57 ANEXO F. Ensayo de Microscopia. Figura F1. Microscopía (10X) del recubrimiento. Figura F2. Diagrama del equipo usado para registro del espesor de la capa sulfinizada. 58