I° medio Modulo aprendizaje reacciones
Anuncio
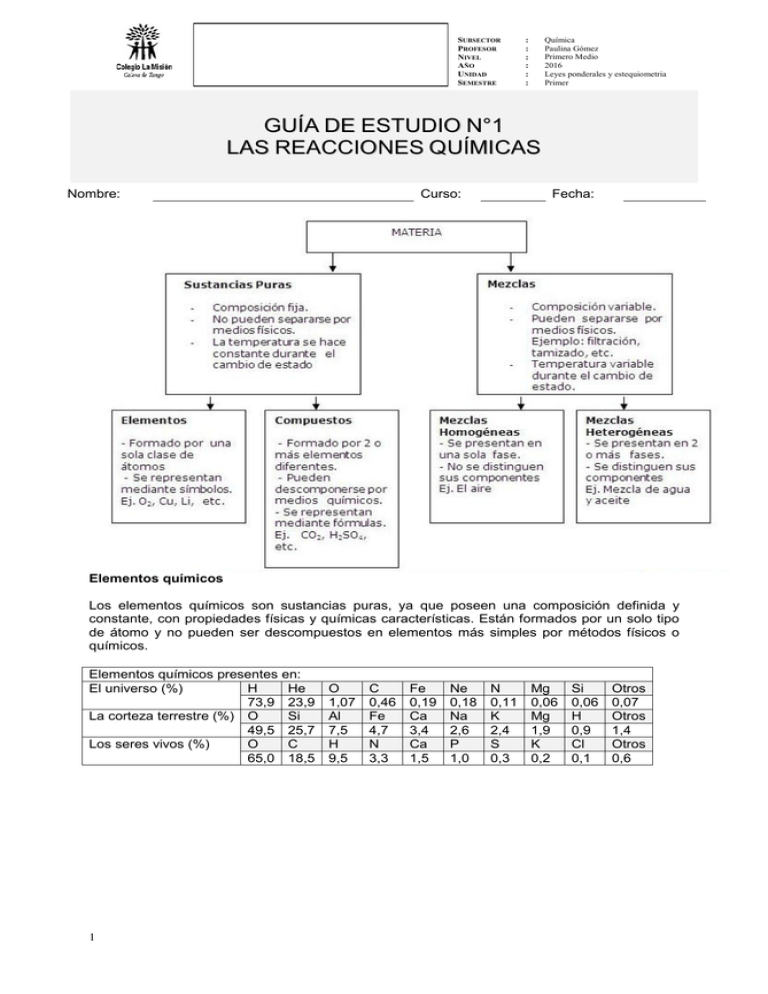
SUBSECTOR PROFESOR NIVEL AÑO UNIDAD SEMESTRE Química Paulina Gómez Primero Medio 2016 Leyes ponderales y estequiometria Primer : : : : : : GUÍA DE ESTUDIO N°1 LAS REACCIONES QUÍMICAS Nombre: Curso: Fecha: Elementos químicos Los elementos químicos son sustancias puras, ya que poseen una composición definida y constante, con propiedades físicas y químicas características. Están formados por un solo tipo de átomo y no pueden ser descompuestos en elementos más simples por métodos físicos o químicos. Elementos químicos presentes en: El universo (%) H He 73,9 23,9 La corteza terrestre (%) O Si 49,5 25,7 Los seres vivos (%) O C 65,0 18,5 1 O 1,07 Al 7,5 H 9,5 C 0,46 Fe 4,7 N 3,3 Fe 0,19 Ca 3,4 Ca 1,5 Ne 0,18 Na 2,6 P 1,0 N 0,11 K 2,4 S 0,3 Mg 0,06 Mg 1,9 K 0,2 Si 0,06 H 0,9 Cl 0,1 Otros 0,07 Otros 1,4 Otros 0,6 Compuestos químicos Al igual que los elementos químicos, los compuestos químicos son sustancias puras, ya que poseen una composición definida y constante, con propiedades físicas y químicas características. Estos están formados por átomos de dos o más elementos unidos mediante enlaces químicos, en proporciones definidas. Pueden ser descompuestos en sustancias más simples por métodos físicos o químicos. Compuestos químicos más comunes Fórmula Nombre Características química H2O Agua Líquido esencial para los seres vivos, es un disolvente de amplio uso. CO2 Dióxido de Gas que se produce en las reacciones de combustión, por carbono ejemplo, en la respiración. HCl Ácido Se secreta en el estómago para realizar la digestión. En el clorhídrico ámbito industrial se utiliza para limpiar metales NaOH Hidróxido de Forma parte de algunos productos de limpieza. Sirve para sodio limpiar cañerías. NaCl Cloruro de Conocido como sal común. En su forma mineral se conoce sodio como halita. C4H10 Butano Componente del gas licuado C6H12O6 Glucosa Es un azúcar simple que se sintetiza mediante la fotosíntesis. En la tabla periódica se conocen 118 elementos químicos, pero el número de compuestos que existen supera los 10 millones. LAS REACCIONES QUÍMICAS Transformaciones de la materia: Cuando se produce un cambio físico en la materia no varía la naturaleza de las sustancias, ya sea estén constituidas por elementos o compuestos; tampoco se originan sustancias nuevas, sino que solo cambia la forma del estado de agregación de ellas. Ejemplos de estas transformaciones son los cambios de estado. Si se produce un cambio químico, una o más sustancias se transforman en otra u otras sustancias que poseen propiedades diferentes a las de las sustancias iniciales. A los cambios químicos se les denomina reacciones químicas que consisten en la combinación de elementos o compuestos para formar nuevas sustancias o en la descomposición de compuestos en sus elementos u otras sustancias: Esto necesariamente implica la ruptura de algunos enlaces entre los átomos y la generación de otros. Una reacción química se reconoce por: o Un cambio de color. o La formación de un sólido o precipitado en una disolución. o El desprendimiento de un gas en forma de burbujeo en una disolución. o El desprendimiento o absorción de calor, manifestado por el cambio de temperatura en el recipiente de reacción. Sin embargo en algunas reacciones químicas no aparece ninguno de estos signos. Para que se produzca una reacción química debe existir un intercambio de energía con el entorno, por lo general, esta energía es energía calórica. Así las reacciones químicas se pueden clasificar como endergónicas y exergónicas. 2 Representación de las reacciones químicas Se representan con ecuaciones químicas, las que relacionan las cantidades relativas de reactantes o reactivos, que corresponden a las sustancias que reaccionan, con los productos, que son las sustancias que se generan. Loe elementos y compuestos que participan en una reacción química se representan por sus símbolos y fórmulas químicas, respectivamente, agregando además el estado físico. La flecha, →, que separa a los reactantes de los productos indica el sentido en que la reacción se desarrolla. En este caso la flecha tiene solo un sentido; por lo tanto, indica que la reacción es irreversible. La ecuación química debe estar balanceada, es decir, tiene que haber el mismo número de átomos a ambos lados de ella, pues debe cumplir la ley de conservación de la masa. Para lograr el equilibrio se agregan los llamados coeficientes estequiométricos delante de la fórmula o símbolo de cada sustancia. La energía en las reacciones químicas En una reacción química suceden intercambios de energía potencial con el medio ambiente. Para romper un enlace se necesita energía y al formarse un enlace se libera energía. Si la energía de los reactantes es menor que la de los productos, la reacción solo ocurre si se le suministra energía. En este caso, la reacción se denomina endergónica. Si la energía de los reactantes es mayor que la de los productos, la reacción que se produce libera energía. En este caso, la reacción se denomina exergónica. 3 Ejemplos: Síntesis o formación de agua: 2H2 (g) + O2 2 H2O (l) + energía (g) Descomposición de agua: 2 H2O (l) + energía 2H2 (g) + O2 (g) Clasificación de las reacciones químicas 1) Reacción de síntesis: cuando dos sustancias se unen para dar una: A+B→ C Por ejemplo: 2Fe +O2 → 2FeO CaO+H2O → Ca(OH)2 CaO+CO2 → CaCO3 2H2+O2 → 2H2O 2) Reacción de descomposición: justo al contrario que la anterior, una sustancia se descompone en varias: A → B+C Por ejemplo: H2CO3 → CO2+H2O K ClO3 → K Cl+O2 3) Reacción de sustitución: Un átomo de un compuesto sustituye a un átomo de otro. Los productos de esta reacción son un nuevo elemento y un compuesto distinto. AB + X → XB + A Por ejemplo: 2HCl +Zn → Zn Cl2 + H2 CuSO4+Zn → ZnSO4+Cu Cl2+ NaBr → NaCl +Br2 4) Doble descomposición o doble sustitución (metátesis): Son aquellas en que los iones en solución acuosa de dos compuestos intercambian sus posiciones y generan nuevos compuestos. AB Por ejemplo: + XY → AY + XB AgNO3+ NaCl → NaNO3 + AgCl HCl + NaOH → NaCl + H2O ¿Cómo ocurre una reacción química? Teoría de las colisiones Esta teoría considera que las moléculas son partículas que chocan continuamente. Postula que para que dos o más átomos o moléculas reaccionen y se produzca una reacción, es imprescindible que ocurran choques efectivos entre los reactantes con una orientaciòn adecuada y una mìnima energía. Sin embargo, solo existen algunos choques que son efectivos. 4 Para que las colisiones sean efectivas se deben cumplir tres requisitos fundamentales: • Solo pueden ser efectivas las colisiones que ocurren entre las partículas de los reactivos. • Deben ocurrir entre moléculas que tengan una orientación o disposición geométrica adecuada, de lo contrario rebotan. • Las partículas deben chocar con una energía mínima ( energía de activación) La velocidad de las reacciones químicas: La velocidad de una reacción química se define como la variación de la concentración de uno de los productos o la disminución de uno de los reactantes en una unidad de tiempo. ¿Qué factores influyen en la velocidad de una reacción? Se ha observado experimentalmente que la velocidad de las reacciones químicas aumenta: • Al elevar la temperatura del sistema. • Al incrementar la concentración de los reactantes. • Al aumentar la superficie de contacto de un sólido. • Por la presencia de un catalizador. 5 ACTIVIDADES: (Responder en el espacio en blanco asignado) 1.-Responde en tu cuaderno las siguientes preguntas: a) ¿Qué es una molécula? b) ¿Qué es un compuesto? c) ¿Qué es un elemento químico? d) ¿En qué se diferencia un átomo de una molécula? e) ¿En qué se diferencia un elemento químico de un compuesto? f) ¿Qué es una fórmula química y qué datos sacamos a partir de ella? g) ¿Qué es un cambio químico? h) ¿Cómo se reconoce la presencia de un elemento químico en una fórmula química? i) ¿Cuántos y cuáles elementos existen en una molécula de CoF2? Fundamenta tu respuesta. 6 j) ¿Cuántos y cuáles elementos existen en una molécula de Al(OH)3? Fundamenta tu respuesta. k) ¿Qué representa una ecuación química y cuáles son sus partes más importantes? l) ¿en qué consiste el balance de ecuaciones y para que se realiza? 2.-Equilibra y clasifica (línea punteada) las reacciones químicas que se indican a continuación: 1.- S8 + O2 → SO3 ………………… 2.- Na + Cl2 → NaCl ………………… 3.- Mg + O2 → MgO ………………… 4.- H2 + Br2 → HBr ………………… 5.- CO + O2 → CO2 ………………… 6.- Al2O3 + H2O → Al(OH)3 ………………… 7.- P4 + O2 → P2O3 ………………… 8.- Cl2 + O2 → Cl2O ………………… 9.- HgO → Hg + O2 ………………… 10.- CaCO3 → CaO + CO2 ………………… 11.- AgCl → Ag + Cl2 ………………… 12.- C6H12O6 + O2 → CO2 + H2O ………………… 13- C7H16 + O2 → CO2 + H2O ………………… 14.- C5H10 + O2 → CO2 + H2O ………………… 15.- CH4 + O2 → CO2 + H2O ………………… 16.- Al4C3 + H2O → Al(OH)3 + CH4 ………………… 7 17.- FeBr3 + H2SO4 → Fe2(SO4 )3 + HBr ………………… 18.- Mg + CO2 → MgO + C ………………… 19.- B2O3 + C → B4 C3 + CO2 ………………… 20.- NaOH + FeSO4 → Fe(OH)2 + Na2SO4 ……………… 21 K2CrO4 + Ba(NO3)2 → BaCrO4 + KNO3 ………………… 22.- Mg(OH)2 + ( NH4 )3PO4 → Mg3 (PO4 )2 + NH3 + H2O …………… 23.- CaCO3 + H3PO4 → Ca3(PO4 )2 + CO2 + H2O …………… Química en la web: link para balancear ecuaciones químicas: http://balanceoecuaciones.blogspot.com/ Química en la web: link para encontrar información sobre reacciones químicas, estequiometría y balance de ecuaciones químicas http://www.lamanzanadenewton.com/materiales/aplicaciones/lrq/lrq_index.html 3.- Responde las siguientes preguntas en el espacio en blanco asignado : A) Observa la siguiente ecuación y escribe toda la información que puedas obtener de ella. C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g) + calor y luz B) En un matraz se hicieron reaccionar trozos de piedra caliza con ácido clorhídrico. Se obtuvo cloruro de calcio, dióxido de carbono y agua. La ecuación de esta reacción es la siguiente: CaCO3 (s) + 8 2HCl(ac) CaCl2 (ac) + CO2(g) + H2O(l) Durante el experimento de la reacción anteriorse midió, a intervalos regulares de tiempo, la masa total de los reactantes más los productos en dos condiciones: i) Con el matraz abierto. ii) Con el matraz cerrado. Observa la figura siguiente y señala cuál de estos gráficos muestra los resultados de este experimento en la forma i) e II). Justifica tu respuesta. Forma I): Forma II): 9







