infraestructura - Organización Panamericana de la Salud. Bolivia
Anuncio

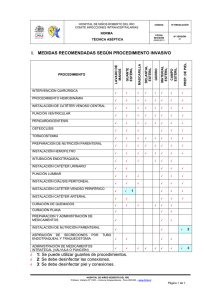
Diagnóstico de laboratorio DIAGNOSTICO DE LABORATORIO Esther Damiani Elizabeth Torrico Patricia Rosales Resumen El trabajo de laboratorio es fundamental en el diagnóstico de infecciones asociadas a servicios de salud (IASS), tanto para apoyar y confirmar el diagnóstico clínico como también para determinar el perfil de resistencia antimicrobiana de los patógenos. Ambos tipos de información fortalecen los programas de prevención y control de IASS. Por otro lado el aislamiento e identificación de los patógenos y el establecimiento del perfil de resistencia permiten definir protocolos para el uso prudente y adecuado de antimicrobianos. INFRAESTRUCTURA La infraestructura del laboratorio es determinante para garantizar la calidad del trabajo. Las instalaciones deben cumplir normas de seguridad física, instalaciones de agua, electricidad y gas a la vista y en buenas condiciones. Se debe prever que el laboratorio debe contar con áreas separadas según la siguiente descripción: a) Área de información y entrega de resultados b) Área de toma de muestra 243 Vigilancia, prevención y control de infecciones asociadas a servicios de salud c) Área análisis - procesamiento de muestras biológicas d) Área de preparación de medios de cultivo y reactivos e) Área de disposición de material contaminado f) Almacén de reactivos y medios de cultivo g) Baño y vestidor El ingreso de pacientes y personas ajenas al laboratorio debe estar restringido a las áreas (a) y (b); se deben contar con señalización. Desde el punto de vista de bioseguridad también se pueden dividir en: a) Áreas libres: Que son las áreas donde pueden circular paciente y/o visitantes, correspondiente a información, recepción, y toma de muestra. b) Áreas limitadas: De ingreso restringido para pacientes y visitantes, corresponde al laboratorio donde se realizan los procedimientos. c) Área restringida: Dentro de los ámbitos del laboratorio corresponde a áreas estériles, por ejemplo el espacio de preparación de medios de cultivo, esterilización de material; también se puede asignar como área restringida al cubículo de procesamiento de muestras biológicas. BIOSEGURIDAD Los laboratoristas se encuentran bajo riesgo de entrar en contacto con patógenos que pueden ocasionar infecciones que varían desde infecciones inaparentes hasta infecciones severas y potencialmente fatales. Se definen como infecciones adquiridas en el laboratorio aquellas que son ocasionadas por el hecho de trabajar en el laboratorio, sin importar su grado de severidad. Los patógenos con los que entran más frecuentemente en contacto son M. tuberculosis, Salmonella spp., Shigella spp., y los virus de la Hepatitis C y B. Sin embargo, en los EE.UU. el 40% de las infecciones contraídas en el laboratorio son causadas por Rickettsia spp., siendo Coxiella burnetti responsable del 95% de dichas infecciones, lo que muestra la mayor infectividad de algunos organismos a pesar de su baja frecuencia de ocurrencia. Entre las causas bacterianas más comunes de infecciones adquiridas en el laboratorio se encuentran Salmonella typhi, Brucella melitensis y Chlamydia spp., mientras que entre las infecciones virales predominan aquellas causadas por los virus Hanta y los arbovirus. 244 Diagnóstico de laboratorio Actividades que pueden provocar infecciones adquiridas en el laboratorio Algunas de las actividades propias al trabajo de laboratorio pueden aumentar el riesgo de contraer una infección de laboratorio. Se destacan entre ellas las siguientes rutas de posible contacto: Inhalación El proceso de mezclar, triturar, centrifugar especimenes clínicos puede generar aerosoles. Ingestión Las siguientes acciones pueden producir infección por esta vía: • Contacto mano-boca subconsciente. • Inserción de objetos contaminados a la boca (lápices, dedos). • Ingestión de comida en el lugar de trabajo o la falta de lavado de manos antes de comer o fumar. • Pipeteo con la boca. Inoculación La inoculación parenteral de material infectado puede ocurrir a causa de accidentes cuando se manejan agujas, bisturís y objetos rotos de vidrio. Por lo tanto, todo laboratorio debe desechar agujas y objetos punzantes en contenedores especiales para disminuir el riesgo de inoculación accidental. Contaminación de la piel y de las mucosas El salpicado con líquidos contaminados hacia las membranas mucosas de los ojos, nariz y boca puede ocasionar infecciones. Para reducir el riesgo de contacto es necesario acatar las normas generales de bioseguridad y las recomendaciones para la disposición del material contaminado y para el comportamiento del personal de laboratorio. NORMAS GENERALES DE BIOSEGURIDAD • No se permite el ingreso al laboratorio a personas ajenas al mismo. • No se permite: comer, beber, fumar o aplicarse cosméticos en áreas de trabajo. 245 Vigilancia, prevención y control de infecciones asociadas a servicios de salud • Evitar el pipeteado con la boca, para ello se debe emplear pro pipetas. • Las superficies de los mesones deben ser descontaminadas diariamente, antes de iniciar el trabajo y al terminar el mismo. • En caso de contaminación accidental se debe desinfectar inmediatamente con: Hipoclorito de Sodio - Solución al 0,5 % (de lavandina comercial) para uso cotidiano y Solución 1 % para casos de contaminación de magnitud importante. • Todos los procedimientos deben realizarse cuidadosamente para minimizar la formación de aerosoles además en gabinete cerrado y bajo la protección del mechero de gas. • Después de procesar muestras y al dejar el laboratorio, el personal se debe lavar las manos cuidadosamente con agua y jabón. • El uso de mandil, guantes, gorro y barbijo en el laboratorio es imprescindible para evitar la contaminación de las prendas personales. • En caso de salir del laboratorio para asistir a reuniones dentro de la misma institución o asistir al comedor se deberá usar otro mandil destinado para tal efecto . Normas de disposición del material contaminado • Todo el material de vidrio empleado, con medios de cultivo, muestras u otros líquidos o materiales biológicamente activos, deben ser sometidos a esterilización en Autoclave a 121º C por 30 minutos. • Después de este procedimiento, se puede lavar y esterilizar para ser reutilizado. • En el caso de recipientes no autoclavables, que contengan material bioactivo, este material debe ser sometido durante una hora a solución 1% de Hipoclorito de Sodio (preparado diariamente), antes de ser desechado y lavado el recipiente. • Siempre se debe usar jeringas descartables, las mismas que deben ser adecuadamente desechadas de acuerdo a normas generales. • Los mandiles, toallas, etc. deben ser sometidos a la acción del hipoclorito de sodio antes de ser lavados con detergente. 246 Diagnóstico de laboratorio Normas para el personal del laboratorio • El personal del laboratorio debe usar mandil, guantes, gorro, lentes de protección y bata de laboratorio para todos los procedimientos. • Las damas deberán recoger el cabello para evitar contaminarlo durante los procedimientos. • En el caso de manipulación de muestras que impliquen riesgo de Nivel III deberán usar barbijo. • Lavarse las manos después de los análisis y antes de salir del laboratorio. • El personal auxiliar debe ser instruido sobre los procedimientos de bioseguridad para evitar infectarse. Bioseguridad en el transporte de muestras dentro del hospital o institución El transporte interno de la muestra incluye la transferencia de especímenes de la consulta médica, bloque operatorio o sala del hospital al laboratorio dentro de la propia instalación; de un hospital o de un punto de toma de muestra periférico a un laboratorio de diagnóstico centralizado; o de un laboratorio a otro. El cuidado que se debe tener con los tubos o recipientes que contienen las muestras es que deben depositarse y ser transportados en gradillas de seguridad de tal forma que mantenga su posición vertical y no deben ser llevados en la mano o sueltos; más bien se los debe situar en una gradilla dentro de un contenedor de transporte que pueda retener fugas o derrames y asegurar una protección adicional. Si es posible el contenedor de transporte debe tener en la base papel absorbente humedecido con un desinfectante (lavandina al 0.5%). El personal que lleva las muestras al laboratorio debe estar conciente de que se tratan de muestras potencialmente infecciosas por lo tanto debe tener conocimiento de las normas básicas de bioseguridad. Rol del laboratorio de microbiología en el control y prevención de las infecciones hospitalarias. El laboratorio de Microbiología tiene un rol muy importante en dos tipos de actividades: Apoyo del programa de control de infecciones y la protección del personal de laboratorio para evitar que contraigan una infección de laboratorio. 247 Vigilancia, prevención y control de infecciones asociadas a servicios de salud Entre las actividades del primer grupo se incluyen las siguientes: • Participación, a todo nivel, en las actividades de control de infecciones en el hospital principalmente a través del comité de control de infecciones • Aislamiento e identificación de los patógenos responsables de infecciones. • Elaboración del reporte del perfil microbiológico del hospital (distribución de gérmenes) • Caracterización de los patrones de susceptibilidad de dichos patógenos • Elaboración del reporte anual del perfil antimicrobiano del hospital (tasas de resistencia) • Reporte, en un lapso de tiempo apropiado, de los datos de laboratorio pertinentes al programa de control de infección • Ejecución de estudios ambientales en áreas de mayor riesgo, en aquellas pocas situaciones, donde dicha información es pertinente • Estudio de brotes epidémicos intrahospitalarios • Detección de portadores entre el personal médico y no médico • Control microbiológico de la efectividad de la desinfección y esterilización • Estudios de aguas y alimentos • Estudio de material estéril, instrumental y soluciones desinfectantes Uno de los papeles importantes que juega el laboratorio de Microbiología es el campo epidemiológico. La epidemiología hospitalaria se ocupa de las infecciones hospitalarias y de sus determinantes. El proceso de describir y definir la ocurrencia de infecciones nosocomiales, identificar a los reservorios o causas, las rutas de transmisión, los pacientes afectados y los factores asociados permite precisamente desarrollar procedimientos para controlar y prevenir dichas infecciones. Un primer paso en este proceso es el de distinguir entre infecciones que son endémicas y aquellas que son epidémicas. Los esfuerzos del programa de control de infecciones tratan de disminuir ambos tipos de ocurrencias. Los brotes epidémicos pueden ser controlados por medidas de control de infección, razón por la cual toda ocurrencia temporal de un grupo de infecciones 248 Diagnóstico de laboratorio similares debe ser analizada con este objetivo en mente. Se define un brote epidémico como la ocurrencia de un número mayor de infecciones de un tipo determinado dentro de un hospital. Por lo general, dicho brote ocurre durante un periodo de tiempo definido y afecta a una población específica dentro del hospital. RECOLECCION Y TRANSPORTE DE MUESTRAS EN INFECCIONES INTRAHOSPITALARIAS El objetivo fundamental de los cultivos bacteriológicos es aislar el o los agentes etiológicos de una probable infección asociada a servicios de salud, con el fin de apoyar al médico clínico en la confirmación diagnóstica y orientar el uso racional de antibióticos en el tratamiento del paciente. Por otra parte, hay que resaltar que para tener un diagnóstico etiológico preciso es necesario la elección y recolección apropiada de la muestra. Todo resultado emitido por el laboratorio de bacteriología dependerá de la calidad de la muestra recibida o recolectada; además si la muestra recolectada es conservada en forma incorrecta o enviada fuera de los tiempos establecidos, llevará a resultados confusos ya que no permitirá recuperar al verdadero agente etiológico de un proceso infeccioso, y a su vez, un diagnóstico equivocado puede conducir al empleo erróneo y/o innecesario de agentes antimicrobianos. Por lo tanto, aquel personal de salud involucrado en la recolección de muestras, debe tener conocimiento de los procedimientos así como emplear las conductas adecuadas en las normas establecidas para este fin. Es importante recalcar que toda recolección de muestra debe realizarse ANTES DE LA ADMINISTRACION DE ANTIMICROBIANOS; de no ser posible es necesario esperar por lo menos, 48 hrs. de suspendido o terminado el tratamiento, (excepto en el caso de orinas: NO menos de 5 días). Si el antibiótico tuviera vida media prolongada se debe esperar más de 48 horas; si no se pueden suspender la administración del antibiótico, recolectar la muestra justo antes de la siguiente dosis. Es mejor explicar claramente al paciente sobre el procedimiento al que va ser sometido, de esta manera existirá mayor colaboración por parte del paciente en el momento de la recolección de muestra. El material recolectado debe ser representativo del proceso infeccioso en investigación, para lo cual debe seleccionarse el mejor sitio para la toma de 249 Vigilancia, prevención y control de infecciones asociadas a servicios de salud muestra, de esta manera se aumenta la probabilidad de aislar el microorganismos evitando la contaminación con la flora saprofita. La cantidad de muestra debe ser suficiente como para permitir un completo análisis microbiológico. En el caso de que la cantidad sea pequeña se deben priorizar los exámenes. Es importante que la solicitud del examen o cultivo además de tener los datos generales del paciente, se disponga del diagnóstico presuntivo ya que esto permitirá al microbiólogo tener una pauta para investigar e identificar al agente etiológico. También es importante que en esta solicitud existan datos como el uso de antibióticos, si es que el paciente ya recibió tratamiento antimicrobiano. Una vez obtenida la muestra ROTULAR adecuadamente los recipientes que las contienen, incluir: - Nombre del paciente. - Tipo de material(para poder seleccionar los medios de cultivo necesarios) - Fecha y hora de recolección. Las muestras SE REMITIRAN INMEDIATAMENTE al laboratorio ya que si se demora en el procesamiento o la forma de conservación no es la adecuada, no se puede asegurar la viabilidad de los organismos fastidiosos ni prevenir el sobredesarollo de las bacterias acompañantes, y dejará de ser representativa del proceso que ocurre en el foco estudiado. En caso de no poder cumplir con este requisito, se tendrán en cuenta las pautas de conservación: • A temperatura ambiente: - Muestras en medio de transporte (semisólidos). - L.C.R. • En refrigeración (4º C): - Orinas (chorro medio, punción suprapúbica) - Catéteres (en solución fisiológica) - Coprocultivos en medio de transporte semisólido, sí el lapso de conservación es mayor de 6 horas ( en medio de Cary Blair) 250 Diagnóstico de laboratorio • En estufa (35°C): - Sangre - Muestras en medio líquido de transporte - Agar Chocolate (sembrado con L.C.R.) De no ser posible esta forma de conservación, dejarlas a temperatura ambiente. CRITERIOS DE RECHAZO DE MUESTRA Debe controlarse cada hoja de pedido y etiqueta de la muestra para ver si se ha incluido toda la información esencial (según ficha en anexos). • Antes de rechazar una muestra debido a información inapropiada incompleta, debe establecerse contacto con la persona responsable para efectuar las correcciones necesarias para así poder completar la información. • Es necesario seguir estrictamente los procedimientos descritos, ya que la muestra obtenida puede ser rechazada por el personal de laboratorio de acuerdo a los siguientes criterios: - Muestra sin rotular o mal rotulada - No indica tipo de muestra o procedencia - No indica tipo de examen en la orden - Inadecuada temperatura de transporte - Demora en el envío de laboratorio - Medio de transporte inadecuado - Muestra que tenga evidencia de haberse derramado - Recipiente inadecuado (ej. Rajaduras) - Muestra con contaminación obvia - Muestra seca en el hisopo - Una sola muestra de hisopado con varias ordenes - Volumen inadecuado - Transporte de hisopo al aire libre* 251 Vigilancia, prevención y control de infecciones asociadas a servicios de salud • En caso de muestras rechazadas, el personal de laboratorio debe explicar al médico solicitante las razones y observaciones en la papeleta de solicitud de examen correspondiente o por vía telefónica, para que de esta manera el médico pueda realizar una nueva solicitud y recolección adecuada de la muestra. INFECCIONES DEL TRACTO URINARIO: UROCULTIVO a.Pacientes que controlan esfínteres Este método de recolección de orina es posible en adultos y en los niños que pueden controlar esfínteres. La muestra adecuada es aquella obtenida de la primera micción en la mañana (primera orina de la mañana), pero si la urgencia del caso o la situación particular lo justificara, se puede realizar la recolección con una retención de orina en vejiga mínima de 3 hrs. La recolección de las muestras dentro del hospital debe ser supervisada por una enfermera o auxiliar de enfermería entrenada. a.1. Pacientes adultas (sexo femenino) • Lavar suavemente los genitales con bastante agua y jabón. El lavado debe hacerse manteniendo las piernas separadas y abriendo a la vez los labios mayores con una mano mientras que con la otra se lava suavemente. No se debe utilizar antisépticos porque pueden mezclarse con la orina y dar resultados falsos negativos. • Secar con una toalla limpia y con los labios aún separados se realizará la micción desechando el primer chorro de orina, que por arrastre mecánico limpia el canal uretral. • Se recogerá la segunda parte de la micción (chorro medio) en un recipiente estéril y de boca ancha. • Inmediatamente cerrar el frasco y se entregará al laboratorio para su procesamiento. • En el momento de la recolección de la muestras se debe tener cuidado de que el frasco debe sujetarse de manera que se evite el contacto con la 252 Diagnóstico de laboratorio pierna, vulva o ropa de la paciente. Los dedos no deben tocar el borde del frasco o la superficie interior. a.2. Pacientes adultos (sexo masculino) • En el hombre la recolección de la muestra es más sencilla, debe realizar la retracción del prepucio y lavar con agua y jabón el meato urinario; enjuagar con bastante agua y secar. • Con el prepucio retraído, se recogerá la orina a la mitad de la micción descartando la primera parte de la misma. • Inmediatamente cerrar el frasco y se entregará al laboratorio para su procesamiento. a.3. Niños: • En niños y niñas mayores la orina se recoge de forma similar a los adultos. b)Pacientes que NO controlan esfínteres b.1. Lactantes • En los recién nacidos, lactantes y niños que todavía no controlan esfínteres, la toma de muestra se realiza a través de la colocación de la bolsa recolectora, previo aseo de los genitales. • La bolsa recolectora no debe permanecer más de 30 minutos en el bebé, caso contrario se tendrán resultados falsos positivos. Por esta razón se deberá cambiar la bolsa colectora de acuerdo al tiempo establecido anteriormente, previo aseo. • Si no se puede obtener la muestra de orina con la bolsa colectora, realizar punción suprapúbica. b.2. Pacientes con sonda b.2.1. Sondados intermitentes - Utilizar sonda nueva estéril - Recoger en tubo o frasco estéril. 253 Vigilancia, prevención y control de infecciones asociadas a servicios de salud b.2.2. Sondados permanentes - De ser posible, cambiar la sonda por una nueva. - Clampear la sonda 2-3 hrs. - Desinfectar el sitio de punción del segmento proximal del catéter del puerto y de la sonda Foley, con alcohol 70%. - Aspirar entre 2 a 5 mL de orina. Verificar el retiro de la pinza(clamp) después de obtener la muestra. - Colocar el material obtenido en el frasco estéril y enviar inmediatamente al laboratorio. • NUNCA se debe recolectar la muestra de la bolsa de drenaje. • NO ENVIAR la punta de la sonda Foley para cultivo, porque el crecimiento bacteriano representa a la flora de la uretra distal. • Si se quiere hacer un control o monitorización en los procesos infecciosos, se recomienda realizar un cultivo de orina después de las 48 horas de haber sido retirada la sonda. • Urocultivos realizados antes del tiempo establecido pueden dar resultados positivos sin que estos estén realmente asociados a procesos infecciosos. c. Punción suprapúbica • Es el método de elección para la recolección de muestras en niños pequeños (recién nacidos y lactantes). • La punción suprapúbica debe ser realizada por el personal médico capacitado, el cual requiere un buen conocimiento de la técnica y de las precauciones que hay que adoptar, con rigurosa asepsia, descartando problemas de hemostasia. • Previamente se aplica anestesia local; los pacientes deben tener la vejiga llena y palpable para poder realizar la punción. • Realizar asepsia de la piel con alcohol 70º, luego aplicar solución de iodopovidona en forma concéntrica en el sitio de punción. Luego de realizada la misma, remover con alcohol 70º. • Puncionar a 1,5 cm. de la sínfisis pubiana, en la línea media, el paciente debe estar en decúbito supino; con una jeringa de 10 ml. y con aguja larga (calibre 19) se aspira el contenido vesical, de 2 a 5 mL. 254 Diagnóstico de laboratorio • Hay que resaltar que es mejor punzar piel sana (evitando escaras o dermatitis). Transporte de la muestra Una vez recolectada la muestra por cualquiera de los métodos mencionados anteriormente, enviar inmediatamente al laboratorio (hasta dentro de los 15 minutos después de la recolección) si esto no es posible mantener a una temperatura de 4º C hasta un lapso de tiempo máximo de 4 horas, caso contrario el reposo de la muestra de orina por más de este tiempo favorecerá a la proliferación de los microorganismos lo cual afectará en los resultados del paciente dando falsos positivos. Observaciones • ES NECESARIO INDICAR EN LA ORDEN DE SOLICITUD DE CULTIVO, EL MÉTODO DE RECOLECCIÓN UTILIZADO (ESPECIALMENTE SI SE TRATA DE NIÑOS), YA QUE ES UN DATO IMPORTANTE A LA HORA DE VALORAR EL RECUENTO DE COLONIAS. • Para la búsqueda de micobacterias, la orina se recoge de la forma descrita anteriormente durante tres días consecutivos. En este caso el volumen de orina debe ser 100-150 mL y se elegirá preferentemente la primera micción de la mañana. Cuando se sospecha la presencia de hongos y virus, el volumen de orina será superior a 20 mL y en el caso de parásitos se recogerá la orina de 24 horas. INFECCIONES DEL TRACTO GASTROINTESTINAL COPROCULTIVO. • Los patógenos entéricos que causan diarrea, están presentes en mayor cantidad y son más fáciles de aislar durante la fase aguda o diarreica del proceso infeccioso intestinal, por este motivo es aconsejable que la muestra sea recolectada en esta fase. • Sólo se procesarán las muestras de materia fecal de consistencia líquida, semilíquida o pastosa NO SE PROCESARÁN LAS DE CONSISTENCIA SÓLIDA; el procesamiento de muestras de heces de consistencia sólida sólo se realizará para estudio de portadores (en caso de bacterias) y para estudio de parásitos. 255 Vigilancia, prevención y control de infecciones asociadas a servicios de salud • La muestra debe ser recolectada en recipiente de boca ancha, con cierre hermético; no es necesario que el frasco esté estéril, pero si debe estar limpio. Se debe tener el cuidado que el frasco no tenga restos de detergentes, jabones, desinfectantes u otros compuestos que contengan iones metálicos. • En el caso de que el transporte de la muestra demore por mucho tiempo o el laboratorio de microbiología distribuya en las salas el medio de transporte Carry - Blair o solución de glicerol tamponado, las muestras pueden ser enviadas en los medios antes mencionados para el estudio bacteriológico. • Si se sospecha de un brote por rotavirus, las muestras deben ser recolectadas en frascos limpios para luego conservarlas entre 2º y 8º C hasta esperar su procesamiento (no utilizar medio de transporte) • Para la recolección es mejor utilizar una cuchara desechable, un palito de helado o un depresor de lengua, con la ayuda de estos se deberá recolectar la porción más significativa de las heces, es decir aquella porción que sea sanguinolenta, mucoide o purulenta. • La cantidad a ser recolectada es del tamaño de una nuez en caso de deposiciones pastosas. Si se tratan de muestras semilíquidas o líquidas debe ser de 10 a 20 mL (una cuchara). • Una vez recolectada la muestra se enviará inmediatamente al laboratorio debidamente rotulada, incluso con la hora de recolección de la muestra. Transporte de la muestra. • Si la muestra no es entregada al laboratorio dentro de una hora, se deberá colocar en el medio de transporte Cary Blair y este mantener a temperatura ambiente. Observaciones. • La muestra NO debe ser recolectada del inodoro y tampoco deben estar contaminadas con orina. • Para recoger las heces NO debe utilizarse papel higiénico, porque suelen tener sales de bario que inhiben algunas bacterias enteropatógenas. • El envío de la muestra sin ningún medio de transporte, es necesario para el examen en fresco, el ensayo de las toxinas de C. difficile (si es que se 256 Diagnóstico de laboratorio realiza), detección por concentración de huevos o parásitos y estudios virológicos (cultivos, inmuno electromicroscopía, ELISA, o látex para rotavirus). • Las muestras para coprocultivo, deberán recolectarse antes de la administración de agentes antidiarréicos. • Es conveniente también evitar, sobre todo para estudios parasitológicos la utilización previa de antiácidos y laxantes oleoso, así como de los compuestos habitualmente utilizados para estudios radiológicos digestivos (bario, bismuto). INFECCIONES DEL TRACTO RESPIRATORIO Infecciones del tracto respiratorio superior (faringitis).Hisopado faríngeo • Se debe contar con una luz directa lo cual ayudará a observar mejor la parte de donde se recolectará la muestra. • El paciente debe estar sentado con la cabeza en hiperextensión. • Solicitar al paciente que abra la boca, saque la lengua y emita un sonido “ah”. • Con la ayuda de un bajalenguas deprimir la lengua y con un hisopo estéril frotar enérgicamente las criptas tonsilares, amígdalas y la parte posterior de la faringe. • Si existe algún exudado, inflamación o material purulento, recolectar también este material. • En el momento de la recolección de la muestra se debe tener cuidado de no tocar la lengua, la mejilla, las encías, úvula y los dientes o muelas, debido a que existe el riesgo de contaminar con la flora bacteriana lo cual dificulta el aislamiento del verdadero agente infeccioso. • Una vez obtenida la muestra sembrar inmediatamente en los medios sólidos de acuerdo a protocolo del laboratorio. 257 Vigilancia, prevención y control de infecciones asociadas a servicios de salud Transporte de la muestra • En el caso de que la muestra ya fue sembrada en los medios sólidos correspondientes, enviar inmediatamente al laboratorio para incubación. • Si esto no es posible colocar el hisopo con la muestra en un medio de transporte (Stuart o Amies con carbón activado) y mantener a temperatura ambiente hasta enviar al laboratorio (no debe pasar de las 24 horas). Observaciones • Este tipo de estudio se restringe a brotes de infecciones intrahospitalarias, en búsqueda de portadores del agente causal del brote. INFECCIONES DEL TRACTO RESPIRATORIO INFERIOR Neumonías Nosocomiales - Neumonías Asociadas a Ventiladores Mecánicos (NAVM) • Se recomienda el uso de criterios microbiológicos cuantitativos para el diagnóstico de la NAVM; este enfoque permite reunir información epidemiológica sobre microorganismos prevalentes en cada hospital y ver la resistencia antimicrobiana en una unidad; reducir y racionalizar el uso de antimicrobianos y discriminar casos con mayor o menor probabilidad de NAVM. • Se recomienda específicamente el uso de cultivo cuantitativo del ASPIRADO ENDOTRAQUEAL (AET). Esta modalidad de diagnóstico tiene una sensibilidad y especificidad comparables a las estrategias diagnósticas basadas en estudios fibrobroncoscópicos como Lavadobroncoalveolar y tiene la ventaja de su universalidad de aplicación, bajo costo e independencia de equipos humanos y técnicos restringidos para su obtención. Método No Invasivo Aspirado Endotraqueal (AET) • Todo paciente con conexión a ventilación mecánica más de 48 horas y presencia de criterios clínicos radiológicos, en el cual no se hayan efectuado cambios de tratamiento antimicrobiano durante las últimas 72 horas. • La muestra debe ser recolectada por personal médico entrenado. 258 Diagnóstico de laboratorio • La muestra debe ser obtenida con técnica aséptica, utilizando un catéter de aspiración introducida por el tubo endotraqueal y conectando el otro extremo del catéter a un tubo de aspiración. • El catéter debe ser introducido hasta encontrar resistencia y NO se debe diluir la muestra con el fin de facilitar su recolección, debido a que se trata de un cultivo cuantitativo. • Si las secreciones son espesas, se deben aplicar aspiraciones intermitentes hasta conseguir la muestra. • La muestra ya obtenida se debe colocar en un frasco estéril. Transporte de la muestra • La muestra debe ser enviada rápidamente al laboratorio, especificando que se requiere cultivo cuantitativo de Aspirado Endotraqueal (AET). Procesamiento de la muestra - Cultivo cuantitativo de aspirado endotraqueal • El cultivo cuantitativo de AET no tiene un protocolo estandarizado reconocido. En este documento se indica una metodología modificada que no excluye alternativas de diseño local o derivadas de otras publicaciones. • Para esta metodología se requiere un tubo estéril con perlas de vidrio, otro con 9,9 ml de solución fisiológica (NaCl 0,9%), agitador, micropipetas de 100 µl con puntas desechables y como medios de cultivo, 2 placas de agar sangre y 2 de Mc Conkey. • Diluir la muestra con solución fisiológica al 0,9 % en una dilución 1:2. • Homogenizar con perlas de vidrio estériles y agitador durante 2 minutos. • Extraer 100 µL de muestra clínica y diluir en 9,9 mL de solución fisiológica (dilución 1:100), agitar en vortex. • Rotular una placa de agar sangre y de Mc Conkey como “placas A” y otro set como “placas B”. • Sembrar 100 µL (0,1 mL) de la muestra diluida en cada placa A, diseminando con una aza de Drigalsky. • En las “placas B” sembrar 10 µL de la muestra diluida 1:100, diseminando de igual manera con la aza de Drigalsky. 259 Vigilancia, prevención y control de infecciones asociadas a servicios de salud • Incubar en atmósfera aeróbica a 35º C hasta 72 hrs. • Realizar lectura de las placas diariamente hasta completar el período de observación (72 hrs.). • En caso de existir crecimiento bacteriano, realizar el recuento respectivo. Lectura de resultados • En las placas A: 1 colonia equivale a 2.000 UFC/mL (2 x 103); 5 colonias = 10.000 (1 x 104); 50 colonias = 100.000 UFC/mL (1 x 105) • En las placas B: 1 colonia equivale a 20.000 UFC/mL (2 x 104); 5 colonias = 100.000 (1 x 105); 50 colonias = 1.000.000 UFC/mL (1 x 106) • La ausencia de colonias equivale a 103 UFC/mL. Interpretación de resultados • Recuento < a 103 UFC/mL, está asociado a una menor probabilidad de NAVM, lo que permite plantear la exclusión del diagnóstico. Esta interpretación sólo es aplicable si no se han realizado modificaciones recientes en la terapia antimicrobiana. • Recuento de 105 UFC/mL, 106 UFC/mL o > 106 UFC/mL, se asocia a NAVM en aproximadamente cuatro quintos de los casos ,valor predictivo positivo (VPP) 82% y los recuentos inferiores señalan la probable ausencia de neumonía a pesar de la sospecha, valor predictivo negativo (VPN) 83%. • Recuento intermedio entre estos valores (>de 103 y < a 106) señala VPN y VPP variables que deben quedar a criterio de los médicos tratantes • Los datos del informe pueden ser analizados tomando en cuenta sólo la especie con el recuento más elevado o, alternativamente, combinando las lecturas de las especies observadas. Informe de laboratorio • La emisión del informe debe incluir un detalle de cada microorganismo aislado, con su recuento y estudio de susceptibilidad correspondiente. Observaciones • La tinción de Gram de la muestra tiene un rendimiento limitado ya que no permite predecir qué tipo de microorganismos tendrá un recuento 260 Diagnóstico de laboratorio significativo. Es sólo aplicable para descartar cierto tipo de agentes. Puede ser incorporado en el procedimiento si es conveniente. • La muestra puede ser sembrada además en placa de agar chocolate, para la detección adicional de Haemophilus influenzae, en casos de NAVM de inicio precoz (durante los primeros 5 días de hospitalización). • No se recomienda siembra en agar Sabouraud, debido a la falta de concordancia entre el recuento de levaduras y los hallazgos histológicos. • El estudio de bacterias anaerobias solamente ha sido estandarizado para la técnica de CP (cepillo protegido), por lo que no es aplicable a través de esta metodología. Métodos Invasivos 1. Fibrobroncoscopía mediante cepillo protegido • La recolección debe ser realizada por personal médico entrenado. • Se utiliza esta técnica para evitar la contaminación orofaringea, con un sistema de doble catéter con cánulas telescópicas. • Se aconseja aerolizar el anestésico a nivel de orofaringe, y vías aéreas proximales y evitar la succión de secreciones a medida que el fibrobroncoscopio pasa por el tubo antes de tomar el cepillado. • Si no se procede así, el anestésico que tiene efecto antibacteriano, puede producir la expulsión de secreciones acumuladas en el canal de succión, aumentando la contaminación. • El extremo protegido del cepillo es capaz de retirar 0,001 ml de secreción presente en la vía respiratoria. Valores iguales o superiores a 103 ufc/ml se consideran positivos. Transporte de la muestra • La muestra debe ser enviada rápidamente al laboratorio, especificando que se requiere cultivo cuantitativo. Lavado broncoalveolar (LBA) • Este un método que permite obtener un lavado del compartimiento alveolar 261 Vigilancia, prevención y control de infecciones asociadas a servicios de salud que se encuentra distal al fibrobroncoscopio impactado en un bronquio subsegmentario. • Este procedimiento debe ser realizado por un equipo médico especializado. • No hay acuerdo en el volumen de solución salina que se debe instilar, fluctúa entre 100 y 240 ml. La sensibilidad varía entre 22 y 100%, con un valor promedio de 69%. • Tomar alícuotas en distintos recipientes: la primera alícuota deberá ser colocada en un frasco, identificado como primera muestra, que se utilizará para el estudio microbiológico. • Todas las otras muestras podrán ser recolectadas en un único frasco estéril (pool). Solamente esta muestra deberá ser utilizada para el cultivo cuantitativo. • El nivel de corte considerado positivo para el LBA es de 104 UFC/ml. Transporte de la muestra. • El transporte de la muestra debe ser inmediata o dentro de los 30 minutos. INFECCIONES SISTEMICAS Hemocultivo La investigación de microorganismos en muestras de sangre constituye uno de los exámenes más importantes en microbiología clínica para el diagnóstico de bacteremia o fugemia. La presencia en sangre de organismos viables sugiere una infección activa en los tejidos. El pronóstico del paciente dependerá de un diagnóstico y tratamiento rápido; ello requiere una identificación precisa u ensayo rápido de susceptibilidad a los antimicrobianos. El momento de la recolección de muestra depende de las condiciones del paciente. En casos no críticos se recomienda obtener dos o tres pares de hemocultivos (aeróbicos y anaeróbicos), separados por intervalos de 30 a 60 minutos antes de comenzar tratamiento antimicrobiano. Sin embargo, esto no es posible en el caso de neonatos, cuando se sospecha meningitis o cuando el paciente se halla en estado crítico . En dichos casos recomendamos tomar dos muestras al mismo tiempo, de dos lugares diferentes, para iniciar tratamiento antimicrobiano 262 Diagnóstico de laboratorio inmediato. No existe información que indique una mayor rentabilidad de los cultivos en relación a si son obtenidos antes, durante o después de un pico febril o escalosfrios ; por consiguiente se recomienda obtener hemocultivos en cualquier momento cuando clínicamente se sospecha la presencia de una bacteremia o fugemia. Principio.Se toma la muestra de sangre del paciente utilizando técnica aséptica con equipo estéril. La sangre se inocula en el frasco de hemocultivo mezclándose con el caldo. La fórmula de medio estimula el desarrollo de agentes aerobios, anaerobios y microaerofilicos. Material. • Frascos de hemocultivo. • Compresas de algodón • Jeringas y agujas estériles de punción IV • Gasa y algodón estériles • Guantes de goma estériles • Alcohol Yodado Obtención de la muestra • Retirar los tapones externos de los frascos. • Desinfectar los tapones de goma con alcohol al 70%. No se recomienda desinfectar los tapones de con tintura de yodo o alcohol yodado puesto que el yodo destruye la goma. • Localizar por palpación la vena que se va a puncionar. Generalmente la red venenosa de la flexura del codo; en los niños será a nivel de la yugular o en recién nacidos aprovechando el botón umbilical, el cual puede ser utilizado para tomar la muestra. • Dado el significado del hemocultivo positivo es importante que la sangre 263 Vigilancia, prevención y control de infecciones asociadas a servicios de salud se tome con el menor riesgo posible de contaminación accidental. Los mejores resultados se obtienen de punciones venosas arteriales. Excepto en situaciones excepcionales, no se recomienda extraer sangre a través de una derivación o catéter ya que estos dispositivos pueden estar colonizados por bacterias que no están presentes en la sangre del paciente; por lo tanto, estos hemocultivos podrían dar resultados falsos positivos. • La desinfección de la piel se debe le hacer con tintura de yodo o sus equivalentes (alcohol yodado) • Extraer la sangre sin tocar en ningún momento el campo desinfectado. Si fuera necesario palpar nuevamente la vena, utilizar guantes de goma estériles o volver a desinfectar el sitio antes de venipuntura. • De acuerdo a los últimos estudios, la cantidad de sangre se considera una variable crítica en el aumento de la positividad de los hemocultivos. A mayor volumen de muestra mayor es la sensibilidad del hemocultivo. Se debe tomar un volumen tal que se obtenga una dilución 1/10 para el medio de cultivo líquido. En adultos se recomiendan 10 mL como mínimo en cada venipuntura. En recién nacidos y prematuros 1 mL; en lactantes 2 a 3 mL; en pre–escolares y escolares 2 a 5 mL; y en adolescentes 10 mL. • Introducir sangre en los frascos evitando que entre aire en el frasco para cultivo en anaerobiosis. Mover los frascos suavemente para que la sangre y el medio de cultivo se mezclen. Transporte.Hasta su envío mantener a 35-37º C; cuando esto no sea posible, mantener a temperatura ambiente. Nunca debe refrigerarase ni congelarse. Si se sospecha anaerobios emplear un medio adecuado para estas bacterias. Observaciones.Cuando no haya venas accesibles puede realizarse la extracción de sangre arterial. No son adecuadas las muestras procedentes de catéter, solamente en caso de que se sospeche infección del propio catéter y se contempla su retirada. Cultivo de catéteres intravasculares El cultivo de catéter intravascular se realizará solo en caso de Sepsis asociada a catéter. Podrá realizarse cultivo cualitativo o semicuantitativo de punta (técnica semicuantitativa de Maki). Esta última técnica es preferida puesto que permite 264 Diagnóstico de laboratorio valorar la contaminación extraluminal del catéter, principal mecanismo por el cual se contaminan a los catéteres de corta permanencia y pueden llegar a ser el origen de un bacteriemia. En el cultivo semicuantitativo se obtiene el segmento distal del catéter y se lo desliza sobre la placa de agar de cultivo. Si se observan >15 colonias del organismo a las 24 horas de incubación y si tal resultado es acompañado de signos locales de inflamación en el sitio de previa inserción del catéter se considera dicho resultado como prueba de infección del sitio del catéter. Esta técnica tiene la limitación de no poder detectar infecciones intraluminales. El cultivo cuantitativo requiere enjuagar el catéter con caldo de cultivo o sonificar el segmento de catéter dentro de un caldo de cultivo. Luego se obtienen diluciones seriales del caldo de cultivo y se siembra en placar de agar sangre. Si se obtienen > 100 colonias del organismo a las 24 horas de incubación se considera como signo de infección. Se ha informado que la sensitividad de las diferentes técnicas es la siguiente: sonificación 80%, cultivo semicuantitativo 60% y enjuague del catéter 40-50%. Por razones técnicas, por lo general, se utiliza la técnica semicuantitativa. Material necesario - Guantes estériles. - Gasas estériles - Pinzas y tijeras estériles - Recipiente estéril con tapa de rosca. - Alcohol etílico o isopropílico al 70 % - Yodo povidona al 10% Obtención del producto - Desinfectar con alcohol al 70% una zona de piel de unos 10 cm correspodiente a la zona de entrada del catéter. Hacerlo en forma de círculos comenzando por el centro. - Repetir la misma operación, pero con iodóforo, dejando que se seque por lo menos un minuto. 265 Vigilancia, prevención y control de infecciones asociadas a servicios de salud - Retirar el catéter con la máxima asepsia. - Ayudandonos de la pinzas y las tijeras estériles, cortar los 5 cm dístales del catéter que corresponden a la porción intravascular. - Introducir el segmento de catéter en un recipiente estéril correctamente identificado. Tamaño de la muestra Cinco cm de la porción más distal. Porciones mayores dificultan el procesamiento en el laboratorio. Transporte La muestra deberá enviarse al laboratorio en un periodo inferior a 30 minutos. Cuando esto no sea posible deberá conservarse a 4º C por 12 horas como máximo. b) Catéteres no removibles La técnica es aplicada cuando por condiciones técnicas o clínicas del paciente no se ha indicado el retiro de catéter. - Paciente neutropénico con catéteres permanentes. - Catéteres de nutrición parenteral. - Implantes vasculares - Catéter doble lumen diálisis. - Paciente sin otra posibilidad de acceso vascular. • La evaluación de estos catéteres debe realizarse en forma cuantitativa ( Método Cuantitativo Simultáneo Diferencial). • Se debe extraer una muestra de sangre de una vena periférica diferente de la de inserción del catéter (HEMOCULTIVO PERIFERICO) y otra de igual volumen a través del mismo (RETROCULTIVO). • Las muestras serán recogidas con HEPARINA ESTÉRIL. Deben ser procesadas en forma INMEDIATA, lo que implica que serán extraídas ÚNICAMENTE EN EL HORARIO DE RECEPCIÓN del Laboratorio de bacteriología. 266 Diagnóstico de laboratorio Procedimiento • Lavarse las manos con antiséptico. • Colocarse guantes estériles. • Desinfectar la zona de punción, tanto el catéter como la piel, con yodopovidona o alcohol yodado. Dejar secar 1 minuto. • Extraer 1,5-2 ml de sangre a través del catéter y recoger en tubo estéril con una gota de heparina estéril. También se puede utilizar para la extracción jeringa heparinizada, en cuyo caso se colocará la sangre en tubo seco estéril. • Agitar y rotular: “RETROCULTIVO”. Extraer igual cantidad de sangre de vena periférica y recoger de igual forma que en el punto anterior. Agitar y rotular: “HEMOCULTIVO PERIFERICO. Las recolección de muestras deben realizarse en forma SIMULTÁNEA y enviarse INMEDIATAMENTE al laboratorio. Observaciones • Se recomienda que a la vez que se recolecta de muestra de catéter (catéter removible), también se tome una muestra de sangre periférica para hemocultivo, de esta manera se evidenciará si realmente existe una bacteriemia ya que en ambas muestras debe aislarse el mismo microorganismo. • La presencia de un número mayor o igual a 15 colonias de un solo tipo de colonias o bacterias, significa que el catéter puede ser la fuente de infección. INFECCIONES DEL SISTEMA NERVIOSO CENTRAL: MENINGITIS INTRAHOSPITALARIAS.Como se ha mencionado con anterioridad la infección intrahospitalaria es aquel proceso infeccioso transmisible, local o sistémico que se presenta después de la 72 hrs. de estancia en el hospital; por lo tanto las causas de las meningitis intrahospitalarias están relacionadas generalmente con las prácticas quirúrgicas que se realiza en el paciente, por lo tanto se pueden encontrar diferentes procesos como las meningitis postquirúrgicas, los abscesos cerebrales, y las infecciones de válvulas de derivación y otros dispositivos. A continuación se detalla la recolección de muestra para cada proceso 267 Vigilancia, prevención y control de infecciones asociadas a servicios de salud Meningitis Post quirúrgicas La incidencia de las mismas varia dependiendo del uso de antibióticos profilácticos peri operatorios y del tipo de cirugía: limpia o limpia contaminada. Los factores de riesgo para la aparición de estas infecciones incluyen focos contiguos de infección, cirugía de urgencia, rasurado total de la herida, reoperación precoz. La muestra para el diagnóstico de estos procesos es el líquido cefalorraquídeo (LCR) Líquido Cefalorraquídeo • La obtención de la muestra es responsabilidad exclusiva del médico entrenado en la técnica de punción lumbar, quien la tomará bajo rigurosas condiciones de asepsia. • El médico debe pedir a la persona, permanecer acostada sobre uno de sus lados, con las rodillas flexionadas hasta tocar su abdomen y la cabeza inclinada con la barbilla pegada al tórax. • Realizar la asepsia de la piel con alcohol al 70% y povidona yodada realizando movimientos concéntricos que van desde el lugar donde se realiza la punción hacia fuera para luego inyectar anestésico local, usualmente entre el 3º y 4º espacios intervertebrales lumbares. • De forma posterior se realiza la inserción de una delgada aguja espinal, la cual tras cruzar los músculos de la espalda, perfora las meninges y permite la recolección del LCR. • Una vez retirada la aguja se limpia nuevamente la espalda de la persona, se coloca una banda adhesiva y se le solicita que permanezca acostada por espacio de 6 a 8 horas. • Depositar la muestra en 2 frascos estériles, el primer frasco servirá para el estudio citoquímico y el segundo frasco para el estudio bacteriológico esto debido a que teóricamente tiene menor probabilidad de contaminarse con epitelio, sangre de la piel o tejido de los capilares que se rompen durante la punción. • La cantidad de muestra mínima debe ser de 1 mL en cada frasco. 268 Diagnóstico de laboratorio Transporte de la muestra. • La muestra debe ser enviada inmediatamente al laboratorio, como el LCR es hipotónico los neutrófilos pueden lisarse, el recuento puede disminuir en un 32% después de 1 hora y en un 50% después de las dos horas de la extracción. • Esta muestra NUNCA DEBE REFRIGERARSE, por lo que el transporte debe realizarse a temperatura ambiente. Abscesos Cerebrales.Es una infección focal, intracerebral que empieza en un área localizada causando cerebritos y desarrolla hasta hacerse una colección de pus rodeada por una cápsula muy vascularizada. El uso de la Tomografía Axial Computarizada (TAC) permite que el absceso sea visualizado y aspirado para el diagnóstico microbiológico. La recolección de la muestra será descrito en el procedimiento para Abscesos Cerrados. Infecciones de Válvulas de derivación y otros dispositivos.La infección de estos sistemas de derivación puede ocurrir entre 1% al 10% dependiendo de la edad del paciente, etiología de la hidrocefalia, la virulencia del microorganismo, tipo de la derivación implantada y la experiencia del neurocirujano. También se ha considerado como factores desencadenantes el tiempo de la cirugía, número de personas en el equipo quirúrgico, la preparación de la piel y la calidad del material del dispositivo. Líquido cefalorraquídeo ventricular.La punción del reservorio para la extracción del LCR es la mejor muestra, no se aconseja extraer LCR proveniente de una derivación externa porque puede estar colonizando el catéter y el resultado sería falso positivo, tampoco la punción lumbar porque al drenar el LCR hacia la cavidad atrial o peritoneal el LCR lumbar puede ser estéril y sería falso negativo. 269 Vigilancia, prevención y control de infecciones asociadas a servicios de salud Procedimiento. • El procedimiento debe ser realizado por personal médico entrenado. • Para la punción se rasura el área del reservorio y el cabello restante debe ser retirado de la zona de punción. • Limpiar el cuero cabelludo con povidona yodada y después con alcohol al 70%, dejar secar por 1 minuto. • Utilizar una aguja 21 o una aguja Huber y puncionar el reservorio (o la válvula si no hay reservorio). • Se debe registrar la presión abierta y cerrada con un manómetro. • Dejar gotear el LCR en un recipiente estéril. NO ASPIRAR. • La cantidad de la muestra es variable debido a la técnica de obtención. Transporte de la muestra. • Debe ser llevada inmediatamente al laboratorio. • El transporte debe ser a temperatura ambiente y NO REFRIGERAR. Observaciones. • El médico debe indicar en la solicitud del examen la procedencia del LCR, es decir “LCR ventricular” ya que esto ayudará bastante en el diagnóstico bacteriológico. INFECCIONES POST QUIRÚRGICAS Y POST CURACIÓN Para le recolección de estas muestras es necesario tomar en cuenta algunos aspectos como la correcta decontaminación de la piel, siempre indicar si la muestra proviene de una cavidad abierta o cerrada, describir precisamente el sitio anatómico del cual se obtiene. De tratarse de heridas, es crítico diferenciar entre muestras superficiales y profundas, siendo estas últimas las únicas útiles para el cultivo de anaerobios, si son recolectadas en forma adecuada. Heridas quirúrgicas.La toma de muestra se realizará con técnica aséptica luego de la limpieza de la zona con suero fisiológico para eliminar la contaminación superficial. Se realizará por punción y se colocará la muestra en recipiente estéril con tapa de rosca, si se sospecha presencia de anaerobios comunicarse con el laboratorio para solicitar medio de transporte. Sí la muestra es obtenida con hisopo realizar primero la 270 Diagnóstico de laboratorio limpieza de la zona con suero fisiológico y gasa estéril para luego embeber en el pus. Abscesos abiertos y Heridas superficiales • Lavarse la manos. • Colocarse guantes estériles. • Lavar con suero fisiológico y gasas estériles cuidadosamente la superficie de la herida para retirar la flora colonizante y el exudado que pueda estar presente. • Recoger el pus mediante jeringa y aguja, aspirando preferentemente de zonas profundas, pero punzado en piel sana adyacente a los bordes de la herida, con una inclinación de 30º a fin de llegar al fondo de la herida o directamente por el orificio de la misma sin tocar los bordes externos. • Cuando la muestra sea insuficiente, instilar suero o solución de Ringer lactato y aspirar nuevamente en la jeringa. • Cuando los procedimientos anteriores no sean factibles, con un hisopo podrá efectuarse el frotis en forma de zig-zag de la herida. • Para muestras líquidas se intentara obtener 1-10 ml. En el resto de las ocasiones se enviará la máxima cantidad posible. • Algunos autores recomiendan obtener una biopsia de tejido de aproximadamente 0.5 x 0.5 cm y profundidad necesaria para involucrar la totalidad del espesor de la herida. • Una vez obtenida la muestra debe ser depositada en un frasco estéril de tapa rosca. Transporte y conservación • El envío al laboratorio debe ser inmediato. • La jeringa de la extracción será eliminada de acuerdo a normas de bioseguridad. La práctica de colocar un tapón de goma en la aguja (usando la jeringa como recipiente de transporte) YA NO ES UTILIZADA por el riesgo para el personal de sufrir un pinchazo con una aguja contaminada con material orgánico. • Si no puede procesarse antes de 2 horas usar medio de transporte. Observaciones. • Las muestras recibidas en hisopo son de escasa rentabilidad y deben obtenerse sólo en circunstancias muy excepcionales, cuando no se pueda recoger la muestra por otros métodos. 271 Vigilancia, prevención y control de infecciones asociadas a servicios de salud • No se debe recolectar la pus emergente. Abscesos cerrados • La recolección debe ser realizada por personal médico entrenado. • Realizar antisepsia de la zona a punzar con alcohol al 70%, de forma concéntrica comenzando por el centro. Abarcar una zona de unos 10 cm. • Repetir la operación con povidona yodada. En pacientes con hipersensibilidad al yodo, se utilizará alcohol 70 % dos veces consecutivas. • Dejar secar al menos 1 minuto para que el antiséptico ejerza su acción. • Realizar una punción-aspiración del absceso con jeringa y aguja. • La muestra más útil es aquella obtenida contra la pared del absceso y puncionando en el lado superior para evitar la fistulización espontánea. • Depositar la muestra a un contenedor estéril. Si se requiere búsqueda de anaerobios introducir en un medio de transporte para anaerobios. • Deberá enviarse un volumen de muestra entre 1-5 ml. Transporte y conservación Las muestras deben enviarse al laboratorio tan pronto como sea posible. Hasta que esto suceda, mantener las muestras y el medio de transporte a temperatura ambiente. Observaciones. Es muy importante especificar en la solicitud la localización del absceso con vistas a la interpretación de los resultados. Si se carece de recipiente para transporte de muestra para anaerobios consultar al laboratorio. INFECCIONES DEL TRACTO GENITAL FEMENINO POST PARTO Endometritis Como se trata de una muestra que proviene del sitio que tiene gran cantidad y variedad de flora comensal, la selección de la misma y el método de recolección es crítico. Se recomienda el uso de hisopos protegidos para realizar la recolección vía cervix, evitando la contaminación con la flora vaginal. 272 Diagnóstico de laboratorio Procedimiento • La paciente no debe estar con menstruación. • Evitar las duchas ginecológicas día previo a la recolección de muestras, así como el uso de cremas vaginales. • Lavarse las manos • Colocarse guantes estériles • Colocar el espéculo. NO usar lubricante. • Introducir un catéter en el orificio cervical y a través de él se extiende el hisopo en la cavidad endometrial • Rotar el hisopo unos 30 segundos para obtener el material. • Si se dispone de medios de cultivo, realizar la siembra correspondiente; caso contrario colocar los hisopos en los medios de transporte adecuados. Transporte de la muestra • Enviar inmediatamente al laboratorio a temperatura ambiente. • NO refrigerar. RESUMEN PARA EL AISLAMIENTO E IDENTIFICACION DE PATOGENOS EN INFECCIONES INTRAHOSPITALARIAS TIPO DE MUESTRA RECOLECCION OBSERVACIONES 1. Absceso abierto Pasar el hisopo por el borde interno de la Limpiar la superficie con alcohol 70%. lesiónen forma de zig-zag. No del centro ni del borde externo. Luego depositar en medio de transporte Stuart. Absceso cerrado Aspirar con jeringa. Utilizar medio de transporte anaerobio Catéter i.v. Limpiar la piel con alcohol 70%, cortar Enviar inmediatamente al laboratorio asépticamente justo en la interfase. de urgencias evitando desecación. Utilizar tubo estéril para transporte Deposición Muestra de heces en frasco de boca ancha Limpiar la superficie con alcohol 70%. La muestra debe recolectarse durante 273 Vigilancia, prevención y control de infecciones asociadas a servicios de salud o hisopo en medio de la enfermedad entérica. Transporte Carry Blair. La búsqueda de Campylobacter, y Vibrio cholera se debe especificar. Frotis faríngeo Utilizando baja lenguas, frotar con una Para test Pack de Streptococcus grupo tórula la faringe posterior y amígdalas. A utilizar tórula de Dacrón. LCR Realizar la técnica bajo punción La obtención de la muestra es de aséptica estricta. responsabilidad del médico. Utilizar tubos estériles para la recolección. microbiológico: Gram, cultivo corriente, Considerar dentro del estudio de hongos, de Koch, latex. Enviar inmediatamente al laboratorio. Líquidos (Pleural, Desinfectar la piel con povidona yodada. La obtención de estas muestras está Peritoneal, articular, Obtener la muestra por punción con a cargo del médico. pericárdico) aguja y jeringa. Utilizar sistema de transporte anaeróbico ( menos de 1 ml) o sembrar en frascos de hemocultivo. Orina: 2ª. micción Mujeres: aseo prolijo de genitales con Se debe utilizar un frasco estéril, la gasa estéril una vez con agua jabonosa y muestra debe llegar al laboratorio luego sólo con agua. Utilizar sólo una antes de 30 minutos o ser mantenida vez cada gasa y siempre de adelante refrigerada por no más de 4 horas. hacia atrás. Mantener labios mayores De preferencia la primera orina de separados durante todo el procedimiento. la mañana o cualquier orina con Hombres: con el prepucio retraído, efectúe retención vesical mayor a 4 horas. aseo minucioso con agua y jabón del glande. Mantener el prepucio retraído hasta la obtención de la muestra. Solicite al paciente que comience a orinar, dejando caer los primeros 10 ml. Orina: Aseo prolijo. Proceder de la misma Debe utilizarse un frasco estéril si Recolector manera que con la orina de 2ª. micción se mantienen las condiciones antes (lactantes, Colocar el recolector asegurándose descritas para la orina de 2ª. micción. preescolares) buena adherencia a la piel. El recolector debe cambiarse La técnica al asecho no es la cada 30 minutos. Anotar que la recomendable por falsos positivos. muestra es de recolector. 274 Diagnóstico de laboratorio Orina: Sonda a Limpiar y desinfectar el área a La orina de la bolsa es inaceptable. permanencia. puncionar de la zona. Obtener la La punta de la sonda Foley muestra con aguja y jeringa estéril. tampoco es apta para cultivar. Y enviarla con su tapa para evitar Anotar que la orina fue obtenida contaminación. por sonda. Orina: Aseo prolijo como el ya descrito. Anotar que la muestra fue Cateterismo Colocar en forma aséptica el catéter en obtenida por cateterismo. la vejiga. Eliminar los primeros 10 ml de orina y luego recolectar la muestra en un frasco estéril. Enviar al Laboratorio de Urgencia antes de 30 min. Punción vesical Preparar área de punción según Identificar como punción vesical. procedimientos estándares. No utilizar cult dip (comercial) Puncionar vejiga justo por encima de Es la muestra indicada en caso de la sínfisis pubiana. Y enviar la jeringa sospecha de anaerobios. inmediatamente al Laboratorio de Urgencia para evitar su contaminación. Sangre Desinfectar con alcohol el tapón de El momento ideal para hacer la goma del frasco de hemocultivos. punción es durante la bacteriemia, Dejar secar 1 minuto. Desinfectar con es decir justo antes del pico febril. povidona yodada la zona a puncionar. Si esto no es posible, obtener 2 a Dejar secar 1 minuto. La proporción 3 hemocultivos mediante diferentes entre el volumen de sangre obtenida y punciones, en un período de 24 el volumen del caldo de cultivo horas separados por 30 - 90 min. debe estar en una relación 1:10. El volumen de sangre a extraer será: En caso de cirugías se toman Adultos: 10 a 30 mL (3 muestras) 5 muestras. Niños: 2 a 5 mL Lactantes: 2 a 3 mL Neonatos: 0,5 a 1 mL Dispositivos Usando guantes estériles limpiar con En caso de no poder enviar al intravasculares alcohol de 70º alrededor de la inserción laboratorio, se podrá mantener del catéter, retirar el catéter en forma refrigerada a 4º C. por 12 hrs. aséptica, cortar a 5 cm de la punta distal 275 Vigilancia, prevención y control de infecciones asociadas a servicios de salud del catéter dejando caer directamente en un tubo o frasco vació estéril con tapa de rosca. Enviar al laboratorio en los próximos 30 minutos para evitar desecación. Secreción Con un hisopo y medio de La muestra debe ser tomada por el endometrial transporte de Stuart o Amies. Obtener dos muestras de secreción profesional especializado siguiendo procedimientos normativos de su endometrial, una para el cultivo y otra Institución. para un frotis directo y coloración Gram. Se debe procesar en un máximo de Mantener a temperatura ambiente en el 14 horas. medio de trasporte hasta llegar al laboratorio. Tracto respiratorio Secreción obtenida por lavado bronco- En frasco estéril con tapa de rosca. inferior alveolar, aspirado transtraqueal. Menos de 2 hrs. A temperatura ( más de 1 ml) ambiente. En caso de volúmenes pequeños 15 a 30 min. Muestra obtenida con cepillo bronquial Conservar a 4ºC menos de 14 horas. Antes de procesar la muestra. Misma debe ser tomada por el médico. BIBLIOGRAFÍA.1. Damiani E, Jáuregui L, Panozo A.; Manual de Procedimientos Para la Detección de las Infecciones Intrahospitalarias, Laboratorio Nacional de Referencia de Bacteriología Clínica, Instituto Nacional de Laboratorios en Salud. INLASA, 2003, La Paz, Bolivia. 2. Zurita J. Recolección y Transporte de Muestras en Microbiología Clínica, Organización Panamericana de la Salud Ecuador, Quito 2004. 3. Koneman E., y col; Diagnóstico Microbiológico; Edit. Panamericana; 5ª. Ed.; Buenos Aires 1999. 4. Sacsaquispe C. R., Ventura E. G.; Manual de Procedimientos Bacteriológicos en Infecciones Intrahospitalarias; Instituto Nacional de Salud, Ministerio de Salud del Perú, año 2001. 5. Asociación Argentina de Microbiología; Bacteriemias e Infecciones de Dispositivos Intravasculares; Módulo 14, Santa Fe 1999. 6. Asociación Argentina de Microbiología; Infecciones Post-Quirúrgicas y Relacionadas a Traumatismos Diversos; Módulo 13, Santa Fe 1999. 276