Marzo 2016
Anuncio
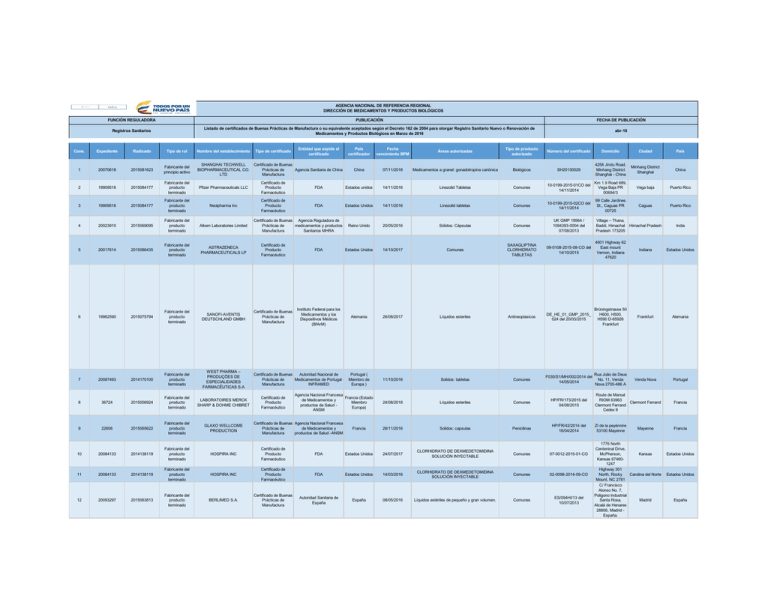
AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS Cons. 1 FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN Registros Sanitarios Listado de certificados de Buenas Prácticas de Manufactura o su equivalente aceptados según el Decreto 162 de 2004 para otorgar Registro Sanitario Nuevo o Renovación de Medicamentos y Productos Biológicos en Marzo de 2016 abr-16 Expediente 20070618 Radicado Tipo de rol Nombre del establecimiento 2015081623 Fabricante del principio activo SHANGHAI TECHWELL BIOPHARMACEUTICAL CO. LTD Tipo de certificado Entidad que expide el certificado Certificado de Buenas Prácticas de Agencia Sanitaria de China Manufactura País certificador China Fecha vencimiento BPM 07/11/2018 Áreas autorizadas Medicamentos a granel: gonadotropina cariónica Tipo de producto autorizado Biológicos Número del certificado Domicilio Ciudad País SH20130029 4258 Jindu Road, Minhang District Shanghai - China Minhang District Shanghai China Vega baja Puerto Rico 2 19909516 2015084177 Fabricante del producto terminado Pfizer Pharmaceuticals LLC Certificado de Producto Farmacéutico FDA Estados unidos 14/11/2016 Linezolid Tabletas Comunes Km 1.9 Road 689, 10-0199-2015-01CO del Vega Baja PR 14/11/2014 00694/3 3 19909516 2015084177 Fabricante del producto terminado Neolpharma Inc Certificado de Producto Farmacéutico FDA Estados Unidos 14/11/2016 Linezolid tabletas Comunes 10-0199-2015-02CO del 14/11/2014 99 Calle Jardines St., Caguas PR 00725 Caguas Puerto Rico 4 20023910 2015069095 Fabricante del producto terminado Alkem Laboratories Limited Reino Unido 20/05/2016 Sólidos: Cápsulas Comunes UK GMP 19564 / 1094393-0004 del 07/08/2013 Village – Thana, Baddi, Himachal Pradesh 173205 Himachal Pradesh India 5 20017614 2015086435 Fabricante del producto terminado ASTRAZENECA PHARMACEUTICALS LP Certificado de Producto Farmacéutico FDA Estados Unidos 14/10/2017 Comunes SAXAGLIPTINA CLORHIDRATO TABLETAS 09-0108-2015-08-CO del 14/10/2015 4601 Highway 62 East mount Vernon, Indiana 47620 Indiana Estados Unidos 6 19962590 2015075794 Fabricante del producto terminado SANOFI-AVENTIS DEUTSCHLAND GMBH Certificado de Buenas Prácticas de Manufactura Instituto Federal para los Medicamentos y los Dispositivos Médicos (BfArM) Alemania 26/08/2017 Líquidos esteriles Antineoplasicos DE_HE_01_GMP_2015_ 024 del 20/03/2015 Brüningstrasse 50 H600, H500, H590 D-65926 Frankfurt Frankfurt Alemania 7 20087493 2014170100 Fabricante del producto terminado WEST PHARMA – PRODUÇÕES DE ESPECIALIDADES FARMACÊUTICAS S.A Certificado de Buenas Autoridad Nacional de Prácticas de Medicamentos de Portugal Manufactura INFRAMED Portugal ( Miembro de Europa ) 11/10/2016 Solidos: tabletas Comunes F030/S1/MH/002/2014 del 14/05/2014 Rua João de Deus No. 11, Venda Nova 2700-486 A Venda Nova Portugal 8 36724 2015056924 Fabricante del producto terminado LABORATOIRES MERCK SHARP & DOHME CHIBRET 24/08/2018 Líquidos esteriles Comunes HP/FR/173/2015 del 04/08/2015 Route de Marsat RIOM 63963 Clermont Ferrand Clermont Ferrand Cedex 9 Francia 9 22606 2015065622 Fabricante del producto terminado GLAXO WELLCOME PRODUCTION Francia 28/11/2016 Solidos: capsulas Penicilinas HP/FR/42/2014 del 16/04/2014 ZI de la peyènnire 53100 Mayenne Francia 10 20084133 2014138119 Fabricante del producto terminado HOSPIRA INC Certificado de Producto Farmacéutico FDA Estados Unidos 24/07/2017 CLORHIDRATO DE DEXMEDETOMIDINA SOLUCIÓN INYECTABLE Comunes 07-0012-2015-01-CO 11 20084133 2014138119 Fabricante del producto terminado HOSPIRA INC Certificado de Producto Farmacéutico FDA Estados Unidos 14/03/2016 CLORHIDRATO DE DEXMEDETOMIDINA SOLUCIÓN INYECTABLE Comunes 02-0098-2014-09-CO 12 20093297 2015063813 Fabricante del producto terminado BERLIMED S.A. Certificado de Buenas Prácticas de Manufactura Autoridad Sanitaria de España España 08/05/2016 Líquidos estériles de pequeño y gran volumen. Comunes ES/094HI/13 del 10/07/2013 Certificado de Buenas Agencia Reguladora de Prácticas de medicamentos y productos Manufactura Sanitarios MHRA Certificado de Producto Farmacéutico Agencia Nacional Francesa Francia (Estado de Medicamentos y Miembro productos de Salud Europa) ANSM Certificado de Buenas Agencia Nacional Francesa Prácticas de de Medicamentos y Manufactura productos de Salud -ANSM Mayenne 1776 North Centeninal Drive, McPherson, Kansas Kansas 674601247 Highway 301 North, Rocky Carolina del Norte Mount, NC 2781 C/ Francisco Alonso No. 7, Poligono Industrial Santa Rosa, Madrid Alcalá de Henares 28806, Madrid España. Estados Unidos Estados Unidos España AGENCIA NACIONAL DE REFERENCIA REGIONAL DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS FUNCIÓN REGULADORA PUBLICACIÓN FECHA DE PUBLICACIÓN Registros Sanitarios Listado de certificados de Buenas Prácticas de Manufactura o su equivalente aceptados según el Decreto 162 de 2004 para otorgar Registro Sanitario Nuevo o Renovación de Medicamentos y Productos Biológicos en Marzo de 2016 abr-16 Cons. Expediente Radicado Tipo de rol Nombre del establecimiento Tipo de certificado Entidad que expide el certificado País certificador Fecha vencimiento BPM Áreas autorizadas Tipo de producto autorizado Número del certificado Domicilio Ciudad País 13 20090125 2015026558 Fabricante del producto terminado BLUPHARMA - INDUSTRIA FARMACEUTICA S.A. Certificado de Buenas Prácticas de Manufactura INFARMED PORTUGAL 28/10/2018 Productos no estériles, empaque primario, control de calidad antibiotico F001/S1/H/001/2016 en S. Martinho do Bispo, Coimbra, 3045-016 Coimbra PORTUGAL Francia 22/01/2017 Productos no estériles: Fabricación de cápsulas blandas. Empaque primario de cápsulas blandas. Antiespasmódico HPF/FR/198/2014 Francia 10/04/2016 Empaque primario: Cápsulas cubierta dura, cápsulas blandas, gomas masticable medicamentosa, tabletas. Empaque secundario. Antiespasmódico HPF/FR/222/2013 29, rue Leon Faucher 51100 REIMS, Francia Reims Francia 28/02/2017 Autorizado para fabricar y vender productos farmacéuticos y medicamentos para ensayos clínicos en Suiza; la licencia de fabricación excluye productos estériles siendo restringido a las formas de dosificación siguientes: hemostático de síntesis -formas de dosificación líquidas no hormonal -formas de dosificación semi sólidas -formas de dosificación sólidas (incluyendo productos biológicos, tal como lisados bacteriológicos) 14-1966 Route de Moncor 10, 1752 Villarssur-Glane, Suiza Villars-sur-Glane Suiza 29/11/2016 Productos estériles: certificación de lotes; Productos no estériles: Cápsulas duras, líquidos para uso interno, otras formas de dosificación hemostático de síntesis sólidas, semisólidos y tabletas; Productos no hormonal biológicos; Acondicionamiento: secundario y Pruebas de Control de Calidad: Microbiológicas no estériles, químicas y físicas. F022/S1/MH/002/2014 R. da Indústria, 2Quinta Grande, Amadora, 2610088, Portugal Amadora Portugal 14 20070928 2015066821 Fabricante del producto terminado LGV CAPSULES Certificado de Buenas Prácticas de Manufactura 15 20070928 2015066821 Acondicionador STRADIS Certificado de Buenas Prácticas de Manufactura 16 17 20013781 20013781 2015074217 2015074217 Empacador Fabricante del granel VIFOR S.A. OM PHARMA S.A. Certificado de Buenas Prácticas de Manufactura Agencia nacional de seguridad de los medicamentos y de los productos para la salud (ANSM), autoridad francesa competente Agencia nacional de seguridad de los medicamentos y de los productos para la salud (ANSM), autoridad francesa competente Agencia Suiza para Productos Terapéuticos (Swissmedic) Certificado de Buenas INFARMED- Autoridad Prácticas de Nacional de Medicamentos Manufactura y Productos sanitarios. I.P. Suiza Portugal 20 rue Louis Charles Vernin Dammarie-les-Lys 77190 Dammarieles-Lys, Francia Francia







