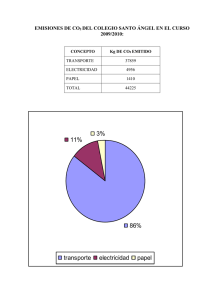
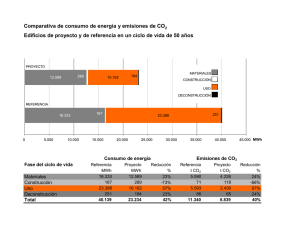
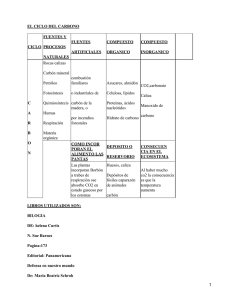
El CO2 como recurso - plataformabioclimatica.com
Anuncio

El CO2 como recurso De la captura a los usos industriales –1– Guías técnicas de energía y medio ambiente 19. El CO2 como recurso. De la captura a los usos industriales Autor Lourdes F. Vega Reservados todos los derechos. Está prohibido, bajo las sanciones penales y el resarcimiento civil previstos en las leyes, reproducir, registrar o transmitir esta publicación, íntegra o parcialmente, por cualquier sistema de recuperación y por cualquier medio, sea mecánico, electrónico, magnético, eletroóptico, por fotocopia o por cualquier otro, sin la autorización por escrito de la Fundación Gas Natural. Edita Fundación Gas Natural Plaça del Gas, 1 Edificio C, 3.ª planta 08003 Barcelona, España Teléfono: 93 402 59 00 Fax: 93 402 59 18 www.fundaciongasnatural.org 2.ª edición, 2011 ISBN: 978-84-614-1195-5 Depósito legal: B-28.351-2010 Impreso en España –2– Índice Prólogo de Pedro-A. Fábregas .............................................................................................................................................................7 Agradecimientos .................................................................................................................................................................................... 11 1. Introducción ....................................................................................................................................................................................... 13 1. El CO2 es un recurso............................................................................................................................................................................. 13 2. Cambio climático y CO2 .................................................................................................................................................................. 21 3. Crecimiento energético y desarrollo sostenible ......................................................................................... 25 4. Políticas de mitigación de emisiones de CO2 ................................................................................................. 33 5. Cómo cuantificar la reducción de emisiones de CO2.......................................................................... 37 6. Conclusiones ................................................................................................................................................................................................... 42 7. Bibliografía.......................................................................................................................................................................................................... 43 2. Captura de CO2 ........................................................................................................................................................................... 45 1. ¿Dónde puede ser capturado el CO2? ........................................................................................................................ 45 2. Tecnologías de captura de CO2 ............................................................................................................................................ 51 3. Procesos de captura y separación de CO2 .......................................................................................................... 60 4. Conclusiones ................................................................................................................................................................................................... 68 5. Bibliografía.......................................................................................................................................................................................................... 69 3. Transporte y almacenamiento de CO2 ................................................................................. 71 1. Transporte de dióxido de carbono .................................................................................................................................. 71 2. Almacenamiento de CO2: criterios .................................................................................................................................. 75 3. Almacenamiento y recuperación asistida de petróleo ..................................................................... 79 4. Almacenamiento en acuíferos salinos profundos................................................................................... 83 5. Almacenamiento en capas de carbón inexplotables .......................................................................... 86 6. Almacenamiento oceánico de CO2................................................................................................................................. 88 7. Selección y seguimiento de un almacén de CO2 ...................................................................................... 89 8. Costes asociados a la captura, transporte y almacenamiento de CO2 ..................... 92 9. Conclusiones ................................................................................................................................................................................................... 98 10. Bibliografía ...................................................................................................................................................................................................... 99 –3– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en recurso? ........................................................................................................................................... 101 1. ¿Es el almacenamiento la única vía posible?...............................................................................................101 2. La utilización del CO2 .......................................................................................................................................................................104 3. Tipología de usos del CO2.........................................................................................................................................................107 4. Fuentes actuales de CO2..............................................................................................................................................................109 5. Requisitos para los nuevos usos del CO2..........................................................................................................113 6. Huella del carbono y análisis del ciclo de vida ..........................................................................................114 7. Conclusiones ................................................................................................................................................................................................118 8. Bibliografía.......................................................................................................................................................................................................119 5. Usos industriales directos del CO2 ....................................................................................... 121 1. El CO2 y la alimentación...............................................................................................................................................................121 2. Aplicaciones del CO2 supercrítico .................................................................................................................................138 3. Tratamiento de aguas y CO2..................................................................................................................................................152 4. Conclusiones ................................................................................................................................................................................................160 5. Bibliografía.......................................................................................................................................................................................................161 6. Conversión del CO2 en usos biológicos y químicos ............................................................................................................................................. 165 1. Usos biológicos del CO2 ............................................................................................................................................................. 166 2. Conversión química del CO2 .................................................................................................................................................171 3. Tecnología para producir combustibles a partir de CO2 .............................................................180 4. Conclusiones ................................................................................................................................................................................................186 5. Bibliografía.......................................................................................................................................................................................................187 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual................................................................................................................................................................... 189 1. Panorama actual en proyectos de captura y almacenamiento de CO2 ............... 189 2. Proyectos de CAC parcialmente financiados por la Unión Europea.........................196 3. Proyectos sobre usos del CO2.............................................................................................................................................205 4. Conclusiones ................................................................................................................................................................................................208 5. Bibliografía.......................................................................................................................................................................................................209 –4– Glosario .......................................................................................................................................................................................................... 211 Índice de figuras ........................................................................................................................................................................... 217 Índice de tablas .............................................................................................................................................................................. –5– 223 –6– Prólogo La complejidad de la dinámica del cambio climático y su evolución en los últimos años, junto al creciente interés de los gobiernos, los científicos, los ciudadanos y las empresas, ha incidido positivamente en el desarrollo de nuevos ámbitos de conocimiento y nuevos planteamientos tecnológicos. Sin embargo, las grandes diferencias entre los diferentes países del mundo, por su situación de reservas de energías convencionales, o las posibilidades mayores o menores de acceder a las energías renovables, los mix energéticos históricos adecuados a la personalidad de cada país y también las diferentes situaciones de desarrollo económico y social, han dado lugar a un amplio abanico de planteamientos en relación a qué hacer en el proceloso mundo de la lucha contra el cambio climático. Las diferentes perspectivas pudieron verse con claridad en los planteamientos desarrollados en la última Conferencia de las Partes, celebrada en Copenhague en diciembre de 2009, y que debía haber orientado los años siguientes al conocido Protocolo de Kioto. También hay perspectivas, claramente minoritarias, que sencillamente niegan el cambio climático, o que indagan de forma persistente en posibles errores de los estudios y trabajos del IPCC, buscando, desde otras posiciones, su permanente descalificación. Debe remarcarse que no es imprescindible demostrar que el mundo se acabará para poder actuar. No es de recibo la actitud de que si el mundo no se acaba no es preciso hacer nada, y que, sencillamente mientras lo estamos discutiendo, es mejor no actuar. La situación es mucho más sencilla: emitir grandes cantidades de gases de efecto invernadero a la atmósfera no es bueno, con lo cual si podemos emitir menos estamos mejorando o perjudicando menos nuestro hábitat natural, con los consiguientes efectos beneficiosos sobre el planeta Tierra y su habitabilidad para la especie humana. Para intentar fijar y concretar la situación pueden aportarse algunas cifras y datos del –7– último informe World Energy Outlook 2009 de la Agencia Internacional de la Energía. La AIE indica que deberíamos conseguir que la concentración de CO2 en la atmósfera no pasase de 450 ppm, que sería el límite para que la temperatura aumente como máximo 2 grados centígrados, con lo cual la situación de deterioro aún sería reversible y no se entraría en una espiral climática no controlable. Para conseguir el resultado enunciado en 2030 deben realizarse una serie de actuaciones que permitan mejorar claramente la situación sobre el escenario tendencial, el del business as usual, reduciendo claramente las emisiones de gases de efectos invernadero para el conjunto de países del mundo, la Agencia Internacional de la Energía indica que la reducción debería conseguirse básicamente de la siguiente forma: • 60% eficiencia en el uso final de la energía • 20% energías renovables • 10% energía nuclear • 10% captura y secuestro de carbono En definitiva, la parte más importante debería provenir de no generar CO2 por el hecho de consumir menos energía, consiguiendo procesos claramente más eficaces; otra forma de consumir energía pero no generar CO2 es con energías renovables y nuclear; y finalmente, una parte pequeña, pero relevante a nivel mundial, debería provenir de generar el CO2 pero capturarlo y evitar que vaya a la atmosfera aumentando el efecto invernadero. Si a estas variables instrumentales le añadimos los otros elementos clásicos de una política energética, como son el aprovechamiento de todas las energías disponibles, la reducción de la intensidad energética de la economía, la seguridad de suministro y unos costes adecuados y competitivos, podríamos construir auténticos escenarios alternativos a la actual realidad de los diferentes países, desde una perspectiva más armónica e integradora de los diferentes elementos de lo que hemos venido en llamar sostenibilidad. –8– Entre los elementos de acción recomendados por la AIE, aparece la captura y secuestro de carbono, que quizás por su novedad, es un concepto relativamente poco conocido dado que está en los albores de su desarrollo, pero cuyo efecto puede equipararse al de la energía nuclear en el año 2030, o al 50% del efecto de todas las energías renovables, lo cual indica una indudable importancia y consistencia en el horizonte del medio y largo plazo, aparte de que es prácticamente la única alternativa para poder utilizar las grandes reservas de carbón existentes sin afectar gravemente al medio ambiente en cuanto a emisiones de CO2. La primera solución es la captura o secuestro del dióxido de carbono, para lo cual existen diferentes tecnologías y procesos para después transportarlo a lugares donde sea posible almacenarlo durante mucho tiempo de forma segura y así impedir su emisión a la atmosfera, con lo cual se evita en parte el agravamiento del efecto invernadero. Sin embargo, este camino aún no totalmente resuelto a nivel de costes competitivos y tecnologías totalmente maduras, nos parecía poco y nos fuimos adentrando en las posibilidades de en lugar de almacenar sine die el CO2 , indagar sobre las posibilidades y las tecnologías en la línea de conseguir hacer algo con el dióxido de carbono, utilizarlo como elemento de otros procesos donde este gas residual pudiese aportar algo positivo por su características inocuas, y no contaminantes, y la facilidad de tomar un aspecto sólido, líquido, gaseoso, o supercrítico, con sus indudables flexibilidades y ventajas. Si el secuestro del CO2 es una tecnología incipiente que alcanzará sus niveles de madurez en 20 años, la utilización como materia prima está aun más allá, pero es indudablemente una labor de frontera deseable, altamente estimulante, y que abre unas grandes expectativas de futuro. Por todo ello, la Fundación decidió realizar un libro que permitiese describir de forma clara y concisa los diferentes conceptos y tecnologías, encargando el trabajo a una reconocida experta de estos ámbitos como es la Doctora Lourdes F. Vega, directora de I+D de Carburos Metálicos, perteneciente al grupo multinacional Air Products, y directora de MATGAS, el centro de investigación especializado puesto en marcha por la Universidad Autónoma de Barcelona, el Consejo Superior de Investigaciones Científicas y Carburos Metálicos, dentro del campus universitario de Bellaterra (Barcelona). –9– El resultado del trabajo nos parece realmente magnífico, por el rigor científico y la amenidad del discurso que permite satisfacer un amplio abanico de inquietudes y avanzar claramente en el conocimiento de una temática poco conocida y de un indudable interés. Esperamos que la publicación de este libro, estimule el avance de las mejores prácticas sostenibles en la industria española, con elementos de modernidad, desarrollo e innovación tecnológica, que permitan avanzar en el nivel de competitividad y ajuste necesario en un contexto cada vez más global. Pedro-A. Fábregas Director General Fundación Gas Natural –10– Agradecimientos La ciencia puede convertirse en una pasión cuando aquello en lo que trabajas tiene una aplicación directa y positiva en lo que nos rodea y en la sociedad. Cuando hace unos años comenzó mi interés por los usos del CO2 como alternativa al almacenamiento geológico nunca pensé que acabaría plasmando mi conocimiento en un libro de carácter divulgativo. Sin embargo, ha sido un proceso apasionante, que me ha permitido aprender con más detalle varias cuestiones que de otra manera no conocería, y que hacen que aún me parezca un tema más atrayente y en el que vale la pena seguir trabajando. Además, este libro me ha permitido interactuar más estrechamente con un equipo humano maravilloso. Quiero agradecer a la Fundación Gas Natural la oportunidad que me brinda de compartir estos conocimientos con todos vosotros, y, muy especialmente, a Manuel Ludevid, su perseverancia para que esto comenzara y llegara a término, su paciente revisión de cada capítulo, su seguimiento tan cercano, y su amistad. A Pedro-A. Fábregas, director de la Fundación, a Nuria Velasco y a todo el equipo, los momentos que hemos compartido y su acogida para que desde el principio me sintiera como en casa. Mi agradecimiento más sincero también a Arturo Meler, el diseñador que con paciencia ha esperado, ha trabajado y ha conseguido poner su impronta artística en el libro, y a Rosa Balart, la correctora de estilo, otro gran instrumento. Por lo que respecta a la parte técnica, agradezco profundamente a Javier Alonso, de Gas Natural Fenosa, su importante contribución a los primeros capítulos, su visión de experto y sus comentarios siempre positivos. Mis compañeros de MATGAS y Carburos Metálicos también han jugado un papel esencial, especialmente Roberta Pacciani, Oriol Ossó, Sonia Guri y Joaquim Torres, que, como expertos en las distintas áreas –11– relacionadas con el CO2, han ido dejando su huella y han revisado pacientemente partes importantes del libro. Mención especial merecen Jose Luis Méndez, Ataulfo Caveda y Javier Godoy, de Carburos Metálicos, y Concha Domingo, del ICMAB-CSIC, quienes durante años han compartido conmigo toda su sabiduría y su pasión por el CO2, que han sabido transmitirme de una manera natural. Agradezco también a Vicente Cortés, de la Fundación Ciudad de la Energía, y a Francisco García Peña y Pedro Casero, de ELCOGAS, la gentileza de proporcionarme la información necesaria sobre los proyectos de captura de CO2 que están liderando, su disponibilidad y el intercambio de opiniones que a lo largo de estos años hemos compartido. Finalmente, pido disculpas a Jordi, Anna, Marta y David, por todo el tiempo que les he robado para dedicárselo al libro. Les agradezco su amor, su paciencia, sus fines de semana diferentes y sus contribuciones, ellos saben ahora un poco más sobre el CO2 y yo sobre cómo comunicarlo. Espero que este libro sirva para transmitir esa visión positiva que el CO2 se merece, y para que todos contribuyamos a mejorar, en lo posible, el futuro de nuestros hijos cuidando de nuestro planeta. Barcelona, Mayo 2010 Lourdes F. Vega –12– Prólogo 1 Introducción Sé tú mismo el cambio que quieres ver en el mundo. Mahatma Gandhi En los últimos años, existe una alarma científica y social en torno al CO2 que también se refleja en los medios de comunicación, en la literatura e incluso en el cine. Fruto de esa alarma, y por su relación con el cambio climático, en muchas ocasiones se identifica, erróneamente, al CO2 como un compuesto nocivo y dañino. El objetivo de este capítulo es mostrar el panorama actual en torno a este tema, antes de pasar a analizar en detalle, en los siguientes capítulos, cómo capturarlo, tratarlo, transportarlo, almacenarlo, así como sus usos presentes y futuros en el mercado. Se pretende mostrar, en primer lugar, qué es el CO2 , cuáles son sus propiedades, ilustrando algunos de sus usos actuales, el ciclo del CO2 y su relación con el cambio climático, así como el panorama actual en cuanto a las fuentes emisoras de CO2 y otros gases de efecto invernadero. 1. El CO2 es un recurso 1.1. ¿Qué es el CO2? El dióxido de carbono, también llamado anhídrido carbónico o gas carbónico, es un gas inodoro, incoloro, ligeramente ácido y no inflamable. Está formado por moléculas lineales de un átomo de carbono ligado a dos átomos de oxígeno, de la forma O = C = O. Su fórmula química es CO2. Es soluble en agua cuando la presión se mantiene constante, y, a pesar de que a temperatura y presión ambiente se encuentra en forma gaseosa (por eso se dice que es un gas), puede ser tanto un líquido como un sólido o un fluido supercrítico, –13– dependiendo de las condiciones de presión y temperatura en que se encuentre. Así, si se somete a temperaturas inferiores de –79 °C a presión atmosférica solidifica, formando la nieve carbónica, mientras que pasa de la fase líquida o vapor a ser un fluido supercrítico a la temperatura de 31 °C y presión de 73 atmósferas. Se llama nieve carbónica o hielo seco al estado sólido del dióxido de carbono. Recibe este nombre porque, pese a parecerse al hielo o a la nieve por su aspecto y temperatura, cuando se evapora (o, más propiamente, cuando se sublima) no deja residuo de humedad. El hielo seco fue obtenido por primera vez en 1825 por el químico francés Charles Thilorier [1]. Un fluido supercrítico es aquel estado de la materia en que se encuentra cualquier sustancia en condiciones de presión y temperatura superiores a su punto crítico. Posee unas propiedades típicas, lo que habitualmente se denomina como «híbrido entre un líquido y un gas», es decir, puede difundir como un gas, y disolver materiales como un líquido. Por encima de las condiciones críticas, pequeños cambios en la presión y la temperatura producen grandes cambios en la densidad. En 1869, Thomas Andrews, en sus estudios con CO2 a presión, a distintas temperaturas, reconoció por primera vez la existencia del punto crítico (31,1 °C). En dicho punto, desaparecía el límite entre gas y líquido. Andrews sugirió que existía una temperatura crítica para cada gas, como se comprobó más tarde para todos los gases. En la figura 1.1 se muestra el diagrama de fases del CO2 en función de la presión y la temperatura, donde pueden observarse las regiones en las que el compuesto se encuentra en estado sólido, líquido, vapor o supercrítico. Las líneas en el diagrama marcan las zonas de coexistencia de dos fases (por ejemplo, sólido-líquido o líquido-gas), mientras que las regiones donde sólo aparece una fase aparecen señaladas con el nombre de la fase a esas condiciones termodinámicas de presión y temperatura. En el punto triple coinciden las tres fases (sólido, líquido y vapor) y, a partir del punto crítico, definido anteriormente, existe el estado supercrítico, en el que no se distingue el vapor del líquido. Las fotos muestran el CO2 en dos estados de coexistencia a lo largo de la línea. De izquierda a derecha corresponden a nieve carbónica y gas (a temperaturas y presiones bajas), tres estados donde coexisten el líquido y el gas a distintas temperaturas y presiones, entre el punto triple y el punto crítico, y, por último, el estado supercrítico. –14– 1. Introducción Figura 1.1. Diagrama de fases del CO2 en función de la presión y la temperatura donde se muestran las distintas fases en equilibrio y el CO2 supercrítico. Al ser el dióxido de carbono un compuesto no tóxico, no inflamable y abundante en la naturaleza, se le considera un solvente «verde» (o medioambientalmente benigno) comparado con otros compuestos volátiles orgánicos a los que podría reemplazar en numerosos procesos químicos. Sus propiedades físicas y químicas son las que hacen que en la actualidad pueda ser usado en multitud de procesos industriales, y son precisamente esas características las que potenciarán su uso en aplicaciones futuras. –15– 1.2. El ciclo del carbono El carbono es un elemento químico de número atómico 6 y símbolo C. Es sólido a temperatura ambiente. Es el pilar básico de la química orgánica. Se conocen cerca de 10 millones de compuestos de carbono, y forma parte de todos los seres vivos conocidos. La reserva fundamental de carbono, en moléculas de CO2 que los seres vivos pueden asimilar, es la atmósfera y la hidrosfera. Este gas está en la atmósfera en una concentración de más del 0,03% y cada año, aproximadamente, un 5% de estas reservas de CO2 se consumen en los procesos de fotosíntesis, es decir que todo el anhídrido carbónico se renueva en la atmósfera cada 20 años. La vuelta natural de CO2 a la atmósfera se hace cuando, en la respiración, los seres vivos oxidan los alimentos produciendo CO2 . En el conjunto de la biosfera, la mayor parte de la respiración la hacen las raíces de las plantas y los organismos del suelo y no, como podría parecer, los animales más visibles. El ciclo del carbono se divide en dos partes, el llamado ciclo biológico y el ciclo geológico o biogeoquímico. El ciclo biológico se refiere al intercambio de CO2 entre los seres vivos y la atmósfera. Este ciclo es relativamente rápido; como se ha comentado, la renovación del carbono atmosférico se produce aproximadamente cada 20 años. Por su parte, el ciclo biogeoquímico (o ciclo geológico) regula la transferencia de carbono entre la atmósfera y la litosfera (océanos y suelo). En este segundo ciclo, el CO2 atmosférico se disuelve en agua formando ácido carbónico que ataca los silicatos que constituyen las rocas, resultando iones bicarbonato. Estos iones disueltos en agua alcanzan el mar, son asimilados por los animales para formar sus tejidos y, tras su muerte, se depositan en los sedimentos. El retorno a la atmósfera se produce en las erupciones volcánicas tras la fusión de las rocas que lo contienen. Este ciclo es de larga duración, al verse implicados los mecanismos geológicos. Además, hay ocasiones en las que la materia orgánica queda sepultada sin contacto con el oxígeno que la descomponga, produciéndose así la fermentación que lo transforma en carbón, petróleo y gas natural, los recursos que estamos consumiendo en grandes cantidades en los últimos siglos para satisfacer nuestras necesidades energéticas. –16– 1. Introducción Figura 1.2. Esquema donde se muestra el ciclo del carbono. Se recogen los intercambios de CO2 entre los distintos reservorios tanto en el ciclo biológico como en el biogeoquímico. 1.3. La producción del CO2 El dióxido de carbono puede obtenerse a partir de distintos procedimientos, algunos de los cuales son procesos biológicos, otros químicos y otros industriales. En algunos casos, es el producto buscado para diferentes usos industriales, pero en otros casos es simplemente un subproducto no deseado, que se desecha emitiéndolo a la atmósfera. Existen numerosas reacciones químicas que dan como producto CO2 , incluyendo, por ejemplo, la reacción entre muchos ácidos y la mayoría de los metales. Asimismo, la combustión de todos los combustibles fósiles (derivados del petróleo, carbón y gas natural) y de la madera producen CO2 , en muchos casos acompañado de agua. En estos casos el CO2 es, en principio, un producto no deseado, que se desecha, emitiéndolo a la atmósfera. Por otra parte, todos los organismos aeróbicos producen CO2 cuando oxidan carbohidratos, ácidos grasos y proteínas en las mitocondrias de las células. –17– Por lo que respecta a la producción industrial de CO2, éste puede obtenerse de distintas fuentes: 1) a partir de la captura y separación del CO2 obtenido mediante la combustión de combustibles fósiles y madera, 2) como subproducto de las plantas de producción de hidrógeno a partir del reformado de gas natural, 3) como subproducto de la fermentación de azúcares en la elaboración de cervezas, whisky y otras bebidas alcohólicas, 4) a partir de la descomposición térmica de la piedra calcárea (carbonato de calcio – CaCO3) en la manufacturación de la cal (óxido de calcio – CaO), 5) como subproducto de la manufacturación de fosfato de sodio y 6) a partir de fuentes naturales, donde se produce por la acción del agua acidificada en piedra calcárea o dolomita. Además, se emite CO2 de manera natural en los géiseres y en la erupción de los volcanes. Figura 1.3. Distintas fuentes de producción de CO2. 1.4. Usos actuales del CO2 El CO2 generado a partir de estos procedimientos se utiliza en numerosas aplicaciones. En el gráfico 1.4 se recogen de manera esquemática algunas de ellas. –18– 1. Introducción Figura 1.4. Algunas aplicaciones actuales del CO2 en distintos sectores. De hecho, en nuestra vida diaria es muy probable que de una forma u otra nos encontremos con este compuesto, o que incluso lo comamos o bebamos. El CO2 se usa en aplicaciones que abarcan desde el tratamiento de aguas (como modificador de pH para tratamiento de aguas residuales, como fuente de minerales en agua desmineralizada o para el tratamiento de aguas de recreo), la limpieza de ropa, la extracción de productos naturales (incluyendo la extracción de la cafeína o la grasa del chocolate), el crecimiento acelerado de plantas en invernaderos, la extinción de incendios, y el tratamiento de productos alimentarios (tanto en la carbonatación de bebidas como la Coca-Cola® o la cerveza, como en la conservación de alimentos en atmósfera modificada), o para la producción de otros productos químicos. –19– En el campo de la electrónica, el CO2 es empleado generalmente en el tratamiento de efluentes líquidos, como solvente en soluciones para la limpieza de chips o durante el enfriamiento de los componentes electrónicos en los ensayos climáticos. En usos medicinales cabe destacar tres grandes aplicaciones: 1) se utiliza en la manipulación de órganos artificiales, ya que produce una atmósfera similar a las condiciones fisiológicas, 2) mezclado con aire u oxígeno se usa como estimulante para mejorar la aireación del sistema respiratorio y 3) se usa en la dilatación quirúrgica para la realización de laparoscopia abdominal. Por lo que respecta a sus aplicaciones en el campo de la síntesis química, se usa para producir otros compuestos. Estos procesos químicos incluyen, entre otros, la urea (que después se usa para la obtención de fertilizantes), el ácido acetilsalicílico, los carbonatos cíclicos y los policarbonatos, de numerosas aplicaciones en el mercado. 1.5. Retos para ampliar los usos del CO2 Además de los procesos industriales mencionados, el CO2 sirve también como fuente de carbón para la fotosíntesis de las plantas. Como se ha visto, desempeña un papel esencial en el ciclo del carbono en la tierra, y es un ingrediente necesario en el ciclo de vida de animales y plantas. En sí mismo, el CO2 no sólo no es un compuesto perjudicial, sino que puede resultar altamente beneficioso. La «mala prensa» que tiene actualmente el dióxido de carbono se debe a que existen evidencias científicas que demuestran que cantidades excesivas de CO2 en la atmósfera resultan perjudiciales para nuestro planeta, siendo esta concentración una de las causas del cambio climático, relacionado con el efecto invernadero [2]. Por tanto, para evitar el exceso de CO2 en la atmósfera debe evitarse que llegue a la misma, para lo cual existen distintas alternativas: 1) capturarlo en las fuentes de emisión y almacenarlo en lugares seguros, 2) mejorar la eficiencia energética, 3) buscar fuentes alternativas de energía que no produzcan CO2, 4) buscar nuevas formas de usarlo, ampliando sustancialmente sus aplicaciones actuales, especialmente si ello implica captura permanente con valorización. A pesar del atractivo que presenta la valorización frente al almacenamiento o secuestro permanente, debemos ser conscientes de que dicha valorización cuenta, sin embargo con barreras importantes [3], [4] como son: –20– 1. Introducción 1) su coste: para obtener CO 2 es preciso capturarlo, separarlo, purificarlo y transportarlo en condiciones adecuadas hasta su lugar de almacenamiento para su uso posterior. Esto lleva asociado un coste, especialmente el proceso de captura y separación. 2) existe la posibilidad de hacer reaccionar químicamente el CO2 y convertirlo en otro compuesto (conocido como conversión química), sin embargo, dada la estabilidad de la molécula de CO2, este proceso requiere una cantidad de energía considerable, necesitándose, además, una fuente de CO2 y co-reactivos para la reacción. 3) comparado con otros gases o productos químicos, actualmente el mercado del CO2 es limitado. De hecho, existen aún pocos incentivos y falta de compromiso industrial para acrecentar los compuestos químicos basados en unidades de carbono. 4) además, se detecta una falta actual de incentivos socioeconómicos que motiven la inversión y búsqueda de nuevas aplicaciones. Aún no existe una presión social, ni política, ni económica que lleve a invertir seriamente en la búsqueda de nuevas aplicaciones del CO2. Estas barreras se irán revisando a lo largo de este libro, así como posibles soluciones para superarlas. 2. Cambio climático y CO2 Para entender por qué las emisiones de CO2 están afectando al cambio climático y buscar soluciones que, al menos, atenúen el problema, debemos revisar cómo se ha alterado el ciclo del carbono y la relación de su desajuste con el efecto invernadero. ¿Cómo se origina el desajuste en el ciclo del carbono, cuándo y por qué?, ¿es posible volver atrás? Se estima que desde 1750 (casi coincidiendo con la Revolución Industrial) el aumento del dióxido de carbono en la atmósfera ha sido del 30%, dando lugar, de forma directa, al incremento de la temperatura global y a la radicalización del efecto invernadero. Para seguir avanzando, y ver la relación entre las emisiones de CO2 a la atmósfera con el cambio climático, cabría ver en primer lugar qué se entiende por efecto invernadero y su relación con el cambio climático: la humanidad está alterando la concentración de ciertos gases en la atmósfera, dichos gases reducen la pérdida neta de radiación infrarroja hacia el espacio, parte de la radiación vuelve a la Tierra, lo que hace que la temperatura de la superficie terrestre sea más cálida y se produzca el denominado «efecto invernadero» (ya que el calentamiento es similar al que ocurre en un invernadero), llamándose a estos gases «gases de efecto invernadero» (GEI) [2]. –21– Ciertos gases de efecto invernadero surgen naturalmente, pero están influenciados directa o indirectamente por la actividad humana, mientras que otros son totalmente antropógenos, generados por dicha actividad. Los principales gases que surgen naturalmente son: vapor de agua (H2O), dióxido de carbono (CO2), ozono (O3), metano (CH4) y óxido nitroso (N2O). Los principales grupos de gases de efecto invernadero completamente antropógenos son: clorofluorocarbonos (CFC), hidrofluorocarbonos (HFC) e hidroclorofluorocarbonos (HCFC) (a los que se denomina colectivamente halocarbonos), y las especies totalmente fluorinadas, como el hexafluoruro de azufre (SF6). El vapor de agua es el mayor contribuyente al efecto invernadero natural y es el que está más directamente vinculado al clima y, por consiguiente, menos controlado directamente por la actividad humana. Esto es así porque la evaporación depende fuertemente de la temperatura de la superficie, y porque el vapor de agua atraviesa la atmósfera en ciclos muy rápidos, de una duración, por término medio, de unos ocho días. Por el contrario, las concentraciones de los demás gases de efecto invernadero están sujetas a la influencia fuerte y directa de las emisiones asociadas con la quema de combustibles fósiles, algunas actividades forestales, agrícolas y ganaderas, y la producción y el empleo de diversas sustancias químicas. Excepto el ozono, todos los gases de efecto invernadero directamente relacionados con las emisiones humanas están bien mezclados en la atmósfera, de forma que su concentración es casi la misma en cualquier parte del planeta y es independiente del lugar donde se produce. El ozono también difiere de los demás gases de efecto invernadero porque no se emite directamente hacia la atmósfera, sino que es fabricado por reacciones fotoquímicas en las que participan otras sustancias, denominadas «precursores», que sí se emiten directamente. En lo que respecta a los procesos de eliminación, todos los gases de efecto invernadero, excepto el dióxido de carbono, se eliminan en buena parte a través de reacciones químicas o fotoquímicas dentro de la atmósfera. Por el contrario, el dióxido de carbono efectúa ciclos continuos entre varios «reservorios» o depósitos de almacenamiento temporales (atmósfera, plantas terrestres, suelos, aguas y sedimentos de los océanos), lo que es conocido como el ciclo del carbono, que es el que se ha visto alterado en los últimos siglos. Tal y como se ha comentado anteriormente, el «problema» actual del CO2 no deriva de su carácter nocivo, que no lo es, ya que como hemos visto es bueno y necesario, sino de su elevada concentración en la atmósfera, que desequilibra el ciclo natural. En la siguiente gráfica (figura 1.5) se observa cómo la concentración de CO2 (representada en partes por millón) se ha mantenido estable (con fluctuaciones periódicas) durante casi 400.000 años, mientras que ha experimentado una subida dramática en los últimos 200 años, coincidiendo con la Revolución Industrial [5]. –22– 1. Introducción La concentración de CO2 durante este largo periodo de tiempo se ha calculado utilizando los núcleos de hielo de Vostok. El método de núcleos de hielo se basa en el estudio de muestras de nieve y hielo acumulados durante muchos años, que han recristalizado, y que contienen en su interior burbujas de aire de los periodos de tiempo anteriores. La composición de estos núcleos de hielo, en especial la presencia de hidrógeno, isótopos de oxígeno y dióxido de carbono, ofrece un panorama del clima del momento. Figura 1.5. Concentración de dióxido de carbono en la atmósfera en los últimos 400.000 años. El círculo rojo de la derecha enmarca la concentración en los últimos 1.000 años, ampliado en la parte superior de la gráfica. [5] Tal y como se observa en la figura 1.5, los cambios más significativos en la concentración de CO 2 durante 400.000 años se relacionan con los ciclos glaciares/interglaciares durante la edad de hielo. Aunque los ciclos glaciares se asocian más directamente con cambios en la órbita de la Tierra, estos cambios también afectan al ciclo del carbono, que a su vez afecta al sistema glaciar. –23– Así pues, la concentración de CO2 en la atmósfera ha ido aumentando de manera paulatina en los últimos siglos, pasando de una concentración casi estable en torno a las 300 ppm (desde el año 1000) a 389 ppm en el año 2000, existiendo una correlación directa con el aumento de la temperatura en dichos años [2], tal y como se muestra en la figura 1.6. Figura 1.6. Concentración de CO2 en la atmósfera, en partes por millón (ppm) en el eje izquierdo (línea azul) y aumento de la temperatura media, en el eje vertical derecho, en función de la temperatura (línea roja), en los últimos 1.000 años. [2] Cabe resaltar que en la gráfica 1.5 se muestran los niveles históricos de dióxido de carbono en los núcleos de hielo promediados aproximadamente cada 1000 años, mientras que actualmente la concentración de CO2 en la atmósfera se mide anualmente. –24– 1. Introducción 3. Crecimiento energético y desarrollo sostenible Existe una clara correlación entre el desarrollo tecnológico y el aumento paulatino de las emisiones de gases de efecto invernadero, de manera similar a como existe una correlación directa entre el aumento de la concentración de CO2 en la atmósfera y el aumento de la temperatura (figura 1.5). De hecho, el aumento vertiginoso de la concentración de CO2 está directamente relacionado con los grandes avances que han hecho que nuestro mundo hoy sea mejor, al menos en cuanto al desarrollo tecnológico asociado a la calidad de vida se refiere. Citamos aquí algunos de los inventos más relevantes en el avance tecnológico de nuestra sociedad, con la fecha en la que se produjeron, relacionados todos ellos en cierta medida con el aumento de las emisiones de CO2 y otros gases de efecto invernadero (ver figura 1.7). Curiosamente, la fecha de aparición de estos inventos, y su posterior uso masivo, está íntimamente ligada al aumento del CO2 en la atmósfera [4]: - en 1769 se inventó la máquina de vapor, - en 1787 el barco de vapor, - en 1860 el automóvil, - en 1900 el avión, - en 1971 los microprocesadores que dan lugar al uso masivo de ordenadores años después y, - en los últimos años, el aumento incesante e ininterrumpido de las industrias generadoras de energías, como motoras del desarrollo tecnológico. Este desarrollo tecnológico está asociado al transporte, a una demanda cada vez mayor de energía, y a otras industrias, siendo éstas las tres grandes fuentes de emisión de CO2 y otros gases de efecto invernadero, y también los tres pilares en los que se apoya la sociedad de bienestar de la que disfrutamos hoy. –25– 1769 - Máquina vapor Figura 1.7. Avances tecnológicos destacados en los últimos siglos y su relación con la concentración de CO2 en la atmósfera (figura adaptada con el permiso de M. Maroto-Valer, U. Nottingham). En la siguiente gráfica, extraída del libro Un planeta en busca de energía, de Pedro GómezRomero [6], se observa una interesante correlación entre el consumo de electricidad y el índice de desarrollo humano, mostrándose que los países industrializados, que poseen el índice de desarrollo más elevado (eje de ordenadas), son los que consumen más electricidad (eje de abscisas). En dicha gráfica se observa también que este mayor consumo eléctrico lo llevan a cabo países donde las horas de luz solar en jornada laboral son muy reducidas durante varios meses al año, siendo además países fríos, y que necesitan, por tanto, un mayor aporte energético para conseguir un confort de temperatura. –26– 1. Introducción Figura 1.8. Correlación entre el consumo de electricidad por habitante y año (kWh) en 2002 y el índice del desarrollo humano en 2003 [6]. Existe pues una relación directa entre el consumo de energía y el índice de desarrollo humano, siendo este índice el que proporciona un mayor bienestar (en el sentido de desarrollo tecnológico) que pocas sociedades avanzadas estarían dispuestas a sacrificar. Es en este contexto en el que como sociedad y ciudadanos responsables debemos buscar un desarrollo sostenible. El dilema es: ¿se debe detener el desarrollo tecnológico en pro de la desaceleración del cambio climático?, ¿estamos dispuestos a hacerlo en términos económicos y sociológicos? La respuesta parece obvia, al menos desde un punto de vista práctico, por tanto, el reto no está en frenar el desarrollo tecnológico, sino en desacoplar las emisiones de gases de efecto invernadero del desarrollo tecnológico. En definitiva, se trata de mantener el compromiso con el desarrollo sostenible, definido en el Informe de la Comisión Mundial sobre el Medio Ambiente y el Desarrollo (Comisión Brundtland) [7] como «el desarrollo que se realiza para satisfacer las necesidades de las generaciones presentes sin comprometer las posibilidades de las del futuro para atender sus propias necesidades». El desarrollo sostenible es la intercesión de tres tipos de desarrollo, el económico del –27– que veníamos hablando, que debe ser viable y equitativo, el desarrollo social, que debe ser equitativo y soportable, y el desarrollo ecológico, que debe ser soportable y viable. La intersección de todos estos atributos tiene un factor común, que es, precisamente, la sostenibilidad. Gráficamente: Figura 1.9. El desarrollo sostenible y su relación con el desarrollo económico, social y ecológico. Ante este dilema, ¿hacia dónde debemos ir?, ¿qué medidas tomar? Se plantea la necesidad de un acuerdo global. En este sentido, uno de los grandes logros en la lucha por el cambio climático y la reducción de emisiones de gases de efecto invernadero lo constituye el llamado Protocolo de Kioto [8]. Se trata de un compromiso formal de los países firmantes, el 11 de diciembre de 1997, para reducir sus emisiones de gases de efecto invernadero en un 5,2% de media en el periodo 2008-2012 con respecto a los niveles alcanzados en 1990. Su objetivo es luchar contra el cambio climático mediante una acción internacional de reducción de las emisiones de determinados gases de efecto invernadero. El Protocolo prioriza la reducción de los principales gases de efecto invernadero estableciendo una serie de medidas como son el cambio a fuentes de energías limpias, la mejora de la eficiencia energética y políticas de ayuda para mitigar el cambio climático. El Protocolo fue inicialmente firmado por 83 países y ratificado por 46 de ellos en 1997. En 2001 eran ya 180 países adheridos a dicho compromiso. En 2004 –28– 1. Introducción lo ratificó Rusia. De los grandes emisores, sólo se habían adherido la Unión Europea y Japón, mientras que China y Estados Unidos decidieron quedarse fuera. Existe pues un claro marco en el que luchar contra el cambio climático hasta 2012, al menos para los países firmantes de dicho protocolo. ¿Qué ocurrirá tras 2012, la era post-Kioto? La Convención Marco de las Naciones Unidas sobre el Cambio Climático (CMNUCC) organiza conferencias anuales desde 1995 para preparar futuros objetivos que reemplacen a los del Protocolo de Kioto. La última edición de la Conferencia Internacional sobre el Cambio Climático (también denominada COP15) se celebró en Copenhague, Dinamarca, del 7 al 18 de diciembre de 2009. La cumbre transcurrió en un clima de tensión entre los países desarrollados y los países en vías de desarrollo, representando un papel importante los dos grandes emisores de CO2 por el uso de combustibles fósiles, EE. UU. y China, y los países en vía de desarrollo. Aunque el texto del acuerdo aún no es definitivo, entre los mínimos consensuados sí destaca el compromiso de reducir las emisiones globales en un 50% en 2050 por debajo de los niveles alcanzados en 1990, pero no se han definido aún cuáles deberían ser las reducciones intermedias entre 2012 y 2050, ni los compromisos individuales que se deben alcanzar. Asimismo, se acordó que los países desarrollados deben proveer de fuentes de financiación suficientes y sostenibles, así como de tecnologías para apoyar la implementación y las medidas de adaptación a fin de evitar dichas emisiones en los países en vías de desarrollo, sin concretar aún cómo se llevará a cabo dicha contribución. Independientemente de los acuerdos de la última cumbre y de su ratificación, Europa ha emprendido un camino hacia la reducción de gases de efecto invernadero en la atmósfera, tomando una serie de medidas para ello. España, como parte de la Unión Europea (UE), participa en un objetivo global de buscar soluciones a esta problemática, centrándose en el desarrollo y la aplicación de tecnologías adecuadas para ello. Los objetivos adoptados por la UE para el 2020 con respecto al protocolo de Kioto son: reducir las emisiones de gases de efecto invernadero en un 20% respecto a los niveles de 1990, reducir en un 20% la energía primaria consumida, aumentar a un 20% la contribución de las energías renovables, y establecer el objetivo mínimo del 10% para los biocombustibles del total de combustible utilizado en los vehículos. Para cumplir con el protocolo de Kioto y con lo acordado en la UE, el compromiso de España es limitar las emisiones a un 15% respecto al valor de sus emisiones de 1990. Para España el reto es muy importante, ya que en el año 2007 las emisiones de CO2 se situaban en un 59,1% por encima de las de 1990. El incumplimiento del Protocolo de Kioto podría representar para la economía española hasta 4.500 millones de euros anuales. Urge, pues, tomar medidas para paliar estas emisiones, buscando alternativas sostenibles al uso y distribución de la energía, y buscando formas alternativas de capturar o transformar los gases emitidos. –29– En noviembre de 2007 se publicó el Plan Estratégico Europeo de Tecnología Energética (EETE), en el que se resalta que la tecnología es una parte crucial de la encrucijada energética, que Europa necesita actuar inmediatamente para producir energía competitiva, segura y sostenible y que los retos relacionados con el cambio climático, seguridad en el suministro energético y competitividad requieren una respuesta coordinada [9]. En este sentido, en los últimos años se han financiado proyectos estratégicos de investigación tanto a nivel español como internacional. La financiación por parte de la administración pública de estos proyectos ayudará a desarrollar y probar las tecnologías necesarias para mejorar la eficiencia energética, captura y almacenamiento de CO2 , búsqueda de fuentes alternativas de energía y la valorización del CO2 como recurso con nuevas aplicaciones industriales. A nivel español citamos, entre otros, varios proyectos financiados por el Centro para el Desarrollo Tecnológico Industrial (CDTI), dentro del programa Ingenio 2010. Mediante este programa el Gobierno español pretende fomentar la cooperación estable públicoprivada en investigación, desarrollo e innovación (I+D+i), en áreas de importancia estratégica para la economía, promoviendo la creación de Consorcios Estratégicos Nacionales de Investigación Técnica (CENIT). Entre los CENIT relacionados con captura de CO2, energías alternativas y desarrollo sostenible destacan: - el CENIT CO2, coliderado por Endesa y Gas Natural Fenosa, centrado en tecnologías de captura, secuestro y almacenamiento de CO2; - el CENIT SPHERA, liderado por Gas Natural Fenosa, centrado en el área de desarrollo tecnológico del hidrógeno y que pretende, a través de la investigación industrial en diferentes tecnologías relacionadas con las áreas de producción, almacenamiento, distribución y utilización, plantear una propuesta integrada que abarque toda la cadena de valor de este vector energético; - el CENIT I+DEA, liderado por Abengoa, que abarca el ciclo completo del bioetanol: producción de materias primas y biotecnología (cultivos energéticos y enzimas), tecnologías de transformación a partir de productos agrícolas y su empleo posterior en motores, y - el CENIT SOST-CO2, liderado por Carburos Metálicos, un proyecto complementario a los anteriores y futurista en cuanto a sus objetivos, ya que se centra en investigar tecnologías alternativas a la captura y el almacenamiento, enfocándose en la captura-valorización del CO2 de manera sostenible, buscando las posibilidades de usar el CO2 como recurso en lugar de considerarlo sólo como un residuo para almacenamiento, abarcando así el ciclo de vida completo del CO2. –30– 1. Introducción Estos proyectos están permitiendo en nuestro país el desarrollo de nuevas tecnologías en colaboración estrecha entre empresas y universidades, apoyados y seguidos por el CDTI. A nivel europeo existen una serie de proyectos y plataformas tecnológicas emblemáticas, entre las que cabría destacar la plataforma de emisiones cero «Zero Emissions Power» (ZEP) (<http://www.zeroemissionsplatform.eu/>). [10] Dicha plataforma es una coalición única de empresas, científicos, académicos y organizaciones no gubernamentales de medio ambiente unidos en su apoyo a la cooperación en temas de captura y almacenamiento (CAC) como una tecnología clave para la lucha contra el cambio climático. Fundada en 2005, ZEP es una de las 35 plataformas tecnológicas europeas iniciadas por la Comisión Europea para orientar el desarrollo y despliegue de tecnologías clave que se traducirá en una mayor competitividad, crecimiento y sostenibilidad en la UE –incluyendo la CAC. La ZEP tiene tres objetivos principales: 1) promover la CAC como una tecnología clave para la lucha contra el cambio climático, 2) hacer comercialmente viable la CAC para el año 2020 a través de apoyo de la UE en programas de demostración, y 3) acelerar la investigación y el desarrollo (I + D) en tecnología de siguiente generación de la CAC y su posterior implantación a partir del 2020. En España existe la Plataforma Tecnológica Española del CO2 o PTECO2 (<http:// www.pteco2.es/>), una iniciativa promovida por empresas, centros de investigación y universidades, creada en el año 2006 gracias al apoyo del Ministerio de Educación y Ciencia. La visión de la PTECO2 es «Contribuir a la mejora de la eficiencia energética en grandes instalaciones industriales y al desarrollo de tecnologías de captura, transporte, almacenamiento y uso de CO2, y su implantación en la industria, para que España cumpla sus compromisos de reducción de emisiones». El alcance general de la PTECO2 es, pues, abordar un desarrollo tecnológico en España que contribuya a disminuir el impacto ambiental, social y económico derivado de las emisiones de gases efecto invernadero en nuestro país. Gracias a la participación de numerosas entidades pertenecientes a la industria española, centros de investigación, universidades, administración pública y sectores de opinión, desde la PTECO2 se está promoviendo un espacio común para el debate y el impulso de cualquier acción que apoye los objetivos de la plataforma. –31– Además de estas plataformas tecnológicas existen proyectos de I+D y proyectos de demostración financiados por la UE, tanto en temas propiamente de I+D de captura, como en plantas de demostración de las distintas tecnologías de captura (entre las que figuran la de Compostilla-El Bierzo y la de ELCOGAS en Puertollano) y de almacenamiento de CO2, como es el caso del proyecto SACS (en inglés, Saline Aquifer CO2 Storage Project), relacionado con el almacenamiento de CO2 en Sleipner, en el mar del Norte, proyectos que se tratarán más adelante en este libro. Por lo que respecta al resto del mundo, tanto Estados Unidos como Japón y Australia tienen programas similares al Plan Estratégico Europeo de Tecnología Energética, siendo el de Estados Unidos el Plan Tecnológico para el Cambio Climático (en inglés, Climate Change Technology Plan), publicado en 2006, mientras que Japón desarrolla, desde 2008, el Programa Tecnológico Innovador de Energía para el Enfriamiento de la Tierra (en inglés, Cool Earth Innovative Energy Technology Program). En dichos planes se abordan tecnologías y soluciones similares al plan europeo, apuntando a la combinación de tecnologías de captura y almacenamiento de CO2, ahorro y eficiencia energética y otras fuentes de energía, incluyendo las renovables y la nuclear, como solución a la mitigación de emisiones de gases de efecto invernadero para paliar el cambio climático. Es importante resaltar que el cambio climático no tiene un efecto negativo sólo sobre el medio ambiente, sino que también puede tenerlo sobre la propia economía. Así, el Informe Stern sobre la economía del cambio climático (Stern Review on the Economics of Climate Change) [11] afirma que se necesita una inversión equivalente al 1% del PIB mundial para mitigar los efectos del cambio climático y que de no hacerse dicha inversión el mundo se expondría a una recesión que podría alcanzar el 20% del PIB global. El informe también sugiere la imposición de ecotasas para minimizar los desequilibrios socioeconómicos. En palabras del propio economista: «Nuestras acciones en las décadas inmediatamente venideras pueden implicar el riesgo de una disrupción de la actividad económica y social durante el resto de este siglo y el siguiente, de una escala parecida a la de las grandes guerras y la Gran Depresión». En resumen, Europa necesita conseguir energía competitiva, segura y sostenible y no puede permitirse separar el cambio climático de la seguridad en el suministro energético ni de la competitividad. Éste es el reto de la Unión Europea en la encrucijada actual. Se trata de mantener ese crecimiento económico que nos ha llevado a donde estamos sin poner en peligro el ecosistema del planeta; para ello es necesario desarrollar diversas tecnologías alternativas, ya que no existe una única tecnología que haga viable el desarrollo sostenible. Afortunadamente, ni Europa ni España son indiferentes a este reto y se están tomando medidas para llevar a cabo el desarrollo de dichas tecnologías. –32– 1. Introducción 4. Políticas de mitigación de emisiones de CO2 Ante este panorama es preciso valorar primero dónde nos encontramos para definir qué medidas tomar y cuándo es necesario aplicarlas. ¿Cómo reducir las emisiones de CO2? Se presenta a continuación una comparativa entre la situación española y la de Europa de los 27 en cuanto al inventario de emisiones de gases de efecto invernadero desde 1990 hasta 2007, a partir de los datos recogidos en el informe emitido por el Programa de Convención para el Cambio Climático (UN Framework Convention for Climate Change) de las Naciones Unidas [12]. En la gráfica siguiente se muestran los números referidos al nivel de emisiones de 1990, año de referencia fijado por el Protocolo de Kioto a partir del cual deben reducirse las emisiones de gases de efecto invernadero. Figura 1.10. Comparación de gases de efecto invernadero emitidos en la Europa de los 27 frente a los emitidos por España en el periodo 1990-2007, referidos a 1990 [12]. –33– Por lo que respecta a nuestro país, las emisiones de CO2-equivalente1 en España han subido un 59,1% desde 1990 hasta 2007, de las cuales el 88,8% se deben al transporte, seguido de industrias de manufactura y construcción e industrias energéticas. Dicho aumento se atribuye, de manera indudable, al crecimiento económico que nuestro país ha experimentado durante estos años. Si volvemos a la figura 1.8, veremos que España se sitúa en una posición óptima en la curva, ya que se encuentra en la parte alta de países con un alto índice de desarrollo humano, mientras que en el eje de consumo eléctrico por habitante se encuentra en la parte izquierda, es decir, de los que menos consumen por habitante entre esos países. Sin embargo, como hemos visto, en el contexto actual, el crecimiento de emisiones de gases de efecto invernadero va íntimamente ligado al desarrollo tecnológico y es evidente que España ha experimentado un gran cambio en los últimos 20 años, que la ha situado en ese lugar de la gráfica 1.8, pero que lleva asociado, entre otras cosas, mayor consumo de energía, de transporte y de productos derivados de distintas industrias. Este avance tecnológico de nuestro país es precisamente el que nos ha llevado a una situación tan alejada de la comprometida con el Protocolo de Kioto. A modo de ejemplo, el consumo total de energía eléctrica en nuestro país ha pasado de 135.000 millones de kilovatios hora (kWh) en 1990 a 271.404 millones de kilovatios hora en 2008, según el Avance Estadístico de la Asociación Española de la Industria Eléctrica (UNESA). A pesar del avance del uso de energías renovables en España en los últimos años, la mayor parte de la energía que consumimos sigue procediendo de fuentes de origen fósil (petróleo, carbón y gas natural), que al quemarse emiten CO2 y otros gases de efecto invernadero si no se aplica una tecnología de captura adecuada. Para invertir la tendencia se ha puesto en marcha la Estrategia de Ahorro y Eficiencia Energética 20042012 (E4), que pretende reducir un 8,5% el consumo de energía primaria, y el Plan de Energías Renovables (PER) para fomentar estas energías. Ambas medidas deberían reducir nuestra dependencia energética y nuestro volumen de emisiones contaminantes a la atmósfera. A nivel global, tal y como se ha comentado, las emisiones de gases de efecto invernadero (GEI) no se deben sólo al sector energético, sino también, y en mayor medida, al transporte, así como a otros procesos industriales. Para reducir emisiones de GEI a la atmósfera sería necesario aplicar medidas en cada uno de los sectores que los emiten. 1 CO2 -equivalente es la cantidad de mezcla dada de gases de efecto invernadero equivalente a la cantidad de CO2 que tendría el mismo potencial de calentamiento global (GWP), medido durante un periodo de tiempo determinado (generalmente, 100 años). –34– 1. Introducción Figura 1.11. Ejemplos de fuentes de emisión de CO2 y otros gases de efecto invernadero: central térmica de carbón (sector energía), vehículos ligeros (sector transporte) y planta industrial de producción de cemento (sector industrial). ¿Qué medidas cabría tomar para reducir las emisiones de CO2 y otros gases de efecto invernadero en cada uno de estos sectores? Por lo que respecta al sector de suministro de energía, éste consta de una serie de procesos complejos para extraer recursos energéticos, convertirlos en formas más deseables y apropiadas de energía, y suministrarla a los lugares donde existe demanda. Técnicamente es posible realizar grandes reducciones de emisiones en este sector coincidiendo con el momento normal de las inversiones para sustituir infraestructura y equipo a medida que se desgasta o queda anticuado [2]. De hecho, se calcula que en los próximos 50-100 años, todo el sistema de suministro de energía se sustituirá al menos dos veces. Entre los medios prometedores para reducir las emisiones futuras en el sector energético cabe destacar (sin seguir ningún orden de prioridad): - la conversión más eficiente de combustibles fósiles; - la utilización de combustibles fósiles con poco carbono (por ejemplo, sustitución de carbón por gas natural); - la descarbonización de gases de escape y combustibles, y almacenamiento de CO2 , también llamado captura, transporte y almacenamiento de CO2 (CAC); - la utilización de energía nuclear, y - la utilización de fuentes de energía renovables. –35– Ninguna de estas medidas debe aplicarse por sí sola y será la combinación adecuada de todas ellas la que lleve a la reducción de emisiones de CO2 en este sector. El sector del transporte es más complejo, ya que, además de emitir CO2 emite otros gases de efecto invernadero, incluidos óxido nitroso (N2O), clorofluorocarbonos (CFC) e hidrofluorocarbonos (HFC). Por ejemplo, las emisiones de óxido de nitrógeno (NOx) de las aeronaves contribuyen a la formación de ozono, que puede tener tanto impacto radiactivo como el propio CO2 de las aeronaves. Para reducir las emisiones de CO2 y otros gases de efecto invernadero de los vehículos ligeros cabría reducir la intensidad energética de los mismos. Si en los vehículos ligeros se utiliza diésel, gas natural y propano en lugar de gasolina se pueden reducir técnicamente las emisiones del ciclo de combustible completo en 10-30%. Cuando se utilizan combustibles alternativos de fuentes renovables se pueden reducir técnicamente las emisiones de gases de efecto invernadero del ciclo de combustible completo en un 80% o más. Entre los elementos más importantes de una estrategia a largo plazo para la mitigación de gases de efecto invernadero en el sector del transporte pueden figurar todos los cambios en la infraestructura urbana y del transporte, para reducir la necesidad de transporte motorizado y desplazar la demanda a medios de transporte que requieran menos energía, lo cual requerirá planificación e inversión por parte de las administraciones públicas. Por último, en los dos últimos decenios, las emisiones de CO2 de combustibles fósiles del sector industrial de la mayoría de los países desarrollados han disminuido o han permanecido constantes, mientras que sus economías han crecido. Las razones son distintas para las economías de los países de la Organización de Cooperación y Desarrollo Económicos (OCDE), impulsadas más por los beneficios de eficiencia y un desplazamiento hacia el sector de servicios, que para las economías en transición, que están sufriendo una gran reestructuración y reducción en sus subsectores de la industria pesada. El hecho de que en este sector las emisiones hayan disminuido o permanezcan prácticamente constantes se debe a que hay muchas posibilidades de conseguir beneficios en el rendimiento energético de procesos industriales, a la eliminación de gases en los procesos y al uso de sistemas coordinados en las empresas que hacen un uso más eficiente de materiales, producción combinada de calor y energía, calor en cascada, etc. Se estima que los países desarrollados podrán reducir las emisiones de CO2 del sector industrial en el 25% con respecto a los niveles de 1990, simplemente sustituyendo las instalaciones y procesos existentes por las opciones tecnológicas más eficientes utilizadas en la actualidad (suponiendo una estructura constante en el sector industrial). Si esa sustitución se produjera en el momento de la rotación de capital normal, incluso sería rentable. –36– 1. Introducción 5. Cómo cuantificar la reducción de emisiones de CO2 Ante la situación que se ha planteado quizás cabe preguntarse cuándo es el mejor momento para actuar, incluso si se debe actuar o esperar a que la situación se vaya solucionando sola. Tal y como muestra la figura 1.12, los datos de crecimiento continuado de emisiones y la tendencia que seguirán, en el caso de que no se actúe, indican que hay que intervenir cuanto antes, mejor hoy que mañana, y de manera eficaz. Figura 1.12 Crecimiento actual y previsible de las emisiones anuales de CO2. (Adaptación de la referencia [13]). –37– A partir de los datos de la figura 1.12 se infiere la urgencia de tomar medidas para reducir las emisiones de CO2 y cambiar la tendencia de crecimiento, para lo cual es preciso saber cómo cuantificar la reducción de emisiones en los distintos sectores. Como se observa en la gráfica, de no actuar ahora, las emisiones de CO2 pueden duplicarse entre el año 2005 y el año 2055. Existen distintos métodos que permiten calcular cómo reducir estas emisiones de gases de efecto invernadero y determinar las medidas que hay que tomar para ello. Recientemente, a través de la Iniciativa de la Mitigación del Carbono (en inglés, Carbon Mitigation Initiative, CMI) se ha desarrollado un método de fácil acceso que permite a aquellas personas, empresas e instituciones que lo deseen ver cuál podría ser su propia contribución para la mitigación del cambio climático [13]. El CMI es un programa que se ha venido desarrollando en la Universidad de Princeton en los últimos diez años, apoyado por las empresas BP y Ford Motor Company, cuyo objetivo es encontrar soluciones al problema de la emisión de gases de efecto invernadero. El método de cálculo desarrollado por el CMI es el denominado «juego de la estabilización de las cuñas», creado por Stephen Pacala y Robert H. Socolow [14], quienes pretenden demostrar a través de él que el calentamiento global es un problema que puede resolverse mediante la aplicación de las tecnologías actuales para reducir las emisiones de CO2. El concepto del método se basa en que si no se hace nada para detener o disminuir las emisiones de CO2 y otros gases de efecto invernadero, dichas emisiones se duplicarán entre el año 2005 y 2055. Si se representan gráficamente las emisiones mundiales de CO2 para los próximos 50 años, la diferencia entre el escenario de statu quo y la ruta plana forma un triángulo. Este triángulo es conocido como el «triángulo de estabilización». El objetivo del juego es mantener planas las emisiones de CO2 en los próximos cincuenta años, utilizando para ello siete trozos o cuñas de una variedad de estrategias diferentes que encajan en el triángulo de estabilización, tal y como se muestra en la figura 1.13. –38– 1. Introducción Figura 1.13. Emisiones de CO2 por año frente al año en que se emiten, mostrando el triángulo de estabilización. El triángulo de estabilización marca las estrategias para la reducción de emisiones de CO2 en 7 Gt (gigatoneladas) por año entre los años 2005 y 2055. Es decir, se trata de buscar y combinar siete estrategias que permitan, cada una de ellas, reducir una gigatonelada de CO2 por año. Para conseguir este objetivo, Pacala y Socolow dividieron ese hipotético triángulo en siete cuñas de estabilización, que representan las diferentes medidas que deben tomarse para reducir las emisiones en esas cantidades. Tal y como sus autores presentaron el concepto originalmente en la revista Science [14], existen 15 estrategias de cuña diferentes. Ninguna de estas estrategias será suficiente por sí misma para construir todo el triángulo de estabilización y, de hecho, se necesitan varias de ellas e incluso el desarrollo de nuevas estrategias para lograr el objetivo. En el sitio web del CMI (<http://cmi.princeton.edu/wedges/flash_intro.php>), se presentan estas estrategias y se proporcionan detalles de cómo usarlas, reorganizándolas en cuatro grandes categorías: eficiencia, descarbonización de la electricidad, descarbonización –39– de combustibles y estrategias forestales y de suelos agrícolas. El contenido de estas categorías son tecnologías conocidas o en proceso de desarrollo, como, por ejemplo, captura y almacenamiento de CO2, energías renovables (solar, eólica, fotovoltaica, etc.), eficiencia energética y conservación, energía nuclear, etc. Se calcula qué implica el uso cada una de estas tecnologías para reducir una cantidad dada de emisiones de CO2 y se eligen las siete cuñas para obtener la reducción total de 7 Gt de CO2 por año. Figura 1.14. Triángulo de estabilización y sus siete cuñas. –40– 1. Introducción No obstante, a pesar de que las estrategias se establecen a partir de tecnologías disponibles o en amplio estado de desarrollo, el reto es importante en cuanto a magnitud. Así, por ejemplo, una cuña (reducción de 1 Gt de CO2 por año) puede implicar: - la captura y almacenamiento del CO2 producido por 800 GW de potencia eléctrica a partir de plantas térmicas, - para construir una cuña basada en energía fotovoltaica, se necesitarían 2.000 gigawatios pico (GWp), aproximadamente 700 veces la capacidad mundial actual, ocupando un espacio, con la tecnología actual, de dos millones de hectáreas, - para reducir la emisión de CO2 con energía nuclear en una cuña se necesitarían 700 GW, el doble de la capacidad actual. Las siete cuñas deben provenir de sectores diferentes (energía, transporte, industria). Asimismo, una cuña puede estar formada por la combinación de varias tecnologías que lleven a la reducción de emisión de 1 Gt de CO2 por año, tal y como se muestra en la figura 1.15. En la web del CMI se pueden encontrar todos los detalles del método y su implementación. Figura 1.15. Una posible cuña de estabilización del triángulo de Pacala y Socolow [14]. –41– El juego de la estabilización de las cuñas se ha hecho popular como herramienta de comunicación para la mitigación del calentamiento global debido a su simplicidad. Se usa en gran variedad de escenarios y por diversidad de jugadores: empresarios, políticos, profesores, estudiantes…, incluso se ha incluido en algunos planes de estudios de secundaria de Estados Unidos. De hecho, el CMI permite a cualquiera utilizar el juego y hacer uso de sus materiales, siempre que compartan los resultados con los responsables del programa. A pesar de su éxito, existen también varias críticas con respecto al juego, siendo la principal de ellas su elevada simplicidad, especialmente en relación con el aspecto económico de la mitigación del calentamiento global. No obstante, no cabe olvidar que se trata precisamente de eso, de un juego que permite concienciar y tomar medidas para mitigar el cambio climático. 6. Conclusiones A modo de resumen de este capítulo, debemos destacar que el dióxido de carbono es necesario, bueno, y es un recurso que debemos aprovechar. No obstante, el exceso de CO2 en la atmósfera y las emisiones que se realizan desde distintos procesos, requieren poner los medios para evitarlas, en todos los sectores, y mediante medidas complementarias. Puesto que el uso de combustibles fósiles sigue siendo, y lo será durante unos años, imprescindible para el desarrollo económico y la seguridad en el suministro energético, una de las medidas que habría que implementar, tal y como recoge el Protocolo de Kioto, es, además de la eficiencia y el ahorro energético, la captura, transporte y almacenamiento de CO2, tema que se tratará en detalle en los siguientes capítulos de este libro. El énfasis en la aplicación de las tecnologías de CAC al sector energético frente al sector del transporte se debe a que en el caso de plantas térmicas y otras fuentes energéticas es más fácil aplicar dichas tecnologías, debido a su carácter localizado, evitando la emisión de grandes cantidades, frente al sector difuso del transporte. Asimismo, deben buscarse nuevas aplicaciones sostenibles del CO2 que fomenten su uso a gran escala. –42– 1. Introducción 7. Bibliografía 1. «Hielo seco», «Efecto invernadero», en <http://es.wikipedia.org/wiki/>. 2. Informes del International Panel for Climate Change (IPCC), en <http://www.ipcc.ch>. 3. C. SONG, «Global challenges and strategies for control, conversion and utilization of CO2 for sustainable development involving energy, catalysis, adsorption and chemical processing», Catalysis Today 115, 2-32, 2006. 4. L. F. VEGA, «Sostenibilidad y eficiencia de las nuevas tecnologías para la captura, transformación y el aprovechamiento del CO 2 : ventajas y retos actuales», en El sector energético ante un nuevo escenario. Editorial Civitas/Thomson Reuters. [Publicado por la Comisión Nacional Energía, 2010]. 5. Figura preparada por Robert A. Rohde, incorporada en el proyecto The Global Warming Art Project (abril 2010). En <http://www.globalwarmingart.com/wiki/File:Carbon_Dioxide_400kyr_png>. 6. P. GÓMEZ-ROMERO, Un planeta en busca de energía. Editorial Síntesis, 2007. 7. G. H. BRUNDTLAND, presidente del «Report of the World Commission on Environment and Development: Our Common Future», conocido como Informe Brundtland [elaborado para la Asamblea General de la ONU, como anexo al documento A/42/427 - Development and International Co-operation: Environment]. 8. El texto del Protocolo de Kioto en español puede consultarse en la web de las Naciones Unidas: <http:// untreaty.un.org/English/notpubl/kyoto-sp.htm>. 9. Plan Estratégico Europeo de Tecnología Energética (EETE), texto completo en: <http://europa.eu/ legislation_summaries/energy/european_energy_policy/l27079_es.htm>. 10. Informe de la Plataforma Europea de Emisiones Cero (ZEP), Supporting Early Demostration of Sustainable Power Generation from Fossil Fuels, del 23 de enero de 2008. En: <http://www.zeroemissionsplatform.eu/>. 11. Informe Stern, texto completo disponible en: <http://webarchive.nationalarchives.gov.uk/+/http://www. hm-treasury.gov.uk/independent_reviews/stern_review_economics_climate_change/stern_review_report. cfm>. 12. Informe de las Naciones Unidas, Convención sobre el Cambio Climático (UNFCCC), sobre el inventario de España de gases de efecto invernadero, años 2007-2008. [FCCC/ARR/2008/ESP 24 abril 2009.] En: <http://unfccc.int/resource/docs/2009/arr/esp.pdf>. –43– 13. R. HOTINSKI y Princeton Environmental Institute, The Stabilization Triangle: Tackling the Carbon and Climate Problem With Today’s Technologies, Princeton University. Disponible en: <http://www. princeton.edu/~cmi>. 14. S. PACALA y R. SOCOLOW, «Stabilization Wedges: Solving the Climate Problem for the Next 50 Years with Current Technologies», Science, 305 (5686), 968-972, 2004 [DOI: 10.1126/science.1100103]. –44– 1. Introducción 2 Captura de CO2 En las especies no sobrevive el más fuerte, ni el más inteligente, sino aquel que mejor se adapta al cambio. Charles Darwin Entre las medidas paliativas para mitigar el cambio climático, el Protocolo de Kioto menciona explícitamente los sistemas de captura, transporte y almacenamiento de CO2. El objetivo de estos sistemas es separar el CO2 producido en distintos procesos hasta obtener una corriente de gases con una concentración suficientemente elevada de CO2 para comprimirla y transportarla hasta el punto donde vaya a ser almacenada de forma definitiva. Los sistemas de captura y almacenamiento de CO2 son sólo aplicables a grandes focos emisores localizados, ya que la cantidad que se capturaría en focos difusos, como por ejemplo los medios de transporte, sería muy pequeña, requiriendo un esfuerzo totalmente desproporcionado. En este capítulo nos centraremos en las tecnologías y procesos disponibles para la captura de CO2 en focos de emisión localizados, mientras que su transporte y almacenamiento se tratarán en el siguiente capítulo. 1. ¿Dónde puede ser capturado el CO2? A pesar de que, como se ha visto en el capítulo anterior, existen grandes focos de emisión en varios sectores, la captura de CO2 sólo se considera viable a día de hoy en grandes focos de emisión, cuyos caudales justifiquen un tamaño adecuado en las instalaciones. Éste es el caso de las grandes centrales de generación de electricidad y, en menor medida, de las refinerías de petróleo, petroquímica, plantas de procesado de gases y de fertilizantes, cementeras e industrias del acero y del papel. Esta captura es la que evitaría que el CO2 se –45– enviara a la atmósfera y, por tanto, ayudaría a mitigar el cambio climático producido por los gases de efecto invernadero. En este capítulo nos centraremos en las tecnologías orientadas a las grandes plantas de generación de electricidad como focos de actuación preferente, aunque muchas de las tecnologías que veremos aquí serán aplicables en gran medida a las otras industrias mencionadas. A nivel global, la mayor parte de la electricidad que consumimos procede de la energía extraída de los combustibles fósiles (carbón, petróleo y gas natural). El carbón ha sido, y es, el combustible fósil más utilizado aunque, en los últimos tiempos, el gas natural ha ido adquiriendo una relevancia cada vez mayor. Las tecnologías desarrolladas para la conversión a electricidad de estos combustibles fósiles se aplican también a la conversión de combustibles renovables (biomasa). Antes de detallar las tecnologías de captura de CO2 , repasaremos brevemente las principales tecnologías de generación de electricidad que emiten CO2 , con el fin de situar y entender mejor los elementos clave para su captura. Las centrales térmicas de carbón más implantadas a nivel mundial son las de carbón pulverizado [1]. Constan de cuatro elementos principales: 1) una caldera en la que se quema el carbón junto con aire, 2) unos equipos de limpieza de los gases producidos en la combustión, 3) un sistema de recuperación y transformación a electricidad de la energía liberada y 4) una chimenea de emisión de los gases. El carbón es molido, pulverizado e inyectado con aire a la caldera. La mayor parte del calor producido por su combustión migra hacia las paredes de la caldera, habitualmente formadas por tubos que conducen agua en su interior. Otra fracción importante del calor producido es recuperado mediante unos serpentines1 situados en la corriente de gases, por los cuales, dependiendo de su situación, circula agua líquida o vapor. El resto de la energía abandona la central con los gases emitidos en la chimenea. En las centrales térmicas, los serpentines se configuran como grandes paquetes de tubos dispuestos en diferentes etapas e inmersos en la corriente que siguen los gases, tras su combustión en la caldera, hacia los equipos de limpieza, antes de alcanzar la chimenea. En función de la presión y la temperatura del agua líquida o vapor que circula por los serpentines, éstos reciben distintos nombres: 1) sobrecalentadores: permiten elevar la temperatura del vapor de agua, 2) recalentadores: reacondicionan el vapor parcialmente 1 Se denomina serpentín o serpentina a un tubo de forma frecuentemente espiral, habitualmente utilizado para enfriar vapores provenientes de la destilación en un calderín y así condensarlos en forma líquida. Suele ser de vidrio, cobre u otro material que conduzca el calor fácilmente. –46– 2. Captura de CO2 utilizado y 3) economizadores: recuperan el calor residual de los gases cuando éstos han perdido prácticamente toda su energía, justo antes de entrar en los sistemas de limpieza, y la ceden al agua que entra en la caldera todavía fría. ¿Cómo se produce la electricidad en estas plantas?: Con el aporte de energía de la combustión, el agua líquida se calienta en la caldera transformándose en vapor. Éste, a presiones y temperaturas muy altas, cede su energía al mover los elementos de una turbina, haciendo que ésta gire. Así, la energía térmica se transforma en energía mecánica en el eje de giro de la turbina. A dicho eje va acoplado un generador eléctrico, cuya misión es convertir la energía mecánica en electricidad. Por su parte, el vapor es enfriado en un condensador y convertido otra vez en agua líquida, que vuelve a los tubos de la caldera, comenzando un nuevo ciclo. El proceso se muestra de manera esquemática en la figura 2.1. Figura 2.1. Esquema de una central térmica de carbón para producir electricidad. –47– Con el avance de la tecnología, ha sido posible generar vapor con más energía (mayor presión y temperatura) y ello hace que se pueda recuperar más energía de la combustión, haciendo el proceso más eficiente. Así, el rendimiento de la conversión ha ido aumentando con el tiempo desde valores cercanos al 30% hasta el 47% en los sistemas actuales. La previsión es alcanzar el 50% con nuevas aleaciones para la fabricación de los tubos por los que circula el agua. La mejora en la eficiencia conduce a una reducción en las emisiones de CO2 , ya que se usa menos combustible por unidad de electricidad producida. Con respecto a los gases de salida, la concentración de CO2 que aparece en ellos es muy diluida (en torno al 14%). Su principal componente es, de hecho, el nitrógeno, dado que en la caldera entra aire (cuya composición mayoritaria es 78% nitrógeno y 21% oxígeno) y en la combustión del carbón sólo se utiliza el oxígeno. Junto con el nitrógeno y el dióxido de carbono aparecen otros gases y partículas en proporciones pequeñas, pero que también deben ser tratados adecuadamente. A pesar de que la concentración de CO2 en la corriente de salida es diluida, dada la enorme cantidad de energía producida, el volumen de CO2 que se genera en una central térmica es de gran magnitud. A modo de ejemplo, la emisión de una central de 500 MW es 9,0 × 106 kg CO2/día (9 kilotoneladas CO2/día) o 3,3 × 109 kg CO2/año (3,3 megatoneladas CO2/año) [2]. Figura 2.2. Central térmica de Meirama, propiedad de Gas Natural Fenosa, en La Coruña. (Cortesía de Gas Natural Fenosa). –48– 2. Captura de CO2 Otro modelo de central de carbón que ha superado la etapa de demostración, pero que aún está poco implantado, es el denominado de gasificación integrada en ciclo combinado (GICC). En estas centrales, en lugar de quemar carbón sólido, éste es gasificado2 , siendo el gas de síntesis producido el que se emplea como combustible. Una vez producido este gas, y bien acondicionado, se quema en la cámara de combustión. Con la energía liberada se produce el movimiento de los elementos de la turbina, en cuyo eje se transforma la energía térmica en energía mecánica. El eje se acopla a un generador eléctrico, transformando la energía mecánica en eléctrica. Dado que el gas que abandona la turbina contiene todavía mucha energía, ésta se recupera en la caldera. Se produce así electricidad de manera similar a la descrita anteriormente para el carbón sólido. La ventaja de estas centrales frente a las de carbón sólido es que aportan una mayor flexibilidad en el tipo de carbón que se puede utilizar, permiten la incorporación de otros combustibles con cierta facilidad y posibilitan un elevado rendimiento en la conversión de la energía por el uso de dos turbinas, una de gas y otra de vapor. La corriente de gases de salida de estas centrales contiene en torno a un 9% de CO2 . Asimismo puede generarse electricidad usando como combustible el gas natural. Siguiendo el esquema citado de uso combinado de turbina de gas-turbina de vapor, pero obviamente sin la necesidad de gasificar el combustible, se encuentran las denominadas centrales de ciclo combinado, la tecnología más común de obtención de electricidad a gran escala a partir de este combustible. Los ciclos combinados de gas natural se han introducido masivamente en los últimos 10-15 años. Las grandes plantas de ciclos combinados de gas natural presentan una eficiencia térmica máxima actual en torno al 56-58%, y este rendimiento sigue aumentando con el uso de turbinas de gas más avanzadas. Una peculiaridad en este tipo de centrales, en relación con las emisiones y captura de CO2 , es la necesidad de refrigeración que tienen los elementos de la turbina de gas, lo que obliga a introducir en la combustión una mayor cantidad de aire que en las centrales típicas de carbón. Por ello, el CO2 aparece aún más diluido en la corriente de gases, en proporciones cercanas al 5%. 2 La gasificación es un proceso termoquímico en el que un sustrato carbonoso (carbón, biomasa, plástico) es transformado en un gas combustible mediante una serie de reacciones que ocurren en presencia de un agente gasificante (aire, oxígeno, vapor de agua o hidrógeno). –49– Figura 2.3. Planta de ciclo combinado de gas natural, propiedad de Gas Natural Fenosa, en Arrúbal, La Rioja. (Cortesía de Gas Natural Fenosa). Tal y como se ha comentado, la concentración de CO2 en las corrientes de salida depende del tipo de central generadora de electricidad. Asimismo existe una relación directa entre el kilowatio-hora de energía producido (kWh) y el equivalente de CO2 generado según el tipo de central. Ambos datos se recogen en la tabla 2.1. Tabla 2.1. Concentración de CO2 en las corrientes de salida y relación entre kWh producido y CO2 dependiendo del tipo de central generadora de electricidad. –50– 2. Captura de CO2 El hecho de que la concentración de CO2 en la corriente de salida sea mucho menor en las centrales de ciclo combinado que en las centrales térmicas de carbón, junto con que la cantidad de CO2 producido por la misma unidad de energía producida (kWh) sea menos de la mitad, hace que la atención actual en la implantación de tecnologías de captura de CO2 esté más focalizada en centrales de carbón que en las de ciclo combinado de gas natural. Además de estos grandes focos emisores derivados de plantas de generación eléctrica, existen otras industrias también emisoras de grandes cantidades de CO2 a las que podría añadirse un sistema para su captura. Se recogen en la tabla 2.2 los datos de emisiones, extraídos del informe de la Agencia Internacional de la Energía [1]: Tabla 2.2. Principales industrias y sus emisiones de CO2. (Datos referidos a 1997) [1]. Hoy en día, en algunas industrias como, por ejemplo, las que se dedican a la producción de fertilizantes, producción de hidrógeno o procesado de gas natural, el CO2 ya se separa del proceso. En la mayoría de los casos se ventea a la atmósfera (o una parte se separa y acondiciona para usos alimenticios o industriales), por lo que podría ser preparado para su almacenamiento con un coste adicional. Esto se hace en la plataforma de Sleipner, en el mar del Norte, donde el CO2 separado del gas natural se inyecta en un acuífero salino profundo, como se explicará más adelante en este libro. 2. Tecnologías de captura de CO2 Se conocen como tecnologías de captura, transporte y almacenamiento de CO2 aquellas tecnologías desarrolladas para capturar («atrapar») el CO 2 de las corrientes gaseosas –51– emitidas durante la producción de electricidad, procesos industriales o procesado de combustibles, acondicionarlo para su almacenamiento, y transportarlo y almacenarlo de manera permanente bajo tierra, evitando así su emisión a la atmósfera. Dado que sólo una parte pequeña de ese CO2 no se almacena de manera permanente sino de forma temporal para ser utilizado con posterioridad en distintos usos industriales, el concepto de captura y almacenamiento de CO2 (CAC) engloba los procesos descritos anteriormente. En la figura 2.4 se presentan de manera esquemática los sistemas de captura de CO 2 clasificados en tres grandes grupos: posterior a la combustión, previa a la combustión y con oxígeno-gas u oxi-combustión [3]. Detallamos a continuación cada uno de ellos: 1) posterior a la combustión (post-combustión): como su nombre indica, esta tecnología se refiere al proceso de separación de CO2 de la corriente de gases de salida de un proceso de combustión. En este caso, primero se quema el combustible (carbón, petróleo, gas o biomasa) y se produce calor y electricidad, junto con una corriente de gases que incluye el CO2 . Éste debe ser separado de dicha corriente (fundamentalmente nitrógeno y oxígeno), comprimido, deshidratado y transportado hasta su lugar de almacenamiento, mientras que el resto de los gases se ventean a la atmósfera. Una dificultad importante de este proceso es que el CO2 está diluido en la corriente de gases (con una concentración de un 12-15%, e incluso menor de un 5% en el caso de gas natural), por lo que resulta más difícil de separar que si estuviera concentrado, especialmente desde el punto de vista energético. 2) previa a la combustión (pre-combustión): la captura en pre-combustión implica la generación de un gas de síntesis (formado por monóxido de carbono e hidrógeno, CO + H 2) seguida de una reacción con agua para convertir el CO en CO2 . A partir de ahí se separa el CO2 del hidrógeno, y este último es utilizado para ser quemado en una turbina, empleado como combustible o para usos en refinerías de petróleo, entre otras aplicaciones. Mientras, el CO2 es acondicionado para su transporte y almacenamiento. Como en la post-combustión, también en este caso el CO 2 está diluido en la corriente de gases. Aunque en los ciclos combinados el CO 2 puede capturarse tanto en pre-combustión como en post-combustión, existen diversos estudios que demuestran que, desde el punto de vista económico, para estos ciclos resulta más efectivo hacerlo en pre-combustión, ya que la captura se lleva a cabo a presiones altas y el propio proceso genera el gas de síntesis necesario [3]. 3) oxígeno-gas u oxi-combustión (en inglés oxyfuel): en este proceso, en lugar de introducir aire en el sistema para la combustión, se introduce oxígeno puro. La ventaja que tiene esta tecnología frente a las anteriores es que la corriente de salida es prácticamente pura en CO2 (al no introducir el nitrógeno, componente mayoritario del aire) por lo que resulta mucho más fácil de tratar, ya que no debe ser separado de –52– 2. Captura de CO2 corrientes diluidas. El inconveniente que presenta es que, para obtener la cantidad de oxígeno necesaria para inyectarlo en la caldera a nivel industrial, se precisa de la instalación de una planta de separación de aire, lo cual encarece el proceso. Figura 2.4. Configuraciones de sistemas de captura de CO2, adaptado del informe del Panel Internacional para el Cambio Climático (IPCC) [3]. Existen otros procesos industriales, tales como el refinado de gas natural o la producción de amoniaco, en que habitualmente se separa el CO2 de la corriente de gases de salida para su posterior uso en el mercado. El procedimiento estándar en estos casos es la separación mediante absorción química3, por lo general con unos compuestos llamados aminas4. 3 Absorción química es la operación que consiste en la separación de uno o más componentes de una mezcla gaseosa con la ayuda de un solvente líquido con el cual forma solución (un soluto, o varios solutos, se absorben de la fase gaseosa y pasan a la líquida). 4 Las aminas son compuestos químicos orgánicos que se consideran derivados del amoniaco (NH 3) y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo (metilo, etilo, propilo, etc.) Según se sustituyan uno, dos o tres hidrógenos, las aminas se denominan primarias, secundarias o terciarias. –53– La elección entre una u otra configuración para capturar el CO2 dependerá del caso concreto de que se trate, por ejemplo, si dicha tecnología se va a incorporar a una central térmica de producción eléctrica ya en funcionamiento o si se trata de una central de nueva construcción, del lugar donde se instale la central (si está cerca o lejos del emplazamiento de almacenamiento final), del proceso industrial que se lleve a cabo, etc. A continuación se profundiza en cada una de las configuraciones de captura anteriormente mencionadas, así como en las tecnologías de captura a escala industrial o en proceso de desarrollo. 2.1. Captura en post-combustión Como ya se ha indicado, la captura en post-combustión se refiere a la separación del CO2 de la corriente del gas de salida de un proceso de combustión. Los combustibles pueden ser cualquier tipo de hidrocarburos, tales como carbón, gas natural, petróleo o biomasa. En el caso de plantas de carbón, la captura en post-combustión se asocia normalmente a plantas de carbón pulverizado y centrales térmicas de combustión con lechos de fluido circulante 5 . Las centrales de carbón pulverizado pueden ser subcríticas, supercríticas o ultra-supercríticas, dependiendo de la presión y temperatura a las que trabajan, a medida que aumentan la presión y la temperatura se vuelven más eficientes. Una central ultra-supercrítica opera a presiones superiores a 248 atmósferas y temperaturas de más de 566 °C. En realidad, tal y como se muestra en la tabla 2.1, el CO2 es sólo una pequeña parte del total de la corriente de salida que se emite a la atmósfera, yendo acompañado de nitrógeno, oxígeno y vapor de agua. Sería impracticable almacenar toda la corriente de salida porque no habría suficientes emplazamientos para ello y, además, los requerimientos energéticos para comprimir el gas de salida serían inabordables, por tanto, es preciso separar el CO2 de los otros componentes antes de almacenarlo. La captura en post-combustión requiere la adición de un sistema que permita separar el CO2 de los otros gases de la corriente de salida, así como un sistema de compresión, para comprimir y acondicionar el CO2 para su transporte posterior. 5 En estas centrales se quema carbón sobre un lecho de partículas inertes (por ejemplo, de piedra caliza), a través de las cuales se hace circular una corriente de aire que mejora la combustión. El proceso de producción de electricidad es similar al descrito para las calderas de carbón pulverizado. –54– 2. Captura de CO2 El acondicionamiento del CO2 requiere también la limpieza de la corriente de gas antes de su entrada en el dispositivo de captura; en particular, los niveles de azufre deben ser muy bajos –inferiores a 10 ppm (partes por millón)– para reducir la corrosión. Una vez la corriente de gas abandona la caldera, el gas se limpia en una torre de lavado de gases que extrae el dióxido de azufre (SO2) y en un dispositivo que elimina las partículas sólidas. La corriente de gas entra en la columna de absorción (representada en el diagrama como «unidad captura CO2»), que contiene una solución de un absorbente químico, habitualmente aminas. Cuando la corriente de gas entra en contacto con la solución de aminas, el CO2 se absorbe en dicha solución. Para extraer el CO 2 y recuperar las aminas, la solución se pasa a una columna de desorción6 donde el CO2 es extraído mediante un aumento de la temperatura. La amina es reciclada y enviada de nuevo a la columna de absorción, mientras que el CO2 es enfriado, secado y comprimido hasta el estado supercrítico [4], [5]. En la figura 2.5 se muestra un esquema simplificado del proceso de captura en post-combustión. Figura 2.5. Esquema simplificado de un proceso de captura en post-combustión. 6 La desorción es el proceso contrario a la absorción (y adsorción). –55– En la actualidad, el método más usado a nivel industrial para la separación del CO2 de corrientes diluidas en concentraciones bajas, tal y como ocurre en las plantas térmicas, es la absorción química con aminas. De hecho, existe experiencia probada desde hace años en la aplicación de esta técnica durante el procesado de gas natural para producir CO2 destinado a usos alimentarios [4]. En la figura 2.6 se muestran fotografías de la central de purificación de gas natural en Salah, Argelia, donde se pueden ver las torres de separación. Además de la absorción química en una solución, o absorción con aminas, existen otras opciones para la captura en post-combustión, incluyendo el uso de otros absorbentes químicos como el amoniaco enfriado, adsorbentes con un solvente (tales como los líquidos iónicos, que también pueden absorber químicamente) o un sorbente sólido (como los MOF, del inglés Metal Organic Frameworks), membranas de separación (por ejemplo, híbridos de membranas con aminas o procesos enzimáticos de CO 2) y la separación criogénica por destilación o congelación [6]. De hecho, existen varios proyectos y consorcios de I+D trabajando en estas líneas de investigación de manera muy activa. Figura 2.6. Purificación de gas natural: separación de CO2 por aminas y almacenamiento de CO2 (en Salah, Argelia). La foto de la derecha muestra las torres de absorción de aminas. –56– 2. Captura de CO2 2.2. Captura en pre-combustión Una forma alternativa de capturar el CO2 es aumentar su concentración y su presión parcial antes de llevar a cabo la combustión. La captura en pre-combustión involucra la separación del CO2 una vez el carbón es gasificado y convertido en un gas de síntesis (rico en monóxido de carbono e hidrógeno), antes de la combustión en una unidad de ciclo combinado. El primer paso del proceso está relacionado con la gasificación del carbón. Luego se usa un reactor para desplazar la reacción del agua y convertir el monóxido de carbono en el gas de síntesis y el vapor en CO2 e hidrógeno. Esto lleva asociado un aumento de la concentración de CO2 , mejorando la eficiencia de su captura y aumentando la cantidad de carbón (en forma de CO2) que puede ser capturada en este proceso. El CO2 es separado usando un sorbente químico, como las aminas, o físico, como Selexol 7, para ser comprimido posteriormente, mientras que el hidrógeno se puede quemar en una turbina para producir electricidad [4]. En la figura 2.7 se muestra el esquema simplificado de un proceso de captura de CO2 en pre-combustión. Figura 2.7. Esquema simplificado de un proceso de captura de CO2 en pre-combustión. 7 El proceso Selexol usa como sorbente (o solvente) un dimetil éter de polietilenglicol (DMPEG). La mayoría de las aplicaciones de este proceso son para gases con un alto contenido de CO 2 y bajo de H2 S. –57– La captura en pre-combustión en plantas de generación eléctrica supone un cambio más radical en su diseño que la captura en post-combustión, sin embargo la tecnología ya ha sido probada a nivel industrial en plantas de producción de amoniaco y otros procesos industriales. Una de las novedades más importantes de este proceso es que el combustible gaseoso es esencialmente hidrógeno. Aunque se han desarrollado turbinas que queman hidrógeno y se ha demostrado su funcionamiento a nivel de planta piloto, la tecnología no tiene el mismo grado de madurez que las turbinas de gas de síntesis. A pesar de que tanto los ciclos combinados como la captura en pre-combustión son tecnologías disponibles, hay muy pocas plantas en el mundo que las utilicen a nivel industrial, existiendo sólo cuatro gigavatios disponibles en las plantas de GICC construidas en todo el mundo a finales de 2007, y, hasta ese momento ninguna de ellas tenía incorporados procesos de captura de CO2 [3]. En España, existe un proyecto pionero a nivel mundial en este sentido, la planta de ELCOGAS, que se tratará en detalle más adelante en este libro. Figura 2.8. Planta de Gasificación Integrada de Ciclo Combinado de ELCOGAS, en Puertollano, España. (Cortesía de ELCOGAS). –58– 2. Captura de CO2 2.3. Captura con oxi-combustión La oxi-combustión se refiere a la combustión de combustibles fósiles en una atmósfera rica en oxígeno (se mezcla oxígeno casi puro con la corriente de entrada, en lugar de hacerlo con aire). En estas condiciones la corriente de salida es prácticamente pura en CO2 , puesto que no se introduce nitrógeno en la caldera, siendo en este caso mucho más fácil de acondicionar y comprimir que en las dos tecnologías explicadas anteriormente. En la figura 2.9 se muestra una unidad de separación de aire que provee de oxígeno a la caldera donde se mezcla con el gas. Después de la combustión es necesario limpiar el gas de partículas sólidas, óxidos de nitrógeno y azufre. Una vez condensada el agua, la corriente del gas de salida tiene una concentración de CO2 suficiente para poder ser comprimido directamente. Sin embargo, la corriente de gas comprimida debe ser limpiada de los co-constituyentes para resultar con la misma pureza que el CO2 comprimido resultado de la captura en post-combustión anteriormente mencionada (es decir, restos de compuestos con azufre y partículas). Figura 2.9. Esquema simplificado de un proceso de captura de CO2 con oxi-combustión. –59– Desde 2008, existen varias plantas de demostración en fase de construcción o en producción en las que se captura CO2 de plantas térmicas; dichas plantas están situadas tanto en Europa como en América. Por su significado para Europa cabe destacar la de Vattenfall en Alemania, primera planta piloto de demostración en oxi-combustión a nivel mundial, y la planta de demostración de El Bierzo (León), coordinada por la Fundación para la Ciudad de la Energía (CIUDEN) junto con Endesa, en fase de construcción, que llevará sus hallazgos a escala industrial en la misma zona. Ambas están parcialmente financiadas por la Unión Europea. 3. Procesos de captura y separación de CO2 Aunque a lo largo de este capítulo se ha ido mencionando la separación de CO2 con aminas, existen en la actualidad varias tecnologías disponibles o en proceso de desarrollo para capturar y separar el CO2 de la corriente de salida de una chimenea o fuente de emisión. Entre ellas cabe citar los procesos de absorción química (fundamentalmente aminas, y, en desarrollo, un proceso con amoniaco enfriado), la adsorción física en distintos materiales, la separación criogénica, la separación por membrana y los procesos de carbonatación-calcinación, con tecnologías basadas en óxido de calcio. 3.1. Absorción química con aminas Los procesos de absorción química constituyen el método más utilizado industrialmente para la separación del CO2 de un flujo de gases, siendo una tecnología madura en el campo de la purificación de gas natural y en la producción de CO2 para usos comerciales, tales como la industria alimenticia y la producción de amoniaco (NH3) y urea para la fabricación de fertilizantes. El fundamento de todos estos procesos es la reacción de una base, normalmente aminas (monoetilamina, MEA), en medio acuoso con un gas ácido. La concentración del CO2 recuperado de un proceso con absorción química basado en aminas es del 99,9%. Sin embargo, existen problemas de degradación de las aminas en presencia de un agente oxidante y, además, la cantidad de energía requerida para la regeneración de las aminas es muy elevada, siendo ésta la limitación más importante del proceso para su uso a gran escala en sistemas de captura y almacenamiento de CO2 (CAC). –60– 2. Captura de CO2 Figura 2.10. Torre de absorción de aminas para captura de CO2, de Mitsubishi Heavy Industries Ltd, una de las empresas que comercializa torres de separación por aminas para aplicaciones industriales. Existen estudios [7], [8] que demuestran que los procesos de absorción basados en agentes químicos son la opción preferida para la captura en post-combustión. Sin embargo, a pesar de ser una tecnología madura, los tamaños de operación alcanzados hasta ahora no son suficientemente grandes, ya que, como se ha mencionado anteriormente, las plantas que incorporan estos sistemas para CAC sólo existen a nivel planta piloto o demostración, mientras que la cantidad capturada en plantas para usos industriales es muy pequeña comparada con la cantidad requerida para CAC. 3.2. Absorción con amoniaco enfriado Un equipo del Instituto de Investigación en Generación Eléctrica de Palo Alto (EPRI), en Estados Unidos, en colaboración con la empresa Alstom, ha desarrollado un proceso con amoniaco enfriado (conocido por su nombre en inglés, chilled ammonia) probándolo en una planta de demostración de 5 MW con un nuevo diseño de absorbedor-regenerador, en Pleasant Prairie, Wisconsin (Estados Unidos) [9]. –61– Este proceso podría reducir considerablemente las penalizaciones energéticas y otros costes comparados con los generados en el proceso tradicional de monoetilamina (MEA). Tiene además la ventaja de una mayor capacidad de carga de CO2 (kilos de CO2 absorbido por kilogramo de absorbente), requiere menos calor para liberar el CO2 y regenerar el absorbente (entre un 49 y un 64%) y no muestra problemas de corrosión ni degradación [5]. Figura 2.11. Planta piloto de separación de CO2 con amoniaco enfriado en Pleasant Prairie, Wisconsin (Estados Unidos) [10]. En octubre de 2009, Alstom, We Energy y EPRI anunciaron el éxito de la planta piloto de Pleasant Praire, demostrando que la tecnología puede ser usada para capturar de manera efectiva CO2 tanto en las plantas actuales como en las que se construyan en el futuro [9]. Se ha instalado una planta de 20 MW de potencia con el sistema de captura incorporado, la American Electric Power’s 1.300-MW Mountaineer Plant, donde se estima que se capturará el 90% de las emisiones de CO2 del gas de salida, evitando la emisión de 100.000 toneladas de CO2 por año. 3.3. Sorbentes físicos Las condiciones de separación de CO2 en procesos de captura en pre-combustión son muy diferentes de las de post-combustión. Por ejemplo, en un proceso GICC modificado –62– 2. Captura de CO2 para captura, la concentración de CO2 será aproximadamente del 35-40% a una presión de 20 bares o superior. En este caso es más adecuado utilizar absorbentes físicos8 , como el Selexol®, con la ventaja de que el CO2 puede ser liberado por despresurización, evitando así el consumo elevado de calor del proceso del limpiado con aminas. Aún así, la presurización del solvente tiene una penalización energética considerable. El uso de absorbentes físicos para la limpieza de CO2 es una tecnología bien establecida, por ejemplo, en la producción de amoniaco y en plantas de procesamiento de gas natural. Figura 2.12. Planta de gas natural en SandRidge que captura el CO2 mediante el proceso Selexol®. 3.4. Sorbentes sólidos Asimismo, es posible separar el CO2 de una mezcla gaseosa mediante la adsorción en sorbentes sólidos, tales como las zeolitas y los carbonos activos. Para ello se utiliza una columna de separación de adsorción por presión (PSA), en la cual se pasa el gas a presión elevada en un lecho empaquetado hasta alcanzar la concentración deseada. El lecho se regenera reduciendo la presión. En el caso de una TSA (separación por cambio de temperatura), el lecho se regenera aumentando la temperatura. Tanto las PSA como las TSA están disponibles comercialmente, siendo métodos estándar de separación de gases, usados especialmente en la producción de hidrógeno y en la separación del CO2 del gas natural. 8 La absorción física depende de la presión parcial del contaminante. Estos procesos son aplicables cuando la presión del gas es alta y hay cantidades apreciables de contaminantes. Los solventes se regeneran con disminución de presión y aplicación baja o moderada de calor. En estos procesos, el solvente absorbe el contaminante, pero como gas en solución y sin que se presenten reacciones químicas. –63– Una de las limitaciones más importantes de esta tecnología para la captura de CO2 a gran escala es que tanto la capacidad total de los materiales como su selectividad son aún muy pequeñas, por lo que en la actualidad se está trabajando en su mejora y en la búsqueda de materiales alternativos (por ejemplo MOF, del inglés Metal Organic Frameworks), como en su combinación con otras tecnologías de captura (híbridos orgánicos-inorgánicos con grupos amina soportados). Tanto en el caso de la absorción química como de la física, el principio de separación es el mismo, tal y como se esquematiza en la figura 2.13. La corriente gaseosa que contiene CO2 entra en la unidad de separación, el CO2 con el sorbente (adsorbente o absorbente) pasa a otra unidad donde se recupera el CO2 , habitualmente por cambio de temperatura o de presión, lo que requiere un aporte de energía, y finalmente se separan por una parte el CO2 , listo para su acondicionamiento posterior, y por otra, el sorbente, que tras ser recuperado, vuelve a la unidad de captura de CO2 para su uso posterior. En el caso de las PSA, el sorbente se regenera en la misma columna aplicando un cambio de presión. Dado que el sorbente se va gastando o degradando, es preciso aportar más cantidad cuando eso ocurra. Figura 2.13. Proceso de adsorción/absorción del CO2 con recuperación del sorbente. 3.5. Separación criogénica El CO 2 también puede ser separado de una corriente gaseosa mediante etapas de enfriamiento y condensación, lo que se conoce como separación criogénica. Esta técnica se emplea comercialmente para corrientes con altas concentraciones de CO2 (típicamente de más de un 90%), pero no suele usarse para corrientes más diluidas. –64– 2. Captura de CO2 La mayor desventaja de este proceso es la gran cantidad de energía que se requiere para la refrigeración, especialmente si se usara en corrientes muy diluidas. Otra desventaja consiste en que es necesario separar otros componentes de la corriente gaseosa, por ejemplo el agua, para evitar bloqueos en las tuberías, con el consiguiente consumo energético adicional. Entre sus principales ventajas cabe destacar que permite la producción directa de CO2 líquido, necesario para ciertas opciones de transporte (por barco). Dadas las condiciones de este proceso, sólo aplicable a altas concentraciones de CO2 y a altas presiones, esta tecnología podría ser adecuada para la captura en pre-combustión y oxi-combustión. Figura 2.14. Proceso de separación de CO2 por destilación criogénica. 3.6. Separación de gases por membrana La separación de gases por membrana permite aislar un componente de una corriente al pasar más rápidamente que los otros. Existen distintos tipos de membranas para separación de gases: membranas porosas inorgánicas, membranas de paladio, membranas poliméricas, zeolitas y otras. Puesto que las membranas no logran altos grados de separación, se hace necesario separar en múltiples etapas, o pasar la corriente de gases cíclicamente, lo cual aumenta la complejidad, el consumo energético y el coste total del proceso. En la actualidad se están desarrollando membranas con solventes soportados, combinando así lo mejor de la membrana y del solvente para la separación con alta pureza de CO2 , sin embargo, existe aún un largo camino por recorrer antes de que la tecnología de membranas pueda ser usada a gran escala en plantas que incorporen tecnologías de captura de CO2 . –65– Figura 2.15. Proceso de separación de CO2 por membrana. 3.7. Ciclos de carbonatación-calcinación El CO2 puede también ser separado de la corriente gaseosa de salida mediante ciclos de carbonatación-calcinación. Estos procesos utilizan óxido de calcio (CaO) como sorbentes sólidos a temperaturas relativamente altas. La utilización de altas temperaturas en la etapa de separación del CO2 tiene la ventaja potencial de la reducción del consumo energético con respecto a los sistemas de absorción química estándar. En este proceso, los gases de combustión se ponen en contacto con el CaO en un reactor (carbonatador), permitiendo la reacción de carbonatación entre el gas y el sorbente sólido, formando carbonato cálcico (CaCO3). Éste puede ser fácilmente separado de la corriente de gases y enviado para su regeneración a un reactor diferente (calcinador). Una de las claves de estos sistemas es el propio sorbente, que debe poseer una buena capacidad de absorción de CO2 y una buena estabilidad química y mecánica durante largos periodos de operación, repetidos cíclicamente. La mayor ventaja del ciclo de carbonatación-calcinación es el bajo consumo energético, debido a la posibilidad de recuperar gran parte de la energía (cerca del 40%) que entra en la unidad de calcinación, –66– 2. Captura de CO2 Figura 2.16. Proceso de separación de CO2 por ciclos de carbonatación-calcinación. gracias a la recirculación de las partículas sólidas (tal y como se realiza en una caldera de lecho fluido circulante). Además, en el mismo proceso se eliminan de manera conjunta el CO2 y el SO2. Las desventajas consisten en que es necesario lavar los gases de combustión para que no se reduzca la reactividad de los sorbentes (el CaO pierde rápidamente su capacidad de absorción después de pocos ciclos de carbonatación-calcinación) y en que se requieren temperaturas muy altas (superiores a los 800 °C) para recuperar el sorbente. Existe una planta piloto en el Instituto del Carbón del Consejo Superior de Investigaciones Científicas (INCAR-CSIC) en Oviedo, España (figura 2.17), que incorpora una tecnología de carbonatación-calcinación, desarrollada por el grupo del Dr. Abanades. En la planta térmica de la Robla, propiedad de Gas Natural Fenosa, se probará dicha tecnología para captura de CO2 proveniente de la combustión de biomasa en post-combustión. Asimismo se está construyendo una planta de demostración de 1 MW en la Pereda, Asturias, auspiciada por el CSIC, Endesa y Hunosa para probar dicha tecnología. –67– Figura 2.17. Planta piloto de carbonatación-calcinación para captura de CO2 diseñada e instalada en el Instituto Nacional del Carbón, del Consejo Superior de Investigaciones Científicas (INCAR-CSIC). (Gentileza del INCAR-CSIC). 4. Conclusiones En este capítulo hemos repasado brevemente en qué tipo de plantas y en qué tipo de procesos es posible incorporar las tecnologías de captura de CO2, así como cuales son las tecnologías actuales y en desarrollo para separarlo de la corriente gaseosa de la que proviene. El proceso de captura lleva asociado su transporte y almacenamiento en lugar seguro y definitivo, tema que trataremos en el siguiente capítulo de este libro. De la información presentada aquí se extrae que la tecnología de captura de CO2 está disponible para ser incorporada a las centrales productoras de energía y a otras plantas industriales que son foco de emisiones localizadas de CO2. Sin embargo, aún no existe ninguna planta energética que opere a nivel industrial con las tecnologías de captura y almacenamiento de CO2 completamente integradas. Esto se debe a razones temporales, dado que la necesidad de la captura y el almacenamiento es un tema reciente, y a razones económicas, ya que, como se verá en el siguiente capítulo, resulta más caro capturar y almacenar que simplemente emitir a la atmósfera. En la actualidad se están llevando a cabo distintos proyectos para demostrar la viabilidad técnica y económica a gran escala de estas tecnologías, con plantas piloto recién inauguradas o en proceso de construcción y proyectos de construcción de plantas con estas tecnologías incorporadas a nivel industrial, algunos de las cuales se verán en el capítulo 7. –68– 2. Captura de CO2 5. Bibliografía 1. Informe de la Agencia Internacional de la Energía (IEA, International Energy Agency), Putting Carbon Back into the Ground, Green House Gas R&D Programme, 2001. 2. YAN LI, B. MARKLEY, A. R. MOHAN, V. RODRÍGUEZ-SANTIAGO, D. THOMPSON, D. van NIERKERK, «Utilization of carbon dioxide from coal-fired power plant for the production of value added products», Design Engineering of Energy and Geo-Environmental Systems Course (EGEE 580), abril, 2006. 3. 4. Informes del International Panel for Climate Change (IPCC), en <http://www.ipcc.ch>. Massachusetts Institute of Technology, The Future of Coal: Option for Carbon-Constrained World, Cambridge, MA, 2007, en <http://web.mit.edu/coal/>. 5. World Resources Institute (WRI), CCS Guidelines: Guidelines for Carbon Capture, Transport and Storage, Washington, DC, 2008. 6. U. S. Department of Energy, National Energy Technology Laboratory, «Carbon Sequestration Technology Roadmap and Program Plan», abril 2007, en <http://www.netl.doe.gov/technologies/carbon_seq/refshell/ projects%20portfolio/2007/2007Roadmap.pdf>. 7. Fundación para Estudios sobre Energía. El futuro del carbón en la política energética española, depósito legal M-18554-2008, 2008. 8. «The IDEAS Factory sandpit and the Green and Sustainable Chemical Technologies Sandpit: the CO 2 Capture and Storage in Salah Project», en <http://www.co2captureproject.org/phase1index.htm>. 9. Electric Power Research Institute (EPRI), Technical Assessment Guide, Volume 1: «Electricity Supply-1993 (revision 7)», Palo Alto, CA, junio, 2007. 10. Carbon Capture News Conference, 8 de octubre de 2009, en <http://p4chilledammonia.com/>. –69– –70– 2. Captura de CO2 3 Transporte y almacenamiento de CO2 La sabiduría consiste en saber cuál es el siguiente paso; la virtud, en llevarlo a cabo David Starr Jordan Tras la captura en las fuentes de emisión, el dióxido de carbono debe ser transportado hasta el lugar donde se almacenará de manera permanente (o temporal, para futuros usos industriales), finalizando así las tres etapas del proceso: captura, transporte y almacenamiento, y evitando su emisión a la atmósfera. En este capítulo nos centraremos en el transporte de CO2 a gran escala y en los distintos enclaves posibles para su almacenamiento permanente, citando algunos proyectos emblemáticos que ya están en marcha. Además, repasaremos brevemente qué condiciones debe cumplir un enclave para que sea apto como almacén de CO2 , cómo se monitoriza la evolución de la cantidad de CO2 y su emplazamiento dentro del almacén tras la inyección, y con el paso de los años. Por último, revisaremos las estimaciones económicas que lleva asociado el proceso de captura, transporte y almacenamiento de CO2 . 1. Transporte de dióxido de carbono Una vez el CO2 ha sido capturado y acondicionado con las tecnologías detalladas en el capítulo anterior, debe ser transportado hasta su lugar de almacenamiento. Existen dos grandes opciones para su transporte, mediante tuberías o gasoductos1, a veces llamados CO2-ductos, que operarían de igual manera que los gasoductos que transportan gas natural en la actualidad, o a través de barcos, en tanques similares a los que se usan para el gas licuado de petróleo (GLP) [1]. 1 Un gasoducto es una conducción o tubería que sirve para transportar gases, habitualmente combustibles, a gran escala. –71– En el transporte por gasoducto, el dióxido de carbono se comprime a presiones muy altas, inyectándolo así en la tubería para su transporte hasta el lugar de almacenamiento. Para mantener al CO2 en estado supercrítico a lo largo de todo el gasoducto, la presión debe mantenerse lo suficientemente alta (superior a 78 atmósferas). En el caso de que el transporte se lleve a cabo a distancias superiores a 300 km, y la presión no sea muy superior a 78 atmósferas, se necesita una estación de compresión para mantener dicha presión en el gasoducto (o CO2-ducto). Estas presiones consiguen evitar la formación de gas, ya que el CO2 permanece siempre en estado supercrítico y, además, permiten una densidad elevada de dióxido de carbono, lo que facilita su transporte. Figura 3.1. Inyector de CO2 a alta presión usado en el campo de Weyburn, Canadá. Además de por tubería, el CO2 puede ser transportado también mediante barcos o buques, de manera similar a como se transportan hoy en día los gases licuados de petróleo (GLP). Puesto que las propiedades del CO2 licuado son similares a las de los GLP, la tecnología que se usa para éstos podría ampliarse para ajustarse a los grandes medios de transporte por barco de CO2 , transportado a una presión de 7 atmósferas. El transporte por barco se considera adecuado cuando existen terrenos difíciles y fuentes de emisión de CO2 alejadas del lugar de almacenamiento, siendo considerablemente más caro que el transporte por tubería. –72– 3. Transporte y almacenamiento de CO2 Los camiones y los vagones cisterna también son opciones técnicamente viables. Estos sistemas transportan CO2 a una temperatura de –20 °C y a una presión de 20 atmósferas. En la actualidad son un medio de transporte habitual para pequeñas cantidades de CO2 , sin embargo, son costosos en comparación con los gasoductos para transporte a gran escala. A día de hoy, tanto el coste como la capacidad de volumen requerida hacen que la única opción viable para captura, transporte y almacenamiento de CO2 (CAC) a gran escala (industrial) sea el transporte por tubería, aunque se está planteando el uso de barcos para plantas de demostración. Figura 3.2. Distintos medios de transporte de CO2: gasoducto, buque y camión cisterna. Para saber qué riesgos potenciales comporta el transporte de CO 2 es necesario tener en cuenta cuáles son sus propiedades. Tal y como vimos en el capítulo 1, el dióxido de carbono es no tóxico y puede ser manejado fácilmente, por lo que el transporte de dicho compuesto no presenta un problema tecnológico, ni de alto riesgo. Ahora bien, el CO2 es más pesado que el aire, tendiendo a situarse en las depresiones, y es asfixiante a elevadas concentraciones, factores que deben tenerse en cuenta tanto en su inyección y transporte como en su almacenamiento y posibles fugas. Operado con las condiciones adecuadas, el riesgo de problemas de fugas en el transporte y almacenamiento de CO2 es muy pequeño: en primer lugar por las propias condiciones en que se transporta y almacena, ya que está en estado supercrítico (siendo, por tanto, su densidad elevada) y, en segundo lugar, por las condiciones de seguridad y estabilidad que se requieren a los lugares en los que se almacenará, tal y como se explicará en la siguiente sección de este capítulo. –73– Para saber cuáles podrían ser los riesgos potenciales para la salud y el medio ambiente se están estudiando en detalle los análogos naturales (procesos similares que ocurren en la naturaleza), como los géiseres y los volcanes, que emiten grandes cantidades de CO2 de manera periódica. Se estima que el comportamiento de estos sistemas y sus implicaciones es muy similar a lo que ocurriría en una fuga de CO2 capturado. Asimismo, se están llevando a cabo estudios en profundidad de las posibles implicaciones de fugas de CO2 dependiendo de la cantidad y del lugar en que pudiera ocurrir. Para la inyección y transporte de CO2 en los CO2-ductos deberían desarrollarse normas de seguridad similares a las usadas en la actualidad para la admisión de gas natural en los gasoductos [1]. Las normas vigentes elaboradas en gran parte en aplicaciones de uso de CO2 para recuperación asistida de petróleo (tecnología que veremos más adelante en este capítulo), podrían servir de punto de partida, pero no son necesariamente idénticas a las que se requerirán para la CAC. Los requisitos más importantes para los gasoductos de CO2 están relacionados, sobre todo, con su trazado y paso por zonas habitadas: un gasoducto de CO2 que atraviesa zonas habitadas debería tener un contenido en sulfuro de hidrógeno (H2S) mucho más bajo del exigido para la recuperación del petróleo, asimismo, se requiere una selección detallada de la ruta, medidas de protección para posibles presiones excesivas y sistemas de detección de fugas, entre otros factores. No obstante, debido a las condiciones mencionadas anteriormente, no se prevén obstáculos técnicos importantes con respecto al diseño de los gasoductos de CO2 para la CAC. Otro factor importante a tener en cuenta en el diseño y construcción de los CO2-ductos son los materiales que deberían utilizarse para su fabricación. Los empleados para el transporte de gas natural suelen estar fabricados con acero al carbono-manganeso; el CO2 seco (sin humedad) no es corrosivo para este material, incluso si contiene pequeñas cantidades de oxígeno, sulfuro de hidrógeno y óxidos de sulfuro o de nitrógeno, como sería el caso del CO2 capturado de una central térmica. Sin embargo, el CO2 húmedo es muy corrosivo, por lo que los gasoductos de CO2 húmedo deberían construirse con una aleación resistente a la corrosión (material que suele tener un coste varias veces superior al del acero al carbono-manganeso), o ser revestidos en su interior con una aleación o una capa continua de polímeros resistentes a la corrosión. La mejor opción, para usar las tecnologías actuales y para reducir el coste, sería secar el CO2 antes de inyectarlo a la tubería. –74– 3. Transporte y almacenamiento de CO2 Figura 3.3. Gasoductos de gas natural en operación fabricados con acero al carbono-manganeso. 2. Almacenamiento de CO2: criterios La etapa del almacenamiento es imprescindible, ya que no puede llevarse a cabo la captura a gran escala como medida paliativa para mitigar el cambio climático si no existen enclaves para el almacenamiento de los gases capturados. Para encontrar esos enclaves es preciso tener en cuenta una estimación de la cantidad de dióxido de carbono que se necesita almacenar en todo el mundo, y que el lugar de almacenamiento debe estar relativamente cerca del lugar de captura. La búsqueda de estos enclaves como lugares seguros para el almacenamiento de CO 2 supone una inversión económica y de tiempo, que también se sumaría, en cierta medida, al coste de captura, transporte y almacenamiento de CO2 , y por tanto, al coste de la energía producida. Encontrar esos enclaves es una de las preocupaciones actuales de las empresas generadoras de energía, de los gobiernos locales, de la Unión Europea y a nivel mundial. Junto con la búsqueda y localización de esos enclaves debe aparecer una normativa que regule dicho almacenamiento, la cual está en proceso de desarrollo tanto en Europa como en Estados Unidos, Australia y Japón. –75– 2.1. ¿Dónde debe almacenarse el CO2? Para almacenar el CO 2 se busca su confinamiento permanente en el subsuelo (lo que denominamos almacenamiento geológico) o en los océanos, en condiciones seguras para las personas, las instalaciones y el medio ambiente, culminando así las tres etapas del proceso de CAC. Las opciones viables, tanto desde el punto de vista técnico, como de seguridad y económico, apuntan en tres direcciones: en yacimientos agotados de petróleo y gas, en formaciones salinas profundas y en capas de carbón inexplotables (es decir, no aprovechables para uso humano). En estos tres casos se habla de almacenamiento geológico. Asimismo, existe la posibilidad de almacenar el CO2 en las profundidades del océano, aunque actualmente la Unión Europea no lo considera una de las opciones viables por razones medioambientales, ya que no se sabe aún cuál podría ser su efecto sobre los ecosistemas. 2.2. Condiciones para el almacenamiento de CO2 Los enclaves elegidos para el almacenamiento seguro del CO2 deben cumplir, en todos los casos, unas ciertas restricciones: - la inyección debe llevarse a cabo a más de 800 metros de profundidad. En esas condiciones el CO2 no es un gas, sino un líquido o está en estado supercrítico, con una densidad un 50-80% similar a la del agua (y similar al petróleo); - asimismo, para evitar fugas que lo devolverían a la atmósfera, es importante que el almacén esté sellado (superior y lateralmente), mediante una roca sello adecuada, y que cuente con mecanismos adicionales para la retención del CO2 (retención geoquímica o adsorción por carbón o pizarras arcillosas). 2.3. Capacidad de los almacenes ¿Qué capacidad deben tener esos almacenes?, es decir, ¿cuánto CO2 «cabe» en un almacén? Para calcular la capacidad de un posible almacén debe tenerse en cuenta que el volumen que ocupa una tonelada de CO2 gas en superficie (0 °C y 1 atmósfera) es muy diferente del –76– 3. Transporte y almacenamiento de CO2 que ocuparía una tonelada de CO2 en estado supercrítico (a 35 °C y unas 80 atmósferas) o almacenado en el subsuelo. Así, una tonelada de CO2 en superficie ocuparía un volumen de 509 m3, mientras una tonelada de CO2 supercrítico en superficie ocupa 1,39 m3 y una tonelada de CO2 a unos 800 m de profundidad ocuparía aproximadamente 9 m3 de volumen de roca almacén2 , considerando una porosidad del 20% y desplazando un 80% del agua contenida [2]. En la figura 3.4 se presenta un esquema de las distintas opciones de almacenamiento permanente del CO2 capturado que cumplen los criterios anteriormente mencionados. Se usa como ejemplo una central térmica para producción de electricidad. Figura 3.4. Posibles lugares de almacenamiento de CO2, incluyendo almacenamiento en acuíferos salinos profundos, reservas agotadas de petróleo o gas, depósitos de carbón no explotables y almacenamiento oceánico (adaptada del IPCC [1]). 2 En térmicos geológicos, la roca almacén es una roca permeable porosa y agrietada cubierta de capas impermeables a la que asciende el gas natural y el petróleo procedente de la roca madre y en la que queda almacenado. Es una roca con intersticios o poros donde puede almacenarse el petróleo, el gas, el agua, etc. –77– En la tabla 3.1 se muestra la capacidad total de almacenamiento de los distintos enclaves estimada por la Agencia Internacional de la Energía [5]. Para tener una idea de si la capacidad prevista es suficiente, se deben comparar estos números con las proyecciones totales de emisiones de CO2 previstas de aquí al 2050, de acuerdo con el escenario business as usual (previsiones si las emisiones siguen la tendencia mostrada hasta ahora) propuesto por el Panel Internacional para el Cambio Climático (en inglés, International Panel for Climate Change – IPCC). Dicho escenario muestra que las técnicas de CAC tendrán un papel muy relevante en la reducción de emisiones de CO2 [1]. Tabla 3.1. Capacidad estimada de los almacenes naturales de CO2 [5]. Las estimaciones de los acuíferos salinos profundos datan de los primeros años de la década de 1990. Estimaciones más recientes sugieren que la capacidad de almacenamiento geológico sólo en la parte noreste de Europa es de más de 800 Gt CO2 . En la actualidad se sigue trabajando activamente en encontrar los mejores emplazamientos y su capacidad total de almacenamiento, aunque, como puede extraerse de los datos de la tabla, la capacidad conocida de los acuíferos salinos sería suficiente para albergar el CO2 capturado procedente de la combustión de todos los combustibles fósiles de los que se dispone a día de hoy. Pasamos a analizar a continuación en más detalle las distintas opciones de almacenamiento, así como el seguimiento posterior de un almacén y los costes asociados a estos procesos. –78– 3. Transporte y almacenamiento de CO2 3. Almacenamiento y recuperación asistida de petróleo Una de las opciones tecnológicas más viables y seguras para almacenar permanentemente el CO2 es en usar los yacimientos agotados de petróleo o gas. La naturaleza se ha encargado de mantener estas reservas fósiles durante millones de años en dichos pozos, de manera estable y segura, por lo que es muy probable que el CO2 pueda permanecer en las mismas condiciones (de manera estable y segura) en dichos almacenes durante gran número de años. La inyección de CO2 en pozos de petróleo agrega un valor añadido al mero almacenamiento, ya que, además, ayuda a la recuperación del petróleo pesado existente, permitiendo la extracción de petróleo adicional (es la denominada recuperación mejorada o asistida del petróleo, en inglés, Enhanced Oil Recovery, EOR). Así, los primeros proyectos de almacenamiento realizados para captura de CO 2 en la historia se relacionan precisamente con la recuperación asistida del petróleo. Para llevarla a cabo, el CO2 , junto con agua, se inyecta bajo tierra a aproximadamente 1.500 metros, en un campo de petróleo ya agotado. La inyección se basa en el mecanismo de miscibilidad 3, mediante la cual el CO2 se mezcla con el petróleo restante en el depósito a la presión y temperatura adecuadas, ayudando a mejorar la extracción en la fase final (terciaria) de la vida del reservorio de petróleo. En esta estrategia, que alterna el gas y la inyección de agua, el CO2 aumenta la presión de inyección del embalse y la fluidez de petróleo, lo que permite al combustible escapar de la roca en la que se encuentra, aumentando el flujo desde los poros hacia los pozos de producción con mayor facilidad. Gran parte del CO2 inyectado es bombeado a la superficie junto con el petróleo y el agua. Luego, el CO2 vuelve a separarse e inyectarse en los pozos. Al final del proceso de recuperación del petróleo, idealmente, todo el CO2 inyectado y reciclado queda almacenado permanentemente en el pozo. El uso de CO2 para la recuperación asistida del petróleo se inició en los Estados Unidos durante la década de 1960, como se documenta en las patentes de Lindauer y Robert [3] y de Sharp Lorld [4], y su primera explotación comercial se llevó a cabo en los campos maduros de la cuenca del Pérmico, al oeste de Texas, en los setenta. En aquellos años, el CO2 separado de la producción de gas natural se ventilaba a la atmósfera, por lo que comenzó a ser usado para la recuperación asistida de petróleo. Para abaratar los costes que suponían la preparación e inyección del CO2 , los proyectos fueron estimulados a través de exenciones 3 La miscibilidad es una característica de los líquidos que les permite mezclarse en cualquier proporción, formando una solución homogénea. –79– fiscales y de incentivos normativos por parte de las autoridades, en un periodo en que la producción doméstica de petróleo comenzaba a declinar rápidamente en Estados Unidos, como ocurrió con la actividad de Shell E & P Occidental y Mobil Producing Company. Figura 3.5. Esquema de la recuperación asistida de petróleo (EOR) mediante inyección de CO2. Gracias a la posibilidad de continuar explotando pozos ya agotados y a los incentivos fiscales asociados, la inyección de CO2 para EOR comenzó a utilizarse progresivamente en otras regiones de Estados Unidos, tales como Oklahoma (1982), Mississippi (1985), Colorado (1986) y Wyoming (1986). Desde el año 2000 estas actividades también han crecido en otras regiones como Michigan, Kansas, California, y más significativamente a lo largo de la costa del Golfo. –80– 3. Transporte y almacenamiento de CO2 Se estima que, en la actualidad, existen a nivel mundial aproximadamente unos 100 pozos donde se está llevando a cabo la recuperación asistida de petróleo por inyección de CO2 , y que en 2006 produjeron alrededor de 250.000 barriles de petróleo. De estos pozos, cerca de 90 se encuentran en Estados Unidos y Canadá, principalmente en las regiones de la cuenca del Pérmico (Texas y Nuevo México), la cuenca del Bighorn (Wyoming), el Campo Rangely (Colorado) y la Cuenca del Salado (Mississippi). Mención especial merece el proyecto de captura, transporte y almacenamiento de CO2 llevado a cabo en el campo de Weyburn, Canadá. Desde el año 2000, la corporación EnCana ha venido utilizando el CO2 capturado de la gasificación de carbón en las Grandes Llanuras de Dakota del Norte (Estados Unidos) para recuperar más petróleo de sus reservas casi agotadas en el pozo de Weyburn, en Saskatchewan, Canadá. La recuperación asistida de petróleo se lleva a cabo mediante el procedimiento descrito anteriormente, al mismo tiempo que se almacena el CO2 de manera permanente. Figura 3.6. Vista parcial del campo de Weyburn, donde se inyecta CO2 para recuperar petróleo mediante la técnica EOR. –81– Figura 3.7. Localización en el mapa del gasoducto desde el lugar donde se captura el CO2, en Dakota del Norte, Estados Unidos, hasta donde se inyecta, en Weyburn, Canadá. El proyecto de EnCana, en Weyburn, es el estudio científico de campo de mayor escala que se está llevando a cabo nivel mundial en la actualidad sobre el almacenamiento de CO2 mediante EOR. A diario, se trasportan e inyectan 3 millones de m3 (5.000 toneladas métricas) de CO2 , para la recuperación de petróleo y el almacenamiento de CO2 . Hasta la fecha se han inyectado y almacenado más de 13 millones de toneladas de CO2 de los 30 millones que se espera almacenar. Para dar una idea de la magnitud de la cantidad acumulada, esto equivale a las emisiones de 6,7 millones de automóviles durante un año. –82– 3. Transporte y almacenamiento de CO2 4. Almacenamiento en acuíferos salinos profundos Otro posible emplazamiento para almacenar el CO 2 capturado es en formaciones geológicas subterráneas distintas de las reservas de petróleo y gas. Así, una opción tecnológica prometedora es la de inyectarlo en acuíferos salinos profundos bajo tierra, en diversas partes del planeta. Los acuíferos salinos profundos son formaciones rocosas subterráneas compuestas por materiales permeables que contienen un alto porcentaje de fluidos salinos no aptos para el consumo humano [5]. En la figura 3.8 se muestra de manera esquemática qué componentes esenciales debe tener un acuífero salino, a una profundidad entre 800 y 1.500 m. Una de estas formaciones salinas profundas se encuentra en el campo de Sleipner, uno de los mayores productores de gas natural en el mar del Norte, en Europa. El gas natural producido en dicho campo contiene hasta un 9% de CO2 , cantidad que debe ser reducida a un máximo de 2,5% para satisfacer las especificaciones de exportación requeridas y las demandas de los clientes. Al ritmo de producción actual, esto equivale a una extracción de casi un millón de toneladas de CO2 al año. Si ese CO2 hubiera sido liberado a la atmósfera, el resultado habría sido un aumento de las emisiones de CO2 de Noruega de casi el 3%. Figura 3.8. Esquema donde se muestran los componentes de un acuífero salino profundo: roca sello impermeable, agua salina no apta para consumo humano, espacio de poros y granos de arena permeable. –83– Figura 3.9. Plataforma de Sleipner donde se extrae gas natural. El CO2 separado de dicho gas natural se inyecta en la formación Utsira [10]. La producción de gas natural del campo de Sleipner, con captura de CO2 , comenzó en 1996, siendo el primer proyecto mundial de inyección de CO2 a gran escala en acuíferos salinos profundos [6]. Fondo Statoil opera el campo de Sleipner en nombre de un grupo de socios industriales productores de gas natural para una amplia gama de clientes. La separación del CO2 de la corriente de gas natural se consigue mediante torres de absorción con aminas de unos 20 metros de altura. El CO2 que se produce se inyecta en el acuífero de la formación Utsira, a unos 800 metros bajo el lecho del mar del Norte. Al operar de esta manera, las emisiones de CO2 a la atmósfera son insignificantes, especialmente comparadas con el 3% de aumento que supondrían para Noruega en el caso de no llevar a cabo este proyecto. En la figura 3.10 se muestra un esquema del proceso, donde se observa cómo el gas natural y el acuífero salino profundo están en dos formaciones geológicas bien diferenciadas [7], [8]. –84– 3. Transporte y almacenamiento de CO2 Figura 3.10. Extracción de gas natural con captura de CO2 e inyección en el acuífero salino de Utsira (Statoil) [7]. El proyecto Sleipner, con capacidad de un millón de toneladas de CO2 anuales, ha marcado un hito en la historia industrial, ya que esta tecnología no había sido probada anteriormente para una operación a gran escala. Se estima que la formación Utsira tiene capacidad para almacenar hasta 600 millones de toneladas de CO2 . La misma tecnología se está implementado actualmente en el campo de Salah en Argelia, operado por BP y Statoil [9]. –85– 5. Almacenamiento en capas de carbón inexplotables El CO 2 puede inyectarse también en capas de carbón inexplotables, es decir, no aptas como recursos para los seres humanos. En algunos casos, al inyectar CO 2 en estas capas de carbón, es posible recuperar metano del interior de las mismas, procedimiento conocido como ECBM (del inglés, Enhanced Coal Bed Methane). El ECBM consiste en reemplazar las moléculas de metano adsorbidas en los microporos de las capas de carbón (pequeños huecos o cavidades dentro de las rocas) por moléculas de CO2 . Las moléculas de metano son desplazadas a las fracturas del carbón y a los pozos de producción, pudiendo ser liberadas para su uso posterior. El CO 2 queda atrapado en dichos microporos y tan sólo una pequeña parte de él llega hasta los pozos de producción, mientras haya una cantidad apreciable de metano que extraer. El proceso se esquematiza en la figura 3.11. La recuperación de metano de esas capas profundas de carbón presenta, pues, un doble beneficio ambiental, recuperando el metano para su uso comercial y almacenando el CO2 inyectado, de manera similar a como ocurre en el EOR. Existen varios proyectos de ECBM en desarrollo en el mundo, seis en Estados Unidos (básicamente localizados en la cuenca del río San Juan, en el Oeste Medio del país), dos en Canadá, uno en Europa, en la cuenca de Silesia, Polonia (proyecto conocido como RECOPOL, en el que colaboran diversos organismos de diferentes países), uno en China y uno en Japón. Gracias a esos proyectos, el gas metano de las capas de carbón ha pasado de ser sólo un riesgo de la explotación del carbón a constituir un recurso importante en el abastecimiento energético, que, en Estados Unidos, con una producción insignificante a principios de los años noventa, han convertido en el 8% de la producción total y el 10% de las nuevas reservas en el 2002. Así, en ese año la producción en Estados Unidos fue de 45.192 millones de m 3 y se estimaron unas reservas de 517.748 millones de m 3. –86– 3. Transporte y almacenamiento de CO2 Figura 3.11. Recuperación de metano a partir de la inyección de CO2 en capas de carbón inexplotables. El aprovechamiento del metano se extiende actualmente a otros países, como Alemania o el Reino Unido, existiendo también algunos proyectos en fase de estudio exploratorio como, por ejemplo, en Asturias, España. Especial mención merecen los esfuerzos realizados en las cuencas San Juan Basin y Black Warrior (Alabama, Estados Unidos), donde la explotación del metano ha alcanzado la plena madurez y el coste de la inyección de CO2 se ve disminuido por la producción de metano. –87– 6. Almacenamiento oceánico de CO2 Finalmente, el CO2 también podría ser almacenado en los océanos. Dicho almacenamiento se llevaría a cabo de dos formas: o bien mediante la inyección y disolución de CO2 en una columna de agua (a más de 1.000 metros de profundidad) por medio de un gasoducto fijo o un buque en desplazamiento, o bien mediante un depósito de CO2 , a través de un gasoducto fijo o una plataforma marítima, en el fondo oceánico a más de 3.000 metros de profundidad, donde el CO2 tiene mayor densidad que el agua y se espera que forme un lago que retrasaría la disolución de CO2 en el entorno (ver figura 3.12). El almacenamiento oceánico y su impacto ecológico aún están en fase de investigación, y en la actualidad no se encuentra entre las opciones aconsejadas por la Unión Europea debido a la falta de conocimiento sobre su posible impacto medioambiental. Captación Gasoducto fijo Buque en desplazamiento Penacho ascendente CO2 gaseoso o líquido Plataforma CO2 líquido Océano Disolución Penacho descendente Disolución 3.000 m Lago Figura 3.12. Posible almacenamiento oceánico de CO2 [1]. –88– CO2 líquido 3. Transporte y almacenamiento de CO2 7. Selección y seguimiento de un almacén de CO2 ¿Cómo se selecciona un lugar para el almacenamiento seguro del CO2? Para ello se debe comenzar por la información geológica de la zona. Se busca la existencia en el subsuelo de pares de formaciones geológicas roca almacén y roca sello superpuestas, con espesor y extensión suficiente, y en condiciones estructurales que garanticen la estanqueidad4 del almacenamiento, a fin de evitar las fugas y mantener el CO2 en el lugar deseado. Aunque, como se está viendo a lo largo de este libro, la captura y el almacenamiento de CO2 es algo muy reciente, la búsqueda de los enclaves para almacenar el dióxido de carbono no comienza desde cero. La exploración de pozos de petróleo y gas natural han permitido realizar numerosos estudios de inspección del subsuelo, y, aunque las condiciones en las que se encuentran estos combustibles fósiles y el lugar donde debe almacenarse el CO2 no sean las mismas en todos los casos, la información geológica obtenida es, sin duda, de gran ayuda para la búsqueda de almacenes de CO2 . Tanto para la selección de un emplazamiento para almacenar el CO2 como para su seguimiento posterior se utilizan, lógicamente, métodos procedentes de la geología, desempeñando un papel preponderante los métodos sísmicos y los métodos de simulación. Para decidir un emplazamiento se requiere, en primer lugar, información geológica de la zona, a partir de la cual se determina la selección del posible almacén y de la roca sello. Mediante cartografía5 se obtienen datos tanto topográficos como geológicos del lugar seleccionado, que se digitalizan para su uso en modelos que permitan representar tanto las condiciones del lugar como calcular su potencial volumen de almacenamiento, obteniendo así información sobre cómo podría almacenarse el CO2 de acuerdo con los requisitos requeridos para los distintos almacenes, y cuánto CO2 «cabría» en dicho almacén. Figura 3.13. Esquema del procedimiento de búsqueda de emplazamientos para posibles almacenes de dióxido de carbono. 4 Cualidad de lo que es estanco, cerrado, incomunicado. 5 La cartografía (del griego chartis, ‘mapa’ y graphein, ‘escrito’ es la ciencia que se encarga del estudio y de la elaboración de los mapas geográficos, territoriales y de diferentes dimensiones. –89– Desde el momento en que el CO2 es inyectado ocurren una serie de procesos físicos y químicos que tienen distinta duración en el tiempo, todos ellos relevantes por lo que se refiere al almacenamiento permanente del CO2 capturado. En la figura 3.14 se presentan de manera esquemática dichos procesos junto con la escala temporal en que ocurren. Figura 3.14. Procesos que tienen lugar a lo largo del tiempo en un emplazamiento geológico donde se encuentre almacenando CO2 a gran escala [2]. Una vez ha comenzado el proceso de almacenamiento en un lugar que cumpla todos los requisitos, bien sea mediante EOR, recuperación de metano o en acuíferos salinos profundos, ¿cómo se sabe qué cantidad de CO2 se ha almacenado y dónde se encuentra éste en el almacén? Esto es lo que se denomina monitorización y seguimiento del almacén. Habitualmente esta información se obtiene a partir de modelos matemáticos del subsuelo (llamados modelos estáticos) junto con modelos de simulación de flujos de inyección de CO2 (modelos dinámicos), y métodos sísmicos, todos ellos procedentes de las ciencias geológicas y que se están adaptando para estudios de almacenamiento geológico de CO2 . Estos modelos se construyen a partir de datos monitorizados y se van actualizando a lo largo del ciclo de vida de los sitios (desde el inicio hasta el fin del almacenamiento de dióxido de carbono y el sellado definitivo del almacén). –90– 3. Transporte y almacenamiento de CO2 La frecuencia con que se actualizan los datos depende de cómo de predictivos sean los modelos que se usan para el sitio específico donde se están monitorizando, cuanto más predictivos menor frecuencia de actualización se requiere. Los instrumentos de vigilancia sismológica han demostrado ser una herramienta de gran ayuda en los proyectos de almacenamiento a gran escala actualmente en curso, tanto en el lugar de Sleipner, mar del Norte, como en el proyecto de Weyburn, ambos mencionados anteriormente. Así, por ejemplo, en Sleipner se han realizado seis estudios repetidos durante más de 12 años que muestran tanto la expansión como la compactación de la «pluma» de CO2 (cómo se extiende el CO2 dentro del acuífero). Las estimaciones de la distribución de la saturación de CO2 se han hecho a partir de datos sísmicos que han ayudado a entender cómo se distribuye el flujo de CO2 con una precisión bastante razonable. En la figura 3.15 se presentan los resultados obtenidos para dicho estudio desde 1999 hasta 2008. Se muestra el punto de inyección de CO2 en 1999 y cómo éste se ha ido desplazando a medida que se inyectaba mayor cantidad a lo largo de los años. El código de colores desde el morado oscuro hasta el amarillo marca el aumento de la amplitud, mediante procedimientos sísmicos estándar. Figura 3.15. Extensión de la pluma de CO2 en el sitio de Sleipner. Se muestran las amplitudes totales y acumuladas por capas a lo largo de 10 años. El mapa se obtiene a partir de técnicas sísmicas y de modelización (adaptada de StatoilHydro [10]). –91– 8. Costes asociados a la captura, transporte y almacenamiento de CO2 Puesto que la captura, transporte y almacenamiento de CO2 es un proceso único, ya que no acaba, en cuanto a herramienta para mitigación del cambio climático, hasta que no se almacena en un lugar seguro, conviene revisar el estado de desarrollo de las distintas tecnologías y sus costes de manera conjunta. Tabla 3.2. Componentes del proceso de CAC, con las fases de desarrollo de las mismas. *Aunque la inyección de CO 2 para recuperación mejorada de petróleo es una tecnología de mercado madura, actualmente en uso en distintos países con yacimientos de petróleo, cuando se utiliza para el almacenamiento de CO 2 , sólo es «económicamente viable en condiciones específicas». –92– 3. Transporte y almacenamiento de CO2 En el cuadro-resumen anterior, adaptado a partir del informe del IPCC [1], se muestran los distintos componentes de la captura y el almacenamiento del CO 2 (CAC), las distintas tecnologías y su situación de desarrollo actual: en fase de investigación, en fase de demostración, si es económicamente viable en condiciones específicas o si el mercado es maduro. De acuerdo con la información de la tabla 3.2, se observa que la mayoría de los componentes de la captura y el almacenamiento de CO2 ya han pasado la etapa de investigación y están a nivel demostración, paso previo a su aplicación a escala industrial. A pesar de ello se sigue hablando de investigación y desarrollo en este campo. La razón fundamental es que, a pesar de que se conocen las diversas tecnologías, existen una serie de retos tanto tecnológicos como económicos que deben superarse para que dichas tecnologías puedan integrarse de manera viable a nivel industrial, siendo este un campo de actividad muy intenso en la actualidad. Entre estos retos cabe destacar la incorporación de mejoras en la eficiencia de las plantas, de materiales óptimos para la captura de CO2 , la reducción del coste energético asociado a la compresión del CO2 y el empleo de membranas de separación de CO2/H 2 , por citar algunos. De hecho, hasta el momento no existe ninguna planta de producción de energía que opere a nivel industrial incluyendo todas estas tecnologías, la integración de las cuales está siendo probada en la actualidad a nivel de planta piloto, para probar su viabilidad técnica y económica a gran escala. El hecho de que no exista ninguna planta operando a nivel industrial dificulta el conocimiento detallado del coste asociado tanto a las inversiones iniciales necesarias para preparar las plantas para captura (el cual se irá amortizando en el tiempo), como el coste de captura por tonelada de CO2 . No obstante, existen distintos estudios en la literatura sobre cuál será el coste por tonelada de CO2 capturado, coste que se añadiría al de la producción de energía en las condiciones actuales. Así, en 2005, el IPCC publicó las siguientes estimaciones [1]: los costes de captura de CO2 varían, dependiendo de la fuente donde se capture y de la tecnología empleada para ello, entre 25-75 $/tonelada CO2 , el transporte entre 1-5 $/tonelada CO2 por cada 100 km y la inyección para su almacenamiento entre 1-2 $/ tonelada CO2 inyectado, notándose una gran diferencia entre los costes de captura y los de transporte y almacenamiento. Estos datos se presentan de manera gráfica en la figura 3.16. –93– Figura 3.16. Costes de las tres etapas del CAC a partir de las estimaciones del IPCC [1]. La consultora McKinsey [11] ha publicado muy recientemente un estudio donde se proporcionan datos detallados de los costes necesarios para evitar las emisiones de CO2 a la atmósfera mediante procesos de captura, transporte y almacenamiento. En el estudio se distingue entre plantas de demostración y plantas ya comerciales, estimando costes dependiendo de su tamaño. Así, el coste de la CAC en las plantas de demostración sería de aproximadamente 60-90 €/tonelada CO2 . Este coste incluye tanto la captura, como el transporte por tubería mediante un gasoducto de 100-200 km de longitud y el almacenamiento geológico, por lo que en valores generales encajan con los publicados por el IPCC, aunque en la banda alta. De acuerdo con el estudio de McKinsey, el coste de la primera planta comercial en el 2020 sería 35-50 €/tonelada CO2 y el coste de las instalaciones a gran escala en el mercado totalmente comercial sería 30-45 €/tonelada CO2 . Se desprende del informe que el desarrollo comercial completo de la CAC podría reducir el coste total de capturar las emisiones de CO2 de manera significativa, siendo –94– 3. Transporte y almacenamiento de CO2 sustancialmente más caro el de las plantas piloto o plantas de demostración que se están construyendo y operando en la actualidad. En la figura 3.17, adaptada del informe de McKinsey, se muestra de manera gráfica el efecto de escala en la reducción de los costes de captura de CO2; a medida que la planta es mayor y produce más electricidad los costes se abaratan. Se utiliza como referencia la planta de 300 MW. Figura 3.17. Efecto del coste de captura de CO2 en función de la escala de la planta (adaptada de [11]). Del proceso completo de la CAC, la mayor parte de los costes se derivan de la captura. Ésta requiere de grandes inversiones, reduciendo la eficiencia de la planta de base de manera significativa. Como puede observarse, el rango de precios estimados para la captura (o la CAC completa) es muy amplio. Ello se debe a que como las tecnologías de captura no han sido probadas aún a escala industrial en plantas térmicas, y muchas de ellas ni siquiera de forma completa a escala demostración, no existen criterios de valor para comparar las –95– distintas tecnologías que se revisaron en el capítulo 2. Para poder reducir la horquilla de precios y precisar los costes se requiere aún de avances tecnológicos y de demostración a distintas escalas, desde el laboratorio hasta plantas industriales. La parte de transporte y almacenamiento representa un papel importante en el coste completo del proceso de CAC, sobre todo si el almacenamiento lleva asociado un valor añadido, como es el caso de la recuperación de petróleo o de metano, en cuyo caso se abaratarían considerablemente los costes e incluso podría salir rentable. Por lo general, se estima que los costes de captura son alrededor del 50-80% de los costes totales de la CAC. Por su parte, los costes de transporte y almacenamiento dependen fuertemente de las características específicas del sitio donde vaya a almacenarse el CO2 , tales como la distancia de transporte, oportunidad de lograr economías de escala mediante la combinación de varias fuentes de emisión y la solución de almacenamiento final. Se estima que los costes de transporte y almacenamiento de CO2 constituyen entre un 20 y un 50% de los costes totales del proceso CAC. En particular, las plantas de demostración se enfrentarán a costes de transporte y almacenamiento relativamente altos. Esto es debido a que la mayoría de los proyectos de demostración se encuentran lejos unos de otros y se necesitan grandes inversiones para el transporte y el almacenamiento de cantidades de CO2 de más de 1 millón de toneladas anuales. Así, de acuerdo con el informe de McKinsey [11], a pesar de que a nivel comercial sea más rentable económicamente el transporte por tubería en la mayoría de los casos, se estima que el transporte por barco es una opción especialmente interesante durante el periodo de demostración. Para terminar este apartado, es preciso tener en cuenta que la propia captura de CO2 requiere energía adicional, lo cual implica una mayor producción de energía y, por tanto, mayor producción de CO2 que si no se llevara a cabo la captura. La tecnología disponible permite capturar entre el 85 y el 95% del CO2 tratado en una planta con captura incorporada. Una central eléctrica equipada con un sistema de CAC (con acceso a almacenamiento geológico u oceánico) necesitaría, aproximadamente, entre el 10 y el 40% más de energía que una planta con una salida equivalente sin CAC, de la cual la mayor parte se utiliza para la captura y la compresión del CO2 . Esto da lugar al concepto de CO2 evitado, que es el CO2 capturado en una planta con CAC menos el CO2 adicional generado por la propia captura, tal y como se muestra esquemáticamente en la figura 3.18. La optimización en las plantas con CAC vendrá dada tanto por una mejora en el rendimiento como por una mayor eficiencia en la captura. –96– 3. Transporte y almacenamiento de CO2 Figura 3.18. Representación del CO2 evitado y CO2 capturado en una planta con CAC. Las líneas azules indican las dos posibles optimizaciones de la planta. –97– 9. Conclusiones En este capítulo hemos repasado brevemente los medios disponibles para transportar el dióxido de carbono desde el lugar donde se captura hasta el lugar donde se almacenará de manera permanente. Se han revisado los requerimientos tanto técnicos como medioambientales para realizar el transporte y el almacenamiento de manera segura. Por lo que respecta al almacenamiento, se han analizado los distintos emplazamientos, con ejemplos de proyectos actualmente en marcha en cada uno de ellos. Se han revisado brevemente las técnicas empleadas para encontrar los almacenes geológicos y para monitorizarlos una vez el CO2 ha sido inyectado y se sigue inyectando. Por último, se han revisado las previsiones publicadas sobre el coste asociado a la captura y almacenamiento de CO2 , teniendo en cuenta también el factor de escala que lleva asociado pasar de plantas demostración a plantas a gran escala. A modo de conclusión podría decirse que el transporte de CO2 no parece presentar problemas ni tecnológicos ni medioambientales (sí económicos), mientras que la clave para los posibles almacenes de CO2 está en encontrarlos cerca de su lugar de emisión, que sean seguros y tengan la capacidad necesaria, todo lo cual requiere estudio, investigación y costes adicionales. Las noticias son esperanzadoras en cuanto a las estimaciones sobre la capacidad necesaria de almacenamiento frente a las previsiones de emisiones: teniendo en cuenta las reservas actuales de combustibles fósiles, incluso si se quemaran todas tendríamos emplazamientos suficientes para almacenar el CO2 generado por ello. Los retos más importantes respecto a la implantación de las tecnologías de CAC como medida paliativa del cambio climático están asociados, por una parte, a los elevados costes de las mismas, que repercutirán, necesariamente, en el coste final de la energía, los propios costes asociados a la búsqueda de los enclaves de almacenamiento y la legislación que rija cómo, dónde y en qué condiciones debe llevarse a cabo. –98– 3. Transporte y almacenamiento de CO2 10. Bibliografía 1. Informe Especial del International Panel for Climate Change, IPCC, «La captación y el almacenamiento de dióxido de carbono. Resumen para responsables de políticas y resumen técnico». [ISBN 92-9169-3197], 2005. 2. V. GABALDON, «Mecanismos de almacenamiento geológico de CO 2 . Áreas y estructuras susceptibles de albergar almacenamientos geológicos de CO2 en España», Instituto Geológico y Minero de España. Jornadas sobre Novedades tras la cumbre de Copenhague en Captura y Almacenamiento de CO 2 , organizadas por Intereconomía. Madrid, 26 de enero de 2010. 3. Jr. LINDAUER, L. ROBERT, «Recovery of hydrocarbons from subterranean reservoirs» [United States Patent 2885003], patente publicada el 5 de mayo de 1959. 4. G. SHARP LORLD, «Method of recovering oil by in-situ produced carbon dioxide» [United States Patent 3174543], patente publicada el 23 de marzo de 1965. 5. Informe de la Agencia Internacional de la Energía (IEA, International Energy Agency), «Putting Carbon Back into the Ground», Green House Gas R&D Programme, 2001. 6. H. KONGSJORDEN, O. KARSTAD, T. A. TORP, «Saline aquifer storage of carbon dioxide in the Sleipner project», Waste Management 17, 303-308 1997. 7. S. HOLLOWAY, A. CHADWICK, E. LINDEBERG, I. CZERNICHOWSKI-LAURIOL, R. ARTS, «Best Practice Manual from SACS – Saline Aquifer CO 2 Storage Project». IEA Greenhouse Gas R&D Programme, Schlumberger Research, European Commission. 8. Web oficial de Statoil, donde se proporciona información sobre el proyecto llevado a cabo en Sleipner: <http://www.statoil.com/en/TechnologyInnovation/NewEnergy/Co2Management/Pages/SleipnerVest. aspx>. 9. Internationa l Energ y Agency Green house Gas R&D Program me. CO2 Capt ure a nd S t or a g e . R , D & D P r oje c t s D a t a b a s e . «P r oje c t D e t a i l s: I n S a l a h P r oje c t », 2 0 0 8 . E n <http://www.co2captureandstorage.info/project_specific.php?project_id=71> 10. Información obtenida del folleto de StatoilHydro, marzo, 2010, <www.statoil.com/en/.../Co2Management Brochure%20CO2%20CCS.pdf> 11. McKINSEY & COMPANY, «Carbon Capture and Storage: assessing the economics», septiembre, 2008. En <http://www.mckinsey.com/clientservice/ccsi/thinking.asp> –99– –100– 3. Transporte y almacenamiento de CO2 4 Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? El investigador que no sabe lo que está buscando no comprenderá lo que encuentra. Claude Bernard Ante la cantidad de CO2 que se espera que haya disponible tras su captura y separación de las fuentes de emisión, la pregunta obvia es si es posible encontrar alternativas al almacenamiento geológico, para utilizar el CO 2 como un recurso y darle así un valor añadido. Tras enumerar las distintas opciones de captura y almacenamiento para mitigar el cambio climático, revisaremos ahora los retos para llevar a cabo la valorización del CO2 a gran escala, sus usos actuales y sus fuentes de procedencia. Describiremos también los requisitos que deben cumplir los procesos involucrados en su utilización, presente y futura, en un contexto medioambiental y económico, y, por último, examinaremos el concepto de huella del carbono como herramienta que permite evaluar la ganancia ambiental neta de los nuevos productos o procesos. 1. ¿Es el almacenamiento la única vía posible? Se estima que en el mundo seguiremos produciendo un 80-85% de la energía que consumimos a partir de combustibles fósiles, al menos hasta 2030. En el capítulo 1 vimos cómo el aumento de la concentración actual de CO2 en la atmósfera, en gran parte consecuencia del uso de esos combustibles, está relacionada con el cambio climático. Debido a ello, existe en la actualidad una preocupación cada vez mayor tanto en el mundo académico como en el industrial, y en la sociedad en general, sobre cómo controlar y reducir las emisiones de CO2 y otros gases de efecto invernadero. –101– Entre las tecnologías disponibles para reducir esas emisiones figura, como hemos visto en los capítulos anteriores, la captura y el almacenamiento del CO2 . Sin embargo, el dióxido de carbono es un compuesto no tóxico, no inflamable y abundante en la naturaleza. ¿Es el almacenamiento permanente la única vía para que el CO 2 producido no llegue a la atmósfera? La respuesta es no. Tal y como se comentó en el capítulo 1, existen distintas tecnologías que contribuyen de una u otra manera a reducir estas emisiones. De forma esquemática aparecen representadas en la figura 4.1 y detalladas en la tabla 4.1. [1] Figura 4.1. Representación de las distintas tecnologías disponibles o en vías de desarrollo para evitar las emisiones de CO2 a la atmósfera. –102– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? Tabla 4.1. Tecnologías disponibles y complementarias para reducir las emisiones de CO2 a la atmósfera [1]. –103– Ninguna de estas tecnologías será por sí sola la solución a la disminución de las emisiones de CO2 en la atmósfera a corto o medio plazo. Sólo la combinación de todas ellas permitirá la reducción efectiva con el menor impacto social y económico posible. Además, es posible optimizar el uso de recursos aplicando soluciones inteligentes [1]. A modo de ejemplo, la energía procedente de recursos naturales puede ser usada a corto plazo para abastecer municipios locales o pequeñas industrias, la que tiene su origen en los combustibles fósiles puede emplearse para la producción de productos químicos, mientras que la energía nuclear es la fuente óptima para demandas de gran intensidad de energía. La primera parte de este libro se ha centrado en la captura y almacenamiento de CO 2 para evitar sus emisiones a la atmósfera como medida paliativa para mitigar el cambio climático. Además de los usos del CO2 que ya se mencionaron en el capítulo 3, relacionados con la recuperación asistida de petróleo y de metano, las tecnologías de captura citadas servirían, con la adecuación necesaria en cada caso, para proveer del CO2 necesario para los nuevos usos industriales. En la última parte de este libro se revisa la utilización del CO 2 en distintas aplicaciones presentes y con gran potencial de futuro. Como se ha venido comentando –y se puede observar en la tabla 4.1–, no es ésta la única alternativa para mitigar el cambio climático, pero sí es una de ellas que, además, ayuda a la economía, al convertir un residuo en un nuevo recurso. 2. La utilización del CO2 Los datos en cuanto a emisiones y usos actuales del CO 2 son irrefutables: las aproximadamente 25 gigatoneladas métricas1 anuales de CO2 emitidas a la atmósfera por la acción humana son muy superiores a los aproximadamente 130 millones de toneladas métricas de CO2 usados anualmente por la industria global [2], es decir, la cantidad de CO2 que se emite hoy en día es casi 200 veces mayor que la cantidad absorbida por la industria global en sus distintas aplicaciones. Con las tecnologías y usos actuales del CO2 , es evidente que su captura y almacenamiento serán necesarios independientemente de la cantidad que la industria termine usando como materia prima o para distintas aplicaciones, al menos a corto y medio plazo. Sin embargo, el desarrollo sostenible plantea la investigación de alternativas al almacenamiento viables a largo plazo, no como solución única al problema de evitar las emisiones de gases de efecto 1 Una gigatonelada son 10 9 toneladas, es decir, mil millones de toneladas. –104– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? invernadero, sino como posibilidad alternativa complementaria a ese almacenamiento. Es mucho más atractivo, a pesar de las actuales limitaciones técnicas y de tamaño de mercado, pensar en el uso de ese CO 2 capturado para nuevas aplicaciones industriales que en su almacenamiento como única opción. Así, el CO2 pasaría de ser considerado un residuo de determinados procesos a ser un recurso, dándole un valor añadido. En los últimos años, el aumento del precio del petróleo y el reconocimiento de la necesidad de reducir el impacto de las industrias, energéticas principalmente, en el cambio climático han llevado a un interés creciente en el uso de fuentes alternativas de energía y de compuestos para la industria química. Esta estrategia incluye, entre otras, la utilización industrial del CO2 y la fijación del CO2 en biomasa, que pueden contribuir tanto a disminuir su acumulación en la atmósfera como a la reducción de emisiones. La utilización directa del CO2 en distintos usos industriales es hoy en día una realidad, con posibilidades de expansión a medida que se desarrollen nuevas tecnologías y que aumente la disponibilidad de CO2 . En muchos casos, los procesos con CO2 sirven para reemplazar otros que utilizan compuestos más perjudiciales para el medio ambiente o de mayor coste. En la tabla 4.2 se presentan algunas aplicaciones tecnológicas del CO2 , junto con el producto al que reemplaza. Tabla 4.2. Ejemplos de aplicaciones tecnológicas en las que se usa el CO2 junto con el producto al que sustituye en dicha aplicación [1]. –105– Por su parte, la fijación directa de CO2 en biomasa de rápido crecimiento (organismos vegetales inferiores) puede contribuir a reducir su acumulación en la atmósfera de forma mucho más acelerada de lo que ocurriría naturalmente (con organismos vegetales o plantas superiores). Este procedimiento puede ser usado tanto para la producción de productos químicos como para la producción de energía (por ejemplo, convirtiendo esa biomasa en combustibles gaseosos o líquidos en lugar de quemar directamente la biomasa), con efectos beneficiosos en la reducción de emisiones de CO2 y acumulación en la atmósfera. Un ejemplo claro de esta biomasa de rápido crecimiento son los microorganismos fotosintéticos o microalgas2 . Figura 4.2. Especies de microalgas (organismos fotosintéticos) eficientes conversores de energía solar y captación de CO2. A la izquierda se muestra la Spirulina platensis [3], a la derecha aparece Chlorella fusca [4], ambas se investigan en la actualidad para cultivos energéticos. De la misma manera que las plantas en el proceso de la fotosíntesis utilizan la luz solar y el CO 2 para producir oxígeno y azúcares, en la actualidad se está trabajando en la implementación de un ciclo de fotosíntesis artificial3 que puede ayudar a reciclar el CO2 complementando el ciclo natural, y contribuir así de manera efectiva a la reducción de emisiones y a su conversión en un recurso. A partir de la fotosíntesis artificial, con la energía y los catalizadores adecuados, es posible, por ejemplo, convertir el CO2 y el agua en metanol, o en un gas de síntesis, entre otros productos. En la figura 4.3 se muestran de manera esquemática los procesos de fotosíntesis natural y artificial. 2 Las microalgas son, en general, los conversores de energía solar más eficientes que existen debido a su sencilla estructura celular. Además, al estar suspendidas en agua, tienen un mejor acceso al CO2 y otros nutrientes. 3 La fotosíntesis artificial es un campo de investigación que intenta imitar la fotosíntesis natural de las plantas, con el fin de convertir dióxido de carbono y agua en carbohidratos y en oxígeno, utilizando para ello la luz del Sol. –106– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? Figura 4.3. Esquema del proceso de fotosíntesis natural y fotosíntesis artificial. En estos procesos y en el resto de los casos en que vaya a utilizarse el CO2 , las tecnologías de uso deben integrarse con las de captura y recuperación a gran escala. Aumentar la utilización del CO2 capturado requiere el desarrollo de nuevas aplicaciones que puedan emplear grandes volúmenes de CO2 . Para que la utilización pueda implicar beneficio, es necesario que las nuevas aplicaciones sean energéticamente más favorables que los procesos existentes. 3. Tipología de usos del CO2 De modo esquemático, la utilización o valorización del CO2 para distintas aplicaciones a gran escala puede clasificarse en tres categorías: 1) utilización directa o tecnológica: uso del CO 2 con distintas tecnologías y aplicaciones de mercado, por ejemplo, extracción de compuestos con CO 2 supercrítico, tratamiento de alimentos, o limpieza en seco, entre otras. –107– 2) utilización biológica (mejorada): fijación del CO2 en biomasa, con su consiguiente utilización en distintos sectores, por ejemplo, cultivo de microalgas para producción de biocombustibles. 3) utilización química: conversión del CO2 en otros productos, también llamado tecnologías C-1 y C-n, por ejemplo, conversión del CO2 en metanol, ácido acético, gas de síntesis, carbonatos, carbamatos, etc. Además de contribuir a la reducción de emisiones de CO2 a la atmósfera y darle un valor añadido, con estos tres procedimientos se desarrollan procesos innovadores que pueden sustituir tecnologías y productos más antiguos, con las consiguientes ventajas adicionales que ello comporta. Así, un beneficio directo sobre el cambio climático puede ser la reducción directa de emisiones de CO2 , mientras que un efecto indirecto puede ser la sustitución de compuestos nocivos por CO 2 para aplicaciones específicas, como es el caso de los compuestos clorofluorocarbonados (CFC), que tienen un potencial de calentamiento global 2.000 veces superior al del CO2 y que pueden ser sustituidos por CO2 supercrítico para muchas de sus aplicaciones actuales. La utilización directa o tecnológica del CO2 contribuye a la reducción de gases de efecto invernadero en la atmósfera; gracias a ella el CO2 sustituye a otros compuestos mucho más dañinos con el medio ambiente y que tienen una capacidad de calentamiento global muy superior. En este caso, incluso si parte del CO2 vuelve a la atmósfera, su uso frente a otros compuestos más perjudiciales será beneficioso con el medio ambiente (ver tabla 4.2). Figura 4.4. Fotografía de un laboratorio donde se investiga el crecimiento de distintos microorganismos fotosintéticos. –108– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? La utilización biológica mejorada tiene un gran potencial, especialmente si se mejora la eficiencia de conversión para producir biocombustibles y otros productos de alto valor añadido, tal y como veremos en el capítulo 6. Se le denomina «mejorada» por su equivalente en inglés enhanced-biological application, debido a la capacidad de los microorganismos de fijar una mayor cantidad de CO2 en menos tiempo que las plantas superiores. La utilización química o transformación del CO2 en otros productos químicos es también de gran actualidad. En estos casos la clave no está en cuánto CO2 se utiliza4, sino, como se ha comentado anteriormente, en la introducción de tecnologías innovadoras que lleven a la reducción de energía y materiales. El CO2 puede ser usado en reacciones químicas para producir carboxilatos, carbonatos y carbamatos, que se obtienen por la incorporación de la molécula completa de CO2 . Existen también procesos en los que la molécula de CO2 se reduce a moléculas C-1 (metanol) o C-n, en estos casos es necesario un aporte de energía, preferentemente renovable, siendo la mejor opción la solar de concentración. El problema que tienen en la actualidad la mayoría de las reacciones mencionadas es que, dada la estabilidad de la molécula de CO2 , es preciso aportar energía para que se lleve a cabo la reacción. Si se mejorara la eficiencia energética para convertir el CO2 en combustibles para usos energéticos o para otros productos, es evidente que se podrían emplear cantidades mucho mayores de CO2 de las que se usan actualmente. Todo ello supondría un gran paso adelante en el desarrollo y la aplicación de productos y procesos energéticos con un nivel de emisiones cercano a cero. 4. Fuentes actuales de CO2 Recordemos que las tecnologías de captura y almacenamiento de CO2 a partir de centrales térmicas aún no están siendo implementadas a escala industrial, por lo que el CO2 que se produce para usos industriales procede de otras fuentes. En la actualidad, el CO2 puede obtenerse a partir de procesos naturales, como la acción del agua acidificada en piedra calcárea o dolomita, o mediante procesos industriales tales como la combustión de combustibles fósiles y madera o como subproducto de las plantas de producción de hidrógeno por reformado de gas natural, en la fermentación de azúcares, en el tratamiento de gas natural (el caso de la plataforma Sleipner visto en el capítulo 3) o en la manufacturación de amoniaco. 4 Si se sintetiza un producto químico a partir de CO2 , éste volverá a generar CO2 , excepto en el caso de polímeros que pueden durar varias décadas o en la carbonatación mineral, donde el CO2 reacciona con la roca. –109– Dependiendo de su origen, el CO2 se obtendrá con mayor o menor grado de pureza. Por ejemplo, el CO2 capturado de una central térmica de carbón contendrá contaminantes tales como oxígeno, óxidos de azufre y óxidos de nitrógeno, que pueden causar efectos negativos en sus distintas aplicaciones. Por tanto, se requiere una limpieza y tratamiento adicional antes de su aplicación final específica, lo cual encarece el coste de producción. Detallamos brevemente las tecnologías más utilizadas en la actualidad, bien por la cantidad y pureza del CO2 que producen, o bien por sus menores requerimientos energéticos. 4.1. Obtención directa de CO2 por combustión La quema de combustibles fósiles y madera produce una serie de reacciones químicas exotérmicas con gran desprendimiento de energía en forma de calor y luz. Las reacciones químicas principales que se producen en la quema de combustibles generan CO2 , CO, agua y óxidos de azufre, siendo los productos principales de la combustión el dióxido de carbono y el agua. Aunque ésta es una manera directa de obtener CO2 , en la actualidad se tiende a desaconsejar su uso (a no ser que la energía liberada en el proceso sea aprovechada para generar energía o productos), en pro de la obtención de CO2 a partir de su captura en las fuentes de emisión. Figura 4.5. Planta de producción de CO2 a partir de la combustión de fuel, situada en Canarias. (Gentileza de Carburos Metálicos). –110– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? 4.2. Producción de CO2 como subproducto del reformado de gas natural El metano (CH4) es el componente mayoritario del gas natural y, como consecuencia de su elevada relación hidrógeno-carbono, se le considera hoy en día una de las principales fuentes de hidrógeno, al menos en un escenario a medio plazo. La vía tradicional de obtención de hidrógeno a partir de metano se basa en procesos de reformado con vapor de agua, que consiste en exponer el gas natural a vapor de agua a alta temperatura y presión. Como resultado de la reacción química, se obtienen hidrógeno y CO2 , así como monóxido de carbono y agua. El proceso tiene una eficiencia de hasta el 80%. En el caso de que el gas natural contenga azufre, éste debe ser eliminado mediante la desulfuración para evitar el envenenamiento de los catalizadores. El proceso de reformado con vapor se lleva a cabo mediante dos reacciones, la primera es la reacción entre el agua y el metano, que se denomina primera reacción de reformado. Ésta tiene lugar entre 800 y 900 °C a una presión aproximada de 25 atmósferas, obteniéndose un gas rico en CO2 e hidrógeno, y CO en menor cantidad. La segunda reacción ocurre entre el CO 2 y el agua a fin de obtener más hidrógeno, produciendo también dióxido de carbono. Ésta es la segunda reacción de reformado, denominada Water Shift Reaction o reacción de desplazamiento por agua. Este proceso se lleva a cabo por medio de las reacciones de cambio de alta a baja temperatura, produciéndose una mezcla gaseosa de H2 , CO2 , H2O y, en menor cantidad, CO y CH4. Después de esta etapa, se realiza una última purificación mediante el proceso de adsorción por vaivén de presión (Pressure Swing Adsorption, PSA), que permite obtener hidrógeno puro al 99,99%, con un contenido energético mayor que el del gas natural del que procede. El CO2 producido en la reacción como subproducto es capturado, habitualmente, en una torre de absorción con aminas, con el procedimiento descrito en el capítulo 2, y acondicionado, bien para su almacenamiento permanente o bien para usos industriales. En las plantas que no están acondicionadas para la captura, este CO2 se ventea a la atmósfera. –111– Figura 4.6. Esquema de la reacción de producción de hidrógeno a partir del reformado con vapor de gas natural que incluye una unidad de captura de CO2. En la siguiente figura se muestra un tanque de almacenamiento del CO2 obtenido por separación en una planta de reformado de gas natural y acondicionado para su uso en alimentación. Figura 4.7. Depósito de almacenamiento de CO2 en la Pobla de Mafumet, propiedad de Carburos Metálicos, del grupo Air Products. (Gentileza de Carburos Metálicos). –112– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? El proceso de obtención de amoniaco (NH3) por reformado de gas natural con vapor de agua es muy similar al de la obtención de hidrógeno descrito anteriormente. Una vez obtenido el gas de síntesis (H2 y CO) éste se comprime a la presión de 200 atmósferas y se lleva al reactor donde tiene lugar la producción del amoniaco, con el catalizador adecuado (en este caso hierro, Fe). Si la reacción se lleva a cabo en el reactor en un solo paso, el rendimiento es sólo del 14-15%. Por tanto, el gas de síntesis que no ha reaccionado circula de nuevo en el reactor pasando antes por dos operaciones: la extracción del amoníaco mediante condensación y la eliminación de inertes mediante purga. El gas de purga se conduce a la unidad de recuperación. La captura del CO2 en este proceso es similar a la descrita para la generación de hidrógeno por reformado con vapor. Figura 4.8. Planta de producción de CO2 a partir de la producción de amoniaco en Palos de la Frontera, Huelva. (Gentileza de Carburos Metálicos). 5. Requisitos para los nuevos usos del CO2 Como se ha venido comentando a lo largo de este libro, la captura de CO 2 en las centrales energéticas lo hará disponible en grandes cantidades. Ese CO2 deberá ser almacenado geológicamente (ver capítulo 3) o bien acondicionado para su utilización en diversas aplicaciones. –113– Para que la utilización del CO2 –ya sea tecnológica, biológica o química– pueda causar una reducción efectiva de sus emisiones a la atmósfera, los nuevos procesos y productos deben cumplir ciertos requisitos: 1) 2) 3) 4) el nuevo proceso debe reducir las emisiones globales de CO2 , debe consumir menos energía y material que el proceso que pretende reemplazar, debe ser más seguro y trabajar en mejores condiciones ambientales y debe ser económicamente viable. La reducción de emisiones globales de CO 2 no es fácil de cuantificar, aunque una herramienta que puede ayudar a ello es el llamado «análisis del ciclo de vida (ACV)», que veremos en la siguiente sección en el contexto de huella de carbono. El consumo de energía debe minimizarse a través del control de parámetros del proceso, tales como la conversión y la selectividad, la temperatura, la presión, y las operaciones posteriores a las reacciones químicas, como la purificación y secado. El control de materiales requiere procesos más directos (con menos etapas), efectivos (con conversiones mayores) y selectivos, con minimización de residuos (gas, líquido y sólido), minimización de materia prima y con una mejor utilización de los átomos de carbono. Puesto que el CO2 no es una sustancia tóxica, su uso no debería causar ningún problema de seguridad con las condiciones de trabajo adecuadas. En particular, puesto que una de sus propiedades es precisamente su capacidad para extinguir el fuego, el riesgo de combustión es prácticamente nulo cuando se utiliza CO2 a alta presión como disolvente, al contrario de lo que ocurre con los disolventes utilizados tradicionalmente para los mismos procesos. Por lo que respecta a la viabilidad económica de la utilización del CO2 , su precio depende directamente de la calidad requerida (pureza), para lo cual deben usarse distintas técnicas de purificación. Cuanta más pureza se demande (por ejemplo, para usos alimentarios) más se encarece el proceso. La viabilidad económica vendrá dada por el alto valor añadido del producto para el que se use el CO2 . 6. Huella del carbono y análisis del ciclo de vida Cuantificar las emisiones de CO2 (o CO2-equivalente) de un proceso o producto no es una tarea fácil o unívoca, ya que depende, en gran medida, de la propia definición del proceso. –114– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? Uno de los conceptos más utilizados hoy en día para valorar la ganancia ambiental de un proceso o producto es la denominada huella del carbono. Se trata de un certificado en el que se cuantifican las emisiones de CO2 (o CO2-equivalente) que se realizan en la cadena de producción, desde la obtención de materias primas hasta el tratamiento de residuos, pasando por la manufacturación y el transporte. La huella de CO2 es, por tanto, una medida del impacto que provocan las actividades del ser humano en el medio ambiente. Figura 4.9. La huella del carbono como medida del impacto ambiental. Una herramienta que permite calcular ese impacto ambiental y que está cada vez más implantada en el mundo empresarial es el denominado análisis del ciclo de vida (ACV). El concepto de «ciclo de vida» hace referencia a la consideración de todos los recursos empleados y de todas las implicaciones ambientales asociadas a la vida de un producto o servicio. Esta perspectiva sugiere considerar en cualquier evaluación ambiental todas las fases de la vida del producto o servicio en cuestión [9]. El ACV es una herramienta cuantitativa, permite recopilar y evaluar las entradas y salidas de materia y energía y los impactos potenciales de un producto, servicio, proceso o actividad a lo largo de toda su vida, es decir, de la «cuna a la tumba». –115– Se dio a conocer en la década de 1960, aunque su uso no comenzó a generalizarse hasta los años noventa. Se trata de una metodología regulada por estándares internacionales (ISO-14040 a ISO-14044). El concepto de ACV es muy simple y lógico: si se conocen los impactos medioambientales asociados a un proceso o producto se pueden tomar decisiones con respecto a ellos basados en su impacto ambiental. En un ACV completo se atribuyen al producto todos los efectos ambientales derivados del consumo de materias primas y energía necesarios para su producción, las emisiones y residuos generados durante la actividad productiva, así como los efectos ambientales de su transporte, uso y gestión final como residuo. Figura 4.10. Procesos involucrados en el ciclo de vida de un armario, desde la materia prima hasta el material de desecho. –116– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? Un estudio de ACV se compone de cuatro etapas interrelacionadas: 1) definición del objetivo y alcance: aquí se debe determinar la aplicación prevista, las razones para realizar el estudio, el público al que va destinado, y si se pretende utilizar los resultados con fines comparativos para ser mostrados públicamente. El alcance incluye también los límites del sistema, el nivel de detalle, la calidad de los datos, las suposiciones realizadas, las limitaciones del estudio, etc. Es en esta etapa cuando se define la unidad funcional (por ejemplo, la producción de 1 kWh de electricidad en una instalación solar fotovoltaica en un país y un año dados, o las emisiones equivalentes de CO2 en una central térmica de 500 MW con un tipo de carbón determinado). 2) análisis del inventario del ciclo de vida (ICV): esta fase supone la recopilación de los datos y los procedimientos de cálculo para cuantificar las entradas y salidas del sistema objeto de estudio. Los datos a incluir en el inventario deben recopilarse para cada proceso unitario considerado dentro de los límites del sistema. 3) evaluación del impacto del ciclo de vida: en esta fase se evalúa la importancia de los impactos ambientales potenciales utilizando los resultados del inventario. Este proceso implica la asociación de los datos con categorías de impacto (por ejemplo, cambio climático en 100 años, potencial de acidificación, potencial de toxicidad humana, etc.). La evaluación incluye los siguientes elementos: selección de categorías de impacto, indicadores y modelos de caracterización, clasificación o asignación de resultados a categorías y caracterización o cálculo de los resultados del indicador traducidos a las unidades equivalentes elegidas. 4) interpretación del ciclo de vida: en esta fase se resumen y discuten, de forma comprensible para los destinatarios del estudio, los resultados del inventario, de la evaluación, o de ambos, como base para establecer unas conclusiones. A partir de estas cuatro fases se elabora un informe en el que se documentan las distintas fases del ACV, los resultados y conclusiones. Se detallan en el mismo los datos y su calidad, los métodos, las suposiciones y limitaciones del estudio. Las decisiones de la aplicación del ACV se basan en hechos científicos, intentando evitar juicios de valor y subjetividad. La metodología tiene un gran potencial no sólo para el estudio de la ganancia ambiental de procesos y productos, sino también para la planificación estratégica, identificación y establecimiento de prioridades, desarrollo de políticas públicas, marketing, gestión ambiental de organizaciones, etc. La evaluación del ciclo de vida se utiliza para responder a preguntas específicas como por ejemplo: qué diferencia existe entre dos procesos de fabricación del mismo producto en términos de utilización de recursos y emisiones; qué diferencia existe entre las tecnologías de captura de CO2 aplicadas a una misma central de energía en términos de recursos y –117– energía; cuáles son las contribuciones relativas de las diferentes etapas del ciclo de vida del producto a las emisiones totales; qué diferencias existen, en términos de emisiones e impacto ambiental, entre el uso de CO2 supercrítico para extracción de cafeína con respecto al proceso de extracción con hexano, etc. Son estas preguntas y este tipo de análisis los que nos ayudarán a cuantificar las emisiones totales de gases de efecto invernadero y, por tanto, a comprobar si los nuevos procesos o productos proporcionarán una ganancia ambiental neta comparada con los procesos a los que se pretende sustituir. La Unión Europea, en su campaña de concienciación sobre el cambio climático, ha puesto a disposición de los ciudadanos a través de la web un instrumento que, de una manera sencilla y aproximada, permite calcular la huella del carbono. Puede accederse a él en la siguiente URL: <http://www.mycarbonfootprint.eu/es>. 7. Conclusiones En este capítulo se ha examinado la posibilidad de usar el CO2 para diversas aplicaciones industriales, teniendo en cuenta los retos actuales para que esta utilización sea viable tanto desde el punto de vista medioambiental como económico. Se han detallado algunas fuentes actuales de CO2 para usos industriales –en algunos de esos usos el CO2 es capturado como subproducto, separado y acondicionado– y se han mencionado otros usos del CO2 . Se detecta la necesidad de desarrollar nuevas tecnologías beneficiosas para el medio ambiente que permitan expandir los usos actuales del CO2 . Por lo que respecta a los requisitos de los nuevos procesos, es preciso que éstos reduzcan el número de emisiones (en unidades de CO2-equivalente con respecto a los procesos a los que sustituyen); asimismo, deben consumir menos energía y materiales, ser más seguros, trabajar en mejores condiciones medioambientales, y, por supuesto, ser económicamente viables. A pesar del reto que esto significa, la realidad es que en la actualidad existen utilizaciones tecnológicas, biológicas y químicas que cumplen todos los requisitos, y se está avanzando en el desarrollo e implantación de nuevas tecnologías que pueden realzar y potenciar aún más esos usos, ayudando a la economía y al desarrollo sostenible. En los siguientes capítulos trataremos en detalle estas aplicaciones. Por último cabe destacar la importancia de la ganancia ambiental que deben tener estos nuevos procesos y productos, la cual puede ser medida a través de herramientas como el análisis del ciclo de vida. –118– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? 8. Bibliografía 1. M. ARESTA, «Carbon Dioxide: Utilization Options to Reduce its Accumulation in the Atmosphere», cap. 1 del libro Carbon Dioxide as Chemical Feedstock, (ed. M. Aresta), WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2010. [ISBN: 978-3-527-32475-0] 2. M. ARESTA, Carbon Dioxide Capture and Storage (ed. M. Maroto), Valer, Woodhead Publishing Limited, Abington Hall, Granta Park, Cambridge, CB21 6AH, Reino Unido, 2009. 3. <http://www.energen.it/inglese/olio_da_alghe.html>. 4. Fotografía procedente de Microbial Cultura Collection del National Institute for Environmental Studies, Japón. Disponible en: <http://mcc.nies.go.jp/strainList.do%3Bjsessionid=B8C53B3A22211A674FA6A5F 66838A3C5?strainId=825&strainNumberEn=NIES-687>. 5. Conferencia ejecutiva sobre «Solar Photoconversion Processes for Recycling Carbon Dioxide from the Atmosphere», Colorado Spring, 1990. 6. P. GRAZIANO, Enzymatic and Model Carboxylation and Reduction Reactions for Carbon Dioxide Utilization, (eds. M. Aresta y J. V. Schloss), Kluwer Academic Publishers, Dordrecht, Países Bajos, 1990, p. 19. 7. M. ARESTA, «Energy from aquatic biomass», en Handbook of Combustion, (eds. M. Lackner, F. Winter y M. Agarwal], vol. 5, ch. 13, Wiley - VCH , Weinheim, 2010. 8. M. ARESTA y A. DIBENEDETTO, CO 2 Conversion and Utilisation (eds. C. Song, A. M. Gaffney y K. Fujimoto), ACS Series Book 809, American Chemical Society, 2002, p. 54. 9. J. RODRIGO, N. CAÑELLAS, M. MENESES, F. CASTELLS y C. SOLE, El consumo de energía y el medio ambiente en la vivienda en España. Análisis del Ciclo de Vida (ACV). Fundación Gas Natural, guías técnicas de energía y medio ambiente, 13, 2008. [ISBN: 978-84-612-2604-7] 10. Calculadora de carbono, <http://www.mycarbonfootprint.eu/es>. –119– –120– 4. Más allá del almacenamiento: ¿es posible convertir el CO2 capturado en un recurso? 5 Usos industriales directos del CO2 El destino es el que baraja las cartas pero somos nosotros los que jugamos. William Shakespeare Dadas sus propiedades físicas y químicas y su carácter inocuo, el CO2 se ha venido usando desde hace años en distintos sectores productivos. Las industrias grandes y pequeñas acumulan experiencia sobre su uso y ventajas frente a otros productos. En este capítulo se revisan brevemente algunas de las aplicaciones tecnológicas más importantes que se llevan a cabo en la actualidad en distintos sectores industriales. Entre ellas se incluye el uso del CO2 en procesos y productos alimentarios, las distintas aplicaciones de la tecnología de fluidos supercríticos, el tratamiento de aguas y otras aplicaciones industriales. Se pone aquí de manifiesto las ventajas de usar el CO2 frente a otros productos más nocivos para el medio ambiente, y la necesidad de desarrollar tecnologías innovadoras para seguir expandiendo sus usos a escala industrial. 1. El CO2 y la alimentación El dióxido de carbono es un compuesto aprobado para usos alimentarios, pues no presenta toxicidad y sus propiedades beneficiosas en la conservación de alimentos han sido ya demostradas. Las propiedades más importantes del CO2 aplicables a la preservación de los alimentos están relacionadas con su capacidad para disminuir el pH, su potencial de penetración en –121– las células y su acción sobre las reacciones enzimáticas1 y sobre las membranas biológicas. Gracias a estas propiedades, hace más de un siglo que se asocia el CO2 a la alimentación, tanto para la carbonatación de bebidas como para la conservación de alimentos. Examinamos a continuación algunas de las aplicaciones actuales del CO2 en relación con la alimentación, así como proyectos de investigación en curso con posibles aplicaciones futuras a corto plazo. Esto incluye la carbonatación de bebidas en sentido amplio, el envasado en atmósfera protectora, la desinsectación de alimentos, el aturdimiento de animales y la refrigeración y congelación. 1.1. Bebidas con CO2 El agua carbonatada, conocida también como soda, agua con gas o agua carbónica, es agua sin saborizantes que contiene dióxido de carbono, el cual burbujea cuando la bebida se despresuriza. Si el agua presenta un mayor contenido de minerales, por provenir de deshielo, se la denomina agua mineral gasificada; si los minerales son aportados artificialmente, decimos que es agua gasificada artificialmente mineralizada [1]. Figura 5.1. Agua carbonatada donde se observa el burbujeo de las moléculas de CO2. 1 Las enzimas son proteínas (macromoléculas) con capacidad de manipular otras moléculas, denominadas sustratos. Un sustrato se une al centro catalítico de la enzima, que lo reconoce y se transforma en un producto a lo largo de un proceso denominado «mecanismo enzimático». –122– 5. Usos industriales directos del CO2 Históricamente, las primeras aguas carbonatadas se preparaban añadiendo bicarbonato de sodio a la limonada, aprovechando que una reacción química entre éste y el ácido cítrico del limón produce dióxido de carbono. De manera industrial, el agua carbonatada se prepara añadiendo CO2 al agua en tanques de almacenamiento a presión. La presión aumenta la solubilidad (es decir, se disuelve más CO2 que bajo condiciones atmosféricas normales). La cantidad de CO 2 que se añade suele variar entre 6 y 8 g por litro. De este proceso se obtiene, como residuo, carbonato de calcio. Cuando se reduce la presión, por ejemplo al abrir la botella, el gas se disocia de la solución, creando las burbujas características. Quizás una de las bebidas más comunes, después del agua natural, es la gaseosa (también llamada refresco o bebida carbonatada). Es una bebida carbonatada y saborizada, efervescente (gracias a su contenido en CO2) y sin alcohol [2]. La fabricación de bebidas carbónicas comenzó en Nueva York en 1832, cuando John Matthews inventó un aparato para mezclar agua con gas de dióxido de carbón y, además, agregarle sabor. De la popularidad de la bebida nacieron negocios para mezclar el agua carbonatada con diferentes sabores como naranja, limón, uva, etc., conocidas genéricamente como sodas. En aquella época, la gaseosa también se vendía en farmacias como remedio para curar diversas enfermedades. En 1885, W. B. Morrison, un farmacéutico propietario de Old Corner Drug Store en Waco, Texas, desarrolló un sabor especial en su fuente de soda. Se le denominó Dr Pepper®, la gaseosa más antigua que aún se vende en Estados Unidos. Casi por la misma época (1886), otro farmacéutico de la ciudad de Atlanta, llamado John S. Pemberton, experimentó con hierbas y especies como la nuez de cola africana y la hoja de coca. El resultado fue una bebida que bautizó con el nombre de Coca-Cola®. En 1898, un farmacéutico de Carolina del Norte, Caleb Bradham, buscaba un tónico para el dolor de cabeza al que le agregó pepsina, una enzima digestiva que degrada las proteínas en el estómago. En 1903, registró la marca de esta bebida como Pepsi®. Con estos descubrimientos nació una nueva industria, la de las gaseosas. Uno de los desafíos que encontró esta industria en sus comienzos fue conservar el CO2 de la bebida hasta el momento del consumo, ya que en el embotellado aparecieron problemas técnicos para lograr un sellado hermético. Dichos problemas fueron solventados con los años. A la botella de vidrio le sucederían otras alternativas de envasado, como la lata y la botella de plástico, que son las que más se emplean en la actualidad –123– Figura 5.2. Bebidas carbonatadas con distintos saborizantes. Las bebidas carbónicas mueven un gran mercado. A modo de ejemplo, en el año 2007 se vendieron en México 135,8 litros per cápita (récord mundial), seguido por Estados Unidos con 96,0 litros y, en tercer lugar, España con 95,4 litros. Además de estas bebidas no alcohólicas, también las bebidas alcohólicas como la cerveza, el cava y el vino contienen dióxido de carbono. El CO2 presente en la cerveza y el vino proviene habitualmente del proceso de fermentación. Además, existen algunos casos en que el CO2 se añade de manera artificial a estas bebidas, como en la cerveza que se vende a presión (cerveza de barril), a la que se añade CO2 con un doble objetivo, enfriar la bebida y mantener el gas que se pierde a medida que se vacía el barril, aportando la cantidad necesaria para que salga a presión por el tirador. Por último, el CO2 también se aplica en el tratamiento de la leche. Hace ya más de 100 años se descubrió que el CO2 disuelto era un agente antimicrobiano que se encontraba presente de forma natural en la leche cruda, aunque con el tiempo el CO2 se disipaba debido al contacto con el aire y al calor. –124– 5. Usos industriales directos del CO2 Figura 5.3. Ejemplos de bebidas alcohólicas que contienen CO2: cerveza, cava y vino. Con la idea de mejorar su conservación, en los últimos años se ha venido trabajando en la adición de CO2 a la leche cruda. Además, el CO2 puede ser utilizado también en bebidas envasadas como las que contienen café, o en productos procesados como el yogur o la crema ácida. La cantidad de CO2 requerida para aumentar la vida útil varía para cada producto lácteo, pues se deben considerar los niveles de grasa y sabor añadido, así como el tipo de material del envase que se utilice. Un ejemplo de este procedimiento es el desarrollado por un grupo de investigadores del Consejo Superior de Investigaciones Científicas junto con Carburos Metálicos [3]. Se trata de inyectar CO2 en la leche cruda refrigerada para conservarla a un determinado pH durante cinco días. Después se extrae el CO2 al vacío y se pausteriza la leche, restituyéndole al producto sus propiedades sensoriales. La ventaja de este tratamiento frente al convencional es que la leche dura más tiempo conservando todas sus propiedades sensoriales. –125– Figura 5.4. Queso Afuega’l Pitu, con denominación de origen asturiana. La leche refrigerada y conservada por acidificación de CO 2 puede ser usada para la fabricación de quesos, y el mismo método se puede emplear para la producción de quesos coagulados con ácidos [4]. Un ejemplo es el queso de la marca Afuega’l Pitu, un derivado de la leche de vaca procedente de Asturias y con denominación de origen protegida. El CO2 se usa también en la industria agroalimentaria en la elaboración de yogures y leches fermentadas para reducir los tiempos de fermentación, mejorar sus características sensoriales y, en algunos casos, aumentar la actividad de la enzima `-galactodiasa2 . 2 La `-galactodiasa es una enzima que cataliza la hidrólisis de lactosa (el azúcar mayoritario de la leche) en los dos monosacáridos que la componen: glucosa y galactosa. –126– 5. Usos industriales directos del CO2 1.2. Envasado en atmósferas modificadas o protectoras En la actualidad existe un interés cada vez mayor por los productos frescos y naturales, con pocos aditivos (o ninguno) y que conserven sus propiedades nutritivas y sensoriales. Asimismo, el ritmo de vida actual nos lleva a la búsqueda de alimentos de preparación fácil y rápida, como los platos precocinados y los productos «listos para consumir». Una vez la fruta, verdura o producto animal se cosecha o sacrifica, se convierte en un entorno adecuado para que las bacterias sigan actuando gracias a los hidratos de carbono, proteínas, grasas y nutrientes de que disponen. Estos son los procesos que generan la degradación del producto, incluyendo alteraciones del color no deseables, pérdida de sabor y textura defectuosa. También la actuación de algunas enzimas provoca el deterioro de los alimentos. Hoy en día es posible prolongar el tiempo de conservación de este tipo de productos envasándolos de una manera adecuada. Se denomina envasado en atmósfera modificada al procedimiento por el cual los alimentos son envasados en un entorno cuya atmósfera se ha modificado de algún modo, es decir, la combinación de gases aparece en distinta proporción que en la del aire de la atmósfera terrestre. En nuestro país, esta técnica se conoce también con el nombre de envasado en atmósfera protectora (EAP). El EAP tiene como objetivo mantener la calidad sensorial y microbiológica (sanitaria) de los productos y prolongar su vida útil, que llega a duplicarse e incluso triplicarse con respecto al envasado tradicional en aire. La técnica implica la eliminación del aire contenido en el envase, seguida de la inyección de un gas o mezcla de gases seleccionados de acuerdo con las propiedades del alimento. El EAP tiene tres componentes básicos: los gases de envasado, el material del envase y las máquinas de envasado/el equipo de envasado, siendo todos ellos pieza clave en el proceso de conservación de los alimentos. En el EAP se genera un ambiente gaseoso óptimo para la conservación del producto, donde el envase ejerce de barrera y aísla, en mayor o menor grado, dicho ambiente de la atmósfera externa [5]. –127– Para el EAP se emplean principalmente tres gases: dióxido de carbono, nitrógeno y oxígeno, aunque pueden utilizarse otros si están aprobados para usos alimentarios en el país donde se aplica. Los productos se envasan en un solo gas o con una mezcla de los dos o tres gases, en distinta proporción, dependiendo del alimento. Figura 5.5. Laboratorio de envasado en atmósfera protectora. (Gentileza de Carburos Metálicos y el IRTA de Cabrils). ¿Cómo actúan estos gases en contacto con los alimentos? El dióxido de carbono inhibe el crecimiento de la mayoría de las bacterias aerobias y mohos que deterioran los alimentos. En términos generales, cuanto más alto es el nivel de CO 2 más largo es el tiempo de conservación [6]. Sin embargo, las grasas y el agua absorben fácilmente el CO2 , por lo tanto, la mayoría de los alimentos lo absorberán. Así, un nivel excesivo puede provocar alteración de los sabores, aumento de la pérdida de agua del producto y colapso del envase. Por lo tanto, es necesario alcanzar un equilibrio entre el tiempo de conservación comercialmente deseable de un producto y el grado de tolerancia hacia los efectos negativos. Para controlar el desarrollo de bacterias y mohos se recomienda un mínimo de un 20% de CO2 . Por su parte, el nitrógeno es un gas inerte que se usa para eliminar el oxígeno del aire en el EAP. Se utiliza también como gas de equilibrio (o de relleno) para evitar el colapso de los envases que contienen alimentos con alto índice de humedad y grasas, causado por la tendencia de estos alimentos a absorber el CO2 de la atmósfera. En el EAP para productos de aperitivo normalmente se utiliza una atmósfera 100% nitrógeno para evitar la rancidez por oxidación de las grasas. –128– 5. Usos industriales directos del CO2 Aunque en general el oxígeno debe eliminarse en el EAP, ya que provoca el deterioro por oxidación de los lípidos (grasas) de los alimentos y favorece el crecimiento de microorganismos aerobios, existen algunos casos en los que su uso es beneficioso. Así, en proporciones adecuadas, ayuda a mantener el color rojo vivo natural en carnes, mantiene la respiración (en frutas y verduras) e inhibe el crecimiento de organismos anaerobios en determinados tipos de pescados y verduras. Figura 5.6. Distintos tipos de alimentos envasados en atmósfera protectora: verduras, aperitivos como patatas chips, panadería y bollería, carne, pescado, fruta fresca variada. La utilización de gases para la conservación de productos alimentarios se inició a principios de la década de 1930, con el envío de carcasas de ternera y cordero de Australia y Nueva Zelanda al Reino Unido en cámaras con dióxido de carbono [6]. Entre 1940 y 1950 se construyeron almacenes estancos para el almacenamiento en atmósfera controlada, a fin de prolongar el tiempo efectivo de conservación de manzanas frescas sometidas a refrigeración [7]. El desarrollo de dichos almacenes hizo que durante un tiempo las aplicaciones comerciales de la conservación por gas se circunscribiesen en gran medida al almacenamiento en atmósfera controlada y al transporte de mercancías a granel como carne y fruta. –129– En la actualidad el EAP es una técnica madura, con ventajas en constante aumento tanto para el proveedor como para el consumidor final. Sus ventajas son claras: prolonga el tiempo de conservación de los alimentos, minimiza las pérdidas del producto, preserva la calidad del mismo, permite un menor uso de conservantes artificiales y flexibiliza las posibilidades de distribución. Las líneas de investigación en esta área están enfocadas al uso de nuevas mezclas de gases y a mejoras en el envasado de alimentos a fin de aumentar la vida útil de nuevos productos. Se presenta en la tabla 5.1 una relación de productos donde se compara su vida útil cuando están envasados en aire o con atmósfera protectora. Tabla 5.1. Comparación entre el tiempo de vida útil de varios productos alimentarios envasados en aire o con atmósfera modificada [8]. Dado que la cantidad de CO2 que se utiliza con esta técnica es muy pequeña, y que parte de él vuelve a la atmósfera, su uso en el EAP no se considera una tecnología que sirva para mitigar el cambio climático. Sí muestra, sin embargo, el valor añadido del CO2 y su potencial en aplicaciones de vital importancia para nuestra vida. 1.3. Atmósferas modificadas para la desinsectación de alimentos Las atmósferas modificadas pueden utilizarse también para el control de plagas en alimentos en los distintos estadios de la vida de los insectos (huevo, larva o adulto). La presencia de insectos y ácaros, así como los residuos de los productos que se utilizan para su control (plaguicidas) son uno de los problemas sanitarios más importantes que –130– 5. Usos industriales directos del CO2 afectan a la industria alimentaria. Diversas especies de insectos y plagas atacan las materias primas después de la cosecha, así como los productos elaborados a partir de ellas. Entre estas especies se encuentran los lepidópteros o polillas, los coleópteros (gorgojos y escarabajos), los psócidos (piojo de los libros) y los ácaros [9], [10]. La materia prima puede infectarse en distintas etapas: en el campo, en los graneros de los agricultores, durante el proceso de secado a que se someten algunos productos o bien en las bodegas o los contenedores donde se transporta de un lugar a otro. En los almacenes o silos, dependiendo de las condiciones ambientales, es posible que las poblaciones de insectos y ácaros aumenten considerablemente. El producto puede también contaminarse durante el proceso de almacenamiento y distribución. Tradicionalmente se han venido aplicando tratamientos químicos para la desinsectación de alimentos, sin embargo, dado el carácter perjudicial que dichos compuestos tienen para el medio ambiente (especialmente el bromuro de metilo, CH3Br), en el Protocolo de Montreal se prohibió su uso para estas aplicaciones, por lo que se está trabajando activamente en tratamientos alternativos. Figura 5.7. Alimentos infectados por determinadas plagas de insectos. (Gentileza del IRTA-Cabrils, autor: Jordi Riudavets). Como se ha comentado anteriormente, una de las propiedades del CO2 es su acción sobre las membranas biológicas. Afecta a varias características fisiológicas, metabólicas, biológicas y de comportamiento de los insectos. Uno de sus principales efectos es que actúa sobre el –131– estímulo de abertura de los espiráculos3 que regulan la respiración. Este hecho induce, de forma indirecta, la pérdida de agua y posterior desecación produciendo la muerte del insecto. También produce acidificación en los fluidos internos lo que provoca modificaciones en muchas vías metabólicas afectando a su crecimiento, desarrollo y reproducción [11]. Gracias a estas propiedades, el uso de CO2 representa una alternativa excelente a los productos tóxicos usados tradicionalmente (bromuro de metilo, fosfina, insecticidas) para el control de plagas en alimentos [12]. Además de ser altamente eficaz, proporciona una tecnología más respetuosa con el medio ambiente, es un gas que no deja residuos, su utilización y producción no están reguladas por motivos de seguridad, es reciclable y es muy empleado en aplicaciones alimentarias por su inocuidad. Figura 5.8. Alimentos que pueden ser tratados con atmósfera modificada con CO2 para su desinsectación. (Gentileza de Carburos Metálicos). El procedimiento de desinsectación de alimentos con CO 2 se basa en el envasado en atmósfera protectora o modificada. Se sustituye la atmósfera que envuelve el producto por otra con una alta concentración de CO2 . 3 Un espiráculo es un orificio respiratorio presente en el tegumento o tejido de los insectos, los arácnidos y otros animales con respiración traqueal. –132– 5. Usos industriales directos del CO2 La eficacia de las atmósferas protectoras o modificadas varía con la temperatura, la humedad, la concentración del gas y el tiempo de tratamiento. Las temperaturas bajas y las humedades relativas elevadas incrementan generalmente el tiempo de exposición requerido para obtener efectos letales. A concentraciones elevadas de CO2 su eficiencia se incrementa notablemente. No obstante, los resultados que se obtienen varían de una especie a otra, y de cuál sea el estado de desarrollo del insecto. El aumento de presión incrementa la cantidad de CO2 que se puede disolver en los fluidos internos. Por lo tanto se logra potenciar su efectividad (efecto químico) y se consigue, en el proceso de descompresión, la rotura de las paredes celulares producida por la salida del gas de las células donde se ha disuelto (efecto físico). Así pues, el dióxido de carbono a presión y con una descompresión rápida después de un tiempo de tratamiento relativamente corto es altamente efectivo para el control de las plagas que afectan a los productos alimentarios [12]. Así, en condiciones generales de aplicación, utilizando concentraciones de CO2 superiores al 40% y de O2 inferiores al 5%, el tiempo de tratamiento dura entre 4 y 20 días, dependiendo del producto de que se trate [12], mientras que a una presión entre 15 y 20 atmósferas dicho tiempo se reduce y basta un tratamiento entre 15 y 120 minutos, y entre 30 segundos y 10 minutos para la descompresión posterior [13]. Las atmósferas protectoras o modificadas están indicadas para tratar los productos almacenados en silos, cámaras herméticas, palés y sacas big bags y para evitar o eliminar las contaminaciones en los alimentos cuando éstos ya están envasados. Figura 5.9. Formas de almacenamiento de productos alimentarios a los que puede aplicarse la atmósfera modificada con CO2 para su desinsectación: silos, big bags y palés. –133– Las aplicaciones de CO 2 a presión están indicadas como tratamiento sistemático para eliminar de forma rápida (minutos u horas) las contaminaciones por plagas de las materias primas en el momento de la entrada a fábrica o, también, en los productos elaborados al final de la cadena de fabricación, como seguridad de que se envasan o comercializan sin contaminaciones. Figura 5.10. Autoclave para el tratamiento a presión que permite eliminar de manera rápida las plagas de las materias primas. (Gentileza Carburos Metálicos). 1.4. Aturdimiento de animales Los sectores porcino y avícola, igual que cualquier otro sector de la industria agroalimentaria, están sujetos a la creciente demanda de alimentos que garanticen la salud de los consumidores, que provengan de animales que hayan sido tratados sin causarles dolor o sufrimiento innecesario, y que tengan una alta calidad. Uno de los principales objetos de preocupación social es la forma en que los animales son sacrificados en los mataderos Habitualmente, estos animales son sacrificados por desangrado mediante incisión. La muerte no se produce de manera inmediata, sino que requiere de la pérdida de cierta cantidad de sangre. Durante el sacrificio, los animales están sometidos a una serie de actuaciones que les causan sufrimiento, dolor y miedo. Para evitarlo, actualmente se exige que todos los animales sean aturdidos antes de ser colgados y desangrados. –134– 5. Usos industriales directos del CO2 Figura 5.11. Animales que deben ser aturdidos antes de ser sacrificados para el consumo humano [14]. El aturdimiento debe causar la inconsciencia del animal de forma inmediata y prolongarse hasta su muerte, tal y como lo refleja la directiva del consejo 93/119/EEC de 22 de diciembre de 1993 sobre protección de los animales en el momento de su sacrificio, y el Real Decreto 54/1995 de la legislación española. No obstante, un sistema correcto de aturdimiento no sólo deber salvaguardar el bienestar de los animales sino también garantizar otra serie de requisitos no menos importantes como son la seguridad alimentaria, la seguridad del operador y la calidad tecnológica y sensorial del producto final. En porcino y aves los métodos más utilizados son el aturdimiento eléctrico y la exposición al dióxido de carbono. El sistema de aturdimiento eléctrico es el más empleado. Consiste en la descarga de una corriente eléctrica en el cerebro con una intensidad lo suficientemente alta como para provocar una despolarización del sistema nervioso central y un estado de inconsciencia reversible. El aturdimiento eléctrico presenta algunos problemas tanto al animal como para la calidad del producto final. Requiere que los animales sean individualizados y sujetados mecánicamente, para que el contacto de los electrodos con la cabeza sea en la zona correcta y se asegure así un aturdimiento efectivo. Este manejo previo a la insensibilización causa un alto nivel de estrés en el animal. En segundo lugar, el aturdimiento eléctrico induce un ataque epiléptico acompañado de fuertes contracciones que provocan una rápida caída del pH muscular, favoreciendo la aparición de carnes pálidas, blandas y exudadas4 [15], [16]. 4 La exudación es el proceso que consiste en la salida de un líquido de un cuerpo (o del recipiente en que está contenido), por transpiración o a través de sus rendijas. –135– El CO2 es un gas que, al ser inhalado, produce insensibilidad sin dejar residuos químicos. Para aturdir a los animales por este procedimiento se les introduce en jaulas y son bajados al interior de un pozo con una concentración atmosférica entre 80 y 90% de CO 2 . El animal permanece en el interior del pozo durante un tiempo suficiente para que se mantenga inconsciente hasta su muerte por desangrado, de acuerdo con la directiva europea [14]. Como ventaja frente al aturdimiento eléctrico, cabe destacar que este sistema no requiere la sujeción de los animales y actualmente permite el tratamiento en grupos, reduciendo así el estrés previo al sacrificio. Mejora también la calidad del producto final, ya que disminuye la intensidad de las convulsiones. Por estos motivos, en los mataderos de ganado porcino y avícola, el sistema con CO2 ha experimentado un fuerte crecimiento en detrimento del aturdimiento eléctrico. No obstante, la exposición de los animales a altas concentraciones de CO2 ha sido criticada desde el punto de vista del bienestar animal [17]. La pérdida de consciencia no es inmediata y puede durar unos 30 segundos. El CO 2 es un gas ácido, por lo tanto su inhalación provoca irritación de la mucosa. Además, es un potente estimulador respiratorio que causa hiperventilación y sensación de asfixia antes de la pérdida de la consciencia [18] [20]. Por todo ello, en la actualidad se está investigando la utilización de menor proporción de CO2 en combinación con otros gases para el aturdimiento de animales. 1.5. Refrigeración y congelación de alimentos Aunque los humanos prehistóricos almacenaban la carne en cuevas de hielo, la industria de los congelados tiene un origen más reciente que la del envasado. El proceso de congelación fue utilizado comercialmente por primera vez en 1842, pero la conservación de alimentos a gran escala por congelación comenzó a finales del siglo XIX con la aparición de la refrigeración mecánica. La congelación retrasa el deterioro de los alimentos y prolonga su seguridad evitando el desarrollo de los microorganismos y ralentizando la actividad enzimática. Cuando el agua de los alimentos se congela, se convierte en cristales de hielo y deja de estar a disposición de los microorganismos que la necesitan para su desarrollo. No obstante, la mayoría de ellos (a excepción de los parásitos) siguen viviendo durante la congelación, así pues, es preciso manipular los alimentos con cuidado, tanto antes como después de ésta y evitar que se rompa la cadena del frío. –136– 5. Usos industriales directos del CO2 El CO2 , bien en su forma sólida como nieve carbónica o bien con equipos que lo usan en forma líquida como fluido refrigerante, se emplea a nivel industrial para mantener los alimentos a temperaturas reducidas. Ello se debe a su capacidad enfriadora en fase líquida, y a que no reacciona con los alimentos cuando está en contacto directo con ellos en fase sólida, como nieve carbónica. Los dos gases criogénicos que se usan con más frecuencia para la congelación de alimentos son el nitrógeno líquido y el CO2 . Debido a su menor coste, la congelación con nitrógeno líquido está más implantada a nivel industrial que la que se lleva a cabo con CO2 , aunque las dos son similares en cuanto a efectividad y forma de operar. Cuando el CO2 líquido se inyecta de forma adiabática (sin intercambiar calor con el entorno) en un contenedor, se produce nieve carbónica que se deposita tanto en el producto como en los paquetes que lo rodean. El CO2 se va sublimando5 gradualmente, reduciendo la temperatura del producto mientras se transporta. Cuando el CO2 se sublima tiende a transferir aproximadamente el 85% de su capacidad enfriadora al alimento congelado. Gracias a estas propiedades es preferible usar esta técnica frente a otras más convencionales de congelación que requieren un capital más elevado. Figura 5.12. Carnes congeladas con nieve carbónica. 5 La sublimación es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. –137– Normalmente se utiliza el CO 2 en el amasado de productos de panadería, mientras se va amasando se inyecta CO 2 para enfriar la masa y evitar así el calentamiento por rozamiento. Asimismo, es un procedimiento útil para la carne picada que se emplea para hacer hamburguesas a nivel industrial, ya que facilita el amasado posterior del producto una vez descongelado [21]. La aplicación de transporte refrigerado con pellets de CO2 para productos perecederos ofrece una alternativa que disminuye los altos costes iniciales que conlleva la adquisición de unidades refrigeradas, con una alta flexibilidad en las operaciones y diversas opciones de uso. Esta tecnología es aplicable a todas las industrias con necesidad de prolongar la cadena de frío para la preservación de la calidad de sus productos. La demanda del transporte refrigerado está asociada en gran medida con el transporte de productos perecederos frescos, congelados y de la industria agroalimentaria. La industria de la transformación, y en particular la química y de procesos, demandan también este tipo de transporte aunque en menor escala. 2. Aplicaciones del CO2 supercrítico Un problema importante con el que se encuentran las industrias de procesamiento de alimentos, fármacos, textiles y otras es el de los disolventes6 , ya que manejan grandes volúmenes de estos compuestos, con el consiguiente riesgo ambiental y el elevado coste que implica su posterior tratamiento como residuo. Entre los disolventes comunes se encuentran la acetona, el acetonitrilo, el hexano, el metanol, el estireno, el tolueno, la trementina, etc. También existen los denominados disolventes halogenados7, como son el tetracloruro de carbono, los clorofluorocarbonos (CFC), el clorobenceno, el cloroformo, el bicloruro de etileno, el cloruro de metileno, el percloroetileno (tetracloroetileno, PER), el metil cloroformo y el tricloroetileno. Los compuestos halogenados son muy usados en la industria debido a su baja reactividad y escasa flamabilidad. Sin embargo, se ha demostrado que dañan la capa de ozono, aumentando la temperatura de la Tierra, por lo que existe una tendencia a la eliminación total de su uso [22]. 6 Son compuestos que pueden disolver o extraer otras sustancias. Se encuentran en forma líquida pero desprenden vapores. La vía de intoxicación más común es la respiratoria, sin embargo pueden producirse intoxicaciones por vía digestiva y cutánea. 7 Compuestos que contienen halógenos. Los halógenos forman el grupo 17 (o VIIA) de la tabla periódica de clasificación de los elementos químicos, y son: flúor, cloro, bromo, yodo y astato. –138– 5. Usos industriales directos del CO2 Asimismo, los disolventes orgánicos tradicionales tienen un efecto nocivo para la salud humana. Dichos compuestos se evaporan con facilidad (por lo cual se les llama volátiles). Una exposición a cantidades masivas puede ocasionar la muerte instantánea; la exposición prolongada puede producir ceguera, arritmias cardiacas y lesiones renales, hepáticas, pulmonares y del sistema nervioso central. Incluso, algunos de ellos –acetonitrilo, benceno, tetracloruro de carbono, cloroformo, percloroetileno y tricloroetileno– aparecen en las listas de compuestos que pueden causar cáncer. Figura 5.13. Algunos disolventes orgánicos comunes: acetona, aguarrás, glicol, tolueno. El CO2 a presión y temperaturas moderadas muestra unas propiedades muy parecidas a estos compuestos, pudiendo usarse con mayor seguridad y menor impacto ambiental en procesos industriales donde se emplean disolventes orgánicos. El uso de CO2 como alternativa a los disolventes orgánicos ha permitido el desarrollo de lo que se denomina tecnología de fluidos supercríticos (FSC). Ésta se basa en el hecho de que es posible ajustar la solubilidad de un compuesto en CO2 supercrítico simplemente cambiando la presión y temperatura de la operación. –139– Aunque en sus inicios la tecnología de fluidos se planteó como una alternativa al uso de disolventes orgánicos, su aplicación se ha ido expandiendo a múltiples campos en los últimos 15 años, incluyendo áreas tan diversas como la alimentación, la síntesis de nuevos materiales, el procesado de plásticos, la limpieza de pieles, la extracción de compuestos de alto valor añadido, el lavado de ropa en seco, los equipos electrónicos, la extracción de grasas, etc. A continuación describimos alguno de ellos en más detalle. Figura 5.14. Equipos de laboratorio para la investigación con CO2 supercrítico situados en el centro de investigación MATGAS, en Barcelona. A la izquierda se presentan dos reactores de 250 y 300 ml, respectivamente, mientras que a la derecha se muestra una planta piloto de laboratorio. (Gentileza de MATGAS). –140– 5. Usos industriales directos del CO2 2.1. Procesos de extracción de productos con CO2 supercrítico De manera similar a la extracción mecánica de carbón de una mina, o la de una pieza de un equipo, la extracción puede aplicarse para obtener y separar un compuesto que está contenido en un material sólido o líquido. La extracción química es un procedimiento de separación de una sustancia que puede disolverse en dos disolventes no miscibles entre sí, con distinto grado de solubilidad y que habitualmente están en contacto a través de una interfase. La extracción química está limitada por dos mecanismos: la solubilidad del extracto (producto a separar) en el disolvente y la transferencia de materia entre la matriz donde se encuentra el extracto y el disolvente. Los fluidos supercríticos presentan ventajas en los procesos de extracción química frente a otros disolventes ya que, al comportarse como un líquido, facilitan la disolución de los solutos, a la vez que su comportamiento como gas favorece la transferencia permitiendo una fácil separación de la matriz. Esto conlleva un proceso de extracción más rápido, eficiente y selectivo que en el caso de la extracción líquido-líquido (proceso tradicional de extracción). Entre las aplicaciones industriales de la extracción con CO2 supercrítico destacan la obtención de la cafeína del café y del té, del lúpulo para producir cerveza, de los pesticidas contenidos en los cereales, de productos naturales como la resina del pimentón o aceites esenciales. También se utiliza el CO2 supercrítico para la extracción de grasa del cacao, de la piel o de piezas metálicas, para la limpieza de los microchips electrónicos, la eliminación del TCA (tricloroanisole) del corcho y para la limpieza en seco de la ropa. Figura 5.15. Productos naturales a los que se les aplica la técnica de extracción con CO2 supercrítico para obtener la cafeína. Café (izquierda) y té verde (derecha). –141– El CO2 supercrítico se utiliza también en la extracción de productos de alto valor añadido para sus aplicaciones en farmacia, cosmética, etc. A modo de ejemplo, en la figura 5.16 se muestra la harina de la flor de caléndula antes y después de ser tratada con CO2 supercrítico, así como la luteína8 , el extracto obtenido. Gracias a sus propiedades antioxidantes, la luteína ayuda a proteger el organismo del ataque de los radicales libres. Ese efecto antioxidante hace que sus posibles usos terapéuticos sean muy diversos. Figura 5.16. Resultado del proceso de extracción del pigmento de la caléndula. De izquierda a derecha, harina de caléndula antes y después del tratamiento con CO2 supercrítico, y pigmento extraído. (Gentileza de MATGAS). La investigación sobre nuevas aplicaciones de la tecnología de fluidos supercríticos es un área muy activa a nivel global en el mundo académico. Existen numerosos investigadores expertos en este campo, agrupados en asociaciones a nivel nacional e internacional. Citamos, a modo de ejemplo, la Asociación Internacional para el Avance de los Fluidos Supercríticos [23] (ISASF, International Society for the Advancement of Supercritical Fluids), que agrupa a investigadores y empresas del sector procedentes de Europa, Asia y América. Su objetivo es la difusión de información sobre dicha tecnología entre los distintos actores que intervienen en la misma, tanto a nivel de investigación como a nivel industrial. En España se ha creado la Asociación Empresarial para el Fomento de las Tecnologías Supercríticas (AFTS), auspiciada por el centro tecnológico AINIA e integrada por distintas empresas y algunos centros de investigación. Su objetivo es alinear las necesidades de las empresas privadas con las iniciativas innovadoras e investigadoras que tienen centros 8 La luteína es un pigmento amarillo de la familia de los carotenoides que se encuentra en las algas, caléndula, guisantes, puerros, arándanos, brócoli, yema de huevo, espinacas, acelga, repollo, col, maíz, tomate, plátano, perejil, apio, patata blanca, flor de calabaza y naranja. La yema de huevo posee un 85% de luteína, el maíz un 60% y el brócoli un 20%. –142– 5. Usos industriales directos del CO2 tecnológicos y organismos de investigación, universidades y empresas públicas de cara a convertirse en un clúster tecnológico nacional de primer nivel en este ámbito. Existe, asimismo, la Asociación Española de Fluidos Comprimidos (FLUCOMP), un foro de debate, estudio y promoción de las tecnologías FSC que fomenta la colaboración entre los grupos de investigación y empresas para la implementación de estas tecnologías. La actividad de esta asociación se orienta más a la investigación que a la aplicación directa en el mercado. A pesar de las numerosas ventajas que aporta la tecnología de fluidos supercríticos respecto a los disolventes orgánicos, aun no está extendida su implantación a nivel industrial con todo su potencial. Así, en 2005 existían menos de 40 instalaciones con recipientes de volumen superior a 100 litros en Europa, aunque en la actualidad esta tecnología está teniendo una implantación cada vez mayor en Asia [24], [25]. Las limitaciones más importantes para su implantación a nivel industrial derivan, por un lado, del desconocimiento de la tecnología, al ser aún muy reciente, frente a las tradicionales en el sector, y por otro, de la resistencia a la inversión en nuevas instalaciones. Existen estudios que demuestran que el aumento de capacidad de las instalaciones disminuye drásticamente el coste del producto final, consiguiendo una amortización del capital en un plazo de tiempo corto [24]. Las ventajas sobrepasan en la mayoría de los casos sus limitaciones, tratándose de una tecnología más limpia, segura y eficiente que las tradicionales. En España, existen varias instalaciones que operan a nivel industrial, incluyendo dos para la extracción del pimentón, una para el tratamiento del corcho usado como tapones de botellas de vino (extracción del TCA del corcho) y otra polivalente y versátil para la extracción de compuestos destinada a terceras empresas. Altex (Alta Tecnología Extractiva, S. A, <http://www.altex.com>), es una empresa de base tecnológica situada en Paterna, Valencia. Fue creada con el objetivo de dar acceso a la utilización industrial de CO2 supercrítico en procesos de extracción y purificación avanzados, así como en tratamientos específicos de materiales para terceros. Se trata de la primera planta industrial de carbónico supercrítico polivalente y versátil, diseñada y construida en España con tecnología propia y adaptada a las necesidades del tejido industrial. La versatilidad de la planta ofrece un amplio abanico de aplicaciones en sectores diversos, como son: química fina, alimentación, bebidas, farmacia, cosmética, petroquímica, etc. [26]. –143– Figura 5.17. Fotos de algunos de los equipos que componen las instalaciones de Altex, en Paterna, Valencia. (Gentileza de Altex). Igualmente, la empresa Corchos de Mérida, perteneciente al grupo Oeneo Bouchage, <http://www.oeneo-bouchage.com>, utiliza la tecnología de fluidos supercríticos para el tratamiento del corcho mediante el proceso DIAMANT®, obteniendo los tapones conocidos como DIAM. La tecnología DIAMANT®, desarrollada por Oeneo Bouchage en colaboración con el Laboratorio de los Fluidos Supercríticos de la Comisión de la Energía Atómica de Francia, se utiliza para extraer de la harina de corcho determinados componentes químicos indeseables como los cloroanisoles (más particularmente el 2,4,6 tricloroanisole o TCA), que pueden ocasionar desviaciones sensoriales del vino embotellado [27]. El TCA es precisamente el que otorga el desagradable «sabor a corcho» de algunos vinos, y debe ser evitado para preservar la calidad de los mismos. Según afirma Pascal Chatonnet, enólogo por la facultad de Burdeos y consejero de la firma Excell, el lavado de los tapones de corcho con cloro forma automáticamente el precursor de estos aromas. Ciertos mohos naturales de los corchos, que no serían especialmente dañinos en sí mismos, transforman en TCA los restos organoclorados que esta operación deja. Las alternativas son encontrar un proceso que permita la extracción de los TCA (como la extracción supercrítica con CO2) o bien la sustitución del corcho por otro tipo de material, con las consiguientes desventajas que ello puede ocasionar sobre el sabor del vino. –144– 5. Usos industriales directos del CO2 Figura 5.18. Tapones de corcho DIAM tratados con la tecnología de fluidos supercríticos para la extracción de los TCA. Las instalaciones de la empresa Corchos de Mérida, en San Vicente de Alcántara, se dedican exclusivamente a la aplicación industrial del proceso DIAMANT®. En ellas se han invertido 15,5 millones de euros y cuenta con una capacidad de producción de 500 millones de tapones al año. Figura 5.19. Instalaciones para el tratamiento de tapones de corcho con CO2 supercrítico de la empresa Corchos de Mérida, en San Vicente de Alcántara, Badajoz. (Gentileza de Corchos de Mérida). –145– 2.2. Aplicaciones en el sector textil Una de las aplicaciones más conocidas de los fluidos supercríticos en el sector textil es la limpieza en seco con CO2 . Este procedimiento se caracteriza por eliminar la suciedad y las manchas de tejidos y prendas sin provocar pérdida de color, encogimiento o cambio de forma, sin arrugar el tejido tras su limpieza y sin dejar olor. Además, no se usan disolventes orgánicos perjudiciales para el medio ambiente, como el percloroetileno (PER), habitual en los procesos convencionales de limpieza en seco. Empresas como Washpoint USA, en Estados Unidos, (<http://www.washpoint.com>) y Fred Butler en Europa, (<http://www.hangerseurope.com>) tienen implantado este proceso a nivel industrial, y aseguran que el lavado en seco con CO2 es más barato que el convencional usando PER. La empresa estadounidense pone al alcance de cualquier interesado, a través de su página web, un programa sencillo y personalizado de cálculo comparativo del coste total de limpieza en seco de un kilogramo de ropa con tecnologías convencionales y mediante la limpieza con CO2 [28]. Otras aplicaciones extractivas de los fluidos supercríticos en este sector es el desengrasado de curtidos y determinación de grasa y pentaclorofenol en cueros, así como la extracción tanto de lanolina como de ceramidas de la lana de oveja. La ceramida de la lana tiene una composición lipídica muy similar a la de la piel humana, por lo que muestra notables ventajas de cara a su aplicación en formulaciones cosméticas frente a las ceramidas sintetizadas en un laboratorio o las extraídas por procesos convencionales de fuentes vegetales [29]. Figura 5.20. Dos lavadoras comerciales que utilizan la tecnología de CO2 supercrítico para la limpieza de ropa en seco [28]. –146– 5. Usos industriales directos del CO2 En cuanto al tintado textil, la mayor ventaja de la aplicación de esta tecnología frente a las convencionales reside en la sustitución del agua por CO2 supercrítico. Tras el proceso convencional de tintado de fibras, el agua utilizada ha de tratarse como residuo contaminante y obliga, además, a que el tejido sea sometido a un proceso de secado, con el consiguiente gasto energético. Tras el tintado con CO2 supercrítico, éste se recupera del medio como gas, de tal forma que no quedan residuos del mismo en la fibra, y ésta queda lista para su procesado final, sin necesidad de la etapa de secado. Por otra parte, el CO2 es prácticamente reciclado en su totalidad y se consigue un tintado uniforme y rápido del tejido sin dañarlo [29]. Empresas europeas como UHDE y DyeCoo, que desarrollan máquinas y procesos de tintado con CO2 , aseguran que este método es entre un 20 y un 30% más barato que el proceso de tintado convencional. Hemos visto algunas aplicaciones industriales en el sector textil, pero sus posibilidades son mayores, ya que muchas de las aplicaciones que podrían emplearse en este sector están aún en fase de investigación. Como en el caso de la extracción anteriormente comentada, las principales limitaciones para su implantación son el miedo a reemplazar una tecnología madura por una tecnología embrionaria o en desarrollo, la inversión inicial necesaria en el equipo de alta presión y el desconocimiento de las posibilidades de la propia tecnología. Figura 5.21. Ejemplo de aplicación de extracción con CO2 supercrítico en el sector textil: desengrasado de piel. (Gentileza de MATGAS). –147– 2.3. Síntesis y modificación de materiales El CO 2 supercrítico permite procesar productos químicos por recristalización o precipitación, así como impregnar materiales con distintas sustancias, modificar superficies para aplicaciones específicas, encapsular compuestos activos y procesar plásticos. El procesado por precipitación con CO 2 supercrítico para obtener micropartículas o nanopartículas es un proceso más simple que el convencional, y con unas prestaciones superiores: permite obtener en una sola etapa partículas de tamaños inferiores a 100 nm con una distribución de tamaños menor, sin un exceso de partículas finas, sin tensiones térmicas y controlando la forma de una sustancia polimórfica9 [30]. Las partículas así producidas son de alto valor añadido, con aplicaciones en el sector farmacéutico, cosmético y químico, entre otros. En la micronización convencional10 , la obtención de partículas inferiores a una micra implica la combinación de diversas etapas: cristalización, sembrado de cristales, secado, criba y molienda. La micronización supercrítica permite simplificar este proceso a una única etapa de cristalización [32] donde se añaden hasta tres sustancias: el producto que se va a micronizar, el fluido supercrítico y, eventualmente, un disolvente11. Figura 5.22. Nanopartículas obtenidas por precipitación en CO2 supercrítico [31]. 9 En ciencia de los materiales y mineralogía, se denomina polimorfismo a la capacidad de un material sólido de existir en más de una forma o estructura cristalina, todas ellas con la misma composición de elementos químicos. Por ejemplo, el diamante y el grafito son polimorfos del carbono. 10 Micronización es el proceso de reducción del tamaño de las partículas de un material sólido a un diámetro de unas pocas micras (10 -6 metros). Sin embargo, los usos modernos (generalmente en la industria farmacéutica) requieren unos diámetros medios a escala nanométrica (10 -9 metros). 11 El orden como se añaden estas sustancias permite definir multitud de técnicas como RESS, GAS, ASES, SAS, PGSS y DELOS, técnicas que se agrupan en tres clases: precipitación por expansión rápida, por antisolvencia y por soluciones saturadas de CO2 supercrítico. Los detalles de cada una de estas técnicas pueden encontrarse, entre otras, en las referencias [25] y [30] de este capítulo. –148– 5. Usos industriales directos del CO2 Las prestaciones superiores del proceso con CO 2 supercrítico se justifican por un mecanismo de precipitación distinto al convencional. En éste, la reducción de la solubilidad se realiza por cambios térmicos y está limitado por la transferencia térmica del disolvente. En la micronización supercrítica, la reducción de solubilidad se consigue por cambios de presión, que se transmiten a velocidad del sonido. Se consiguen así unas condiciones muy homogéneas que permiten obtener una gran cantidad de núcleos y un bajo crecimiento de ellos, y, por tanto, unas partículas más uniformes y pequeñas. Cada vez se está extendiendo más el concepto de liberación controlada de fármacos, incluyendo la liberación de productos antimicrobianos para fines alimentarios. Los sistemas de liberación controlada de fármacos incluyen materiales compuestos con estructuras complejas que, en la mayoría de los casos, se fabrican utilizando disolventes orgánicos y aditivos tales como los tensoactivos12 , entre otros. Los disolventes orgánicos y aditivos son difíciles de eliminar en su totalidad, lo que podría dar lugar a problemas de toxicidad o alergias. Una técnica alternativa al uso de disolventes tradicionales para su síntesis es la impregnación supercrítica, ya que permite encapsular el principio activo sin alterar el recubrimiento. Como en la impregnación convencional, el fluido supercrítico actúa como medio o transporte para introducir el principio activo hasta el interior del material, ya sea poroso o sólido. La ventaja del proceso de impregnación en CO 2 supercrítico frente a los métodos convencionales es que la concentración de agente antimicrobiano en el material es fácilmente ajustable en función de las condiciones de operación, presión y temperatura. Además, no se producen pérdidas del agente antimicrobiano durante el procesado y el método de impregnación es muy sencillo. La impregnación supercrítica se lleva a cabo en dos recipientes a presión, el primero contiene el principio activo que se ha de encapsular, por ejemplo el compuesto antioxidante o antibacteriano, y el segundo la sustancia que debe impregnarse, como el plástico. El CO2 supercrítico entra en el primer recipiente, donde disuelve la sustancia activa y la transporta hasta el segundo recipiente, donde se encuentra la matriz que se va a impregnar. 12 Los tensoactivos son sustancias que influyen, por medio de la tensión superficial, en la superficie de contacto entre dos fases (p. ej., dos líquidos insolubles uno en otro). Cuando se utilizan en la tecnología doméstica se les denomina emulgentes o emulsionantes, esto es, sustancias que permiten conseguir o mantener una emulsión. –149– Figura 5.23. Polímeros impregnados con CO2 supercrítico. Las dos imágenes de la izquierda corresponden a polietileno (PE) impregnado con triclosan [33]; a la derecha, polimetacrilato de metilo (PMMA) con colorante azul. (Gentileza de MATGAS). En la impregnación de plásticos, el CO2 presenta la ventaja de ser capaz de hinchar un plástico amorfo mientras esté disuelto en su interior, reduciendo su densidad y potenciando la difusión de las sustancias disueltas en él. Esta propiedad permite tanto introducir sustancias como extraerlas, por ejemplo eliminando residuales de monómeros o dímeros del plástico. Figura 5.24. Expansión de polipropileno (PP) en CO2 supercrítico. A la izquierda se presenta el material antes de la expansión, a la derecha aparece el material expandido jugando con las temperaturas de transición vítrea, temperaturas de termoformado y la presión. (Gentileza de MATGAS). –150– 5. Usos industriales directos del CO2 El CO 2 se utiliza también como medio de reacción para modificar las propiedades superficiales de un material (por ejemplo, para cambiar su afinidad al agua, pasando de ser hidrófilo a ser hidrófobo). La modificación de una superficie para hacerla hidrófoba se presenta como una solución para mejorar la tensión interfacial entre una fase inorgánica y una fase orgánica. Por ejemplo, el dióxido de titanio (TiO2) modificado para ser hidrófobo se emplea en la ingeniería de materiales fotocatalíticos y en células solares sensibles al color (en inglés, dye-sensitized solar cells), así como en rellenos de papel y en las industrias de los plásticos, cosmética y biomateriales [33]. El cambio de afinidad al agua del material puede llevarse a cabo mediante un proceso de silanización13. En la actualidad, hay dos métodos químicos para llevarlo a cabo: la impregnación en fase vapor y la reacción en solución. Este último se utiliza cuando la presión del vapor de silano es muy baja, lo que ocurre para la mayoría de silanos. Además de las ambientales, las ventajas de llevar a cabo el proceso de silanización utilizando CO2 supercrítico en lugar de los disolventes orgánicos, se centran, de nuevo, en la baja viscosidad del CO2 supercrítico y la elevada difusión de estas disoluciones. En la figura 5.25 se muestra el efecto de la silanización en una nanopartícula de dióxido de titanio (TiO2). Figura 5.25. Gota de agua en una superficie nanométrica de TiO2. Izquierda: gota sobre la superficie hidrófila; derecha: gota sobre la superficie hidrófoba tratada usando el método de silanización en CO2 supercrítico. (Gentileza de C. Domingo, ICMAB-CSIC). 13 El silano o hidruro de silicio (IV), es un compuesto químico cuya fórmula es Si H4 . De forma más general, un silano es cualquier análogo de los alcanos, pero derivado del silicio. El proceso de silanización consiste en la introducción de un grupo silano (R 3 Si–) a una molécula. –151– 3. Tratamiento de aguas y CO2 Según se constata en el primer informe de Naciones Unidas sobre el desarrollo de los recursos hídricos del mundo, «Agua para todos, agua para la vida» [35], el 59% del consumo total de agua en los países desarrollados se destina a uso industrial, el 30% a consumo agrícola y el 11% restante a uso doméstico. En 2025, el consumo de agua destinada a uso industrial alcanzará los 1.170 km3/año, cifra que en 1995 se situaba en 752 km3/año [36]. Figura 5.26. Ejemplos de consumo de agua en los tres sectores: industrial, agrícola y doméstico. 3.1. Tratamiento de aguas residuales De los tres sectores mencionados, el industrial no sólo es el que más gasta, sino también el que más contamina. Más de un 80% de los residuos peligrosos del mundo se producen en los países industrializados, mientras que en las naciones en vías de desarrollo, un 70% de los residuos que se generan en las fábricas se vierten al agua sin ningún tipo de tratamiento previo, contaminando así los recursos hídricos disponibles. –152– 5. Usos industriales directos del CO2 Figura 5.27. Vertido de aguas contaminadas. Estos datos aportan una idea de la importancia que tiene el tratamiento y la reutilización de aguas residuales en el sector industrial en el mundo, especialmente en aquellos países con escasos recursos hídricos, como es España. La comunidad internacional ha reconocido en múltiples foros el importante papel que representa el agua en un sistema sostenible de desarrollo industrial a largo plazo. La Agenda 21, surgida de las conversaciones de la Cumbre de Río, concluye en el capítulo 30 que las políticas y operaciones comerciales e industriales pueden desempeñar un papel decisivo en la conservación medioambiental y el mantenimiento de los recursos si se incrementa la eficacia de los procesos de producción y se adoptan tecnologías y procedimientos limpios, reduciendo al mínimo, e incluso evitando, los deshechos. En el ámbito europeo, la Directiva 2000 incorpora la calidad como objetivo de la política general del agua, lo que supone un impulso para las tecnologías actuales o en vías de desarrollo encaminadas a que el agua retorne a la Tierra, una vez utilizada, en condiciones que no sólo permitan la supervivencia, sino la regeneración de algunos de nuestros ecosistemas. Según el Libro Blanco del Agua [37], el consumo en España es de 35.000 hm3/año. Sin embargo, su uso presenta particularidades respecto a la media mundial, ya que el 68% se destina a regadío, el 18% a abastecimiento de población e industria, y el 14% restante a sistemas de refrigeración para la producción de energía. De acuerdo con el Instituto Nacional de Estadística (INE), en España el volumen de agua residual recogido en 2003 fue de 3.469 hm3, de los que sólo se reutilizó un 4% (unos 170 hm3). –153– Aunque es difícil cuantificar el volumen de aguas residuales que pueden reutilizarse para distintos usos, todos los estudios que se han realizado sobre la materia confirman el enorme potencial de España en este campo. Entre los métodos más rigurosos para determinar la capacidad de reutilización de recursos hídricos se encuentra el elaborado por Hochstrat y colaboradores [38]. Según su modelo, España tiene un potencial de reciclado de 1.300 hm3, un orden de magnitud muy superior al actual. En la directiva 91/271 CEE, de Tratamiento de Aguas Residuales Urbanas, se definen los distintos tipos de aguas residuales: 1) aguas residuales domésticas: Aquellas procedentes de zonas de vivienda y servicios generadas principalmente por el metabolismo humano y las actividades domésticas. 2) aguas residuales industriales: Todas las aguas residuales vertidas desde locales utilizados para efectuar cualquier actividad comercial o industrial, que no sean aguas residuales domésticas ni aguas procedentes de la lluvia. 3) aguas residuales urbanas (ARU): Las aguas residuales domésticas o su mezcla con aguas residuales industriales y/o aguas de escorrentía pluvial. Habitualmente, todas ellas se recogen en un sistema colector y son enviadas mediante un emisario terrestre a una planta EDAR (Estación Depuradora de Aguas Residuales). Las industrias que realicen el vertido de sus aguas residuales en esta red colectora deben acondicionarlas previamente. Figura 5.28. Detalle de una estación depuradora de aguas residuales (EDAR). –154– 5. Usos industriales directos del CO2 Los compuestos orgánicos e inorgánicos que se encuentran en aguas residuales proceden de instalaciones industriales diversas. A diferencia de las aguas residuales domésticas, los efluentes industriales contienen con frecuencia sustancias que no se eliminan con un tratamiento convencional, bien por estar en concentraciones elevadas, o bien por su naturaleza química. Muchos de los compuestos orgánicos e inorgánicos que se han identificado en aguas residuales industriales son objeto de regulación especial debido a su toxicidad o a sus efectos biológicos a largo plazo. En la actualidad existen distintas técnicas para el tratamiento de aguas residuales. Pueden clasificarse en tres grandes categorías: tratamientos físicos (adsorción, sedimentación, precipitación, etc.), químicos (procesos electroquímicos, desinfección, etc.) y biológicos (por microorganismos aerobios o anaerobios). Asimismo están emergiendo tecnologías entre las que se incluyen la oxidación y el tratamiento con membranas. El vertido de aguas alcalinas precisa un tratamiento corrector de los efluentes industriales para reducir su pH a niveles tolerables. Este tratamiento requiere el uso de una especie ácida, como el ácido sulfúrico o clohídrico, cuya naturaleza agresiva y corrosiva hace aconsejable el uso de métodos alternativos de neutralización, entre los que se encuentra la utilización de CO2 . Los procesos de neutralización de aguas residuales con CO2 ofrecen grandes ventajas operativas y medioambientales frente a otros tratamientos con productos químicos [39]: 1) mejores condiciones de trabajo, ya que elimina el riesgo de quemaduras, vapores tóxicos y otras lesiones derivadas del manejo de ácidos minerales. 2) neutralización segura: se evitan los riesgos de sobreacidificación con ácidos fuertes. 3) inversión inicial baja. Existen diferentes sistemas de aplicación, pero todos ellos son equipos simples, seguros y de pequeñas dimensiones. 4) proceso automatizado. La automatización evita el manejo por parte del personal de ácidos corrosivos y el movimiento de los mismos en el interior de la planta. 5) funcionamiento continuo. El control de pH es automático, sin necesidad de mantenimiento. 6) economía. La utilización de CO2 resulta muy económica al suprimir costes indirectos de operación y por las características químicas del gas, que permiten el diseño de plantas de tratamiento con materiales menos costosos. –155– Esta tecnología está implantada en el mercado para tratar aguas en distintos sectores entre los que destacan: plantas embotelladoras, industrias de detergentes y lejías, textil y de tintes, conservera, alimentaria, papelera, química y petroquímica. Si las características de la instalación lo permiten, se puede realizar una inyección directa en tubería, o bien una difusión en la balsa o depósito de neutralización, mediante disposición de una parrilla de difusores en el fondo de la misma. En otros casos, es posible realizar la neutralización mediante equipos diseñados específicamente para ello, tales como Neutracab-F [39]. Figura 5.29. Neutralización de aguas residuales con CO2. A la izquierda, esquema del proceso, a la derecha, equipo Neutrocar-F, comercializado por Carburos Metálicos, del grupo Air Products. 3.2 Remineralización de aguas potables con CO2 El agua potable es, hoy en día, un recurso natural cada vez más difícil de obtener, al menos con las características físico-químicas y sensoriales adecuadas. La creciente necesidad de este bien nos obliga a que todas las fuentes sean optimizadas. Existe, además, una exigencia cada vez mayor por parte del consumidor en cuanto a la calidad sensorial de dichas aguas. –156– 5. Usos industriales directos del CO2 Actualmente y debido al aumento de las necesidades de agua en las grandes ciudades, no siempre es posible escoger un agua potable que reúna las condiciones idóneas para su suministro a través de la canalización y tubería de distribución. Así, existen aguas muy blandas, consideradas aguas agresivas. Un agua de estas características puede, cuando las condiciones del medio lo proporcionan, dar origen a fenómenos de corrosión. Tiende a disolver el carbonato cálcico (CaCO3)14 de las tuberías de fibrocemento, debilitando sus paredes. Si, además, la tubería es de hierro y carece de protección al CaCO3, sufre un ataque del agua por corrosión, dando color y turbidez. En este caso se trata de aguas naturales poco mineralizadas y con un exceso de CO2 agresivo [40]. La introducción del dióxido de carbono en las tuberías regula un estado de equilibrio entre los bicarbonatos disueltos, el carbonato cálcico incrustado y el CO 2 añadido. Por tanto, para el tratamiento de aguas blandas o agresivas se aconseja el empleo de CO2 en combinación con cal o hidróxido cálcico15 , para aumentar la dureza del agua. Esto es muy importante para el caso de aguas totalmente desalinizadas o con grados de dureza muy bajos. Este proceso se conoce con el nombre de remineralización, y es muy significativo en plantas potabilizadoras, ya que el agua blanda es indigesta. Figura 5.30. Fotografía de una fuente de agua apta para el consumo humano. 14 El carbonato de calcio es un compuesto químico muy abundante en la naturaleza, componente principal de las rocas, en diferentes partes del mundo, y de las conchas y esqueletos de muchos organismos (p. ej. moluscos, corales) o de las cáscaras de huevo. Es la causa principal del agua dura. Su fórmula química es CaCO 3 . 15 El hidróxido de calcio, también conocido como cal muerta y/o cal apagada, es un hidróxido cáustico de fórmula Ca(OH) 2 . Es un cristal incoloro o polvo blanco, obtenido al reaccionar óxido de calcio con agua. –157– Las características del CO2 como producto alimentario permiten su uso en el tratamiento de aguas potables y ofrece una estabilidad continua de las características del agua tratada. Su reducida inversión, y la facilidad de adaptación de los sistemas de suministro, hacen de este proceso un sistema de rápida instalación, sin necesidad de paradas en el abastecimiento del agua en las redes públicas. El proceso de remineralización carbónica es un proceso completamente autónomo y capaz de ajustarse para suministrar la cantidad de gas requerido según las necesidades del medio en el que se actúe. Existen diferentes sistemas de inyección: inyección directa en tubería, mediante parrilla de difusores en el fondo de una balsa, mediante la recirculación del agua que se va a tratar, etc., pudiendo diseñarse la solución óptima adecuada a cada situación particular. Figura 5.31. Planta potabilizadora de agua situada en Barberá del Vallés, Barcelona. Propiedad de Veolia. 3.3. Tratamiento de aguas de recreo con CO2 El CO2 puede usarse, asimismo, para tratar aguas de recreo o piscinas disminuyendo su pH. Las piscinas de recreo y los spas se asocian a la idea de salud y bienestar. Sin embargo, es preciso mantener un elevado grado de desinfección en las instalaciones para evitar infecciones microbianas, lo cual provoca, paradójicamente, un riesgo para la salud de sus usuarios por los productos requeridos para ello. –158– 5. Usos industriales directos del CO2 Figura 5.32. Piscinas y spas que pueden ser tratadas con CO2. Los compuestos más usados para la desinfección de estas aguas de recreo son aquellos basados en cloro, tales como el hipoclorito sódico, con una elevada capacidad de influencia sobre el cambio climático cuando se evapora. Cuando estos compuestos reaccionan con la materia orgánica se forman las cloroaminas y los trihalometanos (THM). Estos compuestos son altamente volátiles y pueden encontrarse en la atmósfera de piscinas cubiertas y spas. La concentración de estos compuestos volátiles es mayor aún cerca de la superficie del agua, siendo máxima justo a la distancia a la que los nadadores respiran [41]. Dado que estos compuestos pueden actuar como oxidantes, se estima que su inhalación es muy probablemente la responsable de algunos de los desordenes de salud que experimentan los usuarios habituales de piscinas. Estudios recientes llevados a cabo por investigadores de la Universidad Autónoma de Barcelona demuestran los beneficios del uso del CO2 en aguas de recreo [42]. Además de la menor utilización de los compuestos clorados, el CO2 disminuye la presencia de oxidantes en el aire que se encuentra sobre la piscina (cerca de la superficie), disminuyendo también la formación de trihalometanos con respecto a los valores obtenidos cuando se usaron compuestos clorados para reducir el pH. Esto proporciona un valor añadido para la salud de los nadadores, que dejan de inhalar los compuestos nocivos que se desprenden cercanos a la superficie del agua tratada cuando se sustituye al CO2 por compuestos clorados. –159– 4. Conclusiones Se han revisado aquí algunas de las aplicaciones industriales de uso directo del CO2 que se están llevando a cabo tanto en el ámbito de la alimentación como en la industria química, farmacéutica, textil y de nanotecnología, así como aplicaciones al tratamiento de aguas residuales, aguas potables y de recreo. La extensión y el alcance de estas aplicaciones muestran que la utilización tecnológica o directa del CO2 permite mejorar nuestra calidad de vida, y, en la mayoría de los casos, sustituye a otros compuestos perjudiciales para el medio ambiente. Se obtiene así una ganancia ambiental neta, además de un beneficio económico, mediante estos procesos. Se ha constatado también que, a pesar de las ventajas de las tecnologías basadas en CO 2 , en algunos casos existe cierta reticencia a su adopción, ocasionada, por una parte, por desconocimiento de las nuevas tecnologías y sus prestaciones y, por otra, debido al riesgo que comporta la inversión inicial de capital por cambio de tecnología. Son las implicaciones medioambientales y la legislación correspondiente las que están llevando a la adopción de estas nuevas tecnologías, siendo necesario, también, una mayor divulgación de sus ventajas, para obtener una mayor penetración en los distintos sectores. –160– 5. Usos industriales directos del CO2 5. Bibliografía 1. Agua_carbonatada. <http://es.wikipedia.org/wiki/> 2. Gaseosa. <http://es.wikipedia.org/wiki/>. 3. J. C. BADA GANCEDO, C. GONZALEZ DE LOS REYES GAVILÁN, P. RUAS Y MADEIDO, Procedimiento de conservación de la leche cruda refrigerada con CO 2 y posterior degasificación. (Patente 2-143-425 concedida 1/12/2000). Consejo Superior de Investigaciones Científicas (CSIC) y Carburos Metálicos. 4. P. RUAS-MADEIDO, Empleo de dióxido de carbono para aumentar el periodo de conservación de la leche cruda refrigerada y su aplicación en el proceso de elaboración de quesos. Tesis Doctoral de la Universidad de Oviedo. Departamento de Biología Funcional y del Instituto de Productos Lácteos de Asturias (IPLACSIC). <http://hdl.handle.net/10261/8730>. 5. E. GARCIA IGLESIAS, L. GAGO CABEZAS y J. L. FERNÁNDEZ NUEVO, Tecnologías de envasado en atmósfera protectora. (Informe de vigilancia tecnológica), Fundación para el conocimiento madri+d CEIM. <http://www.madrimasd.org>. 6. Guía de envasado en atmósfera protectora. Publicada por Carburos Metálicos, Grupo Air Products. <http:// www.carburos.com/productos_sectores/eap_que_es.html>. 7. F. KIDD y C. WEST, «Effect of Carbon Dioxide Upon Carbon Dioxide Production in the Absence of Oxygen», New Phytologist, 44 (2), 231-233, 1945. Blackwell Publishing para New Phytologist Trust. <http:// www.jstor.org/stable/2428822>. 8. R. PARRY (Coord.), Envasado de los alimentos en atmósfera modificada. Editores A. Madrid Vicente ediciones, Madrid, 1995. [ISBN: 84-87440-76-2] 9. RIUDAVETS, C. CASTAÑE, O. ALOMAR, M. J. PONS y R. GABARRA, Journal of Stored Products Research, 45, 91-96, 2009. 10. J. RIUDAVETS, C. CASTAÑE, O. ALOMAR, M. J. PONS, R. GABARRA y S. GURI, «Atmósferas modificadas para el control de plagas en productos alimentarios», Alimentaria, 40-45, 2008. 11. Folleto de Carburos Metálicos sobre desinsectación de alimentos con CO 2 . 12. Patente de Carburos Metálicos sobre desinsectación de alimentos, ES2186559. 13. Patente de Carburos Metálicos sobre desinsectación de alimentos, EP1523250. 14. Directiva del consejo 93/119/EEC de 22 de diciembre de 1993, relativa a la protección de los animales en el momento de su sacrificio o matanza. Bruselas, UE. –161– 15. A. VELARDE, M. GISPERT, L. FAUCITANO, X. MANTECA y A. DIESTRE. «Effect of stunning method on the incidence of PSE meat and haemorrhages in pork carcasses». Meat Science 55, 309-314, 2000. 16. A. VELARDE, M. GISPERT, L. FAUCITANO, X. MANTECA y A. DIESTRE. «Effects of the stunning procedure and the halothane genotype on meat quality and incidence of hemorrhages in pigs». Meat Science 58, 313-319, 2001. 17. R. HOENDERKEN, J. G. VAN LOGTESTJIN, W. SYBESMA y W. J. M. SAPNJAARD, «KohlendioxidBetaubung von Schlachtschweinen». Fleischwirtschaft, 59, 1572-1578, 1979. 18. A. B. M. RAJ y N. G. GREGORY, «Welfare implications of the gas stunning of pigs 1. Determination of aversion to the initial inhalation of carbon dioxide or argon». Animal Welfare, 4, 273-280, 1995. 19. A. B. M. RAJ y N. G. GREGORY, «Welfare implications of the gas stunning of pigs 2. Stress of induction of anaesthesia». Animal Welfare, 5, 71-78, 1996. 20. A. B. M. RAJ, S. P. JOHNSON, S. B. WOTTON y J. L. McINSTRY, «Welfare implications of gas stunning of pigs 3. Time to loss of Somatosensory Evoked Potentials and Spontaneous Electrocorticogram of pigs during exposure to gases». British Veterinary Journal, 153, 329-340, 1997. 21. Comunicación personal, Dra. Sonia Guri, Carburos Metálicos y MATGAS. 22. I. SUSAETA, P. LOPEZ, I. GARAY, «Extracción con fluidos supercríticos para la eliminación de contaminantes», Ingeniería Química, abril, 117-122, 2003. 23. Asociación Internacional para el Avance de los Fluidos Supercríticos: <http://www.isasf.net/>. 24. G. BRUNNER, «Supercritical fluids: technology and application to food processing». J. of Food Engineering 67, 21-33, 2005. 25. J. TORRES, «CO 2 supercrítico más que una alternativa de bajo impacto ambiental a los disolventes orgánicos», ponencia presentada en las Jornadas de Tecnología Transversal para la Industria Alimentaria, Cosmética y Farmacéutica, Universitat Autònoma de Barcelona, 2010. 26. Alta Tecnología Extractiva S. A., <http://www.altex.es>. 27. Grupo Oeneo Bouchage, <http://www.oeneo-bouchage.com>. 28. Empresa americana Washpoint USA que comercializa la tecnología y máquinas de lavado en seco con CO 2 supercrítico, <http://www.washpoint.com>. 29. I. GARAY, «La tecnología de fluidos supercríticos y sus aplicaciones más relevantes en productos textiles», AITEX Review, enero, 2009. 30. M. J. COCERO, M. A. MARTIN, F. MATTEA y F. VARONA, «Encapsulation and co-precipitation processes with supercritical fluids: Fundamentals and applications». J. of Supercritical Fluids 47, 546-555, 2009. –162– 5. Usos industriales directos del CO2 31. Experimentos llevados a cabo en el laboratorio de fluidos supercríticos de MATGAS, <http://www. matgas.com>, por investigadores del departamento de Nanociencia Molecular y Materiales Orgánicos del Instituto de Ciencia de Materiales del Consejo Superior de Investigaciones Científicas, ICMAB-CSIC <http://www.icmab.es>. 32. I. PASQUALI y R. BETTINI, «Are pharmaceutics really going supercritical?». International J. of Pharmaceutics 364, 176-187, 2008. 33. Trabajo realizado por investigadores de MATGAS dentro del proyecto Europeo SURFACE_T: «Sustainable surface technology for multifunctional materials», (STREP NMP2- CT-2005-013524). 34. C. A. GARCÍA-GONZALEZ, J. FRAILE, A. LOPEZ-PERIAGO y C. DOMINGO, «Preparation of silane-coated TiO2 nanoparticles in supercritical CO2», Journal of Colloid and Interface Science 338, 491-499, 2009. 35. Informe de las Naciones Unidas (UNESCO), Water for people, Water for life, Executive Summary of the UN World Water Development Report, Paris, France. UNESCO-WWAP (2003). En <http://www. unesco.org/water/wwap>. 36. A. RODRÍGUEZ FERNÁNDEZ-ALBA. P. LETON GARCÍA, R. ROSAL GARCÍA, M. DORADO VALIÑO, S. VILLAR FERNÁNDEZ y J. M. SANZ GARCÍA, Tratamientos avanzados de aguas residuales industriales, Colección dirigida por J. de la Sota Rius, Fundación para el Conocimiento madri+d CEIM, 2006. [Depósito legal M-30985-2006]. 37. Ministerio de Medio Ambiente y Medio Rural y Marino. Libro blanco del agua en España, 2000. 38. R. HOSCHSTRAT, T. WINTGENS, T. MELIN y P. JEFFREY, «Wastewater reclamation and reuse in Europe: a model-based potential estimation», Water Supply 5, 67-75, 2005. 39. Carburos Metálicos, <http://www.carburos.com/productos_sectores/wwt_co2p.html>. 40. Carburos Metálicos, <http://www.carburos.com/productos_sectores/wwt_co2r.html>. 41. U. LAHL, K. BÄTJER, J. V. DÜSZELN, B. GABEL, B. STACHEL y W. THIEMANN, «Distribution and balance of volatile halogenated hydrocarbons in the water and air of covered swimming pools using chlorine for water disinfection». Water Res. 15, 803-814, 1981. 42. A. GOMA, A. GUISASOLA, C. TAYA, J. A. BAEZA, M. BAEZA, A. BARTROLI, J. LAFUENTE y J. BARTROLI, «Effects of carbon dioxide as pH reducer in chlorinated indoor swimming pools, Chemosphere», 2010, (en prensa). –163– –164– 5. Usos industriales directos del CO2 6 Conversión del CO2 en usos biológicos y químicos Una persona es capaz de lograr lo que sea si su entusiasmo no tiene límites. William Charles Schwab El dióxido de carbono puede convertirse en productos químicos, combustibles y polímeros mediante las tecnologías existentes para llevar a cabo estos procesos. Sin embargo, dado que la cantidad de CO2 que utiliza la industria química (excluyendo la de combustibles) es equivalente al 1-2% del total de las emisiones de CO2 producidas por la acción humana, la síntesis de productos químicos basados en CO2 puede contribuir a reducir las emisiones, pero no de una manera significativa a día de hoy. En este capítulo revisaremos algunas de las aplicaciones del CO2 para generar otros productos químicos o combustibles mediante tecnologías biológicas o químicas. Aunque aún existen limitaciones para implementar dichas tecnologías a gran escala, el interés por su desarrollo y aplicación está creciendo enormemente en los últimos años, dado el valor añadido de los productos que se obtienen y las nuevas oportunidades que se presentan para la química industrial. Es importante que estas nuevas tecnologías se desarrollen al mismo tiempo que las de CAC, de tal forma que algunas de ellas puedan ser incluidas en el diseño y construcción de la misma planta que las contenga. –165– 1. Usos biológicos del CO2 1.1. Microalgas para capturar CO2 En el capítulo 4 se mencionó la utilización biológica mejorada como posible uso del CO2 como recurso. En este capítulo profundizaremos en dicha tecnología. Se trata de aprovechar el crecimiento de plantas capaces de alimentarse del CO2 de la corriente de salida de una chimenea u otra fuente de emisión, evitando así su liberación a la atmósfera. Esta tecnología se conoce también con el nombre de transformación biomimética (de mimo, ‘imitación’) de la naturaleza, ya que pretende aprender de ella la forma de disponer eficientemente de los recursos. Se basa en aprovechar el hecho de que los organismos fotosintéticos o microalgas usan la energía solar para convertir el CO2 y el agua en biomasa. En los sistemas acuosos pueden encontrarse dos familias de organismos fotosintéticos: macroalgas1 y microalgas. Es posible obtener compuestos de alto valor añadido a partir de las dos familias. Sin embargo, puesto que los organismos inferiores o microalgas son capaces de absorber una mayor cantidad de CO2 que las plantas superiores, creciendo, además, a un ritmo mayor y más fácilmente controlable, en los últimos años se están dedicando grandes esfuerzos en su crecimiento como posible medio de captura de CO2 y uso posterior de la biomasa generada. Figura 6.1. Macroalga, microalga de agua salada y microalga de agua dulce. Las microalgas resultan ser uno de los organismos fotosintéticos más eficientes en utilizar la energía solar. Por lo general, las plantas superiores presentan una eficiencia fotosintética alrededor del 2% o menor. Las microalgas, gracias a su simplicidad estructural, tienen una eficacia fotosintética claramente superior y, según las condiciones ambientales y de cultivo, pueden alcanzar entre 4-8% [1]. Existen estimaciones de productividades tan altas como 60-80 toneladas de peso seco por hectárea y año, en contraste con cultivos convencionales que producen del orden de 10-30 t/año [2], [3]. 1 Las macroalgas son algas marinas multicelulares y por lo tanto se diferencian de las algas microscópicas en su tamaño. –166– 6. Conversión del CO2 en usos biológicos y químicos El crecimiento de microalgas para producir combustibles no es nuevo. Ya en 1960, Oswald y sus colaboradores [4] presentaron un análisis conceptual tecnoeconómico sobre la transformación biológica de la energía solar, proponiendo el uso de estanques de canalización a gran escala para el cultivo de microalgas en los nutrientes de las aguas residuales, y para fermentar la biomasa de algas en condiciones anaerobias a metano combustible. El metano se iba a convertir en electricidad, reciclando el CO2 que contienen gases de escape e introduciéndolo en los estanques para apoyar la producción de algas. El contenido en grasas o lípidos de las microalgas varía en función del peso seco celular entre el 20 y el 40%, aunque se han encontrado especies cuyo contenido es de hasta el 85%. Por ejemplo, Botryococcus braunii es una variedad única de microalgas, con un contenido de hidrocarburos de cadena larga entre un 30 y 40% (peso seco), extraíbles para producir sustitutos. Para llevar a cabo esta extracción se requieren distintos tipos de procesos físicos y químicos, que encarecen la obtención de productos a partir de las microalgas. Figura 6.2. Imagen del alga unicelular Botryococcus braunii, utilizada para la extracción de biodiésel. 1.2. Producción industrial de microalgas Hay dos diseños básicos para la producción a gran escala de estos microorganismos: sistemas abiertos tipo carrusel, en los que el cultivo está expuesto a la atmósfera, y sistemas cerrados o fotobiorreactores [1]. Los sistemas abiertos (o piscinas) se construyen con diferentes materiales (cemento, plásticos, arcillas revestidas) y están constituidos por canales poco profundos en forma de circuito cerrado con un nivel de agua que no supera los 15-20 cm. Para mejorar la distribución de nutrientes y CO2 se utilizan paletas rotatorias, optimizando así la producción de microalgas. Generalmente ocupan grandes áreas de terreno (500-5.000 m2). –167– Estos sistemas son relativamente baratos de construir y operar, pero presentan varios inconvenientes, como baja productividad, fácil contaminación, recuperación costosa del producto por estar en un medio diluido y dificultad para el control de la temperatura [5]. Estas limitaciones estimularon el desarrollo de fotobiorreactores cerrados, construidos con materiales transparentes como vidrio y policarbonato, entre otros. A diferencia de las piscinas abiertas, los fotobiorreatores permiten cultivos unialgales por periodos prolongados y no tienen los problemas de contaminación de los sistemas abiertos. Figura 6.3. Producción industrial de microalgas en sistemas tipo carrusel, llevado a cabo por la empresa Petroalgae, en Florida (Estados Unidos). Los primeros fotobiorreactores fueron propuestos en los años ochenta por Pirt y sus colaboradores [6], y permitieron establecer cultivos de alta densidad celular, tres veces superior a los sistemas convencionales de carrusel. Figura 6.4. Fotobiorreactores para la producción de microalgas. –168– 6. Conversión del CO2 en usos biológicos y químicos El uso de microalgas que transforman el CO2 en otros productos es un ámbito de investigación en crecimiento incesante. Tanto grandes como pequeñas empresas investigan en la actualidad diversas rutas de transformación de CO2 a bioetanol, biobutanol, biogás y otros combustibles potenciales. Aunque las rutas más comunes son las que utilizan microorganismos fotosintéticos para la conversión de CO2 en productos como biocombustibles y bioetanol, también es posible extraer otros compuestos de interés comercial como proteínas, lípidos, glicerol, pigmentos, enzimas y biopolímeros. La investigación en este campo se está llevando a cabo en diferentes partes del planeta, y con una gran intensidad. En 1999, el Departamento de Energía de los EE. UU. (DOE) publicó su Programa de Ayudas sobre Especies Acuáticas (ASP), así como los subprogramas para la conversión de algas en biodiésel, con una duración de 16 años. En nuestro país existen también investigaciones pioneras en este sentido, con una fuerte inversión económica. Citamos, a modo de ejemplo, las actividades que están llevando a cabo diversas empresas en el proyecto CENIT SOST-CO2, (<http://www.cenit-sostco2.com>), con un presupuesto en esta área de más de 12 millones de euros. 1.3. Ventajas y retos de las microalgas para producción de energía De modo general, la mayor ventaja que presenta el crecimiento de microalgas mediante el CO2 y otros nutrientes es clara: se trata, de nuevo, de convertir el CO2 de residuo a recurso, generando otros productos químicos o fuentes de energía. Como ventajas adicionales [1] frente a otros cultivos energéticos2 cabe destacar que las microalgas pueden ser cultivadas todo el año y cosechadas continuamente, pueden crecer en tierras marginales en las regiones áridas del mundo, sus cultivos no compiten con la agricultura tradicional por cantidad o calidad de suelos y no requieren del uso de pesticidas y herbicidas. Además, por ser organismos unicelulares, su biomasa entera posee productos de interés, a diferencia de las plantas superiores en las que los productos recuperables se encuentran en sitios u órganos específicos, lo que dificulta su extracción. A pesar de las numerosas ventajas mencionadas y de los esfuerzos que se llevan a cabo para optimizar su producción y aprovechamiento, existen todavía limitaciones que superar en este campo, entre los que se incluyen: 1) la propia escala. Entre las mejores tecnologías para la producción de biodiésel se describe el uso de 1 acre de algas por tonelada de CO2 . Para capturar 10.000 t/día 2 Los cultivos energéticos son plantaciones de crecimiento rápido que se realizan con el propósito específico de producir energía en alguna de sus tipologías: térmica, eléctrica o mediante su transformación en biocombustibles. –169– de una central eléctrica de 500 MW, se necesitan 10.000 acres de cultivo de algas en sistemas abiertos. Aunque algas con una mayor tasa de conversión en biomasa que las tradicionales y el uso de fotobiorreactores pueden paliar en parte este problema, existen otros problemas tecnológicos, como la penetración de la luz en el reactor para favorecer la reacción. 2) la supervivencia de los organismos fotosintéticos en contacto con la corriente de gas procedente de la planta de energía eléctrica. Como todos los seres vivos, las condiciones ambientales que rodean a las microalgas requieren un delicado equilibrio entre temperatura, composición, etc., para que los microorganismos sobrevivan. 3) la extracción de biocombustibles de forma eficiente requiere una compleja ingeniería de proceso que normalmente no está disponible para las empresas start up con una gran base biológica o focalizadas exclusivamente en el cultivo de algas. Por otra parte, muchas de las grandes empresas que poseen esa compleja ingeniería de procesos carecen del know-how y la experiencia en el campo de las microalgas, de ahí que sea totalmente imprescindible la sinergia entre estos dos tipos de expertos. 1.4. Costes de producción de biomasa a partir de microalgas Según Chisti [5], en la comparación de fotobiorreactores y carruseles para la producción de biodiésel con microalgas, el coste de producir la biomasa es el factor relevante. Se estima que la producción de un kilogramo de biomasa microalgal cuesta 2,95 $ para los fotobiorreactores y 3,80 $ para los carruseles. Estas estimaciones asumen que el CO2 está disponible sin ningún coste, lo cual no es del todo correcto, aunque podría abaratarse considerablemente con la implementación a gran escala de las CAC y la proximidad de los sistemas de producción de algas a las fuentes generadoras de CO2. Si la capacidad de producción anual de biomasa se aumenta a 10.000 toneladas, el coste de producción por kilogramo se reduce a aproximadamente 0,47 y a 0,60 $ para fotobiorreactores y carruseles, respectivamente. Suponiendo que la biomasa contiene 30% de aceite en peso, su coste para proporcionar un litro de aceite estaría en torno a 1,40 y 1,81 $ para los fotobiorreactores y los carruseles, respectivamente. En comparación, el aceite de palma crudo, que es probablemente el aceite vegetal más barato, se vendió durante 2006 a un precio promedio de 0,52 dólares por litro. Mientras que, durante el mismo año, el precio promedio del petrodiésel excluyendo los impuestos y la distribución fue, en Estados Unidos, de 0,49 $/L. El biodiésel de aceite de palma cuesta –170– 6. Conversión del CO2 en usos biológicos y químicos aproximadamente 0,66 $/por litro, un 35% más que el petrodiésel. Esto sugiere que el proceso de conversión del aceite de palma en biodiésel añade alrededor de 0,14 $/por litro al precio del aceite; para que ese biodiésel sea competitivo respecto al petrodiésel, no debería exceder 0,48 $/por litro, asumiendo una ausencia de impuesto sobre el biodiésel. De la misma manera, un precio razonable para el aceite de microalga sería 0,48 $/por litro para ser competitivo respecto al petrodiésel. El objetivo estratégico es reducir su coste de producción desde alrededor de 2,80 a 0,48 $/por litro. Para ello, se plantea una estrategia productiva basada en la optimización de las microalgas a través de la ingeniería genética, avances en la ingeniería de fotobiorreactores y en la biorrefinería [5]. Una biorrefinería microalgal puede producir simultáneamente biodiésel, forraje, fertilizantes, biogás y energía eléctrica. La extracción de otros productos de alto valor añadido relacionados con la industria farmacéutica, cosmética y alimentaria, proporciona un margen mayor, dependiendo de la especie de alga producida y del producto de valor añadido obtenido. 2. Conversión química del CO2 También el CO2 puede ser usado como recurso mediante su conversión en otros productos químicos. Así, por una parte, es posible incorporar la molécula entera del CO2 en un producto mediante un proceso que no requiere gran cantidad de energía, y, por otra parte, el CO2 puede convertirse en fuente de carbono (proceso conocido como tecnología C-1) mediante una reacción que requiere un gran aporte energético (ya que precisa romper la molécula de CO2, que presenta unos enlaces químicos muy estables). Hay diversos motivos para producir sustancias químicas a partir de CO2 [7]: 1) el CO2 es barato (especialmente si se considera la cantidad que se capturará con CAC) y no tóxico, pudiendo reemplazar a sustancias químicas tóxicas tales como el fosgeno o isocianatos para algunos procesos químicos. 2) la producción de sustancias químicas a partir de CO2 puede proporcionar nuevos y valiosos materiales tales como el policarbonato, así como conducir hacia nuevos rumbos la síntesis de sustancias químicas. 3) la producción de sustancias químicas a partir de CO2 tiene un impacto pequeño pero positivo en el balance global del carbono. 4) el uso de CO2 como materia prima o co-reactivo es un reto y una oportunidad, ya que estimula la búsqueda de nuevas soluciones en la química industrial. –171– El CO2 es un compuesto altamente oxidante y termodinámicamente estable. Esto significa: que su conversión (rotura de la molécula) requiere sustancias con alto contenido de energía libre (NH3, aminas, etc.) o una fuente externa de energía (fotoquímica, eléctrica o térmica). Habitualmente se necesita el uso de un catalizador3 para que la reacción se lleve a cabo de forma eficiente. En la tabla 6.1 se presentan algunos de los productos obtenidos por conversión química del CO2 , incluyendo la producción mundial y la cantidad de CO2 fijado. Tabla 6.1. Usos del CO2 en la industria química por síntesis de compuestos orgánicos [7]. A continuación, detallamos brevemente la producción de cada uno de ellos y sus usos más extendidos. 2.1. Producción y usos de la urea La urea es un compuesto químico cristalino e incoloro, de fórmula CO(NH2)2. Se encuentra abundantemente en los riñones y en la materia fecal. Es el principal producto terminal del metabolismo de proteínas en los seres humanos y en los demás mamíferos. La orina humana contiene unos 20 g por litro, y un adulto elimina entre 25 a 39 g diariamente. La síntesis de urea a nivel industrial se realiza a partir de amoniaco (NH3) líquido y CO2 en estado gaseoso. La reacción se verifica en dos pasos. En el primero, los reactivos mencionados forman un producto intermedio llamado carbamato de amonio y, en la segunda etapa, el carbamato se deshidrata para formar urea. 3 Un catalizador es una sustancia que está presente en una reacción química en contacto físico con los reactivos, y acelera, induce o propicia dicha reacción sin actuar en la misma. –172– 6. Conversión del CO2 en usos biológicos y químicos Figura 6.5. Urea cristalina preparada comercialmente. La urea es el producto más usado como fertilizante agrícola, gracias a su alto contenido en nitrógeno. Se utiliza también como estabilizador en explosivos de carbonocelulosa y es un componente básico de resinas preparadas sintéticamente. Asimismo, se usa en los piensos para rumiantes. Es una fuente de nitrógeno no proteico que puede aprovechar la flora bacteriana que vive en el sistema digestivo de estos animales para producir proteínas, que nutren a su huésped. Es mucho más barata que las proteínas de origen vegetal, y aunque los animales consumen calorías para convertir la urea en proteína, resulta más rentable. Otra de sus utilidades importantes en la industria química es la fabricación de resinas urea-formaldehído, teniendo como uso principal la aglomeración de madera; también tiene aplicaciones en la industria de la fundición y para productos plásticos termoestables, entre otras. En la figura 6.6 se muestran algunas de estas aplicaciones. Figura 6.6. Distintas aplicaciones de la urea y de las resinas de urea-formaldehido, producidas a partir de CO2. –173– 2.2. Producción de ácido acetilsalicílico (aspirina) El ácido acetilsalicílico o AAS (C9H8O4) es un fármaco de la familia de los salicilatos, usado frecuentemente como antiinflamatorio, analgésico, para el alivio del dolor leve y moderado, antipirético y antiagregante plaquetario indicado para personas con alto riesgo de coagulación sanguínea, principalmente individuos que ya han tenido un infarto agudo de miocardio [9]. El AAS fue sintetizado por primera vez por Charles Frédéric Gerhardt, en 1853, y por Hermann Kolbe, en 1859, en forma de sal, aunque en estos procesos el ácido no se obtenía muy puro. En 1897, el químico alemán Felix Hoffmann, de la empresa Bayer, consiguió sintetizar ácido salicílico con gran pureza [11]. Sus propiedades terapéuticas como analgésico y antiinflamatorio fueron descritas en 1899 por el farmacólogo alemán Heinrich Dreser, lo que permitió su comercialización en forma de polvo, en un frasco de cristal. Ese mismo año fue patentado con el nombre de Aspirin®. Figura 6.7. Ácido acetilsalicílico en su forma cristalina (izquierda), y como producto final en la aspirina (derecha). Posteriormente, en 1971, el farmacólogo británico John Robert Vane demostró que el AAS suprime la producción de prostaglandinas y tromboxanos (ver glosario), lo que abrió la posibilidad de usarlo en bajas dosis como antiagregante de plaquetas, ampliando enormemente su campo comercial y compensando el hecho de que, en la actualidad, su uso como antiinflamatorio de elección haya sido desplazado por otros medicamentos más eficaces y seguros. –174– 6. Conversión del CO2 en usos biológicos y químicos La reacción química de la síntesis de la aspirina se considera una esterificación4 y se produce a partir de ácido salicílico y anhídrido acético. El ácido salicílico5 (o ácido 2-hidroxibenzoico) recibe su nombre de salix, la denominación latina del sauce, de cuya corteza fue aislado por primera vez. Se trata de un sólido incoloro que suele cristalizar en forma de agujas y en cuya síntesis participa el CO2. Por su parte el anhídrido acético, de fórmula química (CH3CO)2O, es uno de los anhídridos carboxílicos más simples y más utilizados en síntesis orgánica. Desde 1899, año en que comenzó a comercializarse, se han fabricado 350 billones de comprimidos de aspirina [11]. En el mundo se consumen cada día 216 millones de aspirinas. 2.3. Producción de carbonatos Los carbonatos son las sales del ácido carbónico o ésteres, con el grupo R–O–C(=O)–O–R’. Las sales tienen en común el anión (CO3)2- y se derivan del ácido carbónico H2CO3. Según el pH (la acidez de la disolución) están en equilibrio con el bicarbonato y el dióxido de carbono. La mayoría de los carbonatos, excepto los de los metales alcalinos, son poco solubles en agua. Debido a esta característica son importantes en geoquímica y forman parte de muchos minerales y rocas. El carbonato más abundante es el carbonato cálcico (CaCO3), que se halla en diferentes formas cristalinas como la calcita y la aragonita (una modificación formada a altas temperaturas). Figura 6.8. Distintas imágenes de carbonato cálcico en forma de calcita y aragonita. 4 Se denomina esterificación al proceso por el cual se sintetiza un éster. Un éster es un compuesto derivado formalmente de la reacción química entre un ácido carboxílico y un alcohol. 5 Para fabricar una tonelada de ácido salicílico son necesarios 730 kg de fenol, 310 kg de NaOH, 450 kg de CO 2 , 410 kg de H2 SO 4 , 10 kg de Zn, 20 kg de ZnSO 4 y 20 kg de carbón activado. –175– El carbonato cálcico también se encuentra en forma maciza como caliza, como mineral metamórfico en forma de mármol, y es a menudo el cemento natural de las piedras areniscas. La caliza es una roca sedimentaria compuesta mayoritariamente por carbonato de calcio, generalmente calcita. También puede contener pequeñas cantidades de minerales como arcilla, hematita, siderita, cuarzo, etc., que modifican (a veces sensiblemente) el color y el grado de coherencia de la roca. Figura 6.9. Formación caliza de origen hidrotermal en Pamukkale, Turquía. Figura 6.10. Distintas formas de carbonato cálcico encontradas en la naturaleza. Izquierda: estalactitas y estalagmitas en la gruta de las Maravillas (Aracena, España), y cuevas de mármol (Puerto Tranquilo, Chile). –176– 6. Conversión del CO2 en usos biológicos y químicos Sustituyendo una parte del calcio por magnesio se obtiene la dolomita (CaMg(CO3)2). Abunda en la naturaleza en forma de rocas dolomíticas y se utiliza como fuente de magnesio y para la fabricación de materiales refractarios (es una roca ígnea6). En España encontramos una variedad negra de la dolomita, la teruelita, en la provincia de Teruel. Figura 6.11. Dos fotografías de dolomita, transparente y negra (teruelita). Uno de los carbonatos más importantes industrialmente es el carbonato sódico. En la naturaleza se encuentra en algunas lagunas salinas, por ejemplo, en Egipto, aunque la gran mayoría se obtiene a partir de la cal en el proceso Solvay. En este proceso se hace pasar amoniaco y dióxido de carbono (en estado gaseoso los dos) por una solución saturada de cloruro de sodio formando carbonato ácido de sodio y cloruro de amonio (ambos solubles en agua). El carbonato sódico es un intermedio en la obtención de productos como el jabón, el percarbonato sódico utilizado como blanqueante, el vidrio, la sosa (NaOH), etc. Se encuentra entre los diez productos químicos de mayor producción en Norte América y constituye casi el 25% de cada gramo de vidrio. Figura 6.12. Carbonato de sodio obtenido químicamente usando CO2. 6 Las rocas ígneas se forman cuando el magma (roca fundida) se enfría y se solidifica. –177– Las cenizas de madera también se componen en gran medida de carbonatos. Estos han dado incluso el nombre a un elemento, el potasio (K) del inglés pot ash, ‘ceniza debajo de la caldera’ ya que se obtenía habitualmente de esta fuente. El carbonato cálcico y sus derivados tienen distintas aplicaciones industriales: en medicina se utiliza habitualmente como suplemento del calcio, como antiácido y agente adsorbente; también es fundamental en la producción de vidrio y cemento, forma parte de la formulación de las pastas dentales y sirve para el blanqueo de papel, entre otros productos. En la figura 6.13 se muestran algunas de estas aplicaciones. Figura 6.13. Distintas aplicaciones industriales del carbonato cálcico. 2.4. Síntesis y usos de policarbonatos El CO2 se viene usando en la síntesis de polímeros (o plásticos) desde 1960. El nombre policarbonato viene dado por tratarse de polímeros que presentan grupos funcionales unidos por grupos carbonato en una larga cadena molecular. En 1953, Hermann Schnell, investigador de Bayer AG, experimentando con poliéster y fosgeno gaseoso consiguió un nuevo material al que llamó policarbonato. Por su parte, los laboratorios de la división de plásticos del grupo General Electric (GE) sintetizaron –178– 6. Conversión del CO2 en usos biológicos y químicos policarbonato a base de éster de ácido carbónico. Ambas empresas llegaron a un acuerdo sobre la repercusión que dicho descubrimiento podría tener en el mercado y su distribución comercial. Existen distintas formas de sintetizar químicamente los policarbonatos. De entre ellas la que más se comercializa es la de bisfenol A. La empresa Bayer lo vende bajo el nombre Makrolon® y General Electric lo hace bajo el nombre Lexan®. Las dos moléculas principales que intervienen en la síntesis del policarbonato son las de bisfenol A y fosgeno. Estudios recientes demuestran que es posible sustituir el fosgeno, un componente químico altamente tóxico, por CO2. Figura 6.14. Policarbonato cristalino sintetizado industrialmente. Cuando en 1958 empezó la producción de Makrolon®, se producían 40 toneladas mensuales en la planta de Uerdingen (Alemania). A finales del año 2002, la cifra se incrementó hasta las 550 toneladas diarias. La producción mundial de Bayer es de unas 740.000 toneladas. Recientemente, BASF anunció que es posible obtener policarbonato a partir de óxido de propileno y dióxido de carbono. La empresa ha logrado desarrollar catalizadores que permiten almacenar CO2 en grupos de óxido de propileno y producir, de esta forma, polímeros de cadena larga (como el policarbonato). Esos polímeros y sus copolímeros respectivos son biodegradables y podrían convertirse en un importante grupo de materiales, porque su perfil de propiedades se asemeja a las del polietileno y polipropileno. Además, son reciclables y correctos ambientalmente. –179– El policarbonato es un grupo de termoplásticos fácil de trabajar, moldear y termoformar7. Es un material de uso común tanto en los hogares como en laboratorios y en la industria debido a sus tres cualidades principales: gran resistencia a los impactos, resistencia a la temperatura y propiedades ópticas excepcionales. Los principales campos de aplicación de los policarbonatos son, en la industria óptica, para crear lentes de todo tipo de gafas; en electrónica, se utilizan como materia prima para la fabricación de CD, DVD y algunos componentes de ordenadores; en el ámbito de la seguridad, en la fabricación de cristales antibalas y escudos antidisturbios para la policía y, en diseño y arquitectura, como cubrimiento de espacios y otras aplicaciones. En la figura 6.15 se muestran algunas de ellas. Figura 6.15. Algunos materiales fabricados a partir de policarbonato. 3. Tecnologías para producir combustibles a partir de CO2 Es posible utilizar el CO2 como fuente de carbono (la denominada tecnología C1) para generar productos químicos y combustibles. Sin embargo, dado el aporte energético 7 El termoformado es un proceso que consiste en dar forma a una lámina plástica por medio de calor (120 ºC a 180 ºC) y vacío (600 a 760 mmHg) utilizando un molde o matríz (madera, resina epóxica o aluminio). –180– 6. Conversión del CO2 en usos biológicos y químicos requerido en estos casos (por la estabilidad de la molécula de CO2), el reciclado de CO2 tiene sentido si se utilizan fuentes de energía renovable sin producir CO2 adicional. La repercusión que podría tener el uso de CO2 como fuente de energía renovable para producción de combustibles es inmensa. A modo de ejemplo, la cantidad de combustible líquido que se consumió en los Estados Unidos en 1999 fue de 13,60 millones de barriles por día, lo que lleva asociada una cantidad de carbono del mismo orden de magnitud que las emisiones de CO2 de los combustibles fósiles procedentes de centrales térmicas para producción de electricidad. Este número se ha incrementado significativamente en los últimos diez años, de manera similar a como lo han hecho las emisiones de CO2. Para obtener combustibles a partir de CO2 existen dos grandes opciones: la hidrogenación, es decir la reacción de CO2 con H2, que lleva a la producción de metanol, y la síntesis de Fischer-Tropsch8 que utiliza gas de síntesis producido a partir de CO2. Ambas tecnologías llevan asociada la rotura de la molécula de CO2 , lo cual requiere una gran cantidad de energía. 3.1. Fotosíntesis artificial Un campo de investigación muy activo se centra en conseguir la rotura directa de la molécula de CO2, imitando el ciclo natural de la fotosíntesis. La fotosíntesis artificial trata de replicar el proceso natural, convirtiendo la luz solar, agua y dióxido de carbono en hidratos de carbono y oxígeno, tal y como se explicó en el capítulo 4. El CO, el ácido fórmico o el metanol formados a partir de la reducción del CO2 por fotosíntesis artificial pueden ser usados para producir una gran variedad de productos químicos, incluyendo los combustibles líquidos. Los laboratorios Sandia, de Estados Unidos, han denominado a este proceso conversión de energía solar a combustible (en inglés, solar-to-petrol). Para que esta tecnología pueda llevarse a cabo a gran escala, es necesario desarrollar un proceso efectivo y selectivo para reducir CO2, preferentemente a CO o metanol (CH3OH). 8 El proceso Fischer-Tropsch es un proceso químico para la producción de hidrocarburos líquidos (gasolina, keroseno, gasoil y lubricantes) a partir de gas de síntesis (CO y H2). Fue inventado por los alemanes Franz Fischer y Hans Tropsch en los años veinte. –181– Además de la rotura de la molécula de CO2 utilizando concentradores solares (denominada fisión térmica), existen otras dos alternativas para la fisión del CO2: la reducción electroquímica y la foto-catalítica. De la fotorreducción se puede obtener CO, formaldehído, ácido fórmico/formato, metanol o metano. De todos estos compuestos el metanol, el metano y el CO son los más atractivos para la producción de combustibles líquidos [12]. Figura 6.16. Horno donde se inicia la concentración del calor solar necesario para llevar a cabo la reacción del proceso solar-to-petrol. (Cortesía de los Laboratorios Nacionales de Sandia, Estados Unidos). Hasta la fecha, las investigaciones se han centrado en semiconductores como el dióxido de titanio (TiO2), que presenta una alta estabilidad electroquímica. Desgraciadamente, este material no absorbe luz visible y requiere la utilización de lámparas UV de alta potencia. Por tanto, estos materiales sólo podrían considerarse absolutamente sostenibles para la producción de combustibles líquidos a partir de CO2 si se utilizaran paneles solares para generar la energía eléctrica necesaria. Recientemente ha aparecido una nueva generación de catalizadores capaces de absorber en la banda visible del espectro solar. Si se consigue que la banda de conducción de estos materiales sea mayor que el potencial de reducción del CO2, estaríamos ante candidatos ideales para llevar a gran escala la reducción fotocatalítica del CO2. –182– 6. Conversión del CO2 en usos biológicos y químicos La ventaja que presenta esta tecnología frente a otras posibles aplicaciones del CO2, o a su almacenamiento, es que éste desaparece de manera permanente del ciclo, convirtiéndose en productos de valor añadido. Sin embargo, existe aún un largo camino por recorrer para poder utilizar esta tecnología a gran escala, siendo las principales limitaciones el que aún no es bien conocido ni el mecanismo de la reacción ni la selectividad, la poca eficiencia de los catalizadores actuales y la energía requerida para llevar a cabo la reacción. Es, por tanto, un área de gran potencial y donde se precisa seguir avanzando en investigación tanto fundamental como aplicada. Figura 6.17. Nanotubos de dióxido de titanio, materiales desarrollados para la reducción fotocatalítica del CO2 (Gentileza de Carburos Metálicos e IREC) [14]. 3.2. Producción de metanol La síntesis de metanol (CH 3OH) a partir de CO2 es una reacción bien conocida. Recientemente ha atraído un nuevo interés dado el potencial del metanol en una futura economía de hidrógeno. En 1923, los químicos alemanes Alwin Mittasch y Pier Mathias (de BASF) desarrollaron un método para convertir el gas de síntesis (una mezcla de CO, CO2 e hidrógeno) en metanol. El proceso utiliza un catalizador de óxido de cromo y manganeso, y requiere de presiones extremadamente elevadas que van desde 50 hasta 220 atm y temperaturas de hasta 450 °C. La producción moderna de metanol es más eficiente, se utilizan catalizadores –183– (comúnmente cobre) capaces de funcionar a presiones más bajas. El metanol moderno de baja presión (LPM) fue desarrollado por la Imperial Chemical Company (ICI) del Reino Unido a finales de 1960 con la tecnología actualmente propiedad de Johnson Matthey, que es un licenciatario líder en tecnología de metanol. El uso de metanol como combustible de automoción recibió atención durante las crisis del petróleo en la década de los setenta del pasado siglo debido a su disponibilidad, bajo coste y beneficios medioambientales. A mediados de los años noventa, se vendieron en Estados Unidos más de 20.000 vehículos de combustible flexible (VCF) capaces de funcionar con metanol o gasolina. Además, durante gran parte de la década de 1980 y principios de los 90, los combustibles de gasolina que se vendían en Europa iban mezclados con pequeños porcentajes de metanol. A pesar del éxito técnico, los fabricantes de automóviles dejaron de construir VCF a metanol a finales de los años noventa, cambiando su atención a los vehículos propulsados por etanol debido al aumento del precio del metanol y a la caída en precios de la gasolina. Recientemente ha surgido un nuevo interés gracias a los procesos mencionados en este capítulo. Figura 6.18. Vehículos de combustible flexible actualmente en el mercado. Asimismo, el metanol se usa en otros dispositivos que almacenan energía, tales como las baterías o pilas de combustible. En la figura 6.19 aparecen dos de estas aplicaciones. Figura 6.19. Dos dispositivos que funcionan con baterías de metanol: ordenador (Fujitsu) y teléfono móvil (Toshiba). –184– 6. Conversión del CO2 en usos biológicos y químicos 3.3. Reformado seco de metano para producir combustibles En las últimas décadas también ha crecido el interés hacia los procesos químicos que permiten obtener un gas de síntesis (CO e hidrógeno) a partir de la reacción de metano (CH4) con CO2. Esta reacción recibe el nombre de reformado seco de metano, por similitud al reformado con vapor de gas natural que vimos en el capítulo 2. A partir de esta reacción se obtienen los precursores para la producción de combustibles renovables mediante la síntesis de Fischer-Tropsch o metanol. Aunque la reacción es muy atractiva y tiene ventajas frente al reformado de metano con vapor de agua (no se precisa vapor para reactivar el catalizador), también presenta varios inconvenientes. El inconveniente principal es la desactivación del catalizador debido a la deposición de carbono. En la actualidad se están haciendo numerosos esfuerzos para desarrollar nuevos catalizadores para esta reacción o nuevas formas de llevarla a cabo (por ejemplo, combinando el proceso con la tecnología de microondas [14]). Una de las opciones más viables es el uso de catalizadores carbonosos (como alternativa a los catalizadores basados en metales), debido a su bajo coste, su resistencia a altas temperaturas y la ausencia de envenenamiento por azufre. Además, es una reacción muy endotérmica, por lo que se requiere un gran aporte de energía para llevarla a cabo. –185– 4. Conclusiones En este capítulo hemos revisado algunas de las tecnologías que convierten el CO2 en un recurso para diferentes sectores industriales, o en combustible. Su uso como materia prima para producir esos compuestos químicos no sólo es interesante para ayudar en la mitigación de las emisiones de gases de efecto invernadero, sino que también es un reto importante para explorar nuevos conceptos y nuevas oportunidades para la catálisis y la química industrial, buscando soluciones más favorables con el medio ambiente. El crecimiento de microalgas y el aprovechamiento de la biomasa algal generada es un área de gran actualidad, en la que se están realizando grandes inversiones para desarrollar e implementar tecnologías más eficientes desde el punto de vista económico. El proceso es tremendamente atractivo, ya que esta biomasa es capaz de capturar CO2 y de crecer de una manera muy eficiente. Además, sería posible construir plantas de producción de microalgas en las proximidades de las plantas generadoras de CO2. Los retos están en el propio crecimiento de la biomasa, en las condiciones adecuadas de operación, y en la extracción eficiente de los productos de la biomasa generada. Por su parte, la conversión química del CO2 permite utilizarlo como materia prima para la formación de otros productos, bien integrándolo como un todo, o bien mediante la rotura de la molécula. Existen numerosos productos químicos en el mercado que proceden del CO2. En el caso de procesos que requieran la rotura de la molécula, debido a su estabilidad, es necesario aportar una gran cantidad de energía para que puedan llevarse a cabo de manera medioambientalmente sostenible, desempeñando un papel muy importante la energía solar de concentración. –186– 6. Conversión del CO2 en usos biológicos y químicos 5. Bibliografía 1. I. ALBARRACÍN, Microalgas: potenciales productoras de biodiésel. Ponencia presentada en el XV Simposio Electrónico Internacional «La producción de biocombustibles con eficiencia, estabilidad y equidad», 2007. 2. E. OLGUIN, Microalgae biomass as source of chemicals, fuels, and proteins. Presentado en Sixth Australian Biotechnology Conference, University of Queensland, St. Lucia Brisbane, 1984. 3. H. KOJIMA, Y-K LEE, Photosynthetic microorganisms in Environmental Biotechnology. Springer-Verlag. Hong-Kong, 2001. 4. W. J. OSWALD, H. B. GOTAAS, C. G. GOLUEKE, W. R. KELLEN, E. F. GLOYNA y E. R. HERMANN, «Algae in waste treatment», Sewage and Industrial Wastes, 29, pp. 437-457, 1957. Publicado por Water Environment Federation. 5. Y. CHISTI, «Biodiesel from microalgae», Biotechnology Advances 25, 294-306, 2007. 6. S. L. PIRT, Y. K. LEE, M. R. WALACH, M. W. PIRT, H. H. BALYUZI y M. J. BAZIN, «A tubular bioreactor for photosynthetic production of biomass from carbon dioxide: Design and performance» J. Chem. Tech. Biotechnol, 33B, 35-38, 1983. 7. G. CENTI y S. PERATHONER, «Reacciones catalíticas heterogéneas con CO 2: Estado y perspectivas», capítulo publicado en Studies in Surface Science and Catalysis 153. (Ed. S. -E. Park, J. -S. Chang y K. -W. Lee). Elsevier B. V., 2004. 8. Y. LI, B. MARKLEY, A. RAM MOHAN, V. RODRÍGUEZ-SANTIAGO, D. THOMPSON y D. VAN NIEKERK, «Utilization of carbon dioxide from coal-fired power plant for the production of value-added products», Design Engineering of Energy and Geo-Environmental Systems Course (EGEE 580), capítulo 4, 2006. 9. «Aspirina», en <http://es.wikipedia.org/wiki/>. 10. RSC Environment, «Sustainability and Energy Forum: Converting Carbon Dioxide to Chemicals». The Royal Society of Chemistry, 27 de julio de 2006. 11. «Más de 100 años. La historia de la aspirina». Bayer Health Care, disponible en: <http://www.bayaspirina. com.ar/historia.asp>. 12. P. USUBHRATANA, D. MCMARTIN, A. VEAWAB y P. TONTIWACHWUTHIKUL, «Photocatalytic Process for CO2 Emission Reduction from Industrial Flue Gas Streams», Ind. Eng. Chem. Res. 45, 25582568, 2006. –187– 13. K. IKEUE, S. NOZAKI, M. OGAWA, M. ANPO, «Characterization of self-standing Ti-containing porous silica thin films and their reactivity for the photocatalytic reduction of CO2 with H2O». Catal. Today, 74, 241, 2002. 14. Proyecto CENIT SOST-CO2, «Nuevas utilizaciones industriales sostenibles del CO2». En <http://www. cenit-sostco2.com>. –188– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual 7 Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual El ignorante afirma, el sabio duda y reflexiona. Aristóteles Una vez comprobado que tanto la captura como el almacenamiento y el aprovechamiento del CO2 son viables a escala de planta piloto, el siguiente paso sería implementar estas tecnologías a escala industrial. Para ello se cuenta con barreras económicas, asociadas a los costes y riesgos de poner en marcha a gran escala una nueva tecnología, con barreras técnicas, relacionadas con la localización y acondicionamiento de los almacenes, y con barreras sociales. La ayuda proveniente de fondos públicos puede ser un gran aliciente para que las empresas se muevan en esa dirección y aceleren la adopción completa de dichas tecnologías. En este capítulo revisaremos algunos de los proyectos que han logrado superar esas barreras y están en marcha. Se trata de proyectos relacionados tanto con la captura y almacenamiento, como con los nuevos usos, haciendo hincapié en aquellos que son singulares. Se presenta también un resumen de los proyectos financiados por la Unión Europea. 1. Panorama actual en proyectos de captura y almacenamiento de CO2 Tal y como se describió en los capítulos 2 y 3, la captura y el almacenamiento de CO2 aún no se está llevando a cabo de manera integrada a nivel industrial. Sin embargo, gracias al protocolo de Kioto, y a la normativa establecida en algunas regiones del planeta para –189– controlar las emisiones de gases de efecto invernadero, en los últimos años se ha iniciado la construcción de varias plantas de distinto tamaño que incorporan tecnologías de CAC, desde plantas piloto a plantas de demostración, con proyección de construir y operar plantas a escala industrial en un horizonte de pocos años. En la figura 7.1, adaptada del artículo de Haszedine [1], aparecen representados distintos proyectos de construcción de plantas que incorporen tecnologías de CAC, indicando la cantidad de CO2 que se capturará (directamente relacionada con el tamaño de la planta), la tecnología de separación empleada para capturarlo y el año en el que está previsto que operen dichas plantas. Existe también una web con un mapa interactivo donde aparece información de los distintos lugares en los que se están llevando a cabo proyectos de CAC y la fase en que se encuentran [2]. Figura 7.1. Plantas de demostración e industriales programadas en todo el mundo. El tamaño de los círculos representa la cantidad de CO2 que se capturará. Figura adaptada del artículo de revisión de Haszeldine [1]. Curiosamente el almacenamiento de CO2 se llevó a cabo a nivel industrial antes que el propio proceso de captura, ya que, como vimos en el capítulo 3, el CO2 se ha venido utilizando para la recuperación asistida de petróleo desde hace varias décadas. Sin embargo, la integración de captura con almacenamiento es mucho más reciente, existiendo algunos proyectos que ya lo hacen a gran escala: así, desde 1996, el CO2 se separa del gas natural del yacimiento de Sleipner y se inyecta en un acuífero salino profundo en Utsira (Noruega). –190– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual Desde el inicio de este proyecto se han almacenado alrededor de un millón de toneladas de CO2 por año. También en Salah, Argelia, se está llevando a cabo la separación del CO2 del gas natural para su posterior almacenamiento geológico, a una tasa de alrededor de 1,2 millones de toneladas por año. El tercer gran proyecto en marcha, mencionado en el capítulo 3, es el del campo de Weyburn, en Canadá, donde se inyecta el CO2 separado de una planta de gas natural en Dakota del Norte (Estados Unidos) para la recuperación asistida de petróleo. Mencionamos a continuación algunos proyectos que incorporan captura y almacenamiento de manera integrada, escogidos por su singularidad o porque están más directamente relacionados con nuestro país, existiendo, como se ha mencionado, otros proyectos en distintas partes del mundo. 1.1. La planta de Vattenfall en Alemania La primera planta piloto con tecnología de captura y almacenamiento de CO2 incorporada se encuentra situada en la zona industrial de Alemania denominada Schwarze Pumpe, a unos 4 km al sur de la ciudad de Spremberg. La planta, que está en operación desde septiembre de 2008, es propiedad de la empresa sueca Vattenfall AB, la cual ha invertido más de setenta millones de euros en el proyecto. Se trata de una planta piloto con tecnología de oxi-combustión, equipada también con una instalación de limpieza de gases de combustión para eliminar las cenizas volantes y el dióxido de azufre. La planta tiene una capacidad de 30 MW, y pretende servir de referencia para la construcción de plantas de mayor tamaño. En ella se producen a diario 240 toneladas de CO2, parte del cual se vende para usos comerciales y otra parte es transportado en camiones hasta un yacimiento de gas agotado en el que se está almacenando, también como experiencia piloto. Figura 7.2. Imágenes de la planta piloto de Vattenfall que incluye la tecnología CAC. De izquierda a derecha: vista de la planta, tanques de almacenamiento de CO2 y camiones para su transporte posterior. La planta se encuentra en Schwarze Pumpe, Alemania. (Gentileza de Vattenfall). –191– 1.2. Proyecto de CIUDEN-Compostilla Por su parte, el gobierno de España, a través de la Fundación Ciudad de la Energía (CIUDEN) ha puesto en marcha un programa de captura de CO2 que tiene como objetivo crear una planta experimental para investigar las distintas opciones tecnológicas de captura de CO2. Se trata de una planta piloto ubicada en Cubillos del Sil (León), en El Bierzo, una comarca históricamente ligada a la producción energética, especialmente mediante la minería y el empleo del carbón. Esta planta incorpora en su primera fase procesos de oxi-combustión. La instalación permite investigar con todo tipo de carbones e incorpora dos tecnologías distintas de oxicombustión, carbón pulverizado (CP) y lecho fluido circulante (LFC). De hecho, la primera planta piloto que investigará la oxicombustion con LFC a nivel mundial será precisamente ésta. La planta está dotada, además, de unidades de depuración de gases y sistemas de compresión y purificación del CO2. Sus características técnicas le proporcionan una gran flexibilidad y versatilidad funcional y la convierten en un centro de referencia mundial para el desarrollo y validación de las tecnologías que reúne. Figura 7.3. Planta piloto de CAC en el Bierzo, León, junto a la central térmica de Compostilla. (Gentileza de CIUDEN). –192– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual Como singularidades importantes se destacan que tiene dos calderas, una de carbón pulverizado, de 20 MW, y otra de lecho fluido circulante, de 30 MW de capacidad, así como un gasificador de biomasa de 3 MW de potencia, para ensayar vías innovadoras de utilización de biomasa sostenible. Actualmente, la planta está en avanzado estado de construcción, y se espera que esté operativa a finales de 2010 o en 2011. Figura 7.4. Estado actual de las obras de las obras de la planta piloto de El Bierzo (León), de la Ciudad de la Energía, CIUDEN. (Gentileza de CIUDEN). 1.3 La planta piloto de captura de CO2 y producción de H2 de ELCOGAS La primera planta del mundo para capturar el CO2 antes de su combustión en una central térmica, la planta piloto de ELCOGAS, en Puertollano. Esta planta tiene una capacidad de 14 MW y está ubicada dentro de las instalaciones de la central de Gasificación Integrada en Ciclo Combinado (GICC) de 335 MW eISO situada en Puertollano (Ciudad Real), también propiedad de la empresa ELCOGAS. La planta capturará 35.000 toneladas de CO2, produciendo 700 toneladas de H2 anualmente. Esta planta piloto forma parte del Proyecto Singular y de Carácter Estratégico PSE-CO2 desarrollado con la colaboración de la Universidad de Castilla-La Mancha (UCLM), CIEMAT e INCAR-CSIC dentro de la iniciativa española Tecnologías avanzadas de conversión, captura y almacenamiento de CO2 , con un presupuesto original de 18,5 millones de euros y que está siendo subvencionado por el Ministerio de Ciencia e Innovación y la Junta de Comunidades de Castilla-La Mancha. –193– ELCOGAS, S.A. se constituyó en abril de 1992 para llevar a cabo la construcción, explotación y comercialización del proceso industrial desarrollado, de una central de 335 MW eISO a instalar en Puertollano. Tiene como socios industriales Endesa, EDF, Iberdrola, Hidrocantábrico, Enel, EDP, Siemens, BWE, y Krupp Koppers. Figura 7.5. Vista general de la central GICC de 335 MW eISO de ELCOGAS, en Puertollano. (Gentileza de ELCOGAS). El objetivo que se persigue en ELCOGAS es validar a escala industrial, explorando alternativas a escala de laboratorio, las tecnologías de precombustión con producción de H2 en su planta de GICC. Para ello se debe demostrar la viabilidad de la captura de CO2 y producción de H2 en un GICC que emplea combustibles fósiles sólidos y residuos como fuente de alimentación principal, y obtener datos económicos reales y suficientes para escalar el proyecto a la capacidad total de producción de gas de síntesis del GICC de Puertollano. –194– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual El diseño de la central GICC de Puertollano se basa en el concepto de máxima integración entre sus tres unidades principales: una unidad de gasificación, que puede emplear como combustible una mezcla de carbón y coque, una unidad de ciclo combinado y una unidad de separación del aire. Dada la alta integración existente entre las tres unidades se obtiene una elevada eficiencia bruta. Otra de las características de esta central es la flexibilidad de alimentación ya que utiliza combustibles de bajo coste como carbón, coque de petróleo, biomasa, etc. Figura 7.6. Vista total de la planta piloto de captura de CO2 en ELCOGAS, Puertollano. (Gentileza de ELCOGAS). La puesta en marcha de la planta está prevista para mayo de 2010, con pruebas para obtener datos para diferentes condiciones de operación y grados de pureza en marzo de 2011. La experiencia de la planta GICC de Puertollano establece una base sólida para la cooperación internacional. Entre otras cosas, la experiencia de ELCOGAS está contribuyendo a la construcción de la primera planta de GICC con captura de CO2 en China, el proyecto GreenGen. La generación de energía de China está dominada por el poder del carbón (80%), y ha crecido en un 12-15% anual desde 2003. Sólo en 2005, la capacidad creció en 70 GW, lo que equivale a la capacidad total instalada en Gran Bretaña. Esta evolución ha hecho de China el mayor emisor mundial de gases de efecto invernadero, y en la actualidad está buscando tecnologías para reducir esas emisiones. –195– 2. Proyectos de CAC parcialmente financiados por la Unión Europea 2.1. Proyectos de I+D Durante los años 2002 a 2006 la Unión Europea financió, dentro del VI Programa Marco, varios proyectos de investigación y desarrollo relacionados con captura y almacenamiento de CO2. El coste total de esos proyectos ascendía a unos 130 millones de euros, de los cuales la Unión Europea financiaba aproximadamente 60 millones de euros. El objetivo era acelerar el desarrollo de la tecnología para que pudiera llegar antes al mercado. Algunos de los resultados obtenidos como consecuencia de esos proyectos son los que están permitiendo que hoy se puedan implementar tecnologías de CAC a nivel de planta piloto o planta demostración. En la tabla 7.1 se presenta un resumen de lo más significativo de esos proyectos, la información más completa aparece recogida en la referencia [3]. Tabla 7.1. Proyectos de investigación y desarrollo relacionados con CAC financiados por la Unión Europea en el VI Programa Marco [3]. –196– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual –197– –198– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual –199– –200– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual 2.2. El Programa Energético Europeo para la Recuperación y las tecnologías CAC El Parlamento Europeo y el Consejo adoptaron en 2009 el Reglamento (CE) nº 663/2009 1 [4] 1 donde se establece el Programa Energético Europeo para la Recuperación –PEER- (en inglés, European Energy Programme for Recovery, EEPR). El PEER es un instrumento financiero cuyo objetivo general es estimular la recuperación de la recesión que afecta a la economía de la UE y, al mismo tiempo, acercar la UE a cumplir la política energética y los objetivos climáticos, es decir, la seguridad y la diversificación de la energía, el funcionamiento del mercado interior de la energía y la reducción de emisiones de gases de efecto invernadero. Para lograr estos objetivos, el PEER está dotado con una dotación financiera de 3.980 millones de euros en apoyo de los tres sub-programas: 2.365 millones de euros para proyectos de infraestructura de electricidad; 565 millones de euros para proyectos de energía eólica marina; y 1.050 millones de euros para proyectos de captura y almacenamiento de CO2 . Las subvenciones pueden cubrir hasta el 50% de los costes de inversión subvencionables en el caso de gas e infraestructura eléctrica y proyectos, y hasta un 80% en el caso de la CAC. La Comisión aprobó conceder 1.000 millones de euros a seis proyectos de CAC, de los cuales 180 corresponden al proyecto de Endesa-Ciuden con cargo al Programa de Recuperación Económica de la Comisión Europea (PEER-2009). En la tabla 7.2 aparecen los seis proyectos de CAC originalmente seleccionados por la Unión Europea [4]. –201– Tabla 7.2. Proyectos originalmente aprobados por la UE para CAC, con cargo al plan PEER. –202– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual 2.3. Investigación aplicada sobre CAC en España: el proyecto CENIT_CO2 De entre los proyectos de investigación emblemáticos relacionados con la captura y almacenamiento de CO2 llevados a cabo en España cabe destacar el proyecto CENIT_CO2. Se trata de un consorcio de investigación entre empresas y centros públicos de investigación parcialmente financiado por el CDTI, perteneciente a los proyectos CENIT del programa Ingenio 2010 mencionados en el capítulo 1. El consorcio está integrado por 14 empresas industriales y 16 organismos de investigación, liderado por ENDESA Generación, con una participación relevante y co-liderazgo de Gas Natural Fenosa. El CENIT_CO2 tiene como objetivo principal la investigación, desarrollo y validación de nuevos conocimientos y soluciones integradas que permitan reducir las emisiones de CO2 a la atmósfera, emisiones generadas por la combustión de los combustibles fósiles en los procesos de generación eléctrica. El proyecto se divide en cinco módulos técnicos (eficiencia en combustión, captura en combustión, captura en post-combustión, almacenamiento, valorización) uno de gestión y uno de divulgación, cada uno de los cuales contiene líneas de proyecto principales y otros subproyectos. –203– Este proyecto ha tenido una duración de cuatro años, y ha dado lugar al desarrollo de nuevos conocimientos, patentes, publicaciones en revistas de prestigio internacional y nuevos proyectos, incluyendo plantas de demostración para probar las tecnologías desarrolladas. En la clausura oficial del proyecto en marzo de 2010 se presentaron los resultados más relevantes, entre los que cabe destacar [6], [7]: - Estudio de las distintas alternativas de utilización de biomasa: cocombustión directa, gasificación y utilización de combustibles líquidos. - Diseño e ingeniería de la instalación de ensayos de una planta de captura de CO2 utilizando ciclos de carbonatación-calcinación de 30 kWt. Dicha planta se encuentra situada en la central térmica de la Robla, propiedad de Gas Natural Fenosa. - Diseño e ingeniería de la instalación de ensayos de captura en postcombustión (de 3-5 toneladas de CO2 al día) ubicada en la central térmica de Compostilla, propiedad de Endesa. - Se han definido y establecido criterios de selección y caracterización de estructuras para el almacenamiento de CO 2 . Asimismo se ha desarrollado una metodología a partir de modelización y simulación para analizar el comportamiento del CO2 almacenado y la seguridad del almacén a largo plazo. - En la línea de valorización del CO2 se han conseguido varios resultados relevantes: Se han probado métodos para crear policarbonatos con glicerina y CO2 , la producción de metano con bacterias y la fijación de CO2 en esponjas de hierro para formar magnetita. Se han desarrollado procesos para la activación de carbones con gases de combustión, catalizadores para la hidrogenación del CO2 y aplicaciones para estimular el crecimiento de plantas en invernaderos. Se ha construido una instalación de ensayos para la captura de CO2 mediante microorganismos fotosintéticos. –204– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual 3. Proyectos sobre usos del CO2 En los capítulos 5 y 6 se han revisado algunas de las aplicaciones del CO 2 en usos directos, así como en usos biológicos y químicos. También en estos campos existen varios proyectos de investigación, desarrollo e implementación industrial. Entre ellos cabe mencionar los proyectos que se están ejecutando en varias partes del mundo relacionados con el crecimiento de algas a partir de CO 2 y su posterior uso para la extracción de productos de alto valor añadido. Así, por ejemplo, la empresa RWE ha construido una planta piloto de algas en Niederaussem (Alemania) para extraer varios productos finales. La planta ocupa un área de 600 m 2 , con un volumen total de 55.000 litros, de la cual se espera obtener 6.000 kg de biomasa por cada 12.000 kg de CO 2 capturado/evitado. Figura 7.7. Planta piloto de crecimiento de algas, uno de los usos biológicos del CO2, construida junto a la central térmica de RWE en Niederaussem, Alemania. –205– Asimismo, como se detalló en el capítulo 5, se están investigando a escala industrial nuevas aplicaciones del CO 2 supercrítico para reemplazar otros compuestos más perjudiciales con el medio ambiente. Entre los proyectos llevados a cabo en nuestro país donde varias empresas y centros de investigación están desarrollando tecnología a distintos niveles para usos del CO 2destacamos, además del CENIT_CO2, mencionado en el apartado anterior, el proyecto CENIT SOST-CO2, titulado «Nuevas utilizaciones industriales sostenibles del CO 2» [8]. El proyecto SOST-CO2 está parcialmente financiado por el CDTI dentro del programa Ingenio 2010, y tiene como objetivo abordar el ciclo de vida completo del CO 2 , desde su captura en las fuentes de emisión pasando por su transporte, su almacenamiento y su valorización a gran escala. El consorcio, liderado por Carburos Metálicos, está integrado por 15 empresas y 29 centros de investigación, abarcando sectores industriales tan diversos como gases, aguas, alimentación, energía, materiales e ingeniería, entre otros. Dispone de un presupuesto de más de 26 millones de euros, y una extensión de 4 años, desde 2008 hasta 2011. El proyecto está dividido en tres grandes bloques: captura, transformación y aprovechamiento del CO 2 . Dentro de cada bloque se definen varias actividades, incluyendo la fotosíntesis artificial, el crecimiento de algas como generación de biomasa y captura de CO 2 , y distintos usos directos del CO 2 en materiales, agua, alimentación, etc. En la figura 7.8 se muestra un esquema del proyecto. –206– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual Figura 7.8. Esquema del proyecto SOST-CO2 donde se detallan las actividades y las empresas que participan en cada una de ellas. –207– 4. Conclusiones En este capítulo hemos revisado muy brevemente algunos de los proyectos pioneros que se están llevando a cabo relacionados con la captura, el transporte, el almacenamiento y los usos del CO2. Como se ha venido analizando a lo largo del libro, existen tecnologías aplicables tanto a la captura como al almacenamiento y los usos del CO2. Hemos visto en este capítulo que tanto la Unión Europea como otros países han comenzado programas con fuentes de financiación importantes para acelerar el desarrollo e implementación de dichas tecnologías. Falta, sin embargo, una inversión económica mayor para su optimización y aplicación a escala industrial, haciendo los procesos económico y medioambientalmente viables en menor tiempo. –208– 7. Proyectos representativos en captura, almacenamiento y valorización del CO2: panorama actual 5. Bibliografía 1. R. S. HASZELDINE, «Carbon Capture and Storage: How Green Can Black Be?». Science, 325, 16471652, 2009. 2. Mapa con proyectos de CAC en operación, en construcción y planificados. <http://www.worldcoal.org/ carbon-capture-storage/ccs-map/>. 3. Informe de la Unión Europea «CO2 capture and storage projects», [ISBN 92-79-03724-2, ISSN 1018-5593, 2007]. Disponible en <http://ec.europa.eu/research/research-eu>. 4. Relación de proyectos concedidos por la Unión Europea con cargo al EEPR, disponible en: <http:// ec.europa.eu/energy/grants/2009_07_15_en.htm>. 5. Documento MEMO/09/542 publicado por la Unión Europea el 9 de diciembre de 2009. Disponible en: <http://europa.eu/rapid/pressReleasesAction.do?reference=MEMO/09/542>. 6. Presentación de resultados del proyecto CENIT_CO2. Información disponible en: <http://www.cenitco2. es/Members/aliciavd/News_Item.2010-03-30.2904>. 7. Comunicación personal del Dr. John Chamberlain, Gas Natural Fenosa. 8. Proyecto CENIT SOST-CO2, «Nuevas utilizaciones industriales sostenibles del CO2». <http://www. cenit-sostco2.com>. –209– –210– Glosario Glosario • Absorción química. Es la operación que consiste en la separación de uno o más componentes de una mezcla gaseosa con la ayuda de un solvente líquido con el cual forma solución (un soluto o varios se absorben de la fase gaseosa y pasan a la líquida). • Aleación. Es una mezcla sólida homogénea de dos o más metales, o de uno o más metales con algunos elementos no metálicos. Las aleaciones están constituidas por elementos metálicos en estado elemental (estado de oxidación nulo), por ejemplo Fe, Al, Cu, Pb. Pueden contener algunos elementos no metálicos por ejemplo P, C, Si, S, As. • Aminas. Son compuestos químicos orgánicos que se consideran derivados del amoniaco (NH3) y resultan de la sustitución de los hidrógenos de la molécula por los radicales alquilo (metilo, etilo, propilo, etc). Según se sustituyan uno, dos o tres hidrógenos, las aminas se denominan primarias, secundarias o terciarias. • Aragonita (o aragonito). Es una de las formas cristalinas del carbonato de calcio (CaCO3), junto con la calcita. Puede encontrarse en forma de estalactitas, y también en la concha de casi todos los moluscos y en el esqueleto de los corales. Entre sus variedades destaca la llamada flos-ferri, ‘flor de hierro’, que se asemeja a un coral. • Calcita. Es un mineral del grupo de los carbonatos, grupo V/B de la clasificación de Strunz. A veces se usa como sinónimo la palabra «caliza», aunque es incorrecto pues la caliza es una roca y no un mineral. Su nombre viene del latín calx, que significa ‘cal viva’. Es el mineral más estable que existe de carbonato de calcio, frente a los otros dos polimorfos con la misma fórmula química aunque distinta estructura cristalina: la aragonita y la vaterita, más inestables y solubles. –211– • Caldera. Es una máquina o dispositivo de ingeniería que está diseñado para generar vapor saturado. Éste se genera a través de transferencia de calor a presión constante, en la cual el fluido, originalmente en estado líquido, se calienta y cambia de estado. • Carbamatos (o uretanos). Son un grupo de compuestos orgánicos que comparten un mismo grupo funcional cuya estructura es –NH(CO)Lo–. Los carbamatos son ésteres del ácido carbámico, NH 2COOH, un compuesto inestable. • Carbonato de calcio. Es un compuesto químico muy abundante en la naturaleza, componente principal de las rocas en diferentes partes del mundo, y de las conchas y esqueletos de muchos organismos (p. ej. moluscos, corales) o de las cáscaras de huevo. Es la causa principal del agua dura. Su fórmula química es CaCO3. • Catalizador. Sustancia que está presente en una reacción química en contacto físico con los reactivos, y acelera, induce o propicia dicha reacción sin actuar en ella. • Ceramidas. Es una familia de lípidos. La ceramida se compone de un ácido graso unido mediante un enlace amida a una esfingosina, un alcohol insaturado de 18 carbonos. Es la molécula base de los esfingolípidos, muy abundantes en la bicapa lipídica de las membranas celulares. • Cultivos energéticos. Son plantaciones de crecimiento rápido que se realizan con el propósito específico de producir energía en alguna de sus formas: térmica, eléctrica o mediante su transformación en biocarburantes. • Disolventes. Son compuestos que pueden disolver o extraer otras sustancias. Se encuentran en forma líquida pero desprenden vapores. La vía de intoxicación más común es la respiratoria, sin embargo pueden producirse intoxicaciones por vía digestiva y cutánea. • Energía de activación. Valor de la energía que es necesario aplicar (en forma de calor, electricidad o radiación) para que dos moléculas determinadas colisionen y se produzca una reacción química. • Enzimas. Son moléculas de proteínas que tienen la capacidad de facilitar y acelerar las reacciones químicas que tienen lugar en los tejidos vivos, disminuyendo el nivel de la «energía de activación» propia de la reacción. Generalmente, las enzimas se nombran añadiendo el sufijo -asa a la raíz del nombre de la sustancia sobre la que actúan. • Espiráculo. Es un orificio respiratorio presente en el tegumento o tejido de los insectos, los arácnidos y otros animales con respiración traqueal. –212– Glosario • Estalactita. Procede del griego stalaktos, ‘gota’. Es un tipo de estructura natural que cuelga del techo o de la pared de una cueva. Se forma como resultado de los depósitos minerales continuos transportados por el agua que se filtra en la cueva, en especial los de bicarbonato cálcico que precipitan en carbonato cálcico y se deposita formando la estalactita. • Estalagmita. Es una estructura natural como la estalactita, pero formada en el suelo de las cuevas, en lugar de en los techos. • Exudación. Proceso que consiste en la salida de un líquido de un cuerpo (o del recipiente en que está contenido), por transpiración o a través de sus rendijas. • Fotosíntesis artificial. Proceso o serie de procesos que intentan imitar la fotosíntesis natural de las plantas con el fin de convertir dióxido de carbono y agua en carbohidratos y en oxígeno, utilizando para ello la luz del sol. • Gasificación. Es un proceso termoquímico en el que un sustrato carbonoso (carbón, biomasa, plástico) es transformado en un gas combustible mediante una serie de reacciones que ocurren en presencia de un agente gasificante (aire, oxígeno, vapor de agua o hidrógeno). • Glaciar. Es una gruesa masa de hielo que se origina en la superficie terrestre por acumulación, compactación y recristalización de la nieve, mostrando evidencias de flujo en el pasado o en la actualidad. Su existencia es posible cuando la precipitación anual de nieve supera la evaporada en verano, por lo cual la mayoría se encuentra en zonas cercanas a los polos, aunque existen en otras zonas montañosas. El proceso del crecimiento y establecimiento del glaciar se llama glaciación. Consta de tres partes: cabecera o circo, lengua y valle o zona de ablación. • Hidrofílico (o hidrófilo). Procede de la palabra griega hydros, ‘agua’ y philia, ‘amistad’; es el comportamiento de toda molécula que tiene afinidad por el agua. • Hidrofobia. Proviene del griego, donde se combinan las palabras hydros, ‘agua’ y fobia, ‘horror’. Por lo tanto, una sustancia hidrófoba es la que repele el agua. • Hidróxido de calcio. También conocido como cal muerta y/o cal apagada, es un hidróxido cáustico de fórmula Ca(OH)2 . Se presenta en forma de cristal incoloro o polvo blanco, obtenido al reaccionar óxido de calcio con agua. • Luteína. Es un pigmento amarillo de la familia de los carotenoides que se encuentra en las algas, caléndula, guisantes, puerros, arándanos, brócoli, yema de huevo, espinacas, acelga, repollo, col, maíz, tomate, plátano, perejil, apio, patata blanca, flor de calabaza y naranja. La yema de huevo posee un 85% de luteína, el maíz un 60% y el brócoli un 20%. La luteína tiene propiedades antioxidantes lo que hace que sus posibles usos terapéuticos sean muy diversos. –213– • Macroalgas. Microorganismos fotosintéticos. Son algas marinas multicelulares, y por lo tanto se diferencian de las algas microscópicas en su tamaño. • Microalgas. Microorganismos fotosintéticos. En general son los conversores de energía solar más eficientes debido a su sencilla estructura celular. Además, al estar suspendidas en agua, tienen un mejor acceso al CO2 y otros nutrientes que las macroalgas. • Micronización. Es el proceso de reducción del tamaño de las partículas de un material sólido a un diámetro de unas pocas micras (10 –6 metros). Sin embargo, los usos modernos (generalmente en la industria farmacéutica) requieren unos diámetros medios a escala nanométrica (10 –9 metros). • Polimorfismo (en ciencia de los materiales y en mineralogía). Capacidad de un material sólido de existir en más de una forma o estructura cristalina, todas ellas con la misma composición de elementos químicos. Por ejemplo, el diamante y el grafito son polimorfos del carbono. • Prostaglandinas. Son un conjunto de sustancias de carácter lipídico derivadas de los ácidos grasos de 20 carbonos (eicosanoides), que contienen un anillo ciclopentano y constituyen una familia de mediadores celulares, con efectos diversos, a menudo contrapuestos. Los bioquímicos Sune K. Bergström, Bengt I. Samuelsson y John R. Vane recibieron conjuntamente en 1982 el Premio Nobel en Fisiología y Medicina por sus investigaciones sobre estas sustancias. • Roca ígnea. Del latín ignis, ‘fuego’. Se forma cuando el magma (roca fundida) se enfría y se solidifica. • Serpentín. Se denomina serpentín o serpentina a un tubo de forma frecuentemente espiral que suele utilizarse para enfriar vapores provenientes de la destilación en un calderín y así condensarlos en forma líquida. Acostumbra a ser de vidrio, cobre u otro material que conduzca el calor fácilmente. • Sublimación. Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. • Tecnologías de captura, transporte y almacenamiento de CO 2 (CAC). Son aquellas tecnologías desarrolladas para capturar («atrapar») el CO2 de las corrientes gaseosas emitidas durante la producción de electricidad, procesos industriales o procesado de combustibles, acondicionarlo para su almacenamiento, y transportarlo y almacenarlo de manera permanente bajo tierra, evitando así su emisión a la atmósfera. –214– Glosario • Tensoactivos (o tensioactivos). Son sustancias que influyen por medio de la tensión superficial en la superficie de contacto entre dos fases (p. ej., dos líquidos insolubles uno en otro). Cuando se utilizan en la tecnología doméstica se les denomina emulgentes o emulsionantes, esto es, sustancias que permiten conseguir o mantener una emulsión. • Termoformado. Proceso que consiste en dar forma a una lámina plástica por medio de calor (120 °C a 180 °C) y vacío (600 a 760 mm/hg) utilizando un molde o matriz (madera, resina epóxica o aluminio). • Tromboxanos. Son el resultado principal de la acción de la enzima ciclooxigenasa sobre el ácido araquidónico. Se trata de un conjunto de hormonas con efecto autocrino y paracrino, sintetizadas a partir del ácido araquidónico que, al igual que las prostaglandinas y leucotrienos, están demostrando recientemente sus importantes funciones. Su principal función biológica es participar en la hemostasia, es decir en los procesos de coagulación y agregación plaquetaria. –215– –216– Índice de figuras Índice de figuras 1.1. Diagrama de fases del CO2 en función de la presión y la temperatura donde se muestran las distintas fases en equilibrio y el CO2 supercrítico ................................................................ 15 1.2. Esquema donde se muestra el ciclo del carbono. Se recogen los intercambios de CO2 entre los distintos reservorios tanto en el ciclo biológico como en el biogeoquímico ........ 17 1.3. Distintas fuentes de producción de CO2 ........................................................................................................... 18 1.4. Algunas aplicaciones actuales del CO2 en distintos sectores ..................................................................... 19 1.5. Concentración de dióxido de carbono en la atmósfera en los últimos 400.000 años. El círculo rojo de la derecha enmarca la concentración en los últimos 1.000 años, ampliado en la parte superior de la gráfica [5] ............................................................................................... 23 1.6. Concentración de CO2 en la atmósfera, en partes por millón (ppm) en el eje izquierdo (línea azul) y aumento de la temperatura media, en el eje vertical derecho, en función de la temperatura (línea roja), en los últimos 1.000 años [2] ........................................................................... 24 1.7. Avances tecnológicos destacados en los últimos siglos y su relación con la concentración de CO2 en la atmósfera (figura adaptada con el permiso de M. Maroto-Valer, U. Nottingham) ....................................................................................................................... 26 1.8. Correlación entre el consumo de electricidad por habitante y año (kWh) en 2002 y el índice del desarrollo humano en 2003 [6] ........................................................................................................ 27 1.9. El desarrollo sostenible y su relación con el desarrollo económico, social y ecológic ..................... 28 1.10. Comparación de gases de efecto invernadero emitidos en la Europa de los 27 frente a los emitidos por España en el periodo 1990-2007, referidos a 1990 [12] ...................................................... 33 1.11. Ejemplos de fuentes de emisión de CO2 y otros gases de efecto invernadero: central térmica de carbón (sector energía), vehículos ligeros (sector transporte) y planta industrial de producción de cemento (sector industrial) ................................................................ 35 1.12. Crecimiento actual y previsible de las emisiones anuales de CO2. (Adaptación de la referencia [13])....................................................................................................................... 37 1.13. Emisiones de CO2 por año frente al año en que se emiten, mostrando el triángulo de estabilización .................................................................................................................. 39 1.14. Triángulo de estabilización y sus siete cuñas........................................................................................ 40 1.15. Una posible cuña de estabilización del triángulo de Pacala y Socolow [14] ..................................... 41 2.1. Esquema de una central térmica de carbón para producir electricidad ............................................ 47 2.2. Central térmica de Meirama, propiedad de Gas Natural Fenosa, en La Coruña. (Cortesía de Gas Natural Fenosa)... ........................................................................................................ 48 2.3. Planta de ciclo combinado de gas natural, propiedad de Gas Natural Fenosa, en Arrúbal, La Rioja. (Cortesía de Gas Natural Fenosa)... .................................................................... 50 –217– 2.4. Configuraciones de sistemas de captura de CO2, adaptado del informe del Panel Internacional para el Cambio Climático (IPCC) [3] ..................................................................... 53 2.5. Esquema simplificado de un proceso de captura en post-combustión ............................................. 55 2.6. Purificación de gas natural: separación de CO2 por aminas y almacenamiento de CO2 (en Salah, Argelia). La foto de la derecha muestra las torres de absorción de aminas. ............................................................................................................................... 56 2.7. Esquema simplificado de un proceso de captura de CO2 en pre-combustión. ................................. 57 2.8. Planta de Gasificación Integrada de Ciclo Combinado de ELCOGAS, en Puertollano, España. (Cortesía de ELCOGAS) ................................................................................. 58 2.9. Esquema simplificado de un proceso de captura de CO2 con oxi-combustión... ............................. 59 2.10. Torre de absorción de aminas para captura de CO2, de Mitsubishi Heavy Industries Ltd, una de las empresas que comercializa torres de separación por aminas para aplicaciones industriales ......................................................................................................................... 61 2.11. Planta piloto de separación de CO2 con amoniaco enfriado en Pleasant Prairie, Wisconsin (Estados Unidos) [10] ............................................................................................................ 62 2.12. Planta de gas natural en SandRidge que captura el CO2 mediante el proceso Selexol® ................ 63 2.13. Proceso de adsorción/absorción del CO2 con recuperación del sorbente ......................................... 64 2.14. Proceso de separación de CO2 por destilación criogénica .................................................................. 65 2.15. Proceso de separación de CO2 por membrana ..................................................................................... 66 2.16. Proceso de separación de CO2 por ciclos de carbonatación-calcinación.... ...................................... 67 2.17. Planta piloto de carbonatación-calcinación para captura de CO2 diseñada e instalada en el Instituto Nacional del Carbón, del Consejo Superior de Investigaciones Científicas (INCAR-CSIC). (Gentileza del INCAR-CSIC) ......................................................................... 68 3.1. Inyector de CO2 a alta presión usado en el campo de Weyburn, Canadá .......................................... 72 3.2. Distintos medios de transporte de CO2: gasoducto, buque y camión cisterna ................................. 73 3.3. Gasoductos de gas natural en operación fabricados con acero al carbono-manganeso ................ 75 3.4. Posibles lugares de almacenamiento de CO2, incluyendo almacenamiento en acuíferos salinos profundos, reservas agotadas de petróleo o gas, depósitos de carbón no explotables y almacenamiento oceánico (adaptada del IPCC [1])................................................. 77 3.5. Esquema de la recuperación asistida de petróleo (EOR) mediante inyección de CO2 ..................... 80 3.6. Vista parcial del campo de Weyburn, donde se inyecta CO2 para recuperar petróleo mediante la técnica EOR .......................................................................................................... 81 3.7. Localización en el mapa del gasoducto desde el lugar donde se captura el CO2, en Dakota del Norte, Estados Unidos, hasta donde se inyecta, en Weyburn, Canadá..................... 82 –218– Índice de figuras 3.8. Esquema donde se muestran los componentes de un acuífero salino profundo: roca sello impermeable, agua salina no apta para consumo humano, espacio de poros y granos de arena permeable ................................................................................................................. 83 3.9. Plataforma de Sleipner donde se extrae gas natural. El CO2 separado de dicho gas natural se inyecta en la formación Utsira [10] ............................................................................... 84 3.10. Extracción de gas natural con captura de CO2 e inyección en el acuífero salino de Utsira (Statoil) [7] ................................................................................................................................ 85 3.11. Recuperación de metano a partir de la inyección de CO2 en capas de carbón inexplotables ......... 87 3.12. Posible almacenamiento oceánico de CO2 [1]....................................................................................... 88 3.13. Esquema del procedimiento de búsqueda de emplazamientos para posibles almacenes de dióxido de carbono ............................................................................................................................. 89 3.14. Procesos que tienen lugar a lo largo del tiempo en un emplazamiento geológico donde se encuentre almacenando CO2 a gran escala [2] ................................................................................ 90 3.15. Extensión de la pluma de CO2 en el sitio de Sleipner. Se muestran las amplitudes totales y acumuladas por capas a lo largo de 10 años. El mapa se obtiene a partir de técnicas sísmicas y de modelización (adaptada de StatoilHydro [10]).............................................................. 91 3.16. Costes de las tres etapas del CAC a partir de las estimaciones del IPCC [1] ..................................... 94 3.17. Efecto del coste de captura de CO2 en función de la escala de la planta (adaptada de [11]). .......... 95 3.18. Representación del CO2 evitado y CO2 capturado en una planta con CAC. Las líneas azules indican las dos posibles optimizaciones de la planta............................................. 97 4.1. Representación de las distintas tecnologías disponibles o en vías de desarrollo para evitar las emisiones de CO2 a la atmósfera .................................................................................................... 102 4.2. Especies de microalgas (organismos fotosintéticos) eficientes conversores de energía solar y captación de CO2. A la izquierda se muestra la Spirulina platensis [3], a la derecha aparece Chlorella fusca [4], ambas se investigan en la actualidad para cultivos energéticos. ..... 106 4.3. Esquema del proceso de fotosíntesis natural y fotosíntesis artificial .............................................. 107 4.4. Fotografía de un laboratorio donde se investiga el crecimiento de distintos microorganismos fotosintéticos ........................................................................................................... 108 4.5. Planta de producción de CO2 a partir de la combustión de fuel, situada en Canarias. (Gentileza de Carburos Metálicos) ....................................................................................................... 110 4.6. Esquema de la reacción de producción de hidrógeno a partir del reformado con vapor de gas natural que incluye una unidad de captura de CO2..................................................... 112 4.7. Depósito de almacenamiento de CO2 en la Pobla de Mafumet, propiedad de Carburos Metálicos, del grupo Air Products. (Gentileza de Carburos Metálicos) ........................... 112 4.8. Planta de producción de CO2 a partir de la producción de amoníaco en Palos de la Frontera, Huelva. (Gentileza de Carburos Metálicos) ......................................................................... 113 4.9. La huella del carbono como medida del impacto ambiental ............................................................ 115 –219– 4.10. Procesos involucrados en el ciclo de vida de un armario, desde la materia prima hasta el material de desecho........................................................................................................................... 116 5.1. Agua carbonatada donde se observa el burbujeo de las moléculas de CO2 ................................... 122 5.2. Bebidas carbonatadas con distintos saborizantes.............................................................................. 124 5.3. Ejemplos de bebidas alcohólicas que contienen CO2: cerveza, cava y vino.... ................................ 125 5.4. Queso Afuega’l Pitu, con denominación de origen asturiana..... ...................................................... 126 5.5. Laboratorio de envasado en atmósfera protectora. (Gentileza de Carburos Metálicos y el IRTA de Cabrils) .................................................................................................................................. 128 5.6. Distintos tipos de alimentos envasados en atmósfera protectora: verduras, aperitivos como patatas chips, panadería y bollería, carne, pescado, fruta fresca variada............................. 129 5.7. Alimentos infectados por determinadas plagas de insectos. (Gentileza del IRTA-Cabrils, autor: Jordi Riudavets) .......................................................................................................................... 131 5.8. Alimentos que pueden ser tratados con atmósfera modificada con CO2 para su desinsectación. (Gentileza de Carburos Metálicos)...... ...................................................................... 132 5.9. Formas de almacenamiento de productos alimentarios a los que puede aplicarse la atmósfera modificada con CO2 para su desinsectación: silos, big bags y palés ........ 133 5.10. Autoclave para el tratamiento a presión que permite eliminar de manera rápida las plagas de las materias primas. (Gentileza Carburos Metálicos) ....................................................... 134 5.11. Animales que deben ser aturdidos antes de ser sacrificados para el consumo humano [14].......135 5.12. Carnes congeladas con nieve carbónica ............................................................................................. 137 5.13. Algunos disolventes orgánicos comunes: acetona, aguarrás, glicol, tolueno ................................ 139 5.14. Equipos de laboratorio para la investigación con CO2 supercrítico situados en el centro de investigación MATGAS, en Barcelona. A la izquierda se presentan dos reactores de 250 y 300 ml, respectivamente, mientras que a la derecha se muestra una planta piloto de laboratorio. (Gentileza de MATGAS)............................................................................................... 140 5.15. Productos naturales a los que se les aplica la técnica de extracción con CO2 supercrítico para obtener la cafeína. Café (izquierda) y té verde (derecha)....... ................................................... 141 5.16. Resultado del proceso de extracción del pigmento de la caléndula. De izquierda a derecha, harina de caléndula antes y después del tratamiento con CO2 supercrítico, y pigmento extraído. (Gentileza de MATGAS)......................................................................................................... 142 5.17. Fotos de algunos de los equipos que componen las instalaciones de Altex, en Paterna, Valencia. (Gentileza de Altex)................................................................................................................ 144 5.18. Tapones de corcho DIAM tratados con la tecnología de fluidos supercríticos para la extracción de los TCA ............................................................................................................................ 145 5.19. Instalaciones para el tratamiento de tapones de corcho con CO2 supercrítico de la empresa Corchos de Mérida, en San Vicente de Alcántara, Badajoz. (Gentileza de Corchos de Mérida) ........................................................................................................ 145 –220– Índice de figuras 5.20. Dos lavadoras comerciales que utilizan la tecnología de CO2 supercrítico para la limpieza de ropa en seco [28]......... ...................................................................................................................... 146 5.21. Ejemplo de aplicación de extracción con CO2 supercrítico en el sector textil: desengrasado de piel. (Gentileza de MATGAS)......... ......................................................................... 147 5.22. Nanopartículas obtenidas por precipitación en CO2 supercrítico [31].............................................. 148 5.23. Polímeros impregnados con CO2 supercrítico. Las dos imágenes de la izquierda corresponden a polietileno (PE) impregnado con triclosan [33]; a la derecha, polimetacrilato de metilo (PMMA) con colorante azul. (Gentileza de MATGAS) ............................ 150 5.24. Expansión de polipropileno (PP) en CO2 supercrítico. A la izquierda se presenta el material antes de la expansión, a la derecha aparece el material expandido jugando con las temperaturas de transición vítrea, temperaturas de termoformado y la presión. (Gentileza de MATGAS) ......................................................................................................................... 150 5.25. Gota de agua en una superficie nanométrica de TiO2. Izquierda: gota sobre la superficie hidrófila; derecha: gota sobre la superficie hidrófoba tratada usando el método de silanización en CO2 supercrítico. (Gentileza de C. Domingo, ICMAB-CSIC)..................................... 151 5.26. Ejemplos de consumo de agua en los tres sectores: industrial, agrícola y doméstico .................. 152 5.27. Vertido de aguas contaminadas ........................................................................................................... 153 5.28. Detalle de una estación depuradora de aguas residuales (EDAR).................................................... 154 5.29. Neutralización de aguas residuales con CO2. A la izquierda, esquema del proceso, a la derecha, equipo Neutrocar-F, comercializado por Carburos Metálicos, del grupo Air Products ............................................................................................................................................ 156 5.30. Fotografía de una fuente de agua apta para el consumo humano................................................... 157 5.31. Planta potabilizadora de agua situada en Barberá del Vallés, Barcelona. Propiedad de Veolia ............................................................................................................................... 158 5.32. Piscinas y spas que pueden ser tratadas con CO2 .............................................................................. 159 6.1. Macroalga, microalga de agua salada y microalga de agua dulce................................................... 166 6.2. Imagen del alga unicelular Botryococcus braunii, utilizada para la extracción de biodiésel ........ 167 6.3. Producción industrial de microalgas en sistemas tipo carrusel, llevada a cabo por la empresa Petroalgae, en Florida (Estados Unidos) ......................................................................... 168 6.4. Fotobiorreactores para la producción de microalgas ........................................................................ 168 6.5. Urea cristalina preparada comercialmente ......................................................................................... 173 6.6. Distintas aplicaciones de la urea y de las resinas de urea-formaldehido, producida a partir del CO2........................................................................................................................................ 173 6.7. Ácido acetilsalicílico en su forma cristalina (izquierda), y como producto final en la aspirina (derecha)............................................................................................................................... 174 –221– 6.8. Distintas imágenes de carbonato cálcico en forma de calcita y aragonita................. ..................... 175 6.9. Formación caliza de origen hidrotermal en Pamukkale, Turquía.................. .................................... 176 6.10. Distintas formas de carbonato cálcico encontradas en la naturaleza. Izquierda: estalactitas y estalagmitas en la gruta de las Maravillas (Aracena, España), y cuevas de mármol (Puerto Tranquilo, Chile).................. ..................................................................... 176 6.11. Dos fotografías de dolomita, transparente y negra (teruelita) .......................................................... 177 6.12. Carbonato de sodio obtenido químicamente usando CO2 ................................................................ 177 6.13. Distintas aplicaciones industriales del carbonato cálcico.................... .............................................. 178 6.14. Policarbonato cristalino sintetizado industrialmente ......................................................................... 179 6.15. Algunos materiales fabricados a partir de policarbonato ................................................................. 180 6.16. Horno donde se inicia la concentración del calor solar necesario para llevar a cabo la reacción del proceso solar-to-petrol. (Cortesía de los Laboratorios Nacionales de Sandia, Estados Unidos) ..................................................................................................................................... 182 6.17. Nanotubos de dióxido de titanio, materiales desarrollados para la reducción fotocatalítica del CO2 (Gentileza de Carburos Metálicos e IREC) [14]..................... .......................... 183 6.18. Vehículos de combustible flexible actualmente en el mercado..................... ................................... 184 6.19. Dos dispositivos que funcionan con baterías de metanol: ordenador (Fujitsu) y teléfono móvil (Toshiba) ...................................................................................................... 184 7.1. Plantas de demostración e industriales programadas en todo el mundo. El tamaño de los círculos representa la cantidad de CO2 que se capturará. Figura adaptada del artículo de revisión de Haszeldine [1]...................... ............................................................................ 190 7.2. Imágenes de la planta piloto de Vattenfall que incluye la tecnología CAC. De izquierda a derecha: vista de la planta, tanques de almacenamiento de CO2 y camiones para su transporte posterior. La planta se encuentra en Schwarze Pumpe, Alemania. (Gentileza de Vattenfall .......................................................................................................................... 191 7.3. Planta piloto de CAC en el Bierzo, León, junto a la central térmica de Compostilla. (Gentileza de CIUDEN)........................ ................................................................................................... 192 7.4. Estado actual de las obras de las obras de la planta piloto de El Bierzo (León), de la Ciudad de la Energía, CIUDEN. (Gentileza de CIUDEN)......................... ................................... 193 7.5. Vista general de la central GICC de 335 MW eISO de ELCOGAS, en Puertollano. (Gentileza de ELCOGAS) ....................................................................................................................... 194 7.6. Vista total de la planta piloto de captura de CO2 en ELCOGAS, Puertollano. (Gentileza de ELCOGAS) ....................................................................................................................... 195 7.7. Planta piloto de crecimiento de algas, uno de los usos biológicos del CO2, construida junto a la central térmica de RWE en Niederaussem, Alemania ................................... 205 7.8. Esquema del proyecto SOST-CO2 donde se detallan las actividades y las empresas que participan en cada una de ellas........................ ........................................................... 207 –222– Índice de tablas Índice de tablas 2.1. Concentración de CO2 en las corrientes de salida y relación entre kWh producido y CO2 dependiendo del tipo de central generadora de electricidad............................................................. 50 2.2. Principales industrias y sus emisiones de CO2. (Datos referidos a 1997) [1] ......................................... 51 3.1. Capacidad estimada de los almacenes naturales de CO2 [5]...................................................................... 78 3.2. Componentes del proceso de CAC, con las fases de desarrollo de las mismas .................................. 92 4.1. Tecnologías disponibles y complementarias para reducir las emisiones de CO2 a la atmósfera [1] ..................................................................................................................................... 103 4.2. Ejemplos de aplicaciones tecnológicas en las que se usa el CO2 junto con el producto al que sustituye en dicha aplicación [1] .......................................................................................................... 105 5.1. Comparación entre el tiempo de vida útil de varios productos alimentarios envasados en aire o con atmósfera modificada [8].. ........................................................................................................ 130 6.1. Usos del CO2 en la industria química por síntesis de compuestos orgánicos [7] .............................. 172 7.1. Proyectos de investigación y desarrollo relacionados con CAC financiados por la Unión Europea en el VI Programa Marco [3]... ................................................................................. 196 7.2. Proyectos originalmente aprobados por la UE para CAC, con cargo al plan PEER ........................ 202 –223–