1.2.4. ESPECTROS DE EMISIÓN Y SERIES ESPECTRALES
Anuncio
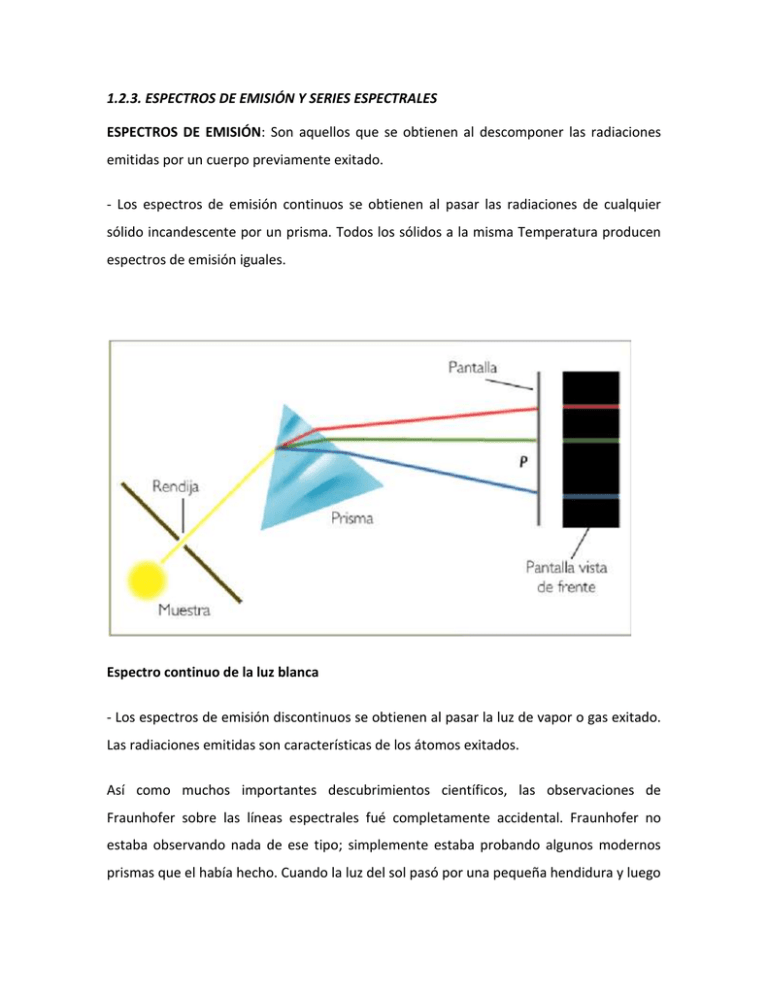
1.2.3. ESPECTROS DE EMISIÓN Y SERIES ESPECTRALES ESPECTROS DE EMISIÓN: Son aquellos que se obtienen al descomponer las radiaciones emitidas por un cuerpo previamente exitado. - Los espectros de emisión continuos se obtienen al pasar las radiaciones de cualquier sólido incandescente por un prisma. Todos los sólidos a la misma Temperatura producen espectros de emisión iguales. Espectro continuo de la luz blanca - Los espectros de emisión discontinuos se obtienen al pasar la luz de vapor o gas exitado. Las radiaciones emitidas son características de los átomos exitados. Así como muchos importantes descubrimientos científicos, las observaciones de Fraunhofer sobre las líneas espectrales fué completamente accidental. Fraunhofer no estaba observando nada de ese tipo; simplemente estaba probando algunos modernos prismas que el había hecho. Cuando la luz del sol pasó por una pequeña hendidura y luego a través del prisma, formó un espectro con los colores del arco iris, tal como Fraunhofer esperaba, pero para su sorpresa, el espectro contenía una serie de líneas oscuras. ¿Líneas oscuras? Eso es lo opuesto de todo lo que hemos venido hablando. Usted me ha dicho que los diferentes elementos crean una serie de líneas brillantes a determinadas longitudes de onda. Eso es lo que ocurre cuando un elemento es calentado. En términos del modelo de Bohr, el calentar los átomos les dá una cierta energía extra, así que algunos electrones pueden saltar a niveles superiores de energía. Entonces, cuando uno de estos electrones vuelve al nivel inferior, emite un fotón—en una de las frecuencias especiales de ese elemento, por supuesto. Y esos fotones crean las líneas brillantes en el espectro que usted me mostró. Exactamente—eso es lo que se llama espectro de emisión. Pero hay otra forma en que un elemento puede producir un espectro. Suponga que en lugar de una muestra calentada de un elemento, usted tiene ese mismo elemento en la forma de un gas relativamente frío. Ahora, digamos que una fuente de luz blanca—conteniendo todas las longitudes de onda visibles—es dirigida al gas. Cuando los fotones de la luz blanca pasan a través del gas, algunos de ellos pueden interactuar con los átomos—siempre que tengan la frecuencia apropiada para empujar un electrón de ese elemento hasta un nivel superior de energía. Los fotones en esas frecuencias particulares son absorbidos por el gas. Sin embargo, como usted lo anotó antes, los átomos son “transparentes” no lei esto y no me fije que esta editado a proposito para exponerme a los fotones de otras frecuencias… Entonces todas las otras frecuencias saldrían intactas del gas. Así, el espectro de la luz que ha pasado a través del gas tendría algunos “agujeros” en las frecuencias que fueron absorbidas. Es correcto. El espectro con estas frecuencias faltantes se llama espectro de absorción. (Note que las líneas oscuras en un espectro de absorción aparecen en las mismas exactas frecuencias de las líneas brillantes en el correspondiente espectro de emisión.). Y eso fué lo que vió Fraunhofer? Si. Bajo un cuidadoso exámen, el espectro “continuo” del sol resultó ser un espectro de absorción. Para llegar a la tierra, la luz del sol necesita pasar a través de la atmósfera del sol, que está mucho más fría que la parte del sol en que la luz es emitida. Los gases en la atmósfera del sol absorben ciertas frecuencias, creando las cerca de 600 líneas oscuras que Fraunhofer observó. (Se llaman líneas de Fraunhofer, en su honor.) Sin embargo, Fraunhofer nunca supo de todo esto. Nadie pudo ofrecer una explicación de las líneas espectrales hasta algunas décadas más tarde. SERIES ESPECTRALES Las diferentes líneas que aparecieron en el espectro del hidrógeno se podían agrupan en diferentes series cuya longitud de onda es más parecida; • Serie Lyman: zona ultravioleta del espectro. • Serie Balmer: zona visible del espectro. • Serie Paschen zona infrarroja del espectro. • Serie Bracket: zona infrarroja del espectro. • Serie Pfund: zona infrarroja del espectro. ESPECTRO: Del latín spectrum (imagen), se puede definir el e. en Física como una sucesión ordenada de radiaciones (v.) electromagnéticas.
