UNIDAD 6 Diseño del cuaderno de recogida de datos
Anuncio

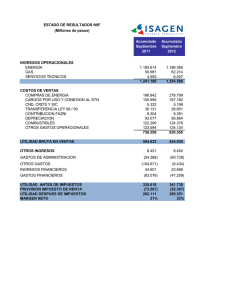
UNIDAD 6 Diseño del cuaderno de recogida de datos (CRD) Rosa Arboix Diplomada en Informática. Q.F.Bayer, SA. Gestora de datos clínicos Esta unidad temática del curso Monitorización de ensayos clínicos pretende ofrecer al alumno una serie de recomendaciones básicas para el diseño del cuaderno de recogida de datos, tanto en lo que se refiere a contenido y estructura como a formato. Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Durante la fase de diseño de cualquier ensayo clínico, es necesario prever algún sistema de recolección de datos. Las nuevas tecnologías han abierto nuevas posibilidades que permiten capturar los datos y almacenarlos directamente en soportes electrónicos. Su uso en el mundo de la investigación clínica está cada vez más extendido, y existen pocas dudas de que acabarán siendo de uso sistemático en pocos años. La unidad temática 16, Captura electrónica de datos, está dedicada a hablar de estas posibilidades. A pesar de ello, hoy por hoy, el sistema más habitual para organizar la recolección de los datos de un ensayo clínico sigue siendo el cuaderno de recogida de datos o CRD (en inglés Case Record Form o CRF). Dichos CRD no son mas que un conjunto de formularios de papel convenientemente encuadernados, que permiten (o habrían de permitir) el registro de toda la información necesaria para poder analizar los resultados de un ensayo clínico. El diseño del CRD es una tarea con mayor importancia de la que a veces se le concede. Por un lado, los resultados de un ensayo clínico dependen de los datos. Datos de mala calidad (incompletos, equivocados o distorsionados) producirán resultados de dudosa credibilidad. Por otro, la calidad de los datos depende de la calidad del CRD. Un CRD mal diseñado puede propiciar errores a la hora de cumplimentarlo por parte de su usuario. Si bien el diseño de formularios de registro de datos es una tarea genéricamente importante en cualquier área de investigación aplicada, lo es particularmente en la investigación clínica. La razón es que los usuarios del CRD no son (como ocurre en otras áreas de investigación) ‘encuestadores profesionales’ habituados a cumplimentar escrupulosamente los formularios que se les facilita. Adicionalmente, la presión asistencial a la que están sometidos y el conocimiento a veces superficial del protocolo del estudio, propician los errores al cumplimentar el CRD. Por tanto, es fundamental que el diseño del mismo facilite al máximo esta tarea en lugar de dificultarla y generar frustración en el investigador. Esta unidad temática pretende ofrecer al alumno una serie de recomendaciones básicas para el diseño de CRD, tanto en lo que se refiere a contenido y estructura como a formato. 2 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 1. El CRD como vehículo de datos El CRD no sólo sirve para capturar los datos sino que también hace las funciones de un almacén y de un vehículo para transportar los datos desde la fuente original (el paciente) hasta la base de datos que habrá que analizar. Tras su cumplimentación en un centro asistencial, los CRD se trasladarán a un centro de proceso de datos. Allí se incorporarán a una base de datos (soporte electrónico) de manera que podamos acceder fácilmente a ellos para analizarlos. Durante este camino, distintos profesionales tendrán que trabajar con el CRD. 3 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 2. Implicaciones del diseño del CRD para distintos profesionales del ensayo clínico Además del usuario más obvio (el investigador que lo cumplimentará), los monitores, los grabadores de datos, los gestores de datos y los estadísticos, necesitarán utilizar el CRD: Los monitores deben revisar los datos que ha registrado el investigador en el CRD con distintas finalidades como: • • Verificar su autenticidad comparándolos con la historia clínica del paciente. Verificar que todos los datos solicitados han sido cumplimentados y que no hay datos contradictorios o inconsistentes. Los gestores de datos deben: • • • Preparar una base de datos que permita alojarlos y, en gran medida, la estructura de esta base de datos vendrá condicionada por la estructura del CRD. Preparar un plan de validación de datos, es decir, un conjunto de reglas lógicas que se aplicarán a los datos, una vez grabados, con objeto de identificar posibles errores, carencias o inconsistencias en los datos. Todos los datos potencialmente problemáticos tendrán que verificarse en el CRD para descartar posibles errores de transcripción durante la grabación. Los grabadores de datos no hacen otra cosa que enfrentarse a CRD cumplimentados y transcribir los datos a la base de datos del estudio. Cuando el estadístico analiza los datos, el CRD es una referencia obligada para tener bien presente su estructura y la forma en que se han generado (formulación exacta de las preguntas). De otro modo, pueden hacerse interpretaciones incorrectas de los resultados del análisis. Quizás de forma menos intensiva, los responsables del proyecto y quienes intervengan en la redacción del informe final (redactores), utilizarán también el CRD para referencia y consulta. Uno de los desafíos más agudos en el diseño de CRD es el de conseguir un diseño que facilite al máximo la tarea de todos los profesionales que deben trabajar con él, cuyas necesidades son diversas. Ocurre con cierta frecuencia que, lo que facilita la tarea de uno, dificulta la de otro y viceversa. Aunque no es tarea fácil, es importante intentar un compromiso aceptable. Ya hemos comentado que un CRD mal diseñado puede inducir a una cumplimentación errónea por parte del investigador, y puede hacerlo hasta el punto de amenazar seriamente los objetivos del ensayo clínico. Por tanto, quizás debiera ser esta la primera prioridad: poner las cosas fáciles al investigador, porque él es quien cumplimenta el CRD. 4 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Además de que un mal diseño tendrá un impacto negativo sobre la calidad de los datos, lo tendrá también sobre los costes, porque hará perder más tiempo del necesario. No sólo al investigador que lo cumplimenta, sino a los demás profesionales que tendrán que manejar el CRD. Notablemente, si el defecto de diseño ha inducido una cumplimentación incorrecta, habrá que hacer las rectificaciones oportunas en el CRD tras detectar los datos mal cumplimentados y esta tarea consume mucho tiempo a los gestores de datos y a los monitores. El coste inducido por problemas de diseño en el CRD puede ser muy elevado. 5 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3. Principios generales del diseño de CRD El diseño de CRD corre a cargo de distintos profesionales en distintos entornos. No es infrecuente, en el seno de grupos de investigación clínica relativamente pequeños, que el diseño del CRD corra a cargo del responsable del proyecto o del monitor. En organizaciones de mayor tamaño, suele ser responsabilidad de los gestores de datos que, en organizaciones grandes, pueden llegar a estar exclusivamente dedicados al diseño de CRD. En cualquier caso, para tener oportunidades de diseñar un buen CRD o, sobre todo, para evitar un CRD potencialmente desastroso, es necesario disponer de conocimiento y experiencia previa en dos áreas: El área terapéutica del ensayo clínico, del entorno en que se realizará (tipo de centro, sala, UCI, etc.), y la idiosincrasia de los investigadores, que puede ser variable según la especialidad o la región. Los procesos que habrá que someter a los datos tras la cumplimentación del CRD (grabación, verificación, codificación y análisis). Ambos tipos de conocimiento raramente se combinarán en una única persona. Por lo tanto, falta que contribuyan al diseño del CRD al menos dos personas. Una puede ser el responsable del proyecto o el monitor, y la otra un gestor de datos. Normalmente, uno de ellos hará una primera propuesta de CRD y la otra lo revisará. No importa demasiado en qué orden, pero sí importa que intervengan los dos. Naturalmente, lo ideal sería que todos profesionales que van a trabajar con el CRD tuvieran la oportunidad de revisarlo desde sus particulares puntos de vista. Si esto se considera demasiado ineficiente, al menos habría que someterlo a revisión por parte del usuario principal, es decir, el investigador, práctica que lamentablemente no es particularmente frecuente, por no demorar más el comienzo del ensayo clínico. En el caso de ensayos clínicos con tamaños muestral muy elevado, es muy recomendable someter el CRD a una prueba piloto antes de darlo por definitivo. 6 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.1. El contenido del CRD Lo primero y primordial al abordar el diseño de un CRD es definir su contenido. Para ello, es imprescindible disponer del protocolo del ensayo clínico o, al menos, de un esquema del estudio en el que se especifiquen sus objetivos, el diseño escogido y los criterios de evaluación propuestos para cada objetivo. Es absurdo y muy ineficiente comenzar el diseño de un CRD antes de que estas cosas estén decididas. La lectura del protocolo debería permitir definir el contenido del CRD hasta sus más mínimos detalles (por ejemplo, la formulación exacta de las preguntas). De hecho, si esto no fuera así, deberíamos entender que el protocolo del ensayo clínico está todavía incompleto. Cuando el protocolo del ensayo clínico se haya completado, el contenido del CRD debe definirse con una sola idea en la mente: registrar todo lo necesario y nada más que lo necesario. Cuando se define el contenido del CRD, es muy fácil sucumbir a la tentación de incluir preguntas innecesarias para satisfacer los objetivos del ensayo clínico aludiendo que podrían ser interesantes. Esto no es motivo suficiente: si tan interesantes son, habrían de estar recogidas como uno de los objetivos del estudio y, si no es así, hay que resistirse a incluirlas. Hay dos buenas razones para recomendar esta resistencia: La primera es que la calidad de los datos suele ser inversamente proporcional a su cantidad, de modo que vale la pena concentrar los esfuerzos en lo imprescindible en lugar de disiparlos con lo prescindible. La segunda razón es que la inclusión de un dato adicional en un CRD no es gratis (cada dato que se incluya en un CRD ocupa espacio, con lo que el CRD se hincha y se encarece su impresión. Su cumplimentación será más tediosa (y habrá que pagar este esfuerzo). Habrá que grabar, verificar, analizar e interpretar un dato más. Todo ello redunda en un incremento de dedicación y de costes). El coste de un ensayo clínico es proporcional a la cantidad de datos registrados. Un CRD debe limitarse a incluir lo imprescindible, sin excepciones. Por drástica que parezca, esta debe ser la regla de oro del diseñador de CRD. Y debe estar preparado a mantenerla, porque recibirá constantes invitaciones a violarla. Todo el mundo quiere añadir cosas. Siempre. 7 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Un caso particular de pregunta improcedente es la duplicación de preguntas o la inclusión de preguntas redundantes. Preguntar dos veces lo mismo sólo sirve para tener que verificar si en las dos ocasiones se ha obtenido la misma respuesta y, si no ha sido así, tener que aclarar cuál es incorrecta y rectificarla. Esto se ve a menudo en relación con ciertos criterios de inclusión. Si en un ensayo clínico se exige que los pacientes tengan una edad comprendida entre 18 y 65 años, no es recomendable incluir la pregunta ”¿Tiene el paciente una edad comprendida entre 18 y 65 años?“ porque en la sección de datos demográficos vamos a preguntar la fecha de nacimiento. Otro caso de redundancia particularmente frecuente ocurre cuando la fecha de la visita se solicita en todas las páginas de una misma visita. La fecha de una visita debe preguntarse una sola vez, en la primera hoja correspondiente a esa visita. Sin embargo, en las páginas de las exploraciones complementarias correspondientes a una visita (por ejemplo, radiografías, electrocardiogramas, etc.) hay que solicitar la fecha en que se ha realizado la exploración, que no tiene por qué coincidir con la fecha de la visita. En el caso de analíticas de productos biológicos como sangre, esputo etc., debe solicitarse la fecha de toma de la muestra. Hay quien argumenta que, de todas formas, conviene incluir esta pregunta para que de esta forma el investigador tenga presente el criterio de inclusión. La idea de que en el CRD se recuerde al investigador ciertos aspectos relevantes (y los criterios de inclusión lo son) no implica que debamos hacer una pregunta de la que esperamos obtener una respuesta. Basta incluirlo como recordatorio o advertencia, sin solicitar respuesta. Otra cosa que debe evitarse es solicitar datos que pueden derivarse a partir de otros solicitados previamente. Por ejemplo, no solicitaremos el Indice de Masa Corporal (IMC = peso en Kg / (talla en m)2) si disponemos del peso y la talla. Tampoco solicitaremos la media de tres determinaciones de la presión arterial si disponemos de éstas, aunque el dato a analizar sea la media. Tras la grabación de los datos, este tipo de cálculos se hacen de manera fácil, rápida y sin cometer errores con un ordenador. Si solicitamos el dato derivado en el CRD, de todas formas habrá que recalcularlo para verificar que se ha calculado correctamente. La única excepción de esta regla ocurre si el dato derivado es necesario para tomar alguna decisión durante el ensayo (por ejemplo, evaluar un criterio de inclusión como IMC > 28 Kg/m2, ó modificar la dosis del fármaco en estudio en base a la media de las tres determinaciones de la presión arterial). El médico tendrá que calcularlo de todas formas para verificar si el paciente cumple o no dicho criterio. En tales casos, conviene que el campo para el dato derivado (por ejemplo, IMC) esté próximo al de los datos necesarios para calcularlo (peso y talla). Si el cálculo no es trivial hay que indicar la fórmula. 8 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.2. La estructura del CRD La totalidad de la información que se solicita en un CRD ocupa un buen número de páginas. La longitud de un CRD es variable según los ensayos, pudiendo oscilar desde muy pocas páginas a varios cientos de ellas. En los ensayos clínicos de fase III, el CRD tiende a ser considerablemente largo. Toda esta información se estructura en distintos bloques temáticos que contienen datos relacionados y que, según el uso y costumbre de cada entorno, se denominan secciones, apartados, paneles (o incluso páginas si ocupan toda una página física). Así, se habla de la sección de datos demográficos, el panel de signos vitales o la página de acontecimientos adversos. Un CRD debe organizarse de acuerdo con alguna lógica. En principio, hay dos opciones para organizar un CRD: por secciones o por visitas. En la organización por secciones, los datos análogos que se registran a lo largo de todo el ensayo clínico se disponen en una misma página. Ejemplo de esto es la siguiente tabla: Página de signos vitales en un CRD organizado por secciones. La página permite registrar los signos vitales correspondientes a todas las visitas del ensayo clínico. VISITA Signos vitales 1 2 3 4 Pulso (ppm) Tempereatura axilar (ºC) P.A.S. (mmHg) P.A.D. (mmHg) Por tanto, tendríamos una página para cada tipo de información (signos vitales, analíticas, etc.) y cada una de estas páginas tendría una estructura similar a la anterior (acaso con un número de columnas variable, según las visitas en las que deba registrarse esa información). Esta estructura suele tener la ventaja de que se consigue un CRD bastante compacto, pero tiene el grave inconveniente de que, en cada visita, el investigador debe preocuparse de recorrer todas las páginas del CRD para ver qué información debe registrar en la visita actual. Esto es incómodo y propicia las omisiones accidentales. 9 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) En la organización por visitas, las páginas del CRD se ordenan cronológicamente: primero se presentan las páginas correspondientes a la primera visita, luego las de la segunda, y así sucesivamente, con separadores entre visitas. La información que no deba vincularse a una visita puede situarse al final, utilizando separadores específicos (por ejemplo, acontecimientos adversos, medicaciones concomitantes), e insertando en cada una de las visitas avisos o recordatorios que nos conduzcan a su cumplimentación en el caso que sea necesario. Aunque el CRD será más largo, la organización por visitas es muy recomendable porque es mucho más fácil de utilizar y evita omisiones accidentales. El investigador no necesita saber lo que debe evaluar en cada visita. Simplemente debe limitarse a cumplimentar todas las páginas contenidas en el separador de la visita actual. Además de las hojas necesarias para registrar la información requerida en cada visita, puede interesar incluir hojas adicionales, en un separador aparte, en previsión de que puedan tener lugar visitas extraordinarias, sobre todo en estudios largos. Bajo el esquema de organización por visitas, dentro de cada una de ellas, las distintas páginas y secciones deben organizarse de un modo lógico. Por ejemplo, en la primera visita es lógico presentar la página de criterios de inclusión antes que las demás si esto es lo primero que hay que verificar. También es recomendable disponer las secciones (que procedan) lo más acorde posible con la estructura clásica de la historia clínica: antecedentes personales y familiares, anamnesis, exploración física, exploraciones complementarias (RX, ECG, datos de laboratorio, etc.), datos de la prescripción terapéutica. También es importante la estructura de los distintos ítems contenidos dentro de una página física. En la medida de lo posible, conviene agrupar los distintos ítems en bloques relacionados, separando estos bloques suficientemente. 10 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) A veces, habrá más de un modo de estructurar las preguntas. Consideremos el siguiente ejemplo: Dos posibles formas de estructurar la misma información Las dos posibilidades que se muestran son equivalentes en cuanto a la información registrada. Pero dicha información se estructura de manera diferente en los dos casos. En el primer caso, se obtienen dos datos (las respuestas a cada una de las dos preguntas), cuya consistencia habrá que verificar (un sí en la primera pregunta habría de implicar alguna respuesta en la segunda y un no en la primera, ninguna respuesta a la segunda). Además requerirá dos campos en la base de datos. La segunda estructura propuesta produce un único dato, con lo que no existen potenciales problemas de inconsistencia, y requerirá un único campo en la base de datos. La grabación también se simplifica. Por último, es muy importante numerar todas las páginas del CRD. Se facilita de este modo la referencia a cualquier punto del mismo. 11 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.3. Identificadores Un punto muy importante en el diseño de CRD es garantizar que todos los datos que se registren quedan perfectamente identificados, es decir, que se podrá saber en todo momento a qué estudio, investigador, paciente, visita y campo o pregunta corresponde. Ciertos defectos de diseño del CRD pueden impedir esta identificación y las consecuencias son muy graves. No conocer a qué corresponde un dato es como no tenerlo. Esta situación puede suceder con facilidad. Supóngase que sólo se identifica el paciente en la primera página de un CRD. Si, por alguna razón, se separa una de las páginas del resto del CRD, será imposible saber a qué paciente corresponde. En estudios largos, puede convenir procesar las páginas a medida que se va acumulando información, de forma que las páginas se separan del resto a propósito, a medida que se van cumplimentando. En tales casos, la identificación de cada página individual es absolutamente imprescindible. Para evitar problemas, es absolutamente recomendable que todas las páginas del CRD tengan una cabecera con los identificadores necesarios y, en la medida de lo posible, que estos identificadores estén preimpresos. El conjunto de identificadores a incluir en un CRD es variable según el estudio y los estándares del promotor. Algunos de los identificadores más habituales son: Nombre o código del estudio. Nombre o código del fármaco en estudio. El código de centro o de investigador. El código de paciente (por ejemplo, número de randomización). El número de visita (excepto en páginas no vinculadas a visita, como acontecimientos adversos o medicaciones concomitantes). El periodo en que tiene lugar la visita (por ejemplo, screening, tratamiento, seguimiento). El nombre de la página o sección (por ejemplo, Datos demográficos, Acontecimientos adversos, etcétera). El número de página y el total de páginas del CRD. 12 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.4. El lenguaje empleado en el CRD El lenguaje empleado en un CRD debe ser sencillo y claro. Las frases deben ser lo más cortas posible y, sobre todo, exentas de ambigüedad. Quien lo cumplimente no debe tener dudas acerca de lo que se está preguntando. Una fuente habitual de ambigüedad en la interpretación es el uso de dobles negaciones. Un ejemplo de doble negación sería el siguiente: "Quién me está leyendo no es un extraterrestre (si/no)". Algunos términos pueden tener más de una interpretación. Por ejemplo, en el entorno de los ensayos clínicos ‘valor basal’ suele entenderse como el valor de una variable al inicio del ensayo o antes de comenzar el tratamiento del ensayo. Sin embargo, algunos investigadores pueden interpretarlo como el valor al inicio de la enfermedad, que puede ser muy anterior al inicio del ensayo clínico. Deben evitarse las abreviaturas, tanto en el texto preimpreso del CRD (por ejemplo criterios I/E, AE, SAE, etc.), como en las respuestas. Aunque hay algunas abreviaturas muy extendidas y que posiblemente no admiten más que una interpretación (como EPOC, por Enfermedad Pulmonar Obstructiva Crónica), pueden albergar ambigüedad (por ejemplo, en inglés, COLD puede usarse por Chronic Obstructive Lung Disease o bien para indicar un resfriado), o ser ininteligibles para otras personas (por ejemplo, ACxFA por Arritmia completa por Fibrilación Auricular). Cuando se traduzca un CRD existente a otro idioma es importante garantizar que no se introducen distorsiones. Para ello puede utilizarse la traducción y retrotraducción (se traduce del idioma A al B y luego se traduce el resultado del B al A para ver si lo que se obtiene es igual que el punto de partida). En cierto tipo de preguntas como las de los cuestionarios de calidad de vida, no se trata tanto de hacer una traducción textual como una adaptación transcultural, y para ello existe una metodología específica. 13 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.5. Formulación de preguntas En la sección anterior, se ha comentado la necesidad de que las preguntas sean claras y exentas de ambigüedad. Para conseguirlo, conviene procurar que los enunciados de las preguntas: Sean cortos y concisos. Eviten las dobles negaciones. Por ejemplo: Pregunta. ¿No ha tenido dolor? Respuestas. si/no ¿Qué significa un “no” por respuesta? Usen términos positivos. Es mejor: "dejar en blanco” que “no rellenar”, o “evitar abreviaturas” que “no usar abreviaturas”. Representen una única idea evitando preguntas o compuestas. Por ejemplo, en la pregunta “¿Diarrea o dolor de más de 6 semanas de evolución?”, ¿qué es lo que debe tener más de 6 semanas de evolución? 14 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Eviten excesivas interdependencias entre preguntas. Si son inevitables, dispóngalas de modo que la interdependencia sea evidente. Como se muestra en el siguiente ejemplo: Disposición de los elementos para indicar la interdependencia de preguntas. Las flechas, la tabulación a la derecha y las cajas, ayudan a entender lo que se debe responder según cual sea la respuesta a una pregunta previa. 15 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.6. Mecanismos de respuesta En función de cuál sea el tipo de información solicitada en una pregunta, podemos obtener como respuesta dos tipos distintos de datos: • • Numéricos. Textuales. Cuando la respuesta a una pregunta sea necesariamente un texto, podemos utilizar tres posibles formas de respuesta: • • • Cerrada. Semi-cerrada. Abierta. Siempre que podamos acotar las posibles respuestas a una pregunta es muy recomendable utilizar respuestas cerradas. Según cuál sea la pregunta, puede ser inmediato y sencillo organizar una respuesta cerrada, como en los siguientes ejemplos: Sexo: Fumador actual: Dolor: Tipo de Diabetes: hombre / mujer sí / no nuIo / leve / moderado / intenso tipo 1 / tipo 2 En este tipo de campos, la legibilidad es mayor si las opciones de respuesta se disponen verticalmente que si se disponen horizontalmente. Como se muestra en el siguiente ejemplo: Disposición horizontal o vertical de las respuestas. La disposición vertical facilita la legibilidad. DISPOSICIÓN HORIZONTAL Hábito tabáquico: DISPOSICIÓN VERTICAL Hábito tabáquico: 16 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Respuesta cerrada Cuando se deciden las opciones de respuesta (cerrada) asociadas a una pregunta, es muy importante garantizar que son exhaustivas (por exhaustivas se entiende que agotan todas las posibilidades) y mutuamente excluyentes. De no ser así, podría ocurrir que, para un paciente determinado, ninguna de las respuestas previstas es adecuada y en tal caso el investigador no podrá responder. Esto ocurre en el caso A) que mostramos a continuación, si el paciente no utilizó ningún tratamiento previamente: Además de exhaustivas, las posibles respuestas deben ser incompatibles entre sí. En otro caso, puede que más de una sea cierta, como en el caso A). Si un paciente ha seguido dieta hipocalórica y además ha tomado ADO, tendrá que marcar estas dos opciones. Esto se denomina opción de respuesta múltiple y no es aconsejable porque no proporciona evidencia (negativa) para las opciones que no han sido señaladas porque podría tratarse de una omisión. Para evitar este problema es mejor disgregar la pregunta anterior en tres preguntas distintas, como se hace en el caso B): A veces la compatibilidad de varias respuestas atiende a un claro error de diseño. Como en el siguiente ejemplo, en el que no sabríamos qué hacer con un paciente de 30 o de 50 años: Categorías de respuesta compatibles. Un paciente de 30 o de 50 años podría situarse en más de una casilla. 17 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) En algunos casos, la propia naturaleza de la información que interesa registrar es tal que las distintas opciones que conviene incluir son compatibles. Veamos el siguiente ejemplo: Respuestas compatibles debido a la naturaleza de lo que se pregunta. Conviene aclarar si es posible señalar más de una respuesta o, por el contrario, se desea una única respuesta. Supongamos el caso A). Si un paciente ha sufrido un acontecimiento adverso (AA), ha dejado de tomar la medicación del estudio y se presenta a la siguiente visita diciendo que retira su consentimiento, las tres primeras son procedentes. En casos como este, debemos decidir qué nos interesa registrar. Puede que nos interese registrar todos los motivos por los que se retira un paciente. Si es así, tendríamos que insertar la instrucción “Márquese todas las respuestas que procedan”. Alternativamente podemos formular la pregunta de distinta manera, para registrar únicamente la causa principal, tal como se ha hecho en el caso B). Por último en lo que se refiere a las preguntas con respuesta cerrada, deben pretender que se marque la opción correcta en lugar de que se tache lo incorrecto (deben evitarse instrucciones del tipo “táchese lo que no proceda”). Respuesta semi-cerrada En algunos casos, no es posible acotar todas las respuestas posibles. Puede que su número sea muy elevado o que sean imprevisibles. Por ejemplo, el motivo por el que un paciente se ha retirado del estudio es una información importante y típicamente solicitada en casos de terminación prematura del estudio. Pero es imposible prever todas las posibles causas. En estos casos, debemos plantearnos el uso de un mecanismo de respuesta semi-cerrado, si podemos anticipar algunas de las respuestas previsiblemente más frecuentes. 18 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Respuestas semi-cerradas. Se prevé algunas de las posibles respuestas, pero se permite añadir otras. Para facilitar esta tarea y minimizar errores de grabación, las respuestas cerradas o semi-cerradas deben incorporar los códigos que posteriormente se grabarán en la base de datos. Estos códigos también deben ser lo suficientemente pequeños para no distraer la atención de la persona que cumplimenta el cuaderno y lo suficientemente grandes para ser legibles para el grabador de datos puesto que es el dato que se grabará en la base de datos. Los códigos, y el orden en que se presentan, deben ser consistentes a lo largo del CRD. Si decidimos codificar las respuestas de tipo si/no del siguiente modo: 1=sí 2=no, debemos hacerlo siempre así, evitando que en otro lugar del CRD aparezca, por ejemplo: 1=no 2=sí, o bien: 0=no 1=sí. Respuestas abiertas Si las posibles respuestas a una pregunta son completamente imprevisibles, será necesario recurrir a campos abiertos, es decir, ofrecer un espacio en blanco para escribir la respuesta en forma de texto libre. Este es el caso, por ejemplo, de los acontecimientos adversos, las medicaciones concomitantes y las enfermedades concomitantes. 19 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Sin embargo, los campos abiertos deben evitarse en lo posible por varias razones: No hay control sobre la respuesta y potencialmente puede responderse a algo distinto a lo que se pregunta. La grabación es más costosa y a veces los textos son ilegibles. Es necesario codificar las respuestas a posteriori. Si no se hace, los sinónimos (dolor de cabeza y cefalea, dolor cólico y dolor tipo cólico, etc.) no se identificarán como tales y el resultado del análisis será muy difícil de interpretar. Lo mismo ocurre con las variaciones ortográficas (neumotórax y pneumotórax), incluyendo los espacios en blanco, guiones y otros separadores (hemiparesia, hemiparesia, hemi paresia) o mayúsculas (HEMORRAGIA, Hemorragia y hemorragia). Cuando utilicemos campos abiertos es necesario prever un espacio suficiente. En el caso de los acontecimientos adversos o las enfermedades, las descripciones pueden ser largas. Si recomendamos evitar el uso de abreviaturas, debe haber espacio para términos como “Enfermedad pulmonar obstructiva crónica”. Finalmente, en relación con las respuestas de tipo textual, recuérdese que, cuando puedan utilizarse, las respuestas cerradas son siempre mucho mejores que las semicerradas, y éstas son mejores que las abiertas. Respuestas de tipo numérico Cuando la respuesta a una pregunta sea de tipo numérico, la primera recomendación (por ejemplo, es mejor registrar la temperatura en grados centígrados que ofrecer un mecanismo de respuesta cerrado como, por ejemplo, 1= < 37º / 37º o más) es registrar el número sin recurrir a agrupaciones. Si interesa este tipo de agrupación, siempre podremos hacerlo a posteriori. Al diseñar el campo que debe alojar el número, podemos optar por distintas formas, como muestran los siguientes ejemplo: Distintas posibilidades para registrar datos numéricos En el caso A), optamos por un espacio en blanco en el que se pueda escribir cualquier tipo de número. También podemos forzar el formato en que debe escribirse el número, mediante separadores para cada dígito y/o el separador decimal, para indicar la aproximación con que se debe registrar el valor, como en el caso B). 20 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Esta opción tiene la ventaja de que obtendremos los números siempre en el mismo formato y con la misma aproximación. Además, no habrá problemas de lectura en relación con la ubicación del separador decimal. Evidentemente, hemos de verificar que ofrecemos suficientes espacios para los dígitos. Cuando la cantidad solicitada pueda expresarse en distintas unidades de medida, es importante hacerlas constar al lado del campo numérico (por ejemplo, Kg. para el peso corporal, mg/dL para la glucemia, etc.). Si se trata de una medición que debe realizarse adoptando especiales precauciones, es recomendable insertar una advertencia al lado del campo (por ejemplo, paciente en decúbito, al lado de los campos para presión arterial). Un caso un tanto especial de campos numéricos son los destinados a registrar fechas y horas. En cuanto a las fechas, es imprescindible indicar el formato deseado, que debería ser el habitual en el medio en que se realizará el estudio. En Europa, las fechas suelen indicarse en este orden: día-mes-año. El formato americano, sin embargo, es mes-día-año. Sea cual sea el medio del estudio, hay que explicitar el formato esperado, como se hace en el caso C). Los campos destinados a registrar la hora deben acompañarse de una advertencia para que se utilice el formato de 24h. Alternativamente, se puede solicitar en formato 12h pero añadiendo un campo para indicar si se trata de la mañana (AM) o de la tarde (PM). 21 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.7. Instrucciones y advertencias Conviene insertar instrucciones o advertencias que pueden ayudar al investigador a cumplimentar correctamente el CRD. Estas instrucciones pueden ser de carácter general o local. Las instrucciones generales deberían presentarse al inicio del CRD. Puede utilizarse el reverso de la primera página para ahorrar espacio. Algunas de estas instrucciones pueden ser: Utilice un bolígrafo y asegúrese de que todas las copias quedan marcadas (cuando se use papel copia). Procure contestar todas las preguntas. Si no dispone de suficiente información para responder, indíquelo con las iniciales ND de "no disponible". Escriba con letra clara y legible. Evite las abreviaturas. Si se equivoca, no borre el dato ni use líquido corrector (tipo Typex). Tache el dato erróneo con una única línea y escriba al lado el dato correcto. No olvide firmar y fechar la corrección. Conviene limitar estas instrucciones porque, si son muy extensas, el usuario puede no leerlas o no recordarlas. Las instrucciones locales se incluyen cerca de la pregunta o sección a que hacen referencia. Por ejemplo: En el campo destinado a registrar medicaciones concomitantes, puede insertarse la siguiente instrucción: “Por favor, indique el nombre comercial”. Al inicio de un bloque de preguntas destinadas a averiguar embarazo, lactancia y uso de anticonceptivos, se puede insertar la siguiente instrucción: “Sólo para mujeres potencialmente fértiles”. 22 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Además de las instrucciones, pueden insertarse advertencias o recordatorios para el investigador, en un intento de asegurar que implemente correctamente el protocolo del ensayo clínico. Estas instrucciones pueden ser de utilidad también para el monitor, en el momento de revisar el CRD. Un ejemplo de estas instrucciones: Instrucción para verificar un criterio de inclusión. En casos como el anterior, en que la advertencia hace referencia a un dato que se registra en el CRD, dicha advertencia debe situarse cerca del campo destinado a capturar ese dato. Se desaconsejan las llamadas con notas al pié de página porque pueden pasar desapercibidas. Si se decide estructurar el CRD por visitas, pero se incluyen otros apartados para registrar información no vinculada a las visitas (por ejemplo, acontecimientos adversos y medicaciones concomitantes), es importante insertar un recordatorio en cada visita para que el investigador no olvide registrar la información relevante. Por ejemplo: “No olvide registrar cualquier acontecimiento adverso que haya presentado el paciente en la página XX”. 23 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.8. El diseño gráfico y la apariencia La apariencia de un CRD es importante porque tiene impacto sobre la probabilidad de cometer errores al rellenarlo. Una de las primeras cuestiones es decidir la orientación del papel con la que se diseñará el CRD: • • Vertical. Horizontal. La combinación de ambas es incómoda para el usuario. Los márgenes deben ser suficientes e iguales en todas las hojas. En general, conviene ser generoso con el espacio, sobrio con los efectos y parco con la tinta. No todos los tipos de letra se leen con igual facilidad: Distinta legibilidad según el tipo de letra Es muy recomendable utilizar un tipo que sea claro, por ejemplo el tipo Arial, y hacerlo consistentemente a lo largo de todo el CRD, variando el tamaño si es necesario, pero procurando no bajar de 8 puntos. Los efectos, como negrita, cursiva, subrayado o sombreado, deben utilizarse para enfatizar o para discriminar cosas diferentes evitando su uso excesivo. Los colores deben evitarse porque se pierden al hacer fotocopias, porque no todas las personas los distinguen, y porque encarecen la impresión. Por ejemplo, podemos usar: • • • La negrita para enfatizar. La cursiva para instrucciones o advertencias. Los sombreados para las cabeceras o títulos de bloque o sección. Sea como sea, es importante hacerlo consistentemente en todo el CRD. 24 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Si un bloque sólo procede en ciertos casos, dependiendo de la respuesta a una pregunta previa, debe procurarse que resulte evidente sin necesidad de leer ese bloque. Para ello puede ser interesante utilizar flechas y desplazar el bloque condicionado hacia la derecha. Como se muestra en el siguiente ejemplo: Disposición de los elementos para indicar la interdependencia de preguntas. Las flechas, la tabulación a la derecha y las cajas, ayudan a entender lo que se debe responder según cual sea la respuesta a una pregunta previa. Si la sección condicionada es muy larga, puede ser mejor insertar una advertencia en la cabecera y dedicar una sección o página sólo para este fin. Por ejemplo: “Solo si el paciente es una mujer potencialmente fértil”. El uso de las mayúsculas debe restringirse, y sólo usarlas al inicio de la frase y en los nombres propios. LOS TEXTOS ESCRITOS ENTERAMENTE EN MAYUSCULAS SE LEEN PEOR QUE los que están escritos en minúsculas. 25 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Es importante disponer los distintos ítems de una página formando bloques visuales que nos ayuden a comprender de un vistazo la estructura de dichos ítems: las preguntas que están temáticamente relacionadas, lo que son preguntas y sus respuestas correspondientes, etc. Es buena idea utilizar marcos para diferenciar secciones, si hay más de una en una misma página. Por ejemplo: Uso de marcos para diferenciar bloques de preguntas 26 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Como ya hemos dicho, hay que ser generoso con el espacio. Las páginas muy densas son más difíciles de entender y de cumplimentar. Sin embargo, el espaciado también debe usarse inteligentemente, para separar lo que no está relacionado. Por ejemplo, no conviene espaciar excesivamente las preguntas y sus mecanismos de respuesta asociados, como en el siguiente ejemplo: Uso inadecuado del espaciado. Las preguntas y sus correspondientes respuestas están demasiado separadas. Dentro de un bloque, los espaciados entre preguntas deben ser uniformes. El espaciado entre palabras también debe ser uniforme. 27 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) La alineación es importante. La legibilidad es mejor si se alinean las preguntas y también las respuestas. Alineación de preguntas y respuestas. La alineación de las preguntas (por la derecha) y de las respuestas (por la izquierda) mejora mucho la legibilidad. No alineadas: Alineadas: 28 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.9. Número de copias y montaje del CRD Antes de imprimir un CRD ya diseñado, debemos decidir algunas cuestiones. En primer lugar, tendremos que decidir si es necesario que las páginas tengan copias (siempre es así si el ensayo clínico se debe llevar a cabo bajo los principios de las Buenas Prácticas Clínicas) y en ese caso cuántas se requieren. Es habitual que se incluya la original y 2 o 3 copias en papel auto-copiable. Una segunda cuestión que hay que decidir es cómo se montará el CRD. Es bastante práctico el uso de carpetas con anillas, sobre todo si las páginas deben procesarse tan pronto como han sido cumplimentadas. El inconveniente es la posibilidad de pérdida de alguna página, más difícil cuando se opta por la encuadernación (siempre que el encolado sea de calidad), pero entonces el manejo del CRD es más engorroso. Como ya se ha comentado, conviene utilizar separadores con la pestaña rotulada para facilitar la localización de las páginas (por ejemplo, visita 1, visita 2, etc., acontecimientos adversos, etc.). 29 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 3.10. Otros aspectos a considerar Campo comentario Existe cierta tendencia a incluir en el CRD campos abiertos para que el investigador haga comentarios libres. Estos campos no son recomendables por varias razones: Primero, porque, como dijimos al principio, la regla de oro debe ser preguntar lo necesario y nada más. Incluir un campo de comentarios completamente inespecífico “por si el investigador tiene algo interesante que añadir” es diametralmente opuesto a esta filosofía. En segundo lugar, suele ocurrir que el investigador, cuando ve este campo, siente la necesidad de poner algo para no parecer vago. La mayoría de las veces se registra información completamente irrelevante. Si no es así, y se registra algo relevante, como por ejemplo “el paciente ha presentado un infarto agudo de miocardio y ha muerto”, esta información debería estar registrada en otro lugar del CRD (acontecimientos adversos). Si lo está, entonces el comentario es irrelevante. Pero si no lo está, la situación es grave porque esta información puede pasar desapercibida. La razón es que, a diferencia de las respuestas codificadas (como las que suelen incluirse en la sección de acontecimientos adversos), no son analizables. Sólo pueden listarse y leerse una a una, lo que no resulta muy práctico más que en ensayos clínicos de pequeña muestra. Por lo tanto, los campos de comentario no añaden más que complicaciones y deben evitarse o minimizar su uso. Modificaciones del CRD Otra advertencia importante es que debe evitarse toda modificación del CRD una vez se haya iniciado el ensayo clínico. Las modificaciones pueden alterar la estructura de los datos que se registran y ello ocasionaría graves problemas de grabación, de análisis y de interpretación de datos. La única excepción admisible es el caso en el que se detecte una carencia vital en el CRD después de comenzar el estudio. 30 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Estándares Cuando se aborda el diseño de un CRD, siempre es aconsejable utilizar páginas, secciones o preguntas estándar si se dispone de tales estándares. En caso contrario, puede que se disponga al menos de CRD utilizados en ensayos clínicos similares realizados con anterioridad que se podrán adaptar al ensayo clínico actual o al menos servir de fuente de inspiración. En ciertos ámbitos como la medida de la calidad de vida, existen cuestionarios estandarizados que han sido desarrollados y validados por otros grupos de investigación. Es buena idea utilizarlos sin introducir mejoras, tras solicitar permiso a quien mantenga los derechos de distribución (Copyright). Hojas adicionales Además de las hojas necesarias para registrar la información requerida en cada visita, puede interesar incluir hojas adicionales en previsión de que puedan tener lugar visitas extraordinarias, sobre todo en estudios largos. 31 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 4. Estandarización de CRD Posiblemente, a estas alturas opinéis que el diseño de CRD es una tarea delicada y que requiere mucha atención. Además, es fácil cometer errores de diseño que pueden tener impacto en la calidad de los datos. La estandarización se presenta como la gran solución a este problema. Por estandarización entendemos la decisión de adoptar elementos estándares que se reutilizarán siempre de la misma forma en distintos CRD (distintos ensayos clínicos). Estos elementos pueden ser diversos: Tipo de letra para preguntas, instrucciones o advertencias, títulos de sección. Orientación y márgenes de las hojas del CRD. Tipo (con o sin borde superior) y tamaño de las casillas destinadas a registrar texto libre, números, fechas, etc. Cabecera de las páginas con los identificadores. Tamaño y posición de los códigos en respuestas cerradas. Preguntas y su formulación. Opciones de respuesta y sus códigos asociados en respuestas cerradas. Naturalmente, el mayor grado de estandarización se alcanza cuando se dispone de secciones enteras o páginas estandarizadas para registrar los datos que, en la práctica totalidad de los ensayos clínicos tendrán que registrarse, como los criterios de inclusión y exclusión, datos demográficos, los signos vitales, los antecedentes de interés (enfermedades concomitantes o comorbilidad), los acontecimientos adversos o las medicaciones concomitantes. En la medida en que dispongamos de una librería de páginas estándar, la elaboración de un nuevo CRD será más ágil y menos costosa. El CRD se diseñará fácil y rápidamente, adaptando las páginas estándar al ensayo clínico actual y reduciendo las tareas de nuevo diseño a aquellos aspectos que son específicos de este ensayo clínico. Además de simplificar la tarea, la estandarización minimiza los errores, no sólo de diseño, sino de cumplimentación por parte del investigador; de revisión por parte del monitor; de creación de la base de datos del estudio y de las reglas lógicas de verificación de completitud y consistencia de datos por parte del gestor de datos; de grabación de datos; de codificación; de análisis y de interpretación por parte del estadístico. El uso repetido del estándar hace que quienes manejan el CRD se acostumbren rápidamente a él y lo conozcan bien, lo que siempre minimiza la probabilidad de cometer errores o hacer interpretaciones indebidas. Además, el uso repetido permitirá ir depurando el estándar si se detectan deficiencias en su diseño. 32 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Aunque las ventajas son considerables, la estandarización entraña siempre cierta inflexibilidad, porque hay que ceñirse al estándar. No tiene sentido desarrollar un estándar para no seguirlo. El estándar podrá adaptarse a cada ensayo clínico, en algunos de sus elementos (por ejemplo, título del ensayo clínico o del fármaco del estudio en la cabecera de la página), pero la mayoría de ellos no podrá modificarse. Cuando se desarrollan, las páginas estándares deberían acompañarse de instrucciones explícitas acerca de lo que es lícito modificar y lo que no. Es habitual que se permita añadir elementos pero no eliminar o alterar elementos. 33 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 5. Páginas o apartados de uso común en los CRD Como se dijo en la sección El contenido del CRD, la prioridad de un CRD debe ser contener todo lo necesario y nada más que lo necesario. Pues bien, hay una serie de cosas que son siempre necesarias (con independencia del área terapéutica y del objetivo del ensayo clínico). En esta sección describimos el contenido típico de algunas de las secciones que normalmente están presentes en un CRD. 34 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 5.1. Criterios de inclusión y exclusión (I/E) Los criterios de inclusión y exclusión del estudio deben ser verificables. De otro modo no podríamos garantizar, en el momento de interpretar los resultados, a qué tipo de pacientes se refieren. Por ello siempre necesitaremos incluir un apartado destinado a obtener la información relevante para verificarlos. Normalmente, la página de criterios de I/E está constituida por la lista de dichos criterios, redactados en forma de pregunta, al estilo de la siguiente: “¿Tiene el paciente antecedentes de infarto agudo de miocardio?” El mecanismo de respuesta es cerrado: “sí” o “no”. Suelen distinguirse dos bloques, uno para los criterios de inclusión y otro para los de exclusión. Debe desaconsejarse la práctica de enfatizar de algún modo (por ejemplo, mediante negrita) las respuestas afirmativas en los criterios de inclusión y negativas en los de exclusión (es decir, lo que debe ocurrir para que el paciente sea elegible), porque induce la respuesta. Es fundamental verificar que la redacción de los criterios I/E en esta página del CRD coincide exactamente con la del protocolo. También es recomendable ofrecerlos en el mismo orden y, si están numerados en el protocolo, preservar la numeración. Para ello, si un criterio puede verificarse a partir de otros datos del CRD (por ejemplo, edad y sexo), cabe incluirlo, no en forma de pregunta, sino de recordatorio, sin mecanismo de respuesta asociado. Un efecto de apagado puede ayudar a comprender que la omisión del mecanismo de respuesta no es una omisión accidental o defecto de diseño, como en el siguiente ejemplo: 35 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 5.2. Demografía y datos antropométricos basales Esta es una sección bastante simple, que suele presentarse al principio del CRD (primera visita) y que suele incluir: Iniciales del paciente (a menos que se pregunten en la cabecera de cada página). La fecha de nacimiento. El sexo. La raza. La talla. El peso. Es preferible la fecha de nacimiento en lugar de la edad expresada en años, pero, en cualquier caso, no deben preguntarse ambas. En algunos países no está permitido preguntar la raza. 36 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 5.3. Historia médica, enfermedades concomitantes o comorbilidad Esta página está destinada a registrar toda condición patológica que sufra el paciente en el momento de iniciar el estudio. Debería servir para registrar cualquier condición crónica diagnosticada con anterioridad al inicio del estudio, como por ejemplo, diabetes, hipertensión, etc. Las condiciones agudas (por ejemplo, amigdalitis aguda) sufridas con anterioridad que ya se han resuelto antes de iniciar el estudio no suelen ser de interés, a menos que hayan ocurrido poco antes del inicio del ensayo clínico. Por tanto, esta página tendría que invitar a registrar toda condición que, en el momento de iniciar el estudio (o durante cierto periodo previo), permanece activa o ha dejado secuelas (por ejemplo, infarto agudo de miocardio). Los antecedentes quirúrgicos pueden ser poco relevantes (por ejemplo, apendicectomía a los 16 años en un paciente de 45 años), o muy relevantes (by-pass aortocoronario, gastrectomía), según la indicación en estudio. Sea cual sea el propósito concreto de esta página, conviene insertar una instrucción que lo especifique. La información solicitada en esta página puede ser variable según los gustos. Si no existen buenos motivos para ello, es conveniente mantenerla sencilla y no solicitar mucha información de cada condición registrada. Probablemente el mínimo imprescindible es: Condición (campo abierto, suficientemente largo). Fecha de inicio o diagnóstico (campo de tipo fecha, al menos año obligatorio). La continuación de la condición tras la finalización del estudio (o la fecha de resolución). Un ejemplo de diseño para esta página se muestra a continuación: Posible diseño para registrar comorbilidad. 37 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Nótese que la primera pregunta podría parecer innecesaria, pero no es así. Si no la incluyéramos y no se registra ninguna condición en la tabla, no tendríamos evidencia positiva de que no hay condiciones concomitantes. El investigador podría haber omitido esta página inadvertidamente. Este tipo de preguntas que preceden a un bloque de datos se denominan a veces puertas o preguntas-puerta. Hay que tener presente que las enfermedades, intervenciones quirúrgicas o, en general, condiciones patológicas que pueda sufrir un paciente después de iniciarse el ensayo clínico deben considerarse, por definición, acontecimientos adversos. En consecuencia, no deberían registrarse aquí sino en la página de acontecimientos adversos. Por tanto, esta página debe ubicarse en la primera visita exclusivamente. 38 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 5.4. Medicaciones concomitantes o comedicación El objetivo de esta página es registrar cualquier medicación que se administre al paciente durante el estudio (o que se haya administrado inmediatamente antes del iniciarlo), exceptuando el tratamiento propio del ensayo clínico. Estructuralmente, esta página será similar a la de enfermedades concomitantes. Necesitaremos una pregunta puerta y una parrilla para registrar las medicaciones y sus características, entre las que cabe considerar: La fecha de inicio. La fecha de finalización. La vía de administración (por ejemplo: oral, i.m., etc.). La posología (por ejemplo: 100 mg/12h, 20 mg/48h, a demanda, etc.). La continuación tras la finalizar del estudio (si continúa, la fecha de finalización no podrá rellenarse y, de no tener confirmación de continuación, podríamos pensar que se trata de una omisión accidental). Hay quien incluye además un campo para registrar la indicación del tratamiento, pero esta práctica suele tener más inconvenientes que ventajas. Se trata, de hecho, de información redundante porque dichas indicaciones deberían estar registradas como enfermedades concomitantes o como acontecimientos adversos. Por tanto, la inclusión de este campo debe obligar a verificar la consistencia con lo registrado en esas páginas. Además, una medicación puede indicarse para más de una patología (por ejemplo, diuréticos para insuficiencia cardíaca e hipertensión), lo que complica considerablemente las cosas. Es muy recomendable que todos los tratamientos concomitantes se registren en la misma página y que exista una sola de estas páginas (en lugar de incluir una en cada visita), posiblemente ubicada al final del CRD. Por tanto, convendrá incluir recordatorios en cada visita para que el investigador no olvide registrar cualquier nuevo tratamiento, o cambio de tratamiento en esta página. 39 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 5.5. Acontecimientos adversos (AA) Esta es una de las páginas más importantes y más complejas del CRD. Su importancia viene dada por el tipo de información que se registra, que es crucial para evaluar la seguridad de un medicamento. Su complejidad viene dada por la dificultad que entraña el registro de la información relevante de un modo estructurado. Es esta página se pretende registrar todo acontecimiento adverso que ocurra al paciente durante el estudio. Como ya se ha comentado en unidades previas, el concepto de AA es muy amplio. Constituyen AA todas las enfermedades, las intervenciones quirúrgicas, los accidentes (por ejemplo, caída casual) y sus consecuencias (por ejemplo, traumatismos, quemaduras), los síntomas o signos aislados (por ejemplo, cansancio, náuseas, mareo, tristeza) y los hallazgos anormales en exploraciones complementarias (por ejemplo, valores de analíticas, resultados de electrocardiogramas). La diversidad de AA hace muy difícil el registro de sus características de una forma sistemática y estructurada. A pesar de ello, es importante registrar, además de los AA, ciertas características como las siguientes: La fecha de inicio (completa) del AA. La fecha de finalización (completa) del AA. La gravedad (de acuerdo con cierta definición establecida) del AA. La intensidad del AA. La relación del AA con el tratamiento del ensayo clínico, por apreciación subjetiva del investigador. Las medidas adoptadas (por ejemplo, disminuir o retirar el tratamiento del ensayo clínico, administrar tratamientos específicos). La resolución o consecuencias (por ejemplo, resolución con o sin secuelas, incapacidad permanente, muerte). Estructuralmente, esta página es similar a las anteriores, con una pregunta puerta y una parrilla para registrar cada AA y sus características. Al igual que en el caso de los tratamientos concomitantes, es muy recomendable que todos los AA se registren en la misma página y que exista una sola de estas páginas al final del CRD en lugar de incluir una en cada visita (es posible que necesitemos más de una página física si en el estudio se esperan abundantes AAs, pero en tal caso las situaremos todas juntas, en una única sección dedicada al registro de AA). Por tanto, convendrá incluir recordatorios en cada visita para que el investigador no olvide registrar cualquier nuevo AA o cambio en AA registrados previamente y pendientes de resolución. 40 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 5.6. Finalización del estudio Esta página pretende registrar información relativa a la completitud del ensayo clínico. Algunos pacientes abandonan el estudio antes de completarlo en la forma prevista en el protocolo. En tal caso, es importante saberlo, así como conocer los motivos. Normalmente, se pregunta en primer lugar si el paciente ha completado el estudio. En caso de que no sea así se solicita el motivo (fundamental) y la fecha de interrupción del estudio. La lista de opciones de respuesta a esta pregunta es variable según los usos de cada compañía, pero suelen estar presentes las siguientes (o variaciones de ellas): Acontecimiento adverso. Exitus. Fracaso terapéutico. Retirada de consentimiento. Violación del protocolo. Pérdida de seguimiento (el paciente no acude a visita). En caso de exitus, debe registrarse el motivo y la fecha del mismo. No olvidéis incluir un espacio para la firma del investigador (al menos en esta hoja). 41 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Resumen La elaboración de CRD es una tarea de extremada importancia durante el diseño de un ensayo clínico. De ella dependerá la calidad de los datos y, por tanto, la credibilidad de los resultados de un ensayo clínico. . El diseño de CRD es una tarea en la que es fácil cometer errores de diseño o, al menos, terminar con un diseño que diste de ser óptimo. Entre otras ventajas, la estandarización permite ir depurando el resultado, además de agilizar y hacer más eficientes todos los procesos en los que interviene el CRD. No sólo su diseño y su cumplimentación, sino también la revisión, grabación, validación y análisis de los datos. Algunas de las recomendaciones más destacables al abordar el diseño de un CRD son las siguientes: Incluid todo lo necesario, pero sólo lo necesario. Aseguraos la identificación de la información mediante el uso de identificadores apropiados (por ejemplo, número de paciente). Sed breves y claros al redactar preguntas, instrucciones y recomendaciones. Evitad las redundancias: no solicitéis dos veces lo mismo. Evitad en lo posible las preguntas abiertas. Si podéis, usad preguntas cerradas y semi-cerradas y pre-codificadlas. Utilizad los efectos de texto y el diseño gráfico para facilitar la cumplimentación (identificación de los distintos elementos a golpe de vista). Aseguraos de que es consistente con todos los elementos repetitivos del CRD: desde los códigos asignados a las respuestas “sí/no”, hasta la ubicación del número de visita en una página o el tipo de letra y la forma de las cajas en todo el CRD. Antes de darlo por bueno, verificad la consistencia con el protocolo (por ejemplo, criterios de inclusión). Cuando hayáis terminado (o así lo creáis), haced que lo revise una persona con criterio pero que no haya estado vinculado a su elaboración. 42 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Ejercicios En este apartado de la unidad encontraréis tres ejercicios resueltos, en el que se os plantean distintas preguntas. Os recomendamos que los resolváis antes de consultar las soluciones. 43 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Ejercicio 1 Diseña una página de CRD para registrar los siguientes datos de laboratorio: Hematología: Leucocitos, Hematíes, Hemoglobina, Hematocrito y Plaquetas. Bioquímica: Sodio, Potasio, Creatinina, SGOT y SGPT. Ejercicio 2 La sección que se muestra a continuación presenta varios inconvenientes. Cita al menos dos. 44 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Ejercicio 3 En un cuaderno de recogida se incluía la siguiente sección: Un investigador respondió como se muestra a continuación: Este investigador interpretó que le estaban solicitando los años (en este caso 5) y su equivalente en meses (12x5=60). ¿Cómo podría haberse evitado este error? 45 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Soluciones Ejercicio 1 La página que has dibujado puede diferir considerablemente de la que se presenta a continuación como solución a este ejercicio: Número de estudio Iniciales del paciente Número de centro / número de paciente XXXXXXX VISITA xx Hematología y Bioquímica Recuerde: no olvide registrar en la página de Acontecimientos adversos (pág. xx) cualquier valor clínicamente significativo. De todas formas, ten en cuenta: 1. Es importante no haber olvidado la cabecera con los identificadores imprescindibles: número de estudio, iniciales del paciente, número de centro y paciente, número de visita, número de página / número total de páginas y título de la página. Las casillas correspondientes al número de centro y al número de paciente nos indican que no vamos a tener más de 99 centros ni más de 99 pacientes por centro. Además, se ha añadido la versión y fecha del protocolo sobre la cual estaremos diseñando nuestro cuaderno, así como la versión y fecha del CRD. Dado que tanto para los protocolos como para los CRD generalmente se generan muchas versiones, es necesario identificarlas convenientemente. 46 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) 2. Recogemos fecha de extracción de la muestra. La fecha de la visita estará recogida en la primera página de la visita que corresponda. El registro de otra fecha en esta página no se considera una duplicidad ya que en muchas ocasiones la extracción no se realiza exactamente el mismo día y por tanto, las fechas pueden ser distintas. Etiquetando el campo de fecha indicamos cómo debemos recogerla: dos dígitos para el día, dos para el mes y cuatro para el año. 3. Se ha dibujado una casilla grande en blanco para el registro del valor. En este caso se ha optado por dejar un espacio en blanco y no incluir las unidades. Aunque esto pueda parecer poco ortodoxo, en la práctica puede ser la mejor solución por dos motivos: Primero, porque a veces los investigadores suelen utilizar las cifras analíticas sin tener demasiado claras las unidades y pueden cometer errores tanto si el CRD exige una unidades determinadas como si se espera que el investigador las indique. Segundo porque conoceremos las unidades cuando solicitemos al laboratorio del centro los intervalos de normalidad de cada variable analítica, cosa que tendremos que hacer ineludiblemente en todo ensayo clínico con determinaciones analíticas. 4. La página está un poco vacía. Si se trata de un estudio corto con pocas páginas es correcto. Si se tratara de un estudio largo deberíamos procurar registrar más información en cada página ya que, si no, el CRD nos resultaría demasiado voluminoso. 5. Se ha añadido un recordatorio para el investigador. Este tipo de recordatorios son útiles, si no hay muchos y si son claros y concisos. Hay personas partidarias de convertir este tipo de avisos en preguntas del tipo: "¿Hay algún valor clínicamente significativo?" 1=No, 2=Sí. "En caso afirmativo, regístrelo, por favor, en la página de acontecimientos adversos". No obstante la información que se obtiene no es necesariamente mejor y, además, estamos obligando al investigador a rellenar una casilla más, al grabador de datos a realizar otra pulsación y al gestor de datos a revisar la consistencia entre esta respuesta y lo registrado en la página de acontecimientos adversos. 47 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Ejercicio 2 Los posibles inconvenientes que se podrían generar en el momento de rellenar esta sección serían los siguientes: 1. El investigador debe realizar muchos cálculos innecesarios. Por ejemplo, el cálculo de las medias. 2. Una vez calculada la velocidad media, se indica que se debe codificar el resultado en función de si es superior o igual a 0,6 m/sec o inferior. Esto es innecesario ya que podrá hacerse a posteriori. 3. En el caso de que el paciente no haya podido realizar el ejercicio, se debe marcar 0=imposible y se debe especificar por qué. Debería analizarse si es realmente necesario un campo abierto para el “por qué” ó simplemente sería suficiente que el investigador indicara que ha sido imposible realizar el ejercicio. 4. La disposición de los elementos no ayuda a entender lo que hay que hacer. Las cajas reservadas para codificar la velocidad (a la derecha) están alineadas con los intentos, de modo que, a primer golpe de vista, parece que deban alojar información de los intentos (cuando no es así). Esto hace que no sea inmediato entender lo que hay que responder en estas cajas que, por otra parte, no están encabezadas o precedidas por título o pregunta alguna. 5. Las instrucciones son demasiado extensas. 6. Se duplica innecesariamente la estructura intento / 2º intento. Se podría haber creado una estructura como la que se muestra a continuación: Tiempo (segundos) Nº de pasos intento 2º intento Media Y después preguntar las medidas derivadas, si es que son necesarias para tomar alguna decisión. 48 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Ejercicio 3 Con el fin de evitar este tipo de respuestas podríamos haber añadido el vocablo "y" entre las casillas correspondientes a los años y los meses, o haber añadido una instrucción como por ejemplo: 49 de 50 Unidad 6. Diseño del cuaderno de recogida de datos (CRD) Bibliografía Cobos A, Francesch JJ. (1996). Cómo diseñar un cuaderno de recolección de datos. Jano; LI: 1681. Lawrence G. "Case record form design". En : Rondel RK, Varley SA, Webb CF. (1993) Clinical Data Management. West Sussex; 133-152. Stone DH. (1993). "Design a questionnaire". BMJ; 307:1264-1266. Spilker B, Schoenfelder J. (1991). Data Collection Forms in Clinical Trials. New York: Raven Press. 50 de 50