Termodinámica Unidad 3 Primera Ley
Anuncio

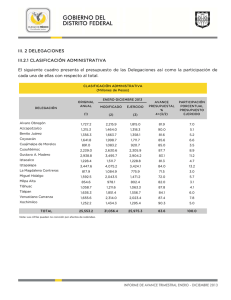
Termodinámica: Primera Ley de la Termodinámica Presenta: M. I. Ruiz Gasca Marco Antonio Instituto Tecnológico de Tláhuac II Septiembre, 2015 Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 1 / 12 1 Introducción y objetivo 2 3.1 Transferencia de energía por calor, trabajo y masa 3 Ejercicio 1 4 3.2 Ecuación general de la Energía 5 Ejercicio 2 6 3.3 Balance de energía para sistemas cerrados 7 3.4 Balance de energía para sistemas de flujo estable. 8 3.5 Balance de energía para sistemas de flujo No estable. 9 Ejercicio 3 y 4 10 Conclusiones Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 2 / 12 Introducción y objetivo Objetivo: Aplicar la primera ley de la termodinámica para realizar balances de energía en sistemas cerrados y abiertos. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 3 / 12 Introducción y objetivo Acerca de la primera ley: Como una de las leyes más importantes de la termodinámica nos introduce el principio general de conservación de la energía, lleva al concepto de energía interna de una sustancia. El estudio de estos principios nos permite relacionar los cambios energéticos en las fronteras de un sistema. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 3 / 12 3.1 Transferencia de energía por calor, trabajo y masa Primera Ley de la Termodinámica: Transferencia de energía por calor, trabajo y masa. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 4 / 12 3.1 Transferencia de energía por calor, trabajo y masa Joule y el equivalente mecánico del calor Los resultados experimentales de James Prescott Joule (1818-1889) con el siguiente dispositivo: Arrojan la siguiente equivalencia: El trabajo de 4,184J es necesario para elevar la temperatura de 1g de agua en 1◦ C. El equivalente mecánico del calor queda: 4,184J(mecánica) = 1cal(térmica) Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 4 / 12 Ejercicio 1 Ejercicio Se deja caer agua desde una altura h sobre el suelo, en un recipiente termicamente aislado y lleno de agua. Considere que toda la energía mecánica potencial en la caída se convierte en calor. ¿Cuál debe ser h para elevar la temperatura 1◦ C? (tip: Q = mc∆T) Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 5 / 12 3.2 Ecuación general de la Energía Primera Ley de la Termodinámica: Ecuación general de la energía. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 6 / 12 3.2 Ecuación general de la Energía Considere el experimento de Joule, pero ahora las paredes aislantes serán paredes conductoras. Postulado del Primer principio de la energía Uno de los posibles postulados de la primera ley es: La variación de energía interna de un sistema es igual al calor transferido al sistema más el trabajo realizado por el sistema Aunque se puede enunciar de diversas formas, está tan bien establecida que no se cuestiona su validez cuando se aplica adecuadamente a problemas reales. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 6 / 12 3.2 Ecuación general de la Energía Ecuación General de la Energía Para un sistema cerrado es: ∂Q = dE − ∂W Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 6 / 12 Ejercicio 2 Ejercicio [Primera ley] Agitación del agua: Un sistema consiste en 3kg de agua. Sobre él se realiza un trabajo de 25 kJ agitándolo con un mecanismo. Durante el proceso, 15 kcal de calor se escapan del sistema debido a imperfecciones en el aislamiento. ¿Cuál es la variación de energía interna? Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 7 / 12 3.3 Balance de energía para sistemas cerrados Primera Ley: Balance de energía para sistemas cerrados. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 8 / 12 3.3 Balance de energía para sistemas cerrados Ecuación de conservación de energía para un sistema cerrado También conocida como balance energético general para un sistema cerrado además de ser como se expresa la primera Ley: ∆Emc = Q + W donde Em c es la energía de la masa de control. Con palabras: Variación de energía del sistema = Transferencia neta de energía al sistema mediante interacción de calor+ Transferencia neta de energía al sistema mediante interacción de trabajo. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 8 / 12 3.3 Balance de energía para sistemas cerrados Forma Diferencial Además de la presentada anteriormente, la forma referida al tiempo del balance de energía para sistemas cerrados: dEmc = Q̇neto + Ẇneto dt Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 8 / 12 3.4 Balance de energía para sistemas de flujo estable. Fundamento teórico: Balance de energía para sistemas de flujo estable. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 9 / 12 3.4 Balance de energía para sistemas de flujo estable. Proceso cíclico estable 1.- Para un sistema cerrado que experimenta un procesos cíclico, el principio de conservación queda: I I ∂Q + ∂W = 0 Régimen estacionario 2.- Cuando un sistema funciona en régimen estacionario, el tiempo deja de ser una variable del problema, esto significa: dE =0 dt Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 9 / 12 3.4 Balance de energía para sistemas de flujo estable. Algunos dispositivos que pueden trabajar en procesos de flujo estable durante su operación: Figura: Bomba (aumento de presión). Marco Antonio (ITT II) Figura: Compresor (cambio de volumen) México D.F., Tláhuac Septiembre, 2015 9 / 12 3.4 Balance de energía para sistemas de flujo estable. Algunos dispositivos que pueden trabajar en procesos de flujo estable durante su operación: Figura: Turbina (disminución de presión, pero velocidad de salida mayor) Figura: Toberas y Difusores Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 9 / 12 3.5 Balance de energía para sistemas de flujo No estable. Primera Ley de la termodinámica: Balance de energía para sistemas de flujo No estable. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 10 / 12 3.5 Balance de energía para sistemas de flujo No estable. Sistemas de flujo no estable De igual manera que lo visto en la unidad 1 para el caso de la masa, un régimen no estable conduce a estados transitorios, es decir: dE 6= 0 dt Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 10 / 12 Ejercicio 3 y 4 Ejercicios Dos sistemas cerrados, A y B experimentan un proceso en el cual se transfieren trabajo, y la energía de cada uno aumenta. (a) En el sistema A, el trabajo transferido al sistema es 100,0 kJ, y la energía total aumenta en 55,0 kJ. (b) En el sistema B, el sisema realiza un trabajo de 77,800 ft lbf , mientras que la energía total aumenta en 55 Btu. Encuéntrese el calor transferido en el sistema A en kJ y en el sistema B en Btu. Comentese si se suministra o se extrae del sistema. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 11 / 12 Ejercicio 3 y 4 Ejercicios A un sistema cerrado se le suministra energía mediante una resistencia eléctrica y una rueda de paletas, 188.5 y 30.0 W respectivamente. La ecuación del flujo de calor cedido al entorno está dada por Q̇sal = 218,5(1 − exp(−0,03t)), donde t está en segundos y Q̇ en vatios. (a) Determinese la ecuación de la variación de energía del sistema dE respecto al tiempo en función del dt tiempo. (b) Represéntese gráficamente esta relación funcional para los 3 primeros minutos de funcionamiento. Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 11 / 12 Conclusiones Conclusiones y parte final Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 12 / 12 Conclusiones Gracias por su atención Sección de preguntas, discusión, comentarios y conclusiones Marco Antonio (ITT II) México D.F., Tláhuac Septiembre, 2015 12 / 12