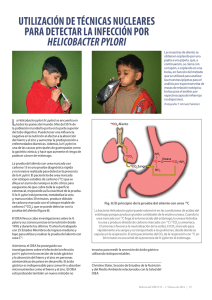
TesisMayofinal 09x - Instituto Politécnico Nacional
Anuncio

INSTITUTO POLITÉCNICO NACIONAL “PREDICCIÓN Y ANÁLISIS COMPUTACIONAL DE NUEVAS INTERACCIONES ENTRE PROTEÍNAS QUE PARTICIPAN EN LA PATOGÉNESIS DE Helicobacter pylori” TESIS Que para obtener el grado de: MAESTRO EN CIENCIAS EN BIOTECNOLOGÍA GENÓMICA Presenta: ALDO SEGURA CABRERA Reynosa, Tamaulipas, México, Junio del 2009 ÍNDICE CONTENIDO ................................................................................................................................ PÁGINA ABREVIATURAS...................................................................................................................................... i RELACIÓN DE CUADROS Y FIGURAS ...............................................................................................ii RESUMEN ............................................................................................................................................... iv ABSTRACT.............................................................................................................................................. vi 1 INTRODUCCIÓN .................................................................................................................................. 1 2 ANTECEDENTES ................................................................................................................................. 3 2.1 Historia y características generales de Helicobacter pylori................................................................. 3 2.2 La infección por Helicobacter pylori ................................................................................................... 3 2.2.1 Enfermedades producidas por Helicobacter pylori .......................................................................... 3 2.3 Aspectos moleculares de Helicobacter pylori ..................................................................................... 5 2.3.1 Genómica................................................................................................................................... 5 2.3.2 Transcriptómica y proteómica ................................................................................................... 7 2.3.3 Interactómica ............................................................................................................................. 9 2.4 Métodos para la determinación de interacciones entre proteínas ...................................................... 11 2.4.1 Métodos experimentales .......................................................................................................... 12 2.4.1.1 Sistema de dos híbridos en levadura ............................................................................. 12 2.4.1.2 Purificación por afinidad en tándem acoplada a espectrometría de masas ............................. 14 2.4.1.3 Interacciones entre proteínas a nivel atómico................................................................ 16 2.4.2 Métodos computacionales ....................................................................................................... 16 2.5 Bases de datos de interacciones entre proteínas ................................................................................ 20 2.5.1 BIND (Biomolecular Interaction Network Database) ............................................................. 21 2.5.2 DIP (Database of Interacting Proteins) ................................................................................... 21 2.5.3 MINT (Molecular INTeraction database) .............................................................................. 21 2.5.4 3did (3D interacting domains) ................................................................................................. 22 2.5.5 IntAct (IntAct database) .......................................................................................................... 22 2.5.6 HPRD (The Human Protein Reference Database) .................................................................. 22 2.6 Calidad de los métodos de determinación de interacciones entre proteínas ...................................... 23 3 PLANTEAMIENTO DEL PROBLEMA ............................................................................................. 25 4 JUSTIFICACIÓN ................................................................................................................................. 25 5 OBJETIVOS ......................................................................................................................................... 26 5.1 Objetivo general ................................................................................................................................. 26 5.2 Objetivos específicos ......................................................................................................................... 26 6 HIPÓTESIS .......................................................................................................................................... 26 7 METODOLOGÍA ................................................................................................................................. 27 7.1 Obtención de las proteínas de participación conocida en la patogénesis (proteínas raíz) ................. 27 7.2 Construcción de la red de interacciones entre proteínas de H. pylori................................................ 27 7.3 Predicción de nuevas interacciones y proteínas involucradas en la patogénesis de H. pylori ........................................................................................................................................................ 28 7.4 Análisis del papel de las predicciones en patogénesis ....................................................................... 29 8 RESULTADOS .................................................................................................................................... 30 8.1 Proteínas asociadas a motilidad y quimiotaxis .................................................................................. 34 8.2 Proteínas asociadas a la adaptación al medio ácido ........................................................................... 39 8.3 Proteínas asociadas al metabolismo del nitrógeno ............................................................................ 41 8.4 Proteínas asociadas con el sistema de secreción tipo IV ................................................................... 43 8.5 Proteínas asociadas con la respuesta a estrés ..................................................................................... 45 8.6 Proteínas asociadas a la síntesis de lipopolisacáridos ........................................................................ 45 9 DISCUSIÓN ......................................................................................................................................... 50 9.1 Proteínas asociadas a motilidad y quimiotaxis .................................................................................. 54 9.2 Proteínas asociadas a la adaptación al medio ácido ........................................................................... 57 9.3 Proteínas asociadas al metabolismo del nitrógeno ............................................................................ 60 9.4 Proteínas asociadas con el sistema de secreción tipo IV ................................................................... 61 9.5 Proteínas asociadas con la respuesta a estrés ..................................................................................... 63 9.6 Proteínas asociadas a la síntesis de lipopolisacáridos ........................................................................ 66 9.7 Interconexión entre agrupamientos de proteínas ............................................................................... 68 9.8 Limitaciones del estudio ................................................................................................................... 69 10 CONCLUSIONES .............................................................................................................................. 71 11 RECOMENDACIONES..................................................................................................................... 72 12 REFERENCIAS.................................................................................................................................. 73 13 GLOSARIO ...................................................................................................................................... 102 14 APÉNDICE ....................................................................................................................................... 106 ABREVIATURAS 3D: Tridimensional. ADN: Ácido desoxirribonucleico. ARN: Ácido ribonucleico. ATP: Adenosín trifosfato. BLAST: de las siglas en inglés, herramienta para la búsqueda del alineamiento local básico. COX: Ciclo oxigenasa. MALDI-MS: Espectrometría de masas, variante desorción/ionización láser asistida por matriz. MALT: Linfoma asociado a mucosa. NCBI: Centro Nacional para la Información Biotecnológica de EE.UU., por sus siglas en inglés. ORF: Marco de lectura abierto, por sus siglas en inglés. PIANA: Análisis de redes e interacciones entre proteínas, por sus siglas en inglés. RMN: Resonancia magnética nuclear. ROS: Especies reactivas de oxígeno. STRING: Herramienta de búsqueda para la recuperación de interacciones de genes/proteínas, por sus siglas en inglés. TAP-MS: Purificación por afinidad en tándem acoplada a espectrometría de masas, por sus siglas en inglés. Y2H: Sistema de doble híbrido en levadura, por sus siglas en inglés. i RELACIÓN DE CUADROS Y FIGURAS CONTENIDO ............................................................................................................................. PÁGINA Cuadro1. Asociación entre el contexto funcional de proteínas (GUP) y su conocida función en patogénesis .......................................................................................................................................... 31 Cuadro 2. Valores de GUP para cada una de la proteínas que integraron la red de interacción y su probable asociación en patogénesis de H. pylori........................................................... 32 Cuadro 3. Lista de proteínas candidato asociadas a quimiotaxis y motilidad ........................................ 35 Cuadro 4. Lista de proteínas candidato asociadas a adaptación al medio ácido .................................... 40 Cuadro 5. Lista de proteínas candidato asociadas al metabolismo del nitrógeno .................................. 42 Cuadro 6. Lista de proteínas candidato asociadas al sistema de secreción tipo IV ................................ 43 Cuadro 7. Lista de proteínas candidato asociadas a proteínas de respuesta a estrés .............................. 46 Cuadro 8. Lista de proteínas candidato asociadas a síntesis de lipopolisacáridos ................................. 48 Figura 1. Método de doble hibrido en levadura ...................................................................................... 14 Figura 2. Método de purificación por afinidad en tándem acoplado a espectrometría de masas ........................................................................................................................................................ 15 Figura 3. Métodos computacionales de predicción de interacciones entre proteínas basados en el contexto genómico .......................................................................................................................... 18 Figura 4. Construcción de la red de interacción a partir de las proteínas raíz obtenidas de la base de datos MvirDB.............................................................................................................................. 27 Figura 5. Cálculo del GUP de una proteína, del valor predictivo positivo y la sensibilidad a diferentes umbrales de GUP .................................................................................................................... 28 Figura 6. Red de interacción entre proteínas asociadas a patogénesis de H. pylori ............................... 33 Figura 7. Agrupamiento de proteínas asociadas a la quimiotaxis y motilidad ....................................... 34 Figura 8. Estructura cristalográfica donde se observa la interacción entre las proteínas CheA y CheY de E. coli........................................................................................................................... 36 ii Figura 9. Organización a nivel genómico de los genes fliF, fliG y fliH, respecto a los genes candidato dxs y lepA ................................................................................................................................ 38 Figura 10. Agrupamiento de proteínas asociadas a la adaptación al medio ácido ................................. 39 Figura 11. Estructura cristalográfica donde se observa la interacción entre la proteína NikR y el ADN de E. coli .................................................................................................................................. 40 Figura 12. Agrupamiento de proteínas asociadas a el metabolismo del nitrógeno ................................ 41 Figura 13. Agrupamiento de proteínas asociadas al sistema de secreción tipo IV ................................. 43 Figura 14. Agrupamiento de proteínas asociadas a la respuesta a estrés................................................ 45 Figura 15. Estructura cristalográfica donde se observa la interacción entre la subunidad alfa de la ADN polimerasa con TrxA, durante el proceso de reparación del ADN del bacteriófago T7 ........................................................................................................................................ 47 Figura 16. Agrupamiento de proteínas asociadas a síntesis de lipopolisacáridos .................................. 48 iii Predicción y análisis computacional de nuevas interacciones entre proteínas que participan en la patogénesis de Helicobacter pylori Resumen La información de interacciones entre proteínas producto de experimentos a gran escala en humano y otros organismos eucariotes ha sido de gran valor para la comprensión a nivel de sistemas de diversos procesos biológicos. Sin embargo, en organismos procariotes se dispone de limitada información sobre las interacciones entre proteínas; siendo Helicobacter pylori (H. pylori) el primer organismo de este tipo estudiado a nivel de las interacciones entre proteinas. Para contribuir al entendimiento de la participación de las proteínas en la patogénesis de H. pylori, se construyó una red de interacción para 127 proteínas asociadas a patogénesis, combinado datos de interactomas obtenidos a nivel experimental, predicciones de alta confiabilidad y análisis in silico. La red resultante presentó un total de 330 proteínas con 1,271 interacciones. La predicción de nuevas interacciones entre proteínas se realizó mediante los métodos de búsqueda de interólogos y basados en el contexto genómico, en combinación con información derivada de experimentos de los interactomas disponibles y minería de datos. Todas las proteínas presentes en la red se agruparon de acuerdo a procesos celulares específicos, esto indica que el análisis realizado esta en concordancia con la evidencia experimental disponible de interacciones proteína-proteína. Para predecir nuevas proteínas patogénicas se realizó un análisis del contexto funcional para cada una de las proteínas que integraron la red. Cincuenta proteínas candidato se obtuvieron con valor predictivo positivo y sensibilidad superior al 60%. El análisis in silico predice la asociación de las proteínas candidato con los procesos de quimiotaxis y motilidad, adaptación al medio ácido, respuesta al estrés, sistema de secreción tipo IV, síntesis de lipopolisacáridos y formación de biopelículas. Se demostró la importancia del análisis computacional de redes de interacción para caracterizar la posible función de proteínas hipotéticas o para explorar nuevas funciones de proteínas conocidas. Así, se proponen funciones para 13 proteínas hipotéticas, para la proteína CheA, para el regulador transcripcional Nik.R y para la superóxido dismutasa SodB. CheA es una proteína de conocida función en quimiotaxis; en el presente estudio se determinó su posible asociación con la exportación de proteínas flagelares durante el ensamblaje del flagelo y iv con la formación de biopelículas, el cual es un proceso poco comprendido en el contexto de la patogénesis de H. pylori. NikR fue asociada con la adaptación al medio acido y SodB con la inhibición de la apoptosis de las células del hospedero. Finalmente, estas nuevas interacciones proporcionan una base teórica para descubrir nuevos factores asociados a patogénesis mediante su validación experimental y para el desarrollo de estrategias terapéuticas novedosas. v Computational prediction and analysis of novel interactions between proteins involved in Helicobacter pylori pathogenesis Abstract Information on protein interactions produced by large-scale experiments in human and other eukaryotic organisms has contributed to the understanding of biological processes at system level. However, only a limited amount of interaction data is available for prokaryotes, the main information was produced from Helicobacter pylori (H. pylori). To better understand the participation of proteins in H. pylori pathogenesis, we built a protein interaction network for 127 known proteins involved in H. pylori pathogenesis and expanded the network by combining experimental interactome data, high confidence predictions and in silico analysis. The resulting interaction network includes 1,271 interactions between 330 proteins. To predict protein–protein interactions, the interolog and genomic context methods were used in combination with the information derived from existing high-throughput interactome assays and data mining. All the proteins present in the network were clearly located in different clusters, which resulted to have a correspondence with specific cellular processes. This indicates that our analysis is reliable. To predict novel pathogenic proteins an analysis of functional context for each protein was carried out. In this network, 50 pathogenesis candidate proteins were identified with more than 60% positively predictive value and sensitivity. The in silico analysis predicts the involvement of candidate proteins in chemotaxis and motility, acid adaptation, response to stress, secretion system type IV, lipopolysaccharides synthesis and biofilm formation. The importance of computational analysis in protein interaction networks to characterize the possible function of unknown proteins or to explore new function of known proteins was demonstrated. These include 13 hypothetical proteins, the CheA protein, the transcriptional regulator NikR and superoxide dismutase SodB. CheA, a known chemotactic protein, was shown to be associated with protein exportation during flagellar assembly, and appears to be involved in early biofilm formation; such process is still poor understood in the H. pylori pathogenesis context. NikR was associated to acid adaptation and SodB has been involved in the inhibition of host cell apoptosis. Finally, these new interactions provide a theoretical basis for finding new factors in pathogenesis by further experimental validation and for the development of novel therapeutic strategies. vi 1. Introducción Las interacciones entre proteínas desempeñan un papel fundamental en varios aspectos de la organización estructural y funcional de la célula, y van desde la formación de estructuras macromoleculares y complejos enzimáticos, hasta la regulación y transducción de señales (Pawson et al., 2000, 2002). Actualmente, se cuenta con bases de datos que contienen información sobre interacciones proteína-proteína obtenida mediante métodos experimentales, siendo el sistema de doble híbrido en levadura y la purificación por afinidad acoplada a espectrometría de masas los que han sido aplicados a escala genómica. Así mismo, estos métodos sólo han logrado cubrir una pequeña fracción del proteoma de los organismos en estudio. La compresión global de la interacción entre proteínas, como en el caso de eucariotes, no ha alcanzado el mismo nivel de desarrollo para el caso de las bacterias. Helicobacter pylori (H. pylori) es uno de los organismos mas estudiados a este nivel. Esta bacteria, infecta a más del 50% de la población mundial y en México se estima que más del 66% de la población adulta está infectada con esta bacteria (Torres et al., 1998). La infección por H. pylori es la principal causa de gastritis crónica, ulceras pépticas, y es considerado un factor de riesgo para el desarrollo de adenocarcinoma gástrico y linfomas gástricos (Montecucco et al., 2001; Peek y Blaser, 2002). A pesar de la importancia de H. pylori como patógeno humano, queda mucho por aprender de su biología y los mecanismos por los que causa enfermedad. Los resultados del mapa de interacción de las proteínas determinado experimentalmente en H. pylori sólo cubren el 46% de su proteoma (Rain et al., 2001), así mismo se estima que aproximadamente el 50% de estas interacciones son falsos positivos y negativos, dadas las limitaciones actuales de las técnicas para su estudio (Cusick et al., 2005). De esta manera, existe una gran cantidad y diversidad de interacciones entre proteínas asociadas a patogénesis que no han sido determinadas en esta bacteria. En el presente trabajo, mediante métodos computacionales, se integró información derivada de las diferentes bases de datos de carácter público, la cual permitió predecir y analizar interacciones entre proteínas asociadas a patogénesis de H. pylori. El método parte de la construcción de una red de interacciones entre proteínas a partir de una base de datos de proteínas de asociación conocida a patogénesis. Analizando el contexto funcional de cada una de las proteínas que integraron la red se identificaron nuevas interacciones y 1 proteínas asociadas a patogénesis. También se demuestra que este tipo de análisis puede ser utilizado para visualizar en contexto diferentes procesos biológicos y para generar nuevas hipótesis de acerca de la función y evolución de las proteínas; principalmente, las hipotéticas y proteínas no caracterizadas funcionalmente. Finalmente, se proporciona una lista de 50 proteínas candidato, la cual es evaluada mediante el uso de anotaciones funcionales disponibles en bases de datos públicas y de la búsqueda en la literatura. Se concluye discutiendo el papel de las predicciones en la patogénesis de H. pylori y las limitaciones del presente estudio. 2 2. Antecedentes 2.1. Historia y características generales de Helicobacter pylori En 1975, Colin y Jones observaron bacilos Gram negativos en el 80% de los pacientes con úlcera gástrica. En 1983 Marshall y Warren hallaron bacilos con forma de “S” en biopsias gástricas y las cultivaron usando técnicas para Campylobacter por lo que los denominaron Campylobacter pyloridis. En 1987 Marshall y Godwin realizaron la primera revisión de la nomenclatura denominándolo Campylobacter pylori; posteriormente, mediante estudios filogenéticos se demostró que el microorganismo no pertenece al género Campylobacter y se sugirió un género diferente; Helicobacter (Goodwin et al., 1989). 2.2. La infección por H. pylori La infección por H. pylori es la infección bacteriana más común en el ser humano y por lo menos la mitad de la población mundial está infectada. Su reservorio primario es el estómago humano y su vía de transmisión no está completamente clara pero parece ser por la ruta oral-oral y fecal-oral. La magnitud de la prevalencia esta relacionada con las condiciones sanitarias y económicas, siendo más alta en los países subdesarrollados (Cave, 1997). 2.2.1. Enfermedades producidas por H. pylori Todos los infectados con H. pylori desarrollan gastritis crónica, la cual es asintomática. Solo el 20% tendrán una entidad clínica que incluye úlceras pépticas (15%), cáncer gástrico (1-2%), linfoma gástrico (menos del 1%); por lo tanto la mayoría de los infectados permanecen asintomáticos (Parkin et al., 1988; Nomura et al., 1994; Shimiyama et al., 1997; Strobel et al., 1998; Weel et al., 1998; Ye et al., 1999). La aparición de estas entidades clínicas depende de la interacción entre las características genéticas del huésped, del medio ambiente y del genotipo infectante; actualmente no hay medios clínicos o de laboratorio que identifiquen pacientes que podrían tener secuelas por la infección o pacientes portadores asintomáticos. En varias zonas a nivel mundial se ha demostrado que H. pylori es la principal causa de ulcera péptica, siendo el 90% duodenales y hasta 80% gástricas; en otros países la 3 prevalencia puede disminuir como por ejemplo en EE.UU. debido a mayor consumo de anti-inflamatorios no esteroideos (AINES); la evidencia demuestra que la erradicación del agente causal reduce la recurrencia de ulceras pépticas (Cover et al., 1995; Everhart et al., 2000). La proporción de adenocarcinomas gástricos atribuibles a H. pylori va desde el 60 a 90%, diversos estudios han documentado que H. pylori es la principal causa de este tumor (Guarner et al., 1993; Kobayashi et al., 1993). El cáncer gástrico es la segunda de las neoplasias más frecuentes del tubo digestivo en todo el mundo y en México es la cuarta y quinta para el sexo femenino y masculino, respectivamente (Parkin, 2004). Hasta el momento no se ha identificado que H. pylori produzca mutaciones o carcinogénesis de manera directa, por lo tanto se considera que este efecto lo realiza de manera indirecta estando relacionado con una fuerte respuesta inflamatoria que se desencadena en el estómago infectado la cual se sigue por una serie de cambios morfológicos y moleculares que pueden darse en el orden: gastritis crónica, gastritis crónica atrófica, metaplasia intestinal, displasia y cáncer (Correa y Piazuelo, 2008). Esta secuencia de cambios, sugiere que la inflamación crónica es un pre-requisito para el desarrollo de tumores. La modulación de este proceso inflamatorio, puede determinar en gran parte que se produzca o no un desenlace neoplásico. La diferencia entre estas dos posibilidades es la secreción de ácido: los pacientes con úlcera duodenal presentan secreción normal o aumentada de ácido, y los pacientes con úlcera gástrica, generalmente presentan hipocloridia (Correa y Piazuelo, 2008). La mayoría de las cepas de H. pylori se pueden agrupar en dos fenotipos distintos con base en la presencia o no de la isla de patogenicidad cag (cag-PAI, por sus siglas en inglés), la cual es una región del ADN que contiene de 30 a 40 genes, que codifican factores de virulencia, incluyendo el gen cagA, que codifica la proteína citotóxica CagA (Cecini et al., 1996; Cover et al., 1995; Evans et al., 1998). Las cepas que expresan esta proteína son altamente virulentas e inducen mayor producción de citoquinas inflamatorias como la interleucina 8 (IL–8), e inducen simultáneamente proliferación y apoptosis celular significativa (Pan et al., 1997; Rudi et al., 1998). Estas proteínas Cag son introducidas por H. pylori en el interior de la célula epitelial, por un mecanismo secretor mediante el cual la proteína es inyectada. En el citoplasma la proteína CagA es fosforilada, en grado variable, a mayor fosforilación, mayor potencial oncogénico de la cepa de H. pylori (Odenbreit et al., 4 2000; Stein et al., 2000). La proteína CagA fosforilada interactúa con diversas moléculas y activan proteínas cinasas (Backert et al., 2001; Yamazaki et al., 2003). Cuando una persona está infectada por H. pylori el riesgo de cáncer gástrico es de 2 a 3 veces mayor, pero si tiene anticuerpos anti-Cag A el riesgo aumenta hasta 11 veces pudiendo aumentar hasta 20 veces dependiendo del grado de fosforilación. Más aún, si se combina con la alteración genética del gen que codifica la síntesis de la interleucina 1-β (IL-1β), el riesgo puede aumentar hasta 87 veces (Covacci et al., 1993; Manetti et al., 1995; Cover et al., 1995). La IL-1β, es una citocina proinflamatoria y un muy potente inhibidor de la secreción de ácido (100 veces más potente que el omeprazol) (Susuki et al., 2002; Graham et al., 2003). 2.3. Genómica funcional de H. pylori 2.3.1. Genómica En la actualidad se ha determinado la secuencia del genoma completo de seis cepas de H. pylori (acceso a Entrez Genome marzo 2009): 1) la cepa 26695 que fue aislada en el Reino Unido de un paciente con gastritis (Tomb et al., 1997); 2) la cepa J99 aislada en Estados Unidos de un paciente con úlcera duodenal (Alm et al., 1999); 3) la cepa HPAG1 aislada en Suecia de un paciente con gastritis atrófica crónica (Oh et al., 2006); 4) la cepa Shi470, esta proviene de un aislado del antro gástrico de un paciente amerindio de Perú; 5) la cepa P12, proviene de un aislado clínico de un paciente con úlcera duodenal; y 6) la cepa G27, fue aislada de una endoscopia practicada a un paciente en Toscana, Italia (Baltrus et al., 2009). El cromosoma circular de la cepa 26695 contiene 1,667,867-pb, el de la J99 1,643,831-pb, el de la HPAG1 1, 596,366-pb, el de la Shi470 1,608,548-pb, el de la P12 1,673,813-pb y el de la G27 1,652,983-pb. El promedio en el contenido de G + C es del 39% en todas las cepas secuenciadas. La cepa HPAG1 presenta 43 genes que no son detectables o están representados de manera incompleta en los genomas de J99 y 26695. De estos 43 genes, tres tienen relación con sistemas de restricción-modificación de otras especies bacterianas. Los productos predichos de 15 de los 43 genes antes mencionados presentan alta similitud con otras proteínas reportadas en las otras cepas de H. pylori; dos de estos ORFs codifican para genes asociados con citotoxina cag localizados en una cag-PAI, otros cuatro 5 están relacionados con componentes de sistemas de restricción-modificación, finalmente uno más está relacionado también con proteínas Cag (CagY), sin embargo se encuentra localizado fuera de la isla de patogenicidad (Oh et al., 2006). CagY forma parte de una estructura en forma de pili que es el núcleo del sistema de secreción tipo IV requerido para la translocación de la proteína CagA en las células del epitelio gástrico; la introducción de CagA lleva a la activación en cascada de una serie de cinasas que trae consigo cambios morfológicos en las células del huésped e induce la producción de interleucina-8. Así mismo, HPAG1 carece de 29 genes presentes en las otras dos cepas; cinco de éstos son miembros de los sistemas de restricción-modificación, dos son miembros de la cag-PAI, una proteína periférica de membrana, una integrasa/recombinasa putativa y se desconoce la función de los otros 20. La mayoría de los genes de J99 y 26695 que están perdidos en HPAG1 se localizan en las llamadas zonas de plasticidad. Los tres genomas contienen dos copias de los genes 16S y dos juegos de los genes 5S-23S del ARN ribosomal; adicionalmente la cepa 26695 contiene un gen extra del 5S ARNr. Del mismo modo, la cepa G27 posee 58 genes que no están presentes en las cepas HPAG1, J99 y 26695. La mayoría de estos genes específicos de G27 codifican para proteínas hipotéticas (Baltrus et al., 2009). Un análisis de sintenia de las cepas HPAG1, 26695 y J99 muestran que en contraste a otras bacterias los genes ARNr de H. pylori no están situados continuamente en el cromosoma, sugiriendo que su regulación es más compleja que la de otros procariotes. Los tres genomas codifican para 36 especies de ARNs de transferencia, aparentemente localizados en las mismas regiones del mapa cromosomal en las dos cepas. Otras características que comparten las cepas son: ausencia de un origen de replicación identificable, longitud promedio de secuencias codificables, de donde se han detectado 1536 ORFs para la cepa HPAG1, 1576 para 26695 y 1489 para J99 representando el 91%, el 90% y el 90% del genoma respectivamente (Boneca et al., 2003). 6 2.3.2. Transcriptómica y proteómica En la patogénesis de H. pylori, diversos factores externos influyen, entre los que destaca el pH de las secreciones gástricas, el cual es esencial para el establecimiento y colonización de la mucosa estomacal. Breves exposiciones de la bacteria a pH de 3.5 genera un incremento en la expresión de proteínas de choque térmico y de la colonización estomacal; estos cambios en la fisiología bacteriana se consideran una respuesta a señales fisicoquímicas a través de regulación génica (Tomb et al., 1997). Allan et al., (2001) identificó genes diferencialmente expresados cuando la cepa 26695 fue expuesta a medios con pH 4.0 o pH 7.0. Entre los genes que incrementaron su expresión a pH bajo fueron: cagA, HP0681 y HP1289 (únicos en H. pylori) los cuales participan en el sistema de secreción tipo IV; así como también, genes que codifican para enzimas involucradas en la síntesis de fosfolípidos y lipopolisacáridos. Por otra parte, existen genes cuya expresión génica disminuye a pH bajo, este es el caso de genes que codifican para proteínas involucradas en la síntesis de nucleótidos, proteínas flagelares y proteínas periféricas de membrana. En otro estudio Ang et al., (2001) diseñaron un dispositivo de microarreglos donde productos de PCR fueron fijados a una membrana; representando 1543 ORFs de la cepa 26695. Este método fue utilizado para evaluar la respuesta transcripcional global a las 48 hrs. de crecimiento a pH 5.5 o pH 7.2. Alrededor de 53 ORFs fueron altamente expresados en ambas condiciones; sugiriendo que bajo condiciones estresantes estos genes son esenciales en la fisiología bacteriana. Así mismo, 445 ORFs fueron expresados de manera estable en ambas condiciones sin variación significativa. Esto implica que sus productos probablemente son necesarios para mantener las funciones básicas en la célula bacteriana. A pH bajo, un total de 80 ORFs incrementaron significativamente sus niveles de expresión, mientras que en otros 4 ORFs su expresión fue suprimida. Los restantes 952 ORFs no fueron detectables bajo cualquiera de las condiciones de pH. Scott et al., (2007) sometió a H. pylori a una exposición crónica (10 días) en medio ambiente gástrico y determinó el perfil de expresión génica. La comparación del transcriptoma “in vitro” e “in vivo” a pH 7.4 reveló dos grupos de genes de función conocida que incrementan al doble su expresión; tres de estos grupos responden tanto al medio ácido “in vitro” como a la infección gástrica. 7 Otros investigadores han demostrado que la infección por H. pylori afecta el equilibrio entre proliferación y apoptosis de las células epiteliales gástricas. En particular H. pylori ha mostrado tener la capacidad de inducir la transcripción de la ciclina D1, uno de los reguladores del ciclo celular de las células antes citadas (Hirata et al., 2001). Del mismo modo, la proteína-1 de membrana de H. pylori ha mostrado capacidad de inducir la sobre expresión del factor de necrosis tumoral alfa y producir tumores en ratones desnudos; sugiriendo que este podría ser un mecanismo celular involucrado en el desarrollo de cáncer gástrico (Suganuma et al., 2001). Otro sistema molecular que es inducido por H. pylori y que ha mostrado tener relación con el cáncer gástrico es el sistema de la ciclo oxigenasa 2 (COX 2). El análisis de biopsias de 160 pacientes, 97 con dispepsia no ulcerosa (47 negativos y 50 positivos para H. pylori) y 63 con cáncer gástrico, fue realizado para evaluar tanto la expresión de COX 2 como la proliferación celular y la apoptosis (Wambura et al., 2002). En pacientes con dispepsia no ulcerosa y positivos para H. pylori, la expresión de COX 2 fue significativamente más alta en los que los negativos. Por su parte las biopsias de pacientes con cáncer gástrico presentaron una mayor expresión de COX 2, en las regiones anatomicas que corresponden al cuerpo y antro gastrico, que los pacientes con dispepsia no ulcerosa. Estos resultados sugieren que la expresión de COX 2 está asociada con la pérdida de la integridad en el epitelio gástrico y por lo tanto participa en la carcinogénesis gástrica. Por otra parte, después de la secuenciación de las cepas J99 y 26695, Jungblut et al., (2000) realizaron un análisis comparativo del proteoma de H. pylori en las dos cepas antes citadas y una más, cuyo genoma no ha sido secuenciado (cepa SS1). El análisis del perfil proteico por 2D-PAGE reveló 1863 bandas para la cepa 26695, 1662 para la J99 y 1448 para SS1; estos perfiles revelan alta variabilidad en los productos de expresión de cada cepa. Posteriormente utilizando espectrometría de masas en la variante de desorción/ionización láser asistida por matriz (MALDI-MS), mediante la cual se obtiene la huella digital de las proteínas, se identificaron 152 proteínas, incluidos nueve factores de virulencia y 28 antígenos. Se confirmo la expresión de 27 ORFs hipotéticos y 6 ORFs desconocidos y se observo que sólo un pequeño número de proteínas eran comunes para las cepas estudiadas. Una aproximación similar fue realizada para caracterizar los subproteomas con el fin de identificar proteínas importantes en la interacción huésped-patógeno (Backert et al., 2005). Para ello se realizó el análisis de la composición de dos fracciones proteicas de H. 8 pylori; que corresponden a las proteínas solubles y la otra con las proteínas de la estructura celular (incluidas las de membrana). Las 50 proteínas más abundantes en el análisis de 2DPAGE fueron identificadas mediante su huella digital por MALDI-MS. Numerosas proteínas periféricas de membrana, 4 proteínas Cag, la citotoxina vacuolizante (VacA), otros potenciales factores de virulencia y pocas proteínas ribosomales fueron identificadas en la fracción de proteínas de la estructura celular. En contraste, la enzima catalasa (Kat A), la gamma-glutamiltranspeptidasa (Ggt), y la proteína activadora de neutrófilos (NapA) se encontraron exclusivamente en la fracción de proteínas solubles. La identificación de estos subproteomas es de suma importancia para identificar nuevos factores de virulencia y antígenos de potencial valor terapéutico o diagnóstico contra las infecciones causadas por este patógeno. 2.3.3. Interactómica Con la disponibilidad de la secuencia completa de genomas de varios organismos se han desarrollado aproximaciones globales para un mejor entendimiento de las funciones de las proteínas. Así, se han determinado varios mapas de interacción (interactomas) tanto para eucariotes como en procariotes. El primer mapa de interacciones entre proteínas determinado para un procarionte fue precisamente el de H. pylori (Rain et al., 2001). La estrategia experimental fue el sistema de dos híbridos en levadura; se analizaron 261 proteínas contra una biblioteca compleja de fragmentos genómicos de la cepa 26695, utilizando aproximadamente 10 millones de clonas. De manera general se encontraron más de 1200 interacciones entre proteínas de H. pylori, cubriendo alrededor del 46.6% del proteoma. Explorando el mapa de interacciones proteína-proteína se visualizaron diferentes rutas celulares y se predijo la función de varias proteínas, éste es el caso de sistemas de quimiotaxis. El genoma de H. pylori presenta tres homólogos de proteínas de E. coli que están involucradas en rutas quimiotacticas (CheA, CheW and CheY) y proteínas tales como TlpA similares a receptores de quimiotaxis (MCPs). Los resultados mostraron que la proteína CheA interactúa con CheY y CheW; y los distintos dominios interactuantes fueron identificados de manera precisa. El dominio de CheA que se une a CheY precisamente traslapa con su dominio interactuante; esta asignación se realizó mediante un estudio estructural del homólogo en E. coli (Welch et al., 9 1998). El sitio de unión de TlpA para CheW fue localizado en un dominio susceptible de metilación de una proteína conocida en E. coli, por lo tanto fue implicado en la transducción de señales quimiotácticas. El complejo ureasa también fue examinado. La actividad ureasa es esencial para la patogenicidad de H. pylori y su síntesis requiere dos subunidades estructurales UreA y UreB, y el producto de cuatro genes accesorios: ureE, ureF, ureG, ureH14; los respectivos homólogos en E. coli juegan un papel importante en la incorporación de níquel (Cussac et al., 1992). El mapa de interacción revela la conexión entre UreA y UreB, y una de las dos interacciones homo-oligoméricas de las subunidades estructurales (UreA); el homodímero UreB no fue detectado. Otra conexión fue observada entre proteínas accesorias UreH y UreA mediante sus subunidades estructurales; esto es consistente con el presunto papel de chaperona de UreH (Mobley et al., 1995). Un nuevo vínculo estructural fue encontrado entre UreG y UreE. Adicionalmente a la proteínas accesorias, el operón ureasa codifica para una proteína interna de membrana (UreI); esencial para la adaptación a pH ácido (Skouloubris et al., 1998) y funcionan como un canal para urea dependiente de pH (Weeks et al., 2000). El tercer dominio citoplasmático de esta proteína revela una interacción potencial con la proteína ExbD involucrada en la transmisión de energía mediante fuerza motora de protones a receptores fuera de la membrana celular. La combinación de datos genómicos y proteómicos también ha permitido predecir la función de las proteínas en el contexto de las redes de interacción. El proteoma de H. pylori contiene un homólogo de la proteína HolB en E. coli. En E. coli esta proteína interactúa con HolA para formar parte del núcleo de la ADN polimerasa (Dong et al., 1993). Los resultados en el mapa de interacción de H. pylori muestra un alto puntaje de interacción entre HolB y un polipéptido no caracterizado (HP1247). Un alineamiento entre HolA de E. coli y HP1247 remarca similitud a nivel estructural. Así, tomando como referencia a HolA le fue asignada una función similar a la proteína HP1247 en H. pylori. Varias de las interacciones también fueron analizadas en el contexto de la estructura tridimensional de las proteínas. La ARN polimerasa procariota está compuesta de un núcleo (α2ββ’) asociado con un factor sigma. En H. pylori, las subunidades beta están fusionadas en un polipéptido sencillo (RpoB). Uno de los dos factores sigma alternativos presentes en H. pylori (HP1032) es similar a la proteína FliA de E. coli, la cual es necesaria para la transcripción 10 de genes involucrados en la biosíntesis del flagelo (Liu y Matsumura, 1995). De esta manera se identificó de manera precisa una región de RpoB que interacciona con FliA de H. pylori. Este trabajo es el único que se ha realizado a gran escala para H. pylori y ha permitido la identificación de complejos que están presentes en otros organismos, por ejemplo en E. coli y C. jejuni. Así mismo, se ha complementado el análisis a nivel de secuencia para inferir homología y estudios de predicción de operones basados en la localización de genes en el cromosoma. Finalmente, los dominios interactuantes identificados fueron analizados en el contexto de la estructura tridimensional de las proteínas. Precisamente, este tipo de análisis contextuales permitieron la asignación de funciones para proteínas no caracterizadas, proporcionando materia prima para futuros ensayos biológicos (Rain et al., 2001). 2.4. Métodos para la determinación de interacciones entre proteínas Las interacciones entre proteínas desempeñan un papel fundamental en varios aspectos de la organización estructural y funcional de la célula (Pawson et al., 2000; 2002). Las interacciones entre proteínas básicamente pueden ocurrir en los siguientes niveles: i) las que ocurren entre dominios de una misma cadena polipeptídica, ii) las que ocurren entre dominios de diferentes cadenas polipeptídicas en proteínas multiméricas, y iii) las que ocurren de manera transitoria en complejos formados entre proteínas independientes (Teichmann et al., 2001). Hasta la actualización correspondiente al 23 de marzo del 2009 en el Centro Nacional para la Información Biotecnológica de EE.UU. (NCBI, por sus siglas en ingles) se dispone de las secuencias de aminoácidos codificadas por 867 genomas secuenciados completamente. Además, se dispone de un gran número de datos obtenidos a través de microarreglos de ADN; e información sobre interacciones proteína-proteína obtenida mediante los métodos de dos híbridos en levadura, la purificación por afinidad y los microarreglos de proteínas acoplados a espectrometría de masas, cristalografía de rayos X, co-inmunoprecipitación, resonancia magnética nuclear (RMN) y resonancia de plasmones de superficie (BIAcore). No obstante la gran cantidad de información proporcionada por estos métodos, debido a dificultades para su escalamiento sólo dos de ellos han sido aplicados a escala genómica: el sistema de dos híbridos en levadura y la purificación por 11 afinidad acoplada a espectrometría de masas. Ejemplos de aplicación de estos métodos son los mapas de interacción entre proteínas determinados para Saccharomyces cerevisiae (Uetz et al., 2000; Ito et al., 2001; Gavin et al., 2002; Ho et al., 2002), Caenorhabditis elegans (Walhout et al., 2000), Helicobacter pylori (Rain et al., 2001), Drosophila melanogaster (Giot et al., 2003) y Campilobacter jejuni (Parish et al., 2007). Los resultados proporcionados por estas aproximaciones de análisis global junto con la de experimentos a pequeña escala han dado lugar a la creación de una amplia variedad de bases de datos, al tiempo que la visión sobre la función de las proteínas ha evolucionado. Desde el punto de vista clásico, la función de una proteína, está determinada por su acción local; mientras que en un contexto sistémico la función de una proteína se define como el entramado de interacciones con otras moléculas. Esta nueva forma de comprender a los sistemas biológicos desde un punto de vista contextual es el objeto de estudio de la biología de sistemas. Análisis de genómica funcional han mostrado que la complejidad de los organismos no depende del número de proteínas codificadas en sus genomas, sino del número de interacciones entre ellas (Claverie, 2001). Así, la planta Arabidopsis thaliana, el nemátodo Caenorhabditis elegans, la mosca Drosophila melanogaster y el ser humano poseen un número similar de genes (25,498; 19,099; 14,100 y 30,000-35,000; respectivamente). Por ello, la optimización y el desarrollo de métodos para predecir y analizar los detalles acerca de las interacciones entre proteínas tanto a nivel atómico como a escala genómica sigue siendo una de las áreas en constate desarrollo (Edwards et al., 2002; Jansen et al., 2002). Una vez dilucidadas las redes de interacciones o “interactoma” en sistemas celulares modelos, será posible el diseño de fármacos más específicos y la ingeniería de procesos celulares (Serrano, 2007). 2.4.1. Métodos experimentales 2.4.1.1 Sistema de doble híbrido en levadura (Y2H) El desarrollo de la técnica de Y2H se fundamenta en que activadores transcripcionales eucariotas tienen al menos dos tipos de dominios, uno que se une directamente a la región promotora (dominio de unión al ADN) y otro que activa la 12 transcripción (dominio de activación). Se ha demostrado que la separación del dominio de unión (BD) y del dominio de activación (AD) da como resultado una inactividad transcripcional, la cual es restablecida si el BD se asocia físicamente con un AD (Fields y Song, 1989). Así, un segmento de ADN que codifica para una proteína de interés es fusionado al respectivo que codifica para un BD (construcción cebo o carnada). Un procedimiento similar es utilizado para crear una quimera que incluye un segmento codificante para otra proteína de interés fusionado a un AD (construcción presa). Ambas construcciones son clonadas por separado en vectores de expresión e introducidas en una célula de levadura. Una vez expresadas las proteínas fusionadas y si éstas interaccionan el factor transcripcional podrá ensamblarse, activando la transcripción de un gen reportero (Figura 1). Los sistemas Y2H más ampliamente utilizados son los basados en GAL4/LexA, donde GAL4 controla la expresión del gen LacZ que codifica para la beta-galactosidasa. Para realizar un escaneo a nivel genómico dos variantes del sistema Y2H han sido desarrolladas: escaneo basado en una matriz y escaneo sobre una biblioteca. En la primer variante de las antes mencionadas, se crea una matriz de clonas “presa”, donde cada clona expresa una proteína “presa” particular en un pocillo de una placa de reacción. Entonces, cada proteína “cebo” es acoplada sobre un arreglo de clonas “presa” y aquellas donde dos proteínas interaccionan son seleccionadas en base a la expresión de un gen reportero y a su posición en la placa de reacción. En la segunda variante, cada “cebo” es escaneado contra una biblioteca que contiene segmentos al azar de cADN u ORFs. Así, aquellas proteínas que interaccionan serán seleccionadas por su capacidad de crecer sobre sustratos específicos y caracterizadas mediante secuenciación. Las principales ventajas del método Y2H son: rapidez y sencillez, detección de interacciones transitorias y que es realizado in vivo. 13 Figura 1. Método de doble híbrido en levadura. Sin embargo el método también presenta desventajas, entre ellas: interferencia entre los dominios fusionados, detección de interacciones uno a uno dejando de lado los efectos cooperativos, su capacidad de detectar interacciones transitorias la hace susceptible de uniones inespecíficas, los procesos de modificación post-traduccional y de plegamiento pueden variar entre la levadura y otros organismos. Esto hace difícil escanear proteínas de mamíferos y de procariontes mediante Y2H, así como también proteínas de membrana. Se pueden utilizar diferentes técnicas de análisis in vitro para validar los resultados de Y2H pueden (Shoemaker y Panchenko, 2007). 2.4.1.2. Purificación por afinidad en tándem acoplada a espectrometría de masas (TAP-MS) Este método consiste en la generación de una construcción que incluye un segmento génico que codifica para una proteína de interés con un segmento que codifica para la etiqueta TAP. Una etiqueta TAP está formada por la proteína A de Staphylococcus con dominios de unión para inmunoglobulina G (IgG), y un péptido de unión a calmodulina separado por un sitio de rompimiento para la proteasa del virus del tabaco (Rigaut et al., 1999; Puig et al., 2001). Posteriormente, la construcción se expresa en una célula de 14 levadura donde esta puede formar complejos con otras proteínas. En el primer paso de la purificación, la proteína A se une a IgG que se encuentra fija a una matriz; después se procede a realizar un lavado para eliminar los contaminantes, se adiciona la proteasa y se rompe la unión entre la proteína A y la matriz de IgG. El producto del primer paso es posteriormente eluido mediante su incubación con perlas cubiertas de calmodulina en presencia de calcio; nuevamente se realiza un lavado y los complejos formados con la proteína de interés, son purificados bajo condiciones nativas, por lo tanto, manteniendo la integridad del complejo. Los componentes del complejo formado son resueltos por 2DPAGE, digeridos enzimáticamente por proteasas y los fragmentos son identificados mediante espectrometría de masas (Figura 2). La principal ventaja de este método es su capacidad para determinar complejos multiproteicos, a diferencia de Y2H donde sólo resuelve interacciones uno contra uno, dejando de lado los efectos cooperativos. Entre las desventajas del método se encuentran: sólo se detectan interacciones estables, por lo cual las transitorias no se detectan, la proteína no se expresa en el momento de la lisis y finalmente, la interferencia del TAP-cassette en la interacción (Shoemaker y Panchenko, 2007). Figura 2. Método de purificación por afinidad en tándem acoplado a espectrometría de masas. 15 2.4.1.3. Interacciones entre proteínas a nivel atómico La información a nivel atómico más detallada de las interacciones entre proteínas puede ser proporcionada por la cristalografía de rayos X y espectroscopía de resonancia magnética nuclear, pero el número de complejos determinados por estas técnicas sigue siendo bajo (Tong et al., 2001). Al mismo tiempo, la caracterización en tiempo real de interacciones entre proteínas in vivo puede ser alcanzada mediante técnicas espectroscópicas, las cuales requieren la adición de una marca fluorescente a la proteína de interés (Lippincott-Schwartz y Patterson, 2003; Piehler, 2005). Otro método efectivo para determinar interacciones entre ligandos solubles y receptores inmovilizados sobre una placa de oro es la llamada resonancia de plasmones de superficie (Cooper, 2003; Karlsson, 2004). Recientemente, se han desarrollado nuevos métodos para analizar la interacción entre proteínas a nivel atómico. Éste es el caso de la microscopía de fuerza atómica (Yang et al., 2003) y de técnicas fluorescentes, que son capaces de caracterizar cambios conformacionales en las proteínas durante la interacción (Margittai et al., 2003). 2.4.2. Métodos computacionales En el análisis funcional de un genoma, un paso crítico es la comprensión de las interacciones entre las proteínas que codifica (Eisenberg et al., 2000). Por ello se ha desarrollado un conjunto de métodos teóricos para abordar el problema de la predicción de interacciones entre proteínas a partir del análisis de sus secuencias, de información de los genomas y de datos cristalográficos de complejos macromoleculares. De manera general, los métodos utilizan como hipótesis que si se conoce el modo de interacción entre dos proteínas o dos dominios de proteínas, cualquier interacción que pueda ocurrir entre proteínas homólogas involucra contactos del mismo tipo (Teichmann et al., 2001). Sin embargo, existen algunos casos en los que proteínas homólogas poseen diferentes modos de interacción. Por ejemplo, la enzima nucleótido difosfato quinasa se presenta en la naturaleza en forma de hexámero o tetrámero dependiendo de la especie (Morera et al., 1994). El reconocimiento proteína-proteína está determinado por las propiedades físicas y químicas de la superficie interfacial, la cual ha sido caracterizada en términos de su geometría (tamaño, forma y complementariedad) y de su naturaleza química (tipo de grupo 16 químico y aminoácido, hidrofobicidad, interacciones electrostáticas y enlaces por puente de hidrógeno). El análisis de las superficies de contacto entre proteínas o región interfacial tuvo sus inicios con el trabajo de Chothia y Janin (1975). A partir de ese año y hasta la fecha, siguen apareciendo diferentes trabajos sobre el tema (Janin y Chothia, 1990; Lawrence y Colman, 1993; Jones y Thornton, 1997; Chakrabarti y Janin, 2002; Headd et al., 2007; Yan et al., 2008). Se han desarrollado métodos que utilizan la información contenida en los genomas o también llamados métodos basados en el contexto genómico, entre los principales están: fusión génica, perfiles filogenéticos y vecindad génica. Por ejemplo, un evento de fusión génica representa la fusión física de dos genes relacionados a nivel funcional y separados físicamente, para producir un solo gen multifuncional (Figura 3). Dandekar et al., (1998) utilizaron la información asociada a la conservación del orden de genes ortólogos y la arquitectura de operones en 6 genomas de procariotas y 3 de arqueas. Con este método, se identificaron para cada genoma alrededor de 100 proteínas involucradas en interacciones físicas directas previamente descritas a nivel experimental. El método desarrollado por Pellegrini et al. (1996), denominado perfiles filogenéticos, se basó en la co-evolución de proteínas que interactúan, dicho de otra manera presencia-ausencia de genes ortólogos en genomas diferentes. Si el patrón de proteínas ortólogas (presencia-ausencia) se conserva en organismos de la misma especie, se debe probablemente a que una de las proteínas no puede ejercer su función sin la otra (Figura 3). Huynen et al. (2000) aplicaron este método al genoma de Mycoplasma genitalium, prediciendo 34% de los pares como interactuantes y un 29% adicional pertenecientes a la misma vía metabólica o proceso funcional. Así mismo, métodos basados en la fusión de dominios se fundamentan en la hipótesis de que cuando dos proteínas A y B contienen dominios homólogos a dominios diferentes de una tercera proteína en otro organismo, pero A y B no son homólogas entre sí, entonces A y B interaccionan (Marcotte et al., 1999; Enright et al., 1999). 17 Figura 3. Métodos computacionales de predicción de interacciones entre proteínas basados en el contexto genómico. (A) Representación del método de vecindad génica para 8 genomas completos, mostrando un par de genes (marcados con color rojo y azul) que están físicamente próximos en los 8 genomas. Además, se muestra en un par de genomas un evento de fusión génica entre dos genes (marcados en color amarillo y azul claro). (B) Representación de perfiles filogenéticos de los genes de la representación previa. Los tres pares de genes tienen los mismos patrones de co-ocurrencia en los 8 genomas, por tanto, sus productos podrían interaccionar físicamente. (C) Representación de dos alineamientos de secuencias para un par de familias de proteínas, se muestran las regiones conservadas marcadas en color rojo y azul, respectivamente. Para cada familia de proteínas, mutaciones co-relacionadas (marcadas en color verde) están presentes en subarboles idénticos, indicando que estos sitios podrían estar involucrados en interacciones entre proteínas de cada una de estas familias. La limitación de los métodos basados en el contexto genómico radica en que sólo son aplicables a genomas secuenciados completamente, para tener la certeza de la ausencia de genes específicos; por otro lado son aplicables solamente en bacterias, donde el orden de los genes es una característica relevante; y por último dependen de la calidad del alineamiento múltiple de las proteínas en estudio (Valencia y Pazos, 2002). 18 En 2001, se desarrolló un método de predicción de patrones de secuencia característicos, observados con regularidad, en pares de proteínas cuya interacción ha sido comprobada de forma experimental (Sprinzak y Margalit, 2001). Una de las proteínas posee un patrón de secuencia característico, definido en la clasificación InterPro (Apweiler et al., 2001), y la otra proteína que interacciona un segundo patrón característico. A este conjunto de pares de patrones característicos se les denominaron patrones de secuencia correlacionados. Wojcik y Schächter (2001) combinaron métodos de búsqueda de similitud de secuencia y agrupamiento de secuencias (“clustering”) con la información contenida en las bases de datos acerca de dominios en interacción proteína-proteína. Este método se ha empleado para predecir el mapa de interacción de proteínas en la bacteria Escherichia coli, utilizando la información previa del mapa de interacción de H. pylori. Pazos y Valencia (2001, 2002) combinaron información a nivel de secuencia y genómica para calcular las distancias evolutivas entre proteínas que pertenecen a familias relacionadas y para calcular la correlación de mutaciones entre posiciones de un alineamiento múltiple de secuencias. Esta idea se basa en observaciones previas que indican una correspondencia entre los árboles filogenéticos de familias de proteínas interactuantes no homólogas (ejemplo: la insulina y receptor para insulina). Este método se ha aplicado a gran escala, utilizando 67,000 pares de proteínas de E. coli, de los cuales 2,742 fueron predichos correctamente. Se ha desarrollado un método similar al anterior; en éste se alinean árboles filogenéticos, representados por matrices, para definir proteínas específicas involucradas en interacciones. Este método se ha aplicado a más de 18 familias de proteínas con resultados satisfactorios (Ramani y Marcotte, 2003). Lu et al. (2002) desarrollaron un método denominado MULTIPROSPECTOR que se basa en la metodología conocida con el nombre de modelaje por hilvanado (del inglés “threading”). Esta metodología es utilizada para la predicción de estructura cuaternaria, y consta de dos fases. Una primera fase ejecuta el método de “threading” PROSPECTOR, para generar un conjunto de estructuras 3D potenciales de la proteína en estudio. En una segunda fase, re-evalúan la compatibilidad de las estructuras 3D generadas con las estructuras molde que forman parte de complejos cristalográficos determinadas experimentalmente. El método fue evaluado utilizando un conjunto de 40 homodímeros, 15 19 heterodímeros y 69 monómeros, explorados contra una selección de 2,478 estructuras representativas del banco de datos de proteinas (PDB, por sus siglas en inglés). El método predijo correctamente 36 homodímeros, 15 heterodímeros y 65 monómeros. Además, se evaluaron todas las posibles interacciones para proteínas de levadura, de un total de 2,865 predicciones utilizando MULTIPROSPECTOR (Lu et al., 2002), 1,138 están documentadas en la base de datos de interacciones entre proteínas (DIP, por sus siglas en inglés). Sprinzak et al., (2003) propusieron un método para evaluar la exactitud de los datos experimentales sobre interacciones proteína-proteína obtenidos por el método de doble híbrido. Estos investigadores sugieren que el 50% de las interacciones proteína-proteína identificadas en la levadura S. cerevisiae corresponden a casos positivos y que el número total de interacciones para este organismo oscila entre 10,000 y 16,600 interacciones. Por último, Goffard et al. (2003) desarrollaron el método IPPRED para predecir interacciones entre proteínas basado en la similitud de secuencias amino acídicas. Para inferir las interacciones entre proteínas IPPRED utiliza el programa BLAST (Altschul et al., 1990), datos experimentales documentados en la base de datos BIND (Bader et al., 2003) y en la literatura científica. Además, IPPRED está disponible a través de una interfase en el sitio de internet http://cbi.labri.fr/outils/ippred/. 2.5. Bases de datos de interacciones entre proteínas Para documentar y describir las interacciones entre proteínas, se ha creado un grupo de bases de datos que incluyen toda la información obtenida por los diferentes métodos experimentales descritos anteriormente. A continuación se describe de manera general las principales bases de datos, concentrando la atención en el tipo de datos que contienen y cómo accederlas. 20 2.5.1. BIND (Biomolecular Interaction Network Database) http://bond.unleashedinformatics.com/ Esta base de datos, documenta interacciones moleculares que incluyen proteínaproteína, proteína-ARN, proteína-ADN, proteína-moléculas pequeñas, complejos moleculares, y vías metabólicas. Los datos experimentales obtenidos por doble-híbrido, espectrometría de masas, cristalografía, bibliotecas de fagos se incluyen en esta base de datos (Bader et al., 2003). Actualmente (marzo 2009), BIND documenta 158,489 interacciones, y 3,705 complejos. 2.5.2. DIP (Database of Interacting Proteins) http://dip.doe-mbi.ucla.edu Esta base de datos, documenta interacciones moleculares, proteína-proteína, determinadas experimentalmente por los métodos de doble-híbrido, inmunoprecipitación, ensayos de bloqueo con anticuerpos monoclonales y anotaciones extraídas de la literatura científica, entre otros. DIP está implementada como una base de datos relacional, la cual se define como aquella en donde todos los datos visibles al usuario están organizados estrictamente como tablas de valores, y en donde todas las operaciones de la base de datos operan sobre estas tablas. En DIP la base de datos relacional esta formada por cuatro tablas. Una primera con información sobre las proteínas, una segunda sobre interacciones proteínaproteína, una tercera que describe detalles sobre los experimentos, y la cuarta tabla contiene la lista de todas las referencias en Medline. DIP permite la representación visual de las interacciones así como navegar a través de la red de interacciones proteicas mediante internet (Xenarios et al., 2001; 2002). Hasta marzo del 2009 el número de proteínas contenidas en DIP ascendía a 20,728 y el número de interacciones a 57,684. 2.5.3. MINT (Molecular INTeraction database) http://cbm.bio.uniroma2.it/mint/index.html MINT contiene información sobre complejos moleculares, interacción entre dominios, modificaciones enzimáticas de las proteínas interactuantes, constantes de unión y otros datos cinéticos. Toda la información contenida en MINT es “curada” de manera 21 manual por expertos, y está organizada en una base de datos relacional (Zanzoni et al., 2002). Actualmente (marzo 2009), MINT tiene documentadas 110,164 interacciones. 2.5.4. 3did (3D interacting domains) http://gatealoy.pcb.ub.es/3did/ Esta base de datos permite explorar los detalles de interacciones entre dominios derivados de estructuras tridimensionales (Stein et al., 2005). Para cada dominio, se proporciona una vista de todas sus interacciones con otros dominios. En algunos casos se muestran comparaciones estructurales entre las superficies interfaciales de dominios interactuantes, revelando la variación de interacciones entre pares de familias de dominios. InterPreTS es un servicio en línea asociado a 3did que predice interacciones entre dominios basado en la similitud a nivel de secuencia con proteínas de una base de datos de dominios interactuantes (Aloy y Russell, 2003). Hasta marzo del 2009, 3did tiene documentadas 115,559 interacciones. 2.5.5. IntAct (IntAct database) http://www.ebi.ac.uk/intact/site/index.jsf La principal meta de este proyecto es proporcionar un repositorio público con información referente a interacciones proteína-proteína derivadas experimentalmente (Kerrien et al., 2007). La base de datos hace un uso extensivo de vocabularios controlados, los cuales permiten obtener una descripción consistente con los detalles experimentales que fueron utilizados para generar la información. Para soportar búsquedas generalizadas, estos vocabularios tienen una estructura jerárquica y dentro de lo posible, son utilizados sistemas de referencia tales como la base de datos de taxonomía del NCBI o la base de datos de Ontologías génicas (GO). Actualmente (marzo 2009), IntAct tiene documentadas 189,082 interacciones. 2.5.6. HPRD (The Human Protein Reference Database) http://www.hprd.org/ HPRD contiene información que ha sido manualmente curada para la mayoría de las proteínas del ser humano (Peri et al., 2003). Información concerniente a proteínas 22 involucradas con enfermedades humanas es anotada y enlazada a la base de datos de herencia mendeliana en humanos (OMIM database). El NCBI proporciona un enlace a HPRD a través de su bases de datos de proteínas de humano (Entrez gene y RefSeq). La base de datos despliega información sobre las funciones de las proteínas de humano, incluyendo: interacciones proteína-proteína, modificaciones post-traduccionales, relaciones enzima-sustrato y asociaciones con enfermedades. Toda la información es “curada” de manera manual por expertos a través de análisis bioinformáticos de las secuencias de las proteínas. Actualmente (marzo 2009), HPRD tiene documentadas 38,167 interacciones. 2.6. Calidad de los métodos de determinación de interacciones entre proteínas El método estándar para evaluar la calidad de las interacciones detectadas a nivel experimental se basa en que se debe detectar la misma interacción por diferentes métodos (Schwikowski et al., 2000). Por ejemplo en S. cerevisiae, se han determinado a nivel experimental y de manera independiente varios interactomas, lo que ha producido un total de 80,000 interacciones. Sin embargo, sólo 2,400 interacciones fueron comunes a todos los interactomas de S. cerevisiae (von Mering et al., 2002). Existen varias explicaciones para esto; posiblemente los métodos no han alcanzado aún su máximo desarrollo; varios de estos métodos producen una gran cantidad de falsos positivos y negativos, y algunos otros presentan problemas para ciertos tipos de interacciones. Cada uno de los métodos para determinar las interacciones entre proteínas, producen una distribución de interacciones única con respecto a las categorías funcionales de las mismas. Estas diferencias en la cobertura sugieren que los métodos presentan debilidades y fortalezas. Así, los métodos de purificación de complejos resuelven pocas interacciones para proteínas involucradas en transporte y en recepción de señales, debido posiblemente a que estas fracciones del proteoma por lo general son ricas en proteínas de membrana, las cuales son difíciles de purificar. Similarmente, el sistema de Y2H, a diferencia de otros métodos, difícilmente detecta interacciones entre proteínas involucradas en el proceso de traducción (von Mering et al., 2002). Otro enfoque para validar la interacciones combina la información que brindan métodos experimentales independientes con datos 3D obtenidos por cristalografía de rayos X (Edwards et al., 2002). Siguiendo esta línea de razonamiento, la integración de diferentes 23 bases de datos o diferentes métodos, contribuirá a validar las anotaciones en las mismas (Gerstein et al., 2002). Un ejemplo de ello lo constituye el método propuesto por Tong et al. (2002) que consistió en combinar la metodología de despliegue en fagos (“phage display”) con Y2H. Primeramente, mediante una biblioteca de fagos, se realizó una búsqueda de secuencias consenso en proteínas de levadura capaces de unirse a dominios de reconocimiento de péptidos desplegados en la superficie de cada fago. Como resultado de esta búsqueda se obtiene un entramado de interacciones que conecta a proteínas que poseen una secuencia consenso con aquellas que poseen dominios de reconocimiento específico para esas secuencias, a la vez, define sitios de unión en algunas de las proteínas. Un segundo entramado de interacciones se obtiene de la búsqueda de proteínas que interaccionan con los dominios de reconocimiento de las secuencias consenso, utilizando el método de doble-híbrido. Este método ha sido aplicado en la búsqueda de proteínas que interactúan con dominios SH3; estos dominios se encuentran principalmente en proteínas involucradas en vías de señalización. 24 3. Planteamiento del problema El conocimiento del contexto de las interacciones de una proteína es crucial para comprender las funciones celulares. Sin embargo, los métodos experimentales para determinar a gran escala las interacciones entre proteínas sólo cubren una pequeña fracción del proteoma de una célula bajo condiciones específicas. En el mismo contexto, para el caso de las bacterias, incluido H. pylori, la compresión del papel biológico de las interacciones entre proteínas no ha alcanzado el mismo nivel de desarrollo como en el caso de organismos eucariontes, como el humano y la levadura S. cerevisiae. Más aún, para microorganismos patógenos de humano poco se sabe acerca del papel que juegan en la patogénesis las interacciones entre proteínas. 4. Justificación En muy pocas especies bacterianas, incluyendo a H. pylori, se han analizado las interacciones entre proteínas a nivel global. H. pylori es la bacteria que más personas infecta en el mundo. En México el 66% de la población adulta está infectada con esta bacteria. La infección por H. pylori es la principal causa de gastritis crónica, ulceras pépticas y adenocarcinoma gástrico, también produce linfomas gástricos asociados amucosa (MALT), anemia ferropénica, y actualmente es tema de discusión que sea la causa de por lo menos el 50% de los casos de púrpura trombocitopénica idiopática. Dada la importancia de la H. pylori como patógeno, es necesario comprender los mecanismos moleculares por los que causa enfermedad. En este sentido, los resultados del mapa de interacción entre proteínas de H. pylori sólo cubren el 46% de su proteóma, así mismo se estima que aproximadamente el 50% de los resultados obtenidos en experimentos de interactómica son falsos positivos o falsos negativos. De tal manera que existe una amplia cantidad y diversidad de información por confirmar y explorar, a fin de elucidar algunas de las interacciones entre proteínas asociadas a patogénesis que no han sido determinadas en esta bacteria. La construcción de un modelo de la red interacciones entre proteínas asociadas a patogénesis de H. pylori revelará información detallada acerca de los procesos celulares activados por este patógeno durante el proceso de infección. Entre las posibles aplicaciones prácticas de este trabajo están la identificación de potenciales blancos para el diseño racional de fármacos y vacunas, la ingeniería de procesos celulares y el desarrollo de nuevas estrategias de tratamiento. 25 5. Objetivos 5.1. General Identificar nuevas interacciones entre proteínas de participación conocida en patogénesis de H. pylori. 5.2. Específicos Construir in silico una red de interacciones, a partir de proteínas que se conoce que participan en la patogénesis de H. pylori. Identificar nuevas interacciones de proteínas asociadas a patogénesis de H. pylori. Predecir nuevas proteínas asociadas a patogénesis de H. pylori. Analizar el papel de las interacciones predichas en la patogénesis de H. pylori. Proponer una lista de proteínas candidato con probable asociación a patogénesis de H. pylori. 6. Hipótesis “El análisis de redes de interacción entre proteínas permite asignar funciones adicionales a proteínas de función patogénica conocida y, predecir nuevas proteínas con probable asociación a patogénesis de H. pylori”. 26 7. Metodología 7.1. Obtención de las proteínas con participación conocida en la patogénesis (proteínas raíz) De la base de datos MvirDB (http://mvirdb.llnl.gov/) se obtuvieron todas aquellas proteínas con participación conocida en la patogénesis de H. pylori. Esta base de datos contiene información sobre proteínas que funcionan como toxinas, factores de virulencia y resistencia a los antibióticos (Zhou et al., 2006). 7.2. Construcción de la red de interacciones entre proteínas de H. pylori Mediante el sistema de análisis STRING (von Mering et al., 2009) y a partir de las proteínas raíz se obtuvo una red de interacciones. Los parámetros para la generación de la red fueron: Active Prediction Methods (Neighborhood, Gene Fusion, Co-occurrence, Coexpression, Text mining, Experiments y Databases); confidence score (0.7=high confidence); network depth (1) y edge scaling factor (80%). Esta configuración implica la obtención de una red de interacciones con un alto nivel de confiabilidad (Figura 4). Figura 4: Construcción de la red de interacción a partir de las proteínas raíz obtenidas de la base de datos MvirDB. Las proteínas raíz son introducidas en STRING, el cual construye la red a partir de las citadas proteínas mediante la adición de sus compañeros de interacción directos. 27 7.3. Predicción de nuevas interacciones y proteínas involucradas en la patogénesis de H. pylori. Una vez obtenida la red de proteínas involucradas en la patogénesis, se obtuvo para cada una de las proteínas el grado de unión a patogénesis (GUP). El GUP de una proteína es igual al número de proteínas raíz con las cuales interacciona (Figura 5), excluyendo a la misma proteína (Aragues et al., 2008). Posteriormente, para evaluar el nivel de probabilidad estadístico del GUP como indicador de asociación a patogénesis, se realizó el cálculo del valor predictivo positivo y la sensibilidad a diferentes umbrales de GUP (GUP≥0, ≥1 y ≥5). El valor predictivo positivo es igual al número verdaderos positivos entre los positivos. La sensibilidad es igual al número de verdaderos positivos entre la suma de falsos negativos y verdaderos positivos. En este contexto y dando un umbral de GUP= N, positivos serán proteínas con GUP ≥ N. Verdaderos positivos serán proteínas que se conoce que están involucradas en la patogénesis. Falsos negativos serán proteínas que se conoce que están involucradas en la patogénesis cuyo valor de GUP es menor de N (Figura 5). El análisis estadístico fue realizado mediante una tabla de contingencia 2X2 y prueba de X2. Por último, utilizando el GUP de cada una de las proteínas se predijeron nuevas proteínas involucradas en la patogénesis de H. pylori. Figura 5: Cálculo del GUP de una proteína, del valor predictivo positivo y la sensibilidad a diferentes umbrales de GUP. El GUP de una proteína es igual al número de proteínas raíz con las cuales interacciona, excluyendo a la misma proteína. El cálculo del GUP involucra tres pasos: i) se crea una base de datos de proteínas de conocida asociación a patogénesis (proteínas raíz); ii) se crea una red de interacción a partir de 28 las proteínas raíz; y iii) se calcula el GUP para cada una de las proteínas presentes en la red de interacciones. En el ejemplo proporcionado, se observa que proteínas con un alto valor de GUP son más probables a estar asociadas a patogénesis en comparación a aquellas con bajos valores de GUP. 7.4. Análisis del papel de las predicciones en la patogénesis El análisis funcional de las predicciones se realizó mediante la búsqueda de anotaciones en las bases de datos Uniprot (The UniProt Consortium, 2008), Pfam (pfam.sanger.ac.uk) y con el sistema de minería de datos iHop (Hoffmann y Valencia, 2004). En lo que respecta al análisis de propiedades funcionales a nivel de redes de interacción, éste fue realizado mediante el software Cytoscape (Shannon et al., 2006) y sus complementos MCODE (Bader y Hogue, 2006) y BINGO (Maere et al., 2005). 29 8. Resultados El análisis de redes de interacción entre proteínas es una de las principales aproximaciones en la caracterización funcional de las proteínas, ya que permite asignar funciones a proteínas aún no descritas o nuevas funciones a proteínas conocidas. En el presente trabajo, mediante el análisis de redes de interacción entre proteínas, se realizó la predicción de nuevas interacciones entre proteínas involucradas en la patogénesis de H. pylori. Este análisis se sostiene en la hipótesis de que dentro de una red de interacción, aquellas proteínas que están involucradas en un mismo proceso biológico tienden a presentar alta conectividad entre ellas. Por lo tanto, proteínas de H. pylori que interaccionan, de manera frecuente, con aquellas de conocida participación en su patogénesis son probablemente proteínas que también están involucradas en dicho proceso. En contraste, con aquellas proteínas que presentan pocas o nulas interacciones con proteínas de participación conocida involucradas en la patogénesis. El sistema de análisis STRING 8.0 (Jensen et al., 2009) fue utilizado para construir una red de interacciones a partir de proteínas de participación conocida en la patogénesis (denominadas proteínas raíz). STRING ejecuta una serie de algoritmos de predicción basados en contexto genómico y transfiere interacciones determinadas, a nivel experimental, de organismos modelo hacia otras especies, mediante la ortología de las respectivas proteínas (interólogos). Los resultados arrojados por STRING, además de contener interacciones directas, también incluye interacciones funcionales (indirectas). Es decir, proteínas que comparten algún sustrato, proteínas que se regulan entre sí a nivel transcripcional y proteínas que participan en un complejo multi-proteico. Así, en el presente estudio STRING fue capaz de detectar interacciones entre proteínas asociadas a patogénesis que previamente ya habían sido descritas mediante experimentos bioquímicos en H. pylori y otras bacterias. Este es el caso del complejo ureasa, del sistema de transporte ExbD-ExbB-TonB, del sistema de motilidad y quimiotaxis, y del sistema de secreción tipo IV; todos ellos actúan como complejos multiproteicos. Estos ejemplos ilustran las capacidades analíticas del sistema de análisis antes citado. STRING, en su versión número ocho, incluye información de 2.5 millones de proteínas pertenecientes a 630 organismos (Jensen et al., 2009). El conjunto de proteínas de participación conocida en la patogénesis de H. pylori (proteínas raíz) fue obtenido de la base de datos MvirDB (http://mvirdb.llnl.gov/). Esta base 30 de datos incluye proteínas o genes asociados a toxinas y factores de virulencia. La información de esta base de datos proviene de revisión de literatura y de información contenida en otras bases de datos. La lista final del total de proteínas obtenidas de MvirDB fue de 127 proteínas. Posteriormente, la lista de proteínas raíz fue introducida a STRING. En 15 proteínas, STRING no encontró interacciones de alta confiabilidad, por lo tanto se eliminaron. La red resultante cuenta con un total de 330 proteínas y 1,271 interacciones. Para cada una de las proteínas que integraron la red, se realizó un análisis para determinar la asociación entre su contexto funcional (GUP) y su conocida función en patogénesis. Este tipo de análisis ha mostrado ser útil para determinar la asociación de proteínas o genes con cáncer (Aragues et al., 2008). Los resultados mostraron que el GUP de las proteínas fue un buen parámetro para predecir si una proteína está asociada a patogénesis de H. pylori. El nivel de probabilidad estadístico del indicador fue evaluado mediante una prueba de X2 (Cuadro 1). Posteriormente, utilizando el GUP de cada una de las proteínas se predijeron nuevas proteínas involucradas en la patogénesis de H. pylori con valor predictivo positivo y sensibilidad por encima del 60%, con respecto al GUP (Cuadro 2). Con estos resultados la red inicial fue filtrada y se obtuvo una red final de 712 interacciones entre 153 proteínas involucradas en la patogénesis de H. pylori, de las cuales 50 corresponden a proteínas candidato (Figura 6). Así, la red de interacciones obtenida está compuesta de proteínas de participación conocida en la patogénesis de H. pylori y sus compañeros directos de interacción. Cuadro 1. Asociación entre el contexto funcional de proteínas (GUP) y su conocida función en patogénesisa. Proteínas asociadas a patogénesis Proteínas con GUP ≥ 0 Proteínas con GUP ≥ 1 127 101 GUP ≥ 0 vs. GUP ≥ 1 76.04 > 3.84 X2 cal > X2tab (1 gl, 0.05) Proteínas con GUP ≥ 5 54 GUP ≥ 1 vs. GUP ≥ 5 70.44 > 3.84 X2 cal > X2tab (1 gl, 0.05) a La evaluación se realizó comparando proteínas con GUP ≥ 0, GUP ≥ 1 y GUP ≥ 5. El valor de probabilidad (p) de la prueba X2 indica diferencia estadística entre el conjunto de proteínas con GUP ≥0 y aquellas con GUP ≥ 1 y GUP ≥ 5. 31 Cuadro 2. Valores de GUP para cada una de la proteínas que integraron la red de interacción y su probable asociación en la patogénesis de H. pylori. Los valores predictivo positivo y sensibilidad se obtuvieron con relación al GUP. GUP No. de proteínas: total /(proteínas raíz) Valor predictivo positivo (%) Sensibilidad (%) ≥0 ≥1 ≥2 ≥3 ≥4 ≥5 ≥10 330 (127) 317 (101) 139 (79) 91 (68) 68 (58) 60 (54) 43 (41) 12 32 60 75 85 90 95 100 80 61 53 45 42 32 Mediante los complementos MCODE (Bader y Hogue, 2006) y BiNGO (Maere et al., 2005), incorporados en el programa Cytoscape (Shannon et al., 2006) y el sistema de minería de datos iHOP (http://www.ihop-net.org), se realizó el análisis de la red de interacción entre proteínas para determinar la probable función de proteínas candidato asociadas con patogénesis en H. pylori. El complemento MCODE permite detectar regiones dentro de una red de interacción de proteínas muy conectadas ó agrupadas. En general, estas regiones corresponden a complejos multi-proteicos o vías celulares asociadas con un proceso biológico en particular (Figura 6). El análisis realizado con MCODE resultó en un total de seis agrupamientos de proteínas; cada uno de los cuales está asociado con un proceso de patogénesis en particular. Este resultado permitió ademas, corroborar la hipótesis de que las proteínas asociadas con un proceso biológico en particular tienden a presentar alta conectividad entre ellas. Además, los agrupamientos de proteínas fueron analizados mediante el complemento BiNGO; el cual fue utilizado con el objetivo de determinar términos y anotaciones de ontología génica (GO terms, por sus siglas en inglés). Los términos de ontología génica (términos GO) representan un conjunto de vocabularios controlados (ontologías) para describir un gen o atributos de un producto génico en términos de su proceso biológico, de sus componentes celulares y su función molecular (The Gene Ontology Consortium, 2000). Actualmente, para un gen o proteína la gran mayoría de las bases de datos biológicas incluyen, en algún apartado, la anotación de sus términos de ontología génica. Esto facilita la búsqueda de información funcional 32 estableciendo un tipo de anotación estándar para un producto génico presente en diferentes bases de datos. Figura 6: Red de interacción entre proteínas asociadas a patogénesis de H. pylori. Cada nodo representa una proteína y cada enlace entre dos proteínas representa una interacción entre sí mismas. Las proteínas en color rojo corresponden a las proteínas raíz y las marcadas en verde, a las proteínas candidato. También se muestran los agrupamientos de proteínas producidos por MCODE; cada uno es marcado con un color que corresponde al tipo de proceso biológico asociado a patogénesis. Como se observa en la Figura 6, los agrupamientos de proteínas obtenidos se corresponden con procesos celulares especificos asociados a patogénesis de H. pylori. A continuación se describen las interacciones de las proteínas candidato dentro de cada agrupamiento. 33 8.1. Motilidad y quimiotaxis El agrupamiento de proteínas asociado a motilidad y quimiotaxis está constituido por 13 proteínas candidato de un total de 45 proteínas (Figura 7). Figura 7: Agrupamiento de proteínas asociadas a la quimiotaxis y motilidad de H. pylori. Las proteínas en color verde corresponden a proteínas raíz y las marcadas en color rojo, a proteínas candidato. El análisis realizado con BINGO indica que el agrupamiento de proteínas, además de estar enriquecido con términos GO para los procesos biológicos asociados con en el ensamblaje del flagelo y quimiotaxis, también lo están aquellos asociados síntesis de tiamina. La presencia de este último grupo de términos es inesperada ya que aparentemente no existe alguna relación funcional entre la quimiotaxis, motilidad y síntesis de vitaminas del complejo B. En el cuadro 3 se enlistan las 13 proteínas candidato correspondiente a este agrupamiento de proteínas. 34 Cuadro 3. Lista de proteínas candidato asociadas a quimiotaxis y motilidad en H. pylori. Gen/proteína Descripción Código de acceso en UniProt Valor predictivo positivo (VPP) cheA Histidín quinasa O25153 95% ylxH Proteína de unión al ATP O25678 95 % dxs Transferasa. O25121 87 % lepA Proteína de unión al GTP, factor de elongación. O25122 75% ileS Isoleucina-tARN sintetasa. P56456 75% murB UDP-Nacetilmuramato deshidrogenasa. O25963 75% thiF Proteína para síntesis de tiamina. O25494 60% HP0356 Proteína hipotética. O25123 60% HP0813 Proteína hipotética. O25493 60% HP0817 Proteína hipotética. O25495 60% HP0114 Proteína hipotética. O24936 60% O25673 60% P64657 60% Proteína hipotética. HP1029 HP0245 Proteína hipotética. En este agrupamiento de proteínas, al menos cuatro proteínas candidato comparten patrones de interacción con proteínas involucradas en el ensamblaje del flagelo o quimiotaxis. Por ejemplo, la proteína CheA, interacciona con las proteínas CheV, CheW, CheY, MotA, MotB, FliM, FliG, FliA, FlhF, FlhA y FlhB. Este alto número de 35 interacciones de CheA se ve reflejado en un alto valor predictivo positivo (Cuadro 3). CheA es una conocida proteína de los denominados sistemas de dos componentes. Estos sistemas de proteínas están asociados con la transducción de señales en organismos procariotes y cumplen funciones en el proceso de quimiotaxis. Así, las interacciones de CheA con CheV, CheW y CheY, eran esperadas, ya que de las cuatro proteínas se conoce su papel en la quimiotaxis. Además, algunas de sus interacciones ya han sido determinadas a nivel experimental en otros procariotes (Figura 8). Sin embargo, las interacciones con las otras proteínas raíz no eran esperadas, ya que la mayoría están asociadas con el proceso de exportación de proteínas que conduce al ensamblaje del flagelo. Figura 8: Estructura cristalográfica donde se observa la interacción entre las proteínas CheA y CheY de E. coli. Código de acceso a la base de datos PDB: 1EAY. La proteína marcada con el color verde corresponde a CheY y la marcada en color naranja a la proteína CheA (McEvoy et al., 1998). Las proteínas candidato YlxH, Dxs y ThiF pertenecen a un grupo de proteínas asociadas con la síntesis de vitaminas del complejo B y las tres presentan interacciones con algunas de las proteínas raíz citadas. En el caso de la proteína YlxH, ésta interacciona con las mismas proteínas que CheA. A excepción de CheW, CheV y CheY, las cuales están asociadas, de manera específica, con quimiotaxis. YlxH es una proteína de unión al ATP y está asociada con síntesis de Vitamina B12. Existe escasa información acerca de la función que desempeña esta proteína. Las proteínas candidato Dxs y ThiF interaccionan con las proteínas raíz FliG, FliH y FliF y MotA y MotB, respectivamente. El análisis de las anotaciones de Dxs y ThiF en UniProt revela que son proteínas asociadas a la síntesis de vitaminas del complejo B. las 36 proteínas raíz con las cuales interaccionan Dxs y ThiF participan tanto en la exportación de proteínas para el ensamblaje del flagelo como en la generación de un gradiente de protones necesario para la rotación flagelar. Las proteínas candidato IleS y MurB interaccionan con las proteínas raíz FliQ y FliL. Las dos últimas proteínas raíz pertenecen a la región estructural del cuerpo basal del flagelo. Las proteínas de esta región tienen función estructural y en la exportación de proteínas para el ensamblaje del flagelo. IleS es una proteína que participa en la síntesis de proteínas, evitando la agregación incorrecta de amino ácidos por el tARN. Por su parte, MurB es una proteína que participa en síntesis de péptido glicano y está relacionado tanto en la degradación como en la síntesis de la pared celular (Benson et al., 1996). Las proteínas LepA y HP0356 interaccionan con FliF, FliG y FliH. Estas últimas son proteínas de membrana que constituyen parte del sistema de rotación flagelar participando en la exportación de proteínas para el correcto ensamblaje del flagelo. El análisis de secuencia de HP0356 mostró que corresponde a una proteína hipotética de la cual no se dispone de información. En el caso de LepA, no se conoce su función con certeza en bacterias; el análisis de su secuencia revela la presencia de una familia de dominios relacionados con la síntesis de proteínas y con la unión a los ribosomas, dependiente de GTP (accesos de Pfam: PF00679, PF00009, PF03144 y PF06421). A nivel genómico, LepA tiene una disposición estructural de vecindad con proteínas flagelares y con la proteína candidato Dxs. Sin embargo, esta disposición estructural sólo se observó en algunas especies del género Helicobacter, Bacillus, Geobacillus y Oceanobacillus. De tal manera, que la citada organización a nivel genómico de LepA con proteínas flagelares podría ser una característica única de pocos géneros bacterianos (Figura 9). Esto es importante, considerando que aquellos genes que guardan una relación de vecindad en el genoma, tienden a codificar proteínas que interaccionan o que están asociadas al mismo proceso biológico (Dandekar et al., 1998). 37 Figura 9: Organización a nivel genómico de los genes fliF, fliG y fliH, respecto a los genes candidato dxs y lepA. Imagen modificada del sistema de información para patógenos microbianos de EE. UU. (NMPDR, por sus siglas en inglés). Las proteínas candidato HP0813 y HP0817 son proteínas hipotéticas que interaccionan con las proteínas raíz MotA y MotB. Estas últimas proteínas están asociadas con la membrana celular y participan en el proceso de flujo de protones que genera el torque del flagelo. El análisis de secuencia de estas proteínas hipotéticas sólo reveló información para la proteína HP0813, la cual presenta un dominio tipo beta-lactamasa (accesso de PFAM número: PF00753), asociados a la resistencia a los antibióticos. HP0114 corresponde a una proteína hipotética que interacciona con las proteínas FlaB y SpsE. FlaB es el componente minoritario del filamento flagelar. Esta región se encuentra conectada al gancho flagelar, constituido por las proteínas FlgK y FlgL y es la que realiza el trabajo hidromecánico necesario para la propulsión. Por su parte, SpsE pertenece a otro agrupamiento de proteínas asociadas con la síntesis de polisacáridos. De esta manera HP0114 establece un vínculo entre dos agrupamientos de proteínas sin aparente relación funcional. De las proteínas hipotéticas HP1029 y HP0245 no se dispone de información. Por lo tanto, la única probable asociación funcional con este agrupamiento estaría determinada por sus patrones de interacción. HP1029 interacciona con FliM y FliY, proteínas que constituyen el llamado “complejo switch” que es el regulador del rotor flagelar. HP0245 interacciona con las proteínas FlgK y FlgL. Ambas proteínas pertenecen a la región estructural conocida como gancho del flagelo. Se requieren de nuevos estudios para corroborar la asociación de estas proteínas hipotéticas. A manera de resumen, en este agrupamiento algunas de las interacciones encontradas no eran esperadas debido a su aparente carencia de significado biológico. Este 38 el caso de proteínas asociadas a síntesis de vitaminas del complejo B y aquellas involucradas en el proceso de traducción durante la síntesis de proteínas. Mientras que otras interacciones eran esperadas, como es el caso de proteínas asociadas específicamente con quimiotaxis o en el caso de proteínas raíz que dadas sus características estructurales necesitan estar ancladas a la pared celular. 8.2. Adaptación al medio ácido El agrupamiento de proteínas asociado a adaptación al medio ácido está constituido por 4 proteínas candidato de un total de 18 proteínas (Figura 10). Figura 10: Agrupamiento de proteínas asociadas a la adaptación al medio ácido de H. pylori. Las proteínas marcadas en color rojo corresponden a proteínas raíz y las marcadas en color verde, a proteínas candidato. El análisis realizado con BINGO sugiere que este agrupamiento de proteínas está enriquecido con términos GO para los procesos asociados a catálisis de la arginina y metabolismo de la urea, síntesis de lipopolisacáridos asociados a la pared celular. Del mismo modo que en el agrupamiento anterior, la presencia de éste último grupo de términos GO es inesperada, ya que aparentemente no existe una asociación funcional entre el sistema de adaptación al medio acido y componentes estructurales de la pared celular. 39 Cuadro 4. Lista de proteínas candidato asociadas a adaptación al medio ácido de H. pylori. Gen/proteína Descripción Código de acceso en UniProt Valor predictivo positivo (VPP) nikR Regulador transcripcional dependiente de níquel. O25896 87% glmM Fosfoglucosamina mutasa. P25177 60 % O25983 60 % O25985 60% csrA smpB Regulador del almacenamiento de carbono. Proteína de unión al tmARN. La proteína NikR es un factor de transcripción dependiente de níquel (Figura 11). NikR interacciona con NixA, UreA, ExbD1 y ExbB1. NixA es una proteína de membrana, encargada de la importación del níquel al interior de la célula. UreA corresponde a una de las subunidades de la enzima ureasa; responsable de la adaptación al medio ácido. Por su parte, ExbD1 y ExbB1 son proteínas que forman un complejo con la proteína TonB. Este complejo de proteínas se encarga, mediante un gradiente de protones, de la movilización de complejos que contienen níquel (Schauer et al., 2008). Figura 11: Estructura cristalográfica donde se observa la interacción entre la proteína NikR y el ADN de E. coli. Código de acceso a la base de datos PDB: 2HZV. La proteína marcada con el color verde corresponde a NikR y la estructura marcada en color naranja al ADN. 40 Por su parte, la proteína GlmM interacciona con UreA y UreB, ambas forman la estructura básica del complejo ureasa. GlmM es una enzima de la familia de las fosfohexosas mutasas. Estas enzimas son importantes en la producción de intermediarios durante la síntesis de péptido glicano de la pared celular (Jolly et al., 1999). Las proteínas candidato CsrA y SmpB interaccionan con las proteínas del tipo ExbB2 y ExbD2 que forman un complejo con TonB. La función de este complejo ya fue citado anteriormente. CsrA pertenece a una familia de proteínas de unión al ARN que actúa sobre la traducción de genes y/o sobre la estabilidad de los transcritos. El mecanismo mediante el cual CsrA activa o suprime la expresión de determinados genes aún no se conoce. SmpB es una proteína de unión al tmARN. El complejo SmpB-tmARN es fundamental en un proceso conocido como trans-traducción, el cual es un mecanismo utilizado por las bacterias para el aseguramiento de la calidad de la síntesis de proteínas (Keiler et al., 1996; Dulebohn et al., 2007; Moore y Sauer, 2007; Keiler, 2008). Por último, en este agrupamiento sobresalen interacciones que relacionan al complejo ureasa con estructuras asociadas a la pared celular, y remarca el papel que podrían desempeñar una serie de reguladores a nivel transcripcional y traduccional, alterando la expresión de genes necesarios para la adaptación al medio ácido. 8.3. Metabolismo del nitrógeno El agrupamiento de proteínas asociado a metabolismo del nitrógeno está constituido por 7 proteínas candidato de un total de 9 proteínas (Figura 12). Figura 12: Agrupamiento de proteínas asociadas a el metabolismo del nitrógeno de H. pylori. Las proteínas marcadas en color rojo corresponden a proteínas raíz y las marcadas en color verde, a proteínas candidato. El análisis con BINGO reveló términos de ontología génica asociados a la síntesis de glutamina y la síntesis de compuestos nitrogenados. En el cuadro cinco se enlistan las 41 siete proteínas candidato para este agrupamiento de proteínas. Cuadro 5. Lista de proteínas candidato asociadas al metabolismo del nitrógeno de H. pylori. Gen/proteína Descripción Código de acceso en UniProt Valor predictivo positivo (VPP) speA Arginina descarbolixasa. O25176 75 % aspB Aspartato amino transferasa. O25383 75% murI Glutamato racemasa. P56068 60% ggt Gama glutamil tranpeptidasa. O25743 60% gltx1 Glutamil-tARN sintetasa. P96551 60% gltx2 Glutamil Glutaminil-tARN sintetasa. O25360 60% HP0056 Delta-1-pirrolina5-carboxilato deshidrogenasa. O24897 60% Las proteínas candidato en este agrupamiento interaccionan en su totalidad con GlnA y GdhA, que corresponden a la glutamina sintetasa y glutamato deshidrogenasa. GlnA y GdhA son clave en el metabolismo del nitrógeno. Además, la proteína candidato SpeA interacciona con la proteína RocF, la cual corresponde al agrupamiento de adaptación al medio ácido (Figuras 1, 4 y 6). Esta interacción tendría significado biológico ya que se conoce que el metabolismo del nitrógeno está directamente relacionado con la adaptación al medio ácido (Ver discusión). El análisis de las anotaciones disponibles en la base de datos UniProt revela que las proteínas candidato Ggt, HP0056, AspB, MurI y SpeA están asociadas con el metabolismo del glutamato, y GltX1 y GltX2 estan asociadas con la adición del glutamato al tARN. El glutamato es amino ácido clave en el metabolismo del nitrógeno de H. pylori. En este agrupamiento, a diferencia de los anteriores, se observa una mayor uniformidad funcional de las proteínas que lo constituyen. Sobresaliendo el papel que juega 42 el glutamato en el metabolismo del nitrógeno y su interconexión con la adaptación al medio acido. 8.4. Sistema de secreción tipo IV El agrupamiento de proteínas asociado al sistema de secreción tipo IV está constituido por 8 proteínas candidato de un total de 42 proteínas (Figura 13). Figura 13: Agrupamiento de proteínas asociadas al sistema de secreción tipo IV de H. pylori. Las proteínas marcadas en color verde corresponden a proteínas raíz y las marcadas en color rojo, a proteínas candidato. El análisis con BINGO identificó términos de ontología génica asociados con la patogénesis, conjugación bacteriana y transporte de moléculas. En el cuadro 6 se enlistan las 8 proteínas candidato para este agrupamiento de proteínas. Cuadro 6. Lista de proteínas candidato asociadas al sistema de secreción tipo IV de H. pylori. Gen/proteína Descripción Código de acceso en UniProt Valor predictivo positivo (VPP) trbI Proteína del sistema de secreción tipo IV, relacionada con VirB10. O24883 92 % hopQ Proteína de membrana externa. O25791 87% HP1342 Proteína de membrana externa. O34523 75% HP0439 Proteína hipotética. O25187 75% 43 HP0040 Proteína hipotética. O24881 75% HP0922 Proteína de membrana externa. O25579 60% HP0120 Proteína hipotética. O24939 60% HP0066 Proteína hipotética. O24906 60% En primer lugar, las proteínas candidato HopQ y HP1342 corresponden a proteínas de la membrana externa de H. pylori. Ambas proteínas interaccionan con las proteínas raíz Cag3, CagS, VacA y CagA, las cuales están asociadas directamente a patogénesis. Por ejemplo, se conoce que CagA y VacA son potentes cito-toxinas capaces de alterar la vías de señalización de las células del hospedero (Censini et al., 1996; Akopyants et al., 1998; Blomstergren et al., 2004). Del mismo modo, las proteínas candidato HP0922, HP0066 y HP0120 presentan patrones de interacción similares a HopQ y HP1342. HP0922, HP0066 y HP0120, presentan interacciones con las proteínas de membrana externa BabA y Omp1, las cuales son adhesinas conocidas en H. pylori. Además, HP0922, HP0120 y HP0066 interaccionan por separado con CagA, Cag3 y VacA, respectivamente. Por otro lado, existe un grupo de proteínas candidato que comparten algunos patrones de interacción. Tal es el caso de las proteínas HP0040, HP0439 y TrbI. Las tres proteínas interaccionan con HP0017 y HP0459. Además, TrbI interacciona con Cag5, CagE, VirB11 y TraG. Estas últimas proteínas raíz, al igual que HP0017 y HP0459, participan durante el ensamblaje del sistema de transferencia horizontal de genes. HP0040 y HP0439 son proteínas hipotéticas. El análisis de la secuencia de HP0439 revela la presencia de dominios del tipo VirB8. Este tipo de dominios están presentes en proteínas trans-membranales que constituyen componentes primarios del sistema de transporte de ADN (Kumar y Das, 2001). A manera de resumen, en la figura 7 se observa que este agrupamiento presenta tres subgrupos. El subgrupo más denso e interconectado corresponde en su totalidad a proteínas raíz que conforman la estructura básica del sistema de secreción tipo IV encargado de la 44 inyección de cito-toxinas. Otro subgrupo de proteínas que comparte patrones interacción corresponde a adhesinas y cito-toxinas. El último subgrupo está constituido por proteínas asociadas a transferencia horizontal de genes. Este agrupamiento de proteínas muestra una organización estructurada, donde cada subgrupo corresponde a funciones particulares del sistema de secreción tipo IV. 8.5. Proteínas de respuesta a estrés. El agrupamiento de proteínas asociado a respuesta a estrés está constituido por 7 proteínas candidato de un total de 16 proteínas (Figura14). Figura 14: Agrupamiento de proteínas asociadas a la respuesta a estrés de H. pylori. Las proteínas marcadas en verde corresponden a proteínas raíz y las marcadas en color rojo, a proteínas candidato. El análisis con BINGO sugiere que este agrupamiento de proteínas está enriquecido con términos GO en procesos biológicos asociados a metabolismo de ácidos nucleicos, síntesis de macromoléculas, metabolismo de especies reactivas de oxígeno, interconversión entre nucleótidos y nucleósidos, así como al metabolismo de ribonucleótidos. En el cuadro 7 se enlistan las ocho proteínas candidato. 45 Cuadro 7. Lista de proteínas candidato asociadas a proteínas de respuesta a estrés de H. pylori. Gen/proteína Descripción Código de acceso en UniProt Valor predictivo positivo (VPP) sodB Superóxido dismutasa. P43312 87 % Proteína ribosomal S2 (30S). P56009 rpsB groL Chaperonina. P42383 60% ndk Nucleósido difosfato quinasa. P56075 60% ADNE Subunidad alfa de la ADN polimerasa III. P56157 60% nrdA Ribonucleotido difosfato reductasa. P55982 60% uvrC Endonucleasa. P56428 60% 75% La proteína candidato SodB corresponde a la proteína superóxido dismutasa, de la cual se conoce su función en los sistemas celulares de destoxificación. SodB interacciona con las proteínas raíz SecA, TsaA, Pfr, IscS y Tpx. De igual forma, GroL y Ndk, que corresponden a una chaperona molecular y una nucleósido quinasa, interaccionan con las proteínas raíz TsaA y TrxA, respectivamente. Las proteínas raíz TrxA y TrxB pertenecen a la familia de las tiorredoxinas. Las proteínas candidato UvrC, NrdA y DnaE interaccionan con estas proteínas raíz. Igualmente, DnaE interacciona con la proteína raíz LpxB. El análisis de la secuencia de UvrC muestra la presencia de dominios asociados a la reparación del daño del ADN; NrdA es una proteína que provee los precursores necesarios para la síntesis de ADN y DnaE corresponde a la subunidad alfa de la ADN polimerasa III (Figura 15), la cual muestra actividad exonucleasa de 3’a 5’; importante en la reparación del daño al ADN (Beard et al., 2001). 46 Figura 15: Estructura cristalográfica donde se observa la interacción entre la subunidad alfa de la ADN polimerasa con TrxA, durante el proceso de reparación del ADN del bacteriófago T7. Código de acceso a la base de datos PDB: 1SKR. La proteína marcada con el color verde corresponde a la ADN polimerasa y la estructura marcada en color naranja a la proteína TrxA. La proteína candidato RpsB interacciona con las proteínas raíz SecA, FliR y FliA, las cuales están asociadas a la exportación de proteínas flagelares. RpsB es una proteína ribosomal encargada de la regulación de la traducción. Aunque sorprende la interacción de RpsB con las proteínas raíz antes citadas, ya que parece carecer de significado biológico, diversos estudios en otras bacterias demuestran que RpsB se produce bajo condiciones de estrés (Jurgen et al., 2001). Resumiendo, este agrupamiento presenta proteínas candidato con funciones presuntivas en concordancia con las de las proteínas raíz de este agrupamiento. Entre las que destacan aquellas asociadas con la reparación del daño al ADN, con la respuesta al estrés oxidativo y síntesis de proteínas. Mecanismos clave para la sobrevivencia de este patógeno en ambiente hostil, como lo es el epitelio gástrico. 47 8.6. Síntesis de lipopolisacáridos El agrupamiento de proteínas asociado a lipopolisacáridos está constituido por 11 proteínas candidato de un total de 20 proteínas (Figura 16). Figura 16: Agrupamiento de proteínas asociadas a síntesis de lipopolisacáridos de H. pylori. Las proteínas marcadas en color verde corresponden a proteínas raíz y las marcadas en color rojo, a proteínas candidato. El análisis con BINGO sugiere que este agrupamiento de proteínas esta enriquecido con términos GO para procesos biológicos asociados a síntesis de lípidos, metabolismo de carbohidratos, polisacáridos y lipopolisacáridos. En el cuadro 8 se enlistan las nueve proteínas candidato para este agrupamiento de proteínas. Cuadro 8. Lista de proteínas candidato asociadas a síntesis de lipopolisacáridos de H. pylori. Gen/proteína Descripción Código de acceso en UniProt Valor predictivo positivo (VPP) spsC Transferasa. O25130 92% kdtA Transferasa. O25611 75 % rfaD Epimerasa. O25530 75% HP0102 Proteína hipotética. O24928 75% HP0277 Ferredoxina. O25054 60% hldE Transferasa. O25529 60% algC Pirofosforilasa. O25865 60% galU Epimerasa. O25363 60% 48 flaA1 Epimerasa. O25511 60% gmhA Isomerasa. O25528 60% HP1570 Proteína hipotética. O26090 60% La proteína candidato SpsC interacciona con las proteínas raíz NeuA, RfbD, HP0043, WbpB y NolK. Del mismo modo, la proteína candidato HP0102 interacciona con RfbD, HP0043 y NolK. SpsC corresponde a una proteína con actividad amino transferasa y HP0102 a una proteína hipotética. Todas las proteínas raíz que interaccionan con SpsC y HP0102 están asociadas a la síntesis de polisacáridos; en particular con la síntesis de un componente estructural del antígeno O, la cual es una molécula importante en la virulencia bacteriana (Stroeher et al., 1995; Rashid et al., 2003). Las proteínas candidato KdtA y HP0277 interaccionan con las proteínas raíz RfaC, CoaD. Además, KdtA interacciona con la proteína raíz LpxB. KdtA es una enzima con actividad transferasa. Las proteínas raíz con las cuales interacciona KdtA están relacionadas con la síntesis de una estructura llamada núcleo de oligosacárido necesaria para el anclaje de lipopolisacáridos a la membrana celular. HP0277 corresponde a una ferredoxina. Este tipo de proteínas confieren resistencia al estrés oxidativo, mediante la reducción de diferentes tipos de peróxidos a su correspondiente alcohol (Wood et al., 2003). Por otro lado, un grupo de proteínas candidato comparte algunos patrones de interacción. Este el caso de la proteínas candidato GmhA, HldE, RfaD, GalU y AlgC. GmhA, HldE, RfaD interaccionan con las proteínas raíz RfbD y RfaC, las cuales están relacionadas con el sistema de exportación del antígeno O. Además, RfaD y HldE interaccionan con HP0043. GalU y AlgC también interaccionan con HP0043 y, además, con GalE. GmhA, HldE y RfaD presentan funciones de isomerasa, transferasa y epimerasa, respectivamente. Del mismo modo, GalU y AlgC presentan funciones de epimerasa y pirofosforilasa. Las proteínas candidato FlaA1 y HP1570 interaccionan con las proteínas raíz NeuA y SpsE, las cuales están asociadas con la síntesis de lipopolisacáridos de superficie. FlaA1 corresponde una proteína con actividad epimerasa y HP1570 a una proteína hipotética. Finalmente, este agrupamiento presenta un conjunto de proteínas que presentan 49 funciones relacionadas con la síntesis de polisacáridos, específicamente con la síntesis del antígeno O y del núcleo de oligosacárido. Estas últimas son moléculas importantes en la estructura y función de los lipopolisacáridos de superficie. 9. Discusión Desde que Warren y Marshall (1983), asociaron por primera vez a H. pylori con la aparición de ulceras gástricas, pasando por la era genómica y post-genómica; diversos estudios han proporcionado información respecto a las proteínas y/o genes que son esenciales durante el proceso de patogénesis de H. pylori. Sin embargo, las funciones celulares que resultan de la interacción entre las proteínas requieren de ser investigadas desde una perspectiva holística, es decir el estudio de la biología de sistemas (Aloy y Russel, 2006; Aloy, 2007). Así, la construcción de redes de interacción entre proteínas es un punto de partida en el entendimiento de los sistemas celulares. En el caso particular de H. pylori, las redes de interacción entre proteínas se han investigado mediante métodos experimentales. Este estudio ha permitido el análisis de aproximadamente el 50% del proteoma de H. pylori (Rain et al., 2001). En el presente trabajo, se realizó un análisis, a nivel de sistemas, de la red de interacción entre proteínas asociadas a patogénesis de H. pylori. Para construir la red de interacción de proteínas se utilizó de una base de datos de proteínas de función conocida asociada a patogénesis de H. pylori (proteínas raíz). Inicialmente, a partir de las proteínas raíz se construyó una red de interacción entre proteínas solamente tomando en cuenta las interacciones reportadas en el interactoma determinado a nivel experimental por Rain, et al., (2001). El procedimiento anterior se realizó con el objetivo de determinar la cobertura de la información a nivel experimental de interacciones entre proteínas disponible para las proteínas raíz. Los resultados obtenidos de este análisis revelaron una baja cobertura (50%) de interacciones; es decir, a nivel experimental sólo se dispone de datos de interacciones entre proteínas para el 50% de las proteínas raíz. En vista de lo anterior se procedió a realizar las predicciones para el restante 50% de proteínas raíz que carecen de datos de interacción a nivel experimental. Las predicciones fueron realizadas con el programa PIANA, el cual implementa el método de los interólogos (Aragues et al., 2006); sin embargo, nuevamente los resultados no fueron satisfactorios; alcanzándose una cobertura del 56%. Esto aún sin descontar que se estima 50 que el 50% de las interacciones reportadas por el método de Y2H son falsos positivos y negativos; esto es debido a la limitación propia de la metodología (von Mering et al., 2003). En concordancia a lo reportado por Aragues et al., (2008) con esta baja cobertura no fue posible aplicar el método de análisis del contexto funcional para cada una de las proteína que integran una red de interacción (GUP). Diversos estudios sobre métodos para la determinación de interacciones entre proteínas a nivel experimental y computacional, sugieren que la mejor manera de incrementar la cobertura y calidad de un estudio de interactómica es a través de la combinación de diferentes métodos (Schwikowski et al., 2000; Edwards et al., 2002; von Mering et al., 2002). Por lo tanto, esta situación remarcó la necesidad de incluir más métodos de predicción para mejor la cobertura y de encontrar una forma de evaluar la calidad de las interacciones. El sistema de análisis STRING cumplió con todos los requerimientos antes citados (Jensen et al., 2009). STRING contiene interacciones entre proteínas que han sido determinadas a nivel experimental por estudios a gran escala y de baja escala (interacciones físicas directas). Ejemplos de los primeros, son los resultados producidos por los ensayos de tipo Y2H y TAP-MS. Los segundos corresponden a los experimentos clásicos de bioquímica y genómica, reportados de manera individual. Por otro lado, STRING también predice interacciones indirectas; es decir, proteínas que comparten vía metabólica o proceso celular específico, proteínas co-reguladas a nivel transcripcional y proteínas que participan en un complejo multi-proteico. Tomando en cuenta toda esta información, STRING realiza predicciones mediante el método de los “interólogos”. Además, utiliza la información contenida en una gran cantidad de genomas secuenciados completamente y realiza predicciones basadas en el contexto genómico. Los métodos basados en el contexto genómico son idóneos cuando se requiere predecir interacciones entre proteínas de organismos procariotes ya que se fundamentan en el orden y contenido de los genes dentro de un genoma; ambas propiedades son una característica distintiva de los genomas de estos organismos (Valencia y Pazos, 2002). Por ejemplo, los genes vecinos en varios genomas (operones potenciales) tienden a codificar proteínas que interaccionan entre sí. Finalmente, STRING es capaz de determinar con probabilidad estadística la interacción entre las proteínas mediante la implementación de una función de puntaje. Con la aplicación de los métodos y filtros citados se logró obtener una red de interacciones entre 51 proteínas con alta cobertura (88%) y confiabilidad de probabilidad estadística (puntaje de STRING=0.7). La red de interacción entre proteínas resultado del presente estudio cumple con las siguientes funciones. Cerca del 40% del genoma de H. pylori aún no está anotado (Boneca et al., 2003). Entre los principales objetivos de los proyecto sobre los interactomas es predecir la función de proteínas hipotéticas y proteínas sin función asignada. La red de interacción entre proteínas resultado del presente estudio cumple con este objetivo ya que ofrece indicios de probables funciones de proteínas hipotéticas derivadas su interacción con proteínas de función conocida asociada a patogénesis de H. pylori. Esto es, asociación de función por “culpabilidad” (Figura 5). Este método fue inicialmente desarrollado para predecir la posible asociación entre proteínas con cáncer (Aragues et al., 2008). Existen otros métodos basados en la teoría de grafos que intentan asignar funciones o papeles biológicos a las proteínas que integran una red de interacciones (Yook et al., 2004). Este último tipo de métodos han permitido determinar que las redes biológicas adoptan una organización deacuerdo a la ley de potencias, a este tipo de organización se le conoce como “libre de escala” (Barabási y Oltvai, 2004). En una red “libre de escala”, existen nodos (proteínas en este estudio) que concentran una gran cantidad interacciones y otros que presentan pocas; es por ello que a los primeros se les conoce como “focos de la red”. Generalmente, para poder caracterizar la organización de una red se realiza el cálculo de una serie de parámetros, conocidos como parámetros de la topología de la red. Entre los que destaca el conocido como “grado del nodo”, este parámetro hace referencia al número total de conexiones que presenta un nodo dentro de una red de interacción, por lo cual es muy útil para caracterizar a los focos de la red. Esto último es importante debido a que el análisis del interactoma de S. cerevisiae ha demostrado que los focos de la red de interacción corresponden a genes esenciales, y que su afectación puede resultar letal para el organismo (Barabási y Oltvai, 2004). A pesar de la importancia del cálculo de los parámetros topológicos de una red de interacción, en el presente trabajo éstos no fueron calculados por las siguientes razones: Primero, uno de los algoritmos de predicción utilizado por STRING se basa en el conocimiento previo. En este algoritmo, para cada proteína introducida en STRING, realiza una búsqueda en la literatura, de manera que si encuentra algún reporte donde se mencione la interacción con otra proteína, STRING la 52 toma como verdadera. Así tendríamos que en una red de interacción construida a base de datos “curados”, como en el caso del algoritmo citado, se esperaría que aquellas proteínas sobre las cuales la comunidad científica ha puesto mucho interés sean las que presenten un mayor número de interacciones. Hoffmann y Valencia, (2003) reportan que en el interactoma de S. cerevisiae no hay una correlación entre el “grado del nodo” y el numero de citas en la literatura para 380 genes. De esta manera se justifica la omisión del cálculo de parámetros topológicos de la red de interacción obtenida en el presente estudio, ya que de haberlo hecho se podría llegar a conclusiones erróneas; por ejemplo, asignar erróneamente a una proteína como esencial en la patogénesis de H. pylori solamente basados en su número total de interacciones. Segundo, Aragues et al., (2008) demuestran estadísticamente, que el “grado del nodo” no es un buen indicador para predecir la función de una proteína y que el método basado en el análisis del contexto de una proteína dentro de una red de interacción no es influenciado por el uso de datos “curados”. Todo este conjunto de observaciones justifican el uso de la metodología empleada en éste estudio. A continuación, para cada agrupamiento de proteínas se discuten los resultados obtenidos en el presente trabajo. 53 9.1. Motilidad y quimiotaxis Uno de los aspectos fundamentales de la infección de H. pylori es su capacidad de moverse a través de la capa mucosa del lumen gástrico para así poder acceder a la superficie del epitelio gástrico. El tránsito hacia el epitelio gástrico está dirigido por la búsqueda de un nicho que le proporcione los nutrientes y condiciones necesarias para la proliferación. Este movimiento dirigido requiere de la quimiotaxis y motilidad. Para ello un conjunto de proteínas actúan de manera concertada ensamblando estructuras o participando en cascadas de señalización. Este es el caso de la proteína candidato CheA; de la cual es conocido su papel en los sistemas de transducción de señales en bacterias. Específicamente, CheA interactúa con CheW y CheV, se auto-fosforila y transfiere su grupo fosfato a CheY. Esto se traduce en una señal para los motores flagelares, modificando la dirección rotacional del flagelo. Sin embargo, en el presente estudio se determinó que CheA interacciona con un grupo de proteínas asociadas a la exportación de proteínas flagelares para el ensamblaje del flagelo. Estas nuevas interacciones de CheA no han sido estudiadas previamente, por lo cual podrían indicar una nueva función para esta proteína. Existen en la literatura científica, dos artículos que soportan algunas de las nuevas interacciones descritas para CheA. Por ejemplo, en un estudio de proteómica diferencial en C. jenuni sugiere que CheA, FlhA y FliA (estas dos últimas son proteínas flagelares) son indispensables durante proceso de formación de biopelículas (Kalmokoff et al., 2006). Un hallazgo similar fue descrito en Aeromonas spp (Kirov et al., 2004). Ambos trabajos reportan el papel de estas proteínas durante las primeras etapas de la formación de biopelículas. El aumento de la expresión de estas proteínas podría relacionarse con la necesidad de exportación de otras proteínas flagelares necesarias para el ensamblaje del flagelo, con la formación de una matriz tridimensional que facilitaría el contacto célula-célula o como un componente de matriz extracelular. Esto es fundamental dada la evidencia de que H. pylori es capaz de formar biopelículas en la mucosa gástrica del hospedero (Carron et al., 2006; Cellini et al., 2008). De esta manera, se sugiere una probable función reguladora de CheA en la exportación de proteínas flagelares durante las primeras etapas de la formación de las biopelículas en H. pylori. Por otro lado, en este agrupamiento se encontró que las proteínas candidato YlxH, ThiF y Dxs, presentan dominios asociados con la síntesis de vitaminas del complejo B. La 54 proteína YlxH presenta interacciones con algunas de la proteínas con las que interacciona CheA, con excepción de CheW y CheV. Aunque existe poca información de la proteína YlxH, el análisis de su secuencia con el programa BLASTp resultó con una similitud del 63% (valor E de 3 x 10-63) y un mismo contenido de dominios funcionales con la proteína FlhG de C. jejuni, de acuerdo al acceso en la base de datos PFAM: PF01656. FlhG pertenece a una familia de reguladores esenciales para la síntesis proteínas asociadas al ensamblaje del flagelo. Por ejemplo, existe evidencia de que el homólogo de FlhG (FleN) en P. aeruginosa regula a nivel transcripcional el número de flagelos (Dasgupta et al., 2000 y 2003). Esto sugiere que YlxH podría ser un homólogo de FlhG, con función similar en H. pylori. Las proteínas candidato Dxs y ThiF interaccionan con proteínas relacionadas con la exportación de proteínas flagelares y con proteínas generadoras del torque flagelar. Posiblemente estas proteínas candidato proporcionen moléculas o intermediarios que sean útiles en la producción de co-factores en la síntesis de proteínas flagelares. Así, estos patrones de interacción sugieren un vínculo entre proteínas relacionadas con la síntesis de vitaminas del complejo B, la quimiotaxis y la exportación de proteínas para el ensamblaje del flagelo. Otro hallazgo importante en este agrupamiento de proteínas fue la presencia de proteínas candidato asociadas con el proceso de traducción en la síntesis de proteínas. Este fue el caso de las proteínas IleS y LepA. Por ejemplo, en E. coli, LepA se ha asociado a la síntesis de proteínas de membrana; específicamente, con la fidelidad del proceso de traducción (Qin et al., 2006; Youngman y Green, 2007). Así mismo, su homólogo en S. cerevisiae, ha mostrado que es capaz de unirse, de manera GTP dependiente, a los ribosomas mitocondriales y funcionar como un factor asegurador de la fidelidad de la síntesis de proteínas mitocondriales, principalmente de aquellas asociadas con la formación de complejos de la cadena transportadora de electrones (Bauerschmitt, et al., 2008). Esta última observación es fundamental considerando que uno de los primeros eventos del ensamblaje del flagelo involucra la inserción de FliF y proteínas relacionadas en la membrana plasmática para constituir la base del motor flagelar. Posteriormente, FliG, que corresponde a la principal proteína del rotor, se ensambla sobre la base constituida por FliF y el proceso prosigue hasta que el ensamblaje del motor se completa. Una vez que se han constituido las estructuras básicas del flagelo (sistema motor y de exportación), se inicia el 55 proceso de exportación de proteínas para ir ensamblando las estructuras distales del flagelo. El paso inicial en la exportación de proteínas flagelares consiste en la formación de un macrocomplejo de proteínas que involucra a las proteínas FliH y FliI. El macrocomplejo, posteriormente se acopla a las compuertas del sistema de exportación localizado en la base del flagelo y facilita la entrada de las proteínas para ser exportadas. Diversos estudios reportan que, en ausencia de FliH, no es posible el acoplamiento a las compuertas del sistema de exportación; así FliH es esencial en el proceso. Así mismo, mutantes de fliG y fliF en H. pylori son incapaces de realizar la exportación necesaria para el correcto ensamble del flagelo (Allan et al., 2000). Estos mecanismos de revisión a nivel traducción serían fundamentales como un paso previo a la exportación de proteínas que ensamblarían al flagelo. Este conjunto de evidencias sugiere que IleS y LepA podrían estar asociadas en la regulación y aseguramiento de la fidelidad de la síntesis de las proteínas FliQ y FliL, FliF, FliG y FliH, respectivamente; las cuales son clave en las etapas iníciales del proceso, de ensamblaje y funcionamiento del flagelo. La proteína candidato MurB interacciona con proteínas asociadas al cuerpo basal del flagelo. Esta estructura anatómica es la encargada de anclar el flagelo a las envolturas celulares, da soporte al sistema de exportación de proteínas y al rotor flagelar. MurB es una proteína que participa en síntesis de péptidoglicanos y está relacionada tanto en la degradación como en la síntesis de la pared celular. Esto es fundamental considerando que las proteínas que pertenecen al cuerpo basal del flagelo deben estar ancladas a nivel de la capa de péptidoglicano. Por lo tanto, dadas las características funcionales de MurB se sugiere que está asociada con la inserción y anclaje de las proteínas del cuerpo basal del flagelo. Para la proteína candidato HP0813 se determinó la presencia un dominio con actividad beta-lactamasa. La base de datos 3DID, reporta que en varias estructuras cristalográficas este tipo de dominios, además de participar en la resistencia a los antibióticos, interacciona con dominios de proteínas relacionadas con el transporte electrónico a través de la membrana celular y con el reconocimiento de proteínas de la membrana celular. Acceso a la anotaciones de estos dominios en la base de datos PFAM: PF00258 y PF01473, respectivamente. Este conjunto de evidencias sugiere que HP0813 podría contribuir, junto con MotA y MotB, en la generación de torque necesario para la 56 rotación flagelar. La proteína candidato HP0114 parece interaccionar con proteínas del gancho flagelar y con una proteína asociada a la síntesis de polisacáridos. Estas interacciones que presenta HP0114 podrían actuar como un vínculo entre proteínas relacionadas con la síntesis de polisacáridos y proteínas del filamento flagelar. Esto es fundamental considerando que tanto el ensamblaje del flagelo, como la fuerza rotacional de desplazamiento implican que las proteínas de dichas estructuras estén glicosiladas para funcionar de manera óptima. Por ejemplo existe evidencia experimental donde mutantes de C. jenuni carentes de los genes asociados a glicosilación de las flagelinas presentan fenotipos no motiles (Guerry et al., 2006; McNally et al., 2006). Por último, dada la importancia que juega el flagelo en el proceso de colonización y persistencia de la infección por H. pylori, este agrupamiento de proteínas sugiere una interconexión entre los sistemas de quimiotaxis, exportación y motilidad. De tal manera que H. pylori asegura un proceso de síntesis de proteínas fidedigno, principalmente de las que son indispensables en las primeras etapas del ensamblaje del flagelo. 9.2. Adaptación al medio ácido La adaptación al medio ácido es la capacidad de H. pylori de mantener el pH periplasmático cercano a la neutralidad; permitiendo que en el citoplasma se mantengan valores de pH fisiológicos. Varios genes asociados a la adaptación del medio ácido son requeridos por H. pylori para colonizar modelos animales. Principalmente, genes asociados con la síntesis de ureasa (Weeks et al., 2000; Mollenhauer-Rektorschek et al., 2002; Marcus et al., 2005). Entre los resultados obtenidos para este agrupamiento de proteínas, destaca la proteína candidato NikR, la cual interacciona con proteínas asociadas con la enzima ureasa y con el metabolismo del níquel. Es conocido que NikR es un regulador transcripcional asociado con la homeostasia del níquel. El níquel juega un papel importante en la colonización y persistencia de H. pylori. De manera específica, el níquel funciona como cofactor de la enzima ureasa. La enzima se encarga, en gran parte, de la adaptación al medio ácido. Sin embargo, aunque este metal es esencial para la sobrevivencia de H. pylori, a gran concentración puede resultar tóxico para la bacteria. Por lo tanto, es necesario un control de 57 su importación. Diversos estudios sugieren que a alta concentración de níquel, NikR es capaz de unirse a la región promotora de nixA, ureA y del operón exbB-exbD-tonB. Esto produce dos fenómenos: en primer lugar, se suprime la producción de nixA y de exbBexbD-tonB y, simultáneamente, la importación de níquel y se activa la transcripción de ureA para la utilización de este metal (Abraham et al., 2006; Dosanjh et al., 2007; Zambelli et al., 2008). Mientras este trabajo estuvo en progreso, un estudio indica que, además de la función homeostática del níquel, la actividad de NikR está directamente ligada a cambios en el pH (Li y Zamble, 2009). Así, la inclusión de NikR en este agrupamiento de proteínas se soporta de manera experimental constituyendo una prueba ciega para dichas predicciones. La conclusión de las observaciones sugiere que NikR es un regulador transcripcional con función preponderante en la adaptación al medio ácido y consecuentemente en patogénesis de H. pylori. Igualmente, la proteína candidato GlmM interacciona con las subunidades estructurales del complejo ureasa (UreA-UreB). Aparentemente esta interacción entre GlmM y UreA-UreB carece de significado biológico, ya que GlmM corresponde a una enzima asociada a la síntesis de péptido glicano de la pared celular. Además, estudios realizados en E. coli y S. gordonii sugieren que GlmM participa en el ciclo celular bacteriano y en la formación de biopelículas (Shimazu et al., 2008). Esta asociación funcional de GlmM es también soportada por los resultados de este trabajo, ya que GlmM interacciona con FtsH, una proteína asociada con el citoesqueleto y ciclo celular bacteriano (resultados no mostrados). Recientemente, se ha reportado a nivel experimental el interactoma del complejo ureasa en H. pylori. Una de las conclusiones de este trabajo fue que existe una relación entre el complejo ureasa con proteínas del citoesqueleto y del ciclo celular bacteriano (Stingl et al., 2008). Estos hallazgos sugieren que tal vínculo esta dado por la necesidad de crear un compartimento celular que contenga una fracción del complejo ureasa, facilitando sus actividades en respuesta al pH ácido. A la luz de las observaciones, se sugiere que GlmM, en conjunto con proteínas que conforman el citoesqueleto bacteriano, contribuye a la generación un compartimento capaz de contener al complejo ureasa, facilitando la entrega de sustratos al mismo. Nuevamente, se presentan proteínas candidato asociadas con el proceso de traducción en la síntesis de proteínas. Este es el caso de CsrA y SmpB, las cuales 58 interaccionan con proteínas raíz asociadas con el transporte de moléculas a través de la membrana celular. Por ejemplo, en C. jejuni se demostró que CsrA es esencial para la sobrevivencia bajo estrés, para la formación de biopelículas y para la invasión de células del hospedero (Fields y Thompson, 2008). Esta evidencia soporta el papel de CsrA en este agrupamiento de proteínas, considerando que el medio ambiente ácido por si mismo genera condiciones de estrés. Adicionalmente, estudios en E. coli, Y. pseudotuberculosis y S. entérica, demuestran que CsrA actúa como un regulador de genes asociados con virulencia (Cerca y Jefferson, 2008; Heroven et al., 2008; Kerrinnes et al., 2008). Por su parte, la proteína candidato SmpB participa en el proceso conocido como trans-traducción. En bacterias este proceso ha sido estudiado a detalle con el fin de entender los mecanismos de control de calidad del flujo de la información genética (Keiler et al., 1996; Dulebohn et al., 2007; Moore y Sauer, 2007; Keiler, 2008). La trans-traducción es un mecanismo utilizado para rescatar ribosomas secuestrados por mARNs carentes de señales de terminación apropiadas, por tanto, incapaces de reanudar el proceso de traducción. En consecuencia, la trans-traducción disminuye el número de cadenas defectuosas de mARN y además, es utilizada para adicionar a proteínas incompletas, amino ácidos que funcionan como etiquetas, útiles para la degradación de estas proteínas defectuosas. A pesar de que este mecanismo ha sido estudiado a detalle, se desconocen muchos aspectos relacionados con su papel biológico específico. Estudios en cepas de E. coli, Salmonella o Synechocystis con defectos en la trans-traducción, resultaron ser hipersensibles al efecto de los antibióticos (Vioque y de la Cruz, 2003; Luidalepp et al., 2005). Deficiencias en la transtraducción afecta la habilidad de S. typhimurium de colonizar ratones y de sobrevivir dentro de los macrófagos (Baumler et al., 1994). Una cepa de Y. pseudotuberculosis con defectos en la trans-traducción, resultó ser no virulenta en un modelo de infección murino (Okan et al., 2006). Del mismo modo que para NikR, durante el desarrollo de este trabajo se publicó un estudio donde se demuestra que la proteína candidato SmpB es esencial para H. pylori. Entre los principales resultados de este trabajo se destaca que las afectaciones al gen smpB producen una disminución de la división celular y que smpB aumenta su expresión en condiciones de pH bajo, similares a las encontradas a nivel gástrico. Al igual que en NikR, esta evidencia soporta la validez de la metodología empleada en el presente trabajo. 59 Csra y SmpB, interaccionan con el sistema de transporte constituido por las proteínas ExbB2, ExbD2 y TonB, su función ya fue citada. Existe evidencia que demuestra que la estabilidad de TonB es dependiente de la presencia de proteínas del tipo ExbB y ExbD. Por ejemplo, en E. coli, cuando estas dos últimas proteínas están ausentes, la vida media de TonB disminuye como producto de su degradación (Lucchetti-Miganeh, et al., 2008). Esta observación sugiere que CsrA y SmpB, bajos condiciones de pH acidas, regulan la producción de las proteínas del tipo ExbB y ExbD y, por lo tanto, del transporte de sustratos por TonB. En resumen, este agrupamiento de proteínas se evidencia su función en las distintas redes de regulación, en la modulación de cambios conductuales a nivel celular y en la expresión de factores de virulencia necesarios para la persistencia y colonización de H. pylori en su hospedero. 9.3. Metabolismo del nitrógeno El proceso de asimilación de nitrógeno es esencial para la síntesis de biomoléculas, tales como amino ácidos, purinas, pirimidinas y amino glucósidos. Las bacterias obtienen el nitrógeno principalmente de moléculas inorgánicas donde el amoniaco es el compuesto requerido para el anabolismo del nitrógeno. GlnA y GdhA son las enzimas que participan en tal proceso. Específicamente, catalizan la condensación del glutamato y amoniaco para producir glutamina (Eisenberg et al., 1987). Existe evidencia que sugiere que mutaciones del gen glnA son letales para H. pylori (Garner et al., 1998). En B. subtilis mutaciones de gltX también resultaron letales para la bacteria (Gagnon et al., 1994). Además, existen estudios que asocian a GlnA con virulencia de varios patógenos de humanos. Este es caso de M. tuberculosis, donde GlnA ha mostrado ser esencial para sobrevivencia dentro de los macrófagos (Tullius et al., 2003) y de S. pneumoniae, que tiene función durante el proceso de adherencia e invasión (Kloosterman et al., 2006). Al igual que las proteínas raíz GlnA y GdhA, se sugiere que las proteínas candidato de este agrupamiento están involucradas con el metabolismo del glutamato. Por ejemplo, Ggt cataliza la ruptura del glutatión liberando el grupo glutamil que será utilizado por GlnA y/o GdhA en la síntesis de glutamato. HP0056 oxida a la prolina para producir directamente glutamato y AspB cataliza la conversión de aspartato a glutamato. MurI está asociada con 60 la síntesis de intermediarios de la pared celular a partir del glutamato. GltX1 y GltX2, ambas corresponden a glutamil-tARN sintetasas y están asociadas con la síntesis de proteínas. Dado que el amoniaco es la principal fuente inorgánica para la obtención de nitrógeno, existe un vínculo entre el agrupamiento de proteínas asociado a adaptación al medio ácido y con el agrupamiento de proteínas asociado con el metabolismo del nitrógeno. Como ya se mencionó, el complejo ureasa degrada la urea para producir dióxido de carbono y amoniaco. Una parte del amoniaco realiza función de tampón mientras que el restante es convertido a amonio para ser utilizado en el metabolismo del nitrógeno. Además, existe otra fuente de amoniaco para la hidrólisis de urea. Esta vía alterna está asociada con la degradación del amino ácido arginina. Las enzimas responsables de tal proceso son la arginasa (RocF) y la arginina descarboxilasa (SpeA). Esta última es una de las proteínas candidato de este agrupamiento de proteínas. Del mismo modo para el complejo ureasa, la acción de RocF está asociada con la adaptación de H. pylori al medio ácido, mientras que, SpeA se le ha asociado con el equilibrio del pH intracelular. Las figuras 6 y 7 resumen el vínculo entre los agrupamientos de proteínas citados y las proteínas RocF y SpeA. Estas últimas, tienen como función la regulación del pH y suplementan parte del amoniaco necesario para el óptimo funcionamiento de este agrupamiento de proteínas. Por último, este agrupamiento de proteínas da evidencia de la interrelación entre diferentes sistemas metabólicos, así como también de redundancia biológica que produce vías alternas para mantener los niveles celulares de glutamato y, por tanto, de la homeostasia celular que contribuye a la patogénesis de H. pylori. 9.4. Sistema de secreción tipo IV Muchas cepas de H. pylori contienen la isla de patogenecidad Cag (Cag-PAI, por sus siglas en inglés), cuyos genes codifican para la mayoría de los componentes del sistema de secreción tipo IV (Odenbreit, 2005). La presencia de tal isla ha sido asociada con la virulencia de las cepas de H. pylori (Cover y Blaser, 1999). En este agrupamiento se identificaron proteínas candidato que interaccionan con proteínas de función conocida como adhesinas. Este es el caso de las proteínas candidato 61 HopQ, HP1342, HP0922, HP0066 y HP0120. El análisis de las anotaciones disponibles en la base datos UniProt para estas proteínas candidato sugiere que su localización sub-celular está asociada con la membrana externa de H. pylori. De manera particular, el análisis de la secuencia de HP0922 revela la presencia de un grupo de dominios relacionado con la familia de cito-toxinas de la familia VacA, acceso en PFAM: PF03797, PF02691 y PF03077. El mismo análisis para la secuencia de HP0066 demuestra la presencia de dominios de la familia FtsK/SpoIIIE. En E.coli y B. subtilis, las proteínas que contienen estos dominios participan en la regulación de su ciclo celular y en la transferencia de ADN inter-cromosómico (Begg et al., 1995; Wu y Errington, 1994). La proteína HP0120 corresponde a una proteína hipotética de la cual sólo se dispone información acerca de su patrón de interacción, por lo tanto, se requiere de mayores estudios de función para sostener la predicción. Las proteínas raíz que interaccionan con las proteínas candidato citadas participan en tres procesos de la patogénesis de H. pylori. Las proteínas raíz Cag3 y CagS están asociadas con en el sistema de secreción tipo IV (T4SS), el cual es clave en la secreción e inyección de cito-toxinas. BabA y Omp1 son proteínas de la membrana externa que funcionan como adhesinas contribuyendo con el proceso de fijación al epitelio gástrico del hospedero y VacA es una potente cito-toxina. En el caso de las proteínas raíz CagA y VacA (cito-toxinas), ambas se introducen en las células del epitelio gástrico. La introducción de estas cito-toxinas produce cambios en las células gástricas, desde producción de una respuesta inflamatoria, mediada por la liberación de citoquinas, hasta inducción de apoptosis celular (Censini et al., 1996; Akopyants et al., 1998; Blomstergren et al., 2004). Así mismo, se ha documentado que aquellos pacientes que portan cepas de H. pylori con algunas de las cito-tóxinas y adhesinas citadas anteriormente presentan daño gástrico severo y son un factor de riesgo para desarrollo de cáncer y ulcera gástrica (Warburton et al., 1998; Umit et al., 2009). Estas observaciones sugieren una probable función de HP0922 como cito-toxina, HP0066 en la transferencia horizontal de genes y de HopQ, HP1342 y HP0120 como adhesinas. Así mismo, es importante considerar que las proteínas de la membrana externa son, por lo general, inmunogénicas y, por lo tanto, son un blanco en el desarrollo de vacunas y de métodos específicos de diagnóstico. 62 Las proteínas candidato HP0040, HP0439 y TrbI comparten algunos patrones de interacción con proteínas raíz asociadas a la transferencia horizontal de genes. HP0040 y HP0439 corresponden a proteínas hipotéticas que presentan dominios del tipo VirB9 y VirB8, respectivamente; ambos tipos de dominio están asociados a estructuras que participan en la conjugación bacteriana. Por ejemplo, se ha documentado que en A. tumefaciens, las proteínas que presentan dominios del tipo VirB8 interaccionan con componentes estructurales del sistema conjugación bacteriana, como son VirB9 y VirB10 (Kumar y Das, 2001). En el caso de TrbI, su homólogo en A. tumefaciens, aunque no es esencial, incrementa, de manera significativa, la eficiencia del proceso de conjugación bacteriana (Alt-Morbe et al., 1996). Por lo tanto, se sugiere una función similar de TrbI con la de su homólogo en A. tumefaciens. A manera de resumen, considerando la localización sub-celular y el análisis de la función de las proteínas raíz con las interaccionan las proteínas candidato, se sugiere que estas últimas podrían estar asociadas al proceso de conjugación bacteriana, de adhesión y del proceso de inyección de cito-toxinas que alteran la homeostasis de las células del epitelio gástrico. Además, de acuerdo a la actividad cito-toxica de algunas de estas proteínas candidato, su presencia en determinadas cepas podría estar asociada a la intensidad del daño que producen en el epitelio gástrico del hospedero, siendo un factor de riesgo para desarrollo del cáncer gástrico. 9.5. Proteínas de respuesta a estrés El estrés oxidativo es un problema experimentado por cualquier ser vivo. La reducción parcial del oxígeno molecular por la auto-oxidación de flavoproteínas genera una mezcla de radicales superóxido y de peróxido de hidrógeno (Imlay, 2003). Estos compuestos son la principal fuente para la producción de especies reactivas de oxígeno, las cuales son capaces de alterar la función de las proteínas y la estructura del ADN (Imlay y Linn, 1988; Imlay, 2003). H. pylori es una bacteria microaerofílica vulnerable a los efectos tóxicos del superóxido, por tanto, debe de contar con mecanismos de destoxificación eficaces que le permitan colonizar un medio ambiente con condiciones de estrés, tal como el epitelio gástrico. 63 Entre los resultados obtenidos para este agrupamiento destaca la presencia de las proteínas candidato SodB, GroL y Ndk. La mayoría de las proteínas raíz con las cuales interaccionan estas proteínas candidato, a excepción de SecA, presentan actividad antioxidante. SecA corresponde a una proteína asociada a translocación de macromoléculas a través de la membrana celular. Así, la interacción entre SodB y SecA es fundamental considerando que ya se ha demostrado que SodB es secretada por H. pylori. Aunque su función en la fracción extracelular no está bien documentado, se sugiere que ésta participa en el proceso de patogénesis (Backert et al., 2005). Por ejemplo, en M. tuberculosis existe evidencia de que SodB se secreta y es capaz de inhibir la muerte celular programada en las células infectadas del hospedero (Edwards et al., 2001; Hinchey et al., 2007). Por su parte, en E. coli y C. jejuni, los homólogos de GroL y Ndk han sido asociadas a proteínas de repuesta a estrés. En particular, GroL previene alteraciones del plegamiento de las proteínas y Ndk repara el ADN (Goswami et al., 2006; Klancnik et al., 2006). Además, se ha demostrado, mediante estudios de proteómica diferencial, que GroL está sobre-producida en H. pylori cuando infecta las células del epitelio gástrico (Backert et al., 2005). Una posible explicación a este comportamiento de GroL podría estar relacionado con las etapas iníciales de la infección. Cuando H. pylori infecta el epitelio gástrico se desencadena una respuesta inflamatoria de tipo inmunológico. Durante este proceso, puede liberarse al medio, una gran cantidad de especies reactivas de oxígeno (Bagchi et al., 1996; Nardone et al., 2004). Por lo tanto, H. pylori debe ser capaz de adaptarse a tales condiciones de estrés. En estudios proteómicos previos se ha documentado que GroL se secreta por H. pylori y su presencia en la fracción extracelular se ha asociado con la producción de interleucina 8 (Lin et al., 2005). Esta citoquina, además de coadyuvar con el funcionamiento del sistema inmune, se caracteriza por producir inflamación de los tejidos. Esto es fundamental considerando que uno de los procesos en el establecimiento y persistencia de H. pylori sobre el epitelio gástrico es la inducción de una respuesta inflamatoria crónica. Así, GroL sería una proteína fundamental para la persistencia de la infección por H pylori. Las proteínas candidato UvrC, NrdA y ADNE interaccionan con las proteínas raíz TrxA y TrxB; las cuales están asociadas a mantener el equilibrio oxido-reducción de la célula. Existe evidencia que demuestra que la actividad catalítica de NrdA se facilita por la acción reductora de TrxA y TrxB (Gallardo-Madueño et al., 1998). Por su parte, LpxB es 64 capaz de generar enlaces glucosídicos. Tomando en conjunto las observaciones anteriores, es posible visualizar una maquinaria completa capaz de producir componentes asociados a síntesis de ADN; sugiriendo que UvrC, NrdA y DnaE conforman un grupo de proteínas encargadas de la reparación del daño del ADN. Por otra parte resalta la presencia de una proteína candidato asociada a regulación de la traducción. Este es el caso de la proteína RpsB que interacciona con proteínas asociadas al sistema de exportación de proteínas relacionadas con el ensamblaje del flagelo. Por ejemplo, en un análisis proteómico de B. subtilis, se ha observado que junto con otras proteínas de estrés, la presencia de RpsB está aumentada (Jürgen et al., 2001). Del mismo modo, en Listeria monocytogenes y Bifidobacterium longum, se ha documentado que RpsB está aumentada bajo condiciones de estrés por alta concentración de NaCl y bilis (Duché et al., 2002; Sánchez et al., 2005). Esta última observación permite explicar la interacción de RpsB con las proteínas flagelares FliA y FliR. Durante su tránsito por el tracto gastrointestinal H. pylori debe tolerar y resistir condiciones de estrés causado por la bilis. La presencia de bilis es una condición desfavorable para la motilidad de H. pylori. En consecuencia, el sistema flagelar debería de funcionar aún en respuesta al estrés causado por la bilis. Posiblemente, RpsB facilita, bajo estas condiciones de estrés, la síntesis de las proteínas que son importantes para el ensamblaje de las estructuras básicas del flagelo. Por otra parte, aunque la interacción de RpsB con SecA (esta última proteína ya fue citada), pareciera carecer de relación funcional, en un estudio proteómico de las proteínas secretadas por H. pylori, se documentó una gran cantidad de proteínas ribosomales sin función conocida pero esto sugiere probable función en patogénesis (Backert et al., 2005). Por lo cual, SecA podría facilitar la exportación RpsB al medio extracelular. Estas observaciones sugieren que RpsB podría regular bajo condiciones de estrés la síntesis de proteínas que son útiles para el ensamblaje de estructuras celulares. Este agrupamiento demuestra que es un grupo de proteínas cuya función permite a H. pylori sobrevivir bajo una variedad de condiciones de estrés. Es por esto que H. pylori es hábil para sobrevivir bajo condiciones adversas y persistir en la mucosa gástrica. Por lo tanto, es interesante conocer cómo funcionan los mecanismos de respuesta a estrés de H. pylori, lo cual es clave en el entendimiento del mecanismo de persistencia y patogénesis de dicho patógeno. 65 9.6. Síntesis de lipopolisacáridos La presencia de lipopolisacárido (LPS) es una de las principales características distintivas de las bacterias Gram (-) y la serología de estas moléculas ha sido un procedimiento de rutina para la diferenciación dentro de una especie bacteriana. El LPS es una molécula abundante en superficie celular y funciona como barrera de protección contra agentes externos. Una molécula de LPS está constituida por tres elementos básicos: el lípido A el cual esta embebido en la cara externa, de la membrana externa de la bacteria; el núcleo de oligosacárido, que funciona como una región de enlace entre las dos caras de la membrana externa y finalmente el antígeno O que es un determinante serotipo-específico, presente como una unidad polimérica extendiéndose lejos de la superficie celular. Todas las proteínas raíz y candidato de este agrupamiento presentan funciones relacionadas con la síntesis de los componentes básicos del LPS, antes citados. Por ejemplo, en V. cholera, RfbA, RfbD y RfbE, son proteínas homólogas en H. pylori de HP0043, RfbD y de la proteína candidato SpsC, respectivamente. RfbA, RfbD y RfbE participan en la síntesis de perosamina, un componente básico del lipopolisacárido que constituye al antígeno O y en la síntesis de la matriz de lipopolisacárido que produce una colonia de bacterias con morfología rugosa específica (Stroeher et al., 1995; Rashid et al., 2003). La proteína raíz NolK también está asociada con la síntesis del antígeno O en E. coli (Wang et al., 2006). Mientras que en el complejo Mycobacterium avium se ha documentado que las proteínas homólogos de RfbD y de la proteína candidato HP0102 están involucrados en la síntesis de lipopolisacáridos de superficie (Miyamoto et al., 2007). Para el caso de la interacción entre WbpB y la proteína candidato SpsC, existe evidencia de que en P. aeruginosa y B. pertussis, sus proteínas homólogos, participan en la síntesis de un raro trisacárido que se incorpora al antígeno O, confiriéndole a estos patógenos resistencia a la acción lítica del complemento y, por consecuencia, facilita el proceso de colonización del hospedero (Harvill et al., 2000; Westman et al., 2008). Las proteínas candidato KdtA y HP0277 comparten patrones de interacción; ambas interaccionan con las proteínas raíz RfaC y CoaD. Ademas, Kdta interacciona con la proteínas raíz LpxB. La interacción de KdtA con las proteínas raíz antes citadas, podría soportarse considerando que en E. coli, K. pneumoniae y S. enterica se ha demostrado que KdtA, RfaC y CoaD, en conjunto, participan en la síntesis de un oligosacárido que forma 66 parte del núcleo del lipopolisacárido, estructura asociada al anclaje del lipopolisacárido con la membrana celular (Heinrichs et al., 1998; Izquierdo et al., 2002). LpxB corresponde a una enzima asociada a síntesis del lípido A. La interacción entre KdtA y LpxB es clave considerando que el núcleo de oligosacárido, ya citado, está unido al lípido A que permite el anclaje de la molécula de lipopolisacárido a la membrana celular (Whitfield et al., 1997). Por su parte, la proteína candidato HP0277 corresponde a una ferredoxina; este tipo de proteínas están asociadas con la respuesta al estrés oxidativo. La interacción de HP0277 con las proteínas raíz antes citadas podría explicarse, considerando que diversos estudios sugieren que bajo estrés oxidativo, los diferentes constituyentes estructurales lipídicos pueden tener serias alteraciones comprometiendo la integridad de la célula bacteria. Este puede ser caso de los fosfolípidos de la membrana celular que pueden ser oxidados por radicales libres, llevando a una desestabilización de la bicapa lipídica y, por consiguiente, de una disfunción de la membrana celular (Hazell y Graham, 1990; Khulusi et al., 1995; Sun et al., 2003). Considerando lo anterior, podría proponerse que HP0277 contribuye para evitar la degradación de los diferentes productos lipídicos sintetizados por RfaC y CoaD, manteniendo así la integridad celular. Otras proteínas candidato que podrían desempeñar una función similar a la propuesta para KdtA son GmhA, HldE, RfaD, GalU y AlgC. La evidencia que podría sostener la predicción de las interacciones para las proteínas candidato antes mencionadas parte de estudios que demuestran que en E. coli, N. meningitidis y S. typhimurium, las proteínas homólogos de GmhA, HldE, RfaD, HP0043 y RfaC están asociadas a la síntesis del núcleo del lipopolisacárido (Sirisena et al., 1992; Shih et al., 2001; Kneidinger et al., 2002). Del mismo modo, en A. ferrooxidans se ha asociado a los homólogos de GalU y GalE con la producción de exolipolisacáridado involucrado en la formación de biopelículas (Barreto et al., 2005). Por su parte, AlgC está implicada en la síntesis del núcleo del lipopolisacárido en P. aeruginosa (Kooistra et al., 2003). Las proteínas candidato FlaA1 y HP1570 interaccionan con las proteínas raíz NeuA y SpsC. Se ha documentado en C. jejuni que PseF y PseC, proteínas homólogas en H. pylori de NeuA y SpsC, respectivamente, participan en la glicosilación de las flagelinas del filamento flagelar y que las mutantes carentes de los genes asociados a glicosilación de las flagelinas presentan fenotipos no motiles (Guerry et al., 2006; McNally et al., 2006). 67 Estudios realizados en A. hydrophila y C. jejuni sugieren que las proteínas homólogos de FlaA1, NeuA y SpsE participan activamente en la glicosilación de proteínas flagelares (Guerry et al., 2006; Canals et al., 2007). En C. jejuni, se ha observado que tal glicosilación está asociada a un fenómeno llamado auto-aglutinación a su vez asociado a la formación de biopelículas en las células del epitelio intestinal (Guerry, 2007). Así mismo, en C. jejuni se ha demostrado, a nivel experimental, que existe una interacción física entre las proteínas ortólogos de HP1570 y NeuA (Parrish et al., 2007). Por tanto, se sugiere que las proteínas candidato FlaA1 y HP1570 podrían estar asociadas a glicosilación de proteínas flagelares. Por último, este agrupamiento de proteínas remarca la importancia de las proteínas involucradas en síntesis del antígeno O y de los lipopolisacáridos de superficie en H. pylori cuya función está asociada a una respuesta inflamatoria del epitelio gástrico y con la evasión del sistema inmune. Además, se estable un vínculo entre este agrupamiento de proteínas y el que corresponde al ensamblaje del flagelo mediante glicosilación de las flagelinas, proteínas clave para la actividad hidrodinámica del flagelo. 9.7. Interconexión entre agrupamientos de proteínas La red de interacción entre proteínas del presente estudio, demuestra varios agrupamientos entre proteínas, cada uno representando un sistema asociado a proceso especifico durante el proceso de patogénesis de H. pylori. No obstante esta especificidad, la interconexión entre dichos agrupamientos no ha sido estudiada. En este estudio se demuestra la interconexión entre el sistema que conforman las proteínas flagelares y el sistema de síntesis de polisacáridos (Figura 6). Esta relación está dada por la modificación postraduccional de las flagelinas (glicosilación) lo que les permite ensamblar metaestructuras (ver discusión para este agrupamiento). Del mismo modo, se determinó una interconexión entre el sistema de adaptación al medio ácido y el metabolismo del nitrógeno (Figura 6). Estos dos sistemas forman un bucle que se auto-regula. Por ejemplo, la urea es producto final del metabolismo de la arginina y otros amino ácidos. Posteriormente, la urea puede ser desdoblada por la enzima ureasa produciendo CO2 y amoniaco para funcionar como tampón. Ambos sistemas están asociados a la liberación y asimilación del amoniaco, por lo tanto contribuyen a la manutención del balance del nitrógeno en H. pylori. Estas interconexiones de los sistemas dan evidencia de la redundancia inherente a los sistemas 68 biológicos permitiendo vías o caminos alternos para un mismo proceso biológico; manteniendo la homeostasia celular. 9.8. Limitaciones del estudio La red de interacción de proteínas del presente estudio tiene limitaciones. Se combinaron datos de interacción entre proteínas a nivel experimental y predicciones a nivel computacional. Esta combinación de métodos proporciona una mayor cobertura pero también se deben considerar sus posibles fallas. Por ejemplo, en el caso de los ensayos de doble híbrido en levadura no son 100% verificables, ya que un alto número de interacciones putativas no pueden ser confirmadas por otros métodos (falsos positivos). Además, se ha observado que interacciones entre proteínas confirmadas por varios métodos difícilmente podrían ocurrir en la naturaleza puesto que las proteínas que participan en dicha interacción están confinadas a espacios u organelos celulares diferentes. Este último tipo de interacciones se denominan falsos positivos biológicos (Cusick et al., 2005). Por otro lado, los falsos negativos pueden presentarse por varias causas, entre las que destaca la alteración del plegamiento de la proteína producto de la fusión y por diferentes mecanismos de modificación postraduccional en la levadura, etc. La purificación por afinidad en tándem es otro método utilizado para caracterizar interactomas. Sin embargo, al igual que el sistema de doble híbrido en levaduras las limitaciones son una pobre cobertura del proteoma del organismo en estudio (Cusick et al., 2005). Por ejemplo, los interactomas caracterizados de S. cerevisiae (Uetz et al., 2000; Ito et al., 2001), C. elegans (Li et al., 2004) y H. pylori (Rain et al., 2001) presentan una cobertura del proteoma de cerca del 15%, 5% y 47%, respectivamente. Esto sin considerar los probables falsos positivos y negativos. Por tal motivo, para varios organismos modelo se han caracterizado varios mapas de interacción entre proteínas para validar tales interacciones. Por su parte, los métodos in silico también tienen limitaciones ya que la gran mayoría de los aquí utilizados se basan en la identificación de señales evolutivas. Sin embargo podrían existir proteínas que carecen, o que no se pueden detectar dichas señales. Así mismo, la mayoría de los métodos computacionales, basados en el contexto genómico, no distinguen entre una interacción física o funcional. Otra limitación es que el alto nivel de 69 confiabilidad aplicado durante el filtrado de las interacciones entre proteínas, obtenidas por STRING, es muy astringente. Esto es, STRING considera que una interacción entre proteínas es confiable si existen varias fuentes de información o métodos que la soporten. Por lo cual, las interacciones de proteínas verdaderas poco documentadas o soportadas por varios métodos (experimental o computacional) son ignoradas. Por lo tanto, la red de interacción entre proteínas aquí propuesta muy probablemente no representa el total de las proteínas asociadas a patogénesis de H. pylori. En consecuencia, las predicciones deben de ser validadas a nivel experimental. 70 10. Conclusiones En el presente trabajo se construyó una red de interacción entre proteínas a partir de una base de datos de proteínas con función conocida asociada a patogénesis de H. pylori. Esto permitió, identificar y priorizar un conjunto de nuevas interacciones y proteínas asociadas a patogénesis de H. pylori. El análisis a nivel de sistemas resultó en nuevas funciones para algunas proteínas ya caracterizadas. Este es el caso de CheA, NikR y SodB. CheA está asociada a exportación de proteínas flagelares para el ensamblaje del flagelo y participa durante las primeras etapas del desarrollo de las biopelículas. NikR es una proteína reguladora maestra de un conjunto de genes clave asociadas a adaptación al medio acido. SodB, además de presentar actividad antioxidante, se secreta para inhibir la muerte celular programada de las células del hospedero. El análisis de la red de interacción entre proteínas del presente predecir nuevas proteínas con probable asociación a patogénesis y nuevas hipótesis susceptibles de ser validadas a nivel experimental. Entre las nuevas proteínas se identificó a un grupo de proteínas candidato asociadas a regulación del proceso de traducción en la síntesis de proteínas. Estas proteínas están presentes en todos los agrupamientos de proteínas, con la excepción del sistema de proteínas de secreción tipo IV y el de la síntesis de lipopolisacáridos. Estas proteínas aparecen justo en aquellos agrupamientos de proteínas que son esenciales en las primeras etapas de la infección, sugiriendo que son necesarias para un control de calidad de la síntesis de proteínas durante el proceso de patogénesis de H. pylori. Por último, el análisis de la red de interacción entre proteínas da evidencia de las estrategias evolutivas del patógeno para desarrollo y persistencia del proceso infeccioso. Así mismo, demuestra que varios de los procesos biológicos asociados a patogénesis de H. pylori no son independientes. Por el contrario, están interconectados generando un sistema redundante capaz de modificarse para responder a diferentes estímulos del medio ambiente. 71 11. Recomendaciones Una vez concluido el presente estudio, se considera interesante investigar sobre otros aspectos relacionados con las interacciones entre proteínas de H. pylori y, por lo tanto, se recomienda: • Extender los análisis expuestos en esta tesis al estudio de otros procesos biológicos de H. pylori. • Mejorar el método de predicción basado en el contexto funcional mediante la inclusión de otros tipos de información experimental, por ejemplo información estructural de regiones interfaciales derivadas de complejos proteicos depositados en la base de datos PDB. • Evaluar si existen diferencias a nivel de interacción entre proteínas de las seis cepas de H. pylori de las que se dispone su genoma completo. • Finalmente, seleccionar algunas de las proteínas candidato propuestas y realizar su validación experimental. 72 12. Referencias • Abraham, L.O.; Li, Y.; Zamble, D.B. (2006). The metal- and DNA-binding activities of Helicobacter pylori NikR. J Inorg Biochem. 100(5-6):1005-14. • Akopyants, N.S.; Clifton, S.W.; Kersulyte, D.; Crabtree, J.E.; Youree, B.E.; Reece, C.A.; Bukanov, N.O.; Drazek, E.S.; Roe, B.A.; Berg, D.E. (1998). Analyses of the cag pathogenicity island of Helicobacter pylori. Mol Microbiol. 28(1):37-53. • Allan, E.; Clayton,C.L.; McLaren, A.; Wallace D.M.; Wren, B.W. (2001). Characterization of the low pH responses of Helicobacter pylori using genomic ADN arrays. Microbiology, 147:2285-2292. • Alm, R.A.; Ling, L.S.; Moir, D.T.; King, B.L.; Brown, E.D.; Doig, P.C.; Smith, D.R.; Noonan, B.; Guild, B.C.; deJonge, B.L.; Carmel, G.; Tummino, P.J.; Caruso, A.; Uria-Nickelsen, M.; Mills, D.M.; Ives, C.; Gibson, R.; Merberg, D.; Mills, S.D.; Jiang, Q.; Taylor, D.E.; Vovis, G.F.; Trust, T.J. (1999). Genomic-sequence comparison of two unrelated isolates of the human gastric pathogen Helicobacter pylori. Nature, 14;397(6715):176-80. • Aloy, P.; Russell, R.B. (2002). Interrogating protein interaction networks through structural biology. Proc Natl Acad Sci USA., 99: 5896-901. • Aloy, P.; Russell, R.B. (2003). InterPreTS: protein interaction prediction through tertiary structure. Bioinformatics, 19:161-2. • Aloy, P.; Russell, R.B. (2006). Structural systems biology: modelling protein interactions. Nat Rev Mol Cell Biol. 7(3):188-97. • Aloy, P. (2007). Shaping the future of interactome networks. Genome Biol. 8(10):316. 73 • Alt-Morbe, J.; Stryker, J.L.; Fuqua, C.; Li, P.L.; Farrand, S.K.; Winans, S.C. (1996). The conjugal transfer system of Agrobacterium tumefaciens octopine-type Ti plasmids is closely related to the transfer system of an IncP plasmid and distantly related to Ti plasmid vir genes. J Bacteriol 178:4248-4257. • Altschul, S.F.; Gish, W.; Miller, W.; Myers, E.W.; Lipman, D.J. (1990). Basic local alignment search tool. J Mol Biol., 215:403-10. • Ang, S.; Lee, C.; Peck, K.; Sindici, M.; Matrubutham, U.; Gleeson, M.A.; Wang, J.T. (2001). Acid-induces gene expression in Helicobacter pylori: study in genomic scale by microarray. Infect. Immun., 69:1679-1686. • Apweiler, R.; Attwood, T.K.; Bairoch, A.; Bateman, A.; Birney, E.; Biswas, M.; Bucher, P.; Cerutti, L.; Corpet, F.; Croning, M.D.; Durbin, R.; Falquet, L.; Fleischmann, W.; Gouzy, J.; Hermjakob, H.; Hulo, N.; Jonassen, I.; Kahn, D.; Kanapin, A.; Karavidopoulou, Y.; Lopez, R.; Marx, B.; Mulder, N.J.; Oinn, T.M.; Pagni, M.; Servant, F.; Sigrist, C.J.; Zdobnov, E.M. (2001). The InterPro database, an integrated documentation resource for protein families, domains and functional sites. Nucleic Acids Res., 29:37-40. • Ashburner, M., et al. (2000). Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nat. Genet., 25, 25–29. • Aragues, R.; Jaeggi, D.; Oliva, B. (2006). PIANA: protein interactions and network analysis. Bioinformatics. 15;22(8):1015-7. • Aragues, R.; Sander, C.; Oliva, B. (2008). BMC Bioinformatics. 27;9:172. 74 • Bagchi, D.; Bhattacharya, G.; Stohs, S.J. (1996). Production of reactive oxygen species by gastric cells in association with Helicobacter pylori. Free Radic Res. 24(6):439-50. • Backert, S.; Moese, S.; Selbach, M.; Brinkmann, V.; Meyer, T.F. (2001). Phosphorylation of tyrosine 972 of the Helicobacter pylori CagA protein is essential for induction of a scattering phenotype in gastric epithelial cells. Mol Microbiol., 42(3):631-44. • Backert, S.; Kwok, T.; Schmid, M.; Selbach, M.; Moese, S.; Peek, R.M. Jr.; König, W.; Meyer, T.F.; Jungblut, P.R. (2005). Subproteomes of soluble and structurebound Helicobacter pylori proteins analyzed by two-dimensional gel electrophoresis and mass spectrometry. Proteomics, 5(5):1331-45. • Bader, G.D.; Betel, D.; Hogue, C.W.V. (2003). BIND: the biomolecular interaction network database. Nucleic Acids Res., 31:248-50. • Bader, G.D.; Hogue, C.W. (2003). An automated method for finding molecular complexes in large protein interaction networks. BMC Bioinformatics. 13;4:2. • Barabási, A.L.; Oltvai, Z.N. (2004). Network biology: understanding the cell's functional organization. Nat Rev Genet. 5(2):101-13. • Bäumler, A.J.; Kusters, G.J.; Stojiljkovic, I.; Heffron, F. (1994). Salmonella typhimurium loci involved in survival within macrophages. Infect Immun. 62:1623– 1630. • Bauerschmitt, H.; Funes, S.; Herrmann, J.M. (2008). The membrane-bound GTPase Guf1 promotes mitochondrial protein synthesis under suboptimal conditions. J Biol Chem. 283(25):17139-46. 75 • Beard, W.A. Wilson, S.H. (2001). DNA lesion bypass polymerases open up. Structure. 9(9):759-64. • Begg, K.J.; Dewar, S.J.; Donachie, W.D. (1995). A new Escherichia coli cell division gene, ftsK. J Bacteriol 177:6211-6222. • Benson, T.E.; Walsh, C.T.; Hogle, J.M. (1996). The structure of the substrate-free form of MurB, an essential enzyme for the synthesis of bacterial cell walls. Structure 4:47-54. • Berman, H.M.; Battistuz, T.; Bhat, T.N.; Bluhm, W.F.; Bourne, P.E.; Burkhardt, K.; FENA, Z.; Gilliland, G.L.; Iype, L.; Jain, S.; Fagan, P.; Marvin, J.; Padilla, D.; Ravichandran, V.; Schneider, B.; Thanki, N.; Weissig, H.; Westbrook, J.D.; Zardecki, C. (2002). The Protein Data Bank. Acta Crystallogr D Biol Crystallogr., 58, 899. • Blaser, J.M. (1991). Helicobacter pylori. Princ and Pract Inf Dis. Update 9: 3-9. • Boneca, I.G.; de Reuse, H.; Epinat, J.C.; Pupin, M.; Labigne, A.; Moszer, I. (2003). A revised annotation and comparative analysis of Helicobacter pylori genomes. Nucleic Acids Res. 31(6):1704-14. • Blomstergren, A.; Lundin, A.; Nilsson, C.; Engstrand, L.; Lundeberg, J. (2004). Comparative analysis of the complete cag pathogenicity island sequence in four Helicobacter pylori isolates. Gene. 328:85-93. • Cave, D.R. (1997). Epidemiology and Transmission of Helicobacter pylori Infection. How Is Helicobacter pylori Transmitted?. Gastroenterology, 113: S9S14. 76 • Carron, M.A.; Tran, V.R.; Sugawa, C.; Coticchia, J.M. (2006). Identification of Helicobacter pylori biofilms in human gastric mucosa. J Gastrointest Surg 10, 712– 717. • Censini, S.; Lange, C.; Xiang, Z.; Cabtree, J.E.; Giara, P.; Borodovsky, M.; Rappuoli, R.; Covacci, A. (1996). cag, a Pathogenicity Island of Helicobacter pylori, Encodes Type I-Specific and Disease-Associated Virulence Factors. Proc Natl Acad Sci USA., 93: 14648-14653. • Cellini, L.; Grande, R.; Di Campli, E.; Di Bartolomeo, S.; Di Giulio, M.; Traini, T.; Trubiani, O. (2008). Characterization of a Helicobacter pylori environmental strain. J Appl Microbiol. 105(3):761-9. • Cerca, N.; Jefferson, K.K. (2008). Effect of growth conditions on poly-Nacetylglucosamine expression and biofilm formation in Escherichia coli. FEMS Microbiol Lett. 283(1):36-41. • Chakrabarti, P.; Janin, J. (2002). Dissecting protein-protein recognition sites. Proteins, 47: 334-43. • Chothia, C.; Janin, J. (1975). Principles of protein-protein recognition. Nature, 256:705-8. • Claverie, J.M. (2001). Gene number: What if there are only 30,000 human genes? Science, 291:1255-7. • Cooper, M.A. (2003). Label-free screening of bio-molecular interactions. Anal Bioanal Chem, 377: 834-842. • Correa, P.; Piazuelo, M.B. (2008). Natural history of Helicobacter pylori infection. Dig Liver Dis., 2008, 4. 77 • Covacci, A.; Censini, S.; Bugnoli, M. (1993). Molecular Characterization of the 128-kDa Immunodominant Antigen of Helicobacter pylori Associated with Citotoxicity and Duodenal Ulcer. Proc Natl Acad Sci USA., 90: 5791-5795. • Cover, T.; Glupczynski, Y.; Lage, A.; Burette, A.; Tummuru, Mr.; Perez-Perez, G.; Blaser, M. (1995). Serologic Detection of Infection with cagA + Helicobacter pylori Strains. J Clin Microbiol. 33:1496-1500. • Cover, T.L.; Blaser, J.M. (1999). Helicobacter pylori factors associated with disease. Gastroenterology. 117(1):257-61. • Crennell, S.J.; Garman, E.F.; Laver, W.; Vimr, E.; Taylor, G.L. (1993). Crystal structure of a bacterial sialidase (from Salmonella typhimurium LT2) shows the same fold as an influenza virus neuraminidase. Proc Natl Acad Sci USA, 90:9852-6. • Cussac, V.; Ferrero, R.L.; Labigne, A. (1992). Expression of Helicobacter pylori urease genes in Escherichia coli grown under nitrogen-limiting conditions. J. Bacteriol., 174, 2466-2473. • Cusick, M.E.; Klitgord, N.; Vidal, M.; Hill, D.E. (2005). Interactome: gateway into systems biology. Hum Mol Genet. 14 Spec No. 2:R171-81. • Dandekar, T.; Snel, B.; Huynen, M.; Bork, P. (1998). Conservation of gene order: a fingerprint of proteins that physically interact. Trends Biochem Sci., 23:324-8. • Dasgupta. N.; Arora, S.K.; Ramphal, R. (2000). fleN, a gene that regulates flagellar number in Pseudomonas aeruginosa. J Bacteriol. 182(2):357-64. 78 • Dasgupta, N.; Wolfgang, M.C.; Goodman, A.L.; Arora, S.K.; Jyot, J.; Lory, S.; Ramphal, R. (2003). A four-tiered transcriptional regulatory circuit controls flagellar biogenesis in Pseudomonas aeruginosa. Mol Microbiol. 50(3):809-24. • Dong, Z.; Onrust, R.; Skangalis, M.; O'Donnell, M. (1993). ADN polymerase III accessory proteins. I. holA and holB encoding delta and delta9. J. Biol. Chem., 268, 11758-11765. • Dosanjh, N.S.; Hammerbacher, N.A.; Michel, S.L. (2007). Characterization of the Helicobacter pylori NikR-P(ureA) DNA interaction: metal ion requirements and sequence specificity. Biochemistry. 46(9):2520-9. • Duché O, Trémoulet F, Namane A, Labadie J; European Listeria Genome Consortium. (2002). A proteomic analysis of the salt stress response of Listeria monocytogenes. FEMS Microbiol Lett. 215(2):183-8. • Dulebohn, D.; Choy, J.; Sundermeier, T.; Okan, N.; Karzai, A.W. (2007). Transtranslation: the tmRNA-mediated surveillance mechanism for ribosome rescue, directed protein degradation, and nonstop mRNA decay. Biochemistry.46:4681– 4693. • Edwards, K.J.; Metherell, L.A.; Yates, M.; Saunders, N.A. (2001). Detection of rpoB mutations in Mycobacterium tuberculosis by biprobe analysis. J Clin Microbiol. 39(9):3350-2. • Edwards, A.M.; Kus, B.; Jansen, R.; Greenbaum, D.; Greenblatt, J.; Gerstein, M. (2002). Bridging structural biology and genomics: assessing protein interaction data with known complexes. Trends Genet., 18:529-36. • Eisenberg, D.; Almassy, R.J.; Janson, C.A.; Chapman, M.S.; Suh, S.W.; Cascio, D.; Smith, W.W. (1987). Some evolutionary relationships of the primary biological 79 catalysts glutamine synthetase and RuBisCO. Cold Spring Harb Symp Quant Biol. 52:483-90. • Eisenberg, D.; Marcotte, E.M.; Xenarios, I.; Yeates, T.O. (2000). Protein function in the postgenomic era. Nature., 405:823-6. • Enright, A.; Iliopoulos, I.; Kyrpides, N.; Ouzounis, C. (1999). Protein interaction maps for complete genomes based on gene fusion events. Nature, 402:86-90. • Evans, D.; Queiroz, D.; Mendes, E.; Evans Jr, D. (1998). Helicobacter pylori CagA status and s and m alleles of VacA in isolates from individuals with a variety of H. pylori associated gastric diseases. J Clin Microbiol., 36: 3435-3437. • Everhart, J.E.; Kruszon-Moran, D.; Perez-Perez, G.I.; Tralka, T.S.; McQuillan, G. (2000). Seroprevalence and ethnic differences in Helicobacter pylori infection among adults in the Unites States. J Infect Dis., 181: 1359-1363. • Fields, S.; Song, O. (1989). A novel genetic system to detect protein-protein interactions. Nature, 340(6230):245-246. • Fields, J.A.; Thompson, S.A. (2008). Campylobacter jejuni CsrA mediates oxidative stress responses, biofilm formation, and host cell invasion. J Bacteriol. 190(9):3411-6. • Gallardo-Madueño, R.; Leal, J.F.; Dorado, G.; Holmgren, A.; López-Barea, J.; Pueyo, C. (1998). In vivo transcription of nrdAB operon and of grxA and fpg genes is triggered in Escherichia coli lacking both thioredoxin and glutaredoxin 1 or thioredoxin and glutathione, respectively. J Biol Chem. 273(29):18382-8. • Gallet, X.; Charloteaux, B.; Thomas, A.; Brasseur, R. (2000). A fast method to predict protein interaction sites from sequences. J Mol Biol., 302:917-26. 80 • Gagnon, Y.; Breton, R.; Putzer, H.; Pelchat, M.; Grunberg-Manago, M.; Lapointe, J. (1994). Clustering and co-transcription of the Bacillus subtilis genes encoding the aminoacyl-tRNA synthetases specific for glutamate and for cysteine and the first enzyme for cysteine biosynthesis. J Biol Chem. 269(10):7473-82. • Garner, R.M.; Fulkerson, J. Jr.; Mobley, H.L. (1998). Helicobacter pylori glutamine synthetase lacks features associated with transcriptional and posttranslational regulation. Infect Immun. 66(5):1839-47. • Gavin, A.C.; Bösche, M.; Krause, R.; Grandi, P.; Marzioch, M.; Bauer, A.; Schultz, J.; Rick, J.M.; Michon, A.M.; Cruciat, C.M.; Remor, M.; Höfert, C.; Schelder, M.; Brajenovic, M.; Ruffner, H.; Merino, A.; Klein, K.; Hudak, M.; Dickson, D.; Rudi, T.; Gnau, V.; Bauch, A.; Bastuck, S.; Huhse, B.; Leutwein, C.; Heurtier, M.A.; Copley, R.R.; Edelmann, A.; Querfurth, E.; Rybin, V.; Drewes, G.; Raida, M.; Bouwmeester, T.; Bork, P.; Seraphin, B.; Kuster, B.; Neubauer, G.; Superti-Furga, G. (2002). Functional organization of the yeast proteome by systematic analysis of protein complexes. Nature, 415(6868):141-147. • Gerstein, M.; Lan, N.; Jansen, R. (2002). Integrating interactomes. Science, 295:284-7. • Goffard, N.; Garcia, V.; Iragne, F.; Groppi, A.; de Daruvar, A. (2003). IPPRED: server for proteins interactions inference. Bioinformatics, 19:903-4. • Goodwin, C.S.; Armstrong, J.A.; Chilvers, T.; Peters, M.; Collins, M.D.; Sly, L.; McConnell, W.; Harper, W.E.S. (1989). Transfer of Campylobacter pyloridis and Campylobacter mustelae to Helicobacter gen. nov. as Helicobacter pylori comb. nov. and Helicobacter mustelae comb. nov., respectively. Int J Syst Bacteriol. 39: 397-405. 81 • Goswami M, Mangoli SH, Jawali N. (2006). Involvement of reactive oxygen species in the action of ciprofloxacin against Escherichia coli. Antimicrob Agents Chemother. 50(3):949-54. • Guerry, P.; Ewing, C.P.; Schirm, M.; Lorenzo, M.; Kelly, J.; Pattarini, D.; Majam, G.; Thibault, P.; Logan S. (2006). Changes in flagellin glycosylation affect Campylobacter autoagglutination and virulence. Mol Microbiol. 60(2):299-311. • Guerry, P. (2007). Campylobacter flagella: not just for motility. Trends Microbiol. 15(10):456-61. • Graham, D.Y.; Opekun, A.R.; Yamaoka, Y.; Osato, M.S.; el-Zimaity, H.M. (2003). Early events in protom pump inhibitor associated exacerbation of corpus gastritis. Aliment Phamacol Ther, 17: 193-200. • Grigoriev, A. (2001) A relationship between gene expression and protein interaction on the proteome scale: analysis of the bacteriophage t7 and the yeast Saccharomyces cerevisiae. Nucleic Acids Res., 29,3513-3519. • Guarner, J.; Mohar, A.; Parsonnet, J.; Halperin, D. (1993). The association of Helicobacter pylori with gastric cancer and preneoplastic gastric lesions in Chiapas Mexico. Cancer, 71: 297-301. • Harvill, E.T.; Preston, A.; Cotter, P.A.; Allen, A.G.; Maskell, D.J.; Miller, J.F. (2000). Multiple roles for Bordetella lipopolysaccharide molecules during respiratory tract infection. Infect Immun. 68(12):6720-8. • Hazell, S.L.; Graham, D.Y. (1990). Unsaturated fatty acids and viability of Helicobacter (Campylobacter) pylori. J Clin Microbiol. 28(5):1060-1. 82 • Headd, J.J.; Ban, Y.E.; Brown, P.; Edelsbrunner, H.; Vaidya, M.; Rudolph, J. (2007). Protein-protein interfaces: properties, preferences, and projections. J Proteome Res., 6(7):2576-86. • Hinchey, J.; Lee, S.; Jeon, B.Y.; Basaraba, R.J.; Venkataswamy, M.M.; Chen, B.; Chan, J.; Braunstein, M.; Orme, I.M.; Derrick, S.C.; Morris, S.L.; Jacobs, W.R. Jr.; Porcelli, S.A. (2007). Enhanced priming of adaptive immunity by a proapoptotic mutant of Mycobacterium tuberculosis. J Clin Invest. 117(8):2279-88. • Hirata, Y.; Maeda, S.; Mitsuno, Y.; Akanuma, M.; Yamaji, Y.; Ogura, K.; Yoshida, H.; Shiratori, Y.; Omata, M. (2001). Helicobacter pylori activates the cyclin D1 gene through mitogen-activated protein kinase pathway in gastric cancer cells. Infect. Immun, 69:3965-3971. • Heinrichs, D.E.; Yethon, J.A.; Amor, P.A.; Whitfield, C. (1998). The assembly system for the outer core portion of R1- and R4-type lipopolysaccharides of Escherichia coli. The R1 core-specific beta-glucosyltransferase provides a novel attachment site for O-polysaccharides. J Biol Chem. 273(45):29497-505. • Heroven, A.K.; Böhme, K.; Rohde, M.; Dersch, P. (2008). A Csr-type regulatory system, including small non-coding RNAs, regulates the global virulence regulator RovA of Yersinia pseudotuberculosis through RovM. Mol Microbiol. 68(5):117995. • Ho, Y.; Gruhler, A.; Heilbut, A.; Bader, G.D.; Moore, L.; Adams, S.L.; Millar, A.; Taylor, P.; Bennett, K.; Boutilier, K. (2002). Systematic identification of protein complexes in Saccharomyces cerevisiae by mass spectrometry. Nature, 415(6868):180-183. • Hoffmann, R.; Valencia, A. (2003). Life cycles of successful genes. Trends Genet. 19(2):79-81. 83 • Huynen, M.; Snel, B.; Lathe, W.; Bork, P. (2000). Predicting protein function by genomic context: quantitative evaluation and qualitative. Genome Res ,10:1204-10. • Imlay, J.A.; Linn, S. (1988). DNA damage and oxygen radical toxicity. Science. 240(4857):1302-9. • Imlay, J.A. (2003). Pathways of oxidative damage. Annu Rev Microbiol. 57:395418. • Ito, T.; Tashiro, K.; Muta, S.; Ozawa, R.; Chiba, T.; Nishizawa, M.; Yamamoto, K.; Kuhara, S.; Sakaki, Y. (2000). Toward a protein-protein interaction map of the budding yeast: A comprehensive system to examine two-hybrid interactions in all possible combinations between the yeast proteins. Proc Natl Acad Sci USA, 97(3):1143-1147. • Izquierdo, L.; Merino, S.; Regué, M.; Rodriguez, F.; Tomás, J.M. (2002). Synthesis of a Klebsiella pneumoniae O-antigen heteropolysaccharide (O12) requires an ABC 2 transporter. J Bacteriol. 185(5):1634-41. • Janin, J.; Chothia, C. The structure of protein-protein recognition sites. (1990). J Biol Chem., 265:16027-30. • Jansen, R.; Greenbaum, D.; Gerstein, M. (2002). Relating whole-genome expression data with protein-protein interactions. Genome Res., 12:37-46. • Jensen, L.J.; Kuhn, M.; Stark, M.; Chaffron, S.; Creevey, C.; Muller, J.; Doerks, T.; Julien, P.; Roth, A.; Simonovic, M.; Bork, P. von Mering, C. (2009). Nucleic Acids Res. 37(Database issue):D412-6. 84 • Jones, S.; Thornton, J.M. (1997). Prediction of protein-protein interaction sites using surface patches. J Mol Biol., 272:133-43. • Jungblut, P.R.; Bumann, D.; Haas, G.; Zimny-Arndt, U.; Holland, P.; Lamer, S.; Siejak, F.; Aebischer, A.; Meyer, T.F. (2000). Comparative proteome analysis of Helicobacter pylori. Mol. Microbiol., 36:710-725. • Jürgen B, Hanschke R, Sarvas M, Hecker M, Schweder T. (2001). Proteome and transcriptome based analysis of Bacillus subtilis cells overproducing an insoluble heterologous protein. Appl Microbiol Biotechnol. 55(3):326-32. • Kalmokoff, M.; Lanthier, P.; Tremblay, T.L.; Foss, M.; Lau, P.C.; Sanders, G.; Austin, J.; Kelly, J.; Szymanski, C.M. (2006). Proteomic analysis of Campylobacter jejuni 11168 biofilms reveals a role for the motility complex in biofilm formation. J. Bacteriol. 188: 4312-4320. • Karlsson, R. (2004). SPR for molecular interaction analysis: A review of emerging application areas. J Mol Recognit., 17: 151-161. • Keiler, K.C.; Waller, P.R.; Sauer, R.T. (1996). Role of a peptide tagging system in degradation of proteins synthesized from damaged messenger RNA. Science 271: 990–993. • Keiler, K.C. (2008). Biology of trans-Translation. Ann Rev Microbiol. 62:133–151. • Kerrien, S.; Alam-Faruque, Y.; Aranda, B.; Bancarz, I.; Bridge, A.; Derow, C.; Dimmer, E.; Feuermann, M.; Friedrichsen, A.; Huntley, R.; Kohler, C.; Khadake, J.; Leroy, C.; Liban, A.; Lieftink, C.; Montecchi-Palazzi, L.; Orchard, S.; Risse, J.; Robbe, K.; Roechert, B.; Thorneycroft, D.; Zhang, Y.; Apweiler, R.; Hermjakob, H. (2007). IntAct-open source resource for molecular interaction data. Nucleic Acids Res., 35, 561-5. 85 • Kerrinnes, T.; Zelas, Z.B.; Streckel, W.; Faber, F.; Tietze, E.; Tschäpe, H.; Yaron, S. (2008). CsrA and CsrB are required for the post-transcriptional control of the virulence-associated effector protein AvrA of Salmonella enterica. Int J Med Microbiol. • Khulusi, S.; Ahmed, H.A.; Patel, P.; Mendall, M.A.; Northfield, T.C. (1995). The effects of unsaturated fatty acids on Helicobacter pylori in vitro. J Med Microbiol. 42(4):276-82. • Kirov, S.M.; Castrisios, M.; Shaw, J.G. (2004). Aeromonas flagella (polar and lateral) are enterocyte adhesins that contribute to biofilm formation on surfaces. Infect Immun. 72(4):1939-45. • Klancnik, A.; Botteldoorn, N.; Herman, L.; Mozina, S.S. (2006). Survival and stress induced expression of groEL and rpoD of Campylobacter jejuni from different growth phases. Int J Food Microbiol. 112(3):200-7. • Kloosterman, T.G.; Hendriksen, W.T.; Bijlsma, J.J.; Bootsma, H.J.; van Hijum, S.A.; Kok, J.; Hermans, P.W.; Kuipers, O.P. (2006). Regulation of glutamine and glutamate metabolism by GlnR and GlnA in Streptococcus pneumoniae. J Biol Chem. 281(35):25097-109. • Kneidinger, B.; Larocque, S.; Brisson, J.R.; Cadotte, N.; Lam, J.S. (2003). Biosynthesis of 2-acetamido-2,6-dideoxy-L-hexoses in bacteria follows a pattern distinct from those of the pathways of 6-deoxy-L-hexoses. Biochem J. 371(Pt 3):989-95. • Kobayashi, K.; Sakamoto, J.; Kito, T.; Yamamura, Y.; Koshikawa, T.; Fujita, M.; Watanabe, T.; Nakazato, H. (1993). Lewis blood group-related antigen expression in normal gastric epithelium, intestinal metaplasia, gastric adenoma, and gastric carcinoma. Am J Gastroenterol., 88: 919-924. 86 • Kooistra, O.; Bedoux, G.; Brecker, L.; Lindner, B.; Sánchez-Carballo, P.; Haras, D.; Zähringer, U. (2003). Structure of a highly phosphorylated lipopolysaccharide core in the Delta algC mutants derived from Pseudomonas aeruginosa wild-type strains PAO1 (serogroup O5) and PAC1R (serogroup O3). Carbohydr Res. 338(23):266777. • Kumar, R.B.; Das, A. (2001). Functional analysis of the Agrobacterium tumefaciens T-DNA transport pore protein VirB8. J Bacteriol 183:3636-3641. • Lawrence, M.C.; Colman, P.M. (1993). Shape complementarity at protein/protein interfaces. J Mol Biol., 234:946-50. • Li, S.; Armstrong, C.M.; Bertin, N.; Ge, H.; Milstein, S.; Boxem, M.; Vidalain, P.O.; Han, J.D.; Chesneau, A.; Hao, T.; Goldberg, D.S.; Li, N.; Martinez, M.; Rual, J.F.; Lamesch, P.; Xu, L.; Tewari, M.; Wong, S.L.; Zhang, L.V.; Berriz, G.F.; Jacotot, L.; Vaglio, P.; Reboul, J.; Hirozane-Kishikawa, T.; Li, Q.; Gabel, H.W.; Elewa, A.; Baumgartner, B.; Rose, D.J.; Yu, H.; Bosak, S.; Sequerra, R.; Fraser, A.; Mango, S.E.; Saxton, W.M.; Strome, S.; Van Den Heuvel, S.; Piano, F.; Vandenhaute, J.; Sardet, C.; Gerstein, M.; Doucette-Stamm, L.; Gunsalus, K.C.; Harper, J.W.; Cusick, M.E.; Roth, F.P.; Hill, D.E.; Vidal, M. (2004). A map of the interactome network of the metazoan C. elegans. Science. 303(5657):540-3. • Li, Y.; Zamble, D. (2009). The pH-responsive DNA-binding activity of Helicobacter pylori NikR. Biochemistry. 48 (11), 2486–2496. • Lin, S.N.; Ayada, K.; Zhao, Y.; Yokota, K.; Takenaka, R.; Okada, H.; Kan, R.; Hayashi, S.; Mizuno, M.; Hirai, Y.; Fujinami, Y.; Oguma, K. (2005). Helicobacter pylori heat-shock protein 60 induces production of the pro-inflammatory cytokine IL8 in monocytic cells. J Med Microbiol. 54(Pt 3):225-33. 87 • Lippincott-Schwartz, J.; Patterson, G.H. (2003). Development and use of fluorescent protein markers in living cells. Science, 300: 87-91. • Liu, X.; Matsumura, P. (1995). An alternative sigma factor controls transcription of flagellar class-III operons in Escherichia coli: gene sequence, overproduction, purification and characterization. Gene, 164, 81-84. • Lu, L.; Lu, H.; Skolnick, J. (2002). MULTIPROSPECTOR: an algorithm for the prediction of proteinprotein interaction by multimeric threading. Proteins, 49:35064. • Lucchetti-Miganeh, C.; Burrowes, E.; Baysse, C.; Ermel, G. (2008). The posttranscriptional regulator CsrA plays a central role in the adaptation of bacterial pathogens to different stages of infection in animal hosts. Microbiology 154: 16-29. • Luidalepp, H.; Hallier, M.; Felden, B.; Tenson, T. (2005). tmRNA decreases the bactericidal activity of aminoglycosides and the susceptibility to inhibitors of cell wall synthesis. RNA Biol.2:70–74. • Maere, S.; Heymans, K.; Kuiper, M. (2005). BiNGO: a Cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks. Bioinformatics. 21(16):3448-9. • Marcus, E.A.; Moshfegh, A.P.; Sachs, G.; Scott, D.R. (2005). The periplasmic alpha-carbonic anhydrase activity of Helicobacter pylori is essential for acid acclimation. J Bacteriol. 187(2):729-38. • Manetti, R.; Massari, P.; Burroni, D.; De Bernard, M.; Marchini, A.; Olivieri, R.; Papani, E.; Montecucco, A.; Rappuoli, R.; Telford, J. (1995). Helicobacter pylori Cytotoxin: Importance of Native Conformation for Induction of Neutralizing Antibodies. Infect Imm., 63: 4476-4480. 88 • Marcotte, E.M.; Pellegrini, M.; Thompson, M.J.; Yeates, T.O.; Eisenberg, D. (1999). A combined algorithm for genome-wide prediction of protein function. Nature, 402:83-6. • Margittai, M.; Widengren, J.; Schweinberger, E.; Schröder, G.F.; Felekyan, S.; Haustein, E.; König, M.; Fasshauer, D.; Grubmüller, H.; Jahn, R.; Seidel, C.A. (2003). Single-molecule fluorescence resonance energy transfer reveals a dynamic equilibrium between closed and open conformations of syntaxin 1. Proc Natl Acad Sci USA, 100: 15516-15521. • McEvoy, M.M.; Hausrath, A.C.; Randolph, G.B.; Remington, S.J.; Dahlquist, F.W. (1998). Two binding modes reveal flexibility in kinase/response regulator interactions in the bacterial chemotaxis pathway. Proc.Natl.Acad.Sci.USA 95: 7333-7338. • McNally, D.J.; Hui, J.P.; Aubry, A.J.; Mui, K.K.; Guerry, P.; Brisson, J.R.; Logan, S.M.; Soo, E.C. (2006). Functional characterization of the flagellar glycosylation locus in Campylobacter jejuni 81-176 using a focused metabolomics approach. J Biol Chem. 281(27):18489-98. • Mobley, H.L.; Island, M.D.; Hausinger, R. P. (1995). Molecular biology of microbial ureases. Microbiol. Rev., 59, 451-480. • Mollenhauer-Rektorschek, M.; Hanauer, G.; Sachs, G.; Melchers, K. (2002). Expression of UreI is required for intragastric transit and colonization of gerbil gastric mucosa by Helicobacter pylori. Res Microbiol. 153(10):659-66. • Morera, S.; Lebras, G.; Lascu, I.; Lacombe, M.L.; Veron, M.; Janin, J. (1994). Refined X-ray structure of Dictyostelium discoideum nucleoside diphosphate kinase at 1.8Å resolution. J Mol Biol., 243:873-90. 89 • Moore, S.D.; Sauer, R.T. (2007). The tmRNA system for translational surveillance and ribosome rescue. Annu Rev Biochem. 76:101–124. • Murzin, A.G.; Brenner, S.E.; Hubbard, T.; Chothia, C. (1995). SCOP: a structural classification of proteins database for the investigation of sequences and structures. J. Mol. Biol,. 247, 536–540. • Miyamoto, Y.; Mukai, T.; Maeda, Y.; Nakata, N.; Kai, M.; Naka, T.; Yano, I.; Makino, M. (2007). Characterization of the fucosylation pathway in the biosynthesis of glycopeptidolipids from Mycobacterium avium complex. J Bacteriol. 189(15):5515-22. • Nardone, G.; Rocco, A.; Malfertheiner, P. (2004). Helicobacter pylori and molecular events in precancerous gastric lesions. Aliment Pharmacol Ther. 20(3):261-70. • Nomura, A.; Stemmarmann, G.; Chyan, P.; Perez-Perez, G.; Blaser, M. (1994). Helicobacter pylori infection and risk for duodenal and gastric ulceration. Ann Inter Med., 120: 977-981. • Odenbreit, S.; Püls, J.; Sedlmaier, B.; Gerland, E.; Fischer, W.; Haas, R. (2000). Translocation of Helicobacter pylori CagA into gastric epithelial cells by type IV secretion. Science, 25;287(5457):1497-500. • Odenbreit, S. (2005). Adherence properties of Helicobacter pylori: Impact on pathogenesis and adaptation to the host. Int J Med Microbiol. 295:317–324. • Oh, J.D.; Kling-Bäckhed, H.; Giannakis, M.; Xu, J.; Fulton, R.S.; Fulton, L.A.; Cordum, H.S.; Wang, C.; Elliott, G.; Edwards, J.; Mardis, E.R.; Engstrand, L.G.; Gordon, J.I. (2006). The complete genome sequence of a chronic atrophic gastritis 90 Helicobacter pylori strain: evolution during disease progression. Proc Natl Acad Sci U S A., 27;103(26):9999-10004. • Okan, N.A.; Bliska, J.B.; Karzai, A.W. (2006). A Role for the SmpB-SsrA system in Yersinia pseudotuberculosis pathogenesis. PLoS Pathogens.2:e6. • Pan, Z.; van der Hulst, R.; Su, W.M.; Feller, M.; Xiao, S.; Tytgat, G.N.; Dankert, J.; van der Ende, A. (1997). Equally high prevalence of infection with cagA-positive Helicobacter pylori in chinise patients with pepic ulcer diseases and those with chronic gastritis-associated dyspepsia. J Clin Microbiol., 35: 1344-1347. • Parkin, D.; Laara, E.; Muir, C. (1988). Estimates of the world wide frequency of sixteen major cancer in 1980. Int J Cancer, 41: 184-197. • Parkin, D.M. (2004). International variation. Oncogene, 23: 6329–40 • Parrish, J.R.; Yu, J.; Liu, G.; Hines, J.A.; Chan, J.E.; Mangiola, B.A.; Zhang, H.; Pacifico, S.; Fotouhi, F.; DiRita, V.J.; Ideker, T.; Andrews, P.; Finley, R.L. Jr. (2007). A proteome-wide protein interaction map for Campylobacter jejuni. Genome Biol. 8(7):R130. • Pazos, F.; Valencia, A. (2001). Similarity of phylogenetic trees as indicator of protein-protein interaction. Protein Eng., 14:609-14. • Pazos, F.; Valencia, A. (2002). In silico two-hybrid system for the selection of physically interacting proteins pairs. Proteins, 47:219-27. • Pawson, T.; Nash, P. (2000). Protein-protein interactions define specificity in signal transduction. Genes Dev., 14:1027-47. 91 • Pawson, T.; Raina, M.; Nash, P. (2002). Interaction domains: from simple binding events to complex cellular behavior. FEBS Lett., 513:2-10. • Pellegrini, M.; Marcotte, E.M.; Thompson, M.J.; Eisenberg, D.; Yeates, T.O. (1999). Assigning protein functions by comparative genome analysis: protein phylogenetic profiles. Proc Natl Acad Sci USA., 96:4285-8. • Peri, S.; Navarro, J.D.; Amanchy, R.; Kristiansen, T.Z.; Jonnalagadda, C.K.; Surendranath, V.; Niranjan, V.; Muthusamy, B.; Gandhi, T.K.; Gronborg, M.; Ibarrola, N.; Deshpande, N.; Shanker, K.; Shivashankar, H.N.; Rashmi, B.P.; Ramya, M.A.; Zhao, Z.; Chandrika, K.N.; Padma, N.; Harsha, H.C.; Yatish, A.J.; Kavitha, M.P.; Menezes, M.; Choudhury, D.R.; Suresh, S.; Ghosh, N.; Saravana, R.; Chandran, S.; Krishna, S.; Joy, M.; Anand, S.K.; Madavan, V.; Joseph, A.; Wong, G.W.; Schiemann, W.P.; Constantinescu, S.N.; Huang, L.; Khosravi-Far, R.; Steen, H.; Tewari, M.; Ghaffari, S.; Blobe, G.C.; Dang, C.V.; Garcia, J.G.; Pevsner, J.; Jensen, O.N.; Roepstorff, P.; Deshpande, K.S.; Chinnaiyan, A.M.; Hamosh, A.; Chakravarti, A.; Pandey, A. (2003). Development of human protein reference database as an initial platform for approaching systems biology in humans. Genome Res., 13(10):2363-71. • Piehler, J. (2005). New methodologies for measuring protein interactions in vivo and in vitro. Curr Opin Struct Biol., 15: 4-14. • Puig, O.; Caspary, F.; Rigaut, G.; Rutz, B.; Bouveret, E.; Bragado-Nilsson, E.; Wilm, M.; Séraphin, B. (2001). The tandem affinity purification (TAP) method: A general procedure of protein complex purification. Methods, 24: 218-229. • Qin, Y.; Polacek, N.; Vesper, O.; Staub, E.; Einfeldt, E.; Wilson, D.N.; Nierhaus, K.H. (2006). The highly conserved LepA is a ribosomal elongation factor that backtranslocates the ribosome. Cell 127, 721–733. 92 • Rain, J.C.; Selig, L.; De Reuse, H.; Battaglia, V.; Reverdy, C.; Simon, S.; Lenzen, G.; Petel, F.; Wojcik, J.; Schächter, V.; Chemama, Y.; Labigne, A.; Legrain, P. (2001). The protein-protein interaction map of Helicobacter pylori. Nature. 409(6817):211-5. • Ramani, A.K.; Marcotte, E.M. (2003). Exploiting the co-evolution of interacting proteins to discover interaction specificity. J Mol Biol ., 327: 273-84. • Rashid, M.H.; Rajanna, C.; Ali, A.; Karaolis, D.K. (2003). Identification of genes involved in the switch between the smooth and rugose phenotypes of Vibrio cholerae. FEMS Microbiol Lett. 227(1):113-9. • Rigaut, G.; Shevchenko, A.; Rutz, B.; Wilm, M.; Mann, M.; Seraphin, B. (1999). A generic protein purification method for protein complex characterization and proteome exploration. Nature, 17:1030-2. • Rudi, J.; Kolb, C.; Maiwald, M.; Kuck, D.; Sieg, A.; Galle, P.; Stremmel, W. (1998). Diversity of Helicobacter pylori vacA and cagA Genes and Relationship to VacA and Protein Expression, Cytotoxin Production, and Associated Diseases. J Clin Microbiol., 36: 944-948. • Sánchez, B.; Champomier-Vergès, M.C.; Anglade, P.; Baraige, F.; de Los ReyesGavilán, C.G.; Margolles, A.; Zagorec, M. (2005). Proteomic analysis of global changes in protein expression during bile salt exposure of Bifidobacterium longum NCIMB 8809. J Bacteriol. 187(16):5799-808. • Serrano, L. (2007). Synthetic biology: promises and challenges. Mol Syst Biol. 3:158. • Schauer, K.; Rodionov, D.A.; de Reuse, H. (2008). New substrates for TonBdependent transport: do we only see the 'tip of the iceberg'?. Trends Biochem Sci. 33(7):330-8. 93 • Schwikowski, B.; Uetz, P.; Fields, S. (2000). A network of protein-protein interactions in yeast. Nature Biotechnol., 18:1257-61. • Scott, D.R.; Marcus, E.A.; Wen, Y.; Oh, J.; Sachs, G. (2007). Gene expression in vivo shows that Helicobacter pylori colonizes an acidic niche on the gastric surface. Proc Natl Acad Sci USA., 104(17):7235-40. • Shannon, P.; Markiel, A.; Ozier, O.; Baliga, N.S.; Wang, J.T.; Ramage, D.; Amin, N.; Schwikowski, B.; Ideker, T. (2006). Cytoscape: a software environment for integrated models of biomolecular interaction networks. Genome Res. 13(11):2498504. • Shih, G.C.; Kahler, C.M.; Carlson, R.W.; Rahman, M.M.; Stephens, D.S. (2001). gmhX, a novel gene required for the incorporation of L-glycero-D-manno-heptose into lipooligosaccharide in Neisseria meningitidis. Microbiology. 147(Pt 8):236777. • Shimazu, K.; Takahashi, Y.; Uchikawa, Y.; Shimazu, Y.; Yajima, A.; Takashima, E.; Aoba, T.; Konishi, K. (2008). Identification of the Streptococcus gordonii glmM gene encoding phosphoglucosamine mutase and its role in bacterial cell morphology, biofilm formation, and sensitivity to antibiotics. FEMS Immunol Med Microbiol. 53(2):166-77. • Shimiyama, T.; Fukuda, S.; Tanaka, M.; Mikami, T.; Saito, Y.; Munakata, A. (1997). High Prevalence of CagA-positive Helicobacter pylori strains in Japanese asymptomatic patients and gastric cancer patients. Scand J Gastroenterol., 32: 465468. 94 • Shoemaker, B.A.; Panchenko, A.R. (2007). Deciphering protein-protein interactions. Part I. Experimental techniques and databases. PLoS Comput Biol., 3(3): e42. • Sirisena, D.M.; Brozek, K.A.; MacLachlan, P.R.; Sanderson, K.E.; Raetz, C.R. (1992). The rfaC gene of Salmonella typhimurium. Cloning, sequencing, and enzymatic function in heptose transfer to lipopolysaccharide. J Biol Chem. 267(26):18874-84. • Skouloubris, S.; Thiberge, J.M.; Labigne, A.; De Reuse, H. (1998). The Helicobacter pylori UreI protein is not involved in urease activity but is essential for bacterial survival in vivo. Infect. Immun., 66, 4517-4521. • Sprinzak, E.; Margalit, H. (2001). Correlated sequencesignatures as markers of protein-protein interaction. J Mol Biol., 311:681-92. • Sprinzak, E.; Sattath, S.; Margalit, H. (2003). How reliable are experimental protein-protein interaction data? J Mol Biol ., 327:919-23. • Stebbins, C.E. (2005). Structural microbiology at the pathogen-host interface. Cell. Microbiol., 7: 1227-1236. • Stein, M.; Rappuoli, R.; Covacci, A. (2000). Tyrosine phosphorylation of the Helicobacter pylori CagA antigen after cag-driven host cell translocation. Proc Natl Acad Sci USA., 97(3):1263-8. • Stein, A.; Russell, R.B.; Aloy, P. (2005). 3did: interacting protein domains of known three-dimensional structure. Nucleic Acids Res., 33:D413-7. 95 • Stingl, K.; Schauer, K.; Ecobichon, C.; Labigne, A.; Lenormand, P.; Rousselle, J.C.; Namane, A.; de Reuse, H. (2008). In vivo interactome of Helicobacter pylori urease revealed by tandem affinity purification. Mol Cell Proteomics. 7(12):2429-41. • Strobel, S.; Bereswill, S.; Balig, P.; Allgaier, P.; Sonntag, H.G.; Kist, M. (1998). Identification and analysis of a new vacA genotype variant of Helicobacter pylori in different patient groups in Germany. J Clin Microbiol., 36: 1285-1289. • Stroeher, U.H.; Karageorgos, L.E.; Brown, M.H.; Morona, R.; Manning, P.A. (1995). A putative pathway for perosamine biosynthesis is the first function encoded within the rfb region of Vibrio cholerae O1. Gene. 166(1):33-42. • Suganuma, M.; Kurusu, M.; Okabe, S.; Sueoka, N.; Yoshida, M.; Wakatsuki, Y.; Fujiki, H. (2001). Helicobacter pylori membrane protein 1: a new carcinogenetic factor of Helicobacter pylori. Cancer Res., 61:6356-6359. • Suzuki, M.; Suzuki, H.; Kitahora, T.; Miyazawa, M.; Nagahashi, S.; Suzuki, K.; Ishii, H. (2002). Treatment with a proton pump inhibitor promotes corpus gastritis in patients with Helicobacter pylori-infected antrum-predominant gastritis. Aliment Pharmacol Ther., 16: 159-165. • Tatusov, R.L.; Fedorova, N.D.; Jackson, J.D.; Jacobs, A.R.; Kiryutin, B.; Koonin, E.V.; Krylov, D.M.; Mazumder, R.; Mekhedov, S.L.; Nikolskaya, A.N.; Rao, B.S.; Smirnov, S.; Sverdlov, A.V.; Vasudevan, S.; Wolf, Y.I.; Yin, J.J.; Natale, D.A. (2003). The COG database: an updated version includes eukaryotes. BMC Bioinformatics, 4, 41. • Teichmann, S.A.; Murzin, A.G.; Chothia, C. (2001). Determination of protein function, evolution and interactions by structural genomics. Curr Opin Struct Biol., 11:354-63. 96 • Tomb, J.F.; White, O.; Kerlavage, A.R.; Clayton, R.A.; Sutton, G.G.; Fleischmann, R.D.; Ketchum, K.A.; Klenk, H.P.; Gill, S.; Dougherty, B.A.; Nelson, K.; Quackenbush, J.; Zhou, L.; Kirkness, E.F.; Peterson, S.; Loftus, B.; Richardson, D.; Dodson, R.; Khalak, H.G.; Glodek, A.; McKenney, K.; Fitzegerald, L.M.; Lee, N.; Adams, M.D.; Hickey, E.K.; Berg, D.E.; Gocayne, J.D.; Utterback, T.R.; Peterson, J.D.; Kelley, J.M.; Cotton, M.D.; Weidman, J.M.; Fujii, C.; Bowman, C.; Watthey, L.; Wallin, E.; Hayes, W.S.; Borodovsky, M.; Karp, P.D.; Smith, H.O.; Fraser, C.M.; Venter, J.C. (1997). The complete genome sequence of the gastric pathogen Helicobacter pylori. Nature, 388(6642):539-47. • Tong AH, Drees B, Nardelli G, Bader GD, Brannetti B, Castagnoli L, Evangelista M, Ferracuti S, Nelson B, Paoluzi S, Quondam M, Zucconi A, Hogue CW, Fields S, Boone C, Cesareni G. (2002). A combined experimental and computational strategy to define protein interaction networks for peptide recognition modules. Science, 295. • Tullius, M.V.; Harth, G.; Horwitz, M.A. (2003). Glutamine synthetase GlnA1 is essential for growth of Mycobacterium tuberculosis in human THP-1 macrophages and guinea pigs. Infect Immun. 71(7):3927-36. • Umit, H.; Tezel, A.; Bukavaz, S.; Unsal, G.; Otkun, M.; Soylu, A.R.; Tucer, D.; Otkun, M.; Bilgi, S. (2009). The relationship between virulence factors of Helicobacter pylori and severity of gastritis in infected patients. Dig Dis Sci. 54(1):103-10. • Uetz, P.; Giot, L.; Cagney, G.; Mansfield, T.A.; Judson, R.S.; Knight, J.R.; Lockshon, D.; Narayan, V.; Srinivasan, M.; Pochart, P.; Qureshi-Emili, A.; Li, Y.; Godwin, B.; Conover, D.; Kalbfleisch, T.; Vijayadamodar, G.; Yang, M.; Johnston, M.; Fields, S.; Rothberg, J.M. (2000). A comprehensive analysis of protein-protein interactions in Saccharomyces cerevisiae. Nature, 403(6770):623-627. 97 • Valencia, A.; Pazos, F. (2002). Computational methods for the prediction of protein interactions. Curr Opin Struct Biol. 12(3):368-73. • Vioque, A.; de la Cruz, J. (2003). Trans-translation and protein synthesis inhibitors. FEMS Microbiol Lett.218:9–14. • von Mering, C.; Krause, R., Snel, B.; Cornell, M.; Oliver, S.G.; Fields, S.; Bork, P. (2002). Comparative assessment of large-scale data sets of protein-protein interactions. Nature, 417:399-403. • Walhout, A.J.; Boulton, S.J.; Vidal, M. (2000). Yeast two-hybrid systems and protein interaction mapping projects for yeast and worm. Yeast, 17(2):88-94. • Wanbura, C.; Aoyama, N.; Shirasaka, D.; Sakai, T.; Ikemura, T.; Sakashita, M.; Maekawa, S.; Kuroda, K.; Inoue, T.; Ebara, S.; Miyamoto, M.; Kasuga, M. (2002). Effect of Helicobacter pylori-induced cyclooxygenase-2 on gastric epithelial cell kinetics: implication for gastric carcinogenesis. Helicobacter, 7:129-138. • Wang, W.; Peng, X.; Wang, Q.; Cheng, J.S.; Wang, L. (2006). Sequence of Escherichia coli O11 O-antigen gene cluster and identification of molecular markers specific to O11. Wei Sheng Wu Xue Bao. 46(3):341-6. • Warburton, V.J.; Everett, S.; Mapstone, N.P.; Axon, A.T.; Hawkey, P.; Dixon, M.F. (1998). Clinical and histological associations of cagA and vacA genotypes in Helicobacter pylori gastritis. J Clin Pathol. 51(1):55-61. • Weeks, D.L.; Eskandari, S.; Scott, D.R.; Sachs, G. (2000). A H+-gated urea channel: the link between Helicobacter pylori urease and gastric colonization. Science. 287(5452):482-5. 98 • Weel, J.F.; van der Hulst, R.W.M.; Gerrits, Y.; Roorda, P.; Feller, M.; Dankert, J.; Tytgat, G.N.; van der Ende, A. (1998). The interrelationship between cytotoxinassociated gene A, vacuolating cytotoxin and Helicobacter pylori-related diseases. J Infect Dis., 173: 1171-1175. • Welch, M.; Chinardet, N.; Mourey, L.; Birck, C.; Samama, J.P. (1998). Structure of the CheY-binding domain of histidine kinase CheA in complex with CheY. Nature Struct. Biol., 5, 25-29. • Westman, E.L.; Preston, A.; Field, R.A.; Lam, J.S. (2008). Biosynthesis of a rare diN-acetylated sugar in the lipopolysaccharides of both Pseudomonas aeruginosa and Bordetella pertussis occurs via an identical scheme despite different gene clusters. J Bacteriol. 190(18):6060-9. • Whitfield, C.; Amor, P.A.; Köplin, R. (1997). Modulation of the surface architecture of gram-negative bacteria by the action of surface polymer:lipid A-core ligase and by determinants of polymer chain length. Mol Microbiol. 23(4):629-38. • Wojcik, J.; Schächter, V. (2001). Protein-protein interaction map inference using interacting domain profile pairs. Bioinformatics, 17 Suppl 1:296-305. • Wu, L.J.; Errington, J. (1994). Bacillus subtilis spoIIIE protein required for DNA segregation during asymmetric cell division. Science 264:572-575. • Yan, C.; Wu, F.; Jernigan, R.L.; Dobbs, D.; Honavar, V. (2008). Characterization of protein-protein interfaces. Protein J., 27(1):59-70. • Yang, Y.; Wang, H.; Erie, D.A. (2003). Quantitative characterization of biomolecular assemblies and interactions using atomic force microscopy. Methods, 29: 175-187. 99 • Yamazaki, S.; Yamakawa, A.; Ito, Y.; Ohtani, M.; Higashi, H.; Hatakeyama, M.; Azuma, T. (2003). The CagA protein of Helicobacter pylori is translocated into epithelial cells and binds to SHP-2 in human gastric mucosa. J Infect Dis., 87(2):334-7. Epub 2002 Dec 19. • Ye, D.; Willhite, C.; Blanke, S.R. (1999). Identification of the Minimal Intracellular Vacuolating Domain of the Helicobacter pylori Vacuolating Toxin. J Biol Chemis., 274: 9277-9282. • Yook, S.H.; Oltvai, Z.N.; Barabási, A.L. (2004). Functional and topological characterization of protein interaction networks. Proteomics. 4(4):928-42. • Youngman, E.M.; Green, R. (2007). Ribosomal translocation: LepA does it backwards. Curr Biol. 17(4):R136-9. • Yu, H.; Luscombe, N.M.; Lu, H.X.; Zhu, X.; Xia, Y.; Han, J.D.; Bertin, N.; Chung, S.; Vidal, M.; Gerstein, M. (2004). Annotation transfer between genomes: protein– protein interologs and protein–ADN regulogs. Genome Res., 14, 1107–1118. • Xenarios, I.; Fernández, E.; Salwinski, L.; Joyce-Duan, X.; Thompson, M.J.; Marcotte, E.M.; Eisenberg, D. (2001). DIP: The database of interacting proteins: 2001 update. Nucleic Acids Res., 29:239-41. • Xenarios, I.; Salwinski, L.; Duan, X.J.; Higney, P.; Kim, S.M.; Eisenberg, D. (2002). DIP, the database of interacting proteins: a research tool for studying cellular networks of protein interactions. Nucleic Acids Res., 30:303-5. • Zambelli, B.; Danielli, A.; Romagnoli, S.; Neyroz, P.; Ciurli, S.; Scarlato, V. (2008). High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J Mol Biol. 383(5):1129-43. 100 • Zanzoni, A.; Montecchi-Palazzi, L.; Quondam, M.; Ausiello, G.; Helmer-Citterich, M.; Cesareni, G. (2002). MINT: a molecular interaction database. FEBS Lett, 513:135-40. 101 13. Glosario Ácido desoxirribonucleico (ADN): molécula que almacena la información genética. Amino ácido: unidad monomérica fundamental de las proteínas. Ácido ribonucleico (ARN): molécula que transmite información genética. Además cumple con funciones estructurales y de acoplamiento en la maquinaria de traducción de la informacion. ARN mensajero: molécula de ARN, copia de un gene, que lleva la información desde el genoma hasta donde se realiza la traducción. Bioinformática: disciplina científica emergente que utiliza tecnología de la información para organizar, analizar y distribuir información biológica con la finalidad de responder preguntas complejas en biología. Conformación: arreglo espacial que adopta una molécula, en virtud de los diferentes ángulos de rotación que pueden adquirir sus enlaces químicos. Dominio de una proteína: se refiere a una unidad estructural independiente de otras cadenas en la misma proteína, generalmente es el responsable de las características funcionales, evolutivas y de plegamiento de las proteinas. Enzima: proteína con actividad catalítica, es decir; que acelera una reacción química específica sin destruirse en el proceso. Las moléculas blanco de una enzima se denominan sustratos. Eucarionte: organismo con núcleo organizado y cromosomas. Forma parte de un gran grupo que difiere de los procariontes (las bacterias y organismos similares) que carecen de núcleo. Existen diferencias fundamentales entre la organización genética de uno y otro 102 grupo. Genoma: término que denota a todo el material genético de un organismo vivo. En un ser humano, por ejemplo, se refiere a todas las secuencias de todos los cromosomas de una célula. In vitro: se refiere a condiciones experimentales en las que no existen células u organismos vivos. Condiciones dadas en portaobjetos microscópicos, tubos de ensayo, etcétera In vivo: se refiere a condiciones experimentales que incorporan células u organismos vivos. In silico: se referiere a experimentos hechos con el uso de computadoras, por ejemplo simulaciones o predicciones. Interactoma: se refiere al conjunto total de interacciones entre las proteínas dentro de un organismo. Molécula: conjunto de átomos unidos unos con otros por enlaces fuertes. Es la expresión mínima de un compuesto o sustancia química. Trabajar con estas entidades primordiales justifica el uso del término “molecular” para denominar diversas áreas de la investigación en biología. (Entidad química constituida por la unión de varios átomos. Es la expresión mínima de un concepto químico. Una macromolécula puede estar constituida.por miles o hasta millones de átomos, típicamente enlazados en largas cadenas.) Mutagénesis: proceso por el cual se inducen cambios en el material genético de un organismo. El proceso puede ser espontáneo o inducido. Nucleótido: unidad fundamental de los ácidos nucleicos. Constituida por una base nitrogenada, un azúcar y un fosfato. Organelo: estructura intracelular especializada en una función determinada, como el 103 núcleo, las mitocondrias, los cloroplastos, los ribosomas, etcétera. Proteína: polímero constituido por una hebra o cadena lineal de unidades llamadas aminoácidos. La secuencia de aminoácidos de una proteína determina su estructura y su función. Las proteínas son los productos primarios codificados por los genes, encargadas de organizar la actividad bioquímica celular. Proteoma: el término describe el conjunto total de proteínas expresadas por un genoma completo, incluyendo las modificadas después de la traducción. Replicación: proceso por el cual las moléculas de ADN se duplican, generando dos copias iguales a partir de una sola. El proceso requiere la separación de las dos hebras de la molécula original. Ribosoma: organelo encargado de manufacturar proteínas, de acuerdo con las instrucciones del ADN (presentes en el ARN mensajero). Es un agregado de proteínas y ARN, llamado ribosomal. Sintenia: es la localización conservada de genes en posiciones equivalentes en especies relacionadas. Sitio activo: zona de una enzima con la que se asocia el sustrato y donde se induce su transformación química para dar un producto. Los sitios activos frecuentemente son hendiduras en la superficie de las enzimas. Sustrato: sustancia o molécula con la que interacciona una enzima, transformándose en productos. Traducción: proceso por medio del cual se lee la secuencia de codones del ARN y se elabora una cadena de proteína, con la secuencia correspondiente, de acuerdo con el código genético. 104 Transcripción: proceso por el que un gene se expresa, mediante la síntesis de un ARN que contiene la misma secuencia del gene. Transcriptoma: el término se refiere al estudio de los perfiles de expressión de todos los genes presentes en el genoma. Los estudios de expresión sugieren pistas sobre la función de los genes. Aunque son muchos los métodos para estudiar el transcriptoma el más utilizado es el microarray de ADN, que permite el análisis simultáneo de la expresión de miles de genes. Transducción de señal: frase que se aplica al proceso por el cual una señal molecular (por ejemplo, la presencia de una hormona en el medio extracelular) es convertida en una respuesta (por ejemplo, generación de un compuesto en el medio intracelular). Esta respuesta puede ser después amplificada o atenuada y, a su vez, dar origen a otro evento de transducción de señal. Transformación: procedimiento que permite introducir, directamente a células vivas, moléculas de ADN. Existen varios procedimientos que pueden lograr este objetivo: tratamiento con calcio, descarga eléctrica, pistolas génicas, etcétera. 105 14. Apéndice Lista de las 127 proteínas raíz obtenida de la base de datos MvirDB. Número Nombre común Número de acceso en UniProt 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 HP0037 HP0043 rfbD nolK ureH ureG ureF ureE ureI ureB ureA flaB bcp rfaJ hcpD fliR spsE nifU hcpE dps flgI rfaC amiE HP0017 HP0317 flgH neuA fliF fliG fliH galE gdhA tpx cheW O24878 O24884 O24885 O24886 Q09067 Q09066 Q09065 Q09064 Q09068 P69996 P14916 Q07911 P55979 O24967 O24968 O24978 O24980 O25009 O25021 P43313 O25028 O25056 O25067 O24862 O25086 O25092 O25093 O25118 O25119 O25120 O25127 P55990 O25151 O25152 106 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 HP0019 HP0616 HP0393 nifS HP0441 HP0459 glnA cag1 cag5 virB11 cag-Z cag8 cagT cagS cag16 cag17 cag20 cag22 cagE cagA fliN flaA pfr wbpB HP0686 feoB fliD fliS flhB secA hpaA HP0807 motA motB trxA trxB lpxB flgE HP0876 vacA flgD fur fliY O24864 O25337 O25154 O25161 O25189 O25206 P94845 O25257 O25260 Q7BK04 O25261 O25263 P97245 P97227 O25270 O25271 O25274 O25276 Q48252 P55980 O25306 P0A0S1 P52093 O25390 O25395 O25396 P96786 O25448 P56416 O25475 P55969 O25487 P65410 P56427 P66928 P56431 O25537 P50610 O25543 P55981 O25565 O25671 O25674 107 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 fliM flhF flhA cheY nixA tly flgK gluP amiF exbB exbD tonB rocF HP1400 fliQ fliI trbB exbB2 exbD2 coaD fliE flgC ceuE tsaA iscS cag7 omp13 alpA HP0913 cag10 cag11 cag14 cag18 cag21 cag24 cag3 cag4 cag9 cagC cagI cagP babA fliP O25675 O25679 O06758 P71403 Q48262 O25718 O25744 O25788 O25836 O25897 O25898 O25899 O25949 O25950 P0A0S3 O07025 O25965 O25986 P64101 O26010 P67708 O26080 O26082 P21762 O25008 O25262 O25355 O25570 O25571 O25265 O25266 O25268 O25272 O25275 O25277 O25258 O25259 O25264 O25278 O25273 O25269 O25840 O25394 108 121 122 123 124 125 126 127 fliA flaG flgG omp1 HP0651 HP0725 traG O25676 O25094 O26104 Q1CVE6 O25366 O25218 O25652 109