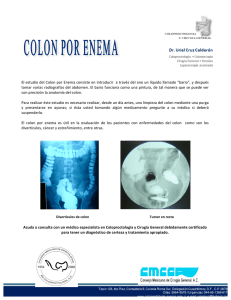
Tesis - Universidad de Colima
Anuncio

Universidad de Colima Programa de Residencias Médicas de la Secretaría de Salud GUÍA DIAGNÓSTICO TERAPÉUTICA DE LA ENFERMEDAD DIVERTICULAR DEL COLON Monografía que para obtener el Diploma de Especialista en Cirugía General Presenta Diego Paris Xilotl Asesor Metodológico Dr. Julio César Naranjo Chávez Jefe del Servicio de Cirugía General, Hospital Regional Universitario de Colima Asesor Clínico Dr. Christian Jorge Torres Ortiz Ocampo Médico Adscrito al servicio de Cirugía General, Hospital Regional Universitario de Colima Colima, Colima, Enero de 2009 D. en C. Carlos Enrique Tene Pérez Director Facultad de Medicina PRESENTE Por medio de la presente comunico a Usted que el alumno Diego Paris Xilotl, inscrito en el Programa de Especialidad en Cirugía General, adscrito a la Facultad de Medicina de la Universidad de Colima, ha concluido la monografía titulada “Guía Diagnóstico – Terapéutica de la Enfermedad Diverticular del Colon”, la cual reúne la originalidad y calidad suficiente para ser sometida a la consideración del jurado de examen de grado correspondiente. Atentamente Colima, Colima, Enero de 2009 __________________________________ Dr. Christian Jorge Torres Ortiz Ocampo Asesor Clínico ___________________________ Dr. Julio César Naranjo Chávez Asesor Metodológico CONTENIDO Introducción y Definiciones Anatomía Epidemiología Etiopatogenia Síntomas y Signos Examen clínico Exámenes auxiliares Diagnóstico diferencial Tratamiento Conclusiones Anexos Bibliografía ÍNDICE DE FIGURAS, TABLAS Y ANEXOS FIGURAS Figura 1: Hallazgos anatómicos de un segmento de colon con divertículos Figura 2: Diámetros y longitudes de los segmentos del colon Figura 3: Riego arterial del intestino grueso Figura 4: Vasos rectos y sus ramificaciones Figura 5: Arteria mesentérica inferior Figura 6: Anastomosis vasculares del intestino grueso Figura 7: Drenaje venoso del intestino grueso Figura 8: Linfáticos del intestino grueso Figura 9: Inervación intrínseca del intestino grueso Figura 10: Aspectos específicos de la anatomía del sigmoides Figura 11: Representación de una Zona de segmentación del colon Figura 12: Complicaciones de la enfermedad diverticular Figura 13: Clasificación de Hinchey Figura 14: Enfermedad diverticular del colon. TAC Figura 15: TAC abdominal en diverticulitis y neoplasia de colon Figura 16: Estudio contrastado en diverticulitis Figura 17: Estudio contrastado en diverticulitis Figura 18: Colonoscopia Figura 19: Absceso diverticular y drenaje percutáneo TABLAS Tabla 1: Datos tomográficos de diverticulitis moderada y severa ANEXOS Anexo 1: Abordaje diagnóstico inicial Anexo 2: Valoración del paciente con diverticulitis severa Anexo 3: Complicaciones de la enfermedad diverticular Anexo 4: Complicaciones de la enfermedad diverticular RESUMEN El término “enfermedad diverticular del colon”, representa un espectro de cambios anatómicos y fisiopatológicos en el colon, relacionados a la presencia de divertículos, siendo más frecuentes en el colon sigmoides. Puede referirse a un estado asintomático (diverticulosis) o a cualquiera de varias combinaciones de síntomas, cambios y complicaciones inflamatorias (diverticulitis). En el desarrollo de la enfermedad se asocian una dieta baja en fibra, el sedentarismo, la ingesta de AINES, el tabaquismo y el estreñimiento de cualquier causa. Una clasificación clínica de la enfermedad diverticular engloba la patología en Enfermedad asintomática, Enfermedad sintomática no complicada, Enfermedad sintomática recurrente y Enfermedad complicada. Los síntomas y signos variarán de acuerdo a la gravedad de la presentación, pudiendo ser tributarios de manejo médico conservador o quirúrgico. Esta guía propone el abordaje diagnóstico y terapéutico de la enfermedad diverticular del colon. ABSTRACT The term “diverticular disease of the colon” represents a wide spectrum of anatomical and pathological changes en the colon, related to the presence of diverticula, being more frequent in the sigmoid colon. It may refer to an asymptomatic state (diverticulosis) or to any combination of signs, symptoms and inflammatory complications (diverticulitis). In the development of the disease there are several factors associated, such as low fiber intake, sedentarism, NSAID’s, tobacco use and constipation. A clinical classification of the disease includes: Asymptomatic disease, Symptomatic non complicated disease, Symptomatic recurrent disease and Complicated disease. Signs and symptoms may vary according to illness severity, leading to conservative treatment or surgical treatment. This guide proposes the diagnostic and therapeutic approach of the diverticular disease of the colon. INTRODUCCIÓN Y DEFINICIONES El término “enfermedad diverticular” del colon, representa un espectro de cambios anatómicos y fisiopatológicos en el colon, relacionados a la presencia de divertículos. Estos cambios ocurren más frecuentemente en el colon sigmoides. Este espectro puede variar desde la presencia de un divertículo único hasta la presencia de múltiples divertículos. Puede referirse a un estado asintomático (diverticulosis) o a cualquiera de varias combinaciones de síntomas, cambios y complicaciones inflamatorias (diverticulitis). Los síntomas pueden abarcar desde simples cambios fisiológicos en la motilidad del colon relacionadas a una actividad neuromuscular alterada, hasta varios grados de respuesta inflamatoria localizada o interacciones inflamatorias complejas que llevan a la peritonitis difusa y al choque séptico. Estos síntomas más complejos y sus complicaciones resultantes surgen de alteraciones en la integridad de la pared de uno o más divertículos. Los divertículos son excrecencias pequeñas del colon (0.5 – 1cm de diámetro) que aparecen en los sitios de penetración vascular entre la tenia mesentérica y una de las tenias antimesentéricas. En los sitios donde se encuentran mayor cantidad de divertículos, la capa muscular prácticamente está ausente (Figura 1). Técnicamente, dichas lesiones son divertículos falsos (pseudodivertículos); los divertículos verdaderos (que son mucho menos frecuentes que los falsos) involucran todas las capas de la pared intestinal, siendo ejemplo característico, el divertículo único del ciego. El colon sigmoides es el sitio más frecuentemente afectado por divertículos: en 90% de los pacientes con diverticulosis (definida como la mera presencia de divertículos) está afectado el colon sigmoides1. Si un divertículo se inflama como resultado de obstrucción fecal, moco endurecido o erosión mucosa, puede ocurrir una perforación local (micro perforación) – proceso conocido como diverticulitis. Actualmente, se prefiere englobar los términos de diverticulosis y diverticulitis bajo el nombre de Enfermedad Diverticular. Figura 1. Hallazgos anatómicos de un segmento de colon con divertículos. Las lesiones se localizan en las zonas 97 donde penetran las estructuras vasculares. Modificado de Skandalakis JE, 2004 ANATOMÍA La longitud total del intestino grueso se estima entre 1.3 y 1.8 metros; de acuerdo a “Anatomía de Gray”2, se estima en 1.5m, mientras que Goligher3 lo estima en 1.25m. En la Figura 2 se ilustran los diámetros aproximados de los diferentes segmentos del intestino grueso. Figura 2. Diámetros y longitudes aproximados de los distintos segmentos del Intestino Grueso. Tomado de 97 Skandalakis JE, 2004 Saunders et al4 reportan mediciones intraoperatorias de 118 pacientes, con una media de 114cm (rangos de 68-159 cm); 17% no tenían sigmoides libre por adherencias; 8% presentaban un mesocolon de 10cm o más y 9% presentaban un mesocolon ascendente de 10cm o más. Veinte por ciento de los pacientes tuvieron flexuras esplénicas móviles y en 29% de los casos el colon transverso llegaba a la sínfisis del pubis por efecto péndulo. Riego arterial El ciego y el colon ascendente reciben sangre de dos ramas de la arteria mesentérica superior: las arterias cólica derecha y la ileocólica (Figura 3). Estas arterias forman arcadas a partir de las cuales los vasos rectos pasan hacia la pared colónica medial. Al llegar a la superficie del colon, los vasos rectos se dividen ramas largas y cortas. Las ramas cortas riegan el borde mesentérico del colon; las ramas largas riegan las porciones laterales y antimesentéricas. Las ramas largas mandan ramificaciones hacia los apéndices epiplóicos (Figura 4). Figura 3. Riego arterial del Intestino Grueso. Arterias mesentéricas superior e inferior y sus ramas. Modificado de 97 Skandalakis JE, 2004 El colon transverso recibe su vasculatura de la arteria cólica media, rama de la mesentérica superior. De acuerdo a Steward y Rankin5, en 37% de los casos el ángulo esplénico recibe riego sanguíneo de la cólica media. En el resto de los casos, el ángulo esplénico y la porción izquierda del colon transverso son irrigados por la arteria cólica izquierda, rama de la arteria mesentérica inferior Figura 4. Vasos rectos y sus ramificaciones con respecto a la circunferencia del intestino grueso. El recuadro muestra 97 la irrigación a nivel de los apéndices epiplóicos del colon. Modificado de Skandalakis JE, 2004 La arteria mesentérica inferior surge de la aorta al nivel de la 3ª vértebra lumbar, en o cerca del borde inferior de la tercera porción del duodeno. Las ramas de la arteria mesentérica inferior son la arteria cólica izquierda, con sus ramas ascendente y descendente para el colon descendente, 1 a 9 arterias sigmoideas y la arteria rectal (hemorroidal) superior (Figura 5). En 38% de los casos, existe una arteria cólica media accesoria. La arteria cólica izquierda llega y termina en el ángulo esplénico del colon en 86% de los casos, mientras que en 14% de los casos se anastomosa con la arteria marginal proveniente de la arteria cólica media. Figura 5. Arteria mesentérica inferior y sus ramas. Modificado de Skandalakis JE, 2004 97 En la anatomía vascular del colon, la rama ascendente de la arteria cólica izquierda es el vaso de aporte primario (96.9%). De acuerdo a Furst et al. 6 una arteria cólica izquierda intacta, incluyendo sus colaterales a nivel del ángulo esplénico, brindan suficiente irrigación a la porción proximal del colon ascendente después de ligar las arterias cólica media y cólica derecha desde su origen. Para efectos de anastomosis a nivel de colon, debemos recordar que los vasos rectos cortos son responsables de la irrigación de 2/3 de la circunferencia total, mientras que las ramas largas se anastomosan hacia el borde antimesentérico, siendo responsables sólo de 1/3 de la irrigación de la circunferencia del colon. La arteria marginal de Drummond (Figura 6) está compuesta por arcadas de anastomosis entre las arterias ileocólica, cólica derecha, cólica media, cólica izquierda y sigmoideas, formando un vaso único. La arteria marginal corre paralela al borde mesentérico del colon, a 1 – 8 cm de la pared intestinal. Puede o no terminar a nivel de la arteria rectal superior. Figura 6. Anastomosis vasculares del intestino grueso. Arteria marginal de Drummond. Modificado de Skandalakis JE, 97 2004 La anastomosis entre las arterias ileocólica y cólica derecha está ausente en 5% de los casos. Griffiths7 describió un punto de fragilidad vascular a nivel del ángulo esplénico del colon (“Punto crítico de Griffiths”), postulando que debía mantenerse la vasculatura de la arteria cólica izquierda en cuestiones de resecciones y anastomosis. En estudios posteriores, Michels et al. 8 demostraron una adecuada anastomosis vascular en 61% de los casos, mala anastomosis en 32% y no anastomosis en 7%, restando importancia quirúrgica al punto descrito por Griffiths. El punto crítico de Sudeck ya no es considerado tan “crítico” como antes se pensaba. Sudeck describió un punto en la arteria rectal superior en el cual la ligadura de la arteria no desvacularizaría un largo muñón rectosigmoideo. Este punto se encuentra justo por arriba del origen de la última arteria sigmoidea; su posición varía de acuerdo al número de las arterias sigmoideas. En aproximadamente 50% de los casos, la arteria marginal de Drummond continúa en sentido descendente para unirse a la arteria rectal superior. El punto de Sudeck estaría proximal a esa unión. La importancia del punto de Sudeck radica en el procedimiento quirúrgico a realizar. En algunas hemicolectomías izquierdas en las que se deja un muñón sigmoideo largo, puede ser difícil movilizar el colon transverso debido a un mesocolon transverso corto. Este problema se soluciona realizando una ligadura de la arteria rectal superior por arriba del punto crítico de Sudeck. El concepto de Sudeck falla al reconocer otras dos fuentes de irrigación al recto. Una es la red intramural de la submucosa. La otra es a partir de las arterias rectales media e inferior, especialmente de esta última. Goligher9 afirma que las arterias rectales (hemorroidales) media e inferior son capaces de irrigar un muñón rectal distal hasta un punto por lo menos 8 a 10cm por arriba de la reflexión peritoneal. De acuerdo a Michels et al.8 además de las tres arterias hemorroidales (rectales), hay otras ramas colaterales para la irrigación del recto y el sigmoides, e incluyen: Ramas de la arteria vesical inferior. Arterias del músculo elevador del ano. Arteria sacra media. Plexo arterial retroperitoneal posterior, que une la circulación visceral y parietal. Drenaje venoso Las venas del colon siguen a las arterias (Figura 7). Del lado derecho, las venas se unen para formar la vena mesentérica superior. Las venas del ángulo hepático del colon y de la porción derecha del colon transverso drenan a la vena gastroepiploica o a la vena pancreatoduodenal anterosuperior. El drenaje de la porción izquierda del colon transverso es hacia la vena mesentérica inferior. La vena rectal superior drena el colon sigmoides y parte del colon descendente; al recibir las venas tributarias (cólica izquierda y sigmoideas) se forma la vena mesentérica inferior. El recto tiene drenaje venoso por la rectal superior, que drena en la mesentérica inferior y hacia la vena porta. Las venas rectales media e inferior drenan hacia la vena iliaca interna y, por ende, a la circulación sistémica. Figura 7. Drenaje venoso del Intestino Grueso. Venas mesentérica superior e inferior. Modificado de Skandalakis JE, 97 2004 Drenaje linfático El drenaje linfático del colon se ha dividido en 4 grupos (Figura 8): Epicólico: debajo de la serosa de la pared intestinal. Paracólico: en la arteria marginal. Intermedio: en el trayecto de las arterias mayores, mesentéricas superior e inferior. Principal: en la raíz de las arterias mesentéricas superior e inferior. Este grupo incluye: o Nódulos mesentéricos o Nódulos aórticos o Nódulos lumbares izquierdos A nivel rectal, el drenaje se realiza preferentemente hacia los grupos principal e intermedio, aunque puede haber drenaje al sistema hipogástrico y hacia la iliaca interna. A nivel del conducto anal, por debajo de la línea pectinada, el drenaje se realiza hacia los ganglios inguinales. Figura 8. Linfáticos del Intestino Grueso. Grupos ganglionares. Modificado de Skandalakis JE, 2004 97 Inervación Inervación intrínseca Del esófago al ano, el tracto digestivo está dotado de dos redes nerviosas intramurales (Figura 9). El plexo mientérico (Auerbach) controla la motilidad, mientras que el plexo submucoso (Meissner) controla la secreción. Fibras vagales y simpáticas hacen sinapsis con estas células ganglionares intramurales. Actualmente se considera que el sistema gastrointestinal tiene su propio grupo nervioso, conocido como plexo intramural o sistema nervioso entérico10. Se estima que hay 100 millones de neuronas en este sistema. Las neuronas posganglionares simpáticas y parasimpáticas hacen sinapsis con neuronas tanto del plexo mientérico como del plexo submucoso. Las fibras posganglionares simpáticas, también hacen sinapsis directa en las células epiteliales. Las neuronas de los dos plexos, generalmente denominadas fibras parasimpáticas posganglionares, forman una red neuronal con amplias sinapsis; entre estos plexos, también hay interneuronas. Figura 9. Inervación intrínseca del intestino grueso. Inervación simpática y parasimpática; plexo intramural. 97 Modificado de Skandalakis JE, 2004 Inervación simpática El aporte simpático del colon derecho se origina de los últimos seis segmentos torácicos de la médula espinal. Las fibras preganglionares pasan por la cadena ganglionar simpática, luego a los nervios esplácnicos torácicos y hacen sinapsis en los plexos celíaco, aórtico y mesentérico superior. A partir de los plexos, las fibras posganglionares pasan junto las arterias del mesenterio hacia el intestino delgado y el colon derecho. Del lado izquierdo, las fibras preganglionares surgen de los primeros dos (o tres) segmentos lumbares de la médula espinal, viajan en forma de nervios lumbares esplácnicos hacia los plexos aórtico y mesentérico inferior. A partir de los ganglios de estos plexos, las fibras posganglionares siguen las ramas de la arteria mesentérica inferior hacia el colon izquierdo y la porción proximal del recto. Inervación parasimpática Las fibras vagales del tronco posterior pasan como la división celíaca hacia y a través del ganglio celiaco sin hacer sinapsis. A partir del ganglio celíaco, las fibras preganglionares pasan con la arteria mesentérica superior hacia el intestino delgado y el colon derecho, donde hacen sinapsis con células ganglionares de los plexos intramurales. El colon izquierdo recibe fibras parasimpáticas de los nervios esplácnicos pélvicos, que emergen del 2º, 3º y 4º nervios sacros. Estas fibras siguen el trayecto del nervio presacro para llegar al plexo mesentérico inferior. A partir de este plexo, las fibras preganglionares siguen las ramas de la arteria mesentérica inferior al colon izquierdo y al recto superior. Aspectos específicos de la anatomía del sigmoides A nivel de la cresta iliaca, el colon descendente se convierte en colon sigmoides y adquiere mesenterio. Se describe que el colon sigmoides tiene dos porciones: (1) la porción ilíaca, fija y localizada en la fosa iliaca izquierda, y (2) la porción pélvica, móvil. Para efectos prácticos, el sigmoides inicia en la cresta iliaca y termina a nivel de la tercera vértebra sacra. La porción pélvica tiene forma de omega (Ω) e inicia en el borde medial del psoas mayor. Tiene un mesenterio (mesocolon pélvico o mesosigma) fijo a la pared pélvica posterior. Termina en la unión rectosigmoidea, localizada a nivel de la 3ª vértebra sacra. Los vasos rectales superiores se encuentran en el mesenterio de la porción pélvica del sigmoides. Shafik11 sugirió que la unión rectosigmoidea actúa como un esfínter: se abre de forma refleja por la contracción sigmoidea (reflejo inhibitorio rectosigmoideo) permitiendo el paso de materia fecal hacia el recto, y se cierre por contracción del recto (reflejo excitatorio rectosigmoideo) previniendo el reflujo fecal hacia el sigmoides. Irrigación arterial y drenaje venoso Las ramas sigmoideas de la arteria mesentérica inferior dan irrigación al colon sigmoides. Puede existir una rama sigmoidea de la arteria cólica izquierda que irriga al sigmoides proximal. El drenaje venoso está dado por la vena mesentérica inferior Linfáticos Los vasos linfáticos drenan hacia nódulos que se encuentran en el trayecto de la arteria cólica izquierda, posteriormente a los nódulos de la arteria mesentérica inferior para drenar en los nódulos lumbares izquierdos o a los nódulos aórticos izquierdos. Inervación El colon sigmoides está inervado por nervios autónomos. Las fibras del dolor tienen sentido ascendente vía los nervios lumbares esplácnicos y la cadena simpática lumbar del 1º o 2º segmentos lumbares de la médula espinal. Consideraciones quirúrgicas Durante la movilización de las porciones ilíaca y pélvica del sigmoides, es necesario identificar y proteger el uréter izquierdo y los vasos gonadales ipsilaterales. La vena mesentérica inferior puede ser ligada sin ningún problema. De ser posible, realizar la ligadura cerca de su final o en su confluencia con la vena esplénica o la vena mesentérica superior. La sección del colon 3-4 cm por debajo de un tumor es adecuada para tumores rectosigmoideos ya que el flujo linfático en la mayoría de los casos no es retrógrado. La mayoría, si no es que todos los linfáticos involucrados están a 2 cm o menos por debajo del tumor. El promontorio del sacro es un sitio anatómico que delimita el final del sigmoides. En raras ocasiones existen porciones individuales de mesenterio para el recto proximal y el sigmoides terminal. La arteria mesentérica inferior también puede ser ligada siempre y cuando existan anastomosis entre las arterias cólica derecha, cólica media y marginal que las conecten con la arteria cólica izquierda. La fijación del mesosigma a la pared abdominal tiene muchas variaciones. En la mayoría de los individuos inicia en la fosa iliaca izquierda siguiendo una trayectoria inferior y medial. En otros, la unión es sinuosa (con forma de C, S o U invertida). El uréter izquierdo pasa por la base del mesosigma a través de la fosa intersigmoidea (Figura 10). Figura 10. Aspectos específicos de la anatomía del sigmoides. A) Dimensiones promedio del mesosigma. B) Relación 97 del uréter izquierdo con el mesosigma por la fosa intersigmoidea. Modificado de Skandalakis JE, 2004 EPIDEMIOLOGIA La prevalencia de la enfermedad diverticular puede ser difícil de establecer, puesto que los estudios por autopsia tienden a subestimar la frecuencia de la enfermedad debido a que los divertículos pequeños pueden no ser detectados. Por el contrario, los cálculos de prevalencia mediante empleo de estudios radiológicos tienden a sobreestimarla, puesto que estos estudios se solicitan a pacientes que presentan alguna sintomatología gastrointestinal que justifica su estudio. La incidencia de diverticulitis es de 10 a 25% en pacientes con diverticulosis12. La incidencia de la enfermedad diverticular se incrementa con la edad. Los divertículos son muy frecuentes en los ancianos, presentándose en más del 80% de los pacientes mayores de 85 años13. Consecuentemente, mientras la población en general continúa envejeciendo, el riesgo general de complicaciones diverticulares va en aumento 14. Se estima que de 10-20% de los pacientes con divertículos desarrollarán síntomas de diverticulitis, y sólo 10-20% de éstos requerirán hospitalización. De aquellos hospitalizados, 20-50% requerirán intervención quirúrgica15. En general, menos del 1% de los pacientes con divertículos requerirán manejo quirúrgico 16. ETIOPATOGENIA Una dieta que contiene bajas cantidades de fibra y grandes cantidades de carbohidratos refinados se asocia con un aumento en la incidencia de las emergencias de la enfermedad diverticular17, 18. Una dieta de bajo residuo facilita el desarrollo de estreñimiento, el cual puede llevar al desarrollo de un aumento de presión intraluminal a nivel del intestino grueso. De manera adicional, es común encontrar altos niveles de elastina en la pared del colon que contiene divertículos19, lo cual causa acortamiento de las tenias12. Se pueden desarrollar áreas de alta presión o zonas de segmentación (Figura 11), generalmente en el colon sigmoides, lo cual lleva a la protrusión de los divertículos a este nivel18. Figura 11. Representación esquemática de una zona de segmentación del colon. Se ha propuesto que estos 27 compartimientos de alta presión llevan al desarrollo de divertículos. Tomado de Welch JP, 2006 Si se produce una microperforación de un divertículo de pared delgada puede aparecer contaminación con organismos fecales de manera local o, en ocasiones, de manera general. El tejido pericólico (generalmente el mesenterio y la grasa pericólica) presenta inflamación, mientras que la mucosa tiende a permanecer con características normales. Hay varios factores que se asocian al desarrollo de la enfermedad diverticular y sus complicaciones, los cuales incluyen sedentarismo19, ingesta de AINES20, 21, tabaquismo22 y estreñimiento de cualquier causa. La obesidad se asocia a la ingesta de dietas bajas en fibra23, observándose cada vez más pacientes jóvenes obesos con enfermedad diverticular. Clasificación El Colegio Americano de Cirugía (ACS, por sus siglas en inglés) clasifica a la enfermedad diverticular en dos grandes rubros: Simple ( o no complicada) Complicada Existe, además, una clasificación clínica que engloba de manera más didáctica, el abordaje de la enfermedad diverticular92: Enfermedad asintomática Enfermedad sintomática no complicada Enfermedad sintomática recurrente Enfermedad complicada SÍNTOMAS Y SIGNOS Enfermedad diverticular no complicada Los síntomas clásicos de la diverticulitis no complicada son dolor en el cuadrante abdominal inferior izquierdo, febrícula o fiebre de bajo grado, cambios en la dinámica defecatoria (periodos alternos entre estreñimiento y diarrea asociados a urgencia rectal) y, posiblemente, sintomatología urinaria si el colon afectado se encuentra adyacente a la vejiga. Si el colon sigmoides es muy redundante, el dolor puede ser más intenso en el cuadrante abdominal inferior derecho. El diagnóstico diferencial incluye patologías urinarias y ginecológicas, carcinoma de colon perforado, enfermedad de Crohn, colitis isquémica y, en ocasiones, apendicitis aguda. La presencia de diarrea crónica, afección de múltiples áreas del colon, enfermedad perianal, fístulas perineales o cutáneas, o síntomas extra intestinales sugieren enfermedad de Crohn. El sangrado transrectal debe hacer sospechar enfermedad inflamatoria intestinal, isquemia o cáncer; el sangrado transrectal es raro en presencia de diverticulitis sola. Dada la prevalencia de los divertículos, no debe sorprender que coexistan el carcinoma de colon con la enfermedad diverticular. Enfermedad diverticular complicada La enfermedad diverticular complicada se define como diverticulosis asociada a una o más de las siguientes entidades: estenosis, absceso, fístula, sangrado o perforación libre (Figura 12)24, 25. En general, el absceso se presenta en 76% de los casos, la obstrucción en 6%, la fístula en 10% y la hemorragia digestiva baja en 8%93.La enfermedad diverticular puede ser particularmente difícil de diagnosticar26, 27, especialmente porque el paciente puede no tener historia de enfermedad diverticular. Figura 12. Complicaciones de la enfermedad diverticular. Se incluyen perforación libre con formación de absceso, 27 hemorragia, obstrucción y fístula. Modificado de Welch JP, 2006 El sangrado de tubo digestivo bajo es una complicación bien descrita de la enfermedad diverticular28; de hecho, los divertículos son la causa colónica más frecuente de sangrado de tubo digestivo bajo masivo29. Cuando se produce sangrado, es más frecuente la asociación a diverticulosis que a diverticulitis (por traumatismo de los vasos submucosos, más que por perforación directa por el proceso inflamatorio agudo). Aproximadamente el 50% de los sangrados diverticulares se originan en el hemicolon derecho, a pesar de la baja incidencia de diverticulosis en este segmento colónico. Los pacientes tienden a ser ancianos26 y a tener enfermedad cardiovascular e hipertensión. La ingesta regular de AINE’s puede aumentar el riesgo de esta complicación. El sangrado generalmente cede espontáneamente30, siendo innecesario el tratamiento quirúrgico de urgencia. La forma más común de diverticulitis complicada es el desarrollo de un absceso pericólico, típicamente caracterizado por la presencia de fiebre y escalofríos. Dichos abscesos pueden ser pequeños y estar bien localizados o extenderse a sitios distantes (por ejemplo, la pelvis). Los abscesos pueden englobarse en la clasificación de las perforaciones diverticulares propuesta por Hinchey31, en la cual el Tipo I se refiere a abscesos pericólicos localizados, mientras que el tipo II se refiere a grandes abscesos mesentéricos que se extienden hacia la pelvis o a otros sitios (Figura 13). En raras ocasiones, el absceso se forma en el espacio retroperitoneal, extendiéndose a sitios distantes como el muslo o el flanco abdominal. La localización del absceso puede definirse de manera precisa por medio de tomografía contrastada. Algunos abscesos drenan hacia tejidos o vísceras adyacentes, resultando la formación de fístulas. Las fístulas que con mayor frecuencia se presentan (50 a 65% de los casos) son las colovesicales. Esta complicación es menos frecuente en mujeres debido a la protección relativa que confiere la presencia del útero. La sintomatología de las fístulas colovesicales tienden a abarcar el tracto urinario (por ejemplo, neumaturia, hematuria y urgencia urinaria. La presencia de fecaluria es diagnóstico de fístula colovesical o enterovesical. Las fístulas colovaginales (que constituyen el 25% de todas las fístulas diverticulares) son frecuentemente observadas en pacientes que han sido sometidas a histerectomías32. El colon afectado se encuentra adyacente a la cúpula vaginal. De manera más frecuente, las pacientes se quejan de descarga vaginal fétida; sin embargo, hay pacientes que presentan evacuaciones fecales o gasto fecaloide a través de la vagina. Aproximadamente 10% de las obstrucciones del colon se atribuyen a la enfermedad diverticular. La diverticulitis aguda puede causar edema y obstrucción funcional que generalmente se resuelve con antibióticos y reposo intestinal. Es más frecuente la formación de estenosis, generalmente resultado de ataques recurrentes de diverticulitis. Es común encontrar fibrosis pericólica circunferencial, con una marcada angulación del colon pélvico y con adherencias a las paredes laterales de la pelvis. Los pacientes refieren constipación y evacuaciones en escíbalos. En estos casos, la colonoscopia puede ser difícil y peligrosa (con alto riesgo de sangrado y perforación). Diferenciar una estenosis diverticular de un carcinoma de colon puede ser imposible. Figura 13. Clasificación de la Diverticulitis de Hinchey. Tipo I: Diverticulitis con absceso pericólico. Tipo II: Diverticulitis con absceso retroperitoneal o pélvico. Tipo III: Diverticulitis con peritonitis purulenta. Tipo IV: Diverticulitis con 27 peritonitis fecal. Modificado de Welch JP, 2006 El término diverticulitis maligna se ha empleado para describir una forma extrema de diverticulitis del sigmoides que se caracteriza por un flegmón extenso con gran cantidad de reacción inflamatoria que se extiende por debajo de la reflexión peritoneal, con una gran tendencia hacia la obstrucción y la formación de fístulas33. La diverticulitis maligna se observa en menos del 5% de los pacientes mayores a 50 años sometidos a eventos quirúrgicos por diverticulitis aguda33. Esta entidad asemeja la enfermedad de Crohn, y la tomografía abdominal demuestra inflamación extensa. En estos casos, se sugiere realizar resecciones en etapas antes de intentar una resección primaria del flegmón pélvico. El grado de inflamación disminuye de manera importante después de una cirugía inicial, mejorando el pronóstico de una resección y anastomosis subsecuentes33. Una complicación rara pero peligrosa de la diverticulitis aguda es la perforación libre (se estima una incidencia de 1 a 2% de los casos)34, que incluye tanto la perforación como un absceso diverticular en el abdomen, causando peritonitis generalizada (peritonitis purulenta; Hinchey III) y fuga de materia fecal por un divertículo abierto hacia la cavidad peritoneal (peritonitis fecal; Hinchey IV). Se ha observado que la incidencia de perforaciones diverticulares libres ha ido en aumento 35. La mortalidad general en estos pacientes es de 20 a 30%, con 13% por peritonitis purulenta y aproximadamente 43% por peritonitis fecal34. La diverticulitis recurrente es infrecuente y ocurre en el 1-10% de los casos, asociándose a una resección distal incompleta, realizando la anastomosis en tejido de sigmoides remanente. La tasa de una nueva resección se calcula en aproximadamente 0-3%92. EXAMEN CLÍNICO Enfermedad diverticular no complicada El examen físico revela dolor en el cuadrante abdominal inferior izquierdo, con grados variables de resistencia muscular y de hiperestesia. Ocasionalmente, es posible palpar un plastrón. Las heces pueden contener trazas de sangre, siendo inusual el sangrado macroscópico. Se encuentran presentes la inflamación localizada del divertículo inflamado y del mesenterio adyacente, y puede estar presente un flegmón. Dependiendo de la severidad de los síntomas, el paciente puede ser manejado de manera ambulatorio o ser ingresado para terapéutica intrahospitalaria. Enfermedad diverticular complicada En paciente con absceso pericólico puede encontrarse un plastrón o una masa en la exploración abdominal, pélvica o rectal. En pacientes con fístula colovaginal, se observa tejido de granulación en el ápex de la cúpula vaginal. En un paciente con obstrucción, puede haber distensión abdominal importante, generalmente de instalación lenta y progresiva; la hiperestesia puede o no estar presente, pero si hay desgarros en la tenia cecal, es común que se presente en el cuadrante inferior derecho. En pacientes con perforaciones libres, hay hiperestesia e hiperbaralgesia marcadas, generalmente iniciando de manera súbita en el cuadrante inferior izquierdo e irradiándose conforme pasan las horas hacia la totalidad del abdomen. Pueden desarrollarse hipotensión y oliguria de manera posterior. Pacientes con rectorragia (o hematoquezia) generalmente no muestran datos de dolor abdominal, predominando la hipotensión y la hipovolemia, dependiendo del grado de sangrado. EXÁMENES AUXILIARES Estudios de imagen El estudio de imagen más confiable ante la sospecha de diverticulitis aguda es la TAC abdominal con contraste oral y rectal36. Los datos sugestivos de diverticulitis son el engrosamiento local de la pared intestinal o la inflamación de la grasa pericólica adyacente; es posible encontrar aire libre en cavidad o colecciones líquidas (Figura 14). Los hallazgos más frecuentes (encontrados en 70 a 100% de los casos) son engrosamiento de la pared visceral, divertículos e inflamación de la grasa37. En algunos casos no es posible detectar abscesos pequeños en el mesocolon o en la pared intestinal. El diagnóstico de neoplasia no se puede excluir por completo cuando hay engrosamiento de la pared intestinal (Figura 15)13. Figura 14. Enfermedad diverticular del colon. Tomografía Axial abdominal donde se evidencia engrosamiento de la 96 pared del colon sigmoides (flecha). Tomado de Wolff BG, 2007 Hay datos tomográficos sugestivos de enfermedad diverticular moderada y severa, como se muestra en la Tabla 1: Diverticulitis aguda moderada Diverticulitis aguda severa Engrosamiento de la pared (mayor de Aire libre 4mm) Absceso pericólico o a distancia Inflamación de la grasa pericólica: Obstrucción Hipervascularización Extravasación de contraste Edema Peritonitis difusa 92 Tabla 1. Datos tomográficos de diverticulitis moderada y severa . Aunque la TAC abdominal ha tendido a reemplazar los estudios contrastados en el diagnóstico de la enfermedad diverticular, éstos últimos pueden ser más útiles para diferenciar la enfermedad diverticular de una neoplasia. Un estudio contrastado también puede ser complementario cuando en la TAC surge la sospecha de una probable neoplasia36. Cuando se sospecha enfermedad diverticular debe utilizarse material de contraste hidrosoluble en lugar de bario, debido a las complicaciones propias de la extravasación del bario (Figuras 16 y 17). En la situación aguda, sólo debe evaluarse el colon izquierdo. Las neoplasias se sospechan al encontrar una transición abrupta hacia una mucosa anormal sobre un segmento relativamente corto de intestino; la diverticulitis generalmente presenta una transición gradual hacia el colon afectado en un segmento largo del mismo, con la mucosa remanente normal. Si el estudio contrastado revela extravasación del contraste delineando un absceso, un trayecto fistular intramural o una fístula, es más frecuente que se deba a enfermedad diverticular11. La colonoscopia se evita cuando se sospecha diverticulitis aguda, debido al riesgo de perforación. Puede realizarse 6 a 8 semanas posteriores a la resolución del evento agudo para descartar otras patologías (Figura 18). Si la enfermedad diverticular está avanzada, el procedimiento endoscópico puede ser difícil; el segmento diverticular debe ser evaluado en su totalidad para excluir una neoplasia con seguridad. Figura 15. Tomografía Axial abdominal. En la figura de la izquierda, la flecha indica engrosamiento de la pared intestinal y un divertículo. El diagnóstico más probable era diverticulitis. En la figura de la derecha, la flecha muestra deformidad de la mucosa, con una lesión en “corazón de manzana”. La endoscopia subsecuente demostró un 96 carcinoma que obstruía el colon casi en su totalidad. Tomado de Wolff BG, 2007 Figura 16. El estudio contrastado muestra extravasación del colon sigmoides (flecha); se observa también un 96 divertículo. Tomado de Wolff BG, 2007 Figura 17. Se observa extravasación hacia la cavidad de un absceso por diverticulitis en la unión del colon descendente con el sigmoides. Tomado de Wolff BG, 2007 96 En el caso de sangrado de tubo digestivo bajo, la colonoscopia se enfoca a la búsqueda de pólipos, neoplasia o hemorragia diverticular. En caso de sangrado masivo es útil la arteriografía selectiva para localizar la fuente de sangrado y realizar una embolización superselectiva. El riesgo actual de isquemia es bajo cuando se realizan técnicas superselectivas. El sangrado durante la arteriografía puede facilitarse con la administración de heparina o urokinasa; sin embargo, este abordaje es riesgoso y sólo debe utilizarse si se han agotado otros medios para localizar el sitio de sangrado. La angiografía es útil en casos de sangrado con volúmenes entre 0.5 y 1 ml por minuto, mientras que la gammagrafía con eritrocitos marcados detecta sangrados con volúmenes de 0.1 ml por minuto. Figura 18. Colonoscopia con demostración de múltiples divertículos sin datos macroscópicos de complicación o 96 agudización. Tomado de Wolff BG, 2007 Si hay una fístula colovesical, la TAC pélvica contrastada con cortes finos es muy útil. Los hallazgos clásicos son divertículos sigmoideos, engrosamiento de la vejiga y el colon, aire en la vejiga, opacificación del trayecto fistuloso y la vejiga con el contraste y, posiblemente, un absceso. La cistoscopia es menos específica, mostrando probable edema o eritema en el sitio de la fístula. Un enema contrastado ayuda a descartar malignidad. Las pruebas más útiles para diagnosticar fístulas colovaginales, son la TAC contrastada y la vaginografía con sonda de Foley. En raras ocasiones, se desarrollan fístulas colocutáneas, causando eritema y ruptura cutánea. También se pueden desarrollar fístulas colouterinas, las cuales son bastante raras. DIAGNÓSTICO DIFERENCIAL El diagnóstico diferencial incluye síndrome de Intestino Irritable, neoplasia, Enfermedad Intestinal Inflamatoria, apendicitis, obstrucción intestinal, colitis isquémica, padecimientos ginecológicos y padecimientos urinarios. Quizá el Síndrome de Intestino Irritable sea el más difícil de diferenciar. Síndrome de intestino irritable (SII) Debido a la prevalencia de la enfermedad diverticular, muchos pacientes con SII tienen enfermedad diverticular concomitante. Sin embargo, debido a que la enfermedad diverticular es generalmente asintomática, la diverticulosis en estos pacientes no siempre es la causante de los síntomas, sino un confusor en el diagnóstico diferencial. Se deben conocer los criterios de Roma II para diagnosticar SII para clarificar el diagnóstico diferencial. Criterios de Roma II para diagnóstico de SII Molestia o dolor abdominal de por lo menos 12 semanas de evolución (aunque no sean consecutivas) en los últimos 12 meses que tienen dos o tres de las siguientes características: 1. Mejora con la defecación; y/o 2. El inicio se asocia con cambios en la frecuencia de las evacuaciones; y/o 3. El inicio se asocia con cambios en la forma (apariencia) de las evacuaciones Síntomas que de manera cumulativa soportan el diagnóstico de SII: 1. Frecuencia anormal de evacuaciones (>3 por día o <3 por semana) 2. Forma anormal de evacuaciones (pastosa/dura o laxa/acuosa) 3. Paso anormal de las evacuaciones (estreñimiento, urgencia, sensación de vaciado incompleto); 4. Evacuación de moco 5. Sensación de distensión abdominal Síntomas de cuidado que no son típicos de SII: 1. 2. 3. 4. 5. 6. Dolor que generalmente despierta o interfiere con el sueño Diarrea que usualmente despierta o interfiere con el sueño Sangrado en las heces (oculto o visible) Pérdida de peso Fiebre Examen físico anormal Neoplasia de colon Distinguir la enfermedad diverticular de la neoplasia puede ser difícil. Las técnicas de imagen pueden dar apoyo significativo para la distinción entre las dos patologías, pero ocasionalmente es necesaria una resección para tener certeza. Varias características del colon por enema sugieren el diagnóstico de enfermedad diverticular, como preservación de la mucosa, estenosis largas y presencia de divertículos. Se prefiere el colon por enema para determinar la extensión de la enfermedad previo al planteamiento de la resección. Aunque la colonoscopia puede determinar la extensión de la enfermedad, no siempre es posible el avance de la misma en angulaciones importantes o estenosis de la luz intestinal. La TAC evalúa la totalidad del abdomen, pudiendo identificar enfermedades concurrentes y dando datos que sugieran patologías colónicas subyacentes. Se ha observado un aumento paralelo entre la incidencia de neoplasia de colon y la edad. Debe considerarse la presencia de pólipos y neoplasia al iniciar un protocolo de estudio de enfermedad diverticular. Se han reportado casos de adenocarcinoma que surgen en presencia de divertículos87. Ya que los divertículos tienen sólo la capa mucosa y serosa, la infiltración avanzada es común en los casos de neoplasia asociada, presentando estados avanzados aún con lesiones pequeñas. En una revisión del Registro Sueco del Cáncer, los pacientes con diverticulitis tuvieron un mayor riesgo a largo plazo de desarrollo de neoplasia del colon izquierdo al compararse con diverticulosis asintomática (riesgo relativo = 4.2)88, 89, 90. Enfermedad inflamatoria del Colon La enfermedad de Crohn puede ser particularmente difícil de diferenciar de la enfermedad diverticular. Ambas se pueden presentar con complicaciones similares, como fístulas, flegmones y abscesos. La afección rectal, la enfermedad anal, los datos extracolónicos y el sangrado, sugieren enfermedad de Crohn. “Diverticulitis recurrentes”, que requieren resecciones repetidas, deben siempre sugerir el involucro de la enfermedad de Crohn91. La colitis ulcerativa generalmente no causa problemas como diagnóstico diferencial de la enfermedad diverticular; el sangrado y una endoscopia mostrando afección rectal, generalmente son suficientes para la diferenciación entre ambas patologías. TRATAMIENTO Dieta y Manejo Médico El manejo inicial de la enfermedad diverticular asintomática es la dieta. El objetivo de la modificación de la dieta es aumentar el volumen de las heces, así como la disminución de su consistencia, con disminución en el tiempo del tránsito intestinal y disminución de la presión intraluminal. Todas estas medidas disminuyen la segmentación, factor asociado al desarrollo de la enfermedad diverticular. La cantidad ideal de fibra se desconoce; sin embargo, la recomendación diaria es de 20 a 30 gr. En general, la fibra puede obtenerse al ingerir alimentos ricos en fibra o con suplementos alimenticios. La evidencia muestra una disminución importante en el desarrollo de diverticulosis, aunque no se ha demostrado en realidad una disminución en la frecuencia de presentación de diverticulitis o de sus complicaciones38-41. En casos de diverticulitis aguda, y en ausencia de signos y síntomas sistémicos (fiebre, leucocitosis marcada, taquicardia e hipotensión), la mayoría de los pacientes responderán a un régimen de reposo intestinal y antibióticos de manera ambulatoria. La dieta generalmente se restringe a bajo residuo o líquidos claros durante la fase aguda de la enfermedad pero, al resolverse los síntomas agudos, se debe instalar una dieta rica en fibra. No hay necesidad de prohibir la ingesta de semillas, ya que no hay evidencia que marque una mejor evolución con respecto a esta práctica. Se deben instalar antibióticos adecuados para incluir cobertura de Gram – negativos y anaerobios. Los microorganismos predominantes en los cultivos de abscesos diverticulares agudos y de líquido de peritonitis incluyen bacterias aerobias facultativas como Escherichia coli y Streptococcus spp. Los anaerobios más comúnmente aislados incluyen Bacteroides spp. (B. fragilis), Peptostreptococcus, Clostridium y Fusobacterium spp 42. En general, se utilizan dos pautas antimicrobianas: la monoterapia con ertapenem o la combinación de metronidazol con alguna cefalosporina de tercera generación o una quinolona, ambos esquemas a dosis estándares. El uso de anticolinérgicos como terapia adyuvante se basa en la disminución teórica del dolor relacionado al espasmo y a la hipermotilidad del colon sigmoides. No se ha comprobado eficacia con esta conducta. Los aminosalicilatos poseen un amplio espectro de actividad antiinflamatoria y además interfieren en la interacción de las bacterias intestinales con las células epiteliales. Actualmente hay protocolos de estudio con empleo de mesalazina y probióticos en la prevención de ataques recurrentes de diverticulitis; en específico, se ha observado tendencia en la prevención de ataques recurrentes mediante la asociación de mesalazina y Lactobacillus casei. Los signos que sugieren una enfermedad más severa incluyen leucocitosis importante, fiebre, taquicardia o hipotensión, así como una exploración física que demuestra una patología intraabdominal más avanzada; todo esto obliga la hospitalización del paciente para su manejo intrahospitalario. A los pacientes ingresados generalmente se les realiza una TAC abdominal para confirmar el diagnóstico, descartar otras posibilidades diagnósticas y evaluar posibles complicaciones que pudieran modificar el manejo establecido inicialmente43. Se deben administrar antibióticos intravenosos. El paciente generalmente es dejado en ayuno hasta que se observe mejoría clínica y se descarta la intervención quirúrgica como manejo inicial. La dieta es gradualmente progresada hasta lograr altas cantidades de fibra. Los síntomas generalmente remiten en 24-72 hrs. La falla en la mejoría clínica debe obligar a una revaloración, inclusive a realizar una nueva TAC abdominal para valorar una probable intervención quirúrgica o drenaje de absceso. El empeoramiento del paciente, especialmente con datos de peritonitis, debe hacer pensar en un manejo quirúrgico de urgencia. Manejo quirúrgico El manejo quirúrgico de la enfermedad diverticular tiene varias opciones, ante lo cual se debe individualizar al paciente de acuerdo a sus necesidades. El cirujano general debe conocer estas opciones así como sus indicaciones para el manejo del caso en específico. El objetivo siempre será el manejo de un paciente complejo de modo que se maximice la oportunidad de realizar un procedimiento electivo definitivo en lugar de una cirugía de urgencia. La opciones quirúrgicas incluyen resección primaria con anastomosis con o sin desfuncionalización proximal, resección con colostomía proximal y sutura del muñón rectal (procedimiento de Hartmann) o fístula mucosa (procedimiento de Mikulicz), desfuncionalización con drenaje de absceso, cierre primario con desfuncionalización proximal y, raramente, colectomía subtotal. Otras medidas incluyen lavado de cavidad transoperatorio y la opción de un abordaje laparoscópico. La discusión histórica de estas opciones incluye el abordaje en tres etapas con desfuncionalización y drenaje, seguido de resección y un tercer procedimiento para restablecer el tránsito intestinal. Una modificación de este abordaje incluye la sutura primaria del sitio de perforación con colocación de un parche de epiplón como parte de la cirugía inicial44. Las alternativas incluyen el abordaje en dos tiempos, con procedimiento de Hartmann o Mikulicz seguido de un segundo procedimiento quirúrgico para restablecer el tránsito intestinal y con resección con anastomosis primaria, con o sin desfuncionalización proximal en el mismo procedimiento. En general, las discusiones actuales se basan en las ventajas de un procedimiento de una sola etapa contra procedimientos en dos etapas en casos agudos que requieren una cirugía de emergencia 4547 . El abordaje en tres etapas se utiliza de manera excepcional y se reserva para pacientes sumamente inestables48, 49. Para el paciente con absceso intraabdominal, hay gran cantidad de evidencia que apoya las ventajas del drenaje percutáneo y con respecto a la conversión de una cirugía de emergencia, con sus incrementos en morbilidad y mortalidad, con respecto a la realización de una cirugía electiva43,50. En general, los abscesos menores de 5cm responden a tratamiento médico, mientras que los mayores a esta dimensión, deben ser manejados inicialmente con drenaje percutáneo 95. De manera similar, un absceso intraabdominal que no responde a tratamiento médico debe ser drenado de manera percutánea o transrectal, dependiendo de su localización (Figura 19). Figura 19. A) Un absceso diverticular en hueco pélvico. B) El mismo absceso posterior a drenaje percutáneo 96 quiado por TAC. Modificado de Wolff BG, 2007 Si el drenaje no puede realizarse de manera no quirúrgica (por acceso riesgoso por situación anatómica) o si el drenaje es realizado pero no mejora la sintomatología sistémica, se indica el procedimiento quirúrgico. En general, este escenario estaría representado por un Hinchey II avanzado. Aunque es posible que los hallazgos transoperatorios aboguen por una resección con anastomosis con o sin desfuncionalización proximal, es más probable que se requiera un procedimiento de Hartmann. Indicaciones para cirugía de enfermedad diverticular aguda Las indicaciones para cirugía de la enfermedad aguda incluyen: 1. Falla al tratamiento médico, incluyendo un flegmón persistente, falla del drenaje percutáneo o transrectal de un absceso o fiebre en incremento, leucocitosis, taquicardia, hipotensión, signos de sepsis o una exploración física en peores condiciones. 2. 3. 4. 5. Perforación libre con peritonitis. Obstrucción que no se resuelve con tratamiento conservador. Fístula. Imposibilidad de excluir un carcinoma La perforación sin peritonitis puede no requerir intervención quirúrgica de emergencia. Procedimientos quirúrgicos Para la enfermedad aguda, la elección del evento quirúrgico depende en gran medida de la respuesta inflamatoria encontrada en el momento de la cirugía. Debido a que la gran mayoría de los eventos agudos pueden manejarse de manera conservadora (incluyendo el drenaje percutáneo de la mayoría de los abscesos), el hecho de que se requiera una cirugía de emergencia sugiere avance de la enfermedad y la necesidad de ser conservadores. En general, la mayoría de los Hinchey tipo I y algunos tipo II pueden manejarse con un procedimiento en una etapa (resección y anastomosis) si el paciente se encuentra estable, la contaminación es limitada y es posible realizar una adecuada preparación intestinal45, 50, reconociendo, sin embargo, que la preparación del colon en resecciones electivas ha sido recientemente cuestionada51. La desfuncionalización proximal puede ser adecuada. La mayoría de los casos de Hinchey tipos III y IV requieren un abordaje en dos etapas. Hay evidencia reciente que sugiere resección y anastomosis en pacientes muy seleccionados con peritonitis fecal extensa45, 48. Existen criterios absolutos y relativos a considerar para la decisión de la realización de una anastomosis primaria, los cuales son: Criterios absolutos o Inestabilidad hemodinámica o Peritonitis fecal avanzada o ASA IV Criterios relativos o Inmunosupresión o Obesidad o Insuficiencia renal aguda o Insuficiencia respiratoria aguda Una desventaja importante del procedimiento en dos etapas es que en 35 – 45% de los pacientes nunca se cerrará la colostomía52, 53. Sin embargo, en pacientes con incontinencia preexistente, el procedimiento de Hartmann debe ser el procedimiento de elección. Para los pacientes a los cuales no se les cierra la colostomía, debe vigilarse el muñón rectal para el desarrollo de neoplasia, ya que esta porción tiene el mismo riesgo de desarrollo de neoplasia que el resto del colon54. Con respecto al sangrado asociado a la enfermedad diverticular, más del 85% ceden con simples medidas de apoyo. El tratamiento quirúrgico se indica con persistencia de hemorragia (manifestada por necesidad de más de 3 paquetes globulares en 24h por dos días o más) o cuando el sangrado recurre. Es indispensable localizar el sitio de sangrado para hacer la resección de la porción afectada con anastomosis en un mismo procedimiento. Se calcula una tasa de mortalidad de 40% asociada a las colectomías “a ciegas”, con una tasa de resangrado de hasta 60%. Sin embargo, en la enfermedad diverticular que se extiende a lo largo de todo el colon, puede ser recomendable la colectomía total abdominal, con anastomosis ileorrectal, para disminuir la morbilidad vinculada al resangrado. 94. Complicaciones de la resección y anastomosis Los factores pronósticos de complicación de la resección de la enfermedad diverticular incluyen: edad avanzada (mayor de 70-75 años), dos o más comórbidos asociados, constipación en el examen inicial, uso de esteroides, sepsis, obesidad 48, 55, 56 y resección de emergencia en lugar de electiva. Las complicaciones de la resección incluyen fuga de anastomosis y hemorragia. La prevalencia de fuga de anastomosis intraperitoneal baja se considera entre 2 y 5%57. Dicha fuga puede llevar a sepsis localizada o sistémica sin un absceso, un absceso con o sin sepsis, peritonitis y estenosis. El diagnóstico depende de un alto índice de sospecha por el cirujano y una rápida respuesta ante cualquier signo inusual de sepsis. La presencia de fiebre, dolor abdominal vago, diarrea, síntomas obstructivos, oliguria, íleo posoperatorio prolongado y sepsis deben hacer pensar en fuga de la anastomosis. El diagnóstico se confirma con un enema con contraste hidrosoluble y/o una TAC abdominal con contraste intravenoso, oral o rectal. Una fuga controlada sin absceso puede manejarse en la mayoría de los casos con antibióticos intravenosos. La extravasación del medio de contraste, la falla de respuesta al tratamiento en 24-48 horas o sepsis severa inicial o peritonitis obligan a exploración quirúrgica, resección de la anastomosis y desfuncionalización proximal. La reparación de la anastomosis con desfuncionalización proximal generalmente es insatisfactoria por el alto riesgo de recurrencia de la fuga por el estado inflamatorio del tejido. Una excepción sería una fuga puntiforme con respuesta inflamatoria limitada, que puede ser manejada con reparación, lavado colónico y desfuncionalización proximal. Una fuga que resulta en un absceso puede manejarse generalmente con drenaje percutáneo o transrectal. Nuevamente, la falla de respuesta al tratamiento requiere laparotomía, desmantelamiento de la anastomosis y desfuncionalización proximal. La fístula se presenta en 5 – 10% de los casos, siendo la más frecuente la fístula colovesical93. Una fístula colocutánea relacionada a una resección diverticular generalmente responderá a un tratamiento no quirúrgico. Pensando que no hay obstrucción distal o cuerpo extraño y que la enfermedad de Crohn no fue la causante de lo síntomas originales, se espera un cierre espontáneo. Pasos importantes para facilitar éste cierre incluyen drenaje de cualquier absceso no drenado, atención de las necesidades nutricionales y cuidado apropiado de las heridas. La estenosis es una complicación rara relacionada a la resección diverticular a menos que la patología de base sea la enfermedad de Crohn. En el caso raro que se presente la estenosis, las etiologías probables incluyen isquemia o sepsis localizada por una fuga de anastomosis. Dichas estenosis pueden ser manejadas con dilatación con un balón hidrostático o con un proctoscopio rígido, pero ocasionalmente requerirán reconstrucción de la anastomosis. Se reportan lesiones ureterales en 1 a 10% de las cirugías abdominales58. La identificación temprana de cualquier lesión es fundamental para prevenir una morbilidad importante. A pesar de que los stents ureterales no han mostrado una disminución en la tasa de lesiones, si mejoran la identificación transoperatoria de los uréteres y la identificación temprana de cualquier lesión ureteral59. La decisión de colocar stents ureterales antes de la cirugía debe realizarse en función de la sospecha clínica y la extensión de la inflamación retroperitoneal visible en la TAC abdominal. Indicaciones de cirugía para enfermedad recurrente y crónica. Pacientes como episodios múltiples y recurrentes de diverticulitis aguda documentados por TAC deben ser considerados para resección. Los parámetros de la sociedad americana de cirujanos de colon y recto indican que debe considerarse una resección electiva después de uno o dos ataques de diverticulitis bien documentados, dependiendo de la severidad del ataque y la edad y condición médica del paciente. Pacientes con diverticulitis complicada deben ser considerados para resección después de un primer ataque60. La meta es realizar una operación electiva en lugar de una operación emergente. Esto requiere una predicción adecuada de aquellos pacientes que de manera más probable terminen con una complicación seria como resultado de su enfermedad. Una sugerencia ha sido resecar después de un episodio de diverticulitis en pacientes jóvenes (generalmente menores de 40 - 50 años). No cabe duda que la edad por si misma debiera ser una consideración primaria al tomar la decisión de operar. La literatura se mezcla entre propuestas de un manejo más agresivo de la enfermedad en pacientes jóvenes61-67 y aquellos que creen que la edad por sí misma no aumenta de manera significativa el riesgo 68-75. La evidencia tomográfica de enfermedad complicada o “severa” ha sido uno de esos criterios que predicen el riesgo. La presencia de absceso, aire extraluminal y contraste extraluminal se han asociado con un incremento en el riesgo de mala evolución con el tratamiento médico independientemente de la edad76,77. Otro intento es identificar grupos específicos de pacientes que se encuentran con un riesgo incrementado. Los pacientes inmunocomprometidos son un grupo que se encuentra en un riesgo particular de mala evolución78. El riesgo se atribuye a una mayor incidencia de perforación libre y complicaciones inflamatorias más severas cuando ocurre la perforación. Como ejemplo, los pacientes con enfermedad renal poliquística autosómica dominante sometidos a trasplante renal son un grupo de riesgo muy elevado79-82. Se recomienda resección profiláctica en dichos pacientes con historia de cualquier diverticulitis. Los pacientes sometidos a resección por enfermedad crónica casi siempre serán candidatos a una resección de una etapa con anastomosis primaria. Si se encuentra afectada solo una porción del sigmoides, se recomienda realizar la sigmoidectomía total con anastomosis primaria (si el caso lo permite) ya que el sigmoides es la porción más frecuentemente afectada y el sitio donde las recurrencias son más frecuentes (inclusive después de la anastomosis); el margen proximal de sección deberá realizarse en tejido sano (es decir, sin datos de inflamación) a pesar de encontrarse más divertículos proximales al sitio de sección; la importancia radica en asegurar que no existan divertículos en la línea de anastomosis. De manera adicional, los pacientes que regresan a cierre de colostomía después de drenaje y desfuncionalización inicial, desfuncionalización con cierre primario de la perforación, o desfuncionalización con resección con procedimiento de Hartmann o Mikulicz, pueden ser manejados típicamente con solo una cirugía adicional. Las complicaciones relacionadas por enfermedad crónica son paralelas a las descritas por la enfermedad aguda. De manera adicional una complicación observada en la enfermedad crónica es la falla para brindar mejoría sintomática. Esto generalmente resulta por pasar por alto diagnósticos como enfermedad de Crohn o Síndrome de intestino irritable. Cualquier “recurrencia” de los síntomas después de la resección por diverticulitis crónica debe hacer pensar en esta posibilidad. La presencia de síntomas intestinales funcionales preoperatorios en este grupo de pacientes se ha asociado con pobres resultados funcionales posoperatorios83. Técnicas para resección adecuada Las guías de práctica de la Sociedad Americana de Cirujanos de Colon y Recto sugieren varias recomendaciones sobre la resección en la enfermedad diverticular. Para resecciones electivas, debe ser removido todo el colon afectado que presente pared engrosada, pero no necesariamente todo el colon proximal que tenga divertículos. Puede ser aceptable conservar colon proximal con divertículos, siempre y cuando el colon no se encuentre hipertrófico o con datos de inflamación aguda. Todo el colon sigmoides debe ser removido. Cuando se opte por anastomosis, debe hacerse entre porciones sanas de colon proximal y recto y debe ser libre de tensión y estar bien vascularizada84. El predictor de recurrencia más importante después de una sigmoidectomía por enfermedad diverticular no complicada es una anastomosis al sigmoides distal en lugar de realizarla al recto 85. CONCLUSIONES La enfermedad diverticular del colon es una entidad que ha mostrado un incremento importante en su incidencia; es evidente que la incidencia real no puede ser estimada, ya sea por falta de diagnóstico adecuado o por la presencia únicamente de diverticulosis. Se han observado factores que incrementan la incidencia de la enfermedad, tales como la baja ingesta de fibra en la dieta, la obesidad, la ingesta de medicamentos (como los AINE’s), el sedentarismo y, probablemente se asocien trastornos estructurales y de la motilidad del colon, haciendo que sea considerada una enfermedad multifactorial. El diagnóstico oportuno y adecuado llevará a una mejor valoración de los pacientes, así como a un correcto manejo, ya sea conservador o quirúrgico (Anexo 1). Es imperativo contar con la sospecha clínica, así como con los elementos imagenológicos suficientes para poder clasificar al paciente (en específico, la tomografía axial computada) (Anexo 1). En el panorama del paciente con enfermedad complicada (entiéndase clasificación de Hinchey III y IV, o pacientes Hinchey II que progresan y que no responden a tratamiento conservador) no existe duda que el abordaje debe ser quirúrgico y con carácter de Urgente (Anexo 2). En estos casos, la evidencia demuestra que el mejor procedimiento es el la cirugía en dos etapas, llámese procedimiento de Hartmann o procedimiento de Mikulicz, para una reinstalación posterior. Quizá la controversia se presente en el seguimiento de los pacientes con enfermedad complicada en clasificación de Hinchey I y II que tienen adecuada respuesta al tratamiento. En estos casos, está indicada una colonoscopia posterior al evento agudo, con el fin de corroborar el diagnóstico y descartar alguna patología agregada (en específico, neoplasia) (Anexo 1). Ya que la edad ha dejado de ser indicación categórica para realizar un procedimiento quirúrgico definitivo, es imperativo individualizar cada caso, analizando si el paciente tiene comórbidos agregados o no, así como su edad y su expectativa de vida, con el fin de otorgar un manejo ya sea conservador (con tratamiento para prevenir recurrencias de ataques agudos) o quirúrgico (disminuyendo en lo posible la morbimortalidad asociada), todo con el fin de mejorar la calidad de vida del paciente. En el caso de presentarse complicaciones propias de la enfermedad diverticular (como absceso, estenosis, fístula o hemorragia), se deberá individualizar cada caso en particular, dependiendo obviamente de la complicación de la que se trate. Cada una de las complicaciones amerita una evaluación y manejo en específico, los cuales pueden englobarse en los Anexos 3 y 4. ANEXO 1 – FLUJOGRAMA DE DECISIONES Anexo 1. Abordaje diagnóstico inicial. El paciente debe contar con un adecuado interrogatorio y una adecuada exploración física para sospechar el diagnóstico. Se debe solicitar TAC abdominal con contraste oral y rectal a fin de identificar probables complicaciones que ameriten resolución quirúrgica urgente. En caso de ser un cuadro leve y tener adecuada respuesta al tratamiento médico, se deberá dar seguimiento ambulatorio para confirmar el diagnóstico mediante colonoscopia o estudios de contraste para valorar una probable resolución quirúrgica (dependiendo del caso individualizado). ANEXO 2 – FLUJOGRAMA DE DECISIONES Anexo 2. Valoración del paciente con datos tomográficos de diverticulitis severa. Una vez contando con el estudio tomográfico adecuado, es posible la Estadificación de la diverticulitis de acuerdo a la clasificación de Hinchey. Los casos clasificados como Hinchey I y II, son tributarios de tratamiento médico conservador inicial. Si la respuesta al tratamiento médico es favorable, el paciente puede continuar con su estudio de forma ambulatoria; si no hay respuesta satisfactoria al tratamiento médico, deberá valorarse una intervención quirúrgica de emergencia. Si el estudio tomográfico clasifica al paciente como Hinchey III o IV, se deberá realizar una intervención quirúrgica urgente, decidiendo el procedimiento de acuerdo a los hallazgos transoperatorios e individualizando cada caso en particular. ANEXO 3 – FLUJOGRAMA DE DECISIONES Anexo 3. Complicaciones de la enfermedad diverticular. El absceso intraabdominal será valorado de acuerdo a sus dimensiones; menores de 5cm son tributarios de manejo conservador; mayores de 5cm son tributarios de drenaje percutáneo inicial. La obstrucción intestinal secundaria es tributaria a tratamiento médico inicial, individualizando el caso en específico. ANEXO 4 – FLUJOGRAMA DE DECISIONES Anexo 4. Complicaciones de la enfermedad diverticular. La fístula deberá ser evaluada de acuerdo a los órganos involucrados y requieren tratamiento individualizado. La hemorragia puede manejarse inicialmente de forma conservadora; si el manejo no surte el efecto deseado, se deberá valorar angiografía y realizar intervención quirúrgica según sea el caso. BIBLIOGRAFÍA 1. Stollman NH, Raskin JB: Diverticular disease of the colon. J Clin Gastroenterol 29:241, 1999 2. Williams PL. Anatomy of the colon en: Williams PL (ed). Gray's Anatomy (37th ed). Churchill Livingstone. Edinburg, 1989: 1774-1787. 3. Goligher JC. Surgical anatomy of the colon, rectum and anal canal en: Turell R (ed). Diseases of the Colon and Anorectum (2nd ed). WB Saunders. Philadelphia, 1969. 4. Saunders BP, Phillips RK, Williams CB. Intraoperative measurement of colonic anatomy and attachments with relevance to colonoscopy. Br J Surg 1995;82:14911493. 5. Steward J, Rankin FW. Blood supply of the large intestine: Its surgical considerations. Arch Surg 1933;26:843. 6. Furst H, Hartl WH, Lohe F, Schildberg FW. Colon interposition for esophageal replacement: an alternative technique based on the use of the right colon. Ann Surg 2000;231:173-178. 7. Griffiths JD. Surgical anatomy of the blood supply of the distal colon. Ann R Coll Surg 1956;19:241-256. 8. Michels NA, Siddharth P, Kornblith PL, Parke WW. The variant blood supply to the small and large intestine: its import in regional resections. J Int Coll Surg 1963;39:127 9. Goligher JC. Surgery of the Anus, Rectum and Colon (4th ed). Baillière Tindall. London, 1980. 10. Guyton AC, Hall JE. Textbook of Medical Physiology (9th ed). WB Saunders Co. Philadelphia, 1996. 11. Shafik A. Sigmoido-rectal junction reflex: role in the defecation mechanism. Clin Anat 9:391-394, 1996. 12. Stollman NH, Raskin JB: Diverticular disease of the colon. J Clin Gastroenterol 29:241, 1999 13. Ferzoco LB, Raptopoulos V, Silen W: Acute diverticulitis. N Engl J Med 338:1521, 1998 14. Kang JY, Hoare J,Tinto, et al: Diverticular disease of the colon. Aliment Pharm Therap 17:1189, 2003 15. Somasekar K, Foster ME, Haray PN. The natural history diverticular disease: is there a role for elective colectomy? J R Coll Surg Edinb 2002;47:481–484. 16. Roberts PL, Veidenheimer MC. Current management of diverticulitis. Adv Surg 1994;27:189–208. 17. Makela J, Kiviniemi H, Laitinen S: Prevalence of perforated sigmoid diverticulitis is increasing. Dis Colon Rectum 45:955, 2002 18. Fisher N, Berry CS, Fearn T, et al: Cereal dietary fiber consumption and diverticular disease: a lifespan study in rats. Am J Clin Nutr 43:788, 1985 19. Whiteway J, Morson BC: Elastosis in diverticular disease of the sigmoid colon. Gut 26:258, 1985 20. Pemberton JH, Armstrong DN, Dietzen CD. Diverticulitis en: Yamada T (ed). Textbook of Gastroenterology (2 nd ed). JB Lippincott Co, Philadelphia, 1995 21. Alsoori WH, Giovannucci EL, Rimm EB, et al: Prospective study of physical activity and the risk of symptomatic diverticular disease in men. Gut 36:276, 1995 22. Goh H, Bourne R: Non-steroidal anti-inflammatory drugs and perforated diverticular disease: a case-control study. Ann R Coll Surg Engl 84:93, 2002 23. Morris CR, Harvey IM, Stebbing WS, et al: Epidemiology of perforated colonic diverticular disease. Postgrad Med J 78:654, 2002 24. Papagrigorladis S, Macey L, Bourantas N, et al: Smoking may be associated with complication in diverticular disease. Br J Surg 86:923, 1999 25. Pereira MA, Ludwig DS: Dietary fiber and body weight regulation: observations and mechanisms. Pediatr Clin North Am 48:969, 2001 26. Chapman J, et al. Complicated diverticulitis. Is it time to rethink the rules? Ann Surg 242:576, 2005 27. Welch JP, Cohen JL. Diverticulitis en: ACS surgery: principles and practice. Web MD, 2006. 28. McConnell EJ, Tessier DJ, Wolff BG: Population based incidence of complicated diverticular disease of the sigmoid colon based on gender and age. Dis Colon Rectum 46:1110, 2003 29. Hughes LE: Complications of diverticular disease: inflammation, obstruction and bleeding. Clin Gastroenterol 4:147, 1975 30. McGuire HH: Bleeding colonic diverticula: a reappraisal of natural history and management. Ann Surg 220:653, 1994 31. Hinchey GC, Schall GH, Richards MB: Treatment of perforated diverticulitis of the colon. Adv Surg 12:85, 1978 32. Woods RJ, Lavery IC, Fazio VW, et al: Internal fistulas in diverticular disease. Dis Colon Rectum 31:591, 1988 33. Morgenstern L: “Malignant” diverticulitis: a clinical entity. Arch Surg 114:1112, 1979 34. Sanford MB, Ryan JA Jr. The proper surgical treatment of perforated sigmoid diverticulitis with generalized peritonitis en: Welch JP (ed). Diverticular Disease: Management of the Difficult Surgical Case. Williams & Wilkins, Baltimore, 1998 35. Schwesinger WH, Page CP, Gaskill HV III, et al: Operative management of diverticular emergencies: strategies and outcomes. Arch Surg 135:558, 2000 36. Ambrosetti P, Jenny A, Becker C, et al: Acute left colonic diverticulitis—compared performance of computed tomography and water-soluble contrast enema: prospective evaluation of 420 patients. Dis Colon Rectum 43:1363, 2000 37. Kircher MF, Rhea JT, Kihiczak D, et al: Frequency, sensitivity, and specificity of individual signs of diverticulitis on thin-section helical CT with colonic contrast material: experience with 312 cases. AJR Am J Roentgenol 178:1313,2002 38. Aldoori W, Ryan-Harshman M. Preventing diverticular disease. Review of recent evidence on high-fibre diets. Can Fam Physician 2002;48:1632–1637. 39. Aldoori WH, Giovannucci EL, Rockett HR, et al. A prospective study of dietary fiber types and symptomatic diverticular disease in men. J Nutr 1998;128:714–719. 40. Aldoori WH, Giovannucci EL, Rimm EB, et al. Prospective study of physical activity and the risk of symptomatic diverticular disease in men. Gut 1995;36:276–282. 41. Marlett JA, McBurney MI, Slavin JL. Position of the American Dietetic Association: health implications of dietary fiber. J Am Diet Assoc 2002;102:993–1000 42. Brook I, Frazier EH. Aerobic and anaerobic microbiology in intra-abdominal infections associated with diverticulitis. J Med Microbiol 2000;49:827–830. 43. Hachigian MP, Honickman S, Eisenstat TE, et al. Computed tomography in the initial management of acute left-sided diverticulitis. Dis Colon Rectum 1992;35:1123–1129. 44. Kronborg O. Treatment of perforated sigmoid diverticulitis: a prospective randomized trial. Br J Surg 1993;80:505–507. 45. Bahadursingh AM, Virgo KS, Kaminski DL, et al. Spectrum of disease and outcome of complicated diverticular disease. Am J Surg 2003;186:696–701. 46. Schilling MK, Maurer CA, Kollmar O, et al. Primary vs. secondary anastomosis after sigmoid colon resection for perforated diverticulitis (Hinchey Stage III and IV): a prospective outcome and cost analysis. Dis Colon Rectum 2001;44: 699–703. 47. Farthmann EH, Ruckauer KD, Haring RU. Evidence-based surgery diverticulitis: a surgical disease? Langenbecks Arch Surg 2000;385:143–151. 48. Chandra V, Nelson H, Larson DR, et al. Impact of primary resection on the outcome of patients with perforated diverticulitis. Arch Surg 2004;139:1221–1224. 49. Zeitoun G, Laurent A, Rouffet F, et al. Multicentre, randomized clinical trial of primary versus secondary sigmoid resection in generalized peritonitis complicating sigmoid diverticulitis. Br J Surg 2000;87:1366–1374. 50. Rothenberger DA, Wiltz O. Surgery for complicated diverticulitis. Surg Clin North Am 1993;73:975–992. 51. Guenaga KF, Matos D, Castro AA, et al. Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst Rev 2003;2:CD001544. 52. Maggard MA, Zingmond D, O’Connell JB, et al. What proportion of patients with an ostomy (for diverticulitis) get reversed? Am Surg 2004;70:928–931. 53. Desai DC, Brennan EJ Jr, Reilly JF, et al. The utility of the Hartmann procedure. Am J Surg 1998;175:152–154. 54. Haas PA, Fox TA Jr. The fate of the forgotten rectal pouch after Hartmann’s procedure without reconstruction. Am J Surg 1990;159:106–110. 55. Pessaux P, Muscari F, Ouellet JF, et al. Risk factors for mortality and morbidity after elective sigmoid resection for diverticulitis: prospective multicenter multivariate analysis of 582 patients. World J Surg 2004;28:92–96. 56. Elliott TB, Yego S, Irvin TT, Elliott TB, Yego S, Irvin TT. Five year audit of the acute complications of diverticular disease. Br J Surg 1997;84:535–539. 57. Vernava AM III, Longo WE. Postoperative anastomotic complications en: Hicks TC (ed). Complications in Colon and Rectal Surgery. Williams & Wilkins. Baltimore, 1996 58. Roach MB, Donaldson DS. Urologic complications of colorectal surgery en: Hicks TC (ed). Complications in Colon and Rectal Surgery. Williams & Wilkins. Baltimore, 1996 59. Leff EI, Groff W, Rubin RJ, et al. Use of ureteral catheters in colonic and rectal surgery. Dis Colon Rectum 1982;25:457–460. 60. Practice parameters for the treatment of sigmoid diverticulitis. The Standards Task Force. The American Society of Colon and Rectal Surgeons. Dis Colon Rectum 2000;43:289. 61. Makela J, Vuolio S, Kiviniemi H, et al. Natural history of diverticular disease: when to operate? Dis Colon Rectum 1998;41:1523–1528. 62. Schauer PR, Ramos R, Ghiatas AA, et al. Virulent diverticular disease in young obese men. Am J Surg 1992;164:443–446. 63. Minardi AJ Jr, Johnson LW, Sehon JK, et al. Diverticulitis in the young patient. Am Surg 2001;67:458–461. 64. Ambrosetti P, Robert JH, Witzig JA, et al. Acute left colonic diverticulitis: a prospective analysis of 226 consecutive cases. Surgery 1994;115:546–550. 65. Ambrosetti P, Robert JH, Witzig JA, et al. Acute left colonic diverticulitis in young patients. J Am Coll Surg 1994;179: 156–160. 66. Anderson DN, Driver CP, Davidson AI, et al. Diverticular disease in patients under 50 years of age. J R Coll Surg Edinb 1997;42:102–104. 67. Cunningham MA, Davis JW, Kaups KL. Medical versus surgical management of diverticulitis in patients under age 40. Am J Surg 1997;174:733–735. 68. Acosta JA, Grebenc ML, Doberneck RC, et al. Colonic diverticular disease in patients 40 years old or younger. Am Surg 1992;58:605–607. 69. Schweitzer J, Casillas RA, Collins JC. Acute diverticulitis in the young adult is not “virulent.” Am Surg 2002;68:1044–1047. 70. Reisman Y, Ziv Y, Kravrovitc D, et al. Diverticulitis: the effect of age and location on the course of disease. Int J Colorectal Dis 1999;14:250–254. 71. Spivak H, Weinrauch S, Harvey JC, et al. Acute colonic diverticulitis in the young. Dis Colon Rectum 1997;40: 570–574. 72. Biondo S, Pares D, Marti Rague J, et al. Acute colonic diverticulitis in patients under 50 years of age. Br J Surg 2002;89: 1137–1141. 73. Guzzo J, Hyman N. Diverticulitis in young patients: is resection after a single attack always warranted? Dis Colon Rectum 2004;47:1187–1190. 74. West SD, Robinson EK, Delu AN, et al. Diverticulitis in the younger patient. Am J Surg 2003;186:743–746. 75. Vignati PV, Welch JP, Cohen JL. Long-term management of diverticulitis in young patients. Dis Colon Rectum 1995;38:627–629. 76. Poletti PA, Platon A, Rutschmann O, et al. Acute left colonic diverticulitis: can CT findings be used to predict recurrence? AJR Am J Roentgenol 2004;182:1159–1165. 77. Ambrosetti P, Robert J, Witzig JA, et al. Prognostic factors from computed tomography in acute left colonic diverticulitis. Br J Surg 1992;79:117–119. 78. Tyau ES, Prystowsky JB, Joehl RJ, et al. Acute diverticulitis. A complicated problem in the immunocompromised patient. Arch Surg 1991;126:855–858. 79. Lederman ED, McCoy G, Conti DJ, et al. Diverticulitis and polycystic kidney disease. Am Surg 2000;66:200–203. 80. Dominguez FE, Albrecht KH, Heemann U, et al. Prevalence of diverticulosis and incidence of bowel perforation after kidney transplantation in patients with polycystic kidney disease. Transpl Int 1998;11:28–31. 81. Lederman ED, Conti DJ, Lempert N, et al. Complicated diverticulitis following renal transplantation. Dis Colon Rectum 1998;41:613–618. 82. Pirenne J, Lledo-Garcia E, Benedetti E, et al. Colon perforation after renal transplantation: a single-institution review. Clin Transplant 1997;11:88–93. 83. Thorn M, Graf W, Stefansson T, et al. Clinical and functional results after elective colonic resection in 75 consecutive patients with diverticular disease. Am J Surg 2002;183:7–11. 84. Wong WD, Wexner SD, Lowry A, et al. Practice parameters for the treatment of sigmoid diverticulitis: supporting documentation. The Standards Task Force. The American Society of Colon and Rectal Surgeons. Dis Colon Rectum 2000;43: 290– 297. 85. Thaler K, Baig MK, Berho M, et al. Determinants of recurrence after sigmoid resection for uncomplicated diverticulitis. Dis Colon Rectum 2003;46:385–388. 86. The Standards Task Force. Practice parameters for the treatment of sigmoid diverticulitis. Dis Colon Rectum 2006; 49: 939–944 87. Cohn KH, Weimar JA, Fani K, et al. Adenocarcinoma arising within a colonic diverticulum: report of two cases and review of the literature. Surgery 1993;113:223– 226. 88. Stefansson T, Ekbom A, Sparen P, et al. Association between sigmoid diverticulitis and left-sided colon cancer: a nested, population-based, case control study. Scand J Gastroenterol 2004;39:743–747. 89. Stefansson T, Ekbom A, Sparen P, et al. Increased risk of left sided colon cancer in patients with diverticular disease. Gut 1993;34:499–502. 90. Stefansson T, Ekbom A, Sparen P, et al. Cancers among patients diagnosed as having diverticular disease of the colon. Eur J Surg 1995;161:755–760. 91. Berman IR, Corman ML, Coller JA, et al. Late-onset Crohn’s disease in patients with colonic diverticulitis. Dis Colon Rectum 1979;22:524. 92. Rodríguez M, et al. Enfermedad diverticular: revisión histórica y estado actual. Cir Esp 2001; 70: 253-260 93. Capitán L et al. Complicaciones de la enfermedad diverticular del colon. Tratamiento quirúrgico y su morbilidad. Cir Esp 2000; 68:557-561 94. Takahashi T. Colon, recto y ano. Enfermedades médico quirúrgicas (3ª ed). México, DF. 95. Aydin HN, Remzi FH. Diverticulitis: when and how to operate? Dig Liv disease 2004; 36(7):435-445 96. Thorson AG, Goldberg SM. Benign colon: diverticular disease en: Wolff BG (ed). The ASCRS textbook of colon and rectal surgery. Springer, New York, 2007 97. Skandalakis JE. Anatomical complications in general surgery (2 New York, 2004 nd ed). McGraw – Hill,