1_ESO_files/T-12 DIVERSIDAD MATERIA
Anuncio

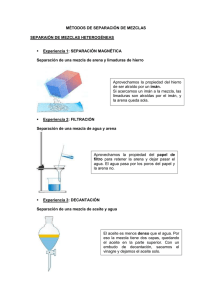
TEMA 12 DIVERSIDAD Y ESTRUCTURA DE LA MATERIA TEMA 12 DIVERSIDAD Y ESTRUCTURA DE LA MATERIA ¡Una actividad para comenzar ... ¡Una actividad para comenzar ... Trabajando entre todos vamos a tratar de: definir lo que es una mezcla (observa a tu alrededor y señala qué cosas en la clase son mezclas). indica dos sólidos que sean solubles en agua y dos que no lo sean ¿Son mezclas ¿Son mezclas el café con leche? el agua con arena? un yogur de fresa? un yogur con trozos de fresa? el agua con sal? el aire? una bolsa llena de basura? ¿Son mezclas el café con leche? el agua con arena? un yogur de fresa? un yogur con trozos de fresa? el agua con sal? el aire? una bolsa llena de basura? ¿Qué diferencias observas entre todas ellas?, ¿puedes clasificarlas en dos grupos? MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Las mezclas son un tipo de materia formado por dos o más sustancias puras diferentes. Se dividen en dos tipos: MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Las mezclas son un tipo de materia formado por dos o más sustancias puras diferentes. Se dividen en dos tipos: MEZCLAS HOMOGÉNEAS: si todas las porciones que podemos tomar de ellas tienen las mismas propiedades. En ellas no podemos diferenciar los componentes que las forman. MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Las mezclas son un tipo de materia formado por dos o más sustancias puras diferentes. Se dividen en dos tipos: MEZCLAS HOMOGÉNEAS: si todas las porciones que podemos tomar de ellas tienen las mismas propiedades. En ellas no podemos diferenciar los componentes que las forman. MEZCLAS HETE RO GÉNEAS: s us p ro p ie d ade s n o s o n constantes, varían de un lugar a otro de la mezcla. En ellas si podemos distinguir los componentes que las forman. Clasifica: Clasifica: Copia en tu cuaderno el cuadro siguiente y escribe si las mezclas son homogéneas o heterogéneas. Clasifica: Sistemas heterogéneos Sistemas homogéneos Una paella Los gases de un volcán Un diamante Una botella con aceite de oliva Yogur de sabor a fresa Una bolsa llena de basura Un vaso de leche con azúcar Arena con virutas de hierro Yogur con trozos de fresa Un litro de petróleo Una infusión de té Copia en tu cuaderno el cuadro siguiente y escribe si las mezclas son homogéneas o heterogéneas. ...Y ahora, ...Y ahora, Entre los sistemas homogéneos del ejercicio anterior, ¿cuáles están formados por varias sustancias y cuáles por una sola? ...Y ahora, Entre los sistemas homogéneos del ejercicio anterior, ¿cuáles están formados por varias sustancias y cuáles por una sola? Luego ... ¿no todas las sustancias de la naturaleza son mezclas?, ¿cómo llamamos a las que no lo son? SUSTANCIAS PURAS SUSTANCIAS PURAS SUSTANCIA PURA: Es un tipo de materia con propiedades características y composición constante. Está formada por un único componente o unidad elemental, que es la parte más pequeña que podemos encontrar y que tiene todavía las propiedades de ese tipo de materia SUSTANCIAS PURAS SUSTANCIA PURA: Es un tipo de materia con propiedades características y composición constante. Está formada por un único componente o unidad elemental, que es la parte más pequeña que podemos encontrar y que tiene todavía las propiedades de ese tipo de materia Las diferentes propiedades (densidad, temperaturas de fusión o ebullición, etc) que presentan las sustancias puras nos permiten diferenciar unas de otras ELEMENTOS Y COMPUESTOS Entre las sustancias puras todavía encontramos una gran diferencia: algunas de ellas pueden descomponerse en sustancias más sencillas (agua); otras no (oro, platino, carbono, oxígeno). ELEMENTOS Y COMPUESTOS Entre las sustancias puras todavía encontramos una gran diferencia: algunas de ellas pueden descomponerse en sustancias más sencillas (agua); otras no (oro, platino, carbono, oxígeno). ELEMENTOS: sustancia pura que no puede descomponerse en otras más sencillas. COMPUESTOS: sustancia pura que puede descomponerse en otras más sencillas. MEZCLAS HOMOGÉNEAS Pueden presentarse en los tres estados: MEZCLAS HOMOGÉNEAS Pueden presentarse en los tres estados: gaseosas: como el aire. líquidas: como el agua de mar. sólidas: como el bronce (cobre+estaño) MEZCLAS HOMOGÉNEAS Pueden presentarse en los tres estados: gaseosas: como el aire. DISOLUCIONES líquidas: como el agua de mar. sólidas: como el bronce (cobre+estaño) MEZCLAS HOMOGÉNEAS Pueden presentarse en los tres estados: gaseosas: como el aire. DISOLUCIONES líquidas: como el agua de mar. sólidas: como el bronce (cobre+estaño) ALEACIONES DISOLUCIONES: DISOLUCIONES: DISOLVENTE: el componente que se encuentra en mayor proporción. DISOLUCIONES: DISOLVENTE: el componente que se encuentra en mayor proporción. SOLUTO (Ó SOLUTOS): e l c om p o ne n te (ó componentes) en proporciones menores. DISOLUCIONES: DISOLVENTE: el componente que se encuentra en mayor proporción. SOLUTO (Ó SOLUTOS): e l c om p o ne n te (ó componentes) en proporciones menores. Nota importante: en el caso de las disoluciones acuosas vamos a considerar como disolvente siempre al agua, aunque se halle en proporción menor. SOLUBILIDAD DE UNA SUSTANCIA PURA La máxima cantidad de soluto, expresada en gramos, que se disuelve en 100 g de agua a una temperatura determinada. SOLUBILIDAD DE UNA SUSTANCIA PURA La máxima cantidad de soluto, expresada en gramos, que se disuelve en 100 g de agua a una temperatura determinada. La temperatura juega un importante papel en el proceso de disolución: a mayor temperatura los sólidos se disuelven mejor (aumenta su solubilidad). con los gases ocurre lo contrario, a mayor temperatura disminuye su solubilidad. CONCENTRACIÓN DE UNA DISOLUCIÓN Según la cantidad de soluto, las disoluciones se dividen en: CONCENTRACIÓN DE UNA DISOLUCIÓN Según la cantidad de soluto, las disoluciones se dividen en: diluidas: la cantidad de soluto es pequeña (o muy pequeña). concentradas: la cantidad de soluto es grande, cercana al valor de la solubilidad. saturadas: aquellas que no pueden admitir más cantidad de soluto (si añadimos más precipita en el fondo y no se disuelve) CONCENTRACIÓN DE UNA DISOLUCIÓN CONCENTRACIÓN: cantidad de soluto en la disolución. Se puede expresar como el “porcentaje en masa”, que corresponde a los gramos de soluto que hay en 100g de disolución, o sea: % masa= gramos de soluto gramos de disolución . 100 ... Actividades ... Actividades Vamos a hacer todas las actividades de las páginas 211 (resueltas) y 210 ... Actividades Vamos a hacer todas las actividades de las páginas 211 (resueltas) y 210 ¡¡ Y luego en casa has de hacer desde la 21 a la 25 de la página 223 !! ... Actividades ... Actividades Recuerda: mañana hay que traer de casa una etiqueta de agua mineral. ... Cada uno con su etiqueta ... Cada uno con su etiqueta En tu etiqueta: ¿Qué es el disolvente? Cita los solutos que hay. ¿Cual es la concentración de la disolución? ¿Es el agua mineral una sustancia pura? ... Cada uno con su etiqueta En tu etiqueta: ¿Qué es el disolvente? Cita los solutos que hay. ¿Cual es la concentración de la disolución? ¿Es el agua mineral una sustancia pura? ¡¡ Por cierto, ¿se disuelve igual el cola-cao en leche fría que en leche caliente? MÉTODOS DE SEPARACIÓN DE MEZCLAS Podemos separar los componentes de una mezcla mediante métodos físicos relativamente sencillos. Estos métodos se basan en las diferentes propiedades físicas (densidad, estado de agregación, temperatura de fusión o ebullición, etc...) de las sustancias que componen la mezcla. ... Vamos a pensar ... Vamos a pensar ¿Cómo separarías una mezcla de ... agua y arena. agua y sal. hierro y arena. MÉTODOS DE SEPARACIÓN FILTRACIÓN: usada para separar sólidos insolubles de líquidos; está basada en el diferente tamaño de las partículas de los componentes de la mezcla (agua y arena) MÉTODOS DE SEPARACIÓN FILTRACIÓN: usada para separar sólidos insolubles de líquidos; está basada en el diferente tamaño de las partículas de los componentes de la mezcla (agua y arena) En el laboratorio: MÉTODOS DE SEPARACIÓN FILTRACIÓN: usada para separar sólidos insolubles de líquidos; está basada en el diferente tamaño de las partículas de los componentes de la mezcla (agua y arena) En el laboratorio: ejemplos: depuradoras. bolsas de té, cafeteras, MÉTODOS DE SEPARACIÓN FILTRACIÓN: usada para separar sólidos insolubles de líquidos; está basada en el diferente tamaño de las partículas de los componentes de la mezcla (agua y arena) En el laboratorio: ejemplos: bolsas de té, cafeteras, depuradoras. TAMIZACIÓN: método equivalente para separar sólidos (arena y grava en la construcción) MÉTODOS DE SEPARACIÓN DECANTACIÓN: permite separar líquidos que no se mezclan por su diferente densidad (agua y aceite) MÉTODOS DE SEPARACIÓN DECANTACIÓN: permite separar líquidos que no se mezclan por su diferente densidad (agua y aceite) En el laboratorio: MÉTODOS DE SEPARACIÓN DECANTACIÓN: permite separar líquidos que no se mezclan por su diferente densidad (agua y aceite) En el laboratorio: ejemplos: usado ta m bién en las depuradoras (separa el agua de los aceites y grasas domésticos). MÉTODOS DE SEPARACIÓN DESTILACIÓN: basada en la diferente temperatura de ebullición de los componentes de la disolución. Se usa para separar líquidos miscibles entre sí. MÉTODOS DE SEPARACIÓN DESTILACIÓN: basada en la diferente temperatura de ebullición de los componentes de la disolución. Se usa para separar líquidos miscibles entre sí. En el laboratorio: MÉTODOS DE SEPARACIÓN DESTILACIÓN: basada en la diferente temperatura de ebullición de los componentes de la disolución. Se usa para separar líquidos miscibles entre sí. En el laboratorio: ejemplos: usada en perfumería, en las ref i nerías pa ra sepa ra r to dos los componentes del petróleo. ¿Te imaginas por qué el whisky, el vodka o el ron se fabrican en destilerías? MÉTODOS DE SEPARACIÓN CRISTALIZACIÓN: basada en la diferente solubilidad al variar la temperatura, se usa para separar sólidos disueltos en líquidos. MÉTODOS DE SEPARACIÓN CRISTALIZACIÓN: basada en la diferente solubilidad al variar la temperatura, se usa para separar sólidos disueltos en líquidos. En el laboratorio: MÉTODOS DE SEPARACIÓN CRISTALIZACIÓN: basada en la diferente solubilidad al variar la temperatura, se usa para separar sólidos disueltos en líquidos. En el laboratorio: MÉTODOS DE SEPARACIÓN CRISTALIZACIÓN: basada en la diferente solubilidad al variar la temperatura, se usa para separar sólidos disueltos en líquidos. En el laboratorio: ejemplos: se usa en salineras y azucareras ... Vamos a pensar ... Vamos a pensar ¿Cómo separarías una mezcla de azufre y limaduras de hierro?. ¿Cómo separarías una mezcla de sal y azufre?. ¿Qué técnica se utiliza para obtener sal en las salinas?. Si tuvieras que extraer sin impurezas cierta sustancia sólida disuelta en el agua, ¿qué técnica emplearías? Si quieres separar dos líquidos insolubles entre sí, ¿qué técnica emplearías?. ¿y si fueran solubles?. ¿Qué procesos físicos intervienen cuando se separan dos o más sustancias mediante una destilación?. ... Vamos a pensar ... Vamos a pensar Ahora una más complicada. ¿Cómo separarías una mezcla de arena, limaduras de hierro y sal? ... Vamos a pensar Ahora una más complicada. ¿Cómo separarías una mezcla de arena, limaduras de hierro y sal? Para que te resulte más sencillo puedes hacer esquemas de separación como el de la imagen siguiente ... ARENA+LIMADURAS DE HIERRO+SAL ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+AGUA SALADA ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+AGUA SALADA FILTRACIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+AGUA SALADA FILTRACIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+AGUA SALADA FILTRACIÓN ARENA AGUA SALADA ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+AGUA SALADA FILTRACIÓN ARENA AGUA SALADA EVAPORACIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+AGUA SALADA FILTRACIÓN ARENA AGUA SALADA EVAPORACIÓN ARENA+LIMADURAS DE HIERRO+SAL IMANTACIÓN LIMADURAS DE HIERRO ARENA+SAL DISOLUCIÓN ARENA+AGUA SALADA FILTRACIÓN ARENA AGUA SALADA EVAPORACIÓN SAL ESTRUCTURA DE LA MATERIA Todas las sustancias del universo están formadas por ÁTOMOS ¿Cómo es un átomo? El átomo está formado por partículas menores: electrones (carga eléctrica negativa); protones (con carga positiva) y neutrones (sin carga). como en cada átomo hay el mismo número de protones que de electrones la materia es eléctricamente neutra. en todos los átomos hay un núcleo muy pequeño y denso donde se encuentran los protones y neutrones. Y una corteza muy alejada donde se disponen los electrones girando en sus órbitas. (El átomo es, por tanto, como un sistema solar en miniatura que está prácticamente hueco) ESTRUCTURA DE LA MATERIA EL SISTEMA PERIÓDICO En la naturaleza existen 112 átomos diferentes que se corresponden con otros tantos elementos químicos. cada elemento químico se representa mediante un símbolo con una o dos letras (Au, Ag, O, Cl, Fe, Al, U, Ca). Cada elemento químico se caracteriza por su número atómico: Z, que corresponde al número de protones que posee. Todos los elementos se agrupan en una tabla llamada TABLA o SISTEMA PERÍÓDICO, en la que se ordenan por orden creciente de su número atómico y otras características, en 18 columnas verticales (grupos) y 7 filas horizontales (períodos) EL SISTEMA PERIÓDICO LAS SUSTANCIAS PURAS FÓRMULAS QUÍMICAS: combinación de símbolos químicos y números enteros (subíndices) que expresan los átomos que componen una sustancia y en qué cantidad aparecen. LAS SUSTANCIAS PURAS FÓRMULAS QUÍMICAS: combinación de símbolos químicos y números enteros (subíndices) que expresan los átomos que componen una sustancia y en qué cantidad aparecen. CO2 LAS SUSTANCIAS PURAS FÓRMULAS QUÍMICAS: combinación de símbolos químicos y números enteros (subíndices) que expresan los átomos que componen una sustancia y en qué cantidad aparecen. CO2 HNO3 LAS SUSTANCIAS PURAS FÓRMULAS QUÍMICAS: combinación de símbolos químicos y números enteros (subíndices) que expresan los átomos que componen una sustancia y en qué cantidad aparecen. H2SO4 CO2 HNO3 LAS SUSTANCIAS PURAS FÓRMULAS QUÍMICAS: combinación de símbolos químicos y números enteros (subíndices) que expresan los átomos que componen una sustancia y en qué cantidad aparecen. H2SO4 CO2 HNO3 H2O LAS SUSTANCIAS PURAS FÓRMULAS QUÍMICAS: combinación de símbolos químicos y números enteros (subíndices) que expresan los átomos que componen una sustancia y en qué cantidad aparecen. CO2 C6H6 H2SO4 HNO3 H2O LAS SUSTANCIAS PURAS FÓRMULAS QUÍMICAS: combinación de símbolos químicos y números enteros (subíndices) que expresan los átomos que componen una sustancia y en qué cantidad aparecen. CO2 C6H6 H2SO4 HNO3 C6H12O6 H2O LAS SUSTANCIAS PURAS Las sustancias puras están formadas por átomos, que se pueden agrupar de diferentes modos, o no hacerlo. Dependiendo de ello, hablamos de sustancias atómicas; moleculares o iónicas. LAS SUSTANCIAS PURAS Las sustancias puras están formadas por átomos, que se pueden agrupar de diferentes modos, o no hacerlo. Dependiendo de ello, hablamos de sustancias atómicas; moleculares o iónicas. SUSTANCIAS ATÓMICAS: la unidad elemental es el átomo, que puede encontrarse aislado (gases nobles: He, Ar, Ne) o en agrupaciones ordenadas formando redes cristalinas (carbono, oro, plata) SUSTANCIAS MOLECULARES: su unidad elemental es la molécula, formada por la agregación de, al menos, dos átomos iguales o diferentes. (H2O, CO2, O3, CH4) SUSTANCIAS IÓNICAS: sus unidades elementales son los iones, átomos que han perdido o ganado electrones y, por tanto, cargados eléctricamente. (NaCl, KCl) ELEMENTOS QUÍMICOS Elementos más abundantes del universo: H y He (elementos primordiales: primeros en formarse y todos se forman a partir de ellos en las estrellas). Estrellas: 74% de su masa es H; 24% es He. En la Tierra: ELEMENTOS QUÍMICOS Elementos más abundantes del universo: H y He (elementos primordiales: primeros en formarse y todos se forman a partir de ellos en las estrellas). Estrellas: 74% de su masa es H; 24% es He. En la Tierra: ELEMENTOS QUÍMICOS Y en los seres vivos: ELEMENTOS QUÍMICOS Y en los seres vivos: ELEMENTOS QUÍMICOS Y en los seres vivos: BIOELEMENTOS: C, H, O, N (96% masa de los seres vivos); otros secundarios (Ca, Na, K, P, ...) OLIGOELEMENTOS: absolutamente indispensables, pero en cantidades muy pequeñas (Fe, I, S, Co, Mg, ...) MATERIALES DE INTERÉS ECONÓMICO PLÁSTICOS: se extraen del petróleo METALES: se obtienen de minerales. Son imprescindibles en la actividad industrial porque son muy buenos conductores de la electricidad y del calor; son resistentes, tenaces y maleables. (se suelen emplear en aleaciones). SU P E R C OND U CTOR ES: m a t e r i a l e s s i n resistencia al paso de la corriente eléctrica. (resonancia magnética nuclear; trenes de le v i tación; ace le radore s de partículas; circuitos digitale s, e stacione s telefonía móvil, etc...) MATERIALES DE INTERÉS ECONÓMICO PLÁSTICOS: se extraen del petróleo METALES: se obtienen de minerales. Son imprescindibles en la actividad industrial porque son muy buenos conductores de la electricidad y del calor; son resistentes, tenaces y maleables. (se suelen emplear en aleaciones). SU P E R C OND U CTOR ES: m a t e r i a l e s s i n resistencia al paso de la corriente eléctrica. (resonancia magnética nuclear; trenes de le v i tación; ace le radore s de partículas; circuitos digitale s, e stacione s telefonía móvil, etc...) MATERIALES DE INTERÉS ECONÓMICO PLÁSTICOS: se extraen del petróleo METALES: se obtienen de minerales. Son imprescindibles en la actividad industrial porque son muy buenos conductores de la electricidad y del calor; son resistentes, tenaces y maleables. (se suelen emplear en aleaciones). SU P E R C OND U CTOR ES: m a t e r i a l e s s i n resistencia al paso de la corriente eléctrica. (resonancia magnética nuclear; trenes de le v i tación; ace le radore s de partículas; circuitos digitale s, e stacione s telefonía móvil, etc...) MATERIALES DE INTERÉS ECONÓMICO PLÁSTICOS: se extraen del petróleo METALES: se obtienen de minerales. Son imprescindibles en la actividad industrial porque son muy buenos conductores de la electricidad y del calor; son resistentes, tenaces y maleables. (se suelen emplear en aleaciones). SU P E R C OND U CTOR ES: m a t e r i a l e s s i n resistencia al paso de la corriente eléctrica. (resonancia magnética nuclear; trenes de le v i tación; ace le radore s de partículas; circuitos digitale s, e stacione s telefonía móvil, etc...) ... Y para terminar: ... Y para terminar: Repasaremos haciendo los ejercicios de las páginas 216, 218 y 222. Y la lectura de la página 220.