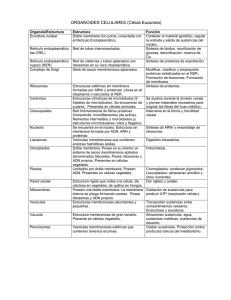
Retículo Endoplasmático Rugoso
Anuncio

Organelos Membranosos Envoltura Nuclear Retículo Endoplasmático Rugoso Sistema de Endomembranas Endosomas Lisosomas Retículo Endoplasmático Liso Aparato de Golgi Retículo Endoplasmático Rugoso participa en la síntesis de proteínas es un organelo prominente en células secretoras formado por sacos aplanados llamados cisternas las cisternas están comunicadas entre sí y ubican en forma paralela cerca del núcleo presenta polirribosomas las proteínas son integradas a organelos, membranas o secretadas al exterior realiza el plegado inicial y la glicosilación de las proteínas las sustancias sintetizadas pasan luego al aparato de Golgi Retículo Endoplasmático Rugoso (RER) Retículo Endoplasmático Rugoso (RER) retículo endoplásmico liso envoltura nuclear retículo endoplásmico rugoso cisternas ribosomas Incorporación Traduccional de Proteínas al RER La PRS lleva al complejo hasta el RER donde se une al receptor de la PRS. Cuando comienza la síntesis proteica emerge el péptido señal que es reconocido por la PRS. La PRS se libera y el ribosoma se une a un complejo de translocación de membrana llamado Sec61. Se reanuda la traducción y la cadena polipeptídica es traslocada a través de la membrana. Se elimina el péptido señal y se libera el polipéptido en la luz del RE. los ribosomas inicialmente se encuentran libres en el citosol pero existe una secuencia señal que permite unir el ribosoma e insertar la proteína al RE la señal, llamada péptido señal, es una secuencia compuesta por 6-20 a.a. hidrofóbicos el PS es reconocido por la PRS (partícula reconocimiento señal), que lleva al ribosoma al RER donde hay un receptor para la PRS la PRS es un complejo de ARN y proteínas, que tiene 6 polipéptidos y una molécula de ARN llamada 7SL. Retículo Endoplasmático Rugoso Translocación Postraduccional de Proteínas al RER • Algunas proteínas se sintetizan en ribosomas libres y se incorporan después al RER. • Este proceso no requiere de la PRS, como en el caso anterior. • El péptido señal es reconocido por dos proteínas receptoras diferentes, que forman el complejo Sec 62/63, asociadas al complejo Sec61. • El complejo Sec62/63 reconoce el PS y el Sec61 permite translocar la proteína. • Este proceso requiere también de una chaperona llamada BiP para traslocar la proteína. Inserción de Proteínas Integrales a la Membrana del RER • Las proteínas se incluyen en la membrana mediante regiones hidrofóbicas que atraviesan la bicapa lipídica. • Las partes que atraviesan la membrana son regiones en hélice alfa constituidas por 20 a 25 aminoácidos hidrófobos. • Algunas proteínas atraviesan la bicapa una vez y otras varias veces. • Pueden estar orientadas con el extremo amino o carboxilo hacia afuera. • La orientación de las proteínas de membrana se establece a medida que las cadenas se traslocan al RER. Inserción de Proteínas Integrales a la Membrana del RER • El mecanismo más común da como resultado la síntesis de proteínas integrales con sus extremos carboxilo terminal hacia el citosol. • La inserción requiere de una secuencia señal amino terminal que inicia la translocación y una secuencia de detención de la transferencia que ancla la proteína a la membrana. las proteínas tienen una secuencia amino-terminal que es eliminada por la peptidasa señal durante el pasaje de la cadena por el canal del complejo Sec61 luego se anclan a la membrana por una segunda hélice alfa que atraviesa la bicapa ubicada en el centro de la proteína esta secuencia de detención de la transferencia, produce el cierre del canal de la Sec61 y bloquea el pasaje de la cadena polipeptídica así, la porción carboxilo terminal de la cadena se sintetiza en el citosol Inserción de Proteínas Integrales a la Membrana del RER • Otras proteínas pueden anclarse a la membrana del RE mediante secuencias señal internas que no son eliminadas por la peptidasa señal • Estas secuencias internas son reconocidas por la PRS y trasladadas a la membrana del RE • Sin embargo, como no son eliminadas, también actúan como hélices alfa transmembrana que permiten el anclaje de las proteínas a la membrana del RE. • Las secuencias señal internas pueden dirigir la translocación por el extremo amino o bien del extremo carboxilo terminal de la cadena. • Por tanto, según la orientación de la señal, las proteínas pueden tener su extremo amino o bien su extremo carboxilo terminal expuesto al citosol. Inserción de Proteínas Integrales a la Membrana del RER • Las proteínas politópicas son insertadas mediante una serie alterna de secuencias señal internas y secuencias transmembrana de detención de la transferencia. primero, una secuencia señal interna da lugar a la inserción de la cadena polipeptídica en la membrana luego una secuencia de detención de la transferencia, por lo cual la cadena forma un bucle en la luz del RE, y la síntesis de la proteína continúa hacia el lado citosólico de la membrana Inserción de Proteínas Integrales a la Membrana del RER una segunda secuencia señal, hace que la cadena en crecimiento se inserte otra vez en la membrana, dando lugar a otro dominio en forma de bucle en el lado citosólico de la membrana a esto le puede seguir otra secuencia de detención de la transferencia, y luego otra secuencia señal y así sucesivamente ello genera dominios en forma de bucle expuestos tanto a la luz del RE como a lado citoplásmico de la membrana Procesamiento de Proteínas en el RER 1. Rotura proteolítica del péptido señal a medida que la cadena polipeptídica se transloca a través de la membrana del RE. 2. Plegamiento de las cadenas polipeptídicas. 3. Ensamblaje de proteínas formadas por varias subunidades (cuaternarias). 4. Formación de los puentes disulfuro. 5. Agregado de hidratos de carbono a las glucoproteínas (glicosilación). Procesamiento de Proteínas en el RER • las proteínas se translocan a través de la membrana del RE a modo de cadenas polipeptídicas sin plegar mientras prosigue su traducción. • estos polipéptidos se pliegan en forma tridimensional en el RE por medio de chaperonas moleculares que facilitan el plegamiento de las cadenas polipeptídicas. una de las proteínas principales en la luz del RE es un miembro de la familia de las chaperonas Hsp70 llamado BiP BiP se une a la cadena sin plegar cuando atraviesa la membrana y luego pliega la proteína y ensambla las proteínas oligoméricas en el RE las proteínas bien ensambladas se separan de BiP y pasan al aparato de Golgi Glicosilación de Proteínas en el RER • El proceso comienza con la transferencia de un oligosacárido común compuesto por 14 monosacáridos a un residuo de asparagina de la cadena polipeptídica en crecimiento. El oligosacárido está compuesto siempre por 2 Nacetilglucosaminas, 3 glucosas y 9 manosas El oligosacárido se localiza en la membrana del retículo endoplásmico unido a un lípido transportador llamado dolicol fosfato. La enzima encargada de agregar el oligosacárido es llamada oligosacariltransferasa. Procesamiento de Proteínas en el RER • La oligosacariltransferasa reconoce una secuencia especial de 3 aminoácidos de la cadena polipeptídica y une el oligosacárido a uno de estos tres aminoácidos de la secuencia que es la asparagina. Una vez unido a la proteína, el oligosacárido inicial sufrirá modificaciones posteriores. Se eliminan tres residuos de glucosa y uno de manosa mientras la proteína está en el RE. Posteriormente las glicoproteínas pasarán al aparato de Golgi donde sufrirán modificaciones adicionales. Retículo Endoplasmático Liso Retículo Endoplasmático Liso Funciones 1. síntesis de lípidos 2. síntesis de hormonas esteroides 3. detoxificación 4. movilización de glucosa 5. almacenamiento y liberación de calcio Síntesis de Lípidos • los fosfolípidos son sintetizados en la cara citoplásmica de la membrana del RE, a partir de precursores citosólicos hidrosolubles • en primer lugar, dos ácidos grasos unidos a la coenzima A se combinan con glicerol-3-fosfato mediante una enzima unida a la membrana • el fosfolípido resultante, ácido fosfatídico, se inserta en la membrana • luego, las enzimas de la cara citoplásmica de la membrana adicionan diferentes grupos a las cabezas polares • ello da lugar a la fosfatidilcolina, fosfatidilserina, fosfatidiletanolamina o fosfatidilinositol. Síntesis de Lípidos • la síntesis de fosfolípidos en la cara citosólica de la membrana del RE permite que las cadenas hidrófobas de los ácidos grasos permanezcan ocultas en la membrana • eso permite que las enzimas unidas a la membrana catalicen sus reacciones con los precursores hidrosolubles del citosol • sin embargo, la síntesis de estos fosfolípidos en la cara citoplásmica hace que los fosfolípidos nuevos sólo se inserten en la cara citosólica de la membrana del RE. Síntesis de Lípidos • Para mantener una membrana estable, algunos de estos fosfolípidos de nueva síntesis deben transferirse a la otra monocapa del RE. • Esta transferencia no tiene lugar espontáneamente ya que requiere el paso de un grupo polar a través de la membrana. • Por ello existen enzimas que trasladan a los lípidos y que son denominadas flipasas. • Estas catalizan la translocación de fosfolípidos a través de la membrana del RE, dando lugar a un crecimiento uniforme de las dos partes de la bicapa. Síntesis de Esteroides Detoxificación o inactivación de drogas • Fase I: se produce la oxidación de las drogas por medio de un “sistema oxidativo de función mixta” comprende dos cadenas transportadoras de electrones formadas por: flavoproteínas (citocromo c reductasa y citocromo b5 reductasa) hemoproteínas (citocromo b5 y citocromo P450) • Fase II: las moléculas oxidadas son unidas a moléculas hidrofílicas que inactivan a la droga y forman compuestos solubles y fáciles de eliminar por el organismo. Las enzimas que participan en esta fase se llaman transferasas y las más importantes son las que transfieren grupos sulfato. Movilización de Glucosa glucógeno-fosforilasa 1. Glucógeno Glucosa 1-fosfato (G1P) glucogenólisis fosfoglucomutasa 2. Glucosa 1-fosfato Glucosa 6-fosfato (G6P) glucosa 6-fosfatasa 3. Glucosa 6-fosfato Glucosa libre membrana plasmática 4. Glucosa libre en el REL espacio extracelular por difusión facilitada Almacenamiento y Liberación de Calcio • se mantiene una baja concentración citosólica de Ca mediante transporte activo (tipo P) hacia vesículas del REL llamadas calciosomas. • las vesículas tienen canales iónicos especiales que se abren cuando el citosol necesita calcio en forma transitoria. Aparato de Golgi modifica, clasifica y traslada las proteínas hacia su destino final (lisosomas, membrana plasmática o secreción) sintetizan glucolípidos y esfingomielina en plantas sintetizan los polisacáridos de la pared celular se encuentra presente en todas las células eucariotas se ubica entre el RE y la MP, cerca del centrosoma Aparato de Golgi formado por subunidades menores llamadas dictiosomas, que miden 1 µm los dictiosomas están formados por cisternas y vesículas las cisternas son discoidales, aplanadas, se disponen en forma paralela y están separadas por 20 a 30 nm el número de cisternas varía entre 3 y 7 según el tipo de célula cada dictiosoma tiene una cara proximal (cis) y otra distal (trans) la cara cis es convexa y mira hacia la envoltura nuclear la trans es cóncava y da hacia la membrana plasmática Aparato de Golgi la cis presenta de vesículas de transición que vienen del RE y traen la mayoría de las proteínas sintetizadas a su vez hay transporte de vesículas de una cisterna a otra, que llevan las proteínas que se van modificando en las diferentes cisternas Aparato de Golgi la cara cis del dictiosoma recibe las vesículas del RER y comienza a modificar las proteínas las cisternas intermedias continúan la maduración de las glucoproteínas por acción de complejos enzimáticos las cisternas distales terminan el procesamiento seleccionan y separan los distintos tipos de proteínas Glicosilación el procesamiento de glucoproteínas se produce a partir del oligosacárido de 14 monosacáridos que fue agregado a la proteína en el RER Glicosilación • este proceso origina miles de oligosacáridos específicos para cada tipo de proteína • a veces se agregan tantos que los glúcidos son más abundantes que la proteína Síntesis de Polisacáridos de la Pared Celular Pared Celular Celulosa es un polímero de glucosa sintetizado en la superficie celular por enzimas de la membrana plasmática. Hemicelulosa son moléculas complejas de cadena ramificada que se sintetizan en el aparato de Golgi y son transportadas mediante vesículas a la superficie celular. Pectinas • La síntesis de estos polisacáridos de la pared celular es una función importante para la célula vegetal. • Hasta el 80 % de la actividad metabólica del aparato de Golgi de las células vegetales se dedica a la síntesis de polisacáridos. Mecanismo de transporte de las Vesículas invaginación de la membrana formación de la vesícula Proteínas de revestimiento y gemación de Vesículas • La superficie de las vesículas está recubierta por proteínas de revestimiento que dirigen la gemación de las vesículas permitiendo la distorsión de la membrana. • Se han caracterizado tres tipos de vesículas revestidas de proteínas que intervienen en diferentes tipos de transporte vesicular. Vesículas revestidas COP COPII: se originan a partir del RE y transportan su carga hasta el aparato de Golgi. COPI: se originan a partir del compartimento intermedio RE-Golgi o del aparato de Golgi, y participan en las vías de recuperación que sirven para retener a las proteínas residentes en el Golgi y en el RE. Vesículas revestidas de clatrina: permiten la captación de moléculas extracelulares desde la membrana plasmática mediante endocitosis y del transporte de moléculas desde el Golgi a los lisosomas. Vesículas Revestidas por Clatrina • Las vesículas revestidas por clatrina están compuestas por dos clases de complejos proteicos, clatrina y proteínas adaptadoras, que se unen al lado citosólico de las membranas. • La clatrina desempeña un papel estructural, forma una estructura semejante a la red de basket que distorsiona la membrana y dirige la gemación de las vesículas. • La unión de la clatrina a las membranas está mediada por proteínas adaptadoras, pero actúan diferentes proteínas adaptadoras en la formación de vesículas en la membrana plasmática y en el Golgi. Vesículas COP • Están constituidas por complejos proteicos diferentes, que funcionan como la clatrina y las proteínas adaptadoras. • El ensamblaje de la cubierta de la vesícula requiere de proteínas de unión a GTP, que regulan la unión de las proteínas de revestimiento a la membrana. Fusión de Vesículas La fusión de una vesícula de transporte implica dos tipos de acontecimientos: 1. En primer lugar, la vesícula de transporte debe reconocer específicamente la membrana diana correcta; por ejemplo, una vesícula que transporta enzimas lisosómicas tiene que llevar su carga sólo a los lisosomas. 2. En segundo lugar, la membrana de la vesícula y la membrana diana deben fusionarse, entregándose el contenido de la vesícula al orgánulo diana. Según el modelo actual, el reconocimiento entre una vesícula y su blanco está mediado por la interacción específica entre pares de proteínas transmembrana, seguido por la fusión entre las bicapas lipídicas de la vesícula y de la membrana diana. Fusión de Vesículas – Hipótesis SNARE • la fusión de las vesículas está mediada por la interacción entre un par específico de proteínas, denominadas SNAREs, que se ubican en la membrana de la vesícula y en la membrana diana. • Además de las SNAREs, la fusión de vesículas requiere otro tipo de proteína llamado Rab, que son una familia de proteínas de unión a GTP (existen más de 30 tipos diferentes y se ha demostrado que intervienen en procesos específicos del transporte de vesículas). Fusión de Vesículas – Hipótesis SNARE • Tras la unión de las SNAREs y la fusión de las membranas, se requiere un complejo de otras dos proteínas (el complejo NSF/SNAP) para completar el proceso del transporte de vesículas. • Las proteínas NSF/SNAP no se requieren la fusión de las membranas, sino que actúan después de la fusión de la membrana para desmontar el complejo SNARE, y permitir que las SNAREs se puedan reutilizar en ciclos posteriores.