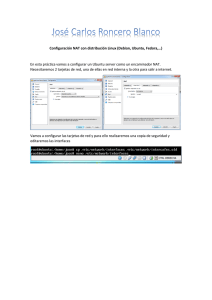
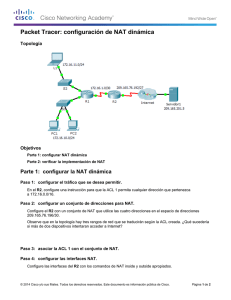
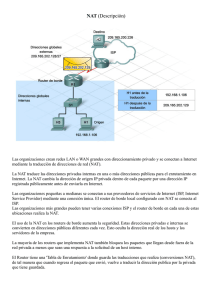
- Ninguna Categoria
Flora & Fauna of Baja Talamanca, Costa Rica
Anuncio
MUSEO NACIONAL DE COSTA RICA DEPARTAMENTO DE HISTORIA NATURAL PROYECTO LIMÓN CIUDAD PUERTO – HISTORIA NATURAL DOCUMENTACIÓN DE RECURSOS BIOLÓGICOS EN LA REGIÓN DE BAJA TALAMANCA, LIMÓN, COSTA RICA Editor: Joaquín Sánchez González AGOSTO 2014 ÍNDICE Introducción General 1 Objetivo General 2 Objetivos Específicos 3 Área de Estudio 3 Hábitats Naturales de la Región de Baja Talamanca 6 Diversidad de Plantas Vasculares en la Región de Baja Talamanca, 15 Limón, Costa Rica Los Macrohongos de Baja Talamanca, Limón, Costa Rica 40 Caracterización de Mamíferos en la Región de Baja Talamanca y 61 Estribaciones de la Fila Matama, Limón, Costa Rica Avifauna de la Región de Baja Talamanca, Limón, Costa Rica 84 Diversidad de Mariposas Diurnas y Nocturnas en la Región de 112 Baja Talamanca, Limón, Costa Rica Anexo 1. Listado de Plantas Vasculares 129 Anexo 2. Lista de los Macrohongos 201 Anexo 3. Lista de Mamíferos 207 Anexo 4. Listado de Aves 211 Anexo 5. Lista de los Mariposas 225 Fotografías de plantas, hongos, mamíferos, aves y mariposas 258 AGRADECIMIENTOS Este proyecto se llevó a cabo gracias a la colaboración de diferentes instituciones estatales, personas y empresas privadas por lo que expresamos nuestro agradecimiento por la atención brindada. En primer lugar al Museo Nacional de Costa Rica y al Proyecto Limón Ciudad Puerto por el financiamiento del proyecto. Al Área de Conservación La Amistad Caribe por los permisos de entrada a las áreas protegidas, así como los permisos de recolecta de especímenes. A las empresas Veragua Rain Forest Park, Selva Bananito Lodge y Tropical Zoo Plants, por permitir el uso de sus propiedades e instalaciones para llevar a cabo la observación y recolección de especímenes de flora y fauna. Asimismo el agradecimiento es extensivo al personal admisnistrativo y técnicos de estas empresas por su apoyo en las labores de campo. 1 INTRODUCCIÓN GENERAL La zona del Caribe Sur de Costa Rica, alberga la mayor cobertura boscosa del país, con considerables extensiones de bosque inalterado, principalmente en las partes montañosas. El cantón de Talamanca está cubierto en un 66 % de bosques primarios o poco intervenidos, con una alta representatividad de la flora y fauna del país (Bustillo et al. 1993, Valverde 1998). En esta región se encuentra parte de la cordillera de Talamanca, un área reconocida por su riqueza en especies endémicas, que junto con la península de Osa son las principales áreas con esta característica en América Central (Dinerstein et al. 1995). En parte la riqueza biológica de esta zona se debe a que la diferencia de altitud entre la costa y la cordillera de Talamanca en un trayecto de tan solo 60 km produce una serie de hábitats y zonas de vida que permiten el establecimiento de una rica variedad de plantas y animales. A pesar de que se han hecho diversas incursiones por parte del Museo Nacional, Instituto Nacional de Biodiversidad y Missouri Botanical Garden para recolectar muestras de vegetación, aun quedan zonas sin explorar y especies de plantas y animales aun desconocidos para la ciencia, algunos de los cuales han sido descritos en tiempos recientes (Soto & Monro 2008, Monro 2009, Acuña 2010). Una de estas zonas poco exploradas es la fila de Matama, que aún conserva una buena cantidad de bosque denso y en los últimos años ha rendido una buena cantidad de especies de plantas nuevas para la ciencia. La zona comprendida entre el río Matina y la frontera con Panamá, desde el nivel del mar hasta los 400 m aproximadamente, constituye la región florística de Baja Talamanca según definición de Zamora et al. (2004). Esta región presenta una mezcla de muchas especies provenientes de diversas regiones fitogeográficas. Contiene elementos florísticos tanto del Pacífico suramericano, como de la Amazonia cisandina que se mezclan con componentes mesoamericanos y antillanos. Asimismo en las partes altas se da una combinación de elementos típicamente montanos 2 que llegan a altitudes bajas y al contrario elementos típicos de tierras bajas que suben hasta tierras medias (Zamora et al. (2004). El presente trabajo es una caracterización de la región de Baja Talamanca, desde el punto de vista de diferentes grupos biológicos (plantas, hongos, aves, mamíferos y mariposas), grupos de los que posee colecciones el Museo Nacional de Costa Rica. La delimitación de esta región de estudio obedece a que es una unidad con condiciones biológicas particulares, dentro de la cual se encuentra la ciudad de Limón. Para cada uno de los grupos en estudio se expone un capítulo donde se detalla las principales características en cuanto a representatividad, número de familias, de géneros y especies de la zona de Baja Talamanca, así como para cada una de las localidades de muestreo. Se presentan resultados en cuanto a hábitats para los diferentes grupos. Se presentan listados de especies importantes para la conservación, ya sea porque están bajo alguna categoría de amenaza, son endémicas regionales o son importantes desde el punto de vista cultural o turístico. Se presentan anexos con listados de especies con algunas anotaciones, así como una muestra de fotografías representativas de la colección de algunas especies de la zona. OBJETIVO GENERAL Aportar conocimiento sobre la flora y la fauna de Baja Talamanca, para promover su conservación y uso sostenible, mediante productos divulgativos dirigidos al público en general residente y visitante de la Ciudad de Limón. 3 OBJETIVOS ESPECÍFICOS 1. Recolectar especímenes de plantas, hongos, aves, mamíferos, mariposas en diferentes localidades de la región de Baja Talamanca, Costa Rica, para ser incorporados a las colecciones de referencia del Museo Nacional de Costa Rica. 2. Documentar mediante fotografías, videos y archivos de sonido las diferentes especies y hábitats de plantas, hongos, mamíferos, aves y mariposas de la región de baja Talamanca. 3. Producir una guía ilustrada de las especies más llamativas de la zona, de manera que pueda ser utilizada por guías de turismo y público en general para conocer los recursos biológicos de la zona. 4. Producir láminas de diferentes temas relacionados con la flora y fauna de la zona. ÁREA DE ESTUDIO Este proyecto se desarrolló en la región de Baja Talamanca, la cual constituye una de las 25 regiones florísticas en que se ha dividido a Costa Rica (Zamora et al. 2004). Esta región se localiza desde el sur del río Matina hasta el río Sixaola, frontera con Panamá. Se extiende desde el nivel del mar hasta los 400 msnm. El relieve se caracteriza por poseer una llanura costera de menos de 100 m de altitud, de un ancho variable entre 1 y 4 km que se extiende desde la ciudad de Limón hasta el río Sixaola (Bergoeing 1998). Dentro de esta misma altitud se localizan los valles de los ríos Banano, Bananito, Estrella y valle de Talamanca. Las partes más elevadas están constituidas por la fila Carbón, cerca de Cahuita y las estribaciones de la fila Matama y cordillera de Talamanca por el oeste. 4 Para efectos de este trabajo se eligieron tres zonas de estudio tomando en cuenta los siguientes aspectos: Representatividad de los diferentes grupos de flora y fauna en las colecciones y bases de datos; que hubiera áreas de bosque importantes en cuanto a extensión, vulnerabilidad, y acceso y por último que hubiera representatividad de bosques de diferentes altitudes. Las áreas de estudio son las siguientes: Las planicies. Comprende aquellas zonas entre 0 y 100 msnm, donde se localizan las llanuras costeras y los valles fluviales. Los sitios de recolecta y documentación de especímenes se localizaron en la cuenca del río Bananito dentro de los predios de Selva Bananito Lodge, el Parque Nacional Cahuita y el Refugio Nacional de Vida Silvestre Gandoca-Manzanillo. Las Brisas de Veragua y sus alrededores. Localidad que se encuentra 12 km al sur de Liverpool. Los sitios de recolecta y documentación de especímenes se encuentran entre los 100 y 500 msnm, Se hicieron muestreos dentro de las cuencas de los ríos Victoria, Segundo y Blanco específicamente en la propiedad de Veragua Rainforest Park. Cerros Chimú (767 msnm) y Muchilla (880 msnm). Ambos cerros pertenecen a las estribaciones de la Fila Matama. Se hicieron varias expediciones con el fin de obtener registros de la flora y fauna de la zona montañosa cercana a la ciudad de Limón. Cuadro 1. Sitios de recolecta de especímenes, con la respectiva zona de vida a la que pertenecen. Sitio de Recolecta Zona de Vida Las Brisas de Veragua Bosque Muy Húmedo Tropical Bananito Bosque Muy Húmedo Tropical Parque Nacional Cahuita Bosque Húmedo Tropical RNVS Gandoca-Manzanillo Bosque Húmedo Tropical Cerro Muchilla Bosque Pluvial Premontano Cerro Chimú Bosque Muy Húmedo Premontano 5 Figura 1. Localización de los sitios de estudio en la región de Baja Talamanca, Costa Rica. 6 HÁBITATS NATURALES DE LA REGIÓN DE BAJA TALAMANCA Bosque Lluvioso Tropical Este tipo de bosque se encuentra en tierras bajas (0500 msnm), con precipitación anual que ronda los 3000 a 6000 mm anuales, con temperatura promedio entre 27 y 28 oC. Se le conoce con varios nombres: Bosque ombrófilo (ombro: lluvia), bosque muy lluvioso, bosque ecuatorial, pluvisilva, bosque húmedo o muy húmedo (Gómez 1986, Vargas Ulate 2009). En general se puede decir que la estructura del bosque consta de tres estratos. El más alto llamado dosel tiene una altura entre los 30 a 40 m, donde las copas de los árboles se tocan unas con otras formado una densa cobertura que detiene el paso de la luz a estratos más bajos. Algunos árboles emergentes logran crecer a alturas de hasta 50 m y sobresalen del dosel. El estrato intermedio tiene árboles de hasta 20 m, a veces formado por individuos juveniles del estrato superior que se encuentran a la espera de que la caída de un árbol abra un claro en el bosque para crecer y cerrar de nuevo el dosel. El estrato inferior, llamado sotobosque, está formado por árboles pequeños, arbustos y palmas. El suelo se encuentra cubierto por una gruesa capa de hojas y ramas en descomposición, cubierto por algunas hierbas, palmas pequeñas y helechos. La mayoría de las especies de árboles poseen raíces poco profundas, debido a que los nutrientes se encuentran más bien en las capas superiores del suelo, por la descomposición de la materia orgánica. Es por esta razón que al menos un 50 % de las especies arbóreas presentan gambas, que son extensiones del tronco que ayudan al sostén de estos gigantescos árboles (Vargas Ulate 2009). 7 Estos bosques junto con los de la península de Osa son los más exuberantes de Costa Rica. En ellos se encuentran muchos de los árboles maderables de gran valor, por lo que han sufrido una explotación intensiva. En muchos sitios del Caribe solo sobreviven franjas de bosque a la orilla de ríos y canales. Una vez que se extrajo la madera el suelo fue dedicado a los monocultivos (cacao, banano y piña) y ganadería. Por otra parte, la fauna es de gran riqueza y de la cual casi no existen inventarios exhaustivos. Muchas de las especies de mamíferos, aves y reptiles son objeto de caza furtiva, por lo que muchas poblaciones han sido reducidas casi a la extinción. Manglar El manglar es un hábitat formado por vegetación muy tolerante a la salinidad, que ocupan la zona entre mareas cercana a las desembocaduras de cursos de agua dulce de las costas del trópico. En Costa Rica las mayores extensiones de este tipo de vegetación se encuentran a lo largo de la costa pacífica (Jiménez 1994). En el Caribe el manglar de la laguna Gandoca, es el más grande, más desarrollado y en mejor estado de conservación, además ha sido el más estudiado de la zona. Es el único manglar de Costa Rica, junto con el del Parque Nacional Corcovado, donde se han preservado algunas zonas continuas de bosque y manglar (Jiménez & Soto 1985, Cortés 1991). Las especies más comunes son: Rhizophora mangle (mangle rojo), Avicennia germinans (mangle salado), Laguncularia racemosa (mangle blanco) y Conocarpus erecta (mangle botón). Los árboles alcanzan alturas entre 3 y 12 m. Este manglar es muy importante para varias especies de aves acuáticas, para 8 la reproducción y supervivencia del sábalo real (Megalops atlenticus) la especie de mayor importancia para pesca deportiva en el Caribe de Costa Rica, y el manatí ( Trichechus manatus), esta última en vías de extinción en todo su ámbito de distribución (Coll et al. 2001). Lagunas La laguna Gandoca es la más extensa de la costa Caribe sur de Costa Rica. Además del manglar antes mencionado, la laguna está rodeada por otros tipos de vegetación, transicionales hacia el bosque tropical muy húmedo, como son los yolillales (Raphia taedigera) mezclados con helechos (especialmente la negraforra, Acrostichum aureum). En los márgenes de la laguna también son abundantes árboles de Cassipourea guianensis, Inga multijuga (guabo de estero), Posoqueria latifolia (guayaba de mono), Prioria copaifera (cativo), Xylosma panamensis y Zygia latifolia (sotacaballo); arbustos de Montrichardia arborescens; bejucos como Allamanda cathartica, Cydista aequinoctialis, Lonchocarpus densiflorus y Rhabdadenia biflora, así como lirios de agua (Eichornia crassipes) y varias especies de pastos (Coll et al. 2001). En los árboles se han visto algunos mamíferos como los monos araña ( Ateles geoffroyi) y los monos congo (Alouatta palliata), pero también es factible la presencia de los monos carablanca (Cebus imitator), los perezosos de dos dedos (Choloepus hoffmanii) y tres dedos, la ardilla roja (Sciurus granatensis), y varias especies de murciélagos incluyendo el murciélago narigudo 9 (Rhynchonycteris naso), que descansa de día a veces formando fila india en los troncos de árboles cercanos al agua. Yolillales El yolillal es un bosque anegado en áreas cercanas a la costa, que en su núcleo se encuentra dominado casi exclusivamente por la palma Raphia taedigera (yolillo). En la periferia se encuentran otras especies como: Pentaclethra macroloba (gavilán), Pterocarpus officinalis (sangrillo), Luehea seemanii (guácimo colorado), Grias cauliflora (tabacón), Prioria copaifera (cativo), Carapa nicaraguensis (caobilla) y helechos (Acrostichum aureum y A. danaeifolium). En los límites del yolillal se establece una asociación de transición compuesta de yolillo y árboles del bosque húmedo (Gómez 1986, Coll et al. 2001). Este tipo de vegetación se encuentra en Tortuguero, Cahuita y en el Refugio de Vida Silvestre Gandoca-Manzanillo. Aunque en apariencia el yolillal parece un ecosistema monótono, impenetrable e insalubre, en realidad es muy importante ya que es refugio de diversas especies animales. En la estación seca estos bosques se secan parcial o totalmente durante algunos meses, lo que permite el uso del hábitat por parte de varias especies de aves, mamíferos y reptiles. Entre los más notables se encuentran el manigordo (Leopardus pardalis), zainos (Tayassu tajacu), mapaches (Procyon lotor), monos cariblancos (Cebus capuccinus), pavones (Crax rubra) y el cocodrilo americano (Crocodylus acutus). 10 Mientras los ambientes aledaños son deforestados, algunas de esas especies se movilizan a estos humedales buscando refugio, por lo que actualmente parecen ser más fáciles de encontrar en yolillales que en los bosques donde otrora fueran comunes (Beneyto 2013). Cativales o cativeras El catival es también un bosque anegado, aunque en menor grado que el yolillal. Está compuesto hasta en un 90 % de árboles de Prioria copaifera (cativo), mezclado con Pterocarpus officinalis (sangrillo), Carapa nicaraguensis (caobilla), Symphonia globulifera (cerillo) y Pentaclethra macroloba (gavilán) (Gómez 1986). El cativo es un árbol de hasta 40 m de altura por 1 m de diámetro, con tronco cilíndrico, recto y sin gambas. Es una especie que ha sido explotada por la buena calidad de su madera, para la fabricación de plywood y enchapes. Actualmente está catalogada como amenazada (Jiménez Madrigal 1998). una especie Este tipo de vegetación se encuentra en Tortuguero y una buena representación está protegida en el Refugio Nacional de Vida Silvestre Gandoca-Manzanillo, entre Punta Mona y Middle Creek. 11 Bosques de Sangrillos Estos bosques corresponden a otro tipo de bosque anegado, en terrenos aluviales y costeros, el cual se inunda periodicamente de una forma considerable. En este caso la especie dominante es Pterocarpus officinalis (sangrillo), la cual puede llegar a formar rodales casi puros. Otras especies que pueden estar presentes en menor grado son Carapa nicaragüenses (caobilla), Symphonia globulifera (cerillo) y Pentaclethra macroloba (gavilán). Existe una importante representación de este tipo de bosque en el P.N. Cahuita, de hecho el nombre Cahuita, se origina de las palabras miskitas "cawi" (sangrillo o sangregado) y "ta" (punta), es decir punta de sangrillos o sangregados. 12 Vegetación del litoral Esta vegetación se caracteriza por la presencia de especies adaptadas a suelos arenosos y está limitada por la marea alta. La planta más común es Cocos nucifera (coco), también comunes son: Alibertia edu- lis (madroño), Amphitecna latifolia (jícaro de playa), Annona glabra (anona de charco), Chrysobalanus icaco (icaco), Coccoloba uvifera (uva de playa), Conocarpus erectus (Mangle botón), Costus woodsonii, Cyperus ligularis, Dalbergia ecastaphyllum, Hymenocallis littoralis, Inga multijuga, Ipomoea imperati, Ipomoea pes-caprae, Montrichardia arborescens, Morinda citrifolia (noni), Piper littorale (Piperaceae), Rhabdadenia biflora, Sphagneticola trilobata, Tabernaemontana alba (huevos de caballo), Talipariti tiliaceum, Terminalia catappa (almendro de playa), Thevetia ahouai (chirca silvestre), Randia aculeata, Vigna luteola yXylosma panamensis,. Por su carácter de transición esta vegetación es importante como sitio de paso para diversas especies de aves y mamíferos. Entre los mamíferos que suelen llegar a este tipo de vegetación están: el mapache (Procyon lotor), el pizote (Nasua narica), la guatuza (Dasyprocta punctata), los monos Carablanca (Cebus capucinus) y congo (Alouatta palliata), los perezosos de dos dedos (Choloepus hoffmanii) y tres dedos, la ardilla roja (Sciurus granatensis), entre otros. Las playas de la vertiente Caribe son importantes sitios de descanso y alimentación para numerosas especies migratorias. 13 Bosques de las cordilleras La mayor cobertura boscosa de la provincia encuentra caribeñas en de de la la Limón se estribaciones Cordillera de Talamanca, Fila Matama y Cordillera Volcánica Central. Es bien conocido que la flora y fauna más rica del país se encuentra a altitudes entre los 500 y 1500 msnm, por lo que hacer una descripción es sumamente difícil. Pocos estudios se han hecho en estos sitios, debido en gran parte, a la dificultad de acceso producto de la topografía irregular de la zona. La mayor parte de esta zona se encuentra protegida por el Parque Internacional La Amistad y reservas indígenas. Es un área que alberga una de las áreas más extensas de bosque denso la parte sur de Mesoamérica. Se encuentran ecosistemas de tierras medias, bosques montanos, robledales, sabanas de altura, turberas, lagos fríos y páramos. La flora puede albergar cerca de 3000 especies de plantas. La diversidad de otros grupos biológicos, tales como aves, mamíferos, anfibios y reptiles, insectos, de igual manera es inmensa. Esta zona es reconocida por ser un área de alto endemismo, de indiscutible importancia para la ciencia y la conservación. LITERATURA CITADA Acuña C., R. H. 2010. A new species of Zamia (Zamiaceae) from Costa Rica. Brenesia 73-74: 29-33. Beneyto, D. 2013. Humedales olvidados. [en línea]. http://www.espores.org/index.php?option= com_k2&view=item&id=217:article-investigació&Itemid=6&lang=es#startOfPageId217. [Mayo 2013]. 14 Bergoeing, J.P. 1998. Geomorfología de Costa Rica. Instituto Geográfico Nacional. San José, Costa Rica. Pp. 355-358. Bustillo, R., J.D. Alfaro, L. Tenorio, G. Aguilar, C. Garcia & B. Venegas. 1993. Diagnóstico de prefactibilidad del Corredor Biológico Talamanca-Caribe.The Nuature Conservancy. RBAACA-CEDARENA-MIRENEM-ANAL. 155 p. Coll, M., A. C. Fonseca & J. Cortés. 2001. El manglar y otras asociaciones vegetales de la laguna de Gandoca, Limón, Costa Rica. Rev. Biol. Trop. 49. Supl. 2: 321-329. Cortés, J. 1991. Ambientes y organismos marinos del Refugio Nacional de Vida Silvestre GandocaManzanillo, Limón, Costa Rica. GEOISTMO 5: 62-68. Gómez, L.D. 1986. Vegetación de Costa Rica, apuntes para una biogeografía costarricense. Vegetación y Clima de Costa Rica. Vol. 1. Editorial UNED. San José, Costa Rica. 323 pp. Jiménez, J.A. 1994. Los Manglares del Pacífico Centroamericano. EFUNA, Heredia, Costa Rica. 352 p. Jiménez, J.A. & R. Soto. 1985. Patrones regionales en la estructura y composición florística de los manglares de la costa pacífica de Costa Rica. Rev. Biol. Trop. 33: 25-37. Monro, A. K. 2009. A new species of Pilea (Urticaceae) from the Talamanca Mountains, Costa Rica. Phytotaxa 2 (24-28). Soto, D. A. & A. K. Monro. 2008. Una nueva especie de Cuatresia (Solanaceae) de Costa Rica y Panamá. J. Bot. Res. Inst. Texas 2: 41–44. Valverde, O. 1998. Estructura forestal y patrones floristicos de dos bosques tropicales húmedos de la cordillera de Talamanca, Costa Rica. Brenesia 49-50: 39-60. Zamora, N., B. E. Hammel, M. H. Grayum. 2004. Vegetación. In: B.E. Hammel, M. H. Grayum, C. Herrera & N. Zamora (eds.). Manual de Plantas de Costa Rica, Vol I. Monogr. Syst. Bot. Missouri Bot. Gard. 97 : 91-216. 15 DIVERSIDAD DE PLANTAS VASCULARES EN LA REGIÓN DE BAJA TALAMANCA, LIMÓN, COSTA RICA Armando Estrada Chavarría Herbario Nacional (CR) Departamento de Historia Natural Museo Nacional de Costa Rica [email protected] RESUMEN La región de Baja Talamanca incluye principalmente bosques húmedos y muy húmedos de elevaciones bajas y medias, con una representación de alrededor del 24% (2 258 especies), de la riqueza florística del país. Esta riqueza florística se concentra mayormente en las familias Rubiaceae y Fabaceae, seguidas por Poaceae, Araceae, Melastomataceae, Orchidaceae y Piperaceae, que entre todas incluyen poco más de un 30% del total de especies registradas. A nivel de géneros Piper, Psychotria, Anthurium, Miconia, Solanum, Inga, Peperomia, Thelypteris y Passiflora, representan los grupos más diversos. Las formas de vida herbácea y arborescente son la más predominante en términos de diversidad, seguidas por la vegetación arbustiva y por los bejucos y enredaderas en menor proporción. El componente epífito es relativamente bajo en la zona, representando casi un 14 % del total de especies registradas y dominado ampliamente por las familias Orchidaceae y Araceae y los géneros Anthurium, Peperomia y Philodendron. Existe, también un importante grupo de plantas acuáticas, de al menos 44 especies, muy comunes en lagunas y pantanos o incluso en el mar. Estas especies pertenecen mayormente a las familias Cyperaceae y Araceae, y a grupos de helechos y lirios de agua. Algunas de estas plantas viven totalmente sumergidas en aguas dulces y otras en aguas salinas como los llamados zacates marinos (Halodule wrightii, Syringodium filiforme y Thalassia testudinum). En relación con las especies de interés para la conservación se registraron 76 especies endémicas del país, lo cual representa alrededor de un 3% del total de especies del área, un porcentaje de endemismo bajo, en relación con el porcentaje nacional (11-12 %). Se registró, además, un grupo de 50 especies con una distribución restringida a esta región del Caribe Sur, muchas de las cuales son endémicas nacionales o regionales (Costa Rica – Panamá), las cuales forman parte de la flora exclusiva de esta región. También se registraron 29 especies bajo alguna categoría documentada de amenaza a su conservación. Finalmente los principales hallazgos registrados corresponden a entidades que aún se encuentran en estudio y que posiblemente representen, al menos, nuevos registros para la flora del país, además de la ampliación de distribución de algunas especies. 16 INTRODUCCIÓN El Caribe Sur costarricense es una exuberante región de bosques lluviosos tropicales, con una elevada riqueza florística, conformada por una mezcla de elementos amazónicos, antillanos, mesoamericanos, del Pacífico Suramericano y otros exclusivos de la región (Gómez 1982, 1986, Zamora et al. 2004). Esta región presenta ciertas particularidades ambientales y de vegetación que la distinguen como una unidad florística a nivel nacional, denominada por Zamora et al. (2004) como la región de Baja Talamanca. Esta área se diferencia de las regiones más al norte del Caribe costarricense, por una disminución de la humedad y la presencia de planicies más estrechas, producto de la cercanía de la cordillera de Talamanca al litoral (Zamora et al. 2004). La región se caracteriza además por una mayor heterogeneidad ambiental, que incluye como principales componentes geográficos la presencia de una zona litoral, planicies periódicamente inundadas y áreas onduladas de mejor drenaje, valles fluviales importantes y una abrupta región montañosa de mayor elevación, que corresponde a las estribaciones de la Cordillera. El ámbito altitudinal de la región va de los 0 a los 400 msnm. Estas condiciones permiten la presencia de variados ecosistemas y una flora muy diversa, que aunque característica de la región caribeña en general, presenta algunos elementos propios o exclusivos. En las zonas más bajas, planas y cercanas a la costa, se presentan áreas pantanosas y frecuentemente inundados, en las cuales se desarrollan asociaciones vegetales particulares (ej. cativales, yolillales, manglares), con alta dominancia de unas pocas especies (ej. Prioria copaifera, Pterocarpus officinalis, Carapa nicaraguensis, Pentaclethra macroloba, Raphia taedigera, Rhizophora mangle) y una baja diversidad florística. Las áreas con mejor drenaje y topografía irregular presentan una vegetación más heterogénea y variada, la cual se enriquece con elementos montanos en las áreas montañosas de mayor elevación cercanas a la cordillera (Zamora et al. 2004). A pesar de que se han hecho diversas incursiones por parte del Museo Nacional, Universidad de Costa Rica, Instituto Nacional de Biodiversidad y Missouri Botanical Garden para caracterizar y 17 documentar su riqueza biológica, aun quedan zonas sin explorar y especies de plantas aun desconocidas para la ciencia, algunas de los cuales han sido descritas en tiempos recientes (Hammel 2003, Kriebel 2004, Rodríguez 2004, Monro 2009, Acuña 2010, Gómez-Laurito 2010). Estos aspectos justifican la realización de este trabajo de recolecta y registro de observaciones de flora de esta región, con el fin de aportar conocimiento sobre la flora de la región de Baja Talamanca, para promover su conservación y uso sostenible, mediante productos divulgativos dirigidos al público en general residente y visitante de la ciudad de Limón. MATERIAL Y MÉTODOS Área de estudio El área de estudio incluye en su totalidad la región botánica denominada Baja Talamanca, la cual se extiende desde el sur del río Matina hasta la frontera de Panamá e incluye la zona litoral, las llanuras y las estribaciones de la cordillera de Talamanca hasta los 400 msnm (Zamora et al. 2004). Adicionalmente se incluyeron algunos sectores de la fila Matama (cordillera de Talamanca), de 400 hasta 1300 msnm (ver Fig. 1, de la sección de introducción de este informe), los cuales se analizan por separado. Los sitios de recolecta visitados durante el proyecto específicamente fueron: 1. Las Brisas de Veragua específicamente en la propiedad de Veragua Rainforest Park (incluyendo al Cerro Chimú), 2. Márgenes del río Bananito, en la propiedad de Selva Bananito Lodge, 3. Parque Nacional Cahuita (incluyendo a la localidad cercana de Estero Negro), 4. Refugio Nacional de Vida Silvestre Gandoca-Manzanillo y 5. Estribaciones de la Fila Matama (Cerros Chimú y Muchilla). 18 Recolección de la información La información de la diversidad de plantas en la zona de estudio se obtuvo tanto de datos previos a este estudio provenientes principalmente de bases de datos de herbarios, como de trabajo de campo realizado durante el proyecto (recolecta de plantas y observaciones de campo, 20112013). Los datos previos se obtuvieron mayormente de las bases de datos del Herbario Nacional (CR) y del Herbario del Instituto Nacional de Biodiversidad (INB), con corte al 2 de junio de 2014 (información previa existente). Se consultó además, algunas fuentes bibliográficas y de internet con información sobre la flora de la región (Epidendra 2014, Sánchez 1983). La información de las dos fuentes anteriores (datos previos y datos de trabajo de campo), se unieron en una base de datos con la información completa de cada espécimen la cual incluye: 1. grupo taxonómico, 2. familia, 3. Origen o procedencia (nativa, cultivada, introducida o naturalizada, endémica del país), 4. Nombre científico y autor, 5. Recolector y número, 6. Fecha de recolecta, 7. Descripción de localidad, 8. Coordenadas geográficas (latitud y longitud), 9. Elevación y 10. Descripción del espécimen. Adicionalmente, para cada especie se anotó la forma (hierba, arbusto, árboles y bejucos y enredaderas) y el hábito (terrestre vs. epífito) de la planta. Análisis de la información florística Previo al análisis de la información se realizó un proceso de depuración de los datos que consistió en eliminar registros duplicados y en estandarizar y actualizar la nomenclatura taxonómica de las especies. Las labores de estandarización y actualización taxonómica se realizaron mediante consulta al sistema TROPICOS del Missouri Botanical Garden (http:// www.tropicos.org/) y a la página Web Taxonomic Name Resolution Service (http://tnrs.iplantcollaborative.org/). 19 Los análisis realizados son descriptivos y consisten en resumir la información desde la perspectiva taxonómica. La diversidad florística de la zona de estudio se describe por medio de la composición de la flora en función de taxones (familia, géneros y especies), especies más comunes en diversos ambientes, especies de interés para la conservación (especies endémicas del país, especies exclusivas del Caribe Central y Sur y especies amenazadas) y especies de interés turístico. Lista con anotaciones de la flora En el Anexo 1 se incluye un listado florístico de las plantas del área de estudio. El listado está ordenado por grupo taxonómico mayor: Pteridophyta vs. Spermatophyta, Gimnospermas y Angiospermas (monocotiledóneas y dicotiledóneas). Dentro de cada uno se enumeran las familias, géneros y especies alfabéticamente. Para cada especie se indica: i) autor botánico, ii) espécimen testigo (iniciales del recolector, número de muestra y herbario donde está depositado), iii) Procedencia u origen de la especie y iv) Forma de crecimiento. RESULTADOS Diversidad taxonómica Los datos florísticos de la zona de estudio comprenden 11 285 registros, entre ejemplares de herbario (10 817 registros) y observaciones de campo (468 registros). Los ejemplares están debidamente herborizados y depositados en el Herbario Nacional (CR) y/o en el Herbario del Instituto Nacional de Biodiversidad (INB). Del total de ejemplares, 1 456 (13,5%) fueron recolectados durante el trabajo de campo realizado. Además, se generaron alrededor de 9 000 imágenes digitales de plantas. 20 En total, se registraron 2 258 especies de plantas vasculares nativas o naturalizadas (más 98 especies introducidas), que incluyen Helechos y grupos afines, Gimnospermas y Angiospermas (Cuadro 1). Esta diversidad de especies representa alrededor de un 24 % de la flora del país, de acuerdo con el dato nacional de diversidad de 9 361 especies (Zamora et al. 2004). Una lista con anotaciones se presenta en el Anexo 1, con todas las especies nativas e introducidas a la zona. Entre las familias con mayor número de especies (70 ó + spp.) destacan Rubiaceae (150 spp.), Fabaceae (138 spp.), Poaceae (105 spp.), Araceae (92 spp.), Melastomataceae (88 spp.), Orchidaceae (79 spp.) y Piperaceae (71 spp., Fig. 1), las cuales incluyen poco más del 30% (723 spp.) de la diversidad total de especies (2 258 sp). A nivel de géneros, los grupos más diversos (20 ó + spp.) fueron Piper (Piperaceae) con 48 spp., Psychotria (Rubiaceae) con 40 spp., Anthurium (Araceae) con 32 spp., Miconia (Melastomataceae) con 30 spp., Solanum (Solanaceae) con 27 spp., Inga (Fabaceae) con 23 spp., Peperomia (Piperaceae) con 23 spp., Thelypteris (Thelypteridaceae) con 22 spp. y Passiflora (Passifloraceae) con 20 spp. Cuadro 1. Diversidad taxonómica por categorías mayores de plantas vasculares en la región de Baja Talamanca. Categoría taxonómica Pteridophyta (helechos y afines) Lycophyta Pterophyta Spermatophyta Gimnospermae Coniferophyta Cycadophyta Gnetophyta Angiospermae Monocotyledoneae Dicotiledoneae Total Familias Géneros Especies 2 23 4 61 15 185 0 1 1 0 1 1 0 1 1 26 124 177 210 641 918 517 1 539 2 258 Familias 21 Acanthaceae Arecaceae Euphorbiaceae Gesneriaceae Cyperaceae Solanaceae Malvaceae Asteraceae Piperaceae Orchidaceae Melastomataceae Araceae Poaceae Fabaceae Rubiaceae Género s 0 50 100 150 Especies/Géneros 200 Figura 1. Familias de plantas vasculares más diversas en número de especies (+37 spp.) en la región de Baja Talamanca. Diversidad de forma de vida La flora del área de estudio está representada en una mayor proporción por vegetación herbácea (44 %) y vegetación arborescente (28 %) y en menor medida por vegetación arbustiva (17 %) y por bejucos y enredaderas (11 %, Fig. 2). Esta representación de formas o hábitos de vida de las plantas, es similar a la registrada a nivel nacional, donde predomina la vegetación herbácea (más aún cuando se incluye el componente epífito) y la vegetación arbórea (Zamora et al. 2004). 22 En cuanto a la representación taxonómica por cada forma de vida, en la vegetación herbácea (Fig. 3A) las familias más diversas son Poaceae (102 spp.), Araceae (88 spp.), Orchidaceae (76 spp.), Cyperaceae (54 spp.) y Asteraceae (40 spp.). En este tipo de vegetación las especies más abundantes (en función de la cantidad de veces registrada) son Tectaria incisa (Tectariaceae), Peperomia obtusifolia (Piperaceae), Adenostemma platyphyllum (Asteraceae), Anthurium ochranthum (Araceae), Anthurium upalaense (Araceae), Kyllinga tibialis (Cyperaceae), Columnea nicaraguensis (Gesneriaceae), Cyperus luzulae (Cyperaceae), Fimbristylis cymosa (Cyperaceae), Sphagneticola trilobata (Asteraceae), (Piperaceae), Peperomia pernambucensis (Piperaceae), Peperomia rotundifolia Thelypteris nicaraguensis (Thelypteridaceae), Anthurium bakeri (Araceae), Orthoclada laxa (Poaceae) y Phyla nodiflora (Verbenaceae), todos con 20 o más registros en toda la región). 1200 1000 Acuáticas 44 % Epífitas/Hemiepífitas No. de Especies Terrestres 800 28 % 600 17 % 400 11 % 200 0 Herbáceas Arbustivas Arborescentes Bejucos Forma de Vida Figura 2. Diversidad (número de especies) según la forma de vida de las plantas en la región de Baja Talamanca. 23 La vegetación arborescente (Fig. 3B) está representada mayormente por Fabaceae (75 spp.), Rubiaceae (64 spp.), Melastomataceae (38 spp.), Malvaceae (33 spp.) y Moraceae (31 spp.). Aquí las especies más abundantes corresponden a Carpotroche platyptera (Achariaceae), Posoqueria latifolia (Rubiaceae), Compsoneura mexicana (Myristicaceae), Psychotria grandis (Rubiaceae), Lunania parviflora (Salicaceae), (Rhizophoraceae), Malouetia Amphitecna guatemalensis latifolia (Apocynaceae), (Bignoniaceae), Cassipourea Mortoniodendron guianensis anisophyllum (Malvaceae), Perebea hispidula (Moraceae), Pterocarpus officinalis (Fabaceae), Sterculia costaricana (Malvaceae), Callicarpa acuminata (Lamiaceae), Colubrina spinosa (Rhamnaceae), Xylosma panamensis (Salicaceae), Coccoloba uvifera (Polygonaceae) y Unonopsis storkii (Annonaceae, todos con 18 o más registros en toda la región). En este tipo de vegetación la recolecta y el registro de las especies se ve muy afectado por el tamaño de los individuos, por lo cual es evidente un sesgo hacia especies arborescentes de menor tamaño. Al considerar solamente las especies de tamaños grandes (más de 20 m de altura), las más comunes fueron: Mortoniodendron anisophyllum (Malvaceae), Pterocarpus officinalis (Fabaceae), Sterculia costaricana (Malvaceae), Hura crepitans (Euphorbiaceae), Prioria copaifera (Fabaceae), Ficus maxima (Moraceae), Inga multijuga (Fabaceae), Quararibea asterolepis (Malvaceae), Luehea seemannii (Tiliaceae), Rhizophora mangle (Rhizophoraceae), Andira inermis (Fabaceae), Annona papilionella (Annonaceae), Pentaclethra macroloba (Fabaceae), Poulsenia armata (Moraceae), Symphonia globulifera (Clusiaceae), Spondias mombin (Anacardiaceae), Carapa nicaraguensis (Meliaceae), Ficus insipida (Moraceae), Trattinnickia aspera (Burseraeae) y Virola multiflora (Myristicaceae, todos con 7 o más registros en toda la región). En la vegetación arbustiva (Fig. 3C), dominan en diversidad Rubiaceae (47 spp.), Piperaceae (42 spp.), Melastomataceae (37 spp.), Solanaceae (33 spp.) y Arecaceae (26 spp.). Las especies arbustivas más abundantes fueron Acalypha costaricensis (Euphorbiaceae), Besleria trichostegia (Gesneriaceae), Varronia curassavica (Boraginaceae), Clidemia petiolaris (Melastomataceae), Malpighia albiflora (Malphigiaceae), Psychotria marginata (Rubiaceae), Neea amplifolia (Nyctaginaceae), Chamaedorea dammeriana (Arecaceae), Solanum rovirosanum (Solanaceae), 24 Lantana trifolia (Verbenaceae), Hamelia patens (Rubiaceae), Piper littorale (Piperaceae), Clidemia dentata (Melastomataceae), Alibertia edulis (Rubiaceae), Hamelia axillaris (Rubiaceae), Psychotria suerrensis (Rubiaceae), Tournefortia bicolor (Boraginaceae) y Varronia spinescens (Boraginaceae, todos con 18 o más registros en toda la región). Finalmente los bejucos y enredaderas (Fig. 3D), están mayormente representados por las familias Fabaceae (30 spp.), Cucurbitaceae (26 spp.), Passifloraceae (20 spp.), Convolvulaceae (16 spp.) y Bignoniaceae (15 spp.). Los bejucos y enredaderas más comunes fueron Cissus verticillata (Vitaceae), Ipomoea indica (Convolvulaceae), Ipomoea pes-caprae (Convolvulaceae), Ipomoea imperati (Convolvulaceae), Gurania makoyana (Cucurbitaceae), Ipomoea mauritiana (Convolvulaceae), Maripa nicaraguensis (Convolvulaceae), Passiflora megacoriacea (Passifloraceae), Schlegelia fastigiata (Schlegeliaceae), Aristolochia sprucei (Aristolochiaceae), Sechium venosum (Cucurbitaceae), Passiflora biflora (Passifloraceae), Passiflora vitifolia (Passifloraceae), Heteropsis oblongifolia (Araceae), Mendoncia retusa (Acanthaceae), Passiflora lobata (Passifloraceae), Sabicea villosa (Rubiaceae), Uncaria tomentosa (Rubiaceae), Ampelocissus javalensis (Vitaceae), Aristolochia trilobata (Aristolochiaceae), Canavalia rosea (Fabaceae), Momordica charantia (Cucurbitaceae), Smilax domingensis (Smilacaceae) y Solanum volubile (Solanaceae, todos con 10 o más registros en toda la región). 25 Figura 3. Familias con más especies en cada forma de vida: (A) Herbaceae, (B) Arborescente, (C) Arbustiva y (D) Bejucos y enredaderas, en la región de Baja Talamanca. En relación con el componente epífito en general (incluyendo hierbas y arbustos epífitos), este representa casi un 14% (314 especies) de la flora registrada en la región, menor que el patrón nacional de un 22% (Zamora et al. 2004) y que el de bosques nubosos (20-35%); pero mayor que el de las áreas más secas y estacionales del país (alrededor de un 2-5%, Cascante, en prep.) Este componente epífito está representado mayormente por las familias Orchidaceae (71 spp.) y Araceae (65 spp.), seguidas de lejos por las familias Bromeliaceae (28 spp.), Gesneriaceae (26 spp.), Polypodiaceae (22 spp.), Piperaceae (21 spp.) y en menor medida otras 21 familias (con menos de 10 spp. cada una, Fig. 4). A nivel de géneros destacan Anthurium (30 spp.), Peperomia (20 spp.), 26 Philodendron (16 spp.), Drymonia (11 spp.), Epidendrum (11 spp.), Monstera (11 spp.), Tillandsia (9 spp.), Asplenium (8 spp.) y Columnea (8 spp.). Acá las especies más abundantes fueron Peperomia obtusifolia (Piperaceae), Anthurium upalaense (Araceae), Columnea nicaraguensis (Gesneriaceae), Peperomia pernambucensis (Piperaceae), Peperomia rotundifolia (Piperaceae), Anthurium bakeri (Araceae), Peperomia serpens (Piperaceae), Anthurium obtusum (Araceae), Anthurium gracile (Araceae), Anthurium acutangulum (Araceae), Anthurium fatoense (Araceae), Monstera tuberculata (Araceae), Anthurium ravenii (Araceae), Aechmea pubescens (Bromeliaceae), Anthurium clavigerum (Araceae), Anthurium kunthii (Araceae), Anthurium spathiphyllum (Araceae), Anthurium watermaliense (Araceae), Columnea tulae (Gesneriaceae), Peperomia macrostachyos (Piperaceae), Drymonia macrophylla (Gesneriaceae), Philodendron radiatum (Araceae), Tillandsia bulbosa (Bromeliaceae), Vandenboschia collariata (Hymenophyllaceae), Weberocereus trichophorus (Cactaceae, todos con 10 o más de registros en toda la región). Existe, además, un importante grupo de plantas acuáticas, muy comunes en lagunas y pantanos o incluso en el mar. Este tipo de plantas se registraron 44 especies en la región, principalmente de las familias Cyperaceae (10 spp., géneros Eleocharis y Fimbristylis) y Araceae (4 spp.), Montrichardia arborescens, Pistia stratiotes, Urospatha grandis, Spirodela intermedia), del grupo de los helechos (6 spp., Ceratopteris pteridoides, Ceratopteris thalictroides, Acrostichum aureum, Acrostichum danaeifolium de la famila Pteridaceae y Azolla mexicana y Salvinia minima de la familia Salviniaceae) o de los llamados lirios ( Echinodorus tunicatus, Limnocharis flava, Limnocharis laforestii, Heteranthera reniformis, Pontederia sagittata, Eichhornia crassipes). Otras plantas viven totalmente sumergidas en aguas dulces como Ceratophyllum sp. (Ceratophyllaceae), Marathrum foeniculaceum (Podostemaceae) y Potamogeton crispus (Potamogetonaceae); o en aguas salinas como los llamados zacates marinos: Halodule wrightii (Cymodonaceae), Syringodium filiforme (Cymodoceaceae) y Thalassia testudinum (Hydrocharitaceae), además de Halophila decipiens (Hydrocharitaceae) otra especie marina sumergida. Familias 27 Urticaceae Rubiaceae Psilotaceae Hydrangeaceae Ericaceae Campanulaceae Asteraceae Solanaceae Lycopodiaceae Commelinaceae Santalaceae Loranthaceae Davalliaceae Pteridaceae Melastomataceae Hymenophyllaceae Cactaceae Marcgraviaceae Cyclanthaceae Aspleniaceae Dryopteridaceae Piperaceae Polypodiaceae Gesneriaceae Bromeliaceae Araceae Orchidaceae 0 10 20 30 40 50 No. de Especies 60 70 80 Figura 4. Diversidad de especies epífitas por familia en la región de Baja Talamanca. Especies de interés para la conservación En relación con las especies de interés para la conservación se registraron 76 especies endémicas del país (Apéndice I), lo cual representa alrededor de un 3% del total de especies del área, un porcentaje de endemismo bajo, en relación con el porcentaje nacional (11-12 %, Zamora et al. 2004) y esperable para esta zona. De estas especies destacan Chloroleucon sp. A 28 (Fabaceae/Mim.), Desmoncus costaricensis (Arecaceae), Dicranopygium tatica (Cyclanthaceae), Eugenia ludoviciana (Myrtaceae), Herpetacanthus stenophyllus (Acanthaceae), Hoffmannia subcapitata (Rubiaceae), Justicia almedae (Acanthaceae), Manilkara spectabilis (Sapotaceae), Mortoniodendron longipedunculatum (Malvaceae), Nectandra longipetiolata (Lauraceae), Paradrymonia alata (Gesneriaceae), Streblacanthus monospermus (Acanthaceae), Thelypteris oroniensis (Thelypteridaceae) y Weberocereus trichophorus (Cactaceae), todas con una distribución muy delimitada y restringida a la región del Caribe Sur costarricense, por lo cual se pueden considerar como plantas exclusivas de la zona. Otro grupo de especies, aunque no endémicas del país, tienen una distribución restringida a esta región del Caribe Sur, algunas incluso corresponden a endemismos regionales compartidos entre Costa Rica y Panamá (*), razón por la cual también son parte de esa flora exclusiva de la zona. Este grupo incluye 36 especies: Anthurium fatoense* (Araceae), Anthurium pageanum* (Araceae), Anthurium paludosum (Araceae), Calyptrogyne condensata* (Arecaceae), Cassytha filiformis (Lauraceae), Dicranopygium (Cyclanthaceae), Dracontium grandifolium spruceanum Dicranopygium (Cyclanthaceae), (Araceae), Dresslerothamnus wallisii angustiradiatus* (Asteraceae), Epidendrum angustisegmentum* (Orchidaceae), Ficus apollinaris (Moraceae), Gasteranthus acropodus* (Gesneriaceae), Gasteranthus imbricans* (Gesneriaceae), Goeppertia allenii* (Marantaceae), (Hydrocharitaceae), (Solanaceae), Halodule Heliconia Megalastrum wrightii Halophila (Cymodoceaceae), talamancana* (Heliconiaceae), Lycianthes squamosum (Dryopteridaceae), decipiens sanctae-marthae Monolena primuliflora (Melastomataceae), Monstera obliqua (Araceae), Passiflora pallida (Passifloraceae), Pentagonia hirsuta (Rubiaceae)*, Philodendron grayumii (Araceae), Psychotria sixaolensis (Rubiaceae)*, Quararibea gomeziana* (Bombacaceae), Reldia minutiflora (Gesneriaceae), Rhamnidium caloneurum* (Rhamnaceae), Rhynchospora colorata (Cyperaceae), Sciadocephala dressleri (Asteraceae), Scutellaria tenuipetiolata (Lamiaceae), Spartina spartinae (Poaceae), Syringodium filiforme (Cymodoceaceae), Terminalia buceras (Combretaceae), Thalassia (Hydrocharitaceae), Triolena spicata (Melastomataceae), Triplasis purpurea (Poaceae). testudinum 29 Dentro de las especies consideradas como amenazadas por diferentes estudios (Jiménez 1998, Estrada et al. 2005, Estrada & Rodríguez 2009), en la región se registraron 4 especies en la categoría de Peligro de Extinción o Peligro Crítico Abarema barbouriana (Fabaceae), Hymenolobium mesoamericanum (Fabaceae), Passiflora nelsonii (Passifloraceae), Passiflora pallida (Passifloraceae); 6 especies Amenazadas o En Peligro Cedrela odorata (Meliaceae), Copaifera aromatica (Fabaceae), Cynometra hemitomophylla (Fabaceae), Humiriastrum diguense (Humiriaceae), Passiflora arbelaezii (Passifloraceae), Sideroxylon capiri (Sapotaceae); y 19 especies categorizadas como Vulnerables, especialmente por ser especies muy escasas y/o sometidas a una explotación intensa: Balizia elegans (Fabaceae), Campnosperma panamensis (Anacardiaceae), Ceiba pentandra (Malvaceae), Dipteryx panamensis (Fabaceae), Dussia macroprophyllata (Fabaceae/Pap.), Lecythis ampla (Lecythidaceae), Macrohasseltia macroterantha (Flacourtiaceae), Maranthes panamensis (Chrysobalanaceae), Minquartia guianensis (Olacaceae), Passiflora guatemalensis (Passifloraceae), Passiflora seemannii (Passifloraceae), Passiflora serratifolia (Passifloraceae), Passiflora talamancensis (Passifloraceae), Prioria copaifera (Fabaceae/Caes.), Ruptiliocarpon caracolito (Lepidobotryaceae), Sacoglottis trichogyna (Humiriaceae), Terminalia buceras (Combretaceae), Terminalia bucidoides (Combretaceae) y Terminalia oblonga (Combretaceae). Finalmente existe un grupo de especies que presenta alguna característica de interés social o cultural ya sea por su historia cultural, uso o particularidad ecológica, lo cual las hace llamativas para el sector turístico y la sociedad en general. Entre estas especies destacan las tres únicas especies de “zacates” marinos conocidas en el país Halodule wrightii (Cymodonaceae), Syringodium filiforme (Cymodoceaceae) y Thalassia testudinum (Hydrocharitaceae), y las dos únicas especies de gimnospermas nativas encontradas en la región Gnetum leyboldii (Gnetaceae), Zamia neurophyllidia (Zamiaceae). Entre las especies de importancia cultural muy asociadas a la artesanía, medicina popular o gastronomía caribeña están: achiote (Bixa orellana), arasá (Eugenia stipitata), bejuco del hombre (Heteropsis oblongifolia), cacao (Theobroma cacao), caña brava (Gynerium sagittatum), cocotero (Cocos nucifera), estococa (Carludovica drudei), gavilana (Neurolaena lobata), 30 fruta de pan (Artocarpus altilis)*, icaco (Chrysobalanus icaco), indio desnudo (Bursera simaruba), jengibre (Zingiber officinale)*, jackfruit (Artocarpus heterophyllus)*, katuk (Sauropus androgynus)*, noni (Morinda citrifolia)*, ñampí (Dioscorea trifida)*, pejibaye (Bactris gasipaes)*, rosa de Jamaica (Hibiscus sabdariffa)*, seso vegetal (Blighia sapida)*, sorosí (Momordica charantia), uña de gato (Uncaria tomentosa), vainillas (Vanilla spp., Orchidaceae), yuca (Manihot esculenta), zarzaparrillas (Smilax spp.), muchas de ellas especies introducidas (*). Hallazgos de interés Los hallazgos de mayor relevancia encontrados dentro del área de estudio, se refieren a entidades que aún se encuentran en estudio y que posiblemente representen, al menos, nuevos registros para la flora del país, estas son Buchenavia sp. (Combretaceae), Caryodaphnopsis sp. (Lauraceae), Ficus sp. (Moraceae), Guarea sp. (Meliaceae), Ocotea sp. (Lauraceae), Pouteria sp. (Sapotaceae), Psiguria sp. (Cucurbitaceae) y Passiflora sp. (Passifloraceae). Por otra parte, se documentaron varias ampliaciones de distribución: Annona amazonica (Annonaceae), anteriormente conocido en el Pacífico Sur y en el Caribe solo en la Estación Biológica la Selva, Sarapiquí; Virola cf. macrocarpa (Myristicaceae), solo conocido en el Pacífico Central y Sur; Itzaea sericea (Convolvulaceae) antes conocida de la vertiente pacífica (Cerro Turrubares, El Rodeo y P.N. Carara); Arachnothryx costaricensis (Rubiaceae), solo conocido en vertiente Caribe de las cordilleras de Guanacaste y Tilarán y una colección del Pacífico Central; Vochysia gentryi (Vochysiaceae), una especie anteriormente solo conocida en la llanuras de San Carlos y en la vertiente Pacífica; Psychotria clivorum antes conocida de Upala y Nyssa talamancana (Cornaceae), un árbol de gran tamaño, muy escaso y endémico de Costa Rica y Panamá, anteriormente solo conocido un poco más al sur de esta región, entre 500 y 800 m (P.N. Hitoy Cerere, Amubri y Alto Lari en la cordillera de Talamanca y Bocas del Toro en Panamá). 31 Vegetación de las planicies (0-100 msnm) Esta región incluye todas las tierras bajas y las áreas costeras del Caribe Sur, de 0 a 100 msnm. En estas áreas se registró una diversidad de 1 854 especies nativas o naturalizadas (más 93 especies introducidas), provenientes de 8 147 registros de plantas. Las familias de plantas con mayor número de especies fueron: Fabaceae (119 spp.), Rubiaceae (108 spp.), Poaceae (100 spp.), Araceae (79 spp.), Melastomataceae (63 spp.), Asteraceae (59 spp.), Orchidaceae (58 spp.), Piperaceae (58 spp.), Cyperaceae (50 spp.) y Malvaceae (50 spp.). A nivel de géneros destacan Piper (41 spp.), Anthurium (29 spp.), Psychotria (27 spp.), Solanum (24 spp.) y Miconia (21 spp.). En comparación con los datos registrados para toda la región de Baja Talamanca, se presentan prácticamente las mismas familias y géneros más diversos, en un orden muy similar. En las áreas cercanas a la costa, se presentan bosques muy húmedos, con suelos mal drenados, donde son comunes especies arborecentes como Andira inermis (Fabaceae), Annona papilionella (Annonaceae), Apeiba membranacea (Malvaceae), Astrocaryum alatum (Arecaceae), Brosimum lactescens (Moraceae), Carapa nicaraguensis (Meliaceae), Cassipourea guianensis (Rhizophoraceae), Dussia macroprophyllata (Fabaceae), Elaeis oleifera (Arecaceae), Ficus colubrinae (Moraceae), Ficus insipida (Moraceae), Genipa americana (Rubiaceae), Grias cauliflora (Lecythidaceae), Hieronyma alchorneoides (Euphorbiaceae), Hura crepitans (Euphorbiaceae), Iriartea deltoidea (Arecaceae), Luehea seemannii (Malvaceae), Ormosia panamensis (Fabaceae), Otoba novogranatensis (Myristicaceae), Pentaclethra macroloba (Fabaceae), Poulsenia armata (Chilamate espinoso), Prioria copaifera (Fabaceae), Pterocarpus officinalis (Fabaceae), Quararibea asterolepis (Malvaceae), Socratea exorrhiza (Arecaceae), Spondias mombin (Anacardiaceae), Symphonia globulifera (Clusiaceae), Terminalia oblonga (Combretaceae), Virola koschnyi (Myristicaceae), Virola multiflora (Myristicaceae) y Virola sebifera (Myristicaceae). Una variante de estos bosques (La Selva Anegada Igapoide, denominada por Gómez 1986), son áreas dominadas principalmente por árboles de sangrillo (Pterocarpus officinalis) y cativo 32 (Prioria copaifera) y en menor grado la palma de yolillo (Raphia taedigera), los cuales presentan suelos con frecuencia inundados (ej. alrededores de Cieneguita, Estero Negro y P.N. Cahuita). Otras zonas pantanosas y también frecuentemente inundadas, presentan los llamados cativales, un tipo de bosque muy alto, donde predomina mayormente el cativo ( Prioria copaifera), aunque también son frecuentes especies como la caobilla (Carapa nicaraguensis), el guácimo colorado (Luehea seemannii), el gavilán (Pentaclethra macroloba), la fruta dorada (Virola koschnyi, V. multiflora y V. sebifera) y las palmas arborescentes Iriartea deltoidea y Socratea exorrhiza. También existen otras áreas que permanencen inundadadas permanentemente (La Selva Anegada Igapoide en su núcleo, según Gómez 1986), las cuales están dominadas básicamente por el yolillo ( Raphia taedigera), con muy pocas especies arborescentes como el sangrillo (Pterocarpus officinalis) y el gavilán (Pentaclethra macroloba). Estas áreas corresponden a los llamados Yolillales y presentan una diversidad muy baja (Gómez 1986), producto de estas extremas condiciones edáficas. En las áreas costeras las especies arborescentes más frecuentes son Andira inermis (Fabaceae), Annona glabra (Annonaceae), Amphitecna latifolia (Bignoniaceae), Citharexylum caudatum (Verbenaceae), Coccoloba uvifera (Polygonaceae), Cocos nucifera (Arecaceae), Elaeis oleifera (Areaceae), Inga multijuga (Fabaceae), Malouetia guatemalensis (Apocynaceae), Morinda citrifolia (Rubiaceae), Talipariti tiliaceum (Malvaceae), Terminalia catappa (Combretaceae), Thevetia ahouai (Apocynaceae) y Zygia latifolia (Fabaceae). Además de hierbas y arbustos como Alibertia edulis (Rubiaceae), Chrysobalanus icaco (Chrysobalanaceae), Costus woodsonii (Costaceae), Crinum erubescens (Amaryllidaceae), Dalbergia monetaria (Fabaceae), Dalbergia ecastaphyllum (Fabaceae), Hymenocallis littoralis (Amaryllidaceae), Montrichardia arborescens (Araceae), Nephrolepis brownii (Nephrolepidaceae), Piper littorale (Piperaceae), Posoqueria latifolia (Rubiaceae), Randia aculeata (Rubiaceae), Spathiphyllum friedrichsthalii (Araceae), Sphagneticola trilobata (Asteraceae) y bejucos como Canavalia rosea (Fabaceae), Ipomoea imperati (Convolvulaceae), Ipomoea mauritiana (Convolvulaceae), Ipomoea pes-caprae (Convolvulaceae), Rhabdadenia biflora (Apocynaceae) y Vigna luteola (Fabaceae). Por su parte, en los esteros es común la presencia de manglares, donde domina principalmente Rhizophora mangle 33 (Rhizophoraceae), junto a otros mangles como Avicennia germinans (Acanthaceae), Conocarpus erectus (Combretaceae) y Laguncularia racemosa (Combretaceae), además del helecho Acrostichum aureum (Pteridaceae). En los bordes de los ríos son típicos los árboles de Albizia carbonaria, Vachellia ruddiae y Zygia longifolia, todos de la familia Fabaceae, arbustos de Clibadium grandifolium (Asteraceae) y las hierbas Gynerium sagittatum (caña brava) y Pennisetum purpureum (Zacate gigante) de la famila Poaceae, que tienden a formar densos grupos. Vegetación de Veragua y áreas aledañas La localidad de Veragua incluye áreas de elevación baja y media entre los 100 y 500 msnm, como parte de las cuencas de los ríos Victoria, Peje y Segundo, al oeste de la ciudad de Limón. En esta región se registró una diversidad de 558 especies nativas o naturalizadas, provenientes de 835 registros de plantas. Las familias con mayor número de especies fueron: Rubiaceae (50 spp.), Melastomataceae (37 spp.), Araceae (32 spp.), Piperaceae (27 spp.), Fabaceae (24 spp.), Gesneriaceae (20 spp.), Orchidaceae (17 spp.), Malvaceae (14 spp.), Asteraceae (11 spp.), Meliaceae (11 spp.) y Solanaceae (11 spp.). A nivel de géneros destacan Piper (20 spp.), Anthurium (17 spp.), Psychotria (14 spp.), Miconia (13 spp.), Inga (12 spp.), Clidemia (9 spp.) y Heliconia (9 spp.). En comparación con los datos registrados para toda la región de Baja Talamanca, se presentan prácticamente las mismas familias y géneros más diversos, aunque no todos ubicados en el mismo orden; destaca el ascenso en diversidad de la familia Gesneriaceae y un descenso de la familia Fabaceae. Es muy posible también que se requiera mayor muestreo en algunos grupos (ej. Piperaceae, Asteraceae, Poaceae, Cyperaceae, Solanaceae, Arecaceae). Estas áreas presentan bosques muy húmedos con árboles que sobrepasan los 30 m de altura y hasta 2 m de diámetro, los cuales conforman el dosel superior. Entre las especies de árboles que podemos encontrar en este estrato se encuentran: Apeiba membranacea (Peine de mico), 34 Aspidosperma spruceanum (Apocynaceae), Brosimum lactescens (Moraceae), Bursera simaruba (Burseraceae), Carapa nicaraguensis (Meliaceae), Cedrela odorata (Meliaceae), Ceiba pentandra (Malvaceae), Chimarrhis parviflora (Rubiaceae), Chionanthus panamensis (Oleaceae), Cordia megalantha (Boraginaceae), Dussia macroprophyllata (Fabaceae), Ficus garcia-barrigae (Moraceae), Guarea kunthiana (Meliaceae), Hieronyma alchorneoides (Euphorbiaceae), Hura crepitans (Euphorbiaceae), Ilex skutchii (Aquifoliaceae), Inga leiocalycina (Fabaceae), Lecointea amazonica (Fabaceae), Macrohasseltia macroterantha (Salicaceae), Maranthes panamensis (Chrysobalanaceae), Matisia cordata (Malvaceae), Minquartia guianensis (Olacaceae), Mortoniodendron anisophyllum (Malvaceae), Pentaclethra macroloba (Fabaceae), Poulsenia armata (Moraceae), Pterocarpus officinalis (Fabaceae), Quararibea asterolepis (Malvaceae), Ruptiliocarpon caracolito (Lepidobotryaceae), Sterculia recordiana (Malvaceae), Symphonia globulifera (Clusiaceae), Tabebuia rosea (Bignoniaceae), Terminalia oblonga (Combretaceae), Trattinnickia aspera (Burseraceae), Virola koschnyi (Myristicaceae). En un segundo estrato debajo del dosel son abundantes árboles como Annona papilionella (Annonaceae), Calatola costaricensis (Icacinaceae), Brosimun guinense (Moraceae), Compsoneura mexicana (Myristicaceae), Jacaratia spinosa (Caricaceae), Protium spp. (Burseraceae), Matisia ochrocalyx (Malvaceae), Talauma gloriensis (Magnolia), Virola multiflora (Myristicaceae), Xylopia bocatorena (Annonaceae). En este estrato son distintivas y abundantes palmas arborescentes como Socratea exhorrhiza (Maquenque), Iriartea deltoidea (Palmito dulce, Chonta) y Astrocaryum alatum (Coquillo, coquito). La parte baja del bosque o sotobosque contiene una buena cantidad de palmas como la suita o coligallo (Calyptrogyne ghiesbreghtiana), la suita (Asterogyne martiana), arbustos de las familias de las rubiáceas y melastomatáceas, el cacao de montaña (Carpotroche platyptera), la guayaba de mono (Posoqueria latifolia), zamias (Zamia neurophyllidia), diversas plantas trepadoras entre las que destaca la familia de las aráceas con filodendros, anturios y tabacones y algunos helechos arborecentes (Cyathea stipularis y Alsophila cuspidata). En los bosques secundarios de etapas tempranas o intermedias de recuperación abundan las Heliconias (especialmente Heliconia longa, H. mariae, H. pogonantha var. holerythra), las Calateas 35 o platanillas (Marantaceae), hierbas de las familias Poaceae y Cyperaceae; el bejuco Uncaria tomentosa (Rubiaceae, Uña de gato) y arbustos o árboles pequeños de las familias Melastomataceae, Piperaceae y Rubiaceae (especialmente Isertia laevis y Psychotria berteriana), así como árboles de Cecropia insignis y C. obtusifolia (Urticaceae, guarumos), Colubrina spinosa (Rhamnaceae), Cordia cymosa (Boraginaceae), Inga spp. (Fabaceae, guabas), Ochroma pyramidale (Malvaceae, balsa), Pentaclethra macroloba (Fabaceae, gavilán), Senna papillosa (Fabaceae) y Trema micrantha (Cannabaceae, jucó). El componente epífito representa alrededor de un 14 % (81 spp.) de la flora total y está ampliamente representado por las familas Araceae (26 spp.), Gesneriaceae (13 spp.) y Orchidaceae (13 spp.) que incluyen más del 60% de esta flora epífita. A nivel de géneros destacan por su diversidad Anthurium (15 spp.), Drymonia (7 spp.), Peperomia (6 spp.), Columnea (5 spp.) y Philodendron (5 spp.). Algunas de las especies de epífitas más comunes son Anthurium bakeri, Anthurium cuspidatum, Anthurium clavigerum, Anthurium consobrinum, Anthurium ravenii, Anthurium watermaliense y Philodendron hederaceum de la familia Araceae; Columnea purpurata, Columnea maculata y Drymonia macrophylla de la familia Gesneriaceae; Peperomia macrostachyos, Peperomia rotundifolia y Peperomia serpens de la famila Piperaceae. Vegetación de las estribaciones de la Fila Matama (Cerros Chimú y Muchilla) Estas áreas incluyen las estribuaciones de la Fila Matama más cercanas a la costa, específicamente el cerro Chimú (cuenca alta del río Segundo) y el cerro Muchilla, en elevaciones que van de los 500 y 1300 msnm. En estas zonas, aunque más allá de la región de Baja Talamanca, se realizaron algunas incursiones a manera de exploración botánica, con el fin documentar la flora de una región poco explorada en el país, por lo cual los datos de diversidad todavía son muy preliminares. En estas áreas se registró una diversidad de 477 especies nativas o naturalizadas, provenientes de 714 registros de plantas. Las familias de plantas con mayor número de especies fueron: Rubiaceae (52 spp.), Araceae (38 spp.), Gesneriaceae (29 spp.), Melastomataceae (29 spp.), 36 Piperaceae (23 spp.), Arecaceae (20 spp.) Orchidaceae (11 spp.) y Clusiaceae (10 spp.). A nivel de géneros destacan Anthurium (26 spp.), Psychotria (16 spp.), Piper (14 spp.), Heliconia (9 spp.), Peperomia (9 spp.), Columnea (8 spp.), Drymonia (8 spp.) y Miconia (8 spp.). En comparación con los datos registrados para toda la región de Baja Talamanca, aunque se mantienen varias de las mismas familias y géneros más diversos, acá destaca la presencia de las familas Gesneriaceae, Arecaceae y Clusiaceae entre los primeros lugares en diversidad y la ausencia de Fabaceae en estos primeros lugares. En estas áreas se presentan bosques muy conservados y extensos, muy húmedos o pluviales, con nubosidad frecuente, condiciones diferentes a las de los bosques de áreas más bajas. Acá se presenta una composición florística más heterogénea y mezclada, difícil de caracterizar, con elementos de partes altas y bajas y un componente exclusivo de estas áreas medias. Algunos elementos arbóreos propios de estas áreas y ausentes en elevaciones bajas son Alzatea verticillata (Alzateaceae), Arachnothryx calycosa (Rubiaceae), Billia rosea (Sapindaceae), Byrsonima herrerae (Malpighiaceae), Chionanthus panamensis (Oleaceae), Daphnopsis morii (Thymelaeaceae), Dystovomita paniculata (Clusiaceae), Gordonia fruticosa (Theaceae), Helicostylis tovarensis (Moraceae), Inga latipes (Fabaceae), Meliosma depressiva (Sabiaceae), Meliosma glabrata (Sabiaceae), Nyssa talamancana (Cornaceae), Plinia salticola (Myrtaceae), Vochysia gentry (Vochysiaceae), Ternstroemia tepezapote (Theaceae). El componente epífito en estos bosques está mejor representado que en los bosques de tierras bajas del Caribe, con alrededor de un 22% de la flora total, con las familias Araceae (33 spp.), Gesneriaceae (14 spp.), Orchidaceae (9 spp.) y Piperaceae (8 spp.), como las familias más diversas. También los datos de endemismo tienen a ser mayores que en tierras bajas con cerca de un 6% (el doble del registrado para toda la región de Baja Talamanca). Varios de los hallazgos registrados y aún en estudio proceden de estas áreas: Passiflora sp. (Passifloraceae), Ficus sp. (Moraceae), Guarea sp. (Meliaceae). Además, es importante el registro de la especie Nyssa talamancana (Cornaceae), un árbol de gran tamaño, muy escaso y endémico de Costa Rica y Panamá, anteriormente solo conocido un poco más al sur de esta región, entre 500 y 37 800 m (P.N. Hitoy Cerere, Amubri y Alto Lari en la cordillera de Talamanca y Bocas del Toro en Panamá). CONCLUSIONES Y RECOMENDACIONES La región de Baja Talamanca aún posee una cobertura boscosa considerable, especialmente en sus partes montañosas. El presente estudio demuestra el valor de los bosques aquí presentes para la conservación, ya que albergan una alta diversidad florística (2 258 especies), estimada en alrededor de un 24 % de la flora costarricense. Además, se presentan especies exclusivas del Caribe Sur, que no se encuentran en otras partes del país (varias endémicas nacionales o regionales) y otras que se encuentran en alguna categoría de amenaza, principalmente por la sobreexplotación o por la pérdida de su hábitat. Además en esta región se encontraron especímenes que podrían resultar en informes o especies nuevas para el país. A nivel de ecosistémico en la región también se encuentra una importante representación de diferentes tipos de humedales (Manglares, Yolillales, Cativales, bosques de Sangrillos), que son hábitat de gran importancia para diferentes especies de flora y fauna. La principal amenaza de estos bosques sigue siendo la deforestación y desconocimiento de su importancia para las poblaciones humanas. En algunas partes aún se observa una intensa tala de árboles. En otros lugares con cobertura boscosa se presentan abras, socolado de la parte baja del bosque y apertura de caminos, con miras al cambio de uso de suelo. Es importante promover en la región actividades enfocadas a la protección y conservación de estos ricos bosques. Se debe difundir más el conocimiento disponible sobre la biodiversidad de esta región, promover su valoración e importancia para la sociedad e incentivar su uso sostenible con actividades económicas de bajo impacto ambiental, así como reconocer económicamente los servicios ambientales y ecosistémicos de las áreas silvestres aún presentes en la zona. 38 LITERATURA CITADA Acuña C., R. H. 2010. A new species of Zamia (Zamiaceae) from Costa Rica. Brenesia 73-74: 29-33. Bustillo, R., J.D. Alfaro, L. Tenorio, G. Aguilar, C. Garcia & B. Venegas. 1993. Diagnóstico de prefactibilidad del Corredor Biológico Talamanca-Caribe.The Nature Conservancy. RBAACA-CEDARENA-MIRENEM-ANAL. 155 p. Cascante, A. Las Plantas del Dosel del Bosque: Guía para los géneros de plantas epifitas floríferas de Costa Rica. Museo Nacional de Costa Rica. En prep. Epidendra: The Global Orchid Taxonomic Netword, 2004. Parque Nacional Cahuita [online]. <http://www.epidendra.org/parquesnacionales/cahuita/index.htm>.[julio 2014]. Estrada, A. & A. Rodríguez. 2009. Flores de Pasión de Costa Rica. Editorial INBio. Heredia, Costa Rica. 448 p. Estrada, A., A. Rodríguez A. & J. Sánchez. 2005. Evaluación y categorización del estado de conservación de plantas en Costa Rica. Museo Nacional de Costa Rica, Instituto Nacional de Biodiversidad, Sistema Nacional de Áreas de Conservación (SINAC-MINAET). Mimeografíado. 228 pp. Gómez-Laurito, J. 2010. Una nueva Eugenia L. (Myrtaceae) del Caribe costarricense. Brenesia 7374: 26-27. Hammel, B. 2003. New Species of Cyclanthaceae from Southern Central America and Northern South America. Novon 13: 52-63. Jiménez, Q. 1998. Árboles maderables en peligro de extinción en Costa Rica. 2da edición. Editorial INBio. Heredia, Costa Rica. 163 p. Kriebel Haehner, R. 2004. Two new species and one new name in the Gesneriaceae from Costa Rica. Rhodora 106(925): 43–51. Monro, A. K. 2009. A new species of Pilea (Urticaceae) from the Talamanca Mountains, Costa Rica. Phytotaxa 2: 24-28. 39 Rodríguez G., A. 2004. Cinco especies nuevas de Mortoniodendron (Tiliaceae) para Costa Rica. Novon 14(4): 476–485. Sánchez V., P.E. 1983. Flórula del Parque Nacional Cahuita. Editorial Universidad Estatal a Distancia. San José, Costa Rica. 377 p. Valverde, O. 1998. Estructura forestal y patrones floristicos de dos bosques tropicales húmedos de la cordillera de Talamanca, Costa Rica. Brenesia 49-50: 39-60. Zamora, N., B. E. Hammel, M. H. Grayum. 2004. Vegetación. In: B.E. Hammel, M. H. Grayum, C. Herrera & N. Zamora (eds.). Manual de Plantas de Costa Rica, Vol I. Monogr. Syst. Bot. Missouri Bot. Gard. 97 : 91-216. 40 LOS MACROHONGOS DE BAJA TALAMANCA, LIMÓN, COSTA RICA Armando Ruiz Boyer Departamento de Historia Natural Museo Nacional de Costa Rica [email protected] RESUMEN Se realizó un inventario de los macrohongos de la región de Baja Talamanca, Limón, Costa Rica. La información para este trabajo se obtuvo de una búsqueda en las colecciones depositadas en el Herbario Nacional de Costa Rica (CR) y en el Herbario del Instituto Nacional de Biodiversidad (INB); además, de las recolectas y observaciones de campo llevadas a cabo por el autor y otros investigadores del Departamento de Historia Natural del Museo Nacional de Costa Rica (MNCR), durante el período comprendido entre febrero de 2011 y septiembre de 2012. Un total de 146 especies se registraron para la zona. Los órdenes Polyporales y Agaricales (Basidiomycetes), y Xylariales (Ascomycetes), fueron los grupos mejor representados. Las especies más frecuentes corresponden a las orejas de palo Earliella scabrosa, Phellinus gilvus, Pycnoporus sanguineus, Rigidoporus microporus y Trametes elegans. Debido a las diferentes sustancias activas, por ejemplo alucinógenas y tóxicas, que poseen algunos de los hongos incluidos en este estudio, se recomienda consultar con un especialista cuando no se tenga total certeza de la identidad de ellos. En este trabajo se resaltan algunas especies de interés turístico por su condición alucinógena, medicinal, comestible y tóxica. El mantenimiento de los bosques en su estado natural, es de suma importancia para evitar no sólo la pérdida de los sustratos que requieren los hongos para su crecimiento, sino también para conservar la enorme biodiversidad que estos albergan, especialmente en las zonas tropicales. 41 INTRODUCCIÓN Los macrohongos son aquellos hongos que podemos observar fácilmente a simple vista, es decir, aquellos que se caracterizan por formar estructuras reproductoras macroscópicas. La mayoría de estos hongos se clasifican dentro de dos grandes divisiones o filos: Ascomycota y Basidiomycota (Franco-Molano et al. 2005), que en este estudio serán tratadas como Ascomycetes y Basidiomycetes, respectivamente. La primera de ellas representa el grupo más numeroso dentro del reino de los hongos y microscópicamente se distingue por poseer ascos y ascosporas, estas últimas estructuras se producen dentro de los ascos y por lo general se observan en número de ocho; mientras que la segunda está constituida por basidios y basidiósporas, las cuales se forman fuera del basidio y usualmente se presentan en número de cuatro (Binion et al. 2008). Los miembros de estos dos grupos poseen formas, colores y texturas muy variadas y llamativas; en éstos encontramos las conocidas copitas, los dedos, las sombrillas, las estrellas de tierra, los cuernos hediondos, los nidos de pájaro y las orejas de palo, entre otras. Por ejemplo, pueden crecer sobre madera viva o madera muerta, suelo, estiércol y hojarasca. Aunque, es posible encontrarlos sobre un sinfín de sustratos que proporcionen nutrientes para su buen desarrollo. Diversos hongos, representantes de dichas divisiones, son empleados como alimento por el ser humano, ya que, contienen tantos nutrientes como algunos alimentos de origen animal o vegetal, y además de gran cantidad de agua poseen proteínas, vitaminas, minerales y otras sustancias (Mata 2003). Otros son utilizados en la medicina tradicional porque tienen propiedades anticancerígenas y antitumorales, a que sirven como hemostáticos o de ellos se extraen sustancias para controlar y a veces curar algunas enfermedades (Franco-Molano et al. 2005). Sin embargo, algunos también pueden ser alucinógenos y tóxicos, debido a las diferentes sustancias activas que poseen. Por lo anterior, siempre es recomendable consultar con un especialista en micología, persona que estudia los hongos, cuando no se tenga total certeza de la identidad de ellos. En este 42 estudio se incluyen, en el apartado de especies de interés, algunos taxones que son de importancia por su condición alucinógena, medicinal, comestible y tóxica. El objetivo de este trabajo es documentar las especies de macrohongos presentes en el Caribe Sur de Costa Rica, con el fin de facilitar el conocimiento de la diversidad de estos organismos en el área, además de contribuir a fomentar los planes de manejo para la conservación de los bosques y la diversidad biológica en la zona. MATERIAL Y MÉTODOS La información para este estudio proviene de una búsqueda en las colecciones depositadas en el Herbario Nacional de Costa Rica (CR) y en el Herbario del Instituto Nacional de Biodiversidad (INB); además, de las recolectas y observaciones de campo realizadas por el autor y otros investigadores del Departamento de Historia Natural del Museo Nacional de Costa Rica (MNCR). Las recolectas y observaciones de campo se realizaron en la región de Baja Talamanca (ver Fig.1, de la sección de introducción de este informe), en tres zonas altitudinales. La primera comprende las planicies de 0-100 msnm. En esta zona se visitaron tres localidades: el Parque Nacional Cahuita (0-10 msnm), el Refugio de Vida Silvestre Gandoca-Manzanillo (0-10 msnm) y los márgenes del río Bananito (30-100 msnm). La segunda zona fue la localidad de Las Brisas de Veragua, concretamente en la propiedad de Veragua Rain Forest Park, con un gradiente altitudinal entre 230 y 420 msnm. También, se recorrieron las estribaciones sureste y noreste del cerro Muchilla (entre 140 y 490 msnm). La tercera zona fue las estribaciones del cerro Chimú, entre 600 a 700 msnm. Se efectuaron un total de 11 giras de campo entre febrero de 2011 y septiembre de 2012. Las giras se distribuyeron de la siguiente manera: 3 giras a Veragua Rain Forest Park (28 febrero-4 marzo 2011, 21-25 marzo 2011, 3-7 de octubre 2011), 2 giras a Bananito (11-15 abril 2011, 21-25 43 noviembre 2011), 3 giras al Parque Nacional Cahuita (22-26 agosto 2011, 7-11-mayo 2012, 12-14 septiembre 2012), 2 giras al Refugio de Vida Silvestre Gandoca-Manzanillo (9-13 abril 2012, 28-31 agosto 2012) y 1 gira a las estribaciones del cerro Chimú (10-11 septiembre 2012). Los ejemplares producto de dichas giras se encuentran depositados en el Herbario Nacional de Costa Rica (CR). Adicionalmente, se tomaron fotografías de los ejemplares, las cuales se utilizaron como material de apoyo y fueron incorporadas a la colección de imágenes del Departamento de Historia Natural del Museo Nacional de Costa Rica. Los especímenes se recolectaron al azar en bosques secundarios poco intervenidos a partir de recorridos por el sotobosque, orilla de ríos, bordes de caminos y senderos. Se examinaron troncos en pie, caídos o en descomposición y mantillo. Los cuerpos fructíferos recolectados se colocaron, según el grupo, en bolsas de papel o en papel encerado y se tomó nota de sus características macroscópicas (por ejemplo, color, forma y tamaño) en estado fresco así como del sustrato en el que se encontraron. Cuando fue posible se identificó el sustrato. Posteriormente, fueron llevados al herbario para su preservación e identificación. La preservación se realizó por secado en estufa a aproximadamente 30ºC durante 1 ó 2 días, de acuerdo con la consistencia de cada ejemplar. La identificación se realizó a partir de preparaciones de las estructuras fértiles de cada ejemplar montadas en KOH (Hidróxido de Potasio) al 3% y en reactivo de Melzer (Gilbertson & Ryvarden 1986), que luego fueron observadas por medio de un microscopio óptico. Se utilizó la literatura taxonómica disponible (Furtado 1967, 1981; Ryvarden & Johansen 1980; Gilbertson & Ryvarden 1986, 1987; Larsen & Cobb-Poulle 1990; Núñez & Ryvarden 1995; Ruiz-Boyer 1998; Mata 2003; Ryvarden 2004; Franco-Molano et al. 2005) y cuando los ejemplares no presentaron esporas, se compararon con muestras de herbario ya identificadas (Herbario Nacional de Costa Rica [CR], Herbario de la Escuela de Biología, Universidad de Costa Rica [USJ] y el Herbario del Instituto Nacional de Biodiversidad [INB]). 44 Se evaluaron características macroscópicas (por ejemplo, forma, tamaño y color) y microscópicas (por ejemplo, presencia o ausencia de estructuras estériles [cistidios, cistidiolos, setas, etc.], esporas y dimensiones) de los cuerpos fructíferos (Ryvarden 1991, Mata 2003, Mata et al. 2003, Franco-Molano et al. 2005). Las especies incluidas en este trabajo se listan en orden alfabético por clase, orden, familia y género según Kirk et al. (2001, 2008) y a cada una de ellas se le asocian observaciones (cuando lo amerita) y un ejemplar testigo (Anexo 2). Se excluyen de este estudio los microhongos y los Myxomycetes. RESULTADOS Y DISCUSIÓN Descripción de los macrohongos de Baja Talamanca Un total de 937 especímenes de macrohongos se registraron para la región de Baja Talamanca. Estos especímenes representan 146 especies que se distribuyen en 2 clases, 11 órdenes, 27 familias y 76 géneros. La clase Basidiomycetes fue la mejor representada con 126 especies (86,3%). La mayoría de las especies pertenecen a los órdenes Polyporales (60) y Agaricales (37), seguidos por los Geastrales y Phallales (7), Hymenochaetales (6), Auriculariales (5), Russulales (2), y Boletales y Trechisporales (1). De la clase Ascomycetes se encontró un número menor de especies (20) que representa un 13,7% del total. El orden Xylariales con 14 especies fue el mejor representado dentro de este grupo seguido por los Pezizales con 6 especies. Los Xylariales han sido mencionados como uno de los grupos mejor conocidos en zonas tropicales (Carranza et al. en prep.). Estos resultados coinciden con los obtenidos en La Estación La Leona, Parque Nacional Corcovado, Península de Osa, provincia de Puntarenas, donde la mayor diversidad estuvo representada igualmente por los Polyporales y los Agaricales (Basidiomycetes) y los Xylariales (Ascomycetes) (Carranza et al. en prep.). 45 La familia Polyporaceae (Basidiomycetes) con 18 géneros y 37 especies es la mejor representada en la zona de estudio (Fig.1). De acuerdo con la información disponible sobre la diversidad de la familia en Costa Rica (Carranza & Ruiz-Boyer 2005, Ruiz-Boyer 2006, Mata et al. 2007, Mata & Ryvarden 2010), los miembros de esta familia en la zona de Baja Talamanca representan aproximadamente un 21% de los géneros y un 11% de las especies que actualmente se conocen para el país. El género Xylaria (Ascomycetes, Xylariaceae, 10 especies) fue el que registró la mayor riqueza en la zona, seguido por Geastrum (Basidiomycetes, Geastraceae, 7 especies), Polyporus (Basidiomycetes, Polyporaceae, 6 especies), Rigidoporus (Basidiomycetes, Meripilaceae, 6 especies), Trametes (Basidiomycetes, Polyporaceae, 6 especies) y Auricularia (Basidiomycetes, Auriculariaceae, 5 especies). Las especies más frecuentemente recolectadas pertenecen al grupo de los Basidiomycetes y corresponden sin lugar a dudas a las orejas de palo: Earliella scabrosa, Phellinus gilvus, Pycnoporus sanguineus, Rigidoporus microporus y Trametes elegans. Estas especies parecen tener una distribución amplia en el país y es posible encontrarlas desde zonas bajas hasta zonas montañosas. Earliella scabrosa (Polyporaceae), se caracteriza por poseer basidiocarpos resistentes, efuso-reflejos, cutícula rojiza y los poros blancos a pardo-claros, los cuales varían de irregulares, alargados a sinuosos (Núñez & Ryvarden 2001). Phellinus gilvus (Hymenochaetaceae), se distingue por sus cuerpos fructíferos delgados, con la superficie del píleo que varía de glabra a densamente verrucosa, con una tonalidad distintivamente rojiza y por sus poros, que presentan una coloración rosadarojiza (Núñez & Ryvarden 2000). Pycnoporus sanguineus (Polyporaceae), se distingue por su consistencia coriácea y por poseer la superficie superior rojizo-anaranjada que con la edad se torna blancuzca, quedando sólo algunas zonas rojizas principalmente cuando esta expuesto al sol. La superficie inferior es del mismo color que la superior, y presenta poros redondos y pequeños (Gilbertson & Ryvarden 1987). Rigidoporus microporus (Meripilacerae), se caracteriza, cuando fresco, por sus basidiocarpos flexibles, de crema a anaranjados y cuando seco por su consistencia 46 dura. Sus poros son pequeños, de redondos a angulares, y difíciles de observar a simple vista. Trametes elegans (Polyporaceae), se distingue por su himenóforo frecuentemente variable, el cual puede ser lamelado a poroide-sinuoso en un mismo ejemplar (Ryvarden & Johansen 1980). Además, porque sus basidiocarpos poseen la superficie del píleo blancuzca, la cual puede presentar zonas pardo-oscuras o variar a blanco-grisáceas con la edad. 4 4 Mycenaceae Géneros 5 Hymenochaetaceae 4 6 Sarcoscyphaceae 3 6 Marasmiaceae Familias Especies 4 7 Ganodermataceae 3 7 Phallaceae 5 14 Xylariaceae 3 20 Agaricaceae 11 37 Polyporaceae 18 0 5 10 15 20 25 30 35 40 Número de géneros y especies Figura 1. Familias de macrohongos mejor representadas en la región de Baja Talamanca, provincia de Limón, Costa Rica. Se indica el número de géneros y especies por familia. Dentro del grupo de los Ascomycetes dos especies del género Cookeina (Sarcoscyphaceae) fueron las más comunes, a saber: C. speciosa y C. tricholoma. Ambas son especies comestibles de consistencia flexible o hulosa, que presentan forma de copa y que son de amplia distribución en el 47 país. La primera de ellas se caracteriza por la coloración anaranjada-rojiza con varias filas de pelos blancos finos y cortos en el margen de la copa. En tanto, que la segunda se distingue por su tonalidad anaranjada y por la presencia de pelos blancos a pardos que cubren toda la superficie externa de la copa. De acuerdo con Guzmán & Piepenbring (2011), estos hongos son comunes en áreas tropicales poco o nada perturbadas, por lo que pueden emplearse como indicadores ecológicos de poco disturbio en los bosques. Aunque la mayoría de las especies estudiadas poseen ámbitos amplios de distribución en Costa Rica, algunas de ellas representan datos importantes para la zona de estudio. Por ejemplo, la especie Rigidoporus microporus fue observada utilizando como sustrato un árbol vivo de la familia Melastomataceae, es decir, se encontró como un organismo parásito. Por lo general, esta especie se ha observado como saprófita en troncos que se encuentran en diferentes etapas de descomposición. Otros taxones por el contrario, como es el caso de Polyporus virgatus (Polyporaceae), parecen tener un ámbito de distribución más restringido. Esta especie es muy rara en Costa Rica y hasta este proyecto no se tenían ejemplares depositados en los principales herbarios nacionales (CR, USJ, INB). Al parecer representa la segunda recolecta en el país. De acuerdo con Carranza et al. (1984), el único registro conocido para Costa Rica hasta la fecha era el mencionado por Murrill (1915) en su obra “Tropical Polypores”. Esta especie también se ha descrito de Cuba (Murrill 1915) y de Colombia (Franco-Molano et al. 2005). Macroscópicamente se caracteriza por su píleo estriado (con surcos o hendiduras), usualmente infundibuliforme (con forma de embudo) y por la superficie oscura de los poros (Núñez & Ryvarden 1995). Algunas de las especies estudiadas poseen una distribución cosmopolita, es decir, han sido citadas a nivel mundial como son los casos de: Chlorophyllum molybdites, Coprinus disseminatus, Ganoderma applanatum sensu lato, Ganoderma lucidum sensu lato y Schizophyllum commune. Otras en cambio son más comunes a nivel tropical, tales como: Auricularia delicata, Cookeina speciosa, Cookeina tricholoma, Coriolopsis byrsina, Datronia caperata, Earliella scabrosa, Hexagonia hydnoides, Pycnoporus sanguineus, Trametes elegans, Trichaptum perrottetii y 48 Trichaptum sector. Aunque no fueron recolectadas o registradas durante el desarrollo de este trabajo es de esperar que algunas otras especies como por ejemplo: Perenniporia tephropora, Phellinus linteus y Trametes modesta, también se encuentren en la zona ya que son taxones frecuentemente observados en áreas tropicales y subtropicales (Gilbertson & Ryvarden 1987, Núñez & Ryvarden 2001, Ryvarden 2004). La mayoría de las especies estudiadas (más del 90%) fueron encontradas como saprófitas, es decir, creciendo sobre madera caída o en descomposición. Es posible que este hecho esté relacionado con la abundante madera muerta presente en las zonas visitadas, la cual es utilizada por los hongos que actúan como organismos descomponedores. Descripción de los macrohongos de las planicies (0-100 msnm) Un total de 245 especímenes de macrohongos se registraron para las planicies comprendidas entre 0-100 msnm (esto es, Parque Nacional Cahuita, Refugio de Vida Silvestre GandocaManzanillo y los márgenes del río Bananito), provincia de Limón. Estos especímenes representan 85 especies, que se distribuyen en 2 clases, 9 órdenes, 22 familias y 53 géneros. La clase Basidiomycetes fue la mejor representada con 82 especies (96,5%). La mayoría de las especies pertenecen a los órdenes Polyporales (46) y Agaricales (22), seguidos por los Phallales (5), Auriculariales (4), Hymenochaetales (2), y los Geastrales, Russulales y Trechisporales (1). En cuanto a la clase Ascomycetes, se encontró sólo tres especies que representan un 3,5% del total estudiado. Todas las especies encontradas pertenecen al orden Pezizales. No se documentaron especies del orden Xylariales, a pesar de ser uno de los grupos mejor conocidos dentro de los Ascomycetes en zonas tropicales (Carranza et al. en prep.). La familia Polyporaceae (Basidiomycetes) con 15 géneros y 32 especies es la mejor representada en la zona de estudio (Fig. 2). El género Polyporus (Basidiomycetes, Polyporaceae, 6 especies) fue el que registró la mayor riqueza en la zona, seguido por Trametes (Basidiomycetes, 49 Polyporaceae, 5 especies), Auricularia (Basidiomycetes, Auriculariaceae, 4 especies), Trichaptum (Basidiomycetes, Polyporaceae, 4 especies), Coriolopsis (Basidiomycetes, Polyporaceae, 3 especies), Ganoderma (Basidiomycetes, Ganodermataceae, 3 especies), Hexagonia (Basidiomycetes, Polyporaceae, 3 especies) y Rigidoporus (Basidiomycetes, Meripilaceae, 3 especies). 2 2 Mycenaceae 2 2 Marasmiaceae 4 Auriculariaceae Familias Especies Géneros 1 4 Ganodermataceae 2 5 Phallaceae 3 12 Agaricaceae 9 32 Polyporaceae 15 0 5 10 15 20 25 30 35 Géneros y Especies Figura 2. Familias de macrohongos mejor representadas en las planicies de 0-100 msnm. Se indica el número de géneros y especies por familia. La mayor parte de las especies encontradas en la zona fueron observadas principalmente en áreas boscosas. De ellas destacan, por la cantidad de ejemplares registrados, ocho orejas de palo que pertenecen a varias familias del orden Polyporales, a saber: Ganoderma australe sensu lato y Ganoderma applanatum sensu lato (Ganodermataceae), Phellinus gilvus (Hymenochaetaceae), Rigidoporus microporus (Meripilaceae), y Coriolopsis byrsina, Datronia caperata, Fomes fasciatus y Trametes elegans (Polyporaceae). Además, de la llamativa Caripia montagnei (Marasmiaceae, 50 Agaricales), que representa un hongo de distribución tropical, de tamaño pequeño, de consistencia dura y en forma de copa o embudo; cuyos cuerpos fructíferos presentan un color que varía de blanco a crema y que se desarrollan en grupos numerosos, algunas veces de más de 50 individuos. Este hongo crece sobre ramitas o troncos en descomposición tirados en el suelo y se ha mencionado que posee propiedades medicinales (antiinflamatorias) (Carranza et al. 2014). En el litoral, es decir, en los troncos caídos en la playa o en la vegetación detrás de la playa, fundamentalmente aquella ubicada a los lados de los senderos habilitados para los recorridos de los turistas, se observaron especies muy comunes como Ganoderma lucidum sensu lato (Ganodermataceae), Oudemansiella canarii (Physalacriaceae), Coriolopsis polyzona, Earliella scabrosa, Hexagonia hydnoides, Lentinus crinitus y Pycnoporus sanguineus (Polyporaceae), además de Schizophyllum commune (Schizophyllaceae). De acuerdo con Guzmán & Piepenbring (2011), los hongos Hexagonia hydnoides, Lentinus crinitus, Pycnoporus sanguineus, y Schizophyllum commune, son frecuentes en todos los tipos de vegetación tropical con fuerte alteración humana y que por lo tanto pueden emplearse como indicadores ecológicos de disturbio. Cabe indicar que algunas de las especies antes referidas se encontraron en ambos ecosistemas (área boscosa y litoral), aunque no fueron las más recolectadas o registradas para ser mencionadas en cada uno de ellos, tales son los casos de Coriolopsis polyzona, Earliella scabrosa y Hexagonia hydnoides. Por lo general, todas las especies anteriores presentan una distribución amplia en el país y la mayoría de ellas se han documentado principalmente para las zonas bajas, donde producen cuerpos fructíferos durante casi todo el año. Las especies más frecuentemente recolectadas en ésta franja altitudinal fueron: Cookeina speciosa, Cookeina tricholoma (Ascomycetes), Earliella scabrosa, Fomes fasciatus, Phellinus gilvus, Pycnoporus sanguineus, Rigidoporus microporus y Trametes elegans (Basidiomycetes). Fomes fasciatus (Polyporaceae) se caracteriza por su consistencia leñosa y por poseer la superficie superior con zonas que varían de pardas, pardo-oliváceas, grisáceas a negras con la edad. La superficie inferior es de pardo-clara a pardo-oscura, con poros pequeños y redondos, que son difíciles de observar a simple vista. En el país es común en bosques de tierras bajas, aunque puede ser observado desde el nivel del mar hasta los 2 100 m. 51 La mayoría de las especies identificadas en la zona (más del 90%) fueron encontradas creciendo sobre madera caída o en estado en descomposición, es decir, como organismos saprófitos. Descripción de los macrohongos de Veragua y alrededores Un total de 169 especímenes de macrohongos se registraron para la zona de Veragua. Estos especímenes representan 34 especies, que se distribuyen en 2 clases, 5 órdenes, 12 familias y 24 géneros. La clase Basidiomycetes fue la mejor representada con 33 especies (97,1%). La mayoría de las especies pertenecen al orden de los Polyporales (19), seguido por los Agaricales (9), Auriculariales (4) e Hymenochaetales (1). De la clase Ascomycetes, se encontró una sola especie, Cookeina speciosa (Sarcoscyphaceae), que representa un 2,9% del total estudiado. No se encontraron especies del orden Xylariales. La familia Polyporaceae (Basidiomycetes) con 10 géneros y 12 especies es la mejor representada en la zona de estudio (Fig. 3). El género Auricularia (Basidiomycetes, Auriculariaceae, 4 especies) fue el que registró la mayor riqueza en la zona, seguido por Ganoderma (Basidiomycetes, Ganodermataceae, 3 especies), Rigidoporus (Basidiomycetes, Meripilaceae, 3 especies), Polyporus (Basidiomycetes, Polyporaceae, 2 especies) y Trametes (Basidiomycetes, Polyporaceae, 2 especies). Las especies más frecuentemente recolectadas en la zona fueron: Earliella scabrosa, Rigidoporus microporus y Trametes elegans (Basidiomycetes). Todas son conocidas comúnmente como orejas de palo y son representantes de la familia Polyporaceae, una de las familias mejor estudiadas en el país (Carranza & Ruiz-Boyer 2005, Ruiz-Boyer 2006, Mata et al. 2007, Mata & Ryvarden 2010, Ryvarden 2012). La mayor parte de las especies analizadas (más del 90%) fueron encontradas creciendo sobre madera caída o en descomposición, es decir, como organismos saprófitos. 52 Figura 3. Familias de macrohongos mejor representadas en la zona de Veragua y alrededores, provincia de Limón, Costa Rica. Se indica el número de géneros y especies por familia. Descripción de los macrohongos de las estribaciones del cerro Chimú Un total de 10 especímenes de macrohongos se registraron para las estribaciones del cerro Chimú, provincia de Limón. Estos especímenes representan 10 especies, que se distribuyen en 1 clase, 3 órdenes, 5 familias y 9 géneros. Todas las especies identificadas pertenecen a la clase Basidiomycetes, por consiguiente no se encontraron especímenes de la clase Ascomycetes. La mayoría de las especies se incluyen en el orden de los Polyporales (7), seguido por los Agaricales (2) e Hymenochaetales (1). Las especies identificadas son: Dictyopanus pusillus, Coriolopsis floccosa, Ganoderma lucidum sensu lato, Nigrofomes melanoporus, Phellinus gilvus, Polyporus tenuiculus, Schizophyllum commune, Tinctoporellus epimiltinus, Trametes elegans y Trametes villosa. Todas fueron observadas creciendo sobre troncos en descomposición, es decir, actuando como organismos saprófitos. Excepto por Dictyopanus pusillus (Mycenaceae) y Schizophyllum commune 53 (Schizophyllaceae), el resto de las especies encontradas corresponden al grupo de las conocidas orejas de palo, que la principal característica macroscópica en la mayor parte de las especies es la presencia de poros en la superficie inferior del cuerpo fructífero. A pesar de poseer poros, Dictyopanus pusillus no es considerado en la literatura como un miembro del orden Polyporales, sino que es incluido en el orden Agaricales (Kirk et al. 2008). Esta especie presenta un tamaño pequeño y una coloración que varía de blanca, amarillenta a gris claro y a veces presenta tonos rosados, con poros angulares que varían de 3-4 por milímetro (Franco-Molano et al. 2000). Descripción de los macrohongos de las estribaciones del cerro Muchilla Un total de 21 especímenes de macrohongos se registraron para las estribaciones sureste y noreste del cerro Muchilla, provincia de Limón. Estos especímenes representan 12 especies, que se distribuyen en 2 clases, 3 órdenes, 5 familias y 11 géneros. La clase Basidiomycetes fue la mejor representada con 11 especies (91,7%). La mayoría de las especies pertenecen al orden de los Polyporales (9), seguido por los Agaricales (2). De la clase Ascomycetes, se encontró una sola especie, Cookeina speciosa (Sarcoscyphaceae), que representa un 8,3% del total estudiado. Las especies identificadas son: Caripia montagnei, Cookeina speciosa, Coriolopsis byrsina, Coriolopsis polyzona, Cyathus striatus, Earliella scabrosa, Ganoderma australe sensu lato, Hexagonia hydnoides, Nigroporus vinosus, Rigidoporus microporus, Trametes elegans y Trichaptum perrottetii. Todas fueron observadas creciendo sobre troncos en descomposición. De las especies anteriores, Cyathus striatus (Agaricaceae) representa una de las más llamativas por la forma de nido de pájaro que poseen sus cuerpos fructíferos. Por su pequeño tamaño y por su coloración pardo oscura es algo difícil de observar en el campo. Sin embargo, una vez visto es fácil de reconocer principalmente por los surcos o hendiduras longitudinales profundas, brillantes y de color gris ceniza que posee en la cara interna de la copa (Calonge 1999). 54 Especies de interés A continuación se presentan algunas de las especies encontradas que son de interés por su condición alucinógena, medicinal, comestible y tóxica. Auricularia delicata (Auriculariaceae). Especie de distribución tropical, se ha comunicado desde México a Ecuador e islas del Caribe (Mata 2003). En Costa Rica es común en todo el país. Se distingue por la consistencia gelatinosa del cuerpo fructífero y por la apariencia reticulada de la superficie fértil o inferior, característica que sólo se presenta en ésta especie de Auricularia (Mata 2003). Es comestible (Franco-Molano et al. 2005). Auricularia fuscosuccinea (Auriculariaceae). Especie de amplia distribución, se conoce de las zonas templadas de América del Sur y en América tropical, desde Tennessee (Estados Unidos) hasta Argentina; Australia, Filipinas y Guyana (Franco-Molano et al. 2005). En Costa Rica es común en todo el país. Es comestible (Franco-Molano et al. 2005). Auricularia mesenterica (Auriculariaceae). Especie que se ha comunicado para Europa, Asia, Australia y América (Mata 2003). En Costa Rica se encuentra en zonas húmedas, sobre madera caída o en descomposición, aunque también es posible encontrarla como parásito (Mata 2003). Es comestible (Mata 2003, Franco-Molano et al. 2005). Chlorophyllum molybdites (Agaricaceae). Especie cosmopolita (Franco-Molano et al. 2000). En Costa Rica ha sido comunicada para las provincias de San José, Heredia, Limón y Guanacaste (Mata 2003), también se ha documentado para el Parque Nacional Corcovado, Península de Osa, provincia de Puntarenas (Carranza et al. 2014). Esta especie crece en zonas abiertas y se caracteriza por su forma de sombrilla, su consistencia carnosa y por las escamas pardo claras que presenta en la superficie superior del cuerpo fructífero. No obstante, su principal distinción está en la superficie inferior, la cual posee lamelas de color blanco cuando joven a verdes cuando envejece, de ahí su 55 nombre, que proviene de las palabras griegas “Chlorós”=Verde y “Phýllon”=Lamelas. Representa un hongo tóxico (Franco-Molano et al. 2000), que puede causar náuseas, vómito, diarrea, calambres y a veces hemorragias intestinales (Mata 2003). Cookeina speciosa (Sarcoscyphaceae). Especie de distribución tropical. Se ha observado en Centroamérica, el Caribe, América del Sur, África y Asia (Denison 1967). En Costa Rica se ha documentado en todo el país (Mata 2003), principalmente en zonas bajas, creciendo por lo general sobre troncos en descomposición. Su forma de copa y la coloración anaranjada-rojiza del cuerpo fructífero favorecen su fácil identificación en el campo. Ha sido comunicada como comestible en México (Boa 2004); sin embargo, en Costa Rica sus usos no son conocidos (Mata 2003). Coprinus disseminatus (Agaricaceae). Especie de distribución cosmopolita, se encuentra en zonas templadas y tropicales (Franco-Molano et al. 2005). En Costa Rica es común en todo el país en zonas boscosas y urbanas (Mata 2003). Su coloración blanco-grisácea y su superficie muy estriada y polvosa ayudan a su identificación (Mata 2003). Es comestible, no obstante carece de interés culinario por su pequeño tamaño y la dificultad de limpiar los cuerpos fructíferos (Mata 2003). Ganoderma applanatum sensu lato (Ganodermataceae). Especie de distribución cosmopolita, que pertenece a un complejo que incluye varios taxones (Moncalvo & Ryvarden 1997). Se encuentra creciendo sobre troncos caídos o en descomposición en todo el país. Se reconoce por la consistencia leñosa y pesada de los cuerpos fructíferos y por el himenóforo o superficie inferior formada por poros de color blancuzco, los cuales pueden tornarse pardo-oscuros al manipularse (Mata 2003). Posiblemente sea medicinal, ya que se estudia como inhibidor de la formación de células cancerígenas (Mata 2003). Ganoderma lucidum sensu lato (Ganodermataceae). Es una especie de distribución cosmopolita, que pertenece a un complejo que incluye varios taxones (Moncalvo & Ryvarden 1997). En Costa Rica se encuentra en todo el país, creciendo sobre árboles vivos o troncos en descomposición. Ha sido 56 utilizada tradicionalmente en la medicina oriental por su efecto vigorizante, debido a que incrementa la longevidad, la potencia sexual, la resistencia y la recuperación de enfermedades; también se usa en el tratamiento contra el cáncer (Franco-Molano et al. 2005). Hexagonia hydnoides (Polyporaceae). Especie de amplia distribución en el trópico (Franco-Molano et al. 2005). En Costa Rica, se encuentra en todo el país, principalmente en zonas bajas (Mata et al. 2003). Se distingue por poseer una masa densa de pelos negros erectos y ramificados sobre la superficie superior del píleo (Gilbertson & Ryvarden 1986), los cuales pueden llegar a caerse total o parcialmente y dejar al descubierto una superficie pardo-oscura y a menudo brillante. En México es utilizado en la medicina tradicional para aliviar erupciones, verrugas o infecciones de la piel, esto se logra frotando la superficie porosa del hongo contra la piel afectada (Guzmán 1997). En Costa Rica sus usos son desconocidos (Mata et al. 2003). Psilocybe cubensis (Strophariaceae). Especie de amplia distribución en América del Norte, América Central, islas del Caribe y América del Sur (Mata 2003). En Costa Rica se encuentra en todo el país, creciendo en potreros sobre estiércol o suelo (Mata 2003). Representa uno de los hongos alucinógenos más comunes en los potreros subtropicales de todo el mundo (Guzmán & Piepenbring 2011). Se le conoce como el “hongo mágico” y se ha utilizado en rituales indígenas en México y América Central (Mata 2003). Pycnoporus sanguineus (Polyporaceae). Especie de distribución tropical. En Costa Rica se encuentra en todo el país (Mata 2003). Se distingue por la coloración rojizo-anaranjada de los cuerpos fructíferos (tanto la superficie superior como la inferior), los cuales crecen sobre madera en descomposición en zonas abiertas. Es utilizado por algunas comunidades indígenas por sus propiedades medicinales. En México lo usan para eliminar verrugas y desinflamar los pies (PérezSilva et al. 1988). 57 Schizophyllum commune (Schizophyllaceae). Especie cosmopolita, que crece sobre ramas o troncos en descomposición. En Costa Rica es muy común en todo el país (Mata 2003). Ha sido utilizada como comestible en países como Etiopía, México y Guatemala (Franco-Molano et al. 2005). Según Guzmán & Piepenbring (2011), es comercializada en los mercados populares en los dos últimos países. De acuerdo con Hobbs (1995), ésta especie tiene propiedades que inhiben la formación de tumores e incrementan la vitalidad. No obstante, Franco-Molano et al. (2000) indica que también puede causar trastornos en personas con deficiencias inmunológicas. CONCLUSIONES Y RECOMENDACIONES La presencia de los hongos en la naturaleza es de gran beneficio, entre otras razones porque actúan como organismos descomponedores, por lo que favorecen el equilibrio en los ecosistemas a partir del flujo de energía y nutrientes. El mantenimiento de los bosques en su estado natural, es de suma importancia para evitar no sólo la pérdida de los sustratos que requieren los hongos para su crecimiento, sino también para conservar la enorme biodiversidad que estos albergan, especialmente en las zonas tropicales. Un mejor conocimiento de los hongos de zonas tropicales se logra con ecosistemas que tengan un alto grado de conservación, es decir, donde encontremos madera viva y madera muerta, ésta última principalmente en diferentes etapas de descomposición. Con el cumplimiento de esta pauta favoreceríamos el desarrollo, el conocimiento y el estudio de las diferentes especies fúngicas, que también son vitales en otros campos, debido a que tienen gran importancia económica pues son utilizadas en la alimentación, en la industria y en la medicina. En este estudio se incluyen hongos con propiedades alucinógenas, medicinales, comestibles y tóxicas; y aunque, la mayoría de los hongos que encontramos en nuestros bosques no son tóxicos, siempre es recomendable consultar con un especialista si existiese duda de la identidad de las especies. Se espera que la información que se suministra en éste trabajo sirva de insumo y contribuya a mejorar los planes de manejo y conservación de los bosques del Caribe Sur de nuestro país. 58 LITERATURA CITADA Binion, D.E., S.L. Stephenson, W.C. Roody, H.H. Burdsall Jr., L.N. Vasilyeva & O.K. Miller Jr. 2008. Macrofungi Associated with Oaks of Eastern North America. West Virginia University Press. 467 p. Boa, E. 2004. Wild edible fungi: a global overview of their use and importance to people. FAO Technical papers 17. Roma, Italia. 147 p. Calonge, F.D. 1999. Setas de Madrid (y alrededores). 2. Gasteromycetes. Sociedad Micológica de Madrid. Eurocolor, España. 159 p. Carranza, J. & A. Ruiz-Boyer. 2005. Checklist of polypores of Costa Rica. Revista Mexicana de Micología 20: 45-52. Carranza, J. & J.A. Sáenz. 1984. Wood decay fungi of Costa Rica. Mycotaxon 29: 151-166. Carranza Velázquez, J., W. Marín Méndez, A. Ruiz Boyer & J.F. DiStéfano. 2014. Guía de los macrohongos más comunes del Parque Nacional Corcovado, Estación La Leona. San José, Costa Rica. Editorial de la Universidad de Costa Rica. 94 p. Carranza, J., W. Marín Méndez, A. Ruiz-Boyer & J.F. DiStéfano. En prep. Riqueza de macrohongos en la Estación La Leona, Parque Nacional Corcovado, Puntarenas, Costa Rica. Denison, W. 1967. Central American Pezizales. II. The Genus Cookeina. Mycologia 59:306-317. Franco-Molano, A.E., R. Aldana-Gómez & R.E. Halling. 2000. Setas de Colombia (Agaricales, Boletales y otros hongos). Guía de campo. Multimpresos Ltda. Medellín, Colombia. 156 p. Franco-Molano, A.E., A.M. Vasco-Palacios, A.A. López-Quintero & T. Boekhout. 2005. Macrohongos de las Región del medio Caquetá-Colombia. 1 ed. Multimpresos Ltda. Medellín, Colombia. 211 p. Furtado, J.S. 1967. Some tropical species of Ganoderma (Polyporaceae) with pale context. Persoonia 4(4): 379-389. Furtado, J.S. 1981. Taxonomy of Amauroderma (Basidiomycetes, Polyporaceae). Memoirs of the New York Botanical Garden 34: 1-109. Gilbertson, R.L. & L. Ryvarden. 1986. North American Polypores. Vol. I. Fungiflora, Oslo. 59 Gilbertson, R.L. & L. Ryvarden. 1987. North American Polypores. Vol. II. Fungiflora, Oslo. Guzmán, G. 1997. Los nombres de los hongos y lo relacionado con ellos en América Latina. Introducción a la etnomicobiota y micología aplicada de la región. Sinonimia vulgar y científica. Instituto de Ecología, A.C., Xalapa, Veracruz, México. 356 p. Guzmán, G. & M. Piepenbring. 2011. Los hongos de Panamá. Introducción a la identificación de los macroscópicos. Instituto de Ecología, A. C., Xalapa, Veracruz, México. 372 p. Hobbs, L. 1995. Medicinal mushrooms: an exploration of tradition, healing and culture. 3 ed. Interweave Press, Inc. Loveland, Colorado. 161 p. Kirk, P.M., P.F. Cannon, J.C. David & J.A. Stalpers. 2001. Ainsworth & Bisby’s Dictionary of Fungi. 9th ed. International Mycological Institute. CAB International, London, UK. Kirk, P.M., P.F. Cannon, D.W. Minter & J.A. Stalpers. 2008. Ainsworth & Bisby’s Dictionary of Fungi. 10th ed. CAB International, Wallingford, UK. Larsen, M.J. & L.A. Cobb-Poulle. 1990. Phellinus (Hymenochaetaceae). A survey of the world taxa. Fungiflora, Oslo. Mata, M. 2003. Macrohongos de Costa Rica. Instituto Nacional de Biodiversidad. Vol. I. 2 da ed. Santo Domingo, Heredia, Costa Rica. 256 p. Mata, M., R. Halling & G.M. Mueller. 2003. Macrohongos de Costa Rica. Instituto Nacional de Biodiversidad. Vol. II. Santo Domingo, Heredia, Costa Rica. 240 p. Mata, M., A. Ruiz-Boyer, J. Carranza & L. Ryvarden. 2007. Nuevos registros de hongos poliporoides (Basidiomycetes) para Costa Rica. Boletín de la Sociedad Micológica de Madrid 31: 123-129. Mata, M. & L. Ryvarden. 2010. More new and interesting species from Costa Rica. Studies in neotropical polypores 27. Synopsis Fungorum 27. Fungiflora, Oslo. Moncalvo, J.M. & L. Ryvarden. 1997. A nomenclatural study of the Ganodermataceae Donk. Fungiflora, Oslo, Norway. 114 p. Murrill, W. A. 1915. Tropical Polypores. New York. 113 p. Núñez, M. & L. Ryvarden. 1995. Polyporus (Basidiomycotina) and related genera. Sinopsis Fungorum 10. Fungiflora, Oslo. 60 Núñez, M. & L. Ryvarden. 2000. East Asian Polypores. Ganodermataceae and Hymenochaetaceae. Vol. I. Synopsis Fungorum 13. Fungiflora, Oslo. Núñez, M. & L. Ryvarden. 2001. East Asian Polypores. Polyporaceae s. lato. Vol. II. Synopsis Fungorum 14. Fungiflora, Oslo. Pérez-Silva, E., E. Aguirre-Acosta & C. Pérez-Amor. 1988. Aspectos sobre el uso y la distribución de Pycnoporus sanguineus (Polyporaceae) en México. Rev. Mex. Micol. 4:137-144. Ruiz-Boyer, A. 1998. La familia Ganodermataceae (Aphyllophorales) en Costa Rica. Brenesia 49-50: 21-37. Ruiz-Boyer, A. 2006. Los hongos poliporoides (Basidiomycetes) del Área de Conservación Pacífico Central (ACOPAC), Costa Rica. Brenesia 65:19-41. Ryvarden, L. 1991. Genera of polypores, nomenclature and taxonomy. Synopsis Fungorum 5. Fungiflora, Oslo. Ryvarden, L. 2004. Neotropical polypores. Part I. Synopsis Fungorum 19. Fungiflora, Oslo. Ryvarden, L. 2012. Studies in neotropical polypores 32. Some new species from Costa Rica. Synopsis Fungorum 30: 33-43. Ryvarden, L. & I. Johansen. 1980. A preliminary polypore flora of East Africa. Fungiflora, Oslo. 61 CARACTERIZACIÓN DE MAMÍFEROS EN LA REGIÓN DE BAJA TALAMANCAY ESTRIBACIONES DE LA FILA MATAMA, LIMÓN, COSTA RICA Francisco Durán Alvarado Mastozoología Departamento de Historia Natural Museo Nacional de Costa Rica [email protected] RESUMEN Se realizó un muestreo de campo y revisión de bases de datos para elaborar una caracterización de la riqueza de mamíferos en algunos sectores de la región de Baja Talamanca, Limón, Costa Rica. Se visitaron las localidades de Las Brisas de Veragua, Bananito, Parque Nacional Cahuita, Refugio Nacional de Vida Silvestre Gandoca-Manzanillo y Cerro Chimú. Se utilizaron varias técnicas de muestreo de mamíferos: redes de niebla, trampas Sherman, trampas Tomahawk, cámaras trampa, recorridos para observaciones visuales, búsqueda de huellas y consultas a funcionarios y residentes de los lugares visitados. Se registraron 91 especies de mamíferos. El grupo con más representatividad de especies fue el de los murciélagos (Chiroptera) con 47, seguido de los carnívoros (Carnivora) con 13 especies y los roedores (Rodentia) con 11. Entre los grupos con menos representatividad están: el armadillo (Dasypus novemcinctus), conejo de monte (Sylvilagus gabbi) y la danta (Tapirus bairdii) solo presentan una especie. Entre los murciélagos tres especies del género Carollia (C. perspicillata, C. castanea y C. sowelli) y una del género Artibeus (A. jamaicensis) fueron las que más se capturaron con más de la mitad de los registros. De las 91 especies de mamíferos, 54 fueron registradas en alguna de las localidades de la zona de las planicies (Bananito, Cahuita, Gandoca-Manzanillo) y 55 fueron registradas en Veragua (esto incluye naturalmente varias especies que fueron registradas en ambas zonas de estudio). Entre las especies de importancia para la conservación destacan el puma (Puma concolor), el jaguar (Panthera onca), el saino (Pecari tajacu), el cabro de monte (Mazama temama) y la danta (Tapirus bairdii). De las especies registradas, 17 se incluyen en alguna categoría de amenaza dentro de las listas de UICN, CITES o MINAET. La cacería y la pérdida de hábitat estén entre las principales amenazas de estas especies de mamíferos. 62 INTRODUCCIÓN La mastofauna de Costa Rica ha sido estudiada con cierto detalle en algunas zonas, sin embargo aún existen zonas con menos descripción y conocimientos de este grupo. Las localidades mejor documentadas han sido el Parque Nacional Santa Rosa (Guanacaste) y la Estación Biológica La Selva, Puerto Viejo de Sarapiquí, unbicadas en las tierras bajas (Janzen & Wilson 1991). Las tierras medias y altas de Costa Rica en general han sido poco estudiadas y la región menos documentada en general es la Cordillera de Talamanca (Rodríguez-H. et al. 2002). En mamíferos se han efectuado algunos estudios en diversas partes de la vertiente Caribe, algunos con mayor esfuerzo de muestreo que otros (Timm et al. 1989, Timm 1994, Sáenz 2010, Astiazarán 2013). Las investigaciones en La Selva, que es uno de los más detallados han arrojado una riqueza de 116 especies, la cuál es una de las más elevadas del país, por ser una zona que limita con el Parque Nacional Braulio Carrillo y otras grandes zonas protegidas (Timm 1994). Se caracteriza por una elevada cantidad de especies de murciélagos (105 spp.) y roedores (45 spp.), además de que la mayoría se las especies de mamíferos de la localidad son ampliamente distribuidas en el trópico americano (Timm 1994). En muestreos en otras zonas del Caribe, en general se esperaría una riqueza de especies similar, incluyendo algunas pocas que solo se encuentran en la vertiente Caribe hasta el momento como el caso del murciélago blanco Ectophylla alba (La Val & Rodríguez-H. 2002). Este trabajo tiene como objetivo hacer una descripción preliminar de la mastofaunala zona de Baja Talamanca, con el fin de incentivar su conocimiento y protección por parte de entes gubernamentales y sociedad civil. MATERIAL Y MÉTODOS El estudio se llevó a cabo en la zona conocida como Baja Talamanca (ver Fig. 1, de la sección de introducción de este informe). Se dividió la región en tres abarcó tres zonas altitudinales: la primera comprende las planicies situadas a una altitud entre 0 y un poco más de 100 msnm. Se 63 trabajó en tres localidades: Parque Nacional Cahuita (0-30 msnm), Refugio Nacional de Vida Silvestre Gandoca-Manzanillo (0-30 msnm), Estero Negro (0-15 msnm) y Bananito (30-130 msnm). La segunda zona fue la localidad de Las Brisas de Veragua específicamente en la propiedad de Veragua Rainforest Park, en un gradiente altitudinal entre 200 y 460 msnm. La tercera zona fue el cerro Chimú, que se ubica de 700 a 800 msnm. Se efectuaron un total de 15 giras entre noviembre del 2010 y mayo del 2013, repartidas de la siguiente manera: 6 giras a Veragua (30 noviembre-3 diciembre 2010, 21-25 febrero 2011, 5-8 abril 2011, 11-13 mayo, 4-7 octubre, 24-28 octubre), 3 giras a Bananito (25-29 abril 2011, 30 mayo2 junio 2011, 28 noviembre-1 diciembre 2011), 2 giras a Parque Nacional Cahuita (22-26 agosto 2011, 21-25-mayo 2012), 3 giras a Gandoca-Manzanillo (16-20 abril 2012, 5-9 noviembre 2012, 1416 mayo 2013) y 1 gira a cerro Chimú-Veragua (25-29 junio 2012). La primera gira de Cahuita incluyo un breve muestreo en Estero Negro, Cahuita. El sitio de trabajo en Bananito (provincia Limón, cantón Limón, distrito Valle de la Estrella) es un mosaico de bosque secundario, potreros y plantaciones de palma africana (9° 48’ 46” N, 83° 03’ 41,6” W). Se encuentra en las márgenes del río Bananito, dentro de la zona de vida de Bosque Muy Húmedo Tropical. Se trabajó en un área de bosque secundario perteneciente a la empresa Selva Bananito Lodge. Este bosque presenta gran variedad de árboles altos (7 m ó más) y de alturas inferiores, con algunas palmas y piperáceas entre otros tipos de arbustos en el sotobosque. También se trabajó en un área de crecimiento secundario cerca del albergue con presencia de heliconias, melastomatáceas y otros arbustos o árboles de hasta unos 4 m (9° 49’ 20” N, 83° 03’ 46,9” W). El Parque Nacional Cahuita (provincia Limón, cantón Talamanca, distrito Cahuita), es un área natural protegida, ubicada a 42 km al sur de la ciudad de Limón. Cuenta con un área de 1 067,9 ha terrestres y 22 400 ha marinas. El parque se encuentra dentro de la zona de vida de Bosque muy húmedo tropical. Posee varios hábitats importantes como son el bosque pantanoso, el bosque mixto no inundado, el manglar, con predominio del mangle colorado, y la vegetación del litoral. 64 En este parque se recorrió el sendero que pasa por áreas de vegetación a orillas de la playa con partes de crecimiento secundario, donde destacan cocoteros, palmas, hierbas y algunos árboles altos (5 m o más), estos últimos sobre todo en el sector de Puerto Vargas. En agosto del 2011, se incluyó un breve muestreo en un fragmento de bosque a orillas de Estero Negro, detrás del Hotel Colón Caribe (9° 51’ 15,6” N, 82° 56’ 43,6” W). Este fragmento presenta algunos árboles de cerca de 7 m de alto, palmas y en las márgenes del río predominio de vegetación herbácea. El Refugio Nacional Vida Silvestre Gandoca-Manzanillo (provincia Limón, cantón Talamanca, distrito Sixaola) se ubica al SE de la costa Caribe costarricense, entre la desembocadura de los ríos Cocles y el Sixaola. Es parte integral del Corredor Biológico Talamanca Caribe (CBTC) en su extremo SE. Va desde el nivel del mar hasta 185 msnm, en los cerros de Manzanillo. Tiene una extensión de 9 449 ha que se distribuyen en: 4 436 ha de ambientes marinos, 5 013 comunidades terrestres (tanto zonas naturales como con alteración antrópica), y 15 km de línea de costa. En el refugio, existe solamente una zona de vida, el Bosque muy húmedo tropical. Los ecosistemas terrestres mejor representados son humedales; como yolillales, manglares, cativales y pantanos; pero también se encuentran bosques secundarios maduros, plantaciones de bananos y crecimiento secundario (García & Grant 2012). La segunda zona altitudinal el bosque de Veragua (provincia de Limón, cantón Limón, distrito Río Blanco), se ubica 12 km al sur de Liverpool, cerca de la comunidad denominada Las Brisas de Veragua, en la cuenca del río Victoria, propiamente en terrenos pertenecientes a la empresa Veragua Rainforest (9° 55’ 35,2” N, 83° 11’ 27,8” W). Los terrenos aledaños al centro de visitantes se encuentran dentro de la zona de vida de Bosque muy húmedo tropical. Se muestreó en varias áreas de bosque secundario maduro con presencia de piperáceas, heliconias y palmas en el sotobosque, entre otras especies (por ejemplo 9° 55’ 32,8” N, 83° 11’ 18,5” W; 9° 55’ 22,5” N, 83° 11’24,1” W). Los árboles alcanzan alturas hasta unos 25 m o más. También se trabajó cerca de la entrada al parque Veragua, a orillas del camino, donde es una vegetación de crecimiento secundario 65 con predominio de heliconias, piperáceas, hierbas y algunos arbustos de poca altura, que bordean sectores de bosque secundario (9° 56’ 40,6” N, 83° 12’ 12,1” W). La tercera zona se ubica en el cerro Chimú (Provincia de Limón, cantón Limón, distrito Matama). Se tomaron algunos registros de mastofauna en varios sectores de un bosque primario con árboles de 25 m o más de alto (9° 53’ 00,6” N, 83° 13’ 53,0” W). Recolección e identificación de murciélagos (Chiroptera) En cada uno de los sitios de muestreo se colocaron de dos a tres redes de niebla de 12 m de longitud (24-36 m), las cuales se mantuvieron abiertas de 6:00 p.m. a 11:00 p.m. o más, dependiendo de la actividad de los murciélagos y las condiciones del clima. Las redes fueron revisadas entre 15 ó 30 minutos, según la frecuencia de la captura de murciélagos. Los sitios muestreados fueron: Áreas de bosque secundario, con árboles de alturas mayores a 10 m, vegetación de sotobosque con piperáceas, palmas, heliconias y otras. Crecimiento secundario con vegetación herbácea y arbustos de menos de 3 m. Crecimiento secundario con menos vegetación herbácea y más presencia de piperáceas y heliconias arbustos de alturas mayores a 3 m. Borde bosque secundario junto a zona de playa (Cahuita). Ribera de río cerca de bosque secundario y potrero (Bananito). Ribera de río bordeada de bosque secundario, con predominio de heliconias, árboles de entre 10-15 m y plantación de palma. Ribera de laguna o pantano en la playa (Gandoca-Manzanillo). Las especies y número de individuos capturados se registraron cada noche. Se identificaron con ayuda de la Clave de Campo para los Murciélagos de Costa Rica (Timm et al. 1999). Se 66 recolectaron individuos pertenecientes a especies poco representadas en la Colección de Mastozoología del Museo Nacional de Costa Rica, especies comunes como registro para el área, o bien de especies de difícil identificación en el campo. Se tomaron datos de sexo, edad, estado reproductivo, algunas medidas corporales y ubicación geográfica mediante un aparato de GPS. No se recolectaron hembras activas o preñadas. Los especímenes no recolectados se anotaron en la bitácora de observaciones. Recolección e identificación de roedores y otros mamíferos El muestreo se realizó mediante la colocación trampas para pequeños mamíferos en algunos hábitats. Se utilizaron las trampas Sherman pequeñas y grandes por ser el método más efectivo para capturar pequeños mamíferos terrestres (Jones et al. 1996). Las trampas fueron colocadas en: Áreas de bosque secundario, con árboles de alturas mayores a 10 m, vegetación de sotobosque con piperáceas, palmas, heliconias y otras. Áreas de crecimiento secundario con vegetación herbácea y arbustos de menos de 3 m. Áreas de crecimiento secundario con menos vegetación herbácea y más presencia de piperáceas y heliconias y arbustos de alturas mayores a 3 m. Borde bosque secundario y de plantaciones de banano (Gandoca-Manzanillo). Estas trampas se cebaron con semillas de girasol y esencia de vainilla, para luego colocarlas preferentemente en horas de la tarde, para ser revisadas a la mañana siguiente. Se colocaron las trampas en línea recta separándolas cada cinco metros entre sí. Se registró del número de individuos y especies. También se colocaron dos trampas Tomahawk no plegables (Modelo 106) para captura o registro de especies de tamaño pequeño a mediano, como zorros pelones. Estas se cebaron con banano u otra fruta y atún para gatos. Se colocaron en el sotobosque a nivel del suelo o en ocasiones a alturas de aproximadamente 1 m. 67 Fototrampeo Para apoyo del muestreo de medianos y grandes mamíferos se utilizaron cámaras trampa de las marcas Wildgame XC6, Reconyx HC 500 Hyperfire y Bushnell Trophy Cam XLT, con modos de imagen (Reconyx) y video. Se colocaron, durante las giras programadas, al margen de senderos o ciertos puntos estratégicos como lugares donde se detectara acumulaciones de frutos, semillas o desperdicios de comida. En algunos casos se utilizó un atrayente como frutos, atún, perfume o aceite de bacalao. Se revisaron aproximadamente cada 24 h. Observaciones complementarias de especies de tamaño medio Para registro de mamíferos medianos y grandes también se hicieron caminatas por los senderos existentes tanto en horas diurnas como nocturnas, con el fin de detectar registros visuales, huellas o excrementos. Para algunas especies se tomó en cuenta los avistamientos por lugareños o funcionarios de las áreas protegidas, para la confección de una lista de especies esperadas o probables. Estos registros fueron tomados en cuenta solo si presentó la suficiente certeza de las especies mencionadas y su ubicación por lo menos aproximada. Adicionalmente para los registros visuales se tomaron datos del número de individuos, especie y sitio donde se observó para efectos de cuantificar dichos registros. Bases de datos De forma complementaria se realizó una búsqueda de los registros de mamíferos dentro de la zona de estudio (localidades de Baja Talamanca, Costa Rica), depositados en la base de datos de la Global Biodiversity Information Facility (GBIF), una organización internacional que trata que los datos científicos sobre biodiversidad estén disponibles en Internet (http://data.gbif.org). En el Anexo 3 se presenta una lista de especies de la zona de estudio. 68 Imágenes digitales Se tomaron imágenes digitales de las especies observadas y/o recolectadas, rastros de mamíferos y algún otro aspecto importante del bosque o del hábitat de la fauna. Las imágenes se depositaron en la colección de imágenes del Departamento de Historia Natural, del Museo Nacional de Costa Rica. RESULTADOS En la región de Baja Talamanca se registraron 91 especies de mamíferos, incluyendo especies informadas por funcionarios y residentes de las localidades, además de los especímenes incluídos en la base de datos de GBIF. En la lista anexa, se observan los registros y capturas en cada uno de estos sitios. De las especies registradas, 17 poseen alguna categoría de amenaza según UICN, CITES o MINAET. Estas son tres especies de monos, dos especies de murciélagos, el perezoso de dos dedos, el delfín costero, el manatí, la danta y ocho carnívoros. El grupo con más especies registradas fueron los murciélagos (Chiroptera) con 47 especies, seguido por los carnívoros (Carnivora) con 13 especies y los roedores (Rodentia) con 11 especies. Por otro lado los grupos de los armadillos (Cingulata), conejos (Lagomorpha), dantas (Perissodactyla) y los mamíferos acuáticos (Sirenia y Cetacea) solo registran una especie (Fig. 1). 69 SIRENIA CETACEA PERISSODACTYLA LAGOMORPHA Órdenes CINGULATA ARTIODACTYLA PRIMATES PILOSA DIDELPHIMORPHIA RODENTIA CARNIVORA CHIROPTERA 0 5 10 15 20 25 30 35 40 45 50 Número de especies Figura 1. Especies de mamíferos por orden, registrados en la región de Baja Talamanca. La mayoría de las especies registradas fueron del orden Chiroptera (murciélagos), que es el grupo con más especies dentro de los mamíferos en Costa Rica, con más de 100 especies (Rodríguez-H. et al. 2002). Dentro de este ordens, como es usual, las especies más comunes son los filostómidos que frecuentan los estratos inferiores del bosque (Fig. 2). Destacan especies de ámbito de distribución amplio como las de los géneros Carollia y Artibeus. Tres especies del género Carollia (C. perspicillata, C. castanea y C. sowelli) y una del género Artibeus (A. jamaicensis) fueron las que más se capturaron con más de la mitad de los registros. Otros murciélagos del género Artibeus fueron menos frecuentes en las capturas, pero también se trata de especies altamente adaptables a sitios con vegetación alterada, fragmentada o de crecimiento secundario (Galindo-González 2004). Todas, incluyendo las del género Carollia se caracterizan por dietas altas en frutos de plantas como Ficus sp., Piper sp.y Cecropia sp. entre otros, lo que los convierte en importantes dispersores de semillas en terrenos abiertos. 70 Otras especies importantes son el murciélago bilobulado (Uroderma bilobatum) con 24 registros y el murciélago narigón (Rhynchonycteris naso) con 26 registros. Sin embargo, cabe señalar que la alta captura de especímenes de U. bilobulatum se debió a la alta visitación en busca de alimento por parte de individuos de esta especie a un higuerón (Ficus sp.) cercano, en la localidad de Bananito, en otros sitios estudiados las capturas fueron menores. Por su parte el murciélago narigón no fue capturado en redes, pero es relativamente fácil de observar en los árboles a orillas de ríos y en algunas edificaciones, en donde reposa durante el día, en grupos de varios individuos. Micronycteris hirsuta Mimon crenulatum Glossophaga soricina Noctilio leporinus Especies Artibeus lituratus Artibeus watsoni Uroderma bilobatum Rhynchonycteris naso Carollia sowelli Carollia perspicillata Artibeus jamaicensis Carollia castanea 0 10 20 30 40 50 60 Número de registros Figura 2. Especies de murciélagos con más registros de individuos en la región de Baja Talamanca. En menor número se capturaron especies insectívoras y nectarívoras, al igual que aquellas consideradas en el gremio de insectívoras del follaje. Estas últimas se consideran más dependientes de cierta cubierta boscosa (Clarke et al. 2005). Son los casos de especies pertenecientes al género 71 Micronycteris, de Trachops cirrhosus (en Cahuita y Gandoca-Manzanillo), Tonatia saurophila (en Veragua) y la especie Mimon crenulatum (en Bananito, cerro Chimú y Veragua). En el caso de los roedores, algunas especies fueron registradas con mayor frecuencia. La guatuza (Dasyprocta punctata) fue observada frecuentemente en Veragua, además de sus rastros en los senderos y ser uno de los mamíferos más frecuentes en el fototrampeo. Su presencia es un buen indicador, pues según estudios recientes, la desaparición de los roedores de este género a menudo influye en la distribución y abundancia de algunas especies de plantas (Vargas 2008). También se registraron a menudo sus rastros y por fototrampeo en Cahuita y en Gandoca-Manzanillo. No ha sido tan frecuente su registro en Bananito. El otro roedor de gran tamaño, el tepezcuintle (Cuniculus paca) fue registrado sobre todo en Veragua y Cahuita por medio del fototrampeo. La captura de roedores menores como los ratones (Cricetidae y Echimyidae) fue muy baja. Solamente la rata de monte (Proechymis semispinosus) y la rata semiespinosa con abazones (Heteromys desmarestianus) fueron capturadas con las trampas Sherman. En las selvas tropicales de tierras bajas a menudo ha sido notable esta baja captura de los roedores (Voss & Emmos 1996). Los mamíferos carnívoros se encuentran a menudo bien representados por varias familias debido a su variedad de formas y ecología. En este caso las especies registradas corresponden a las familias Felidae o gatos silvestres (5), Procyonidae (mapaches, pizotes y afines) con 4 especies, Mustelidae o parientes de la comadreja (3) y Mephitidae con 1 especie. Especies muy comunes de didélfidos como el zorro pelón (Didelphis marsupialis) y el zorro cuatro ojos (Philander opossum), fueron registrados en casi todas las localidades, tanto como por observación directa, fototrampeo, huellas y por trampas Tomahawk. En general, en el fototrampeo o por medio de huellas, se ha registrado la presencia de varias especies de medianos y grandes mamíferos como el saíno (Pecari tajacu), el cabro de monte (Mazama americana), el grisón (Galictis vittata), el jaguar (Panthera onca) y el puma (Puma concolor). Un registro notable es el mono 72 colorado o mono araña (Ateles geoffroyi), por ser una especie amenazada que es altamente sensible a la destrucción de su hábitat (Wainwright 2002). Fue observado en el fragmento de bosque en Estero Negro y en un área de manglar en Gandoca-Manzanillo. Otras especies registradas por los residentes y que son importantes para la conservación son dos mamíferos acuáticos: el manatí (Trichechus manatus) y el delfín fluvial (Sotalia fluviatilis). Estas especies están limitadas a algunos sectores de la costa caribeña del país (García & Grant 2012). El manatí es una especie amenazada, y ha sido históricamente de gran importancia para los pobladores del Caribe costarricense como parte de su dieta (Palmer 1994). El delfín fluvial es de importancia por su vulnerabilidad a las prácticas pesqueras inapropiadas y actualmente ha llegado a ser un atractivo turístico en la zona de Gandoca para los turistas (Wainwright 2002). Un registro particular mencionado en la base de datos de GBIF (Field Museum of Natural History 18286) es de un ejemplar de pecari labiado, chancho de monte o cariblanco (Tayassu pecari) que dice únicamente “Limón” como localidad, sin fecha de recolección y sus coordenadas caen en el distrito de Limón. Posiblemente se trate de un especímen que estuvo en cautiverio. Actualmente la especie está ausente en las tierras bajas del Caribe Sur ya que su área de distribución actual son áreas protegidas y zonas aledañas de sitios como el Parque Nacional Corcovado, Parque Nacional Tortuguero, algunas pocas partes del Área de Conservación Guanacaste y partes del Parque Internacional de la Amistad (Wainwright 2002). En general los registros son similares, en cuanto a composición de especies y con alguna variación en la riqueza de especies, a otros estudios de mastofauna del Caribe. Los mamíferos registrados son especies ampliamente distribuidas en América Latina. Este muestreo arrojó 91 especies de mamíferos en general y 31 especies medianas y grandes (se excluyen roedores, murciélagos y mamíferos acuáticos). 73 En la Estación Biológica La Selva Timm registra 116 especies de mamíferos, con predominio de murciélagos y roedores. Astiazarán (2013) en un muestreo de solo mamíferos medianos y grandes (se excluyen murciélagos y roedores) en La Tirimbina, Sarapiquí, registra 17 especies, pero en un tiempo breve de muestreo. Sáenz (2010) reporta 22 especies de mamíferos medianos y grandes para la un sector de la Reserva Pacuare y alrededores. Las diferencias en cuanto a riqueza de especies de pueden deber a factores como el esfuerzo de muestreo y el grado de conservación del bosque en las localidades, que tal vez varíe de una localidad a otra. En el caso de este muestreo en Baja Talamanca, la riqueza de especies entre las localidades de estudio varió poco. Sin embargo algunas especies de importancia turística o para la conservación fueron registradas únicamente en algunas de las localidades, lo que no indica necesariamente que estén ausentes en las otras, pero sería factible su corroboración de presencia o ausencia a futuro. Mamíferos de las planicies de (0-100 msnm) De las 91 especies de mamíferos de la lista anexa, 54 fueron registradas en alguna de las localidades de las planicies de la zona de estudio (incluso especies compartidas con las zonas más altas del estudio). Algunas pocas especies son exclusivas del Caribe costarricense, como el caso de dos mamíferos acuáticos: el manatí (Trichechus manatus) y el delfín costero (Sotalia guianensis). En estas zonas costeras del Caribe es más fácil observar ciertas especies de mamíferos que en las zonas montañosas. Algunas de dichas especies incluyen los monos carablanca ( Cebus imitator) y congo (Alouatta palliata), la guatuza (Dasyprocta punctata) y el perezoso de dos dedos (Choloepus hoffmanii), en reposo en los árboles; así como carnívoros como el tolomuco ( Eira barbara), el pizote (Nasua narica) y el mapache (Procyon lotor). En el caso del mapache, de manera similar que en el Parque Nacional Manuel Antonio (Pacífico Central), ha variado sus hábitos para ajustarse a los grupos de turistas, donde puede recoger sobras de comida e incluso robar bolsas (Carrillo & Vaughan 1993). De ahí la importancia de concientizar a las personas de no alimentarlos, ni poner sus pertenencias a su alcance, para evitar 74 este comportamiento que perjudica a la fauna silvestre. Sus huellas son fáciles de hallar en la arena de la playa. En el grupo de los pequeños mamíferos, algunos murciélagos son frecuentes en la capturas de redes. Los principales son los murciélagos fruteros del género Carollia, el murciélago frutero de Jamaica (Artibeus jamaicensis), especies muy adaptables a hábitat abiertos o con vegetación alterada (La Val & Rodríguez-H. 2002). Dentro de las especies más características de esta zona están el murciélago pescador (Noctilio leporinus) puede habitar arriba de los 100 m, sin embargo es más frecuente de encontrar en las zonas de Gandoca-Manzanillo y Cahuita en cursos de agua cercanos al mar. Lo mismo para la otra especie de este género, el murciélago pescador menor (Noctilio albiventris), no registrada en este trabajo, pero que potencialmente habita la zona y se ha observado en zonas aledañas (lista anexa). El caso del murciélago Rynchonycteris naso, es importante de mencionar. Este murciélago que puede habitar hasta altitudes mucho mayores, está asociado a cursos de agua, donde captura su alimento consistente de insectos que vuelan sobre el agua. Es muy frecuente de observar en árboles o edificaciones de las zonas más bajas como Cahuita. Otra especie sobresaliente por ser propia de la vertiente Caribe de parte de Centroamérica, es el murciélago blanco (Ectophylla alba), muy conocido por aparecer a menudo en fotografías de afiches de naturaleza. Restringidos a esta zona, específicamente a la zona de Gandoca-Manzanillo están las dos especies acuáticas, el manatí (Trichechus manatus) y el defín fluvial (Sotalia guianensis). Por esa limitada distribución son importantes para la conservación y el turismo, como se mencionará más adelante. Mamíferos de Veragua y alrededores De las especies de mamíferos de la lista anexa, 55 fueron registradas en esta localidad (incluso especies también registradas en las localidades de la zona basal). Aunque comparten la mayoría de las especies con la zona basal, es indudable que el estado de conservación de sus bosques 75 y su alejamiento de zonas muy pobladas favorece la presencia de especies de mamíferos más vulnerables a la pérdida de hábitat o la presión antropogénica. Varias especies fueron frecuentes en esta localidad como: el zorro pelón (Didelphis marsupialis), los primates mono congo (Alouatta palliata) y mono carablanca (Cebus imitator); roedores como la guatuza (Dasyprocta punctata), el tepezcuintle (Cuniculus paca) y la rata espinosa (Proechimys semispinosus); el armadillo (Dasypus novemcinctus), el saíno (Pecari tajacu), el cabro de monte (Mazama temama) y la martilla (Potos flavus). Estas especies son potenciales dispersores y depredadores de semillas por lo que su presencia indica un ecosistema aún saludable, que se podría modificar con su desaparición o disminución (Stoner et al. 2007). Algunas especies de murciélagos al parecer son más frecuentes en estos bosques, aunque no están ausentes de bosques de la parte basal. Se trata de especies un poco más dependientes de las zonas boscosas, menos alteradas por actividades humanas, sobre todo insectívoros de follaje, como por ejemplo el murciélago lagartijero (Tonatia saurophila) y el murciélago parreado (Mimon crenulatum) (Clarke et al. 2005). De modo similar especies no registradas en este muestreo, pero recolectadas en zonas aledañas, reportadas en la revisión de bases de datos de GBIF, como el murciélago dorado (Chrotopterus auritus) y el murciélago espectral (Vampyrum spectrum). Mamíferos de cerro Chimú En esta localidad solo se efectuó un muestreo. Por ese motivo se presentan muy pocos registros, los cuales son en su mayoría de especies previamente registrados en alguna de las otras localidades, excepto tres grandes mamíferos citados a continuación. La danta (Tapirus bairdii) ha sido observada por uno de los funcionarios del Parque Veragua en cerro Chimú, es posible que esta especie sea muy rara o ausente en otras zonas del Caribe Sur más afectadas por factores antropogénicos, ya que requiere de grandes extensiones de hábitat (González-Maya et al. 2009). Las huellas de grandes felinos como el puma (Puma concolor) y el 76 jaguar (Panthera onca) solo se registraron en el sendero a este cerro, aunque los funcionarios y residentes los han observado en Veragua y alrededores. Al igual que la danta, los grandes felinos también requieren para su subsistencia de grandes extensiones de bosque (González-Maya et al. 2008). Estos registros presentan a esta zona como potencialmente importante para la conservación de especies de medianos y grandes mamíferos. Otras especies comunes en otras zonas registradas durante esta breve gira incluyen al mono carablanca (Cebus imitator), la martilla (Potos flavus), el saíno (Pecari tajacu), el cabro de monte (Mazama temama) y la guatuza (Dasyprocta punctata). Los murciélagos capturados fueron de la familia Phyllostomidae: la carolia castaña (Carollia castanea), el murciélago frutero de Jamaica (Artibeus jamaicensis), el murciélago musaraña (Glossophaga soricina) y el murciélago parreado (Mimon crenulatum). Especies de interés para la conservación, ecológico o turístico Choloepus hoffmanni (Perezoso de dos dedos), esta especie es considerada amenazada de extinción y está protegida y regulada por la Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554 y el decreto No. 26435-MINAE, aunque es relativamente frecuente de encontrar. Ateles geoffroyi (Mono colorado), está considerado en peligro de extinción, por la pérdida de hábitat debido a deforestación y a la cacería para aprovechar su carne. Es especie protegida por la Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554 y el decreto No. 26435-MINAE. Al parecer para su supervivencia requiere de bosque poco alterado, aunque utiliza corredores de bosque de galería, manglares y bosque seco en otras áreas (Reid 1997). Thyroptera tricolor (Murciélago de ventosas), es una especie asociada a parches de platanilla (Heliconia spp.), bijagua (Calathea spp.), plantaciones de bananos y plátanos (Musa spp.) o plantas relacionadas, cuyas hojas jóvenes utiliza como refugio al pegarse con ayuda de las ventosas de sus 77 alas. Según parece la abundancia de esta especie está relacionada con la disponibilidad de estas plantas (La Val & Rodríguez-H. 2002). Ectophylla alba (Murciélago blanco), es una especie que solo se registra para las tierras bajas del Caribe. Utiliza como refugio “tiendas” hechas a partir de hojas de plantas como Heliconia y Calathea, las cuales modifica al morder las venas principales, de manera que la hoja se dobla y forma un refugio (Wainwright 2002). Galictis vittata (Grisón), es considerada una especie rara y amenazada de extinción, debido a la pérdida de su hábitat por la deforestación. Está protegida por la Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554 y el decreto No. 26435-MINAE. Lontra longicaudis (Nutria neotropical), es un mamífero que habita sobre todo ríos o arroyos con poca contaminación. En estudios en La Selva, Sarapiquí, se ha determinado que se alimenta sobre todo de crustáceos y peces (Spinola & Vaughan 1994). Se considera en peligro de extinción la pérdida de su hábitat debido a la contaminación de los ambientes acuáticos. Está protegida por la Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554 y el decreto No. 26435-MINAE. También incluida en el Apéndice l de CITES. Bassaricyon gabbii (Olingo), es menos común que sus parientes como la martilla, es considerada una especie amenazada de extinción, debido a la pérdida de su hábitat por la deforestación. Está protegida según Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554 y el decreto No. 26435-MINAE. Puma concolor (Puma, León americano), es uno de los mayores felinos del país. Caza una gran variedad de presas como venados, monos, tortugas, ratas de selva y otros (Wainwright 2002). La subespecie P.concolor costaricensis está en el Apéndice l de CITES. Está en peligro de extinción 78 debido a pérdida de hábitat y a la cacería. Está protegida por la Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554 y el decreto No. 26435-MINAE. Panthera onca (Jaguar), es una especie en peligro debido a la cacería y la deforestación. Caza una gran variedad de animales, desde pequeños roedores hasta algunos medianos mamíferos como saínos (Pecari tajacu). Está protegida por la Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554, el decreto No. 26435-MINAE y el Apéndice l del Convenio sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre (CITES). Cuniculus paca (Tepezcuintle), es una especie interesante para conservación en el área pues se trata de un mamífero muy perseguido y cazado, por campesinos y cazadores furtivos, que se ha vuelto raro o ausente en varias partes del país. En el Refugio Nacional de Vida Silvestre Barra del Colorado y áreas cercanas, se estimó la cacería que la cacería anual es de 882 individuos (Wainwright 2002). Pecari tajacu (Saíno), es otra especie muy perseguida por los cazadores, y que también se ve afectada por la pérdida de hábitat debido a la deforestación. Forma grupos y es frecuente encontrar sus huellas en áreas con poca intervención humana. Se alimenta de muchos tipos de materias desde raíces, semillas y frutos hasta pequeños animales y carroña. Mazama temama (Cabro de monte, venado forestal), es una especie de venado pequeño de bosques húmedos y bosques secundarios viejos. Es cazado por su carne y a veces por ser considerado problemático para cultivos (Wainwright 2002). Por su tamaño y aspecto es un bonito ejemplo para educación ambiental. Las siguientes son especies identificadas como emblemáticas para la región del Caribe costarricense, según la consulta a funcionarios de áreas protegidas y habitantes de la zona. 79 Trichechus manatus (Manatí, vaca marina), es una especie propia de algunos sitios del Caribe. Al parecer se encuentra en mayor abundancia en el Parque Nacional Tortuguero y en el Refugio Nacional de Vida Silvestre Gandoca-Manzanillo, de ahí la necesidad promover el conocimiento y protección de esta especie. Se alimenta de plantas acuáticas. Se incluye como especie protegida en la Ley de Conservación de la Vida Silvestre No. 7317, la Ley Orgánica del Ambiente No. 7554, el decreto No. 26435-MINAE y también en el apéndice l del Convenio sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre (CITES). Ha sido declarado símbolo nacional de Costa Rica mediante Ley No 17984 del 30 de julio de 2014. Chironectes minimus (Zorro de agua), es una especie de zarigüeya, familia del zorro pelón, pero adaptado a un hábito de vida semiacuático, lo que lo hace único en su grupo. Es difícil de observar debido a sus hábitos nocturnos y esquivos. Tiene membranas entre los dedos de las patas traseras para nadar. Captura crustáceos e insectos acuáticos y tal vez otros organismos como pequeños peces y ranas. Sotalia guianensis (Delfín costero, delfín estuarino, tucuxi, delfín gris), es un delfín costero que al parecer está restringido a la costa del Refugio Nacional de Vida Silvestre Gandoca-Manzanillo (Gamboa-Poveda & May-Collado 2006). Este aspecto lo convierte en una especie emblemática de la zona. Se alimenta de peces y pequeños calamares. Viaja en bandas de 2 a 7 ó más individuos, aunque han sido registrados en grandes grupos en forma ocasional en otros sitios de su área de distribución, o incluso se asocia a grupos de otras especies como el delfín bufeo ( Tursiops truncatus). Está incluido en el Apéndice l del Convenio sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestre (CITES). 80 CONCLUSIONES RECOMENDACIONES En las zona de estudio los mamíferos registrados aparte de su importancia ecológica, poseen una composición de especies que incluye 17 que poseen alguna categoría de amenaza según UICN, CITES o MINAET. Los monos, como el carablanca y el mono congo, sen condiciones naturales, se mantienen estables en fragmentos de bosque variables en extensión (Zaldívar et al. 2004). Otros aspectos como la genética pueden afectar el riesgo de amenaza a sus poblaciones (Zaldívar et al. 2004). El perezoso de dos dedos realmente es uno de los mamíferos que se mantienen bien en áreas donde no son cazados, aún en fragmentos de bosque variables en extensión (Wainwright 2002). La danta es una especie que es escasa en zonas con alta cacería y deforestación, porque requiere de bosque primario para mantener poblaciones viables (Carbonell & Torrealba 2007). Por eso es una de las especies principales en materia de conservación, aunque en la zona de estudio es rara y casi ausente, excepto un registro facilitado por funcionarios de Veragua. Los carnívoros suelen ser vulnerables a la cacería y a la perdida de hábitat, debido a su baja abundancia. Especialmente los felinos (jaguar, puma y manigordo) así como la nutria (Lontra longicaudis). En estas zonas es muy probable la presencia de otras dos especies de felinos costarricenses de pequeño tamaño que son frecuentes en el país como el caucel o tigrillo ( Leopardus wiedii) y león breñero (Puma yagouaroundi). Las dos especies acuáticas (manatí y delfín costero) tienen el problema de su distribución restringida y relativa vulnerabilidad de su hábitat. Estas dos especies son una herramienta de educación ambiental y conservación debido a estar limitadas a solo una pequeña porción del Caribe. 81 Algunas de las especies, si bien no tienen una categoría de amenaza, son muy perseguidas por cazadores ilegales, por lo cual es importante su protección. El caso del cabro de monte ( Mazama temama), el saíno (Pecari tajacu) y el tepezcuintle (Cuniculus paca). Estas especies son buenas indicadoras de que el hábitat y la disponibilidad de alimento aún son adecuados, y se hace necesaria la protección de estos sitios. Sobre todo porque según algunos funcionarios, la cacería parece ser un factor a tomar en cuenta en las áreas visitadas, particularmente en Veragua y Bananito. Baja Talamanca es una zona de gran riqueza de fauna. Sin embargo se requieren estudios a más largo plazo para describir su composición absoluta. Este informe incluye una muestra notable de esta riqueza de mastofauna que incluye mamíferos en vías de extinción o amenazadas, especies exclusivas del Caribe latinoamericano y especies con potencial turístico, así como mamíferos con un importante rol en las selvas tropicales húmedas, por lo que su conservación es de importancia para la mantenimiento de la biodiversidad nacional. LITERATURA CITADA Aranda, M. 2000. Huellas y otros rastros de los mamíferos grandes y medianos de México. CONABIO, Instituto de Ecología, Mexico D. F., 212 pp. Astiazarán A., A. 2013. Riqueza y la abundancia de mamíferos medianos de la reserva biológica Tirimbina, Costa Rica. Therya 4: 597-601. Carbonell, F. & I. Torrealba. 2007. Conservación en ecotonos interculturales y transfronterizos: la danta (Tapirus bairdii) en el Parque Internacional La Amistad, Costa Rica-Panamá. Tapir Specialists Group Newsletter 16/1(21): 24-30. Carrillo, E. & C. Vaughan. 1993. Variación en el comportamiento de Procyon spp. (Carnivora: Procyonidae) por la presencia de turistas en un área silvestre de Costa Rica. Revista de Biología Tropical 41: 843-848. Clarke, F.M., D. V. Pio & P. A. Racey. 2005. A comparison of logging systems and bat diversity in the Neotropics. Conservation Biology 19:1194-1204. 82 Galindo-González, J. 2004. Clasificación de los murciélagos de la región de Los Tuxtlas, Veracruz, respecto a su respuesta a la fragmentación del hábitat. Acta Zoológica Mexicana 20(2):239243. Gamboa-Poveda, M. & L. J. May-Collado. 2006. Insights on the ocurrence, residency, and behavior of two coastal dolphins from Gandoca-Manzanillo, Costa Rica: Sotalia guianensis and Tursiops truncatus (Family Delphinidae). International Whale Commission (IWC)’s Scientific Committee Documents SC/58/SM4. 9 pp. García, T. & I. Grant. 2012. Guía interpretativa. Un recorrido por el Refugio Nacional de Vida Silvestre Gandoca-Manzanillo. INBio, Area de Cobservación La Amistad Caribe, MAG y BID, Santo Domingo, Heredia, 131 pp. González-Maya, J., B.G. Finegan, J. Schipper & F. Casanoves. 2008. Densidad absoluta y conservación del jaguar y sus presas en la Región Talamanca Pacífico, Costa Rica. Serie Técnica No. 7, The Nature Conservancy, San José, Costa Rica, 55 pp. González-Maya, J.F., J. Schipper & K. Rojas-Jiménez. 2009. Elevational distribution and abundance of Baird’s tapir (Tapirus bairdii) at different protection areas in Talamanca region of Costa Rica. Tapir Conservation 18: 29-35. Janzen, D. H. & D. E. Wilson. 1991. Mamíferos. In: D.H. Janzen (ed.). Historia Natural de Costa Rica. Editorial Universidad de Costa Rica, San José. P. 439-461. La Val, R. K. & B. Rodríguez-H. 2002. Murciélagos de Costa Rica. Santo Domingo de Heredia, C.R., Editorial INBio, 320 pp. Palmer, P. 1994. Wa’apin man. La historia de la costa talamanqueña de Costa Rica según sus protagonistas.Editorial de la Universidad de Costa Rica, San José, Costa Rica. 402 pp. Reid, F. 1997. A field guide to the mammals of Central America & Southeast Mexico. Oxford University Press, New York. 334 pp. Rodríguez-H. B., F. A. Chinchilla & L. J. May. 2002. Lista de Especies, Endemismo y Conservación de los Mamíferos de Costa Rica. Revista Mexicana de Mastozoología 6: 21-57. 83 Sáenz, C. B. 2010. Ensamble de Mamíferos medianos y grandes de un sector forestal Río Pacuare y sus cercanías (Reserva indígena Nairi Awari y Parque Nacional Barbilla). M. Sc. Tesis, Universidad Nacional, Costa Rica. Heredia, Costa Rica, 53 pp. SINAC. 2014. Parque Nacional Cahuita [en línea]. http://www.sinac.go.cr/AC/ACLAC/PNCahuita/ Paginas/default.aspx [Julio 2014]. Spinola, P. & C. Vaughan. 1994. Dieta de la nutria neotropical (Lutra longicaudis) en la Estación Biológica La Selva, Costa Rica. Vida Silvestre Neotropical 4(2): 125-132. Stoner, K. E., P. Riba-Hernández, K. Vulinec & J. E. Lambert. 2007. The role of mammals in creating and modifying seedshadows in tropical forests and some possible consequences of their elimination. Biotropica 39: 316–327. Timm, R.M. 1994. Mammals. In: L.A. McDade, K. S. Bawa, H. A. Hespenheide & G. S. Hartshorn (eds.). La Selva: ecology and natural history of a neotropical rain forest, , 229-237. Chicago: Univ. of Chicago Press. Timm, R. M., D. E. Wilson, B. L. Clauson, R. K. LaVal & C. S. Vaughan. 1989. Mammals of the La Selva–Braulio Carrillo Complex, Costa Rica. North American Fauna 75:1–162. Timm, R. M., R. K. La Val & B. Rodríguez-H. 1999. Clave de campo para los murciélagos de Costa Rica. Brenesia 52: 1-32. Vargas, J. H. 2008. Defaunación de dasipróctidos y sus consecuencias sobre la distribución y abundancia de palmas en el bosque amazónico. M. Sc. Tesis, Universidad de Chile, Facultad de Ciencias, 34 p. Voss, R. S. & L. H. Emmons. 1996. Mammalian diversity in Neotropical lowland rainforests: A preliminary assessment. Bulletin of the American Museum of Natural History 230: 1-115. Wainwright, M. 2002. The Natural History of Costa Rican Mammals. A Zona Tropical Publication, 384 pp. Zaldivar, M.E., O. Rocha, K.E. Glander, G. Aguilar, A.S., Huertas, R. Sanchez & G. Wong. 2004. Distribution, ecology, life history, genetic variation, and risk of extinction of nonhuman primates from Costa Rica. Revista de Biología Tropical 52: 679-693. 84 AVIFAUNA DE LA REGIÓN DE BAJA TALAMANCA, LIMÓN, COSTA RICA Silvia E. Bolaños Redondo Departamento de Historia Natural Museo Nacional de Costa Rica [email protected] RESUMEN La vertiente Caribe de nuestro país cuenta con una enorme diversidad biológica y las aves no son la excepción. El objetivo de este trabajo fue determinar la composición de aves de la región de Baja Talamanca en Limón así como en detalle para cada sitio estudiado. Para cumplir con el objetivo planteado, se realizaron muestreos en sitios de las planicies de Baja Talamanca, Veragua y los cerros Chimú y Muchilla. Se abarcó hábitats variados desde bosques maduros hasta ambientes costeros; asimismo, se realizó una recopilación de información disponible en bases de datos en línea. La riqueza de especies de la región de Baja Talamanca estuvo representada por 426 especies, lo que constituye el 47% de la avifauna nacional, sobresalen las familias Tyrannidae, Parulidae, Accipitridae y Thraupidae. Se presenta un total de 42 especies amenazadas de acuerdo con el Reglamento a la Ley de Conservación de Vida Silvestre, y 20 especies endémicas regionales. Dentro del listado de aves identificadas para Baja Talamanca, una gran mayoría fueron registradas en el área de planicies (0-100msnm) y en menor porcentaje en la zona de Veragua; respecto a la avifauna de los cerros Chimú y Muchilla, la riqueza fue baja aunque interesante por la diferencia de altitudes que presentan con respecto al resto de sitios (altitudes mayores a 400 mnsm). La zona de Baja Talamanca es escenario de importantes eventos biológicos como las migraciones latitudinales y movimientos altitudinales de algunas de las especies. La complejidad de ambientes resulta en la enorme riqueza de aves residentes y migratorias, esfuerzos en investigaciones más detalladas y protección conjunta entre iniciativas privadas y estatales, aunado a un programa de educación, favorecerían la conservación de especies. 85 INTRODUCCIÓN Costa Rica es reconocida por su alta diversidad biológica. En el caso de las aves, en un pequeño territorio, nuestro país alberga poco más de 900 especies tanto residentes como migratorias, por lo que en comparación con otros sitios posee la mayor riqueza de especies por área (Sandoval & Sánchez 2011). Las diferencias en temperatura, pluviosidad y altitudes, se han combinado para producir la rica y variada vegetación que es la base para la riqueza avifaunística (Stiles & Skutch 2003). La región Caribe de nuestro país no es la excepción, la diversidad de hábitats en una región influye fuertemente sobre el número de especies que se encuentran en ella (Blake et al. 1990), de ahí la gran variedad de avifauna presente en la zona Caribe, donde la complejidad de ambientes permite la ocupación permanente y temporal de las aves. De acuerdo con las zonas avifaunísticas definidas por Slud (1964), el Caribe costarricense ocupa la zona “Tierras bajas del Caribe” y de acuerdo a las Áreas Importantes para la Conservación de las Aves de Costa Rica (AICAS), cinco zonas son las que se encierran en esta porción del territorio nacional, una de ellas “La Amistad Caribe” que constituye uno de los puntos de mayor diversidad debido a la continua cobertura boscosa que presenta y a la posición geográfica en que se encuentra (Sandoval & Sánchez 2011). El Caribe ha podido defender parte de sus tierras en áreas protegidas estatales como el Parque Nacional Cahuita, el Refugio Nacional de Vida Silvestre GandocaManzanillo, entre otras, y otras iniciativas de carácter privado que poco a poco han logrado el 50% de cobertura boscosa en el país; estudios recientes han catalogado a Costa Rica como un caso de éxito en torno a la deforestación, resaltando la zona Caribe (Boucher et. al 2014); no obstante, la expansión de monocultivos como el de la piña sigue siendo una amenaza para la conservación y continuidad de los grandes parches boscosos y por tanto, de la conservación de especies clave. El objetivo del presente trabajo fue determinar la composición de aves de la región de Baja Talamanca en Limón por medio de la caracterización de los ecosistemas de los sitios estudiados. 86 MATERIAL Y MÉTODOS Sitios de estudio El estudio se realizó en la región de Baja Talamanca (ver Fig.1, de la sección de introducción de este informe). Se estudiaron tres zonas: las planicies entre 0-100 msnm, Las Brisas de Veragua (100-400 msnm) y los cerros Chimú y Muchilla (alturas mayores a los 400 msnm). Las planicies entre 0-100 msnm fueron representadas con los sitios Aguas Zarcas (9° 53´ 26.1´´ N, -83° 06´ 53.9´´ W), Cuenca del río Bananito (Finca privada Selva-Bananito Lodge 9° 49´ 26.3´´ N, -83° 03´ 45.6´´ W), Estero Negro (9° 51´ 06.2´´ N, -82° 56´ 50.8´´W), Parque Nacional Cahuita (9° 44´ 59.2´´ N, -82° 48´ 58.2´´ W) y Refugio Nacional de Vida Silvestre Gandoca-Manzanillo (9° 37´ 26.1´´, -82° 37´ 10.1´´W). La zona de Aguas Zarcas se ubica cerca de la ciudad de Limón, en la cuenca del río Banano, en este sitio se visitó la finca privada del vivero Tropical Zoo Plants, caracterizado por un hábitat de crecimiento secundario inicial y avanzado. En la cuenca del río Bananito, la reserva Selva-Bananito se ubica en la base del cerro Muchilla, estribaciones de la Cordillera de Talamanca, y se caracteriza por presentar variados hábitat como bosque ripario, potrero arbolado, borde de bosque secundario, bosque secundario, cuerpos de agua como lagunas y ríos, incluso plantaciones de palma aceitera. Por su parte, el Parque Nacional Cahuita, importante área protegida en Limón, presenta ambientes de playa, lagunas, bosques inundados pantanosos con Yolillo y Sangrillo. Otra significativa área protegida de la provincia es el Refugio Nacional de Vida Silvestre Gandoca-Manzanillo, que presenta humedales reconocidos a nivel internacional como sitio RAMSAR. Más arriba de los 100 msnm, los sitios de Veragua, cerro Chimú y cerro Muchilla, se ubican en las estribaciones de la Cordilllera de Talamanca. Veragua a 12 km de de la ciudad de Liverpool se caracteriza por presentar hábitat muy bien conservados, como bosques maduros asimismo presenta un importante cuerpo de agua como lo es el río Victoria. Por su parte los cerros Muchilla y Chimú, presentan bosques secundarios por arriba de los 400 msnm. 87 Durante el periodo de estudio se realizaron un total de 20 giras de campo. Al sitio Aguas Zarcas se realizó una única visita en la semana del 16 al 19 de noviembre del 2011; a la cuenca del río Bananito se realizaron visitas en las semanas del 19 al 22 de octubre del 2010, del 3 al 6 de mayo de 2011 y del 21 al 24 de noviembre del 2011 (en esta misma semana se visitó el cerro Muchilla). El Parque Nacional Cahuita fue visitado en las fechas del 22 al 26 de agosto (en esta misma semana se visitó el Estero Negro), del 7 al 11 de mayo de 2012 y del 10 al 14 de setiembre del 2012 (en esta misma fecha se hizo una visita al cerro Chimú). Al Refugio Nacional de Vida Silvestre GandocaManzanillo se realizaron giras del 9 al 13 de abril de 2012, del 27 al 31 de agosto de 2012, del 5 al 9 de noviembre de 2012, del 13 al 17 de mayo de 2013 y del 10 al 13 de diciembre de 2013; a Veragua las visitas se realizaron en las siguientes fechas: del 8 al 12 de noviembre del 2010, 21 al 25 de febrero de 2011, 11 al 15 de abril de 2011, del 13 al 16 de setiembre del 2011, del 3 al 7 de octubre del 2011 y del 8 al 11 de octubre de 2013; y finalmente al cerro Chimú las giras se hicieron del 24 al 28 de octubre del 2011 y del 25 al 29 de junio de 2012. Recolección e identificación de ejemplares de aves Para la captura de aves se utilizaron redes de niebla de 6 y 12 m de longitud, las cuales se ubicaron en los puntos de muestreo escogidos. Los hábitats muestreados fueron: cultivo con crecimiento secundario inicial, crecimiento secundario avanzado e inicial, bosque secundario avanzado y borde, bosque ripario, bosque secundario maduro, bosque maduro, vegetación detrás de playa, playa, catival, vegetación al lado de estero. Las redes se abrieron de las 05:30 a las 10:30 hrs. y de las 14:00 a las 17:30 hrs. y se revisaron cada 15-20 minutos. Todos los ejemplares recolectados (un ejemplar de cada especie y cuando existió dimorfismo sexual, dos ejemplares por sitio de estudio) se documentaron con notas de campo que incluyeron: fecha, condición climática, localidad (provincia, cantón, distrito y sitio específico de recolecta), coordenadas, altitud, recolector, acompañantes, especie, número de ave recolectada, hábitat y datos 88 del ave (coloraciones de partes suaves: iris, maxila, mandíbula, tarso, planta, uñas y peso). La identificación de los ejemplares se hizo con base en la literatura especializada y la colección de referencia científica. Los ejemplares se recolectaron considerando su representatividad para la Colección de Aves del Museo Nacional de Costa Rica, como para la caracterización de la avifauna de la zona en general; se excluyeron de la recolecta aquellas especies bajo categorías de amenaza. Los ejemplares recolectados han sido depositados en la colección de ornitología del Museo Nacional de Costa Rica. La información de aquellos individuos que fueron capturados y después liberados, fue tratada como observaciones, de igual forma se tomaron los mismos datos que para las aves recolectadas, a excepción de coloraciones de partes suaves y peso. Registro de información de aves en el campo La recolección de la información de campo consistió en la identificación de las aves observadas y escuchadas en cada uno de los puntos de muestreo. Los hábitat muestreados fueron: cultivo con crecimiento secundario inicial, crecimiento secundario avanzado e inicial, bosque secundario avanzado y borde, bosque ripario, bosque secundario maduro, bosque maduro, vegetación detrás de playa, playa, catival, yolillal, vegetación al lado de estero, estero, jardín, potrero arbolado, laguna, manglar, río, estuarios. Estos puntos de muestreo incluyeron las zonas donde se colocaron redes de niebla para la captura de aves así como otros transectos de los sitios de estudio en donde se realizaron recorridos. Los individuos que fueron identificados a nivel de especie, fueron anotados como observaciones; junto a esta información, se anotaron también datos como: fecha, condición climática, localidad (provincia, cantón, distrito, sitio específico de observación), coordenadas, altitud, observador, hábitat, número de individuos observados y cuando fue posible, anotaciones sobre comportamientos vistos. Se tomaron en cuenta observaciones diurnas y nocturnas. 89 Recopilación de información Además de la información generada bajo este proyecto de investigación, se realizó una búsqueda en la base de datos Global Biodiversity Information Facility (GBIF) así como en la base de datos de Zoología del Museo Nacional de Costa Rica; con el fin de recopilar más información disponible de registros de aves para el área de estudio de la provincia de Limón. En el Anexo 4 se presenta un listado general de las especies de aves registradas para la zona de estudio. RESULTADOS Y DISCUSIÓN Descripción general de la avifauna de la zona de Baja Talamanca Para la región de Baja Talamanca se ha registrado una comunidad de aves compuesta por 426 especies, constituyendo alrededor del 47% de la avifauna nacional. Tales especies se encuentran distribuidas en 62 familias, las mejor representadas corresponden a: Tyrannidae, Parulidae, Accipitridae y Thraupidae (Fig.1). Los géneros mejor representados de estas cuatro familias fueron: Contopus y Empidonax de la familia Tyrannidae, Geothlypis y Setophaga pertenecientes a la familia Parulidae; de la familia Accipitridae, los géneros más abundantes fueron Accipiter y Buteo, y de la familia Thraupidae, los más representativos fueron Tangara y Saltator (Fig. 2). Familias más abundantes 90 Cardinalidae Emberizidae Falconidae Furnariidae Columbidae Scolopacidae Ardeidae Icteridae Thamnophilidae Trochilidae Thraupidae Accipitridae Parulidae Tyrannidae 10 10 10 11 12 12 14 16 16 19 25 25 31 41 0 5 10 15 20 25 30 Número de especies 35 40 45 Figura 1. Familias de aves más representativas de acuerdo al número de especies, encontradas en la zona de Baja Talamanca. Respecto al estatus, el 70% de las especies son residentes, un 24% son migratorias y el restante 6%, presenta poblaciones tanto residentes como migratorias. Según el Reglamento a la Ley de Conservación de Vida Silvestre, se presentan 42 especies con poblaciones reducidas o amenazadas, así como cinco en peligro de extinción ( Jabiru mycteria, Eurypyga helias, Ibycter americanus, Ara ambiguus, Icterus mesomelas); es decir que un 11% de las aves registradas presentan alguna categoría de amenaza. 91 13 14 12 8 6 4 4 5 6 6 5 3 4 2 Tyrannidae Parulidae Accipitridae Saltator Tangara Buteo Accipiter Setophaga Geothlypis Empidonax 0 Contopus Número de especies 10 Thraupidae Géneros más abundantes Figura 2. Géneros más abundantes de acuerdo al número de especies, hallados en la zona Baja Talamanca. Dentro del listado de especies, se encuentran algunas de importancia por ser endémicas regionales (especies cuya distribución se limita a Costa Rica y a otros países cercanos), 20 en total, tales como: el copete de nieve (Microchera albocoronata), el tucancillo orejiamarillo (Selenidera spectabilis), la tangara negro y dorado (Chrysothlypis chrysomelas), la eufonia coroniamarilla (Euphonia luteicapilla), entre otras. Algunas son doblemente significativas ya que no sólo se encuentran amenazadas, sino también, son endémicas a nivel regional como el trogón ojiblanco ( Trogon clathratus), el perico frentirrojo (Aratinga finschi), el pájaro sombrilla (Cephalopterus glabricollis), el pájaro campana (Procnias tricarunculatus), la tangara piquiganchuda (Lanio leucothorax) y la tangara lomiazufrada (Heterospingus rubrifrons). 92 La zona Caribe de nuestro país forma parte de la zona avifaunística Bosque tropical muy húmedo o pluvial (Slud 1964), caracterizado por una avifauna de extrema riqueza y diversidad (Stiles 1971). La comunidad de aves registrada para la zona de Baja Talamanca de casi el 50% de la avifauna nacional, es clara evidencia de esta vasta riqueza. Se presentan grupos tan variados que reflejan la complejidad de hábitat presentes en el área, especies de zonas boscosas, de áreas abiertas y parcialmente abiertas, de cuerpos de agua, urbanas, entre otros; quienes utilizan estos hábitat de forma permanente (aves residentes) o temporal en su paso o residencia invernal en el país durante la época migratoria (especies migratorias). Tal riqueza de especies y hábitat ha logrado identificar dentro de la zona de Baja Talamanca, tres de las áreas importantes para la conservación de las aves (AICAS) definidas para Costa Rica: A. Cahuita, Gandoca-Manzanillo, y corredor para aves migratorias; B. Kèköldi y C. La Amistad Caribe (Sandoval & Sánchez 2011). La lista de especies registrada abarca grupos de bosque como tinamúes, crácidos, algunos rapaces, palomas, nictibios, colibríes, momotos, bucos, hormigueros, trepadores, cotingas, reinitas, tangaras, entre otros; de humedales de interior como patos, zambullidores, cigüeñones, garzas, rálidos, jacanas y martines pescadores; de mares, costas y playas como pardelas, fragatas, piqueros, pelícanos, correlimos y gaviotas; y de zonas abiertas como algunos emberizidos, ictéridos, y gorriones (Passeridae). Las familias más numerosas encontradas, específicamente Tyrannidae y Parulidae, coinciden con las más abundantes a nivel nacional. La familia Accipitridae es otra familia numerosa dentro del país, su significativa representación en Baja Talamanca es reflejo de la importancia del área como zona de paso para rapaces durante la migración. Las tangaras (Thraupidae), figuran dentro de las seis familias más numerosas registradas en el territorio nacional, Stiles (1969) menciona que hay gran diversidad de ellas en zonas de vida húmedas. Los géneros mejor representados dentro de estas familias en la zona de estudio, coinciden con aquellos más cuantiosos dentro de las familias a nivel nacional. 93 De la lista de especies registrada, una gran mayoría fue registrada para las planicies de 0-100 msnm, en menor porcentaje se registran especies para la zona de Veragua (entre 200 y 450 m) y el resto son registradas en sitios que no fueron visitados en campo bajo este proyecto de investigación pero que de igual forma son áreas valiosos para el registro de avifauna. De esta manera en lugares como Kèköldi se enlista el gavilán de Cooper (Accipiter cooperii), la polluela sora (Porzana carolina), el cuclillo piquigualdo (Coccyzus americanus), el cuclillo piquinegro (Coccyzus erythropthalmus), el copete de nieve (Microchera albocoronata), el cernícalo americano (Falco sparverius) el mosquerito lomiamarillo (Myiobius sulphureipygius) y el pájaro campana (Procnias tricarunculatus). Para la zona de Bratsi especies como el gavilán ranero (Geranospiza caerulescens), el caracara avispera (Ibycter americanus) y la plañidera moteada (Laniocera rufescens), y para la Reserva Biológica Hitoy Cerere el hormiguerito pizarroso (Myrmotherula schisticolor), el hormiguero de Zeledón (Myrmeciza zeledoni) y el vireón cejirrufo (Cyclarhis gujanensis). El área en general, como se mencionó anteriormente, es importante para aves residentes, endémicas, migratorias y amenazadas; es sitio visitado y ocupado por residentes que migran o se dispersan altitudinalmente y especies migratorias latitudinales. Como migrantes altitudinales se encuentran las más conocidas: el pájaro sombrilla (Cephalopterus glabricollis) y el pájaro campana (P. tricarunculatus), pero también hay otros que se dispersan altitudinalmente como el copete de nieve (M. albocoronata), el saltarín gorgiblanco (Corapipo altera) y el mosquerito ojimanchado (Mionectes olivaceus), entre otros. Respecto a las migratorias latitudinales, muchas rapaces diurnas son objeto de observación en el área debido a las enormes parvadas que se pueden apreciar como las de zopilote cabeza roja (Cathartes aura), junto a gavilanes aludos (Buteo platypterus) y gavilanes de Swainson (Buteo swainsoni) en los meses de octubre y abril principalmente; no obstante, hay muchas otras especies de rapaces que son avistadas; asimismo hay aves que migran utilizando humedales como los correlimos (Scolopacidae, Charadriidae) y gaviotas (Laridae), y otras que se ven de manera menos conspicua en ecosistemas terrestres como las reinitas (Parulidae), zorzales (Catharus spp. e Hylocichla mustelina) y mosqueros (Tyrannidae) (por mencionar algunos). 94 Avifauna de las planicies (0-100 msnm) La riqueza de aves de la zona de 0-100 msnm estuvo compuesta por 397 especies, lo que representa un 44% de la avifauna del país. Esta comunidad avifaunística se encuentra distribuida en 62 familias, las más abundantes en términos de especies son: Tyrannidae, Parulidae y Thraupidae. Respecto a los géneros mejor representados en términos de número de especies para dichas familias, los constituyen Contopus, Empidonax (Familia Tyrannidae), Geothlypis, Setophaga (Familia Parulidae) y Tangara, Saltator (Familia Thraupidae). El estado de distribución de las especies registradas para la zona basal está compuesto en un 71% por especies residentes, un 23% por especies migratorias y un 6% por especies que poseen poblaciones residentes y migratorias. De acuerdo con la legislatura nacional, 42 especies de las 397 registradas para la zona se encuentran amenazadas: 38 presentan poblaciones reducidas o amenazadas y cuatro en peligro de extinción. El endemismo regional para las planicies entre 0-100 msnm está representado por 15 especies, algunas de ellas el carpinterito alirrufo (Piculus simplex), el tororoi pechicanelo (Hylopezus dives), la cotinga nivosa (Carpodectes nitidus), el soterrey gorginegro (Pheugopedius atrogularis), el soterrey pechirrayado (Cantorchilus thoracicus), el semillero piquirrosado (Oryzoborus nuttingi), entre otras. Esta zona encierra una gama de hábitats importantes para las aves, los ecosistemas de bosque tropical húmedo, litoral (playa y vegetación detrás de la playa), bosques anegados (catival y yolillal), manglar y laguna, registran la ocupación de una gran cantidad de especies residentes y 95 migratorias. Una importante riqueza fue reportada, en donde el 93% de la avifauna de Baja Talamanca es identificada en su área basal. El bosque tropical lluvioso presente en esta región de Costa Rica es exuberante, con una enorme riqueza de fauna, donde las aves no son la excepción. Dentro de las especies que se informan para este hábitat se encuentran algunas doblemente importantes por tratarse de especies residentes que están amenazadas y cuya distribución abarca solamente la vertiente Caribe del país, entre ellas: el tinamú pizarroso (Crypturellus boucardi), el gavilán dorsiplomizo (Leucopternis semiplumbeus), el buco pinto (Notharchus tectus), el halcón de monte dorsigrís (Micrastur mirandollei), el perico azteco (Aratinga nana), la lapa verde (Ara ambiguus), el saltarín cabecigrís (Piprites griseiceps), la urraca pechinegra (Cyanocorax affinis), la tangara lomiazufrada (Heterospingus rubrifrons) y el bolsero coliamarillo (Icterus mesomelas). No obstante, hay otras especies que ocupan la zona boscosa y que llaman la atención por encontrarse también amenazadas (presentan poblaciones reducidas), por ejemplo el tinamú mayor (Tinamus major), la pava crestada (Penelope purpurascens), el pavón (Crax rubra), el rey de zopilotes (Sarcoramphus papa), el gavilán negro mayor (Buteogallus urubitinga), la paloma escamosa (Patagioenas speciosa), la lechucita vermiculada (Megascops guatemalae), el búho penachudo (Lophostrix cristata), la tangara piquiganchuda (Lanio leucothorax) y varias especies de psitácidos, entre otros. Dentro de los bosques se ubican cuerpos de agua como ríos y quebradas. En el caso del río Bananito se registraron especies como el garzón (Mycteria americana), la garza real (Ardea alba), la garceta azul (Egretta caerulea), el andarríos maculado (Actitis macularius), la garza nivosa (Egretta thula), el águila pescadora (Pandion haliaetus), entre otros. En la cuenca del río Bananito hay presencia de pequeñas quebradas rodeadas de bosques en los que se registran especies importantes como la garza del sol (Eurypyga helias), de igual manera en éstos bosques riparios se avistaron aves como la tangara hormiguera gorgirroja (Habia fuscicauda), el batará lineado (Cymbilaimus lineatus), el picogrueso negro azulado (Cyanocompsa cyanoides), entre otros. No obstante, a pesar del estado de éstos parches boscosos, en los alrededores del río Bananito también se presentan ambientes alterados como plantaciones de palma aceitera, potreros arbolados, crecimientos secundarios iniciales 96 caracterizados por avifauna como sargentos (Ramphocelus passerinii), tijos (Crotophaga sulcirostris), espigueros variables (Sporophila americana), semilleros picogrueso (Oryzovorus funereus), pinzones cabecilistados (Arremonops conirostris), garcillas bueyeras (Bubulcus ibis) e incluso chachalacas (Ortalis cinereiceps) en los bordes de bosque colindantes a los potreros. Los hábitats ya mencionados son sitios de refugio y alimentación de paso o residencia invernal de grupos de especies migratorias como es el caso de rapaces, mosqueros, vireos, reinitas y tangaras. El área importante para la conservación de las aves (AICA) Cahuita, Gandoca-Manzanillo, y corredor para aves migratorias, abarca distintos hábitats con cobertura boscosa entre la línea costera y las montañas por debajo de los 300 msnm, desde el sur de la ciudad de Limón hasta el río Sixaola. En esta área se incluyen ecosistemas como lagunas, yolillales, manglares, ríos y canales. Gran parte de esta AICA se encuentra en áreas protegidas como el Parque Nacional Cahuita y el Refugio Nacional Mixto de Vida Silvestre Gandoca-Manzanillo (Sandoval & Sánchez 2011). Muchas de las especies de las planicies (0-100 msnm) se comparten entre los diferentes ambientes acuáticos, por lo que es difícil hacer una caracterización por hábitat. Sin embargo, para hábitat litorales como las playas se registran especies de ambientes marinos como la tijereta de mar (Fregata magnificens), el pelícano pardo (Pelecanus occidentalis) y el piquero moreno (Sula leucogaster). Respecto a este último, la colonia de anidación del Caribe se ubica en los islotes cercanos a la isla Uvita, donde enfrenta diferentes amenazas debido a la presencia humana (Villarreal et al. 2010). Otras especies residentes que se observan en este ecosistema litoral incluyen chorlitos como el collarejo (Charadrius collaris) y el picudo (Charadrius wilsonia); asimismo, las costas caribeñas también son ocupadas por aves migratorias como chorlitejos (Pluvialis spp. y Charadrius spp.), playeros como el arenero (Calidris alba) y el vuelvepiedras rojizo (Arenaria interpres), gaviotas como la gaviota reidora (Leucophaeus atricilla) y la pagaza real (Thalasseus maximus), entre otros. Otros avistamientos interesantes que se dieron en las costas fue el paso de 97 cientos de individuos en migración de la golondrina tijereta ( Hirundo rustica) y de la golondrina ribereña (Riparia riparia). En la vegetación detrás de la playa es común observar al gavilán cangrejero ( Buteogallus anthracinus) buscando presas que se encuentren en playa. Otras especies como el trogón coliplomizo (Trogon massena), el tucán pico iris (Ramphastos sulfuratus), el batará plomizo (Thamnophilus atrinucha), la reinita mielera (Coereba flaveola) y reinitas migratorias como la gusanera (Helmitheros vermivorum) y la de costados castaña (Setophaga pensylvanica), fueron registradas en este tipo de vegetación. Estas son especies que habitan bordes de bosque pero también algunas se encuentran dentro del bosque y sitios con vegetación de crecimiento secundario alto (Garrigues & Dean 2007). Otros hábitats importantes son los bosques anegados como los cativales y yolillales; sin embargo, para una caracterización más detallada de su avifauna es necesario dedicar más horas de observación. Un escaso ejemplo donde se incluye este tipo de hábitats es el trabajo realizado en el Refugio Nacional Mixto de Vida Silvestre Limoncito, donde se registran poco más de 70 especies de aves, compuesta principalmente por especies de hábitos acuáticos como las garzas (Piedra & Bravo 2002). En el presente trabajo dentro de las cativeras se identificaron, entre otras, aves como el rascón cuelligrís (Aramides cajaneus), el hormiguero dorsicastaño (Myrmeciza exsul), el hormiguero calvo (Gymnocichla nudiceps), el saltarín cuelliblanco (Manacus candei), el soterrey castaño (Cantorchilus nigricapillus) y la reinita cabecidorada (Protonotaria citrea); aves que prefieren zonas boscosas con agua o pantanosas (Stiles & Skutch 2003). En los yolillales, se encuentran algunas de las especies mencionadas anteriormente pero otras fueron identificadas también, tales como la garza tigre (Tigrisoma mexicanum) y el huevo frito (Laterallus albigularis). En sectores como Cahuita es frecuente ver en los bosques inundados al martín pescador enano (Chloroceryle aenea). 98 El manglar más grande y menos alterado de la costa caribeña costarricense se encuentra alrededor de la Laguna de Gandoca, este manglar es de los pocos en el país que aún cuenta con zonas continuas de bosque y manglar; asimismo, la laguna de Gandoca es la más extensa del Caribe Sur, dominada por mangle, yolillos y palma real (Coll et al. 2001, MINAE/SINAC-UICN/ORMA 1998). Esta laguna es hábitat de especies como la garceta azul (Egretta caerulea), la garza real (Ardea alba), la garcilla verde (Butorides virescens), el martín pescador collarejo (Megaceryle torquatus) y el martín pescador verde (Chloroceryle americana). En la parte cercana a la costa se registran aves como el soldadito (Himantopus mexicanus), el chorlitejo semipalmado (Charadrius semipalmatus) y el cormorán neotropical (Phalacrocorax brasilianus). En otras lagunas de reducido tamaño, aves como la gallina de agua (Porphyrio martinicus) y la jacana centroamericana (Jacana spinosa) son comunes de observar. Por otro lado, en sitios como los canales en el límite sur del Parque Nacional Cahuita habitan especies como el pato aguja (Anhinga ahnhinga), el martinete cabecipinto (Nyctanassa violacea) y la garceta tricolor (Egretta tricolor), y en los canales de Estero Negro otras como el chocuaco (Cochlearius cochlearius) y la golondrina lomiblanca (Tachycineta albilinea). Es importante mencionar que para las bajuras del Caribe Sur, hay identificados reportes particulares como por ejemplo el del galán sin ventura (Jabiru mycteria) sobre la quebrada Westfalia (Alvarado et al. 1999) y en Kèköldi, avistamientos accidentales de la especie. Avifauna de Veragua De acuerdo a los registros procesados, la avifauna de la zona de Veragua estuvo compuesta por 220 especies, lo que representa el 24% de la riqueza del país. Del total de 42 familias identificadas, las más abundantes, es decir aquellas con mayor número de especies fueron Tyrannidae, Thraupidae y Trochilidae. 99 Dentro de estas familias, se destacaron ciertos géneros por su abundancia de especies, como lo fueron Todirostrum, Contopus, Myiarchus y Myiozetetes, pertenecientes a la familia Tyrannidae; Tachyphonus y Tangara, correspondientes a la familia Thraupidae, y por último, los géneros Phaethornis y Amazilia de la familia Trochilidae. Para la localidad de Veragua, el 82% de las especies registradas son residentes, el 15%, migratorias y el restante 3% son especies con poblaciones tanto residentes como migratorias. El número de especies amenazadas según el Reglamento a la Ley de Conservación de Vida Silvestre es de 22, la garza del sol (Eurypyga helias) es la única amenazada de extinción, el resto están catalogadas como especies con poblaciones reducidas o amenazadas. Aves como el trogón ojiblanco (Trogon clathratus), el pájaro sombrilla (Cephalopterus glabricollis), la tangara lomiazufrada (Heterospingus rubrifrons), la tangara cenicienta (Tangara inornata), y la eufonia gorricanela (Euphonia anneae), son algunas de las 11 especies que dentro de la lista de aves de Veragua presentan endemismo regional. La zona de Veragua forma parte de las estribaciones de la Fila Matama, Cordillera de Talamanca, contiene bosques en un estado de conservación relativamente bueno, por lo que posee una rica biodiversidad. En el caso de la avifauna, poco más de la mitad (52%) de las especies registradas para la zona de estudio, Baja Talamanca, fueron identificadas en esta localidad. Las familias más abundantes coinciden con aquellas que son numerosas a nivel nacional, se encontraron entre las cinco primeras, las familias Trochilidae y Thamnophilidae. En el caso de los colibríes, es un grupo que muestra una mayor diversidad en bosques húmedos de bajuras y altitudes intermedias, mientras que los hormigueros es un grupo común y característico del bosque tropical húmedo (Stiles 1969). Respecto a los géneros identificados como abundantes, algunos de ellos corresponden con los más numerosos de las familias correspondientes, así sucede con Contopus para Tyrannidae, Tangara para Thraupidae y Amazilia para Trochilidae. 100 Debido al tipo de cobertura presente en el área (principalmente boscosa), la representación de especies acuáticas es baja, y prácticamente ninguna para aquellas de hábitos costeros. En Veragua figuran cuerpos de agua como ríos y quebradas, el más notorio es el río Victoria donde se registran especies como la garza del sol (E. helias), ave en peligro de extinción; las reinitas acuáticas (Parkesia spp.) y la guardaribera (Myiothlypis fulvicauda). La franja altitudinal donde se encuentra Veragua (200 - 450 msnm), presenta la particularidad de que se observan especies cuya distribución incluye bajuras y elevaciones intermedias, otras de solo elevaciones intermedias y otras de zonas más altas que migran o se dispersan altitudinalmente. De esta manera, en el listado anexo resalta avifauna propia de Veragua como lo es la garza tigre de río (Tigrisoma fasciatum), el vencejo común o grisáceo (Chaetura vauxi) que habita entre los 600 y 2200 msnm pero que desciende en ocasiones a bajuras cercanas (Stiles & Skutch 2003, Garrigues & Dean 2007), el mirlo montañero (Turdus plebejus) que habita en áreas superiores a los 1200 msnm y que después de la época de cría se dispersa a sitios más bajos (Stiles & Skutch 2003, Garrigues & Dean 2007), el trogón ojiblanco (T. clathratus), la tangara negro y dorado (Chrysothlypis chrysomelas) y la eufonia gorricanela (E. anneae); éstos últimos tres, como ya fue mencionado anteriormente, endémicos para la región y en el caso del trogón, catalogado amenazado con poblaciones reducidas o amenazadas. Veragua es importante sitio para especies residentes y migratorias, se han hecho interesantes registros como por ejemplo el nictibio grande (Nyctibius grandis) con cría, así como adulto y cría del búho penachudo (Lophostrix cristata), la presencia de migrantes altitudinales en la segunda mitad del año, la garza del sol (E. helias) cazando en el río Victoria, individuos del gavilán aludo (Buteo platypterus) ocupando perchas de descanso, numerosas capturas de zorzales ( Catharus spp.) dentro del bosque, uso de plantas para alimentación por diferentes especies, entre otros. En general, la mayoría de la avifauna de Veragua, es de hábitat con buena cobertura boscosa, lo que evidencia el buen estado de los ecosistemas que encierra el lugar. 101 Avifauna de cerros Chimú y Muchilla En las visitas realizadas a los cerros Chimú y Muchilla, se logró identificar un total de 61 especies, distribuidas en 29 familias. Las familias más numerosas de acuerdo al número de especies fueron: Trochilidae (6 especies), Thamnophilidae (4 especies), Furnariidae (4 especies), Tyrannidae (4 especies) y Turdidae (4 especies). Debido a la poca cantidad de especies registradas, muchos de los géneros de dichas familias cuentan son tan sólo un representante, de esta manera para la familia Trochilidae, el género Phaethornis sobresale con tres especies, pero el resto de géneros Eutoxeres, Chalybura y Thalurania sólo cuentan con una. Para las familias Thamnophilidae, Furnariidae y Tyrannidae los respectivos géneros (1. Thamnophilus, Epinecrophylla, Myrmeciza, Phaenostictus; 2. Dendrocincla, Glyphorhynchus, Dendrocolaptes, Lepidocolaptes y 3. Mionectes, Contopus, Empidonax, Megarhynchus), cuentan con tan sólo una especie. En la familia Turdidae, sobresale el género Catharus con tres especies. La avifauna identificada en los cerros Chimú y Muchilla, está compuesta por un 77% de especies residentes, un 20% de especies migratorias y un 3% de aves con poblaciones residentes y migratorias. Las especies tinamú grande (Tinamus major), pava crestada (Penelope purpurascens), rey de zopilotes (Sarcorhamphus papa) y el loro verde (Amazona farinosa) registradas en estos sitios, están catalogadas como especies con poblaciones reducidas o amenazadas según el Reglamento a la Ley de Conservación de Vida Silvestre. Respecto al endemismo, sólo la especie Pheugopedius atrogularis, el soterrey gorginegro, es endémico regional, su distribución abarca del este de Nicaragua hasta el noroeste de Panamá (Stiles & Skutch 2003, Garrigues & Dean 2007). 102 La avifauna registrada en los cerros Chimú y Muchilla es muy semejante a aquella encontrada para las partes más bajas (0-100 msnm) y Veragua; no obstante, en el cerro Chimú se registraron dos especies únicas para éste sitio, el gallito hormiguero cabecinegro ( Formicarius nigricapillus) y el zorzal cabecinegro (Catharus mexicanus), ambos registrados a una altura alrededor de los 700 msnm. El gallito hormiguero cabecinegro se distribuye a lo largo de la vertiente Caribe entre los 400 y 1200 msnm, en la parte sureste de la vertiente se le encuentra entre los 600 y 1200 msnm; y el zorzal cabecinegro es una especie que habita entre los 300 y 800 msnm, desplazándose en la vertiente Caribe hasta los 1000 msnm, ambas especies son de bosques maduros, aunque el gallito puede visitar las áreas de crecimiento secundario avanzado que se encuentren adjuntas (Stiles & Skutch 2003, Garrigues & Dean 2007); reflejando el hábitat conservado que presenta Chimú. Especies importantes para la conservación Sula leucogaster: El piquero moreno es un ave marina que se encuentra distribuida a lo largo de ambas costas del país, se reproduce en islas, en el Caribe, lo hace en los islotes cerca de Isla Uvita (Quiribrí), cerca de Limón; no obstante, esta colonia enfrenta amenazadas como contaminación, depredación por animales domésticos y silvestres, así como la afluencia no controlada de turismo. Eurypyga helias: Esta especie conocida como la garza del sol, sol y luna o ave canasta. Se le puede observar en quebradas dentro de áreas boscosas, principalmente en aquellas de curso rápido. Se ha catalogado para el país como especie en peligro de extinción. Al desplegar sus alas con el llamativo patrón que poseen, atrae la atención de quienes la observan. Trogon clathratus: El trogón ojiblanco es una especie amenazada con poblaciones reducidas o amenazadas, su distribución mundial se restringe a Costa Rica y el oeste de Panamá, por tanto es endémica para la región. Dentro del país, habita en las laderas más bajas y piedemontes del lado 103 Caribe (de Panamá al Volcán Miravalles); la literatura menciona que se reproduce entre 90 y 1100 msnm y desciende de las partes altas de su distribución entre mediados y fines de la época lluviosa. Chloroceryle inda: Comúnmente conocido como Martín pescador ventrirrufo, es un ave con poblaciones reducidas o amenazadas, y cuya distribución se restringe a las bajuras del Caribe, en especial a bosques pantanosos costaneros como los presentes en Cahuita y Manzanillo. También es posible observarlo aunque menos frecuente en quebradas de bosques. Falco peregrinus: El halcón peregrino es un rapaz migratorio, cuyas poblaciones se han catalogado como reducidas o amenazadas, sus números disminuyeron gravemente por el uso del DDT (insecticida) en Norteamérica. Es un representante de las muchas especies rapaces que forman parte del evento de la migración latitudinal que tiene lugar en el país y que se observa de forma tan espectacular en la zona Caribe. Ara ambiguus: La lapa verde se encuentra en la lista de especies en peligro de extinción de acuerdo al Reglamento a la Ley de Conservación de Vida Silvestre. Sus poblaciones han sido fuertemente afectadas por la deforestación. Esta ave habita bosques húmedos de bajuras, se alimenta principalmente de frutos de almendro amarillo (Dipteryx panamensis), desplazándose estacionalmente de acuerdo a su fructificación. Pionus menstruus: El loro cabeciazul o chucuyo presenta poblaciones reducidas o amenazadas en el país. Su distribución es restringida a las bajuras del Caribe desde Limón y Siquirres hacia el sur, y también en las bajuras de la zona del Pacífico sur al norte de Sierpe y en el área de San Vito. Como el resto de las especies de psitácidos, el tráfico de mascotas es un problema. Cephalopterus glabricollis: El pájaro sombrilla es una especie endémica de Costa Rica y el oeste de Panamá. Según el Reglamento a la Ley de Conservación de Vida Silvestre, se ubica en la categoría de aves con poblaciones reducidas o amenazadas. Frecuenta áreas boscosas y realiza migraciones 104 altitudinales, debido a su estado, es una especie poco común de observar, lo que la hace atractiva de avistar. Heterospingus rubrifrons: Esta especie conocida comúnmente como tangara lomiazufrada es endémica de la región, se distribuye de Costa Rica al este de Panamá. En Costa Rica forma parte de la lista de aves con poblaciones reducidas o amenazadas, su distribución dentro del país está confinada a las bajuras y piedemontes del Caribe Sur, desde el nivel del mar hasta los 700 msnm. Eventos biológicos de interés Las aves realizan diferentes movimientos, algunas lo hacen a nivel local, son especies residentes que se mueven de una zona a otra dentro del mismo territorio nacional; y otras que realizan desplazamientos pero a una escala mayor, moviéndose latitudinalmente, especies que migran de Norteamérica hacia Centro y Suramérica ó aquellas que lo hacen en dirección contraria. Se estima que al menos la mitad de la avifauna costarricense muestra algún grado de movimiento estacional (Stiles 1983). La zona Caribe de nuestro país es un importante escenario para la observación de tan interesantes eventos biológicos. MOVIMIENTOS ALTITUDINALES Los movimientos altitudinales de las especies pueden involucrar migraciones o dispersiones, se estima que hay de 50 a 75 especies (y probablemente más) migrantes en el país (Stiles 1991). Generalmente las aves que realizan estos movimientos son de hábitos frugívoros y nectarívoros, cuyos recursos alimentarios varían espacial y temporalmente de acuerdo a los periodos de floración y fructificación de la vegetación (Stiles & Skutch 2003). Para la zona del Caribe se han identificado especies de colibríes, palomas, tucanes, trogones, cotingas, saltarines, mirlos, tangaras, entre otros (Pringle et al. 1984, Blake & Loiselle 2000). 105 Durante las visitas en campo realizadas bajo este proyecto, se registraron especies de zonas altas en elevaciones intermedias, patrón más común de observar en migrantes altitudinales del país (desplazarse a alturas mayores para reproducirse durante la época seca y posterior al periodo reproductivo moverse hacia elevaciones menores) (Stiles 1991); de esta manera, por ejemplo, en Veragua en los meses de octubre y noviembre, se capturaron y observaron aves como el pájaro sombrilla (Cephalopterus glabricollis), la paloma collareja (Patagioenas fasciata), el mirlo montañero (Turdus plebejus) y el mirlo vientriblanco (Turdus obsoletus). También se registró la amazilia pechiazul (Amazilia amabilis) quien realiza otro patrón, posterior a la época reproductiva pasa de las bajuras a elevaciones intermedias, tal y como lo informan Stiles & Skutch (2003). Por otra parte, se registraron especies de elevaciones intermedias en áreas de bajuras, en Aguas Zarcas de Limón en el mes de noviembre se capturaron varios individuos del saltarín gorgiblanco (Corapipo altera), especie que habita regularmente entre los 400 y 1000 msnm en la vertiente Caribe, pero durante los meses de julio y enero, se mueve a menores elevaciones (Garrigues & Dean 2007). En estudios realizados en esta especie, se observa una correlación positiva entre los movimientos desde bajuras hacia zonas altas con los picos de fructificación (fructificación que coincide específicamente con la época de cría de la especie) (Boyle 2006, Rosselli 1994). Al parecer la abundancia de frutos no es clave en sus movimientos de zonas más altas a zonas más bajas, otras razones que deben ser probadas, podrían ser las que causantes de tales migraciones (Boyle 2006). Otra especie que llama la atención es la clorofonia cejidorada ( Chlorophonia callophrys) para la cual recolectas históricas en las bajuras del Caribe Sur de especímenes depositados en el Museo de Zoología Comparada de la Universidad de Harvard, evidencian su migración altitudinal, Stiles & Skutch (2003) mencionan que en el Caribe esta ave puede descender a razón de la escasez de frutos en las partes más altas durante la época lluviosa. 106 De las especies registradas en este trabajo, hay otras aparte de las mencionadas, que según la bibliografía (Stiles 1991, Stiles & Skutch 2003), realizan movimientos de este tipo dentro del país como el jacobino nuquiblanco (Florisuga mellivora), el copete de nieve (Microchera albocoronata), la ninfa coronivioleta (Thalurania colombica), el tucancillo orejiamarillo (Selenidera spectabilis), la tangara dorada (Tangara icterocephala), la tangara cabecicastaña (Tangara gyrola), la eufonia gorricanela (Euphonia anneae), entre otros. A pesar de la falta de estudios que demuestren la ruta precisa que utilizan las diferentes especies que migran o se dispersan altitudinalmente en la zona de Caribe Sur, es importante resaltar que los corredores biológicos representan áreas fundamentales para el desplazamiento de individuos; de esta forma en el Área de Conservación La Amistad Caribe, corredores como Cordillera a Cordillera y Talamanca Caribe junto a áreas protegidas como la Zona Protectora Cuenca del Río Banano y la Reserva Biológica Hitoy Cerere, pueden estar jugando un papel muy significativo para el paso de especies entre el Parque Internacional La Amistad (Cordillera de Talamanca) y las bajuras y piedemontes del Caribe Sur. MIGRACIÓN LATITUDINAL En Costa Rica se presenta la migración latitudinal boreal y austral. En este trabajo se registran 125 especies que migran y utilizan la región de Baja Talamanca como sitio de paso o residencia temporal. La migración latitudinal boreal es fuertemente notoria en esta zona con el paso de grandes grupos de rapaces como zopilotes, gavilanes, halcones y paserinos como golondrinas; asimismo, en los diferentes hábitats, se pueden encontrar otras especies cuya migración es menos llamativa, pero igualmente interesante. En la zona de Baja Talamanca se ubica parte del corredor migratorio de aves del Caribe Mesoamericano, por el que pasan millones de individuos de 150 especies aproximadamente entre ellas aves acuáticas, canoras y rapaces; con respecto a estas últimas, la zona de Kèköldi se ha 107 identificado como uno de los tres mejores puntos a nivel mundial para observar rapaces en migración, este territorio indígena ha tenido picos de conteos de 3,6 millones de aves en la migración de otoño y de 1,5 millones en primavera (Sandoval & Sánchez 2011). En la lista registrada para Baja Talamanca se registran especies de rapaces como el zopilote cabeza roja (Cathartes aura) (que llama la atención por sus numerosos grupos), el águila pescadora (Pandion haliaetus), el elanio colinegro (Ictinia mississippiensis), el elanio plomizo (Ictinia plumbea), el aguilucho norteño (Circus cyaneus), el gavilán aludo (Buteo platypterus), el gavilán de Swainson (Buteo swainsoni), el gavilán colirrojo (Buteo jamaicensis), el cernícalo americano (Falco sparverius) y el halcón peregrino (Falco peregrinus). Durante las visitas de campo en el camino de entrada hacia Veragua y hacia el cerro Chimú, se observaron muchos individuos aislados del gavilán aludo (B. platypterus) durante el día y al atardecer, utilizando esta área como sitio de descanso. Otras aves como golondrinas también se observan en la zona en grandes cantidades, a finales del mes de agosto (migración de otoño), en unos cuantos minutos se contabilizaron más de 500 individuos de la golondrina tijereta (Hirundo rustica), volando sobre mar y playa del sector Puerto Vargas en el Parque Nacional Cahuita; durante el mes de mayo (migración de primavera) esta misma especie se vio acompañada por la golondrina ribereña (Riparia riparia) en su paso por el mismo sitio. Muchas veces estas golondrinas son acompañadas durante la migración por la golondrina risquera (Petrochelidon pyrrhonota) (Garrigues & Dean 2007). Muchas especies de hábitos acuáticos también utilizan el área, algunas son: la garza ceniza (Ardea herodias), el chorlito dorado menor (Pluvialis dominica), el zarapito trinador (Numenius phaeopus), el playero arenero (Calidris alba), el vuelvepiedras rojizo (Arenaria interpres), el correlimos occidental (Calidris mauri), la gaviota reidora (Leucophaeus atricilla), la pagaza real (Thalasseus maximus). 108 Dentro de las migratorias terrestres que se identifican en Baja Talamanca se encuentran cucos, chotacabras, mosqueros, vireos, zorzales, reinitas, tangaras y caciques, especies que utilizan todos los hábitat disponibles desde crecimientos secundarios hasta bosques maduros. Entre las frecuentes se pueden observar el zorzal de Swainson (Catharus ustulatus), la tangara veranera (Piranga rubra), el cacique veranero (Icterus galbula), entre otras. Llaman la atención los casos del zorzal dorsirrojizo (Catharus fuscescens), el pájaro-gato gris (Dumetella carolinensis), la población migratoria del añapero menor (Chordeiles acutipennis), el añapero zumbón (Chordeiles minor), el vencejo de paso (Chaetura pelagica), el mosquerito verdoso (Empidonax virescens) y la reinita coronicastaña (Setophaga palmarum), ya que son migratorias más comunes de observar a lo largo de la costa Caribe del país (Stiles 1988, Stiles & Skutch 2003, Garrigues & Dean 2007). Algunas de las especies migratorias registradas en el campo, fueron vistas en los diferentes lugares haciendo uso de los recursos, por ejemplo se vio a la tangara veranera ( Piranga rubra), a la tangara escarlata (Piranga olivacea) y a la reinita verdilla (Oreothlypis peregrina) alimentándose de frutos del árbol de capulín (Muntingia calabura); al vireo ojirrojo (Vireo olivaceus) se le vio ingiriendo frutos de Psychotria berteriana y al cacique (Icterus galbula), néctar de poró (Erythrina fusca). Así también, especies como el andarríos maculado y el martín pescador norteño, se les observó en busca de alimento en el río Bananito y a las reinitas acuáticas ( Parkesia motacilla y P. noveboracensis) en el río Victoria. Los tiránidos como los pibís (Contopus spp.) y los mosqueritos (Empidonax spp), se les vio cazando insectos en los diferentes hábitat. CONCLUSIONES Y RECOMENDACIONES El Caribe de Costa Rica presenta una complejidad de hábitat que confluye en una extraordinaria diversidad de especies. Tales ambientes se distribuyen en áreas protegidas por el Estado así como en territorios privados y son ocupados por una variedad de aves tanto residentes como migratorias. Las reservas privadas son importantes sitios para las aves; no obstante, es necesario un mayor acercamiento entre los propietarios y el Sistema Nacional de Áreas de Conservación con el fin de fomentar las iniciativas de investigación y protección en estos sitios, los 109 cuales representan zonas de amortiguamiento de las áreas protegidas y de conexión entre las mismas. La creación o el fortalecimiento de zonas que conecten los distintos parches boscosos (como los corredores biológicos), aunado a un programa de educación ambiental, permitirá un panorama más positivo para estas poblaciones, así como para el resto de las especies vulnerables a la fragmentación, por ejemplo el caso de las migrantes altitudinales. Tales estrategias de manejo que se generen a partir de las distintas investigaciones que se realicen, idealmente, deberían ejecutarse en conjunto entre áreas protegidas y reservas privadas. Respecto a las iniciativas de investigación, a pesar del inventario avifaunístico que maneja la zona, aún hay lagunas de información, el sitio tiene potencial para mucha más investigación, por ejemplo estudios sobre la ruta de migración altitudinal que realizan algunas aves residentes, así como avifauna ligada a ecosistemas como cativeras y yolillales, e informes más sencillos como las ampliaciones de distribución que podrían darse a futuro para ciertas especies. Entre mejor se conozca la avifauna del área, mejores medidas de manejo se podrán aplicar e incluso realizar una mejor interpretación ambiental de las áreas de la zona. LITERATURA CITADA Alvarado, G. M., M. García & H. Gómez. 1999. Avistamiento de Jabiru mycteria (Aves: Ciconiidae), en Westfalia, Limón, Costa Rica. Brenesia 52: 65-66. Blake, J. G., F. G. Stiles & B. A. Loiselle. 1990. Birds of La Selva Biological Station: Habitat Use, Trophic Composition, and Migrants. In: A.H. Gentry (ed.). Four Neotropical Rainforests. Yale University Press. Pp. 161-269. Blake, J. G. & B. A. Loiselle. 2000. Diversity of birds along an elevational gradient in the Cordillera Central, Costa Rica. The Auk 117 (3): 663-686. Boucher, D., P. Elias, J. Faires & S. Smith. 2014. Historias de éxito en torno a la deforestación.Union of Concerned Scientists. 55 pp 110 Boyle, A. 2006. Why do birds migrate? The role of food, habitat, predation and competition. Tesis de Doctorado. Universidad de Arizona, Tucson, Arizona. 272 pp. Coll, M., A. C. Fonseca & J. Cortés. 2001. El manglar y otras asociaciones vegetales de la laguna de Gandoca, Limón, Costa Rica. Rev. Biol. Trop. 49. Supl. 2: 321-329. Garrigues, R & R. Dean. 2007. The Birds of Costa Rica: A Field Guide. Editorial Zona Tropical. Ithaca, Nueva York. 387 pp. Martínez, D. 2007. Campanas en Kèköldi. Zeledonia 11 (1): 47. MINAE/SINAC-UICN/ORMA. Inventario de los humedales de Costa Rica. Editorial Editorama. San José, Costa Rica. 380 pp. Piedra, L. & J. Bravo. 2002. Refugio Nacional de Vida Silvestre Limoncito (RNVSL): Restauración y Manejo de Bosques Inundables de Palma (Raphia taedigera) y Cativo (Prioria copaifera). Informe Final. Programa Humedales de Costa Rica: Uso y Conservación. 22 pp. Pringle, C., I. Chacón, M. Grayum, H. Greene, G. Hartshom, G. Schatz, G. Stiles, C. Gómez & M. Rodríguez. 1984. Natural History Observations and Ecological Evaluation of the La Selva Protection Zone, Costa Rica. Brenesia 22: 189-206. Reglamento a Ley de Conservación de la Vida Silvestre. (2005, 10 de marzo). La Gaceta, 180, setiembre 20, 2005. Rosselli, L. 1994. The anual cycle of the White-ruffed manakin Corapipo leucorrhoa, a tropical frugivorous altitudinal migrant, and its food plants. Bird Conservation International 4 (2-3): 143-160. Sandoval, L. & C. Sánchez (eds.). 2011. Important bird Areas in Costa Rica. Unión de Ornitólogos de Costa Rica. San José, Costa Rica. 196 pp. Stiles, F. G. 1969. Introduction to the Avifauna of Costa Rica. Organization for Tropical Studies. 42 pp. Stiles, F.G. 1988. Notes on the distribution and status of certain birds in Costa Rica. The Condor 90: 931-933. Stiles, F.G. 1991. Aves: Introducción. In: D.H. Janzen (ed.). Historia Natural de Costa Rica. Editorial de la Universidad de Costa Rica, San José, Costa Rica. pp. 515-629. 111 Stiles, F.G. & A. Skutch. 2003. Guía de Aves de Costa Rica. 3era edición. Editorial INBio. Santo Domingo, Heredia, Costa Rica. 571 pp. Slud, P. 1964. The Birds of Costa Rica: Distribution and Ecology. Bulletin of the American Museum of Natural History 128: 1-430. Villarreal, J., J. Pereira & M. Salazar. 2010. Colonia de piqueros morenos (Sula leucogaster) del Caribe sur, Costa Rica: una supervivencia amenazada. Zeledonia 14 (1): 14-20. 112 DIVERSIDAD DE MARIPOSAS DIURNAS Y NOCTURNAS EN LA REGIÓN DE BAJA TALAMANCA, LIMÓN, COSTA RICA German Vega Araya Departamento de Historia Natural Museo Nacional de Costa Rica [email protected] RESUMEN Se realizó un muestreo en la zona de Baja Talamanca, Limón, Costa Rica para determinar e interpretar la fauna de mariposas diurnas y nocturnas de esta región. Por otra parte se hizo una búsqueda de registros en las bases de datos del Museo Nacional y del INBio para completar el listado de especies. Se registraron 448 especies de mariposas diurnas distribuidas en 5 familias, 25 subfamilias y 253 géneros. Esta diversidad representa el 28% de las especies de mariposas diurnas informadas para Costa Rica. La mayor diversidad la presentó la familia Nymphalidae con 224 especies, seguida por Lycaenidae con 111 y Hesperiidae con 101. El 55% de las especies (246) están asociadas al ecosistema de bosque y un 45% (202) al ecosistema de crecimiento secundario. La familia con mayor diversidad de especies asociadas al ecosistema de bosque fue Nymphalidae con 135 (67%), seguida por Lycaenidae con 65 y Hesperiidae con 25 especies. Se inventariaron 1 631 especies de mariposas nocturnas pertenecientes a 24 familias, 47 subfamilias y 743 géneros. La mayor diversidad se presentó en 5 familias: Arctidae (288), Noctuidae (498), Geometridae (229), Notodontidae (194) y Sphingidae (101). Resultó particularmente interesante la familia Sphingidae, con una diversidad que representa más del 60% de las especies de esta familia documentadas para Costa Rica. Las cinco familias de mariposas diurnas encontradas aportaron especies o subespecies con algún grado de endemismo. La familia Lycaenidae presentó el mayor número de subespecies endémicas de Costa Rica (10) y endémicas regionales, Costa Rica-Panamá (18); no obstante, la familia Nymphalidae mostró la mayor diversidad de especies endémicas de Costa Rica (3) y endémicas regionales (9). A nivel general se determinaron 13 especies y 36 subespecies endémicas regionales, entre las que se puede mencionar: Mimoides pausanias prasinus (Costa Rica-Panamá), Godyris zavaleta caesiopicta (Costa Rica-Panamá), Opsiphanes zelotes zelotes (Costa RicaColombia), Meseme hypermegala (Costa Rica-Colombia). 113 INTRODUCIÓN Las mariposas son uno de los grupos de insectos mejor conocidos desde el punto de vista taxonómico y biológico, y el tercer orden más numeroso dentro del reino animal. La mayor diversidad de mariposas se presenta en la región neotropical, con el 42% de las especies de las superfamilias Papilionoidea y Hesperioidea (Lamas 2000). En Costa Rica, se han documentado un total de 1 595 especies de mariposas diurnas, distribuidas en 6 familias de las cuales las más diversas son Lycaenidae con 511 especies y Hesperiidae con 486 especies (Lamas 2004, Chacón 2007). No obstante, la familia mejor estudiada en su taxonomía y biología es Nymphalidae, además de ser la mas importante desde del punto de vista turístico y económico. En lo que referente a las mariposas nocturnas, en Costa Rica se han registrado alrededor de 6 000 especies pertenecientes a 27 familias, de las cuales las más diversas son Noctuidae con 2 200 especies y Geometridae con 1500. De las mariposas nocturnas las familias mejor conocidas en su biología son Sphingidae y Saturnidae. Existe una estrecha relación entre las mariposas y las plantas tanto por los hábitos herbívoros de los estados larvales, como por los requerimientos nectarívoros de los adultos (Kremen 1992). Esta adaptación ultraespecífica, se traduce en la gran importancia que ellas tienen en la pirámide ecológica de los ecosistemas terrestres y en el rol de estos insectos como polinizadores de ciertos grupos de plantas (Anderson & Anders 2002). Las mariposas, por mantener este vínculo específico con las plantas y presentar una sensibilidad a los cambios de temperatura, humedad y radiación provocados por la alteración de su hábitat, constituyen excelentes indicadores de la diversidad biológica y herramientas de gran valor en los programas de conservación, monitoreo y educación ambiental (Santos et al. 2012, Sparrow et al. 1994 ). Las alteraciones de los ecosistemas por la acción antropogénica, implican la necesidad de preservar la diversidad biológica, siendo fundamental el estudio de la diversidad de especies de una zona definida, y mas aún en función con el uso de los recursos que les presentan los diferentes ecosistemas (Lazzeri et al. 2010). En la región Caribe de Costa Rica una de las áreas bióticas poco estudiadas, que a la vez coincide con perturbaciones extensas, corresponde a la franja altitudinal que va desde el nivel del 114 mar hasta los 600 m. Esta área es muy diversa en especies de mariposas y exhibe subespecies típicas de Panamá y Colombia, presentando áreas como la zona de Bibri que constituyen auténticos limites biológicos (De Vries 1987, 1997). En el presente estudio se desarrolló y recopiló información para determinar e interpretar la fauna de mariposas diurnas y nocturnas de la región de Baja Talamanca, Costa Rica. MATERIAL Y MÉTODOS Área de estudio El estudio abarcó la región de Baja Talamanca (ver Fig.1, de la sección de introducción de este informe). Dentro de esta región se estudiaron dos zonas altitudinales: la primera comprende las tierras situadas a una altitud entre 0 y 100 msnm con tres localidades: Parque Nacional Cahuita (0 30 msnm), Refugio Nacional de Vida Silvestre Gandoca-Manzanillo (0-30 msnm) y márgenes del río Bananito en la propiedad de Selva Bananito Lodge (30-130 msnm). La segunda corresponde a la localidad de Las Brisas de Veragua, concretamente en la propiedad de Veragua Rainforest Park (200 y 460 msnm). Metodología La información que se presenta sobre la diversidad de mariposas en la zona de estudio, se compiló mediante una revisión de la Colección Entomológica del Museo Nacional de Costa Rica, y la base de datos del Instituto Nacional de Biodiversidad (INBio 2001). Además se realizaron recolectas y observaciones de campo en diferentes visitas a las localidades estudiadas. La información recopilada se integró en una base de datos propiedad del Museo Nacional, donde se especifica la información taxonómica, biogeográfica y biológica de cada ejemplar, imagen u observación obtenida. Se realizaron un total de 13 giras entre noviembre del 2010 y mayo del 2013, distribuidas de la siguiente forma: 5 giras a Veragua Rain Forest Park (30 noviembre -3 diciembre 2010, 21-25 115 febrero de 2011, 5-8 abril de 2011, 4-7 octubre, 24-28 octubre), 3 giras a Bananito (25-29 abril 2011, 30 mayo-2 junio 2011, 28 noviembre-1 diciembre 2011), 2 giras a Parque Nacional Cahuita (22-26 agosto 2011, 21-25-mayo 2012), 3 giras a Gandoca-Manzanillo (16-20 abril 2012, 17-21 julio 2012, 5-9 noviembre de 2012). Las recolectas y observaciones de las mariposas se iniciaron a las 9:30 a.m para concluir entre las 4:00 y 5:00 p.m. Para la recolecta de las especies de mariposas que utilizan las flores como su fuente de alimentación (néctar y polen) se utilizaron redes de mano, y para las especies que se alimentan de frutos en descomposición trampas de altura tipo Van Someren – Rydon (Hughes et al. 1998). Se emplearon 9 trampas de altura con cebo de banano en descomposición y fueron colocadas a diferentes alturas dentro del bosque, procurando abarcar los diferentes estratos (sotobosque, subdosel, dosel). Con las redes de mano se realizaron recolectas principalmente en bordes de bosque, matorrales, claros, bordes de ríos, quebradas, vegetación arbustiva en bordes de playa, y parches de floración en potreros o cultivos abandonados (crecimiento secundario). Adicionalmente algunas especies se registraron por observación directa en los sitios estudiados. RESULTADOS Y DISCUSIÓN Diversidad taxonómica En total se informan 1 631 especies de mariposas diurnas y nocturnas. En el Anexo 5 se presenta una lista con anotaciones de las especies por localidad, colección y grado de endemismo. La lista de mariposas diurnas esta ordenada taxonómicamente según Lamas (2004) y las nocturnas de acuerdo con Chacón & Montero (2007). 116 Mariposas diurnas Se registraron 448 especies de mariposas diurnas pertenecientes a 5 familias, 25 subfamilias y 253 géneros. La mayor diversidad la presentaron las familia Nymphalidae con 224 especies, seguida por Lycaenidae con 111 y Hesperiidae con 101 (Fig. 1). La familia Nymphalidae representa el 47% de las especies de mariposas diurnas registradas. Dentro de esta familia la subfamilia más diversa fue Nymphalinae con 80 especies y 40 géneros. Los géneros más importantes fueron Adelpha con 14 especies, seguido por Memphis con 11. En la familia Lycaenidae la subfamilia Riodininae resultó la más diversa con 71 especies y el género más importante fue Mesosemia con 7 especies. En la familia Hesperiidae la subfamilia Pyrginae presentó la mayor diversidad con 59 especies y él género con mayor número de especies resulto ser Urbanus con 12 especies. La diversidad de especies de mariposas diurnas en la zona de estudio representa aproximadamente un 28% de las especies registradas para Costa Rica (Lamas 2004, Chacón & Montero 2007). Papilionidae Familias Pieridae Géneros Hesperiidae Especies Lycaenidae Nymphalidae 0 50 100 150 200 Número de géneros y especies 250 Figura 1. Diversidad de géneros y especies por familia de mariposas diurnas en la región de Baja Talamanca, Limón, Costa Rica. 117 El 55% de las especies (246) están asociadas al ecosistema de bosque y un 45% (202) al ecosistema de crecimiento secundario. La familia con mayor diversidad de especies asociadas al ecosistema de bosque fue Nymphalidae con 135 (67%), seguida por Lycaenidae con 65 y Hesperiidae con 25 (Fig. 2). Entre las especies asociadas al ecosistema de bosque están las siguientes: Parides childrenae (Papilionidae), Dismorphia amphione (Pieridae), Eumaeus godarti (Lycaenidae), Eryphanis lycomedon (Nymphalidae). En el ecosistema de crecimiento secundario las familias que aportaron el mayor número de especies fueron Nymphalidae con 89 y Hesperiidae con 76; sin embargo, la familia con mayor porcentaje de especies de crecimiento secundario fue Pieridae con el 75% del total recolectado de esta familia. Como especies típicas de crecimiento secundario se pueden mencionar la siguientes: Pyrgus oileus (Hesperiidae), Heraclides thoas (Papilionidae), Rekoa palegon (Lycaenidae) y Danaus plexippus (Nymphalidae). Pieridae Familias Papilionidae Crecimiento Secundario Bosque Lycaenidae Hesperiidae Nymphalidae 0 50 Especies 100 150 Figura 2. Diversidad de mariposas diurnas por ecosistema encontradas en la región de Baja Talamanca, Limón, Costa Rica. 118 Evidentemente la familia mejor representada es Nymphalidae; no obstante, es la tercera en diversidad de especies en Costa Rica después de Lycaenidae y Hesperiidae (Chacón & Montero 2007). El haber obtenido una mayor diversidad de especies en Nymphalidae, se puede atribuir a que aproximadamente el 50% de las especies de esta familia se alimentan de frutos en descomposición por lo que pueden determinarse un mayor número de especies utilizando trampas de altura dentro del bosque. En el este estudio, con la colocación de estas trampas, se registraron 50 especies en su mayoría de las subfamilias Charaxinae y Morphinae. La alta diversidad en Nymphalidae se ve reflejada en los dos géneros de mariposas diurnas más espectaculares del Neotrópico: Morpho y Caligo. Del género Morpho se halló las cinco especies registradas para Costa Rica dentro del bosque lluvioso: M. cypris, M. deidamia, M. helenor, M. menelaus y M. theseus; en el género Caligo también asociado al ecosistema de bosque, las seis especies informadas para este género en Costa Rica están presentes en el área estudiada: Caligo brasiliensis, C. illioneus, C. oedipus, C. oileus, C. telamonius, y C. atreus. Mariposas nocturnas Se registraron 1 631 especies de mariposas nocturnas pertenecientes a 24 familias, 47 subfamilias y 743 géneros. La mayor diversidad se presentó en 5 familias: Arctidae (288), Noctuidae (498), Geometridae (229), Notodontidae (194) y Sphingidae (101); en conjunto representan el 87% de las especies registradas (Fig. 3). Resultó particularmente interesante la familia Sphingidae, con una diversidad que representa más del 60% de las especies de esta familia informadas para Costa Rica (Chacón & Montero 2007). Los géneros más diversos fueron: Euglyphis (Lasiocampidae) con 26 especies, Hemicereas (Notodontidae) con 24, Xylophanes (Sphingidae) con 22, Disphragis (Notodontidae) con 18, Cosmosoma (Arctidae) con 16, y Automeris (Saturnidae) con 14. Es importante mencionar que se obtuvo el 77% de las especies del género Automeris registradas para Costa Rica. 119 En los ecosistemas boscosos las mariposas nocturnas son más numerosas e importantes que las diurnas como polinizadoras; así, se distingue la familia Sphingidae por su nivel de especialización en la función polinizadora y por la cantidad de especies vegetales de las cuales es vector; Posoqueria latifolia (Rubiaceae), conocida como fruta de mono, es polinizada por este grupo de mariposas, así como otras especies de esta familia con flores largas y tubulares. Las guabas (Inga ruiziana, I. marginata, Fabaceae), el gavilán (Pentaclethra macroloba, Fabaceae) y el guácimo colorado (Luehea seemannii, Malvaceae), entre otras (Haber & Frankie 1980, Finegan 1993). Sphingidae Crambidae Familias Notodontidae Géneros Especies Geometridae Arctidae Noctuidae 0 100 200 300 400 Número de géneros y especies 500 600 Figura 3. Diversidad de familias de mariposas nocturnas en la región de Baja Talamanca, Limón, Costa Rica. 120 Endemismo Las cinco familias de mariposas diurnas encontradas aportaron especies o subespecies con algún grado de endemismo. La familia Lycaenidae presentó el mayor número de subespecies endémicas de Costa Rica (10) y endémicas regionales, Costa Rica-Panamá (18); no obstante, la familia Nymphalidae mostró la mayor diversidad de especies endémicas de Costa Rica (3) y endémicas regionales (9). A nivel general se determinaron 13 especies y 36 subespecies endémicas regionales, entre las que se puede mencionar: Mimoides pausanias prasinus (Costa Rica-Panamá), Godyris zavaleta caesiopicta (Costa Rica-Panamá), Opsiphanes zelotes zelotes (Costa Rica-Colombia), Meseme hypermegala (Costa Rica-Colombia). Estos taxones endémicos regionales son compartidos con Panamá y en algunos casos con Suramérica. Según DeVries (1987, 1997) esta particularidad se atribuye a que en esta región, alrededor de Bibrí, parece existir un genuino limite biológico respecto a la fauna de mariposas de Panamá y Suramérica. Además en esta región están presentes la especie y subespecie endémicas de Costa Rica, Magneuptychia agnata y Napeogenes peridia hemisticta. Todas las especies y subespecies con algún grado de endemismo están asociadas a ecosistemas de bosque poco alterado. Especies notables Mimoides pausanias prasinus (Papilionidae). Esta especie es endémica regional (Costa Rica – Panamá) y está restringida a la vertiente Caribe entre los 100 y 500 msnm. En Costa Rica es rara en colecciones y siempre está asociada a ecosistemas de bosque (DeVries 1987). Recientemente fue descrito su ciclo biológico en Annona amazonica (Murillo 2013). Asphita leander (Hesperiidae). Se distribuye entre México y Colombia, sin embargo es la primera vez que se recolecta en Costa Rica, lo cual representa un nuevo género y una nueva especie para elo 121 país. Este ejemplar fue recolectado mientras se alimentaba del néctar de flores de asteráceas que crecen en el borde del bosque. Pyrrhopygopsis agaricon (Hesperiidae). Este género hasta el momento aparecía con una distribución entre Colombia y Brasil. La aparición en esta zona del país significa una ampliación de ámbito de distribución y un nuevo género y una nueva especie de mariposa para Costa Rica. Este ejemplar se recolectó en flores de acantáceas y asteráceas en los márgenes del río Victoria. Nymphidium manthus (Riodinidae). Esta especie se distribuye de Costa Rica a Venezuela y Brasil; sin embargo, el único registro que se tenía de esta especie para Costa Rica obedece a un único ejemplar del Museo Británico de Historia Natural sin datos precisos de localidad (DeVries 1997). Catoblepia orgetorix championi (Nymphalidae). Esta especie es endémica regional (Nicaragua Panamá) y está restringida a la vertiente atlántica. Vettius chagres (Hesperiidae). Este es el único ejemplar en colecciones de esta especie para Costa Rica. Mariposas de las planicies zona de 0-100 msnm Mariposas diurnas Se registraron 303 especies de mariposas diurnas pertenecientes a cinco familias, 18 subfamilias y 168 géneros. La mayor diversidad la presentaron las familia Nymphalidae con 146 especies, seguida por Hesperiidae con 65 y Lycaenidae con 60. Nymphalidae representa el 48% de las especies de mariposas registradas. Dentro de esta familia la subfamilia más diversa fue Biblidinae con 26 especies y 14 géneros. Los géneros más importantes fueron Heliconius con nueve especies, seguido por Adelpha con siete. En la familia Hesperiidae la subfamilia Pyrginae resultó la más 122 diversa con 45 especies y el género más importante fue Urbanus con siete especies. En la familia Lycaenidae el 70% de las especies (35) pertenecen a la subfamilia Riodininae y la mayoría de géneros presentan menos de tres especies. El 49% de las especies (148) están asociadas al ecosistema de bosque y un 51% (155) a ecosistemas de crecimiento secundario como: vegetación arbustiva en bordes de playa, matorrales en áreas de cultivo abandonadas, potreros arbolados y bordes de quebradas y ríos. La familia con mayor diversidad de especies asociadas al ecosistema de bosque fue Nymphalidae con 135 (67%), seguida por Lycaenidae con 46 y Hesperiidae con 25. Entre las especies asociadas al ecosistema de bosque están las siguientes: Parides sesostris (Papilionidae), Dismorphia amphione (Pieridae), Eumaeus godarti (Lycaenidae) y Eryphanis lycomedon (Nymphalidae). En ambientes de crecimiento secundario las familias que aportaron el mayor número de especies fueron Nymphalidae con 89 y Hesperiidae con 76; sin embargo, la familia con mayor porcentaje de especies fue Pieridae con el 75% del total recolectado de esta familia (Fig. 5). DeVries (1994) sostiene que el aumento en la diversidad de especies de la familia Pieridae y principalmente de la subfamilia Colidianidae, es un reflejo de la perturbación humana, que crea hábitats para las plantas hospederas como las leguminosas herbáceas, las crucíferas y otras familias como asteráceas y verbenáceas cuyas flores son fuentes de néctar para los adultos de esta familia. Como especies típicas de este ecosistema se pueden mencionar a Pyrgus oileus (Hesperiidae), Heraclides thoas (Papilionidae), Rekoa palegon (Lycaenidae) y Phoebis philea (Pieridae), todas características de áreas de crecimiento secundario. La diversidad de especies de mariposas diurnas registrada en esta zona representa aproximadamente un 26% de las especies reportada para Costa Rica (Lamas 2004, Chacón & Montero 2007). Este porcentaje es significativo considerando que la zona muestreada es prácticamente la vegetación que crece en borde de playa, y que a pesar de estar alterada, conserva recursos como plantas hospederas, productoras de néctar y frutos dulces necesarios para mantener las poblaciones de las diferentes especies de mariposas que allí viven. 123 Es importante destacar que los bosques conocidos como cativales son ecosistemas de bosque poco alterado que presenta diversos hábitats para mariposas. En los claros donde entra la luz de forma directa alrededor del medio día, se observaron hierbas creciendo sobre el sendero cuyas flores pequeñas y de color blanco fueron visitadas por especies propias de este ecosistema como Entheus matho, Mictris crispus, Celanenorrhinus monartus, Nymphidium haematostictu y Aeria eurimedia agna; estas dos últimas endémicas entre Costa Rica y Panamá. En el suelo del sotobosque donde son típicos los satíridos se encontraron las especies Pierella helvina y P. luna volando encima del mantillo o posadas sobre hongos en descomposición, además de una hembra de P. helvina ovopositando en las base de las hojas de una platanilla. En la mayor parte del catival donde entra la luz de forma difusa se observaron volando diferentes helicónidos como Heliconius hecale formosus, Philaethria diatonica, y H. cydno galanthus posada sobre flores de Psychotria berteriana. Sobre la vegetación arbustiva en el borde de las quebradas que delimitan o atraviesan el catival se encontraron volando hembras y machos de Parides childrenae, Battus belus, Biblis hyperia y dos machos de Eurybia patrona persona visitando las flores de platanillas. En los bordes de este bosque y en áreas de matorrales se encontraron especies propias de crecimiento secundario como Heliconius erato, Chlosyne janais, Urbanus viteroboana, Theope publius, Panthiades bathildis, Xenophaens tryxus visitando flores de Stachytarpheta sp. y de otros arbustos o hierbas. Mariposas nocturnas Se registraron 1 204 especies de mariposas nocturnas pertenecientes a 21 familias, 11 subfamilias y 675 géneros. La mayor diversidad de especies se presentó en cinco familias: Noctuidae (430), Arctidae (252), Geometridae (198), Notodontidae (186) y Sphingidae (86). Es importante mencionar que esta zona está aportando al inventario total de Baja Talamanca el 59% de las especies registradas para Costa Rica de la familia Sphingidae. Los géneros más diversos fueron: Xylophanes (Sphingidae) con 18 especies, Pero (Geometridae) con 16, Automeris (Saturniidae) con 12 y Nemoria (Geometridae) con 12. 124 Mariposas de Veragua Mariposas diurnas Se registraron 272 especies de mariposas diurnas pertenecientes a cinco familias, 17 subfamilias y 92 géneros. La mayor diversidad la presentaron las familias Nymphalidae con 140 especies, seguida por Lycaenidae con 58 y Hesperiidae con 57. Nymphalidae representa el 51% de las especies de mariposas diurnas registradas. Dentro de esta familia la subfamilia más diversa fue Charaxinae con 23 especies y ocho géneros. Los géneros más importantes fueron Memphis con 10 especies, seguido por Adelpha con ocho. En la familia Lycaenidae la subfamilia Riodininae resultó la más diversa con 30 especies y el género Mesosemia aportó el mayor número de especies (5). En la familia Hesperiidae la subfamilia Pyrginae presentó la mayor diversidad con 39 especies y él género Urbanus presentó la mejor representación con seis especies. El 61% de las especies (168) están asociadas al ecosistema de bosque y un 38% al ecosistema de crecimiento secundario. La familia con mayor diversidad de especies asociadas al ecosistema de bosque fue Nymphalidae con 100 especies (59%), seguida por Lycaenidae con 32 y Hesperiidae con 30. Es importante resaltar la alta diversidad de charaxinos encontrada en esta localidad, la cual representa el 45% de las especies de esta subfamilia registradas para Costa Rica (Lamas 2004, De Vries 1987). Entre las especies de esta subfamilia se pueden mencionar: Memphis anna elina, Agrias aedon, A. amydon y Zaretis isidora, muy raras en colecciones. En los ambientes de crecimiento secundario las familias que aportaron el mayor número de especies fueron Nymphalidae con 40 especies y Hesperiidae con siete. La familia Pieridae exhibió el mayor porcentaje de especies de crecimiento secundario con el 90% del total recolectado de esta familia. Como especies típicas de este ecosistema se pueden mencionar Phoebis philea (Pieridae), Dryas iulia (Nymphalidae), Urbanus simplicius y Arawacus togarna (Lycaenidae). 125 Mariposas nocturnas Se registraron 640 especies de mariposas nocturnas pertenecientes a 18 familias, 38 subfamilias y 284 géneros. La mayor diversidad de especies de mariposas nocturnas se presentó en cinco familias: Noctuidae (193), Arctidae (141), Geometridae (102), Notodontidae (89) y Sphingidae (41); en conjunto representan el 82% de las especies registradas. Los géneros más diversos fueron: Xylophanes (Sphingidae) con 15 especies, Euglyphis (Lasiocampidae) con 12 especies, y Gonodonta (Noctuidae) con 11. Xylophanes obtuvo el 51% de las 31 especies registradas para Costa Rica en este género (Janzen 2005). CONCLUSIONES Y RECOMENDACIONES La fauna de mariposas presente en la región de Baja Talamanca comparte una considerable cantidad de especies y subespecies con Panamá y Suramérica. Se presenta un importante endemismo regional y local en las cinco familias de mariposas diurnas presentes en Costa Rica. Precisamente esta condición evidenciada en relativamente pocas visitas a las localidades de estudio y en condiciones climáticas extremas, pone de manifiesto el gran potencial biológico que posee esta región. La conservación de las poblaciones de mariposas registradas en este estudio, principalmente de las especies dependientes de ecosistemas de bosque, depende de la continuidad de las áreas boscosas. Esto por cuanto estas áreas son utilizadas por los machos durante la búsqueda de las hembras, y por las hembras en la búsqueda de las plantas hospederas. Además las áreas de bosque garantizan la disponibilidad de frutos en descomposición y néctar como fuente de alimento para los adultos. Esta condición también es fundamental para otros organismos como aves y mamíferos. Por tanto, se pone de manifiesto la importancia de recomendar a los sectores administrativos de áreas silvestres tanto privadas como estatales, la reforestación con especies nativas relacionadas con estos grupos zoológicos. 126 Los altos valores de diversidad en las familias Lycaenidae y Riodinidae puede atribuirse que en Baja Talamanca se mantienen ambientes con niveles intermedios de perturbación, lo que genera una heterogeneidad ambiental. Estas condiciones permiten el establecimiento de un gran número de especies al encontrar diferentes sitios o hábitat para percha, alimentación y reproducción, principalmente de especies que se alimentan de néctar y polen, como son la totalidad de estas dos familias. La zona de Baja Talamanca es una región con alto potencial turístico, de modo que es posible integrar a través de la educación y capacitación de los pobladores, el conocimiento sobre mariposas comunes y raras. Las granjas de mariposas han demostrado que estos insectos pueden convivir en armonía con las poblaciones humanas, si se dan las condiciones adecuadas, como puede ser la promoción de una producción sostenible, la protección de los bosques existentes y un enriquecimiento de la vegetación que permita el aumento y mantenimiento de la diversidad. A partir información base desarrollada con este estudio, se puede comenzar a realizar investigación sobre las comunidades de mariposas diurnas y nocturnas en las distintas zonas de bosque, y seleccionar especies con potencial a nivel de jardines de mariposas, para generar información sobre su biología, ecología y comportamiento. Con esta información se capacita a productores que mantienen grupos de especies tradicionales que no les permiten competir en el mercado, y que les impide obtener una mayor aceptación del producto ante las empresas exportadoras de crisálidas. Es necesario concientizar a los productores de mariposas de exportación sobre las ventajas de la diversificación de especies. En esta región se encontraron las cinco especies del género Morpho , asociadas a ecosistemas de bosques húmedos y muy húmedos en Costa Rica. Las cinco especies son de gran valor estético y comercial, no obstante, en Costa Rica solo se cultiva una de ellas, la especie Morpho helenor, dejando de lado las restantes que son de mayor atractivo turístico y valor comercial. Aunado a lo anterior lo más interesante, es que en los bosques de las diferentes 127 localidades estudiadas se encontraron las especies de plantas hospederas de cada una de estas especies. LITERATURA CITADA Anderson, S. & L. A. Anders. 2002. Floral scents in butterfly-pollinated plants: possible convergence in chemical composition. Botanical Journal of the Liennean Society. 140: 129153. Chacón, I. & J. Montero. 2007. Mariposas de Costa Rica. Instituto Nacional de Biodiversidad (INBio). Heredia, Costa Rica. 366 pp. D´Abrera, B. 1994. Butterflies of the Neotropical Region. Part VII. Lycaenidae. Hill House. Victoria, Australia. 1270 pp. DeVries, P.J. 1987. The Butterflies of Costa Rica and their Natural History: Papilionidae, Pieridae, Nymphalidae. Vol 1. New Jersey, Princeton University Press. 327 pp. DeVries, P.J. 1997. The Butterflies of Costa Rica and their Natural History: Riodinidae. Vol. 2. New Jersey, Princeton University Press. 288 pp. Finegan, B. 1993. Curso Intensivo Internacional de Silvicultura y Manejo de Bosques Naturales Tropicales. Tema: bases ecológicas para la silvicultura. Turrialba, Costa Rica, Catie. 225 pp. Haber, W.A. & G.W. Frankie. 1989. A Tropical Haw moth – Community: Costa Rican Dry Forest. Sphingidae. Biotropica. 21: 155 – 172. Hughes, J. B., C. D. Gretchen & P.R. Ehrlich. 1998. Use of fruit bait traps for monitoring of butterflies (Lepidoptera: Nymphalidae). Revista de Biología Tropical 46: 220 – 225. Instituto Nacional de Biodiversidad. 2001. ATTA [en línea]. <http: atta.inbio.ac.cr > [Febrero 2014]. Janzen, D.H. & W. Hallwachs. 2005. Caterpillars, pupae, butterflies & moths of the ACG [en línea]. <http//Janzen.sas.upenn.edu/caterpillars/database.lasso>[Enero 2013]. Kremen, C. 1992.Assessing the indicator properties of species assemblages for natural areas monitoring. Ecological Applications, 2:203-217. 128 Lamas, G. 2000. Estado actual del conocimiento de la sistemática de los lepidópteros, con especial referencia a la Región Neotropical. In: M.F. Piera, J.J. Morrone & A. Meliá (eds.). Hacia un Proyecto CYTED para el Inventario y Estimación de la Diversidad Entomológica en Iberoamérica: PriBES 2000 (Monografía Tercer Milenio). Sociedad Entomológica Aragonesa, Zaragoza, España. Pp. 253-260. Lamas, G. 2004. Checklist: Part 4A. Hesperioidea-Papilionionoidea. In: J.B. Heppner (ed). Atlas of Neotropical Lepidoptera. Vol. 5. Gainsville, Fl., Scientific Publishers, 439 pp. Lazzeri, M.G. & M.E. Bar. 2010. Diversidad del orden Lepidoptera (Hesperioidea y Papilionoidea) de la Ciudad Corrientes, Argentina. Revista de Biología Tropical 59: 299-308. Murillo, L.R. 2013. Early Stages and Natural History of Mimoides Pausanias prasinus and M. euryleon clusocolis (Lepidoptera, Papilionidae) from Costa Rica. Annual Review & Resarch in Biology, 3 (1): 22 – 30. Narváez, Z. & P. Soriano. 1996. Composición y Estructura de la Comunidad de Sphingidae (Insecta: Lepidoptera) de una Selva Nublada Andina. ECOTROPICOS. 9 (1):9-20. Santos, A., R.A. Muñoz, M. A. Osorios & M. Osorios M. 2012. Mariposas Papilionoidea y Hesperioidea (Insecta: Lepidoptera) de la Isla Majé, Comarca Guna Madungandí, Panamá. Tecnociencia 14: 39- 46. Sparrow, H.R., T.D. Sisk, P.R. Ehrlich & D.D. Myrphy. 1994. Techniques and guidelines for monitoring Neotropical Butterflies. Conservat. Biol. 8: 800-809. ANEXOS 129 Anexo 1. Listado de Plantas Vasculares de la región de Baja Talamanca y los cerros Chimú y Muchilla, Limón, Costa Rica Armando Estrada Herbario Nacional (CR) Departamento de Historia Natural Museo Nacional de Costa Rica (23 de julio de 2014) Abreviaciones y códigos de iniciales empleados Códigos de Procedencia Int. Natu. Nat. End. Excl. No nativa del país, introducida y cultivada en la zona No nativa del país, pero creciendo naturalmente (naturalizada) Nativa del país Endémica de CR En en país restringida (exclusiva) al Caribe Sur (Nativa o Endémica) * Se refiere a especies que no se registraron para la región de Baja Talamanca, solo se registraron en las estribaciones de Fila Matama. Códigos de Forma de Crecimiento Herb. Herb. ep. Arbu. Arbu. ep. Arb. Bej. Herbácea terrestre Herbácea epífita Arbustiva Arbustiva epífita Arborescente Bejucos y enredaderas Códigos de Herbarios CR: Herbario Nacional de Costa Rica (CR) INB: Herbario del Instituto Nacional de Biodiversidad JBL s/n (Obs.): tomado de Página Epidendra. Parque Nacional Cahuita [online]. <http://www.epidendra.org/parquesnacionales/cahuita/index.htm>. [julio 2014] Obs. Especies observadas (sin ejemplar de herbario) 130 Nombre y abreviaciones de recolectores botánicos mencionados en la lista AC AE AF AHG AJ AJI AKM AL AM AMC AMO AQ AR ARB ARG AS ASO AT BH CAT CKH CS CSA DMA DMP DS DSn EA EL EMC ER EWL FA FL FQ GC GCR GD GES GG GH GR GSH HK HP JAE JB JBE JBL JEJ JFM JG JGL JJC Cascante, Alfredo Estrada Chavarría, Armando Fernández, Álvaro Gentry, Alwyn H. Jiménez, Allan Jiménez, Alfonso Monro, A. K. Lot, Antonio Moreno, Alberth Chacón, Abelardo M. Mora, Angela Quesada, Alonso Rojas, Alexander Francisco Ruiz - Boyer, Armando Rodríguez González, Alexánder Soto, Armando Solís, Angel Tonduz, Adolphe Hammel, Barry E. Todzia, Carol A. Horich, Clarence Kl. Schnell, Charles Sánchez, César Martínez, Daniel Porter, Duncan M. Solano, Daniel Santamaría, Daniel Alfaro, Evelio Lépiz, Eduardo Mora Castro, Edgar Rojas, Elías Lathrop, Earl W. Almeda, Frank Ling, Francisco Quesada, Freddy Carballo, Gerardo Crow, Garrett Davidse, Gerrit Schatz, George E. Gallardo, Gerardina Herrera, Gerardo Rivera, Gerardo Hartshorn, Gary S. Kennedy, Helen Pittier, Henry Echeverría, José Antonio Bittner, Jens Berrocal, José Jardin Botanico Lankester Jiménez Vargas, José Esteban Morales, Juan Francisco González Ramírez, Jose Angel Gomez-Laurito, Jorge Córdoba, José J. JL JLG JRG JS JU JWK K KB KSW LA LDG LDV LG LP LRH MBA MBG MCR MG MJB MMC MQ NG NZ OV PJM PKG PS PW PZ QJ RA RB RC RCH RH RK RLW RM RMA RO RP RS RWL SG SL TBC TDP TFD UC WA WB WH León, Jorge Gentry, Johnnie L. Grant, Jason R. Sánchez González, Joaquín Utley, John F. Kress, W. John Khan Barringer, Kerry A. Walter, K. S. Acosta, Luis Gómez Pignataro, Luis Diego Vargas, Luis Diego González, Luis Poveda Álvarez, Luis Jorge Holdridge, Leslie R. Barrelier, Marlon Gargiullo, Margaret B. Roviralta, María del Carmen Grayum, Michael Howard Bumby, M. J. Chavarría, María Marta Quirós, Manuel Garwood, Nancy Zamora V., Nelson Valverde, Oscar Maas, Paul J. M. Godfrey, R. K. Sánchez Vindas, Pablo E. Wilkin, Paul Zika, Peter F. Jiménez, Quírico Aguilar, Reinaldo Baker, Richard A. Callejas, Ricardo Chacón, Rafael Hernández, Ricardo Kriebel, Ricardo Wilbur, Robert L. Moran, Robbin C. Alfaro, Rita M. Ocampo, Rafael A. Pohl, Richard W. Soto, Ricardo Lent, Roy W. Ginzbarg, Steven Lobo, Silvia Croat, Thomas B. Pennington, Terence D. Daniel, T. F. Chavarría, Ulises Alverson, William S. Burger, William Carl Hammitt, William E. 131 Pteridophyta LYCOPHYTA Lycopodiaceae Huperzia dichotoma (Jacq.) Trevis. GH 2375 (CR-INB) Nat. Herb. ep. Huperzia linifolia (L.) Trevis. HP 9206 (CR) Nat. Herb. ep. Lycopodiella cernua (L.) Pic. Serm. HP 12406 (CR) Nat. Herb. Phlegmariurus dichaeoides (Maxon) B. Øllg. MG 9644 (CR-INB) Nat. Herb. Phlegmariurus polycarpos (Kunze) B. Øllg. MG 9652 (CR-INB) Nat. Herb. Selaginellaceae Selaginella anceps (C. Presl) C. Presl AT 9491 (CR) Nat. Herb. Selaginella arthritica Alston RM 3097 (CR) Nat. Herb. Selaginella atirrensis Hieron. EMC 178 (CR-INB) Nat. Herb. Selaginella bombycina Spring LDG 23431 (CR) Nat. Herb. Selaginella erythropus (Mart.) Spring AR 4537 (CR-INB) Nat. Herb. Selaginella eurynota A. Braun RO 1735 (CR) Nat. Herb. Selaginella oaxacana Spring LA 1932 (CR-INB) Nat. Herb. Selaginella plana (Desv. ex Poir.) Hieron. MQ 461 (CR) Intr. Herb. Selaginella porelloides (Lam.) Spring GG 359 (CR-INB) Nat. Herb. Selaginella sertata Spring GG 343 (INB) Nat. Herb. Selaginella umbrosa Lem. ex Hieron. GG 355 (CR-INB) Nat. Herb. PTEROPHYTA Aspleniaceae Asplenium auriculatum Sw. GG 373 (INB) Nat. Herb. ep. Asplenium auritum Sw. JG 1617 (INB) Nat. Herb. ep. Asplenium cirrhatum Rich. ex Willd. RO 1983 (CR) Nat. Herb. ep. Asplenium formosum Willd. AT 9456 (CR) Nat. Herb. Asplenium holophlebium Baker * RR 2713 (CR) Nat. Herb. ep. Asplenium laetum Sw. GH 7715 (CR) Nat. Herb. Asplenium macilentum Kunze ex Klotzsch GG 327 (CR-INB) Nat. Herb. ep. Asplenium pteropus Kaulf. JG 1877 (CR-INB) Nat. Herb. ep. Asplenium rigidum Sw. AT 9475 (CR) Nat. Herb. ep. Asplenium riparium Liebm. AT 9473 (CR) Nat. Herb. Asplenium serra Langsd. et Fisch. AT 9459 (CR) Nat. Herb. ep. Asplenium serratum L. AT 9450 (CR) Nat. Herb. ep. Hemidictyum marginatum (L.) C. Presl ARG 3530 (CR-INB) Nat. Herb. Blechnaceae Blechnum occidentale L. AT 9482 (CR) Nat. Herb. Blechnum schiedeanum (Schltdl. ex C. Presl) Hieron. * GH 2716 (CR) Blechnum serrulatum Rich. GH 7704 (CR) Nat. Herb. Salpichlaena volubilis (Kaulf.) J. Sm. AT 9468 (CR) Nat. Bej. Nat. Herb. 132 Cyatheaceae Alsophila cuspidata (Kunze) D. S. Conant AE 4878 (CR) Nat. arb. Cyathea bicrenata Liebm. AE 4796 (CR) Nat. arb. Cyathea chiricana var. contigua (Underw. ex Maxon) Lehnert FQ 14 (INB) Cyathea microdonta (Desv.) Domin ARG 1903 (INB) Nat. arb. Cyathea multiflora Sm. LDG 407(CR) Nat. arb. Cyathea poeppigii (Hook.) Domin AT 9202 (CR) Nat. arb. Cyathea povedae A. Rojas * RR 2726 (CR) Nat. Arb. Cyathea squarrosa (Rosenst.) Domin GG 71 (INB) End. arb. Cyathea ursina (Maxon) Lellinger AE 5694 (CR) Nat. Herb. Nat. arb. Davalliaceae Nephrolepis biserrata (Sw.) Schott AE 5078 (CR) Nat. Herb. ep. Nephrolepis brownii (Desv.) Hovenkamp & Miyam. SL 3071 (CR) Nat. Herb. Nephrolepis multiflora (Roxb.) Jarrett ex C. V. Morton GC 276 (INB) Nat. Herb. ep. Nephrolepis pendula (Raddi) J. Sm. GG 348 (INB) Nat. Herb. ep. Nephrolepis rivularis (Vahl) Mett. ex Krug AT 9455 (CR) Nat. Herb. ep. Dennstaedtiaceae Dennstaedtia bipinnata (Cav.) Maxon ARG 1910 (CR-INB) Nat. Herb. Dennstaedtia cicutaria (Sw.) T. Moore AT 8644 (CR) Nat. Herb. Dennstaedtia dissecta (Sw.) T. Moore AT 9452 (CR) Nat. Herb. Dennstaedtia globulifera (Poir.) Hieron. * GH 2598 (INB) Nat. Herb. Dennstaedtia wercklei (H. Christ) R. M. Tryon * GH 2641 (CR-INB) Nat. Herb. Hypolepis hostilis (Kunze) C. Presl ARG 648 (INB) Nat. Herb. Saccoloma inaequale (Kunze) Mett. RO 1670 (CR) Nat. Herb. Dryopteridaceae Bolbitis lindigii (Mett.) Ching GH 2345 (CR-INB) Nat. Herb. Bolbitis nicotianifolia (Sw.) Alston GH 7708 (CR) Nat. Herb. Bolbitis oligarchica (Baker) Hennipman * RR 2754 (CR) Nat. Herb. Bolbitis portoricensis (Spreng.) Hennipman AT 9477 (CR) Nat. Herb. Didymochlaena truncatula (Sw.) J. Sm. GC 470 (INB) Nat. Herb. Elaphoglossum backhouseanum T. Moore AT 9449 (CR) Nat. Herb. ep. Elaphoglossum herminieri (Bory ex Fée) T. Moore GH 3011 (CR-INB) Nat. Herb. ep. Elaphoglossum lalitae L. D. Goméz JBE 43 (CR) Nat. Herb. ep. Elaphoglossum latum (Mickel) Atehortua ex Mickel GG 349 (CR-INB) Nat. Herb. ep. Elaphoglossum nigrescens (Hook.) T. Moore ex Diels AR 4545 (CR-INB) Nat. Herb. ep. Elaphoglossum nigrosquama A. Rojas * GH 2621 (CR) End. Herb. ep. Elaphoglossum oblanceolatum C. Chr. * GH 2633 (CR-INB) Nat. Herb. ep. Elaphoglossum palmense H. Christ * AE 5506 (CR) Nat. Herb. ep. Elaphoglossum variabile A. Rojas GH 3014 (CR-INB) Nat. Herb. ep. 133 Lastreopsis exculta (Mett.) Tindale ARG 3510 (CR-INB) Nat. Herb. Megalastrum lunense (Christ) A. R. Sm. & R. C. Moran RM 3117 (CR) Nat. Herb. Megalastrum squamosum A. Rojas ARG 688 (CR-INB) Nat. Excl. Herb. Megalastrum subincisum (Willd.) A. R. Sm. et R. C. Moran AT 9478 (CR) Nat. Herb. Olfersia cervina (L.) Kunze RO 1996 (CR) Nat. Herb. Polybotrya caudata Kunze AR 847 (CR) Nat. Herb. ep. Polybotrya osmundacea Humb. et Bonpl. ex Willd. GG 357 (INB) Nat. Herb. ep. Polybotrya polybotryoides (Baker) H. Christ GG 345 (CR-INB) Nat. Herb. ep. Stigmatopteris lechleri (Mett.) C. Chr. AT 9480 (CR) Nat. Herb. Stigmatopteris sordida (Maxon) C. Chr. RM 3315 (CR) Nat. Herb. Gleicheniaceae Dicranopteris pectinata (Willd.) Underw. GG 360 (CR-INB) Nat. Bej. Hymenophyllaceae Hymenophyllum horizontale C. V. Morton * DSn 6464 (INB) Nat. Herb. ep. Trichomanes crispum L. BH 24856 (CR-INB) Nat. Herb. ep. Trichomanes diversifrons (Bory) Mett. ex Sadeb. RM 3100 (CR) Nat. Herb. Trichomanes elegans Rich. LDG 23423 (CR) Nat. Herb. Trichomanes galeottii E. Fourn. GH 7684 (CR) Nat. Herb. ep. Trichomanes hymenophylloides Bosch LDG 23500 (CR) Nat. Herb. ep. Trichomanes membranaceum L. JBE 46 (CR) Nat. Herb. ep. Trichomanes punctatum Poir. ARG 650 (INB) Nat. Herb. ep. Trichomanes rigidum Sw. * GH 2508 (CR) Nat. Herb. Vandenboschia collariata (Bosch) Ebihara & K. Iwats. EMC 156 (CR-INB) Nat. Herb. ep. Lindsaeaceae Lindsaea divaricata Klotzsch GH 7597 (CR) Nat. Herb. Lindsaea lancea (L.) Bedd. GH 7686 (CR) Nat. Herb. Lindsaea stricta (Sw.) Dryand. GH 7688 (CR) Nat. Herb. Lonchitis hirsuta L. GH 7717 (CR) Nat. Herb. Lomariopsidaceae Cyclopeltis semicordata (Sw.) J. Sm. AT 8522 (CR) Nat. Herb. Lomariopsis fendleri D. C. Eaton JB 2236 (CR) Nat. Herb. Lomariopsis japurensis (Mart.) J. Sm. GH 7580 (CR) Nat. Herb. Lomariopsis vestita E. Fourn. HP 9203 (CR) Nat. Herb. Lygodiaceae Lygodium heterodoxum Kunze JB 2234 (CR) Nat. Bej. Lygodium venustum Sw. MQ 481 (CR) Nat. Bej. 134 Marattiaceae Angiopteris evecta (G. Forst.) Hoffm. AE 5481 (CR) Intr. Herb. Danaea carillensis H. Christ * GH 2514 (CR) End. Herb. Danaea moritziana C. Presl RCH 943 (CR) Nat. Herb. Danaea nodosa (L.) Sm. MG 8008 (CR-INB) Nat. Herb. Danaea wendlandii Rchb. f. ARG 653 (INB) Nat. Herb. Marattia interposita H. Christ * GH 2586 (CR-INB) Nat. Herb. Metaxyaceae Metaxya rostrata (Kunth) C. Presl BH 17511 (CR-INB) Nat. Herb. Ophioglossaceae Ophioglossum reticulatum L. MG 8028 (CR-INB) Nat. Herb. Osmundaceae Osmundastrum cinnamomeum (L.) C. Presl BH 24858 (CR-INB) Nat. Herb. Polypodiaceae Campyloneurum aphanophlebium (Kunze) T. Moore JBE 45 (CR) Nat. Herb. ep. Campyloneurum costatum (Kunze) C. Presl GG 331 (CR-INB) Nat. Herb. ep. Campyloneurum latum T. Moore AT 9441 (CR) Nat. Herb. ep. Cochlidium serrulatum (Sw.) L. E. Bishop GH 7700 (CR) Nat. Herb. ep. Dicranoglossum panamense (C. Chr.) L. D. Goméz RO 1556 (CR) Nat. Herb. ep. Enterosora trifurcata (L.) L. E. Bishop LDG 23438 (CR) Nat. Herb. ep. Microgramma lycopodioides (L.) Copel. RM 3106 (CR) Nat. Herb. Microgramma nitida (J. Sm.) A. R. Sm. LDG 7100 (CR) Nat. Herb. ep. Microgramma percussa (Cav.) de la Sota MG 8040 (CR-INB) Nat. Herb. Microgramma reptans (Cav.) A. R. Sm. MQ 462 (CR) Nat. Herb. ep. Niphidium crassifolium (L.) Lellinger RS 849 (CR) Nat. Herb. ep. Niphidium oblanceolatum A. Rojas HP 12702 (CR) Nat. Herb. ep. Pecluma pectinata (L.) M. G. Price JG 1718 (INB) Nat. Herb. ep. Phlebodium pseudoaureum (Cav.) Lellinger AT 9460 (CR) Nat. Herb. ep. Polypodium dissimile L. RB 38 (CR) Nat. Herb. ep. Polypodium dulce Poir. * RR 2755 (CR) Nat. Herb. Polypodium fraternum Schltdl. et Cham. LDG 897 (CR) Nat. Herb. ep. Polypodium fraxinifolium Jacq. * RR 2718 (CR) Nat. Herb. ep. Polypodium furfuraceum Schltdl. et Cham. AT 9474 (CR) Nat. Herb. ep. Polypodium plectolepidioides Rosenst. AR 4563 (CR-INB) End. Herb. ep. Polypodium polypodioides (L.) Watt JB 2210 (CR) Nat. Herb. ep. Polypodium tico A. Rojas * GH 2695 (CR) End. Herb. ep. Serpocaulon caceresii (Sodiro) A.R. Sm. AT 9451 (CR) Nat. Herb. ep. Serpocaulon dissimile (L.) A.R. Sm. AR 4540 (CR-INB) Nat. Herb. ep. 135 Serpocaulon loriciforme (Rosenst.) A.R. Sm. RO 1563 (CR) Nat. Herb. ep. Serpocaulon maritimum (Hieron.) A.R. Sm. LDG 398 (CR) Nat. Herb. ep. Terpsichore atroviridis (Copel.) A. R. Sm. * GH 2540 (CR) Nat. Herb. ep. Terpsichore lehmanniana (Hieron.) A. R. Sm. MG 9651 (CR-INB) Nat. Herb. ep. Psilotaceae Psilotum nudum (L.) P. Beauv. MG 10030 (CR-INB) Nat. Herb. ep. Pteridaceae Acrostichum aureum L. OV 1287 (CR) Nat. Herb. Acrostichum danaeifolium Langsd. et Fisch. MBG 712 (CR) Nat. Herb. Adiantum × variopinnatum Jermy et T. G. Walker GH 7562 (CR) Nat. Herb. Adiantum fructuosum Poepp. ex Spreng. AR 4532 (CR-INB) Nat. Herb. Adiantum isthmicum B. Zimmer JG 1844 (INB) Nat. Herb. Adiantum latifolium Lam. RO 1669 (CR) Nat. Herb. Adiantum macrophyllum Sw. AT 9458 (CR) Nat. Herb. Adiantum obliquum Willd. RO 1982 (CR) Nat. Herb. Adiantum petiolatum Desv. AT 9485 (CR) Nat. Herb. Adiantum reptans A. Rojas AQ 3267 (CR) Nat. Herb. Adiantum seemannii Hook. AT 8580 (CR) Nat. Herb. Adiantum tenerum Sw. MG 8471 (CR) Nat. Herb. Adiantum terminatum Kunze ex Miq. GG 369 (INB) Nat. Herb. Adiantum tetraphyllum Humb. et Bonpl. ex Willd. AT 9442 (CR) Nat. Herb. Adiantum trichochlaenum Mickel et Beitel JB 2213 (CR) Nat. Herb. Adiantum villosum L. TBC 43239 (CR) Nat. Herb. Adiantum wilsonii Hook. MG 8006 (CR-INB) Nat. Herb. Ananthacorus angustifolius (Sw.) Underw. et Maxon GH 2998 (CR-INB) Nat. Herb. ep. Anetium citrifolium Splitg. GH 7567 (CR) Nat. Herb. ep. Antrophyum lineatum (Sw.) Kaulf. GH 7714 (CR) Nat. Herb. ep. Ceratopteris pteridoides (Hook.) Hieron. AR 9050 (CR) Nat. Herb. Ceratopteris thalictroides (L.) Brongn. MG 8030 (CR-INB) Nat. Herb. Pityrogramma calomelanos (L.) Link RO 1744 (CR) Nat. Herb. Pityrogramma dealbata (C. Presl) R. M. Tryon MG 8065 (CR) Nat. Herb. Pityrogramma trifoliata (L.) R. M. Tryon LDG 6807 (CR) Nat. Herb. Polytaenium cajenense (Desv.) Benedict AT 9479 (CR) Nat. Herb. ep. Polytaenium guayanense (Hieron.) Alston * DSn 6746 (CR) Nat. Herb. ep. Polytaenium lineatum (Sw.) J. Sm. * GH 2594 (CR) Nat. Herb. ep. Pteris altissima Poir. AT 9440 (CR) Nat. Herb. Pteris grandifolia L. ARG 545 (CR-INB) Nat. Herb. Pteris herrerae A. Rojas et M. Palacios * GH 2599 (CR-INB) Nat. Herb. Pteris propinqua J. Agardh ARG 1904 (CR-INB) Nat. Herb. Pteris pungens Willd. AT 9471 (CR) Nat. Herb. 136 Pteris quadriaurita Retz. AT 8579 (CR) Nat. Herb. Pteris tripartita Sw. MG 8035 (INB) Nat. Herb. Radiovittaria stipitata (Kunze) E. H. Crane JBE 44 (CR) Vittaria lineata (L.) Sm. MQ 465 (CR) Nat. Herb. ep. Nat. Herb. ep. Salviniaceae Azolla mexicana C. Presl AT 9165 (CR) Nat. Herb. Salvinia minima Baker AE (Obs.) Nat. Herb. Schizaeaceae Actinostachys pennula (Sw.) Hook. GH 7606 (CR) Nat. Herb. Schizaea elegans (Vahl) Sm. GH 7693 (CR) Nat. Herb. Tectariaceae Tectaria acutiloba (Hieron.) Maxon JFM 7721 (INB) Nat. Herb. Tectaria athyrioides (Baker) C. Chr. AR 4530 (CR) Nat. Herb. Tectaria brauniana (H. Karst.) C. Chr. RO 1999 (CR) Nat. Herb. Tectaria draconoptera (D. C. Eaton) Copel. WB 10909 (CR) Nat. Herb. Tectaria faberiana A. Rojas ARB 1941 (CR) Nat. Herb. Tectaria heracleifolia (Willd.) Underw. HP 14138 (CR) Nat. Herb. Tectaria incisa Cav. AT 9483 (CR) Nat. Herb. Tectaria nicotianifolia (Baker) C. Chr. AT 9445 (CR) Nat. Herb. Tectaria plantaginea (Jacq.) Maxon GH 2990 (CR-INB) Nat. Herb. Tectaria rivalis (Mett. ex Kuhn) C. Chr. AT 9484 (CR) Nat. Herb. Tectaria rufovillosa (Rosenst.) C. Chr. MG 4485 (CR) Nat. Herb. Tectaria subebenea (H. Christ) C. Chr. AT 9447 (CR) Nat. Herb. Thelypteridaceae Macrothelypteris torresiana (Gaudich.) Ching RM 3095 (CR) Nat. Herb. Thelypteris balbisii (Spreng.) Ching AT 9461 (CR) Nat. Herb. Thelypteris curta (H. Christ) C. F. Reed AT 9439 (CR) Nat. Herb. Thelypteris decussata (L.) Proctor AT 9453 (CR) Nat. Herb. Thelypteris dentata (Forssk.) E. P. St. John WH 114 (CR) Natu. Herb. Thelypteris eggersii (Hieron.) C. F. Reed AR 4555 (CR-INB) Nat. Herb. Thelypteris falcata (Liebm.) R. M. Tryon GG 350 (INB) Nat. Herb. Thelypteris francoana (E. Fourn.) C. F. Reed AT 9463 (CR) Nat. Herb. Thelypteris ghiesbreghtii (Hook.) C. V. Morton WB 10968 (CR) Nat. Herb. Thelypteris gigantea (Mett.) R. M. Tryon * RR 2762 (CR-INB) Nat. Herb. Thelypteris glandulosa (Desv.) Proctor WB 10916 (CR) Nat. Herb. Thelypteris grandis A. R. Sm. LDG s/n (CR) Nat. Herb. Thelypteris hispidula (Decne.) C. F. Reed LDG s/n (CR) Nat. Herb. Thelypteris imbricata (Liebm.) C. F. Reed AMO 163 (CR-INB) Nat. Herb. 137 Thelypteris interrupta (Willd.) Iwatsuki GCR 7499 (INB) Nat. Herb. Thelypteris leprieurii (Hook.) R. M. Tryon * RR 2666 (CR) Nat. Herb. Thelypteris lingulata (C. Chr.) C. V. Morton JG 1631 (CR-INB) Nat. Herb. Thelypteris nicaraguensis (E. Fourn.) C. V. Morton EMC 159 (CR-INB) Nat. Herb. Thelypteris oligocarpa (Humb. et Bonpl. ex Willd.) Ching LDG s/n (CR) Nat. Herb. Thelypteris opulenta (Kaulf.) Fosberg GH 7727 (CR) Nat. Herb. Thelypteris oroniensis L. D. Goméz JB 2216 (CR) End. Excl. Herb. Thelypteris patens (Sw.) Small AR 4536 (CR-INB) Nat. Herb. Thelypteris pellita (Willd.) Proctor et Lourteig PKG 66439 (CR) Nat. Herb. Thelypteris serrata (Cav.) Alston LDG 7101 (CR) Nat. Herb. Thelypteris tetragona (Sw.) Small HP 12703 (CR) Nat. Herb. Woodsiaceae Diplazium cristatum (Desr.) Alston HP 9200 (CR) Nat. Herb. Diplazium diplazioides (Klotzsch et H. Karst.) Alston LA 1948 (INB) Nat. Herb. Diplazium ferulaceum (T. Moore ex Hook.) Lellinger LDG 23496 (CR) Nat. Herb. Diplazium grandifolium (Sw.) Sw. TBC 43249 (CR) Nat. Herb. Diplazium ingens H. Christ AT 9443 (CR) Nat. Herb. Diplazium lechleri (Mett.) T. Moore * DSn 6505 (INB) Nat. Herb. Diplazium lindbergii (Mett.) H. Christ AT 9438 (CR) Nat. Herb. Diplazium prominulum Maxon GH 7707 (CR) Nat. Herb. Diplazium striatastrum Lellinger ARG 4898 (CR-INB) Nat. Herb. Diplazium striatum (L.) C. Presl MG 5767 (CR) Nat. Herb. 138 Spermatophyta Gimnospermae CYCADOPHYTA Zamiaceae Zamia neurophyllidia D. W. Stev. AE 5226 (CR) Nat. Arbu. GNETOPHYTA Gnetaceae Gnetum leyboldii Tul. LDG 20464 (CR) Nat. Bej. Angiospermae MONOCOTYLEDONEAE Alismataceae Echinodorus tunicatus Small AJI 2894 (CR) Nat. Herb. Limnocharis flava (L.) Buchenau JG 1539 (CR-INB) Nat. Herb. Limnocharis laforestii Duchass. ex Griseb. JG 2266 (INB) Nat. Herb. Alstroemeriaceae Bomarea obovata Herb. JBE 59 (CR) Nat. Bej. Amaryllidaceae Crinum erubescens L. f. JFM 7699 (CR-INB) Nat. Herb. Hymenocallis littoralis (Jacq.) Salisb. OV 1282 (CR) Nat. Herb. Araceae Alocasia plumbea Van Houtte RO 3090 (CR) Intr. Herb. Anthurium acutangulum Engl. MG 4321 (CR) Nat. Herb. ep. Anthurium bakeri Hook. f. GH 7556 (CR) Nat. Herb. ep. Anthurium bradeanum Croat & Grayum MG 5810 (CR) Nat. Herb. ep. Anthurium brownii Mast. * GH 2629 (CR-INB) Nat. Herb. ep. Anthurium caperatum Croat & R. A. Baker * RR 2737 (CR) Nat. Herb. ep. Anthurium clavigerum Poepp. AMC 75 (CR-INB) Nat. Herb. ep. Anthurium clidemioides Standl. EMC 198 (INB) Nat. Herb. ep. Anthurium consobrinum Schott RB 151 (CR) Nat. Herb. ep. Anthurium cucullispathum Croat * GH 2512 (CR) Nat. Herb. ep. Anthurium cuspidatum Mast. HP 9229 (CR) Nat. Herb. ep. Anthurium durandii Engl. GH 7596 (CR) Nat. Herb. ep. Anthurium dwyeri Croat ARG 722 (INB) Nat. Herb. ep. Anthurium fatoense K. Krause GH 7549 (CR) Nat. Excl. Herb. ep. Anthurium flexile Schott OV 1153 (CR) Nat. Herb. ep. Anthurium formosum Schott JBE 39 (CR) Nat. Herb. ep. Anthurium gracile (Rudge) Schott KB 3541 (CR) Nat. Herb. ep. 139 Anthurium interruptum Sodiro JBE 50 (CR) Nat. Herb. ep. Anthurium kunthii Poepp. GH 3064 (CR-INB) Nat. Herb. ep. Anthurium lancifolium Schott BH 17522 (CR-INB) Nat. Herb. ep. Anthurium llanense Croat GH 7573 (CR) Nat. Herb. ep. Anthurium michelii Guillaumin AE 4893 (CR) Nat. Herb. ep. Anthurium microspadix Schott * DSn 6841 (CR-INB) Nat. Herb. ep. Anthurium obtusilobum Schott * RR 2743 (CR) Nat. Herb. ep. Anthurium obtusum (Engl.) Grayum AT 9511 (CR) Nat. Herb. ep. Anthurium ochranthum K. Koch TBC 43243 (CR) Nat. Herb. Anthurium orteganum Engl. * DSn 6454 (INB) Nat. Herb. ep. Anthurium pageanum Croat LDG 23448 (CR) Nat. Excl. Herb. ep. Anthurium paludosum Engl. GH 7690 (CR) Nat. Excl. Herb. ep. Anthurium panduriforme Schott * RR 2723 (CR) Nat. Herb. ep. Anthurium pentaphyllum (Aubl.) G. Don EMC 138 (CR-INB) Nat. Herb. ep. Anthurium propinquum Sodiro * DS 4847 (INB) Nat. Herb. ep. Anthurium ramonense Engl. ex K. Krause GH 7553 (CR) Nat. Herb. ep. Anthurium ravenii Croat & R. A. Baker GH 7652 (CR) Nat. Herb. ep. Anthurium scandens (Aubl.) Engl. HP 9227 (CR) Nat. Herb. ep. Anthurium scherzerianum Schott * RR 2747 (CR) End. Herb. ep. Anthurium schottianum Croat & R. A. Baker TBC 43247 (CR) End. Herb. Anthurium spathiphyllum N. E. Br. AC 538 (CR) Nat. Herb. ep. Anthurium spectabile Schott LA 2826 (INB) End. Herb. ep. Anthurium subsignatum Schott EMC 145 (CR-INB) Nat. Herb. ep. Anthurium upalaense Croat & R. A. Baker AT 9507 (CR) Nat. Herb. ep. Anthurium watermaliense hort. ex L. H. Bailey & Nash RO 2210 (CR) Nat. Herb. ep. Anthurium wendlingeri G. M. Barroso * GH 2510 (CR) Nat. Herb. ep. Dieffenbachia concinna Croat & Grayum BH 21895 (CR-INB) End. Herb. Dieffenbachia davidsei Croat & Grayum BH 21884 (INB) Nat. Herb. Dieffenbachia grayumiana Croat BH 21904 (CR-INB) Nat. Herb. Dieffenbachia longispatha Engl. & K. Krause WB 10905 (CR) Nat. Herb. Dieffenbachia nitidipetiolata Croat & Grayum BH 24685 (CR-INB) Nat. Herb. Dieffenbachia oerstedii Schott BH 21928 (CR-INB) Nat. Herb. Dieffenbachia tonduzii Croat & Grayum AE 5275 (CR) Nat. Herb. Dracontium gigas (Seem.) Engl. SG s/n (CR) Nat. Herb. Dracontium spruceanum (Schott) G. H. Zhu AQ 333 (CR) Nat. Excl. Herb. Epipremnum pinnatum (L.) Engl. LA 2215 (INB) Intr. Herb. ep. Heteropsis oblongifolia Kunth RMA 22 (CR) Nat. Bej. Homalomena wendlandii Schott MG 4516 (CR) Nat. Herb. Monstera costaricensis (Engl. & K. Krause) Croat & Grayum MG 5247 (CR) End. Herb. ep. Monstera dissecta (Schott) Croat & Grayum MG 5761 (CR) Nat. Herb. ep. Monstera diversifolia Croat & Grayum MG 8063 (INB) Nat. Bej. Monstera glaucescens Croat & Grayum KB 3043 (CR) Nat. Herb. ep. 140 Monstera luteynii Madison JG 3272 (INB) End. Herb. ep. Monstera obliqua Miq. AC 551 (CR) Nat. Excl. Herb. ep. Monstera oreophila Madison * DS 4857 (INB) Nat. Herb. ep. Monstera pinnatipartita Schott MG 5281 (CR) Nat. Herb. ep. Monstera pittieri Engl. MG 4341 (CR) Nat. Herb. ep. Monstera spruceana (Schott) Engl. MG 4352 (CR) Nat. Herb. ep. Monstera standleyana G. S. Bunting AE (Obs.) Nat. Herb. ep. Monstera tenuis K. Koch TBC 43306 (CR) Nat. Herb. ep. Monstera tuberculata Lundell RMA 26 (CR) Nat. Herb. ep. Montrichardia arborescens (L.) Schott OV 1270 (CR) Nat. Herb. Philodendron alliodorum Croat & Grayum AC 2279 (CR) Nat. Herb. ep. Philodendron aurantiifolium Schott MG 5268 (CR) Nat. Herb. ep. Philodendron brevispathum Schott MG 8024 (CR-INB) Nat. Herb. ep. Philodendron fragrantissimum (Hook.) G. Don BH 17512 (CR-INB) Nat. Herb. ep. Philodendron grandipes K. Krause TBC 43253 (CR) Nat. Herb. Philodendron grayumii Croat JG 1643 (INB) Nat. Excl. Herb. ep. Philodendron hederaceum (Jacq.) Schott RS 839 (CR) Nat. Herb. ep. Philodendron herbaceum Croat & Grayum BH 17529 (CR-INB) Nat. Herb. ep. Philodendron inaequilaterum Liebm. MG 5269 (CR) Nat. Herb. ep. Philodendron jodavisianum G. S. Bunting * DSn 6498 (INB) Nat. Herb. ep. Philodendron ligulatum Schott JBE 49 (CR) Nat. Herb. ep. Philodendron radiatum Schott LP 1166 (CR) Nat. Herb. ep. Philodendron rhodoaxis G. S. Bunting AC 259 (CR) Nat. Herb. ep. Philodendron rigidifolium K. Krause RO 3657 (CR) Nat. Bej. Philodendron rothschuhianum (Engl.) Croat & Grayum AC 2291 (CR) Nat. Herb. ep. Philodendron sagittifolium Liebm. RS 832 (CR) Nat. Herb. ep. Philodendron schottianum H. Wendl. ex Schott * DSn 6803 (INB) Nat. Herb. ep. Philodendron schottii K. Koch HP 9223 (CR) Nat. Bej. Philodendron sulcatum K. Krause * DSn 6816 (INB) Nat. Herb. ep. Philodendron tripartitum (Jacq.) Schott MG 5809 (CR) Nat. Herb. ep. Philodendron verrucosum L. Mathieu ex Schott AT 9512 (CR) Nat. Herb. ep. Philodendron wendlandii Schott GH 2993 (CR-INB) Nat. Herb. ep. Pistia stratiotes L. JFM 19695 (INB) Nat. Herb. Rhodospatha pellucida Croat & Grayum UC 1933 (INB) Nat. Herb. ep. Spathiphyllum friedrichsthalii Schott MBG 690 (CR) Nat. Herb. Spathiphyllum laeve Engl. OV 1144 (CR) Nat. Herb. Spathiphyllum montanum (R. A. Baker) Grayum * AE (Obs.) Nat. Herb. Spathiphyllum phryniifolium Schott WB 10958 (CR) Nat. Herb. Spathiphyllum wendlandii Schott AE 5007 (CR) Nat. Herb. Spirodela intermedia W. Koch AL 1251 (CR) Nat. Herb. Stenospermation angustifolium Hemsl. HP 9226 (CR) Nat. Herb. ep. Stenospermation marantifolium Hemsl. AT 9508 (CR) Nat. Herb. ep. 141 Syngonium macrophyllum Engl. LA 1887 (INB) Nat. Herb. ep. Syngonium peliocladum Schott LDV 3848 (CR-INB) Nat. Herb. ep. Syngonium podophyllum Schott JGL 5578 (CR) Nat. Herb. ep. Syngonium schottianum H. Wendl. ex Schott EMC 133 (INB) Nat. Herb. ep. Syngonium triphyllum Birdsey ex Croat WB 10943 (CR) Nat. Herb. ep. Urospatha grandis Schott OV 1221 (CR) Nat. Herb. Xanthosoma dealbatum Grayum RB 75 (CR) End. Herb. Xanthosoma undipes (K. Koch & C. D. Bouché) K. Koch AE 4869 (CR) Nat. Herb. Arecaceae Asterogyne martiana (H. Wendl.) H. Wendl. ex Hemsl. EA 2143 (CR-INB) Nat. Arbu. Astrocaryum alatum H. F. Loomis AE 528 (CR) Nat. arb. Astrocaryum standleyanum L. H. Bailey UC 1939 (INB) Nat. arb. Attalea rostrata Oerst. BH 21910 (INB) Nat. arb. Bactris caudata H. Wendl. ex Burret * GH 2526 (CR) Nat. Arbu. Bactris dianeura Burret * DSn 6800 (INB) Nat. Arbu. Bactris gasipaes Kunth UC 1947 (INB) Intr. Arb. Bactris glandulosa Oerst. MG 5254 (CR) Nat. Arbu. Bactris gracilior Burret RO 1894 (CR) Nat. Arbu. Bactris hondurensis Standl. JB 2243 (CR) Nat. Arbu. Bactris maraja Mart. MG 8003 (CR-INB) Nat. Arbu. Bactris militaris H. E. Moore GH 7653 (CR) Nat. Arbu. Calyptrogyne condensata (L. H. Bailey) Wess. Boer OV 1129 (CR) Nat. Excl. Arbu. Calyptrogyne ghiesbreghtiana (Linden & H. Wendl.) H. Wendl. KB 3039 (CR) Nat. Arbu. Chamaedorea dammeriana Burret ARG 1920 (CR-INB) Nat. Arbu. Chamaedorea deckeriana (Klotzsch) Hemsl. OV 1117 (CR) Nat. Arbu. Chamaedorea lucidifrons L. H. Bailey AC 2294 (CR) Nat. Arbu. Chamaedorea macrospadix Oerst. RO 1896 (CR) Nat. Arbu. Chamaedorea palmeriana Hodel & N. W. Uhl * DSn 6478 (INB) Nat. Arbu. Chamaedorea pinnatifrons (Jacq.) Oerst. KB 3562 (CR) Nat. Arbu. Chamaedorea pumila H. Wendl. * GH 2521 (CR) Nat. Arbu. Chamaedorea scheryi L. H. Bailey BH 22351 (INB) Nat. Arbu. Chamaedorea tepejilote Liebm. HP 9236 (CR) Nat. Arbu. Cocos nucifera L. AE (Obs.) Nat. arb. Cryosophila cookii Bartlett BH 21859 (INB) End. arb. Cryosophila warscewiczii (H. Wendl.) Bartlett AE 5460 (CR) Nat. arb. Desmoncus costaricensis (Kuntze) Burret MG 4463 (CR) End. Excl. Arbu. Desmoncus schippii Burret AE 5184 (CR) Nat. Arbu. Elaeis oleifera (Kunth) Cortés LDV 3755 (CR-INB) Nat. arb. Euterpe precatoria Mart. BH 21938 (INB) Nat. arb. Geonoma congesta H. Wendl. ex Spruce RO 2898 (CR) Nat. Arbu. Geonoma cuneata H. Wendl. ex Spruce WB 10941 (CR) Nat. Arbu. 142 Geonoma deversa (Poit.) Kunth AQ 329 (CR) Nat. Arbu. Geonoma interrupta (Ruíz & Pav.) Mart. GH 2984 (CR-INB) Nat. Arbu. Geonoma longevaginata H. Wendl. ex Spruce OV 1145 (CR) Nat. Arbu. Geonoma oxycarpa Mart. FL 46 (CR) Nat. Arbu. Iriartea deltoidea Ruíz & Pav. AE 524 (CR) Nat. arb. Prestoea decurrens (H. Wendl. ex Burret) H. E. Moore JG 1843 (INB) Nat. arb. Raphia taedigera (Mart.) Mart. LP 1169 (CR) Nat. arb. Reinhardtia gracilis (H. Wendl.) Drude ex Dammer RO 2205 (CR) Nat. Arbu. Reinhardtia simplex (H. Wendl.) Drude ex Dammer OV 1139 (CR) Nat. Arbu. Sabal mauritiiformis (H. Karst.) Griseb. & H. Wendl. MG 5253 (CR) Nat. arb. Socratea exorrhiza (Mart.) H. Wendl. BH 21887 (INB) Nat. arb. Synechanthus fibrosus (H. Wendl.) H. Wendl. RO 1896 (CR) Nat. Arbu. Synechanthus warscewiczianus H. Wendl. * RR 2689 (CR) Nat. Arbu. Welfia regia Mast. JFM 7751 (INB) Nat. arb. Asparagaceae Cordyline fruticosa (L.) A. Chev. WB 10937 (CR) Intr. Arbu. Bromeliaceae Aechmea angustifolia Poepp. & Endl. JGL 8780 (CR) Nat. Herb. ep. Aechmea bracteata (Sw.) Griseb. JG 1670 (INB) Nat. Herb. ep. Aechmea magdalenae (André) André ex Baker JB 2291 (CR) Nat. Herb. Aechmea mariae-reginae H. Wendl. GG 114 (CR-INB) Nat. Herb. ep. Aechmea nudicaulis (L.) Griseb. AMO 108 (INB) Nat. Herb. ep. Aechmea pittieri Mez GG 219 (INB) End. Herb. ep. Aechmea pubescens Baker LDG sn (CR) Nat. Herb. ep. Aechmea tillandsioides (Schult. f. ex Mart.) Baker GH 7568 (CR) Nat. Herb. ep. Catopsis juncifolia Mez & Werckle EL 289 (CR-INB) Nat. Herb. ep. Catopsis morreniana Mez JGL 12329 (CR) Nat. Herb. ep. Catopsis nutans (Sw.) Griseb. BH 24868 (CR-INB) Nat. Herb. ep. Catopsis sessiliflora (Ruíz & Pav.) Mez SL 3029 (CR) Nat. Herb. ep. Guzmania desautelsii Read & L. B. Sm. LDG 23433 (CR) Nat. Herb. ep. Guzmania lingulata (L.) Mez QJ 1836 (CR-INB) Nat. Herb. ep. Guzmania monostachia (L.) Rusby ex Mez GG 189 (CR-INB) Nat. Herb. ep. Guzmania scherzeriana Mez AC 2289 (CR) Nat. Herb. ep. Guzmania sprucei (André) L. B. Sm. * AE 5407 (CR) Nat. Herb. ep. Guzmania stenostachya L. B. Sm. SL 3020 (CR) Nat. Herb. ep. Pitcairnia atrorubens (Beer) Baker BH 17513 (INB) Nat. Herb. Ronnbergia hathewayi L. B. Sm. * AE 5202 (CR) Nat. Herb. ep. Tillandsia acostae Mez & Tonduz LA 1937 (CR-INB) Nat. Herb. ep. Tillandsia anceps G. Lodd. JFM 4929 (INB) Nat. Herb. ep. Tillandsia bulbosa Hook. MG 8041 (CR-INB) Nat. Herb. ep. 143 Tillandsia festucoides Brongn. ex Mez EA 2153 (CR-INB) Nat. Herb. ep. Tillandsia filifolia Schltdl. & Cham. JGL 9555 (CR) Nat. Herb. ep. Tillandsia juncea (Ruíz & Pav.) Poir. EA 2154 (INB) Nat. Herb. ep. Tillandsia monadelpha (E. Morren) Baker JGL 9554 (CR) Nat. Herb. ep. Tillandsia usneoides (L.) L. ARG 1922 (CR-INB) Nat. Herb. ep. Tillandsia variabilis Schltdl. JFM 7717 (INB) Nat. Herb. ep. Vriesea chontalensis (Baker) L. B. Sm. EL 290 (INB) Nat. Herb. ep. Vriesea heliconioides (Kunth) Hook. ex Walp. AC 529 (CR) Nat. Herb. ep. Werauhia viridiflora (Regel) J. R. Grant AC 2280 (CR) Nat. Herb. ep. Burmanniaceae Apteria aphylla (Nutt.) Barnhart GH 7609 (CR) Nat. Herb. Gymnosiphon panamensis Jonker GH 7610 (CR) Nat. Herb. Cannaceae Canna indica L. MBG 700 (CR) Nat. Herb. Commelinaceae Callisia monandra (Sw.) Schult. & Schult. f. GH 2414 (INB) Nat. Herb. Cochliostema odoratissimum Lem. OV 1224 (CR) Nat. Herb. ep. Commelina diffusa Burm. f. WB 10340 (CR) Nat. Herb. Commelina erecta L. AMC 73 (CR-INB) Nat. Herb. Commelina rufipes Seub. PJM 7905 (INB) Nat. Herb. Dichorisandra amabilis J. R. Grant WH 145 (CR) Nat. Herb. Dichorisandra hexandra (Aubl.) Standl. AE 5422 (CR) Nat. Herb. ep. Floscopa robusta (Seub.) C. B. Clarke OV 1120 (CR) Nat. Herb. Gibasis geniculata (Jacq.) Rohweder RK 424 (INB) Nat. Herb. Murdannia nudiflora (L.) Brenan JG 2277 (CR-INB) Natu. Herb. Tinantia leiocalyx C. B. Clarke ex Donn. Sm. GG 75 (CR-INB) Nat. Herb. Tradescantia grantii Faden MG 5776 (CR) End. Herb. Tradescantia spathacea Sw. MQ 472 (CR) Nat. Herb. Tradescantia zanonia (L.) Sw. AE 540 (CR) Nat. Herb. Tradescantia zebrina hort. ex Heynh. RO 2850 (CR) Nat. Herb. Tripogandra serrulata (Vahl) Handlos K 1192 (CR) Nat. Herb. Costaceae Costus bracteatus Rowlee GH 7638 (CR) Nat. Herb. Costus laevis Ruíz & Pav. WB 10395 (CR) Nat. Herb. Costus lima K. Schum. GG 187 (CR-INB) Nat. Herb. Costus nitidus Maas AQ 3284 (CR) Nat. Herb. Costus pulverulentus C. Presl GH 7674 (CR) Nat. Herb. Costus speciosus Sm. ARG 2640 (CR-INB) Natu. Herb. 144 Costus woodsonii Maas ARG 2257 (CR-INB) Nat. Herb. Dimerocostus strobilaceus Kuntze HK 4675 (CR-INB) Nat. Herb. Cyclanthaceae Asplundia alata Harling MG 5270 (CR) Nat. Herb. Asplundia ceci Hammel * DSn 6462 (INB) Nat. Herb. ep. Asplundia euryspatha Harling ARG 4901 (INB) Nat. Herb. ep. Asplundia ferruginea Grayum & Hammel MG 5280 (CR) Nat. Herb. ep. Asplundia multistaminata Harling JS 2297 (CR) Nat. Herb. ep. Asplundia uncinata Harling BH 21870 (INB) Nat. Herb. Asplundia utilis (Oerst.) Harling KB 3547 (CR) Nat. Herb. ep. Carludovica drudei Mast. FL 51 (CR) Nat. Herb. Carludovica palmata Ruíz & Pav. BH 14286 (CR) Nat. Herb. Carludovica rotundifolia H. Wendl. ex Hook. f. AE 527 (CR) Nat. Herb. Carludovica sulcata Hammel BH 14356 (CR) Nat. Herb. Cyclanthus bipartitus Poit. ex A. Rich. RB 44 (CR) Nat. Herb. Dicranopygium grandifolium Harling BH 18094 (INB) Nat. Excl. Herb. ep. Dicranopygium tatica Hammel AE 5009 (CR) End. Excl. Herb. ep. Dicranopygium umbrophilum Hammel KB 3487 (CR) Nat. Herb. Dicranopygium wallisii (Regel) Harling BH 22355 (INB) Nat. Excl. Herb. Dicranopygium wedelii Harling JGL 8718 (CR) Nat. Herb. ep. Evodianthus funifer (Poit.) Lindm. AE 568 (CR) Nat. Herb. ep. Sphaeradenia garciae Harling * DSn 6481 (INB) Nat. Herb. ep. Thoracocarpus bissectus (Vell.) Harling BH 18107 (CR-INB) Nat. Bej. Cymodoceaceae Halodule wrightii Asch. AL 1256 (CR) Nat. Excl. Herb. Syringodium filiforme Kütz. AL 1258 (CR) Nat. Excl. Herb. Cyperaceae Calyptrocarya glomerulata (Brongn.) Urb. MG 4499 (CR) Nat. Herb. Calyptrocarya luzuliformis T. Koyama GH 7591 (CR) Nat. Herb. Cladium jamaicense Crantz JGL 8330 (CR) Nat. Herb. Cyperus aggregatus (Willd.) Endl. JGL 9511 (CR) Nat. Herb. Cyperus amabilis Vahl AT 8606 (CR) Nat. Herb. Cyperus compressus L. JGL 9505 (CR) Nat. Herb. Cyperus croceus Vahl GH 2994 (CR-INB) Nat. Herb. Cyperus esculentus L. AT 8739 (CR) Nat. Herb. Cyperus giganteus Vahl JGL 1026 (CR) Nat. Herb. Cyperus hermaphroditus (Jacq.) Standl. AT 9505 (CR) Nat. Herb. Cyperus imbricatus Retz. WH 118 (CR) Nat. Herb. Cyperus laxus Lam. AT 9501 (CR) Nat. Herb. 145 Cyperus ligularis L. MBG 692 (CR) Nat. Herb. Cyperus luzulae (L.) Rottb. ex Retz. MBG 722 (CR) Nat. Herb. Cyperus miliifolius Poepp. & Kunth RO 3287 (CR) Nat. Herb. Cyperus ochraceus Vahl WH 121 (CR) Nat. Herb. Cyperus odoratus L. MBG 734 (CR) Nat. Herb. Cyperus prolixus Kunth RO 1705 (CR) Nat. Herb. Cyperus rotundus L. RH 83095 (CR) Nat. Herb. Cyperus sphacelatus Rottb. JGL 8345 (CR) Nat. Herb. Cyperus surinamensis Rottb. RS s/n (CR) Nat. Herb. Eleocharis elegans (Kunth) Roem. & Schult. AT 9219 (CR) Nat. Herb. Eleocharis geniculata (L.) Roem. & Schult. AT 9216 (CR) Nat. Herb. Eleocharis interstincta (Vahl) Roem. & Schult. GCR 7493(CR) Nat. Herb. Eleocharis minima Kunth GH 7698 (CR) Nat. Herb. Eleocharis mutata (L.) Roem. & Schult. HP 10342 (CR) Nat. Herb. Eleocharis plicarhachis (Griseb.) Svenson GCR 7495 (CR) Nat. Herb. Eleocharis retroflexa (Poir.) Urb. SL 3036 (CR) Nat. Herb. Fimbristylis autumnalis (L.) Roem. & Schult. EA 2105 (CR-INB) Nat. Herb. Fimbristylis cymosa R. Br. MQ s/n (CR) Nat. Herb. Fimbristylis dichotoma (L.) Vahl AT 9221 (CR) Nat. Herb. Fimbristylis littoralis Gaudich. JGL 3945 (CR) Nat. Herb. Fimbristylis spadicea (L.) Vahl GCR 7503 (INB) Nat. Herb. Fuirena camptotricha C. Wright LA 2186 (CR-INB) Nat. Herb. Fuirena umbellata Rottb. RO 2788 (CR) Nat. Herb. Hypolytrum longifolium (Rich.) Nees GH 7557 (CR) Nat. Herb. Kyllinga brevifolia Rottb. AT 9218 (CR) Nat. Herb. Kyllinga pumila Michx. AT 8747 (CR) Nat. Herb. Kyllinga tibialis Ledeb. AT 9122 (CR) Nat. Herb. Lipocarpha micrantha (Vahl) G. C. Tucker AT 8607 (CR) Nat. Herb. Mapania assimilis T. Koyama JGL 8849 (CR) Nat. Herb. Remirea maritima Aubl. JGL 9578 (CR) Nat. Herb. Rhynchospora colorata (L.) H. Pfeiff. JGL 3030 (CR) Nat. Excl. Herb. Rhynchospora corymbosa (L.) Britton AE 5753 (CR) Nat. Herb. Rhynchospora polyphylla (Vahl) Vahl JGL 8720 (CR) Nat. Herb. Rhynchospora radicans subsp. microcephala (Bertero ex Spreng.) W. W. Thomas RO 2002 (CR) Nat. Herb. Rhynchospora radicans subsp. radicans (Schltdl. & Cham.) H. Pfeiff. WH 122 (CR) Nat. Herb. Rhynchospora watsonii (Britton) Davidse MG 4487 (CR) Nat. Herb. Scleria flagellum-nigrorum P. J. Bergius * DS 4925 (INB) Nat. Herb. Scleria latifolia Sw. JGL 8389 (CR) Nat. Herb. Scleria macrophylla J. Presl & C. Presl WH 123 (CR) Nat. Herb. Scleria melaleuca Rchb. ex Schltdl. & Cham. RO 2795 (CR) Nat. Herb. Scleria microcarpa Nees ex Kunth JGL 3946 (CR) Nat. Herb. 146 Scleria mitis P. J. Bergius MBG 689 (CR) Nat. Herb. Scleria secans (L.) Urb. JGL 9542 (CR) Nat. Herb. Dioscoreaceae Dioscorea alata L. RO 3285 (CR) Intr. Bej. Dioscorea davidsei O. Téllez BH 21919 (CR-INB) Nat. Bej. Dioscorea mexicana Scheidw. JJC 2030 (CR) Nat. Bej. Dioscorea pilosiuscula Bertero AT 9517 (CR) Nat. Bej. Dioscorea standleyi C. V. Morton LDG 23463 (CR) Nat. Bej. Dioscorea trifida L. f. RO 3286 (CR) Intr. Bej. Dioscorea urophylla Hemsl. BH 21857 (CR-INB) Nat. Bej. Eriocaulaceae Tonina fluviatilis Aubl. JS 2610 (CR) Nat. Herb. Haemodoraceae Xiphidium caeruleum Aubl. EA 2123 (CR-INB) Nat. Herb. Heliconiaceae Heliconia calatheiphylla G. S. Daniels & F. G. Stiles * GH 2596 (INB) End. Herb. Heliconia colgantea R. R. Sm. ex G. S. Daniels & F. G. Stiles * DSn 6830 (INB) Nat. Herb. Heliconia ignescens G. S. Daniels & F. G. Stiles * ARG 11657 (INB) Nat. Herb. Heliconia imbricata (Kuntze) Baker AC 265 (CR) Nat. Herb. Heliconia irrasa R. R. Sm. AC 268 (CR) Nat. Herb. Heliconia latispatha Benth. WB 10331 (CR) Nat. Herb. Heliconia longa (Griggs) H. J. P. Winkl. AE 4820 (CR) Nat. Herb. Heliconia lophocarpa G. S. Daniels & F. G. Stiles AE 5185 (CR) Nat. Herb. Heliconia mariae Hook. f. WB 10456 (CR) Nat. Herb. Heliconia mathiasiae G. S. Daniels & F. G. Stiles AE 4819 (CR) Nat. Herb. Heliconia pogonantha Cufod. KB 3455 (CR) Nat. Herb. Heliconia rostrata Ruíz & Pav. LDV 3838 (CR-INB) Intr. Herb. Heliconia talamancana G. S. Daniels & F. G. Stiles WB 1100 (CR) Nat. Excl. Herb. Heliconia trichocarpa G. S. Daniels & F. G. Stiles AE 5190 (CR) Nat. Herb. Heliconia vaginalis Benth. OV 1223 (CR) Nat. Herb. Heliconia wagneriana Petersen AT 9434 (CR) Nat. Herb. Hydrocharitaceae Halophila decipiens Ostenf. AL 1257 (CR) Nat. Excl. Herb. Najas guadalupensis (Spreng.) Magnus MJB 423 (CR) Nat. Herb. Thalassia testudinum K. D. Koenig AL 1255 (CR) Nat. Excl. Herb. 147 Marantaceae Calathea carlae H. Kenn. * ARG 11661 (INB) Nat. Herb. Calathea crotalifera S. Watson HK 5245 (INB) Nat. Herb. Calathea inocephala (Kuntze) H. Kenn. & Nicolson FL 34 (CR) Nat. Herb. Calathea lasiostachya Donn. Sm. BH 18102 (CR-INB) Nat. Herb. Calathea lutea (Aubl.) Schult. AT 9435 (CR) Nat. Herb. Calathea similis H. Kenn. NZ 4898 (INB) Nat. Herb. Ctenanthe dasycarpa (Donn. Sm.) K. Schum. RB 49 (CR) Nat. Herb. Goeppertia allenii (Woodson) Borchs. & S. Suárez BH 22287 (INB) Nat. Excl. Herb. Goeppertia cleistantha (Standl.) Borchs. & S. Suárez BH 18093 (INB) Nat. Herb. Goeppertia foliosa (Rowlee ex Woodson & Schery) Borchs. & S. Suárez OV 1118 (CR) Nat. Herb. Goeppertia gymnocarpa (H. Kenn.) Borchs. & S. Suárez HK 3797 (CR) Nat. Herb. Goeppertia hammelii (H. Kenn.) Borchs. & S. Suárez WB 10377 (CR) End. Herb. Goeppertia indecora (Woodson) Borchs. & S. Suárez BH 18125 (CR-INB) Nat. Herb. Goeppertia leucostachys (Hook. f.) Borchs. & S. Suárez * DSn 6487 (INB) Nat. Herb. Goeppertia martinicensis (Standl.) Borchs. & S. Suárez WB s/n (CR) Nat. Herb. Goeppertia micans (L. Mathieu) Borchs. & S. Suárez BH 18108 (CR-INB) Nat. Herb. Goeppertia robiniae (H. Kenn.) Borchs. & S. Suárez AC 261 (CR) End. Herb. Goeppertia silvicola (H. Kenn.) Borchs. & S. Suárez HK 3796 (CR) Nat. Herb. Goeppertia warszewiczii (L. Mathieu ex Planch.) Borchs. & S. Suárez AJI 2870 (CR) Nat. Herb. Ischnosiphon elegans Standl. MG 4376 (CR) Nat. Herb. Ischnosiphon inflatus L. Andersson JS 2338 (CR) Nat. Herb. Maranta gibba Sm. AHG 1298 (CR) Nat. Herb. Pleiostachya leiostachya (Donn. Sm.) Hammel OV 1321 (CR) Nat. Herb. Pleiostachya pruinosa (W. Bull ex Regel) K. Schum. WB 8438 (CR) Nat. Herb. Stromanthe palustris H. Kenn. BH 14352 (CR) End. Herb. Musaceae Musa coccinea Andrews AMC 48 (CR-INB) Intr. Herb. Musa textilis Née BH 24489 (INB) Intr. Herb. Musa velutina H. Wendl. & Drude AKM 6598 (INB) Intr. Herb. Orchidaceae Acianthera ellipsophylla (L. O. Williams) Pridgeon & M. W. Chase MG 8055 (INB) Nat. Herb. ep. Acronia cardiothallis (Rchb. f.) Luer * GH 2719 (CR) Nat. Herb. Acronia phyllocardioides (Schltr.) Luer AQ 3262 (CR) Nat. Herb. Brassavola nodosa (L.) Lindl. AE 2513 (CR) Nat. Herb. ep. Brassia arcuigera Rchb. f. JFM 7704 (INB) Nat. Herb. ep. Campylocentrum fasciola (Lindl.) Cogn. JBL s/n (Obs.) Nat. Herb. ep. 148 Catasetum maculatum Kunth RB 2 (CR) Nat. Herb. ep. Caularthron bilamellatum (Rchb. f.) R. E. Schult. JBL s/n (Obs.) Nat. Herb. ep. Comparettia falcata Poepp. & Endl. JFM 7679 (INB) Nat. Herb. ep. Coryanthes picturata Rchb. f. RO 2186 (CR) Nat. Herb. ep. Coryanthes sp. Hook. JBL s/n (Obs.) Nat. Herb. ep. Cryptarrhena guatemalensis Schltr. BH 22320 (INB) Nat. Herb. ep. Elleanthus glaucophyllus Schltr. MCR 1259 (CR) Nat. Herb. ep. Elleanthus hymenophorus (Rchb. f.) Rchb. f. GH 3018 (CR-INB) Nat. Herb. ep. Encyclia alata (Bateman) Schltr. GH 7622 (CR) Nat. Herb. ep. Epidendrum anceps Jacq. RO 2213 (CR) Nat. Herb. ep. Epidendrum angustisegmentum (L. O. Williams) Hágsater JBL s/n (Obs.) Nat. Excl. Herb. ep. Epidendrum cardiophorum Schltr. AMO 170 (CR-INB) Nat. Herb. ep. Epidendrum eburneum Rchb. f. RS 848 (CR) Nat. Herb. ep. Epidendrum flexuosum G. Mey. JFM 7695 (INB) Nat. Herb. ep. Epidendrum macroclinium Hágsater GH 2505 (INB) Nat. Herb. ep. Epidendrum nocturnum Jacq. GH 7685 (CR) Nat. Herb. ep. Epidendrum storkii Ames JFM 10928 (INB) Nat. Herb. ep. Epidendrum strobiliferum Rchb. f. JBL s/n (Obs.) Nat. Herb. ep. Epidendrum tridens Poepp. & Endl. GH 7687 (CR) Nat. Herb. ep. Epidendrum turialvae Rchb. f. AM 59 (CR-INB) End. Herb. ep. Epistephium ellipticum R. O. Williams & Summerh. GH 7605 (CR) Intr. Herb. Erycina pumilio (Rchb. f.) N. H. Williams & M. W. Chase RO 1674 (CR) Nat. Herb. ep. Erythrodes lunifera (Schltr.) Ames AQ 3283 (CR) Nat. Herb. Erythrodes vesicifera (Rchb. f.) Ames AQ 3277 (CR) Nat. Herb. Gongora leucochila Lem. GH 7586 (CR) Nat. Herb. ep. Heterotaxis maleolens (Schltr.) I. Ojeda & Carnevali GH 3003 (CR-INB) Nat. Herb. ep. Ionopsis satyrioides (Sw.) Rchb. f. CAT 186 (CR) Nat. Herb. ep. Ionopsis utricularioides (Sw.) Lindl. JBL s/n (Obs.) Nat. Herb. ep. Leochilus labiatus (Sw.) Kuntze JBL s/n (Obs.) Nat. Herb. ep. Leochilus scriptus (Scheidw.) Rchb. f. GH 2383 (INB) Nat. Herb. ep. Lycaste tricolor (Klotzsch) Rchb. f. LA 2220 (INB) Nat. Herb. ep. Maxillaria bracteata (Schltr.) Ames & Correll JFM 10932 (INB) Nat. Herb. ep. Maxillaria elatior (Rchb. f.) Rchb. f. BH 24651 (CR-INB) Nat. Herb. ep. Maxillaria fulgens (Rchb. f.) L. O. Williams AE (Obs.) Nat. Herb. ep. Maxillaria microphyton Schltr. * GH 2724 (CR) End. Herb. ep. Maxillaria sanguinea Rolfe RWL 1498 (CR) Nat. Herb. ep. Maxillariella diuturna (Ames & C. Schweinf.) M.A. Blanco & Carnevali AE 4990 (CR) Nat. Herb. ep. Microchilus tridax (Rchb. f.) Ormerod * AE 5178 (CR) Nat. Herb. Mormolyca dressleriana (Carnevali & J.T. Atwood) M.A. Blanco JS 2434 (CR) Nat. Herb. ep. Mormolyca hedwigiae (Hamer & Dodson) M.A. Blanco JBL s/n (Obs.) Nat. Herb. ep. Muscarella aristata (Hook.) Luer MG 9656 (CR-INB) Nat. Herb. ep. 149 Muscarella zephyrina (Rchb. f.) Luer MG 4444 (CR) Nat. Herb. ep. Nidema boothii (Lindl.) Schltr. GG 204 (CR-INB) Nat. Herb. ep. Notylia sp. Lindl. JBL s/n (Obs.) Nat. Herb. ep. Octomeria valerioi Ames & C. Schweinf. AE (Obs.) Nat. Herb. ep. Oncidium stenotis Rchb. f. RB 86 (CR) Nat. Herb. ep. Ornithocephalus bicornis Lindl. GH 3069 (INB) Nat. Herb. ep. Pescatorea cerina (Lindl. & Paxton) Rchb. f. * AE 5406 (CR) Nat. Herb. ep. Pleurothallis geminicaulina Ames GH 7621 (CR) Nat. Herb. ep. Pleurothallis helleri A. D. Hawkes AE 5255 (CR) Nat. Herb. ep. Pleurothallis lanceana G. Lodd. GH 7695 (CR) Nat. Herb. ep. Pleurothallis microphylla A. Rich. & Galeotti GH 7628 (CR) Nat. Herb. ep. Pleurothallis rhodoglossa Schltr. GH 2415 (INB) Nat. Herb. ep. Pleurothallis rowleei Ames EA 2091 (CR-INB) Nat. Herb. ep. Pleurothallis setosa C. Schweinf. JFM 14718 (INB) Nat. Herb. ep. Polystachya masayensis Rchb. f. JBL s/n (Obs.) Nat. Herb. ep. Prosthechea vespa (Vell.) W. E. Higgins * GH 2686 (CR) Nat. Herb. ep. Psychopsis krameriana (Rchb. f.) H. G. Jones GH 3061 (INB) Nat. Herb. ep. Psygmorchis pusilla (L.) Dodson & Dressler RB 168 (CR) Nat. Herb. ep. Reichantha tonduzii (Woolward) Luer GH 2422 (INB) Nat. Herb. ep. Rodriguezia compacta Schltr. RO 2099 (CR) Nat. Herb. ep. Scaphyglottis minutiflora Ames & Correll SL 3100 (CR) Nat. Herb. ep. Scaphyglottis prolifera Cogn. CAT 206 (CR) Nat. Herb. ep. Sigmatostalix integrilabris Pupulin * GH 2640 (INB) Nat. Herb. ep. Sobralia fragrans Lindl. AE 5256 (CR) Nat. Herb. ep. Specklinia grobyi (Bateman ex Lindl.) Pridgeon & M.W. Chase AE 4861 (CR) Nat. Herb. ep. Specklinia imraei (Lindl.) Luer * AE 5403 (CR) Nat. Herb. ep. Stanhopea sp. J. Frost ex Hook. JBL s/n (Obs.) Nat. Herb. ep. Stanhopeastrum pullum (Rchb. f.) Szlach. AE (Obs.) Nat. Herb. ep. Trichocentrum ascendens (Lindl.) M. W. Chase & N. H. Williams JFM 7691 (CR-INB) Nat. Herb. ep. Trichocentrum cebolleta (Jacq.) M. W. Chase & N. H. Williams RO 3686 (CR) Nat. Herb. ep. Trichosalpinx memor (Rchb. f.) Luer GH 7627 (CR) Nat. Herb. ep. Trigonidium egertonianum Bateman ex Lindl. JBL s/n (Obs.) Nat. Herb. ep. Trisetella triaristella (Rchb. f.) Luer CAT 239 (CR) Nat. Herb. ep. Vanilla costaricensis Soto Arenas LA 2187 (CR-INB) End. Bej. Vanilla dressleri Soto Arenas GC 325 (INB) Nat. Bej. Vanilla planifolia Andrews EL 87 (CR-INB) Nat. Bej. Vanilla sarapiquensis Soto Arenas JBL s/n (Obs.) End. Bej. Warrea costaricensis Schltr. AE 5232 (CR) Nat. Herb. Xylobium squalens (Lindl.) Lindl. AE (Obs.) Nat. Herb. ep. Xylobium sulfurinum (Lem.) Schltr. RO 2512 (CR) Nat. Herb. ep. 150 Pandanaceae Pandanus tectorius Parkinson WH 22 (CR) Intr. Arb. Poaceae Acroceras zizanioides (Kunth) Dandy AT 8566 (CR) Nat. Herb. Andropogon bicornis L. SL 3043 (CR) Nat. Herb. Andropogon fastigiatus Sw. JFM 7782 (CR-INB) Nat. Herb. Andropogon glomeratus (Walter) Britton RB 24 (CR) Nat. Herb. Anthephora hermaphrodita (L.) Kuntze RO 1782 (CR) Nat. Herb. Arundinella berteroniana (Schult.) Hitchc. & Chase RO 1977 (CR) Nat. Herb. Arundinella deppeana Nees ex Steud. MG 9659 (CR-INB) Nat. Herb. Axonopus compressus (Sw.) P. Beauv. RP 12912 (CR) Nat. Herb. Bambusa vulgaris Schrad. ex J. C. Wendl. RO 2613 (CR) Intr. Arbu. Calamagrostis bogotensis (Pilg.) Pilg. RP 10022 (CR) Nat. Herb. Cenchrus brownii Roem. & Schult. MBG 733 (CR) Nat. Herb. Cenchrus echinatus L. HP 4202 (CR) Nat. Herb. Cenchrus incertus M. A. Curtis AT 9121 (CR) Nat. Herb. Chloris barbata Sw. SL 2595 (CR) Nat. Herb. Chloris radiata (L.) Sw. RO 1790 (CR) Nat. Herb. Chusquea simpliciflora Munro WB 10441 (CR) Nat. Arbu. Coix lacryma-jobi L. RP 12925 (CR) Natu. Herb. Cryptochloa concinna (Hook. f.) Swallen MG 8068 (CR-INB) Nat. Herb. Cymbopogon citratus (DC.) Stapf RO 2855 (CR) Intr. Herb. Cymbopogon winterianus Jowitt ex Bor MG 4528 (CR) Intr. Herb. Cynodon dactylon (L.) Pers. 4204 (CR) Natu. Herb. Dactyloctenium aegyptium (L.) Willd. HP 4198 (CR) Natu. Herb. Digitaria abyssinica (Hochst. ex A. Rich.) Stapf SL 2968 (CR) Natu. Herb. Digitaria bicornis (Lam.) Roem. & Schult. RP 9971 (CR) Nat. Herb. Digitaria ciliaris (Retz.) Koeler AT 9119 (CR) Nat. Herb. Digitaria horizontalis Willd. RP 9965 (CR) Nat. Herb. Digitaria setigera Roth ex Roem. & Schult. MG 10034 (CR-INB) Natu. Herb. Dinebra panicea (Retz.) P. M. Peterson & N. Snow RP 13194 (CR) Nat. Herb. Dinebra scabra (Nees) P. M. Peterson & N. Snow HP 4199 (CR) Nat. Herb. Echinochloa colona (L.) Link RO 2497 (CR) Nat. Herb. Echinochloa polystachya (Kunth) Hitchc. RS 804 (CR) Nat. Herb. Eleusine indica (L.) Gaertn. RP 11093 (CR) Natu. Herb. Elytrostachys clavigera McClure RP 13719 (CR) Nat. Arbu. Eragrostis acutiflora (Kunth) Nees RP 10006 (CR) Nat. Herb. Eragrostis amabilis (L.) Wight & Arn. ex Nees JGL 3964 (CR) Natu. Herb. Eragrostis ciliaris (L.) R. Br. JGL 3963 (CR) Natu. Herb. Eragrostis pectinacea (Michx.) Nees RO 2843 (CR) Nat. Herb. Eriochloa polystachya Kunth RO 197 3 (CR) Nat. Herb. 151 Eustachys petraea (Sw.) Desv. JGL 300 (CR) Nat. Herb. Gynerium sagittatum (Aubl.) P. Beauv. RP 9995 (CR) Nat. Arbu. Homolepis aturensis (Kunth) Chase RS 2099 (CR) Nat. Herb. Hymenachne amplexicaulis (Rudge) Nees RO 2307 (CR) Nat. Herb. Hyparrhenia rufa (Nees) Stapf RO 3084 (CR) Natu. Herb. Ichnanthus nemorosus (Sw.) Döll RO 1645 (CR) Nat. Herb. Ichnanthus pallens (Sw.) Munro ex Benth. AT 8636 (CR) Nat. Herb. Imperata contracta (Kunth) Hitchc. RP 9941 (CR) Nat. Herb. Isachne arundinacea (Sw.) Griseb. RO 2492 (CR) Nat. Herb. Ischaemum timorense Kunth RO 3086 (CR) Natu. Herb. Ixophorus unisetus (J. Presl) Schltdl. RP 9993 (CR) Nat. Herb. Lasiacis divaricata (L.) Hitchc. AT 8527 (CR) Nat. Herb. Lasiacis nigra Davidse JJC 2036 (CR) Nat. Herb. Lasiacis oaxacensis (Steud.) Hitchc. WB 10405 (CR) Nat. Herb. Lasiacis scabrior Hitchc. UC 1943 (CR-INB) Nat. Herb. Lasiacis sloanei (Griseb.) Hitchc. RP 11123 (CR) Nat. Herb. Lasiacis sorghoidea (Desv. ex Ham.) Hitchc. & Chase AT 9213 (CR) Nat. Herb. Lasiacis standleyi Hitchc. AT 9500 (CR) Nat. Herb. Leptochloa virgata (L.) P. Beauv. RP 13197 (CR) Nat. Herb. Lithachne pauciflora (Sw.) P. Beauv. RP 11106 (CR) Nat. Herb. Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs AT 9114 (CR) Nat. Herb. Ocellochloa stolonifera (Poir.) Zuloaga & Morrone RP 13188 (CR) Nat. Herb. Olyra latifolia L. AT 9494 (CR) Nat. Herb. Oplismenus burmannii (Retz.) P. Beauv. AT 8637 (CR) Nat. Herb. Oplismenus hirtellus (L.) P. Beauv. LDG 23468 (CR) Nat. Herb. Orthoclada laxa (Rich.) P. Beauv. AT 9210 (CR) Nat. Herb. Oryza latifolia Desv. AT 100 (CR) Nat. Herb. Oryza sativa L. RO 2846 (CR) Intr. Herb. Panicum grande Hitchc. & Chase RP 13718 (CR) Nat. Herb. Panicum laxum Sw. RO 3085 (CR) Nat. Herb. Panicum pilosum Sw. AT 9495 (CR) Nat. Herb. Panicum polygonatum Schrad. AT 8557 (CR) Nat. Herb. Panicum trichanthum Nees AT 8600 (CR) Nat. Herb. Panicum trichoides Sw. RO 1971 (CR) Nat. Herb. Pariana parvispica R. W. Pohl MG 4303 (CR) End. Herb. Paspalum conjugatum P. J. Bergius RP 9945 (CR) Nat. Herb. Paspalum fasciculatum Willd. ex Flügge RP 11108 (CR) Nat. Herb. Paspalum microstachyum J. Presl RO 3158 (CR) Nat. Herb. Paspalum minus E. Fourn. EWL 5535 (CR) Nat. Herb. Paspalum notatum Flügge RP 9968 (CR) Nat. Herb. Paspalum orbiculatum Poir. RO 1993 (CR) Nat. Herb. Paspalum paniculatum L. AT 9496 (CR) Nat. Herb. 152 Paspalum pilosum Lam. JS 342 (CR) Nat. Herb. Paspalum plicatulum Michx. RP 11104 (CR) Nat. Herb. Paspalum saccharoides Nees ex Trin. RO 1678 (CR) Nat. Herb. Paspalum setaceum Michx. RP 9970 (CR) Nat. Herb. Paspalum standleyi Chase EWL 5534 (CR) Nat. Herb. Paspalum vaginatum Sw. HP 4210 (CR) Nat. Herb. Paspalum virgatum L. AT 8691 (CR) Nat. Herb. Pennisetum purpureum Schumach. RO 2171 (CR) Natu. Herb. Pharus lappulaceus Aubl. JFM 7707 (CR-INB) Nat. Herb. Pharus latifolius L. RP 11095 (CR) Nat. Herb. Pharus virescens Döll AT 9207 (CR) Nat. Herb. Pharus vittatus Lem. AT 9552 (CR) Nat. Herb. Phragmites australis (Cav.) Trin. ex Steud. JGL 3989 (CR) Nat. Herb. Pseudechinolaena polystachya (Kunth) Stapf RP 13189 (CR) Nat. Herb. Rhynchelytrum repens (Willd.) C. E. Hubb. AS 30 (CR-INB) Natu. Herb. Rottboellia cochinchinensis (Lour.) Clayton RP 11097 (CR) Natu. Herb. Setaria palmifolia Stapf RP 11101 (CR) Nat. Herb. Setaria parviflora (Poir.) Kerguélen AT 9215 (CR) Nat. Herb. Setaria vulpiseta (Lam.) Roem. & Schult. AMO 146 (CR-INB) Nat. Herb. Sorghum bicolor (L.) Moench RH 83100 (CR) Intr. Herb. Sorghum halepense (L.) Pers. RP 11087 (CR) Intr. Herb. Spartina spartinae (Trin.) Merr. ex Hitchc. HP 4209 (CR) Nat. Excl. Herb. Sporobolus jacquemontii Kunth JGL 5559 (CR) Nat. Herb. Sporobolus tenuissimus (Mart. ex Schrank) Kuntze RO 1789 (CR) Nat. Herb. Sporobolus virginicus (L.) Kunth RP 9942 (CR) Nat. Herb. Stenotaphrum secundatum (Walter) Kuntze RP 13203 (CR) Nat. Herb. Streptochaeta sodiroana Hack. WB 10305 (CR) Nat. Herb. Triplasis purpurea (Walter) Chapm. RP 10010 (CR) Nat. Excl. Herb. Uniola pittieri Hack. RP 11084 (CR) Nat. Herb. Urochloa fusca (Sw.) B. F. Hansen & Wunderlin RO 1779 (CR) Natu. Herb. Urochloa mutica (Forssk.) T. Q. Nguyen RO 1572 (CR) Nat. Herb. Pontederiaceae Eichhornia crassipes (Mart.) Solms RS s/n (CR) Natu. Herb. Heteranthera reniformis Ruíz & Pav. JG 1547 (CR-INB) Nat. Herb. Pontederia sagittata C. Presl JGL 10012 (CR) Nat. Herb. Potamogetonaceae Potamogeton crispus L. AL 1254 (CR) Natu. Herb. 153 Smilacaceae Smilax domingensis Willd. AT 9242 (CR) Nat. Bej. Smilax mollis Humb. & Bonpl. ex Willd. ARG 1912 (CR-INB) Smilax panamensis Morong RMA 24 (CR) Nat. Bej. Smilax spinosa Mill. WA 3216 (CR) Nat. Bej. Smilax vanilliodora F. W. Apt AT 9516 (CR) Nat. Bej. Nat. Bej. Typhaceae Typha domingensis Pers. RB 177 (CR) Nat. Herb. Zingiberaceae Alpinia purpurata (Vieill.) K. Schum. K 1201 (CR) Intr. Herb. Hedychium coronarium J. König RH 83113 (CR) Natu. Herb. Kaempferia rotunda L. MG 8256 (CR-INB) Intr. Herb. Renealmia alpinia (Rottb.) Maas AT 9436 (CR) Nat. Herb. Renealmia cernua (Sw. ex Roem. & Schult.) J. F. Macbr. AT 9238 (CR) Nat. Herb. Renealmia concinna Standl. JS 2410 (CR) Nat. Herb. Renealmia costaricensis Standl. MG 4488 (CR) Nat. Herb. Renealmia foliifera Standl. * DSn 6810 (INB) Nat. Herb. Renealmia lucida Maas * RR 2715 (CR) Nat. Herb. Renealmia mexicana Klotzsch ex Petersen HK 3792 (CR) Nat. Herb. Renealmia pluriplicata Maas AC 555 (CR) Nat. Herb. Renealmia scaposa Maas * GH 2714 (CR) End. Herb. Zingiber officinale Roscoe RO 2848 (CR) Intr. Herb. DICOTILEDONEAE Acanthaceae Aphelandra aurantiaca (Scheidw.) Lindl. UC 1904 (CR-INB) Nat. Herb. Aphelandra campanensis Durkee JGL 9496 (CR) Nat. Arbu. Aphelandra dolichantha Donn. Sm. * AE 5200 (CR) Nat. Herb. Aphelandra golfodulcensis McDade JJC 2050 (CR) Nat. Arbu. Aphelandra seibertii Leonard AT 9384 (CR) Nat. Excl. Herb. Aphelandra sinclairiana Nees AT 9302 (CR) Nat. Arbu. Asystasia gangetica (L.) T. Anderson K 1217 (CR) Natu. Herb. Avicennia germinans (L.) L. RS s/n (CR) Nat. arb. Chamaeranthemum tonduzii Lindau AT 8567 (CR) End. Herb. Graptophyllum pictum (L.) Griff. BH 24711 (INB) Intr. Herb. Hemigraphis alternata (Burm. f.) T. Anderson RK 448 (INB) Intr. Herb. Herpetacanthus panamensis Leonard CS 810 (CR) Nat. Herb. Herpetacanthus stenophyllus Gómez-Laur. & Grayum OV 1147 (CR) End. Excl. Arbu. Justicia almedae T. F. Daniel TFD 6228 (CR) End. Excl. Herb. Justicia betonica L. JS 2365 (CR) Nat. Arbu. Justicia chamaephyton D. N. Gibson AT 9553 (CR) Nat. Herb. 154 Justicia comata (L.) Lam. AT 9304 (CR) Nat. Herb. Justicia crenata (Leonard) Durkee AC 530 (CR) Nat. Arbu. Justicia densibracteata Durkee & McDade * DS 4922 (CR-INB) End. Arbu. Justicia metallica Lindau GH 7575 (CR) Nat. Herb. Justicia parvibracteata Leonard DS 991 (CR-INB) End. Herb. Justicia pittieri Lindau HP 8642 (CR) Nat. Herb. Justicia refractifolia (Kuntze) Leonard WB 10951 (CR) Nat. Herb. Justicia tonduzii Lindau JGL 9523 (CR) End. Herb. Justicia trichotoma (Kuntze) Leonard GG 58 (CR-INB) Nat. Arbu. Louteridium costaricense Radlk. & Donn. Sm. ARB 1934 (CR) Nat. Arbu. Mendoncia gracilis Turrill JS 2531 (CR) Nat. Bej. Mendoncia retusa Turrill ARG 3542 (CR-INB) Nat. Bej. Odontonema callistachyum (Schltr. & Cham.) Kuntze AT 8508 (CR) Nat. Herb. Razisea spicata Oerst. JGL 8756 (CR) Nat. Arbu. Razisea wilburii McDade AF 1414 (CR-INB) End. Arbu. Ruellia biolleyi Lindau QJ 784 (CR-INB) Nat. Herb. Ruellia blechum L. AT 9303 (CR) Nat. Herb. Ruellia cooperi Leonard AT 9297 (CR) Nat. Herb. Ruellia malacosperma Greenm. RS 2108 (CR) Intr. Herb. Ruellia metallica Leonard RS 821 (CR) Nat. Herb. Ruellia nudiflora (Engelm. & A. Gray) Urb. GC 475 (INB) Nat. Herb. Ruellia pittieri Lindau AS 42 (INB) Nat. Herb. Ruellia praeclara Standl. GH 2372 (CR-INB) Nat. Arbu. Ruellia tonduzii Lindau GH 7655 (CR) Nat. Herb. Ruellia tubiflora Kunth AT 9296 (CR) Nat. Arbu. Stenostephanus silvaticus (Nees) T. F. Daniel AE 376 (CR-INB) Nat. Arbu. Streblacanthus monospermus Kuntze AM 9 (CR-INB) End. Excl. Herb. Thunbergia fragrans Roxb. MG 5258 (CR) Intr. Bej. Achariaceae Carpotroche platyptera Pittier EA 2078 (CR-INB) Nat. arb. Actinidiaceae Saurauia rubiformis Vatke DS 3592 (INB) Nat. arb. Saurauia yasicae Loes. JU 682 (CR) Nat. arb. Aizoaceae Sesuvium portulacastrum (L.) L. JGL 8699 (CR) Nat. Herb. GH 2713 (CR) Nat. Arb. Alzateaceae Alzatea verticillata Ruíz & Pav. * 155 Amaranthaceae Achyranthes aspera L. HP 4295 (CR) Nat. Herb. Alternanthera costaricensis Kuntze AE 5736 (CR) Nat. Herb. Alternanthera laguroides (Standl.) Standl. AT 8634 (CR) Nat. Herb. Alternanthera tenella Colla JG 2252 (INB) Nat. Herb. Amaranthus dubius Mart. ex Thell. JG 504 (INB) Nat. Herb. Amaranthus spinosus L. LG 1970 (CR-INB) Nat. Herb. Blutaparon vermiculare (L.) Mears HP 12692 (CR) Nat. Herb. Chamissoa altissima (Jacq.) Kunth AT 9288 (CR) Nat. Herb. Cyathula achyranthoides (Kunth) Moq. ARG 2299 (CR-INB) Nat. Herb. Cyathula prostrata (L.) Blume LDV 3847 (CR-INB) Nat. Herb. Iresine diffusa Humb. & Bonpl. ex Willd. AT 8635 (CR) Nat. Herb. Pleuropetalum pleiogynum (Kuntze) Standl. LA 1899 (CR-INB) Nat. Arbu. Pleuropetalum sprucei (Hook. f.) Standl. * ARG 11651 (CR-INB) Nat. Arbu. Anacardiaceae Anacardium excelsum (Bertero & Balb. ex Kunth) Skeels AE 4933 (CR) Anacardium occidentale L. RO 1900 (CR) Intr. Arb. Campnosperma panamense Standl. OV 1135 (CR) Nat. arb. Mangifera indica L. AE s/n () Intr. Arb. Spondias dulcis Parkinson SL 3025 (CR) Intr. Arb. Spondias mombin L. WH 11 (CR) Nat. arb. Tapirira guianensis Aubl. AE (Obs.) Nat. arb. Nat. arb. Annonaceae Anaxagorea crassipetala Hemsl. JG 1540 (CR-INB) Nat. arb. Anaxagorea panamensis Standl. ARG 1014 (CR-INB) Nat. Arbu. Anaxagorea phaeocarpa Mart. JS 2212 (CR) Nat. arb. Annona amazonica R. E. Fr. AE 5234 (CR) Nat. arb. Annona glabra L. AE 5377 (CR) Nat. arb. Annona mucosa Jacq. JG 1880 (CR-INB) Nat. arb. Annona muricata L. MG 10027 (CR-INB) Intr. Arb. Annona papilionella (Diels) H. Rainer WH 49 (CR) Nat. arb. Annona pittieri Donn. Sm. GC 305 (CR-INB) Nat. arb. Annona reticulata L. RO 2308 (CR) Nat. arb. Annona volubilis Lundell GC 225 (CR-INB) Nat. Bej. Cananga odorata (Lam.) Hook. f. & Thomson ARG 2256 (CR-INB) Intr. Arb. Cymbopetalum costaricense (Donn. Sm.) Saff. AC 557 (CR) Nat. arb. Desmopsis heteropetala R. E. Fr. AE 415 (CR-INB) End. arb. Desmopsis microcarpa R. E. Fr. OV 1146 (CR) Nat. Arbu. Desmopsis panamensis (B. L. Rob.) Saff. JGL 8809 (CR) Nat. arb. Desmopsis schippii Standl. NZ 4868 (INB) Nat. Arbu. 156 Duguetia panamensis Standl. MG 4484 (CR) Nat. arb. Guatteria aeruginosa Standl. AM 70 (CR-INB) Nat. arb. Guatteria amplifolia Triana & Planch. OV 1219 (CR) Nat. arb. Guatteria diospyroides Baill. RS 823 (CR) Nat. arb. Guatteria dolichopoda Donn. Sm. HP 9166 (CR) Nat. arb. Guatteria elegantissima R. E. Fr. * GH 2701 (CR) Nat. Arb. Guatteria lucens Standl. ARG 687 (CR-INB) Nat. arb. Mosannona costaricensis (R. E. Fr.) Chatrou GES 1111 (CR) End. arb. Rollinia danforthii Standl. WA 2584 (CR) Nat. arb. Sapranthus viridiflorus G. E. Schatz MG 4503 (CR) Nat. arb. Stenanona panamensis Standl. OV 1142 (CR) Nat. arb. Unonopsis bullata Maas & G. E. Schatz ARG 636 (INB) Nat. arb. Unonopsis hammelii G. E. Schatz & Maas NZ 4899 (INB) End. arb. Unonopsis storkii Standl. & L. O. Williams OV 1222 (CR) Nat. arb. Xylopia bocatorena Schery OV 1126 (CR) Nat. arb. Xylopia sericophylla Standl. & L. O. Williams LA 2095 (INB) Nat. arb. Apiaceae Eryngium foetidum L. MBG 718 (CR) Nat. Herb. Hydrocotyle ranunculoides L. f. AE (Obs.) Nat. Herb. Apocynaceae Allamanda cathartica L. OV 1260 (CR) Intr. Bej. Asclepias curassavica L. RO 1742 (CR) Nat. Herb. Aspidosperma excelsum Benth. BH 17510 (INB) Nat. arb. Aspidosperma spruceanum Benth. ex Müll. Arg. AE (Obs.) Nat. arb. Catharanthus roseus (L.) G. Don MG 10039 (INB) Intr. Herb. Fischeria panamensis Spellman AE 393 (CR-INB) Nat. Bej. Gonolobus albomarginatus (Pittier) Woodson AE 4736 (CR) Nat. Bej. Lacmellea panamensis (Woodson) Markgr. JG 2817 (CR-INB) Nat. arb. Macoubea mesoamericana J. F. Morales BH 17516 (CR-INB) Nat. arb. Macropharynx renteriae A. H. Gentry JFM 8000 (CR-INB) Nat. Bej. Malouetia guatemalensis (Müll. Arg.) Standl. OV 1216 (CR) Nat. arb. Mandevilla hirsuta (A. Rich.) K. Schum. GG 8 (INB) Nat. Bej. Mesechites trifidus (Jacq.) Müll. Arg. GC 306 (INB) Nat. Bej. Odontadenia macrantha (Roem. & Schult.) Markgr. AE 4934 (CR) Nat. Bej. Odontadenia verrucosa (Willd. ex Roem. & Schult.) K. Schum. ex Markgr. JFM 4926 (INB) Nat. Bej. Prestonia longifolia (Sessé & Moc.) J. F. Morales JS 2360 (CR) Nat. Bej. Prestonia portobellensis (Beurl.) Woodson AE 2504 (CR) Nat. Bej. Prestonia riverae J. F. Morales JFM 7748 (INB) End. Bej. Rauvolfia aphlebia (Standl.) A. H. Gentry HP 14034 (CR) Nat. arb. 157 Rhabdadenia biflora (Jacq.) Müll. Arg. LA 2202 (CR-INB) Nat. Arbu. Sarcostemma clausum (Jacq.) Schult. AT 8661 (CR) Nat. Bej. Stemmadenia alfaroi (Donn. Sm.) Woodson DS 3587 (CR-INB) Nat. arb. Stemmadenia donnell-smithii (Rose) Woodson AMO 117 (CR-INB) Nat. arb. Stemmadenia robinsonii Woodson HP 8617 (CR) Nat. Arbu. Tabernaemontana alba Mill. RA 4670 (CR-INB) Nat. arb. Tabernaemontana amygdalifolia Jacq. * AE 5146 (CR) Nat. Arb. Tabernaemontana arborea Rose ex Donn. Sm. AF 1427 (CR-INB) Nat. arb. Tabernaemontana longipes Donn. Sm. AE (obs.) Nat. arb. Tassadia obovata Decne. MG 5775 (CR) Nat. Bej. Thevetia ahouai (L.) A. DC. AT 9770 (CR) Nat. Arbu. Thevetia peruviana (Pers.) K. Schum. RR 3128 (INB) Intr. Arb. Aquifoliaceae Ilex guianensis (Aubl.) Kuntze GH 7692 (CR) Nat. arb. Ilex maxima W. J. Hahn AE 5235 (CR) Nat. arb. Ilex paraguariensis A. St.-Hil. AE 5482 (CR) Intr. Arb. Ilex skutchii Edwin ex T. R. Dudley & T. R. Dudley AE 4809 (CR) Nat. arb. Araliaceae Dendropanax arboreus (L.) Decne. & Planch. AT 8512 (CR) Nat. arb. Dendropanax globosus M. J. Cannon & Cannon * GH 2616 (INB) Nat. Arb. Dendropanax gonatopodus (Donn. Sm.) A. C. Sm. AE 387 (CR-INB) Nat. arb. Dendropanax oliganthus (A. C. Sm.) A. C. Sm. ARG 4914 (INB) Nat. arb. Hydrocotyle mexicana Schltdl. & Cham. JBE 56 (CR) Nat. Herb. Oreopanax capitatus (Jacq.) Decne. & Planch. ARG 575 (CR-INB) Nat. Arbu. Schefflera nicaraguensis (Standl.) A. C. Sm. JFM 4933 (INB) Nat. arb. Schefflera systyla (Donn. Sm.) R. Vig. * RR 2687 (CR) Nat. Arbu. ep. Aristolochiaceae Aristolochia cordiflora Mutis ex Kunth GH 3066 (CR-INB) Nat. Bej. Aristolochia gorgona M.A. Blanco GC 246 (INB) Nat. Bej. Aristolochia odoratissima L. HP 16039 (CR) Nat. Bej. Aristolochia pilosa Kunth MQ 640 (CR) Nat. Bej. Aristolochia sprucei Mast. AT 9373 (CR) Nat. Bej. Aristolochia tonduzii O. C. Schmidt HP 9286 (CR) Nat. Bej. Aristolochia trilobata L. OV 1293 (CR) Nat. Bej. Asteraceae Adenostemma platyphyllum Cass. GC 286 (CR-INB) Nat. Herb. Ageratina badia (Klatt) R. M. King & H. Rob. AT 8685 (CR) Nat. Herb. Ayapana elata (Steetz) R. M. King & H. Rob. AT 9313 (CR) Nat. Herb. Baccharis pedunculata (Mill.) Cabrera * DSn 6541 (CR) Nat. Herb. 158 Bidens pilosa L. AT 8724 (CR) Nat. Herb. Bidens reptans (L.) G. Don WH 156 (CR) Nat. Bej. Calea jamaicensis (L.) L. MQ 1040 (CR) Nat. Arbu. Chaptalia nutans (L.) Pol. GG 74 (CR-INB) Nat. Herb. Chromolaena odorata (Lam.) R. M. King & H. Rob. AT 8647 (CR) Nat. Herb. Clibadium eggersii Hieron. KB 3512 (CR) Nat. Arbu. Clibadium glomeratum Greenm. LA 1875 (CR-INB) Nat. Arbu. Clibadium grandifolium S. F. Blake GG 213 (CR-INB) Nat. Arbu. Clibadium surinamense L. JRG 92-01956 (CR) Nat. Arbu. Clibadium sylvestre Aubl. JG 1662 (CR-INB) Nat. Herb. Conyza bonariensis (L.) Cronquist GG 196 (INB) Nat. Herb. Conyza canadensis (L.) Cronquist RO 1743 (CR) Nat. Herb. Cosmos caudatus Kunth WB 10407 (CR) Nat. Herb. Crassocephalum crepidioides (Benth.) S. Moore DS 1310 (CR-INB) Nat. Herb. Critonia morifolia (Mill.) R. M. King & H. Rob. AT 9571 (CR) Nat. Arbu. Cyanthillium cinereum (L.) H. Rob. RH 83-105 (CR) Nat. Herb. Dresslerothamnus angustiradiatus (T.M. Barkley) H. Rob. MG 9648 (CR-INB) Nat. Excl. Bej. Eclipta prostrata (L.) L. RS sn (CR) Nat. Herb. Eirmocephala brachiata (Benth.) H. Rob. AT 75461 (CR) Nat. Arbu. Eleutheranthera ruderalis (Sw.) Sch. Bip. ARG 11154 (INB) Nat. Herb. Emilia fosbergii Nicolson WB 10512 (CR) Nat. Herb. Emilia sonchifolia (L.) DC. JGL 6050 (CR) Nat. Herb. Erechtites hieraciifolius (L.) Raf. ex DC. AT 9139 (CR) Nat. Herb. Fleischmannia imitans (B.L. Rob.) R. M. King & H. Rob. * DS 4900 (INB) Nat. Herb. Fleischmannia microstemon (Cass.) R. M. King & H. Rob. WB 10899 (CR) Nat. Herb. Fleischmannia pycnocephala (Less.) R. M. King & H. Rob. AT 8698 (CR) Nat. Herb. Fleischmannia sideritidis (Benth.) R. M. King & Rob. ARG 2293 (CR-INB) Nat. Herb. Garcilassa rivularis Poepp. & Endl. AT 8559 (CR) Nat. Herb. Hebeclinium macrophyllum (L.) DC. AT 8603 (CR) Nat. Herb. Heterocondylus vitalbae (DC.) R. M. King & H. Rob. AT 8611 (CR) Nat. Herb. Ichthyothere scandens S. F. Blake * GH 2578 (INB) Nat. Herb. Koanophyllon hylonoma (B. L. Rob.) R. M. King & H. Rob. LA 1952 (CR-INB) Nat. Arbu. Koanophyllon pittieri (Klatt) R. M. King & H. Rob. AT 8516 (CR) Nat. arb. Lagascea mollis Cav. ARG 2652 (CR-INB) Nat. Herb. Lasianthaea fruticosa (L.) K. M. Becker AT 9314 (CR) Nat. Arbu. Liabum bourgeaui Hieron. GH 2506 (INB) Nat. Herb. Melanthera nivea (L.) Small JGL 10199 (CR) Nat. Herb. Mikania banisteriae DC. LA 2061 (INB) Nat. Bej. Mikania guaco Humb. & Bonpl. LA 2863 (CR-INB) Nat. Bej. Mikania hookeriana DC. AE 4806 (CR) Nat. Bej. Mikania houstoniana (L.) B. L. Rob. AT 9316 (CR) Nat. Arbu. Mikania micrantha Kunth PZ 2629 (CR) Nat. Bej. 159 Mikania vitifolia DC. AT 8534 (CR) Nat. Bej. Neomirandea araliifolia (Less.) R. M. King & H. Rob. GH 2428 (CR-INB) Nat. Arbu. ep. Neurolaena lobata R. Br. AT 95680 (CR) Nat. Arbu. Pectis diffusa Hook. & Arn. RO 2866 (CR) Nat. Herb. Pectis prostrata Cav. ARG 2280 (CR-INB) Nat. Herb. Porophyllum ruderale (Jacq.) Cass. GH 2442 (CR-INB) Nat. Herb. Pseudelephantopus spicatus (Juss.) Vahl LP 3272 (CR) Nat. Herb. Pseudelephantopus spiralis (Less.) Cronquist LP s/n (CR) Nat. Herb. Salmea scandens (L.) DC. HP 9566 (CR) Nat. Arbu. Schistocarpha eupatorioides (Fenzl) Kuntze RO 2303 (CR) Nat. Herb. Sciadocephala dressleri R. M. King & H. Rob. QJ 1835 (CR-INB) Nat. Excl. Herb. Sinclairia polyantha (Klatt) Rydb. AE (Obs.) Nat. Arbu. Sphagneticola trilobata (L.) Pruski AT 8750 (CR) Nat. Herb. Spilanthes urens Jacq. K 1180 (CR) Nat. Herb. Struchium sparganophorum (L.) Kuntze GH 7639 (CR) Nat. Herb. Synedrella nodiflora (L.) Gaertn. ARG 2311 (CR-INB) Nat. Herb. Tagetes erecta L. DSn 6437 (INB) Nat. Herb. Tessaria integrifolia Ruíz & Pav. FA 3241 (CR) Nat. Arbu. Tithonia diversifolia (Hemsl.) A. Gray AMO 120 (INB) Nat. Herb. Tridax procumbens L. DMP 1131 (CR) Nat. Herb. Tuxtla pittieri (Greenm.) Villaseñor & Strother HP 9565 (CR) Nat. Bej. Vernonia patens Kunth AT 8650 (CR) Nat. Arbu. Zexmenia virgulta Klatt AT 9569 (CR) Nat. Arbu. Balanophoraceae Helosis cayennensis (Sw.) Spreng. * GH 2519 (CR) Nat. Herb. Begoniaceae Begonia carletonii Standl. RB 062879 (CR) Nat. Herb. Begonia convallariodora C. DC. * RR 2730 (CR) Nat. Herb. Begonia corredorana C. DC. AE 4816 (CR) Nat. Herb. Begonia fischeri Schrank AE (Obs.) Nat. Herb. Begonia glabra Aubl. AT 8520 (CR) Nat. Herb. Begonia hirsuta Aubl. ARB 1954 (CR) Nat. Herb. Begonia multinervia Liebm. LA 1914 (INB) Nat. Herb. Begonia semiovata Liebm. AT 9588 (CR) Nat. Herb. Begonia sericoneura Liebm. RO 1727 (CR) Nat. Herb. Bignoniaceae Amphitecna isthmica (A. H. Gentry) A. H. Gentry JGL 9530 (CR) Nat. arb. Amphitecna kennedyae (A. H. Gentry) A. H. Gentry ARG 1009 (CR-INB) Nat. arb. Amphitecna latifolia (Mill.) A. H. Gentry HP 16004 (CR) Nat. arb. 160 Anemopaegma chrysoleucum (Kunth) Sandwith SL 2956 (CR) Nat. Bej. Arrabidaea florida DC. JGL 9540 (CR) Nat. Bej. Arrabidaea verrucosa (Standl.) A. H. Gentry AHG 1320 (CR) Nat. Bej. Callichlamys latifolia (Rich.) K. Schum. AHG 1313 (CR) Nat. Bej. Clytostoma binatum (Thunb.) Sandwith AE 5774 (CR) Nat. Bej. Crescentia cujete L. AE 542 (CR) Nat. arb. Cydista aequinoctialis (L.) Miers HP 16105 (CR) Nat. Bej. Jacaranda copaia (Aubl.) D. Don RO 3550 (CR) Nat. arb. Lundia corymbifera (Vahl) Sandwith GG 179 (CR-INB) Nat. Bej. Macfadyena uncata (Andrews) Sprague & Sandwith ARG 2235 (CR-INB) Nat. Bej. Mansoa kerere (Aubl.) A. H. Gentry MG 4411 (CR) Nat. Bej. Mansoa standleyi (Steyerm.) A. H. Gentry RO 3552 (CR) Nat. Bej. Martinella obovata (Kunth) Bureau & K. Schum. ARG 4902 (INB) Nat. Bej. Paragonia pyramidata (Rich.) Bureau KB 3599 (CR) Nat. Bej. Parmentiera macrophylla Standl. ARG 605 (CR-INB) Nat. arb. Stizophyllum inaequilaterum Bureau & K. Schum. JFM 7762 (CR-INB) Nat. Bej. Stizophyllum riparium (Kunth) Sandwith ARG 2236 (CR-INB) Nat. Bej. Tabebuia rosea (Bertol.) DC. AE (obs.) Nat. arb. Tanaecium jaroba Sw. JFM 7959 (CR-INB) Nat. Bej. Tynanthus macranthus L. O. Williams KB 198085 (CR) Nat. Arbu. Bixaceae Bixa orellana L. RO 3656 (CR) Natu. arb. Bixa urucurana Willd. BH 18115 (CR-INB) Nat. arb. Boraginaceae Bourreria mollis Standl. UC 1911 (CR-INB) Nat. arb. Cordia alliodora (Ruíz & Pav.) Oken WH 18 (CR) Nat. arb. Cordia collococca L. JG 1726 (CR-INB) Nat. arb. Cordia cymosa (Donn. Sm.) Standl. AE 5575 (CR) Nat. arb. Cordia diversifolia Pav. ex A. DC. MBG 691 (CR) Nat. arb. Cordia dwyeri Nowicke AE 4815 (CR) Nat. arb. Cordia eriostigma Pittier AE 5765 (CR) Nat. arb. Cordia lucidula I. M. Johnst. MG 4514 (CR) Nat. arb. Cordia megalantha S. F. Blake AE 5218 (CR) Nat. arb. Cordia porcata Nowicke ARG 2262 (CR-INB) Nat. arb. Tournefortia angustiflora Ruíz & Pav. JGL 12177 (CR) Nat. Arbu. Tournefortia bicolor Sw. AE 2506 (CR) Nat. Arbu. Tournefortia cuspidata Kunth MG 5819 () Nat. Arbu. Tournefortia glabra L. AKM 6558 (INB) Nat. Arbu. Tournefortia hirsutissima L. AT 9321 (CR) Nat. Arbu. Tournefortia latisepala Nowicke EA 2135 (INB) Nat. Bej. 161 Tournefortia maculata Jacq. JBE 37 (CR) Nat. Bej. Varronia curassavica Jacq. AE 2507 (CR) Nat. Arbu. Varronia spinescens (L.) Borhidi AT 9291 (CR) Nat. Arbu. Brassicaceae Nasturtium officinale R. Br. ARG 611 (INB) Natu. Herb. Burseraceae Bursera simaruba (L.) Sarg. AE 544 (CR) Nat. arb. Protium confusum (Rose) Pittier JS 2304 (CR) Nat. arb. Protium costaricense (Rose) Engl. JBE 65 (CR) Nat. arb. Protium glabrum (Rose) Engl. AC 401 (CR) Nat. arb. Protium panamense (Rose) I. M. Johnst. WA 3280 (CR) Nat. arb. Protium pittieri (Rose) Engl. WB 10923 (CR) Nat. arb. Protium ravenii D. M. Porter AE 4799 (CR) Nat. arb. Tetragastris panamensis (Engl.) Kuntze AF 475 (CR-INB) Nat. arb. Trattinnickia aspera (Standl.) Swart RO 3662 (CR) Nat. arb. Cactaceae Epiphyllum phyllanthus (L.) Haw. RO 3691 (CR) Nat. Herb. ep. Epiphyllum phyllanthus subsp. hookeri (Haw.) U. Guzmán UC 1930 (CR-INB) Nat. Herb. ep. Epiphyllum thomasianum (K. Schum.) Britton & Rose AE 5547 (CR) Nat. Herb. ep. Hylocereus calcaratus (F. A. C. Weber) Britton & Rose CKH 9 (INB) End. Herb. ep. Hylocereus stenopterus (F. A. C. Weber) Britton & Rose RB 149 (CR) Nat. Herb. ep. Pereskia lychnidiflora DC. DMA 1 (CR) Nat. Arbu. Rhipsalis baccifera (J. S. Muell.) Stearn HP 9259 (CR) Nat. Herb. Weberocereus trichophorus H. Johnson & Kimnach GH 7623 (CR) End. Excl. Herb. ep. Weberocereus tunilla (F. A. C. Weber) Britton & Rose RS 800 (CR) Nat. Herb. Calophyllaceae Calophyllum brasiliense Cambess. BH 24885 (INB) Nat. arb. Calophyllum inophyllum L. AE 5436 (CR) Natu. arb. Mammea americana L. LA 2827 (CR-INB) Intr. Arb. Campanulaceae Burmeistera cyclostigmata Donn. Sm. JBE 36 (CR) Nat. Herb. ep. Burmeistera microphylla Donn. Sm. MG 9647 (INB) Nat. Herb. Burmeistera vulgaris E. Wimm. * GH 2717 (CR) Nat. Herb. ep. Centropogon coccineus (Hook.) Regel ex B. D. Jacks. DS 142 (CR-INB) Centropogon granulosus C. Presl WB 10482 (CR) Nat. Herb. Centropogon palmanus (Donn. Sm.) E. Wimm. * ARG 11405 (CR-INB) Hippobroma longiflora (L.) G. Don RH 83088 (CR) Natu. Herb. Nat. Herb. End. Herb. 162 Cannabaceae Cannabis sativa L. GC 409 (CR-INB) Intr. Herb. Celtis iguanaea (Jacq.) Sarg. GG 154 (CR-INB) Nat. arb. Celtis schippii Standl. AE 5222 (CR) Nat. arb. Trema integerrima (Beurl.) Standl. AE (Obs.) Nat. arb. Trema micrantha (L.) Blume AQ 3314 (CR) Nat. arb. Capparaceae Caphexandra heydeana (Donn. Sm.) H. H. Iltis & Cornejo AT 8528 (CR) Nat. Arbu. Capparidastrum discolor (Donn. Sm.) Cornejo & Iltis JG 1536 (INB) Nat. arb. Capparidastrum mollicellum (Standl.) X. Cornejo & H. H. Iltis JGL 11962 (CR-INB) Nat. arb. Crateva tapia L. JGL 9551 (CR) Nat. arb. Forchhammeria trifoliata Radlk. ARG 865 (CR-INB) Nat. arb. Preslianthus pittieri (Standl.) H. H. Iltis & Cornejo QJ 787 (CR-INB) Nat. arb. Quadrella filipes (Donn. Sm.) H. H. Iltis & Cornejo BH 18142 (CR-INB) Nat. Arbu. Caricaceae Carica cauliflora Jacq. AE 5064 (CR) Nat. Arbu. Carica papaya L. WB 10508 (CR) Nat. arb. Jacaratia dolichaula (Donn. Sm.) Woodson FL 62 (CR) Nat. arb. Jacaratia spinosa (Aubl.) A. DC. LA 2105 (CR-INB) Nat. arb. Caryophyllaceae Drymaria cordata (L.) Willd. ex Schult. AT s/n (CR) Nat. Herb. Celastraceae Cheiloclinium cognatum (Miers) A. C. Sm. JFM 7736 (CR-INB) Nat. arb. Crossopetalum parviflorum (Hemsl.) Lundell ARG 2285 (CR-INB) Nat. Arbu. Elachyptera floribunda (Benth.) A. C. Sm. RS 831 (CR) Nat. Bej. Hippocratea volubilis L. JGL 10190 (CR) Nat. Arbu. Maytenus guyanensis Klotzsch AE (Obs.) Nat. arb. Peritassa pruinosa (Seem.) A. C. Sm. * GH 2689 (CR) Nat. Bej. Salacia multiflora (Lam.) DC. * GH 2627 (INB) Nat. Bej. Tontelea hondurensis A. C. Sm. GH 7665 (CR) Nat. Bej. Ceratophyllaceae Ceratophyllum sp. RS s/n (CR) Nat. Herb. Chloranthaceae Hedyosmum brenesii Standl. AM 28 (CR-INB) Nat. Arbu. Hedyosmum costaricense C. E. Wood ex W. C. Burger * DSn 6619 (CR) Hedyosmum goudotianum Solms AQ 3309 (CR) Nat. arb. Nat. Arbu. 163 Chrysobalanaceae Chrysobalanus icaco L. AT s/n (CR) Nat. Arbu. Hirtella guatemalensis Standl. JGL 13205 (CR) Nat. arb. Hirtella racemosa Lam. AE 390 (INB) Nat. arb. Hirtella triandra Sw. AT s/n (CR) Nat. arb. Licania belloi Prance GH 7548 (CR) Nat. arb. Licania platypus (Hemsl.) Fritsch RO 2593 (CR) Nat. arb. Maranthes panamensis (Standl.) Prance & F. White AE 4895 (CR) Parinari parvifolia Sandwith AE (Obs.) Nat. arb. Nat. arb. Cleomaceae Andinocleome pilosa (Benth.) Iltis RO 2505 (CR) Nat. Herb. Cleoserrata serrata (Jacq.) Iltis MBG 705 (CR) Nat. Herb. Corynandra viscosa (L.) Cochrane & Iltis JEJ 1548 (CR) Nat. Herb. Melidiscus giganteus (L.) Raf. AT 9371 (CR) Nat. Herb. Podandrogyne decipiens (Triana & Planch.) Woodson * GH 2610 (CR-INB) Tarenaya hassleriana (Chodat) Iltis FQ 7 (INB) Nat. Herb. Tarenaya longipes (DC.) Iltis ARG 4584 (CR-INB) Nat. Herb. Nat. Arbu. Clusiaceae Chrysochlamys glauca (Oerst. ex Planch. & Triana) Hemsl. ARG 883 (CR-INB) Nat. arb. Chrysochlamys grandifolia (L. O. Williams) Hammel DS 3598 (CR-INB) Nat. arb. Chrysochlamys nicaraguensis (Oerst., Planch. & Triana) Hemsl. OV 1206 (CR) Nat. arb. Chrysochlamys silvicola (Hammel) Hammel * JS 2382 (CR) Nat. Arbu. Chrysochlamys tenuis Hammel JGL 8839 (CR) Nat. arb. Clusia cooperi Standl. GH 7701 (CR) Nat. arb. Clusia croatii D' Arcy RS 825 (CR) Nat. arb. Clusia cylindrica Hammel JGL 3914 (CR) Nat. arb. Clusia dukei Maguire * RR 2769 (CR-INB) Nat. Arbu. ep Clusia gracilis Standl. GC 359 (CR-INB) Nat. arb. Clusia uvitana Pittier HP 12704 (CR) Nat. arb. Clusia valerioi Standl. JS 2566 (CR) Nat. arb. Dystovomita paniculata (Donn. Sm.) Hammel * GH 2710 (CR) Nat. Arb. Garcinia intermedia (Pittier) Hammel ARG 582 (CR-INB) Nat. arb. Garcinia madruno (Kunth) Hammel JGL 12172 (CR) Nat. arb. Garcinia magnifolia (Pittier) Hammel BH 22315 (INB) Nat. arb. Garcinia mangostana L. AE 5489 (CR) Intr. Arb. Garcinia sp. B. Hammel FL 55 (CR) Nat. arb. Marila laxiflora Rusby AE (Obs.) Nat. arb. Symphonia globulifera L. f. AT s/n (CR) Nat. arb. Tovomita croatii Maguire MG 5276 (CR) Nat. Arbu. Tovomita longifolia (Rich.) Hochr. JG 1866 (CR-INB) Nat. arb. 164 Combretaceae Buchenavia sp. AE 5424 (CR) Nat. arb. Combretum cacoucia Exell QJ 810 (CR-INB) Nat. Bej. Combretum decandrum Jacq. BH 22338 (INB) Nat. Bej. Combretum laxum Jacq. LA 2176 (CR-INB) Nat. Arbu. Conocarpus erectus L. RS s/n (CR) Nat. arb. Laguncularia racemosa (L.) C. F. Gaertn. OV 1272 (CR) Nat. arb. Terminalia buceras (L.) C. Wright AE 5366 (CR) Nat. arb. Terminalia bucidoides Standl. & L. O. Williams RA 4674 (INB) Nat. arb. Terminalia catappa L. NG 1442 (CR) Natu. arb. Terminalia oblonga (Ruíz & Pav.) Steud. AE (obs.) Nat. arb. Connaraceae Connarus costaricensis G. Schellenb. GC 335 (INB) End. Bej. Connarus lambertii (DC.) Sagot ARG 696 (CR-INB) Nat. Arbu. Connarus panamensis Griseb. PS 92 (CR) Nat. Bej. Rourea suerrensis Donn. Sm. HP s/n (CR) Nat. Bej. Convolvulaceae Ipomoea × leucantha Jacq. MG 4410 (CR) Nat. Bej. Ipomoea alba L. GC 268 (INB) Nat. Bej. Ipomoea batatas (L.) Lam. AT s/n (CR) Nat. Bej. Ipomoea batatoides Choisy JG 1657 (INB) Nat. Bej. Ipomoea carnea Jacq. RS 2103 (CR) Nat. Arbu. Ipomoea imperati (Vahl) Griseb. AE 2508 (CR) Nat. Herb. Ipomoea indica (Burm.) Merr. PW 118 (CR) Nat. Bej. Ipomoea mauritiana Jacq. AC 388 (CR) Nat. Bej. Ipomoea pes-caprae (L.) R. Br. HP s/n (CR) Nat. Bej. Ipomoea philomega (Vell.) House MBG 701 (CR) Nat. Bej. Ipomoea quamoclit L. AMC 57 (CR-INB) Nat. Bej. Ipomoea tiliacea (Willd.) Choisy PW 476 (CR) Nat. Bej. Ipomoea variabilis (Schltdl. & Cham.) Choisy JG 3002 (INB) Nat. Bej. Iseia luxurians (Moric.) O'Donell BH 19654 (CR-INB) Nat. Bej. Itzaea sericea (Standl.) Standl. & Steyerm. * JS 2462 (CR) Nat. Bej. Maripa nicaraguensis Hemsl. AT s/n (CR) Nat. Bej. Merremia dissecta (Jacq.) Hallier f. RO 3661 (CR) Nat. Bej. Merremia tuberosa (L.) Rendle GC 333 (CR-INB) Nat. Bej. Merremia umbellata (L.) Hallier f. AE 5767 (CR) Nat. Bej. Cornaceae Nyssa talamancana Hammel & N. Zamora * AE 5405 (CR) Nat. Arb. 165 Crassulaceae Kalanchoe pinnata (Lam.) Pers. PZ 2601 (CR) Natu. Herb. Cucurbitaceae Cayaponia attenuata (Hook. & Arn.) Cogn. AT s/n (CR) Nat. Bej. Cayaponia glandulosa (Poepp. & Endl.) Cogn. RA 4671 (CR-INB) Nat. Bej. Cayaponia macrocalyx Harms AE 4826 (CR) Nat. Bej. Cayaponia racemosa (Mill.) Cogn. RO 3284 (CR) Nat. Bej. Cayaponia sessiliflora Wunderlin AE 5786 (CR) Nat. Bej. Cionosicys guabubu Grayum & J. A. González * AE 5310 (CR) Nat. Bej. Cionosicys macranthus (Pittier) C. Jeffrey AE 5270 (CR) Nat. Bej. Citrullus lanatus (Thunb.) Matsum. & Nakai RB 164 (CR) Nat. Bej. Cucumis melo L. GH 2440 (CR-INB) Intr. Bej. Cyclanthera multifoliola Cogn. AT 8704 (CR) Nat. Bej. Cyclanthera tenuisepala Cogn. AT s/n (CR) Nat. Bej. Elateriopsis oerstedii (Cogn.) Pittier 44 (CR-INB) Nat. Bej. Fevillea cordifolia L. GH 2434 (CR-INB) Nat. Bej. Gurania coccinea Cogn. * GH 2536 (CR) Nat. Bej. Gurania makoyana (Lem.) Cogn. MBG 686 (CR) Nat. Bej. Gurania tubulosa Cogn. AE 4864 (CR) Nat. Bej. Luffa acutangula (L.) Roxb. WB 11015 (CR) Intr. Bej. Melothria dulcis Wunderlin AE 5748 (CR) Nat. Bej. Melothria pendula L. K 1221 (CR) Nat. Bej. Melothria trilobata Cogn. AE 2509 (CR) Nat. Bej. Momordica charantia L. RO 2856 (CR) Nat. Bej. Psiguria sp. AE 5156 (CR) Nat. Bej. Psiguria triphylla (Miq.) C. Jeffrey JGL 9539 (CR) Nat. Bej. Psiguria warscewiczii (Hook. f.) Wunderlin OV 1191 (CR) Nat. Bej. Rytidostylis gracilis Hook. & Arn. AT s/n (CR) Nat. Bej. Sechium edule (Jacq.) Sw. WB 11014 (CR) Nat. Bej. Sechium pittieri (Cogn.) C. Jeffrey ARG 553 (CR-INB) Nat. Bej. Sechium venosum (L. D. Goméz) Lira & F. Chiang AT s/n (CR) Nat. Bej. Selysia prunifera (Poepp. & Endl.) Cogn. GH 2371 (CR-INB) Nat. Bej. Sicydium tamnifolium (Kunth) Cogn. JG 2981 (CR) Nat. Bej. Tecunumania quetzalteca Standl. & Steyerm. * GH 2600 (INB) Nat. Bej. Dichapetalaceae Dichapetalum grayumii Prance AE 5583 (CR) Nat. Bej. Dichapetalum nevermannianum Standl. & Valerio ARG 852 (INB) Nat. Arbu. Dichapetalum rugosum (Vahl) Prance ARG 572 (CR-INB) Nat. Arbu. 166 Dilleniaceae Davilla kunthii A. St.-Hil. PS 121 (CR) Nat. Bej. Davilla nitida (Vahl) Kubitzki JG 1645 (CR-INB) Nat. Bej. Doliocarpus dentatus (Aubl.) Standl. JS 2279 (CR) Nat. Bej. Doliocarpus major J. F. Gmel. AJI 2861 (CR) Nat. Bej. Doliocarpus multiflorus Standl. RK 179 (INB) Nat. Bej. Tetracera portobellensis Beurl. AT s/n (CR) Nat. Bej. Tetracera volubilis L. AKM 6593 (INB) Nat. Bej. Tetracera willdenowiana Steud. LP 1146 (CR) Nat. Bej. Dipentodontaceae Perrottetia sessiliflora Lundell JS 2323 (CR) Nat. arb. Elaeocarpaceae Sloanea guianensis (Aubl.) Benth. * GH 2653 (INB) Nat. Arb. Sloanea laevigata Dam. A. Sm. BH 22298 (INB) End. arb. Sloanea medusula K. Schum. & Pittier LP 121138 (CR) Nat. arb. Sloanea picapica Standl. BH 22319 (INB) Nat. arb. Sloanea tuerckheimii Donn. Sm. ARG 719 (INB) Nat. arb. Ericaceae Cavendishia herrerae Luteyn & J. F. Morales * GH 2623 (INB) End. Arbu. ep. Cavendishia melastomoides (Klotzsch) Hemsl. * DS 4908 (INB) Nat. Arbu. ep. Cavendishia quereme (Kunth) Benth. & Hook. f. * ARG 11665 (CR-INB) Nat. Arbu. ep. Psammisia ramiflora Klotzsch JS 2419 (CR) Nat. Arbu. ep. Erythroxylaceae Erythroxylum macrophyllum Cav. AC 577 (CR) Nat. arb. Euphorbiaceae Acalypha arvensis Poepp. & Endl. PZ 2612 (CR) Nat. Herb. Acalypha costaricensis (Kuntze) Knobl. ex Pax & K. Hoffm. JB 2252 (CR) Nat. Arbu. Acalypha diversifolia Jacq. AT s/n (CR) Nat. Arbu. Acalypha ferdinandii K. Hoffm. JS 2286 (CR) Nat. Arbu. Acalypha hispida Burm. GC 361 (CR-INB) Intr. Arbu. Acalypha macrostachya Jacq. ARG 2259 (CR-INB) Nat. arb. Acalypha villosa Jacq. JG 7095 (CR) Nat. Arbu. Acidoton nicaraguensis (Hemsl.) G. L. Webster EA 2067 (CR-INB) Nat. Arbu. Adelia triloba (Müll. Arg.) Hemsl. JG 1601 (CR-INB) Nat. arb. Adenophaedra grandifolia (Klotzsch) Müll. Arg. * RR 2668 (CR) Nat. Arb. Alchornea costaricensis Pax & K. Hoffm. JG 2968 (CR-INB) Nat. arb. Caperonia palustris (L.) A. St.-Hil. OV 1197 (CR) Nat. Herb. 167 Cleidion castaneifolium Müll. Arg. ARG 4920 (CR-INB) Nat. arb. Cnidoscolus aconitifolius (Mill.) I. M. Johnst. MG 10025 (CR-INB) Nat. arb. Conceveiba pleiostemona Donn. Sm. BH 17521 (CR-INB) Nat. arb. Croton billbergianus Müll. Arg. OV 1154 (CR) Nat. arb. Croton punctatus Jacq. OV 1211 (CR) Nat. Arbu. Croton schiedeanus Schltdl. JG 1554 (CR-INB) Nat. arb. Dalechampia dioscoreifolia Poepp. AC 548 (CR) Nat. Herb. Dalechampia shankii (Ant. Molina) Huft GH 3070 (CR-INB) Nat. Bej. Dalechampia websteri Armbr. ARG 651 (CR-INB) Nat. Herb. Euphorbia bahiensis (Klotzsch & Garcke) Boiss. WH 175 (CR) Nat. Herb. Euphorbia bombensis Jacq. ARG 4578 (CR-INB) Nat. Herb. Euphorbia cotinifolia L. AT s/n (CR) Nat. arb. Euphorbia cyathophora Murray RO 1693 (CR) Nat. Herb. Euphorbia heterophylla L. KB 3083 (CR) Nat. Herb. Euphorbia hirta L. AT 8759 (CR) Nat. Herb. Euphorbia hypericifolia L. AT s/n (CR) Nat. Herb. Euphorbia hyssopifolia L. MQ 510 (CR) Nat. Herb. Euphorbia mesembryanthemifolia Jacq. K 1235 (CR) Nat. Herb. Euphorbia oerstediana (Klotzsch & Garcke) Boiss. AQ 3317 (CR) Nat. Herb. Euphorbia pulcherrima Willd. JG 2217 (INB) Natu. arb. Euphorbia thymifolia L. RB 139 (CR) Nat. Herb. Gymnanthes riparia (Schltdl.) Klotzsch GSH 1853 (CR) Nat. arb. Hippomane mancinella L. JG 2798 (INB) Nat. arb. Hura crepitans L. AT s/n (CR) Nat. arb. Jatropha curcas L. RO 2867 (CR) Nat. arb. Jatropha gossypiifolia L. AQ 380 (CR) Nat. Herb. Jatropha integerrima Jacq. GC 353 (CR-INB) Intr. Arbu. Jatropha podagrica Hook. MQ 522 (CR) Intr. Arbu. Mabea occidentalis Benth. MG 4311 (CR) Nat. arb. Manihot brachyloba Müll. Arg. KB 3080 (CR) Nat. Arbu. Manihot esculenta Crantz AT s/n (CR) Nat. Arbu. Omphalea diandra L. JGL 9342 (CR) Nat. Bej. Plukenetia stipellata L. J. Gillespie JFM 7965 (CR-INB) Nat. Bej. Sapium allenii Huft AE 5723 (CR) End. arb. Sapium laurifolium (A. Rich.) Griseb. RA 4678 (CR-INB) Nat. arb. Sapium rigidifolium Huft BH 22293 (INB) Nat. arb. Tetrorchidium euryphyllum Standl. * GH 2515 (CR) Nat. Arb. Fabaceae Abarema barbouriana (Standl.) Barneby & J. W. Grimes RA 4665 (CR-INB) Abrus precatorius L. AE 5785 (CR) Natu. Bej. Aeschynomene americana L. MQ s/n (CR) Nat. Herb. Nat. arb. 168 Aeschynomene ciliata Vogel RO 2299 (CR) Nat. Herb. Aeschynomene sensitiva Sw. ARG 4591 (CR-INB) Nat. Herb. Albizia carbonaria Britton AE 5236 (CR) Nat. arb. Alysicarpus vaginalis (L.) DC. PZ 2604 (CR) Nat. Herb. Andira inermis (W. Wright) Kunth AT s/n (CR) Nat. arb. Arachis pintoi Krapov. & W. C. Greg. MBG 683 (CR) Intr. Herb. Balizia elegans (Ducke) Barneby & J. W. Grimes OV 1175 (CR) Nat. arb. Bauhinia beguinotii Cufod. AE (Obs.) Nat. Arbu. Bauhinia monandra Kurz RR 3114 (INB) Intr. Arb. Brownea macrophylla hort. ex Mast. AE 5478 (CR) Intr. Arb. Cajanus cajan (L.) Millsp. MBG 710 (CR) Intr. Arbu. Calliandra calothyrsus Meisn. JG 3250 (INB) Nat. arb. Calliandra riparia Pittier LDV 3842 (CR-INB) Intr. Arb. Calliandra trinervia Benth. * AE 5174 (CR) Nat. Arb. Calopogonium caeruleum (Benth.) Sauv. AT s/n (CR) Nat. Bej. Calopogonium mucunoides Desv. GC 282 (CR-INB) Nat. Bej. Canavalia oxyphylla Standl. & L. O. Williams BH 22302 (CR) Nat. Bej. Canavalia rosea (Sw.) DC. AT 9146 (CR) Nat. Bej. Canavalia villosa Benth. SL 3058 (CR) Nat. Bej. Cassia grandis L. f. WH 71 (CR) Nat. arb. Centrosema molle Mart. ex Benth. RO 2302 (CR) Nat. Bej. Centrosema plumieri (Turpin) Benth. RB 136 (CR) Nat. Bej. Chaetocalyx latisiliqua (Poir.) Benth. ex Hemsl. RO 3089 (CR) Nat. Bej. Chamaecrista nictitans (L.) Moench WB 10352 (CR) Nat. Herb. Chloroleucon sp. AE 4942 (CR) End. Excl. arb. Clitoria ternatea L. MQ s/n (CR) Intr. Bej. Cojoba catenata (Donn. Sm.) Britton & Rose * GH 2547 (CR) Nat. Arb. Cojoba sp. A. Sin autor ARG 681 (CR-INB) Nat. arb. Copaifera aromatica Dwyer OV 1355 (CR) Nat. arb. Crotalaria incana L. WB 8456 (CR) Nat. Herb. Crotalaria retusa L. MBG 699 (CR) Nat. Herb. Crotalaria sagittalis L. OV 1165 (CR) Nat. Herb. Cynometra hemitomophylla (Donn. Sm.) Britton & Ros BH 18147 (CR-INB) Cynometra retusa Britton & Rose BH 24674 (CR-INB) Nat. arb. Dalbergia ecastaphyllum (L.) Taub. RA 4666 (CR-INB) Nat. arb. Dalbergia monetaria L. f. MG 8057 (CR-INB) Nat. arb. Delonix regia (Bojer) Raf. RR 3112 (INB) Intr. Arb. Desmodium adscendens (Sw.) DC. ARG 2310 (CR-INB) Nat. Herb. Desmodium axillare (Sw.) DC. RO 3156 (CR) Nat. Herb. Desmodium barbatum (L.) Benth. & Oerst. GG 63 (CR-INB) Nat. Herb. Desmodium cajanifolium (Kunth) DC. GH 2377 (CR-INB) Nat. Arbu. Desmodium incanum DC. AT s/n (CR) Nat. Herb. Nat. arb. 169 Desmodium intortum (Mill.) Urb. WB 8466 (CR) Nat. Bej. Desmodium purpusii Brandegee GG 32 (CR-INB) Nat. Bej. Desmodium scorpiurus (Sw.) Desv. WB 10449 (CR) Nat. Herb. Dioclea malacocarpa Ducke AC 569 (CR) Nat. Bej. Dioclea reflexa Hook. f. AE 5347 (CR) Nat. Bej. Dioclea wilsonii Standl. JG 1663 (CR-INB) Nat. Bej. Diphysa americana (Mill.) M. Sousa JG 1641 (CR-INB) Nat. arb. Dipteryx panamensis (Pittier) Record & Mell BH 24883 (INB) Nat. arb. Dussia macroprophyllata (Donn. Sm.) Harms PS 68 (CR) Nat. arb. Dussia tessmannii Harms LA 2085 (INB) Nat. arb. Entada polystachya (L.) DC. AE 5512 (CR) Nat. Bej. Enterolobium cyclocarpum (Jacq.) Griseb. AE (Obs.) Nat. arb. Erythrina berteroana Urb. GC 467 (INB) Nat. arb. Erythrina cochleata Standl. AC 578 (CR) Nat. arb. Erythrina gibbosa Cufod. AM 19 (INB) Nat. arb. Fairchildia panamensis (Benth.) Britton & Rose OV 1215 (CR) Nat. arb. Flemingia macrophylla (Willd.) Kuntze ex Merr. MG 10026 (INB) Nat. Arbu. Flemingia strobilifera (L.) Aiton MG 8067 (CR-INB) Intr. Arbu. Gliricidia sepium (Jacq.) Kunth ex Walp. JG 2779 (INB) Nat. arb. Guilandina bonduc L. AE (Obs.) Nat. Bej. Hymenolobium mesoamericanum H. C. Lima WB 10428 (CR) Nat. arb. Indigofera hirsuta L. JS 2632 (CR) Natu. Arbu. Indigofera suffruticosa Mill. AT s/n (CR) Nat. Arbu. Indigofera trita L. f. WB 10448 (CR) Nat. Herb. Inga chocoensis Killip ex T. S. Elias JFM 7995 (CR-INB) Nat. arb. Inga ciliata C. Presl JG 1661 (CR-INB) Nat. arb. Inga densiflora Benth. PS 99 (CR) Nat. arb. Inga edulis Mart. AT s/n (CR) Natu. arb. Inga exalata T. S. Elias * GH 2703 (CR) Nat. Arb. Inga goldmanii Pittier AT 9358 (CR) Nat. arb. Inga jefensis Liesner & D'Arcy ARG 4515 (CR-INB) Nat. arb. Inga jinicuil Schltdl. & Cham. ex G. Don LA 1919 (INB) Nat. arb. Inga latipes Pittier * AE 5722 (CR) End. Arb. Inga leiocalycina Benth. GC 494 (CR-INB) Nat. arb. Inga marginata Willd. AT s/n (CR) Nat. arb. Inga mortoniana Jorge León AS 66 (CR-INB) Nat. arb. Inga multijuga Benth. OV 1273 (CR) Nat. arb. Inga nobilis Willd. LA 2875 (INB) Nat. arb. Inga oerstediana Benth. ex Seem. JG 2281 (INB) Nat. arb. Inga pezizifera Benth. AE 4830 (CR) Nat. arb. Inga punctata Willd. OV 1295 (CR) Nat. arb. Inga ruiziana G. Don AT s/n (CR) Nat. arb. 170 Inga samanensis L. Uribe WB 8468 (CR) Nat. arb. Inga sapindoides Willd. MG 5816 (CR) Nat. arb. Inga spectabilis (Vahl) Willd. AMC 49 (CR-INB) Nat. arb. Inga thibaudiana DC. ARG 652 (CR-INB) Nat. arb. Inga tonduzii Donn. Sm. ARG 900 (CR-INB) Nat. arb. Inga umbellifera (Vahl) Steud. AE 4873 (CR) Nat. arb. Lecointea amazonica Ducke GSH 1851 (CR) Nat. arb. Lonchocarpus densiflorus Benth. OV 1254 (CR) Nat. Bej. Lonchocarpus heptaphyllus (Poir.) DC. LA 2171 (CR-INB) Nat. arb. Lonchocarpus luteomaculatus Pittier AE 5367 (CR) Nat. arb. Lonchocarpus macrophyllus Kunth MG 5291 (CR) Nat. arb. Lonchocarpus unifoliolatus Benth. OV 1201 (CR) Nat. arb. Machaerium floribundum Benth. GH 2500 (CR-INB) Nat. Arbu. Machaerium seemannii Benth. RS 2102 (CR) Nat. Arbu. Macrolobium costaricense W. C. Burger AM 61 (CR-INB) Nat. arb. Macrolobium hartshornii R. S. Cowan GH 3073 (CR-INB) Nat. arb. Macroptilium lathyroides (L.) Urb. MG 4521 (CR) Nat. Herb. Mimosa diplotricha C. Wright ex Sauvalle GG 223 (CR-INB) Nat. Herb. Mimosa guilandinae (DC.) Barneby SL 3049 (CR) Nat. Bej. Mimosa myriadenia (Benth.) Benth. GG 64 (INB) Nat. Bej. Mimosa pigra L. WB 10974 (CR) Nat. Arbu. Mimosa pudica L. WB 10339 (CR) Nat. Herb. Mucuna holtonii (Kuntze) Moldenke DS 3588 (CR-INB) Nat. Bej. Mucuna sloanei Fawc. & Rendle AE 2521 (CR) Nat. Bej. Mucuna urens (L.) DC. AE 2522 (CR) Nat. Bej. Muellera unifoliolata (Benth.) M. Sousa JG 1743 (CR-INB) Nat. arb. Ormosia amazonica Ducke ARG 4860 (INB) Nat. arb. Ormosia coccinea (Aubl.) Jacks. PS 88 (CR) Nat. arb. Ormosia macrocalyx Ducke RS 2100 (CR) Nat. arb. Ormosia panamensis Benth. AE 5365 (CR) Nat. arb. Ormosia subsimplex Spruce ex Benth. JG 3269 (INB) Nat. arb. Oxyrhynchus trinervius (Donn. Sm.) Rudd JG 2848 (CR-INB) Nat. Bej. Pentaclethra macroloba (Willd.) Kuntze PS 82 (CR) Nat. arb. Prioria copaifera Griseb. OV 1278 (CR) Nat. arb. Prosopis juliflora (Sw.) DC. MQ s/n (CR) Nat. arb. Pterocarpus officinalis Jacq. WH 75 (CR) Nat. arb. Pueraria phaseoloides (Roxb.) Benth. AKM 6615 (INB) Intr. Herb. Rhynchosia erythrinoides Schltdl. & Cham. BH 18391 (CR-INB) Nat. Herb. Rhynchosia minima (L.) DC. AT s/n (CR) Nat. Bej. Samanea saman (Jacq.) Merr. RLW 25631 (CR) Nat. arb. Schnella guianensis (Aubl.) Wunderlin ARG 728 (INB) Nat. Bej. Schnella outimouta (Aubl.) Wunderlin RO 3542 (CR) Nat. Bej. 171 Senegalia hayesii (Benth.) Britton & Rose AC 523 (CR) Nat. Bej. Senegalia multipinnata (Ducke) Seigler & Ebinger LA 1865 (INB) Nat. Bej. Senna cobanensis (Britton & Rose) H. S. Irwin & Barneby AT 9148 (CR) Nat. Herb. Senna hayesiana (Britton & Rose) H. S. Irwin & Barneby AT 9796 (CR) Nat. Arbu. Senna obtusifolia (L.) H. S. Irwin & Barneby WB 10388 (CR) Nat. Herb. Senna occidentalis (L.) Link AT s/n (CR) Nat. Herb. Senna papillosa (Britton & Rose) H. S. Irwin & Barneby WH 27 (CR) Nat. arb. Senna reticulata (Willd.) H. S. Irwin & Barneby MBG 684 (CR) Nat. arb. Sophora tomentosa L. JGL 12108 (CR) Nat. Arbu. Swartzia costaricensis (Britton) N. Zamora HP s/n (CR) Nat. arb. Tamarindus indica L. JG 2290 (INB) Intr. Arb. Vachellia ruddiae (D. H. Janzen) Seigler & Ebinger AE 419 (CR) Nat. arb. Vigna caracalla (L.) Verdc. MG 4429 (CR) Nat. Bej. Vigna luteola (Jacq.) Benth. MBG 697 (CR) Nat. Herb. Vigna peduncularis (Kunth) Fawc. & Rendle AMO 114 (CR-INB) Nat. Herb. Vigna unguiculata (L.) Walp. JEJ 1542 (CR) Intr. Bej. Vigna vexillata (L.) A. Rich. MQ s/n (CR) Nat. Bej. Zygia brenesii (Standl.) L. Rico RA 5021 (CR-INB) End. arb. Zygia confusa L. Rico JGL 12201 (CR) Nat. arb. Zygia gigantifoliola (Schery) L. Rico QJ 727 (CR-INB) Nat. arb. Zygia inaequalis (Humb. & Bonpl. ex Willd.) Pittier LA 2195 (CR-INB) Nat. arb. Zygia latifolia (L.) Fawc. & Rendle ARG 2549 (CR-INB) Nat. arb. Zygia longifolia (Humb. & Bonpl. ex Willd.) Britton & Rose OV 1296 (CR) Nat. arb. Gentianaceae Enicostema verticillatum (L.) Engl. JL 2571 (CR) Nat. Herb. Voyria aphylla (Jacq.) Pers. GH 7604 (CR) Nat. Herb. Voyria corymbosa Splitg. AE 5363 (CR) Nat. Herb. Voyria flavescens Griseb. MG 8548 (INB) Nat. Herb. Voyria kupperi Suess. AE 4805 (CR) Nat. Herb. Voyria tenella Hook. WH 43 (CR) Nat. Herb. Gesneriaceae Besleria columneoides Hanst. JGL 8375 (CR) Nat. Arbu. Besleria flavovirens Nees & Mart. AE 4920 (CR) Nat. Arbu. Besleria laxiflora Benth. AT s/n (CR) Nat. Arbu. Besleria notabilis C. V. Morton AQ 3254 (CR) Nat. Arbu. Besleria pauciflora Rusby MMC 988 (CR-INB) Nat. Arbu. Besleria robusta Donn. Sm. AT 9556 (CR) Nat. Arbu. Besleria solanoides Kunth * DS 4856 (INB) Nat. Herb. Besleria trichostegia Donn. Sm. AT 9558 (CR) Nat. Arbu. Chrysothemis friedrichsthaliana (Hanst.) H. E. Moore GG 201 (CR-INB) Nat. Herb. 172 Chrysothemis pulchella (Donn) Decne. AE 536 (CR) Nat. Herb. ep. Codonanthe crassifolia (H. Focke) C. V. Morton WH 77 (CR) Nat. Herb. ep. Codonanthe macradenia Donn. Sm. GH 7696 (CR) Nat. Herb. ep. Codonanthe uleana Fritsch GH 7590 (CR) Nat. Herb. ep. Columnea consanguinea Hanst. * DSn 6453 (INB) Nat. Arbu. ep. Columnea gloriosa Sprague AE 5195 (CR) End. Herb. ep. Columnea grata C. V. Morton HP 16010 (CR) End. Herb. ep. Columnea kalbreyeriana Mast. BH 17950 (INB) Nat. Herb. Columnea maculata C. V. Morton GH 3000 (CR-INB) Nat. Arbu. ep. Columnea nicaraguensis Oerst. AE 2505 (CR) Nat. Herb. ep. Columnea oxyphylla Hanst. MG 9650 (CR-INB) Nat. Herb. ep. Columnea parviflora C. V. Morton * ARG 11404 (INB) Nat. Herb. ep. Columnea purpurata Hanst. AT s/n (CR) Nat. Herb. ep. Columnea sanguinolenta (Klotzsch ex Oerst.) Hanst. AT 9307 (CR) Nat. Herb. ep. Columnea tulae Urb. AT s/n (CR) Nat. Herb. ep. Diastema affine Fritsch ARB 1932 (CR) Nat. Herb. Diastema racemiferum Benth. AC 528 (CR) Nat. Herb. Drymonia alloplectoides Hanst. AE 388 (CR-INB) Nat. Arbu. ep. Drymonia conchocalyx Hanst. AE 5196 (CR) Nat. Arbu. ep. Drymonia coriacea (Oerst.) Wiehler GH 3010 (CR-INB) Nat. Arbu. ep. Drymonia lanceolata (Hanst.) C. V. Morton * DSn 6794 (INB) Nat. Arbu. ep. Drymonia macrantha (Donn. Sm.) D. N. Gibson AT s/n (CR) Nat. Arbu. ep. Drymonia macrophylla (Oerst.) H. E. Moore MG 8053 (CR-INB) Nat. Arbu. ep. Drymonia multiflora (Oerst.) Wiehler NZ 4910 (INB) Nat. Bej. Drymonia ovatifolia J.L. Clark * GH 2606 (INB) Nat. Arbu. ep. Drymonia rubra C. V. Morton GH 2499 (CR-INB) Nat. Arbu. ep. Drymonia rubripilosa Kriebel AE 399 (CR-INB) End. Bej. Drymonia serrulata (Jacq.) Mart. JFM 7990 (CR-INB) Nat. Arbu. ep. Drymonia stenophylla (Donn. Sm.) H. E. Moore ARG 583 (CR-INB) Nat. Arbu. ep. Drymonia submarginalis Gómez-Laur. & Chavarria AE 4734 (CR) Nat. Arbu. ep. Drymonia tomentulifera Kriebel * DS 4902 (INB) End. Bej. Drymonia turrialvae Hanst. GH 2411 (CR-INB) Nat. Herb. ep. Drymonia warszewicziana Hanst. ARB 1712 (CR) Nat. Arbu. ep. Episcia lilacina Hanst. AM 47 (CR-INB) Nat. Herb. ep. Gasteranthus acropodus (Donn. Sm.) Wiehler AT 9554 (CR) Nat. Excl. Herb. Gasteranthus imbricans (Donn. Sm.) Wiehler LDG 23515 (CR) Nat. Excl. Arbu. Gasteranthus osaensis L. E. Skog & L. P. Kvist JGL 8333 (CR) End. Herb. Glossoloma tetragonum Hanst. * RR 2720 (CR) Nat. Herb. Kohleria spicata (Kunth) Oerst. MQ 513 (CR) Nat. Herb. Kohleria tubiflora (Cav.) Hanst. MQ 488 (CR) Nat. Herb. Monopyle maxonii C. V. Morton * ARG 11406 (CR-INB) Nat. Herb. Napeanthus apodemus Donn. Sm. HP s/n (CR) Nat. Herb. 173 Napeanthus bracteatus C. V. Morton GH 2987 (CR-INB) Nat. Herb. Paradrymonia alata Kriebel AE 4894 (CR) End. Excl. Herb. ep. Paradrymonia lineata (C. V. Morton) Wiehler JBE 55 (CR) Nat. Herb. ep. Reldia minutiflora (L. E. Skog) L. P. Kvist & L. E. Skog MMC 992 (CR-INB) Nat. Excl. Herb. Hernandiaceae Hernandia didymantha Donn. Sm. HP 12682 (CR) Nat. arb. Hernandia stenura Standl. NZ 1008 (CR) Nat. arb. Humiriaceae Humiriastrum diguense (Cuatrec.) Cuatrec. ARG 645 (INB) Nat. arb. Sacoglottis trichogyna Cuatrec. BH 18390 (CR-INB) Nat. arb. Hydnoraceae Prosopanche costaricensis L. D. Goméz & Gómez-Laur. MBA 36 (INB) Hydrangeaceae Hydrangea peruviana Moric. LA 2114 (INB) Nat. Arbu. ep. Hypericaceae Vismia billbergiana Beurl. Vismia macrophylla Kunth AQ 3273 (CR) Nat. arb. AJI 4105 (CR) Nat. arb. Icacinaceae Calatola costaricensis Standl. JS 2238 (CR) Nat. arb. Lacistemataceae Lacistema aggregatum (P. J. Bergius) Rusby AE 4905 (CR) Nat. arb. Lozania pittieri (S. F. Blake) L. B. Sm. JG 1700 (CR-INB) Nat. arb. Lamiaceae Aegiphila anomala Pittier JFM 7729 (CR-INB) Nat. arb. Aegiphila costaricensis Moldenke OV 1192 (CR) Nat. arb. Aegiphila elata Sw. JFM 7683 (CR-INB) Nat. Arbu. Aegiphila falcata Donn. Sm. AT s/n (CR) Nat. arb. Aegiphila panamensis Moldenke PS s/n (CR) Nat. arb. Callicarpa acuminata Kunth HP s/n (CR) Nat. arb. Clerodendrum paniculatum L. WB 10983 (CR) Intr. Arbu. Hyptis capitata Jacq. AQ 351 (CR) Nat. Herb. Hyptis obtusiflora C. Presl ex Benth. MQ s/n (CR) Nat. Herb. Hyptis pectinata (L.) Poit. JG 3253 (INB) Nat. Herb. Hyptis suaveolens (L.) Poit. RO 3687 (CR) Nat. Herb. End. Herb. 174 Hyptis verticillata Jacq. AT s/n (CR) Nat. Herb. Hyptis vilis Kunth & C. D. Bouché ARG 564 (CR-INB) Nat. Herb. Marsypianthes chamaedrys (Vahl) Kuntze JG 3015 (CR-INB) Nat. Herb. Mentha × piperita L. RO 2849 (CR) Intr. Herb. Ocimum campechianum Mill. AT 8729 (CR) Nat. Herb. Plectranthus amboinicus (Lour.) Spreng. RO s/n (CR) Intr. Herb. Plectranthus scutellarioides (L.) R. Br. RK 444 (INB) Natu. Herb. Salvia occidentalis Sw. AT s/n (CR) Nat. Herb. Salvia serotina L. MQ s/n (CR) Nat. Herb. Scutellaria costaricana H. Wendl. SG s/n (CR) Nat. Herb. Scutellaria tenuipetiolata A. Pool AT 9549 (CR) Nat. Excl. Herb. Teucrium vesicarium Mill. AJI 2867 (CR) Nat. Herb. Vitex cooperi Standl. EA 2096 (CR-INB) Nat. arb. Lauraceae Aniba venezuelana Mez AE 538 (CR) Nat. arb. Beilschmiedia costaricensis (Mez & Pittier) C. K. Allen BH 18116 (CR-INB) Caryodaphnopsis sp. AE 5564 (CR) Nat. arb. Cassytha filiformis L. GH 7582 (CR) Nat. Excl. Herb. Cinnamomum camphora (L.) Nees & Eberm. AE s/n () Intr. Arb. Cinnamomum verum J. Presl AQ 386 (CR) Intr. Arb. Licaria caribaea Gómez-Laur. & Cascante OV 1239 (CR) End. arb. Licaria excelsa Kosterm. BH 18098 (CR-INB) Nat. arb. Nectandra hihua (Ruíz & Pav.) Rohwer MG 8060 (CR-INB) Nat. arb. Nectandra longipetiolata van der Werff MG 5769 (CR) End. Excl. arb. Nectandra membranacea (Sw.) Griseb. AJI 1867 (CR) Nat. arb. Nectandra purpurea (Ruíz & Pav.) Mez JGL 11959 (CR-INB) Nat. arb. Nectandra reticulata (Ruíz & Pav.) Mez AM 35 (CR-INB) Nat. arb. Nectandra umbrosa (Kunth) Mez PS 113 (CR) Nat. arb. Ocotea atirrensis Mez & Donn. Sm. HP 9172 (CR) Nat. Arbu. Ocotea cernua (Nees) Mez RA 4672 (CR-INB) Nat. arb. Ocotea dendrodaphne Mez GG 21 (CR-INB) Nat. arb. Ocotea dentata van der Werff AM 1 (CR-INB) Nat. arb. Ocotea insularis (Meisn.) Mez * GH 2580 (INB) Nat. Arb. Ocotea laetevirens Standl. & Steyerm. QJ 806 (CR-INB) Nat. arb. Ocotea leucoxylon (Sw.) Laness. AMC 58 (CR-INB) Nat. arb. Ocotea macropoda (Kunth) Mez JG 1722 (CR-INB) Nat. arb. Ocotea mollifolia Mez & Pittier OV 1150 (CR) Nat. arb. Ocotea pentagona Mez AT s/n (CR) Nat. arb. Ocotea tenera Mez & Donn. Sm. OV 30 (CR) Nat. arb. Ocotea valerioides W. C. Burger AMO 110 (CR-INB) Nat. arb. Ocotea wedeliana C. K. Allen JFM 7979 (CR-INB) Nat. arb. Nat. arb. 175 Persea americana Mill. WB 10501 (CR) Nat. arb. Persea silvatica van der Werff QJ 726 (CR-INB) End. arb. Pleurothyrium oblongum van der Werff AE 445 (CR-INB) Nat. arb. Lecythidaceae Couroupita nicaraguarensis DC. WH 50 (CR) Nat. arb. Eschweilera calyculata Pittier LP 1167 (CR) Nat. arb. Eschweilera collinsii Pittier GC 408 (INB) Nat. arb. Eschweilera pittieri R. Knuth QJ 789 (CR-INB) Nat. arb. Grias cauliflora L. WH 61 (CR) Nat. arb. Lepidobotryaceae Ruptiliocarpon caracolito Hammel & N. Zamora QJ 1834 (INB) Nat. arb. Linderniaceae Lindernia crustacea (L.) F. Muell. RO 1694 (CR) Nat. Herb. Lindernia diffusa (L.) Wettst. MQ 533 (CR) Nat. Herb. Loganiaceae Spigelia anthelmia L. K 1233 (CR) Nat. Herb. Spigelia hamelioides Kunth WH 136 (CR) Nat. Herb. Spigelia humboldtiana Cham. & Schltdl. ARG 2284 (CR-INB) Nat. Herb. Strychnos colombiensis Krukoff & Barneby MG 5768 (CR) Nat. Bej. Strychnos panamensis Seem. GH 2378 (CR-INB) Nat. Bej. Loranthaceae Oryctanthus cordifolius (C. Presl) Urb. JGL 10193 (CR) Nat. Arbu. ep. Oryctanthus occidentalis (L.) Eichler HP s/n (CR) Nat. Arbu. ep. Passovia pyrifolia (Kunth) Tiegh. EMC 181 (CR-INB) Nat. Arbu. ep. Struthanthus leptostachyus (Kunth) G. Don * GH 2550 (CR) Nat. Arbu. ep. Struthanthus orbicularis (Kunth) Blume AMO 153 (CR-INB) Nat. Arbu. ep. Lythraceae Adenaria floribunda Kunth AQ 346 (CR) Nat. Arbu. Cuphea calophylla Cham. & Schltdl. GC 355 (INB) Nat. Arbu. Cuphea carthagenensis (Jacq.) J. F. Macbr. WB 10466 (CR) Nat. Herb. Cuphea elliptica Koehne MQ 526 (CR) Nat. Herb. Cuphea epilobiifolia Koehne HP s/n (CR) Nat. Herb. Lawsonia inermis L. RO 3170 (CR) Intr. Arbu. Rotala ramosior (L.) Koehne JG 1587 (CR-INB) Nat. Herb. 176 Magnoliaceae Michelia champaca L. AE 5435 (CR) Intr. Arb. Talauma gloriensis Pittier AE 4794 (CR) Nat. arb. Malpighiaceae Adelphia hiraea (Gaertn.) W. R. Anderson TBC 43269 (CR) Nat. Bej. Banisteriopsis elegans (Triana & Planch.) Sandwith BH 22709 (CR-INB) Bunchosia costaricensis Rose * DSn 6450 (INB) End. Arb. Bunchosia dwyeri Cuatrec. & Croat ARG 874 (CR-INB) Nat. Arbu. Bunchosia grayumii W. R. Anderson MG 4384 (CR) Nat. arb. Bunchosia macrophylla Rose ex Donn. Sm. HP 8686 (CR) Nat. arb. Bunchosia polystachia (Andrews) DC. JS 2310 (CR) Nat. arb. Bunchosia ursana W. R. Anderson ARG 4871 (CR-INB) End. Arbu. Byrsonima arthropoda A. Juss. AE (Obs.) Nat. arb. Byrsonima crassifolia (L.) Kunth AM 52 (CR-INB) Nat. Arbu. Byrsonima herrerae W. R. Anderson * GH 2709 (CR) Nat. Arb. Heteropterys leona (Cav.) Exell JFM 4940 (CR-INB) Nat. Bej. Hiraea fagifolia (DC.) A. Juss. BH 14308 (CR) Nat. Arbu. Hiraea faginea (Sw.) Nied. JGL 10201 (CR) Nat. Arbu. Hiraea smilacina Standl. JGL 12162 (CR) Nat. Bej. Malpighia albiflora (Cuatrec.) Cuatrec. EA 2082 (CR-INB) Nat. Arbu. Malpighia emarginata DC. MG 10024 (CR-INB) Intr. Arbu. Malpighia romeroana Cuatrec. AE 5114 (CR) Nat. Arbu. Stigmaphyllon ellipticum (Kunth) A. Juss. OV 1217 (CR) Nat. Bej. Stigmaphyllon lindenianum Juss. HP s/n (CR) Nat. Bej. Stigmaphyllon puberum (Rich.) A. Juss. HP s/n (CR) Nat. Bej. Tetrapterys tinifolia Triana & Planch. AMC 66 (CR-INB) Nat. Bej. Nat. Bej. Malvaceae Abelmoschus esculentus (L.) Moench AQ 355 (CR) Intr. Herb. Abelmoschus moschatus Medik. RO 2606 (CR) Natu. Herb. Apeiba membranacea Spruce ex Benth. BH 22296 (INB) Nat. arb. Byttneria aculeata (Jacq.) Jacq. AT s/n (CR) Nat. Arbu. Ceiba pentandra (L.) Gaertn. AC 495 (CR) Nat. arb. Corchorus siliquosus L. ARG 2534 (CR-INB) Nat. Herb. Durio zibethinus Rumph. ex Murray AE 5487 (CR) Intr. Arb. Goethalsia meiantha (Donn. Sm.) Burret GC 255 (CR-INB) Nat. arb. Gossypium barbadense L. 1125 (CR) Intr. Arbu. Guazuma invira (Willd.) G. Don WH 198 (CR) Nat. arb. Hampea appendiculata (Donn. Sm.) Standl. AE 562 (CR) Nat. arb. Heliocarpus appendiculatus Turcz. AT s/n (CR) Nat. arb. Herrania purpurea (Pittier) R. E. Schult. ARG 3513 (CR-INB) Nat. Arbu. 177 Hibiscus acetosella Welw. ex Ficinus AE 5475 (CR) Intr. Arbu. Hibiscus bifurcatus Cav. AE 5540 (CR) Nat. Arbu. Hibiscus rosa-sinensis L. K 1205 (CR) Intr. Arbu. Hibiscus sabdariffa L. LP sn (CR) Intr. Arbu. Luehea seemannii Triana & Planch. AT s/n (CR) Nat. arb. Malachra alceifolia Jacq. RH 101 (CR) Nat. Herb. Malachra fasciata Jacq. JG 502 (CR-INB) Nat. Herb. Malvaviscus arboreus Cav. HP s/n (CR) Nat. Arbu. Malvaviscus concinnus Kunth AM 36 (CR-INB) Nat. arb. Matisia bracteolosa Ducke LP 1155 (CR) Nat. arb. Matisia cordata Bonpl. BH 22313 (INB) Nat. arb. Matisia obliquifolia Standl. OV 1167 (CR) Nat. arb. Matisia ochrocalyx K. Schum. JGL 12332 (CR) Nat. arb. Melochia lupulina Sw. AT s/n (CR) Nat. Herb. Mortoniodendron anisophyllum (Standl.) Standl. & Steyerm. OV 1152 (CR) Nat. arb. Mortoniodendron costaricense Standl. & L. O. Williams GC 265 (INB) Nat. arb. Mortoniodendron longipedunculatum Al. Rodr. JGL 9531 (CR) End. Excl. Arbu. Mortoniodendron moralesii Al. Rodr. OV 1209 (CR) End. arb. Ochroma pyramidale (Cav. ex Lam.) Urb. AE (Obs.) Nat. arb. Pachira aquatica Aubl. WH 9 (CR) Nat. arb. Pachira quinata (Jacq.) W. S. Alverson AC 510 (CR) Nat. arb. Pavonia castaneifolia A. St.-Hil. & Naudin JGL 12328 (CR) Nat. Arbu. Pavonia fruticosa (Mill.) Fawc. & Rendle AT s/n (CR) Nat. Arbu. Pavonia oxyphyllaria Donn. Sm. GC 487 (INB) Nat. Arbu. Pavonia paludicola Nicolson K 1203 (CR) Nat. Arbu. Pavonia peruviana Gürke ARG 872 (INB) Nat. Arbu. Pavonia schiedeana Steud. ARG 1003 (CR-INB) Nat. Arbu. Quararibea asterolepis Pittier AC 534 (CR) Nat. arb. Quararibea gomeziana W. S. Alverson WA 2136 (CR) Nat. Excl. arb. Quararibea parvifolia Standl. AE 4851(CR) Nat. arb. Quararibea pendula W. S. Alverson WA 2135 (CR) Nat. arb. Quararibea platyphylla Pittier & Donn. Sm. LDG 23484 (CR) Nat. arb. Quararibea stenophylla Pittier HP 12410 (CR) Nat. arb. Sida rhombifolia L. GG 172 (INB) Nat. Arbu. Sida spinosa L. AT s/n (CR) Nat. Arbu. Sida ulmifolia Mill. WA 3108 (CR) Nat. Arbu. Sterculia costaricana Pittier ER 349 (CR-INB) Nat. arb. Sterculia recordiana Standl. AE 4798 (CR) Nat. arb. Talipariti tiliaceum (L.) Fryxell PZ 2641 (CR) Nat. arb. Theobroma angustifolium Sessé & Moc. ex DC. HP s/n (CR) Nat. arb. Theobroma bicolor Bonpl. AE 529 (CR) Nat. arb. Theobroma cacao L. MG 4400 (CR) Nat. arb. 178 Theobroma grandiflorum (Willd. ex Spreng.) K. Schum. AE 5488 (CR) Intr. Arb. Theobroma mammosum Cuatrec. & Jorge León AE 4922 (CR) Nat. arb. Theobroma simiarum Donn. Sm. BH 18106 (CR-INB) Nat. arb. Trichospermum grewiifolium (A. Rich.) Kosterm. AC 400 (CR) Nat. arb. Triumfetta bogotensis DC. AT s/n (CR) Nat. Arbu. Triumfetta lappula L. RO 3088 (CR) Nat. Arbu. Urena lobata L. AE 5760 (CR) Nat. Arbu. Wercklea ferox (Hook. f.) Fryxell GC 336 (CR-INB) Nat. Herb. Wissadula excelsior (Cav.) C. Presl AT s/n (CR) Nat. Arbu. Marcgraviaceae Marcgravia caudata Triana & Planch. JS 2412 (CR) Nat. Arbu. ep. Marcgravia glandulosomarginata Hammel JU 5516 (CR) Nat. Arbu. ep. Marcgravia mexicana Gilg BH 21937 (INB) Nat. Arbu. ep. Marcgravia nepenthoides Seem. KSW 79295 (CR) Nat. Arbu. ep. Marcgravia nervosa Triana & Planch. AM 68 (CR-INB) Nat. Arbu. ep. Marcgravia roonii S. Dressler * RR 2714 (CR) Nat. Arbu. ep. Marcgravia schippii Standl. JU 669 (CR) Nat. Arbu. ep. Sarcopera rosulata de Roon & Bedell * DS 4906 (INB) Nat. Arbu. ep. Sarcopera sessiliflora (Triana & Planch.) Bedell BH 22710 (INB) Nat. Arbu. ep. Souroubea sympetala Gilg WB 8447 (CR) Nat. Arbu. ep. Melastomataceae Aciotis indecora Triana AE 4910 (CR) Nat. Herb. Aciotis rubricaulis (Mart. ex DC.) Triana KB 3475 (CR) Nat. Herb. Adelobotrys adscendens (Sw.) Triana AS 58 (CR-INB) Nat. Bej. Arthrostemma ciliatum Pav. ex D. Don RCH 935 (CR) Nat. Herb. Blakea anomala Donn. Sm. * ARG 11670 (CR-INB) End. Arbu. ep. Blakea gracilis Hemsl. DS 3611 (INB) Nat. Arbu. ep. Blakea litoralis L. O. Williams GC 453 (CR-INB) Nat. Arbu. ep. Blakea maurofernandeziana (Cogn.) Penneys & Almeda AT s/n (CR) Nat. Arbu. ep. Blakea watsonii (Cogn.) Penneys & Almeda GH 7630 (CR) Nat. Arbu. ep. Clidemia capitellata (Bonpl.) D. Don ARG 1911 (CR-INB) Nat. Arbu. Clidemia crenulata Gleason HP s/n (CR) Nat. Arbu. Clidemia densiflora (Standl.) Gleason KB 3573 (CR) Nat. Arbu. Clidemia dentata D. Don. JG 1591 (CR-INB) Nat. Arbu. Clidemia discolor (Triana) Cogn. FA 3255 (CR) Nat. Arbu. Clidemia epiphytica (Triana) Cogn. AC 524 (CR) Nat. Bej. Clidemia gracilis Pittier JGL 9520 (CR) Nat. Arbu. Clidemia hammelii Almeda AE 4950 (CR) Nat. Arbu. Clidemia hirta D. Don DS 1915 (CR-INB) Nat. Arbu. Clidemia japurensis DC. OV 1131 (CR) Nat. Arbu. 179 Clidemia octona (Bonpl.) L. O. Williams ARG 1909 (CR-INB) Nat. Arbu. Clidemia ombrophila Gleason * RR 2677 (CR) Nat. Arbu. Clidemia petiolaris Triana AE 2511 (CR) Nat. Arbu. Clidemia pubescens Gleason AE 453 (CR-INB) Nat. Herb. Clidemia quinquenervia (Mill.) Almeda ARG 1915 (CR-INB) Nat. Arbu. Clidemia reitziana Cogn. & Gleason JG 1692 (CR-INB) Nat. Arbu. Clidemia septuplinervia Cogn. AE 2518 (CR) Nat. Arbu. Clidemia setosa (Triana) Gleason GH 7649 (CR) Nat. Herb. Clidemia subpeltata Kriebel & Almeda ARG 4921 (CR-INB) End. Arbu. Conostegia bracteata Triana AE 5172 (CR) Nat. arb. Conostegia icosandra (Sw. ex Wikstr.) Urb. * GH 2557 (CR) Nat. Arb. Conostegia lasiopoda Benth. LDG 23441 (CR) Nat. arb. Conostegia micrantha Standl. ARG 2300 (CR-INB) Nat. arb. Conostegia montana (Sw.) D. Don ex DC. AE 4948 (CR) Nat. arb. Conostegia muriculata Almeda AQ 356 (CR) Nat. arb. Conostegia rhodopetala Donn. Sm. AE 4822 (CR) End. arb. Conostegia rufescens Naudin CS 605 (CR) Nat. arb. Conostegia setifera Standl. FA 6841 (CR) Nat. arb. Conostegia setosa Triana * DSn 6502 (INB) Nat. Arbu. Conostegia subcrustulata (Beurl.) Triana GG 248 (CR-INB) Nat. Arbu. Conostegia tenuifolia Donn. Sm. AE 416 (CR-INB) Nat. arb. Conostegia xalapensis (Bonpl.) D. Don ex DC. OV 1218 (CR) Nat. arb. Henriettella cuneata (Standl.) Gleason WB 10321 (CR) Nat. arb. Henriettella fascicularis (Sw.) C. Wright JG 3231 (CR-INB) Nat. arb. Henriettella tuberculosa Donn. Sm. OV 1193 (CR) Nat. arb. Heterotis rotundifolia (Sm.) Jacq.-Fel. RK 433 (CR-INB) Natu. Herb. Leandra dichotoma (D. Don) Cogn. ARG 1900 (CR-INB) Nat. Arbu. Leandra granatensis Gleason ARG 642 (CR-INB) Nat. Arbu. Leandra grandifolia Cogn. * DSn 6449 (CR-INB) Nat. Arbu. Leandra longicoma Cogn. AT s/n (CR) Nat. Arbu. Leandra mexicana (Naudin) Cogn. KB 3095 (CR) Nat. Arbu. Loreya mespiloides Miq. ARG 646 (CR-INB) Nat. arb. Meriania macrophylla (Benth.) Triana JFM 10934 (INB) Nat. arb. Miconia affinis DC. AE 539 (CR) Nat. arb. Miconia ampla Triana OV 1160 (CR) Nat. arb. Miconia appendiculata Triana AM 42 (CR-INB) Nat. arb. Miconia barbinervis (Benth.) Triana WA 3224 (CR) Nat. Arbu. Miconia benthamiana Triana AE 5199 (CR) Nat. Arbu. Miconia brenesii Standl. * DSn 6460 (CR-INB) End. Arb. Miconia calocoma Almeda AE 4927 (CR) End. arb. Miconia calvescens DC. GH 2365 (CR-INB) Nat. arb. Miconia centrodesma Naudin AE 439 (CR-INB) Nat. arb. 180 Miconia chamissois Naudin GH 7558 (CR) Nat. Arbu. Miconia doniana Naudin FA 3257 (CR) Nat. arb. Miconia dorsiloba Gleason * DSn 6477 (INB) Nat. Arbu. Miconia elata (Sw.) DC. JG 3239 (CR-INB) Nat. arb. Miconia friedmaniorum Almeda & Umaña D. * ARG 11408 (CR-INB) Nat. Arb. Miconia gracilis Triana ARG 1913 (CR-INB) Nat. Arbu. Miconia impetiolaris (Sw.) D. Don ex DC. AE 402 (CR-INB) Nat. arb. Miconia lacera (Bonpl.) Naudin AE 448 (CR-INB) Nat. Arbu. Miconia lamprophylla Triana AE 5240 (CR) Nat. Arbu. Miconia lateriflora Cogn. AJ 112 (CR-INB) Nat. Arbu. Miconia ligulata Almeda AE 4909 (CR) Nat. arb. Miconia longifolia (Aubl.) DC. MG 8047 (CR-INB) Nat. arb. Miconia matthaei Naudin BH 18099 (CR-INB) Nat. arb. Miconia nervosa (Sm.) Triana GG 72 (CR-INB) Nat. Arbu. Miconia oraria Wurdack JG 3232 (CR-INB) Nat. arb. Miconia paleacea Cogn. BH 18141 (CR-INB) Nat. arb. Miconia prasina (Sw.) DC. AE 4902 (CR) Nat. arb. Miconia pterocaulon Triana BH 17518 (CR-INB) Nat. arb. Miconia punctata (Desr.) D. Don ex DC. LA 2060 (CR-INB) Nat. arb. Miconia reducens Triana OV 1294 (CR) Nat. Arbu. Miconia schlimii Triana AE (Obs.) Nat. arb. Miconia shattuckii Standl. * GH 2645 (CR-INB) Nat. Arbu. Miconia simplex Triana JGL 8358 (CR) Nat. arb. Miconia sparrei Wurdack AKM 6540 (INB) Nat. Arbu. Miconia triplinervis Ruíz & Pav. ARG 4922 (CR-INB) Nat. Arbu. Miconia valerioana (Standl.) Wurdack * AE 5153 (CR) Nat. Arbu. Monolena primuliflora Hook. f. MG 9655 (INB) Nat. Excl. Herb. ep. Mouriri cyphocarpa Standl. JGL 12171 (CR) Nat. arb. Mouriri exilis Gleason LA 2096 (INB) Nat. arb. Mouriri myrtilloides (Sw.) Poir. AE 5735 (CR) Nat. arb. Ossaea brenesii Standl. JBE 52 (CR) Nat. arb. Ossaea laxivenula Wurdack * DSn 6465 (INB) Nat. Arbu. Ossaea micrantha (Sw.) Macfad. ex Cogn. AE 443 (CR-INB) Nat. Arbu. Ossaea robusta (Triana) Cogn. * RR 2676 (CR) Nat. Arb. Pilocosta erythrophylla (Gleason) Almeda & Whiffin GR 1630 (INB) End. Herb. Tibouchina longifolia (Vahl) Baill. AT s/n (CR) Nat. Herb. Tococa guianensis Aubl. OV 1133 (CR) Nat. Arbu. Topobea parasitica Aubl. * GH 2622 (CR) Nat. Arbu. Ep. Triolena hirsuta Triana AT s/n (CR) Nat. Herb. Triolena spicata (Triana) L. O. Williams MG 9654 (CR-INB) Nat. Excl. Herb. ep. 181 Meliaceae Carapa nicaraguensis C. DC. JGL 12204 (CR) Nat. arb. Cedrela odorata L. AE (Obs.) Nat. arb. Guarea bullata Radlk. JGL 12342 (CR) Nat. arb. Guarea ciliata Al. Rodr. * AE 5130 (CR) Nat. Arb. Guarea gentryi Coronado AE (Obs.) Nat. Excl. arb. Guarea guidonia (L.) Sleumer AE (Obs.) Nat. arb. Guarea kegelii Turcz. JFM 7750 (INB) Nat. arb. Guarea kunthiana A. Juss. AQ 3307 (CR) Nat. arb. Guarea macrocalyx Al. Rodr. JG 1711 (CR-INB) End. arb. Guarea pterorhachis Harms JGL 12206 (CR) Nat. arb. Guarea rhopalocarpa Radlk. LA 2111 (CR-INB) Nat. arb. Guarea sp. * AE 5204 (CR) Nat. Arbu. Guarea tafae-malekui Al. Rodr. AE 4899 (CR) End. arb. Guarea talamancana Gómez-Laur. & M. Valerio OV 1157 (CR) Sandoricum koetjape Merr. JGL 4874 (CR) Intr. Arb. Trichilia adolfi Harms ARG 592 (CR-INB) Nat. arb. Trichilia hirta L. BH 14295 (CR) Nat. arb. Trichilia martiana C. DC. ARG 4923 (CR-INB) Nat. arb. Trichilia pallida Sw. SL 3000 (CR) Nat. arb. Trichilia pittieri C. DC. ARG 683 (INB) Nat. arb. Trichilia quadrijuga Kunth OV 1203 (CR) Nat. arb. Trichilia septentrionalis C. DC. AE 4841 (CR) Nat. arb. Trichilia tuberculata (Triana & Planch.) C. DC. MG 4467 (CR) End. arb. Nat. arb. Menispermaceae Abuta panamensis (Standl.) Krukoff & Barneby AE (Obs.) Nat. Bej. Anomospermum reticulatum (Mart.) Eichler ARG 1000 (CR-INB) Nat. Bej. Cissampelos andromorpha DC. AE 4937 (CR) Nat. Bej. Cissampelos fasciculata Benth. JS 2226 (CR) Nat. Bej. Cissampelos grandifolia Triana & Planch. HP s/n (CR) Nat. Bej. Cissampelos pareira L. AT s/n (CR) Nat. Bej. Cissampelos tropaeolifolia DC. JG 1653 (CR-INB) Nat. Bej. Disciphania calocarpa Standl. JS 2222 (CR) Nat. Bej. Hyperbaena leptobotryosa (Donn. Sm.) Standl. ARG 2239 (CR-INB) Nat. Arbu. Hyperbaena smilacina Standl. LA 2159 (CR-INB) Nat. Bej. Metteniusaceae Metteniusa tessmanniana (Sleumer) Sleumer AE 4988 (CR) Molluginaceae Mollugo verticillata L. AT 8674 (CR) Nat. Herb. Nat. arb. 182 Monimiaceae Mollinedia costaricensis Donn. Sm. WA 3110 (CR) Nat. arb. Mollinedia viridiflora Tul. GC 428 (INB) Nat. arb. Moraceae Artocarpus altilis (Parkinson) Fosberg AE s/n () Intr. Arb. Artocarpus heterophyllus Lam. AE s/n () Intr. Arb. Brosimum alicastrum Sw. LP 1139 (CR) Nat. arb. Brosimum guianense (Aubl.) Huber SL 3037 (CR) Nat. arb. Brosimum lactescens (S. Moore) C. C. Berg AE 4919 (CR) Nat. arb. Castilla elastica Sessé ex Cerv. RO 2009 (CR) Nat. arb. Dorstenia choconiana S. Watson AT s/n (CR) Nat. Herb. Dorstenia contrajerva L. RO 2174 (CR) Nat. Herb. Ficus americana Aubl. WH 55 (CR) Nat. arb. Ficus apollinaris Dugand ARG 541 (CR-INB) Nat. Excl. arb. Ficus brevibracteata W. C. Burger JG 2301 (INB) Nat. arb. Ficus cahuitensis C. C. Berg AC 502 (CR) Nat. arb. Ficus citrifolia Mill. JGL 8382 (CR) Nat. arb. Ficus colubrinae Standl. JBE 66 (CR) Nat. arb. Ficus crassivenosa W. C. Burger MG 8021 (INB) Nat. arb. Ficus garcia-barrigae Dugand AE 5563 (CR) Nat. arb. Ficus insipida Willd. PS 60 (CR) Nat. arb. Ficus isophlebia Standl. JGL 5568 (CR) Nat. arb. Ficus maxima Mill. OV 1298 (CR) Nat. arb. Ficus nymphaeifolia Mill. JGL 6039 (CR) Nat. arb. Ficus microcarpa L. f. MQ 456 (CR) Intr. Arb. Ficus pertusa L. f. JGL 10183 (CR) Nat. arb. Ficus popenoei Standl. AE 4970 (CR) Nat. arb. Ficus schippii Standl. LP 1165 (CR) Nat. Bej. Ficus sp. * AE 5408 (CR) Nat. Arb. Ficus tonduzii Standl. AM 4 (CR-INB) Nat. arb. Ficus turrialbana W. C. Burger OV 1249 (CR) Nat. arb. Ficus yoponensis Desv. AE 5322 (CR) Nat. arb. Helicostylis tovarensis (Klotzsch & H. Karst.) C. C. Berg * GH 2697 (CR) Nat. Arb. Maquira guianensis subsp. costaricana (Standl.) C. C. Berg JGL 8355 (CR) Nat. arb. Naucleopsis naga Pittier BH 24678 (CR-INB) Nat. arb. Olmedia aspera Ruíz & Pav. FA 6837 (CR) Nat. arb. Perebea hispidula Standl. OV 1204 (CR) Nat. arb. Poulsenia armata (Miq.) Standl. JGL 9522 (CR) Nat. arb. Pseudolmedia spuria (Sw.) Griseb. BH 17525 (CR-INB) Nat. arb. Sorocea affinis Hemsl. WA 3277 (CR) Nat. arb. 183 Sorocea pubivena Hemsl. OV 1220 (CR) Nat. arb. Sorocea trophoides W. C. Burger JWK 3213 (CR) Nat. arb. Trophis involucrata W. C. Burger RA 4679 (CR-INB) Nat. Arbu. Trophis mexicana (Liebm.) Bureau * RR 2767 (CR-INB) Nat. Arb. Trophis racemosa (L.) Urb. PS 56 (CR) Nat. arb. Moringaceae Moringa oleifera Lam. AE 5479 (CR) Natu. arb. Muntingiaceae Dicraspidia donnell-smithii Standl. RB 68 (CR) Nat. arb. Muntingia calabura L. AE 4939(CR) Nat. arb. Myristicaceae Compsoneura mexicana (Hemsl.) Janovec JG 1537 (CR-INB) Nat. arb. Otoba acuminata (Standl.) A. H. Gentry BH 18120 (CR-INB) Nat. arb. Otoba novogranatensis Moldenke AE (Obs.) Nat. arb. Virola koschnyi Warb. MG 8004 (CR-INB) Nat. arb. Virola macrocarpa A. C. Sm. AE 5428 (CR) Nat. arb. Virola multiflora (Standl.) A. C. Sm. JG 1632 (CR-INB) Nat. arb. Virola sebifera Aubl. JFM 8005 (CR-INB) Nat. arb. Myrtaceae Calyptranthes chytraculia (L.) Sw. ARG 4925 (CR-INB) Nat. arb. Eugenia acapulcensis Steud. AE 5085 (CR) Nat. arb. Eugenia chepensis Standl. ARG 1006 (CR-INB) Nat. arb. Eugenia costaricensis O. Berg ARG 606 (INB) Nat. arb. Eugenia earthiana Sin autor JGL 8364 (CR) End. arb. Eugenia glandulosopunctata P. E. Sánchez & Poveda JS 2411 (CR) Nat. arb. Eugenia ludoviciana Gómez-Laur. AE 4802 (CR) End. Excl. arb. Eugenia monticola (Sw.) DC. RS 2054 (CR) Nat. arb. Eugenia sarapiquensis P. E. Sánchez EA 2120 (CR-INB) End. arb. Eugenia selvana Barrie LP 1153 (CR) End. arb. Eugenia siggersii Standl. RO 3655 (CR) Nat. arb. Eugenia stipitata McVaugh JGL 13034 (CR) Intr. Arbu. Myrcia splendens (Sw.) DC. GG 57 (CR-INB) Nat. arb. Pimenta guatemalensis (Lundell) Lundell AE 5224 (CR) Nat. arb. Pimenta racemosa (Mill.) J. W. Moore AE 5495 (CR) Intr. Arb. Plinia povedae P. E. Sánchez * GH 2643 (CR-INB) Nat. Arb. Plinia salticola McVaugh * GH 2712 (CR) Nat. Arb. Psidium guajava L. AQ 384 (CR) Nat. arb. Syzygium aromaticum (L.) Merr. & L. M. Perry AE 5473 (CR) Intr. Arb. 184 Nyctaginaceae Boerhavia coccinea Mill. AT s/n (CR) Natu. Herb. Boerhavia diffusa L. RB 161 (CR) Nat. Herb. Boerhavia erecta L. AT s/n (CR) Nat. Herb. Guapira costaricana (Standl.) Woodson JFM 8663 (CR-INB) Neea amplifolia Donn. Sm. GH 7724 (CR) Nat. Arbu. Neea delicatula Standl. LDV 3066 (INB) Nat. Arbu. Neea elegans P. H. Allen JFM 8001 (CR-INB) Nat. Arbu. Neea laetevirens Standl. AJI 2864 (CR) Nat. Arbu. Neea orosiana Standl. * DSn 6592 (CR) Nat. Arbu. Neea pittieri Standl. * ARG 11673 (INB) Nat. Arbu. Neea psychotrioides Donn. Sm. AT s/n (CR) Nat. Arbu. Neea urophylla Standl. MG 4382 (CR) Nat. Arbu. Pisonia aculeata L. AT s/n (CR) Nat. Arbu. Nat. arb. Nymphaeaceae Nymphaea ampla (Salisb.) DC. RS s/n (CR) Nat. Herb. Nymphaea glandulifera Rodschied HP s/n (CR) Nat. Herb. Nymphaea prolifera Wiersema MJB 425 (CR) Nat. Herb. Ochnaceae Cespedesia spathulata (Ruíz & Pav.) Planch. AE (Obs.) Nat. Arbu. Lacunaria panamensis (Standl.) Standl. GH 2986 (CR-INB) Nat. arb. Ouratea crassinervia Engl. AM 79 (CR-INB) Nat. Arbu. Ouratea lucens (Kunth) Engl. BH 24876 (CR-INB) Nat. Arbu. Ouratea prominens Dwyer GH 7588 (CR) Nat. arb. Ouratea valerioi Standl. AMC 59 (CR-INB) Nat. arb. Quiina macrophylla Tul. AE 414 (CR-INB) Nat. arb. Sauvagesia erecta L. GG 26 (CR-INB) Nat. Herb. Olacaceae Heisteria acuminata (Bonpl.) Engl. JG 1585 (CR-INB) Nat. arb. Heisteria concinna Standl. LA 2112 (INB) Nat. arb. Heisteria costaricensis Donn. Sm. WA 3220 (CR) Nat. Arbu. Heisteria macrophylla Oerst. JS 2644 (CR) Nat. arb. Heisteria povedae Q. Jiménez & S. Knapp HP 9174 (CR) Nat. arb. Heisteria scandens Ducke * GH 2652 (CR-INB) Nat. Bej. Minquartia guianensis Aubl. AE 4859 (CR) Nat. arb. Oleaceae Chionanthus panamensis (Standl.) Stearn AE 5233 (CR) Nat. arb. 185 Onagraceae Ludwigia affinis (DC.) H. Hara JG 2829 (CR-INB) Nat. Herb. Ludwigia decurrens Walter FA 3246 (CR) Nat. Herb. Ludwigia erecta (L.) H. Hara JG 2767 (CR-INB) Nat. Herb. Ludwigia helminthorrhiza (Mart.) H. Hara JG 2262 (CR-INB) Nat. Herb. Ludwigia hyssopifolia (G. Don) Exell AE 5751 (CR) Nat. Herb. Ludwigia latifolia (Benth.) H. Hara JG 1541 (CR-INB) Nat. Herb. Ludwigia octovalvis (Jacq.) P. H. Raven MBG 706 (CR) Nat. Herb. Ludwigia peploides (Kunth) P. H. Raven GH 7583 (CR) Nat. Herb. Oxalidaceae Averrhoa bilimbi L. AE 5484 (CR) Intr. Arb. Averrhoa carambola L. RO 3547 (CR) Intr. Arb. Oxalis barrelieri L. BH 19664 (CR-INB) Nat. Herb. Oxalis microcarpa Benth. RO 2839 (CR) Nat. Herb. Papaveraceae Bocconia frutescens L. SG s/n (CR) Nat. Arbu. Passifloraceae Passiflora ambigua Hemsl. GH 2504 (CR-INB) Nat. Bej. Passiflora arbelaezii L. Uribe MG 8043 (CR-INB) Nat. Bej. Passiflora auriculata Kunth MG 8061 (CR-INB) Nat. Bej. Passiflora biflora Lam. RB 18 (CR) Nat. Bej. Passiflora costaricensis Killip AT 9327 (CR) Nat. Bej. Passiflora edulis Sims MBG 199 (CR) Intr. Bej. Passiflora foetida L. K 1183 (CR) Nat. Bej. Passiflora guatemalensis S. Watson LA 1911 (CR-INB) Nat. Bej. Passiflora lancearia Mast. LDG 23493 (CR) Nat. Bej. Passiflora lobata (Killip) Hutch. ex J. M. MacDougal RB 129 (CR) Nat. Bej. Passiflora megacoriacea Porter-Utley AE 5051 (CR) Nat. Bej. Passiflora menispermifolia Kunth AT s/n (CR) Nat. Bej. Passiflora nelsonii Mast. & Rose AE 5580 (CR) Nat. Bej. Passiflora oerstedii Mast. AE 5532 (CR) Nat. Bej. Passiflora pallida L. AE 5509 (CR) Nat. Excl. Bej. Passiflora pittieri Mast. AE 5777 (CR) Nat. Bej. Passiflora quadrangularis L. AT s/n (CR) Nat. Bej. Passiflora seemannii Griseb. MG 4523 (CR) Nat. Bej. Passiflora serratifolia L. AT s/n (CR) Nat. Bej. Passiflora sp. * AE 5214 (CR) Nat. Bej. Passiflora talamancensis Killip AE 4982 (CR) Nat. Bej. Passiflora vitifolia Kunth WB 10375 (CR) Nat. Bej. 186 Turnera diffusa Willd. ex Schult. JJC 2146 (CR) Nat. Herb. Turnera subulata Sm. AE 5685 (CR) Intr. Herb. Turnera ulmifolia L. MBG 694 (CR) Nat. Herb. Pentaphylacaceae Ternstroemia tepezapote Schltdl. & Cham. * GH 2694 (CR) Nat. Arb. Phyllanthaceae Hieronyma alchorneoides Allemao DS 1928 (CR-INB) Nat. arb. Margaritaria nobilis L. f. JFM 19675 (INB) Nat. arb. Phyllanthus acuminatus Vahl JG 518 (CR-INB) Nat. arb. Phyllanthus amarus Schumach. & Thonn. JG 505 (CR-INB) Nat. Herb. Phyllanthus skutchii Standl. ARG 862 (INB) Nat. arb. Phyllanthus urinaria L. RS 2114 (CR) Nat. Herb. Sauropus androgynus (L.) Merr. BH 24892 (CR-INB) Intr. Arbu. Phytolaccaceae Microtea debilis Sw. AT s/n (CR) Nat. Herb. Petiveria alliacea L. EMC 185 (CR-INB) Nat. Herb. Phytolacca rivinoides Kunth & C. D. Bouché AQ 353 (CR) Nat. Herb. Rivina humilis L. MBG 693 (CR) Nat. Herb. Trichostigma octandrum (L.) H. Walter HP s/n (CR) Nat. Arbu. Trichostigma polyandrum (Loes.) H. Walter JS 338 (CR) Nat. Arbu. Picramniaceae Picramnia latifolia Tul. LA 2051 (CR-INB) Nat. arb. Picramnia teapensis Tul. * RR 2784 (INB) Nat. Arbu. Piperaceae Peperomia alata Ruíz & Pav. LDG 23520 (CR) Nat. Herb. ep. Peperomia distachya (L.) A. Dietr. AT 9543 (CR) Nat. Herb. ep. Peperomia ebingeri Yunck. JGL 8377 (CR) Nat. Herb. ep. Peperomia emarginella (Sw. ex Wikstr.) C. DC. * RR 2740 (CR) Nat. Herb. ep. Peperomia emiliana C. DC. JU 667 (CR) Nat. Herb. ep. Peperomia glabella (Sw.) A. Dietr. AT s/n (CR) Nat. Herb. ep. Peperomia guapilesiana Trel. LDG 23440 (CR) Nat. Herb. Peperomia hernandiifolia (Vahl) A. Dietr. ARB 1757 (CR) Nat. Herb. ep. Peperomia lancifolia Hook. LDG 23504 (CR) Nat. Herb. ep. Peperomia lancifolioidea W. C. Burger * DSn 6846 (INB) Nat. Herb. ep. Peperomia macrostachyos (Vahl) A. Dietr. WH 78 (CR) Nat. Herb. ep. Peperomia magnoliifolia (Jacq.) A. Dietr. MG 8470 (CR-INB) Nat. Arbu. ep. 187 Peperomia montecristana Trel. MG 4495 (CR) Nat. Herb. ep. Peperomia montium C. DC. ASO 23418 (CR) Nat. Herb. ep. Peperomia obtusifolia (L.) A. Dietr. AT s/n (CR) Nat. Herb. ep. Peperomia oerstedii C. DC. JGL 8729 (CR) Nat. Herb. ep. Peperomia pellucida (L.) Kunth AT s/n (CR) Nat. Herb. ep. Peperomia pernambucensis Miq. AT s/n (CR) Nat. Herb. ep. Peperomia pseudopereskiifolia C. DC. AMO 185 (INB) Nat. Herb. Peperomia pseudorhynchophoros C. DC. BH 22312 (CR-INB) Nat. Herb. ep. Peperomia rotundifolia (L.) Kunth ARG 2314 (CR-INB) Nat. Herb. ep. Peperomia seemanniana Miq. AT 9268 (CR) Nat. Herb. ep. Peperomia serpens (Sw.) Loudon AE 2519 (CR) Nat. Herb. ep. Peperomia syringifolia C. DC. * RR 2759 (CR) Nat. Herb. ep. Peperomia tsakiana C. DC. AT 9540 (CR) Nat. Herb. ep. Peperomia urocarpa Fisch. & C. A. Mey. AS 65 (CR-INB) Nat. Herb. Piper aduncum L. AT s/n (CR) Nat. Arbu. Piper aequale Vahl AT 9387 (CR) Nat. Arbu. Piper aereum Trel. * GH 2704 (CR) Nat. Arbu. Piper arboreum Aubl. AQ 3268 (CR) Nat. arb. Piper arieianum C. DC. MG 5804 (CR) Nat. Arbu. Piper auritum Kunth AQ 335 (CR) Nat. arb. Piper biauritum C. DC. AT 9270 (CR) Nat. Arbu. Piper biolleyi C. DC. AT s/n (CR) Nat. Arbu. Piper biseriatum C. DC. MG 5288 (CR) Nat. Arbu. Piper cenocladum C. DC. AT 9533 (CR) Nat. Arbu. Piper chrysostachyum C. DC. * RR 2725 (CR) Nat. Arbu. Piper corrugatum Kuntze AT 8721 (CR) Nat. Arbu. Piper divaricatum G. Mey. K 1224 (CR) Nat. Arbu. Piper dryadum C. DC. LA 2158 (CR-INB) Nat. Arbu. Piper exiguicaule Yunck. LDG 23502 (CR) Nat. Arbu. Piper fimbriulatum C. DC. AT s/n (CR) Nat. Arbu. Piper friedrichsthalii C. DC. AT s/n (CR) Nat. Arbu. Piper garagaranum C. DC. JGL 8840 (CR) Nat. Herb. Piper glabrescens (Miq.) C. DC. AT 9271 (CR) Nat. Arbu. Piper hispidum Sw. ARG 1907 (CR-INB) Nat. Arbu. Piper imperiale (Miq.) C. DC. GG 122 (INB) Nat. arb. Piper jacquemontianum Kunth HP 12690 (CR) Nat. Arbu. Piper littorale C. DC. AT 9130 (CR) Nat. Arbu. Piper melanocladum C. DC. MG 4469 (CR) Nat. Arbu. Piper multiplinervium C. DC. RO 3665 (CR) Nat. Arbu. Piper nudifolium C. DC. AT s/n (CR) Nat. Herb. Piper otophorum C. DC. JGL 8722 (CR) Nat. Arbu. Piper ottoniifolium C. DC. AT 8675 (CR) Nat. Arbu. 188 Piper peltatum Ruíz & Pav. WH 172 (CR) Nat. Herb. Piper perbrevicaule Yunck. LDG 23446 (CR) Nat. Arbu. Piper phytolaccifolium Opiz JB 2206 (CR) Nat. Arbu. Piper polytrichum C. DC. ARB 1754 (CR) Nat. Arbu. Piper prismaticum C. DC. LA 2092 (CR-INB) Nat. Arbu. Piper pseudolindenii C. DC. AT s/n (CR) Nat. Arbu. Piper reptabundum C. DC. AT 9277 (CR) Nat. Arbu. Piper reticulatum L. AT s/n (CR) Nat. Arbu. Piper schiedeanum Steud. ARG 1924 (CR-INB) Nat. Arbu. Piper silvivagum C. DC. AT 9272 (CR) Nat. Arbu. Piper sinugaudens C. DC. AT s/n (CR) Nat. Arbu. Piper subsessilifolium C. DC. JGL 8804 (CR) Nat. Arbu. ep. Piper terrabanum C. DC. AT s/n (CR) Nat. Arbu. Piper tonduzii C. DC. HP 9392 (CR) Nat. Arbu. Piper trigonum C. DC. RC 13567 (CR-INB) Nat. Arbu. Piper tuberculatum Jacq. LG 1769 (CR-INB) Nat. Arbu. Piper urophyllum C. DC. AT 9537 (CR) Nat. Arbu. Piper urostachyum Hemsl. AQ 366 (CR) Nat. Arbu. Piper villiramulum C. DC. AT 9274 (CR) Nat. Arbu. Piper virgultorum C. DC. AT 9387 (CR) Nat. Arbu. Piper yucatanense C. DC. RC 13555 (INB) Nat. Arbu. Piper zacatense C. DC. RC 13578 (INB) Nat. Herb. Plantaginaceae Bacopa monnieri (L.) Pennell HP 10341 (CR) Nat. Herb. Mecardonia procumbens (Mill.) Small AT 8703 (CR) Nat. Herb. Plantago major L. AE 356 (CR-INB) Natu. Herb. Russelia equisetiformis Schltdl. & Cham. 75-104 (CR) Intr. Herb. Scoparia dulcis L. AT s/n (CR) Nat. Herb. Stemodia verticillata (Mill.) Hassl. JG 2975 (INB) Nat. Herb. Tetranema gamboanum Grayum & Hammel * GH 2644 (CR-INB) End. Herb. Plumbaginaceae Plumbago zeylanica L. K 1211 (CR) Nat. Herb. Podostemaceae Marathrum foeniculaceum Bonpl. RO 2168 (CR) Nat. Herb. Polygalaceae Monnina parasylvatica C. M. Taylor GC 245 (INB) Nat. Arbu. Moutabea gentryi T. Wendt JG 1609 (CR-INB) Nat. Bej. Polygala paniculata L. AT s/n (CR) Nat. Herb. Securidaca diversifolia Pol. QJ 809 (CR-INB) Nat. Arbu. 189 Polygonaceae Coccoloba lehmannii Lindau JGL 11953 (CR-INB) Nat. arb. Coccoloba obovata Kunth ARG 4585 (INB) Extranjera arb. Coccoloba tuerckheimii Donn. Sm. AE (Obs.) Nat. arb. Coccoloba uvifera (L.) L. AT s/n (CR) Nat. arb. Polygonum hydropiperoides Michx. AT 9287 (CR) Nat. Herb. Polygonum punctatum Elliott AT s/n (CR) Nat. Herb. Portulacaceae Portulaca oleracea L. JGL 8391 (CR) Nat. Herb. Primulaceae Ardisia auriculata Donn. Sm. JS 2276 (CR) Nat. arb. Ardisia compressa Kunth WH 182 (CR) Nat. arb. Ardisia copeyana Standl. JS 2258 (CR) End. arb. Ardisia nevermannii Standl. OV 1156 (CR) Nat. Arbu. Ardisia nigropunctata Oerst. AT s/n (CR) Nat. arb. Ardisia opegrapha Oerst. GH 2368 (CR-INB) Nat. Arbu. Ardisia pellucida Oerst. GG 256 (INB) Nat. Arbu. Ardisia wedelii Lundell AE 5453 (CR) Nat. Arbu. Clavija costaricana Pittier MG 4462 (CR) Nat. Arbu. Cybianthus schlimii (Hook. f.) G. Agostini AE 4964 (CR) Nat. Arbu. Hymenandra pittieri (Mez) Pipoly & Ricketson RB 126 (CR) Nat. Arbu. Hymenandra stenophylla (Donn. Sm.) Pipoly & Ricketson HP 9173 (CR) Nat. Arbu. Stylogyne turbacensis (Kunth) Mez PS 87 (CR) Nat. arb. Putranjivaceae Drypetes brownii Standl. * DSn 6819 (INB) Nat. Arb. Drypetes standleyi G. L. Webster ARG 4540 (CR-INB) Nat. arb. Rhamnaceae Colubrina spinosa Donn. Sm. AT 8507 (CR) Nat. arb. Gouania colombiana Suess. JGL 8363 (CR) Nat. Bej. Gouania hypoglauca Standl. AC 546 (CR) Nat. Bej. Gouania polygama (Jacq.) Urb. JFM 7697 (CR-INB) Nat. Bej. Rhamnidium caloneurum Standl. ARG 4919 (INB) Nat. Excl. arb. Rhizophoraceae Cassipourea guianensis Aubl. OV 1279 (CR) Nat. arb. Rhizophora mangle L. RS 88669 (CR) Nat. arb. 190 Rubiaceae Alibertia dwyeri Delprete & C.H. Perss. JS 2439 (CR) Nat. arb. Alibertia edulis (A. Rich.) A. Rich. HP s/n (CR) Nat. Arbu. Alibertia utleyorum (Dwyer) C. M. Taylor MG 4459 (CR) End. arb. Alseis costaricensis C. M. Taylor JG 1552 (CR-INB) End. arb. Amphidasya longicalycina (Dwyer) C. M. Taylor * GH 2520 (CR) Nat. Herb. Arachnothryx bertieroides (Standl.) Borhidi JGL 9334 (CR) Nat. arb. Arachnothryx calycosa (Donn. Sm.) Borhidi * 2670 (CR) End. Arb. Arachnothryx costaricensis (Standl.) Borhidi JS 2271 (CR) Nat. arb. Arachnothryx torresii (Standl.) Borhidi JS 2399 (CR) Nat. Arbu. Bertiera bracteosa (Donn. Sm.) B. Ståhl & L. Andersson JBE 53 (CR) Nat. Arbu. Bertiera guianensis Aubl. GG 60 (CR-INB) Nat. arb. Chimarrhis parviflora Standl. JS 2565 (CR) Nat. arb. Chiococca alba (L.) Hitchc. AT s/n (CR) Nat. Arbu. Chiococca belizensis Lundell MG 8058 (CR-INB) Nat. Bej. Chione venosa (Sw.) Urb. ARG 588 (CR-INB) Nat. arb. Coccocypselum hirsutum Bartl. ex DC. * ARG 11411 (CR-INB) Nat. Herb. Coffea arabica L. LA 2072 (INB) Intr. Arbu. Coffea canephora Pierre ex A. Froehner LA 2072 (INB) Intr. Arb. Cosmibuena grandiflora (Ruíz & Pav.) Rusby PS 118 (CR) Nat. arb. Cosmibuena macrocarpa Benth. PS 98 (CR) Nat. arb. Cosmibuena valerioi (Standl.) C. M. Taylor * GH 2698 (CR) Nat. Arbu. ep. Coussarea curvigemmia Dwyer JGL 11956 (CR-INB) Nat. arb. Coussarea duplex C. M. Taylor * RR 2748 (CR) Nat. Arbu. Coussarea impetiolaris Donn. Sm. OV 1169 (CR) Nat. arb. Coussarea latifolia Standl. AT 9574 (CR) Nat. arb. Coussarea loftonii (Dwyer & M. V. Hayden) Dwyer KB 2642 (CR) Nat. Arbu. Coussarea talamancana Standl. ARG 2240 (CR-INB) Nat. arb. Diodia serrulata (P. Beauv.) G. Taylor JGL 12109 (CR) Nat. Herb. Duroia costaricensis Standl. SL 3113 (CR) End. arb. Faramea eurycarpa Donn. Sm. * DSn 6490 (INB) Nat. Arb. Faramea glandulosa Poepp. & Endl. JS 2330 (CR) Nat. arb. Faramea multiflora A. Rich. GH 2544 (CR) Nat. arb. Faramea occidentalis (L.) A. Rich. JB 2284 (CR) Nat. arb. Faramea parvibractea Steyerm. JS 2255 (CR) Nat. arb. Faramea scalaris Standl. * RR 2692 (CR) Nat. Arb. Faramea suerrensis (Donn. Sm.) Donn. Sm. AE 392 (CR-INB) Nat. arb. Faramea trinervia K. Schum. & Donn. Sm. AT s/n (CR) Nat. Arbu. Genipa americana L. AM 16 (CR-INB) Nat. arb. Geophila macropoda (Ruíz & Pav.) DC. AF 1411 (CR-INB) Nat. Herb. Geophila repens (L.) I. M. Johnst. JS 2589 (CR) Nat. Herb. Gonzalagunia ovatifolia (Donn. Sm.) B. L. Rob. HP s/n (CR) Nat. Arbu. 191 Gonzalagunia stenostachya (Standl.) Burger * DS 4855 (INB) Nat. Arbu. Guettarda crispiflora Vahl AE 5726 (CR) Nat. arb. Guettarda foliacea Standl. DS 5970 (INB) Nat. arb. Hamelia axillaris Sw. ARG 2264 (CR-INB) Nat. Arbu. Hamelia macrantha Little JS 2346 (CR) Nat. Arbu. Hamelia magnifolia Wernham JS 2398 (CR) Nat. Arbu. Hamelia patens Jacq. AT s/n (CR) Nat. Arbu. Hamelia xerocarpa Kuntze WB 10986 (CR) Nat. Arbu. Hippotis panamensis (Dwyer) C. M. Taylor GH 2426 (CR-INB) Nat. arb. Hoffmannia bullata L. O. Williams MG 5789 (CR) Nat. Herb. Hoffmannia congesta (Oerst.) Dwyer * ARG 11648 (INB) Nat. Herb. Hoffmannia inamoena Standl. JB 2248 (CR) Nat. Herb. Hoffmannia liesneriana L. O. Williams GH 2989 (CR-INB) Nat. Herb. Hoffmannia limonensis C. M. Taylor QJ 1832 (CR-INB) Nat. Herb. Hoffmannia longipetiolata Pol. CS 812 (CR) Nat. Arbu. Hoffmannia subauriculata Standl. FL 60 (CR) Nat. Herb. Hoffmannia subcapitata C. M. Taylor JS 2416 (CR) End. Excl. Herb. Hoffmannia valerioi Standl. GH 7723 (CR) Nat. Arbu. Hoffmannia vesiculifera Standl. JS 2262 (CR) Nat. Herb. Hoffmannia viridis Rusby JG 1881 (INB) Nat. Herb. Isertia haenkeana DC. CSA S/n (CR) Nat. arb. Isertia laevis (Triana) B. M. Boom JGL 8758 (CR) Nat. arb. Ixora coccinea L. MBG 682 (CR) Intr. Arbu. Ixora nicaraguensis Wernham HP s/n (CR) Nat. arb. Machaonia martinicensis (DC.) Standl. HP s/n (CR) Nat. Arbu. Macrocnemum roseum (Ruíz & Pav.) Wedd. BH 14293 (CR) Nat. arb. Malanea erecta Seem. GH 7619 (CR) Nat. Bej. Manettia longipedicellata C. M. Taylor JG 2852 (INB) Nat. Bej. Manettia reclinata L. JGL 12183 (CR) Nat. Bej. Mitracarpus hirtus (L.) DC. RB 142 (CR) Nat. Herb. Morinda citrifolia L. LDG 307 (CR) Intr. Arb. Morinda panamensis Seem. JGL 5542 (CR) Nat. arb. Notopleura anomothyrsa (K. Schum. & Donn. Sm.) C.M. Taylor BH 17496 (CR) Nat. Herb. Notopleura capacifolia (Dwyer) C. M.Taylor JG 1556 (CR-INB) Nat. Herb. Notopleura capitata C. M. Taylor AF 479 (INB) Nat. Herb. Notopleura macrophylla (Ruíz & Pav.) C. M. Taylor BH 17946 (INB) Nat. Herb. Notopleura pithecobia (Standl.) C. M. Taylor * GH 2688 (CR) Nat. Arbu. ep. Notopleura polyphlebia (Donn. Sm.) C. M. Taylor KB 3048 (CR) Nat. Herb. Notopleura siggersiana (Standl.) C. M. Taylor JS 2414 (CR) Nat. Herb. Notopleura tonduzii (Standl.) C. M. Taylor ARG 552 (CR-INB) Nat. Herb. Notopleura uliginosa (Sw.) Bremek. GC 234 (CR-INB) Nat. Herb. Oldenlandia corymbosa L. RS 2111 (CR) Nat. Herb. 192 Oldenlandia lancifolia (Schumach.) DC. RH 83103 (CR) Nat. Herb. Palicourea beachiana C. M. Taylor * RR 2667 (CR) Nat. Arb. Palicourea calidicola (C.M. Taylor) C.M. Taylor OV 1172 (CR) Nat. arb. Palicourea eurycarpa (Standl.) C.M. Taylor * JS 2616 (CR) Nat. Arb. Palicourea gomezii C. M. Taylor * DS 4899 (INB) Nat. Arbu. Palicourea guianensis Aubl. PS 69 (CR) Nat. arb. Palicourea hondensis (Standl.) C. M. Taylor OV 1125 (CR) Nat. arb. Palicourea padifolia (Roem. & Schult.) C. M. Taylor & Lorence * GH 2715 (CR) Nat. Arb. Palicourea standleyana C. M. Taylor * DSn 6637 (CR) Nat. Arbu. Palicourea tetragona (Donn. Sm.) C. M. Taylor & Lorence ARG 2274 (CR-INB) Nat. Arbu. Palicourea triphylla DC. OV 1134 (CR) Nat. Herb. Palicourea umbelliformis (Dwyer & M. V. Hayden) C. M. Taylor JS 2347 (CR) Nat. Arbu. Pentagonia costaricensis (Standl.) W. C. Burger & C. M. Taylor AF 472 (CR-INB) Nat. arb. Pentagonia donnell-smithii (Standl.) Standl. JS 2296 (CR) Nat. arb. Pentagonia hirsuta Standl. BH 21926 (CR-INB) Nat. Excl. arb. Pentagonia nuciformis Dwyer ARG 654 (CR-INB) Nat. arb. Pentagonia sp. A BH 21930 (CR-INB) Nat. arb. Pentagonia wendlandii Hook. JGL 11958 (CR-INB) Nat. arb. Posoqueria coriacea M. Martens & Galeotti CSA S/n (CR) Nat. arb. Posoqueria grandiflora Standl. AE 5458 (CR) Nat. arb. Posoqueria grandifructa Hammel & C. M. Taylor JS 2231 (CR) Nat. arb. Posoqueria latifolia (Rudge) Roem. & Schult. OV 1263 (CR) Nat. arb. Psychotria acuminata Benth. GH 7657 (CR) Nat. Arbu. Psychotria alfaroana Standl. MG 5271 (CR) Nat. Herb. Psychotria angustiflora K. Krause ARG 693 (CR-INB) Nat. arb. Psychotria berteroana DC. JS 2204 (CR) Nat. arb. Psychotria brachiata Sw. ARG 2267 (CR-INB) Nat. Arbu. Psychotria buchtienii (H. J. P. Winkl.) Standl. KB 3571 (CR) Nat. Arbu. Psychotria chagrensis Standl. OV 1128 (CR) Nat. Arbu. Psychotria chiriquensis (Standl.) C. M. Taylor * JS 2392 (CR) Nat. Arbu. Psychotria chitariana Dwyer & C. W. Ham. ARG 849 (CR-INB) End. Arbu. Psychotria clivorum Standl. & Steyerm. JS 2331 (CR) Nat. Arbu. Psychotria cooperi Standl. JS 2393 (CR) Nat. Arbu. Psychotria croceovenosa Dwyer * DSn 6636 (CR) Nat. Arbu. Psychotria cyanococca Leem. GG 110 (CR-INB) Nat. Arbu. Psychotria deflexa DC. GC 231 (CR-INB) Nat. Arbu. Psychotria elata (Sw.) Hammel JS 2265 (CR) Nat. Arbu. Psychotria grandis Sw. JGL 9488 (CR) Nat. arb. Psychotria guapilensis (Standl.) Hammel AC 531 (CR) Nat. Herb. Psychotria hamiltoniana C. M. Taylor JS 2479 (CR) Nat. arb. Psychotria hispidula Standl. ex Steyerm. AMO 130 (CR-INB) Nat. Arbu. Psychotria hoffmannseggiana Müll. Arg. BH 14299 (CR) Nat. Arbu. 193 Psychotria jimenezii Standl. JGL 8372 (CR) End. Arbu. Psychotria limonensis K. Krause JB 2290 (CR) Nat. Arbu. Psychotria longicuspis Müll. Arg. * JS 2472 (CR) Nat. Arbu. Psychotria luxurians Rusby ARG 716 (CR-INB) Nat. arb. Psychotria marginata Sw. ARG 2261 (CR-INB) Nat. Arbu. Psychotria micrantha Kunth AC 570 (CR) Nat. Arbu. Psychotria microbotrys Ruíz ex Standl. OV 1124 (CR) Nat. Arbu. Psychotria mortoniana Standl. JS 2442 (CR) Nat. Arbu. Psychotria neillii C. W. Ham. & Dwyer KB 3570 (CR) Nat. Arbu. Psychotria nervosa Sw. NG 1445 (CR) Nat. Arbu. Psychotria panamensis Standl. AMO 141 (CR-INB) Nat. arb. Psychotria phanerandra (Standl. & Steyerm.) Lorence * JS 2386 (CR) Nat. Arbu. Psychotria pilosa Ruíz & Pav. MG 4482 (CR) Nat. Arbu. Psychotria poeppigiana Müll. Arg. OV 1225 (CR) Nat. Arbu. Psychotria psychotriifolia (Seem.) Standl. OV 1115 (CR) Nat. Arbu. Psychotria racemosa (Aubl.) Willd. ARG 2275 (CR-INB) Nat. Arbu. Psychotria remota Benth. JGL 8817 (CR) Nat. Arbu. Psychotria simiarum Lorence OV 1288 (CR) Nat. arb. Psychotria sixaolensis C. W. Ham. ARG 2263 (CR-INB) Nat. Excl. arb. Psychotria stenostachya Standl. JGL 9534 (CR) Nat. Arbu. Psychotria suerrensis Donn. Sm. OV 1141 (CR) Nat. Arbu. Psychotria tenuifolia Sw. GG 254 (CR-INB) Nat. Arbu. Psychotria trichotoma Mart. & Galeotti JS 2345 (CR) Nat. Arbu. Psychotria tsakiana C.M. Taylor GC 482 (INB) Nat. Arbu. Randia aculeata L. AE 2523 (CR) Nat. arb. Randia altiscandens (Ducke) C. M. Taylor GH 2350 (CR-INB) Nat. Bej. Randia brenesii Standl. JS 2270 (CR) Nat. arb. Randia genipoides Dwyer AM 71 (CR-INB) Nat. arb. Randia grandifolia (Donn. Sm.) Standl. JB 2241 (CR) Nat. arb. Randia grayumii Dwyer MG 5287 (CR) Nat. arb. Randia mira Dwyer LDG 23510 (CR) Nat. arb. Raritebe palicoureoides Wernham AM 72 (CR-INB) Nat. arb. Richardia scabra L. WB 10344 (CR) Nat. Herb. Ronabea emetica (L. f.) A. Rich. MG 4522 (CR) Nat. Herb. Rudgea cornifolia (Kunth) Standl. EA 2110 (CR-INB) Nat. arb. Rudgea trifurcata Gómez-Laur. ARG 2241 (CR-INB) End. arb. Rustia occidentalis (Benth.) Hemsl. RS 755 (CR) Nat. arb. Sabicea panamensis Wernham AC 518 (CR) Nat. Bej. Sabicea villosa Roem. & Schult. RO 3169 (CR) Nat. Bej. Schradera reticulata J. Sánchez-Gonz. GH 7585 (CR) Nat. Arbu. ep. Simira maxonii (Standl.) Steyerm. OV 1205 (CR) Nat. arb. Sommera donnell-smithii Standl. GC 387 (CR-INB) Nat. arb. 194 Spermacoce alata Aubl. JG 2221 (INB) Nat. Herb. Spermacoce densiflora (DC.) Alain WH 180 (CR) Nat. Herb. Spermacoce ocymifolia Willd. ex Roem. & Schult. GG 238 (CR-INB) Spermacoce remota Lam. JGL 5552 (CR) Nat. Herb. Uncaria tomentosa (Willd.) DC. AE 2516 (CR) Nat. Bej. Warszewiczia coccinea (Vahl) Klotzsch WB 10885 (CR) Nat. arb. Nat. Herb. Rutaceae Amyris brenesii Standl. LP 4029 (CR) End. arb. Conchocarpus guyanensis (Pulle) Kallunki & Pirani ARG 633 (CR-INB) Nat. arb. Conchocarpus nicaraguensis (Standl. & L. O. Williams) Kallunki & Pirani ARG 647 (CRINB) Nat. arb. Esenbeckia pentaphylla (Macfad.) Griseb. GH 3068 (CR-INB) Nat. arb. Galipea dasysperma Gómez-Laur. & Q. Jiménez JGL 8800 (CR) Nat. arb. Murraya koenigii (L.) Spreng. AE 5474 (CR) Intr. Arb. Ravenia rosea Standl. OV 1159 (CR) Nat. arb. Ruta chalepensis L. RO 2857 (CR) Intr. Herb. Stauranthus perforatus Liebm. ARG 567 (CR-INB) Nat. arb. Zanthoxylum panamense P. Wilson AE 5259 (CR) Nat. arb. Sabiaceae Meliosma brenesii Standl. GH 2342 (CR-INB) Nat. arb. Meliosma depressiva J. F. Morales * GH 2584 (INB) End. Arb. Meliosma donnellsmithii Urb. BH 17531 (CR-INB) Nat. arb. Meliosma glabrata (Liebm.) Urb. AE 401 (CR-INB) Nat. arb. Salicaceae Banara guianensis Aubl. AE 5747 (CR) Nat. arb. Casearia aculeata Jacq. K 1220 (CR) Nat. arb. Casearia arguta Kunth JG 2222 (INB) Nat. arb. Casearia coronata Standl. & L. O. Williams OV 1158 (CR) Nat. arb. Casearia standleyana Sleumer ARG 2243 (CR-INB) End. arb. Casearia sylvestris Sw. QJ 800 (CR-INB) Nat. arb. Casearia tacanensis Lundell ARG 1923 (INB) Nat. arb. Hasseltia allenii Hammel & Grayum GC 368 (CR-INB) Nat. arb. Hasseltia floribunda Kunth GG 20 (CR-INB) Nat. arb. Laetia procera (Poepp.) Eichler AE (Obs.) Nat. arb. Laetia thamnia L. JG 177 (INB) Nat. arb. Lunania mexicana Brandegee RA 4664 (CR-INB) Nat. arb. Lunania parviflora Spruce ex Benth. NZ 2317 (CR-INB) Nat. arb. Macrohasseltia macroterantha (Standl. & L. O. Williams) L. O. Williams AE 4921 (CR) Nat. arb. 195 Pleuranthodendron lindenii (Turcz.) Sleumer LDV 3870 (CR-INB) Nat. arb. Prockia costaricensis Standl. ARG 682 (CR-INB) Nat. Arbu. Ryania speciosa Vahl WB 10308 A (CR) Nat. arb. Xylosma hispidula Standl. ARG 1011 (CR-INB) Nat. arb. Xylosma intermedia (Seem.) Triana & Planch. AE 523 (CR) Nat. arb. Xylosma oligandra Donn. Sm. AE 5759 (CR) Nat. arb. Xylosma panamensis Turcz. NZ 2316 (CR-INB) Nat. arb. Santalaceae Phoradendron burgeri Kuijt HP s/n (CR) Nat. Arbu. ep. Phoradendron piperoides (Kunth) Trel. JFM 7726 (CR-INB) Nat. Arbu. ep. Phoradendron quadrangulare (Kunth) Krug & Urb. ARG 2309 (CR-INB) Nat. Arbu. ep. Sapindaceae Allophylus psilospermus Radlk. LDG 23456 (CR) Nat. arb. Billia rosea (Planch. & Linden) C. Ulloa & P. Jørg. * AE (Obs.) Nat. Arb. Blighia sapida J. König K 1172 (CR) Intr. Arb. Cardiospermum grandiflorum Sw. RO 1799 (CR) Nat. Herb. Cupania cinerea Poepp. & Endl. RO 2905 (CR) Nat. arb. Cupania livida (Radlk.) Croat PS 104 (CR) Nat. arb. Cupania rufescens Triana & Planch. LA 2874 (INB) Nat. arb. Dodonaea viscosa Jacq. OV 1208 (CR) Nat. arb. Matayba ingifolia Standl. * GH 2693 (CR) Nat. Arb. Matayba oppositifolia (A. Rich.) Britton BH 17517 (CR-INB) Nat. arb. Nephelium mutabile L. JFM 13318 (CR-INB) Intr. Arb. Paullinia alata G. Don AT s/n (CR) Nat. Arbu. Paullinia austin-smithii Standl. JG 1742 (CR-INB) End. Arbu. Paullinia bracteosa Radlk. JG 1551 (CR-INB) Nat. Arbu. Paullinia clavigera Schltdl. JFM 4935 (CR-INB) Nat. Arbu. Paullinia cupana Kunth AE 5497 (CR) Intr. Bej. Paullinia ingifolia A. Rich. ex Juss. * AE 5721 (CR) Nat. Arbu. Paullinia itayensis J. F. Macbr. GH 2417 (CR-INB) Nat. Arbu. Paullinia mallophylla Radlk. WB 10327 (CR) Nat. Arbu. Paullinia pinnata L. ARG 2550 (CR-INB) Nat. Arbu. Paullinia pterocarpa Triana & Planch. AC 511 (CR) Nat. Arbu. Paullinia rugosa Benth. ex Radlk. AC 494 (CR) Nat. Arbu. Paullinia serjaniifolia Triana & Planch. OV 1136 (CR) Nat. Arbu. Paullinia trisulca Radlk. AM 86 (CR-INB) Nat. Arbu. Serjania atrolineata Wright AT s/n (CR) Nat. Arbu. Serjania circumvallata Radlk. JG 1646 (CR-INB) Nat. Arbu. Serjania mexicana (L.) Willd. AT s/n (CR) Nat. Arbu. Talisia nervosa Radlk. AE 5459 (CR) Nat. arb. 196 Sapotaceae Chrysophyllum argenteum Jacq. JS 2544 (CR) Nat. Arbu. Chrysophyllum cainito L. ARG 2234 (CR-INB) Nat. arb. Chrysophyllum colombianum (Aubrév.) T. D. Penn. * RR 2696 (CR) Nat. Arb. Chrysophyllum venezuelanense (Pierre) T. D. Penn. RO 2405 (CR) Nat. arb. Manilkara chicle (Pittier) Gilly QJ 781 (CR-INB) Nat. arb. Manilkara spectabilis (Pittier) Standl. AE 5434 (CR) End. Excl. arb. Manilkara zapota (L.) Royen TDP 11456 (CR) Nat. arb. Micropholis melinoniana Pierre JG 2811 (INB) Nat. arb. Pouteria bulliformis Q. Jiménez & T. D. Penn. LP 4563 (CR) Nat. arb. Pouteria caimito (Ruíz & Pav.) Radlk. AE 5485 (CR) Nat. arb. Pouteria campechiana (Kunth) Baehni TDP 11467 (CR) Nat. arb. Pouteria chiricana (Standl.) Baehni TDP 11472 (CR) Nat. arb. Pouteria durlandii (Standl.) Baehni TDP 11460 (CR) Nat. arb. Pouteria filiformis T. D. Penn. ARG 2242 (CR-INB) End. arb. Pouteria fossicola Cronquist LA 2822 (CR-INB) Nat. arb. Pouteria foveolata T. D. Penn. GC 278 (INB) Nat. arb. Pouteria reticulata (Engl.) Eyma TDP 11469 (CR) Nat. arb. Pouteria sapota (Jacq.) H. E. Moore & Stearn TDP 11473 (CR) Nat. arb. Pouteria silvestris T. D. Penn. ARG 655 (INB) Nat. arb. Pouteria sp. AE 5278 (CR) Nat. arb. Pouteria subrotata Cronquist TDP 11463 (CR) Nat. arb. Pouteria torta (Mart.) Radlk. TDP 11471 (CR) Nat. Arbu. Pouteria viridis (Pittier) Cronquist TDP 11470 (CR) Nat. arb. Sarcaulus brasiliensis (A. DC.) Eyma TDP 11466 (CR) Nat. arb. Sideroxylon capiri (A. DC.) Pittier AE 512 (CR) Nat. arb. Synsepalum dulcificum (Schumach. & Thonn.) Daniell AE 5477 (CR) Intr. Arb. Schlegeliaceae Schlegelia fastigiata Schery RB 45 (CR) Nat. Bej. Schlegelia nicaraguensis Standl. BH 24680 (INB) Nat. Bej. Scrophulariaceae Capraria biflora L. MQ s/n (CR) Nat. Herb. Simaroubaceae Quassia amara L. AQ 354 (CR) Nat. arb. Simarouba amara Aubl. RO 3682 (CR) Nat. arb. Siparunaceae Siparuna gesnerioides (Kunth) A. DC. * RR 2782 (INB) Nat. Arbu. Siparuna grandiflora (Kunth) Perkins GG 36 (CR-INB) Nat. Arbu. 197 Siparuna guianensis Aubl. MG 4507 (CR) Nat. Arbu. Siparuna pauciflora (Beurl.) A. DC. ARG 2298 (CR-INB) Nat. Arbu. Siparuna thecaphora (Poepp. & Endl.) A. DC. WA 3211 (CR) Nat. Arbu. Solanaceae Brugmansia suaveolens (Humb. & Bonpl. ex Willd.) Bercht. & J. Presl GC 357 (INB) Nat. Arbu. Capsicum annuum L. AT s/n (CR) Nat. Herb. Cestrum microcalyx Francey ARG 610 (CR-INB) Nat. Arbu. Cestrum nocturnum L. AT s/n (CR) Nat. Arbu. Cestrum racemosum Ruíz & Pav. AT 8624 (CR) Nat. Arbu. Cestrum reflexum Sendtn. AT 9191 (CR) Nat. Arbu. Cestrum schlechtendalii G. Don AM 48 (CR-INB) Nat. Arbu. Cestrum standleyi Francey UC 1910 (CR-INB) Nat. Arbu. Cuatresia cuneata (Standl.) Bohs ARG 4916 (INB) Nat. Arbu. Cuatresia exiguiflora (D'Arcy) Hunz. OV 1119 (CR) Nat. Arbu. Juanulloa mexicana (Schltdl.) Miers GH 7629 (CR) Nat. Bej. Lycianthes amatitlanensis (J. M. Coult. & Donn. Sm.) Bitter JLG s/n (CR) Nat. Herb. Lycianthes heteroclita (Sendtn.) Bitter MG 4437 (CR) Nat. Arbu. Lycianthes maxonii Standl. JS 322 (CR) Nat. Herb. Lycianthes multiflora Bitter RK 171 (INB) Nat. Bej. Lycianthes nitida Bitter AMC 54 (CR-INB) Nat. Arbu. Lycianthes sanctaeclarae (Greenm.) D'Arcy JS 2397 (CR) Nat. Arbu. ep. Lycianthes sanctae-marthae Bitter AM 5 (CR-INB) Nat. Excl. Bej. Merinthopodium neuranthum (Hemsl.) Donn. Sm. GH 2507 (CR-INB) Nat. Arbu. Physalis angulata L. K 1182 (CR) Nat. Herb. Physalis cordata Mill. AT s/n (CR) Nat. Herb. Physalis gracilis Miers JJC 2037 (CR) Nat. Herb. Physalis minuta Griggs JJC 2051 (CR) Nat. Herb. Physalis pubescens L. GG 163 (CR-INB) Nat. Herb. Solanum adhaerens Roem. & Schult. LDV 3852 (INB) Nat. Bej. Solanum arboreum Humb. & Bonpl. ex Dunal JGL 9533 (CR) Nat. Arbu. Solanum aturense Dunal JBE 60 (CR) Nat. Bej. Solanum canense Rydb. GG 162 (CR-INB) Nat. Herb. Solanum circinatum Bohs AE 545 (CR) Nat. Arbu. Solanum diversifolium Dunal BH 18123 (CR-INB) Nat. Arbu. ep. Solanum hispidum Pers. AT s/n (CR) Nat. Arbu. Solanum jamaicense Mill. JG 1544 (CR-INB) Nat. Arbu. Solanum lanceifolium Jacq. AT s/n (CR) Nat. Bej. Solanum lanceolatum Cav. WB s/n (CR) Nat. Arbu. Solanum lycopersicum L. RO 3092 (CR) Nat. Herb. Solanum mammosum L. AT s/n (CR) Nat. Arbu. 198 Solanum nudum Dunal JGL 3931 (CR) Nat. Arbu. Solanum phaseoloides Pol. AT s/n (CR) Nat. Arbu. Solanum ramonense Standl. & C. V. Morton AT s/n (CR) Nat. Arbu. Solanum roblense Bitter KB 3486 (CR) Nat. Arbu. Solanum rovirosanum Donn. Sm. JGL 12195 (CR) Nat. Arbu. Solanum rudepannum Dunal GC 424 (INB) Nat. Arbu. Solanum schlechtendalianum Walp. GH 3063 (CR-INB) Nat. Arbu. Solanum sessiliflorum Dunal RO 3654 (CR) Nat. Arbu. Solanum sotobosquense Bohs LA 1888 (INB) Nat. Arbu. Solanum torvum Sw. GG 222 (CR-INB) Nat. Arbu. Solanum trizygum Bitter JG 1746 (INB) Nat. Herb. Solanum truncatum Standl. & C. V. Morton JBE 60 (CR) Nat. Arbu. Solanum umbellatum Mill. JG 1660 (CR-INB) Nat. Arbu. Solanum velutinum Dunal AM 64 (INB) Nat. Arbu. Solanum volubile Sw. K 1198 (CR) Nat. Bej. Witheringia asterotricha (Standl.) Hunz. SG s/n (CR) Nat. Herb. Witheringia correana D'Arcy ARB 1959 (CR) Nat. Herb. Witheringia macrantha (Standl. & Morton) Hunz. ARG 698 (CR-INB) Nat. Herb. Witheringia meiantha (Donn. Sm.) Hunz. AT s/n (CR) Nat. Herb. Witheringia solanacea L'Her. AC 404 (CR) Nat. Herb. Sphenocleaceae Sphenoclea zeylanica Gaertn. ARG 4588 (CR-INB) Natu. Herb. Staphyleaceae Turpinia occidentalis (Sw.) G. Don BH 14294 (CR) Nat. arb. Theaceae Camellia sinensis (L.) Kuntze AE 5548 (CR) Intr. Arbu. Gordonia brenesii (Standl.) Q. Jiménez JG 2854 (INB) Nat. arb. Gordonia fruticosa (Schrad.) H. Keng * AE 5412 (CR) Nat. Arb. Thymelaeaceae Daphnopsis americana (Mill.) J. R. Johnst. * GH 2603 (CR-INB) Nat. Arbu. Daphnopsis morii Barringer & Nevling ARG 877 (CR-INB) Nat. arb. Ticodendraceae Ticodendron incognitum Gómez-Laur. & L. D. Goméz JFM 10930 (INB) Nat. arb. Ulmaceae Ampelocera macrocarpa Forero & A. H. Gentry ARG 4533 (INB) Nat. arb. 199 Urticaceae Boehmeria ramiflora Jacq. ARB 1682 (CR) Nat. Arbu. Cecropia insignis Liebm. AE (Obs.) Nat. arb. Cecropia obtusifolia Bertol. ARG 2646 (INB) Nat. arb. Coussapoa villosa Poepp. & Endl. AT 9520 (CR) Nat. arb. Laportea aestuans (L.) Chew JGL 3951 (CR) Nat. Herb. Myriocarpa longipes Liebm. JG 1605 (CR-INB) Nat. arb. Phenax angustifolius (Kunth) Wedd. AT s/n (CR) Nat. Arbu. Phenax hirtus (Sw.) Wedd. AQ 3321 (CR) Nat. Herb. Phenax sonneratii (Poir.) Wedd. AS 33 (CR-INB) Nat. Herb. Pilea ecboliophylla Donn. Sm. ARG 594 (CR-INB) Nat. Herb. ep. Pilea involucrata (Sims) Urb. ARG 11156 (INB) Intr. Herb. Pilea microphylla (L.) Liebm. ARG 2292 (CR-INB) Nat. Herb. Pilea nummulariifolia (Sw.) Wedd. MQ 464 (CR) Intr. Herb. Pilea pallida Killip ARG 3534 (CR-INB) End. Herb. Pilea pittieri Killip * GH 2635 (INB) End. Herb. Pilea pteropodon Wedd. MG 5272 (CR) Nat. Herb. Pilea pubescens Liebm. BH 22327 (INB) Nat. Herb. Pourouma bicolor Mart. AF 485 (INB) Nat. arb. Pourouma cecropiifolia Mart. AE 534 (CR) Intr. Arb. Pouzolzia guatemalana (Blume) Wedd. JU 5496 (CR) Nat. Arbu. Pouzolzia obliqua (Poepp.) Wedd. ARG 2278 (CR-INB) Nat. Herb. Urera baccifera (L.) Gaudich. JG 1563 (CR-INB) Nat. Arbu. Urera caracasana (Jacq.) Gaudich. ex Griseb. ARG 2279 (CR-INB) Nat. Arbu. Urera laciniata (Goudot) Wedd. LP 1159 (CR) Nat. Arbu. Urera lianoides A. K. Monro & Al. Rodr. FQ 12 (CR-INB) Nat. Bej. Urera simplex Wedd. AS 54 (CR-INB) Nat. Arbu. Urtica leptophylla Kunth GD 25762 (CR) Nat. Herb. Verbenaceae Citharexylum caudatum L. AJI 4107 (CR) Nat. arb. Citharexylum costaricense Moldenke AT 8735 (CR-INB) Nat. arb. Lantana camara L. AT s/n (CR) Nat. Arbu. Lantana trifolia L. MBG 688 (CR) Nat. Arbu. Lippia alba (Mill.) N. E. Br. ex Britton & P. Wilson AQ 352 (CR) Nat. Arbu. Phyla dulcis (Trevir.) Moldenke AT 9550 (CR) Nat. Herb. Phyla nodiflora (L.) Greene AT s/n (CR) Nat. Herb. Priva lappulacea (L.) Pers. HP s/n (CR) Nat. Herb. Stachytarpheta cayennensis (Rich.) Vahl K 1174 (CR) Nat. Herb. Stachytarpheta friedrichsthalii Hayek AT 9134 (CR) Nat. Arbu. Stachytarpheta jamaicensis (L.) J. Vahl JRG 92-01963 (CR) Nat. Herb. Verbena litoralis Kunth JFM 10937 (INB) Nat. Herb. Volkameria ligustrina Jacq. AE 2512 (CR) Nat. Arbu. 200 Violaceae Amphirrhox longifolia (A. St.-Hil.) Spreng. LRH 5335 (CR) Nat. arb. Corynostylis arborea (L.) S. F. Blake RA 4668 (CR-INB) Nat. Bej. Gloeospermum boreale C.V. Morton JG 1635 (CR-INB) Nat. arb. Gloeospermum diversipetalum L. O. Williams MG 4511 (CR) Nat. arb. Hybanthus attenuatus (Humb. & Bonpl. ex Roem. & Schult.) Schulze-Menz JG 2219 (INB) Nat. Herb. Hybanthus denticulatus H. E. Ballard RA 5663 (INB) Nat. Arbu. Rinorea crenata S. F. Blake WB 10919 (CR) Nat. arb. Rinorea dasyadena A. Robyns ARG 618 (CR-INB) Nat. arb. Rinorea squamata S. F. Blake UC 1926 (CR-INB) Nat. arb. Vitaceae Ampelocissus javalensis (Seem.) W. D. Stevens & A. Pool HP 8640 (CR) Nat. Bej. Cissus alata Jacq. AT 9363 (CR) Nat. Bej. Cissus biformifolia Standl. AM 50 (CR-INB) Nat. Bej. Cissus descoingsii Lombardi AT 9154 (CR) Nat. Bej. Cissus fuliginea Kunth WH 14 (CR) Nat. Bej. Cissus microcarpa Vahl HP 12407 (CR) Nat. Bej. Cissus ulmifolia (Baker) Planch. JFM 7980 (INB) Nat. Bej. Cissus verticillata (L.) Nicolson & C. E. Jarvis AT 8697 (CR) Nat. Bej. Vitis tiliifolia Humb. & Bonpl. ex Roem. & Schult. AT s/n (CR) Nat. Bej. Vochysiaceae Vochysia ferruginea Mart. AE (Obs.) Nat. arb. Vochysia gentryi Marc.-Berti * AE 5720 (CR) Nat. Arb. Vochysia guatemalensis Donn. Sm. JS 2368 (CR) Nat. arb. Ximeniaceae Ximenia americana L. GH 7587 (CR) Nat. arb. 201 Anexo 2. Lista de los macrohongos de la región de Baja Talamanca, Limón, Costa Rica Armando Ruiz Boyer Departamento de Historia Natural Museo Nacional de Costa Rica (Actualizado: 23 de julio de 2014) Abreviaciones y códigos empleados Los géneros y las especies se listan en orden alfabético, según clase, orden y familia de acuerdo con Kirk et al. (2008); con excepción del género Cotylidia que se presenta según Kirk et al. (2001). Observaciones (Obs.): (A), alucinógeno; (C), comestible; (M), medicinal; (T), tóxico. CLASE/Orden/Familia/Especie Testigo Obs. ASCOMYCETES Pezizales Sarcoscyphaceae Aurophora dochmia (Berk. & M.A. Curtis) Rifai Cookeina speciosa (Fr.:Fr.) Dennis Cookeina tricholoma (Mont.) Kuntze Phillipsia domingensis Berk. Phillipsia hartmannii (W. Phillips) Rifai Phillipsia olivacea Rick Umaña, M. 888 (INB) Ruiz-Boyer, A. et al. 2051 (CR) Umaña, M. 134 (INB) Umaña, M. 613 (INB) Calonge, F.D. s. n. (INB) Valladares, R. 372 (INB) C C Xylariales Xylariaceae Hypoxylon monticulosum Mont. Hypoxylon investiens (Schwein.) M.A. Curtis Kretzschmaria clavus (Fr.) Sacc. Kretzschmaria micropus (Fr.) Sacc. Xylaria coccophora Mont. Xylaria enterogena Mont. Xylaria filiformis (Alb. & Schwein.) Fr. Xylaria gracillima (Fr.) Fr. Xylaria hypoxylon (L.) Grev. Xylaria multiplex (Kunze) Fr. Xylaria nigrescens (Sacc.) Lloyd Xylaria obovata (Berk.) Berk. Xylaria polymorpha (Pers.) Grev. Xylaria telfairii (Berk.) Sacc. Valladares, R. 1757 (INB) Fletes, E. 56 (INB) Navarro, E. 6089 (INB) Valladares, R. 31 (INB) Valladares, R. 1751 (INB) Valladares, R. 1090 (INB) Calonge, F.D. s. n. (INB) Valladares, R. 434 (INB) Valladares, R. 41 (INB) Valladares, R. 408 (INB) Umaña, L. 2004 (INB) Navarro, E. 6128 (INB) Calonge, F.D. s. n. (INB) Navarro, E. 6136 (INB) M 202 BASIDIOMYCETES Agaricales Agaricaceae Agaricus riberaltensis Heinem. Calvatia candida (Rostk.) Hollós Calvatia rugosa (Berk. & M.A. Curtis) D.A. Reid Chlorophyllum molybdites (G. Mey.) Massee Coprinus disseminatus (Pers.) Gray Coprinus leiocephalus P.D. Orton Cyathus berkeleyanus (Tul. & C. Tul.) Lloyd Cyathus julietae H.J. Brodie Cyathus striatus (Huds.) Willd. Lepiota hemisclera (Berk. & M.A. Curtis) Sacc. Leucoagaricus hortensis (Murrill) Pegler Lycogalopsis solmsii E. Fisch. Lycoperdon echinatum Pers. Lycoperdon juruense Henn. Lycoperdon perlatum Pers. Lycoperdon pyriforme Schaeff. Morganella afra Kreisel & Dring Morganella fuliginea (Berk. & M.A. Curtis) Umaña, M. 352 (INB) Valladares, R. 52 (INB) Umaña, M. 332 (INB) Umaña, M. 205 (INB) Valladares, R. 455 (INB) Umaña, M. 108 (INB) Navarro, E. 699 (INB) Umaña, M. 155 (INB) Ruiz-Boyer, A. et al. 2044 (CR) Umaña, M. 1188 (INB) Umaña, M. 1191 (INB) Umaña, M. 521 (INB) Umaña, M. 306 (INB) Oses, M.X. 4722 (INB) Valladares, R. 569 (INB) Navarro, E. 11161 (INB) Calonge, F.D. s. n. (INB) Navarro, E. 11167 (INB) T C Kreisel & Dring Morganella velutina (Berk. ex Massee) Kreisel & Umaña, M. s. n. (INB) Dring Smithiomyces mexicanus (Murrill) Singer Umaña, M. 438 (INB) Marasmiaceae Caripia montagnei (Berk.) Kuntze Gymnopus neotropicus (Singer) J.L. Mata Gymnopus omphalodes (Berk.) Halling & J.L. Ruiz-Boyer, A. et al. 1892 (CR) Umaña, M. 1174 (INB) Umaña, M. 889 (INB) M Mata Marasmius cladophyllus Berk. Marasmius haematocephalus (Mont.) Fr. Tetrapyrgos nigripes (Fr.) E. Horak Umaña, M. 952 (INB) Umaña, M. 1019 (INB) Oses, M.X. 1072 (INB) Mycenaceae Dictyopanus pusillus (Pers. ex Lév.) Singer Filoboletus gracilis (Klotzsch ex Berk.) Singer Mycena margarita (Murrill) Murrill Xeromphalina tenuipes (Schwein.) A.H. Sm. Ruiz-Boyer, A. et al. 1725 (CR) Navarro, E. 11168 (INB) Umaña, M. 873 (INB) Umaña, M. 541 (INB) Physalacriaceae Oudemansiella canarii (Jungh.) Höhn Ruiz-Boyer, A. et al. 1763 (CR) C 203 Pleurotaceae Pleurotus ostreatus (Jacq.) P. Kumm. Pleurotus pulmonarius (Fr.) Quél. Valladares, R. 146 (INB) Umaña, M. 123 (INB) C Pluteaceae Pluteus phlebophorus (Ditmar) P. Kumm. Umaña, M. 111 (INB) Schizophyllaceae Schizophyllum commune Fr. Ruiz-Boyer, A. et al. 1677 (CR) C, M Strophariaceae Psilocybe cubensis (Earle) Singer Navarro, E. 7659 (INB) A Tricholomataceae Macrocybe titans (H.E. Bigelow & Kimbr.) Pegler, Lodge & Nakasone Auriculariales Auriculariaceae Auricularia auricula (L.) Underw. Auricularia delicata (Mont.) Henn. Auricularia fuscosuccinea (Mont.) Henn. Auricularia mesenterica (Dicks.) Pers. Auricularia polytricha (Mont.) Sacc. Boletales Sclerodermataceae Scleroderma bovista Fr. Geastrales Geastraceae Geastrum javanicum Lév. Geastrum lageniforme Vittad. Geastrum morganii Lloyd Geastrum rufescens Pers. Geastrum saccatum Fr. Geastrum schweinitzii (Berk. & M.A. Curtis) Zeller Geastrum triplex Jungh. Phallales Phallaceae Laternea triscapa Turpin Ligiella rodrigueziana J.A. Sáenz Mutinus caninus (Huds.) Fr. Neolysurus arcipulvinus O.K. Mill., Ovrebo & Burk Phallus atrovolvatus Kreisel & Calonge Phallus indusiatus Schltdl. Umaña, M. 198 (INB) Navarro, E. 11138 (INB) Ruiz-Boyer, A. et al. 1738 (CR) Ruiz-Boyer, A. et al. 1665 (CR) Ruiz-Boyer, A. et al. 1737 (CR) Umaña, M. 723 (INB) C C C C Umaña, M. 1092 (INB) López, I. 5054 (INB) López, I. 5051 (INB) López, I. 5059 (INB) Valladares, R. 270 (INB) Oses, M.X. 4719 (INB) Umaña, M. 110 (INB) Valladares, R. 27 (INB) Umaña, M. 580 (INB) Umaña, M. 232 (INB) Valladares, R. 1062 (INB) Umaña, M. 595 (INB) Calonge, F.D. s. n. (INB) Ocampo, R. s. n. (CR) C 204 Phallus duplicatus Bosc Umaña, M. 594 (INB) Polyporales Fomitopsidaceae Fomitella supina (Sw.) Murrill Umaña, M. 125 (INB) Ganodermataceae Amauroderma boleticeum (Pat. & Gaillard) Umaña, M. 450 (INB) Torrend Ganoderma amazonense Weir Ganoderma applanatum (Pers.) Pat. sensu lato Ganoderma australe (Fr.) Pat. sensu lato Ganoderma lucidum (Curtis) P. Karst. sensu lato Ganoderma stipitatum (Murrill) Murrill Humphreya coffeata (Berk.) Steyaert Navarro, E. 6843 (INB) Ruiz-Boyer, A. et al. 1641 (CR) Ruiz-Boyer, A. et al. 1708 (CR) Ruiz-Boyer, A. et al. 1690 (CR) Umaña, M. 241 (INB) Umaña, M. 600 (INB) Meripilaceae Rigidoporus biokoensis (Bres. ex Lloyd) Ruiz-Boyer, A. et al. 1667 (CR) Ryvarden Rigidoporus lineatus (Pers.) Ryvarden Rigidoporus microporus (Sw.) Overeem Rigidoporus ulmarius (Sowerby) Imazeki Rigidoporus undatus (Pers.) Donk Rigidoporus vinctus (Berk.) Ryvarden Navarro, E. 11152 (INB) Ruiz-Boyer, A. et al. 1643 (CR) Umaña, M. 539 (INB) Valladares, R. 676 (INB) Valladares, R. 143 (INB) Meruliaceae Gloeoporus thelephoroides (Hook.) G. Cunn. Umaña, M. 114 (INB) Junghuhnia carneola (Bres.) Rajchenb. Umaña, M. 994 (INB) Junghuhnia subundata (Murrill) Manfr. Binder, Navarro, E. 6847 (INB) Hibbett, K.H. Larss., E. Larss., E. Langer & G. Langer Podoscypha fulvonitens (Berk.) D.A. Reid Podoscypha nitidula (Berk.) Pat. Phanerochaetaceae Antrodiella liebmannii (Fr.) Ryvarden Antrodiella murrillii (Lloyd) Ryvarden Ceriporiopsis mucida (Pers.) Gilb. & Ryvarden Podoscyphaceae Cotylidia aurantiaca (Pat.) A.L. Welden Polyporaceae Coriolopsis byrsina (Mont.) Ryvarden Coriolopsis floccosa (Jungh.) Ryvarden Coriolopsis polyzona (Pers.) Ryvarden Datronia caperata (Berk.) Ryvarden Earliella scabrosa (Pers.) Gilb. & Ryvarden Echinochaete brachypora (Mont.) Ryvarden Umaña, M. 67 (INB) Umaña, M. 122 (INB) Ruiz-Boyer, A. et al. 1640 (CR) Ruiz-Boyer, A. et al. 2057 (CR) Navarro, E. 6840 (INB) Umaña, M. 624 (INB) Ruiz-Boyer, A. et al. 1762 (CR) Ruiz-Boyer, A. et al. 1668(CR) Ruiz-Boyer, A. et al. 1873 (CR) Ruiz-Boyer, A. et al. 1865 (CR) Ruiz-Boyer, A. et al. 1724 (CR) Umaña, M. 233 (INB) M M 205 Flabellophora obovata (Jungh.) Núñez & Umaña, M. 913 (INB) Ryvarden Fomes fasciatus (Sw.) Cooke Hexagonia glaber (P. Beauv.) Ryvarden Hexagonia hydnoides (Sw.) M. Fidalgo Hexagonia papyracea Berk. Lentinus concavus (Berk.) Corner Lentinus crinitus (L.) Fr. Nigrofomes melanoporus (Mont.) Murrill Nigroporus vinosus (Berk.) Murrill Panus fulvus (Berk.) Pegler & R.W. Rayner Panus strigellus (Berk.) Overh. Perenniporia martia (Berk.) Ryvarden Polyporus craterellus Berk. & M.A. Curtis Polyporus dictyopus Mont. Polyporus leprieurii Mont. Polyporus tenuiculus (P. Beauv.) Fr. Polyporus tricholoma Mont. Polyporus virgatus Berk. & M.A. Curtis Porogramme albocincta (Cooke & Massee) J. Ruiz-Boyer, A. et al. 1730 (CR) Ruiz-Boyer, A. et al. 1897 (CR) Ruiz-Boyer, A. et al. 1705 (CR) Valladares, R. 148 (INB) Umaña, M. 238 (INB) Ruiz-Boyer, A. et al. 1759 (CR) Ruiz-Boyer, A. et al. 1715 (CR) Ruiz-Boyer, A. et al. 2046 (CR) Umaña, M. 152 (INB) Umaña, M. 73 (INB) Ruiz-Boyer, A. 232 (CR) Umaña, M. 197 (INB) Valladares, R. 106 (INB) Valladares, R. 1454 (INB) Ruiz-Boyer, A. et al. 1691(CR) Ruiz-Boyer, A. et al. 1642 (CR) Ruiz-Boyer, A. et al. 1900 (CR) Ruiz-Boyer, A. et al. 1669 (CR) M C C Lowe Pycnoporus sanguineus (L.) Murrill Tinctoporellus epimiltinus (Berk. & Broome) Ruiz-Boyer, A. et al. 1870 (CR) Navarro, E. 11145 (INB) Ryvarden Trametes cubensis (Mont.) Sacc. Trametes elegans (Spreng.) Fr. Trametes maxima (Mont.) A. David & Rajchenb. Trametes pavonia (Berk.) Fr. Trametes versicolor (L.) Lloyd Trametes villosa (Sw.) Kreisel Trichaptum biforme (Fr.) Ryvarden Trichaptum byssogenum (Jungh.) Ryvarden Trichaptum perrottetii (Lév.) Ryvarden Trichaptum sector (Ehrenb.) Kreisel Ruiz-Boyer, A. 385 (CR) Ruiz-Boyer, A. et al. 1686 (CR) Ruiz-Boyer, A. et al. 1893 (CR) Ruiz-Boyer, A. et al. 2120 Valladares, R. 1207 (INB) Ruiz-Boyer, A. et al. 1678 (CR) Valladares, R. 941 (INB) Ruiz-Boyer, A. et al. 1966 (CR) Ruiz-Boyer, A. et al. 2049 (CR) Umaña, M. 721 (INB) Hymenochaetales Hymenochaetaceae Inonotus patouillardii (Rick) Imazeki Phellinus allardii (Bres.) S. Ahmad Phellinus gilvus (Schwein.) Pat. Phylloporia spathulata (Hook.) Ryvarden Stipitochaete damicornis (Link) Ryvarden Valladares, R. 519 (INB) Navarro, E. 6375 (INB) Ruiz-Boyer, A. et al. 1913(CR) Umaña, M. 459 (INB) Oses, M.X. 1084 (INB) M 206 Schizophoraceae Schizopora flavipora (Berk. & M.A. Curtis ex Valladares, R. 918 (INB) Cooke) Ryvarden Russulales Bondarsewiaceae Wrightoporia tropicalis (Cooke) Ryvarden Valladares, R. 894 (INB) Stereaceae Stereum ostrea (Blume & T. Nees) Fr. Ruiz-Boyer, A. 2087 (CR) Trechisporales Hydnodontaceae Trechispora mollusca (Pers.) Liberta Umaña, M. 691 (INB) 207 Anexo 3. Lista de mamíferos de la región de Baja Talamanca y cerro Chimú, Limón Costa Rica Francisco Durán Alvarado Mastozoología Departamento de Historia Natural Museo Nacional de Costa Rica (29 de julio de 2014) Abreviaciones y códigos de iniciales empleados Observaciones EA Especie amenazada He Hallazgo: especie en estudio Ha Hallazgo: ampliación de distribución IT: e Interés turistico: ecológico IT: m Interés turistico: especie maderable* IT: o Interés turistico: ornamental* IT: c Interés turistico: uso cultural Tipo de registro R Recolecta Re Captura en red y liberado por algún motivo (Preñez, lactancia, otro) O Observación Of Observación por funcionarios residentes del sitio V Vocalización Ra Rastros, huellas F Fototrampeo BI Registrado en base de datos del MNCR B Registrado en base de datos externa (GBIF, MANIS) C Registrado en zonas cercanas y esperados para la zona * Observados en Estero Negro Categorías UICN (Unión Mundial para la Naturaleza) PE Especie en peligro AM Especie casi amenazada VU Especie vulnerable DD No existe suficiente información EP Especie en peligro BP Especie a bajo riesgo de extinción Categoría MINAE (Ministerio del Ambiente y Energía) PR Poblaciones Reducidas (Decreto No. 26435 – MINAE, 1997) PE Peligro de Extinción (Decreto No. 26435 – MINAE, 1997) CITES Según UICN (1999) Estados de conservación tomados de: RodríguezH. B., F. A. Chinchilla y L. J. May. 2002. Lista de Especies, Endemismo y Conservación de los Mamíferos de Costa Rica. Revista Mexicana de Mastozoología 6: 21-57. 208 ORDEN Familia Especie Observaciones Tipo de Registro Categoría UICN Categoría MINAE CITES DIDELPHIMORPHIA Caluromyidae Caluromys derbianus (Waterhouse, 1841) EA O Didelphidae Didelphis marsupialis Linnaeus, 1757 Philander opossum (Linnaeus, 1758) Chironectes minimus (Zimmermann, 1780) IT: c O,F O,F EA, IT: e B, Of Marmosidae Marmosa mexicana Merriam, 1897 O PILOSA Bradypodidae Bradypus variegatus Schinz, 1825* IT: e O EA, IT: e O Megalonychidae Choloepus hoffmanni Peters, 1858 Myrmecophagidae Cyclopes didactylus (Linnaeus, 1758) Tamandua mexicana (Saussure, 1860) IT: e IT: e O,Of F,O IT: e, IT: c O, F CINGULATA Dasypodidae Dasypus novemcinctus Linnaeus, 1758 CHIROPTERA Emballonuridae Cormura brevirostris (Wagner, 1843) Peropteryx kappleri Peters, 1867 Rhynchonycteris naso (Wied-Neuwied, 1820)* Saccopteryx bilineata (Temminck, 1838) B C O* IT: e B Noctilionidae Noctilio albiventris Desmarest, 1818 Noctilio leporinus B O,R,Re IT: e Mormoopidae Pteronotus gymnonotus Natterer 1843 Pteronotus parnellii (Gray, 1843) R C Phyllostomidae Desmodus rotundus (E. Geoffroy, 1810) Glossophaga commissarisi Gardner, 1962 Glossophaga leachii Gray, 1844 Glossophaga soricina (Pallas, 1766) Glossophaga sp. Hylonycteris underwoodi Lonchophylla robusta Miller, 1912 Lonchorhina aurita Tomes, 1863 Macrophyllum macrophyllum (Schinz, 1821) Mimon crenulatum (E. Geoffroy, 1810) Micronycteris hirsuta (Peters 1869) Micronycteris microtis Miller, 1898 IT: c R R, BI B Re, B, BI R R B B R Re, R R Re, R PR 209 Phyllostomus discolor Wagner, 1843 Phyllostomus hastatus (Pallas, 1767) Chrotopterus auritus (Peters, 1856) Tonatia saurophila Koopman & Williams, 1951 Trachops cirrhosus (Spix, 1823) Vampyrum spectrum (Linnaeus, 1758) Carollia castanea H. Allen, 1890 Carollia perspicillata (Linnaeus, 1758) Carollia sowelli Baker et al., 2002 Carollia sp. Artibeus jamaicensis Leach, 1821 Artibeus lituratus (Olfers, 1818) Artibeus sp. R,B,BI C C R, Re R C EA AM PR R, Re R, Re R, Re R R, Re R, Re R, Re R, BI Artibeus phaeotis (Miller, 1902) Artibeus watsoni (Thomas, 1901) Ectophylla alba H. Allen 1892 R IT: e, Platyrrhinus helleri (Peters, 1866) Uroderma bilobatum Peters, 1866 Vampyressa nymphaea Thomas, 1909 Vampyressa thyone Thomas, 1909 Vampyrodes caraccioli (Thomas, 1889) Sturnira lillium (E. Geoffroy, 1810) R, Of R,B R, Re Re, B B C O Thyroptheridae Thyroptera tricolor Spix, 1823 R Vespertilionidae Myotis nigricans (Schinz, 1821) Myotis riparius Eptesicus brasiliensis (Desmarest, 1819) Eptesicus furinalis (d’Orbigny, 1847) Rhogeessa io Thomas 1903 Re,B Re R B C Molossidae Molossus currentium J. A. Allen, 1904 Molossus molossus (Pallas, 1766) Tadarida brasiliensis (I. Geoffroy, 1824) C R* EA B AM PE EA, IT: e,IT: c O* O,V EA, IT: e ,IT: c O, F,V PRIMATES Atelidae Ateles geoffroyi Kuhl, 1820* Alouatta palliata (Gray, 1849)* EA, IT: e,IT: c PE, CITES I PE, CITES I Cebidae Cebus imitator (Linnaeus, 1758) RODENTIA Sciuridae Sciurus variegatoides Ogilby, 1839 Sciurus granatensis Humboldt, 1811 O O,F Heteromyidae Heteromys desmarestianus Gray, 1868 R, B PR 210 Geomyidae Orthogeomys cherriei (J. A. Allen, 1893) EA B Muridae Melanomys caliginosus (Tomes, 1860) Sigmodon hirsutus Burmeister, 1854 Nyctomys sumichrasti (Saussure, 1860) B,R B O Erethizontidae Sphiggurus mexicanus (Kerr, 1792) Of Dasyproctidae Dasyprocta punctata Gray, 1842 IT: e O, Ra, F IT: c F Cuniculidae Cuniculus paca (Linnaeus, 1766) Echimyidae Proechimys semispinosus (Tomes, 1860) O, R, F LAGOMORPHA Leporidae Sylvilagus gabbi (Allen 1877) IT: c O Procyon lotor (Linnaeus, 1758)* IT: e Ra, O,F,Of Nasua narica (Linnaeus, 1776) Potos flavus (Schreber, 1774) Bassaricyon gabbii J. A. Allen, 1876 IT: e O,F IT: e O, V EA V, O EA F F,O,Of EA Ra, O, Of CARNIVORA Procyonidae PE Mustelidae Gallictis vittata (Schreber, 1776) Eira barbara (Linnaeus, 1758) Lontra longicaudis (Olfers, 1818) PR PE, CITES I Mephitidae Conepatus semistriatus (Boddaert, 1784) F, Of Ra Felidae Leopardus pardalis (Linnaeus, 1758) Leopardus wiedii (Schinz, 1821) Puma yaguaroundi (Lacepede, 1809) Puma concolor (Linnaeus, 1771) Panthera onca (Linnaeus, 1758) PE, CITES I EA EA Of AM PE, CITES I EA Of PE, CITES I EA Ra, Of PE, CITES I EA, IT: e,IT: c Ra AM AM,PE,CITES I IT: e Of DD CITES I EA, IT: e,IT: c Of VU PE, CITES I EA, IT: e,IT: c Of VU PE, CITES I CETACEA Delphinidae Sotalia guianensis P. J. van Bénéden SIRENIA Trichechidae Trichechus manatus Linnaeus, 1758 PERISSODACTYLA Tapiridae Tapirus bairdii (Gill, 1865) ARTIODACTYLA Tayassuidae Pecari tajacu (Linnaeus, 1758) Cervidae Mazama temama Kerr 1792 IT: c Ra, F,B IT: c Ra, ,Of(5) 211 Anexo 4. Listado de Aves de la región de Baja Talamanca y los cerros Chimú y Muchilla, Limón, Costa Rica Silvia Elena Bolaños Redondo Ornitología Departamento de Historia Natural Museo Nacional de Costa Rica (22 de julio de 2014) Abreviaciones y códigos de iniciales empleados Estatus R M Residente Migratoria Observaciones EA Especie amenazada ORDEN /Familia TINAMIFORMES Tinamidae ANSERIFORMES Anatidae GALLIFORMES Cracidae Especie Estatus Observaciones Tinamus major Gmelin, 1789 Crypturellus soui Hermann, 1783 Crypturellus boucardi Sclater, 1859 R R R EA Dendrocygna autumnalis Linnaeus, 1758 Cairina moschata Linnaeus, 1758 Anas discors Linnaeus, 1766 R R M Ortalis cinereiceps Gray, 1867 Penelope purpurascens Wagler, 1830 Crax rubra Linnaeus, 1758 R R R EA EA EA EA 212 PODICIPEDIFORMES Podicipedidae PROCELLARIIFORMES Procellariidae CICONIIFORMES Ciconiidae SULIFORMES Fregatidae Sulidae Tachybaptus dominicus Linnaeus, 1766 Podilymbus podiceps Linnaeus, 1758 R R Puffinus lherminieri Lesson, 1839 M Jabiru mycteria Lichtenstein, 1819 Mycteria americana Linnaeus, 1758 R R-M Fregata magnificens Mathews, 1914 R Sula dactylatra Lesson, 1831 Sula leucogaster Boddaert, 1783 R R Phalacrocoracidae Phalacrocorax brasilianus Gmelin, 1789 Anhingidae PELECANIFORMES Pelecanidae Ardeidae R Anhinga anhinga Linnaeus, 1766 R Pelecanus occidentalis Linnaeus, 1766 R Ixobrychus exilis Gmelin, 1789 Tigrisoma fasciatum Such, 1825 Tigrisoma mexicanum Swainson, 1834 Ardea herodias Linnaeus, 1758 Ardea alba Linnaeus, 1758 Egretta thula Molina, 1782 Egretta caerulea Linnaeus, 1758 Egretta tricolor Müller, 1776 Bubulcus ibis Linnaeus, 1758 Butorides virescens Linnaeus, 1758 Agamia agami Gmelin, 1789 Nycticorax nycticorax Linnaeus, 1758 Nyctanassa violacea Linnaeus, 1758 Cochlearius cochlearius Linnaeus, 1766 R-M R R M R-M R-M R-M R-M R-M R-M R R-M R-M R Threskiornithidae Eudocimus albus Linnaeus, 1758 Mesembrinibis cayennensis Gmelin, 1789 EA R R EA EA EA 213 ACCIPITRIFORMES Cathartidae Coragyps atratus Bechstein, 1793 Cathartes aura Linnaeus, 1758 Sarcoramphus papa Linnaeus, 1758 Pandionidae Pandion haliaetus Linnaeus, 1758 Accipitridae Leptodon cayanensis Latham, 1790 Chondrohierax uncinatus Temminck, 1822 Elanoides forficatus Linnaeus, 1758 Elanus leucurus Vieillot, 1818 Harpagus bidentatus Latham, 1790 Ictinia mississippiensis Wilson, 1811 Ictinia plumbea Gmelin, 1788 Circus cyaneus Linnaeus, 1766 Accipiter superciliosus Linnaeus, 1766 Accipiter striatus Vieillot, 1808 Accipiter cooperii Bonaparte, 1828 Geranospiza caerulescens Vieillot, 1817 Buteogallus anthracinus Deppe, 1830 Buteogallus urubitinga Gmelin, 1788 Morphnarchus princeps Sclater, 1865 Pseudastur albicollis Latham, 1790 Leucopternis semiplumbeus Lawrence, 1861 Buteo magnirostris Gmelin, 1788 Buteo platypterus Vieillot, 1823 Buteo brachyurus Vieillot, 1816 Buteo swainsoni Bonaparte, 1838 Buteo albonotatus Kaup, 1847 Buteo jamaicensis Gmelin, 1788 Spizaetus tyrannus Wied, 1820 Spizaetus melanoleucus Vieillot, 1816 Eurypygidae GRUIFORMES Rallidae R R-M R EA M R R R-M R R M M M R M M R R R R R R R M R-M M R-M R-M R R Eurypyga helias Pallas, 1781 R Laterallus albigularis Lawrence, 1861 Laterallus exilis Temminck, 1831 Aramides cajaneus Müller, 1776 Amaurolimnas concolor Gosse, 1847 R R R R EA EA EA EA EA EA EA EA 214 Porzana carolina Linnaeus, 1758 Porphyrio martinicus Linnaeus, 1766 Gallinula galeata Lichtenstein, 1818 M R R Himantopus mexicanus Müller, 1776 R-M Charadriidae Pluvialis squatarola Linnaeus, 1758 Pluvialis dominica Müller, 1776 Charadrius collaris Vieillot, 1818 Charadrius wilsonia Ord, 1814 Charadrius semipalmatus Bonaparte, 1825 Charadrius vociferus Linnaeus, 1758 M M R R-M M R-M Jacanidae Jacana spinosa Linnaeus, 1758 R Scolopacidae Actitis macularius Linnaeus, 1766 Tringa solitaria Wilson, 1813 Tringa melanoleuca Gmelin, 1789 Tringa semipalmata Gmelin, 1789 Tringa flavipes Gmelin, 1789 Numenius phaeopus Linnaeus, 1758 Arenaria interpres Linnaeus, 1758 Calidris alba Pallas, 1764 Calidris minutilla Vieillot, 1819 Calidris pusilla Linnaeus, 1766 Calidris mauri Cabanis, 1857 Limnodromus griseus Gmelin, 1789 M M M M M M M M M M M M Laridae Leucophaeus atricilla Linnaeus, 1758 Gelochelidon nilotica Gmelin, 1789 Chlidonias niger Linnaeus, 1758 Sterna hirundo Linnaeus, 1758 Thalasseus maximus Boddaert, 1783 Thalasseus sandvicensis Latham, 1787 M M M M M M Patagioenas cayennensis Bonnaterre, 1792 Patagioenas speciosa Gmelin, 1789 Patagioenas flavirostris Wagler, 1831 Patagioenas fasciata Say, 1823 Patagioenas nigrirostris Sclater 1859 R R R R R CHARADRIIFORMES Recurvirostridae COLUMBIFORMES Columbidae EA 215 CUCULIFORMES Cuculidae STRIGIFORMES Tytonidae Strigidae CAPRIMULGIFORMES Caprimulgidae Nyctibiidae APODIFORMES Apodidae Columbina talpacoti Temminck, 1810 Claravis pretiosa Ferrari Pérez, 1886 Leptotila verreauxi Bonaparte, 1855 Leptotila cassinii Lawrence, 1867 Geotrygon veraguensis Lawrence, 1867 Geotrygon violacea Temminck, 1809 Geotrygon montana Linnaeus, 1758 R R R R R R R Piaya cayana Linnaeus, 1766 Coccyzus americanus Linnaeus, 1758 Coccyzus erythropthalmus Wilson, 1811 Tapera naevia Linnaeus, 1766 Crotophaga sulcirostris Swainson, 1827 R M M R R Tyto alba Scopoli, 1769 R Megascops guatemalae Sharpe, 1875 Lophostrix cristata Daudin, 1800 Pulsatrix perspicillata Latham, 1790 Glaucidium griseiceps Sharp, 1875 Ciccaba virgata Cassin, 1849 Ciccaba nigrolineata Sclater, 1859 Pseudoscops clamator Vieillot, 1807 R R R R R R R Lurocalis semitorquatus Gmelin, 1789 Chordeiles acutipennis Hermann, 1783 Chordeiles minor Forster, 1771 Nyctidromus albicollis Gmelin, 1789 Nyctibius grandis Gmelin, 1789 Nyctibius griseus Gmelin, 1789 Cypseloides niger Gmelin, 1789 Cypseloides cryptus Zimmer, 1945 Streptoprocne zonaris Shaw, 1796 Chaetura pelagica Linnaeus, 1758 Chaetura vauxi Towsend, 1839 Chaetura cinereiventris Sclater, 1862 R R-M M R R R R-M R R M R R EA EA EA 216 Panyptila cayennensis Gmelin, 1789 Trochilidae TROGONIFORMES Trogonidae CORACIIFORMES Momotidae Alcedinidae R Florisuga mellivora Linnaeus, 1758 Eutoxeres aquila Bourcier, 1847 Glaucis aeneus Lawrence, 1868 Threnetes ruckeri Bourcier, 1847 Phaethornis guy Lesson, 1833 Phaethornis longirostris DeLattre, 1843 Phaethornis striigularis Gould, 1854 Heliothryx barroti Boucier, 1843 Anthracothorax prevostii Lesson, 1832 Discosura conversii Bourcier & Mulsant, 1846 Calliphlox bryantae Lawrence, 1867 Archilochus colubris Linnaeus, 1758 Klais guimeti Bourcier, 1843 Microchera albocoronata Lawrence, 1855 Chalybura urochrysia Gould, 1861 Thalurania colombica Bourcier, 1843 Amazilia amabilis Gould, 1853 Amazilia tzacatl De la Llave, 1833 Hylocharis eliciae Bourcier & Mulsant, 1846 R R R R R R R R R R R, Er M R R, Er R R R R R Trogon clathratus Salvin, 1866 Trogon massena Gould, 1838 Trogon caligatus Gould, 1838 Trogon rufus Gmelin, 1788 R, Er R R R Baryphthengus martii Spix, 1824 Electron platyrhynchum Leadbeater, 1829 R R Megaceryle torquatus Linnaeus, 1766 Megaceryle alcyon Linnaeus, 1758 Chloroceryle amazona Latham, 1790 Chloroceryle americana Gmelin, 1788 Chloroceryle inda Linnaeus, 1766 Chloroceryle aenea Pallas, 1764 R M R R R R EA EA 217 PICIFORMES Bucconidae Notharchus hyperrhynchus Sclater, 1856 Notharchus tectus Boddaert, 1783 Malacoptila panamensis Lafresnaye, 1847 Monasa morphoeus Hahn y Küster, 1823 R R R R Galbulidae Galbula ruficauda Cuvier, 1816 R Ramphastidae Pteroglossus torquatus Gmelin, 1788 Selenidera spectabilis Cassin, 1858 Ramphastos sulfuratus Lesson, 1830 Ramphastos ambiguus Swainson, 1823 R R, Er R R Picidae Melanerpes pucherani Malherbe, 1849 Sphyrapicus varius Linnaeus, 1766 Picoides fumigatus D'Orbigny, 1840 Piculus simplex Salvin, 1870 Celeus loricatus Reichenbach, 1854 Celeus castaneus Wagler, 1829 Dryocopus lineatus Linnaeus, 1766 Campephilus guatemalensis Hartlaub, 1844 R M R R, Er R R R R Micrastur ruficollis Vieillot, 1817 Micrastur mirandollei Schlegel, 1862 Micrastur semitorquatus Vieillot, 1817 Ibycter americanus Boddaer, 1783 Caracara cheriway Miller, 1777 Herpetotheres cachinnans Linnaeus, 1758 Falco sparverius Linnaeus, 1758 Falco columbarius Linnaeus, 1758 Falco rufigularis Daudin, 1800 Falco peregrinus Tunstall, 1771 R R R R R R M M R M FALCONIFORMES Falconidae PSITTACIFORMES Psittacidae Aratinga finschi Salvin, 1871 Aratinga nana Vigors, 1830 Ara ambiguus Bechstein, 1811 Brotogeris jugularis Müller, 1776 Pyrilia haematotis Sclater y Salvin, 1860 R, Er R R R R EA EA EA EA EA EA EA EA EA EA EA 218 PASSERIFORMES Thamnophilidae Pionus menstruus Linnaeus, 1766 Pionus senilis Spix, 1824 Amazona autumnalis Linnaeus, 1758 Amazona farinosa Boddaert, 1783 R R R R Cymbilaimus lineatus Leach, 1814 Taraba major Vieillot, 1816 Thamnophilus doliatus Linnaeus, 1764 Thamnophilus atrinucha Salvin y Godman, R R R 1892 Dysithamnus puncticeps Salvin, 1866 Myrmotherula axillaris Vieillot, 1817 Myrmotherula schisticolor Lawrence, 1865 Epinecrophylla fulviventris Lawrence, 1862 Microrhopias quixensis Cornalia, 1849 Cercomacra tyrannina Sclater, 1855 Gymnocichla nudiceps Cassin, 1850 Myrmeciza exsul Sclater, 1858 Myrmeciza zeledoni Ridgway, 1909 Hylophylax naevioides Lafresnaye, 1847 Gymnopithys leucaspis Sclater, 1855 Phaenostictus mcleannani Lawrence,1860 Grallariidae Hylopezus dives Salvin, 1864 R R R R R R R R R R R R R R, Er Formicarius analis d´Orbigny y Lafresnaye, Formicariidae Furnariidae 1837 Formicarius nigricapillus Ridgway, 1893 R R Sclerurus guatemalensis Hartlaub, 1844 Dendrocincla fuliginosa Vieillot, 1818 Glyphorhynchus spirurus Vieillot, 1819 Dendrocolaptes sanctithomae Lafresnaye, 1852 Xiphorhynchus susurrans Jardine, 1847 Xiphorhynchus lachrymosus Lawrence, 1862 Xiphorhynchus erythropygius Sclater, 1859 Lepidocolaptes souleyetii Des Murs, 1849 Xenops minutus Sparrman, 1788 Automolus ochrolaemus Tschudi, 1844 Synallaxis brachyura Lafresnaye, 1843 R R R R R R R R R R R EA EA EA EA 219 Tyrannidae Ornithion brunneicapillus Lawrence, 1862 Capsiempis flaveola Lichtenstein, 1823 Elaenia flavogaster Thunberg, 1822 Mionectes olivaceus Lawrence, 1868 Mionectes oleagineus Lichtenstein, 1823 Zimmerius vilissimus Sclater & Salvin, 1859 Myiornis atricapillus Lawrence, 1875 Oncostoma cinereigulare Sclater, 1857 Poecilotriccus sylvia Desmarest, 1806 Todirostrum cinereum Linnaeus, 1766 Todirostrum nigriceps Sclater, 1855 Tolmomyias sulphurescens Spix, 1825 Tolmomyias assimilis Pelzeln, 1868 Platyrinchus coronatus Sclater, 1858 Onychorhynchus coronatus Müller, 1776 Terenotriccus erythrurus Cabanis, 1847 Myiobius sulphureipygius Sclater, 1857 Contopus cooperi Swainson, 1832 Contopus sordidulus Sclater, 1859 Contopus virens Linnaeus, 1766 Contopus cinereus Spix, 1825 Empidonax flaviventris Baird, 1843 Empidonax virescens Vieillot, 1818 Empidonax alnorum Brewster, 1895 Empidonax traillii Audubon, 1828 Empidonax minimus Baird, W.M. & S.F. Baird, 1843 Colonia colonus Vieillot, 1818 Attila spadiceus Gmelin, 1789 Rhytipterna holerythra Sclater & Salvin, 1861 Myiarchus tuberculifer d´Orbigny y Lafresnaye, 1837 Myiarchus crinitus Linnaeus, 1758 Pitangus sulphuratus Linnaeus, 1766 Megarhynchus pitangua Linnaeus, 1766 Myiozetetes similis Spix, 1825 Myiozetetes granadensis Lawrence, 1862 Conopias albovittatus Lawrence, 1862 Myiodynastes luteiventris Sclater, 1859 Legatus leucophaius Vieillot, 1818 R R R R R R R R R R R R R R R R R M M M R M M M M M R R R R M R R R R R M M 220 Tyrannus melancholicus Vieillot, 1819 Tyrannus tyrannus Linnaeus, 1758 Genus Incertae Sedis Piprites griseiceps Salvin, 1865 R M R EA Tytiridae Laniocera rufescens Sclater, 1858 Tityra semifasciata Spix, 1825 Tityra inquisitor Lichtenstein, 1823 Pachyramphus cinnamomeus Lawrence, 1861 Pachyramphus polychopterus Vieillot, 1818 Pachyramphus aglaiae Lafresnaye, 1839 R R R R R R EA Cotingidae Querula purpurata Müller, 1776 Cephalopterus glabricollis Gould, 1851 Lipaugus unirufus Sclater,1859 Procnias tricarunculatus Verreaux & Verreaux, R R, Er R 1853 Carpodectes nitidus Salvin, 1865 R, Er R, Er Pipridae Corapipo altera Hellmayr, 1906 Dixiphia pipra Linnaeus, 1758 Ceratopipra mentalis Sclater, 1857 Manacus candei Parzudaki, 1841 R R R R Vireonidae Vireo flavifrons Vieillot, 1808 Vireo philadelphicus Cassin, 1851 Vireo olivaceus Linnaeus, 1766 Vireo flavoviridis Cassin, 1851 Hylophilus ochraceiceps Sclater, 1859 Hylophilus decurtatus Bonaparte, 1838 Vireolanius pulchellus Sclater & Salvin, 1859 Cyclarhis gujanensis Gmelin, 1789 M M M M R R R R Corvidae Psilorhinus morio Wagler, 1829 Cyanocorax affinis Peltzen, 1856 R R Hirundinidae Progne subis Linnaeus, 1758 Progne chalybea Gmelin, 1789 Tachycineta albilinea Lawrence, 1863 Pygochelidon cyanoleuca Vieillot, 1817 Stelgidopteryx serripennis Audubon, 1838 Stelgidopteryx ruficollis Vieillot, 1817 M R R R-M R-M R EA EA EA 221 Riparia riparia Linnaeus, 1758 Petrochelidon pyrrhonota Vieillot, 1817 Hirundo rustica Linnaeus, 1758 M M M Troglodytidae Microcerculus marginatus Sclater, 1855 Troglodytes aedon Vieillot, 1809 Campylorhynchus zonatus Lesson, 1832 Pheugopedius atrogularis Salvin, 1865 Cantorchilus thoracicus Salvin, 1865 Cantorchilus modestus Cabanis, 1861 Cantorchilus nigricapillus Sclater, 1861 Henicorhina leucosticta Cabanis, 1847 Cyphorhinus phaeocephalus Sclater, 1860 R R R R, Er R, Er R R R R Polioptilidae Microbates cinereiventris Sclater, 1855 Ramphocaenus melanurus Vieillot, 1819 Polioptila plumbea Gmelin, 1788 R R R Turdidae Catharus mexicanus Bonaparte, 1856 Catharus fuscescens Stephens, 1817 Catharus minimus Lafresnaye, 1848 Catharus ustulatus Nuttall, 1840 Hylocichla mustelina Gmelin, 1789 Turdus plebejus Cabanis, 1861 Turdus obsoletus Lawrence, 1862 Turdus grayi Bonaparte, 1838 R M M M M R R R Mimidae Dumetella carolinensis Linnaeus, 1766 M Parulidae Seiurus aurocapilla Linnaeus, 1766 Helmitheros vermivorum Gmelin, 1789 Parkesia motacilla Vieillot, 1809 Parkesia noveboracensis Gmelin, 1789 Vermivora chrysoptera Linnaeus, 1766 Mniotilta varia Linnaeus, 1766 Protonotaria citrea Boddaert, 1783 Oreothlypis peregrina Wilson, 1811 Geothlypis poliocephala Baird, 1865 Geothlypis tolmiei Townsend, 1839 Geothlypis philadelphia Wilson, 1810 Geothlypis formosa Wilson, 1811 Geothlypis semiflava Sclater, 1860 M M M M M M M M R M M M R 222 Geothlypis trichas Linnaeus, 1766 Setophaga citrina Boddaert, 1783 Setophaga ruticilla Linnaeus, 1758 Setophaga tigrina Gmelin, 1789 Setophaga cerulea Wilson, 1810 Setophaga americana Linnaeus, 1758 Setophaga magnolia Wilson, 1811 Setophaga castanea Wilson, 1810 Setophaga fusca Müller, 1776 Setophaga petechia Linnaeus, 1766 Setophaga pensylvanica Linnaeus, 1766 Setophaga striata Forster, 1772 Setophaga palmarum Gmelin, 1789 Setophaga coronata Linnaeus, 1766 Myiothlypis fulvicauda Spix, 1825 Cardellina canadensis Linnaeus, 1766 Cardellina pusilla Wilson, 1811 Genus Incertae Sedis Coereba flaveola Linnaeus, 1758 Thraupidae M M M M M M M M M R-M M M M M R M M R Chrysothlypis chrysomelas Sclater & Salvin, 1869 Mitrospingus cassinii Lawrence, 1861 Lanio leucothorax Salvin, 1865 Heterospingus rubrifrons Lawrence, 1865 Tachyphonus luctuosus d´Orbigny & Lafresnaye, 1837 Tachyphonus delattrii Lafresnaye, 1847 Tachyphonus rufus Boddaert, 1783 Ramphocelus sanguinolentus Lesson, 1831 Ramphocelus passerinii Bonaparte, 1831 Thraupis episcopus Linnaeus, 1766 Thraupis palmarum Wied, 1821 Tangara larvata Du Bus de Gisignies, 1846 Tangara inornata Gould, 1855 Tangara lavinia Cassin, 1858 Tangara gyrola Linnaeus, 1758 Tangara icterocephala Bonaparte, 1851 Dacnis venusta Lawrence, 1862 Dacnis cayana Linnaeus, 1766 Chlorophanes spiza Linnaeus, 1758 Cyanerpes lucidus Sclater & Salvin, 1859 Cyanerpes cyaneus Linnaeus, 1766 R, Er R R, Er R, Er R R R R R R R R R, Er R R R R R R R R EA EA 223 Genus Incertae Sedis Saltator coerulescens Vieillot, 1817 Saltator maximus Müller, 1776 Saltator atriceps Lesson, 1832 Saltator grossus Linnaeus, 1766 R R R R Emberizidae Volatinia jacarina Linnaeus, 1766 Sporophila schistacea Lawrence, 1863 Sporophila americana Gmelin, 1789 Sporophila torqueola Bonaparte, 1850 Oryzoborus nuttingi Ridgway, 1884 Oryzoborus funereus Sclater, 1859 Tiaris olivaceus Linnaeus, 1766 Arremon aurantiirostris Lafresnaye, 1847 Arremonops conirostris Bonaparte, 1851 Zonotrichia capensis Müller, 1766 R R R R R, Er R R R R R Cardinalidae Piranga rubra Linnaeus, 1758 Piranga olivacea Gmelin, 1789 Habia fuscicauda Cabanis, 1861 Chlorothraupis carmioli Lawrence, 1868 Caryothraustes poliogaster Du Bus de M M R R Gisignies, 1847 Pheucticus ludovicianus Linnaeus, 1766 Cyanocompsa cyanoides Lafresnaye, 1847 Passerina caerulea Linnaeus, 1758 Passerina cyanea Linnaeus, 1766 Spiza americana Gmelin, 1789 Icteridae Sturnella militaris Linnaeus, 1758 Sturnella magna Linnaeus, 1758 Dives dives Deppe, 1830 Quiscalus mexicanus Gmelin, 1788 Molothrus bonariensis Gmelin, 1788 Molothrus aeneus Wagler, 1829 Molothrus oryzivorus Gmelin, 1788 Icterus prosthemelas Linnaeus, 1766 Icterus spurius Linnaeus, 1766 Icterus mesomelas Wagler, 1829 Icterus galbula Linnaeus, 1758 Amblycercus holosericeus Deppe, 1830 Cacicus uropygialis Lafresnaye, 1843 R M R R-M M M R R R R R R R R M R M R R EA 224 Psarocolius decumanus Pallas, 1769 Psarocolius wagleri Gray, 1845 Psarocolius montezuma Lesson, 1830 Fringillidae Euphonia luteicapilla Cabanis, 1860 Euphonia gouldi Sclater, 1857 Euphonia minuta Cabanis, 1849 Euphonia anneae Cassin, 1865 Chlorophonia callophrys Cabanis, 1861 Passeridae Passer domesticus Linnaeus, 1758 R R R R, Er R R R, Er R, Er R 225 Anexo 5. Lista de los mariposas de la región de Baja Talamanca, Limón, Costa Rica German Vega Araya Departamento de Historia Natural Museo Nacional de Costa Rica (Actualizado: 3 de julio de 2014) Códigos de Fuente MNCR Museo Nacional de Costa Rica INBIO Instituto Nacional de Biodiversidad Códigos de Endemismo E Endémica de Costa Rica Er Endémica regional (Costa Rica-Panamá) La lista está ordenada de mayor a menor nivel taxonómico: Familia, Género, Especie, Subespecies y alfabéticamente.Las familias se ordenaron en el orden taxonómico según Lamas (2004). Para las mariposas nocturnas se presenta una lista resumida, debido a que es el grupo más abundante. Familia Hesperiidae MARIPOSAS DIURNAS Achlyodes busirus heros Ehrmann, 1909 Anastrus meliboea (Godman & Salvin, 1894) Anastrus naeris naeris Anastrus petius peto Anthoptus epictetus (Fabricius, 1793) Antigonus erosus (Hübner, [1812]) Antigonus nearchus (Latreille, 1817) Apaustus gracilis (C. Felder & R. Felder, 1867) Argon lota (Hewitson, 1877) Aroma aroma (Hewitson, 1867) Aspitha leander (Boullet, 1912) Astraptes alardus latia Evans, 1952 Astraptes fulgerator azul (Reakirt, [1867]) Astraptes janeira (Schaus, 1902) Astraptes talus (Cramer, 1777) Autochton longipennis (Plötz, 1882) Autochton zarex (Hübner, 1818) Bolla imbras (Godman & Salvin, 1896) Bungalotis astylos (Cramer, 1780) Bungalotis quadratum (Sepp, [1845]) Fuente INBIO INBIO MNCR MNCR INBIO INBIO MNCR INBIO MNCR INBIO MNCR INBIO MNCR MNCR INBIO INBIO MNCR INBIO MNCR INBIO Endemismo 226 Callimormus juventus Scudder, 1872 Calpodes ethlius (Stoll, 1782) Carrhenes calidius Godman & Salvin, 1895 Carystoides basoches (Latreille, [1824]) Chioides catillus albius Evans, 1952 Cogia calchas (Herrich-Schäffer, 1869) Cycloglypha tisias (Godman & Salvin, 1896) Cyclosemia anastomosis Mabille, 1878 Cyclosemia subcaerulea Schaus, 1912 Cyclosemia herennius subcaerulea (W. Schaus, 1913) Cynea cynea (Hewitson, 1876) Dyscophellus phraxanor (Hewitson, 1876) Dyscophellus porcius (C. Felder & R. Felder, 1862) Ebrietas anacreon (Staudinger, 1876) Ebrietas osyris (Staudinger, 1876) Entheus matho aequatorius Mabille & Boullet, 1919 Eracon clineas (Mebille, 1878) Helias cama Evans, 1953 Heliopetes alana (Reakirt, 1868) Heliopetes arsalte (Linnaeus, 1758) Hyalothyrus neleus pemphigargyra (Mabille, 1888) Milanion marciana Godman & Salvin 1895 Molo mango(Guenée, 1865) Mylon lassia (Hewitson, 1868) Mylon maimon (Fabricius, 1775) Myscelus belti Godman & Salvin, 1879 Narcosius colossus (Herrich-Schäffer, 1869) Nascus phocus (Cramer, 1777) Niconiades xanthaphes Hübner, [1821] Nisoniades bessus (Möschler, 1877) Nisoniades torta Steinhauser 1989 Noctuana stator (Godman & Salvin, 1899) Oxynthes corusca (Herrich-Schäffer, 1869) Paches loxus gloriosus Röber, 1925 Pachyneuria licisca (Plötz, 1882) Panoquina lucas (Fabricius, 1793) Parphorus storax (Mabille, 1891) Pellicia arina Evans, 1953 Perichares philetes (Gmelin, [1790]) Phanus vitreus (Stoll, 1781) Polites vibex (Geyer, 1832) Polythrix asine (Hewitson, 1867) Polythrix octomaculata (Sepp, [1884]) Pompeius pompeius (Latreille, [1824]) INBIO MNCR INBIO MNCR INBIO INBIO MNCR MNCR MNCR MNCR MNCR INBIO MNCR INBIO MNCR MNCR MNCR MNCR MNCR MNCR INBIO MNCR MNCR INBIO INBIO INBIO INBIO INBIO INBIO MNCR MNCR INBIO INBIO INBIO INBIO MNCR MNCR MNCR INBIO INBIO INBIO INBIO MNCR MNCR Er 227 Porphyrogenes sp Watson 1853 Pyrgus adepta Plötz, 1884 Pyrgus oileus (Linnaeus, 1767) Pyrgus orcus (Stoll, 1780) Pyrrhopygopsis agaricon agaricon H. Druce 1908 Pyrrhopygopsis socrates (Ménétriés, 1855) Pythonides jovianus amaryllis Staudinger, 1876 Pythonides proxenus (Godman & Salivn, 1895) Quadrus cerialis (Stoll, 1782) Quadrus contubernalis (Mabille, 1883) Saliana esperi Evans, 1955 Saliana fusta Evans, 1955 Saliana longirostris (Sepp, [1840]) Spathilepia clonius (Cramer, 1775) Staphylus vulgata (Möschler, 1879) Talides sergestus (Cramer, 1775) Talides sinois Hübner, [1819] Telemiades amphion (Geyer, 1832) Telemiades antiope (Plötz, 1882) Telemiades fidesBell, 1949 Telles arcalaus (C. Stoll, 1782) Theagenes aegides Herrich-Schäffer 1869 Thracides joannisii Mabille, 1904 Thracides phidon (Cramer, 1779) Turesis complanula (Herrich-Schäffer, 1869) Typhedanus ampyx (Godman & Salvin, 1893) Typhedanus undulatus (Hewitson, 1867) Urbanus belli (Hayward, 1935) Urbanus dorantes (Stoll, 1790) Urbanus doryssus (Swainson, 1831) Urbanus esta Evans, 1952 Urbanus procne (Plötz, 1881) Urbanus pronta Evans, 1952 Urbanus proteus (Linnaeus, 1758) Urbanus simplicius (Stoll, 1790) Urbanus viterboana (Ehrmann, 1907) Urbanus teleus (Hübner, 1821) Vettius artona (Hewitson, 1868) Vettius chagres Nicolay, 1973 Vettius lafrenaye pica (Herrich-Schäffer, 1869) Vettius marcus (Fabricius, 1787) Xenophanes tryxus (Cramer, 1780) Yanguna cosyra (H. Druce, 1875) Zera hosta Evans, 1953 MNCR MNCR MNCR INBIO MNCR MNCR MNCR MNCR MNCR MNCR MNCR MNCR MNCR MNCR MNCR INBIO INBIO MNCR INBIO MNCR INBIO MNCR INBIO INBIO INBIO INBIO INBIO MNCR MNCR INBIO INBIO INBIO INBIO INBIO MNCR INBIO MNCR MNCR MNCR MNCR INBIO INBIO INBIO MNCR Er Er Er 228 Papilionidae Pieridae Battus belus varus (Kollar, 1850) Battus polydamas (Linnaeus, 1758) Heraclides anchisiades idaeus (Fabricius, 1793) Heraclides androgeus epidaurus (Godman & Salvin, 1890) Heraclides cresphontes (Cramer, 1777) Heraclides thoas autocles (Rothschild & Jordan, 1906) Mimoides euryleon clusoculis (Butler, 1872) Mimoides pausanias prasinus (Rothschild & Jordan, 1906) Parides eurimedes mylotes (H. Bates, 1861) Parides childrenae childrenae (Gray, 1832) Parides erithalion sadyattes (H. Druce, 1874) Parides erithalion smalli K.S. Brown, 1994 Parides eurimedes mylotes (H. Bates, 1861) Parides i. iphidamas (Fabricius, 1793) Parides panares lycimenes (Boisduval, 1870) Parides sesostris zestos (Gray, [1853]) Eurytides dioxippus lacandones (H. Bates, 1864) Pterourus birchallii bryki (Strand, 1930) Aphrissa boisduvalii (C. Felder & R. Felder, 1861) Aphrissa statira (Cramer, 1777) Glutophrissa drusilla tenuis (Lamas, 1981) Archonias brassolis approximata (Butler, 1873) Ascia monuste (Linnaeus, 1764) Catasticta flisa melanisa Eitschberger & Racheli, 1998 Dismorphia amphione praxinoe (Doubleday, 1844) Dismorphia eunoe desine (Hewitson, 1869) Dismorphia theucharila fortunata (Lucas, 1854) Eurema agave millerorum Llorente & Luis, 1987 Eurema albula marginella (C. Felder & R. Felder, 1861) Eurema daira eugenia (Wallengren, 1860) Eurema xantochlora xanthochlora (Kollar, 1850) Glutophrissa drusilla tenuis (Lamas, 1981) Leptophobia aripa elodia (Boisduval, 1836) Perrhybris pamela alethina (Butler, 1872) Phoebis argante (Brown, 1929) Phoebis neocypris virgo (Butler, 1870) Phoebis philea philea (Linnaeus, 1763) Phoebis sennae marcellina (Cramer, 1777) Pieriballia viardi noctipennis (Butler & H. Druce, 1872) Pyrisitia lisa centralis (Herrich-Schäffer, 1865) Pyrisitia nise nelphe (R. Felder, 1869) Rhabdodryas trite (Linnaeus, 1758) MNCR MNCR MNCR INBIO INBIO MNCR INBIO MNCR MNCR MNCR INBIO INBIO MNCR MNCR MNCR INBIO INBIO INBIO MNCR INBIO MNCR INBIO INBIO INBIO INBIO MNCR INBIO INBIO MNCR MNCR INBIO INBIO MNCR INBIO MNCR INBIO INBIO MNCR INBIO INBIO MNCR INBIO Er Er Er 229 Lycaenidae Riodinidae Arawacus togarna (Hewitson, 1867) Arcas cypria (Geyer, 1837) Arcas tuneta (Hewitson, 1865) Atlides bacis (Godman & Salvin, 1887) Atlides polybe (Linnaeus, 1763) Calycopis isobeon (Butler & H. Druce, 1872) Calycopis trebula (Hewitson, 1868) Calycopis xeneta (Hewitson, 1877) Chalybs janias (Cramer, 1779) Contrafacia imma (Prittwitz, 1865) Echinargus huntingtoni hannoides (Clench, 1965) Eumaeus godartii (Boisduval, 1870) Evenus regalis (Cramer, 1775) Iaspis andersoni Robbins 2010 Iaspis temesa (Hewitson, 1868) Janthecla cydonia (H. Druce, 1890) Lamasina draudti (Lathy, 1926) Lamprospilus collucia (Hewitson, 1877) Laothus barajo (Reakirt, [1867]) Megathecla cupentus (C. Stoll, 1781) Ministrymon una scopas (Godman & Salvin, 1887) Oenomaus ortygnus (Cramer, 1779) Ostrinotes keila (Hewitson, 1869) Paiwarria antinous (C. Felder & R. Felder, 1865) Panthiades bathildis (C. Felder & R. Felder, 1865) Panthiades bitias (Cramer, 1777) Panthiades phaleros (Linnaeus, 1767) Pseudolycaena damo (H. Druce, 1875) Rekoa palegon (Cramer, 1780) Strephonota malvania (Hewitson, 1867) Strymon gabatha (Hewitson, 1870) Strymon megarus (Godart, [1824]) Theclopsis mycon (Godman & Salvin, 1887) Theorema eumenia Hewitson, 1865 Theritas hemon (Cramer, 1775) Theritas mavors Hübner, 1818 Thestius lycabas (Cramer, 1777) Tmolus cydrara (Hewitson, 1868) Ziegleria ceromia (Hewitson, 1877) MNCR INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO INBIO INBIO MNCR INBIO INBIO INBIO MNCR INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO MNCR MNCR INBIO MNCR MNCR MNCR INBIO INBIO INBIO INBIO MNCR INBIO MNCR MNCR INBIO Ancyluris inca inca (Saunders, 1850) Baeotis zonata zonata R. Felder, 1869 Calephelis exiguus Austin, 1993 INBIO INBIO INBIO Er E 230 Calephelis iris (Staudinger, 1876) Calephelis sixola McAlpine, 1971 Calospila cilissa (Hewitson, 1863) Caria mantinea lampeto Godman & Salvin, 1886 Caria rhacotis (Godman & Salvin, 1878) Charis anius (Cramer, 1776) Calephelis iris (Staudinger, 1876) Chorinea bogota (Saunders, 1859) Detritivora gynaea (Godart, [1824]) Emesis aurimna (Boisduval, 1870) Emesis lucinda (Cramer, 1775) Eurybia cyclopia cyclopia Stichel, 1910 Eurybia elvina elvina Stichel, 1910 Eurybia lycisca Westwood, 1851 Eurybia patrona persona Staudinger, 1876 Eurybia unxia Godman & Salvin, 1885 Euselasia cheles (Godman & Salvin, 1889) Euselasia chrysippe (H. Bates, 1866) Euselasia regipennis (A. Butler & H. Druce, 1872) Euselasia rhodogyne patella Stichel, 1927 Hades noctula Westwood, 1851 Hypophylla argenissa (Stoll, 1790) Lasaia agesilas callaina Clench, 1972 Leucochimona lagora (Herrich-Schäffer, [1853]) Leucochimona lepida (Godman & Salvin, 1885) Melanis electron melantho (Ménétriés, 1855) Menander menander purpurata (Godman & Salvin, 1878) Mesene phareus (Cramer, 1777) Mesene silaris Godman & Salvin, 1878 Mesenopsis melanochlora (Godman & Salvin, 1878) Mesosemia albipuncta Schaus, 1913 Mesosemia asa Hewitson, 1869 Mesosemia carissima H. Bates, 1866 Mesosemia hesperina Butler, 1874 Mesosemia hypermegala Stichel, 1909 Mesosemia lamachus Hewitson, 1857 Mesosemia zonalis Godman & Salvin, 1885 Metacharis umbrata Stichel, 1929 Metacharis victrix (Hewitson, 1870) Methone cecilia chrysomela (A. Butler, 1872) Napaea eucharila (Bates, 1867) Nymphidium ascolia ascolia Hewitson, [1853] Nymphidium azanoides occidentalis Callaghan, 1986 Nymphidium mantus (Cramer, 1775) INBIO INBIO MNCR INBIO INBIO MNCR MNCR INBIO INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR MNCR MNCR MNCR E Er Er Er Er Er Er Er Er 231 Nymphalidae Nymphidium onaeum Hewitson, 1869 Perophthalma lasus Westwood, 1851 Perophthalma tullius (Fabricius, 1787) Rhetus arcius castigatus Stichel, 1909 Rhetus periander naevianus Stichel, 1910 Sarota gyas (Cramer, 1775) Setabis lagus jansoni (Butler, 1870) Symmachia probetor probetor (Stoll, 1782) Symmachia rubina rubina H. Bates, 1866 Symmachia threissa Hewitson, 1870 Synargis mycone (Hewitson, 1865) Synargis nymphidioides (A. Butler, 1872) Synargis palaeste (Hewitson, 1870) Theope bacenis Schaus, 1890 Theope eudocia Westwood, 1851 Theope publius publius C. Felder & R. Fedler, 1861 Theope speciosa Godman & Salvin, 1897 Theope virgilius (Fabricius, 1793) Thisbe irenea (Stoll, 1780) Thisbe lycorias (Hewitson, [1853]) Xenandra desora Schaus, 1928 Actinote guatemalena guatemalena (H. Bates, 1864) Adelpha attica attica (C. & R. Felder, 1867) Adelpha basiloides (H. Bates, 1865) Adelpha serpa celerio (H. Bates, 1864) Adelpha cocala lorzae (Boisduval, 1870) Adelpha cytherea marcia Fruhstorfer, 1913 Adelpha erotia erotia (Hewitson, 1847) Adelpha felderi (Boisduval, 1870) Adelpha iphiclus iphiclus (Linnaeus, 1758) Adelpha justina valentina Fruhstorfer, 1915 Adelpha leucophthalma leucophthalma (Latreille, [1809]) Adelpha lycorias lycorias (Godart, [1824]) Adelpha phylaca pseudaethalia A. Hall, 1938 Adelpha salmoneus salmonides A. Hall, 1938 Adelpha zina lacina (Butler, 1872) Aeria eurimedia agna Godman & Salvin, 1879 Agraulis vanillae incarnata (N. Riley, 1926) Prepona aedon rodriguezi (Schaus, 1918) Agrias amydon philatelica DeVries, 1980 Altinote ozomene nox (H. Bates, 1864) Anartia fatima fatima (Fabricius, 1793) Anartia jatrophae luteipicta Fruhstorfer, 1907 Anthanassa drusilla lelex (H. Bates, 1864) MNCR INBIO INBIO INBIO INBIO INBIO MNCR INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO MNCR INBIO INBIO INBIO MNCR MNCR INBIO INBIO MNCR INBIO MNCR MNCR INBIO INBIO INBIO MNCR MNCR MNCR Er Er E Er 232 Anthanassa frisia frisia (Poey, 1832) Anthanassa otanes fulviplaga (Butler, 1872) Antirrhea philoctetes tomasia Butler, 1875 Archaeoprepona amphimachus amphiktion (Fruhstorfer, 1916) Archaeoprepona camilla camilla (Godman & Salvin, 1884) Archaeoprepona demophoon gulina (Fruhstorfer, 1904) Archaeoprepona demophon centralis (Fruhstorfer, 1905) Archaeoprepona meander megabates (Fruhstorfer, 1916) Baeotus beotus (Doubleday, [1849]) Biblis hyperia hyperia (Cramer, 1779) Brassolis isthmia isthmia Bates, 1864 Caerois gerdrudtus (Fabricius, 1793) Caligo atreus dionysos Fruhstorfer, 1912 Caligo brasiliensis sulanus Fruhstorfer, 1904 Caligo illioneus oberon Butler, 1870 Caligo oedipus oedipus Stichel, 1903 Caligo oileus scamander (Boisduval, 1870) Caligo telamonius memnon (C. Felder & R. Felder, 1867) Callicore atacama folschveilleri (Attal, 2008) Callicore lyca aerias (Godman & Salvin, 1883) Callicore texa titania (Salvin, 1869) Callicore tolima bugaba (Staudinger, 1876) Callithomia hezia hezia (Hewitson, [1854]) Castilia eranites (Hewitson, 1857) Castilia ofella (Hewitson, [1864]) Catoblepia orgetorix championi Bristow, 1981 Catoblepia xanthicles (Godman & Salvin, 1881) Catonephele mexicana Jenkins & R. G. De la Maza, 1985 Catonephele numilia esite (R. Felder, 1869) Catonephele orites Stichel, 1899 Ceratinia tutia (Hewitson, 1852) Chloreuptychia arnaca (Fabricius, 1776) Chlosyne gaudialis gaudialis (H. Bates, 1864) Chlosyne janais janais (Drury, 1782) Chlosyne lacinia lacinia (Geyer, 1837) Chlosyne narva bonpland (Latreille, [1809]) Cissia confusa (Staudinger, 1887) Cissia joyceae Singer, DeVries & P. Ehrlich, 1983 Cissia labe (Butler, 1870) Magneuptychia libye (Linnaeus, 1767) Cissia pompilia (C. Felder & R. Felder, 1867) Cissia pseudoconfusa Singer, DeVries & Ehrlich, 1983 Cissia similis (Butler, 1867) INBIO INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO INBIO MNCR INBIO MNCR INBIO INBIO INBIO INBIO MNCR MNCR INBIO MNCR INBIO MNCR INBIO MNCR INBIO INBIO MNCR Er Er E Er Er Er Er Er Er Er E 233 Cithaerias pireta pireta (Stoll, 1780) Colobura annulata Willmott, Constantino & J. Hall, 2001 Colobura dirce (Linnaeus, 1758) Consul fabius cecrops (Doubleday, [1849]) Consul panariste jansoni (Salvin, 1871) Danaus gilippus thersippus (H. Bates, 1863) Danaus plexippus (Linnaeus, 1758) Diaethria clymena marchalii (Guérin-Méneville, [1844]) Dione juno huascuma (Reakirt, 1866) Dircenna dero euchytma (C. Felder & R. Felder, 1865) Dircenna olyras relata Butler & Druce, 1872 Doxocopa clothilda (C. Felder & R. Felder, 1867) Dryadula phaetusa (Linnaeus, 1758) Dryas iulia moderata (N. Riley, 1926) Dulcedo polita (Hewitson, 1869) Dynamine hecuba (Schaus, 1913) Dynamine paulina thalassina (Boisduval, 1870) Dynamine postverta mexicana d'Almeida, 1952 Dynamine sosthenes sosthenes (Hewitson, 1869) Dynamine tithia salpensa (C. Felder & R. Felder, 1862) Dynamine vicaria gillotti A. Hall, 1930 Dynastor macrosiris strix (H. Bates, 1864) Ectima erycinoides C. Felder & R. Felder, 1867 Emesis fatimella nobilata Stichel, 1910 Eresia clio clio (Linnaeus, 1758) Eresia emerantia coela H. Druce, 1874 Eresia eunice mechanitis Godman & Salvin, 1878 Eresia ithomioides alsina Hewitson, 1869 Eryphanis lycomedon (C. Felder & R. Felder, 1862) Eueides aliphera gracilis Stichel, 1903 Eueides isabella eva (Fabricius, 1793) Eueides lybia lybioides Staudinger, 1876 Eueides lybia olympia (Fabricius, 1793) Eunica alpais excelsa Godman & Salvin, 1877 Euptoieta hegesia meridiania Stichel, 1938 Euptychia insolata A. Butler & H. Druce, 1872 Euptychia jesia Butler, 1869 Fountainea eurypyle confusa (A. Hall, 1929) Fountainea halice martinezi (J. De la Maza & Díaz, 1978) Godyris zavaleta caesiopicta (Niepelt, 1915) Haematera pyrame (Hübner, [1819]) Haetera macleannania H. Bates, 1865 Hamadryas amphinome mexicana (Lucas, 1853) Hamadryas arinome arienis (Godman & Salvin, 1883) MNCR INBIO INBIO INBIO INBIO MNCR MNCR INBIO MNCR INBIO MNCR INBIO MNCR MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO INBIO MNCR MNCR Er E Er E Er Er Er Er Er Er Er Er 234 Hamadryas februa ferentina (Godart, [1824]) Hamadryas feronia farinulenta (Fruhstorfer, 1916) Hamadryas laodamia saurites (Fruhstorfer, 1916) Heliconius charithonia vazquezae W. Comstock & F. Brown, 1950 Heliconius cydno chioneus H. Bates, 1864 Heliconius cydno galanthus H. Bates, 1864 Heliconius pachinus Salvin, 1871 Heliconius erato petiverana (E. Doubleday, 1847) Heliconius hecale zuleika Hewitson, 1854 Heliconius hecalesia formosus H. Bates, 1866 Heliconius melpomene rosina Boisduval, 1870 Heliconius sapho leuce Doubleday, 1847 Heliconius sara fulgidus Stichel 1906 Hermeuptychia hermes (Fabricius, 1775) Heterosais edessa (Hewitson, [1855]) Heterosais giulia cadra(Hewitson, [1855]) Historis acheronta acheronta (Fabricius, 1775) Historis odius dious Lamas, 1995 Hypna clytemnestra negra C. Felder & R. Felder, 1862 Hypoleria lavinia cassotis (H. Bates, 1864) Hyposcada virginiana evanides Haensch, 1909 Hypothyris euclea valora (Haensch, 1909) Ithomia diasia hippocrenis H. Bates, 1866 Ithomia heraldica H. Bates, 1966 Ithomia jucunda bolivari Schaus, 1913 Ithomia patilla Hewitson, 1852 Janatella leucodesma (C. Felder & R. Felder, 1861) Junonia evarete (Cramer, 1779) Laparus doris viridis (Staudinger, 1885) Lycorea halia atergatis E. Doubleday [1847] Magneuptychia agnata (Schaus, 1913) Magneuptychia libye (Linnaeus, 1767) Magneuptychia tiessa (Hewitson, 1869) Marpesia berania fruhstorferi (Seitz, 1914) Marpesia chiron (Fabricius, 1775) Marpesia furcula (Fabricius, 1793) Marpesia livius alcibiades (Staudinger, 1876) Marpesia merops (Doyère, [1840]) Marpesia petreus (Cramer, 1776) Mechanitis lysimnia labotas Distant, 1876 Mechanitis menapis saturata Godman, 1901 Mechanitis polymnia isthmia H. Bates, 1863 Megeuptychia antonoe (Cramer, 1775) INBIO INBIO MNCR MNCR INBIO MNCR INBIO MNCR MNCR INBIO MNCR INBIO MNCR MNCR INBIO INBIO INBIO MNCR MNCR MNCR MNCR INBIO MNCR INBIO INBIO INBIO MNCR MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR MNCR INBIO INBIO MNCR INBIO Er E Er Er Er E Er Er Er E E Er Er Er E Er 235 Melinaea lilis imitata H. Bates, 1864 Memphis anna elina (Staudinger, 1897) Memphis artacaena (Hewitson, 1869) Memphis aulica (Röber, 1916) Memphis aureola (H. Bates, 1866) Memphis cleomestra ada (A. Butler, 1875) Memphis glauce centralis (Röber, 1916) Memphis mora orthesia (Godman & Salvin, 1884) Memphis moruus boisduvali (W. Comstock, 1961) Memphis nenia (H. Druce, 1877) Memphis philumena indigotica (Salvin, 1869) Memphis proserpina (Salvin, 1869) Morpho cypris bugaba Westwood, 1851 Morpho deidamia polybaptus Butler, 1875 Morpho helenor narcissus Staudinger, 1887 Morpho menelaus amathonte Deyrolle, 1860 Morpho theseus heraldica Niepelt, 1927 Myscelia cyaniris cyaniris Doubleday, [1848] Myscelia ethusa pattenia Butler & H. Druce, 1872 Myscelia leucocyana smalli Jenkins, 1984 Napeogenes tolosa amara Godman, 1899 Nessaea aglaura aglaura (Doubleday, [1848]) Nica flavilla canthara (Doubleday, 1849) Oleria paula (Weymer, 1883) (Typical segregate) Oleria rubescens (Butler & H. Druce, 1872) Opsiphanes bogotanus alajuela Bristow, 1991 Opsiphanes cassina chiriquensis Stichel, 1902 Opsiphanes invirae cuspidatus Stichel, 1904 Opsiphanes quiteria quirinus Godman & Salvin, 1881 Opsiphanes zelotes zelotes Hewitson, 1873 Pareuptychia metaleuca (Boisduval, 1870) Pareuptychia ocirrhoe (Fabricius, 1776) Parides eurimedes mylotes (H. Bates, 1861) Philaethria diatonica (Fruhstorfer, 1912) Pierella helvina incanescens Godman & Salvin, 1877 Pierella luna luna (Fabricius, 1793) Prepona dexamenus Hopffer, 1874 Prepona laertes octavia Fruhstorfer, 1905 Prepona pylene gnorima H. Bates, 1865 Pseudodebis zimri (A. Butler, 1869) Pseudoscada timna saturata (Staudinger, 1885) Pteronymia parva (Salvin, 1869) Pyrrhogyra crameri Aurivillius, 1882 Pyrrhogyra otolais otolais H. Bates, 1864 INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO INBIO INBIO INBIO MNCR MNCR INBIO MNCR INBIO INBIO MNCR INBIO INBIO MNCR MNCR MNCR MNCR MNCR INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR MNCR Er E Er Er Er Er Er Er Er Er E Er Er Er Er Er 236 Scada zibia xanthina (H. Bates, 1866) Selenophanes josephus excultus Stichel, 1902 Siderone galanthis (Cramer, 1775) Siproeta epaphus epaphus (Latreille, 1813) Siproeta stelenes biplagiata (Fruhstorfer, 1907) Smyrna blomfildia datis Fruhstorfer, 1908 Taygetis laches (Fabricius, 1793) Taygetis rufomarginata Staudinger, 1888 Taygetis sosis Hopffer, 1874 Taygetis thamyra (Cramer, 1779) Taygetis uzza Butler, 1869 Taygetomorpha celia (Cramer, 1779) Tegosa anieta anieta (Hewitson, 1864) Temenis laothoe (Cramer, 1777) Thyridia psidii melantho H. Bates, 1866 Tigridia acesta (Linnaeus, 1758) Tithorea tarricina pinthias Godman & Salvin, 1878 Yphthimoides renata (Stoll, 1780) Zaretis isidora (Cramer, 1779) Zaretis itys itys (Cramer, 1777) MNCR INBIO INBIO INBIO MNCR INBIO INBIO INBIO INBIO MNCR INBIO INBIO INBIO MNCR INBIO MNCR MNCR INBIO INBIO MNCR Er Er Er Er MARIPOSAS NOCTURNAS Familia/ Especie Aididae Aidos perfusa Arctiidae Aclytia albistriga Aclytia heber Aclytia punctata Aclytia ventralis Agaraea minuta Agaraea semivitrea Agylla argentifera Agylla asra Agylla exscissa Amaxia apyga Amaxia beata Amaxia chaon Amaxia lepida Amaxia pandama Fuente INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Amaxia pardalis Ammalo helops Amphelarctia priscilla Amycles anthracina Anaulosia sp. Antichloris eriphia Antichloris viridis Aptilosia crocea Apyre separata Araeomolis rhodographa Arctiarpia mossi Atyphopsis sp. Balbura dorsisigna Balbura fasciata Balbura intervenata Baritius eleutheroides Belemnia inaurata Bertholdia albipunctas Bertholdia fumida Biturix venosata INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 237 Calodesma maculifrons Castrica phalaenoides Cercopimorpha sylva Chetone angulosa Chetone ithomia Chrysostola mellita Chrysostola moza Coreura phoenicides Correbia affinis Correbia undulata Correbidia costinotata Correbidia elegans Correbidia germana Correbidia striata Correbidia striata Cosmosoma auge Cosmosoma caecum Cosmosoma cingulatum Cosmosoma festivum Cosmosoma galatea Cosmosoma impar Cosmosoma metallescens Cosmosoma orathidia Cosmosoma pudicum Cosmosoma saron Cosmosoma semifulva Cosmosoma stibostictum Cosmosoma teuthras Cosmosoma xanthostictum Cosmosoma zurcheri Cratoplastis diluta Cresera annulata Cyanarctia flavinigra Cyanopepla submacula Delphyre testacea Dinia eagrus Diospage carilla Diospage chrysobasis Disoidemata sp. Dolichesia falsimonia Dycladia emerita Dycladia felderi Dycladia vitrina Dysschema jansonis INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Dysschema leucophaea Dysschema magdala Dysschema panamensis Dysschema perplexa Dysschema salome Dysschema viuda Ecdemus obscurata Elysius conspersus Elysius discoplaga Elysius nr. discoplaga Emurena tripunctata Epanycles imperialis Epeiromulona icterinus Epeiromulona lephina Epidesma ursula Episcepsis capysca Episcepsis demonis Episcepsis gnomoides Episcepsis hypoleuca Episcepsis lenaeus Episcepsis moloneyi Episcepsis thetis Episcepsis venata Episcepsis vinasia Epitalara commixta Eriphioides fastidiosa Eucereon aeolum Eucereon atrigutta Eucereon aurantiaca Eucereon centrale Eucereon latifascia Eucereon maia Eucereon obscurum Eucereon relegata Eucereon rosadora Eucereon tessellata Eucereon varium Eucereon venosa Eupseudosoma aberrans Evius cochenouri Evius hippia Glaucostola guttipalpis Glaucostola metaxantha Gymnelia colona INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 238 Gymnelia jansonis Gymnelia nobilis Gymnelia salvini Haemaphlebiella venata Halysidota grandis Halysidota intensa Halysidota interlineata Halysidota orientalis Halysidota pectenella Halysidota sannionis Halysidota sp. Halysidota underwoodi Heliactinidia sitia Homoeocera stictosoma Hyaleucerea sp. Hyalurga fenestra Hyalurga sixola Hyalurga sora Hyalurga urioides Hyda basilutea Hypercompe ecpantherioides Hypercompe laeta Hypercompe perplexa Hypercompe sp. Hyperthaema haemacta Hypocharis clusia Hypocrita albimacula Hypocrita arcaei Hypocrita reedia Hyponerita tipolis Ichoria sp. Idalus aleteria Idalus carinosa Idalus crinis Idalus critheis Idalus dares Idalus fasciipuncta Idalus herois Idalus vitrea Illice biota Illice opulentana Illice tessellata Isanthrene crabroniformis Isanthrene felderi INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Ischnognatha leucapera Isostola nigrivenata Ixylasia ciarana Leucanopsis cedon Leucanopsis flavorufa Leucanopsis stipulata Lophocampa atrimaculata Lophocampa catenulata Lophocampa citrina Lophocampa debilis Lophocampa maroniensis Lophocampa modesta Lophocampa subannula Loxophlebia davisi Loxophlebia egregia Lycomorphodes correbioides Lycomorphodes sordida Macrocneme adonis Macrocneme cabimensis Macrocneme iole Macrocneme lades Macroptila monstralis Macroptila nubecula Melese incertus Melese laodamia Melese monima Melese nr. flavimaculata Melese sixola Metallosia nidens Metastatia pyrrhorhaea Metaxanthia atribasis Munona iridescens Mydromera notochloris Myrmecopsis ichneumonea Napata albiplaga Napata flaviceps Napata leucotelus Napata walkeri Neonerita dorsipuncta Neonerita intorta Neritos leucoplaga Nodozana picturata Notarctia proxima Nudur fractivittarum INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 239 Nyridela xanthocera Ochrodota marina Odozana desepta Odozana sixola Odozana unica Opharus consimilis Ordishia godmani Ordishia rutila Ormetica ataenia Ormetica guapisa Ormetica maura Ormetica metallica Ormetica rothschildi Ormetica sicilia Pachydota albiceps Pachydota saduca Pareuchaetes insulata Pelochyta affinis Pelochyta arontes Pelochyta misera Pelochyta ruficollis Pheia elegans Phoenicoprocta sanguinea Poliopastea auripes Poliopastea nr. esmeralda Pompiliodes sp. Prepiella aurea Prepiella pexicera Pseudohyaleucerea vulnerata Pseudomya melanthoides Pseudophaloe cerealia Pseudophaloe helotes Psilopleura dolens Psoloptera thoracica Psychophasma erosa Rhabdatomis cora Rhipha chionoplaga Rhipha flammans Rhynchopyga flavicollis Robinsonia bartolana Robinsonia deiopea Robinsonia dewitzi Robinsonia fogra Sarosa mora INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Saurita afflicta Saurita costaricae Saurita fumosa Saurita phoenicosticta Saurita rubripuncta Saurita sanguinea Saurita stryma Saurita tipulina Scaptius obscurata Sciopsyche tropica Selenarctia flavidorsata Selenarctia schausi Sutonocrea reducta Symphlebia hyalina Symphlebia ipsea Symphlebia tessellata Syntomeida melanthus Syntrichura reba Talara bombycia Talara cara Talara esperanza Talara lepida Talara mona Talara synnephela Thyone grisescens Thysanoprymna hampsoni Trichromia cardinalis Trichromia cotes Trichromia lophosticta Trichromia nr. rhodocraspis Trichromia parnelli Tricypha imperialis Turuptiana obliqua Utetheisa ornatrix Virbia hypophaea Virbia orola Virbia thersites Viviennea ardesiaca Viviennea tegyra Watsonidia reimona Xenosoma nicander Hedilidae Macrosoma albida Macrosoma bahiata INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 240 Macrosoma cascaria Macrosoma conifera Macrosoma heliconiaria Macrosoma hyacinthina Macrosoma intermedia Macrosoma lucivittata Macrosoma rubedinaria Macrosoma semiermis Macrosoma tipulata Bombycidae Anticla antica Olceclostera indentata Anticla antica Apatelodes adrastia Apatelodes albipunctata Apatelodes erotina Apatelodes firmiana Apatelodes lapitha Apatelodes merlona Apatelodes pandara Apatelodes satellitia Apatelodes tuisa Colla rhodophe Drepatelodes umbrilinea Ephoria lybia Epia casnonia Epia muscosa Olceclostera amoria Olceclostera indentata Olceclostera irrorata Olceclostera nigripuncta Quentalia chromana Quentalia ephonia Quentalia numalia Quentalia surynorta Tamphana marmorea Zanola verago Castnidae Amauta cacica Castniomera Castniomera atymnius Castniomera humboldti Divana diva Leucocastnia licus INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Choreutidae Hemorophila tristis Rhobonda gaurisana Brenthia monolychna Hemerophila houttuinialis Hemerophila tristis Rhobonda gaurisana Tortyra cuprinella Tortyra ferratella Tortyra malacozona Tortyra ferratela Crambidae Agathodes designalis Anarmodia nebulosalis Apilocrocis excelsalis Apilocrocis glaucosia Apogeshna acestealis Argyractoides albibasalis Argyractoides leucogonialis Argyractoides sp.1 Arthromastix lauralis Asturodes fimbriauralis Ategumia dilecticolor Ategumia matutinalis Atomopteryx pterophoralis Aulacodes hodevalis Azochis mactalis Azochis ruscialis Blepharomastix colubralis Blepharomastix costaliparilis Blepharomastix nr. schistisemalis Blepharomastix rufilinealis Bocchoris marucalis Bocchoropsis plenilinealis Ceratocilia liberalis Ceratocilia sixolalis Ceratoclasis delimitalis Cirrhocephalina sp. Coenostolopsis apicalis Compacta hirtalis Conchylodes arcifera Conchylodes bryophilalis Conchylodes grammaphora Conchylodes nolkenialis INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 241 Conchylodes ovulalis Conchylodes platinalis Condylorrhiza vestigialis Desmia bajulalis Desmia clarkei Desmia melanopalis Desmia tages Desmia ufeus Desmia vulcanalis Diacme mopsalis Diaphania beckeri Diaphania eumeusalis Diaphania exclusalis Diaphania glauculalis Diaphania latilimbalis Diaphania praxialis Diaphania superalis Diathrausta cacalis Dichocrocis sabatalis Dichogama prognealis Dismidila drepanoides Erilusa leucoplagalis Glaphyria citronalis Glyphodes rubrocinctalis Glyphodes sibillalis Goniorhynchus hampsoni Goniorhynchus salaconalis Gonocausta zephyralis Hahncappsia mellinalis Hahncappsia nigripes Hahncappsia spp Heptalitha argyractalis Heptalitha enareralis Herpetogramma agavealis Herpetogramma decora Herpetogramma phaeopteralis Hositea bicincta Hoterodes ausonia Hymenia perspectalis Lamprosema brunnealis Lamprosema pelealis Leucochroma corope Lipocosma albibasalis Lipocosma calla INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Lygropia nr. tripunctata Lypotigris reginalis Maruca vitrata Massepha lupa Megastes grandalis Megastes praxiteles Megastes pusialis Mesocondyla tarsibarbalis Micromartinia mnemusalis Microphysetica hermeasalis Microthyris anormalis Microthyris prolongalis Midila daphne Midila soror Mimophobetron pyropsalis Neoleucinodes imperialis Neoleucinodes nr. prophetica Neurophyseta albinalis Neurophyseta dasymalis Neurophyseta mollitalis Neurophyseta renata Nonazochis graphialis Omiodes alboanalis Omiodes confusalis Omiodes croceiceps Omiodes cuniculalis Omiodes fulvicauda Omiodes hallwachsae Omiodes humeralis Omiodes indicata Omiodes martyralis Omiodes ochracea Omiodes seminitidalis Omiodes spoliatalis Oxyelophila necomalis Oxyelophila puralis Palpita jairusalis Palpita 'venatalis' Pantographa expansalis Pantographa limata Pantographa suffusalis Parambia gnomosynalis Parapediasia tenuistrigata Petrophila amethystina INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 242 Petrophila auspicatalis Petrophila complicatalis Petrophila mignonalis Petrophila nr. complicatalis Petrophila parvissimalis Petrophila triumphalis Phaedropsis leialis Phostria cyrisalis Phostria euagra Phostria latiapicalis Phostria mapetalis Phostria metalobalis Phostria rufalis Phostria temira Phryganodes plicatalis Pilocrocis cryptalis Pilocrocis cyrisalis Pilocrocis musalis Pilocrocis ramentalis Pilocrocis xanthozonalis Plectrona dohrnii Pleuroptya silicalis Polygrammodes elevata Polygrammodes fenestrata Polygrammodes hartigi Polygrammodes hercules Polygrammodes nervosa Polygrammodes rufinalis Praeacrospila melanoproctis Prenesta fenestrinalis Prenesta latifascialis Prenesta scyllalis Psara pargialis Pseudopyrausta nr.acutangulalis Pyrausta aurea Pyrausta xanthomela Radessa pardalota Rhectosemia multifarialis Rhectosemia viriditincta Salbia lotanalis Samea ecclesialis Siga pyronia Sisyracera subulalis Sparagmia gonoptera INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Spilomela minoralis Spoladea recurvalis Syllepis hortalis Syllepte amando Syllepte dialis Syllepte laticalis Syllepte nr.amando Syllepte nr.nitidalis Syllepte pactolalis Syllepte philetalis Syllepte strigicincta Synclera jarbusalis Syngamia dilutalis Syngamia florella Syngamilyta apicolor Terastia meticulosalis Trichaea hades Trichaea pilicornis Undulambia polystichalis Usingeriessa symphonalis Dalceridae Acraga coa Acraga infusa Acraga isothea Dalcerides alba Dalcerides bicolor Dalcerides dulcicola Dalcerides gugelmanni Paracraga argentea Elachistidae Cerconota "ociaphilina" Chlamydastis orion Ethmia catapeltica Ethmia lichyi Ethmia ungulatella Loxotoma elegans Phelotropa oenodes Philtronoma roseicorpus Timocratica leucocapna Sphingidae Adhemarius daphne Adhemarius gannascus Adhemarius palmeri Adhemarius ypsilon INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO MNCR 243 Aellopos ceculus Aellopos fadus Aellopos titan Aellopus ceculus Aellopus titan Amphimoea walkeri Amphonyx duponchel Amphonyx lucifer Callionima denticulata Callionima falcifera Callionima innus Callionima nomius Callionima pan Callionima parce Cautethia spuria Cocytius antaeus Cocytius duponchel Cocytius lucifer Enyo cavifer Enyo lugubris Enyo ocypete Erinnyis alope Erinnyis ello Erinnyis oenotrus Erinnys alope Erynnis tristis tatius Eumorpha anchemolus Eumorpha capronnieri Eumorpha fasciatus Eumorpha labruscae Eumorpha megaeacus Eumorpha obliquus Eumorpha phorbas Eumorpha satellitia Eumorpha triangulum Eumorpha vitis Eupyrrhoglossum sagra Hemeroplanes ornatus Hemeroplanes triptolemus Isognathus scyron Lintneria merops Madoryx bubastus Madoryx ochus Madoryx oiclus INBIO MNCR MNCR INBIO INBIO INBIO INBIO INBIO MNCR MNCR MNCR INBIO INBIO MNCR INBIO INBIO MNCR INBIO INBIO MNCR MNCR INBIO MNCR MNCR MNCR INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO INBIO INBIO INBIO MNCR INBIO MNCR Madoryx pluto Madoryx plutonius Manduca albiplaga Manduca corallina Manduca dalica Manduca florestan Manduca hannibal Manduca lichenea Manduca occulta Manduca ochus Manduca pellenia Manduca rustica Neococytius cluentius Nycerix stuarti Nyceryx coffaeae Nyceryx riscus Nyceryx stuarti Nyceryx tacita Oryba achemenides Oryba kadeni Pachilia ficus Pachilia resumens Pachylia darceta Pachylia ficus Pachylia syces Pachylioides rusumens Perigonia ilus Perigonia lusca Protambulyx euricles Protambulyx strigilis Pseudosphinx tetrio Stolidoptera tachasara Unzela japix Xylophanes amadis Xylophanes anubus Xylophanes belti Xylophanes ceratomioides Xylophanes chiron Xylophanes cthulhu Xylophanes cyrene Xylophanes godmani Xylophanes guianensis Xylophanes hannemanni Xylophanes jocasta INBIO MNCR MNCR MNCR INBIO MNCR INBIO INBIO INBIO INBIO MNCR INBIO MNCR INBIO MNCR INBIO MNCR MNCR MNCR MNCR INBIO MNCR MNCR MNCR INBIO MNCR INBIO MNCR MNCR MNCR MNCR INBIO INBIO INBIO MNCR MNCR MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO 244 Xylophanes libya Xylophanes loelia Xylophanes pistacina Xylophanes pluto Xylophanes porcus Xylophanes tersa Xylophanes thyelia Xylophanes titana Xylophanes tyndarus Xylophanes undata Xylophanes zurcheri Saturnidae Adeloneivaia boisduvalii Adeloneivaia jason Aphrissa boisduvalii Arsenura armida Arsenura archianassa Arsenura armida Arsenura batesii Automeris banus Automeris belti Automeris celata Automeris dagmarae Automeris durchartrei Automeris exigua Automeris fieldi Automeris hamata Automeris janus Automeris metzli Automeris pallidior Automeris phrynon Automeris postalbida Automeris tridens Automeris zugana Caio championi Cerodirphia avenata Citheronia bellavista Citheronia collaris Copaxa curvilínea Copaxa moinieri Copaxa multifenestrata Copiopteryx semiramis Dirphia horcana Dysdaemonia boreas MNCR MNCR MNCR MNCR MNCR INBIO MNCR INBIO INBIO MNCR MNCR MNCR INBIO INBIO INBIO INBIO MNCR INBIO INBIO MNCR INBIO INBIO MNCR INBIO MNCR MNCR MNCR INBIO INBIO INBIO INBIO INBIO MNCR MNCR INBIO MNCR MNCR MNCR INBIO INBIO INBIO INBIO MNCR Eacles imperiales decoris Eacles masoni Eacles ormondei Gamelia musta Gamelia septentrionalis Hylesia aeneides Hylesia annulata Hylesia continua Hylesia dalina Hylesia frigida Hylesia invidiosa Hylesia rosacea Hylesia rubrifrons Hylesia rufipes Hylesia umbrata Hyperchiria nausica Lonomia electra Molippa simillima Othorene intermedia Othorene purpurascens Oxytenis beprea Oxytenis modestia Oxytenis naemia Oxytenis nubila Periga cluacina Periphoba arcaei Pseudautomeris irene Pseudodirphia regia Ptiloscola dargei Rhescyntis hippodamia Rothschildia erycina Rothschildia erycina nigrescens Rothschildia lebeau inca Rothschildia orizaba Rothschildia triloba Rothschilida lebeau Syssphinx colla Syssphinx molina Syssphinx quadralineata Therinia transversaria Titaea tamerlan Lasiocampidae Euglyphis albigrisea Euglyphis amathuria MNCR INBIO MNCR INBIO INBIO MNCR INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO MNCR MNCR MNCR INBIO INBIO INBIO MNCR MNCR INBIO MNCR INBIO MNCR INBIO MNCR MNCR MNCR MNCR INBIO INBIO MNCR MNCR MNCR INBIO INBIO INBIO MNCR MNCR INBIO INBIO 245 Euglyphis barda Euglyphis braganza Euglyphis braganzoides Euglyphis carola Euglyphis celebris Euglyphis charax Euglyphis definita Euglyphis directa Euglyphis gera Euglyphis inflata Euglyphis laronia Euglyphis larunda Euglyphis lepta Euglyphis lola Euglyphis maria Euglyphis melancholica Euglyphis nebula Euglyphis necopina Euglyphis ornata Euglyphis phyllis Euglyphis rundala Euglyphis scripturata Euglyphis sonia Euglyphis submarginalis Euglyphis thyatira Euglyphis varma Euglyphis zurcheri Nesara caramina Nesara casada Titya bella Tolype caieta Tolype nana Tolype perplexa Tolype primitiva Tytocha lineata Limacodidae Acharia horrida Acharia nesea Acharia ophelians Acharia sarans Epiperola grandiosa Epiperola vafera Euclea bidiscalis Euclea buscki INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Euclea costaricana Euclea distrahens Euclea mesoamericana Euclea norba Euclea plugma Euclea zygia Euphobetron aquapennis Euprosterna elaea Euprosterna hosia Euprosterna wemilleri Narosopsis iangauldi Natada fusca Natada incandescens Natada lalogamezi Natada michorta Natada nindla Natada singulara Paleophobetron perornata Parasa viridogrisea Perola repetita Perola sericea Perola villosipes Phobetron hipparchia Semyra bella Semyra cupreitincta Semyra finita Semyra irena Talima aurora Talima rubicolor Tanadema neutra Vipsophobetron marisa Lymantriidae Sarcina purpurascens Thagona tibialis Megalopygidae Aithorape roseicornis Coamorpha innoxia Hysterocladia eriphua Macara argentea Megalopyge albicolis Megalopyge opercularis Mesoscia dyari Mesoscia terminata Norape nevermanni INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 246 Podalia orsilocha Podalia thanathos Podalia tympania Podalia walkerensis Thoscora acca Trosia dimas Trosia nigropunctigera Mimallonidae Bedosia ligina Cicinnus acuta Cicinnus forbesi Cicinnus joanna Cicinnus motagus Druentica sp. Lacosoma briasia Lacosoma valva Trogoptera rumina Zaphanta infantilis Notodontidae Anita basipuncta Anita divisa Ankale mixta Antaea lichyi Antiopha modica Antiopha multilinea Apela divisa Apela dubiosa Apela neobule Arhacia lignaris Azaxia dyari Bahaia empirica Bardaxima lucilinea Brachyglene schausi Calledema argenta Calledema contingata Calledema humboldti Calledema marmorea Cerura dandon Cerura laqueata Cerura rarata Chliara croesus Chliaroides svidberti Colax phocus Crinodes besckei INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Crinodes ritsemae Crinodes striolata Dasylophia maxtla Dicentria rustica Dicentria vallima Dicentria violacens Didugua argentilinea Dioptis longipenis Disphragis baracoana Disphragis bochica Disphragis delecta Disphragis gelduba Disphragis lama Disphragis ligneata Disphragis livida Disphragis medina Disphragis mephitis Disphragis meretricia Disphragis mullinsi Disphragis notabilis Disphragis perplexa Disphragis plebeia Disphragis poulsoni Disphragis proba Disphragis splendens Disphragis tharis Disphragis viridiflava Drastoma dardania Draudtargia intermedia Drugera mimica Drugera morona Dunama angulinea Elasmia astuta Elymiotis attenuata Elymiotis corana Eragisa barnesi Eragisa sabulosa Erbessa salvini Euharpyia comita Farigia foliata Farigia gamarra Farigia montana Farigia sagana Farigia vecina INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 247 Hadesina caerulescens Hapigia annulata Hapigia denhezi Hapigia nodicornis Hapigia repandens Hapigia ribbei Hapigia simplex Hapigiodes frederica Hapigiodes sigifredomarini Hardingia livida Hardingia maximespina Hemiceras affinis Hemiceras alba Hemiceras cadmia Hemiceras ceiba Hemiceras clarki Hemiceras coatina Hemiceras conspirata Hemiceras constellata Hemiceras flava Hemiceras flavescens Hemiceras losa Hemiceras metastigma Hemiceras modesta Hemiceras muscosa Hemiceras nigrescens Hemiceras pallidula Hemiceras sabis Hemiceras sericita Hemiceras siderea Hemiceras sparsipennis Hemiceras torva Hemiceras transducta Hemiceras vecina Hemiceras vinicosta Hippia schausi Isostyla ithomeina Kalkoma pylaon Kaseria pallida Lepasta bractea Lepasta concordens Lepasta maltha Limiris guatemalensis Lirimiris auriflua INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Lirimiris elongata Lirimiris fascis Lirimiris gigantea Lirimiris guatemalensis Lirimiris lignitecta Lirimiris meridionalis Lirimiris truncata Lobeza medina Lyces cruciata Lyricinus xylophasiodes Lysana chacon Lysana plusiana Magava forensis Magava multilinea Malocampa albolineata Malocampa illimis Malocampa lunula Malocampa matralis Malocampa piratica Malocampa punctata Malocampa satis Marthula rufescens Meragisa salvina Meragisa thryeston Naprepa houla Navarcostes vernieri Nebulosa erymas Notoplusia joanna Nystalea aequipars Nystalea collaris Nystalea corrusca Nystalea ebalea Nystalea lineiplena Nystalea montana Nystalea multiplex Nystalea ocellata Nystalea porgana Nystalea squamosa Nystalea striata Nystalea superciliosa Nystalea virgula Oricia truncata Pauluma corina Pentobesa pinna INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 248 Pentobesa valta Phanoptis cyanomelas Phastia alcimede Polypoetes wagneri Poresta forfex Procolax apulana Psilacron macarisma Rhapigia aymara Rhuda difficilis Rhuda tuisa Rifargia apella Rifargia causia Rifargia culpata Rifargia demissa Rifargia discrepans Rifargia dissepta Rifargia distinguenda Rifargia elgiva Rifargia felderi Rifargia lineata Rifargia myconos Rifargia phanerostigma Rosema attenuata Rosema deolis Rosema dorsalis Rosema epigenea Rosema thestia Scotura leucophleps Sericochroa arecosa Sericochroa luculenta Sericochroa tenuis Skaphita salona Strophocerus albonotata Strophocerus sericea Strophocerus thermesia Tachuda albosigma Tachuda discreta Tithraustes deiphon Tithraustes lambertae Tithraustes noctiluces Trichomoplata cassiope Noctuidae Acanthodica daunus Achaea ablunaris INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Achaeops esperanza Aglaonice hirtipalpis Agrapha meretricia Agrapha nigra Agyra marchandi Amolita pepita Ampelasia azelinoides Amyna amplificans Amyna tristis Anicla infecta Anomis aricina Anomis illita Anomis luridula Anomis rufescensoides Antachara denterna Antachara diminuta Antiblemma calais Antiblemma ceras Antiblemma chephira Antiblemma fuscireticulata Antiblemma hembrilla Antiblemma imitans Antiblemma lothos Antiblemma memoranda Antiblemma patifaciens Antiblemma pira Antiblemma rhoda Antiblemma rubida Anticarsia anisospila Anticarsia gemmatalis Argidia palmipes Argidia palmipes Argidia rufa Argidia tomyris Argidia wedelina Argyrogramma verruca Argyrosticta aurifundens Argyrosticta ditissima Argyrosticta eubotes Argyrosticta vauaurea Aristaria theroalis Ascalapha odorata Athyrma adjutryx Athyrma misera INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 249 Athyrma tuberosa Azeta mimica Azeta rhodogaster Azeta versicolor Bagisara patula Bagisara repanda Baniana gulussa Baniana helle Baniana ostia Baniana phruxus Baniana strigata Baniana veluta Bleptina confusalis Bryolymnia marginata Callopistria floridensis Callopistria panamensis Callopistria panamensis Calyptis idonoides Carteris incana Carteris oculatalis Catephiodes trinidadensis Celiptera grisescens Celiptera levina Ceroctena amynta Ceroctena amynta Ceromacra fuliginea Ceromacra fuliginea Ceromacra putida Ceromacra tymber Chalcoecia emessa Chalcoecia gloria Chalcoecia patricia Chamyna homichlodes Charmodia vectis Charoblemma unilinea Chytonidia chloe Chytonix cyanochlora Chytonix elegans Chytonix mniochroa Chytonix splendens Cladenia mocha Clapra deucalion Clapra marginata Closteromorpha modesta INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Coenipeta anepsia Coenipeta bibitrix Coenipeta catoxantha Coenipeta damonia Coenipeta leucocyma Coenipeta medina Coenipeta phasis Coenipeta suttea Coenipeta tanais Coenipeta umbrata Coenobela joha Coeriana pretiosa Collomena filifera Collomena interstitia Collomena metaphaea Concana intricata Condica abida Condica cupienta Condica imitata Condica mimica Condica mobilis Condica pagetolophus Condica samula Condica selenosa Condica sutor Condica vacillans Coremagnatha orionalis Craterestra lucina Cropia aleuca Cropia cedica Cropia hadenoides Cropia isidora Cropia minthe Cropia phila Cropia templada Cryptochrostis crocea Cryptochrostis suppulchraria Cryptochrysa auripennis Cydosia curvinella Cymatophoropsis heurippa Darceta falcata Deinopa signiplena Diagrapta laminata Dialithis gemmifera INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 250 Diastema tigris Diopa corone Diphthera festiva Dolichosomastis dorsilinea Dolichosomastis dorsilinea Drobeta andrevia Drobeta bullata Drobeta directa Drobeta exscendens Drobeta grandis Drobeta ithaca Drobeta ochriplaga Drobeta poliosema Drobeta tiresias Drobeta tristigma Dusponera fannia Dyomyx cimolia Dyomyx egista Dyomyx inferior Dyomyx psectrocera Dyomyx psectrocera Dyops chromatophila Dyops cuprescens Dyops subdifferens Dyops telharsa Dysgonia expediens Elaeognatha melanosticta Elaeognatha phaenerostola Elaeognatha phaeostrota Elaphria agrotina Elaphria deltoides Elaphria hyposcota Elaphria lucens Elaphria marmorata Elaphria pallescens Elaphria pallescens Elaphria phlegyas Elaphria pulchra Elaphria rubripicta Elaphria subobliqua Emarginea anna Emarginea gammophora Empelathra amplificans Empelathra pindarus INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Encruphion leena Encruphion leena Encruphion xanthotricha Ensipia lamusalis Ephyrodes cacata Epitausa atriplaga Epitausa coppryi Epitausa dilina Epitausa pavescens Epitausa prona Epitausa terranea Epithisanotia sanctijohannis Erastroides emarginata Erebostrota stenelea Erocha mummia Eublemma deliciosa Euclystis guerini Euclystis laluma Euclystis manto Euclystis perplexa Euclystis plusioides Euclystis recurva Euclystis sublignaris Eudocima materna Eudocima memorans Eulepidotis addens Eulepidotis affinis Eulepidotis alabastraria Eulepidotis caeruleilinea Eulepidotis delecta Eulepidotis dominicata Eulepidotis folium Eulepidotis guttata Eulepidotis hermura Eulepidotis juncida Eulepidotis micca Eulepidotis perducens Eulepidotis perlata Eulepidotis rectimargo Eulepidotis superior Eusceptis effusa Eustrotia paloma Eustrotia roseoviridis Eutelia ablatrix INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 251 Eutelia abscondens Eutelia auratrix Eutelia chrysotermina Ferenta castula Focillidia bipunctata Fracara viridata Freilla abluta Freilla humeralis Gabara insulsa Glympis concors Gonodes liquida Gonodes obliqua Gonodonta bidens Gonodonta bidens Gonodonta clotilda Gonodonta fulvangula Gonodonta holosericea Gonodonta immacula Gonodonta incurva Gonodonta indentata Gonodonta lincus Gonodonta nr. sinaldus Gonodonta parens Gonodonta pyrgo Gonodonta sicheas Gonodonta sinaldus Gonodonta sitia Gonodonta syrna Gonodonta uxor Gonuris flaminia Gorgone augusta Gorgone fellearis Gorgone miniopila Graphigona regina Habershonia areos Hampsonodes mastoides Hampsonodes orbica Hayesia grisella Helia argentipes Helia calligramma Helia celita Helia hermelina Helia subjuga Helia vitriluna INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Hemeroblemma acron Hemeroblemma dolosa Hemeroblemma infans Hemeroblemma mexicana Hemeroblemma numeria Hemeroblemma opigena Hemeroblemma turdipennis Hemeroblemma turdipennis Hemicephalis alesa Hemicephalis laronia Hemicephalis laronia Hemicephalis paulina Herminodes atrosignata Herminodes madrina Herminodes nigripalpis Herminodes subclara Herminodes valida Heterochroma bellona Heterochroma eriopioides Heterochroma sarepta Hyamia palpitatalis Hypena andria Hypena angitia Hypena calistalis Hypena coatalis Hypena covitalis Hypena effectalis Hypena hemonalis Hypena lollia Hypena mactatalis Hypena miranda Hypena munda Hypena polybealis Hypena purpuralis Hypena xenaresalis Hypocala andremona Hypogrammodes confusa Ilsea subgeminata Iscadia argentea Iscadia chlorographa Iscadia furcifera Iscadia phaeoptera Iscadia purpurascens Iscadia purpurascens INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 252 Isogona capitalis Isogona continua Isogona natatrix Itomia intrahens Juncaria samia Lacinipolia olivacea Lambana lebana Lascoria alucitalis Lascoria aon Lascoria cristata Lascoria leucorabdota Lascoria manes Lascoria orneodalis Lepidodes gallopavo Lepidodes limbulata Lesmone aemylia Lesmone detrahens Lesmone duplicans Lesmone formularis Lesmone iolas Lesmone umbrifera Letis buteo Letis herilia Letis iphianasse Letis magna Letis mycerina Letis scops Letis scops Leucania latiuscula Leucatomis incondita Lithacodia merta Litoprosopus confligens Lycaugesia calochroia Macrochilo andaca Macrodes columbalis Macrodes cynara Magusa divaricata Marimatha botyoides Masoga rava Mazacyla subpicta Mazacyla subpicta Meganola bifiliferata Meganola pernitens Meganola polydonta INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Melipotis fasciolaris Melipotis januaris Melipotis ochrodes Metalectra carneomacula Metria aenia Metria angulata Metria bruma Metria celia Metria compotrix Metria lydia Metria meretricia Metria minta Metria mollis Metria obsolefacta Metria pacifica Metria subrosea Micrathetis dasarada Mimophisma delunaris Mocis diffluens Mocis disseverans Mocis dyndima Mocis latipes Mopothila ardalus Motya absceuzalis Mursa sotiusalis Nagara fenestra Neocodia asna Neogalea sunia Neophaenis respondens Neophaltis madates Neostictoptera nigripuncta Nicetas annon Nigetia sp. Nola carilla Nola intermedia Nola limona Nola mesographa Nola semirufa Nola triplaga Obroatis curvilineata Obroatis distincta Obroatis distincta Ocalaria dioptica Ogdoconta sp. INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 253 Ommatochila mundula Ophisma aeolida Ophisma despagnesi Ophisma minna Ophisma tropicalis Ophisma variata Oraesia nobilis Oraesia serpens Orodesma fearni Orsa erythrospila Orthodes crenulata Ostha concinna Ostha nomion Ostha rama Oxidercia thaumantis Oxidercia toxea Ozarba semipotentia Paectes chrysoplaga Paectes fovifera Paectes fuscescens Paectes fuscescens Palthis angustipennis Palthis asopialis Palthis bizialis Palthis misantlalis Palthis submarginata Panula inconstans Paralectra exaggerata Parangitia circumcincta Parangitia corma Parangitia subrufescens Pararcte schneideriana Perasia helvina Perigea agnonia Perigea leucanioides Perigea lineata Peteroma albilinea Peteroma laonome Phaeoblemma contracta Phaeoblemma dares Phuphena cilix Phuphena multilinea Plusiodonta aborta Plusiodonta miranda INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Plusiodonta nitissima Plynteria stellata Polionycta attina Polygonoides laciniata Proroblemma rosea Pseudbarydia crespula Pseudbarydia japeta Pseudbarydia selene Pseudogerespa usipetes Pseudophisma pritanis Pseudoplusia includens Ptichodes immunis Quandra hypozonata Radara anartoides Radara aquilalis Radara nealcesalis Radara zoum Radosa ordinata Ramphia albizona Rejectaria aratus Rejectaria aratus Rejectaria magas Rejectaria niciasalis Rejectaria niciasalis Renia acclamalis Renia discoloralis Renia rhetusalis Renodes croceiceps Rhosologia porrecta Rowdenia syllificalis Salia semiothisa Sanys evanescens Scopifera antelia Selenisa lanipes Selenisa suero Selenisa sueroides Sigela leucozoma Smyra stipatura Sosxetra grata Spodoptera androgea Spodoptera dolichos Spodoptera eridania Spodoptera frugiperda Spodoptera latifascia INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 254 Spragueia apicalis Spragueia dama Stauropides persimilis Stibaera albisparsata Stibaera curvilineata Stibaera dentilineata Strathocles pulla Syllectra congemmalis Syllectra erycata Synomera crafti Tarista albiapicalis Tautobriga euspila Thioptera botyoides Thioptera nigrofimbria Thyriodes flabellum Thyriodes terrabensis Trauaxa obliqualis Tripudia quadrifera Tyrissa perstrigata Tyrissa thara Vespola caeruleifera Vespola plumipes Xanthopastis timais Zale fictilis Zale peruncta Pyralidae Accinctapubes albifasciata Anarnatula subflavida Bibasilaris trisulcata Bonchis munitalis Cacozelia elegans Carcha hersilialis Carthara abrupta Carthara albicosta Casuaria crumena Chloropaschia contortilinealis Chloropaschia godrica Chloropaschia granitalis Chloropaschia hemileuca Chloropaschia pegalis Chloropaschia selecta Chrys. sp. Clydonopteron sacculana Cryptoses choloepi INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Dasycnemia obliqualis Deuterollyta cantianilla Deuterollyta dapha Deuterollyta majuscula Deuterollyta oediperalis Deuterollyta subfusca Deuterollyta umbrosalis Deuterollyta zetilla Dolichomia amoenalis Epidelia damia Gephyrella parsimonialis Lepidomys viridans Macalla finstanalis Macalla hyalinalis Macalla niveorufa Macalla noctuipalpis Macalla thyrsisalis Mapeta xanthomelas Mediavia longistriga Milgithea melanoleuca Milgithea suramisa Pandoflabella olivescens Paramacna arnea Paramacna nattereri Phidotricha erigens Pococera hemimelas Psectrodes abrasalis Quadraforma obliqualis Salobrena sp. Semnia auritalis Tallula beroella Tallula juanalis Tamyra ignitalis Thyrididae Banisia furva Dysodia angulisola Macrogonia major Macroprota rhomboidea Microsca polychloralis Orneostoma denticulata Zeuzerodes terminalis Tortricidae Amorbia revolutana Cuproxena duckworthorum INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 255 Icteralaria idiochroma Mictopsichia s. Orthocomotis herbaria Orthocomotis nitida Pseudatteria volcanica Uranidae Urania fulgens Geometridae Acrotomia mucia Acrotomia viminaria Anisoperas atropunctaria Bagodares prosa Ballantiophora gibbiferata Brachurapteryx tesserata Chavarriella fallax Chavarriella porcius Chavarriella semiornata Chloractis pulcherrima Chloropteryx dealbata Chloropteryx nordicaria Chloropteryx opalaria Cimicodes clisthena Cimicodes purpurea Cimicodes subapicata Cratoptera atina Cratoptera zarumata Cundinamarca subalbata Cyclomia disparilis Cyclomia minuta Cyclophora melitia Cyclophora nodigera Dichorda iris Dyspteris tenuivitta Dyspteris trifilaria Dyspteris vecinaria Eois deleta Eois dione Eois dorisaria Eois myrrha Eois numida Eois thetisaria Epimecis conjugaria Epimecis diffundaria Epimecis matronaria INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Epimecis nasica Epimecis patronaria Epimecis puellaria Epimecis subalbida Epimecis subroraria Erastria decrepitaria Ergavia carinenta Erosina hyberniata Eubaphe conformis Euclysia angustitincta Euclysia columbipennis Euclysia dentifasciata Euclysia maculata Eudule sp. Euphyia cinerascens Euphyia crispa Euphyia nigrolineata Euphyia pontina Eusarca flexilis Eusarca minucia Eusarca nemora Eutomopepla artena Eutomopepla discuneata Glena gemina Hagnagora ephestris Herbita lilacina Herbita praeditaria Hyalostenele lutescens Hydata sp. Hydatoscia ategua Hygrochroma olivinaria Hymenomima camerata Hymenomima chacon Hymenomima sp. Hymenomima umbelularia Idaea subcrinita Idaea subfervens Idaea tacturata Iridopsis aviceps Iridopsis eutiches Iridopsis herse Iridopsis lurida Iridopsis pandrosos Iridopsis validaria INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 256 Ischnopteris bryifera Isochromodes epioneata Leptostales angulata Leuciris fimbriaria Leucula circumdata Leucula festiva Leucula lucidaria Lissochlora inconspicua Lissochlora manostigma Macaria abydata Macaria achetata Macaria approximaria Macaria guapilaria Macaria ostia Macaria regulata Melanolophia atrifascia Melanolophia flexilinea Microgonia rufaria Microxydia ruficomma Mimomma ochriplaga Neagathia corruptata Nematocampa arenosa Nematocampa completa Nematocampa straminea Nemoria acutularia Nemoria adaluzae Nemoria adjunctaria Nemoria carolinae Nemoria defectiva Nemoria dentilinea Nemoria epaphras Nemoria florae Nemoria karlae Nemoria punctilinea Nemoria scriptaria Nemoria toxeres Nemoria tutala Nemoria venezuelae Nepheloleuca politia Nephodia orcipennata Oospila albicoma Oospila albipunctulata Oospila atopochlora Oospila camilla INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Oospila concinna Oospila confundaria Oospila fimbripedata Oospila rosipara Oospila venezuelata Opisthoxia amabilis Opisthoxia asopis Opisthoxia bella Opisthoxia bolivari Opisthoxia formosante Oxydia apidania Oxydia sociata Oxydia subdentilinea Oxydia vesulia Palyas micacearia Pantherodes unciaria Paragonia cruraria Paragonia lanuginosa Paragonia planimargo Paragonia procidaria Paragonia tasima Parallage diaphanata Patalene aenetusaria Patalene asychisaria Patalene chaonia Patalene hamulata Patalene luciata Patalene trogonaria Perigramma repetita Perigramma vicina Perissopteryx gamezi Perissopteryx submarginata Perissopteryx ugaldei Pero afuera Pero amanda Pero boa Pero bulba Pero chapela Pero clysiaria Pero delauta Pero dorsipunctata Pero dularia Pero exquisita Pero incisa INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO 257 Pero lignata Pero nigra Pero plagodiata Pero polygonaria Pero protea Pero registrada Pero saturata Pero solitaria Pero stuposaria Phrudocentra albiceps Phrudocentra albicoronata Phrudocentra janeira Phrudocentra pupillata Phrygionis privignaria Phyllodonta indeterminata Physocleora pauper Physocleora plenaria Physocleora taeniata Polla hemeraria Prochoerodes marciana Prochoerodes pilosa Proutoscia mirifica Pyrinia sp. Pyrochlora rhanis Rhodochlora brunneipalpis Rhomboptila brantisiata Semaeopus illimitata Semaeopus varia Semiothisa arenisca Semiothisa divergentata Semiothisa gambaria Semiothisa salsa Sericoptera chiffa Sericoptera virginaria Simena luctifera Simopteryx torquataria Smicropus laeta Spargania augustaria Sphacelodes quadrilineata Sphacelodes vulneraria Stenalcidia plenaria Synchlora astraeoides Synchlora expulsata Synchlora frondaria INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO Synchlora gerularia Synchlora pulchrifimbria Synchlora tenuimargo Tachychlora amilletes Tachyphyle acuta Tachyphyle basiplaga Tachyphyle hamata Tachyphyle oleaster Tachyphyle undilineata Taeniogramma odrussa Thysanopyga abdominaria Thysanopyga amarantha Thysanopyga carfinia Thysanopyga casperia Thysanopyga cermala Thysanopyga gauldi Thysanopyga nigristicta Tmetomorpha bitias Trotopera olivifera Trygodes musivaria Trygodes niobe INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO INBIO FOTOGRAFÍAS 258 PLANTAS Anthurium obtusilobum Besleria robusta Desmoncus schippii Eugenia earthiana Hirtella guatemalensis Lycianthes sanctaclarae 259 PLANTAS Maripa nicaraguensis Metteniusa tessmanniana Miconia valerioana Notopleura polyphlebia Passiflora talamancensis Pentagonia costaricensis 260 PLANTAS Perebea hispidula Preslianthus pittieri Prestonia portobelensis Psiguria warscewiczii Symphonia globulifera Voyria kupperi 261 MACROHONGOS Chlorophyllum molybdites Cookeina speciosa Cookeina tricholoma Coprinus disseminatus Coriolopsis polyzona Earliella scabrosa 262 MACROHONGOS Fomes fasciatus Ganoderma lucidum sensu lato Hexagonia hydnoides Ganoderma australe sensu lato Hexagonia glaber Oudemansiella canarii 263 MACROHONGOS Phellinus gilvus Pycnoporus sanguineus Trametes elegans Polyporus virgatus Rigidoporus microporus Trichaptum sector 264 MAMíFEROS Artibeus jamaicensis Carollia sowelli Cebus imitator Dasyprocta punctata Didelphis marsupialis Ectophylla alba 265 MAMíFEROS Mimon crenulatum Philander opossum Procyon lotor Noctilio leporinus Platyrrhinus helleri Proechimys semispinosus 266 MAMÍFEROS Puma concolor huella Tamandua mexicana Thyroptera tricolor Sciurus granatensis Tonatia saurophila Trachops cirrhosus 267 AVES Ara ambiguus Buteogallus anthracinus Charadrius collaris Chloroceryle aenea ♀ Corapipo altera ♂ Crax rubra ♂ 268 AVES Eurypyga helias Jacana spinosa Manacus candei ♀ Gymnocichla nudiceps Onychorhynchus coronatus ♂ Pelecanus occidentalis 269 AVES Ceratopipra mentalis ♂ Sula leucogaster juvenil Trogon massena ♂ Porphyrio martinicus Thamnophilus atrinucha Turdus plebejus 270 MARIPOSAS DIURNAS Anartia fatima Archaeoprepona demophon gulina Danaus plexippus Arawacus togarna Caligo telamonius memnon Hamadryas laodamia saurites 271 Heliconius erato petiverana Heliconius hecale zuleika Heliconius sara fulgidus Heraclides thoas nealces Hypna clytemnestra negra Siproeta stelenes biplagiata 272 MARIPOSAS NOCTURNAS Adhemarius gannascus Dysdaemia boreas Eumorpha triangulum Automeris janus Eumorpha capronnieri Madoryx pluto
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados