FÍSICA. PRUEBA ACCESO A UNIVERSIDAD +25 TEMA 12. Física
Anuncio

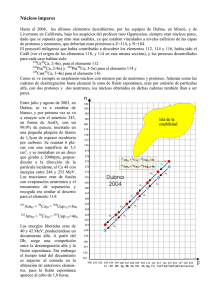
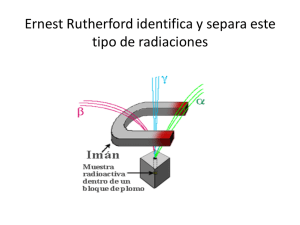
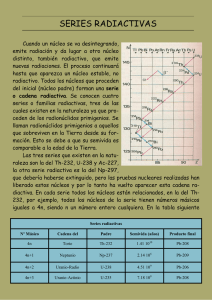
FÍSICA. PRUEBA ACCESO A UNIVERSIDAD +25 TEMA 12. Física nuclear En 1896 H. Becquerel (1852-1908) se encontraba estudiando el fenómeno de la fluorescencia1 para lo que envolvía una placa fotográfica en un papel grueso, encima colocaba un material fluorescente y ambos los exponía a la radiación solar. Cuando desenvolvía la placa fotográfica la encontraba velada, lo que le hacía suponer que la causa 2 era la radiación emitida por el material fluorescente y que ésta debía de ser del tipo de rayos X, pues atravesaba el grueso papel. Varios días consecutivos nublados detuvieron sus experiencias habiendo dejado su experimento metido en un cajón; después de lo cual decidió revelar la placa para apreciar que ésta se encontraba totalmente velada, y no muy poco, como cabría esperar. Este descubrimiento le hizo pensar que la causa del velado de la placa no era la fluorescencia del material, sino algún tipo de radiación procedente del material que era una sal de uranio. Finalmente llegó a la conclusión de que la sal de uranio emitía permanentemente una radiación similar a los rayos X y en todas las direcciones, a las que denominó fluorescencia invisible. Este fenómeno interesó a Marie Sklodowska3(1867-1934) al que denominaron por primera vez, radiactividad. Los Curie llegaron a la conclusión, que la causa de la radiactividad eran los átomos de uranio y que su intensidad era proporcional a la cantidad de uranio presente en la muestra. Ambos, descubrieron que la pechblenda, mineral de uranio, era cuatro veces más activa que el uranio, y la calcolita dos veces más, concluyendo que estos dos minerales debían contener pequeñas cantidades de otra sustancia considerablemente más radiactivas que el uranio. El 27 de junio de 1898 comunicaban el descubrimiento de un nuevo elemento al que denominaron polonio, en honor del país de origen de Marie, y el 11 de diciembre el descubrimiento del elemento radiactivo por excelencia: el radio. Los primeros estudios que se realizaron sobre la radiactividad pusieron de manifiesto unas propiedades generales que podemos resumir: Alto poder de penetración en la materia, pudiendo atravesar láminas metálicas. Alto poder de ionización de la materia al chocar con los átomos que la constituyen y transformarlos en iones que se pueden detectar. Interacción con campos eléctricos y magnéticos. Invariabilidad de la radiactividad ante la acción de factores como la temperatura, la presión, las reacciones químicas, etc. La interacción de la radiactividad con la materia se acompaña de intercambios altamente energéticos. La intensidad de la radiactividad en un material es proporcional a la fracción de elemento activo presente. Tipos de radiaciones Si la radiactividad emitida por un material natural se hace pasar por un campo magnético o eléctrico se observa que se descompone en tres radiaciones: 0 Radiación beta 1 : Está formada por partículas con masa pequeña y carga eléctrica negativa; en concreto se trata de electrones y pueden atravesar láminas de aluminio con energía entorno a 1 MeV. Radiación alfa 2 : Está formada por partículas de mayor masa que las beta y carga eléctrica positiva; en concreto, se trata de núcleos de Helio con masa equivalente a la de dos protones y dos neutrones y carga equivalente a la de dos protones. Tienen poco poder de penetración (hoja de papel) y su energía cinética es del orden de 1 MeV. Radiación gamma : No se desvían en campos magnéticos o eléctricos pues se trata de radiación electromagnética de alta frecuencia (superior a los rayos X), tiene energía del orden de keV y son muy penetrantes en la materia. 4 1 La fluorescencia es la luminiscencia producida por ciertos minerales cuando son expuestos a la acción de ciertos rayos (rayos X, ultravioleta, visibles). Estas radiaciones son transformadas por el mineral en ondas luminosas de longitud de onda mayor que la de los rayos que inciden en él. 2 No podría tratarse de la radiación solar, pues ésta no atraviesa el grueso papel. 3 Más conocida por Marie Curie, esposa de Pierre Curie, físico que le apoyó en sus investigaciones. 1 El núcleo atómico En 1907 H.W. Geiger y E. Mardsen, bajo la supervisión de E. Rutherford, estudiaban el impacto de partículas α sobre láminas delgadas de oro. Una muestra de Radio se ponía en un contenedor con un pequeño orificio por el que escapaba un haz delgado de partículas α que se hacía incidir sobre una placa de sulfato de zinc, la cual tiene la propiedad de emitir luz cuando es alcanzada por una partícula α. Al interponer en su camino una lámina delgada de oro, podían estudiarse las desviaciones que provocaban los átomos de oro a las partículas α. En un principio los resultados obtenidos entraban dentro de lo previsto; la mayoría de las partículas α atravesaban la lámina de oro sin desviarse y algunas se desviaban de tal manera que el número de partículas α dispersadas por el oro decrecía rápidamente con el ángulo de observación, medido respecto a la dirección incidente, y no encontraron evidencia de partículas α que se dispersaran ángulos mayores de 30º. Rutherford les insistió en que tratasen de encontrar partículas α que se desviasen ángulos superiores a 30º. La sorpresa ocurrió cuando, poco después, Geiger le comunicó que Mardsen había observado partículas α dispersadas hacia atrás. Según el propio Rutherford, ".... era como disparar balas sobre un hoja de papel y ver que rebotan". Geiger y Marsden se dedicaron a medir entonces la distribución de las partículas α con más cuidado y, en 1909, publicaron sus resultados. La deflexión seguía una función bien definida que decrecía pronunciadamente con el ángulo, pero que indicaba que la dispersión de las partículas α a ángulos mayores de 90º era muy superior a la que podría atribuirse a una fluctuación estadística. En 1911, Rutherford dio una explicación a los resultados de Geiger y Marsden. Según éste, la dispersión a grandes ángulos indicaba que, contrario a lo pensado hasta entonces, la mayor parte de la masa del átomo, y toda su carga positiva, se encontraba concentrada en una región muy reducida en el centro del átomo: el núcleo. http://www.sc.ehu.es/sbweb/fisica/cuantica/rutherford/rutherford.html Los estudios posteriores para determinar la composición del núcleo, llevaron a pensar que en el núcleo se 1 encontraban los protones ( 1 H ), partícula identificada por Rutherford en 1914 y de la que determinó su masa y su carga. Pero resultó que no sólo bastaban los protones para justificar la masa del núcleo, lo que llevó a suponer la existencia de otra partícula cuya masa sería similar a la del protón y no debería tener carga eléctrica, razón por lo que 1 no fue identificada hasta 1932, denominándose neutrón ( 0 n ). Cada núcleo atómico se identifica por el número de protones o número atómico Z, y por el número de partículas o nucleones que tiene, llamado número másico A. El número de neutrones será pues, A-Z. También, llamaremos núclido a cada tipo de núcleo y los representaremos de manera general con el símbolo químico del elemento químico al que pertenece anteponiéndoles como subíndice Z y como superíndice A. A Z Así por ejemplo: X 238 92 U se refiere al núclido del Uranio con 92 protones, 238 nucleones de los cuales 238-92=146 son neutrones. 3 A.1 Describe la composición de los siguientes núclidos: 1 H , 12 6 C, 60 27 Co , 137 55 Cs Existe una gran cantidad de núclidos que podemos clasificar en: Isótopos: Son núclidos que tienen el mismo Z pero diferente A; es decir, tienen el mismo número de protones pero diferente número de neutrones. Al tener el mismo número de protones se trata de núclidos del mismo 1 2 3 elemento químico. Por ejemplo: 1 H , 1 H , 1 H se trata de los tres isótopos del elemento químico Hidrogeno y que se denominan: protio (el más abundante), deuterio y tritio. Isóbaros: Son núclidos que tienen el mismo A pero diferente Z. Por ejemplo: Isótonos: Son núclidos que tienen el mismo número de neutrones, pero diferente Z y diferente A. Por ejemplo: 13 6 Cy 14 7 14 6 Cy 14 7 N N A.2 Identifica isóbaros, isótonos e isótopos de entre los siguientes núclidos: 55 26 60 Fe , 2960Cu , 28 Ni , 2656 Fe , 3061Zn , 2760Co 2 Si tenemos en cuenta que la masa del electrón es del orden de 1838 veces menor que la del protón o del neutrón, podemos considerar que la masa del átomo se encuentra concentrada en un 99% en el núcleo. Por otra parte, la masa de los átomos debe ser una cantidad muy pequeña por lo que es conveniente definir una unidad de masa adecuada para medir la masa de los átomos. Desde 1961, se estableció la unidad de masa atómica unificada u, como la doceava parte de la masa del isótopo 12 6 C que resulta ser 1,66x10-27 kg. Luego podemos concluir que: 1u lo que nos permite cambiar de escala. 1,66 x1027 kg A.3 Completa la siguiente tabla: Partícula Electrón Protón Neutrón Masa (kg) 9,1x10-31 Masa (u) 1,00783 1,675x10-27 Por lo que respecta a la forma y volumen de los núcleos, los resultados experimentales permiten afirmar que, en su mayoría, tienen forma esférica y que su radio se puede estimar: r r0 3 A -15 donde r0=1,2x10 A.4 Calcula el radio, el volumen y la densidad del núcleo: 137 55 m. Cs . (Sol: 6,2x10-15 m; 9,9x10-43 m3; 2,3x1017 kg/m3) 3 A.5 Compara la densidad del núcleo anterior con la del Os que es de 22,5 kg/dm . ¿Qué te hace pensar? A.6 Considera dos protones del núclido 137 55 Cs que se encuentran separados por una distancia igual al radio y calcula: a) El valor de la fuerza de la interacción gravitatoria. (Sol: 4,8x10-36 N) b) El valor de la fuerza de la interacción eléctrica. (Sol: 6 N) c) La aceleración que debería tener cada protón. (Sol: 3,6x1027 m/s2) d) La energía potencial eléctrica de los dos protones. (Sol: 232 keV) DATOS: mp=1,00783 u; qp=1,6x10-19 C Fuerzas nucleares Una vez establecido que en el núcleo se encuentran los protones y los neutrones quedaba por explicar qué tipo de fuerzas las mantenían unidas. Estas fuerzas deberían actuar a muy corta distancia, del orden de 10-15 m y ser de gran intensidad para justificar la estabilidad del núcleo. La estabilidad del núcleo se puede evaluar desde el punto de vista energético como pasamos a ver. Se ha observado que para núcleos estables ligeros, el número de protones es similar al de neutrones; pero para los núcleos estables masivos (mayor masa) el número de neutrones crece sensiblemente por encima del número de protones. Esto indica que al aumentar el número de protones, también aumenta la intensidad de las fuerzas repulsivas de Coulomb, lo que disminuiría la estabilidad del núcleo. Es por ello que se necesitan más neutrones para mantener estable el núcleo ya que entre neutrones, y entre neutrones y protones, sólo existen fuerzas de atracción. La mayoría de los núclidos estables tienen valores de A par; además, existen ciertos valores de Z y N (número de neutrones), llamados números mágicos, que corresponden a núcleos de gran estabilidad. Por otra parte, también se comprobó que la masa total de un núcleo es menor que la suma de las masas de los nucleones que lo forman, a esta diferencia de masa se le llama defecto de masa. El principio de equivalencia masa-energía, E=mc2, establecido por Einstein en su teoría de la relatividad, permite interpretar esta disminución de masa como la disminución de energía que sufren, los nucleones por separado, al unirse para formar el núcleo y que será la misma que necesitaremos para separar de nuevo los nucleones del núcleo. Esta diferencia de energía es conocida como energía de enlace o ligadura y es la que confiere estabilidad al núcleo. Eligadura Enucleones E núcleo 3 El defecto de masa es m Z ( m protón ) ( A Z ) mneutrón mnúcleo y aplicando el principio de equivalencia: Eligadura c 2 m Para poder realizar comparaciones entre núcleos es interesante conocer la energía media de enlace por nucleón Eligadura/A para cada núcleo cuya representación gráfica se muestra al lado y donde podemos observar: En los núcleos ligeros se aprecia un aumento brusco de la energía de enlace por nucleón hasta A=10. La fusión de dos núcleos ligeros para formar un más pesado, es un proceso en el que se libera energía. Fusión nuclear. Los núcleos más estables son los semipesados entorno a A=62. Hacia los núcleos pesados, la energía media de enlace por nucleón decrece, de tal manera que la fisión de un núcleo pesado para formar dos núcleos semipesados, es un proceso en el que se librera energía. Fisión nuclear. Finalmente, podemos concluir que para justificar las propiedades de los núcleos hay que pensar en un nuevo tipo de interacción (además de la gravitatoria y electromagnética) denominada interacción fuerte cuyas características son: Son fuerzas atractivas entre 1x10-15 y 2x10-15 m, y repulsivas a distancias inferiores a 1x10-15 m. Son de intensidad muy fuerte para vencer la fuerzas repulsivas eléctricas entre los protones a tan cortas distancias. Son de corto alcance, es decir se manifiestan a cortas distancias 1x10-15 m. Son independientes de la carga eléctrica por lo que se dan entre protones, entre neutrones y entre protones y neutrones. A.7 Calcula la energía equivalente de una unidad de masa unificada. (Sol: 934 MeV) 23 A.8 Para el núclido 11 Na de 22,9898 u : a) Calcula el defecto de masa en su formación. (Sol: 3,4x10-28 kg) b) Calcula la energía de ligadura por nucleón. (Sol: 83,2 MeV) c) Calcula la energía necesaria para disociar completamente 1 g de núclidos DATOS: Busca la masa de los nucleones. 23 11 Na . (Sol: 8,1x1011 J) Leyes de la desintegración radiactiva En 1902 E. Rutherford y F. Soddy formularon la ley de la desintegración radiactiva o ley de decaimiento al comprobar que la actividad radiactiva de una sustancia disminuye exponencialmente con el tiempo. El proceso de emisión radiactiva es independiente del estado físico o de la combinación química en la que se encuentre la sustancia radiactiva y se trata de un proceso aleatorio en el que no se puede determinar cuando se desintegrará un núcleo determinado. http://www.colorado.edu/physics/2000/isotopes/radioactive_decay3.html Si tenemos una muestra con N núcleos de un elemento radiactivo. El número de núcleos que se desintegran dN en un intervalo de tiempo infinitesimal dt, es proporcional al número de núcleos presentes y al intervalo de tiempo, lo que matemáticamente se expresa: dN N dt 4 donde λ es la constante radiactiva o constante de desintegración (se mide en 1/s) que tiene un valor propio para cada núclido radiactivo y representa la probabilidad por unidad de tiempo de que un determinado núcleo se desintegre. Si λ tiene un valor grande, la sustancia radiactiva se desintegrará rápidamente. El signo – (-dN) significa que el número de núcleos disminuye. La expresión anterior también la podemos escribir: dN dN N donde el valor absoluto es la dt dt velocidad de desintegración también conocida como actividad (Ac) de la sustancia radiactiva. La unidad de la actividad en el SI es el becquerel (Bq) que equivale a una desintegración/segundo. Otras unidades de actividad 4 No confundir con la longitud de onda utilizada en temas anteriores. 4 utilizadas son el curio (Ci) que equivales a 3,7x1010 desintegraciones/segundo y el rutherford que equivale a 106 desintegraciones/segundo. El número de núcleos radiactivos presentes en una muestra disminuye con el tiempo. Tengamos una muestra radiactiva que a to=0 (inicialmente) tiene No núcleos radiactivos, ¿cuántos quedarán sin desintegrar al cabo de t segundos? Veamos: dN dN N de aquí dt e integrando resulta dt N N t que también podemos expresar: Ln N0 N N 0 e t siendo “e” la base de los logaritmos neperianos. Dado que la masa total de un elemento radiactivo será el producto del número de núcleos por la masa de estos, podemos escribir m Ln t m0 o también m m0 e t donde m0 es la masa inicial y m la masa a tiempo t de la sustancia radiactiva. De igual manera, como la actividad es proporcional a la cantidad de núcleos presentes, también podemos expresar: A Ln c t Ac 0 Un valor característico de los núclidos radiactivos es su periodo de semidesintegración T o tiempo que tiene que transcurrir para que, en una muestra radiactiva, el número de núcleos radiactivo (o la masa de todos ellos) N t tenemos: N0 se reduzca a la mitad, es decir N=N0/2 y sustituyendo en la expresión Ln 1 Ln T 2 Otro concepto interesante es la vida media toma el valor: de donde se deduce T Ln2 , que se interpreta como el promedio de vida de cualquier núcleo y que 1 o bien T Ln 2 A.9 El número de núcleos de una muestra radiactiva se reduce un 15% en 1,54 días. a) Calcula la constante radiactiva del núclido radiactivo. (Sol: 1,2x10-6 1/s) b) Calcula el periodo de semidesintegración del núclido radiactivo. (Sol: 5,8x105 s) c) Calcula la vida media del núclido radiactivo. (Sol: 8,3x105 s) 234 A.10 Tenemos una muestra de 1012 núcleos de U cuyo periodo de semidesintegración es de 2,5x105 años. a) ¿Cuál es la actividad inicial de la muestra? (Sol: 0,088 desintegración/s) 234 U quedarán al cabo de 100 años? (Sol: 9,997x1011) 234 8 c) ¿Cuántos núcleos de U se habrán desintegrado en ese tiempo? (Sol: 3x10 ) b) ¿Cuántos núcleos de A.11 Un gramo de Radio tiene una actividad de 1Ci. Sabiendo que la masa atómica del Radio es 226 u: a) Calcula la constante de desintegración del Radio. (Sol: 1,4x10-11 1/s) b) La vida media de los núcleos de Radio. (Sol:7,2x1010 s) c) El periodo de semidesintegración del Radio. (Sol: 1570 años) 14 A.12 En una excavación arqueológica se encontró un cuenco de calabaza que presentaba una actividad del C de 0,20 desintegraciones/s por cada gramo de carbono. Calcula la antigüedad del cuenco sabiendo que la actividad del 14 C en una planta viva es de 0,27 desintegraciones/s por cada gramo de carbono y que el periodo de 14 semidesintegración del C es de 5570 años. (Sol: 2409 años) Modos de desintegración radiactiva Desde un principio se pensó que las radiaciones que constituyen la radiactividad proceden del núcleo del átomo. De manera natural las sustancias radiactivas emiten los tres tipos de radiaciones antes vistos (α, β, γ) como un 5 mecanismo por el que los núcleos inestables se transforman en otros más estables mediante la liberación de dichas partículas. En estos procesos de desintegración se cumplen los principios de conservación: Conservación de la energía. Conservación del momento lineal. Conservación de la carga eléctrica. Conservación del número de nucleones. Desde 1913, y como resultado de amplias experiencias se conocen las leyes del desplazamiento de Soddy: La emisión de una partícula α por un núcleo origina la formación de otro núcleo con un número atómico inferior de dos unidades y un número másico inferior en cuatro unidades. La emisión de una partícula β por un núcleo origina otro núcleo con número atómico superior en una unidad y como el mismo número másico. La emisión de rayos gamma al ser ondas electromagnéticas no modifica los números característicos del núcleo. Después de la desintegración radiactiva es posible que el nuevo núclido que se forma también sea radiactivo y se proceda a una nueva desintegración. Este proceso continuará hasta que un núclido no sea radiactivo, es decir sea estable. Un conjunto de estos procesos sucesivos es conocido como serie o familia radiactiva. En la actualidad se conocen cuatro familias radiactivas que resumimos en la siguiente tabla: Familia Torio Neptunio Uranio Actinio Núclido inicial 232 Th 237 Np 238 U 235 U T semidesintagración 1,4x1010 años 2,2x106 años 4,5x109 años 7,2x108 años Núclido final 208 Pb 209 Bi 206 Pb 207 Pb Emisión alfa α Se produce en núcleos de elementos pesados o masivos en los que el número de neutrones y muy superior al de protones. Las partículas α fueron identificadas como núcleos de Helio que representamos que están formadas por dos protones y dos neutrones. Este proceso se puede expresar: Por ejemplo: A Z 4 2 He y X AZ42Y 24He 230 90 4 Th 226 88 Ra 2 He Obsérvese la conservación del número atómico y másico. Este proceso también va acompañado de un defecto de masa equivalente a una cantidad de energía que se reparte en forma de energía cinética entre la partícula α y el nuevo núcleo formado. Aplicando los principios de conservación de la energía y momento lineal, se deduce que la velocidad de las partículas α es del orden de 107 m/s que junto con su masa, las hace idóneas como proyectiles para el estudio de los átomos. 218 84 A.13 Completa las siguientes desintegraciones: Emisión beta Po X 24He 4 X 206 80 Hg 2 He 0 1 e y su emisión se produce en los núcleos que tienen muchos más A A 0 neutrones que protones. El proceso se puede expresar: Z X Z 1Y 1 e 218 218 0 Por ejemplo: 84 Po 85 Ac 1 e Estas partículas se identificaron como electrones La emisión de partículas presentaba varios inconvenientes: En el núcleo no hay electrones. El principio de conservación del momento lineal. Para explicar la emisión , W. E. Fermi (1901-1954) postuló la existencia de una interacción, llamada interacción débil, por ser de menor intensidad que la interacción fuerte y la electromagnética y cuyo alcance es del orden de 10-15 m. Para hacer compatible esta la emisión β con los principios de conservación, W. Pauli (1900-1958) propuso que la desintegración daría lugar a la formación de tres partículas: 6 1 0 n 11H 10e donde es el neutrino; partícula sin masa (10000 veces menor que la del electrón) y sin carga por lo que sería difícil de detectar. El neutrino fue detectado en 1952. De manera general, la emisión se puede expresar: ZA X Z A1Y 10e Dado que el neutrón y el protón tienen una pequeña diferencia de masa la energía equivalente máxima de la partícula será: Eβ=(mn-mH)c2 cuyo valor es del orden de 0,78 MeV. Emisión beta Cuando un núcleo presenta deficiencia de neutrones, para compensar esta deficiencia, un protón se desintegra: 1 1 siendo 0 1 H 01n 10e e el positrón. De manera general para cualquier núcleo que emite se puede expresar: A Z Por ejemplo: 13 7 X Z A1Y 10e N 136C 10e Emisión gamma Cuando un núcleo emite una partícula alfa o beta queda en un estado energético elevado o excitado y tiende hacia un estado energético menor mediante la emisión del exceso de energía en forma de fotón de alta energía y que constituye la radiación gamma. Dado que el fotón no tiene masa ni carga, los números atómico y másico no se modifican. El proceso lo podemos expresar: A Z X * ZAX Captura electrónica Se produce en núcleos inestable con defecto de neutrones y consiste en la captura por el núcleo de un electrón de la capa más cercana al núcleo produciéndose el siguiente proceso: 1 1 H 10e 01n La conversión de un protón en un neutrón, disminuye el número atómico del núcleo en una unidad como ocurre en la emisión del positrón. Por ejemplo: 64 29 64 Cu 10e 28 Ni El hueco dejado por el electrón capturado en la primera capa de electrones es ocupado por un electrón de las capas superiores, lo que conlleva la emisión un fotón de rayos X. Por otra parte, el núclido resultante de la captura electrónica, se encuentra en estado excitado, por lo que al pasar al estado fundamental emite un fotón gamma. Como hemos visto los procesos nucleares se representan de manera similar a los procesos químicos, llamándoseles reacciones nucleares; pero ambos procesos debemos diferenciarlos. En las reacciones químicas, las modificaciones se dan en los electrones que rodean el núcleo; mientras que, en las reacciones nucleares, las modificaciones se dan en la composición del núcleo y como hemos observado se cumplen el principio de conservación del número atómico y el número másico. A.14 Completa los siguientes procesos nucleares: 45 20 Ca 10e ; 239 93 Np 239 92 U ; 137 55 Cs137 56 Ba ; 14 8 O 147 N Reacciones nucleares. Radiactividad artificial. Los procesos radiactivos estudiados hasta ahora tienen carácter espontáneo, es decir se producen por la inestabilidad de los núcleos. Veamos ahora los procesos nucleares provocados por la acción de una partícula sobre un núcleo o entre dos núcleos. En estos procesos se dan cambios estructurales en el núcleo y su importancia radica en que las energías que se ponen de manifiesto, son del orden de un millón de veces de las energías que se ponen de manifiesto en las reacciones químicas clásicas (enlaces químicos entre átomos); además de la posibilidad de obtener núcleos de elementos químicos a partir de otros elementos, la deseada transmutación de la materia. 7 En 1919, Rutherford bombardeo nitrógeno con partículas α observando la presencia de partículas de gran alcance, que identificó como protones, y la formación de isótopos de oxígeno. El proceso lo podemos representar: 14 7 N 24He178O 11H 14 17 o también 7 N ( , p ) 8 O De nuevo podemos ver que se cumplen la conservación del número másico y del número atómico, además del momento lineal, energía y momento angular. En 1934, el matrimonio Joliot-Curie utilizaron partículas α para bombardear láminas de Al, observando el siguiente proceso: 30 15 27 13 Al 24He 01n 1530P * siendo el fósforo un elemento radiactivo que en pocos minutos se desintegra dando: P * 1430Si 10e . Este proceso de desintegración tiene una duración muy corta, lo que puso de manifiesto que en la naturaleza sólo existen los elementos radiactivos con periodos muy grandes, habiendo desaparecido, por desintegración, aquellos isótopos radiactivos de pequeños periodos. El matrimonio Joliot-Curie había provocado la formación de un isótopo radiactivo, es decir, la radiactividad artificial. A.15 Completa las siguientes reacciones nucleares: 40 18 Ar 24He11H 11 5 B X 11H 146C 7 3 Li 11H 47Be En los procesos nucleares las variaciones de energía están relacionadas con las variaciones de masa mediante el 2 principio de equivalencia E m c A.16 Calcula la variación de energía asociada al proceso: 14 7 N 24He178O 11H (Sol: 1,9 MeV) 8 DATOS: masas (mN=14,003074 u; mHe=4,002603 u; mH=1,007825 u; mO=16,999131 u); c=3x10 m/s; -27 1 u=1,66x10 kg Fisión nuclear La gráfica de la página 4, en la que se representa la energía de enlace por nucleón, pone de manifiesto que la energía media de enlace por nucleón decrece, de tal manera que la fisión de un núcleo pesado para formar dos núcleos semipesados, es un proceso en el que se librera energía. Por otra parte, el descubrimiento del neutrón, por 1932 por J. Chadwick, como partícula sin carga eléctrica le hacía idóneo para ser utilizado como proyectil contra los núcleos pesados con el fin de provocar su fisión en otros núcleos semipesados y la consiguiente liberación de energía. En 1938, O. Hahn descubrió que impactando núcleos de uranio con neutrones se producía su fisión, proceso que podemos representar: 235 92 * 92 141 1 U 01n 236 92 U 36 Kr 56 Ba 30 n . http://www.sagangea.org/hojared_radiacion/paginas/Fision.html La importancia de este proceso radica: La gran liberación de energía en base al principio de 2 equivalencia masa-energía E m c . La liberación de neutrones que posibilita la continuidad del proceso (reacción en cadena). Este proceso tiene algunas variantes de tal manera que el número de neutrones que se liberar pueden ser 2 o 3. No todos los neutrones resultantes de una fisión pueden producir otra fisión. Si un sólo neutrón produce fisión en otro núcleo, tendremos una reacción de fisión en cadena automantenida y controlada; pero si más de un neutrón provoca nuevas fisiones, el número crece exponencialmente y se produce una explosión nuclear (bomba atómica). A.17 Calcula la energía liberada en la fisión completa de 1 gramos de U-235 según la reacción: 235 92 92 1 U 01n 36 Kr 141 56 Ba 30 n DATOS: masas(mU=235,0439 u; mBa=140,9140 u; mKr=91,9250 u; mn=1,008665 u); 1u=1,66x10-27 kg (Sol: 7,2x1010 J) Reactor nuclear 8 El aprovechamiento de la energía liberada en las reacciones de fisión nuclear se realiza en el reactor nuclear. El combustible o material fisionable es el óxido de uranio enriquecido5 entre el 2 y 3,5% de U-235 que se encuentra en forma de pastillas y metidas en tubos dentro de la vasija del reactor. La vasija del reactor es una estructura blindada de hormigón y placas de plomo para evitar la salida de radiaciones al exterior. Dentro de la vasija del reactor también se encuentra el moderador (agua, agua pesada o grafito) cuya misión es la de disminuir la energía cinética de los neutrones hasta hacerlos 235 aptos para provocar fisiones en los núcleos de U ; y las barras de control (bario o cadmio), que absorben los neutrones excedentes dejando la reacción en cadena de manera automantenida. La energía liberada en la vasija es desalojada mediante el fluido refrigerante que mediante un intercambiador de calor pasa a otro circuito en el que agua en forma de vapor mueve una turbina a la cual está conectado un generador eléctrico. La fisión nuclear tiene un alto rendimiento energético. Sin embargo, representa un riesgo de contaminación radiactiva y la eliminación de los residuos radiactivos de las centrales nucleares representa un grave problema medioambiental. http://www.tecnun.es/Asignaturas/Ecologia/Hipertexto/07Energ/130EnNuclear.htm http://www1.ceit.es/asignaturas/ecologia/hipertexto/13Residu/150ResRadi.htm http://omega.ilce.edu.mx:3000/sites/ciencia/volumen1/ciencia2/42/htm/sec_12.html Fusión nuclear De igual manera, la gráfica de la página 4, en la que se representa la energía de enlace por nucleón, pone de manifiesto que la energía media de enlace por nucleón crece a medida que aumenta el número másico. Si conseguimos acercar dos núcleos ligeros la suficiente para vencer las fuerzas de repulsión, se fusionarán formando un núcleo de menor masa que la suma de las masas de los núcleos que se han fusionado. Esta diferencia de masa se manifiesta mediante la liberación de una cantidad equivalente de energía. A estos procesos se les denomina fusión nuclear, que se caracterizan por la gran cantidad de energía que liberan. Así por ejemplo, un posible proceso de fusión es: 2 1 H 13H 24He 01n en el que se liberan 17,7 MeV de energía. 1 4 0 A.18 Calcula la energía que se libera en el proceso de fusión: 41 H 2 He 2 1 e (Sol: 26,3 MeV) DATOS: masas (mHe=4,002603 u; mH=1,007825 u; me=0,0005485 u); 1u=1,66x10-27 kg 6 La realización de procesos de fusión nuclear, de manera artificial encierra grandes dificultades técnicas pues para que se inicie el proceso son necesarias temperaturas del orden de 100 millones de ºC, lo cual no es fácil. Desde los años 50 del siglo XX se han conseguido estos procesos de fusión de manera incontrolada en las explosiones termonucleares de las llamadas bombas de hidrógeno. En la actualidad se trabaja en distintas líneas para resolver estos problemas técnicos y poder utilizar la fusión nuclear de manera controlada para la obtención de energía ya que tiene notables ventajas sobre la fisión nuclear, pues es radiactivamente más limpia y los núcleos fusionables son más abundantes y fáciles de obtener. http://www.arrakis.es/~lallave/nuclear/fusion.htm http://home.earthlink.net/~umuri/_/Main/T_particulas2.html http://www.noticias.com/articulo/30-06-2005/emil-domec/fusin-nuclear-energia-sustitutiva-sol-que-movera-al-mundo4j68.html http://www.sagan-gea.org/hojared_radiacion/paginas/Fusion.html http://thales.cica.es/rd/Recursos/rd99/ed99-0226-01/capitulo5b.html http://www.invap.net/nuclear/plant_radio/intro.html 5 6 El uranio natural contiene un 0,7% del isótopo U-235, el resto es del isótopo U-238 que no es fisionable. De manera natural, la fusión nuclear se da en el Sol y las estrellas. 9 AYUDAS PARA LA RESOLUCIÓN DE LOS EJERCICIOS DEL TEXTO Lee atentamente el ejercicio y piensa que está relacionado con los párrafos anteriores. Piensa que en los casos más sencillos resolverás el ejercicio aplicando alguna idea o ecuación del párrafo anterior. Si tienes dificultad con el planteamiento físico del ejercicio, consulta la ayuda correspondiente. Si no consigues resolver el ejercicio, plantéale al Profesor tus dificultades el próximo día (no al cabo de una semana o de un mes) A.1 NÚCLIDO NUCLEONES PROTONES( 1 H ) NEUTRONES( 0 n ) H 3 1 2 C 12 6 6 Co 60 27 33 137 55 82 NUCLEONES PROTONES( 1 H ) NEUTRONES( 0 n ) Fe 55 26 29 Cu 60 29 31 3 1 12 6 60 27 137 55 Cs 1 1 A.2 NÚCLIDO 55 26 60 29 1 1 60 28 Ni 60 28 32 56 26 Fe 56 26 30 61 30 Zn 61 30 29 Co 60 27 33 60 27 A.3 Partícula Electrón Protón Neutrón Masa (kg) 9,1x10-31 1,67x10-27 1,675x10-27 Masa (u) 0,00055 1,00783 1,00904 A.4 Para calcular el radio aplica: r r0 3 A donde r0=1,2x10- 15 m. Para calcular el volumen supón que el núcleo tiene forma de esfera (busca el volumen de una esfera); finalmente recuerda que la densidad es d=m/V. 17 13 A.5 2,3x10 /22,5= 1x10 Es decir, la densidad de un núcleo es del orden de 10.000.000.000.000 veces mayor que el material más denso. A.6 Recuerda que la interacción gravitatoria de Fg=Gmpmp/r2 ; la interacción eléctrica Fe=KQpQp/r2 . Despreciando la interacción gravitatoria respecto de la eléctrica a=Fe/mp ; finalmente Ep= KQpQp/r A.7 Aplica E=c2 Δm =(3x108)2 (1,66x10-27) y ponlo en eV y después en MeV. A.8 Δm= Suma de la masa de los nucleones – masa del núcleo formado= 11(1,00783 u)+12(1,000904 u) - 22,9898 u= 0,20481 u. Luego aplica E=c2 Δm y exprésalo en eV; finalmente E/A te dará la energía por nucleon. Para c) recuerda de química que la masa atómica del Na es 23 y que significa que 23 g/mol, luego 1 g serán 1/23= 0,0435 mol de núcleos de Na y como cada mol tiene 6,023x1023 núcleos pues en total tendremos que disociar 0,0435 23 x 6,023x10 núcleos y como antes hemos calculado la energía de formación de un núcleo; entonces: 23 -11 11 0,0435 x 6,023x10 x 3,1x10 = 8,1x10 J 10 A.9 Que se reduce un 15% en 1,54 días significa que al cabo de 1,54 días quedan (N) el 85% de los que había N t con los datos Ln0,85 1,54 24 3600 de inicialmente (N0) luego N/N0=0,85; aplicando Ln N0 donde deducimos . Para b) aplicamos T A.10 La actividad de una muestra es calcular aplicamos T Ln2 1 y para c) aplicamos dN dN 0 para la actividad inicial que sabemos que es N 0 para dt dt Ln2 N t de donde En b) queremos saber cuantos núcleos N que quedan al cabo de 100 años; aplicamos Ln N0 12 deducimos N. Para c) los núcleos desintegrados en 100 años serán los que había 10 menos los que hay al cabo de 100 años y que has calculado en el apartado anterior. -3 -3 A.11 Para a) 1 g de núcleos de Radio son 1/226= 4,42x10 mol de núcleos de radio, donde habrá 4,42x10 x 6,023x1023 = 2,7x1021 núcleos de Radio que tiene una actividad de 1Ci lo que equivale a 3,7x1010 desintegraciones/s y ahora aplicamos dN 0 1 Ln2 N 0 para calcular . Para b) aplicamos y para c) T dt A.12 Ese cuenco de calabaza en algún momento fue una planta viva cuya actividad del carbono-14 era dN 0 dN N 0 0,27 y actualmente sabemos que la actividad del carbono-14 es N 0,20 dt dt N Ln2 0,741 ; por otra parte aplicando T podemos deducir N0 combinando ambas expresiones resulta que N para finalmente aplicar Ln t de donde podemos deducir t. N0 A.13 Aplicaremos la conservación de los nucleones A y la conservación de la carga Z: 218 84 4 Po 214 82 X 2 He 210 82 4 X 206 80 Hg 2 He A.14 Igual que A.13 45 20 45 Ca 10 e 21 X ; 239 93 0 Np 239 92 U 1 e ; 137 55 0 Cs137 56 Ba 1 e ; 14 8 O 147N 01e A.15 Igual que A.13 y A.14 40 18 Ar 24He11H 1943X 11 5 B 24X 11H 146C 7 3 Li 11H 47Be 01n A.16 Es un proceso nuclear en el que E=c2 Δm; para este proceso Δm=(mO+mH)-(mN+mHe)=1,279x10-3 u. Como podrás observar hay un aumento de masa que necesita su equivalente cantidad de energía que normalmente es aportada por el núcleo de Helio. A.17 Primero calculamos la energía asociada al proceso de fisión de un núcleo de U-235 según la ecuación dada: 235 92 92 1 U 01n 36 Kr 141 56 Ba 30 n 2 23 Con la expresión E=c Δm. Pero en 1 g de U-235 hay (1/235)x6,023x10 núcleos de U-235. A.18 Aplicamos E=c2 Δm. EJERCICIOS PROPUESTOS EN LAS PRUEBAS DE ACCESO +25 14 1) Átomos de nitrógeno 7 N atmosférico pueden chocar con un neutrón para transformarse en por emisión, se convierte de nuevo en nitrógeno. 1.a) Escribe las correspondientes ecuaciones nucleares. 14 6 C . A su vez, éste, 11 1.b) Los restos de animales recientes contienen mayor proporción de qué se debe este hecho y qué aplicación tiene? 14 6 C que los restos de animales antiguos. ¿A 2.a) Defina el concepto de isótopo. 2.b) Explique porqué el peso atómico de un elemento expresado en unidades de masa atómica no suele ser un número entero. 3) Defina los siguientes conceptos: a) nucleones; b) número atómico; c) número másico; d) núclido; e) isótopo. 4) Una sustancia radiactiva, cuya masa inicial m0, posee al cabo de t segundos una masa m m0 e 4.a) Calcule el periodo de semidesintegración. 4.b) Calcule el valor de m/m0 al cabo de 10 minutos. 0, 02t . 5) El carbono 14 tiene un período de semidesintegración de 5730 años. 5.a) Calcule su constante de desintegración radiactiva. 5.b) En una mesa de madera se ha desintegrado el 30% del carbono14 que tenía cuando se fabricó. Estime la edad de la mesa. 6.a) Enuncie la ley de desintegración radiactiva explicando el significado de cada uno de los términos que aparecen en la misma. -7 6.b) Se disponen de 0,2 kg de una muestra radiactiva cuya constante de desintegración vale λ=10 1/s . Calcule el tiempo que tiene que transcurrir para que la muestra final sea de 0,05 kg. 7.a) Indique en qué consisten la fisión y la fusión nucleares. 7.b) Explique los conceptos de energía de ligadura, defecto de masa nuclear y de energía media de enlace por nucleón. 8.a) Escribir la ley de desintegración radiactiva, explicando el significado de cada uno de sus términos. 51 8.b) Si tenemos 5x1023 átomos del isótopo Cr cuyo periodo de semidesintegración es 27 días, calcule los átomos que quedaran después de 5 meses. 9.a) Radiactividad natural: Explique el concepto, los tipos, y la naturaleza de las radiaciones emitidas. 9.b) Los núcleos de cierto isótopo radiactivo emiten radiación alfa con un período de semidesintegración de cuatro horas. Una muestra de ese isótopo contiene inicialmente 8,5x1016 átomos. Calcule la velocidad inicial de desintegración y el tiempo que tiene que transcurrir para que la muestra radiactiva se reduzca a la décima parte de la inicial. 10.a) Escribir la ley de desintegración radiactiva, explicando el significado de cada uno de sus términos. Indica también a qué se llama la actividad radiactiva. 10.b) Se dispone en un laboratorio de 5x1015 núcleos para hacer un experimento de desintegración radiactiva. Treinta 14 días después solamente se tienen 4,7x10 núcleos, indíquese el período de semidesintegración en días. 11.a) Escribir la ley de desintegración radiactiva, explicando el significado de cada uno de sus términos. Indica también a qué se llama la actividad radiactiva. b) La constante de desintegración radiactiva de una sustancia vale λ=10-6 1/s. Se dispone inicialmente de 100 g de dicha sustancia. Calcule el tiempo necesario para que la cantidad de sustancia sea 20 g. 12.a) Indique en qué consisten la fisión y la fusión nucleares. 12.b) Explique los conceptos de energía de ligadura, defecto de masa nuclear y de energía media de enlace por nucleón. 13.a) Indique en qué consiste la radiactividad natural. 207 13.b) Los núcleos de 84 Po emiten radiación alfa con un período de semidesintegración de 2,80 h. Escriba la ecuación nuclear del proceso de emisión y calcule el tiempo que debe transcurrir para que una muestra que contiene ese isótopo radiactivo pierda el 75% del mismo por desintegración radiactiva. 12