efecto de inoculacion con bacterias promotoras de desarrollo
Anuncio

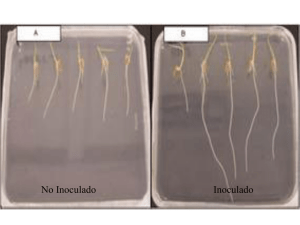
UNIVERSIDAD VERACRUZANA FACULTAD DE CIENCIAS AGRICOLAS “ INOCULACIÓN CON BACTERIAS PROMOTORAS DE CRECIMIENTO EN CUATRO ESPECIES LEÑOSAS DE SELVA BAJA CADUCIFOLIA TRABAJO “ TRABAJO DE EXPERIENCIA RECEPCIONAL INGENIERO AGRÓNOMO PRESENTA FRANCISCO DAVID LÓPEZ CEBALLOS XALAPA, ENRIQUEZ, VER. 2011 DICIEMBRE INDICE I. INTRODUCCION....................................................................................................1 II. HIPOTESIS ..............................................................................................................2 III. OBJETIVOS ...........................................................................................................2 3.1.1. OBJETIVOS GENERAL .......................................................................................2 3.1.2. OBJETIVO PARTICULAR .......................................................................................2 IV. ANTECEDENTES. ................................................................. 3 V. REVISION DE LITERATURA. .................................................. 5 5.1.1. BACTERIAS PROMOTORAS DE CRECIMIENTO VEGETAL (BPCV) ....................5 5.1.2. EL GÉNERO PSEUDOMONAS ...............................................................................6 5.1.3. ZONA DE INFLUENCIA..........................................................................................7 5.1.4. BACTERIAS PROMOTORAS DEL DESARROLLO VEGETAL (PGPR) .................8 5.1.5. MECANISMOS ACCIÓN DIRECTA .........................................................................9 5.1.6. MECANISMOS DE ACCIÓN INDIRECTA (PGPR) .............................................. 10 VI. METODOLOGIA. .................................................................. 12 6.1.1 SITIO DE COLECTA. ............................................................................................ 12 6.1.2 MATERIAL COLECTADO Y GERMINACIÓN. ....................................................... 12 6.1.3 UBICACIÓN DEL VIVERO RUSTICO.................................................................... 12 6.1.4 PROCEDENCIA Y CARACTERIZACIÓN BIOQUÍMICA DE RIZOBACTERIAS. .... 12 6.1.5 INOCULACIÓN Y CRECIMIENTO ......................................................................... 13 6.1.6 ACONDICIONAMIENTO DEL VIVERO RUSTICO. ................................................ 13 6.1.7 DISEÑO EXPERIMENTAL..................................................................................... 13 6.1.8 MATERIALES ........................................................................................................ 14 6.1.9 VARIABLE DE RESPUESTA. ................................................................................ 14 6.10 ANÁLISIS ESTADÍSTICO ....................................................................................... 14 VII. RESULTADOS Y DISCUSIÓN .............................................. 15 VIII. CONCLUSION .................................................................... 20 IX. RECOMENDACIONES .......................................................... 20 X. LITERATURA CITADA ........................................................... 21 XI. ANEXOS ............................................................................. 27 RESUMEN La remoción de la cobertura vegetal por el cambio de uso del suelo en la zona tropical subsúmedo del centro de Veracruz, provoca serios problemas ambientales como; el aumento de la escorrentía, la erosión, el agotamiento de mantos acuíferos, lo cual favorece las inundaciones estacionales. El establecimiento de especies para restauración de la selva baja de la región se dificulta por lo extremo de las condiciones físicas prevalecientes: sequía estacional, suelos compactos con escasa materia orgánica y pendientes pronunciadas, entre las principales. Es importante resaltar que existen, bacterias que se encuentran en el suelo o la rizosfera que se pueden aislar e inocular en cultivares o en plantas de interés comercial para poder obtener un efecto positivo, Hay diferentes géneros de bacterias que han sido utilizados dentro de la biotecnología, con el objetivo de beneficiar una mejor producción. (Hernadez-Rodriguez, et al, 2006). Con el fin de mejorar el desarrollo de plántulas de cuatro especies se evaluó el efecto de inoculación con rizobacterias promotoras del crecimiento (PGPR) aplicándoles baño de raíces por un tiempo de 30 minutos: Las especies elegidas fueron plántulas forestales de dos meses de edad: Acacia macracantha, Acacia farnesiana, Luehea candida y Guazuma ulmifolia. Las especies de rizobacterias utilizadas fueron Pseudomonas flourescens y P. putida, cepas FCA 8, FCA 56 y FCA 60 (concentración: 1x108 células bacterianas por ml). Sólo dos especies (Acacia macracantha y A. farnesiana) mostraron evidencia del efecto de la inoculación para la variable altura. El diseño experimental: fue totalmente aleatorizado con 5 tratamientos, (cada uno por separado mezcladas y testigo) con 3 repeticiones de 5 individuos. Las variables registradas fueron la altura al inicio (incluida en el diseño como covariable) y a los 6 meses. Se aplico ANCOVA, se compararon medias mediante Fisher LSD, luego de corroborar supuestos de normalidad y homocedasticidad según (Zar, 1996) Palabras calve: restauración, propagación, supervivencia, Pseudomonas, crecimiento ABSTRACT The removal of vegetation cover by land use change in tropical subhumid central Veracruz, causes serious environmental problems such as, the increased runoff, erosion, groundwater depletion, which favors seasonal flooding. The establishment of species for restoration of lowland region is hampered by the extreme physical conditions prevailing, seasonal drought, compacted soils with low organic matter and steep slopes. The main. Importantly, there, bacteria found in soil or the rhizosphere that can isolate and inoculate plants or cultivars of commercial interest to obtain a positive effect There are different kinds of bacteria that have been used in biotechnology, in order to benefit a better production. (Hernandez-Rodriguez, et al, 2006). In order to improve the development of seedlings of four species evaluated the effect of inoculation with growth promoting rhizobacteria (PGPR) roots bath applying a time of 30 minutes: : The species chosen were forest seedlings two months: macracantha Acacia, Acacia farnesiana, candida and Guazuma Luehea ulmifolia. The species used were Pseudomonas rhizobacteria and P. flourescens putida strains, FCA 8, FCA 56, FCA 60 (concentration: 1x108 bacterial cells per ml). Only two species (Acacia farnesiana and A. macracantha) showed evidence of the effect of inoculation for the variable height. Experimental design: it was completely randomized with 5 treatments (each separately mixed and control) with 3 replicates of 5 individuals. The variables recorded were high at baseline (included in the design as a covariate) and at 6 months. ANCOVA was applied were compared using Fisher LSD mean, after corroborating assumptions of normality and homoscedasticity by (Zar, 1996) Key Words: restoration, propagation, survival, Pseudomonas, growth DEDICATORIAS A MI MADRE: Gracias a mi madre que con tanto amor y cariño me tuvo sin importar lo adverso de la vida, le agradezco que haya creído y puesto su fe en mi, gracias a ti madre pude realizar una de mis metas más importantes de mi vida. EN MEMORIA DE MI MADRE ERNESTINA CEBALLOS ESCOBEDO 1939-2009. A MIS HERMANOS: A mis carnales y amigos de juego, porque compartí mucho con ellos a pesar de la diferencia de edades siempre estuvieron ahí: Aldito, Tavito, Fili, Marcita, Carito. A MIS AMIGOS: Julio e Iván Camarillo, La Changa, Pepe Villa, Paco Parada, Túpac, Jair, Liz Salazar, Moraima Argelia, Tzinzin, Fisher, Aldo, Martin Mota, El Güero (Isauro), Yoda, el zurdo de la ejidal, AGRADECIMIENTOS A la Dra. Ana Isabel Suárez Guerrero A Dra. María de Jesús Hernández A M.C Tomás F. Carmona Valdovinos A Dr. Roberto Gregorio Chiquito A M.C. Guillermo Rodríguez Rivas A M.C. José Luis Martínez Rodríguez I. INTRODUCCION. La alteración y destrucción de los ecosistemas se debe principalmente a las actividades del ser humano sobre la vegetación natural. Las actividades desarrolladas por el hombre en la agricultura moderna, han hecho desaparecer y modificar grandes extensiones de bosque directa e indirectamente, sin embargo el hombre no es la única causa de la destrucción de estos ecosistemas. Aquí presentamos algunas de las principales causas desencadenadas por el mismo, las cuales son: desmonte, sobrepastoreo, tala inmoderada, incendios, explotación desmedida de algunas especies útiles, erosión genética, entre otras. Actualmente existe dentro de la agricultura el interés por técnicas, estrategias que no deterioren el medio ambiente, que puedan y permitan incrementar la producción en algunos cultivos, como hortalizas y especies forestales. Tal es el caso del uso de biofertilizantes como las rizobacterias. Estas pueden promover el crecimiento en cultivos a través de su metabolismo sin perturbar el mecanismo de la planta, en la que se encuentra una relación entre la raíz y las bacterias del suelo por lo tanto hacen que la dinámica dentro del suelo, se refleje en el buen desarrollo de la misma en muchas circunstancias. Estudios como los de Sánchez y Chontal (2010) y Orozco-Jaramillo y Martínez-Nieto, (2009), el primero con inoculación dual en Cucumis sativus y el segundo en pinus patula; son de los más representativos, han arrojado buenos resultados. Esta alternativa con relación en otras técnicas de fertilización química, pueden favorecer la nutrición de las plantas y consecuentemente, regeneran suelo a largo plazo, sin deteriorar el medio ambiente, mientras la planta se desarrolla rápidamente pasando de plántula a estado adulto. El metabolismo de la bacteria actúa; fijando nitrógeno, y hace que la disponibilidad de nutrimentos esté al alcance de la planta, también tiene cualidades supresoras de patógenos, dado que producen antibióticos de manera natural o compiten por los nutrimentos, dejando al límite a otras bacterias que son patógenas para varios cultivos. Existen alternativas que no contaminan y que se utilizan de manera biológica, como la biofertilización y el uso de microrganismos como: hongos, bacterias y algas que, dentro del contexto agrícola, han tenido éxito (Álvarez y Ferrera-Cerrato, 1994). Cuervo (1997) comenta que al ser incorporados al agro-ecosistema estas rizobacterias, tienen posibilidades de que el rendimiento de algunas plantas y cultivares aumente, pues al mismo tiempo aportan elementos minerales para la fertilidad en el suelo. En las aplicaciones de bacterias se hará referencia en especial a dos especies: Pseudomonas flourescens y P. putida, estos inóculos o (cepas) fueron aplicados a especies forestales del bosque caducifolio tropical como: Acacia macracantha, Acacia farnesiana, Luehea candida y Guazuma ulmifolia. Que son de importancia para la zona de Cerro Gordo, municipio de Emiliano Zapata, Ver., de donde fueron colectadas las semillas. 1 II. HIPOTESIS. La inoculación de plántulas con bacterias promotoras de crecimiento aumentará su crecimiento en altura. III. OBJETIVOS. 3.1 Objetivo general. Determinar el efecto en el desarrollo de la inoculación de las cepas P. flourescens y P. putida en las especies: Acacia macracantha, Acacia farnesiana, Luehea candida y Guazuma ulmifolia de la selva baja caducifolia de Veracruz central. 3.1.1. Objetivo particular. Evaluar el efecto de inoculación en altura de plántulas foréstales de selva baja. 2 IV. ANTECEDENTES. El uso de agrotóxicos ha crecido grandemente en la producción de sustancias químicas, los productos químicos en la agricultura y la ganadería actual constituyen una amenaza para nuestra salud y la del ecosistema. Es así como el exceso desmedido de insecticidas, herbicidas, nematicidas y fertilizantes químicos han tenido efectos negativos en el medio ambiente como la perdida de fertilidad del suelo, problemas de salud humana, asociado con el crecimiento demográfico, los cuales requieren mayores cantidades de alimento (chiquito, 2002) En la actualidad los agricultores usan el suelo como un medio para sostener las plantas, y fertilizarlas químicamente. Esto ha ocasionado alteraciones ecológicas gravísimas debido a la aplicación repetida de fertilizantes químicos, que matan microbios esenciales, necesarios para un suelo ecológicamente saludable. Esto es, que las plantas ya no son capaces de obtener los nutrientes de estos suelos inertes, por lo tanto, se hacen dependientes de los fertilizantes químicos para poder levantar cosechas productivas. Es así, que desde hace 20 años, hasta nuestro tiempo, hayan surgido, nuevas técnicas y prácticas de fertilización en el campo de la agricultura, como la biofertilización. La biofertilización ha tenido diferentes resultados en cultivos, los cuales responden de manera distinta. En la actualidad, con el desarrollo de la tecnología, se han hecho diferentes experimentos cuadro 1 en inoculaciones con bacterias PGPR, que han dado un resultado satisfactorio. El género Pseudomonas es un vasto grupo de bacterias que pueden ser fácilmente ubicadas en el medio ambiente suelo y agua, la gran diversidad ecológica de estas, refleja una gran variedad de requerimientos nutricionales, por lo tanto, tienen la cualidad para metabolizar un amplio abanico de compuestos orgánicos, los cuales permiten el fácil establecimiento de diferentes cultivos, aumentando el éxito en hortalizas. En su mayoría, cuentan con características que les permite la efectiva colonización de la rizosfera, Causando dominio supresor sobre otros microorganismos.1 En últimos 10 años, en especial el género Pseudomonas, ha capturado la atención por su habilidad de establecer por largo tiempo tamaños grandes de poblaciones rizosféricas en los sistemas radicales, ejerciendo efectos benéficos en el desarrollo de las plantas a través de varios de los mecanismos antes mencionados. Según Lemnaceau (2001) en la actualidad muchas de las diferentes bacterias en género y especie son estudiadas como PGPR, entre las cuales están, Azotobacter, Pseudomonas, Azospirillum, Acetobacter y Bacillus, Se considera que la inoculación con estas bacterias podría disminuir el empleo de los agroquímicos que se emplean en la producción de cultivos a gran escala. 1 Consultado en: http://www.rizobacter.com.ar/pgpr-biofertilizantes.html# el 2 de enero de 2012 3 Cuadro 1. Inoculaciones efectivas en variables de crecimiento de varios cultivos. INOCULACION EFECTIVA EN VARIOS CULTIVARES Cultivo Bacterias Anacardium excelsum Bacillus licheniformis Pseudomonas fluorescens Pseudomonas putida Gmelina arborea Azospirillum brasilense Hongos Parámetro Autor Germinación y crecimiento Barreto y Valero 2007 Glomus sp. Germinación y crecimiento Zambrano y Díaz 2008 Pseudomonas sp. Bacillus macerans Enterobacter agglomerans Azotobacter chroococcum Coffea arabica Azospirillum brasilense Suillus luteus Orozco-Jaramillo y Martínez-Nieto 2009 Glomus sp. Número de hojas, diámetro del tallo y biomasa Aguirre-Medina Moroyoqui-Ovill 2011 Cucumis sativus Pseudomonas putida HMA Crecimiento Sánchez y Chontal 2010 Lycopersicon esculentum Pseudomonas putida Rendimiento y altura Fernández Tlapa y Martínez Velazco 2010 Capsicum sp. Bacillus sp. Pseudomonas putida Altura Hernández 2010 Cucumis sativus Pseudomonas putida Pseudomonas fluorescens Altura y rendimiento fruto Bautista Melchor 2010 Pinus patula Altura, peso seco, contenido N suelo y foliar 4 V. REVISION DE LITERATURA. 51.1. Bacterias Promotoras de Crecimiento Vegetal (BPCV). La contaminación por la aplicación de fertilizantes químicos, han causado una gran retención de metales pesados en suelos y mantos freáticos, Cabe mencionar que Álvarez y Ferrera-Cerrato (1994) proponen otras alternativas como la biofertilización y el uso de microorganismos como: hongos, bacterias y algas que dentro del panorama agrícola, han tenido éxito y no contaminan. El uso irracional de los fertilizantes y plaguicidas ocasionan graves daños al ambiente y provocan una fuerte resistencia de los patógenos hacia los mismos, lo que ocasiona utilizar fuertes concentraciones de agroquímicos para eliminar ciertas plagas. Los resultados son contaminación que se presenta con efectos residuales, lo que provoca un desequilibrio en el ecosistema. Compagnoni (1997) dice que el hombre en su afán de desarrollo tecnológico sano, ha aplicado métodos microbiológicos para estudiar ciertos microorganismos y utilizarlos posteriormente bajo el nombre de biofertilizantes en las prácticas agrícolas. Sin embargo, hay bacterias que habitan dentro del suelo y que pueden ser benéficas para las plantas; suelen denominarse de vida libre, y llamadas por sus siglas en ingles PGPR (plant growth promoting rhizobacteria) (Kloepper 1989). Se les denomina por algunos autores como YIB (por sus siglas en inglés (yield increasing bacteria). Estas bacterias aumentan el rendimiento (Piao 1992; Tang 1994). Las rizobacterias (PGPR) según (Schipper et al., 1987). Pueden tener la capacidad específica de incrementar el crecimiento y desarrollo temprano de algunos vegetales, con ciertas capacidades especiales para formar agregados de suelo, fijar el nitrógeno, suprimir actividades patógenas y promover la disposición y absorción de nutrimentos minerales. Son varias las especies de bacterias que pueden incrementar el crecimiento y la productividad vegetal. Estas bacterias estimulan el crecimiento vigoroso del sistema radicular y la germinación de plántulas y/o la recuperación de raíces dañadas. Actúan como biofertilizantes microbianos por el contenido en bacterias fijadoras de nitrógeno y solubilizadoras de fósforo, éstas liberan o fijan elementos nutritivos que están presentes en el suelo, que las plantas no pueden aprovechar (Álvarez y FerreraCerrato, 1994). La inoculación con bacterias promotoras del desarrollo vegetal (PGPR) en una especie forestal puede ser importante para la reforestación y el pago por servicios ambientales, pues tal modalidad ofrece mantenimiento al bosque dándole manejo integrado de recursos. Sin embargo, la etapa más vulnerable del ciclo de vida de las plantas es la germinación, el momento entre ésta y el establecimiento. En esta fase el nuevo individuo contenido en la semilla cuenta con reservas limitadas únicamente para superar la latencia e iniciar su desarrollo independiente (Harper 1977) En el caso de leñosas nativas, adaptadas a sequía y suelos pobres en materia orgánica, la asociación con BPDV puede ser beneficiosa, sin embargo, la siembra en 5 suelos ricos puede permitir la absorción directa de nutrimentos y agua por las raíces, ya que la asociación con bacterias puede reducir el desempeño de las plantas, o finalmente no las afecta (Sánchez y Lozano Chontal 2010). 5.1.2. El Género Pseudomonas. Entre de las PGPR con mejor resultado y con reportes positivos están las del genero Pseudomonas (Ranvskov et al., 1999) que impone biocontrol contra fitopatógenos (Kloepper et al., 1988) (Farias-Rodriguez et al., 1997) y promueve el crecimiento Cesar y Burr (1987) y Díaz-Vargas (1998) Las características generales de las Pseudomonas son, según Caballero-Ramírez (1988, citado por Cerdán, 2004), Gram negativas; autores como Leisingeir y Margraff (1979), comentan que tienen forma de varillas o ligeramente curvadas, y estrictamente aeróbicas únicamente a excepción de las que desnitrifican, flagelos mono-multitrico, raramente no movible, metabolismo fermentativo negativo, catalasas positivas, la mayoría oxidasa positiva, algunos patógenos de plantas son oxidasas. Las bacterias que pertenecen al grupo de las fluorescentes como Pseudomonas flourescens y Pseudomonas putida, pueden colonizar ampliamente en diferentes cultivares y se les considera antagonistas de varios patógenos que se encuentran en el suelo, como Fusarium, Phytophora, Rhizotocnia y Sclerotium (Durkhead et al., 1995). Pseudomonas putida. Esta bacteria sintetiza la enzima 1-aminociclopropano-1-carboxilato desaminasa (ACC) (Jacobson, 1993; Jacobson et al., 1994). Esta enzima hidroliza el ACC, precursor inmediato de la biosíntesis del etileno en plantas, lo hidroliza a nivel atmosférico, provocando una disminución en la concentración ACC en plantas que se traduce en una elongación radicular. Además, el etileno estimula la germinación, rompe la dormancia de las semillas. También actúa sinérgicamente con otros microorganismos como bacterias fijadoras simbióticas (De Freitas et al., 1993). Pseudomonas fluorescens. Esta bacteria tiene la capacidad de disminuir la acción de fitopatogenos a través de la producción de sideroforos y antibióticos. Clark (1989) menciona que se pueden emplear en gran variedad de sustratos en su metabolismo carbonado. Al respecto (De Felipe, s/f) menciona que las Pseudomonas f. son rizobacterias promotoras de crecimiento vegetal, con un amplio efecto en la fisiología de la planta. Una de sus cualidades más importantes después de incrementar el rendimiento de las plantas, es el de no permitir el paso de numerosos patógenos de diferentes cultivares, lo cual se le atribuye a la gran producción de metabolitos con personalidad antimicrobiana, los mecanismos a los que hacemos referencia son; competencia nutricional que se le atribuye a la producción de sideroforos, que secuestran el hierro (Fe), ya que su sólo mecanismo de atrapar el hierro es la causa de que otros 6 microorganismos patógenos, no puedan obtenerlo de manera fácil, construyéndose en un mecanismo de biocontrol en el contexto de la rizosfera. 5.1.3. Zona de Influencia. Rizosfera La región del suelo en los alrededores de la raíz, constituyen un sistema ecológico complejo llamado rizosfera, que es la porción de suelo que se encuentra influenciada por las raíces, en la cual microrganismos, especialmente hongos y bacterias tienen actividades macrobióticas y está caracterizada por una relación compleja entre minerales, gases, líquidos y, por último, materia orgánica, todo esto resultado de la presencia de células vivas y muertas (Linderman, 1988). En función del sustrato en que sobreviven se han distinguido dos grupos: 1) fijadores de nitrógeno que mineralizan restos orgánicos y 2) los que antagonizan acciones patógenas (González y Ferrera-Cerrato, 1995). Al respecto surge otra propuesta conforme a la clasificación hecha por Basham y Holguín (1998), y se denominan PGPB (biocontrol-plant growth promoting), bacterias promotoras del crecimiento vegetal, con actividad de biocontrol. Esta clasificación está descrita para las bacterias que tienen la cualidad para antagonizar fitopatogenos a través de la producción de metabolitos que suprimen e inducen en la planta una resistencia natural. Katpulnick (1991) muestra que en su mayoría son benéficas las BPDV para ciertos cultivos. Cuervo y Rivas (1997) Indican que algunos organismos son simbióticos, o saprofitos de vida libre, y que estas bacterias cuentan con actividades metabólicas pueden ser físicas o químicas, y hacen que algunos elementos dentro del suelo estén asimilables para las plantas (disposición de nutrimentos minerales). Estos también ejercen una capacidad de solubilizar fosfatos, fijan nitrógeno, y con dichas actividades promueven el crecimiento en las plantas (Azcón-Aguilar y Barea, 1991). Los exudados radiculares excretados por las raíces de las plantas tendrán una alta cantidad de carbono orgánico Katpulnick y Okón (1986) y Brown (1997), citado por Villareal-Romero, 1990) y se dividen, en 5 tipos de compuestos (Cenil, 2001): Exudados.- Compuestos de bajo peso molecular (Garbaye, 1994), solubles generalmente en agua, liberados por las células hacia espacios intercelulares y posteriormente al suelo. Son azúcares aminoácidos, y ácidos orgánicos (Brown, 1974), hormonas de crecimiento y vitaminas (Johnson y Curl, 1972; Garbaye, 1974). Secreciones.- Son compuestos de bajo peso molecular liberados como resultado de los procesos metabólicos (hidratos de carbono polimerizados, enzimas) Mucilagos vegetales.- Son originados en el ápice de la raíz (Curl y Truelove, 1986) y segregados por el aparato de Golgi o hidrolizados de polisacáridos de la pared primaria y de células del extremo de la raíz, segregados por pelos capilares o producidos por degradación de bacteriana de células epidérmicas muertas. 7 Mucigel.- Material gelatinoso de superficie de las raíces incluye a mucilagos vegetales; células bacterianas y sus productores metabólicos, cápsulas, capas mucosas, glicalix, así como coloides minerales y materia orgánica en el suelo. Lisados.- Son compuestos liberados por autolisis de las células epidérmicas; las paredes de estas células son dirigidas por estos microorganismos que liberan a la rizósfera los productos de la actividad microbiana. Dependiendo de las especies, edad y condiciones ambientales de las plantas, los exudados radicales pueden constituir hasta el 40% del peso seco de las plantas (Linch y Whippi, 1991). Sin embargo, diversos microorganismos, como hongos micorrizicos (Linderman (1991), Olson et al., (1996) y Toro et al., (1997) o bacterias del género Pseudomonas pueden alterar la composición y presencia de exudados radicales (Kerry, 2000). Según Schipper et al., (1997) (citado por Zenil, 2001). La influencia que los microorganismos de la rizosfera pueden causar en las plantas, puede resumirse en: - Influencia neutra: No afecta el crecimiento - Influencia benéfica: Ya sea por aumento de la disponibilidad y toma de nutrimentos minerales, por la síntesis de sustancias promotoras del crecimiento o por la supresión de microorganismos deletéreos y patógenos. - Influencia deletérea: Puede afectar negativamente el crecimiento vegetal sin parasitar necesariamente al tejido, con alteraciones en el aporte de agua, iones y sustancias promotoras del crecimiento vegetal cambiando las funciones y/o limitando el crecimiento de las raíces. 5.1.4. Bacterias Promotoras del Desarrollo Vegetal (PGPR). Kloepper y Schroth (1978) menciona, que aquellas rizobacterias que habitan en la rizósfera, zona de influencia en la raíz, que en la mayoría de los casos, tienen acciones positivas sobre las plantas. Estos microorganismos mantienen una capacidad productiva del sistema, conservan la biodiversidad, hacen contribuciones con una producción estable y sostenida a largo plazo, manteniendo un equilibrio con el entorno, dado que constituyen una tecnología racional (Mesa et al., 1995). Las PGPR tienen la cualidad de producir sustancias que son fisiológicamente activas y que a través de su acción conjunta, estimulan germinación y desarrollo de los cultivos (Fendrik et al., 1995; Martínez et al., 1997). Hay características que se establecen y definen al grupo de las BPDV. No es indispensable que invadan tejidos internos de la raíz en las plantas, su población es muy elevada en la rizosfera, una vez que se han inoculado, tienen una efectiva capacidad de colonizar la superficie de raíz y, por lo tanto, pueden influir de manera 8 positiva en el desarrollo de la planta. Finalmente, no causa daño al hombre, ni a otros organismos (Jiménez, 2001). 5.1.5. Mecanismos Acción Directa. Sarabia Ochoa et al., (2010). Dice que es importante mencionar que la bacterias promotoras del crecimiento afectan de dos maneras diferentes a la planta: directamente, estas bacterias le proporcionan compuestos ya sintetizados por ella misma, produciendo beneficios para sí; el resultado de esto son compuestos importantes como: nitrógeno, hormonas (crecimiento) y otros nutrientes como el hierro y el fósforo que se originan naturalmente. Los mecanismos indirectos se describirán más adelante. Brown (1974). Señala que uno de las características más importantes de las PGPR es la producción de fitohormonas, por lo que las del género Pseudomonas se encuentran liberando acído indol-acetico, giberelinas y citocininas, en la parte de influencia que es la rizosfera. En ese sentido Lebuhn et al., (1994), mencionan que los efectos apreciables, ocurren cuando la planta está en etapa temprana. También las Pseudomonas muestran especial movilidad cuando son tomados de cultivos jóvenes. Estas pueden promover crecimiento de varias formas, ya sea directa, o indirectamente. Aunque no han sido caracterizados, hay efectos directos que pueden evidenciarse, por ausencia de otros microorganismos. Esto quiere decir que la planta solo interactúa con microorganismos en estudio, mientras que los indirectos solo se pueden observar con la interacción de microorganismos de interés fitopatogeno, los cuales reducen daños en las plantas (Díaz y Vargas et al., 2001; Thrane et al., 2000). Lo que mantiene a limite a las bacterias fitopatogenas en la rizosfera son las actividades bacterianas, ya que también colonizan la raíz, crecen en los exudados y los tejidos de las plantas, con los que están compitiendo de diferentes y variadas formas. Su estudio está más dirigido a la producción de sideroforos por lo tanto Kloepper (1993) menciona que los metabolitos tienen la cualidad de estimular el crecimiento vegetal. Existen bacterias que promueven directamente el crecimiento de plantas como Azospirillum, Enterobacter, Azotobacter, Beijirinckia, Derxia, Metanobacterium, Clostrodium y Desulfovibrio (Díaz-Vargas, 1988 y Díaz-Vargas et al., 2001) Serratia y Arthrobacter (Kloepper, 1993), Alcaligenes, Rhizubium y Agrobacterium (Osullivan y Ogara, 1992), Azoarcus, Zoogloea, Klebsiella y Bradyrhizobium (Kloepper et al., 1988a) Acetobacter, Herbaspirillum y Pseudomonas (Holguin et al., 1996). 9 5.1.6. Mecanismos de Acción Indirecta (PGPR). Desarrollo del control biológico. El termino control biológico se utilizo por primera vez en 1919, con el fin de usar enemigos naturales en el control de insectos que constituían plagas; la palabra control biológico es usado, solo para insectos entomopatogenos, hoy en día se conoce un sin número de diferentes microorganismos por la amplitud de estudios hechos, por lo cual; Burges y Hossey (1971) comentan que el término “Control Biológico” debe dividirse en dos conceptos: 1) Control macrobiológico y 2) Control microbiano patógenos (Alatorre, 1994). Los mecanismos indirectos; ocurren por metabolitos producidos por las bacterias promotoras de desarrollo vegetal (PGPR) que funcionan como determinantes antagónicos, que involucran aspectos de control biológico. Estos suprimen e inhiben el crecimiento de fitopatogenos perjudiciales para su desarrollo, esto es, a través de la producción de sideroforos (antibióticos) y la acción de enzimas líticas (glucanasas, quitanasas) que inducen un tipo de resistencia bajo cualquier mecanismo (Morales R., Valencia J., 2005). La producción de sideroforos por las rizobacterias está inclinada al control de fitopatogenos, lo cual plantea que las rizobacterias convierten el hierro en factores limitantes, ya que lo secuestran, inhibiendo de manera, que el crecimiento de fitopatogenos en la rizosfera sea casi nulo. (Schroth y Hancock, 1982 y Kloepper 1993) menciona que los metabolitos son capaces de estimular el crecimiento vegetal. Becker (1984) comenta que Pseudomonas fluorescens coloniza agresivamente la raíz, exudados y tejidos de la plantas, compitiendo así con hongos en diversas formas. Con estas propiedades de biocontrol producen componentes inhibitorios o metabolitos, tales como; sideroforos y metabolitos secundarios. Por sus propiedades antimicrobianas son consideradas por jugar un papel muy importante en la supresión de enfermedades. La PGPR se ubica mayoritariamente en los siguientes grupos (Holguin et al., 1996): Pseudomonas y Bacillus.- inhiben el crecimiento de microorganismos patógenos (Kloepper et al., 1988b; Kloepper et al., 1989), O’suulivan y O’gara, 1992; Posta et al., 1994; Ranvskov y Jakobsen., 1999; Fernández y Larrea, 2001). Por lo que el acido cianhídrico (HCN), juega un papel importante en el control biológico de patógenos (Schipper, 1988 citado por Kloepper, 1993). Este es producido por bacterias y, particularmente, por el género Pseudomonas (Baker y Schipper et al., 1998) y, junto con la producción de otros metabolitos, puede inhibir el crecimiento de las plantas, mejorarlas o inhibir el desarrollo de ciertas enfermedades, dependiendo de factores ambientales como: especies vegetales, prácticas culturales y factores edáficos (Schipper, 1991) Además de Pseudomonas hay otros géneros que se han reportado con capacidad de sintetizar HCN estos son: Chromobacterium (Leisingeir y Margraff, 1979) Alcaligenes y Bacillus (Kunz et al., 1998) 10 El antagonismo causado por el HCN es atribuido a que este metabolito inhibe la producción de ATP en los citrocromos de las células de los patógenos (Bakker y Schipper, 1987). Por lo tanto tenemos que La Glicina.- es precursor del HCN (Leisingeir y Margraff, 1979; Voisard et al., 1989) que ha sido encontrado en los exudados radicales. Dicha producción microbiana de HCN depende de la composición de los exudados radicales (Schipper et al., 1991), así como la intensidad solar, humedad del suelo, disponibilidad de iones férricos, (Askeland y Morrison, 1983, citado por Schipper, et al., 1991) y la concentración de fosfatos inorgánicos (Castric, 1975). Sideroforos.- El hierro (Fe) es el cuarto elemento con mayor presencia en la tierra, teniendo 2 estados de oxidación (Fe+3- Férrico / Fe+2 Ferroso). En presencia de O2 Fe+2 se oxida a Fe+3, Siendo esta una forma insoluble para el aprovechamiento de las plantas, (Stintzi et al., 2000). Crowley et al, (1991) señalan que el proceso de asimilación del hierro se da en una zona apical de las raíces, zona que esta frecuentemente muy poblada de bacterias; existen más de 1000 diferentes tipos de sideroforos, producidos por microrganismos, siendo las más comunes la pseudobactina, también llamada pioverdina (Leisingeir y Margraff, 1979; Curl y Truelove, 1986; Bar-ness et al., 1991, Guerinot, 1994). Existen diversos tipos de sideroforos, los cuales presentamos a continuación la Pseudobactina B (Andriollo et al., 1992), el ferricromo A, la agrobactina, ferrioxamina B (Bar-ness et al., 1992) y la piocelina (Crosa, 1989). En ese sentido, la habilidad para asimilar el hierro varía entre las diferentes cepas, especies, cultivos y variedades de microorganismos (Bianfait, 1988 citado por Benavides, 2000). Los iones de metales pesados como él Fe, Zn, Mn, y/o Cu no atraviesan literalmente la membrana celular; la forma de paso son los quelatos. Los quelatos sintetizados se llaman ionosforos. Emery (1982) comenta que a los ionosforos específicos para el hierro (Fe) se les llama sideroforos. Los sideroforos del griego (transportadores del hierro) son compuestos de bajo peso molecular, generalmente de menos de 1000 daltones (Guerinot, 1994) por el ion Fe+3, que tienen una alta afinidad (Dileep Kumar y Dube, 1992, Neilands, 1995). 11 VI. METODOLOGIA. 6.1.1 Sitio de colecta. La colecta de semilla se llevo a cabo a 2 km al este de Cerro Gordo, mpio. de Emiliano Zapata, Ver. y la Reformita., en relictos alterados de selva baja caducifolia, en los alrededores se practica la agricultura de temporal y la ganadería extensiva. 6.1.2 Material colectado y germinación. Se colectaron más de 500 semillas de cuatro especies y se germinaron en vivero rústico en sustrato de peat moss, agrolita y suelo común (1:1:2) en tubetes de 100 ml. Los ejemplares de respaldo colectados fueron depositados en el herbario XALU (Benítez Tejeda et al. 2009). 6.1.3 Ubicación del vivero rustico. El experimento fue realizado en el Vivero Universitario, el cual se encuentra ubicado, en la Unidad de Servicios Bibliotecario e Informática (USBI) (fig. 2). Figura 1. Ubicación del experimento en Xalapa, Ver. 6.1.4 Procedencia y caracterización bioquímica de rizobacterias. Las cepas bacterianas fueron aisladas de la rizosfera del portainjerto Citrus volkameriana de acuerdo a la técnica propuesta por Holguin et al. (1996). Tales cepas fueron: FCA-8, FCA-56 y FCA-60, proporcionadas por el Dr. Roberto Gregorio Chiquito del Laboratorio de Química de la Facultad de Ciencias Agrícolas de la Universidad Veracruzana. 12 Con la finalidad de establecer el género y especie de las cepas bacterianas, se llevó a cabo su caracterización bioquímica de acuerdo a las metodologías propuestas por Schaad et al. (2001) y Garrity et al. (2005), considerando las pruebas: fluorescencia, sacarosa, oxidasa, pudrición de papa, hipersensibilidad en tabaco, arginina, levana, crecimiento en medio YS 37°C, crecimiento en medio YS 4°C, gelatinasa, reducción de nitratos, pigmento no fluorescente verde, pigmento no fluorescente naranja, sorbitol, arabinosa, etanol y adonitol, de acuerdo a esta caracterización las cepas fueron identificadas como: FCA-8 Pseudomonas flourescens, FCA-56 Pseudomonas putida, FCA-60 Pseudomonas putida. 6.1.5 Inoculación y crecimiento. Las raíces de las plántulas forestales (Acacia macracantha, Acacia farnesiana, Luehea candida y Guazuma ulmifolia) de dos meses de edad, se sumergieron por 30 minutos en soluciones de inoculo (109 células por ml) de cada una de las cepas de rizobacterias (FCA 8, FCA 56 y FCA 60) la primera corresponde a Pseudomonas flourescens y las restantes a P. putida (Holguín et al., 1996; Schad et al., 2001; Chiquito, com. pers). Inmediatamente después fueron trasplantadas a envases plásticos (500 ml) con peat moss, agrolita y suelo común (1:1:2). Se midió la altura al inicio del experimento y a los 6 meses. Se mantuvo riego a capacidad de campo. 6.1.6 Acondicionamiento del vivero Rustico. Se efectuaron las siguientes actividades para el mismo: chapeo, delimitación, establecimiento y riego capacidad de campo. (figura 3-6) 6.1.7 Diseño Experimental. El diseño experimental fue totalmente aleatorio con 5 tratamientos (cada separado, mezcla y un testigo) con 3 repeticiones de 5 individuos. Las registradas fueron la altura al inicio (incluida en el diseño como covariable) meses. Se aplicó ANCOVA, se compararon medias mediante Fisher LSD, corroborar supuestos de normalidad y homocedasticidad (Zar, 1996). cepa por variables y a los 6 luego de 13 Cuadro No. 2 Clave de los tratamientos que se evaluaron en la investigación. Especie Bacteria Clave Acacia farnesiana, Acacia macracantha, Luehea candida y Guazuma ulmifolia Pseudomonas flourescens FCA-8 Pseudomonas putida FCA-56 Pseudomonas putida FCA-60 Coctel o Mezcla FCA-8, FCA-56, FCA-60 Testigo ******* 6.1.8 Materiales. Los materiales utilizados en este experimento fueron; una cámara fotográfica digital, una computadora, un machete, un flexometro. 6.1.9 Variable de respuesta. La única variable que se midió fue la altura inicial, que fue lo que nos permitió observar, el desarrollo de las plantas, se midió el día 17 de cada mes durante 6 meses, utilizando un flexometro (CM). 6.10 Análisis estadístico. El análisis estadístico de los datos se hizo con el programa de estatística v.7, modulo ANCOVA, con el objeto de evaluar los diferentes tratamientos en el desarrollo de la altura de las plántulas. 14 VII. RESULTADOS Y DISCUSIÓN Figura 2. Acacia farnesiana en medición al principio del mes y a los seis meses respectivamente. (17 julio-17 enero) Figura 3. Acacia macracantha medición al principio del mes y a los seis meses respectivamente. (17 julio-17 enero) 15 Figura 4. Guazuma ulmifolia medición al principio del mes y a los seis meses respectivamente. (17 julio-17 enero) Figura 5. Guazuma ulmifolia medición al principio del mes y a los seis meses respectivamente. (17 julio-17 enero) La respuesta de las especies a la inoculación fue diferente entre ellas. Acacia farnesiana y Acacia macacrantha durante el período de crecimiento respondieron de 16 manera distinta a Luehea candida y Guazuma ulmifolia, confirmando lo planteado por Schipper et al. (1987) de que sólo en algunas especies promueven crecimiento. Luehea y Guazuma no respondieron a los tratamientos. Se encontró evidencia de efecto de las inoculaciones en Acacia farnesiana, que se desarrolló más en una de las inoculaciones (fig. 2). A. macracantha, por el contrario, mostró un efecto negativo a la inoculación, ya que el testigo sobresalió como el mejor tratamiento. Lo anterior confirma lo señalado por Schipper et al. (1991), de que la inoculación puede tener una influencia deletérea (cuadro 3). Figura 6. Altura promedio de plántulas por tratamiento y por especie ± i. confianza. Cuadro 3. Efecto de los tratamientos en altura de los individuos por especie; a<b<c<d. ESPECIE FCA56 FCA8 FC60 TESTIGO MEZCLA ESTADISTICO Acacia farnesiana a b a a a F(4,69) = 5.53 Luehea candida a a a a a F(4,31) = 1.47 Guazuma ulmifolia a a a a a F(4,54) = 0.30 Acacia macracantha cd a bc d b F(4,68) = 8.04 En Acacia farnesiana los mejores resultados significativos se obtuvieron con FCA-O8 (P. flourescens), comprobando lo citado por los autores Burr (1987) y Díaz Vargas (1998) de que éstas promueven el crecimiento (fig. 3). 17 Figura 7. Altura promedio de plántulas de Acacia farnesiana por tratamiento ± i. confianza α = 0.05. En Acacia macracantha la tendencia en el desarrollo de esta especie fue estadísticamente diferente, ya que el tratamiento que tuvo mejores resultados fue el Testigo, en comparación con las cepas FCA56 y FCA60, que son las que le siguieron y que se comportaron de manera homogénea en cuanto a desarrollo (fig.8). d bc cd d b a Figura 8. Altura promedio de plántulas de Acacia macracantha por tratamiento ± i. confianza Guazuma ulmifolia no mostró crecimiento, la tendencia es clara al observar gráficamente los cambios ocurridos en la planta por los tratamientos (fig. 9). La especie Luehea candida tampoco mostró diferencias entre los tratamientos (fig. 9). 18 Figura 9. Altura promedio de plántulas por tratamiento y por especie ± i. confianza. Guazuma ulmifolia. Figura 9. Altura promedio de plántulas por tratamiento y por especie ± i. confianza. Luehea candida. Ambas situaciones son inusitadas, ya que hay numerosas referencias de éxito en inoculaciones con ambas especies de bacterias, que reportan mayores rendimientos y crecimiento en especies arbóreas, como Anacardium excelsum (Barreta y Valero, 2007) y Pinus patula (Orozco Jaramillo y Martínez Nieto, 2009). Por otro lado, los antecedentes de inoculación en arbóreas corresponden a especies de otras afinidades climáticas y edáficas, por lo que las bacterias podrían tener efectos disímiles, que habría que explorar más analizando las raíces. 19 El efecto de inoculaciones fue poco notable en las condiciones de vivero y riego, sin embargo, posiblemente, bajo condiciones naturales de estrés hídrico, después del trasplante, la situación podría ser diferente, y mostrar un efecto benéfico de la inoculación. Más aún, el tiempo de observación del desarrollo fue relativamente corto (6 meses) para observar un efecto. Una explicación alternativa es que pudo no haber una inoculación adecuada, al exceder la concentración del inóculo. Los datos muestran que bajo las circunstancias del experimento y de las especies, en la mayoría de los casos, la mejor opción sería la de no inocular. Sin embargo, es recomendable explorar la inoculación en más especies. VIII. CONCLUSION. Solo las leguminosas tuvieron éxito en la inoculación, acacia farnesiana la de mejor desarrollo, acacia macracantha funciono, pero en el testigo, en cuanto a las especies Luehea candida y Guazuma ulmifolia, no demostraron inoculación IX. RECOMENDACIONES El presente trabajo sirvió para conocer el comportamiento de las plantas de diferente especie bajo inoculación con bacterias, por lo tanto las recomendaciones pertinentes son: realizar actividades como los son: monitoreo de las plantas durante el crecimiento. que el experimento se monte en el lugar de origen de las especies. Que se exploren las especies (leguminosas) Que se exploren las especies ( No leguminosas) 20 X. LITERATURA CITADA Aguirre-Medina Juan Francisco, Daniela Montserrat Moroyoqui-Ovilla, Alexander Mendoza-López, Jorge Cadena-Iñiguez, Carlos Hugo Avendaño-Arrazate, Juan Francisco Aguirre-Cadena 2011. Hongo endomicorrízico y bacteria fijadora de nitrógeno inoculadas a Coffea arabica en vivero articulo jun. 2011. Alatorre, R.R, 1994 Desarrollo de control biológico Memorias V curso de control biológico, Oaxaca. Pp. 15 Álvarez, S.J.D y R. Ferrera-Cerrato. 1994. Loa microorganismos del suelo en la estructura y función de los agroecosistemas. Colegio de Posgraduados (Ed.). Montecillo Edo. de México 44 p. (Cuaderno de Edafología no. 25) Andriollo, N., Guarini, A. y G Cassini. 1992, Isolation and characterization of Pseudobactin B: a pseudobactin-tipe siderophore from Pseudomonas species Strain PD30, Journal Agricultural Food Chemistry 40: 1245-1248. Avendaño Reyes, S. e I Acosta Rosado. 2000. Plantas utilizadas como cercas vivas en el Estado de Veracruz. Madera y Bosques 6(001): 55-71. Azcón-Aguilarand J.M. Barea 1991. Detective interactions between different species of micorrhizal fungi and Rhizubium meliloti strains, and their effects on growth, N2fixation (15N) and nutrition of Medicago sativa L. New Phytologist 117: 399-404 Bar-ness, E., Chen, Y., Hadar. Y., marschner, H. Y V. Romheld. 1991. Siderophores of Pseudomonas putida as an iron source for dicot and monocot plants. En: Chen, Y., y Y,, Hadar (Editores). Iron nitrition and interactions in plants. Kluwer Academic Publishers. Holand. pp: 271-281 Bar-ness, E., Hadar, Chen, Y , Shanzer , A, y J. Libman, 1992. Iron uptake by plants from microbial Siderophore. Plant Physiology 99 : 1329-1335 Barreto Dayant, Nelson Valero, Adriana Muñoz, Arnaldo Peralta, Efecto de Microorganismos Rizosféricos sobre Germinación y Crecimiento Temprano de Anacardium Excelsum 2007 Universidad Popular del Cesar (Colombia) Bautista Melchor P.K., 2010. Biofertilizacion de Plantas de Pepino (Cucumis Sativus L.) con Rizobacterias Promotoras del Crecimiento en Condiciones de Producción Hidropónica (tesis) pag. 11-12 Basham, Y., and Holguín. 1998 Proposal for the division of plant growth-promoting Rhizobacteria into two classifications: biocontrol-PGPB (Plant Growth-promoting bacteria) and PGPB. Soil biology and Biochemestry 30: 1225-1228 Benavides, A. 2000. Absorción y asimilación de hierro en las plantas. Ciencia UANL. 3 195-210 21 Bakker, A. y B. Schippers. 1987. Microbial cyanide production in the rhizosphere in relation to potato yield reduction and Pseudomonas spp-madiated plant growth simulation. Soil Biology and Biochemestry 19 (4) 451 457 Becker, J.O., 1984 Isolation and characterization of antimycotic Bacteria from rhizosphere soil citado en la monografia patricia olvera martinez, 1998. “Control del hongo fitopatogeno phitium sp. Por pseudomonas fluorescens” Pp.31 Bello Maldonado, K.P. 2010. Biofertilizacion de plantas de pepino inoculación en Cucumis sativus L.) Con Rizobacterias promotoras del crecimiento en condiciones de producción hidropónica. Tesis licenciatura Ingeniero Agrónomo. Fac. C. Agrícolas Xalapa. UV. 11 pp. Brown, M.E. 1974. Seed and root bacteriozation. Annu. Rev. Phytopathol 12: 181-197.4 p. Caesar, J y Bur, T. (1987). Growth promoting of Apple seeding and rootstock by specific strains of bacteria. Phytopatology 77: 1583-1588 Catric, P. 1975 Hidrogen cyanide, a secondary metabolite of Pseudomonas aeruginosa. Canadian Journal of microbiology 21: 613-618 Cerdan, C. C. R. 2004. Aislamiento y caracterización e identificación de Pseudomonas fluorescentes de portainjertos de cítricos tolerantes al virus de la tristeza. Tesis de licenciatura, jalapa, ver. 55 p.(Tesis) Cuervo, J. 1997. Eefecto de la aplicación de hongos VA y rizobacterias en el crecimiento de plántulas de dos especies forestales. Tesis de Maestro en ciencias. CATIE. Costa Rica Chiquito C.R.G., 2002 Impacto de la (PGPR) en la uniformidad, vigor ycondicion fitosanitaria de plantas de Chile (capsicum annum L.) y Jitomate (Licopersicum esculentum Miller) determinado al momento de trasplannte. Chiquito Contreras, R.G. Fac. C. Agrícolas Xalapa. Com. pers. Compagnoni, A. Casanova Y P.L. 1997 Cambiando le regole europee per l agricultura biologica. Informatore Agrario 53 (31):60-61 Conafor-Conacyt.UV., L. Gutierrez Carbajal, J. Dorantes López, 2003-2004. Especies forestales de uso tradicuional del estado de veracruz pp. 169-170,198-199 Crosa, J. 1989. Genetics and molecular biology of siderophore-mediated iron transport in bactery. Microbiological Reviews 53: (4) 517-530 Crowley, D. Wang y., Reid, C. y P. Szaniszlo. 1991. Mechanisms or iron acquisition from siderophores by microorganism and plants. Plant and soil 142: 1-7 De Felipe A. Ma. R (S/F) Biotecnologías Limpias en Agricultura. Centro de de ciencias medioambientales (CSIC). 22P. Dileep Kumar, B. y H. Dube 1992. Seed bacterization with a fluorescent Pseudomonas for enhanced plant Growth, yield and diesece control soil Biology and Biochemestry 24 (6) 539-542 22 Diaz Vargas, P., Ferrera-Cerrato, R. Almaraz-Suarez, J.J. y Alcantar-Gonzalez, G. 2001. Inoculacion de bacterias promotoras de Crecimiento en lechuga. Terra 19: 327335 De Freitas, J. R, Gupta, V.V.S.R.y Germida, J.J. 1993, influence of Pseudomonas Siryngae R25 and P. putida R105 on the growth and N2 Fixiation (acetylene reduction activity) of pea (pisum sativum L.) and field vean (phaseolus vulagris L.). Biol.fretil.solis, 16:215-220. Diaz Vargas, P. 1998. Biofertilizacion del cultivo de lechuga (lactuca sativa L.) con bacteria promotoras de crecimiento micorriza arbuscular y vermicomposta. Tesis de maestría colegio de posgraduados. Mexico. Pp. 15-27 Durkhead, P., David, A. y Slininger, P. (1995) Bioatogarfy shows antibiotic production by soil Biology and Biochemestry. 27 (129: 1611-1616 Emery, T. 1982. Iron metabolism in humans and plants. American Science 70: 626-632 Farias-Rodriguez, R., Godínez, R. Zamora, E., y J. Peña-Cabriales 1997. Pseudomonas fluorescentes como agentes de control de bacterias patógenas de plantas: 1. Selección de Cepas de Pseudomonas productoras de sideroforos. Terra 15(4) 383-380 Fendrik, L, M. Del gallo, J. Vanderleyden y M. de zamaroczy. 1995. Azosspirilum! V and relate microorganims. -Genetic-pysology-ecology. Ecological Siences. 37 (12): 577 Fernández Tlapa-Martínez Velazco. 2004 Biofertilizacion de Plantas de Jitomate (Lycopersicon Esculentum miller) con Rizobacterias del Genero Pseudomonas con Manejo Hidropónico pag 24-25 (Tesis). Fernandez-Larrea, O. 2001. Microroganismos antegonistas para el control fitosanitario. Manejo integrado de plagas 62: 95-100 Garbaye, J. 1994 Helper bacteria: A new dimension to the micorrhizal Simbyosis. New phytologist 128: 197-210 Garrity, G.M., A.J. Bell and T. Lilburn. 2005. Bergey’s Manual of systematic bacteriology. 2nd. edn.vol. 2. The Proteobacteria, part B. The Gamma-Proteobacteria. Springer-Verlag.New York. pp. 323-377. Gonzalez –Ramirez, L.P. Y R. Ferrera-Cerrato. 1995. Aislamiento y caracterización de microorganismos de rizosfera, de Maíz (Zea Mays L.) Sociedad Mexicana de la ciencia del suelo (eds.) XXXVL Congreso Nacional De La Ciencia del suelo. Cd. Victoria, Tamaulipas. 91 p. Guerinot, M. 1994. Microbial iron transport. Annual Review Microbiology 48: 743-772, Holguin, G, Basham, Y. y R. Ferrera-Cerrato. 1996. Interacciones entre plantas y microorganismos beneficos: iii Procedimientos para el aislamiento y la caracterización de hongos micorrizicos y rizobacterias promotoras del crecimiento en plantas. Terra 14 (2) : 211-227. Harper JL. 1977. Population biology of plants. Academic Press. NY. 891 pp. 23 Hernández R. Alba 2004, Rizobacterias Promotoras del Crecimiento Vegetal y su influencia en el Crecimiento y Producción de Chile Tipo Choleño (Capsicum sp) en Invernadero (Tesis) pag. 11-20 Hernadez-Rodriguez, A., Heydrich-Perez, M., Velázquez del –Valle, M.G y HernadezLauzardo, A.N. 2006 perspectivas del empleo de rizobacterias como agentes de control biológico en cultivo de importancia económica revista mexicana de fitopatología 24:4249 Holguín, G., Y. Bashan y R. Ferrera-Cerrato. 1996. Interacciones entre plantas y microorganismos benéficos: III. Procedimientos para el aislamiento y caracterización de hongos micorrízicos y rizo bacterias promotoras de crecimiento en plantas. Terra 14(2): 211-227. Johnson, L, L.F. y E.A. Curl. 1972. Methods for research in teh ecology of soil-borne plant pathogens. Burgess Oublishing Company. Estados unidos de America pp: 1-7, 49-57 Jimenez, D. R. Virgen, C. G., Tabares, S.F., Olalde, P. V., 2001 Bacterias Promotoras del Crecimiento de Plantas Agrobiotecnologia. Avance y Perspectiva, 20: 395-400. Kloepper, j. w, and Schroth, M.N. 1978 Plant Growth-promoting rhizoabcteria on radishes. pp. 879-882. In: Proceding of the 4th International conference on Plant Pathogenic Bacteria. Ed Station de Pathologyc Vegetal Et Phytobacteriologic. Vol. 2, Angers, France. Kloepper, j. w., R. Liftshitz, and y schroth, M.N. 1988 Pseodomonas inoculants to benefit plant production. ISI atlas sci. anim. plant sci., 60-64 Kloepper, J. Hume, D Scher, F., Singleton. C., tripping, B., laliberte, M., Frauley, K., Kuchaw, T., Simonson, C, Lifshitz, R. y Lee, I. 1988a. Plant growth-promoting rhizobacteria on canola (rapesed). Plant disease 72: 42-46 Kloepper, J., lifshitz, R., y M., Schroth 1988b. Pseudomonas inoculants to benefit plant production. ISI Atlas of science: Anim Pl. Science: 60-63 Kloepper, j. w., R. M. Zablotowics. 1989. Free-living bacteria inocula for enhancing crop productivity. Tibech 7:39-44 Kloepper, J. 1993 Plant growth-promoting Rhizobateria as Biological control agents. En; Blaine-Metting, F.(Editor) Soil Microbial Ecology: Aplications in agricultural and environmental management. Marcel Dekker, Inc. Estados Unidos de America pp: 255274 Kunz, D., Chen, J. y G. Pan. 1998 Accumulation of Alfa-Keto Acids as essencial components in Cyanide assimilation by Pseudomonas fluorescens NCIMB 11764. Applied and environmental Microbiology 64 (11) 4452-4459 Lebu,M., Heilmman, B. Y Hartman. A. 1994. Effects of drying rewitting stresson microbial auxin production and L.tryptophan catabolism in soils. Boil. Fertile, soils, 18: 302-310 Leisinger, T. y Marggraff, R. 1979 Secondary metabolites of the fluorescent pseudomonas. Microbiological Review 43: 3 422-442 24 Linch J. y J. Whipps. 1991. Substrate flow in the rhizosphere En: Keister, D. y P. Crean (Editores). The rizhosphere and plant Growth Kluwer Acadmic Publisher Holanda. pp: 15-24 Linderman, R, 1988. Micorrhizal interactions with the Rhizospehre microflora: the mycorrrizhosphere effect Phytopatology 78 (3): 356-371 Linderman, R. 1991. Mycorrihizal interaction in the rhizosphere. En: Keister, D y P. Crean (Editores). The rizhosphere and plant growth. Kluwer Academic Publishers, Holanda pp: 343-348 Mesa, A, A. Csanova y P. L. Quintero. 1995 La Rotacion de los Cultivos en Sistemas de Agricultura Sostenibles. En II Encuentro Nacional de Agricultura Orgánica. Conferencia y Mesas redondas. Villa Clara Pag. 27 Morales Ruiz, J.M., Valencia Juárez, G., 2005 Tesis de licenciatura Antagonismo entre aislamiento nativos de Pseudomonas spp. Y Phytophora parasítica en cuatro portainjertos de cítricos tolerantes al V.T.C.PP. 18 Neilands, J. 1995. Siderophores. Structure and fuction of microbial iron transport compounds. The Journal of Biological Chemestry 270 (45) 26723-26726 O’ssulivan, D. y F. O’gara 1992 traits of fluorescent Pseudomonas spp. Involved in suppression of plant root pathogens. Microbiological Review 56(4): 662- 676 Olsson, P.., Baath, E., Jakobsen, L. y B. Soderstrom. 1996. 1996. Soil Bacteria respond to prescen of roots but not to mycelium of arbuscular Mycorrhizal fungi. Soil Biology and Biochmsty 28 (4): 463-470 Orozco-Jaramillo y Martínez-Nieto, 2009 Evaluación de la inoculación con microorganismos fijadores de nitrógeno asimbióticos aislados de la rizósfera de Pinus patula en Colombia BOSQUE 30(2): 70-77 Okon, y Y. Labandera_Gonzalez, C.A. 1994 Agronomic applications of Azospirillum. En: imroving plant productivity whit Rizosphere bacteria. (M.H. Ryder, P.M. Stephens y G.D. Bowwen, Eds). Commonwealth Scientific and industrial research organization. Adelaide, Australia. 274-278 pp Piao, C, G., Tang, W.J.y Chen, Y.X. 1992.Study on the biological activity of yield increasing bacteria. Chin.J.microecol., 4:55-62 Posta, K.., Marschner, H., y V., rombled. 1994. Manganese reduction in the rhizosphre of Mycorhizal and nonmycorrhizal maize. Mycorrhyza 5: 119-124 Ravnskov, S. y I. Jacobsen, 1999. Effects of Pseudomonas flourescens Df57 growth and P uptake of two arbuscular mycorrihizal fungi in sombiosis with cucumber Mycorrihizal 8: 329-334 Romero Rivera N., y Cruz López F., 2005 Influencia de Rizobacterias (PGPR) En la Producción de Jitomate (Lycopersicon Esculentum mil.) en Invernadero pag 8-12 (Tesis) 25 Sánchez, TJ y MI Lozano Chontal. 2010. Inoculación de rizobacterias y hongos micorrizogenos en Cucumis sativa L.) Con manejo hidropónico. (Tesis) licenciatura Ingeniero Agrónomo. Fac. C. Agrícolas Xalapa. UV. 42 pp. Sarabia Ochoa Marcela, et al. 2010.Plantas, hongos micorrízicos y bacterias: su compleja red de interaccionesRevista de la DES Ciencias Biológico Agropecuarias, Universidad Michoacana de San Nicolás de Hidalgopp. 66 Schaad, N.W. J.B. Jones and W. Chun. 2001. Laboratory guide for identification of plant pathogenic bacteria. 3 ed. St. Paul, The American Phytopathology Society. 373 p. Schipper, B. Bakker, A., Bakker P. y R. Van Peer. 1991. Benefical and deleterius effects of (HCN) Producction Pseudomonads on rhizosphere interaction. En. Keister, D. Y P. Cregan (Editores). The rhizosphere and plant growth. Kluwer Academic Publishers. Holanda. pp: 211-219 Schroth, M.N., and Hancock, J. G. 1982. Desease- Suppressive Soil and root colonizing bacteria. Science. 216: 1376-1381. Stintzi, A. Barnes, C., Xu, J. Y K. Raymond. 2000 Microbial iron transport via sIderophore shuttle: a membrane ion tansport paradigm. PNAS 97 (20): 10691-10696 Thrane, C., Harder Nielsen. T. Neiendam Nielsen, M., and Sorensen. J. 2000 Viscosinamide- Producing Pseudomonas flourescens DR54 exerts a biocontrol effect on Phytium Ultimum in sugar beet rhizosphere. FEMS Microbiology Ecology 33: 139.146 Toro, M. Azcon, R. Y J. Barea. 1997 Improvement arbuscular Mycorrhiza Development By inoculation with phosphate-solubilising rhizobacteria to improve rock phosphate Biovailability (32P and nutrient ciclyng. Applied and Environmental Microbiology) 63 (11): 4408-4412 Voisard, C., Keel, C, Haas, D. Y G. Defago. 1989. Cyanide production by Pseudomonas fluorescens helps supress black root rot of tabaco under gnotobiotic conditions. EMBO J. 8: 351-358 Villareal-romero, M. 1990 Efecto de la doble inoculación Azospirillum spp Endomicorriza VA en la producción de trigo (Triticum aestivum, L.) tesis de maestri Colegio de posgraduados. México. Zambrano, Jhon Alexander; Díaz, Lucía Ana. 2008. Efecto de la inoculación de Azospirillum brasilense y Glomus sp. En Gmelina arbórea durante su germinación y manejo en vivero Universitas Scientiarum, Vol. 13, Núm. 2, julio-septiembre, 2008, pp. 162-170 Pontificia Universidad Javeriana Colombia Zar JH. 1996. Biostatistical analysis. 3rd ed. Prentice Hall. USA. 662 pp. Zenil, L. 2001 Flora microbiana de la rizosfera en dos plantas medicinales: sangre de drago (Jatropa Dioica) y Mezquite (prosopis laevigata). Tesis de licenciatura. UAch. México http://www.rizobacter.com.ar/pgpr-biofertilizantes.html# 26 XI. ANEXOS Especies tropicales de selva baja para uso de combustible leña. Nombre científico: Acacia Farnesiana Nombres Comunes en México: Espino, Espino blanco (Oax.). Familia: Mimosácea. Sinonimia: Acacia acicularis Wild.; Mimosa Farnesiana L.; Vachellia farnesiana (L.) Wight et Arn. Forma. Arbusto espino o árbol pequeño, perennifolio o sub-caducifolio, de 1 a 2 m. de altura la forma arbustiva y de 3 a 10 m. la forma arbórea, con un diámetro a la altura del pecho de hasta 40 cm. Copa y Hojas. Copa redonda, Hojas plumosas, alternas, frecuentemente aglomeradas en las axilas de cada par de espinas, bipìnnadas, de 2 a 8 cm. De largo incluyendo el pecíolo, con 2 a 7 pasares de foliolos primarios puestos y de 10 a 25 pares de foliolos secundarios. Tronco y Ramas. Tronco Corto y delgado, bien definido o ramificado desde la base con numerosos tallos. Ramas ascendentes y a veces horizontales, provistas de espinas de 6 a 25mm. De longitud. Corteza. Externa lisa cuando joven y fisurada cuando vieja, gris plomiza a gris pardo oscura, con abundantes lenticelas en líneas transversales. Interna crema amarillenta, fibrosa, con un marcado olor y sabor a ajo. Grosor total: 5 a 6 mm. Flor/Flores en cabezuelas de color amarillo, originadas en las axilas de las espinas, solitarias o en grupos de 23 a 3. Muy perfumada, de 5mm. De largo; cáliz verde, campanulado, papiráceo de 1.8mm. de largo; corola amarillenta o verdosa, de 2.3 mm. De largo. Sus brillantes flores están apiñadas en bolas densas y mullidas y con frecuencia cubren el árbol en forma tal que este da la sensación de una masa amarilla. Fruto. Vainas moreno rojizas semiduras, subcilindricas, solitarias o agrupadas en las axilas de las espinas, de 2 a 10 cm. De largo, terminadas en una punta aguda, valvas coriáceas, fuertes y lisas, tardíamente dehiscentes. Permanecen en el árbol después de madurar. Semilla(s).Semillas reniformes, de 6 a 8 mm. De largo, pardo-amarillentas, de olor dulzón y con una marca linear en forma de “C”L testa de la semilla es impermeable al agua. Sexualidad Y Número Cromosómico: Hermafrodita, 2n=52Distribución.Su área de distribución es heterogénea. En la vertiente pacifica: desde el sur de sonora hasta Chiapas y de manera discontinua en la vertiente atlántica. Altitud: 36 a 1500 (2500) m. Avendaño (2000) 27 Nombres científico: Luehea Candida. Familia: Tiliaceae Sinonimias: Alegría Candida Moc. & Sessé ex DC. Nombres comunes: Algodoncillo, Tepecacao, pepecacao, Patashte, chakats y cuaulote blanco. Características del árbol: Mide hasta 25 m de alto, copa redondeada, ramas ascendentes y colgantes, su tallo recto y su diámetro tiene hasta 70cm, su corteza externa es lisa, se fisura y se pone escamosa cundo envejece de color moreno rojizo. Sus hojas son laminas simples de 10 x 45 cm hasta 23 x 15 cm anchas en la parte media, en la base son redondeadas y en la punta suelen afinarse. El borde de las hojas están finamente aserradas. En el haz de las hijas son de color verde oscuro opaco, tiene vellos finos también hay ausencia de los mismos, en el envés las hojas son de color verde grisáceo o amarillento, presenta grandes nervaduras desde la base, estas a su vez están muy marcadas, sus hojas caen una vez al año, sus flores terminales llegan a medir 15 cm de largo, con flores de 1 a 2 cm tiene la características de tener la forma estrellada y 5cm de diámetro, color blanco, floración de septiembre a marzo, los frutos son capsulas de 2 a 4 cm de largo, contienen numerosas semillas aladas de 1 a 1.2 cm de largo, son de color dorado tostado.. Usos: El uso de esta especie es para vigas, leña, y postes. Calidad de la madera: Considerad de regular calidad al usarla para vigas, postes y leña. Tratamiento: y Aprovechamiento: Ningún tratamiento 6 años de edad con un diámetro aproximadamente de 7 cm y a una altura de 5m y Crece a pleno sol. Distribución: Desde México tropical hasta América central y Colombia, exclusiva del vertiente del golfo de México, desde la sierra de Naolinco, centro de Veracruz y norte de Oaxaca, hasta la península de Yucatán. El producto principal; leña, carbón, construcciones rurales, aserrío y muebles., recomendada para mangos de herramienta, cajas, paneles y tableros de partículas, hormas para zapatos y pulpa para papel. Su madera es de color café, en ocasiones de un color rosado, es una madera dura y pesada, fuerte y tenaz con una textura median y grano recto o ligeramente ondulado, fácil de trabajar Requerimientos: Altitud: nivel del mar a 1000msnm, Temperatura media anual: 26°C Precipitación: 800 a 1600 mm anuales, Clima. Cálido a templado, Suelos: rocosos y arenosos, bien drenados (CONAFOR-CONACYT.UV, 2003-2004) Nombre científico: Guazuma Ulmifolia Lam. Familia: Sterculiaceae. Sinonimias: Guazuma Ulmifolia var. Velutina K. Schum. 28 Nombres comunes: GUÁCIMA / Huacima, Guácimo, guácima, Guazuma, Aquiche, y en su área de distribución cualote, (cualolotl- lengua náhuatl) guerrero, Oaxaca, Chiapas: aquiche, kabal-pixoy- lengua maya, Yucatán- acashti Características del árbol: El árbol mide hasta 15 metros de altura menor tamaño normalmente, copa dispersa y generalmente se ramifica desde la base. El tronco es derecho hasta los 70 cm. De diámetro. La corteza está marcada por hendiduras, se desprenden pequeños ´pedazos de color gris oscuro, Hojas insertadas de forma alterna, son láminas simples de 3 x 1.5 hasta 13 x 6.5 con la base ancha y hacia la punta se afina, el margen de las hojas es aserrado. El color de las hojas es verde oscuro en la cara que y verde amarillento o grisáceo en la cara contraría. En el envés se aprecian de 3 a 5nervios saliendo de la base. As hojas son rasposas en el haz y sedosas en el cara contraria. Estos árboles pierden sus hojas una vez al año. Las flores están dispuestas en racimos, tienen olor penetrante y dulce y de una forma estrellada y son muy pequeñas hasta de 1 cm. Pegadas a las ramas a un costado de donde están insertadas las hojas, tienen color crema verdoso. Su floración es todo el año, los meses son abril y mayo. Su fruto es una capsula muy característica y distintiva mide 10cm; su forma es ovoide, tiene protuberancias cónicas muy numerosas, en la superficie, que son de color verde en estado inmaduro y se tornan oscura y negra cuando madura, es de olor y sabor dulce. Tiene numerosas semillas estás miden aproximadamente de 2 a 2.5mm de largo, redondas, de un color café oscuro, su maduración es casi todo el año, los meses septiembre a abril y permanecen mucho tiempo en el árbol. Usos: Se utilizan especialmente para postes, cercas para casas, y sillas. El tronco y ramas las utilizan para leña, especialmente para hornos de panaderías. Calidad de la madera: De buena a excelente calidad para la leña, mientras consideran ala medra para trabajar de regular calidad. que Tiempo de aprovechamiento y Tratamiento: Secado de la madera de esta especie bajo techo y otra al aire libre. Se utiliza para leña y poste cuando tienen una edad de 2 años, con diámetros de 10 cm a la altura de 4m. Para cimbra y sillas se pueden utilizar los arboles de 15 años de edad el diámetro de estos son de 25cm u con una altura de 8m. Se utiliza para carbón, leña, para herramientas de campo, construcciones rurales, pequeñas embarcaciones, hormas para zapato, instrumentos musicales. Se recomienda para marcos de ventana y puertas. Desde México en zonas calientes de la vertiente oriental, hasta vertiente occidental, América del sur en la zona tropical. Altitud: 0-1200msnm, Temperatura media anual: 20-30°C, Clima cálido húmedo, Precipitación: 1,100 a 1, 300 mm anuales, Suelos de origen volcánico/sedimentario por último, abundante en pastizales arbolados. (CONAFOR-CONACYT.UV, 2003-2004) Nombre científico: Acacia macracantha Nombre común: Faique Familia: Fabaceae / Descripción Botánica: 29 Árbol caducifolio, alcanza hasta 12 m de alto y de 30 a 40 cm de DAP, presenta espinas grandes opuestas en las ramas y el tronco. El fuste es irregular y muy ramificado y su copa es amplia. Hojas compuestas, alternas, bipinnadas con glangulas o nectarios en el ráquiz, tiene de 10 – 24 pares de foliolos sésiles pequeños oblongos de 1.5 – 3 mm de largo y 0.5 – 1 mm de ancho, estípulas caducas. Presenta flores axilares de 1 – 5, en forma de cabezuelas densas amarillas de 1 cm insertadas a pedúnculos de 1 a 3 cm , florece de noviembre a febrero. Fruto es una vaina un tanto plana, su tamaño va de 5- 10 cm x 1 cm de ancho; las semillas son cafés oscuras. Distribución geográfica: Se encuentra distribuido en Latinoamérica por los bosques secos al sur de México, por Centroamérica en Cuba, República Dominicana, Haití, Jamaica, Puerto Rico y en Sudamérica desde Venezuela y bajando principalmente por el lado del Pacífico Colombia, Ecuador, Perú, Bolivia, norte de Argentina y Chile y es menos frecuente Paraguay. En Perú se distribuye por valles interandinos secos como Cajamarca, Cusco, Arequipa, Libertad y por la costa Lambayeque, Lima y en el Ecuador es muy común, se encuentra en Galápagos y por los valles secos interandinos de la sierra de norte a sur, en la costa desde Manabí, Guayas, El Oro y Loja. (Base Trópicos, Missouri Botanical Garden) Ecología: Tiene un rango de distribución muy amplio y se lo puede encontrar desde el nivel del mar y sobre los 3000 metros de altitud. Se encuentra principalmente en sitios de bosque seco asociado con especies arbóreas como: Pasallo o chirigua Eriotheca ruizi , pretino o pigío Cavanillesia platanifolia, guayacán (Tabebuia chrysantha), hualtaco (Loxopteriginum huasango), palo santo (Bursera graveolens), guarapo o castaño (Terminalia valverdae), porotillo o pepito colorado (Erytrina velutina) donde la precipitación generalmente esta bajo los 1000 mm y en valles interandinos secos donde las precipitaciones están por alrededor de los 1500 mm asociado con varios géneros de captus principalmente con Opuntia y otras plantas del genero Baccharis spp. (Chilcas), Roupala sp. y otras especies como Piptadenia colubrina (Hilco). Los usos de este árbol maderable son: en construcciones rurales pero la madera no debe tener contacto con el suelo, también ha sido utilizada en la industria parquetera para pisos y en la elaboración de carbón. Se ha constituido como en una de las mejores leñas por su alto valor calorífico y es muy importante para la preparación de alimentos en el sector rural. Sus vainas y el follaje se constituyen en un muy buen forraje para el ganado.2 2 Consultado el día 12 de enero del 2012: http://www.darwinnet.org/index.php?option=com_content&view=article&id=825:faique-&catid=60 30