ENLACE QUIMICO
Anuncio

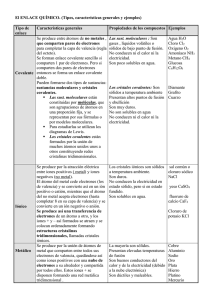
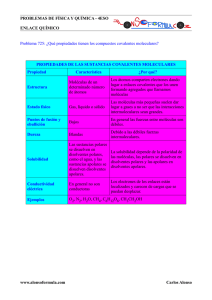
ENLACE QUIMICO DEF: fuerzas que mantienen unidos átomos entre sí o moléculas entre si Sustancias E. Interatómico Existencia de moléculas Ejemplos Iónicos Iónico No Sales, NaCl, CaCl₂ Metálicos Metálico No Zinc, Hierro, Calcio Moleculares Covalente Si H₂O, O₂, CO₂, H₂SO₄ Covalentes Covalente No Diamante, Grafito (C) Dos átomos se unen para conseguir una estructura electrónica más estable que la que tienen inicialmente. Una sustancia molecular polar es la que sus moléculas están formando un dipolo (moleculas neutra con cargas + y – separadas) ENLACE IÓNICO DEF: Es el enlace que se establece entre átomos de elementos de muy distinta electromagnetividad (metal + no metal). El metal cede electrones al no metal convirtiéndose en cationes y aniones. ¿Cuántos electrones pierde el metal? ¿Cuántos gana el no metal? El metal pierde los electrones necesarios para que el no metal consiga la estructura s²p⁶ DEF (valencia iónica de un átomo): numero de electrones que puede ganar o perder. Las sustancias cuyos átomos se unen por enlaces iónicos se llaman sustancias iónicas. La estructura de una sustancia iónica es cristalina iónica: los cationes y aniones están colocados ordenadamente en los nudos de una red tridimensional, de manera que en la sustancia haya el mismo número de cargas positivas y de negativas. *En las sustancias iónicas no hay moléculas. Tipos de sustancias iónicas: todas las sales hidróxidos y todos los óxidos de metales. Propiedades de las sustancias cristalinas: Estado de agregación en condiciones ambientales: son sólidos Punto de fusión y ebullición: alto (++++) Solubilidad: o Solubles en agua (distinta solubilidad) o disolventes polares o Insolubles en disolventes apolares (aceite, CCl₄) Fragilidad: son frágiles (ni dúctiles ni maleables): al deslizarse las capas superiores sobre las inferiores al ser de misma carga se repelen y se rompen. Conductividad electrónica: o Solido: no conduce la corriente eléctrica (las partículas están colocadas ordenadamente y no se pueden trasladar) o Liquido: si que la conducen (las partículas pueden trasladarse, rotar y vibrar) Las sustancias iónicas son electrolitos (se dice que una sustancia es electrolito cuando su disolución acuosa conduce la corriente eléctrica) porque hay aniones y cationes en su disolución acuosa. ENLACE METÁLICO DEF: es el enlace que se da entre átomos de elementos de poca electronegatividad (metales) Los metales tienen una capa de valencia con pocos electrones de valencia por lo que tienden a perderlos y quedarse en forma de catión. En las sustancias metálicas estos cationes se colocan ordenadamente en los nudos de una red tridimensional (red cristalina metálica). La estructura se estabiliza porque los electrones perdidos forman una nube de electrones que se mueve alrededor de los iones. *No hay moléculas en una sustancia metálica Formula: símbolo del elemento. Significado: formado por átomos de ese elemento. Propiedades: Estado de agregación: son sólidos en condiciones ambientales excepto el mercurio que es liquido Puntos de fusión y ebullición: moderadamente altos (++) Son insolubles tanto en disolventes polares como apolares No son frágiles, son dúctiles y maleables, la razón se basa en su estructura, al aplicar presión sobre una parte, unas capas se deslizan sobre otras, siempre habrá electrones entre las capas que estabilicen la estructura. Conductividad eléctrica: buenísimos conductores de la corriente eléctrica porque tienen en su seno electrones libres muy pequeños y se trasladan son mayor facilidad. Conductividad calorífica: son buenos conductores del calor porque poseen electrones libres, al aplicar calor se difunden y calientan rápidamente. Brillo metálico Presentan el efecto fotoeléctrico (descubierto por Einstein, cuando un metal es iluminado por una luz concreta, este metal emite electrones) ENLACE COVALENTE DEF: es el enlace que se establece entre átomos de alta electronegatividad. Este enlace consiste en la compartición de un par de electrones para conseguir una estructura electrónica estable (regla del Octeto) aunque hay excepciones. ¿Cuántos enlaces covalentes puede establecer un átomo? Tantos enlaces como orbitales semillenos tenga en su capa de valencia. Covalencia o valencia covalente: numero de enlaces covalentes que puede establecer. Un elemento puede promocionar un electrón y ampliar su octeto (un electrón salta a un orbital del mismo nivel) SUSTANCIAS CUYOS ÁTOMOS ESTAN UNIDOS COVALENTEMENTE: Sustancias moleculares Sustancias covalentes (sólidos covalentes) SUSTANCIAS MOLECULARES DEF: sustancias cuyos átomos están unidos covalentemente formando moléculas (especies químicas de un número relativamente pequeño de átomos unidos covalentemente que no están formando una microred cristalina). Significado de la formula molecular: el tipo y el número de moléculas unidas. Propiedades Estado de agregación: en condiciones ambientales son sólidos, líquidos o gases (depende de los enlaces intermoleculares) Punto de fusión y ebullición: bajos (+) depende de los enlaces intermoleculares Solubilidad: unos son solubles en agua y en disolventes polares e insolubles en disolventes apolares, otros son solubles en disolventes apolares y no solubles en disolventes polares y en agua. Conductividad eléctrica: no conducen la corriente eléctrica ni en estado dolido, líquido y gas. Hay disoluciones acuosas de determinadas sustancias que conducen la corriente eléctrica y otras sustancias moleculares no la conducen. Hay sustancias moleculares que en agua de rompen en iones y aniones como el HCl. Dureza: algunas sustancias moleculares cristalinas, es decir, que las moléculas se colocan ordenadamente en los nudos de una red tridimensional (en estado sólido). Otras sustancias moleculares, en estado sólido tienen una estructura amorfa. SÓLIDOS COVALENTES DEF: sustancias cuyos átomos están enlazados covalentemente formando una macrored tridimensional (no forman moléculas) Diamante: los Carbonos están unidos a otros Carbonos en una red tetraédrica. Grafito: laminas en las que los carbonos están unidos a otros tres carbonos formando una red hexagonal Sílice (SiO₂): forma una estructura cristalina covalente tetraédrica en la que por cada silicio hay dos oxígenos. Propiedades: Estado de agregación en condiciones ambientales: sólidos Puntos de fusión y ebullición: altísimos ++++ Solubilidad: insolubles en disolventes polares y apolares Dureza: muy duros, excepto el grafito que es exfoliante Conductividad eléctrica: no conducen, excepto el grafito (porque tiene electrones libres)