DEPARTAMENTAL AREA QUIMICA Categoría: 2do Secundaria
Anuncio

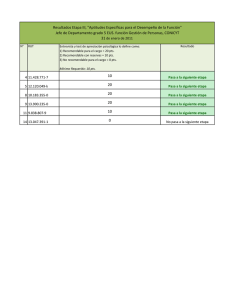
TERCERA ETAPA: DEPARTAMENTAL AREA QUIMICA Categoría: 2do Secundaria Número de Examen 20 de agosto de 2011 Año Internacional de la Química 1. (10 pts., 1pto/c.u.)Indique si es verdadera (V) o falsa (F) cada una de las siguientes afirmaciones: a) b) c) d) e) f) g) h) i) j) El enlace covalente doble es más largo que el enlace covalente simple ( F ) Un ejemplo de sólido amorfo es el vidrio ( V ) En cambios de fase, deposición es lo contrario de sublimación ( V ) La ley de conservación de la masa fue enunciada por John Dalton ( F ) La UMA es igual a 12 gramos del átomo de C12 ( F ) El cero absoluto está a -273, 15 K ( V) El número de masa es igual a la suma del número de electrones y protones ( F ) La evaporación y la condensación del agua ocurren a la misma temperatura ( V ) Un sistema heterogéneo está siempre formado por dos o más sustancias diferentes ( F) Un mol de cualquier gas en Condiciones Normales ocupa siempre el volumen de 22,4 litros ( V ) 2. (22 pts.)En la Tabla se muestra una lista parcial de la Masa y el número atómico de algunos elementos y la figura muestra parcialmente la Tabla Periódica de los Elementos. Tabla Periódica a) (8 pts., 1 pto./ c. símbolo)Escribe el símbolo de los elementos que se muestran en la Tabla de Masas y números atómicos en las casillas correspondientes de la Tabla Periódica b) La configuración electrónica del Ca es: 2 2 6 2 6 1S 2S 2P 3S 3P 4S 2 2pts. c) A qué Familia y Período pertenece el Magnesio. F = IIA P = 3 d) ¿Cuántos electrones, protones y neutrones tiene el 2pts. Nº e-= 20, Nºp+ = 20, Nºno = 20 6 pts. e) Ordene en forma creciente de electronegatividad los elementos del Período del sodio (sólo los elementos que se muestran en la Tabla Periódica parcial, incluyendo al sodio). Na < Mg < Al < Si < P < S < Cl 2pts. f) Ordene en forma creciente de radio atómico los elementos del Período del cromo(sólo los elementos que se muestran en la Tabla Periódica parcial, incluyendo al cromo). Br < Cu < Fe < Mn < Cr < Ca 2pts. 3. (8 pts.)La masa de una probeta graduada vacía es 368 g. Primero, se vierten 150 cm3 de aceite de oliva en la probeta y se pesa éste con su contenido, dando un valor de 503 g. Luego, un bloque de mármol que pesa 102 g. se introduce despacio en la probeta graduada que contiene el aceite; una vez sumergido se lee 190 cm3 en el nivel del aceite, calcular: 3 0,9 g/cm a) La densidad del aceite de oliva es: ……………… 3 pts. b) El volumen del mármol en centímetros cúbicos es: 40 cm3 c) La densidad y peso específico del mármol son: .… 2,55 g/cm3 1 pto. 3 pts. 2,55 1 pto. 4. (16 pts.)Una disolución de ácido sulfúrico concentrado contiene 98 % en peso de H2SO4 y su densidad es 1,84 g/cm3. a) ¿Cuántos gramos de H2SO4 puro contiene 1 litro de la disolución de ácido sulfúrico concentrado? 1803,2 g H2SO4 puro 4 pts. Pag. 1/2 1ra OCEPB - Categoría; 2do de Secundaria b) ¿En qué volumen de la disolución de ácido sulfúrico concentrado (en cm3) se encuentra 100 g de H2SO4puro? 4 pts. En 55,46 cm3 de H2SO4 (concentrado) c) ¿Qué masa en gramos de: hidrógeno, azufre y oxigeno hay en 100 g dela disoluciónde ácido sulfúrico concentrado? 4 pts. 2 g de H, 32 g de S y 64 g de O d) ¿Cuántos átomos de hidrógeno hay en 100 g dela solución de ácido sulfúrico concentrado? 1,2 x 1024 átomos de H Pesos atómicos: H = 1 S = 32 4 pts. O = 16 5. (16 pts.)En 290 g de CxH16O hay 2,408x1025 átomos de hidrógeno. Calcular: 116 ó 116 g/mol a) El peso molecular del CxH16O es: 4 pts. b) El número de moles de CxH16O presentes en la muestra es: c) El valor de “x” del carbono en el compuesto CxH16O es: d) La masa en gramos de una molécula de CxH16O es: 2,5 moles 4 pts. 7 4 pts. 1,92 x 10-22 g/molécula 4 pts. 6. (16 pts.)Una planta industrializadora de sulfato de calcio, necesita producir 8000 kg de sulfato de calcio. Para ello dispone de suficiente cantidad de las dos materias primas necesarias, carbonato de calcio y ácido sulfúrico. El carbonato de calcio que tiene una pureza del 90% se hace reaccionar con 500 litros de ácido sulfúrico en disolución de densidad 1,2 g/cm3y 27,7%p/p. La reacción correspondiente a este proceso es: Carbonato de Calcio + Ácido SulfúricoSulfato de Calcio + Ácido Carbónico a) Escribe la ecuación química correspondiente e iguale por el método que vea conveniente. 2 pts. CaCO3 + H2SO4 CaSO4 + H2CO3 b) (6 pts., 0,5 pts./c.u.)Indique en las casillas correspondientes afirmativamente (SI) o negativamente (NO) el tipo de enlace presente en los compuestos participantes en la reacción: Compuesto Carbonato de calcio Ácido sulfúrico Sulfato de calcio Ácido carbónico Iónico Covalente SI SI SI SI SI SI SI SI Covalente coordinado NO SI SI NO c) Dibuje la estructura de Lewis para el ácido d) ¿Cuál de los reactivos actúa como limitante? e) ¿Qué cantidad queda del reactivo en exceso? carbónico:2pts. El H2SO4, ácido sulfúrico 6347,6 kg de CaCO3 al 90% 1pts. 3pto. f) ¿Cuántos kilogramos de sulfato de calcio se producen si el rendimiento del proceso es del 80%? 2pts. 184,5 kg de CaSO4 7. (12 pts., 2 pts./c. respuesta)Analizamos dos muestras de dos óxidos de níquel. En 2,00 g del primero se encuentra 1,57 g de níquel y en 10 g del segundo se halla 7,33 g de níquel. (pesos atómicos: Ni = 58,7 y O = 16). Llenar la siguiente tabla: Email: [email protected]. 2/2