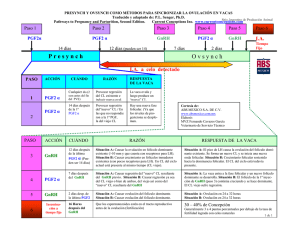
Desde que se conocen las hormonas que participan en la
Anuncio

1 REVISIÓN DE LOS PROTOCOLOS EMPLEADOS EN LA SINCRONIZACIÓN DE CELOS EN BOVINOS SERGIO RAMIRO PALOMARES GARCÍA UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES – U.D.C.A FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA BOGOTÁ D.C., 2009 2 REVISIÓN DE LOS PROTOCOLOS EMPLEADOS EN LA SINCRONIZACIÓN DE CELOS EN BOVINOS SERGIO RAMIRO PALOMARES GARCÍA Trabajo Presentado como requisito para optar al título de Médico Veterinario y Zootecnista. Director EDGAR CIFUENTES Medico veterinario UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES – U.D.C.A FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA BOGOTÁ D.C., 2009 3 NOTA DE ACEPTACIÓN _________________________________ Jurado 1 _________________________________ Jurado 2 _________________________________ Director de monografía Bogotá, D.C., mayo de 2009 4 TABLA DE CONTENIDOS Pág. INTRODUCCIÓN 15 1. OBJETIVOS 1.1. OBJETIVO GENERAL 1.2. OBJETIVOS ESPECÍFICOS 16 16 16 2. PLANTEAMIENTO DEL PROBLEMA 17 3. JUSTIFICACIÓN 18 4. METODOLOGÍA 19 5. IMPACTO ESPERADO 20 6. MARCO TEÓRICO 6.1. ANTECEDENTES 6.2. FISIOLOGÍA REPRODUCTIVA DE LA HEMBRA BOVINA 6.2.1. Anatomía del aparato reproductor de la vaca 6.2.1.1. La vulva 6.2.1.2. La vagina 6.2.1.3. El útero 6.2.2. Foliculogénesis 6.2.3. La ovulación 6.2.4. El cuerpo lúteo 6.2.4.1. Luteolisis 6.2.5. Bases fisiológicas de la reproducción 6.2.5.1. Regulación endocrina: las hormonas de la reproducción 6.3. LA DETECCIÓN DEL ESTRO 6.3.1. Métodos para la detección del estro 6.3.2. Signos de estro 6.3.3. Patrones diarios en los signos de estro 6.3.4. Otros factores que influencian la expresión del estro 21 21 22 22 23 24 24 28 32 35 35 37 41 52 56 61 62 62 5 Pág. 6.3.5. Cálculo de la intensidad de detección de celo 6.3.6. Momento óptimo para el servicio (monta – inseminacion) 6.3.7. Ausencia del estro o anestro 64 64 66 7. LA SINCRONIZACIÓN DE CELOS 7.1. Definicion de la biotecnología de Sincronizacion de Estros 7.2. LAS ONDAS FOLICULARES Y LA SINCRONIZACIÓN 7.3. PROTOCOLOS PARA CONTROLAR LAS DIVERSAS FASES DEL CICLO ESTRAL 7.3.1. Protocolos a base de prostaglandina (PGF-2) 7.3.2. Protocolo Ovsynch (ovulación sincronizada) 7.3.3. Protocolo Heatsynch (celo sincronizado) 7.3.4. Protocolos con la utilización de GnRH + CIDR 7.4. MANIPULACIÓN DEL DESARROLLO FOLICULAR PARA LA SINCRONIZACIÓN DE ESTROS 7.4.1. Relación: Dinámica folicular, progestágenos y fertilidad 7.5. PROTOCOLOS CON PROGESTERONA Y ESTROGENOS 7.5.1. Estrógenos 7.5.2. Progesterona 7.6. Presincronización con progesterona en novillas prepúberes 7.7. Interferencia de los niveles de progesterona y los dispositivos Intravaginales 7.8. Ablación folicular 7.9. Efecto de los agonistas y el GnRH en la dinámica folicular 67 68 70 136 137 139 8. INDUCTORES DE OVULACIÓN 141 CONCLUSIONES 146 BIBLIOGRAFÍA 149 73 75 90 101 111 113 114 116 116 122 135 6 LISTA DE CUADROS Pág. Cuadro 1. Hormonas más importantes en la reproducción 51 Cuadro 2. Signos de estro en las vacas lecheras 63 Cuadro 3. Esquema AM-PM para la inseminacion artificial 65 Cuadro 4. Formas de control del ciclo estral y productos utilizados 75 Cuadro 5. Respuestas ováricas (media +ES) a tratamientos con PGF-2 los días 5, 8 ó 12 del ciclo. 82 Cuadro 6. Esquema de presincronización para novillas cebuínas prepúberes. 135 7 LISTA DE ESQUEMAS Pág. Esquema 1. Relaciones del sistema hipotálamo–hipófisis–ovárico 38 Esquema 2. Etapas del ciclo estral bovino 55 Esquema 3. División de las prostaglandinas según su origen 76 Esquema 4. Tratamiento A con PGF-2 78 Esquema 5. Opciones para sincrinización de estros utilizando 2 inyecciones de PGF-2 con 14 días de diferencia. 81 Esquema 6. Tratamiento B. con PGF-2 83 Esquema 7. Tratamiento C. con PGF-2 84 Esquema 8. Tratamiento D. con PGF-2 84 Esquema 9. Tratamiento de los 10 días. 85 Esquema 10. Esquema general del Ovsynch. 91 Esquema 11. Protocolos de sincronización con Ovsynch y Cosynch. 91 Esquema 12. Protocolo de manejo reproductivo que combina IA a tiempo fijo (Ovsynch) con diagnóstico temprano de gestación usando ultrasonido. 93 Esquema 13. Programa de presincronización para la implementación del Ovsynch. 98 Esquema 14. Programa Presynch-Ovsynch. 98 Esquema 15. Programa de tratamiento y resultados asociados al protocolo 7-11 Synch. 102 Esquema 16. Protocolo MGA. 103 Esquema 17. Esquema general del protocolo Heat–synch. 104 Esquema 18. Protocolos de resincronización de vacas lecheras en lactación diagnosticadas como vacías en un examen de palpación rectal en el día 45 post–inseminación. 106 8 Pág. Esquema 19. Protocolos para resincronización de vacas lecheras en lactación diagnosticadas como vacías en un examen de ultrasonografía en el día 27 post inseminación. 107 Esquema 20. Protocolos utilizados en la resincronización de vacas deacuerdo con la fase del ciclo estral después del diagnostico de preñez en el día 30 pos-IA. 110 Esquema 21. Protocolos de los experimentos en vacas de carne con becerro al pie tratadas con GnRH, PGF-2 y CIDR. 113 Esquema 22. Valerato de Estradiol y desarrollo folicular. 122 Esquema 23. Tratamiento con MGA/PGF-2. 123 Esquema 24. Regimen Crestar. 126 Esquema 25. Tratamiento de sincronización utilizando los implantes de norgestomet (Crestar) con GnRH a las 30 h de removido el implante e IATF, 54 h después de la remoción del implante. 130 Esquema 26. Tratamiento de sincronización de celos e IATF con Crestar y BE. 131 9 LISTA DE FIGURAS Pág. Figura 1. Metodología 19 Figura 2. Aparato reproductor de la hembra 23 Figura 3. Cervix 25 Figura 4. Oviductos 26 Figura 5. Ovario 27 Figura 6. Funciones del folículo y del cuerpo lúteo 27 Figura 7. Folículo y cuerpo lúteo 28 Figura 8. Proceso de desarrollo de los folículos y del cuerpo lúteo 32 Figura 9. Maduración del folículo hasta la ovulación y formación del cuerpo lúteo 34 Figura 10. Ovulación 34 Figura 11. Proceso de luteolisis 36 Figura 12. Estructura y localización del hipotálamo y la glándula Pituitaria 41 Figura 13. Estructura química de la prostaglandina F-2α (PGF-2α) 50 Figura 14. Fases del ciclo estral 52 Figura 15. Días del ciclo estral 57 Figura 16. El ovario de la vaca y su dinámica durante el ciclo estral 58 Figura 17. Método de detección de celo con pinturas y crayones 60 Figura 18. Horas y niveles en que se manifiestan los signos del estro 62 Figura 19. Diagrama para el servicio 66 Figura 20. Mecanismos de acción de la GnRH. 141 10 LISTA DE GRÁFICAS Pág. Gráfica 1. Concentraciones relativas de hormonas en cada fase del ciclo estral con el respectivo folículo y desarrollo del cuerpo lúteo. 54 Gráfica 2. Efecto de la sincronización del estro sobre el desempeño reproductivo durante una sola semana de servicio. 69 Gráfica 3. Fases de crecimiento folicular: reclutamiento (dependiente de la FSH); Selección y dominancia (dependiente de LH); Ovulación o atresia (en la dependencia de la presencia o no del pico preovulatorio de LH). 71 Gráfica 4. Esquema del ciclo estral con 2 ondas foliculares. La primera onda culmina con la atresia del folículo dominante por falta del pico préovulatório de LH (Fase luteínica) la segunda onda culmina con la ovulación (Fase folicular, baja progesterona y pico preovulatório de LH). 72 Gráfica 5. Esquema del ciclo estral con 3 ondas foliculares. La primera y la segunda onda culminan con la atresia de los folículos dominantes por falta del pico preovulatório de LH (Fase luteínica). La tercera onda culmina con la ovulación (Fase folicular, baja progesterona y pico preovulatório de LH). 72 Gráfica 6. Porcentaje de celo después de la PGF-2 80 Gráfica 7. Intervalo PGF-2: ovulación 80 Gráfica 8. Diferentes estatus foliculares al momento de una inyección de PGF-2 y su gran variación en el tiempo de ovulación. 83 Gráfica 9. Dinámica folicular – Ovsynch. 92 11 Pág. Gráfica 10. Distribución de ovulaciones (horas) después de la aplicación de la PGF-2 en Novillas cruzadas cebú tratadas con el protocolo ¨Ovsynch¨ y con una dosis única de prostaglandina. 97 Gráfica 11. Distribución de la ovulación en novillas holstein tratadas con SMB por 9 dias y 1mg de BE im 24h después 131 Gráfica 12. Dinamica folicular de novillas Nelore, Nelore x Angus y Angus, utilizando DP4 1,9 g, Benzoato de Estradiol y Prostaglandina. 136 12 LISTA DE TABLAS Pág. Tabla 1. Tabla 2. Tabla 3. Tabla 4. Tabla 5. Tabla 6. Tabla 7. Resultados cruce rotativo de tres razas bovinas en el norte de Córdoba. Tasa de respuesta luego de la aplicación de una inyección de Cloprostenol, según el día del ciclo en vacas lecheras en lactancia. Sincronización de Celos con PGF-2 en Receptoras Bos indicus. Tasa de preñez en el día 27 y 50 y perdidas de preñez con el uso del protocolo Ovsynch y Heatsynch en la resincronización de vacas diagnosticadas como vacías en el examen de ultrasonido en el día 27 pos I.A. Tasa de preñez en el día 27 y 50 en vacas sometidas a resincronización en diferentes fases del ciclo estral. Frecuencia de los pulsos de LH y tamaño del folículo dominante en vacas implantadas con Norgestomet por 9 días y en ausencia de un CL funcional. Datos obtenidos en el día 9 de la colocación del implante de de Norgestomet. Intervalo entre el tratamiento y el crecimiento de una nueva onda folicular en novillas tratadas con un implante de progestágeno y una inyección de 5mg de estradiol17b (E-17b) un día después. Efecto de distintas dosis de BE (Benzoato de Estradiol) combinadas con 50mg de progesterona administradas en el momento de la inserción del CIDR® en el comienzo de la próxima onda folicular en vacas Hereford Tabla 9. Preñeces logradas por IATF con tres protocolos diferentes de sincronización de celos. Tabla 10. Porcentajes de preñez y retorno de vaquillonas de 15 meses que fueron IATF y Resincronizadas con dispositivos intravaginales con progesterona recibiendo o no 0,5mg de BE (Benzoato de Estradiol) al momento de colocar los dispositivos. 86 88 89 108 109 116 117 Tabla 8. 118 119 120 13 Pág. Tabla 11. Porcentaje de preñez en vacas y novillas que recibieron un tratamiento de control del ciclo estral basado en progesterona en dos años de trabajo, según tratamiento. Tabla 12. Tasas de preñez (%) ajustadas (LSM) en novillas (Bos indicus x Bos taurus) sincronizadas com Crestar® + valerato de estradiol ó Crestar® +BE (Benzoato de estradiol). Tabla 13. Porcentaje de preñez de vacas en lactancia utilizando diferentes protocolos de sincronización con Crestar®. Tabla 14. Porcentaje de preñez en vacas y novillas tratadas con SMB más la administración de BE (Benzoato de estradiol) a las 24 horas de remoción del SMB. 121 128 129 132 Tabla 15. Preñeces logradas por servicio natural de 90 días. 134 Tabla 16. Tasa de ovulación por grupo genético. Tabla 17. Efecto del día del ciclo en la respuesta ovulatoria de vacas Holstein en lactancia al tratamiento de GnRH. Tabla 18. Porcentaje de preñez en vacas y vaquillonas tratadas con SMB mas la administarcion de EB a las 24 horas de la remoción del SMB e IATF. Tabla 19. Porcentaje de preñez en vacas para carne con cria que fueron tratadas con CIDR-B y EB ó GnRH para inducir la ovulación. 137 140 143 144 14 LISTA DE FOTOGRAFÍAS Pág. Fotografía 1. Signos del estro 61 Fotografía 2. Implantes y dispositivos utilizados para la aplicación de progestágenos y progesterona. 115 Fotografía 3. Secuencia de la administración y retiro de un implante de Crestar® (Norgestomet). 126 Fotografía 4. Ilustración de la aspiración folicular guiada por ultrasonido en bovinos. 138 REVISIÓN DE LOS PROTOCOLOS EMPLEADOS EN LA SINCRONIZACIÓN DE CELOS EN BOVINOS1 Edgar Cifuentes Sepulveda2 Sergio Palomares Garcia3 2009 RESUMEN Se revisaron los protocolos de sincronización de celos de fácil aplicación a las condiciones de nuestra ganadería tropical, consientes del valor superlativo de los índices reproductivos en la explotación ganadera cuya finalidad sea eficiencia y rentabilidad, dada la creciente demanda mundial de alimentos y el potencial que se presenta a los países del cinturón tropical, brindar una herramienta de consulta a profesionales y ganaderos, que deseen profundizar en el tema ó iniciar un programa en sus explotaciones. Se revisa la anatomía y fisiología reproductiva del bovino como base de aplicación, la detección del celo y sus consideraciones como principal limitante de la eficiencia reproductiva y de aplicación de biotecnologías. Las Prostaglandinas como protocolo base que revoluciono la reproducción, su respuesta de muy amplia variación ligada al desarrollo folicular y lúteal, la inclusión de la GnRH como inductor de ovulación da origen al Ovsynch, Heatsynch y CIDR – Synch, utilizados ampliamente y con buen éxito en lechería especializada, La sincronización del desarrollo folicular utilizando GnRH y Ablación Folicular como inductores de la onda 1.5 a 2.0 y 1.5 días post aplicación, respectivamente y la combinación estrógenos y progesterona 5.5 días para valerato de estradiol y 4.3 días para benzoato de estradiol, siendo el más utilizado y eficaz actualmente a nivel mundial. Finalmente presincronizacion de novillas pre púberes que aumenta la tasa de ciclicidad en 20% en novillas tratadas con progesterona y estrógeno y los efectos negativos de la Progesterona > 1gr en novillas Bos Indicus, por supresión de los pulsos de LH. Palabras Clave: Ganadería tropical, Bovinos, Sincronización, Biotecnologías, Eficiencia. 1 Trabajo de grado en modalidad Monografía. Director. Práctica privada Genbiotec®. 3 Estudiante último semestre, carrera de Medicina Veterinaria y Zootecnia. 2 15 INTRODUCCIÓN Desde que se conocen las hormonas que participan en la reproducción, el hombre ha pretendido intervenir, modificar o al menos controlar la actividad reproductiva. La modificación de los ciclos para que todas las hembras presenten celo en un periodo breve de tiempo pareciera la técnica complementaria ideal para solucionar las limitaciones del uso de biotecnologías. Al nivel de investigación, este objetivo ha estimulado el desarrollo de numerosas líneas de trabajo por más de tres décadas. (Ascoli et al., 1996). Es conocida la influencia que tienen los días abiertos sobre la rentabilidad económica de la actividad lechera. Los días abiertos son consecuencia de los días transcurridos entre el parto y el primer servicio y la tasa de concepción, los que se ven incrementados por el balance energético negativo que se produce en los primeros meses de lactación en las vacas lecheras. (Diaz Goncalves et al, 2002) La posibilidad de modificar el ciclo estral a través de tratamientos hormonales ha permitido diseñar una variedad de protocolos para reducir el intervalo entre el parto y el primer servicio. El control del ciclo estral puede reducir los problemas de manejo asociados a la detección de celo en vacas, especialmente en sistemas de producción actuales donde la intensificación también ha influido negativamente para que las vacas manifiesten claramente signos de estro. (Diaz Goncalves et al, 2002) 16 1. OBJETIVOS 1.1. Objetivo general Analizar los diferentes protocolos de sincronización de celos utilizados en bovinos, desde el uso de la prostaglandina F2-, hasta los desarrollados actualmente y su adaptación a nuestra ganadería tropical. 1.2. Objetivos específicos Revisar los tratamientos de sincronización de celos con prostaglandinas y sus diferentes alternativas. Analizar trabajos basados en la utilización de progesterona y progestágenos combinados con estrógenos. Documentar la utilización de la GnRH o estrógenos en la sincronización de vacas y novillas. Revisar y analizar ventajas y desventajas del uso de la sincronización de la ovulación en los bovinos. 17 2. PLANTEAMIENTO DEL PROBLEMA La aplicación de biotecnologías como superovulación, fecundación in vitro, IA1(inseminación artificial), IATF (inseminación artificial a tiempo fijo), TE2 (transferencia convencional de embriones) y en general el manejo del hato requiere de la permanente vigilancia de las hembras, para detectar el momento del ciclo estral adecuado para su aplicación, lo que conlleva mucho tiempo e inversión en dinero. Adicionalmente en muchos casos se presentan problemas referidos a la dificultad para establecer el momento exacto en que la hembra bovina está lista para la aplicación de cualquiera de estas técnicas. Además, muchas veces los síntomas de estro son de difícil detección Bos Indicus (estro corto y/ó nocturno) por lo que no puede realizarse el tratamiento en el momento adecuado, otras veces sucede que se cree que un animal ha entrado en celo y se pierde el trabajo, pues se aplica el tratamiento a un animal que no está en listo. 1 2 Inseminación Artificial. Transferencia de embriones. 18 3. JUSTIFICACIÓN La apertura de mercados, los tratados de libre comercio y la situación de la actividad ganadera, exigen la búsqueda de la máxima eficiencia en los procesos, para garantizar un retorno económico adecuado; por lo que la eficiencia reproductiva orientada al aumento de la producción debe ser el objetivo que tanto veterinarios como ganaderos debemos perseguir. En este contexto la optimización de la eficiencia reproductiva unida a programas genéticos serios y a la adopción de tecnologías como la sincronización, deben ser los factores que contribuyan a la mejora de los niveles de reproducción, la calidad genética y la rentabilidad del ganado bovino. Las biotecnologías reproductivas requieren ciertas condiciones que favorezcan su fácil y eficiente aplicación, la sincronización de celos no es la excepción. El bajo nivel tecnológico de los operarios sumado a las deficiencias en la toma de decisiones que conlleva la selección de animales en estado corporal y de ciclicidad no óptimos, tanto como una deficiente sincronización y detección de calores conlleva a que los resultados obtenidos no sean satisfactorios y que muchos ganaderos sientan temor por adoptar estas biotecnologías debido al elevado costo y los bajos resultados obtenidos. Por lo que se hace necesario identificar los factores que limitan el uso, eficiencia, y aplicación a las condiciones de trabajo propias de nuestra ganadería de los proceso de sincronización de celos y ovulaciones en bovinos. (ALBERIO, 2003), (BARUSELLI et al, 2002) (BO, 2004b). (DÍAZ GONÇALVES et al, 2002) 19 4. METODOLOGÍA El desarrollo del documento se llevó a cabo en 4 fases: 1) recopilación de información secundaria, que se obtuvo de diversas fuentes (artículos de revistas, libros, etc.), relativa al tema de investigación; 2) recolección de información primaria mediante la realización de visitas a empresas relacionadas con el tema de sincronización de celos en bovinos; 3) selección de la información obtenida en los diferentes medios consultados; y 4) análisis y realización del documento a partir de la información recolectada (ver Figura 1). Figura 1. Metodología de trabajo. Búsqueda de información secundaria. Selección y tabulación de la información Visitas CGR (biotecnología animal) VITROGEN (biotecnología animal) Análisis de la información. Realización del documento. Fuente: el autor. 20 5. IMPACTO ESPERADO Se espera que este trabajo sirva como medio de consulta para los profesionales y estudiantes de la carrera de Medicina Veterinaria y Zootecnia y carreras afines que deseen ampliar sus conocimientos sobre la sincronización del estro3 en las hembras bovinas, además de proveer información sobre el funcionamiento de su ciclo estral , e información sobre estudios realizados o colectados por diversos investigadores que han trabajado con esta biotecnología. También el productor interesado en el tema, tiene en este trabajo, una herramienta que le sirve, con el apoyo y orientación del veterinario, para la toma de decisiones sobre el protocolo más adecuado para su caso específico. 3 Celo. 21 6. MARCO TEÓRICO 6.1. ANTECEDENTES El control de ciclo sexual se realizaba empíricamente desde la más remota antigüedad. El procedimiento consistía en la introducción de machos en un rebaño de hembras, durante una estación determinada del año, logrando que se sincronizaran los celos y por tanto los partos. Este método tradicional de sincronización se conoce con la denominación de “efecto macho” (Xu et al., 1998). Los métodos empleados en la sincronización del celo son básicamente tratamientos hormonales, que han ido evolucionando simultáneamente con los avances en el conocimiento de procesos fisiológicos que acontecen en el ovario durante el ciclo sexual de las hembras. En 1966, Ericsson señaló que los ovarios de las hembras están capacitados para producir cientos de miles de oocitos durante su vida reproductiva; sin embargo, el número de crías que se obtienen de las hembras gestantes es muchísimo menor (Díaz Gonçalves, 2002). En la década de los 80 y principios de los 90, se realizaron numerosos estudios para conseguir que hembras de alta calidad genética ovularan oocitos después de un tratamiento hormonal consistente en la hiperestimulación ovárica o superovulación, para luego ser inseminadas con semen de un macho también de alta calidad genética; de esta hembra tratada con hormonas, denominada donante, se conseguían de 10 a 12 oocitos y un número igual de embriones (Pedroso et al., 1995). 22 6.2. FISIOLOGÍA REPRODUCTIVA DE LA HEMBRA BOVINA 6.2.1. Anatomía del aparato reproductor de la vaca El aparato reproductor de la vaca está conformado por órganos externos e internos y por los huesos pélvicos. Su función consiste en producir hormonas, recibir los espermatozoides, producir y liberar el óvulo, ofrecer el ambiente para que ocurra la fertilización o unión de los gametos, garantizar la gestación y expulsar la cría al momento del parto y producir hormonas. Las partes del aparato reproductor de la vaca son de afuera hacia adentro (ver figura 2) (Wattiaux, 2000): vulva vagina Útero, formado por: a. Cuello del útero o cérvix b. Cuerpo del útero c. Cuernos uterinos (dos) d. Oviductos, salpinges o trompas uterinas e. Ovarios o gónadas femeninas 23 Figura 2. Aparato reproductor de la hembra. Fuente. Wattiaux, 2000. 6.2.1.1. La vulva Apertura externa del aparato reproductor y puerta de entrada del tracto genital. Se encuentra localizada debajo del ano. Tiene tres funciones principales: dejar pasar la orina, abrirse para permitir la cópula y forma parte del canal de parto. Incluidos en la estructura vulvar están los labios y el clítoris. Los labios de la vulva están ubicados a los lados de la apertura vulvar y tienen aspecto seco y arrugado cuando la vaca no está en celo. En la medida que el animal se acerque al celo, la vulva empezará a hincharse y tomará una apariencia rojiza y húmeda. El vértice inferior de la vulva tiene un mechón de pelos, que en un momento dato puede permitir la detección de secreciones anormales como pus, sangre, etc. El clítoris, el divertículo suburetral y la terminación de la uretra, se encuentran en el vestíbulo vulvar (Dejarnette, 2007). 24 6.2.1.2. La vagina Es un canal que sirve para alojar el pene u órgano copulador del macho y comunica la vulva con el útero, tiene una consistencia músculo–membranosa. Tiene un largo entre 10 y 12,5 cm y es extensible. Termina en el orificio del cuello uterino, cuya unión es abrupta, proyectándose el útero hacia la vagina, formando un fondo de saco alrededor del orificio cervical. En la vagina queda depositado el semen eyaculado por el toro durante la monta natural (Wattiaux, 2000). Las células de la vagina y del cuello uterino secretan una sustancia mucosa que lubrica el tracto reproductivo durante el celo o momento de aceptación del toro para la monta. También sirve como pasaje del feto al nacimiento (Dejarnette, 2007). 6.2.1.3. El útero Está compuesto por cuatro partes anatómicas: Cuello o cervix. Está formado por paredes gruesas, conecta la vagina con el útero. Su estructura interna presenta pliegues circulares que forman anillos y que le dan una consistencia más dura semejando un cuello de gallina o pavo; mide unos 10 cm de largo y entre 3 y 5 cm de grosor, dimensiones que varían de acuerdo con la edad del animal (novillas o vacas). Durante el diestro y durante la gestación, el cuello del útero se encuentra cerrado, aislándolo del exterior. Durante el estro se abre o dilata para permitir la entrada de los espermatozoides y durante el parto normal para garantizar la expulsión de la cría (ver figura 3) (Dejarnette, 2007). 25 Figura 3. Cervix. Fuente. Dejarnette, 2007. Cuerpo del útero y cuernos uterinos: el cuerpo del útero se encuentra a continuación del cuello, es corto, de aproximadamente 4–5 cm, a partir de los cuales se bifurca dando origen a los cuernos uterinos (derecho e izquierdo). La pared muscular del útero es muy delgada. La consistencia de los cuernos varía de acuerdo con los niveles hormonales del animal: se ponen tensos, turgentes o tónicos durante el celo o estro y flácidos, sin tono, durante el diestro (Wattiaux, 2000). En los cuernos uterinos ocurre la anidación del embrión y transcurre la preñez, también suple de nutrientes al feto (Bavera, 2005). Oviductos, salpinges o trompas uterinas: Son la continuación de los cuernos uterinos hacia los ovarios, sirviendo para canalizar el óvulo al desprenderse éste del ovario durante la ovulación, son largas y más o menos flexuosas. El extremo libre es amplio como embudo y rodea o circunda al ovario, lo que le permite recibir al óvulo en el momento de la ovulación; esta parte o extremo se denomina "fimbria" ovárica o infundíbulo. La otra parte está unida al extremo anterior de los cuernos uterinos, propiamente dichos. Flexuosa y delgada cómo una paja, conduce al óvulo hacia el extremo anterior del cuerno uterino (ver figura 4) (Dejarnette, 2007). 26 Figura 4. Oviductos. Fuente. Dejarnette, 2007. Ovarios: En todos los animales, los ovarios son pares, es decir en número de dos, y su tamaño depende de la edad, la especie y el estadio reproductivo del animal. También se llaman gónadas femeninas y representan la parte más importante del aparato reproductivo de la hembra. En la vaca se encuentran suspendidos a derecha y a izquierda, lateralmente, sobre las trompas uterinas, miden entre 3 y 5 cm, son ovoides; su forma varía durante el ciclo estral por la aparición de estructuras como los folículos y el cuerpo lúteo o cuerpo amarillo. El desarrollo de sus componentes histológicos está bajo el control de las hormonas de la hipófisis (ver figura 5) (Dejarnette, 2007). 27 Figura 5. Ovario. Folículos Óvulo maduro Cuerpo lúteo Fuente. Manrique, 1990. El ovario de la vaca está formado de una parte cortical y una zona medular, que se diferencian una de la otra tanto por su estructura, como por sus funciones. La superficie del ovario está cubierta por la túnica albugínea que es una formación densa de tejido conjuntivo. En ella pueden localizarse dos tipos de estructuras: los folículos y los cuerpos lúteos (Bavera, 2005). Figura 6. Funciones del folículo y del cuerpo lúteo. Fuente. Bavera, 2005. 28 o Folículo. Semeja una vejiga llena de líquido; contiene al óvulo y al liberarlo se transforma en cuerpo lúteo y es responsable de la liberación de hormonas femeninas del tipo estrógeno. El folículo constituye la estructura funcional fundamental del ovario (ver figuras 6 y 7) (Bavera, 2005). o Cuerpo lúteo. Es una estructura consistente formada por acumulación de células luteales que crecen en el lugar donde ocurrió la ovulación (rompimiento del folículo). Es responsable de la liberación de la hormona progesterona. Es una estructura transitoria, importante porque mantiene la preñez a través de la secreción de progesterona (ver figuras 6 y 7) (Bavera, 2005). Figura 7. Folículo y cuerpo lúteo. Fuente. Martínez, 2005. 6.2.2. Foliculogénesis Al final de la gestación la frenética actividad de la atresia folicular hace que en apenas 20 semanas la dotación folicular del feto se haya reducido de 1 o 2 millones a sólo 300.000, que llegarán a la pubertad (Spicer y Echternkamp, 1986, citados por Fricke, 2007). La foliculogénesis es el proceso de formación de folículos maduros capaces de ovular a partir de los folículos primordiales que yacen estáticos en el ovario. Este 29 proceso puede ser dividido, de acuerdo con las características fisiológicas de cada grupo de folículos, en las siguientes etapas (ver figura 8) (Spicer y Echternkamp, 1986, citados por Fricke, 2007): a. Folículos prenatales Los folículos prenatales e dividen en: Folículos primordiales. Formados prenatalmente, no permanecen más allá de los 6 meses de vida postnatal. Están constituidos por ovocitos primarios4 rodeados de una única capa de células de la granulosa5, aplanadas, sin zona pelúcida6, rodeados por algunas células de la pregranulosa y envueltos por la membrana basal (Van Wezel y Rodgers 1996, citados por D`Occhio, 2000). Su evolución es independiente de las gonadotrofinas. Componen el stock de folículos formados durante la vida fetal que se van a desarrollar durante la vida reproductiva de la hembra. Esos folículos en estado de quiescencia7 son caracterizados por un oocito8 en la profase de la primera división meiotica (Adams, G. P., 1993). Folículo primario. Aumenta el volumen del ovocito y las células epiteliales adquieren una morfología cúbica, produciendo MPS9, que originan un halo translúcido alrededor del ovocito conocido como zona pelúcida, atravesada por procesos citoplasmáticos de las células de la granulosa, que la mantienen en contacto íntimo con el ovocito. El mecanismo determinante del paso del estadio de folículo primordial a folículo primario, en el cual las células de la granulosa crecen y se multiplican no es totalmente conocido, pero se cree que ocurre sin la 4 Los ovocitos primarios detienen su división poco antes de la ovulación, tras el pico de LH, en que se completa la primera división, con la emisión del primer corpúsculo polar, convirtiéndose el ovocito primario en ovocito secundario (Echeverrás, 2006). 5 Grupo de células que rodean al ovulo y le sirven de sustento y para metabolizar hormonas (Blanco, 1990). 6 Membrana que recubre el embrión cuando éste está en el útero y lo protege de agentes infecciosos evitando que se adhieran a él (Blanco, 1990). 7 Para asegurar la correcta progresión a través del ciclo, las células han desarrollado una serie de puntos de control que previenen la entrada en una nueva fase del ciclo hasta que hayan completado exitosamente la anterior. Los principales componentes de la maquinaria del ciclo celular son las quinasas dependientes de ciclinas (CDK), las que, cuando son activadas, permiten a las células pasar de una fase del ciclo a la siguiente (imbiomed, 2007). 8 Ovulo inmaduro. 9 Mensajeros intracelulares. 30 participación de gonadotropinas (McNatty et al., 1986, citados por Colazo et al., 2000). Folìculo secundario (120u). Proliferan las células de la granulosa formando varias capas y uniéndose entre ellas mediante GAPS10. En las áreas en que se pierde la unión entre las células de la granulosa se forman unas lagunas conocidas como cuerpos de Call–Exner11, previo a la formación del antro por su confluencia. Se diferencian e hipertrofian12 las células tecales13, las internas al final del estadio primario están separadas de la granulosa por una membrana basal impermeable y las externas formadas por comprensión del estroma circundante ante la expansión folicular (Adams, 1993). La granulosa desarrolla receptores para FSH, estrógenos y andrógenos. Con la teca el folículo adquiere un suministro sanguíneo (1 o 2 arteriolas que acaban en una red capilar adyacente a la membrana basal) y las células tecales desarrollan receptores para la LH (Ascoli et al., 1996). Estos folículos parecen abrirse paso hacia la superficie del ovario a través del cono de Strassmann (un penacho cónico que se forma en un polo de la teca) (Asprón, 2004). Los folículos estrogénicos14 también sobresalen por su habilidad para resistir la atresia y pasar a los estadios finales de maduración (Driancourt et al., 1994, citados por Adams, G. P., 1993). Estos folículos tienen el potencial de tornarse ovulatorios cuando son expuestos a un ambiente endocrino adecuado, especialmente en la presencia de un patrón pulsátil de LH con alta frecuencia (Ascoli et al., 1996). 10 Mensajeros intracelulares. Agregados de material denso que se tiñe intensamente en las células de la granulosa de los folículos ováricos en fase de maduración. También pueden verse en tumores ováricos originados en la granulosa (MedCiclopedia, 2007). 12 Hipertrofia es un crecimiento exagerado de las células. 13 Células que están en el folículo junto a las células de la granulosa e intercambian síntesis hormonal con estas. 14 Folículos en maduración que producen estrógeno. 11 31 b. Folículos antrales, terciarios o madurantes La coalescencia15 de los cuerpos de Call–Exner conduce a la formación del antro folicular16, inicialmente semilunar, desplazando a las células de la granulosa que, rodeando el ovocito, permanecen íntegras formando el cumulus oophorus17 (cúmulo prolígero). El líquido folicular, que alcanza unas 1.000, está lleno de esteroides18, péptidos19 y otras sustancias (Baird, 1978). La formación del fluido que pre–llena la cavidad antral ocurre en folículos con diámetro alrededor de 0,2 – 0,4 mm (Turnbull et al., 1977). Luego, posterior a la formación del antro, los folículos entran en un rápido periodo de crecimiento, marcado por la alta proliferación celular (granulosa y teca), en consecuencia los elevados índices mitóticos se observan en folículos entre 0,7 y 1,5 mm declinando cuando alcanzan los 2,2 mm (Echeverrás, 2006). c. Folículos preovulatorio, ovulatorios o maduros Los folículos preovulatorios, denominados también folículos estrogénicos, alcanzan un desarrollo máximo de 15 mm. El cumulus oophorus está arrinconado y constituido por la corona radiada (células de la granulosa que envuelven al ovocito), la zona pelúcida (microvillis20 en el espacio previtelino), la membrana vitelina (membrana del ovocito), la vesícula germinal (citoplasma del ovocito) y la mancha germinal (núcleo del ovocito) (Fricke, 2007). 15 Unión. Cavidad folicular amplia. 17 Son unas CAPS de células adheridas al oocito, que le sirven de protección, sustento y soporte. 18 Hormonas de síntesis grasa como por ejemplo el estrógeno. 19 Son un tipo de moléculas formadas por la unión de varios aminoácidos mediante enlaces peptídicos. Al igual que las proteínas, están presentes en la naturaleza y son responsables de un gran número de funciones, muchas de las cuales todavía no se conocen. La unión de un bajo número de aminoácidos da lugar a un péptido: oligopéptido (número de aminoácidos < 10); polipétido (número de aminoácidos > 10). Los péptidos se diferencian de las proteínas en que son más pequeños (tienen menos de diez mil o doce mil Daltons) y que las proteínas pueden estar formadas por la unión de varios polipéptidos y a veces grupos prostéticos (Blanco, 1990). 20 Vellosidades microscópicas. 16 32 El folículo dominante secreta más del 80% del estradiol y también es responsable por el 55% de la inhibina liberada en la circulación (Campbell et al., 1991). Figura 8. Proceso de desarrollo de los folículos y del cuerpo lúteo. Fuente. Tamayo et al., 2007. 6.2.3. La ovulación En los bovinos, la ovulación se presenta al azar con respecto al ovario que contiene el cuerpo lúteo previo. El desarrollo folicular se produce en ondas. Las ondas foliculares son el desarrollo armónico y simultáneo de varios folículos antrales funcionando a través de estadios integrados de reclutación, selección y dominancia folicular (Hafez, 1987; Fortune et al., 1991; Fernandez Tubino, 2003; Echeverría, 2004; 2005). Durante el ciclo folicular, se presentan generalmente dos (y a veces hasta tres) curvas de actividad folicular; la primera al inicio y la segunda a mitad del ciclo. De la primera surge un folículo dominante (menor a 5 mm de diámetro) que aumenta su tamaño (por encima de los 10 mm de diámetro) entre 33 los días 5 y 11 para luego experimentar atresia 21 (Fortune et al., 1991). En la segunda fase, surgen varios folículos productores de estrógenos y de ellos, uno es el dominante y el que controla el destino de los demás, al haber adquirido el tamaño adecuado, cumple la última fase de crecimiento y se constituye en un folículo preovulatorio (maduro), listo para ovular, que se expande ligeramente sobre la superficie del ovario para luego ser liberado (Manrique, 1990). El folículo dominante secreta más del 80% del estradiol y también es responsable por el 55% de la inhibina liberada en la circulación (Campbell et al., 1991). Los folículos preovulatorios comienzan a segregar 17-ß estradiol, que al aumentar induce el comportamiento estral. El pico de estradiol coincide con valores decrecientes de progesterona, lo que desencadena el pico de LH, luego del cual, si hay folículos maduros, se produce la ovulación (O´Shea et al., 1978). Una vez el folículo se rompe y libera el óvulo, la cavidad se retrae y comienza a llenarse gradualmente de células luteales, que conformarán el cuerpo lúteo. Este cuerpo lúteo alcanza su madurez a los 7 días y se mantiene activo por 8 a 9 días (total: 15 a 17 días), para luego involucionar quedando como pequeñas cicatrices conocidas como cuerpo albicante (Hafez, 1987; Echeverría, 2004; 2005). 21 Atresia es la pérdida de folículos de un ovario que no han alcanzado el estado de folículo preovulatorio. Se previene con la presencia de gonadotropinas. Casi todas las atresias son congénitas. 34 Figura 9. Maduración del folículo hasta la ovulación y formación del cuerpo lúteo. A: óvulo; D: folículo preovulatorio; E: eclosión; F: cuerpo rojo. Fuente. Bavera, 2005. La ovulación ocurre entre 10 y 11 h después de finalizado el estro (o 30 h después de comenzado el estro), salvo en la primera ovulación post parto que se produce sin signos aparentes de celo (Hafez, 1987). Figura 10. Ovulación. Fuente. Bavera, 2005 y Dejarnette, 2007. 35 6.2.4. El cuerpo lúteo El CL es una glándula endocrina temporal que se forma, después de la ovulación, a partir de los tejidos que hacían parte de folículo. Así, el CL puede ser visto como la etapa terminal del desarrollo folicular (Ver figura 11). El CL presenta áreas de marcada ecogenicidad22 dentro del estroma ovárico23 (Singh et al., 1997). Muchos cuerpos lúteos aparecen como masas de tejido sólido, pero también pueden contener cavidades con fluidos. En base a exámenes de ultrasonido en vaquillas, el 79% de los CL de aspecto normal contienen cavidades en algunos casos <2 y en otros >10 mm de diámetro en algún momento del ciclo estral e inicio de la preñez (Kastelic et al., 1990). Las características ultrasonográficas24 del CL, como diámetro transversal, área lútea y ecogenicidad han sido relacionadas con la estructura y funcionamiento luteal (Battocchio et al., 1999; Kastelic et al., 1990; Singh et al., 1997). A pesar de que el ultrasonido es más preciso que la palpación rectal para evaluar los folículos, es difícil distinguir entre un CL en desarrollo y uno en regresión usando cualquiera de las dos técnicas (Pieterse et al., 1990). 6.2.4.1. Luteolisis El CL tiene un ciclo de maduración y regresión similar a la del folículo. En la cavidad dejada por el folículo roto se forma una estructura similar a un coágulo, el cuerpo hemorrágico, que se transforma en CL hacia el día 5 del ciclo (día 0 = estro). El CL es totalmente funcional del día 5 al 15 del ciclo y a partir de este momento, si la vaca no resulta preñada, empieza a involucionar dejando de secretar progesterona, mientras se produce el desarrollo del folículo que ovulará 22 Áreas que aparecen de coloración blanca en la imagen del ecógrafo. Parte de tejido que conforma el ovario en su conjunto. 24 Detectadas mediante la realización de ultrasonido. 23 36 tras el siguiente estro. Al atrofiarse el CL, se convierte en cuerpo albicante25 y permanece visible en el ovario durante varios ciclos subsecuentes (Asprón, 2004). La regresión del CL se debe a la presencia de un factor luteolítico como la PGF2, que es producida por el miometrio durante todo el ciclo estral y alcanza su concentración máxima en el momento de la lúteolisis26 de cada especie. Durante ese periodo la secreción de PGF-2 es pulsátil en razón de 3 a 4 pulsos por día. Se ha establecido que son necesarios cerca de 5 pulsos para que ocurra la lúteolisis completa. Los mecanismos de lúteolisis no están totalmente claros pero hay evidencia de que la involución estructural del cuerpo lúteo es mediada por apoptosis27 (Gaytan et al., 1998). La lúteolisis puede ser bloqueada naturalmente por la acción de una proteína llamada trofoblastina (también llamada interferón t), que es producida durante el periodo próximo a la implantación del embrión, en los días 15 a 25 posteriores a la ovulación y fecundación (Bavera, 2005). Figura 11. Proceso de luteolisis. Fuente. Bavera, 2005. 25 Pequeñas cicatrices que quedan producto de la regresión del cuerpo lúteo. Causa la regresión funcional y morfológica del cuerpo lúteo. 27 Conjunto de reacciones bioquímicas que ocurren en las células de un organismo pluricelular encaminadas a producir la muerte de la célula de manera controlada. 26 37 6.2.5. Bases fisiológicas de la reproducción La capacidad reproductiva de las hembras bovinas depende de cómo se llevan a cabo eventos fisiológicos como: secreción hormonal, fertilización, implantación, formación del embrión, preñez y parto. La fertilidad puede ser interrumpida en cualquiera de los estadios de reproducción mencionados, los cuales son controlados fisiológicamente por el hipotálamo, la hipófisis, los ovarios, la glándula adrenal y el tracto reproductivo (Callejas, 1995). La regulación de la actividad sexual está representada en el organismo por el sistema hipotálamo-hipófisis-ovárico (ver esquema 1). El hipotálamo y la hipófisis anterior en conjunto con los órganos reproductivos aseguran el ritmo de reproducción interrelacionado hipotálamo, hipófisis, ovario y hormonas LH, FSH y esteroides ováricos, para conformar la esencia de la maduración folicular, ovulación, implantación y mantenimiento de la gestación. Todo esto está claramente influenciado por factores hereditarios, nutricionales y ambientales que pueden modificar el ciclo en cualquier animal (Caicedo et al., 2003). Por su naturaleza, el estudio de la reproducción requiere un entendimiento muy claro y profundo de los principios neuroendocrinos tanto desde el punto de vista evolutivo como ecológico y metabólico. El conocimiento de esos procesos e interacciones representa un punto focal sobre el cual el hombre puede influir y de esa manera controlar diferentes aspectos reproductivos (Caicedo et al., 2003). Durante la pubertad se adquieren la capacidad de producción de gametas fértiles y el comportamiento reproductivo. Este es el momento en el cual los animales liberan por primera vez sus células germinales maduras, es decir, es el comienzo de la vida reproductiva (Callejas, 1995). La pubertad representa el tiempo de transición entre el estado de inmadurez y la madurez sexual, donde se resaltan varios caracteres como las conductas de territorialidad, apareamiento y cuidado de las crías entre otras. Es menester que para que esto ocurra el animal haya adquirido una estatura y pesos determinados, 38 por lo que, la raza tiene un efecto significativo sobre el momento de aparición del primer estro, tanto como el ambiente, fotoperíodo y estado nutricional (Cunningham, 1997). La edad del primer estro en novillas varía considerablemente, pero la edad promedio en novillas con estado nutricional bueno, fluctúa entre 10 y 12 meses para razas lecheras y 14 y 15 meses para razas de carne (Cunningham, 1997; Ascoli et al., 1996; De La Sota et al., 2002; Hafez, 1987). Esquema 1. Relaciones del sistema hipotálamo–hipófisis–ovárico. Fuente. Callejas, 1995. 39 Hipotálamo Forma la base del cerebro y se encuentra localizado sobre la glándula pituitaria. Sus neuronas producen la hormona liberadora de gonadotrofina o GnRH. La GnRH, en la eminencia media, se difunde a los capilares del sistema porta hipofisiario28 y de aquí a las células de la adenohipófisis estimulándolas para que sintetice y secrete las hormonas hipofisiarias: folículo-estimulante (FSH) y luteinizante (LH) (Sintex, 2005). Histológicamente, el hipotálamo está compuesto de núcleos, células dispersas y axones, los cuales conectan una célula con la otra. Pero el elemento principal del hipotálamo, desde el punto de vista reproductivo, son las células neurosecretoras, las cuales se encuentran dispersas en núcleos. Estas parecen células endocrinas, debido a la presencia de gránulos secretores compuestos por hormonas verdaderas, las cuales emigran a los axones para ser vertidas a las terminaciones nerviosas (Martínez, 2005). Glándula pituitaria o Hipófisis Es una pequeña glándula localizada en la base del cerebro y consta de dos lóbulos separados uno anterior o adenohipófisis y uno posterior o neurohipófisis. El lóbulo anterior secreta tres hormonas primarias: la folículo estimulante (FSH)29, la luteinizante (LH)30 y la prolactina (PRL), que son conocidas como gonadotropinas porque estimulan las gónadas (ovarios) El papel de la hipófisis en el control reproductivo se ilustra muy bien en el ciclo del ovario (figura 16) (Ascoli et al., 1996). 28 Sistema que transporta hormonas del hipotálamo a la hipófisis mediante unos vasos sanguíneos especiales para esto (Martínez, 2005). 29 Es la responsable del proceso de esteroideogénesis ovárica –producción de estrógeno y progesterona en el ovario–, del crecimiento y la maduración folicular (Sintex, 2005). 30 interviene en el proceso de esteroideogénesis ovárica, ovulación, formación y mantenimiento del cuerpo lúteo (Sintex, 2005). 40 Estas dos hormonas son secretadas a la circulación en forma de pulsos y son reguladas por dos sistemas: el tónico y el cíclico. El sistema tónico produce el nivel basal circulante, siempre presente, de hormonas hipofisiarias las cuales promueven el desarrollo de los elementos germinales y endócrinos de las gónadas. El sistema cíclico opera más agudamente, siendo evidente por solo 12 a 24 horas en cada uno de los ciclos reproductivos de la hembra. Tiene por función primaria causar la ovulación (Sintex, 2005). El lóbulo posterior de la glándula pituitaria secreta una hormona importante en la reproducción: la Oxitocina, que estimula la contracción suave del músculo en el útero y el oviducto. Esto ayuda al transporte del esperma y del óvulo por el oviducto, como también a la expulsión del feto en el momento del parto. Además, estimula las células musculares de la glándula mamaria para ayudar a que la leche descienda (Ascoli et al., 1996). El lóbulo posterior es estimulado para secretar sus productos a través de impulsos nerviosos. El lóbulo anterior secreta sus productos como respuesta a estimulación hormonal recibida a través del torrente sanguíneo (hipotálamo) (Martínez, 2005). Ovario Es el órgano esencial de la reproducción en la hembra y tiene dos funciones principales: la endocrina, a través de la cual se elaboran las hormonas y la exocrina (citogénica), por su producción de óvulos a través de los folículos. Entre las hormonas que producen los ovarios podemos citar a los estrógenos, la progesterona y la inhibina (adaptado de Manrique, 1990). 41 Figura 12. Estructura y localización del hipotálamo y la glándula pituitaria. Fuente. Martínez, 2005. 6.2.5.1. Regulación endocrina: las hormonas de la reproducción La reproducción de la hembra está regulada por numerosas hormonas, secretadas por glándulas especializadas (endocrinas), que generalmente pasan a la sangre o linfa que las transporta a partes específicas del animal (órgano "blanco") donde realizan su función (Asprón, 2004). El cerebro regula la secreción de las glándulas endocrinas a través de las hormonas, sustancias químicas producidas por tejidos específicos, que se vierten directamente en el torrente circulatorio en respuesta a determinados estímulos provocando una respuesta funcional específica, la cual puede manifestarse tanto en forma inmediata como mediata. Como resultado de dicho proceso de transferencia, la célula receptora de dicho estímulo, modifica su comportamiento a través de cambios en sus esquemas metabólicos Los tipos de acciones promovidas por las hormonas pueden ser modificaciones en la permeabilidad de 42 las membranas o en los mecanismos de transporte; modificación de la síntesis proteica y/o modificación de la actividad enzimática celular (Calandra & De Nicola, 1985). De acuerdo con su estructura química las hormonas pueden agruparse en esteroides, aminas31 y aminoácidos, proteínas, derivados de ácidos grasos y péptidos (Willis & Smith, 1994; Dannies, 1999). En cambio, si se tiene en cuenta el criterio funcional, se las considera neurosecretoras, tróficas, glandulares, tisulares o sustancias mediadoras (Echeverría, 2005). Según la velocidad de acción y la duración de la respuesta las hormonas pueden clasificarse como de respuesta rápida y corta duración o de respuesta lenta y persistente (Blanco, 1990; Calandra & De Nicola, 1985). Por último, podemos considerar otra clasificación de acuerdo con la naturaleza de la respuesta metabólica que producen y en tal caso consideramos aquellas de carácter catabólico y anabólico cuyos efectos implicarían un ascenso o descenso de los niveles de AMP32 cíclico intracelular (Calandra & De Nicola, 1985). Las hormonas en general, son eliminadas de la circulación por mecanismos variados: las proteínas y polipéptidos son catabolizados a sus aminoácidos constitutivos principales en el hígado, el riñón y los diferentes órganos efectores; los esteroides son inactivados en el hígado, el riñón u otros tejidos, o, por su naturaleza, pueden ser secuestrados en tejido adiposo; las prostaglandinas son rápidamente inactivadas por los órganos efectores o removidas de la circulación por el pulmón y el hígado (Echeverría, 2004; 2005). En general, la secreción es un proceso que no mantiene una velocidad uniforme y sostenida y puede ser generada tanto en respuesta a un estímulo interno como a uno del medio o puede estar sujeta a variaciones cíclicas como en el caso de las hormonas gonadotróficas, ováricas o las esteroides en general (Blanco, 1990). Las hormonas necesitan ser secretadas desde las células donde son sintetizadas para ejercer sus acciones biológicas, aunque también pueden presentar una 31 Partes químicas de las proteínas, que al igual que los péptidos forman compuestos orgánicos en este caso hormonas (Blanco, 1990). 32 Mensajero intracelular para reconocimiento hormonal. 43 actividad parácrina33 transnacionales, las y autócrina34. cuales ocurren Pueden en sufrir modificaciones determinados post compartimientos subcelulares y son llevadas a cabo en una estricta sucesión de eventos intracelulares, que dan origen a productos biológicamente activos. La biosíntesis de prohormonas es mediada por enzimas endoproteolíticas y son modificadas enzimáticamente a lo largo del proceso de síntesis (Perone & Castro, 1997; Echeverría, 2004). Los controles por retroalimentación están dados por el sistema de retroalimentación negativa, en el cual el aumento de la concentración de las hormonas da lugar a una menor producción de las mismas, usualmente a través de una interacción con el hipotálamo o con la hipófisis (Cunningham, 1997). Una de las características más sobresalientes de las hormonas, es su especificidad. Esto se debe a la presencia de receptores para las mismas. La regulación hormonal de la actividad celular muestra propiedades muy singulares: especificidad, potencia, selectividad y rapidez. Las propiedades que pueden determinar la capacidad de una hormona para interactuar con un receptor son varias: tamaño, composición química, cargas eléctricas, presencia de grupos funcionales críticos, cambios conformacionales, etc. (Blanco, 1990; Calandra & De Nicola, 1985; Huanca, 2001). Estos receptores pueden ubicarse intracelularmente como es el caso de los receptores para las hormonas esteroides y tiroides o estar situados en la membrana y generar respuestas tipo cascada como sería el caso de la adrenalina y la GnRH entre otras (Rang & Dale, 1992; Gether & Kobilka 1998). Una de las características más comunes de los receptores hormonales es su escaso número por célula, el cual puede experimentar variaciones significativas, según sea el estado metabólico de la célula o su estimulación hormonal previa (Echeverrás, 2006). 33 34 Secreción de hormonas, a partir de una célula, que actúan en otro tipo de célula. Secreción que actúa en la misma célula que la produce. 44 Según Hafez (1987), las hormonas que intervienen en la reproducción se dividen en: Primarias: forman parte directa de varios aspectos de la reproducción como la espermatogénesis, ovulación, comportamiento sexual y materno, fecundación, implantación y mantenimiento de la gestación, parto y lactancia. Metabólicas: comprende aquellas hormonas necesarias para el bienestar general y el mantenimiento en buenas condiciones de estado metabólico del animal, lo que permitirá que ocurra la reproducción. A continuación se hace una descripción de las hormonas que participan en el proceso reproductivo y en la producción y finalización del estro. Hormona Liberadora de Gonadotrofinas (GnRH) Las susutancias del hipotálamo que controlan la liberación de las hormonas hipofisiarias fueron inicialmente factores de liberación. A medida que se conocieron sus estructuras químicas, se las ha llamado hormonas liberadoras y su abreviatura genérica es RH. La GnRH es Segregada por el Hipotálamo, es un péptido pequeño de diez bases de aminoácidos, con un peso molecular de 1.183 daltons que está encargado de estimular a la glándula hipófisis para que secrete las hormonas gonodatrofinas FSH y LH. Juega un importante papel en el proestro. Durante el ciclo estral la GnRH se secreta en pulsos cuya ferecuencia cambia según el estadio del ciclo estral y esta en relación a los cambios de las concentraciones de los esteroides ovaricos. Se han sintetizado dos tipos básicos de análogos de GnRH. Los análogos antagonistas parecen unirse al receptor en la hipófisis, pero no induce la liberación de LH o FSH, y bloquean la acción de la hormona natural. Los análogos estimuladores inducen laliberacion de Lh y FSH, al igual que la GnRH natural. La razón del aumento en la actividad biológica de los agonistas GnRH se debe a su capacidad de permanecer unidos al receptor en la hipófisis por mas tiempo que la hormona natural (Navil, 2007). 45 Oxitocina Es una hormona peptidica que se sintetiza en el hipotalamo en el nucleo optico y paraventricular se sintetiza junto con proteinas transportadosras llamadas neurofisisnas y se almacena en la neurohipófisis, una vez liberada a la circulación tinen una vida media muy corta (entre 5 y 10 minutos) ya que es degradada muy rapidamente `por las neuropeptinas del higado y riñon Esta hormona tiene varias funciones como son la contracción de la musculatura uterina y modificacion de los umbrales de excitabilidad del miometrio, intervenir en el mecanismo del parto, colaborando con la expulsión del feto y contracción del utero para asegurar la hemostasia, estimulacion de las celulas mioepiteliales de los alveolos mamarios papa la bajada de la leche, incrementa la frecuencia de contracciones del oviducto interviniendo en el transporte espermático, en la vaca , oveja y el ser humano se produce oxitocina en el CL e interviniendo activamente en el proceso de luteólisis, (Sintex, 2005). Hormonas gonadotrópicas o gonadotropinas Son glicoproteínas producidas y liberadas por la hipófisis anterior, de donde se vierten al torrente sanguíneo, para así alcanzar su órgano objetivo: las gónadas (ovarios). Favorecen la maduración gonadal y la esteroidogénesis, capacitando al organismo para que se pueda reproducir. La síntesis y la liberación de las hormonas gonadotrópicas hipofisiarias, son reguladas por la hormona hipotalámica liberadora de gonadotrofinas (GnRH), misma que provee el enlace entre los sistemas nervioso y endocrino (Prieto–Gómez et al., 2002). Desde el aislamiento de este decapéptido y la identificación de su estructura en 1971, su estudio ha contribuido a entender los mecanismos y el patrón de liberación de las hormonas gonadotrópicas (Peters et al., 1994). 46 Hormona Luteinisante (LH). Hormona producida en la hipófisis. Es una glicoproteína compuesta de una subunidad a y otra b con un peso molecular de 30.000 daltons y una vida media de 30 minutos.los niveles tónicos o basales de LH actúan con la FSH para inducir la secreción de estrógenos de los folículos ováricos. Las células de las teca interna, contiene receptores de LH y mediante su estimulo producen andrógenos, que pasan a las células de la granulosa, donde mediante la acción de la FSH induce aromatización de estos andrógenos para transformarse en estrógenos que son liberadosal antro folicular y de allí a la circulación general. La LH es también responsablede inducir una serie de reacciones enzimáticas que terminan con la ruptura de la pared folicular y la ovulación y por efecto da origen al cuerpo lúteo, mismo que empieza a secretar progesterona, hormona indispensable en la gestacion (Asprón, 2004). Aumenta la síntesis de progesterona a partir del cuerpo lúteo preparando al útero para la implantación del embrión disminuyendo el tono miometrial, aumentando la viscosidad del mucus y cerrando el canal cervical. Además del pico preovulatorio, inducirá la activación del oocito para que continue la meiosis. (Peters et al., 1994). Hormona Folículo estimulante (FSH). Acrónimo del inglés (Follicle–Stimulating Hormone). Hormona gonadotrópica, de naturaleza glicoprotéica producida por el lóbulo anterior de la glándula hipófisis, que se encuentra en el cerebro. Esta compuesta por dos subunidades diferentes denominadas alfa y beta, el peso molecular es de aproximadamente 32.000 daltons,la vida media de esta hoemona va de 2 a 5 horas. Esta hormona en la hembra estimula el crecimiento, desarrollo y función del folículo en los ovarios para que, de esta manera, el óvulo o huevo se encuentre disponible para la fertilización. La FSH, además junto con la LH estimula la síntesis de estradiol e inhibina en las celulsa tecales de los folículos en desarrollo, que a su vez actuaran en conjunto suprimiendo la liberación de FSH por la hipófisis. En las mujeres después de la menopausia, la secreción de FSH aumenta notablemente pasando por filtración renal y llegando a la orina con 47 elnombre de gonadotrofina menopáusica humana (hMG), que es cormercializada como hormona para inducir la superovulacion enmujeres y animales (pergonal®, serono). En la actualidad se usan mas comúnmente extractos de pituitaria de cerdo (Folltropin®, vetrepharm o Pluset®, calier) o de oveja (ovagen®, ICP), que contiene altas cantidades de FSH para la superovulacion de bovinos. (Peters et al., 1994). Hormonas Gonadales Algunas de las hormonas producidas en los ovarios son: los estrógenos y la progesterona, clasificadas ambas como esteroides. Una definición simple de la función de estas hormonas es: los estrógenos estimulan actividad en el sistema reproductivo, mientras que la progesterona inhibe dicha actividad (Reeves, 1989). Estrógenos. Alcanzan su mayor nivel en el estro. Los estrógenos, hormonas esteroideas, son producidos por el folículo ovárico y tienen acciones sobre los distintos órganos en los que intervienen como son las trompas de Falopio, el útero, la vagina, la vulva, el sistema nervioso central –en el cual estimulan la conducta de celo– y el hipotálamo donde ejercen un "feed back" negativo sobre el centro tónico35 y positivo sobre el centro cíclico36 (Sintex, 2005). Los estrógenos son producidos por las células de la pared del folículo en crecimiento en el ovario bajo el control de la LH. El folículo preovulatorio, justamente antes de la ruptura, produce grandes cantidades de estrógenos. El elevado nivel de estrógenos hace que la vaca muestre signos de estro (calor) (Echeverrás, 2006). Las células de la Teca y Granulosa encontradas dentro y alrededor del folículo en crecimiento actúan en conjunto para la producción de estrógenos. Las células de 35 36 Localizado en el núcleo arcuato del Hipotálamo, actúa durante todo el ciclo (Sintex, 2005). Núcleo de tipo pulsátil localizado en el Hipotálamo anterior, regula la ovulación (Sintex, 2005). 48 la teca producen andrógenos que se difunden dentro de las células de la granulosa donde son convertidos en estrógenos. Después de la ruptura, las células de la granulosa se convierten en células luteales grandes, formando las principales células de secreción de progesterona del cuerpo lúteo (Martínez, 2005). Los estrógenos tienen varios efectos: 1) desarrollo y función de los órganos sexuales secundarios, 2) receptividad sexual o conducta estral, 3) ritmo y tipo de crecimiento, especialmente depósito de grasa, y 4) preparación de la vaquilla prepúber y la vaca posparto para el inicio de la actividad sexual cíclica (Asprón, 2004). Además dilatan el cuello del útero, favorecen la contractilidad de la musculatura uterina y generan cambios en la viscosidad del moco cervical, base para la detección del estro (Echeverrás, 2006). El estrógeno de primera importancia en la hembra es el estradiol- 17b, pequeñas cantidades de estrona y estriol son también secretados por diferentes partes del ovario (Echeverrás, 2006). Progesterona. Hormona esteroidea, sintetizada por el cuerpo lúteo, la placenta y las glándulas adrenales su secreción es principalmente estimulada por acción de la LH aunque también se ha visto que participan la FSH, factores de crecimiento similares a la insulina (IGF-1) y las prostaglandinas E2 e I2. Se produce en mayor cantidad durante el metaestro y el diestro y se sintetiza durante todo el período de gestación. Esta hormona prepara el útero para el implante del embrión y para mantener la gestación inhibiendo las contracciones y promoviendo el desarrollo glandular del endometrio, estimulando el engrosamiento en la pared uterina y el desarrollo de glándulas y músculos uterinos. Los efectos de la progesterona se observan después que el tejido blanco ha estado expuesto durante cierto tiempo a la estimulación de los estrógenos (Sintex, 2005). 49 La P4 suprime el desarrollo completo de los folículos y la secreción de estrógenos. Niveles altos de esta hormona y bajos de estrógenos evitan que la vaca presente estro (Asprón 2004). Las funciones de estrógenos y progesterona no siempre son antagónicas y en algunos procesos actúan juntas. El radio de concentración estrógenos/ progesterona determina el inicio y duración de la conducta estral. El desarrollo uterino es iniciado por los estrógenos y completado por la progesterona. Los estrógenos causan contracción uterina cerca del momento del estro y la ovulación para ayudar al transporte espermático. La progesterona elimina la contracción uterina que podría afectar la preñez, hace que se forme tejido secretor (alveolos) de la glandula mamaria. Lo que hace evidente la importancia de esta hormona es la regulación del cilo estral. (Asprón, 2004). Otras hormonas en la reproduccion Prostaglandina F2α Producida por el miometrio, interviene en la regulación neuroendócrina del ciclo estral mediante su efecto luteolítico (de regresión del cuerpo lúteo) y la liberación de oxitocina, cumple además funciones de regulación de los mecanismos de ovulación, susu concentraciones sanguineas son bajas pero se elevanen ciertas condiciones como en el parto. Las prostaglandinas actúan como hormonas autocrinas y paracrinas (Salverson et al., 2002). Las prostaglandinas se pueden sintetizar a partir del ácido araquidónico37 por la acción de diferentes enzimas38 como cicloxigenasas, lipoxigenasas, el citocromo 37 El ácido araquidónico (AA) es un ácido graso esencial, omega-6, formado por una cadena de 20 carbonos con cuatro dobles enlaces (ácido eicosatetraenoico) en las posiciones 5, 8, 11 y 14, por esto es el ácido 20:4(5,8,11,14). Su fórmula química estructural es: CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH= CH(CH2)3COOH (Tamayo et al., 2007). La presencia de dobles enlaces ofrece a la molécula varios sitios potenciales de oxidación enzimática y química, que junto con el posterior reordenamiento, permite la formación de diferentes lípidos con distintas 50 P-450, peroxidasas, etc. El mecanismo durante el cual la PGF-2ª llega del endometrio al ovario en los rumiantes es único, ya que al ser liposoluble difunde de las paredes de la vena utero-ovarica a laarteria ovarica (Adams H. R., 2001). Figura 13. Estructura química de la prostaglandina F2α (PGF-2α). Fuente. Adams H. R., 2001. Reguladores peptídicos Son producidos en la teca y en la granulosa. Tienen como fin potenciar los resultados de las gonadotropinas en la granulosa del folículo prenatal, son glicoproteínas con acción auto, para y endocrina. Estos factores reguladores son (Martínez, 2005): Inhibina. Hormona proteica, coadyuvante, producida por las células de sertoli en el macho y las de la granulosa en la hembra, interviene en el mecanismo de actividades biológicas. El ácido araquidónico está presente en las membranas de las células corporales, y es el precursor en la producción de eicosanoides. Es uno de los ácidos grasos esenciales requeridos por la mayoría de los mamíferos. Las dos principales rutas oxidativas enzimáticas del AA son: 1) vía de la lipoxigenasa (LOX): cuyos productos principales son los leucotrienos, HETE, HPETE y las lipoxinas. 2) vía de la ciclooxigenasa (COX): como productos principales son las prostaglandinas y el tromboxano. Estas dos enzimas no actúan sobre el AA esterificado, por lo que primero debe ser liberado en forma de ácido graso libre de los fosfolípidos de membrana por fosfolipasas (Alberio, 2003). 38 Las enzimas son proteínas que catalizan reacciones químicas. En estas reacciones, las moléculas sobre las que actúa la enzima en el comienzo del proceso son llamadas sustratos, y estas los convierten en diferentes moléculas (los productos). Casi todos los procesos en las células necesitan enzimas para que ocurran en tasas significativas. Como todos los catalizadores, las enzimas funcionan disminuyendo la energía de activación (ΔG‡) para una reacción, así se acelera dramáticamente la tasa de la reacción. La gran mayoría de las reacciones de las enzimas son millones de veces más rápidas que las reacciones no catalizadas. Al igual que ocurre con los catalizadores, las enzimas no son consumidas por las reacciones que ellas catalizan, ni alteran su equilibrio químico. Sin embargo, las enzimas difieren de otros catalizadores por ser más específicas. La actividad de las enzimas puede ser afectada por otras moléculas, llamados inhibidoras que disminuyen su actividad (Adams, H. R., 2001). 51 regulación de la secreción de FSH, ejerciendo un feedback negativo a nivel hipofisiario sobre el estradiol, lo que conduce a la disminución en la secreción de FSH. Al final de la fase lútea disminuyen las cantidades de estradiol–inhibina y nuevamente aumenta la FSH para comenzar el reclutamiento de folículos para los ciclos venideros (Sintex, 2005). Activina. Coadyuvante de la acción de la FSH y antagonista natural de la inhibina, tiene una acción autocrina bien definida y estimulante sobre el proceso de aromatización (Sintex, 2005). Cuadro 1. Algunas Hormonas importantes en la reproducción de la hembra bovina. Hormonas Puntos de interés Estrógenos Principal hormona femenina, responsable de las características sexuales secundarias; signos de comportamiento de celo, cambios fisiológicos en el tracto reproductivo de la hembra, desarrollo de la glándula mamaria. Progestágenos Oxitocina Prolactina Prostaglandina F2α (PGF-2α) Fuente. Martínez, 2005. Liberados por el cuerpo lúteo, causan inhibición del comportamiento sexual, mantenimiento de la preñez y desarrollo de la glándula mamaria Producida en la pituitaria posterior, responsable de las contracciones del musculo liso del endometrio en el útero y de la eyección de leche por las células de la ubre. Producida en la pituitaria anterior, su responsabilidad primaria es estimular la síntesis de leche en la glándula mamaria. Liberada por el endometrio cuando no se ha establecido preñez, causa lisis y regresión del cuerpo lúteo en el ovario para reiniciar el ciclo estral. 52 6.3. LA DETECCIÓN DEL ESTRO El ciclo estral en la vaca se puede definir como el período que hay entre un celo y otro, se caracteriza por la combinación de una serie de acontecimientos fisiológicos que comienzan en un período estral y terminan en el siguiente. La fase luteal está caracterizada por ausencia de manifestaciones típicas de comportamiento sexual, presencia de cuerpo lúteo activo y altos tenores de progesterona plasmática circulantes. La fase folicular comienza con el proestro; en este momento ocurre un aumento del estrógeno del folículo preovulatorio que induce un período de receptividad o estro esta fase es finalizada cerca de la ovulación 35 a 45 h después. La fase luteal abarca el diestro y finaliza cerca de la fase de luteólisis. (ver figura 14) (Echeverría, 2004, 2005; Mc Craken et al., 1999; Niswender et al., 2000). Figura 14. Fases del ciclo estral. Día 0 Día 20 Día 1 FASE FOLICULAR Día 19 Día 4 P4 P2 FASE LUTEAL Día 18 Día 16 Día 11 Día 13 Fuente. Dejarnette, 2007. Día 7 53 Cada ciclo puede estar clásicamente dividido en una fase luteal y en una fase folicular. Su duración promedio es de 21 días, con variaciones de 18 a 24 días y tendencia a ser más corto en novillas. y que se mantiene así desde la pubertad hasta los 10 o 15 años, cuando comienzan los signos de senilidad. El ciclo estral se divide en 4 etapas o estadios, que se muestran en el esquema 2 (Martínez, 2005). 54 Gráfica 1. Concentraciones relativas de hormonas en cada fase del ciclo estral con el respectivo folículo y desarrollo del cuerpo lúteo. Fuente. Martínez, 2005. 55 Esquema 2. Etapas del ciclo estral bovino. ESTRO Día 0 Presencia folículo preovulatorio Pico máximo de estrogenos Después de 12-18 horas PROESTRO METAESTRO Días 17-21 Días 1-4 Declina la Progesterona Ocurre la ovulación Se incrementan los Estrógenos El CL comienza su desarrollo en el lugar donde se produjo la ruptura del folíclo. Próxima onda de desarrollo de folículos DIESTRO Días 5-16 CL en pleno funcionamiento Pico máximo de progesterona engrosamiento del Endometrio Fuente: Martínez, 2005. Etapa preovulatoria (Estro o celo). La palabra estro proviene del latín estros (deseo imperioso). Es un período de aceptación para el apareamiento (receptividad sexual) que normalmente se presenta en novillas pubescentes y vacas no preñadas. Consiste en el cambio rítmico de la conducta sexual surgido durante la pubertad en las novillas. Durante este período la vaca acepta la monta. Ocurre cada 21 días en promedio, aunque este intervalo puede variar normalmente entre 18 y 24 días (Mellisho, 2006). Diferentes autores estiman una duración promedio de 10 a 16 h, con un rango de 3 a 28 h, dependiendo de la raza, la edad, los factores ambientales, sociales, individuales, etc. Por ejemplo: 1) las razas índicas presentan celos más cortos que las europeas; 2) las novillas tienen generalmente celos de 56 menor duración que las vacas; 3) el primer celo pospuberal o pospartal es más breve; 4) en condiciones de estrés el celo dura menos, etc (De La Sota, 2002). Asimismo vale la pena mencionar que un 25 a 30% de los celos dura menos de 8 horas. Por otra parte, algunos celos son "interrumpidos", es decir que el período de receptividad se interrumpe por unas horas en que la hembra no acepta la monta, lo que parece obedecer a un descanso que se toma el animal, apartándose del GSA39 (Mellizo, 2006). Etapa ovulatoria (Metaestro). Día siguiente del celo. Cuando se produce la ovulación y son liberados los óvulos o gametos femeninos contenidos en los folículos (Barros, 2000). Etapa luteal (Diestro). Este período es responsabilidad de la hormona progesterona –liberada por el cuerpo lúteo–, que mantiene al animal fuera del celo y es la responsable de mantener la gestación o preñez. El útero envía, el día 16 o 17 del ciclo, una señal al ovario para que destruya el cuerpo lúteo, cayendo los niveles de progesterona e iniciándose nuevamente el proestro, en caso de que la hembra no hubiese gestado, La hormona responsable de destruir el cuerpo lúteo es la prostaglandina F2, que es liberada por el útero, excepto cuando ocurre la gestación y se mantiene el cuerpo lúteo de gestación (Barros, 2000). Etapa folicular o de regresión lutea (Proestro). Antes del celo. Se presenta si el animal no ha quedado preñado. Durante este período se da el crecimiento de los folículos ováricos, los cuales liberan la hormona femenina (estrógeno) y son responsables de la aparición del nuevo celo (Martínez, 2005). 39 Grupo sexualmente activo. 57 Figura 15. Días del ciclo estral Fuente. Martínez, 2005. Durante el ciclo estral suceden una cadena de eventos que se repiten. En la vaca el proceso de la foliculogénesis (crecimiento y maduración folicular), tiene inicio con la formación de folículos durante la vida fetal, o sea al nacimiento la ternera ya tiene determinado él numero de folículos primordiales en sus gónadas, la mayoría de esos folículos durante su crecimiento van a degenerar en un proceso conocido como atresia folicular, apenas una minoría va a completar su maduración y a ovular (De La Sota, 2002). 58 Figura 16. El ovario de la vaca y su dinámica durante el ciclo estral. Graafian Follicle Folículo primario Óvulo Ovulación Terciario (Graafian) Foliculo (temprano) Ruptura del folículo (Forms from ovulated follicle) Oocito primario Cuerpo hemorrágico Regresión del Cuerpo Lúteo Cuerpo lúteo (Produce progesterona) Folículo secundario Atretic Follicle Cuerpo Lúteo muerto Fuente. Martínez, 2005. 6.3.1. Métodos para la detección del estro Para maximizar la vida productiva de una vaca, esta debe ser servida en un máximo entre los 80 y 90 días luego del parto. Ya sea que el productor utilice inseminación artificial o servicio natural, la detección de estro es un componente crítico para el buen manejo reproductivo en la explotación bovina. Cualquiera que sea el caso, el registro de las vacas en estro o fechas de servicio es necesario para predecir estros (Caicedo, 2003). La detección de estros ha sido uno de los aspectos de la reproducción bovina más estudiados en la actualidad, existiendo para su realización una serie de técnicas que van desde la detección visual de forma continua, uso de pinturas y parches, hasta la utilización de métodos computarizados (De La Sota, 2005). 59 Los signos de celo pueden variar en su duración o intensidad, por lo que el inseminador debe saber reconocer, interpretar y confirmar los signos observados para garantizar la eficiencia en la detección de celos. Programas como la inseminación artificial, dependen básicamente de la eficiencia en la detección de celos. Un elemento fundamental para la detección de celos es la adecuada identificación de todas las vacas o novillas, así como la disposición de registros al día (Bavera, 2005). Se han desarrollado diversos métodos para la detección del estro, entre estos el más confiable se basa en la observación visual de los animales, dos o tres veces al día durante 20 o 30 minutos, en cada ocasión, preferiblemente después del ordeño. El uso de métodos de apoyo para la detección del celo es sólo una forma auxiliar y nunca puede sustituir a la observación visual, siendo la interpretación de las observaciones lo más importante (Bavera, 2005). Entre los métodos de apoyo para la detección de estro, utilizados para aumentar la eficiencia en la detección del celo se cuentan: (1) Pintura en la base de la cola y detectores de presión en la base de la cola. Los detectores de presión (Bovine Beacon, Romage ®) se aplican sobre la base de la cola de la vaca con un adhesivo y son activados por la presión ejercida por el animal que monta. En hatos grandes, se ha extendido la utilización de pintura (Celotest, Northway ®), crayones o tiza para realizar una marca sobre la base de la cola de los animales elegibles a entrar en celo. La monta repetida de los animales en celo borra paulatinamente dicha pintura lo cual es medido en una escala de 5 (intacta) a 0 (borrada completamente) (ver figura 17). (2) Detectores electrónicos de presión en la base de la cola. Los detectores electrónicos de presión en la base de la cola (Heatwatch®, DDx, USA) fueron desarrollados para monitorear de manera continua la frecuencia y duración de las montas que sufren los animales en celo. Sin embargo la intensidad de detección de celo40 es superior con respecto a la detección visual (91% y 54% respectivamente). (3) Retajos y animales tratados 40 Intensidad de detección del celo. Se define como el porcentaje de celos posibles que son observados durantes un período de tiempo específico (De la Sota, 2005). 60 con esteroides masculinos. La utilización de retajos (toros vasectomizados o con pene desviado), novillos, novillas o vacas androgenizadas mejora la intensidad de detección del celo cuando son utilizados en combinación con pintura en la base de la cola, detectores de presión en la base de la cola o marcadores Chin-ball ®, que cuando son utilizados en forma individual. (4) Resistencia eléctrica de los fluidos del tracto reproductivo. La resistencia eléctrica de los fluidos vaginales disminuye durante el proestro y el estro y puede utilizarse si se mide en forma repetida hasta alcanzar un valor mínimo que coincide con el momento del estro. Esta metodología posee una intensidad que varía del 65 al 82% y una exactitud del 57 al 82%. (5) Podómetros. Los animales durante el celo son más activos y utilizan más tiempo caminando o manteniéndose parados que descansando, para medir dicha actividad se han desarrollado varios modelos de podómetros (Afiact, Bossio; Heat Seeker-TX, Alfa-Laval Agri ®) (Dransfield et al., 1998; O´Connor y Senger, 1997; Candfield y Butler, 1989; Maatje K. et al., 1997). Figura 17. Método de detección de celo con pinturas y crayones. Fuente. Bavera, 2005. Mientras más animales se encuentren en celo en un momento dado, mayor será la actividad sexual de grupo y más fácil será la detección del celo. El médico veterinario también puede utilizar tratamientos específicos para inducir los celos (sincronización de celos) y facilitar las labores de detección (Bavera, 2005). 61 6.3.2. Signos de estro La detección del estro requiere de una aguda observación. La mayoría de las vacas poseen un patrón de comportamiento que cambia gradualmente desde el comienzo al final del estro. El mejor indicador de que una vaca está en estro es cuando se mantiene quieta y se deja montar por sus compañeras o por un toro. Algunos signos, que pueden ayudar a identificar el estro en las vacas, se resumen en el cuadro 2, la figura 19 y la fotografía 1 (Bavera, 2005). Fotografía 1. Signos del estro. a) Moco filante, transparente, viscoso d) Apoyo del mentón. f) Monta activa. Fuente. Bavera, 2005. b) Mucus ensuciando cola, pelos demudados, raspaduras. c) Vaca en celo en posición de cubrición, aceptando la monta por otra. e) Monta craneal. g) Monta pasiva. 62 6.3.3. Patrones diarios en los signos de estro El comienzo del estro sigue diferentes patrones, la mayor actividad se presenta durante las últimas horas de la tarde- noche, a lo largo de la noche y en las primeras horas de la madrugada. Las investigaciones muestran que más del 70% de la actividad de monta toma lugar entre las 7:00 p.m. y las 7:00 a.m. (figura 18). De manera que para detectar el estro en el hato, en el 90% de los casos, las vacas deben ser observadas cuidadosamente en las primeras horas de la mañana, las últimas horas de la tarde y en intervalos de cuatro a cinco horas durante el día (Bavera, 2005). Figura 18. Horas y niveles en que se manifiestan los signos del estro. Fuente. Bavera, 2005. 6.3.4. Otros factores que influencian la expresión del estro La expresión y detección de estro puede ser más o menos fácil dependiendo de una serie de factores como el tipo de alojamiento (establo, establo libre, pastura, camino para caminar a lo largo del alambrado, etc.) provee varios grados de facilidad para que la vaca exprese signos de estro y para que los productores los 63 detecten. En hatos más grandes, más de una vaca puede estar en estro al mismo tiempo, cuando esto se presenta, las oportunidades de detección se incrementan en forma dramática debido a que la actividad de monta también se incrementa considerablemente. Por ejemplo, dos vacas en estro al mismo tiempo (grupo sexualmente activo) hacen que la actividad de monta se triplique. En contraste, factores tales como altas temperaturas y humedad, viento, lluvia, nieve, confinamiento, y condiciones que pueden causar que las vacas patinen o caigan, o dolores en las pezuñas tienden a inhibir la expresión de estro (Fuenmayor, 2007). Cuadro 2. Signos de estro en las vacas lecheras. SIGNOS CARACTERÍSTICAS Signos Principales Permanece inmóvil cuando es montada. Dejarse montar Muestra signos asociados con el estro temprano y el tardío. Estro temprano y tardío Signos secundarios1 Balidos como los de un toro. Signos generales de nerviosismo. Corridas hacia adelante como si estuviese atacando. La posición de cabeza a cabeza con otra vaca se ve frecuentemente. Golpes o empujones contra los costados de otras vacas. Olfateo de la vulva o la orina de otros animales acompañado algunas veces con inversión de los orificios nasales. Vacas que se colocan en un círculo, aquella en estro intenta descansar su barbilla en la espalda de la otra. Esto puede conducir o no a la actividad de monta. Vulva rosada e inflamada (edematizada), mucosa vaginal hiperemica, descarga de moco vaginal claro y elástico. Disminución de la producción de leche. Disminución del apetito. Animales sucios (estiércol en los flancos). Formación de grupo, lordosis Vulva enrojecida e inflamada Raspaduras (pérdida de pelo) en la grupa o base de la cola. 1. Signos no-específicos cuya ocurrencia depende de situaciones particulares. Fuente. Wattiaux, 2007 y Fuenmayor, 2007. Muchas de estas señales también pueden estar presentes en el proestro. El síntoma más característico del estro es cuando la hembra se queda inmóvil cuando es montada. Las señales del estro son inducidas por la elevada concentración de estradiol en la circulación, proveniente del folículo preovulatorio, que actúa en centros cerebrales (principalmente hipotalámicos) y medulares. La 64 acción del estradiol es potencializada por la pre-exposición a la progesterona, hecho este que es lógico y no trae mayores consecuencias cuando es un ciclo estral normal. (Wattiaux, 2007). 6.3.5. Cálculo de la intensidad de detección de celo De acuerdo con Fuenmayor et al., (2007), la intensidad de detección de celos se define como el porcentaje de celos posibles que son observados durante un período de tiempo específico. Se han desarrollado varios métodos para expresar el porcentaje de vacas detectadas en celo con respecto al número asumido o calculado que debería estar en celo. Tanto el cálculo de la intensidad de detección, como la comparación entre diferentes métodos de cálculo, presentan dificultades debido a que normalmente se utilizan distintos intervalos de tiempo y se incluyen o no a las vacas preñadas. Además generalmente se asume que: 1. Todas las vacas están ciclando luego de determinado día posparto, 2. Todos los celos detectados corresponden a ciclos estrales (no son falsos positivos), 3. Todos los ciclos estrales son de aproximadamente 21 días. Esto último es particularmente importante en aquellos rodeos donde se utilizan prostaglandinas para la inducción de la luteólisis y la ovulación en las vacas encontradas vacías al tacto (Fuenmayor, 2007). 6.3.6. Momento óptimo para el servicio (monta – inseminación) Entre los factores que determinan el momento óptimo de servicio se incluyen: Duración del celo. Momento de ovulación. Vida fértil del óvulo. 65 Vida fértil del espermatozoide. (Manrique et al., 1990). La ovulación ocurre aproximadamente 30 horas después del inicio del celo. La vida útil del óvulo se estima en 12 horas y la del espermatozoide en 24 horas. El tiempo de capacitación espermática del espermatozoide es de 6 horas (Manrique, 1990). El conocimiento de estas condiciones fisiológicas permitió desarrollar un esquema, denominado sistema AM-PM, que consiste en dos observaciones de 30 minutos cada una, una temprano en la mañana (entre 5 y 7 a.m.) y otra temprano en la noche (entre 6 y 8 p.m.). Las vacas observadas en celo en la mañana se inseminan en la tarde y aquellas observadas en celo en la tarde se inseminan la mañana del día siguiente (ver cuadro 3 y figura 19) (Manrique et al., 1990). Cuadro 3. Esquema AM–PM para la inseminación artificial. Momento adecuado para el servicio, de acuerdo con el período de celo El celo tiene una duración de 10 a 18 horas. Los mejores resultados se obtienen cuando se insemina al final del celo. Como regla práctica se recomienda que la vaca que es observada en celo por la mañana, debe inseminarse por la tarde del mismo día, y las que se observan en celo por la tarde, en la mañana siguiente. Para que la inseminación ocurra en las horas de menor calor, se recomienda hacerlo durante las primeras horas de la mañana (5 a 7 a.m.) y en las últimas horas de la tarde (5 a 7 p.m.) Antes del celo 5 a 10 horas Las vacas comienzan a montarse Demasiado temprano Fin del celo manifiesto Bueno Celo 10 a 18 horas Ideal Bueno 7 a 12 horas Después del celo 12 a 36 horas Fuente. Manrique, 1990. Aquí de desprende el óvulo. Termina la secreción saguinolenta. Demasiado tarde 66 Figura 19. Diagrama para el servicio. Fuente. Manrique, 1990. 6.3.7. Ausencia del estro o anestro Entre los problemas más comunes del rebaño se puede mencionar el anestro o ausencia del celo en las vacas o novillas. El anestro puede ser verdadero y se relaciona con la preñez (la vaca ha parido y el ciclo estral no se ha reestablecido – estro mudo), la mala alimentación, baja condición corporal, amamantamiento, problemas del tracto genital (quiste ovárico, momificación fetal, piómetra) o por otras complicaciones luego del parto. Otro tipo de anestro es el falso, que se asocia con el mal manejo y la mala detección de celos, muchas veces por irregularidad en las observaciones, interpretación errónea de los signos, inadecuada identificación de los animales o mal uso de los registros (Belloso et al., 2002). 67 7. LA SINCRONIZACIÓN DE CELOS La biotecnología ha jugado un papel muy importante en la producción animal, durante años se practica de alguna forma u otra bajo varias banderas desde que el hombre comenzó a domesticar a las especies animales. Muchas de las herramientas antes utilizadas para la reproducción animal, ahora unidas por la biotecnología, tienen y seguirán teniendo un papel muy importante en la selección y propagación de características deseables e importantes a nivel económico en el ganado. Desde este punto de vista, las prácticas de producción animal han sido un éxito biotecnológico desde hace ya mucho tiempo (Sepúlveda et al., 2003). La eficiencia de los sistemas de producción en bovinos es dependiente de la tasa de terneros nacidos y destetados. La aplicación de los resultados de un estudio sobre costos de producción, indicó que el intervalo máximo entre el parto y la concepción sea de 100 días, para que una vaca se torne económicamente rentable en una explotación, lo que significa una tasa de fertilidad en media de 90%. Para que sea posible la obtención de esos índices, es imprescindible que sea utilizada una estación de monta no superior a 60 días. En ese contexto, la sincronización de celos es importante, permitiendo una buena concentración de los partos de las novillas en los momentos más adecuados del año en función del ofrecimiento forrajero (Moraes, 1994). En bovinos de leche o de carne confinados, la identificación de estros es uno de los grandes problemas del proceso de inseminación artificial. En estos sistemas de crianza, la sincronización de estros, asociada a procesos de IATF, es un importante instrumento para fecundar las vacas sin la observación de los estros y, con esto incrementar, los índices de gestación, reducir el intervalo parto concepción y disminuir el número medio de dosis de semen por vaca inseminada. Se ha avanzado a pasos agigantados en el uso de numerosas tecnologías como la sincronización de celos y ovulaciones, biotecnología reproductiva que permite 68 entre otros, la concentración de la inseminación y de la parición en épocas deseables dentro de los sistemas de producción (Evans y Maxwell, 1987), Solucionar el problema de la baja detección de celos en los hatos bovinos, eliminando la detección visual de celos, maximizar los recursos humanos del establecimiento y para ajustarse a un régimen de tareas con periodicidad semanal y adoptar programas de sincronización de celos y/o ovulaciones para la inseminación a tiempo fijo de todos los animales y para programas de Transferencia de Embriones obtenidos por MOET o FIV (Bó et al., 1995). La mayoría de las biotecnologías reproductivas desarrolladas con posterioridad a la sincronización de estros estuvieron relacionadas también con la mejora genética y particularmente centradas en la mejora del uso de la IA, así como en el desarrollo de otras que posibilitaran la ampliación de la capacidad reproductiva de las hembras. Es así como aparecen los métodos de control del ciclo estral que tuvo lugar en la década del 60. Su objetivo original fue simplificar la aplicación de la IA en los países desarrollados, con lo cual era posible disminuir la cantidad de horas dedicadas a este trabajo, disminuyendo así el costo en mano de obra. Más tarde se vio que este objetivo era ampliamente superado con otros impactos que el uso de esta técnica podía tener tanto con el uso de la IA así como simplemente en el manejo reproductivo de los rodeos (Bó et al., 1995). 7.1. Definición de la Biotecnología de Sincronización de Estros En términos prácticos, es importante diferenciar sincronización de inducción de estros. La sincronización consiste en cortar o prolongar el ciclo estral a través de la utilización de hormonas o asociaciones hormonales que induzcan la luteolisis o prolonguen la vida del cuerpo Lúteo, de manera que un grupo de vacas entre en estro y/o ovule durante un corto periodo de tiempo o en un mismo día. Al contrario la inducción de estros consiste en inducir el estro en vacas que están en anestro, a través de la utilización de hormonas o prácticas de manejo. Así mismo la 69 sincronización y la inducción de estros son procesos distintos y aplicables a diferentes categorías de animales (Thatcher et al., 2004a). Gráfica 2. Efecto de la sincronización del estro sobre el desempeño reproductivo durante una sola semana de servicio. Porcentaje Con sincronización Sin sincronización Detectadas con estro Tasa de concepción Tasa de preñez Fuente: Dejarnette, 2007. El objetivo de un buen programa de sincronización es el control preciso del celo, que posibilite la inseminación artificial en tiempo fijo (IATF) sin detección de celo, además necesita estar aliado a altos índices de fertilidad con ovulación sincronizada, las poblaciones blanco son generalmente, los rebaños de bovinos de leche, cuyas tasas de preñez son generalmente pésimas debido al bajo índice de detección de celos y de concepción además de la ocurrencia de anestro, y los de bovinos de carne con alta incidencia de anestro en la época escogida para la reproducción. Las estrategias de programación de la ovulación se han basado en el control de la vida del cuerpo lúteo con prostaglandinas, en la inducción de la ovulación con GnRH o en el impedimento del estro con el uso de tratamientos a base de progestágenos (Thatcher et al., 2004a). 70 7.2. LAS ONDAS FOLICULARES Y LA SINCRONIZACIÓN El desarrollo folicular se produce en ondas. Las ondas foliculares son el desarrollo armónico y simultáneo de varios folículos antrales funcionando a través de estadíos integrados de reclutación, selección y dominancia folicular (Hafez, 1987; Fortune et al., 1991; Fernández Tubino, 2003): Reclutamiento: varios folículos primarios pasan a desenvolverse concomitantemente. Esta fase es dependiente de FSH (Hormona Folículo Estimulante). Selección y dominancia: un folículo crece más que los otros, tornándose dominante e inhibiendo el crecimiento de los demás (dominados). Esta fase es dependiente de la LH (Hormona Luteinizante). Ovulación o atresia: El folículo dominante ovula después de un pico de liberación de LH. Mediante este proceso se selecciona un folículo dominante y se produce la regresión de los folículos subordinados (Tamayo et al., 2007). Durante el ciclo folicular, se presentan generalmente dos (y a veces hasta tres) ondas de actividad folicular; la primera al inicio y la segunda a mitad del ciclo. De la primera surge un folículo dominante (menor a 5 mm de diámetro) que aumenta su tamaño (por encima de los 10 mm de diámetro) entre los días 5 y 11 para luego experimentar atresia (Fortune et al., 1991). En la segunda fase, surgen varios folículos productores de estrógenos y de ellos, uno es el dominante y el que controla el destino de los demás, al haber adquirido el tamaño adecuado, cumple la última fase de crecimiento y se constituye en un folículo preovulatorio (maduro), listo para ovular. Se expande ligeramente sobre la superficie del ovario para luego ser liberado (ver figura 10). Una vez que esto sucede, la cavidad se retrae y comienza a llenarse gradualmente de células que conformarán el cuerpo lúteo (Echeverrás et al., 2006). 71 Si durante el proceso hay un cuerpo lúteo activo, los niveles de progesterona estarán altos (fase luteal) inhibiendo la liberación de LH (Feed Back negativo), y entonces el dominante entra en atresia, y una nueva onda de crecimiento folicular se inicia. La última onda folicular de cada ciclo culmina con la regresión del cuerpo lúteo (inducida por la PGF-2 liberada en el útero). Con la disminución de los Niveles de progesterona, cesa la inhibición sobre la LH que es liberada, induciendo el crecimiento final del folículo, y la ovulación y posterior luteinización formando el nuevo cuerpo lúteo (Fricke, 2007). Este proceso é ilustrado en las gráficas 3, 4 y 5. El folículo dominante es anovulatorio si ocurre en la fase luteal y ovulatorio si ocurre en la fase folicular. Gráfica 3. Fases de crecimiento folicular: reclutamiento (dependiente de la FSH); Selección y dominancia (dependiente de LH); Ovulación o atresia (en la dependencia de la presencia o no del pico preovulatorio de LH) OVULACIÒN DOMINANCIA Fuente: Tecnopec 2005. 72 Gráfica 4. Esquema del ciclo estral con 2 ondas foliculares. La primera onda culmina con la atresia del folículo dominante por falta del pico preovulatorio de LH (Fase luteínica) la segunda onda culmina con la ovulación (Fase folicular, baja progesterona y pico preovulatorio de LH). Fuente: Tecnopec 2005. Gráfica 5. Esquema del ciclo estral con 3 ondas foliculares. La primera y la segunda onda culminan con la atresia de los folículos dominantes por falta del pico preovulatorio de LH (Fase luteínica). La tercera onda culmina con la ovulación (Fase folicular, baja progesterona y pico preovulatorio de LH). Fuente: Tecnopec, 2005. Las investigaciones con el empleo del ultrasonido demuestran que la primera onda, donde los folículos inician su crecimiento, se produce poco después de la 73 ovulación y aproximadamente a los 6 días aparece el folículo dominante; la segunda onda de desarrollo folicular comienza como promedio a los 8,5 días post ovulación, o sea, 9,5 días del ciclo estral en las vacas de tres ondas y 9,5 días post ovulación (10,5 días del ciclo) en las vacas de dos ondas, en estas últimas es la onda donde se produce la ovulación. En las vacas que manifiestan tres ondas foliculares, el folículo ovulatorio surge de la tercera onda el día 18 aproximadamente (Tamayo et al., 2007). Las vacas con dos ondas de crecimiento folicular tienen ciclos más cortos (18 a 20 días) que las de tres ondas (21 a 24 días); lo cual es un indicador a valorar para iniciar los tratamientos superovulatorios (Tamayo et al., 2007). Se ha reportado que el nivel nutricional está asociado con una proporción más elevada de ciclos de tres ondas. Sin embargo, los verdaderos factores genéticos o ambientales para definir el comportamiento de las diferentes poblaciones de hembras bovinas en relación con los patrones de las ondas foliculares no han sido aún establecidos con precisión (Fricke et al., 2007). 7.3. PROTOCOLOS PARA CONTROLAR LAS DIVERSAS FASES DEL CICLO ESTRAL Los programas de sincronización son posibles gracias a los esfuerzos de muchos investigadores que descubrieron métodos farmacológicos de control de cada fase del ciclo estral, en diferentes estadios del ciclo reproductivo de los animales. Los diversos Trabajos mostraron que es posible: • Sincronizar la emergencia de una nueva onda folicular, a través de la inducción de la ovulación (GnRH), de la atresia folicular (progesterona+estradiol), o de la ablación folicular mediante OPU. • Controlar la duración de la fase luteal, usando luteolíticos análogos como la PGF-2 o los estrógenos, simulando una fase luteal, fortaleciendo la 74 progesterona por medio de dispositivos de liberación lenta, o progesterona de administración oral. • Inducir la ovulación en la fase folicular, con GnRH, LH, hCG o estrógeno. • Inducir el crecimiento folicular en animales en anestro, utilizando gonadotrofinas (FSH o eCG) (Tecnopec, 2005). En la actualidad se encuentran disponibles tres métodos base para la sincronización de celos, a partir de los cuales se han desarrollado una serie de protocolos que implican la combinación de estos métodos: 1. PGF-2 con un intervalo de 2 semanas (Ferguson y Galligan, 1993). 2. GnRH y PGF-2 7 días más tarde (Thatcher y Hansen, 1992). 3. Implantes de liberación lenta de progestágenos41 durante 7 o 9 días (MacMillan et al., 1991). Las principales formas de control del ciclo estral y los productos utilizados son resumidos en el cuadro 4. 41 Progestágenos es el nombre genérico dado a un grupo de compuestos similares a la progesterona, entre los que podemos citar el acetato de melengestrol (MGA) -de administración oral-, los implantes subcutáneos de Norgestomet como el SyncroMate-B y el Crestar y los dispositivos intravaginales con progesterona como el CIDR, el DIV-B y el PRID (MacMillan et al., 1991). 75 Cuadro 4. Formas de control del ciclo estral y productos utilizados. TIPO DE FORMA DE PRODUCTO INDICACIÓN FARMACOLÓGICA CONTROL CONTROL UTILIZADO Sincronización de la onda folicular GnRH Gestran Plus Progesterona + Estradiol Primer + RIC-BE Regresión del cuerpo lúteo PGF- 2α Prolise Induce la regresión del cuerpo lúteo en la fase de respuesta (D6 a D17). Inducción de la ovulación Estradiol RIC-BE GnRH Gestran Plus LH Lutropin En ausencia de Progesterona induce la liberación de GnRH y LH y la ovulación en 41 a 45 horas. Induce la liberación de LH y la ovulación en 28 a 30 horas. Provoca un pico exógeno de LH y la ovulación en 26 a 26 horas. hCG ------- Simula el efecto de la LH, induciendo la ovulación en 26 a 28 horas. FSH Folltropin eCG/PMSG ------- Estimula el crecimiento folicular en vacas en anestro, usado también en la superovulación (TE). Estimula el crecimiento folicular, especialmente en vacas en anestro. Inducción del crecimiento folicular Induce el pico de ovulación o luteinización del folículo dominante. Surgimiento de una nueva onda folicular después de 1 día y medio. Induce la atresia folicular y el surgimiento de una nueva onda folicular a los 3 o 4 días. Fuente: Tecnopec, 2005. 7.3.1. Protocolos a base de prostaglandina (PGF-2) El descubrimiento, en la década de los 70, de las prostaglandinas como mediadores de las acciones hormonales y, especialmente, la identificación de la PGF-2α como la “luteolisina” uterina en varias especies domesticas, marcó un hito en el desarrollo de la biotecnología42 reproductiva y determinaron un avance importantísimo en el conocimiento de la fisiología y en la posibilidad de manipulación y control del ciclo estral (Mellisho et al., 2006). 42 El término biotecnología, fue probablemente usado en primer lugar por el húngaro Kart Ereky en 1919. Se podría definir como “toda aplicación tecnológica que utilice sistemas biológicos y organismos vivos o sus derivados para la creación o modificación de productos o procesos para usos específicos” (CDB, 1992, art. 2 PNUD; citado por Wikipedia, 2007). Otra definición es “la utilización de organismos vivos o partes de los mismos para obtener o modificar productos, mejorar plantas o animales o desarrollar microorganismos para objetivos específicos” (Sociedad Española de Biotecnología, 2007). 76 El nombre de prostaglandinas fue dado por Von Euler en 1936 a un grupo de sustancias presentes en semen y en extractos de las glándulas vesiculares del carnero, capaces de inducir contractibilidad o relajación en la musculatura lisa, supuestamente producidas por la glándula prostática (Mellisho, 2006), y cuya actividad biológica no correspondía a ningún compuesto conocido hasta la fecha. Bergstrom estimulado por Von Euler continuo los estudios sobre la purificación y determinación de la estructura química de las prostaglandinas; en 1957 lograron aislarse la mayoría de estos compuestos en estado puro y cristalino y en 1968 se informo la síntesis total de varias prostaglandinas y de análogos de estas.(Bó, 2004a). Se conoció entonces que las prostaglandinas se encuentran en la mayoría de los tejidos del cuerpo (pulmón, timo, músculo esquelético, fluido menstrual, líquido amniótico, intestino, sangre, tejido graso, etc.), actúan muy cerca de donde se producen, y se destruyen rápidamente en la circulación, pues de lo contrario debido a su actividad biológica, inducirían efectos generalizados indeseables. Esto hace que sea muy difícil aislar las prostaglandinas naturales en cantidades comerciales y que la mayor parte de las prostaglandinas que se utilizan a nivel comercial sean sintéticas (Stevenson, 1996). Las prostaglandinas disponibles pueden dividirse como se muestra en el esquema 3: Esquema 3. División de las prostaglandinas según su origen. Prostaglandinas Sintéticas De extracción natural Naturales Fuente. El autor, 2007. Análogos 77 Las primeras, difíciles de obtener, no siempre garantizan un alto grado de pureza. Las naturales de síntesis tiene la formula idéntica a las hormonas que se encuentran en los tejidos; en el caso de la PGF-2, para sus acciones a nivel reproductivo en bovinos, se utilizan dosis de 25 a 40 mg. Los análogos sintéticos tienen el sitio activo de la molécula similar, pero no el resto de la molécula. Son más potentes y en el caso de la PGF-2, se utilizan en dosis menores, que dependen del análogo (150 a 800mg), lo cual reduce el riesgo potencial de efectos secundarios (Bó et al., 2004a). El tratamiento basado en la aplicación de agentes luteolíticos, implica, por definición, la presencia de un cuerpo lúteo en el animal que va a ser tratado. La inyección de prostaglandinas entre los días 5 y 17 del ciclo resulta, dentro de las 24 h siguientes, en una drástica caída en los niveles de progesterona y un aumento de LH y estradiol en plasma, la presentación de celo y el pico preovulatorio dentro de los 2–5 días siguientes y la ovulación en el momento esperado con respecto al celo. La fertilidad de los celos obtenidos es comparable a la de celos espontáneos ó aún superior (De la Sota et al., 2005). La eficacia de estos fármacos como luteolíticos es cercana al 100% cuando son utilizados en forma apropiada. Desde los comienzos de su uso hasta el presente, se han seguido dos caminos para facilitar el uso extendido de este tipo de tratamientos: las estrategias de utilización y la dosis apropiada (De La Sota et al., 2005). Al utilizar PGF-2 para sincronización de celos, el estro suele presentarse entre 2 a 6 días después de la aplicación por lo que siempre se requiere una inseminación asociada a la detección de celos. Un sistema de manejo que podría revolucionar el manejo reproductivo en bovinos es el uso de sincronización de celos e IA a tiempo fijo, que elimine la necesidad de detectar celos, lo cual es posible alcanzar si se 78 logra sincronizar la ovulación después de la aplicación de PGF-2 (Macmillan y Burke, 1996). En 1972, Rowson y en 1974, Cooper y Furr utilizando Cloprostenol, demostraron que en las hembras bovinas ciclando una inyección de 500 g causaba lùteolisis en animales con CL en la mitad de la fase luteal. Si se administraba una segunda dosis 11 días después de la primera todos los animales se encontraban en la fase luteal y eran sensibles a la acción luteolítica (Boscos, 1997) En trabajos posteriores sobre 3.810 novillas de cría, Cooper et al (1974), demostraron que si estas eran inseminadas a las 72 y 96 horas después de la segunda inyección de cloprostenol, sin detección de celos, la fertilidad era normal, surgió así el primer tratamiento de sincronización de estros con prostaglandinas y fue llamado Tratamiento A y para su aplicación se lleva a cabo el siguiente procedimiento: Esquema 4. Tratamiento A con PGF-2. Fuente: CGR, 2002. Los mismos autores informaron que más del 90% de las hembras que estaban ciclando respondían al tratamiento y presentaban estro entre 2 y 4 días después de la segunda inyección; destacaron la gran concentración de los celos y rápida iniciación del mismo después de la segunda inyección, con respecto a la primera. 79 En cualquier grupo de hembras bovinas a las que se administrar PGF-2 con un intervalo de 11 días, responderán a la primera inyección las que se encuentran entre los días 5 y 17 del ciclo al comienzo del tratamiento; mientras que al momento de la segunda inyección la mayoría se encontrara entre los días 8 y 11 del ciclo y responderán a la PGF-2 (Bó, 2004a). Surgieron posteriormente varios protocolos de sincronización de estros con PGF. En general los tratamientos propuestos son modificaciones del Tratamiento A y se utilizan cuando hay buena tasa de detección de estros (Bó, 2004a). Jhonson et al., 1999, realizando varios experimentos con novillas, que se dividieron al azar en 2 grupos G(A )y G(B), que se mantuvieron en potreros diferentes, cada uno con toro marcador vasectomizado. Después de haber observado los celos, las novillas del G(A) fueron tratadas con el esquema de doble dosis. Se dejaron descansar por un periodo mayor a 21 días, permitiendo su retorno al celo natural y se les administro una única inyección de 500ug de cloprostenol, 8 días después de observado el celo. Las novillas del G(B) fueron tratadas con una única inyección en el día 8 del ciclo, descansaron 21 días y luego se les aplico el régimen de doble dosis para completar los tratamientos cruzados, corroborando lo expuesto por Cooper et al., 1974 en cuanto a que la concentración de estros era mayor luego de la segunda inyección y apoyó la hipótesis de que el estadio del ciclo estral en el momento de aplicación de la PGF2, influenciaba el tiempo de aparición del celo. En trabajos posteriores se relacionó además el pico preovulatorio de LH al estadio del ciclo al momento de la inyección (Scaramuzzi et al., 2000). 80 Gráfica 6. Porcentaje de celo después de la PGF-2. 40 35 . 30 % de animales 25 20 15 10 5 0 1 2 3 4 5 6 Días después de la PGF-2 Fuente: Seguin, 1987. Intervalo PGF2 : Ovulación Gráfica 7. Intervalo PGF-2: ovulación. Porcentaje en celo 100 80 60 40 20 0 24 36 48 60 72 84 96 108 120 >120 horas post PGF Novillas Fuente: Wenkoff et al., 1987. Vacas Wenkoff et al., 1987 Trabajos más recientes en vacas de leche lograron mejorar la sincronización con el Tratamiento A, prolongando el intervalo entre dosis hasta 14 días con lo cual se aumenta el numero de animales en fase sensible a la acción de la PGF-2, esto se debería a las diferencias en el patrón de desarrollo folicular inducidas por los cambios metabólicos y hormonales asociados a la lactancia. Con 11 días de intervalo, la segunda dosis de PGF-2 coincide con una alta proporción de vacas en estadios tempranos del ciclo, con CL que no responde al efecto luteolítico, en otro estudio de campo compararon 2 tratamientos con intervalos de 11 y 14 días, 81 en vacas primíparas lactando, el intervalo de 14 días incremento el porcentaje de preñez a primo inseminación y redujo el numero de días vacía, debido a estas observaciones se recomienda un intervalo de 11 días para novillas y de 14 para vacas en lactancia (Thibodeaux, 1992). Esquema 5. Opciones para sincronización de estros inyecciones de PGF-2 con 14 días de diferencia. utilizando 2 Opción 1. Detección del celo e IA después de cada inyección. Detección del celo e IA Detección del celo e IA Detección del celo e IA Opción 1. Detección del celo e IA después la segunda inyección. Fuente: Dejarnette, 2007. Posteriormente con el uso del ultrasonido se pudo dilucidar la dinámica folicular del ciclo ovárico y analizar el efecto de la PGF-2 en un trabajo realizado por (Kastelic et al., 1990) se pudo concluir que la longitud del intervalo desde la inyección de prostaglandina hasta la ovulación dependía del estadio del folículo dominante al momento del tratamiento. Cuando se trataron novillas en los días 5 a 8, el folículo dominante que se encontraba en la fase tardía de crecimiento o estática temprana, se transformaba en ovulatorio, asimismo, cuando la novillas fueron tratadas durante el día 12, era el folículo dominante de la segunda onda, en fase temprana de crecimiento, el que se desarrollaba a ovula torio, otro grupo de novillas fue tratado en el día 8 cuando se espera ocurra el surgimiento de la segunda onda, 14 de 17 novillas ovularon el folículo dominante de la primera onda 82 y solo las 3 restantes de la segunda, en las novillas que ovularon el folículo de la primera onda, el intervalo desde el tratamiento a la ovulación fue más corto que en las que ovularon el folículo dominante de la segunda onda( 4,2 VS 6,3) (Bo et al., 2004b). Cuadro 5. Respuestas ováricas (media +ES) a tratamientos con PGF los días 5, 8 ó 12 del ciclo. Fuente: Kastelic et al., 1990. 83 Gráfica 8. Diferentes estatus foliculares al momento de una inyección de PGF-2 y su gran variación en el tiempo de ovulación. Fuente: Baruselli, 2001. Esquema 6. Tratamiento B con PGF-2. Fuente: CGR 2002. Con este tratamiento entrarán en estro y serán inseminadas, después de la primera dosis de PGF entre, un 60 a 65% de los animales ciclando, con respecto 84 al Protocolo A, se reduce un 35% el costo en dosis de PGF-2 y un 25% en dosis de semen. (Bó et al., 2004b). Esquema 7. Tratamiento C con PGF-2. Fuente: CGR 2002. Con este protocolo, se detecta también el estro, después de la segunda dosis de PGF-2, la ventaja de esta variación es que no se gastarán dosis de semen en animales que no estén ciclando. (Bó et al; 2004b). Esquema 8. Tratamiento D con PGF-2. Fuente: CGR 2002. 85 En este programa es mejor adoptar la detección de estros, pues la concentración de los mismos no permite inseminar a tiempo fijo, podría realizarse con toros, aumentando la oportunidad de servicio cuando estos son estacionados. (Bó et al; 2004b). Esquema 9. Tratamiento de los 10 días. Fuente: CGR, 2002. Es un programa muy práctico y muy aceptado para ganado de carne propuesto por Eaton. Se pueden usar calentadores, si todo el ganado esta ciclando los días previos al servicio entraran en estro del 20% al 25% de las vacas (las que están en lisis natural del CL) de modo que al momento de la inyección todas las hembras no inseminadas y que están ciclando tiene un CL formado (Bó et al., 2004a). Permite acortar el proceso de IA reduciendo la mano de obra y los costos del inseminador, solo se gasta una dosis de semen por animal y en las que están ciclando es un tratamiento muy barato, pero es poco eficiente en grupos de animales con alta incidencia de anestros. (Bó et al., 2004a). Otra variación aplicable a estos protocolos, es administrar PGF-2 96 horas después de exponer los animales al toro; las vacas servidas en ese período no 86 responderán a la PGF, es válido para concentrar las preñeces al comienzo de los servicios naturales estaciónales. . (Bó et al., 2004a). Este tratamiento se uso en 1993 en un establecimiento del norte de Córdoba que utiliza cruzamiento rotativo con tres razas (Brahmán – Hereford – Simmental) en novillas de 15 meses. (Bó et al., 2004a). Los resultados fueron estos: Tabla 1. Resultados cruce rotativo de tres razas bovinas en el norte de Córdoba. Fuente: CGR 2002. Muchos productores lecheros utilizan programas de sincronización con PGF induciendo estro y ovulación con sincronía variable. Esta sincronía, en vacas lecheras en lactancia es insuficiente para lograr buenos resultados con IATF, estas hembras tienen durante el ciclo estral características foliculares diferentes a las de las vacas secas (De la Sota, 1993) y debido a la variabilidad del estado de desarrollo folicular los resultados en preñez de los tratamientos de sincronización, son inferiores a los que se obtienen en novillas (Wiltbank et al., 1996). Relacion entre Dinámica folicular, PGF-2, estro y ovulación Con la puesta en el mercado de las PGF-2, dejaron de usarse los progestágenos en algunos sistemas debido a que se obtenía una baja fertilidad en los tratamientos de 14 días ya que la progesterona no era capaz de bloquear por completo la producción de estrógeno y además no alcanzaba a producir los niveles suficientes de LH para ocasionar la ruptura del folículo y la ovulación, y en cambio si ocasionaba que el folículo dominante, que depende de esta hormona 87 para crecer, continuara haciéndolo. Se pensaba que la progesterona debía imitar lo que sucedía fisiológicamente, pero lo que sucedía realmente es que el folículo crecía demasiado y no se producía la ovulación o resultaba en un óvulo demasiado viejo incapaz de fecundarse, que se denomino como folículo dominante persistente. Esto quedó comprobado por varios trabajos de investigación, en los cuales, además, se asoció esta baja fertilidad a defectos en el transporte de los espermatozoides y a mala calidad del oocito por envejecimiento con bajas posibilidades de ser fertilizado o, en caso de ser fertilizado, a una baja viabilidad embrionaria ya que al producirse altas cantidades de estrógeno por el folículo persistente se altera el medio oviductal y uterino, y este medio hostil produce la muerte del embrión (Bó et al., 2004b). Teniendo en cuenta los problemas asociados a los protocolos con prostaglandina como el intervalo entre estro y ovulación, que está determinado por la fase de desarrollo del folículo dominante y por los tratamientos con progestágenos o progesterona que inducían un folículo dominante persistente que a su vez ovula un oocito de mala calidad, entonces el tratamiento ideal seria sincronizar el desarrollo folicular de manera que todos los animales tuvieran un folículo en crecimiento y con capacidad de ovular en el momento de la administración de prostaglandina o de la remoción del implante de progesterona (Bó et al., 2004b). Existen varios métodos por los cuales se puede considerar el control de la dinámica folicular del bovino. La mayoría de los tratamientos estudiados han sido orientados hacia la eliminación del efecto del folículo dominante (por métodos físicos u hormonales) y de esta manera permitir el comienzo de una nueva onda folicular en un determinado periodo de tiempo conocido. Las bases de este procedimiento derivaron de estudios en los cuales la eliminación del folículo dominante mediante cauterización (Adams, et al., 1993), o su supresión mediante tratamientos con la fracción proteica del fluido folicular bovino (Kastelic et al., 1990), fue seguida de un pico de FSH y el comienzo de una nueva onda folicular. Un método físico recientemente utilizado es la ablación folicular mediante la 88 aspiración guiada por ultrasonografía transvaginal (Bergfelt, et al., 1994). Los tratamientos hormonales pueden incluir la utilización de LH (Martínez et al., 1997) o análogos de la GnRH (Thatcher, et al., 1989), que inducirán la ovulación o la luteinización del folículo dominante, o la supresión de los folículos antrales presentes mediante la utilización de estrógenos y progestágenos (Bo, et al.,1995). Uso de la PGF-2 en Ganado de leche La sincronización del estro en ganado de leche con PGF-2α es implementada para facilitar la detección del estro y mejorar su desempeño reproductivo (Drillich et al., 2000), las tasas de concepción al primer servicio en estudios sobre desempeño reproductivo después de la sincronización varían entre 37 y 60%. Varias razones han sido discutidas para las insatisfactorias tasas de concepción después de los protocolos. Luteolisis incompleta e interferencia del protocolo de sincronización con la dinámica folicular que puede llevar a sincronización sub-optima de la ovulación, insuficiente duración de elevados niveles de progesterona antes del estro usado para la inseminación puede decrecer las tasa de concepción (Rosenberg, 1991; citado por Drillich et al., 2000), en los protocolos de inseminación basados sobre la observación del estro , la dificultad en la detección puede llevar a la inseminación de vacas que no están realmente en estro. Tabla 2. Tasa de respuesta luego de la aplicación de una inyección de Cloprostenol, según el día del ciclo en vacas lecheras en lactancia. 89 Fuente. Momont and Seguin, 1983; citados por Bó, 2004a. Sincronización con PGF-2α en Bos indicus Debido a las dificultades en la detección del estro en cebuínos varios grupos de investigación iniciaron estudios con o objetivo de sincronizar o estro y la ovulación para el empleo de biotecnologías en días predeterminados. En bovinos das razas europeas, la administración de PGF-2α tiene inducido elevadas tasas de manifestación de estro (70 a 90%, Tanabe & Hann, 1984; 66 a 97%, Laverdiere et al., 1995), entretanto, en cebuínos los resultados son contradictorios. En vacas de la raza Nelore (Figueiredo et al., 1997; Castilho et al., 1997a) y Gir (Gambini et al., 1997) fue observada baja manifestación de estro (< 50%) después de los tratamientos con PGF-2α, en presencia misma de un cuerpo lúteo funcional (Pinheiro et al., 1998). Tabla 3. Sincronización de Celos con PGF en Receptoras Bos indicus, Tratadas En Celo Transferidas/ Preñadas/ En Celo Transferidas MATTO GROSSO 854 384 226 89/226 (BRASIL) 2000 (39.4%) Preñadas/ Tratadas 89/854 (10.4%) SANTA CRUZ (BOLIVIA) 2001 700 479 223 111/223 (49.8%) 111/700 (15.9%) GENERAL 1554 863/1554 (55.5%) 449/863 (52.0%) 200/449 (44.5%) 200/ 1554 (12.9%) Fuente. Bó, 2004b. Teóricamente, dos aplicaciones de prostaglandina, con intervalos de 11 a 14 días, inducen el estro en una gran proporción de las hembras ciclando, en cuanto que las hembras en anestro o ciclando irregularmente no responden al tratamiento. Por lo tanto, tales programas no siempre proporcionan alto grado de sincronización o alta tasa de preñez después de la aplicación de 2 dosis de PGF-2α, también a sido observada gran variación en la detección del estro y en la ovulación, tanto en Bos 90 taurus, como en Bos indicus. Este dato indica que el tratamiento con PGF-2α sincroniza eficientemente el momento de la lùteolisis y no el estadio de desenvolvimiento del folículo ovulatorio. Así mismo, protocolos que buscan utilizar a inseminación en tiempo fijo, apenas con a utilización de prostaglandina, no han presentado buenos resultados (Barros et al., 2000). Con la ampliación en los conocimientos sobre el control del ciclo estral, fue posible hacer combinaciones de estrategias de manejo fisiológico como PGF-2, GnRH, y progestágenos (Barros et al., 2000). 7.3.2. Protocolo Ovsynch (ovulacion sincronizada) El Ovsynch (GnRH - PGF-2 -GnRH) fue desarrollado como estrategia de manejo reproductivo para eliminar la necesidad de la detección de celo y permitir la inseminación en tiempo fijo, es constituido por una inyección de GnRH en fases aleatorias del ciclo estral para inducir la ovulación del folículo dominante presente en el momento del tratamiento desde que este en la fase de crecimiento o en el inicio de la fase estática. También, provocará atresia del folículo que no estuviera más viable, surgiendo una nueva onda de crecimiento folicular 2 a 3 días después del tratamiento con GnRH (Pursley et al., 1995). Siete días más tarde, es administrada PGF-2 para regredir el CL ya existente o recientemente formado, seguida de una segunda inyección de GnRH 48 horas más tarde para inducir una nueva ovulación sincronizada 28–32h. La inseminación artificial en tiempo fijo es realizada 12 a 16h post segunda inyección de GnRH. las tasas de preñez son normales después de la IATF. Este protocolo fue implementado con buenos resultados en muchas haciendas de ganado lechero comercial en todo el mundo, como una estrategia para la IATF en el primer servicio posparto, así como para reinseminación en vacas no preñadas. El Ovsynch posibilita la IATF sin la necesidad de detección de celo, aproximadamente 10 a 15% de las vacas presentan señales de estro durante el 91 protocolo, debiendo ser inmediatamente inseminadas, si el objetivo es alcanzar la tasa máxima de preñez (Thatcher, 2004a). Esquema 10. Esquema general del Ovsynch. horas horas Fuente. Dejarnette, 2007. Esquema 11. Protocolos de sincronización con Ovsynch y Cosynch. Animales inseminados 8-16 horas después de la segunda inyección de GnRH. Horas Día Horas Animales inseminados al mismo tiempo con la segunda inyección de GnRH. Fuente: Dejarnette, 2007. 92 Gráfica 9. Dinámica folicular – Ovsynch. Fuente: Baruselli, 2002. El momento de las inyecciones es crucial para que el protocolo de buenos resultados. Si el intervalo entre la inyección de GnRH y de PGF-2 es inferior a 7 días, se disminuye la capacidad de regresión real de un CL recién desarrollado. Si la segunda inyección de GnRH es atrasada para más de 48h serán entonces identificadas más vacas en estro antes de la inyección de GnRH, las vacas no ovulan de forma sincronizada y el tiempo de la inseminación estará errado. Es fundamental que no se modifique el protocolo. Una pregunta común es si las vacas pueden ser inseminadas en el momento de la inyección de GnRH o 24 horas más tarde para tornar el proceso de inseminación más práctico. Las tasas de preñez son más bajas con la inseminación 24 horas post GnRH, siendo que el momento ideal para la inseminación parece ser entre 12 y 18 horas después de esa inyección (Thatcher, 2004a). La respuesta al protocolo Ovsynch es optimizada cuando las vacas ovulan después de la primera inyección de GnRH y cuando existe un CL que responde en el momento de la administración de la PGF-2. Vasconcelos et al. (1999), observaron que el protocolo Ovsynch iniciado entre los días 5 y 9 del ciclo posibilitaría una mayor tasa de ovulación en respuesta a la GnRH. Los folículos que presentan períodos de dominancia de más de 5 días (Austin et al., 1999) o las 93 vacas que iniciaron el protocolo Ovsynch en las fases iniciales del ciclo estral son menos fértiles (Vasconcelos et al., 1999). El esquema 12 muestra un escenario que combina el uso de Ovsynch y el diagnóstico temprano de gestación usando ultrasonido. Los grupos de vacas que pasan el período de espera voluntario recibirían su primera inseminación posparto después de la sincronización de la ovulación con Ovsynch. Esto reduciría dramáticamente los días medianos a la primera IA al eliminar la detección de estro para el primer servicio post parto. El día 25 post IA, se identificarían las vacas no preñadas con ultrasonido, quienes recibirían la primera GnRH para la resincronización con Ovsynch. Esto resultaría en intervalo promedio entre servicios de 35 días para las vacas que requieren resincronización (Fricke, 2007). Esquema 12. Protocolo de manejo reproductivo que combina IA a tiempo fijo (Ovsynch) con diagnóstico temprano de gestación usando ultrasonido. Nótese que las inyecciones hormonales están programadas para los lunes (L) y miércoles (M), los exámenes de ultrasonido los lunes (L), e IA a tiempo fijo (ITF) los jueves (J). El intervalo entre servicios sería de 35 días para las vacas que requieren resincronización. Fuente: Fricke, 2007. Sincronización con Ovsynch en Bos Indicus Con el objetivo de disminuir la variación del tiempo de la ovulación después del tratamiento con prostaglandina, algunos investigadores estudiaron el empleo de análogos do GnRH (gonadotropin releasing hormone), seguido de la aplicación de prostaglandina después de 7 días. El tratamiento con GnRH causa la ovulación del folículo dominante, surgiendo una nueva onda de crecimiento folicular 2 a 3 días 94 después del tratamiento con GnRH (Pursley et al., 1995; Twagiramungu et al., 1995; Bodensteiner et al., 1996, citados por Wiltbank et al., 1997). Algunos trabajos demostraron que los folículos con 0,9 a 1,0 cm. de diámetro en crecimiento ovulan aun en presencia de un cuerpo lúteo funcional, con altos niveles de progesterona (Wiltbank et al., 1997). En un experimento, Pursley et al. (1995) detectaron ovulación en 18 de 20 vacas (90%) y en 13 de 24 novillas (54%) tratadas con GnRH, independientemente de la fase del ciclo estral. Los autores no recomiendan el empleo del método “Ovsynch” para novillas debido a la baja respuesta ovulatoria de la GnRH y debido al hecho de que la ausencia de ovulación no sincroniza el desenvolvimiento de una nueva onda de crecimiento folicular. Por causa de la alta tasa de ovulación a la GnRH, pocos animales presentaron celo entre la primera aplicación de GnRH y la aplicación de prostaglandina después de 7 días, debido a la formación de un cuerpo lúteo que produce progesterona. 60 a 70% de los animales tratados son detectados en celo 4 días después de la aplicación de prostaglandina (Twagiramungu et al., 1995). Vasconcelos (1998), encontró una tasa de ovulación después de la primera aplicación de GnRH de 64% en 156 vacas Holandesas tratadas en diferentes períodos del ciclo estral. El autor observo variación de la tasa de ovulación conforme a la época del ciclo estral, encontrando menores tasas en animales que se encontraban entre los días 1 y 4 (23%) y mayores tasas en animales que estaban entre los días 5 e 9 (96%). entretanto, a tasa de ovulación después de la segunda dosis de GnRH (87%) no fue influenciada por la fase del ciclo estral, mas vario (P < 0,01) de acuerdo con la respuesta a la primera aplicación de GnRH (92% si hubo ovulación y 79% si no hubo ovulación). Fueron observadas ovulaciones entre la aplicación de prostaglandina y la segunda dosis de GnRH (6%) siendo que 7% de los animales no ovularon después de 48 horas de la aplicación de la segunda dosis de GnRH. Los resultados del método “Ovsynch” 95 como la tasa de concepción a la inseminación artificial presentan variaciones entre 26 y 55% (Pursley et al., 1995; Vasconcelos, 1998). Con el objetivo de comparar la eficiencia del tratamiento hormonal utilizando GnRH o hCG en la última aplicación del método “Ovsynch”, Schmitt et al. (1994), verificaron la tasa de preñez superior en novillas tratadas con hCG (52,9% vs. 45,5%), a pesar de no diferir estadísticamente. Los autores verificaron que cuando fue utilizado hCG hubo reducción significativa de ciclos estrales de corta duración (< 16 días) después de la inseminación (6% vs. 15.5%). Esta reducción é justificada por el hecho de que el CL originado de una ovulación inducida por la GnRH tiene capacidad reducida de secretar progesterona. Confirmando estés resultados, estudio reciente realizado por nuestro grupo en novillas Bos indicus x Bos taurus demostró que la hCG promueve ovulación y formación de un CL accesorio con diámetro superior, que produjo mayores concentraciones de progesterona que en animales tratados con GnRH (Marques et al., 2001). En los trabajos realizados por Barros (1998), los animales fueron tratados, en estadíos aleatorios del ciclo estral, con un análogo de GnRH (8 μg de acetato de buserelina, IM, día 0) y siete días más tarde, con PGF-2α (25mg de dinoprost, Lutalyse, vía IM, día 7). Veinte y cuatro horas después de la administración de PGF-2α, todos los animales y recibieron nueva inyección de GnRH (8 μg, vía IM, día 8). Cerca de 20 a 24 horas después de la segunda dosis de GnRH todas las vacas fueron inseminadas artificialmente, sin observación de celo (día 09). Este protocolo fue testado tanto en vacas lactantes (60 a 90 dias pós-parto, n = 44) como en no lactantes (n = 49). Las tasas de preñez (número de vacas preñadas en relación al número de tratadas) después de una única IA en tiempo fijo fueron de 47,7% e 44,9%, para vacas lactantes e no lactantes, respectivamente (Barros et al., 2000). Con el objetivo de sustituir el último tratamiento con GnRH por Benzoato de Estradiol, Barros et al. (2000) realizaron estudios en vacas cebúinas. El protocolo hormonal fue semejante al anterior, pero en lugar de la segunda dosis de GnRH, 96 las vacas recibieron una dosis única de Benzoato de Estradiol (BE, Estrogin, 1,0mg, vía IM, día 8), y cerca de 30 a 34 horas después todos los animales fueron inseminados artificialmente, sin observación de celo (día 9). Este protocolo fue testado en 53 vacas Nelore lactantes (60 a 90 días posparto) que estaban ciclando (confirmado por la presencia de cuerpo lúteo a la palpación rectal) y resulto en una tasa de preñez de 43,3%. Es importante destacar que las vacas Nelore utilizadas en los 2 protocolos arriba descritos se encontraban ciclando (cuerpo lúteo detectado por palpación rectal o ultrasonográfia). Cuando los protocolos GnRHPGF-2α–GnRH e GnRH–PGF-2α–BE fueron testados en vacas en anestro las tasas de preñez fueron más bajas: 14,9% en 67 vacas tratadas con el protocolo 1 y 19,1% en 68 vacas tratadas con el protocolo 2. Por lo tanto, estos tratamientos no son efectivos en animales en anestro y deben ser utilizados solamente en vacas que están ciclando. Los resultados de arriba mostraron que los protocolos de tratamientos hormonales GnRH–PGF-2α–GnRH y GnRH–PGF-2α–BE fueron eficaces en sincronizar la ovulación de vacas Nelore ciclando y originaron tasas de preñez al rededor del 45%, después de una única inseminación artificial en tiempo fijo. La substitución de la segunda dosis de GnRH por benzoato de estradiol, asociada a IA 30 a 34 horas después del BE, resulto en tasa de preñez similar a aquella obtenida con la GnRH, con la ventaja de que el costo do BE es mucho menor que el de la GnRH. La utilización de los protocolos GnRH–PGF-2α–GnRH e GnRH–PGF-2α–BE en vacas en anestro, resulto en tasas de preñez bien inferiores (15 a 19%) a las observadas en animales que estaban ciclando antes del tratamiento (alrededor de 45%) (Baruselli et al., 2002). Se evaluó la respuesta ovulatoria en novillas cebúinas cruzadas tratadas con dosis única de prostaglandina y con el protocolo “Ovsynch”. El intervalo entre la aplicación de la PGF-2α y la ovulación fue de 74,3 ± 12 h (n=26) para el grupo “Ovsynch” y de 72,6 + 21,8 h (n=20) el grupo prostaglandina (P>0,05). La 97 distribución de las ovulaciones después de la aplicación de la PGF-2α se encuentra en la gráfica 10. Se observo mayor variabilidad en el grupo prostaglandina. Los animales tratados con el protocolo “Ovsynch” presentaron mayor tasa de ovulación. Después de la administración de PGF-2α (74,3%; 26/35) que los animales tratados con una dosis única de PGF-2α (58,8%; 20/34). A pesar de la mayor tasa de ovulación, fueron detectadas en estro apenas 22,9% (8/35) en el grupo “Ovsynch”, comparado con 64,7% (22/34) de las novillas de el grupo prostaglandina (P<0,01) (Baruselli et al., 2000). Gráfica 10. Distribución de ovulaciones (horas) después de la aplicación de la PGF-2 en Novillas cruzadas cebú tratadas con el protocolo ¨Ovsynch¨ y con una dosis única de prostaglandina. Fuente. Baruselli et al., 2000. Las investigaciones han demostrado que el protocolo “Ovsynch” viene presentando baja eficiencia en vacas cebúinas lactantes criadas a campo (Barros, 2000; Baruselli et al., 2001). Los trabajos indican la utilización de este protocolo solamente en rebaños con altas tasas de ciclicidad, no siempre encontradas en las propiedades productoras de carne y leche en los trópicos, que poseen rebaño predominantemente cebú. 98 Pre-Synch – Ovsynch: (PGF-2–PGF-2 - GnRH – PGF-2 – GnRH) Moreira et al. (2000), elaboraron un programa de pre-synch (presincronización) para optimizar la respuesta al protocolo Ovsynch, aplicando dos inyecciones de PGF-2 con 14 días de intervalo, siendo la 2da aplicación 12 días antes de la 1ª inyección de GnRH del programa de IATF. Esquema 13. Programa de presincronización para la implementación del Ovsynch. TRATAMIENTO DE PRESINCRONIZACIÓN Días de estro Fuente. Thatcher et al., 2005. Esquema 14. Programa Presynch-Ovsynch. Fuente. Dejarnette, 2007. El programa Presynch-Ovsynch aumento las tasas de preñez en 18 puntos porcentuales (25 para 43%), en vacas cíclicas en lactación. Son posibles otras 99 estrategias de presincronización para optimizar el protocolo de Ovsynch, deben ser bien elaboradas para minimizar el numero de vacas que están en el inicio del metaestro o en el final del diestro, cuando el fuera iniciado, y para tener un posible folículo que ira a ovular con la primera inyección de GnRH. Futuros sistemas para vacas lecheras en lactación pueden incluir la inserción de dispositivos intravaginales con progesterona e inyecciones con altas dosis de estrógenos. Los buenos resultados del protocolo Ovsynch dependen de si las vacas lecheras en lactación están ciclando o no. Las tasas de preñez fueron menores en vacas que no estaban ciclando en el momento en que el protocolo Ovsynch fue iniciado (22% vs. 42%). De modo general, el programa consiguió inducir ciclicidad en el 75% de las vacas en anestro, con base en el numero de vacas en ese estado clasificadas como ovulando con la primera y/o segunda inyección de GnRH. Si las vacas en anestro ovularan con la primera y la segunda inyección de GnRH del protocolo de Ovsynch, entonces las tasas de preñez fueron aparentemente normales (39%). No sorprende el hecho de que el numero de anestro fue mayor en las novillas primíparas o de primera cría (35,6%) de lo que en vacas multíparas (16,9%) la ocurrencia de anestro disminuyo, cuando mejoran los escores de condición corporal registrados en el inicio el protocolo de Ovsynch. La inserción de dispositivos a base de progesterona como parte del protocolo de Ovsynch (entre inyección de GnRH y de PGF-2) también puede beneficiar los animales. El manejo post parto de las vacas lecheras en lactación es de extrema importancia, afectando bastante el desempeño reproductivo. Los esfuerzos hechos para maximizar la salud, el confort y el estatus nutricional de las vacas después del parto (aumentar consumo de materia seca) van a reflejar más tarde en la lactación en términos de una mayor incidencia de vacas ciclando y mejora del desempeño reproductivo (Thatcher et al., 2003). Como el anestro tiene un impacto bastante significativo en las tasas de preñez, el desempeño reproductivo fue evaluado apenas en las vacas cíclicas. Fue observado un aumento en las tasas de preñez, cuando las vacas fueron presincronizadas (52,3%) en comparación a las no presincronizadas (31,1%). El 100 motivo de esas mayores tasas de preñez con el uso del protocolo Ovsynch en vacas presincronizadas fue asociado al numero de vacas que iniciaron el protocolo de sincronización en fases favorables del ciclo estral, fue levantada la hipótesis de que las tasas de preñez con el Ovsynch aumentarían si las vacas recibiesen la primeras inyección de GnRH entre el día 5 y 10 del ciclo estral, y que la presincronización sincronizaría cerca del 90% de las vacas ciclando, de forma que ellas estarían entre el día 5 y 10 del ciclo, cuando fuese iniciado el protocolo. Las vacas con alta concentración plasmática de progesterona (mayor 1ng/ml) después de la primera inyección de GnRH en el momento de la administración de la prostaglandina (o sea vacas altas-altas) probablemente iniciarían el protocolo Ovsynch en un estadio ideal del ciclo estral. Los resultados del número de vacas cíclicas clasificadas como ALTAS-ALTAS indicarían que aproximadamente 87,4% de las presincronizadas fueron consideradas de este tipo en comparación al 71,7% de las no presincronizadas. Por lo tanto, conseguimos programar las vacas para estar en la fase ideal del ciclo para iniciar el programa Ovsynch, lo que resulto en una mayor tasa de preñez sincronizada. Una única inyección de PGF2 12 días antes del inicio del protocolo Ovsynch aumento la tasa de preñez sincronizada en las vacas multíparas. Eso se debe a un aumento del numero de vacas en el inicio del diestro en el comienzo del protocolo Ovsynch (Cartmill et al., 2001). Además del posible beneficio de la optimización del ciclo estral a través de la presincronización, las inyecciones anteriores repetidas de PGF-2 pueden tener un efecto terapéutico benéfico en el ambiente uterino, al estimular fases recurrentes de proestro/estro, permitiendo el lavado natural del útero y mejorando ese ambiente. Navanukraw et al. (2002), concluirían un experimento en el que demostraron que las tasas de preñez con el uso del Ovsynch también podrían ser mejoradas, modificando el programa Presynch/Ovsynch, de forma que el intervalo de la 2a inyección de PGF-2 en el Presynch hasta la 1a de GnRH en el Ovsynch fuese de 101 14 días. La tasa de preñez con el uso del programa Modificado Presynch/Ovsynch fue mayor de lo que en el Ovsynch (49,6% mayor 37,3%) esa pequeña modificación torna la secuencia de las inyecciones más práctica para los criadores con la implementación de aplicaciones semanales. Los tratamientos con progestágenos también podrían ser utilizados para presincronizar el celo, permitiendo posteriormente la implementación de un programa de sincronización que se beneficiaria de las fases de un nuevo folículo dominante y del cuerpo lúteo. Esa es, en verdad, la estrategia del protocolo 7–11 Synch en ganado de carne, destinado a: 1) acortar el periodo de administración de (MGA) sin comprometer la fertilidad y 2) mejorar la sincronía del estro a través de la sincronización del desenvolvimiento y de la ovulación de los folículos de la primera onda (ver esquema 14) (Kojima et al., 2000). La administración de MGA bloquearía el retorno al estro en las novillas que habrían presentado celo espontáneo en el final del ciclo estral. En ese ejemplo, la administración de MGA por 7 días permitió que las novillas que estaban en el inicio del ciclo estral alcanzasen por lo menos el día 7 de desenvolvimiento del CL, estadio en el que la PGF-2 es capaz de regredir el CL. Por lo tanto, la administración de MGA en la dosis diaria de 0,5 mg por novilla por 7 días y de la inyección de PGF-2 vía intramuscular en el día 7 consigue controlar el estro durante el tiempo de vida del CL con apenas 7 días de administración de MGA. Con todo, la tasa de concepción seria menor, si las novillas hubiesen sido inseminadas en ese estro. Tanto para prevenir la en ese estro como para conseguir controlar las ondas foliculares, las novillas recibieron una inyección de hormona liberadora de gonadotropinas (GnRH) por la vía Im en el día 4 después del ultimo día de administración de MGA y una inyección de PGF-2 7 días después de la aplicación de GnRH, en el fondo, el protocolo con administración de MGA y PGF-2 presincroniza el desenvolvimiento folicular, de forma que la inyección posterior de GnRH induce la ovulación, el desenvolvimiento del CL y el surgimiento de los folículos, de manera 102 que la administración de PGF-2 7 días más tarde induce la regresión del CL simultáneamente el desenvolvimiento del folículo dominante sincronizado. Otra alternativa es el uso del CIDR (controlled internal drug release) Hipotéticamente seria posible iniciar el protocolo Ovsynch 2 días después de la retirada del CIDR colocado por un periodo de 7 días y de administrar la PGF-2 en el momento de la remoción. Ese programa garantiza una elevada tasa de renovación folicular con la primera inyección de GnRH. Otra alternativa seria colocar el CIDR simultáneamente a las aplicaciones de GnRH y PGF-2 para garantizar la exposición a la progesterona, y evitar la ocurrencia prematura del estro y estimular el estro en los animales en anestro (Thatcher et al., 2004a). Esquema 15. Programa de tratamiento y resultados asociados al protocolo 7-11 Synch. Desarrollo Folicular PGF-2 GnRH PGF-2 MGA (7 dias) ….. 1 7 11 días 11 Días de Tratamiento Fuente: Kojima et al., 2000. ….. 18 103 Esquema 16. Protocolo MGA. Detección del celo e IA 24 a 60 horas después de PGF. GnRH y tiempo de no respuesta a la IA 72 horas después de PGF Fuente: Dejarnette, 2007. 7.3.3. Protocolo Heatsynch (celo sincronizado) El protocolo Ovsynch es más eficaz cuando es iniciado entre el día 5 y 12 Del ciclo estral. Por lo tanto los programas que involucran presincronización, tales como el Presynch-Ovsynch y/o Presynch-Heatsynch, pueden resultar en mayor tasa de preñez en el primer servicio. Después del primer servicio, el aumento en la tasa de preñez depende de la mejoría en la sobrevivencia de los embriones y de la reinseminación rápida de las vacas que no preñaron o no consiguieron mantener la gestación. Entre los diversos métodos utilizados para identificar vacas no gestantes se incluyen la detección del celo, la verificación de las concentraciones de progesterona, los test bioquímico/inmunológicos, la ultrasonografía y el examen de palpación rectal (Bartolomé et al., 2002a) Una estrategia de control del momento de la ovulación es la aplicación de estradiol exógeno, que es capas de inducir un pico de LH a través del estimulo de la secreción de GnRH por el hipotálamo, cuando es administrado en un ambiente con bajos niveles de progesterona en el final del diestro y proestro. El pico de LH inducido por el estradiol dura cerca de 10 horas, lo que se asemeja al pico espontáneo y es más extenso que el inducido por la GnRH. El cipionato de estradiol (ECP) una forma esterificada de estradiol-17b comercializada para uso en 104 bovinos, ha sido usada como componente de los programas de inseminación artificial en tiempo fijo (IATF) en vacas lecheras en lactación. El ECP es utilizado para sustituir la segunda inyección de GnRH del protocolo Ovsynch, siendo titulado Heatsynch (celo sincronizado). Las vacas son presincronizadas con 2 inyecciones de PGF-2 administradas con un intervalo de 14 días, siendo el Heatsynch iniciado 14 días después de la segunda inyección. Las vacas entonces reciben una inyección de GnRH seguida por PGF-2 7 días más tarde. El ECP (1mg im) es administrado 24 horas después de la inyección de PGF-2 y las vacas son inseminadas 48 horas más tarde. Las tasas de preñez con el uso del protocolo Heatsynch y Ovsynch no presentan diferencias (Bartolomé et al., 2002a) Esquema 17. Esquema general del protocolo Heal–synch. días días días día días Fuente. Dejarnette, 2007. En vacas lecheras en lactación, los porcentajes de detección de celo y ovulación después de la aplicación del ECP fueron de 75,7% y 86,5%, respectivamente. El estro ocurrió en 29,0 +-1,8h (n=28) después de la administración del ECP. Los intervalos medios hasta la ovulación fueron de 55,4 +-2,7h después de la aplicación del ECP y de 27,5 +-1,1h después del inicio del estro. Como el 75% de las ovulaciones ocurrieron entre las 48 y 72 horas después de la administración del ECP, se recomienda que toda vaca en la que el estro sea detectado hasta 1,5 días después de la inyección del ECP sea inseminada en el momento de la detección y todas las restantes a las 48 horas. Con base en las tasas de sincronización de la ovulación y de preñez, El ECP puede ser utilizado en el lugar de la GnRH como una opción para inducir la ovulación en la IATF. Como las vacas lecheras en lactación presentan menores concentraciones plasmáticas de 105 estradiol en el periodo preovulatorio y el estro es menos intenso, la elevación el nivel de estradiol después de la inyección de ECP compensa una deficiencia inducida por la lactación, y nuestra experiencia muestra que las vacas que expresan celo son más fértiles. La secreción de LH es directamente regulada por la GnRH, cuando el estradiol induce la secreción de LH de forma indirecta a través de la retroalimentación positiva de la secreción de GnRH en el hipotálamo, que estimula la secreción de LH. Si las vacas son anovulatorias (anestro ó no desarrollan retroalimentación positiva al estradiol), el protocolo Heatsynch puede no ser tan eficiente como el Ovsynch a base de GnRH. El mayor tono uterino, la facilidad en la inseminación y la ocurrencia del estro con el uso del protocolo heatsynch son hechos bien recibidos por los inseminadotes (Thatcher et al., 2004b). Las tasas de concepción y de preñez fueron evaluadas en 750 vacas lecheras en lactación sometidas a dos programas de manejo reproductivo en tres rebaños comerciales de ganado lechero en la región central del estado de California (Cerri et al., 2003). Los tratamientos fueron: IATF después de un protocolo de Heatsynch o IA con detección de celo. En ambos grupos, las vacas fueron presincronizadas con 2 inyecciones de 25mg de PGF-2 administradas con un intervalo de 14 días. 14 días después de la segunda inyección de PGF-2 las vacas recibieron 100mg de GnRH seguida de una inyección de 25mg de PGF-2 7 días más tarde. Las vacas en el grupo de detección del estro fueron inseminadas artificialmente cuando fueron observadas en estro en los siguientes 7 días, en cuanto a las del grupo Heatsynch/IATF recibieron una inyección de 1 mg de ECP 24h después de la PGF-2 y fueron inseminadas 48 h más tarde. Toda vaca observada en estro antes de la IATF en el grupo de Heatsynch fue inseminada después de la detección. La preñez fue diagnosticada por ultrasonografia en el día 31 después de la IA y reconfirmada a través de palpación rectal a los 45 y 65 días pos IA. Las tasas de preñez en el día 45 después de la IA fueron mayores en las vacas del 106 protocolo Heatsynch de lo que las sometidas a IA después de la detección del estro (Thatcher et al., 2004b). En un estudio de 340 vacas en lactancia (Bartolomé et al., 2002a), normales en términos de reproducción, en el período de septiembre de 2000 a mayo de 2001, fueron utilizadas dos protocolos diferentes de resincronización con base en la fase del ciclo estral, determinada por examen rectal. Las vacas con cuerpo lúteo (diestro n=216) fueron tratadas con PGF-2 e inseminadas después de la detección del estro en un intervalo de 2 a 7 días. En las vacas cuyos estros no fueron observados hasta el día 14 (día 7 y 12 del ciclo estral si hubiesen respondido a la prostaglandina) fueron sometidas al protocolo Ovsynch. Las vacas con un folículo ovárico palpable y tono uterino o con un cuerpo lúteo hemorrágico (proestro y metaestro) fueron tratadas con GnRH y 8 días más tarde (día 7 y 12 del ciclo estral) sometidas al protocolo Ovsynch (n=119) (Bartolomé et al., 2002a). Esquema 18. Protocolos de resincronización de vacas lecheras en lactación diagnosticadas como vacías en un examen de palpación rectal en el día 45 post inseminación. PGF-2/Ovsynch PGF-2 D0 GnRH PGF-2 GnRH IATF D14 D21 D23 D24 CL GnRH/Ovsynch GnRH GnRH PGF-2 GnRH TAI 16 h D0 Folículos/tono Cuerpo Hemorrágico/ edema Fuente. Bartolomé, 2002a. D8 D15 D17 D18 107 En el caso de las vacas en diestro, 39,3% (85/216) fueron detectadas en estro después de la administración de PGF-2 y 60,7% (131/216) fueron inseminadas artificialmente en tiempo fijo. La tasa de preñez en el día 45 fue semejante en las vacas en diestro sometidas al protocolo PGF-2 + Ovsynch con inseminación artificial en tiempo fijo (32,8% [39/11]).Entre las vacas en diestro, no fue observada diferencia estadística en la tasa de concepción entre las inseminadas con detección de estro (37/85; 43,5%) o sometida a IATF (35,9%). Esa diferencia numérica (7,6%) tal vez fuese significativa, si hubiese un mayor número de vacas en cada categoría (Bartolomé et al., 2002a). En un estudio realizado de agosto a diciembre de 2001 con 332 vacas lecheras en lactancia se evaluó la Tasa de Preñez con el uso de protocolos Ovsynch (n=166) y Heatsynch (n=166) en vacas diagnosticadas como no preñadas en el examen de ultrasonido en el día 27 después de la IA. Esquema 19. Protocolos para resincronización de vacas lecheras en lactación diagnosticadas como vacías en un examen de ultrasonografía en el día 27 post inseminación. Heatsynch Dia 0 Ovsynch GnRH Dia 7 PGF-2 Dia 8 ECP (1 mg, 0,5cc) Dia 9 Día 10 IA en el Estro IATF Dia 0 GnRH Dia 7 PGF-2 Dia 9 GnRH +16h IATF Fuente. Thatcher et al., 2004a. En el día 0, las vacas fueron clasificadas de acuerdo con las diferentes fases del ciclo estral, determinadas por palpación rectal y ultrasonido. La cantidad de vacas 108 en los diversos estados fue la siguiente: diestro (46,4% [154/332]), Metaestro (14,8% [49/332]), proestro (22% [73/332]), ovarios quísticos (14,1% [47/332]) y anestro (2,7% [9/332]). No fue observada diferencia en la tasa de preñez en los servicios de resincronización en el día 27 y en el día 50 con el uso del protocolo Heatsynch y Ovsynch. Tabla 4. Tasa de preñez en el día 27 y 50 y perdidas de preñez con el uso del protocolo Ovsynch y Heatsynch en la resincronización de vacas diagnosticadas como vacías en el examen de ultrasonido en el día 27 pos I.A. Protocolo TP en el Día 27 TP en el Día 45 Perdida de Preñez Nº % Nº % Nº % Ovsynch 33/127 26, 0 30/166 18,1 8/33 24,2 Hetasynch 34/132 25,8 33/166 19,9 6/34 17,6 Fuente. Thatcher et al., 2004a. Las tasas de preñez de acuerdo con la fase de el ciclo estral son mostradas en la tabla 5 en las vacas en metaestro, la TP en el día 27 y 50 fue mayor con el Heatsynch (52,2% y 44,4%) de que en el Ovsynch (15,4% y 9,1%). Cuando las vacas están en metaestro, ya fue iniciada una onda de desarrollo folicular y una inyección de GnRH no comienza una nueva onda. Consecuentemente esas vacas ovulan más cerca de la inyección de prostaglandina de forma que es probable que las sometidas al Heatsynch expresen celo y sean inseminadas después de la detección. De hecho un alto porcentaje de vacas en metaestro fue inseminado en el día 9 en el grupo Heatsynch (11/27) en comparación con el Ovsynch (0/22). Las vacas en el grupo Ovsynch no fueron detectadas en estro, siendo inseminadas en el día 10, el que probablemente fue más tarde (Bartolomé et al., 2002b). 109 Tabla 5. Tasa de preñez en el día 27 y 50 en vacas sometidas a resincronización en diferentes fases del ciclo estral. TP en el Día 27 TP en el Día 50 Fase Ovsynch Heatsynch Ovsynch Heatsynch Nº % Nº % Nº % Nº % Diestro 20/64 31,2 14/58 24,1 17/82 20,7 12/72 16,7 Metaestro 2/13 15,4b 12/23 52,2a 2/22 9,1b 12/27 44,4a Proestro 5/26 19,6 7/29 24,1 5/35 14,3 6/38 15,8 Quistica 6/19 31,2b 1/19 5,3c 6/22 27,3d 2/25 8,0c Fuente. Bartolomé, 2002b. a,b,c,d, Porcentajes con distinta letra difieren estadisticamente De enero a diciembre de 2002 fue realizado un estudio con un rebaño de 3.000 vacas lecheras, siendo 877 diagnosticadas como vacías con base en un examen de ultrasonido en el día 30 pos-IA (Día 0). El diagnostico de preñez fue alterado del día 27 al 30 para tener un mayor número de vacas con CL y acelerar el proceso de diagnostico con hechos de desarrollo más adelantados. En el D0 las vacas fueron clasificadas de acuerdo con la fase del ciclo estral y fue colectada una muestra de sangre para posterior análisis de la concentración de P4 en plasma. Con base en el estadio del ciclo estral en los ovarios, las vacas fueron distribuidas así: vacas en diestro, Ovsynch (n=216), Quicksynch (n=92, enero a mayo) o Modified Quicksynch (n=110, junio a diciembre) (esquema 19). Las vacas en metaestro fueron distribuidas en Ovsynch (n=54), Heatsynch (n=50), o GnRH + Ovsynch (n=50). Las vacas en proestro fueron distribuidas en Ovsynch (n=75) o GnRH + Ovsynch (n=73). Las vacas con ovarios quistitos fueron distribuidas en Ovsynch (n=75) o GnRH + Ovsynch (n=78). 110 Esquema 20. Protocolos utilizadas en la resincronización de vacas de acuerdo con la fase del ciclo estral después del diagnostico de preñez en el día 30 pos-IA. PGF2a ECP * IATF D1 D2 D3 Quicksynch D0 PGF2a ECP Ped/IA D0 D1 D2 Nota: Detección de estro 24h post admin. de ECP Ped/IA Ped/IA Modified Quicksynch D3 D4 Ovsynch Nota: Ped = Actividad registrada en el podómetro: Día 4 sin actividad inicio del Ovsynch GnRH GnRH PGF2a GnRH IATF D17 D18 GnRH/Ovsynch D0 D8 D15 Fuente. Thatcher et al., 2004b. El diagnostico de preñez para la inseminación de las vacas resincronizadas fue hecho en el día 30 a través del examen de ultrasonido. La distribución de las vacas clasificadas de acuerdo con la fase del ciclo estral fue la siguiente: diestro 47,7%, metaestro 16,9%, proestro 16,4%, quistes ováricos 17,4%, y anestro 1,6%, en cuanto a la progesterona, en las vacas en diestro el 95% de estas presentaban niveles superiores a 1ng/ml, estos resultados coinciden con un estudio anterior en el cual el 46% de las vacas preñadas estaban en diestro. También se observo que el 61% de las vacas no preñadas tenían P4 mayor a 1ng/ml (Thatcher et al., 2004b). No fue observada diferencia en las tasas de preñez en las vacas en diestro sometidas a Ovsynch (34,7%), ó Modified Quicksynch (28,2%) ó en metaestro sometidas a GnRH + Ovsynch (31,8%), ó GnRH + Ovsynch (27,4%), la tasa de preñez disminuyo en vacas en diestro sometidas a Quicksynch (21,7%), en 111 metaestro sometidas a Ovsynch (24,1%) o al Heatsynch (18%) y con quistes ováricos que recibieron Ovsynch (20%) (Thatcher et al., 2004b). 7.3.4. Protocolos con la Utilización de GnRH + CIDR El CIDR es un dispositivo intravaginal con progesterona, utilizado con asociación con otras hormonas para sincronizar el estro en vacas y novillas de carne y leche. Este producto fue desarrollado en Nueva Zelanda y viene siendo usado hace ya varios años para adelantar el primer estro en la pubertad en novillas y el primer estro posparto en vacas. La tasa de retención del CIDR en un intervalo de siete días es superior al 97%. En algunos casos, ocurre irritación vaginal, que resulta en la observación de un moco claro, turbio o amarillo, cuando se retira el dispositivo. Los casos de moco son normales, no afectando la eficacia del producto. Se debe tener cuidado en el manoseo de esos dispositivo siendo necesario el uso de guantes de látex para evitar la exposición de la progesterona de la superficie del CIDR y a la introducción de agentes contaminantes en la vagina de las hembras tratadas (El-Zarkouny et al., 2001). La respuesta de los ovarios a la GnRH depende de la fase de crecimiento folicular en el que fue administrado. Un alto porcentaje de vacas en los últimos estadios del ciclo estral (día 15 a 17) no consiguieron ovular después de la administración del GnRH (Moreira et al., 2000). De los protocolos de la sincronización del estro o de la ovulación actualmente utilizado en vacas de carne con becerro al pie, el CO-Synch tiende ha ser el más rentable y menos intensivo en mano de obra de lo que otros protocolos de sincronización con IATF. Una desventaja del CO-Synch es que aproximadamente 10 a 20% de las vacas de carne con becerro al pie presentan celos antes e inmediatamente después de la inyección de PGF-2, a menos que esas vacas sean detectadas en estro e inseminadas, ellas no irían a preñar después del uso del protocolo CO-Synch (Lamb et al., 2004). 112 En un estudio que comparo los tratamientos CO-Synch y CO-Synch más CIDR del día – 7 al día 0 mostró que la inclusión del dispositivo mejoro las tasas de preñez después de la IATF pero la progesterona aparentemente no mejoro las tasas de preñez en las vacas de carne con becerro al pie que estaban ciclando en el inicio de los tratamientos, también mostró que las variables del lugar entre las que se incluían diferencias en el pasto y en la dieta, en la composición de la rasa, en la condición corporal, en el intervalo posparto y en la localización geográfica, pueden afectar el resultado de los protocolos con IATF (Lamb et al., 2004). En otro estudio realizado en diferentes localidades, el estro de 2.630 vacas de carne con becerro al pie fue sincronizado, haciéndose inseminación artificial después de 5 tratamientos (ver figura). El porcentaje de vacas que estaba ciclando en el principio de los tratamiento fue de 66,8% (1.534 de 2.296 vacas). El porcentaje de vacas cíclicas vario de 38 a 90% entre los diversos locales las tasas totales de preñez en el día 30 al día 35 variaron de 39 a 67% las mayores tasas de preñez fueron alcanzadas con el protocolo Hibrid Synch + CIDR (57,9%) los resultados obtenidos con el CO-Synch + CIDR (53,6%) y con el Hibrid Synch no tuvieron diferencias significativas, pero fueron más altas que el tratamiento control (52,3%) y que el CO-Synch, talvez las bajas tasas de preñez asociadas al COSynch sean consecuencia del atraso en la IATF realizado a las 60 horas en comparación a los resultados anteriores que presentaban tasa de preñez de 47 a 52% cuando fue hecha a la 42 horas (Larson et al., 2004). 113 Esquema 21. Protocolos de los experimentos en vacas de carne con becerro al pie tratadas con GnRH, PGF-2 y CIDR. PGF-2 Control CIDR IATF y GnRH Detección de estro e I.A GnRH PGF-2 GnRH PGF-2 IATF y GnRH CO-Synch CIDR CO-Synch+CIDR GnRH PGF-2 Hybrid Synch IATF y GnRH Detección de estro e I.A GnRH PGF-2 Hybrid Synch+CIDR -17 IATF y GnRH CIDR IATF y GnRH Deteccion de celos e I .A -7 0 Días en relación a 60 84 Horas en relación a Inyección de PGF-2 la inyección de PGF-2 Fuente. Thatcher et al., 2004b. 7.4. MANIPULACIÓN DEL DESARROLLO FOLICULAR PARA LA SINCRONIZACIÓN DE ESTROS Una de las mayores limitantes para la aplicación masiva de la sincronización de estros es la variabilidad en la respuesta de los animales tratados. Si bien antes se creía que se debía a factores exógenos, trabajos recientes han demostrado que es debido principalmente al estadio o viabilidad de los folículos en el momento de realizar el tratamiento (Bó et al., 1995). 114 La aplicación de la ultrasonografía permitió descubrir qué sucedía con el desarrollo folicular, comprobando la existencia de hasta 2 o 3 ondas foliculares por ciclo, sus diferentes estadios; como reclutamiento, selección dominancia y regresión u ovulación (son fases en las cuales los folículos crecen y uno se hace dominante, o sea más grande, y dependiendo de la etapa del ciclo en la que suceda pude regredir u ovular) esto permitió desarrollar nuevos protocolos de sincronización y de superovulación, así como de tratamiento de patologías como los quistes foliculares (Bó et al., 1995). 7.4.1. Relacion: Dinámica Folicular, progestágenos y fertilidad De la misma manera que lo enunciado anteriormente la ultrasonografía permitió descubrir qué sucedía con el desarrollo folicular cuando los animales eran tratados con dispositivos o implantes conteniendo progesterona o progestágenos sintéticos. El nombre genérico de progestágenos se le da a un grupo de compuestos que son similares a la progesterona. Estos compuestos están en el mercado desde hace varios años, inclusive desde antes que se comenzara la utilización masiva de PGF-2 para sincronización de celos. Dentro de estos compuestos podemos citar los progestágenos de administración oral como el Acetato de Melengestrol (MGA), los implantes subcutáneos de Norgestomet como el Crestar y los dispositivos intravaginales con progesterona como el CIDR-B, el DIV-B y el PRID (Bó et al., 1995). 115 Fotografía 2. Implantes y dispositivos utilizados para la aplicación de progestágenos y progesterona. Fuente. Nasser, 2006. Las altas concentraciones de progesterona tienen un efecto supresivo sobre la secreción pulsátil de LH, mientras que la FSH no es afectada. A su vez, la secreción pulsátil de LH tiene un efecto crítico en el desarrollo del folículo dominante. Pulsos de alta frecuencia estimularán el crecimiento del folículo dominante, mientras que pulsos de baja frecuencia afectarán su desarrollo e inducirán su regresión prematura. Dentro de esta temática se comenzó a estudiar el efecto de los progestágenos sobre los pulsos de LH y el folículo dominante. Este efecto de los progestágenos fue comprobado para casi todo los disponibles en el mercado (MGA, Crestar, CIDR, PRID, etc.) en la tabla siguiente se encuentran los resultados de un experimento donde se utilizó el Crestar. El objetivo fue investigar cuantos implantes subcutáneos de Norgestomet eran necesarios para inducir una frecuencia de pulsos de LH similares a los de la fase luteal. En este experimento se administraron 2 dosis de PGF, una en el Día 7 y otra en el día 8 para lisar el CL y se colocaron 1, 2, 4 y 8 implantes de Crestar en el día 7 (Bó et al.,1997). 116 Tabla 6. Frecuencia de los pulsos de LH y tamaño del folículo dominante en vacas implantadas con Norgestomet por 9 días y en ausencia de un CL funcional. Datos obtenidos en el día 9 de la colocación del implante de de Norgestomet. Fuente. Adaptado de Sanchez et al., 1995. a,b Datos con distintas letras en la misma columna difieren estadisticamente 7.5. PROTOCOLOS CON PROGESTERONA Y ESTROGENOS 7.5.1. Estrógenos Estradiol 17-B La utilización de progesterona y estrógenos puede afectar el desarrollo folicular, suprimiendo el desarrollo del folículo dominante y de esta manera sincronizar el desarrollo de una nueva onda folicular fue investigado críticamente por el grupo de trabajo de Bó et al, en1993. Las conclusiones de una serie de trabajos realizados por este grupo fueron que: los progestágenos y el E-17B administrados en cualquier momento del ciclo estral, induce el crecimiento sincrónico de una onda folicular, aproximadamente 4,3 días después de la inyección de 5mg E-17B; indicaron además que el estradiol suprime el desarrollo de los folículos a través de la supresión de las gonadotrofinas circulantes (FSH y LH) y no por un efecto local a nivel del ovario (Bó et al., 1994). 117 Tabla 7. Intervalo entre el tratamiento y el crecimiento de una nueva onda folicular en novillas tratadas con un implante de progestágeno y una inyección de 5mg de estradiol- 17b (E-17b) un día después. Fuente. Bó et al., 1994. Benzoato de Estradiol (BE) Luego de los trabajos realizados con el E–17b, se diseñaron una serie de experimentos para evaluar la eficacia de otro estrógeno que se encuentra disponible en el mercado, el benzoato de estradiol, los resultados de estos trabajos demostraron que el BE es tan efectivo como el E-17B para sincronizar el desarrollo folicular (Bó et al., 1995). Trabajos posteriores compararon el efecto de las dosis de EB y E–17b y su influencia en el día de comienzo de la nueva onda folicular. Los resultados de este experimento demostraron que la dosis de 5 mg (E17b y EB) indujo el desarrollo de una onda folicular en forma más consistente (Bó, 1995). Diversos experimentos son realizados a fin de evaluar la efectividad de EB en cuanto a: presentación comercial (solución oleosa inyectable o capsulas intravaginales), día de administración (el mismo día de la inserción del progestágeno o el día siguiente), dosis inferiores a 5mg en combinación con 50mg de progesterona vía intramuscular, diferente tipo de animal (novilla-vaca, lechecarne), a fin de ajustar protocolos y dosis (Bó, 1995). Se utilizaron 32 vacas hereford, que recibieron un CIDR en momentos no conocidos del ciclo estral (D0) y fueron distribuidos al azar en 4 grupos (n=8 por grupo): un grupo control (no BE) y 3 grupos que recibieron las siguientes dosis de BE: 1mg, 2,5mg, y 5mg combinados con 50mg de progesterona (P4) 118 administrados vía im. Los animales fueron examinados diariamente por ultrasonografía ovárica para determinar el crecimiento de la próxima onda folicular (Caccia et al., 1998). Tabla 8. Efecto de distintas dosis de EB combinadas con 50mg de progesterona administradas en el momento de la inserción del CIDR en el comienzo de la próxima onda folicular en vacas Hereford. Fuente. CGR, 2002. Se demostró que una dosis de 2,0 a 2,5mg de Benzoato de Estradiol unida a 50mg de progesterona administrados en el momento de la colocación del dispositivo vaginal es más eficiente en la inducción y sincronía de una onda de desarrollo folicular (Caccia et al., 1998). Se diseño un experimento para evaluar las tasas de preñez en hembras bovinas sincronizadas para IATF con diferentes protocolos. El trabajo se realizo en un establecimiento ganadero del norte de santa fe (Argentina), en el que se utilizaron un total de 150 vacas cruza cebú, con cría al pie, con un periodo post parto promedio de 75 días, y una condición corporal (CC) de 2,5 a 3 (escala de 1 a 5). En el día 0, las vacas del grupo 1 (G1) recibieron una esponja impregnada con 250mg de acetato de medroxiprogesterona (chronogest®, Intervet) y 2mg de benzoato de estradiol (Estradiol® 10, Lab. Río de Janeiro) por vía intramuscular (im). Las vacas del grupo 2 (2) recibieron el mismo tratamiento, pero con una inyección de 10mg de acetato de medroxiprogesterona en combinación con 3mg de EB (indugest® 1, intervet). el grupo 3 (G3), fue tratado con un dispositivo de silicona impregnado con 1gr de progesterona natural de liberación lenta controlada 119 (DIB®, Syntex) y 2mg de EB (Estradiol 10, Lab, Río de Janeiro) (im). En el dia 8 se retiraron los dispositivos y se aplico 1 dosis de 500ug de cloprostenol (Ciclase®, Syntex) (im) y a las 24 h (Día 9) se aplico 1mg de EB (im). Treinta y dos horas más tarde se IATF la totalidad de las vacas con semen congelado de un único eyaculado. Los diagnósticos de preñez fueron realizados por ultrasonografía transrectal (100 Falco Vet., Pie Medical, con transductor 8 MHz), 30 días después de la inseminación artificial (Venturini et al., 2007a). Tabla 9. Preñeces logradas por IATF con tres protocolos diferentes de sincronización de celos. Grupo Porcentajes Totales 1 2 56,0 48,0 28/50 24/50 3 52,0 26/50 Fuente: Venturini et al., 2007a. En un estudio que buscaba evaluar el efecto de la administración de 0,5mg de EB al momento de colocar un dispositivo en novillas que fueron previamente sincronizadas con un dispositivo e IATF, sobre los porcentajes de preñez a la IATF, retorno y final, y de retorno. Se utilizaron 112 novillas Angus negras (58) y rojas (54) con 15 meses de edad y una condición corporal de 3,5 a 4 (escala 1 a 5). El día 0 es coloco un DIB más 2mg de BE, im, en el día 8 se retiro el DIB y se inyecto 0,5mg de cipionato de estradiol y 150ug de D(+) Cloprostenol, im y el día 10 se realizo la IATF (50-53h post DIB). Se utilizo semen congelado/descongelado en pajuelas de 0,5ml, provenientes de 2 toros (A y B) de probada fertilidad. 13 días post IATF (Día 23) las novillas se distribuyeron aleatoriamente dentro de raza y toro para recibir un DIB de segundo uso 0,5mg de BE (BE05) o solo con el DIB (control). El día 30 se retiro el DIB y al otro día comenzó la detección de celos e inseminación por 4 días, utilizando semen congelado/descongelado proveniente de 2 toros que habían demostrado en trabajos previos similar comportamiento reproductivo. El diagnostico de gestación se realizo por ecografía (transductor 120 transrectal 4-7MHz, sosnovet 2000) a los 61 días post IATF para determinar preñez de la IATF y del retorno (Madero et al., 2007). Tabla 10. Porcentajes de preñez y retorno de vaquillonas de 15 meses que fueron IATF y Resincronizadas con dispositivos intravaginales con progesterona recibiendo o no 0,5mg de BE al momento de colocar los dispositivos. Tratamientos Preñez IATF Retorno Preñez Retorno Preñez final BE05 69,6 (39/56) 29,4 (5/17) 40,0 (2/5) 73,2 (41,56) Control 60,4 (32/53) 52,4 (11/21) 36,4 (4/11) 67,9 (36/53) BE05 + Control 65,1 (71/109) 41,0 (16/39) 37,5 (6/16) 70,6 (77/109) Fuente. Madero et al., 2007. Se concluye que la administración de 0,5mg de BE no perjudica el porcentaje de preñez ala IATF; no obstante, no mejora el porcentaje de retorno, ni la preñez final por lo que no seria necesaria su aplicación (Madero et al., 2007). La administración de Benzoato de Estradiol (BE) al retirar los dispositivos intravaginales con progesterona, evita un encierre posterior de los animales comparado con el protocolo tradicional que utiliza el BE alas 24 horas post dispositivo. En este caso, algunos investigadores han propuesto que la IATF debe realizarse a las 36 horas post dispositivo. El objetivo de un trabajo realizado por Venturini et al. (2007c), fue evaluar un protocolo de sincronización de celos aplicando BE al retiro de los dispositivos e IATF 36 horas post retiro de los dispositivos, comparándolo con el protocolo tradicional. Se trabajo durante 2 años, utilizando 750 vientres cruzas Brangus y Bradford ¼ a 3/8 (vacas con cría + vacas secas: 357; novillas de 24 meses 348), las vacas con cría tenían un post parto de 80 a 100 días y una condición corporal de todos los vientres de 4 a 4,5 (escala de 1 a 5), el D0 se coloco un TRIU-B más 2mg de benzoato de estradiol im. En el D8 se retiro el TRIU-B, y se administro 150ug de D. Cloprostenol y los animales se distribuyeron en forma aleatoria dentro de cada categoría a recibir 1mg de BE en dicho momento (grupo BE0) ó 24h más tarde (grupo BE24). El servicio se realizo por IATF a las 36 horas (BE0) o 56 (BE24) de retirados los TRIU-B. a las vacas 121 con cría se les practicó un destete temporario entre el retiro del dispositivo y la IATF. En el servicio se uso semen congelado/descongelado en pajuelas de 0,5ml proveniente de un toro probado. El diagnostico de palpación se realizó por palpación transrectal a los 70 días post IATF (Venturini et al., 2007c). Tabla 12. Porcentaje de preñez en vacas y novillas que recibieron un tratamiento de control del ciclo estral basado en progesterona en dos años de trabajo, según tratamiento. Años Categoría Tratamientos Vacas I Novillas Vacas II Novillas Preñez % BE0 50,0 (25/50) BE24 52,6 (30/57) BE0 36,4 (24/66) BE24 37,5 (12/32) BE0 40,8 (51/125) BE24 54,4 (68/125) BE0 44,0 (55/125) BE24 60,8 (76/125) 51,4 (55/107)a 36,7 (36/98)b 47,6 (119/250) 52,4 (131/250) a,b Porcentajes con distintas letras son estadísticamente diferentes EFECTOS PRINCIPALES Años I + II Categoría Tratamientos Vacas + Novillas Preñez % BE0 42,3 (155/366)a BE24 54,9 (186/339)b Fuente. Venturini et al., 2007c. a,b Porcentajes con distintas letras son estadísticamente diferentes Se concluye que la administración de BE al momento del retiro del dispositivo con la realización de una IATF a las 36h de retirado el mismo perjudican el porcentaje de preñez comparado con el tratamiento tradicional (BE a la hora 24 de retirado el dispositivo e IATF a la hora 56 (Venturini et al., 2007c). 122 Valerato de Estradiol (EV) El EV es un estrógeno de vida media larga que se encuentra disponible en el mercado asociado con implantes que contienen el progestágeno sintético Norgestomet. Este preparado comercial es el Crestar y consiste en un implante de liberación lenta de Norgestomet que se coloca subcutánea en la oreja del animal, el tratamiento incluye además una solución inyectable oleosa que contiene 3mg de Norgestomet y 5mg de Valerato de Estradiol (Bó, 1995). En estudios preliminares se observo que el EV tenia un efecto inhibitorio sobre el desarrollo folicular (Bó, 1994), este experimento seria repetido más adelante por Martínez et al. (1997), observándose un intervalo onda tratamiento más largo con el EV que con el E–17b y, a su vez, el comienzo de la onda fue más variable, lo que trajo como consecuencia una ovulación variable (Bó et al., 1995). Valerato de22. Estradiol Desarrollo Folicular Esquema Valerato de yEstradiol y Desarrollo Folicular. ~ 5,5.días (3 – 8) 12 FSH 10 8 6 LH Diámetro Folicular (mm) N + EV 4 9 0 Días Fuente. Bó et al., 1991. Bo et al., 1991 7.5.2. Progesterona La utilización de progestágenos en la sincronización de estros en bovinos data de los años 50, inicialmente siendo administrados por 11 a 14 días a semejanza de los sistemas desarrollados para ovinos. Posteriormente en concordancia con los bajos índices de fertilidad después de la sincronización, el período se disminuyó a 123 7–9 días, presentándose un incremento en los índices de gestación (Gordon, 1996). Los progestágenos son utilizados en la sincronización de estros para aumentar la vida útil del cuerpo lúteo, permitiendo que las vacas presenten regresión del cuerpo lúteo y consiguiente estro en un mismo periodo (Díaz Gonçalves, 2002). Acetato de Melengestrol (MGA) Es el progestágeno que más se ha utilizado en Norteamérica para la sincronización de estros, entre sus ventajas se incluyen: bajo costo, vía de administración oral y muy baja toxicidad, la desventaja podría darse en animales en pastura para asegurar un uniforme consumo de MGA. Uno de los tratamientos con este progestágeno, consiste en administrar 0,5 mg MGA/cabeza/día durante 14 días, seguido de una inyección de PGF-2, 17 días después de suspenderse la administración de MGA, Se detecta celo y se insemina, se ha reportado que este régimen resulta en una buena sincronización de estros con buena fertilidad en novillas (Thatcher et al., 2004a). Esquema 23. Tratamiento con MGA/ PGF-2. MGA/PGF-2 PGF MGA (0.5mg/d) -31 -17 Dia 0 ver celo e I.A Fuente: Funston et al., 2002. La mayoría de las vacas estarán en estro pocos días después de suspendida la ración de MGA. El porcentaje de preñez será optimo, si se detecta estro se IA 12h post estro. La IATF en 72h después de la PGF-2, ha resultado en buena fertilidad en algunos rodeos y mala en otros, por lo tanto una alternativa es IA a todos los 124 animales 72h post PGF-2 y después de detectar estro e IA hasta los 120 h o directamente colocar todos a las 96 h de la administración de la PGF-2. Este tratamiento parece ser más efectivo en animales con condición corporal moderada a buena, comparado con los de condición corporal regular a mala. El destete temporario de 48 h incrementa el porcentaje de vacas de 2 a 3 años que quedaron preñadas en la primera parte de la época de servicio comparada con vacas de la misma edad y el mismo tratamiento pero sin destete temporario o que no recibieron ningún tratamiento (Funston et al., 2002). Otro régimen utilizado, es administrar MGA durante 7 a 9 días y aplicar una inyección de PGF-2 el último día. Este protocolo resulta en una fertilidad un poco más baja que si se aplica la PGF-2 17 días después del MGA. En este régimen, las vacas que comienzan a consumir MGA cuando se encuentran en el estadio final del ciclo estral, tiene la regresión luteal normal pero no ovulan debido a los altos niveles de MGA en la sangre. En estos casos el folículo dominante continúa creciendo y se transforma en un folículo persistente mientras se mantengan los niveles de MGA, produce altos niveles séricos de estrógeno y ovulara un ovocito no viable (Thatcher et al., 2004a). En Canadá, se ha desarrollado recientemente una novedosa forma de mejorar la fertilidad con este régimen; se administran 0,5 mg/cabeza/día de MGA durante 7 días y, además, se inyectan 5 mg de E–1743 y 100 mg de P444 el primer día en que se aplica MGA. El último día de administración de MGA se aplica una dosis luteolítica de PGF-2. Este régimen resulta en un estro fértil y bien sincronizado. La mayor parte del servicio ocurre en un periodo de 3 días, que reduce notablemente el tiempo y el trabajo para la detección de estros comparados con otros tratamientos (Martínez, 2005). 43 44 Estradiol–17β. Tipo de estrógeno. Progesterona. 125 Norgestomet (N) Es un progestágeno sintético utilizado en dos productos comerciales Syncro-MateB (SMB) y Crestar (Cr). El SMB, se encuentra actualmente descontinuado. Los implantes auriculares de progestágenos contiene Norgestomet (17α-acetoxi-11βmetil- 19-norpreg-4-en-3,30-diona), que presenta potencia cerca de 200 veces superior a la progesterona natural. Así, el implante hidronico de Syncro-Mate-B poseia 6mg de norgestomet, en cuanto que el implante silástico de Crestar posee 3mg de norgestomet. El implante de silicona provoca la liberación del progestágeno de forma homogénea y linear (Bó, 1995). El implante es colocado subcutáneamente en la oreja. el producto viene acompañado de una inyección que contiene 5mg de Valerato de Estradiol (EV) y 3mg de Norgestomet (N) que se administran en el mismo momento en que se coloca él implante. El implante es extraído 9 días después, La finalidad de estos implantes es mantener altos los niveles sanguíneos de progestágenos para suprimir la liberación endógena de hormona luteinizante, simulando la fase luteínica del ciclo estral. La regresión luteínica es alcanzada por la aplicación de valerato de estradiol en el inicio del tratamiento o por la aplicación de prostaglandinas en el momento de la remoción del implante (Baruselli et al., 2002). 126 Fotografía 3. Secuencia de la administración y retiro de un implante de Crestar (Norgestomet). Fuente. Walker, 2007. Esquema 24. Regimen Crestar. Iny 2ml 3mg Norgestomet 5mg Valerato de estradiol CRESTAR Impl. Auricular 0 DIA 9 10 Detección de celo e IA am-pm Fuente. Mellisho, 2006. Día 0: implante de norgestomet en la oreja, inyección de 2 cc intramuscular, de (norgestomet 3mg y valerato de estradiol 5mg.) Día 9: se quita el implante. Días 10–14: detección del celo e inseminación siguiendo la regla a.m. – p.m. 127 El uso de estos progestágenos en reproducción ha sido estudiado por más de 30 años (aún cuando todavía no se contaba con PGF en el mercado), investigadores de esa época, como Wiltbank, encontraron que la inyección de 5mg de EV podía inducir la regresión del CL; la idea es que el EV induzca la luteolisis y permita mantener altos los niveles inmediatos del progestágeno que luego serán mantenidos con la liberación lenta del implante subcutáneo. Los trabajos que utilizaron implantes de norgestomet en bovinos demostraron que más del 90% de los animales manifestaban estro después de la retirada del implante, con tasas de concepción variando entre 33 e 68% (Odde, 1990). Los Animales que están en anestro en el inicio del tratamiento también manifiestan estro después de la retirada del implante, pero presentan menor fertilidad que animales cíclicos Los trabajos recomiendan inseminar artificialmente los animales después de 48-54 horas del retiro del implante, con tasas de concepción aceptables (Odde, 1990). Se compararon las tasas de preñez en novillas cebúinas y mestizas Bos indicus x Bos taurus con empleo del implante de Crestar, asociado a una inyección de valerato o benzoato de estradiol en el día de la implantación, las novillas fueron divididas en dos lotes, llevándose en consideración el escore de condición corporal (ECC). Cada grupo recibió uno de los tratamientos: Tratamiento 1: las novillas recibieron un implante auricular de Crestar y una aplicación de Crestar inyectable de (3mg de norgestomet + 5mg de valerato de estradiol). Los implantes permanecieron hasta el D9 (D0=día del implante) cuando fueron retirados. En el Día 8 se aplico una inyección IM de 150 μg de D-cloprostenol (Preloban). Las inseminaciones artificiales en tempo fijo fueron realizadas 54 h después de la retirada de los implantes. Tratamiento 2: las novillas recibieron un implante auricular de Crestar y una inyección de 2mg de benzoato de estradiol + 50mg de progesterona en momento el momento de colocar los implantes (=D0). Los implantes fueron retirados en el D8 y en esta ocasión recibieron una inyección IM de 150 μg de D-cloprostenol (Márquez et al., 2001). 128 Las inseminaciones artificiales en tiempo fijo fueron realizadas cerca de 54 h después de la retirada de los implantes. Los diagnósticos de gestación fueron realizados 35 días después de las inseminaciones artificiales por ultrasonografía. La tasa de preñez fue significativamente superior cuando se empleo el benzoato de estradiol en vez de valerato de estradiol en el inicio del tratamiento de sincronización del estro y de la ovulación para inseminación artificial en tiempo fijo en novillas Bos indicus (Márquez et al., 2001). Tabla 12. Tasas de preñez (%) ajustadas (LSM) en novillas (Bos indicus x Bos taurus) sincronizadas con Crestar + valerato de estradiol o Crestar + benzoato de estradiol. ab Porcentajes con distintas letras so estadisticamente diferentes. Fuente. Madureira et al., 2001. Las diferencias en los índices de preñez pueden deberse al nivel de ciclicidad de los animales utilizados; otros reportes utilizando animales en posparto y novillas, reportaron índices de preñez similares. Autores como Wiltbank y Gonzáles Padilla, utilizando animales en anestro, reportaron altos índices de preñez. Estas observaciones llevaron a la importante conclusión de que la condición corporal de los animales tratados afecta significativamente la fertilidad (Márquez et al., 2001). 129 Igualmente se han reportado diferencias en la fertilidad con relación al estadio del ciclo al inicio del tratamiento: 47% con tratamientos iniciados antes del día 14 vs. 37% después del día 14 del ciclo, estos resultados están relacionados al efecto negativo de la exposición prolongada a los progestágenos y la formación de folículos persistentes (Odde, 1990). Tabla 13. Porcentaje de preñez de vacas en lactancia utilizando diferentes protocolos de sincronización con Crestar. Fuente. CGR, 2002. Combinación de Norgestomet Y PGF -2 Se ha cuestionado la acción luteolítica del estradiol cuando es aplicado en fases tempranas del ciclo estral. En un estudio se encontró que el 50% de las vacas tratadas en fases tempranas del ciclo no mostraron estro y tenían altos niveles de progesterona cuando se quito él implante (Pratt y Spitzer, 1994); estos resultados fueron igualmente observados por Bó et al. (1994), utilizando SMB45 en programas de Superovulación, por lo tanto algunos autores recomiendan aplicar PGF-2, 2 días antes del retiro de los implantes para aumentar los índices de preñez.En general se estima que un 10% de los animales tratados puede presentar CL al momento del retiro del implante y por lo tanto no tendrá estro y ovulación y esto es más significativo en vacas grandes o lecheras en las que se ha reportado hasta un 10% más de preñez con el uso de PGF-2, que en novillas, en general en estas últimas la mayoría entran en estro y ovularán por lo que no se justificaría el uso de la PGF-2 (Bó et al., 2004b). 45 Sincromate–B, marca comercial de progestágeno. 130 Combinación de Norgestomet + EV con GnRH Este protocolo fue desarrollado durante un ensayo, y consiste en la aplicación de GnRH al final del tratamiento con Norgestomet para inducir ovulación (Vasconcellos, 1994). Para este ensayo se utilizaron novillas Holstein que recibieron un implante subcutáneo de Crestar y la inyección de EV el día 0, los implantes fueron removidos el día 9 y la mitad de las novillas recibió 100 g46 de gonadorelina 30 horas después del retiro. Se encontró que la ovulación fue más sincrónica (56–64 h) y la preñez fue numéricamente mayor en las novillas tratadas con GnRH que en las no tratadas (ovulación 60–72 h). Esquema 25. Tratamiento de sincronización utilizando los implantes de norgestomet (crestar) con GnRH a las 30 h de removido el Implante y IATF, 54 h después de la remoción del implante. Crestar Fuente. Vasconcellos et al., 1999. Combinación de Norgestomet + EV con Benzoato de Estradiol (EB) Otra alternativa para inducir la ovulación es utilizar de 0,5 a 1 mg de EB a las 24 h de la remoción del implante de Norgestomet, e inseminar a las 50–52 h post retiro del implante, lo cual sincroniza la ovulación entre las 60–72 h postaplicación, comparado con la gran dispersión de estros en los animales que no recibieron EB. Con respecto a este tratamiento se encuentra diversidad en los resultados en su 46 Microgramos. 131 aplicación, pero en la mayoría de los casos los números son favorables a su utilización (Bó et al., 2004b). Esquema 26. Tratamiento de sincronización de celos e IATF con Crestar y BE. Crestar Fuente. Bó, 2004. Gráfica 11. Distribución de la ovulación en novillas holstein tratadas con Crestar por 9 días y 1mg de BE im 24h después. Fuente. Bó, 2004. 132 Tabla 14. Porcentaje de preñez en vacas y novillas tratadas con SMB más la administración de BE a las 24 horas de remoción del SMB. Fuente. Bó, 2004. ab porcentajes con letras distintas son estadísticamente diferentes Combinación de Norgestomet + EV con eCG La utilización de la eCG para estimular el desarrollo folicular fue estudiada en novillas prepúberes y vacas con cría o vacas lecheras en lactancia. Las dosis a ser utilizadas varían de 300 a 700 UI aunque con 700 UI se corre el riesgo de aumentar los porcentajes de mellizos (Bó et al., 2004b). Se han realizado diversos experimentos entre los que se destacan los que midieron el tiempo posparto y la condición corporal de los animales vs. los porcentajes de ciclicidad, ovulación y preñez y se concluye, que la condición corporal esta influenciada por el tiempo posparto, que debe ser mayor a 70 días, en los cuales los animales deben tener un score de condición corporal mayor o igual a 2,5 para obtener resultados satisfactorios. En los animales con menor score se observa que el tratamiento ayuda a las vacas a ciclar y tener mayor oportunidad de quedar preñadas durante los siguientes servicios (Bó et al., 2004b). 133 Uso del Norgestomet + eCG en Novillas Cruce Indicus La combinación de Norgestomet y eCG ha sido bastante usada en Australia para la sincronización de estros e IATF en novillas cruce Brahmán, principalmente en Queensland por McGowan et al. (1991, 1992). En estos trabajos fueron utilizadas novillas de cruce Indicus, que fueron sometidas a tres diferentes tratamientos T1) PGF-2, con 12 días de diferencia e inseminación a las 72 horas; T2) CIDR-B 10 días + 400UI de eCG + PGF-2, en el momento del retiro del CIDR-B e IA a las 50 h; y, T3) SMB por 10 días + 400UI de eCG + PGF-2, en el momento del retiro e IA a las 50 h; acompañados de un detector de monta que evaluó las veces que el animal había sido montado, mediante el uso de scores de 0 a 6 según la intensidad de monta, si el entore era alto se esperaría que la fertilidad fuera mejor. Una interesante observación de este trabajo es que las novillas que fueron tratadas con CIDR-B ó Crestar y cuyo número de montas fue dudoso (score 5 o 6) también resultaron preñadas mientras que muy pocas de las tratadas únicamente con PGF-2, quedaron preñadas (Baruselli et al., 2002). Otros trabajos con dispositivos vaginales a base de progesterona Se estudió el efecto del tratamiento con el CIDR-B y el momento de la aplicación de la PGF-2, en los porcentajes de estro y de preñez en novillas Holstein. Los animales fueron tratados con CIDR-B por 10 días y subdivididos para recibir media o una dosis luteolítica de PGF-2, en el momento del retiro del implante o 2 días antes, no encontrándose diferencia entre media dosis y dosis completa de PGF2, los resultados de expresión de estro y preñez fueron similares, sin embargo la administración de PGF-2, en el día 8 fue más sincrónica en la expresión de estros. Estos resultados evidenciaron la necesidad de desarrollar protocolos que sincronicen el desarrollo folicular, de manera que todos los animales tengan un folículo en crecimiento y con capacidad de ovular en el momento de la remoción del dispositivo y la administración de PGF-2. Por esta época se comenzó a 134 discutir la posibilidad de que el estradiol podía sincronizar el desarrollo folicular resultando en el comienzo de una nueva onda aproximadamente 4 días después (Bó et al., 1994). Se desarrollaron varios experimentos con cápsulas de estradiol encontrando buena sincronía de estros, pero variabilidad en los porcentajes de preñez entre grupos. En un estudio de Venturini et al. (2007b), donde se buscaba evaluar el porcentaje de preñez de la utilización de dispositivos intravaginales utilizados dos veces en vacas primíparas a las que se les destetaron temporalmente los terneros, se utilizaron 150 vacas primíparas con terneros de más de 80 días de vida y condición corporal (CC) 2,5 (escala 1 a 5), distribuidas al azar en dos grupos con diferentes tratamientos. Grupo 1 (n=75): Día (D)1: destete temporario con tablilla nasal. D11: liberación de los terneros a la lactancia. Grupo 2 (n= 75): (D)1: aplicación de un dispositivo DIB (Syntex Argentina) usado y destete temporario con tablilla nasal. D8: retiro del dispositivo y encierre de los terneros por 72h. D11: liberación de los terneros a la lactancia. La totalidad de las vacas se liberaron a servicio natural con el 4% de toros, a partir del D8, durante 90 días. Los diagnósticos de preñez fueron realizados a los 60 días de finalizado el servicio por ultrasonografia transrectal (Falco vet. Pie medical con transductor de 8 MHz). Tabla 15. Preñeces logradas por servicio natural de 90 días. Grupo Porcentajes Totales 1:DT 62,7 47/75 2:DT + DIB 46,7 35/75 Fuente: Venturini et al., 2007b. Los resultados obtenidos en el Grupo 2, justifican ampliamente su implementación. Se observo que un alto porcentaje de las preñeces del Grupo 2 corresponden al primer ciclo post tratamiento; a diferencia del Grupo 1, en el que los tiempos de gestación fueron más heterogéneos (Venturini et al., 2007b). 135 7.6. Presincronización con Progesterona en novillas prepúberes El aporte de progesterona por cerca de 8 días, en bajas dosis, es capas de acelerar la entrada en reproducción, de las novillas que están próximas a la pubertad (prepúberes). En un experimento realizado por Sá Filho y Baruselli (FMVZ-USP) en 2006, la colocación de dispositivos de Progesterona, preutilizados por 24 días, en novillas Nelore prepúberes, (CL ausente e folículos > 8mm), durante 8 días, con aplicación de 1 ml de Benzoato de Estradiol (24 horas después), aumento significativamente la ciclicidad de esas novillas en el inicio de la estación de monta (de 63% para 83,3% de ciclicidad). Tal manejo resulto e una mejora significativa de la preñez a la IATF en esas novillas, comparándolas con las que no fueron presincronizadas.La utilización de dispositivos impregnados de progesterona, para este fin, puede ser un manejo interesante de ser introducido en rebaños de novillas, en las que se desea anticipar la pubertad y, consecuentemente, aumentar la preñez (Tecnopec, 2005). El manejo es simple y de bajo costo, pues se utilizan dispositivos que serian descartados (dispositivos ya usados por 3 veces). Cuadro 6. Esquema de presincronización para novillas cebuínas prepúberes: Día 0 Insertar dispositivo Día 8 Retirar dispositivo Día 9 Aplicar 1 ml de Benzoato de estradiol Día 20 en adelante Iniciar Protocolo de IATF Fuente. Tecnopec, 2005. Es importante recordar que, la desinfección, de los dispositivos usados en la presincronización, debe ser muy bien hecha. Se recomienda la solución de Amonio cuaternario 1:250, por cerca de 10 a 15 minutos (Tecnopec, 2005). 136 7.7. Interferencia de los niveles de progesterona y los dispositivos intravaginales Una de las características fisiológicas particulares de novillas cebúinas, que interfiere en los resultados de programas de IATF, es relacionado al metabolismo de la progesterona de esos animales. A través de experimentos, realizados por la FMVZ-USP en 2003 e 2004, quedo demostrado que, las altas tasas de progesterona e novillas cebúinas, disminuyen a tasa de crecimiento folicular y la ovulación en programas de IATF. Por eso, los experimentos concluirían que se deben evitar dispositivos con alta concentración de progesterona, en la IATF de novillas cebúinas (Tecnopec, 2005). Gráfica 12. Dinámica folicular de novilhas Nelore, Nelore x Angus e Angus, utilizando DP4 1,9 g, Benzoato de Estradiol y Prostaglandina. Fuente. Carvalho, 2002. 137 Tabla 16. Tasa de ovulación por grupo genético. Grupo genético n Tasa de ovulación (%) Angus 12 75,0 (9/12) Angus X 13 84,6 (11/3) Nelore 12 41,6 (5/12) Fuente. Tecnopec, 2005. Los dispositivos con 1gr o menos de progesterona, liberan esta hormona de forma más fisiológica y adecuada al metabolismo de las novillas cebuinas, generando mejores resultados de preñez en esta categoría animal, que los dispositivos con altas dosis de progesterona. Lo mismo que se previene que las novillas extremadamente sensibles a la progesterona sufran alteraciones en la tasa de ovulación, se deben instruir los siguientes cuidados en la IATF (Tecnopec, 2005): Dar preferencia a dispositivos ya usados (2 o 3 veces) o usar dispositivos con 0,75 gr - 0,5 gr de progesterona. Para dispositivos nuevos: aplicar media dosis de PGF-2 en la inserción del dispositivo y media dosis en la retirada. Ese manejo elimina la producción de progesterona por el eventual cuerpo lúteo activo, presente en los ovarios de algunas novillas, evitándose que el acumulo de progesterona endógena, aumentada por la liberada por el dispositivo, interfiera desfavorablemente en el programa (Tecnopec, 2005). 7.8. Ablación folicular47 Puede ser realizada mediante la aspiración de folículos por ultrasonografía transvaginal (técnica para obtener oocitos para FIV48), en la cual se aspiran todos 47 Aspiración del folículo con una aguja y una bomba de vacío. 138 los folículos presentes, resultando en el comienzo sincrónico de una nueva onda folicular 1,5 días después; si se asocia este procedimiento con la inyección de 2 dosis de PGF-2, a los 4 días con intervalo de 12 horas induciremos regresión luteal en todos los animales, incluso probablemente los que se encuentran en la fase luteal temprana, induciremos una ovulación sincrónica debido a que todos los animales poseen un folículo en la fase de crecimiento en el momento de la PGF2, y esto hace que puedan ovular al mismo tiempo (Bó et al.,1995). Fotografía 4. Ilustración de la aspiración folicular guiada por ultrasonido en bovinos. Fuente: Palomares, 2007. 48 Fertilización in vitro. 139 7.9. Efecto de los agonistas y el GNRH en la dinámica folicular La GnRH y sus agonistas49 han estado disponibles en el marcado por más de 20 años. Al principio la GnRH fue usada solamente en el tratamiento de la degeneración quística folicular en la vaca, pero posteriormente, se utilizó en la sincronización de la ovulación en vacas repetidoras50. Mediante la alteración de la molécula de GnRH nativa se han podido fabricar potentes agonistas. En el mercado se encuentran distintos preparados comerciales con actividad GnRH como la Buserelina, la Gonadorrelina, la Etilamida y la Licerelina. Al final de la década de los ochenta, cuando el advenimiento del ultrasonido permitió la caracterización del desarrollo folicular bovino, Thatcher et al. (1989) y MacMillan y Thatcher (1991), utilizaron un análogo del GnRH para alterar la dinámica folicular, y proporcionaron la base para el desarrollo de un nuevo sistema de sincronización del estro. El desarrollo de un buen sistema de sincronización de estros que controle el crecimiento de los folículos ováricos preovulatorios y la regresión del CL, se puede lograr combinando inyecciones de un agonista de GnRH y de PGF (Badinga, 1994; Schmitt, 1994; Thatcher, 1986). Trabajos realizados por varios grupos demostraron que la inyección (im51) de GnRH producirá la liberación de LH en un pico tipo preovulatorio aproximadamente a las dos horas de la aplicación (Thatcher, 1989). En 1991, Macmillan y Thatcher encontraron que la administración de buserelina durante el diestro (días 11, 12 o 13) alteró la dinámica folicular. Los autores reportaron la 49 Análogos. Vacas que son inseminadas y vuelven a presentar celo, no se preñan, por fallas de ovulación o a nivel hormonal–endocrino, entre muchas otras causas (vitrogen, 2007). 51 Intramuscular. 50 140 alteración de patrones de desarrollo, la aparición de folículos con antro nuboso 52 por aparente luteinización y, en algunos casos, la ovulación del folículo dominante. Posteriormente, esta idea fue explorada por varios grupos resaltando entre los más importantes el de Pursley et al. (1994), y Martínez et al. (1997). Estos trabajos indican que se puede utilizar GnRH o LH para inducir, a través de la ovulación del folículo dominante, el desarrollo de una nueva onda folicular. Este tratamiento es efectivo en vacas en lactancia, pero hay controversia en cuanto al efecto de la GnRH en novillas. El estadio de desarrollo del folículo dominante en el momento de la administración de GnRH afecta el porcentaje de animales que ovulan y el intervalo al inicio de la próxima onda folicular pudiendo variar de 2 a 5 días. Cuando se administra en etapas aleatorias al ciclo estral, el GnRH ocasiona la ovulación del folículo dominante e induce a la emergencia de una nueva onda de crecimiento folicular 2 o 3 días después del tratamiento. Así, 6 o 7 días después, la mayoría de los animales estarán en una fase de desarrollo folicular semejante en el momento de la administración del PGF-2 y, por consiguiente, habrá una mejor sincronización del estro (De la Sota et al., 2005). Tabla 17. Efecto del día del ciclo en la respuesta ovulatoria de vacas Holstein en lactancia al tratamiento de GnRH. Fuente. Wiltbank et al., 1996. 52 Los folículos en una imagen normal de ultrasonido se ven totalmente negros, la utilización de la GnRH produce liberación de LH que hace que el folículo se luteinice y en algunos casos ovule, esta luteinización cambia la vascularidad del folículo y por lo tanto hace que la sangre produzca el efecto de nubocidad en el antro (cavidad) del liquido folicular (Thatcher, 1989). 141 Figura 20. Mecanismos de acción de la GnRH. Fuente. Prieto-Gómez et al., 2002. 8. INDUCTORES DE OVULACIÓN La utilización de inductores de ovulación como Benzoato de Estradiol y GnRH, en los programas de IATF de novillas púberes, resulta en buenas tasas de ovulación, y no difieren estadísticamente en relación a la eficiencia. Investigadores Brasileros, realizaron una serie de experiementos para evaluar el efecto de la administración de GnRH al final del tratamiento de Crestar en la sincronía de la ovulación. Utilizaron 20 vaquillonas Holstein que fueron tratadas con Crestar (más EV + N) por 9 días y la mitad de las vaquillonas recibieron una inyección de 100 μg GnRH (Cystorelin®, Merial) 30 horas después de la remoción 142 del Crestar. La ovulación, fue más sincrónica (56-64 horas) y la preñez fue numéricamente (no significativamente) mayor (7/8) en las vaquillonas tratadas con GnRH que en las no tratadas con GnRH (ovulación 60-76 h y 4/8 preñadas). Hay que destacar que 3 vaquillonas (15%) no tuvieron regresión luteal. Este protocolo también fue utilizado en vacas con cría, donde la administración de 250 μg de GnRH en una cápsula de gelatina a las 30 horas de retirado el implante resultó en un mayor porcentaje de preñez a la IATF en las vacas ciclando (61 vs 22 %) o en anestro (31 vs 14%) con respecto a vacas Control (sin GnRH). (Vasconcelos et al; 1994). Colazo et al., 1996, utilizaron un protocolo similar en vacas ciclando donde se aplicó 10 μg de buserelina (Receptal®, Intervet, Argentina) y se obtuvo una preñez del 54%. Otra alternativa de inducción de la ovulación es utilizar 1 mg de EB a las 24 horas de la remoción del Crestar e IATF a las 50-52 horas pos Crestar. Se diseñaron dos experimentos para evaluar la sincronía de la ovulación y tasas de preñez en vacas y vaquillonas tratadas con un implante Crestar y EB 24 horas después de retirado el implante. En el Experimento 1 se utilizaron 11 vaquillonas Holando de 2 años de edad que recibieron un Crestar y 2 ml de la porción inyectable de 5 mg de EV y 3 mg de N en momentos no conocidos del ciclo estral (Día 0). El Día 9 se retiraron los implantes y 24 horas después 6 vaquillonas recibieron 1 mg EB (Grupo Crestar+EB) mientras que las 5 restantes (Grupo Crestar) no recibieron ningún otro tratamiento. Las vaquillonas fueron examinadas por ultrasonografía cada 12 horas para determinar el momento de la ovulación. Todas las vaquillonas ovularon dentro de las 120 horas pos Crestar, pero la ovulación de las vaquillonas del Grupo Crestar+EB fue más temprana y menos variable (mediana: 60,0 horas, varianza: 24,0 horas, rango: 60-72 horas, P<0.03) que las del Grupo Crestar (mediana: 84,0 horas, varianza: 748,0 horas, rango: 72-120 horas). (Carcedo et al., 2000). El objetivo del Experimento 2 fue comparar las tasas de preñez de vacas tratadas igual al Experimento 1. Se utilizaron 232 vacas y vaquillonas para carne, de cuatro 143 establecimientos que recibieron Crestar y EV+N en el Día 0. El Día 9 los implantes fueron removidos y 137 animales recibieron 1 mg de EB (Grupo Crestar+EB), mientras que 95 animales no recibieron tratamiento (Grupo Crestar). Todos los animales fueron IATF entre 50-55 horas pos remoción del implante y las preñeces fueron diagnosticadas por palpación rectal a los 60 días pos IATF. Ambos grupos estuvieron representados en los cuatro establecimientos. (Carcedo et al; 2000). Tabla 18 Fuente. Carcedo et al, 2001 Además del tratamiento con 1 mg de EB a las 24 horas pos retiro del implante, se puede sincronizar la ovulación utilizando GnRH en el momento de la IATF y con esto disminuir el número de veces que los animales deben pasar por la manga para recibir tratamientos. (Caccia et al., 1998; Martinez et al., 2000). Un grupo argentino repitio este trabajo, se utilizaron 433 vacas para carne con cría, con una condición corporal de 2,5 a 3,5 y que tenían entre 35 y 120 días pos parto. Todas las vacas recibieron un CIDR-B y 2 mg de EB en el Día 0. Además, la mitad de las vacas recibieron 50 mg de P4 al mismo tiempo. En el Día 8 se removieron los CIDR-B y se inyectó una dosis de PGF. Las vacas, fueron subdivididas nuevamente para recibir 1 mg de EB a las 24 horas de retirado el CIDR-B o una inyección de 50 μg de GnRH (Cystorelin®, Merial) en el momento de la IATF. Todas las vacas fueron IATF entre las 50 y 55 horas pos CIDR-B. (Bo et al., 2000). 144 Tabla 19 Fuente. Bo et al, 2000 No hubo diferencias en los índices de preñez entre los tratamientos, sin embargo, Colazo et al, tuvieron un mayor porcentaje de preñez en vaquillonas sincronizadas con CIDR-B y cuya ovulación fue inducida con 0,5 mg de Cipionato de Estradiol (ECP) a las 24 horas de la remoción del CIDR-B (216/331, 65 %) que vaquillonas tratadas con GnRH en el momento de la IATF (169/328, 51%) o ECP en el momento de la remoción del CIDR-B (168/320, 52%; P<0,01). En un experimento preliminar (11) se observó que las ovulaciones ocurrieron en promedio entre 60 y 84 horas después de retirado el CIDR-B con un 37% (3/8) de vacas que ovularon entre las 72 y 84 horas, lo que indica que el semen debería mantenerse viable y en condiciones de fertilizar en el tracto reproductivo femenino durante 24 horas o más. Por lo tanto, el semen utilizado debe ser de excelente calidad en programas de IATF, sobre todo si se decide utilizar GnRH en el momento de la IA. (Colazo et al., 2002). Varios profesionales de campo relataron menor dilatación cervical y mayor dificultad en la inseminación, cuando se utilizan GnRH en lugar de BE, en la IATF de novillas. El Benzoato de Estradiol actúa sobre el cervix, dilatándolo. De este modo, facilita el proceso de inseminación. Siendo la opción más interesante, 145 cuando trabajamos lotes grandes de novillas, donde la agilidad en la inseminación es importante, ademas de su costo mucho menor comparado con la GnRH. 146 CONCLUSIONES Los avances logrados en la comprensión de los mecanismos neuroendocrinos de regulación del ciclo estral y de técnicas como el ultrasonido, han permitido profundizar el conocimiento de la dinámica folicular y luteal. La alta disponibilidad de hormonas sintéticas naturales o análogos a nivel comercial, brindan al profesional una herramienta apropiada para la toma de decisiones en cuanto a los tratamientos de sincronización más adecuados a utilizar en función del tipo de animal que se desea tratar y los objetivos a alcanzar con el uso técnicas de la biotecnología reproductiva como la IATF, MOET o la FIV. Los protocolos de sincronización están basados en el control del Cuerpo Lúteo, el desarrollo folicular y la ovulación. Para controlar la fase luteal se puede inducir la regresión del Cuerpo Lúteo con PGF-2 o estrógenos, o prolongarla mediante dispositivos con liberación lenta de progesterona o progestágenos. De acuerdo con la revision, en trabajos de diferentes autores se concluye que Los dispositivos liberadores de progesterona con concentración superior a 1 gr pueden llegar a causar una fuerte supresión en la liberación hipotalámica de gonadotropinas (LH) causando un bloqueo en la dinámica y desarrollo folicular produciendo anestro en novillas de primera sincronización, esto, probablemente, debido a la falta de niveles importantes de P4 en su sistema ‘’priming’’ y susceptibilidad propia de novillas cruza Bos indicus a la influencia hormonal. La utilización de prostaglandinas significó un aporte trascendental a la producción animal y sentó bases muy importantes para las biotecnologías 147 reproductivas que dependen del ciclo estral. La propiedad luteolitica de la PGF2 la hace imprescindible en los tratamientos para sincronizar los celos en bovinos. Para realizar un control efectivo del desarrollo folicular existen métodos mecánicos como la aspiración de todos los folículos mayores a 5mm presentes en el ovario (nueva onda en 1,5 días después). O tratamientos hormonales con la GnRH, pLH ó progestágenos más estradiol. El tratamiento con GnRH induce ovulación en el 85% de las vacas en lactancia, en las novillas dependerá del estadio del folículo dominante por lo que no es el método de elección en estas últimas. El método Ovsynch, sincroniza la ovulación de manera eficiente, funciona muy bien en vacas de lechería y búfalos, mas no en novillas lecheras dada la poca sensibilidad de estas a la GnRh, su utilización eleva un poco los costos de la sincronización. El intervalo entre el tratamiento con 5mg de E-17B y el comienzo de la nueva onda folicular es de 3 a 5 días, mientras que es de 3 a 4 días en el tratamiento con 2,5mg de EB y 50mg de progesterona y de 3 a 8 días (promedio 5,5 días) con el tratamiento de 5mg de EV y 3mg de Norgestomet. Es importante recalcar que para que el tratamiento sea efectivo, se debe colocar la progesterona (CIDR, SMB etc.) antes de la inyección de estradiol, el estrógeno más disponible comercialmente es el Benzoato, es también el más utilizado además de ser económico es muy seguro y según estudios recientes no necesita ir acompañado de la inyección de progesterona a no ser que se trate de un protocolo de superovulación en vacas donadoras. Los trabajos revisados indican que para obtener una máxima eficiencia en los programas de sincronizacion es necesario controlar, el desarrollo folicular y la ovulación, cosa que podemos lograr con la utilización de progestágenos o progesterona solos o en unión con estrógenos, que es el método actual más eficiente en la sincronización de celos y ovulaciones, también el mas usado a nivel mundial por ser aplicable a los animales aun en condiciones de anestro, 148 es de facil manejo y de bajo costo con excelentes resultados, convirtiéndose una importante y rentable herramienta en los programas reproductivos en las explotaciones de carne y leche. 149 BIBLIOGRAFÍA ADAMS, G. P.; MATTERI, R. L.; KASTELIC, J. P.; KO, J. C. H.; and GINTHER, O. J. (1994). Association between surges of follicles stimulating hormone and the emergence of follicular waves in heifers. J. reprod. Fert. 94. 177-188. ADAMS, G. P. (1993). Dinámica folicular ovárica en el bovino adulto y prepuber. Simposio Internacional de Reproducción Animal. Octubre. Córdoba, Argentina. ADAMS, H. R. (2001). Prostaglandins, related factors, and cytokines. Section 4. Chap 21st pp 420-432 En: ADAMS, H. R. Veterinary pharmacology and therapeutics. 8th Edition. Iowa State University Press/AMES. ALBERIO, R. (2003). Nuevas biotecnologías reproductivas: aspectos biológicos y económicos. INTA–Balcarce. Junio. ASCOLI, M. & SEGALOFF, D. L. (1996). Hormonas adenohipofisarias y sus factores liberadores hipotalámicos. Sección XIII. Cap.55 pp 1447-1467 En: GOODMAN & GILMAN (1996). Las bases farmacológicas de la terapéutica. Volumen 1. Editorial Panamericana. ASPRÓN, M. A. (2004). Curso de Actualización - Manejo Reproductivo del Ganado Bovino. En: Aviso. New York. BADINGA, L.; W. W. THATCHER; C. J. WILCOX; G. MORRIS; K. ENTWISTLE; y D. WOLFENSON (1994). Effect of season on follicular dynamics and plasma concentrations os estradiol-17, progesterone and luteinizing hormone in lactating Holstein cows. Theriogenology, 42(8): 1263-1274. 150 BAIRD, D.T. (1978). Local Utero–Ovarian relationships. In: D. B CRIGHTON, N. B. HYNES, G. R., Control of ovulation. buthetworks, London, pp 217-233. BARROS, C. M.; MOREIRA, M. B.; FIGUEREIDO, R. A. (2000). Synchronization of ovulation in beef cows (Bos indicus) using GnRH, PGF2A and benzoate de estradiol. Theriogenology 53, 1121- 1134. BARUSELLI, P. S.; MARQUES, M. O., MADUREIRA, E. H., NASSER, L. T., REIS, E. L. (2002). Inseminação em tempo fixo em Bos indicus, 1er seminario internacional de reproducción bovina, CGR Bogotá. Pag. 1- 20. BARUSELLI, P. S.; MARQUES, M. O.; MADUREIRA, E. H.; COSTA NETO, W. P. (2001). Increased pregnancy rates in embryo recipients treated with CIDR-B devices and eCG. Theriogenology 55, p. 157. BARUSELLI, P. S.; MARQUES, M. O.; CARVALHO, N. A. T.; VALENTIM, R.; BERBER, R. C. A.; CARVALHO FILHO, A. F.; MADUREIRA, E. H.; COSTA NETO, W. P. (2000). Dinâmica folicular em novilhas receptoras de embrião bovino submetidas a sincronização da ovulação para inovulação em tempo fixo. Arq.Fac.Vet.UFRGS, v.28., p.217. BARTOLOME, J. A.; SILVESTRE, F. T.; ARTECHE, A.C.M.; KAMIMURA, S.; ARCHBALD, L. F. (2002a). The use Ovsynch and heatsynch for resyncronizationof cows open at pregnancy diagnosis by ultrasonography. J Anim Sci, Vol 80. BARTOLOME, J. A.; SHEERIN, P.; LUZNAR, S.; ,MELENDEZ, P.; KELBERT, D.; RISCO, C. A.; THATCHER, W. W.; ARCHBALD, L. F. (2002b). Conception rate in lactating dairy cows using Ovsynch after presyncronization with prostaglandinF2a (PGF2a) or gonadotropin releasing hormone (GnRH). The Bovine Practioner, 36, 1:35-39. BAVERA, G. A. (2005). Ciclo estral. En: Cursos de producción bovina de carne. www.produccion-animal.com.ar. Argentina. Página virtual. 151 BELLOSO, S. E.; PORTILLO, M. G., DE ONDIZ. A.; ROJAS, N.; SOTO, C. G.; RAMIREZ, I. L.; PEREA, G. (2002). Improvement of reproductive performance in crossbred zebu anestrous suckled primiparus cows by treatment with norgestomet implants or 96 h calf removal. Theriogenology 57, 1503-1510. BERGFELT, D. R. PLATA, M. H., GINTHER O.J.; (1994). Counteraction of follicular inhibitory effect of follicular fluid by administration of FSH in heifers. Can J Anim Sci. 74:633–639. BLANCO, A. (1990). Química biológica. Editorial El Ateneo. BO, G. A. (2004a). Sincronizacion de celos para Programas de inseminación artificial y transferencia de embriones en tiempo fijo. Simposio sobre Control farmacológico del ciclo estral de rumiantes. Universidad de San pablo, Brasil Proc: 35 – 60. BO, G. A. et al. (2004b). Sincronización de celos e inseminación artificial. Especialización en reproducción bovina, Modulo III, Zipaquira – Cundinamarca, BÓ, G. A; MEDINA, M., TEGLI, J. C; COSTAMAGNA, A; BROGLIATTI, G. M. (2000). Fixed-time artificial insemination in CIDR-B treated cows induced to ovulate with estradiol benzoate or GnRH. Proc. 14th International Congress on Animal Reproduction (ICAR), Stockholm, Sweden; 2:45 abstr. BO, G. A.; CACCIA, M. (1997). Manipulación del desarrollo folicular en el ganado bovino: su aplicación en programas de sincronización de celos y transferencia de embriones. Informe al concejo de investigaciones cientificas y tecnologicas de la provincia de cordoba. (CONICOR). BO, G. A.; ADAMS G. P.; CACCIA, M.;MARTINEZ, M.; PIERSON, R. A.; MAPLETOFT, R. J.; (1995). Ovarian follicular wave emergente alter treatment with progestogen and estradiol in cattle. Anim. Reprod. Sci; 39: 193 – 204. BO, G. A.; ADAMS G. P.; PIERSON, R. A.; CACCIA, A.; TRIBULO, H.; MAPLETOFT, R. J.; (1994). Follicular wave dynamics alter estradiol-17b treatment of heifers with or without a progestogen implant. Theriogenology; 41. 152 BOSCOS, C. M.; SAMARTZI, F. C.; DELLIS, S. (1997). Use of progestagengonadotrophin treatmens in estrus synchronization of Sheep. Theriogenology 58, 1261-1272. BURKE, J. M.; de la SOTA R. L.; RISCO, C. A.; STAPLES, C. R.;SCHMITT, EJ. P.; THATCHER, W. W.; (1996). Evaluation of timed insemination using a gonadotropin–releasing hormone agonist in lactating dairy cows. J. Anim. Sci; 79: 1385 – 1394. CACCIA, M.; CUTAIA, L.; MORENO, D.; VILLATA, L.; PIA, C.; BÓ, G. (1998). Control del desarrollo folicular en novillas tratadas con CIDR, Benzoato de estradiol y progesterona. Reunión CABIA. CACCIA, M; CUTAIA, L; MORENO, D; BÓ, G. A. (1998). Sincronización del momento de la ovulación en vacas tratadas con CIDR-B, benzoato de estradiol, progesterona y GnRH. Cuartas Jornadas CABIA y Primeras del Mercosur, Buenos Aires, Argentina; 265, abstr. CALANDRA, R. S. & DE NICOLA, A. F. (1985). Endocrinología molecular. Editorial El Ateneo. CALLEJAS, S. (1995a). Fisiología del ciclo estral bovino. Jornadas de Biotecnología de la Reproducción en hembras de interés zootécnico, UNLZ y SYNTEX S.A., Lomas de Zamora 15 y 16 de Junio. CAMPBELL, N. I.; J. L. SEXTON; A. R. MILNER (1991). Fasciola hepatica immuno-precipitation analysis of biosynthe-tically labelled antigens using sera from infected sheep. Parasite Immunol. 13: 105-108. CANFIELD, R. W.; BUTLER, W. R. (1989). Accuracy of predicting the LH surge and optimal insemination time in holstein heifers using a vaginal resistance probe. Theriogenology 41:835–842. CARCEDO, J. A; CACCIA, M., ALONSO, A; TRÍBULO, R. J; BÓ, G. A. (2000). Sincronización de la ovulacion en vacas y vaquillonas tratadas con SMB más 153 benzoato de estradiol 24 h después. Quinto Congreso Argentino de Reproducción Animal, CABIA, Rosario, Argentina; CD abstr. CARTMILL, J. A.; S. Z. EL-ZARKOUNY; B. A. HENSLEY; G. C. LAMB; and J. S. STEVENSON (2001). Stage of cycle, incidence, and timing of ovulation, and pregnancy rates in dairy cattle after three timed breeding protocols. J. Dairy Sci. 84:1051–1059. CARVALHO, A. T.; BARUSELLI, P. S.; ZICARELLI, L.; MADUREIRA, E. H.; VISINTIN, J. A.; D´OCCHIO, M. J. (2002). Control of ovulation with GnRH agonist after superstimulation of follicular growth in buffalo: fertilization and embryo recovery. Theriogenology 58, 1641-1650. CASTILHO, C.; DAYAN, A.; BARROS, C. M. (1997). Responsiveness of Nelore cows corpus luteum to PGF2a, administered intramusculary or via submucosa vulvar. Arq, Fac, Vet, UFRGS, 25:205. CERRI, R. L. A.; K. N. GALVAO; S. O. JUCHEM; R. C. CHEBEL; J. E. P. SANTOS (2003). Timed AI(TAI) with estradiol cypionate (ECP) or insemination at detected estrus in lactating dairy cows. J. dairy Sci. 86: 181. CGR BIOTECNOLOGÍA REPRODUCTIVA (2002). Biotecnología aplicada en reproducción bovina. Diplomado biotecnología reproductiva con énfasis en transferencia de embriones en bovinos. Modulo III. COOPER, M.J.; FURR B., J. A. (1974). The role of prostaglandins in animal breeding. Vet. Rec.1974–94. COLAZO, M. G; BARTOLOMÉ, J; SCHMITDT, E. E; ILLUMINATI, H; SERRANO MOYANO, B; MORALEJO, R. (1996). Sincronización de celos combinando progestágenos, GnRH, PGF, e inseminación a tiempo fijo en vacas para carne. Resúmenes Segundo Simposio Internacional de Reproducción Animal, Carlos Paz; 254 abstr. 154 COLAZO, M. G.; MARTINEZ, M. F.; KASTELIC, J. P.; MAPLETOFT, R. J. (2000). Effects dose and route of administration of Cloprostenol on luteolysis, estrus and ovulation in beef heifers. Animal Reproduction Science. COLAZO, M. G; MARTÍNEZ, M. F; WHITTAKER, P. R; KASTELIC, J. P. AND MAPLETOFT, R. J. (2002). Estradiol cypionate (ECP) in CIDR-B-based programs for fixed time AI in beef heifers. Theriogenology; 57:371 abstr. CUNNINGHAM, J. G. (1997). Fisiología veterinaria. Interamericana McGraw-Hill. DANNIES, P. S. (1999). Protein hormone storage in secretory granules: Mechanisms for concentration and storing. Endocrine Reviews 20 (1): 3-21. DEJARNETTE, M. (2007). Anatomía y fisiología de la reproducción bovina. En: Select Sires. Página virtual. www.selectsires.com. Última consulta mayo 17. DE LA SOTA, R. L.; CONSENTINO, P. (2005). Manejo reproductivo de rodeos lecheros en condiciones pastoriles. Universidad Nacional de La Plata, Intervet, La Plata, Argentina. DE LA SOTA, R. L.; SOTO, A. T.; GOBELLO, M. C. (2002). Farmacología del estro y del parto. Cap. 32 pp 423-434 En: BOTANA LOPEZ, L. M.; LANDONI, M. F.; MARTIN JIMENEZ, T. Farmacología y terapéutica veterinaria. Ed. Mc Graw Hill. Interamericana. DÍAZ GONÇALVES, P. B.; FIGUEREIDO, J. R.; FIGUEREIDO FREITAS, V. J. (2002). Biotécnicas aplicadas á reproduçao animal, Sâo Paulo; Pag: 25 – 42. D´OCCHIO, M. J.; FORDYCE, G.; WHYTE, T. R. (2000). Reproductive responses of cattle to GnRH agonists. Animal Reproduction Science, 60–61, 433–442. DRANSFIELD, M. B. G., NEBEL, R. L.; PEARSON, R. E., WARNICK, L.D. (1998). Timing of insemination for Dairy–Cows identified in estrus by a radiotelemetric estrus detection system. J. Dairy Sci 81:1874–1882. 155 DRILLICH, M.; TENHAGEN, B. A.; HEUWIESER, W. (2000). Effect of one spontaneous estrus cycle (after synchronization with PGF2a) on reproduction performance in dairy cows, Theriogenology 54, 1389-1394. ECHEVERRAS, J. (2006). Endocrinología Reproductiva: Prostaglandina F2a en vacas. Revisión bibliográfica. En: Revista Electrónica de Veterinaria REDVET. Vol. VII, No. 01, enero. http://www.veterinaria.org/revistas/redvet. ECHEVERRÍA, J. (2005). Endocrinología Reproductiva: Benzoato de estradiol. Revisión bibliográfica. Boletín técnico elaborado para Laboratorio Biogénesis S.A. ECHEVERRÍA, J. (2004). Endocrinología Reproductiva: Hormona liberadora de gonadotropinas (Gn-RH). Revisión bibliográfica. Boletin técnico elaborado para Laboratorio Biogénesis S.A. El-Zarkouny, S, Z.; Cartmill, J.A.; Richardson, A. M.; Medina, Britos M.A.; Hensley, B.A.; Stevenson, J. S.; (2001). Presynchronization of estrous cicles in lactating dairy cows with Ovsynch + CIDR an resynchronization of repeat estrus using the CIDR. J Anim Sci 79, Suppl. 1/j Dairy Sci 84, Suppl. 1, abst. 1028, 249. ERICSSON, H.; DEVRIUS, L. O. (1966). Osmotic swelling of mammalian spermatozoa. Exp. Cell. Res. 42:136-156. EVANS, G. y MAXWELL, W. (1987). Salomon’s artificial insemination of sheep and goats. Ed. Sidney, Butterworths. pp.185. FERGUSON, S. D.; GALLIGAN, D. T. (1993). Reproductive programs in dairy herís. Proc Centr Vet Conf. 161–178. FERNÁNDEZ TUBINO, Álvaro (2003). Dinámica folicular: funcionamiento y regulación. Departamento de Reproducción Animal, Facultad de Veterinaria, Montevideo. FIGUEIREDO, R. A.; C. M. BARROS; O. L. PINHEIRO; y J. M.P SOLER (1997). Ovarian follicular dynamics in Nelore breed (Bos indicus) cattle. Theriogenology, 47: 1489-1505. 156 FRICKE, Paul M. (2007). Aplicaciones prácticas del ultrasonido para el manejo reproductivo en ganado lechero. Universidad de Wisconsin. Madison. Última consulta marzo. FUNSTON, R. N.; ANSOTEGUI, R. P.; LIPSEY, R. R.; GEARY, T. W. (2002). Synchronization of estrus in beef heifers using either melengestrol acetate (MGA)/prostaglandin or MGA/Select Synch, Theriogenology 57, 1485-1491. FORTUNE, J. E.; SIROIS, J.; TURZILLO, A. M.; LAVOIR, M. (1991). Follicle selection in domestic ruminants” J. Repro. Fertil. 43: 187-198. GAMBINI, A. M. G.; MOREIRA, M. B. P.; CASTILHO, C.; BARROS, C.M. (1997). Folicular dynamics and zinchronization of ovulation in Girolando cows. Biol Reprod. 56-195. GAYTÁN, F.; BELLIDO, C.; MORALES, C.; & SÁNCHEZ-CRIADO, J. E. (1998). Both prolactin and progesterone in proestrus are necessary for the induction of apoptosis in the regressing corpus luteum of the Rat. Biology of Reproduction 59 1200–1206. GETHER, U.; KOBILKA, B. K. (1998). G protein-coupled receptors. II. Mechanism of agonist activation. J. Biol. Chem. 273:17979-17982. HAFEZ, Ese (1987). Reproducción e inseminación artificial en animales 5º Edición. Editorial Interamericana Mc Graw-Hill. HUANCA, Wilfredo (2001). Inseminación artificial artificial a tiempo fijo en vacas lecheras. En: Revista de Investigación Veterinaria. Perú. Página Virtual. 12 (2): 161-163. KASTELIC, J. P.; KNOPF, L. & GINTHER, O. J. (1990). Effect of day of prostaglandin F2-alfa treament in selection and development of the ovulary follicle in heifers. Anim. Reprod. Sci. 23. 157 KOJIMA, YAMASHITA, M., FUJISAWA, K. (2003). Implementation and Evaluation of SDPA 6.0 (SemiDefinite Programming Algorithm 6.0) September 2002,optimization methods and software. Vol 18. (4) 491 – 505. LAMB. G. C. (2004). Sincronizaçao do estro utilizando CIDR e GnRH. . VIII Curso novos enfoques na produçao e reproduçao de bovinos, Uberlandia – Minas Gerais, Março 18 – 20 de 2004. LARSON. J. E.; LAMB. G. C.; GEARY. T. W.; STEVENSON. J. S.; MARSTON. T. W.; JOHNSON. S. K.; DAY. M. L.; KESLER. D. J.; DEJARNETTE. J. .M. (2004). Estrus syncronization of suckled beef cows using GnRH, prostaglandin PGF2a, and progesterona (CIDR): a multi-location study. Minnesota Beef Cow/Calf Day Report. 37 – 41. LAVERDIÈRE, G.;ROY, G. L.;PROULX, J.; LAVOIE, D.; DUFOUR, J. J. (1995). Estrus synchronization efficiency of PGF2a injection in Shorthorn-Hereford and crossbred Charolais cattle not having exhibited estrus at 4 or 7 days prior to treatment. Theriogenology. 43-5: 899-911. MAATJE, K.; LOEFFLER, S. H.; ENGEL, B. (1997). Predicting optimal time of insemination in cows that show visual signs of estrus by estimating the onset of estrus by podometers. J. Dairy Sci. 80: 1098–1105. Mc CRAKEN, J. A.; CUSTER, E. E.; LAMSA, J. C. (1999). Luteolysis: a neuroendocrine-mediated event. Physiology. Rev 79: 263-323. MACMILLAN, K. L.; BURKE, C. R. (1996). Effects of oestrus cycle control on reproductive efficiency. Anim. Reprod. Sci; 42: 307 – 320. MACMILLAN, K. L., THATCHER, W. W. (1991). Effects of an agonist of gonadotrophin-releasing hormone on ovarian follicles in cattle. BioI. Reprod. 45: 883-889. MADERO, F; DE DOMINIS, O; CANTALLOS, F; CATALANO, R; CALLEJAS, F. (2007). Resincronización de celos en vaquillonas angus: uso de 0,5 milgramos de benzoato de estradiol en el momento de colocar el dispositivo intravaginal con 158 progesterona. 7º Simposio Internacional de Reproducción Animal –IRAC. Córdoba, Argentina. 29 de junio a 1º de julio. MADUREIRA, E. H., BARUSELLI, P. S., MARQUES, M. O., COSTA NETO, W. P. (2001). Increased pregnancy rates in embryo recipients treated with CIDR-B devices and eCG. Theriogenology 55, 157. MANRIQUE, José R. (1990). Fisiología de la reproducción del ganado Lechero. En: FONAIAP divulga. Página virtual. Táchira. No. 33. Enero– junio. MARQUES, M. O.; MADUREIRA, E. H.; OLIVEIRA, C. A.; BO, G. A.; BARUSELLI, P. S. (2001). Avaliação ultra-sonográfica e concentração plasmática de progesterona em novilhas Bos taurus x Bos indicus submetidas a diferentes tratamentos no dia 7 do ciclo estral. In: SimpósioInternacional de Reproducción Animal, Córdoba. MARTÍNEZ P., Nathalia (2005). Fisiología reproductiva de la hembra. Bogotá, Universidad Nacional. MARTINEZ, M. F.; ADAMS, G.P.; KASTELIC, J. P.; BERGFELT, D. R.; MAPLETOFT, R. J. (1997). Induction of follicular wave emergence for estrus synchronization and artificial insemination in heifers. Theriogenology 54. MARTÍNEZ, M. F; KASTELIC, J. P; ADAMS, G. P; MAPLETOFT, R. J. (2000). The use of CIDR-B devices in GnRH/LH-based artificial insemination programs. Theriogenology; 53:202 abstr. MELLISHO SALAS, Edwin (2006). Sincronización de Estro. Curso reproducción animal práctica. Práctica 09. Universidad Nacional Agraria La Molina. MORAES, J. C. F. (1994). Caracterizacao da inseminacao artificial em vacas de corte. Rio grande. Dosul. Revista brasilera de reproducción animal. Vol. 18. P. 142-152. NASSER, Luiz (2006). Controle farmacologico do ciclo estral. Matogrosso Dosul. 159 NAVANUKRAW, C.; L. P. REYNOLDS.; A. T. GRAZUL-VIZKA,; D. A. REDMER; AND P. M. FRISCKE. (2002). Effect of presincronization on conception ratetwo at times artificial insemination protocol in latin dairy cows. J. Dairy. Sci. 85 (Suppl. 1): 263. NAVIL EL TABBAKH, MOHAMED (2007). Inducción de la Ovulación para fertilización in vitro. OBGYN. Egipto. NISWENDER, G. D.; JUENGEL, J. L.; SILVA, P. J.; ROLLYSON, M. K.; McINTUSH, E. W. (2000). Mechanims controlling the function and life span of the corpus luteum. Physiology Rev. 80: (1):1-29. O'CONNOR, M. L.; SENGER, P. L. (1997). Estrus detection, In Youngqtiist RS (ed), Clirrent tlierapy in large animal. Theriogenology 7. WB Saunders. Co. Philadelpliia. ODDE, K. G. (1990). A review synchronization of estrus in postpartum cattle. J. Anim. Sci. v. 68: 817-830. PALOMARES, Sergio (2007). Aspiración folicular guiada por ultrasonido en bovinos. Notas de campo. Córdoba, Colombia. PEDROSO, R.; GONZÁLEZ, N.; JARAMILLO, N. y ÁLVAREZ, C. (1995). Interacción entre el estado metabólico, la condición corporal y la respuesta a los tratamientos de inducción y sincronización del estro en las hembras bovinas. Proc. X Jornada Científica del CIMA. Ministerio de la Agricultura. Abril 22-24. La Habana. PERONE, M. J.; CASTRO, M. G. (1997). Prohormone and proneuropeptide synthesis and secretion. Histol. Histopathol. 12:1179-1188. PETERS, R. A.; MARTINEZ, T. A.; COOK, J. C. (1994). A metal-analysis of studies of the effect of GnRH 11-14 days after insemination on pregnancy rates in cattle. Theriogenology 54, 1317-1326. 160 PIETERSE, M. C.; TAVERNE, M. A.; KRUIP, T. A.; WILLEMSE, A. H. (1990). Detection of corpora lutea and follicles in cows: a comparison of transvaginal ultrasonography and rectal palpation. Vet Rec 156:552-554. PINHEIRO, O. L., BARROS, C. M., FIGUEREDO, R. A., VALLE, E. R. DO, ENCARNAÇÃO, R. O., PADOVANI, C. R. (1998) Estrous behavior and the estrusto-ovulation interval in Nelore cattle (Bos indicus) with natural estrus or estrus induced with prostaglandin F2alpha or norgestomet and estradiol valerate. Theriogenology;49:667-81. PRIETO-GÓMEZ, B.; VELÁZQUEZ-PANIAGUA, M.; (2002). Fisiología de la reproducción: hormona liberadora de gonadotropinas. UNAM. Vol. 45. No. 6. PURSLEY, J. R.; KOSOROK, M. R.; WILTBANK, M. C.; (1997). Reproductive management of lactating dairy cows using synchronized ovulation. J. Dairy Sci. 80:301. PURSLEY, J. R.; M. E. Lee; and M. C. Wiltbank (1995). Synchronization of ovulation in dairy cows using PGF2 and GnRH. Theriogenology. 44:915–923. Pursley JR, Mee MO, Brown MD, Wiltbank MC. (1994). Synchronization of ovulation in dairy cows using GnRH and PGF2α (Abstr). J Anim Sci 1994; 72 (Suppl 1):230. RANG, H. P. & DALE, M. M. (1992). Farmacología. Editorial Churchill Livingstone Cap. 2. REEVES, J. J. (1989). Endocrinología de la reproducción. En: Hafez, E.S.E. Reproducción e Inseminación Artificial en Animales. McGraw-Hill, S.A. de C.V. México D.C. Pág. 91-115. ROWSON, L. E. A.; TERVIT, R.; BRAND, A.; (1972). The use of prostaglandin for synchronization of estrus in cattle. J. Reprod. Fertil. V. 29. SALVERSON, R. R.; DEJARNETTE, J. M.; MARSHALL, C. E., WALLACE, R. A. (2002). Sinchronization of estrus in virginbeef heifers using melengestrol acetate 161 and PGF2a: an efficacy comparasion of Cloprostenol and dinoprost tromethamine, Theriogenology 57, 853-858. SCARAMUZZI, R. J.; ADAMS, N. R.; BAIRD, D. T. (2000). A model for follicle selection and the determimation of ovulation rate in the ewe. Reprod. Fertil. Dev., v.5, p.459-478. SCHMITT, E. J. P.; THATCHER, W. W.; R. L. DE LA SOTA; J. BURKE; C. RISCO (1994). The effect of GnRH analogue on the dynamic of follicular development. Anim. Sci. 74:154-161. SEPÚLVEDA, N.; RISOPATRÓN, J.; RODRÍGUEZ, F.; RODERO, E.; (2003). Fertilidad en vacas lecheras asociada a la sincronización de celos e inseminación a tiempo fijo (IATF) utilizando GnRH y PGF2. Revista Cienfítica, FCV–LUZ. Vol. XIII No. 3. Universidad de Córdoba. Córdoba. SINGH J.; PIERSON, R. A.; ADAMS, G.P. (1997). Ultrasound image attributes of the bovine corpus luteum: structural and functional correlates. J Reprod Fertil 109:35-44. SINTEX (2005). Fisiología reproductiva del bovino. En: Laboratorio de Especialidades Veterinarias. www.produccion-animal.com.ar. Argentina. STEVENSON, J. S.; KOBAYASHI, Y.; SHIPKA, M. P.; RAUCHHOLZ, K. C. (1996). Altering conception of dairy cattle by GnRH preceding luteolysis induced by prostaglandin F2a. J. Dairy Sci. vol 79:402. JOHNSON, W. H.; TALLAM, S. K.; WALTON (1999). Effects of oxytocin on Cloprostenol-induced luteolysis, follicular growth, ovulation and corpus luteum function in heifers. Theriogenology 53, 963-979. TAMAYO, M.; BERNAL, A. y CAMPO, E. (2007). Biotecnología de la reproducción bovina. Factores que influyen en la transferencia de embriones. 162 TANABE, T. Y.; R. C. HANN (1984). Synchronized estrus and subsequent conception in dairy heifers treated with prostaglandin F2 . I. Influence of stage of cycle at treatment, J. Anim. Sci. 58:805-811. TECNOPEC (2005), En: www.tecnopec.com.br. THATCHER, W. W. (2005). Integrated Aplicattion of ovulation control program invairy reproductive management. 6o simposio internacional de reproducción animal -IRAC. Córdoba, Argentina. 24, 25 y 26 de junio. THATCHER, W. W.; (2004a) Utilizaçao de inseminaçao artificial em tempo fixo (IATF) como estratégia para aumentar a tasa de prenhez em vacas leiterias em lactaçao. VIII Curso novos enfoques na produçao e reproduçao de bovinos, Uberlandia – Minas Gerais, Março 18 – 20 de 2004. THATCHER, W. W.; (2004b) Uso do protocolo Heat-Synch para inseminaçao artificial em tempo fixo (IATF) e resincronizaçao em vacas lecheras em lactaçao. VIII Curso novos enfoques na produçao e reproduçao de bovinos, Uberlandia – Minas Gerais, Março 18 – 20 de 2004. THATCHER, V. E., L. P. C. LOPES & O. FROEHLICH (2003). Riggia cryptocularis sp. nov. (Isopoda, Cymothoidae) from the body cavity of a freshwater fish of Mato Grosso do Sul State, Brazil. Revista Brasileira de Zoologia, 20(2): 285-289. THATCHER, W. W.; HANSEN, P. J. (1992). Systems to alter embryo survival. In: Large Dairy Herd Management. Van Horn, H.H & Wilcox, C.J. Editors. THATCHER, W. W.; (1989). Concepts for the regulation of corpus luteine function by the conceptus and ovarian follicles to improve fertility. Theriogenology 31: 149. THATCHER, W. W.; COLLIER, R. J. (1986). Effects of climate on bovine reproduction In: DA. MORROW (ed). Current therapy in Theriotenology. Saunders GO Philadelphia pp. 301-309 163 THIBODEAUX, J. K.; GOODEAUX, L. L.; NUÑEZ-GONZALEZ . (1992). Time of ovulation in dairy heifers following prostaglandin F2a treatment. Agri- practice,1992;13 (4) 8-13. TURNBULL, A. C.; MITCHELL, M. D.; KEIRSE, M. J.; BRUNT, J. D.; ANDERSON, A. B. M.; (1977). Concentrations of the prostacyclin metabolite, 6– keto–prostaglandin f1α, in amniotic fluid during late pregnancy and labour. Headington, Oxford OX3 9DU. TWAGIRAMUNGU, H.; GUILBAULT, L.A.; DEUFOUR, J.J. (1995). Synchronization of ovarian follicular waves with a gonodotropin-releasing hormone agonist to increase the presision of estrus in cattle: a review. J. Anim. Sci, v. 73, p. 3141-3151. VASCONCELLOS, J. L. M; PURSLEY, J. R; WILTBANK, M. C; (1994). Effects of Syncro-Mate-B combined with GnRH on follicular dynamics and time of ovulation. J Anim Sci; 72 (Suppl 1): 174 abstr. VASCONCELOS, J. L. M. (1998) Avaliação do protocolo de sincrinização de ovalação “Ovsynch” e de fatores relacionados à associação entre produção de leite e taxa de concepão. Jaboticabal, 128p. Tese (Doutorado). Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista. VASCONCELOS, J. L.; XILCOX, R. W.; PURSLEY, J. R.; WILTBANK, M. C. ;(1999). Sincronization rate, size ovulatory follicle, and pregnancy rate after sincronization pos ovulation beginning on diference days of the oestrus cicle in lactating dairy cows. Theriogenology 52, 1067-1078. VENTURINI, M. E.; LEONAHRD, O.; (2007a). Resultados de la utilización de diferentes protocolos de sincronización para IATF de vacas con cria al pie. VII Simposio Internacional de Reproducción animal – IRAC, Cordoba, Argentina. 29 Junio a 01 Julio de 2007 164 VENTURINI, M. E.; LEONAHRD, O.; (2007b). utilización de dispositivos intarvaginales usados por segunda vez en vacas primiparas destetadas temporariamente. VII Simposio Internacional de Reproducción animal – IRAC, Cordoba, Argentina.29 Junio a 01 Julio de 2007. VENTURINI, M. E.; CLEDOU, G.; CALLEJAS, S.; (2007c). Uso del Benzoato de estradiol al momento de retirar un dispositivointravaginal con progesterona o 24 horas después en vacas y novillas para cria.. VII Simposio Internacional de Reproducción animal – IRAC, Cordoba, Argentina.29 Junio a 01 Julio de 2007. WALKER, David (2007). Sincronización del estro en el Ganado de carne. Michigan State University. Michigan. WATTIAUX, M. A.; (2000) Detección de celo, servicio natural e inseminación artificial. En: Instituto Babcock para la Investigación y Desarrollo Internacional de la Industria Lechera. Esenciales lecheras: reproducción y selección genética. Universidad de Wisconsin. Madison. WILLIS, A. L. & SMITH, D. L. (1994). Metabolism of Arachidonic Acid: an overview. In: The handbook of immunopharmacology. Lipid mediators. Chap 1 pp 1-32 Ed. WILTBANK, M. C.; (1996). Development of IA and ET programs that do not require detection of estrus using recent information on follicular growth. In: ANNUAL CONVENTION PORTLAND, 15, 1996, Oregon. Proceedings… Oregon: American Embryo Transfer Association. WILTBANK, M. C.; (1997). How information on hormonal regulation of the ovary has improved understanding of timed breeding programs. Proceedings, ANNUAL MEETING OF THE SOCIENTY FOR THERIOGENOLOGY. p. 83-97. XU, Z. Z.; McKNIGHT, D.J.; VISHWANATH, R.; PITT, C. J.; BURTON, L. J.; (1998). Estrus detection using radiotelemetry or visual observation and tail painting for dairy cows on pasture. J. Dairy Sci 81:2890–2896.