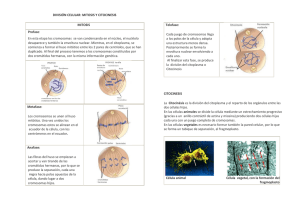
Ministerio de Medio Ambiente y Agua Estado Plurinacional de Bolivia Ministerio de Medio Ambiente y Agua Viceministerio de Recursos Hídricos y Riego Con el apoyo de: Viceministerio de Recursos Hídricos y Riego Ministerio de Medio Ambiente y Agua Guía para la evaluación genotóxica de cuerpos de agua utilizando células de raíces de www.cuencasbolivia.org Calle: Héroes del Acre esquina Conchitas Nº 1778 Telf. (591-2) 2124484 – 2117391 cebollines Guía para la Evaluación Genotóxica en Cuerpos de Agua Utilizando Células de Raíces de Cebollines Autor Ministerio de Medio Ambiente y Agua (MMAyA) Edición y diseño Viceministerio de Recursos Hidricos y Riego (VRHR) Texto: Gloria Rodrigo Lira El presente documento fue elaborado en el marco del Programa Plurianual de Gestión Integrada de Recursos Hídricos y Manejo Integral de Cuencas 2013 – 2017 y su impresión fue posible gracias al apoyo de la Cooperación Suiza en Bolivia a través de HELVETAS Swiss Intercooperation, programa CONCERTAR miembro de GESTOR. Está permitida la reproducción del presente documento, siempre que se cite la fuente.. La Paz –Bolivia 2014 Contenido 1 Recordando la división celular1 2 ¿Qué es genotoxicidad ?5 3 ¿Cómo se evalúa genotoxicidad en cuerpos de agua? 11 4 Protocolo de evaluación15 4.1 Reactivos y material18 4.2 Procedimiento de muestreo19 4.3 Medición de micronúcleos22 4.4 Datos y cálculos26 4.5 Interpretación de resultados28 5 Glosario30 6 Bibliografía consultada31 Presentación Con el objetivo de facilitar la labor de vigilancia, control y monitoreo de la calidad de los cuerpos de agua, en cumplimiento con los artículos 9, 10 y 11 del Reglamento en Materia de Contaminación Hídrica, de la ley del Medio Ambiente (Ley 1333), el Ministerio de Medio Ambiente y Agua (MMAyA), a través del Viceministerio de Recursos Hídricos y Riego (VRHR), elaboró la presente cartilla que se espera pueda ser difundida y aplicada de manera efectiva y concreta por técnicos de medio ambiente de los gobiernos municipales y departamentales, monitores comunales, empresas y cooperativas prestadoras de servicios de agua potable y saneamiento básico e instituciones u organizaciones involucradas y comprometidas con este tema. Como resultado de su aplicación, se espera que se pueda mejorar y ampliar el presente documento, por lo que será de mucho valor toda observación, sugerencia y comentario que se pueda hacer llegar al VRHR para su incorporación en sus próximas ediciones con los reconocimientos que correspondan. Ing. Carlos Ortuño Yáñez VICEMINISTRO DE RECURSOS HÍDRICOS Y RIEGO 1 Recordando la división celular Las plantas y los animales están formados por miles de millones de células individuales organizadas en tejidos y órganos que cumplen diferentes funciones específicas y que se reproducen duplicando tanto su contenido nuclear como el citoplasmático para luego dividirse en dos nuevas células. nes de nuevas células cada segundo simplemente para mantener su estado de equilibrio. Si la división celular se detiene el individuo moriría en pocos días. En especies unicelulares, como las bacterias, hongos, algas, protozoos y las levaduras (Figura 1), cada división de la célula única produce un nuevo organismo. En especies pluricelulares se requieren muchas secuencias de divisiones celulares para crear un nuevo individuo. En cuerpos adultos, la división celular es también necesaria para reemplazar las células perdidas por su desgaste, deterioro o por muerte celular programada o envejecimiento. Un humano adulto debe producir muchos millo- Protozoo Alga Bacterias Hongos Figura 1. Organismos unicelulares 1 El ciclo celular comprende el conjunto de procesos que una célula debe realizar para replicar de manera exacta el ADN1 y separar o dividir los cromosomas replicados en dos nuevas células distintas. La gran mayoría de las células también doblan su masa y duplican todos sus orgánulos citoplasmáticos en cada ciclo o división celular. De este modo, durante el ciclo celular un conjunto complejo de procesos citoplasmáticos y nucleares tienen que coordinarse unos con otros. Dependiendo del tipo de célula, existen dos variantes en la división celular: la mitosis y la meiosis. Mitosis. La mitosis es la división celular asociada a las células somáticas. Las células somáticas representan la totalidad de las células del organismo excepto las células germinales o sexuales y las células embrionarias, que La molécula de ADN (ácido desoxirribonucleico) tiene la estructura de una escalera formada por azúcares, fosfatos y cuatro bases nucleotídicas llamadas adenina (A), timina (T), citosina (C) y guanina (G). El código genético queda determinado por el orden de estas bases, y cada gen tiene una secuencia única de pares de bases. Los científicos utilizan estas secuencias para localizar la posición de los genes en los cromosomas y elaborar el mapa del genoma humano. En casi todos los organismos celulares el ADN está organizado en forma de cromosomas, situados en el núcleo de la célula. 1 2 son el origen de los gametos. Por lo tanto, se encuentran en los huesos, la piel, los tejidos, los órganos y la sangre. Se componen de 23 pares de cromosomas2. Las células somáticas pueden mutar sin transmitir sus modificaciones a los futuros descendientes. Las células somáticas que mutan pueden, sin embargo, ser la causa de diferentes tipos de cáncer. La mitosis, entonces, es el proceso de división o reproducción nuclear de cualquier célula que no sea germinal. Meiosis. Se debe recordar que los organismos superiores que se reproducen de forma sexual se forman a partir de la unión de dos células germinales o sexuales especiales denominadas gametos. Cada célula germinal es diferente genéticamente por la recombinación genética que se da durante la meiosis. Las células germinales son las responsables de la formación de las células reproductoras o gametos, los esperDentro del núcleo, una de las estructuras más importantes son los cromosomas, formados por el ADN y las proteínas presentes en el núcleo. Los cromosomas son semejantes a dos brazos, unidos por el centrómero, donde se ordena el ADN. 2 matozoides en los hombres y los óvulos en las mujeres. Las células germinales contienen toda la información genética de un individuo y la transmiten al embrión, incluyendo eventuales mutaciones genéticas. diferentes combinaciones de genes. La meiosis consta de dos divisiones sucesivas de la célula con una única réplica del ADN. El producto final son cuatro células con n cromosomas. Estas células están situadas en las gónadas de los aparatos reproductores femenino y masculino. Los gametos contienen la mitad de la información genética de un individuo, es decir 23 cromosomas, por lo que se dicen que son células haploides. Estas células necesitan unirse al gameto complementario, que ocurre en el proceso de fecundación, para completar así la información para dar lugar a un individuo humano completo. En la meiosis, a diferencia de la mitosis, sólo se transmite a cada célula nueva un cromosoma de cada una de las parejas de la célula original. Por esta razón, cada gameto contiene la mitad del número de cromosomas que tienen el resto de las células del cuerpo, es decir, 23 cromosomas. Los gametos se originan mediante meiosis, proceso exclusivo de división de las células germinales o también llamadas células sexuales. La meiosis es un mecanismo de división celular que, a partir de una célula diploide (2n), permite la obtención de cuatro células haploides (n) con Cuando en la fecundación se unen dos gametos, la célula resultante, llamada cigoto, contiene toda la dotación doble de cromosomas. Es decir, 46 cromosomas. La mitad de estos cromosomas proceden de un progenitor y la otra mitad del otro. La meiosis, entonces, consiste en dos divisiones sucesivas de una célula diploide acompañadas por una sola división de sus cromosomas (Figura 2). 3 Tabla 1. Diferencias entre la mitosis y la meiosis Mitosis Meiosis 2n 2n 2n 2n A nivel genético Reparto exacto del material genético Segregación al azar de los cromosomas homólogos y entrecruzamiento como fuente de variabilidad genética. Como consecuencia de lo anterior se forman células genéticamente iguales. Produce una reducción del juego de cromosomas a la mitad exacta de los cromosomas homólogos. Meiosis I Mitosis A nivel celular 1n 1n Meiosis II 2n 2n 1n 1n 1n 1n A nivel orgánico Se da este tipo de división en los organismos unicelulares para su reproducción asexual y en pluricelulares para su desarrollo, crecimiento y la reparación y regeneración de tejidos y órganos. 4 Sirve para la formación de las células reproductoras sexuales. Figura 2. Procesos de división del núcleo en células somáticas (mitosis) y células germinales o sexuales (meiosis). 2 ¿Qué es genotoxicidad? Genotoxicidad es la capacidad relativa que tiene un agente físico, químico o biológico de ocasionar un daño en el material genético, originando efectos biológicos adversos en los seres vivos. De acuerdo a su modo de acción o efectos que puede ocasionar se clasifican en mutágenos3, carcinógenos4 y teratógenos5 , dando lugar a los procesos de mutagénesis, carcinogénesis y teratogénesis respectivamente. El daño en el material genético se da en el ADN y en todos aquellos componentes celulares que se encuentran relacionados con la funcionalidad y comportamiento de los cromosomas dentro de la célula, como son las proteínas y el ARN6. Agente químico, físico o biológico capaz de causar daño al ADN Agente químico, físico o biológico qué actúa sobre los tejidos vivos, causando cáncer. 5 Agente o sustancia que actúa sobre el embrión en desarrollo causando alteraciones morfo-fisiológicas. 6 Ácido ribonucleico, es la molécula que dirige la síntesis de proteínas a partir de la información contenida en el ADN. 3 4 A objeto de sistematizar e interpretar estos fenómenos, se desarrolló la Genética Toxicológica, que se constituye como una de las ramas de las ciencias biológicas encargada de evaluar el daño causado en el ADN (Figura 3) por distintos tipos de exposición a potenciales agentes genotóxicos y que se evalúa a partir del monitoreo ambiental y humano. Los primeros estudios llevados a cabo por Ames7, en bacterias que presentaban mutaciones en genes específicos y el desarrollo de la fracción S98 para activación La prueba de Ames se utiliza en la evaluación de mutagenicidad de muestras problema (agua, aire, lixiviados de residuos sólidos, extractos acuosos, etc.). Es considerada parte esencial de las pruebas toxicológicas para la detección y localización de fuentes que generen un daño potencial por la presencia de compuestos genotóxicos. 8 Fracción sobrenadante obtenido del hígado de rata a partir de un homogeneizado por centrifugación a 9000 g durante 20 minutos en un medio adecuado; esta fracción contiene citosol y microsomas. Las ratas utilizadas son de las líneas Sprague-Dawley y Wistar. La fracción S9 se utiliza en conjunción con la prueba de Ames para evaluar el potencial mutagénico de compuestos químicos debido a que permite predecir el posible comportamiento del compuesto a evaluar en su paso por la vía hepática. 7 5 metabólica, permitió demostrar, en experimentos con animales de laboratorio, que entre el 60 y el 90% de las sustancias carcinogénicas fueron mutagénicas. En la década de los 80’s se confirma la función de las mutaciones en el desarrollo del cáncer con el descubrimien- to de los oncogenes por activación de protooncogenes. Ahora se sabe que además de las sustancias denominadas carcinógenos genotóxicos, existen también otros carcinógenos no genotóxicos o epigenéticos que actúan por otros mecanismos. Copia mutada Adenina Timina Citosina Guanina Cadena azúcar - fosfato Figura 3. Esquema del proceso de mutación en la cadena del ADN. 6 El descubrimiento de la relación entre mutagénesis y el desarrollo de tumores permitió establecer la necesidad de evaluar el riesgo de carcinogenicidad por exposición a sustancias químicas mediante la evaluación de mutagenicidad. Por tanto, las pruebas para la detección de mutágenos adquirieron su importancia debido a que estos compuestos tienen la capacidad de alterar el material genético en los organismos y producir: malformaciones en el embrión o feto, mutaciones en las células germinales reduciendo la fertilidad, enfermedades cardíacas, arte- rioesclerosis, influir en los procesos de envejecimiento y provocar mutaciones que pueden generar cáncer (Majer et al., 2005). Según Fiskesjo (1985), los organismos biológicos tienen la capacidad de detectar cambios en la calidad del agua y expresar las alteraciones más sutiles que operan durante cierto tiempo en un ecosistema mediante respuestas individuales o de conjunto. En este sentido, los ensayos o test biológicos se están transformando en herramientas valiosas para la evaluación del impacto ambiental generado por los compuestos mutágenos. 7 Mitocondria Citoesqueleto Núcleo Ribosomas Retículo endoplasmático Centriolo Membrana plasmática Citoplasma Peroxisoma Aparato de Golgi Figura 4. Célula eucariota animal 8 Nucleólo Aparato de Golgi Citoesqueleto Reticulo Endoplasmático Cloroplasto Núcleo Nucleolo Mitocondria Ribosomas Vacuola Citoplasma Membrana Plasmática Pared celular Figura 5. Célula eucariota vegetal 9 Telofase Anafase Interfase Metafase Profase Células de raiz de cebollin en diferentes estadios de división 3 ¿Cómo se evalúa genotoxicidad en cuerpos de agua? Los ensayos de genotoxicidad están diseñados para detectar compuestos que inducen directa o indirectamente a daños genéticos por diferentes mecanismos. Generalmente, se considera que este daño produce efectos heredables y provocan la formación de tumores. Actualmente, se dispone de pruebas con las que se puede determinar un daño genético y así detectar compuestos genotóxicos. Muchas de estas pruebas son bioquímicas, in vivo o in vitro, con micro o macro organismos. Mediante estos ensayos se pueden determinar daños microscópicos o moleculares, o bien la formación de aductos, es decir, complejos que se forman cuando un compuesto químico se une a una molécula biológica, como el ADN o a ciertas proteínas. Para detectar con exactitud o predecir confiablemente los efectos genotóxicos de una sustancia en el ser humano no es suficiente una sola prueba, sino que se debe disponer de por lo menos dos o más alternativas. La correlación entre mutagenicidad y carcinogenicidad es cada día más evidente. Se ha demostrado que 157 de los 175 carcinógenos conocidos también son mutágenos. De ahí la conveniencia de saber con precisión el posible daño que un compuesto puede tener sobre nuestro organismo o sobre otros seres vivos. El monitoreo de los contaminantes por análisis directo requiere conocer el agente químico a verificar, y su evaluación está limitada por la sensibilidad y especificidad del método utilizado 11 Ante esto, los bioensayos ofrecen ventajas considerables debido a que un organismo puede metabolizar un compuesto cualquiera y convertirlo en otro que puede ser aún más tóxico que el original. Actualmente, a nivel mundial, las agencias reguladoras de medio ambiente exigen una batería o conjunto estándar de estudios de genotoxicidad antes de dar autorización para liberar productos de consumo humano, entre ellos el agua potable debido a que el proceso de potabilización requiere de cloro, el mismo que ha mostrado ser mutagénico en diferentes ensayos. La batería estándar para determinar genotoxicidad incluye el llamado test de Ames, que es un ensayo biológico rápido utilizado para determinar el potencial mutagénico y cancerígeno de compuestos químicos9. El procedimiento se describe en una serie de documentos de principios de 1970, escritos por Bruce Ames y su grupo de investigación de la Universidad de California, Berkeley. En este Las pruebas estándar para la carcinogenicidad hechas sobre roedores toman años para completarse y son caras de realizar. 9 12 sentido, el test de Ames es utilizado mundialmente como un ensayo inicial para discriminar nuevos químicos y fármacos por su potencial mutagénico. En varios estudios, las aguas contaminadas han mostrado que pueden inducir daño genético en mamíferos y organismos acuáticos (Minissi y Lombardi, 1997). El efecto mutagénico de estas aguas y sus sedimentos puede ser evaluado bajo condiciones de laboratorio usando sistemas biológicos como bacterias, levaduras, plantas y peces (Minissi et al., 1996). El protocolo mejorado para micronúcleos en raíces de Vicia y Allium (raíces de habas y cebollas) fue establecido como un ensayo estándar internacional por el International Program on Plant Bioassays bajo el auspicio del Programa Ambiental de las Naciones Unidas (Ji et al., 1999; Majer et al., 1999) Entre los diferentes ensayos citogenéticos en plantas, el test de micronúcleos (MCN) en raíces de Vicia faba (haba) es el más sensible para agentes aneugénicos y clastogénicos, además de ser simple, barato y requerir condiciones mínimas de laboratorio (Minassi y Lombardi, 1997). En China el test de MCN en Vicia faba (haba) es un método estándar en monitoreo ambiental (Kong et al., 1998). Sin embargo, en este tipo de ensayos con MCN también puede utilizarse raíces de Tradescantia paludosa (purpurina o amor de hombre) y Allium cepa (cebolla) debido a que resultaron ser bioindicadores altamente sensibles, fáciles de aplicar en diferentes situaciones empleando procedimientos y protocolos sencillos y de bajo costo. Figura 6. Plantines de purpurina (Tradescantia paludosa) Figura 7. Cebollines (Allium cepa) 13 Figura 8. Cebollines en proceso de ensayo 4 Protocolo de evaluación Los micronúcleos son fragmentos de cromosomas o cromosomas completos que, espontáneamente o por causa de agentes que rompen cromosomas o que alteran el huso10 de división, quedan fuera del núcleo durante la mitosis11. Entre estos agentes están las radiaciones, sustancias químicas, plaguicidas, fármacos y otros contaminantes ambientales. Los micronúcleos son conocidos, en el campo de la hematología, como cuerpos de Howell-Jolly. Su forma es generalmente redonda u ovalada, con un diámetro que varía desde 0,4 a 1,6 micras. Su formación ocurre en la anafase de la mitosis12 donde el fragmento cromosóDurante la división celular se forma una estructura especial para desplazar a los cromosomas que recibe el nombre de huso acromático. Después de la división, el huso se desmonta porque no es necesario. 11 La mitosis es la división de la célula en la que, previa duplicación del material genético, cada célula hija recibe una dotación completa de cromosomas. 12 Durante la anafase, los centrómeros se dividen, lo que permite que cada una de las cromátidas idénticas que formaban el par se separen (cromosomas hijos) y se dirijan a los dos polos de la célula arrastradas por los microtúbulos del huso mitótico. 10 mico que no posea centrómero o el cromosoma desorientado no podrá integrarse a un núcleo por carecer del elemento indispensable para orientarse en el huso acromático. Luego, en la telofase, los cromosomas normales, así como los fragmentos que posean centrómeros, dan origen a los núcleos de las células hijas. Sin embargo, los elementos rezagados, que pueden ser fragmentos o cromosomas completos, quedan incluidos en el citoplasma de las células hijas y una proporción de ellos se transforma en uno o varios núcleos secundarios. Tales núcleos son mucho más pequeños que el núcleo principal, de ahí su nombre de micronúcleos (Figura 9, Figura 10). Si el compuesto estudiado es un clastógeno, se formarán micronúcleos pequeños, pero si es un aneuploidógeno, lo que se observará será la formación de micronúcleos grandes (Terradaset. al. 2010). 15 eritrocitos policromáticos de la médula ósea, cultivos de linfocitos de sangre periférica, células de la mucosa bucal, hepatocitos de rata, eritrocitos en peces y aves. Como se indicó antes, en células vegetales, las más utilizadas son las células meióticas de la purpurina ó amor de hombre y las células meristemáticas de cebolla y haba. Como ventajas de la técnica de micronúcleos están: Figura 9. Formación de núcleos y micronúcleos a partir de una célula madre Los micronúcleos son núcleos citoplasmáticos redondos y de tamaños variables con las mismas características histoquímicas que el núcleo principal, pero están envueltos dentro de un pedazo separado de membrana nuclear. Para la realización de esta prueba es indispensable utilizar un tejido en constante división, pero debe considerarse que en las células con poco citoplasma los micronúcleos no son fácilmente distinguibles de los lóbulos o proyecciones del núcleo normal. La prueba se realiza en diferentes tipos celulares como: 16 - La posibilidad de probar un sólo agente o sustancia química sin otros compuestos, -La posibilidad de probar mezclas o muestras complejas en su composición, - La abundancia de células analizables en diferentes periodos del ciclo celular y el que los micronúcleos formados durante la división celular persisten al menos durante la siguiente interfase. Adicionalmente, la prueba no deja lugar a dudas sobre el daño producido, pues lo que se observa como micronúcleos es claramente una pérdida de ADN. Entre las principales desventajas están: -La prueba no detecta agentes que no producen pérdidas de material genético o rezagos anafásicos, y -Tampoco es útil en poblaciones celulares que no se dividen. Figura 10. Formación de micronúcleos en raíces de habas (Vicia faba) que fueron germinados en aguas con arsénico. 17 4.1 Reactivos y material Los reactivos y material requeridos para el ensayo de una muestra se presentan en las Tablas 2 y 3. Sin embargo, éstos pueden ser utilizados hasta para 10 muestras, con excepción de los recipientes para la toma de muestras y las copas de coctel. Tabla 2. Reactivos requeridos para uno a diez ensayos Reactivos Cantidad Ácido acético 99% 100 mL Solución de ácido clorhídrico 1 N 50 mL Etanol 70% 500 mL Solución Etanol: ácido acético (3:1) Tabla 3. Material requerido Material Bisturí o gillete Cantidad 3u Copas de coctel de 100 mL 24 u* Cubreobjetos 1 caja 100 u Gradilla para tubos largos 1u Jarra plástica de 1 L 1u Lápiz negro con goma 1u Marcador indeleble1 u Masking de 1 pulgada 1u Microscopio con objetivos 4x a 120x 1u Pinza metálica de punta fina 1u Piseta para agua de 500 mL 1u 100 mL Portaobjetos 1 caja 50 u H2O hervida de grifo 1 000 mL Probeta de 100 mL 3u H2O destilada 1 000 mL Recipiente plástico de 5 L 1 u* Solución de orceína13 acética 45% 50 mL Servilletas de papel o papel filtro rápido 1u Tubos de ensayo de boca ancha 40 u Vaso de precipitados de 250 mL 7u Viales o frascos de 5 mL con tapa 10 u Contómetro o contador de células 1u Colorante de color rojo violáceo, extraído de líquenes y que tiñe con preferencia núcleos y cromosomas. 13 *Material requerido por muestra a ensayar 18 4.2 Procedimiento de muestreo Durante el muestreo de agua se recomienda tomar las siguientes precauciones14: a) Las muestras no deben incluir partículas grandes, desechos, hojas u otro tipo de material accidental, salvo cuando se trate de muestras de sedimentos. Además, deben ser filtradas para la realización de los ensayos o determinaciones. Si no hubiera papel filtro, se puede usar servilletas de papel. b)Para minimizar la contaminación de la muestra, conviene recogerla con la boca del frasco en la misma dirección de la corriente (Figura 11). 14 c) Se debe tomar un volumen suficiente de muestra, se recomienda entre 2 a 3 litros para eventuales necesidades de repeticiones. d) Se debe realizar todas las determinaciones posibles de campo, como las mediciones de pH, temperatura y conductividad. Para evitar riesgos de contaminación, estas determinaciones deben realizarse en alícuotas de muestras separadas de las que serán enviadas al laboratorio. e) Se deben limpiar muy bien los frascos y demás materiales de recolección. Es importante recordar que en gran parte de los casos la contaminación de los frascos no es visible ni siquiera al microscopio. f) La parte interna de los frascos no debe ser tocada con la mano ni debe quedar expuesta al polvo, humo u otras impurezas. Litter et al., 2009. 19 g) Las personas encargadas de la recolección de muestras deben mantener las manos limpias y usar guantes. para evaluar el grado de contaminación o asimilación de carga orgánica a lo largo del tramo en estudio. h) Los frascos deben ser llenados completamente y de manera rápida con la muestra y luego resguardadas fuera del alcance de la luz solar. l) En el caso de aguas subterráneas, deben considerarse protocolos específicos para evitar la alteración de las muestras. Entre los datos que se deberán registrar están: i) En lo posible, para la preservación en su traslado al laboratorio (Figura 12), las muestras deben ser refrigeradas en cajas de poliestireno de manera inmediata. Para evitar posible contaminación de las muestras, no debe añadirse sal al hielo de refrigeración. - Tiempo de bombeo, - Profundidades de donde se realizaron las recolecciones, - Profundidad del pozo, - Profundidad de los niveles estático y dinámico, - Tipo de bomba, - Profundidad del ranurado, etc. j) Se debe mantener un registro de toda la información de campo. Para esto se deberá llenar una ficha de recolección por muestra o conjunto de muestras de las mismas características. k) El muestreo en pequeños cursos de agua debe hacerse aguas arriba y aguas debajo de las fuentes de contaminación, con la inclusión opcional de puntos adicionales 20 Para determinar si existe una relación de dosis – efecto, la muestra de agua debe evaluarse considerando las siguientes proporciones de dilución: - Sin dilución (100% la muestra), - Dilución al 50%, - Dilución al 25%, - Dilución al 12,55%, y - Dilución al 6,25%. Figura 11. Toma de muestra para ensayos. Las diluciones pueden realizarse con agua hervida de grifo o agua destilada, la misma que deberá utilizarse también para el control negativo o blanco. Figura 12. Lectura de micronúcleos en microscopios. 21 4.3 Medición de micronúcleos Para el ensayo con bulbos de Allium cepa (cebollines), se debe seleccionar el número necesario o suficiente de bulbos con el mismo tamaño y apariencia. Se recomienda bulbos con diámetro de 1 cm. Mínimamente deberá considerarse un número de 140 bulbos, 20 para el control negativo o blanco (agua de grifo o destilada), 20 para el control positivo (muestra sin dilución) y 20 para cada una de las diluciones de la muestra (80 bulbos). Los restantes 20 servirán para reemplazar algún imprevisto. En cada caso deberán realizarse 2 réplicas de 10 bulbos cada una. Si se ve por conveniente, también puede hacerse 3 réplicas para facilitar luego la aplicación de análisis estadístico. De usarse cabezas de cebollas más grandes, tres son suficientes por tratamiento. Para proceder con los ensayos se deberá seguir la siguiente secuencia de acciones: 22 1) Preparación de cebollines: Con un estilete u cuchillo muy fino, de la zona radicular se debe quitar o cortar con cuidado todas las raíces. Se debe evitar lastimar la cofia o lugar de nacimiento de las raíces. Luego se debe retirar la cascara externa de la cabeza del cebollín y finalmente cortar las hojas dejándolas con unos 5 a 7 cm de longitud (Figura 13). 2)En vasos de precipitados o en copas de coctel con agua hervida de grifo o destilada (2 réplicas por tratamiento), se debe colocar 10 bulbos, asegurándose que la zona radicular quede en contacto con el agua (Figura 14), pero nunca tocando la base o fondo del vaso porque se inhibiría el crecimiento radicular. Se puede insertar y sujetar los 10 tallos con palitos mondadientes. la muestra de agua que se está evaluando (control negativo, 6,25%, 12,5%, 25%, 50% y 100%, si fuera necesario también en control positivo) todo por duplicado o triplicado). Figura 13. Cebollines preparados para ser ensayados 3) Dejar reposar en esta agua, a temperatura ambiente, por 48-72 horas hasta que las raíces alcancen una longitud de 1 – 1,5 cm. 4)Al segundo o tercer día, según el crecimiento de las raíces (en invierno estas suelen crecer más lentamente), sacar el manojo de cebollines del agua, lavarlos con agua hervida de grifo y colocarlos en Figura 14. Bulbos de cebollines en agua hervida de grifo 23 5) Dejar el ensayo corriendo por 24 o 48 horas. Anotar en el reporte este dato de tiempo. 6) A las 24 o 48 horas, sacar el manojo de cebollines de las muestras de agua, lavar con agua hervida de grifo o destilada y observar inicialmente las características de las raíces como color, grosor y forma de la terminación, Se debe contar y medir las raíces, reportar los datos en una tabla para procesarlos. 7) Cortar y colectar las raíces de los 20 cebollines de cada tratamiento en viales con tapa conteniendo la solución de etanol: ácido acético 3:1. Se puede utilizar también botellitas de antibióticos. Se debe guardarlos por un máximo de 22 horas para que se fijen y detengan los procesos metabólicos. 8) A las 22 horas se debe cambiar las raíces colectadas a otro vial con etanol al 70% y rotular cada muestra con cuidado. Se puede colocar dentro del vial, junto con 24 las raíces, un papel cebolla con el nombre de la muestra, código, fecha, etc. escrito con lápiz negro. Estas raíces están listas para evaluar micronúcleos. La muestras así preparadas se pueden guardar hasta tres meses en refrigeración. 9) Colocar unas cuantas raíces, pueden ser 5, en un tubo con solución de ácido clorhídrico (HCl) 1 N, tapar y dejar en baño María de 3 a 5 minutos. Si no se cuenta con baño María, se puede usar un vaso con agua hervida. Se debe cuidar que el vial no se abra cuando está en el baño María. 10)Sacar 1 a 2 raíces sobre un portaobjetos, cortar aproximadamente los 3 mm finales de la raíz y eliminar el resto. 11)Cortar las raíces con el gillete o bisturí, de manera transversal en forma de micro rodajas, lo más finamente posible. 12)Añadir una gota de orceína acética y dejar 10 a 15 minutos. Si se seca, añadir más orceína acética. 13)Tapar con un cubreobjetos, presionar fuertemente y repiquetear con la goma de un lápiz. 14)Observar al microscopio, ubicar campos donde las células estén dispersas, contar 1 000 células por placa. Esta acción debe realizarse por duplicado. 15)Reportar las células que contengan uno o más micronúcleos (Figura 15). Figura 15. Células binucleadas presentando más de 3 micronúcleos 25 4.4 Datos y cálculos El recuento de micronúcleos se realiza en microscopio binocular con el objetivo de 40X. El criterio para análisis de micronúcleos de las células debe cumplir con los siguientes requisitos (Fenech 2000; Figura 16): 7) No debe estar sobrepuesto a ninguno de los núcleos, 8) El micronúcleo dudoso será descartado en el análisis. 1)Debe tener morfología idéntica a los núcleos principales, 2) Debe tener una forma redonda u ovalada, 3) Su diámetro debe estar entre 1/16 y 1/3 de los núcleos principales, 4) Debe tener el mismo color, textura y retracción que el núcleo principal, 5) No debe presentar refringencias (núcleos o partes de núcleos brillosos), 6)Debe estar claramente separado del núcleo principal, 26 Figura 16. Célula con núcleo y micronúcleo identificado. 9) Cuando la frecuencia de micronúcleos sea menor de 3/1 000 (0,3%) se deberá evaluar un máximo de 3 000 células. Esto para disminuir la probabilidad de que la presencia de los micronúcleos se pudiese deber a un evento al azar. La frecuencia de Micronúcleos (MCN %) se calcula como sigue: MCN%= Número de células con micronucleos Número total de celulas contadas x 100 Para el análisis estadístico se puede hacer uso de Microsoft Excel y determinar medias y error estándar en cada grupo experimental, así como el cálculo de la varianza de todos los tratamientos. Asimismo, se puede utilizar el t-test Dunnett, que se aplica para determinar la diferencia significativa entre medias del control y los grupos de tratamiento (Duan et al, 1999). Interpretación de 27 4.5 Resultados Los resultados son considerados positivos cuando se observa un aumento significativo en la frecuencia de células con micronúcleos respecto al grupo de control negativo o blanco. En este entendido, si el número de micronúcleos (MCN) formados en el agua evaluada es igual o mayor al doble de los formadas en el ensayo en blanco, se dirá que el agua tiene riesgos genotóxicos. hay un aumento significativo en la presencia de micronúcleos. Es decir, si en el agua evaluada el número de micronúcleos formados es menor al doble de micronúcleos formados en el grupo de control negativo o blanco, se dirá que el agua no tiene riesgos genotóxicos. MCN muestra ≥ 2MCN blanco => Tiene riesgo genotóxico La Figura 17 muestra parte de los resultados con células de raíces de haba (Vicia faba) y la Figura 18 resultados con raíces de cebollines (Allium cepa). Los resultados son considerados negativos cuando no 28 MCN muestra < 2MCN blanco => No tiene riesgo genotóxico Figura 17. Micronúcleos desarrollados en ensayos con células de raíces de Vicia faba (haba). Figura 18. Micronúcleos desarrollados en ensayos con células de raíces de Allium cepa (cebolla). 29 5 Glosario Aneugénicos: Agente capaz de producir en la célula que uno o más cromosomas completos de un conjunto normal falten o se presenten más de una vez. Mutagenicidad: Propiedad de agentes físicos o químicos de inducir cambios en el material genético que se transmiten durante la división celular. Clastogénicos: Agente que causa rotura de los cromosomas y/o consecuentemente, ganancia, pérdida o reordenamiento de los fragmentos cromosómicos Mutágenos: Un agente químico, físico o biológico que altera o cambia la información genética de un organismo y causa un incremento en la frecuencia de mutaciones espontanea. Cuando numerosas mutaciones causan cáncer, se denominan carcinógenos. Micronúcleos: Fragmentos de cromosomas o cromosomas completos que espontáneamente o por causa de agentes que rompen cromosomas, como las radiaciones (agentes que se denominan clastógenos) o que dañan el huso mitótico, como la vincristina (aneuploidógenos), quedan fuera del núcleo durante la mitosis. Mutación: Alteración en la secuencia de ADN. Puede ser causado por daños producidos por químicos, por radiación o por errores durante la replicación y la reparación del ADN. Entre sus consecuencias están las enfermedades genéticas y el cáncer. Genotóxico: Tóxico o dañino para el ADN. Las sustancias genotóxicas pueden unirse directamente al ADN o actuar indirectamente mediante la afectación de las enzimas involucradas en la replicación del ADN y causando, en consecuencia, mutaciones que pueden o no desembocar en un cáncer. Las sustancias genotóxicas no son necesariamente cancerígenas, pero la mayor parte de los cancerígenos son genotóxicos. 6 Bibliografía consultada Ascarrunz M, Rodrigo G. 2010 Manual de Genética Toxicológica. 1ra ed. Universidad Mayor de San Andrés La Paz-Bolivia editor: Mercedes Morales. 252 pp. Capítulo 8. La genética toxicológica desde el punto de vista analítico. 213-245 Duan CQ., Hu B., Jiang XH., Wen CH., Wang Z., Wang YX. 1999 Genotoxicity of water samples from Dianchilake detected by the Vicia faba micronucleus test. Mutation Research 426:121-125 Fenech M. 2000 The in vitro micronucleus technique. Mutation Research 455:81-95 Fiskesjo G. 1985 The Allium test as a standard in environmental monitoring. Hereditas 102:99-112 Kong ZM., Zang Y., Wu QL. 1998 Monitoring the genotoxicity of Lake Taihu, using two kinds of mi-cronucleus tests. Environmental Pollution 99:279-283 Litter MI., Armienta MA., Farías SS. 2009 IBEROARSEN Metodologías analíticas para la determinación y especiación de arsénico en aguas y suelos. Editado por CYTED. Argentina. Ma TH., Xu Z., Xu C., McConnell H., Rabago EV., Arreola GA., Zhang H. 1995 The improved Allium/Viciaroot tip. Micronucleus assay for clastogen-icity of environmental pollutants. Mutation Research 334:185-195 Ma TH. 1999 The international program on plant bioassays and the report of the follow-up study after the handson workshop in China. Mutation Research 426:103-106 Ji Q., Yang h., Zhang X. 1999 Vicia root-micronuclei assays on the clastogenicity of water sam-ples from the Kui River near Xuzhou city, People’s Re-public of China. Mutation Research 426:133-135 Majer B., Grummt T., Uhl M., Knasmüller S. 2005 Use of 31 plant bioassays for the detection of geno-toxins in the aquatic environment. Acta hydrochim. Hydrobiology 33:45-55 Minissi S., Ciccotti E., Rizzoni M. 1996 Micro-nucleus test in erythrocytes of Barbus plebejus (Tele-ostei, Pisces) from two natural environments: a bioassay for the in situ detection of mutagens in freshwater. Mutation Research 367:245-251 Minissi S., Lombi E. 1997 Heavy metal content and mutagenicity activity, evaluated by Vicia faba mi-cronucleus test, 32 of Tiber river sediments. Mutation Research 393:17-21 Minissi S., Caccese D., Passafiume F., Grella A., Ciccotti E., Rizzoni M. 1998 Mutagenicity micronucleus test in Vicia faba root tips, polycyclic aromatic hy-drocarbons and heavy metal content of sediments col-lected in Tiber river and its tributaries within the urban area of Rome. Mutation Research 420:77-84 Terradas M., Martin M., Tusell L., Genesca A. 2010 Genetic activities in micronuclei: is the DNA en-trapped in micronuclei lost for the cell?. Mutation research 705: 60-67. 33
 0
0
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados