Descargar
Anuncio

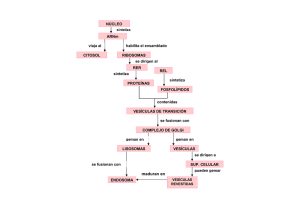
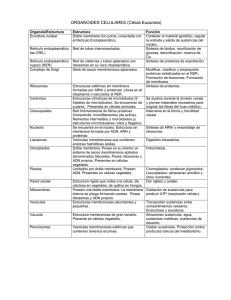
ENDOMEMBRANAS Compilación y armado: Prof. Sergio Pellizza Dto. Apoyatura Académica I.S.E.S Universidad Complutense de Madrid › Facultad de Ciencias Biológicas Profesor: Iñigo Azcoitia Retículos endoplasmáticos y Aparato de Golgi Las vesículas que salen de ellos están cubiertas, lo que facilita la vesiculización y permite uniones específicas con el cargo. Existen tres tipos de cubiertas: COP I y II y las cubiertas de clatrina. El RER manda vesículas a la cara cis del Golgi, formando previamente un compartimento salvaje o ERGIC. El contenido de estas vesículas viaja hasta la cara trans por las distintas cisternas, aunque hay varias teorías sobre cómo lo hace. De la cara trans, salen vesículas que pueden estar cubiertas o no hacia la membrana. Esto puede ocurrir de dos formas: • Vía constitutiva: las vesículas no parecen tener un destino claro, sino que son mandadas a distintas zonas según convenga. • Vía regulada: implica polarización, es decir, las vesículas se dirigen a sitios concretos en respuesta a una señal. Existe además un reciclado de estas vesículas para evitar la pérdida de membrana. RETÍCULO ENDOPLASMÁTICO LISO Es tubular, sin ribosomas asociados y muy empaquetado. Tiene bastante glucógeno alrededor ya que desfosforila glucosa-6-P para que pueda salir de la célula. Se encarga también de la síntesis de lípidos: estos vienen desde el citosol, se incorporan a la membrana y por medio de una flipasa pasan al lumen. BC5 1 Está implicado en procesos de detoxificación: es rico en bombas ABC para poder solubilizar las toxinas con la ayuda del citocromo P450. Por ello, el REL es abundante en los hepatocitos, muy prefundidos por el sistema porta hepático que lleva lo que se ha absorbido en la digestión para su detoxificación. RETÍCULO ENDOPLASMÁTICO RUGOSO Su papel principal es la síntesis de proteínas, por lo que lleva asociados numerosos ribosomas. Las proteínas se incorporan al RER mientras se sintetizan porque es más fácil si no están plegadas (aunque a veces hay translocación proteica mediada por chaperonas). El complejo ribosoma/proteína se una a un receptor en la membrana del RER que gasta GTP. Las proteínas tienen distintas secuencias (en Nterminal, generalmente) según el orgánulo al que vayan. Hay chaperonas tanto en la membrana como en el lumen para ayudar al plegamiento de la proteína, como es el caso de la chaperona BiP que mantiene la proteína con una forma apropiada pero no la pliega. El RER también se encarga de unir proteínas a lípidos por medio del enlace GPI. En el RER se glucosilan proteínas: se unen azúcares en asparaginas (glicosilaciones en N). Esto comienza con el dolicol, un fosfolípido con azúcares que los transfiere a la proteína, y sobre ésta se modifica esa cadena azucarada. BC5 2 El RER manda las vesículas al Golgi indiscriminadamente y no según el tipo de proteínas: si una proteína propia del RER llega al Golgi, ésta volverá al RER porque tiene la secuencia específica para ir a ese orgánulo. Esto implica un transporte desde el Golgi al RER. Si una proteína se sintetiza mal, existen 2 formas distintas para solucionarlo: • Reparación de proteínas: la proteína se repliega por medio de chaperonas. • Erradicación: la proteína se ubicuitina a la vez que se saca del RER para su degradación en el proteasoma. No se sabe muy bien cómo se reconocen las proteínas mal plegadas, pero se sabe que suelen exponer zonas hidrofóbicas. También se propone la existencia de secuencias de señalización o identificación que no tienen porqué estar continuas sino que pueden estar separadas y por un mal plegamiento quedar contiguas formando parches de identificación. CONTROL DE CALIDAD La calnexina y la calrreticulina son chaperonas en la membrana y la luz del RER respectivamente, y ayudan al plegamiento reconociendo sólo proteínas glicosiladas en N cuando se produce hidrólisis, por glicosidasas, de 2 glucosas de las 3 terminales de la ramificación de BC5 3 azúcares del dolicol. Esta hidrólisis evita que sean degradadas las proteínas. Una vez plegada, se elimina la glucosa que queda y algunas manosas (por medio de manosidasas) y se exporta. Si la proteína no está bien plegada, se puede volver a poner la última glucosa ya que es un proceso reversible; aunque no se hace indefinidamente: si tras n veces no se pliega bien, se erradica. BC5 4 RESPUESTA AL MAL PLEGAMIENTO O ESTRÉS DEL RER Esto se produce cuando el RER es incapaz de plegar proteínas de forma eficiente porque hay exceso de proteínas en síntesis o en cantidad mal plegadas. Se debe a que no hay suficientes chaperonas: por ejemplo, hay déficit de BiP y no se puede unir a todas las proteínas mal plegadas. Hay unas proteínas de membrana que en condiciones normales en el RER están unidas a BiP y no se dimerizan, y tienen actividad kinasa intraluminal y nucleasa hacia el citosol (degrada RNA). Cuando hay exceso de proteínas mal plegadas, BiP se suelta de estas enzimas, y éstas se mueven por la membrana hasta que se encuentran y dimerizan. Entonces se produce una fosforilación cruzada y se pone en marcha la actividad nucleasa, que escinde un RNAm característico que está transcrito continuamente en el citosol pero que en condiciones normales no se lee por tener un intrón. Al escindirse su intrón, el RNA se traduce originando un factor de transcripción que hace que se expresen los genes UPR, que son genes de chaperonas: aumenta la síntesis de BiP. Paralelamente, por otro enzima de membrana del RER, disminuye la traducción de proteínas excepto de las necesarias. Si esta situación persiste, la célula muere. CLASIFICACIÓN DE PROTEÍNAS EN EL GOLGI Las proteínas con manosa-6-P se unen a receptores que las reconocen para que entren al Golgi. Del Golgi al RER, las vesículas están cubiertas por COP II; en el Golgi por COP I; y las que salen del Golgi por clatrina. Existe también un transporte del Golgi al RER. Sobre el movimiento vesicular del Golgi, existen dos teorías: • Las cisternas se mueven de cis a trans ya que van progresando según maduran las proteínas, y hay un retroceso de vesículas para mantener las proteínas propias de cada cisterna. Esta teoría es la que prevalece hoy día. BC5 5 • Sólo las proteínas que van madurando se transportan de cisterna en cisterna, por lo que el Golgi es estático y cada cisterna tiene su propia dotación proteica que no hace falta renovar. También hay proteínas preensambladas desde el RER, como el procolágeno, que exceden el tamaño de las vesículas ya que son rígidas y largas, lo que no se explica con ninguno de los modelos anteriores. Vesículas Como tienen que ser curvas, usan fosfatidil serina y lisofosfatidil colina porque permiten esa estructura. Las proteínas de la cubierta se unen a proteínas adaptadoras, que a su vez se pueden unir al cargo tanto directa como indirectamente. La clatrina tiene una estructura de tres patas que se unen como en un balón de fútbol, y no interviene en el reconocimiento del receptor de la membrana de destino. La dinamina favorece el estrangulamiento de la vesícula. La formación de las vesículas sigue estos pasos: • La clatrina interacciona con la proteína de cargo transmembrana, lo que facilita la formación de la cubierta porque es un proceso cooperativo. • La clatrina se pierde cuando se ha formado la vesícula, y ésta es reconocida por los receptores correspondientes en la membrana de destino. • El reconocimiento de la vesícula no está muy conocido, pero se sabe que es por medio de complejos de proteínas y no por una sola. RAB es una proteína G-monomérica esencial en la fusión. BC5 6 En la fusión vesícula-membrana hay una verdadera fusión de la membrana, habiendo continuidad entre ambas; mientras que en los puntos de contacto de membranas, como entre el RE y la mitocondria, hay pérdida de 2 monocapas de las 4. La interacción entre vesícula y membrana tiene estos pasos: • RAB-GDP está inactiva y además inhibida porque tiene unida GDI. • RAB se ancla en la membrana del donador porque se libera de GDI gracias a GDF. • GEF intercambia el GDP por GTP, lo que hace que RAB se active, reconociendo en la membrana de destino al efector. • Las proteínas SNARE (v en el donador y t en el aceptor) son largas y flexibles, y se unen entre ellas pasando de la formación trans (en distintas membranas) a la formación cis (en las mismas membranas). BC5 7 Internalización Hay de distintos tipos: • Fagocitosis: se engloban partículas, En vertebrados lo realizan los macrófagos, pero en situaciones extremas cualquier célula puede hacerlo. Se emiten pseudópodos que engloban la partícula y forma fagosomas. También puede producirse dentro de la célula si un orgánulo fagocita a otro defectuoso, formando autofagosomas. • Macropinocitosis: engloba partículas de forma inespecífica mediante una prolongación. • Mediada por clatrina: semejante a lo visto en endomembranas. • Dependiente de caveolina: forma caveolas, un tipo de vesículas especiales porque no son tan dinámicas como las demás ya que se puede quedar sin estrangular cierto tiempo, incluso se piensa que las puede haber permanentes. Se suelen formar parches de receptores en las caveolas ya que tienen muchos para moléculas extracelulares. Las caveolas convergen en el caveosoma. • Independiente de clatrina y caveolina: poco conocida. En la formación de vesículas, es muy importante el citoesqueleto que forma el córtex celular. Las proteínas nucleadoras de actina ayudan a la polimerización de ésta, haciendo que se empuje la vesícula y se forme. La dinamina se encarga del estrangulamiento. ENDOSOMAS Todos tienen bombas de protones que consumen ATP. Las vesículas primero se fusionan formando el endosoma temprano, que pasa a ser el endosoma multivesicular (MVB). El endosoma tardío recibe a su vez vesículas con productos hidrolíticos desde el trans-Golgi y muy ricas en bombas de H+, y estas vesículas también son llamadas lisosomas primarios. Poseen enzimas capaces de degradar casi cualquier cosa (por ejemplo, no pueden degradar silicio, polisacáridos grandes…). BC5 8 Los lisosomas son el producto de la fusión de las vesículas hidrolíticas con el endosoma tardío. Siguen teniendo actividad hidrolítica y pueden fusionarse a otro endosoma tardío más tarde. A veces quedan en ellos restos no digeribles y que no pueden ser eliminados, como los gránulos de lipofucsina. La vida de los endosomas es breve, y parte del endosoma primario se puede reciclar volviendo a la membrana o al Golgi. No siempre los endosomas terminan en los lisosomas: en células endoteliales se puede producir transcitosis. Esto consiste en la formación de una vesícula de endocitosis que vierte el contenido al otro lado de la célula, como ocurre en el paso de inmunoglobulinas de una madre al lactante; y este transporte es en ambos sentidos y están cubiertos por clatrina. Un ejemplo de internalización es el de las LDL (lipoproteínas de baja densidad). La célula tiene receptores para LDL conectados por medio de una proteína adaptadora a la clatrina. La vesícula acumula varios receptores al unirse las clatrinas y finalmente varias vesículas se fusionan formando el endosoma temprano. Este endosoma temprano tiene dos elementos: el compartimento de clasificación y el de reciclado. Tiene una zona central vesicular y varias zonas tubulares de poca capacidad, produciéndose una clasificación geométrica según lo que quepa en los túbulos y lo que no. Fragmentando los túbulos, se consigue reciclar los receptores de membrana y restos de ésta. BC5 9 SISTEMA ESCRT Es de reciente descripción. No todas las proteínas que entran siguen el mismo patrón de internalización: algunos de los receptores son mono o multiubicuitiados (de modo que no señaliza para degradación) y son reconocidos por este sistema ESCRT, que provoca que estos receptores sean endocitados dentro del endosoma, perdiendo la ubicuitina y siendo degradados. Este sistema participa en dos procesos: • Internalización de proteínas mal plegadas. • Internalización de factores de crecimiento: el receptor se internaliza y viaja por una vesícula por el citosol activando funciones, y se internaliza dentro de la vesícula para que cesen sus efectos. LISOSOMAS SECRETORES Los linfocitos T citotóxicos asesinan las células a las que se unen, exocitando unas moléculas Fas que son recibidas por la otra célula. Además, convierte sus lisosomas en lisosomas secretores con granzimas (proteasas) que hidrolizan numerosos sustratos y con perforinas, que forman poros en la membrana de la otra célula. La perforina no se incorpora al linfocito gracias a sus propias caspasas. Lo que ocurre es una endocitosis del poro de perforina y de las granzimas, que salen una vez dentro de la célula. BC5 10 CAVEOLAS Son vesículas de internalización sin clatrina que se encuentran en músculo, tejido adiposo, endotelios… Son vesículas alargadas con una vida media elevada, que forman huecos en la membrana y que pueden estar ramificados. Cuando se internalizan, también se dirigen a los endosomas. Presentan caveolina íntimamente unida a lípidos de membrana por palmitaciones, dominios hidrofóbicos que deben quedar dentro de la membrana, etc. Las membranas de las caveolas son gruesas y rígidas, con muchos glucoesfingolípidos y colesterol, por lo que están en estado de gel. La caveolina se sintetiza en el RE, y según va madurando por el Golgi se van asociando distintas unidades, que forman los dominios de membrana en que participan. Las caveolas pueden estar también asociadas a proteínas de la matriz extracelular. Las caveolas son importantes en el metabolismo y regulación de lípidos. De hecho, la formación de gotas lipídicas es difícil en mutantes sin caveolina; ya que ésta está presente en la gota internalizada. Allí se encuentra con lípidos de señalización que por fosfolipasas liberan segundos mensajeros que activan un factor de transcripción (PPARα) que facilita que una célula se diferencie en un adipocito. Distribución de lípidos y proteínas En la clasificación mediada por lípidos, éstos tienden a interaccionar entre si de forma favorable y por ello tienen distintas proteínas asociadas. Los fosfoinosítidos pueden presentar hasta tres fosforilaciones en C3,4,5 que varían según el tipo de membrana, por lo que las distintas membranas llevan asociadas distintas fosfoinositol kinasas (como Pi3K) y fosfatasas para interconvertir los distintos fosfoinosítidos y que no se mezclen. Esta composición diferencial permite el reconocimiento de diferentes tipos de fosfoinosítidos por parte de los dominios específicos de proteínas específicas: estas interacciones determinarán el destino de las diferentes vesículas. BC5 11 Las vesículas se fusionan por factores de aproximación y proteínas SNARE de anclaje que fundamentalmente dependen de la interacción lípidos-proteínas. La cubierta ayuda a la reunión de proteínas específicas por medio de las proteínas adaptadoras. También existe una clasificación geométrica, como ocurre con el colágeno, que necesita vesículas alargadas; o la insulina, que necesita grandes vesículas. Además, ciertas proteínas quedan integradas en un cierto dominio debido a la presencia de barreras, como las bandas de unión intercelulares, que evitan el paso de la proteína de un dominio a otro. El movimiento de vesículas viene determinado por el citoesqueleto. Cada vesícula puede tener todos los motores necesarios pero sólo activa los necesarios. Estos motores son la kinesina/dineína en microtúbulos (una u otra según el sentido) y la miosina en los microfilamentos. Pueden darse saltos entre los distintos elementos del citoesqueleto. BC5 12