pam227 efavirenz sustiva sida
Anuncio

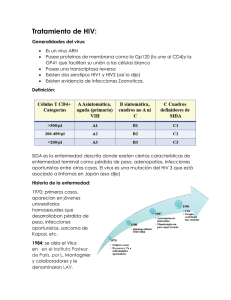
EFAVIRENZ SUSTIVA (Du Pont) GRUPO TERAPÉUTICO ATC - Grupo anatómico: (J) TERAPIA ANTIINFECCIOSA, USO SISTÉMICO. - Grupo específico: J05AG03. ANTIVIRALES DE ACCIÓN DIRECTA. Inhibidores de la transcriptasa inversa no nucleosídicos, específico del VIH-1. INDICACIÓN AUTORIZADA Tratamiento combinado antiviral de adultos, adolescentes y niños mayores de 3 años infectados por VIH . ACCIÓN Y MECANISMO Los medicamentos antiretrovirales actualmente disponibles se dividen en dos grupos: - Inhibidores de la transcriptasa inversa (retrotranscriptasa) - Didanosina - Efavirenz - Estavudina - Lamivudina - Nevirapina - Zalcitabina - Zidovudina - Inhibidores de la proteasa - Indinavir - Nelfinavir - Ritonavir Saquinavir Considerados aisladamente, todos los anti-VIH tiene dos limitaciones importantes: la incapacidad de erradicar totalmente el virus y la aparición de resistencias. Sin embargo, un cambio importante producido en los últimos años en el tratamiento actual del SIDA ha sido el abandono de la monoterapia en favor de tratamientos combinados con dos o tres antivirales. Por este motivo la comparación directa de los medicamentos del grupo tiene poco sentido. Los primeros inhibidores de la transcriptasa inversa en uso clínico eran todos nucleóticos. Por analogía estructural con los nucleótidos naturales, son capaces de impedir la síntesis de DNA viral a partir de la cadena de RNA infectante. Actúan como terminadores de cadena: la transcriptasa inversa los incorpora como eslabones en la cadena de DNA en formación, pero es incapaz de unir de ellos el eslabón siguiente. Obstaculizan así la incorporación del DNA viral a la dotación genética de la célula infectada. La zidovudina fue el primer medicamento anti-SIDA, el más experimentado y se considera todavía la base del tratamiento. Puesto que los medicamentos de este grupo se usan ahora en parejas, los criterios que deben tenerse en cuenta en la selección son los efectos adversos (no deben ser aditivos) y la inducción de resistencias (no deben ser cruzadas). Nevirapina constituyó el primer inhibidor de la transcriptasa inversa comercializado que no tiene naturaleza nucleosídica; posteriormente ha aparecido el efavirenz. Como consideración muy general, hay dos perfiles distintos de efectos adversos dentro del grupo: la zidovudina y (con menor intensidad) la lamivudina tienen toxicidad hematológica (anemia y neutropenia) y gastrointestinal (náuseas). Didanosina, zalcitabina y estavudina presentan, en grados diferentes, riesgo de neuropatía periférica y pancreatitis. El criterio de tratar de evitar la asociación de fármacos del mismo perfil tóxico no rigue para la lamivudina, que tiene una toxicidad comparativamente baja (es en cambio muy susceptible a la resistencia viral, pero la resistencia no es cruzada con la zidovudina). La asociación zidovudina/lamivudina es más potente que la zidovudina sóla sin la indicencia de efectos indeseables empeore demasiado. La mayor peculiaridad de la nevirapina y del efavirenz es su estructura química, muy alejada de los nucleósidos antirretrovirales (de hecho, se parece más a la carbamazepina o a los antidepresivos tricíclicos). No parece presentar resistencia cruzada con los derivados nucleosídicos (zidovudina, especialmente), aunque la resistencia frente a la propia nevirapina aparece de forma relativamente rápida, salvo que se utilice asociado con otros antirretrovirales (dos es el número mínimo recomendado). Los inhibidores no nucleosídicos de la transcriptasa inversa se unen al enzima en una zona relacionada pero diferente de la utilizada por los derivados nucleosídicos. Por este motivo, los derivados no nucleosídicos son capaces de evitar la aparición de resistencia asociada a la mutación de la zona de fijación de los inhibidores nucleosídicos. Ello no quiere decir que los derivados no nucleosídicos no induzcan la aparición de resistencia en el VIH, cosa que ocurre muy rápidamente si no se asocian a otros agentes antirretrovirales. Los inhibidores de la proteasa interfieren una etapa vital en el ensamblaje de nuevos viriones y la diseminación del virus. Una particularidad de la dotación genética del VIH es codificar muchas de sus proteínas vitales como precursores que tienen que ser recortados tras la síntesis para obtener las cadenas protéicas útiles. El corte de las cadenas precursoras está catalizado por una proteasa específica. Entre los componentes virales que no se forman sin la proteasa están la propia proteasa, la transcriptasa inversa y varias proteínas estructurales. Los inhibidores de la proteasa imitan la estructura química de los puntos de la cadena peptídica donde el enzima produce los cortes, bloqueando así la acción. La potencia antiviral es superior a la de los inhibidores de la transcriptasa inversa, pero son también muy susceptibles a las resistencias. De los cuatro medicamentos comercializados, el indinavir parece el mejor en términos de relación eficacia/riesgo. El ritornavir es igual de potente pero tiene una indicencia superior de efectos adversos y el saquinavir (que fue el primer fármaco del grupo) es menos eficaz in vivo debido a la baja biodisponibilidad. La eficacia clínica de nelfinavir parece ser similar al indinavir y superior a saquinavir, en tanto que es mejor tolerado que ritonavir. También la incidencia de interacciones es menor que con ritonavir y saquinavir. Una de sus aparentes ventajas es que no parece existir resistencia cruzada con otros inhibidores de la proteasa o, en el caso de haberla, no parece que sea completa. Esto permitiría, en el caso de que realmente llegue a confirmarse tal condición, que nelvinafir se convirtiese en el inhibidor de prosteasa de primera elección. Sin embargo, por el momento, es indinavir el fármaco del grupo que mejor balance eficacia/toxicidad (incluyendo interacciones) presenta, y por tanto es el elegible como primer tratamiento, siempre en combinación con uno o dos inhibidores de la retrotranscriptasa. El tratamiento del SIDA ha sufrido un profunda reconsideración desde su origen, debida a dos hechos fundamentales, el conocimiento de la cinética viral y la combinación de varios tipos de agentes antirretrovirales. Hasta hace poco se creía que el largo período de latencia entre la infección y la aparición de sintomatología de SIDA se correspondía con una etapa letárgica de la replicación del VIH. La puesta a punto de técnicas de identificación del VIH en plasma ha permitido saber que esto no es así. Por el contrario la primera fase de la infección se caracteriza por una replicación extraordinariamente rápida del virus en tejido linfoideo, que se contrarresta por la aceleración de las tasas de producción y destrucción de las células de defensa inmunitaria. Más de un 30% de los VIH en plasma se renuevan diariamente (semivida viral de menos de dos días) y el ritmo de reemplazo de células CD4 plasmáticas es de 1 millón al día, entre 10 y 100 veces el ritmo normal. La enfermedad aparece cuando el sistema inmunitario pierde la carrera frente a la infección. Este concepto tiene dos aplicaciones: ♦ Explica la escasa eficacia de la monoterapia. La facilidad de mutación y la rapidez de replicación garantiza la aparición y diseminación de cepas resistentes a cualquier medicamento. El VIH es bastante estable genéticamente, pero es debido a que la mayoría de las mutaciones no son viables. ♦ Al parámetro tradicional de evaluación de la progresión de la enfermedad, el recuento de las células CD4, se ha añadido un segundo: la medida de la carga viral (número de cadenas de ARN viral por ml de plasma). El primero mide el estado de las defensas, el segundo la potencia del invasor. Un recuento bajo de CD4 indica una fase avanzada de la enfermedad, una carga viral alta es pronóstico de evolución rápida. Las innovaciones han sido fundamentalmente dos: - Los resultados de ensayos clínicos que demuestran que el tratamiento combinado de dos antirretrovirales tiene mejores resultados que la clásica monoterapia con zidovudina. - La introducción de medicamentos con mecanismos de acción distinto de la inhibición de la transcriptasa inversa, notablemente los inhibidores de la proteasa. La combinación de agentes antirretrovirales inhibidores de la transcriptasa inversa de tipo no nucleosídico con los de estructura nucleosídica ha permitido reducir la aparición de resistencia a estos últimos. Las circunstancias antes citadas han llevado a un criterio terapéutico de atacar pronto y con fuerza al SIDA, usando politerapia para maximizar la eficacia y minimizar la aparición de resistencias. El mínimo es ahora la combinación de dos inhibidores de la transcriptasa inversa, y el régimen normal dos inhibidores de transcriptasa más un inhibidor de proteasa. Las limitaciones principales para usar la fuerza terapéutica máxima son de tipo económico y la aparición de efectos secundarios. Esto obliga a individualizar la terapia en función de la carga viral, el recuento de CD4 y los antecedentes de resistencias y de reacciones adversas al tratamiento previo. Las recomendaciones de tratamiento están en continua revisión. Recuento de linfo- Carga viral citos CD4 (por µl) > 500 <10.000 10.000-30.000 200-500 >30.000 <10.000 < 200 10.000-30.000 >30.000 Cualquiera Recomendaciones terapéuticas Sin tratamiento antiviral. Uso según el estado general del paciente, de una asociación de dos inhibidores de transcriptasa inversa Asociación de dos inhibidores de transcriptasa inversa. Uso según el estado general del paciente, de una asociación de dos inhibidores de transcriptasa inversa Asociación de dos inhibidores de transcriptasa inversa. Asociación de dos inhibidores de transcriptasa inversa más un inhibidor de proteasa Asociación de dos inhibidores de transcriptasa inversa más un inhibidor de proteasa La zidovudina sigue siendo el puntal del tratamiento para los pacientes que no han tenido exposición previa a la misma. En cuanto a los inhibidores de proteasa, razones de buena absorción y menores efectos adversos inducen a elegir el indinavir, pero otros motivos, sobre todo el problema de las resistencias, pueden hacer que otro sea preferible. Los pacientes que estén actualmente bajo tratamiento con zidovudina deben ser reevaluados para adaptarlos a las nuevas pautas terapéuticas. Puesto que hay que contar con un cierto grado de resistencia a la zidovudina, estos casos presentan un problema especial y el tratamiento debe ajustarse a la evolución del paciente, la respuesta previa a la zidovudina y la carga viral. Puede estar justificado aquí la introducción temprana de inhibidores de la proteasa, pero nunca en monoterapia. El tratamiento de la infección primaria; es decir, la referida al período de 4 a 7 semanas de rápida replicación viral que se produce inmediatamente tras la exposición al VIH, resulta esencial. La cuestión de si puede abortarse la evolución posterior del proceso mediante un tratamiento antirretroviral enérgico en este período no ha podido someterse aún a ensayo clínico, pero se recomienda que los pacientes en esta situación sean sometidos durante seis meses al régimen de al menos dos inhibidores de transcriptasa y, de ser apropiado, un inhibidor de proteasa. Estos casos deberían estar bajo un protocolo especial de estudio con el fin de reunir cuantos antes datos acerca de la efectividad del tratamiento. El caso más común de exposición profesional al VIH es la punción accidental con agujas u otro material contaminado. Las estadísticas dan un riesgo promedio de infección del 0,3%, pero depende mucho de la carga infectante, que a su vez depende de la cantidad de material inoculado y del contenido en RNA viral de dicho material. Hay datos indicativos de que el tratamiento con zidovudina reduce en un 80% el riesgo de infección, pero las recomendaciones actuales son un régimen de cuatro semanas con dos inhibidores de la transcriptasa (a ser posible, distintos del que toma el paciente origen de contaminación). Añadir un inhibidor de proteasa en caso de carga infectante elevada. Los centros donde se manipule material biológico de enfermos de SIDA deberían tener un protocolo de actuación de urgencia para estos casos. ASPECTOS MOLECULARES DEL NUEVO FÁRMACO El efavirenz en un inhibidor de tipo no competitivo de la transcriptasa inversa del virus de la inmunodeficiencia humana de tipo 1 (VIH-1). Carece de acción sobre el mismo enzi- ma de los virus VIH-2, así como sobre los diversos tipos de ADN polimerasas presentes en las células humanas. El efavirenz tiene una estructura de tipo no nucleosídico, como la nevirapina (otro inhibidor de la transcriptasa inversa del VIH. Sin embargo, sus estructuras químicas difieren en buena parte. La nevirapina presenta una estructura tricíclica (guarda una cierta semejanza con el antiepiléptico carbamazepina), en tanto que el efavirenz es una estructura bicíclica, basada en un núcleo benzoxazínico. Como peculiaridad estructural destaca la presencia de un triple enlace ligado a un resto de ciclopropano, ambos usados con relativa frecuencia en fármacos con propiedades inhibidoras enzimáticas, como es el caso del efavirenz. ASPECTOS INNOVADORES Efavirenz ha demostrado ser eficaz, en combinación con otros agentes antirretrovirales, en el tratamiento de la infección por VIH-1, produciendo una marcada reducción de los niveles plasmáticos de ARN viral (menos de 400 copias de ARN por ml) en estudios de hasta 24 semanas de duración (aunque hay en curso ensayos clínicos de más largo alcance). Hay diversos estudios clínicos controlados comparando la eficacia del efavirenz con otros inhibidores de la transcriptasa inversa, tanto de tipo nucleosídico (zidovudina, lamivudina, etc) como no nucleosídico (nevirapina). Asimismo, se han realizado ensayos clínicos usando combinaciones de varios inhibidores de la transcriptasa inversa, asociados o no a inhibidores de la proteasa. La asociación de efavirenz + zidovudina + lamivudina (todos ellos inhibidores de la transcriptasa inversa) mantuvo los niveles de ARN viral por debajo de las 400 copias/ml en el 75% de los pacientes, frente al 65% de los tratados con efavirenz + indinavir (inhibidor de la proteasa) y del 55% con zidovudina + lamivudina + indinavir. Igualmente, la combinación de indinavir + INTI (inhibidores nucleosídico de la transcriptasa inversa) + efavirenz resultó eficaz (menos de 400 copias/ml) en el 60% de los pacientes tratados, frente a un 55% con igual combinación, pero sin efavirenz. La comparación con otros inhibidores no nucleosídicos de la transcriptasa inversa (INNTI), como nevirapina, también parece resultar favorable a efavirenz, con niveles de respuesta terapéutica satisfactoria (menos de 500 copias/ml a las 24 semanas) del 60% con efavirenz + INTI, frente a un 45% con nevirapina + INTI. La asociación de efavirenz + nevirapina + INTI produjo, en cualquier caso, los mejores resultados (80% de respuestas satisfactorias). La asociación de efavirenz con varios inhibidores de la proteasa también proporciona resultados esperanzadores. En este sentido, la asociación ritonavir + saquinavir + efavirenz ha demostrado ser segura y eficaz en tratamientos de 24 semanas en más de los dos tercios de pacientes que previamente no habían respondido adecuadamente a terapias antirretrovirales convencionales. Aunque es muy importante disponer de los datos clínicos correspondientes a períodos más prolongados de tratamiento que las 24 semanas empleadas convencionalmente en los estudios realizados hasta ahora, parece claro que la combinación de efavirenz con INTI está permitiendo el diseño de estrategias terapéuticas sin inhibidores de la proteasa y, por consiguiente, menos tóxicas. Por otro lado, los datos actualmente disponibles permiten asegurar que la combinación de efavirenz con inhibidores de la proteasa, como el indinavir, constituye un régimen terapéutico extremadamente potente que es razonablemente bien tolerado. Asimismo, la facilidad de la administración del efavirenz (una sola dosis oral al día), la práctica carencia de efectos adversos graves (menos del 2% de los pacientes tratados), su potencia antirretroviral y la escasa incidencia de interacciones con otros fármacos antirretrovirales, hace considerar al efavirenz como un avance ciertamente considerable en el tratamiento de las infecciones por VIH-1 y, en definitiva, del sida. BIBLIOGRAFÍA - - - Adkins JC, Noble S. Efavirenz. Drugs 1998; 56(6): discussion 1065-6. De Clerq E. Perspectives of non-nucleoside reverse transcriptase inhibitors (NNRTIs) in the therapy of HIV-1 infection. Farmaco 1999; 54(1-2): 26-45. Gazzard BG. Efavirenz in the management of HIV infection. Int J Clin Pract 1999; 53(1): 60-4. McNicholl Ir, Palmer SM, Ziska DS, et al. Antiinfectives update: Focus on treatment and prevention of viral and associated infections. Ann Pharmacother 1999; 33(5): 607-14. Piketty C, Race E, Castiel P, et al. Efficacy of a five-drug combination including ritonavir, saquinavir and efavirenz in patients who failed ona conventional triple-drug regimen: phenotypic resistance to protease inhibitors outcome of therapy. AIDS 1999; 13(11): F71-7. Tashima KT, Caleindo AM, Ahmad M, et al. Cerebrospinal fluid human immunodeficiency virus type 1 (HIV-1) supression and efavirenz drug concentrations in HIV-1-infected patients receiving combination therapy. J Infect Dis 1999; 180(3): 862-4. Zeoind CS, Iacoviello VR. Therapy of HIV-1 infection: Current and future perspectives. Int Pharm J 1998; 12(3): 80-1.