QUÍMICA BIOLÓGICA (Ciencias Biológicas -Curso 2009
Anuncio

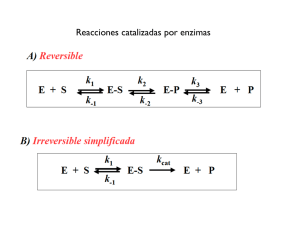
QUÍMICA BIOLÓGICA (Ciencias Biológicas -Curso 2009-) GUIA DE ESTUDIO Nº 1 Evolución bioquímica 1- En un experimento análogo al de Spiegelman, supongamos que una población de moléculas de RNA está formada por 99 moléculas idénticas, cada una de las cuales se replica una vez cada 15 minutos y una molécula que se replica una vez cada 5 minutos. Estimar la composición de la población después de 1, 10 y 25 “generaciones”, si una generación se define como la replicación durante 15 minutos. Supongamos que están disponibles todos los componentes necesarios. 2- Supongamos una molécula de RNA que se replica tiene una mutación (cambio genotípico) y que el fenotipo resultante une monómeros de nucleótido con más afinidad de cómo lo hacen otras moléculas de RNA de la población. ¿Cuál podría ser la ventaja evolutiva de esta mutación?¿En qué condiciones cabría esperar que esta ventaja evolutiva fuese la más importante? 3- Los gradientes iónicos evitan el estrés osmótico, pero necesitan energía para formarse ¿Porqué la formación de un gradiente necesita energía? 4- ¿Cómo se puede utilizar un gradiente de protones, con una alta concentración de protones en el interior de la célula, para bombear iones al exterior de la célula? 5- Para responder a la disponibilidad de azúcares tales como arabinosa, una célula debe tener, al menos dos tipos de proteínas: una proteína transportadora, para permitir que la arabinosa entre en la célula y una proteína de control génico, la cual se una a la arabinosa y modifique la expresión de los genes. Para responder a la disponibilidad de algunas moléculas muy hidrofóbicas, la célula necesita sólo una proteína. ¿Cuál y porqué? Estructura de proteínas 1- Las proteínas transmembrana contiene a menudo α-hélices. Habida cuenta que el interior de las membranas es muy hidrofóbico, predecir qué tipo de aminoácidos habría en estas hélices. ¿Porqué una hélice es especialmente adecuada para encontrarse en el entorno hidrofóbico del interior de una membrana? 2- Las proteínas son muy estables. La vida media de un enlace peptídico en disolución acuosa es casi 1000 años. Sin embargo, El ∆Gº’ de la hidrólisis de las proteínas es negativo y muy grande. ¿Cómo se puede justificar la estabilidad del enlace peptídico teniendo en cuenta el hecho de que la hidrólisis libera una gran cantidad de energía? 3- Traducir la siguiente secuencia de aminoácidos en código de una letra: Leu-Glu-Ala-ArgAsn-Ile-Asn-Gly-Ser-Cys-Ile-Glu-Asn-Cys-Glu-Ile-Ser-Gly-Arg-Glu-Ala-Thr. VER PROBLEMAS DE LA GUIA DE TRABAJOS PRACTICOS (TP 2) Acidos Nucleicos 1- Escribir la secuencia complementaria (en la anotación estandar 5’ 3’ de: a) GATCAA b)TCGAAC, c)ACGCGT y d)TACCAT 1 2- La composición (en unidades de fracción molar) de una de las hebras de un DNA de doble hélice es [A]=0.30 y [G]= 0.24. a) ¿Qué puede decir de las bases [T] y [C] de la misma hebra? b) ¿Qué puede decirse acerca de las bases [A], [G], [T] y [C] de la cadena complementaria? 3- El DNA perdido de un mutante por deleción del bacteriofago λ tiene una longitud de 15 µm en lugar de 17 µm. ¿Cuántos pares de bases se han perdido por esta mutación? Dato 1 kb mide 0.34 µm. 4- a) Suponer que se desea marcar DNA con radiactividad sin marcar el RNA, en células bacterianas en división y crecimiento. ¿Qué molécula radiactiva se deberá añadir al medio de cultivo? b) Supongamos que se desea preparar un DNA con sus átomos de fósforo estructurales marcados uniformemente con 32P. ¿Qué precursores habría que añadir a una disolución que contuviera DNA polimerasa I y DNA molde cebador? Señalar la posición de los átomos radiactivos en estos precursores? 5- Una disolución acuosa contiene DNA polimerasa I y las sales magnésicas de dATP, dGTP, dCTP y dTTP. A diferentes alícuotas de esta disolución se les añaden las moléculas de DNA que se indican a continuación. ¿Cuáles de ellas conducirán a la síntesis de ADN? a) Un círculo cerrado de una única hebra que contiene 1000 nucleótidos. b) n círculo cerrado de doble hebra que contiene 1000 pares de nucleótidos. c) Un círculo cerrado de un hebra que contiene 1000 nucleótidos emparejados con una hebra lineal de 500 nucleótidos con el extremo 3’-OH libre. d) Una molécula lineal de doble hebra que contiene 1000 pares de nucleótidos con el grupo 3’-OH libre en cada uno de los extremos. 6- Se ha purificado un virus que infecta las hojas de tulipán. Tratando una muestra con fenol se eliminan las proteínas víricas. Cuando se aplica el material residual a hojas raspadas se consigue obtener una progenie de las partículas víricas. De ello se deduce que la sustancia infecciosa es un ácido nucleico. Proponer un método simple y muy sensible para determinar si el ácido nucleico infeccioso es ADN o ARN. 7- Polimerasas clave. Comparar la ADN polimerasa I y la ARN polimerasa de E. coli en relación con cada una de las caracterísicas siguientes: a) precursores activados, b) dirección de crecimiento de la cadena, c) conservación del molde y d) necesidad de un cebador. 8- En un código de tripletes no solapado, cada grupo de tres bases de una secuencia ABCDEF… especifica solamente un aminoácido: ABC especifica el primero, DEF el segundo y así sucesivamente – mientras que en un código de tripletes totalmente solapante, ABC especifica el primer aminoácido, BCD el segundo, CDE el tercero y así en adelante. Se supone que se puede mutar un solo nucléotido de un codón y detectar la mutación en la secuencia de aminoácidos. Diseñar un experimento que estableciera si un código genético es solapante o no solapante. 9- Genes y Proteínas: Las proteínas tienen generalmente contenidos bajos en Met y Trp, intermedios en His y Cys, y elevados en Leu y Ser. ¿Cúal es la relación entre el número de codones de un aminoácido determinado y su frecuencia de aparición en las proteínas? ¿Cúal puede ser la ventaja selectiva de esta relación? 2 Investigación en Genes 1- Lectura de secuencias. En la ilustración adjunta se muestra el autorradiograma de un gel con cuatro calles de ADN. a) ¿Cuál es la secuencia de este fragmento de ADN? b) Supongamos que se determina la secuencia del desoxirribonucleótido 5’-TGCAATGGC-3’ por el método de los didesoxi de Sanger. Hacer un esquema que revelaría la secuencia de este oligonucleótido. Figura terminación A G C T 2- La ovoalbúmina es la principal proteína de clara de huevo. El gen de la ovoalbúmina contiene ocho exones separados por siete intrones. Si se quiere producir la proteína en E. coli ¿es mejor utilizar el ADN genómico de la ovoalbúmina o su cADN? ¿Por qué? 3- Especifique las diferencias entre las técnicas de transferencia conocidas como Southern, Northern y Western Blot. 4- ¿Cuál/es de las siguientes aseveraciones son correctas? La técnica de Southern Blot involucra: a) Separación por tamaño de fragmentos de restricción de ADN mediante electroforesis b) Conversión a moléculas de simple hebra con un álcali. c) Transferencia a un filtro de nitrocelulosa. d) Hibridación con una sonda marcada con 32P. 4- Explique el fundamento de la técnica de PCR Enzimas 1- La hidrólisis del pirofosfato a ortofosfato es importante para impulsar reacciones biosintéticas tales como la síntesis de DNA. Esta reacción hidrolíticaesta catalizada en E. coli por una pirofosfatasa que tiene una masa de 120 kd y esta constituida por 6 subunidades idénticas. Para esta enzima una unidad se define como la cantidad de enzima que hidroliza 10 µmoles de pirofosfato en 15 minutos a 37ºC en condiciones de ensayo estándar. La enzima purificada tiene una Vmax de 2800 unidades por miligramo de enzima. a) ¿Cuántos moles de sustrato se hidrolizan por segundo y por miligramo de enzima cuando la concentración de sustrato es mucho mayor que KM? b) ¿Cuántos moles de centro activo existen en un miligramo de enzima? Supones que cada subunidad tiene un solo centro activo? c) ¿Cuál es el número de recambio de la enzima? 2- La penicilina se hidroliza y con ello se inactiva por la penicilinasa (también conocida como βlactamasa), una enzima presente en algunas bacterias resistentes. La masa de esta enzima en S. aureus es 29,6 kd. La cantidad de penicilina hidrolizada en un minuto en una disolución de 10 ml que contiene 10-9 g de penicilinasa purificada se midió como función de la concentración de 3 penicilina. Suponer que la concentración de penicilina no cambia apreciablemente durante el ensayo. Cantidad hidrolizada [Penicilina] µM (nanomoles) 1 0,11 3 0,25 5 0,34 10 0,45 30 0,58 50 0,61 Representar 1/V0 frente a 1/[S] a partir de los datos de la tabla. ¿Parece obedecer la penicilinasa a la cinética de Michaelis-Menten? Si es así, ¿cuál es el valor de KM y cuál es el valor de Vmax? 3- Se mide la cinética de una enzima como función de la concentración de sustrato en presencia y en ausencia del inhibidor (I), concentración a 2 mM. Velocidad (µmoles/min) Sin Inhibidor Con Inhibidor [Sustrato] µM 3 10,4 4,1 5 14,5 6,4 10 22,5 11,3 30 33,8 22,6 90 40,5 33,8 a) Cuales son los valores de KM y Vmax en ausencia del inhibidor? ¿Y en su presencia? b) ¿De qué tipo de inhibición se trata? 4- Se mide la cinética de una enzima como función de la concentración de sustrato en presencia y en ausencia del inhibidor (I), concentración a 100 µM. Velocidad (µmoles/min) Sin Inhibidor Con Inhibidor [Sustrato] µM 3 10,4 2,1 5 14,5 2,9 10 22,5 4,5 30 33,8 6,8 90 40,5 8,1 a) Cuales son los valores de KM y Vmax en ausencia del inhibidor? ¿Y en su presencia? b) ¿De qué tipo de inhibición se trata? 5- Suponer que una enzima mutante se une a un sustrato con una fuerza 100 veces mayor que la de la enzima nativa. ¿Cuál es el efecto de esta mutación sobre la velocidad catalítica si la unión del estado de transición no resulta afectada? 6- Las reacciones siguientes representan el mecanismo de acción de un inhibidor no competitivo. k1 k2 E+S ES +I k-1 E+P kI ESI 4 a) Dibujar una curva estándar de Michaelis-Menten en ausencia y en presencia de cantidades crecientes de inhibidor. Repetir con una representación doble recíproca. b) Explicar los resultados obtenidos en la parte a. 7- Para una enzima que sigue la cinética de Michaelis-Menten simple, ¿cuál es el valor de la Vmax si V0 es igual a 1 µM/minuto a 1/10 KM? 8. Se determinó la representación doble recíproca para una reacción de un solo sustrato catalizada por un enzima a tres concentraciones de enzima diferentes. ¿Cuál de las siguientes tres familias de curvas se podría esperar obtener? Explicarlo a) b) 1/Vo c) 1/Vo 1/Vo 1/[S] 1/[S] 1/[S] 9- Se examinó el efecto del pH sobre la actividad de una enzima. En su centro activo el enzima, tiene un grupo ionizable que, para que se una al sustrato y tenga lugar la catálisis, deberá estar cargado negativamente. El grupo ionizable tiene un pKa de 6. El sustrato está cargado positivamente en todo el rango de pH del experimento. E - + S+ + H+ E-S+ E - + P+ EH a) Dibujar la curva de V0 frente al pH cuando la concentración de sustrato es mucho mayor que la KM de la enzima. b) Dibujar la curva de V0 frente al pH cuando la concentración de sustrato es mucho menor que la KM de la enzima. c) ¿A qué pH la velocidad será igual a la mitad de la velocidad máxima alcanzada en estas condiciones? VER PROBLEMAS DE LA GUÍA DE TRABAJOS PRÁCTICOS Enzimas Alostéricas y Estrategias Regulatorias 1- ¿Porque se considera a una enzima alostérica como una molécula transductora de información? 2- Un sustrato se une con una afinidad 100 veces mayor al estado R que al estado T de un enzima alostérico. Si suponemos que sigue el modelo concertado (MWC), la unión de una molécula de sustrato por molécula de enzima, ¿en qué factor altera la relación de concentraciones de las moléculas de enzima en los estados R y T? 5 3- Una enzima alostérica que sigue el mecanismo concertado presenta una relación T/R de 300, en ausencia de sustrato. Suponer que una mutación invierte esta relación. ¿Cómo afectaría esta mutación a la relación entre la velocidad de la reacción según la concentración de sustrato? 4- Se ha aislado una enzima dimérica que contiene dos centros de activos idénticos. La unión del sustrato a un centro activo disminuye la afinidad por el sustrato del otro centro activo. ¿Qué modelo alostérico se ajusta mejor a esta cooperatividad negativa (concertado o secuencial)? Bioenergética 1- Calcule el ∆G de hidrólisis de ATP en hepatocitos y en miocitos. ¿Cuál sería el valor de la constante de equilibrio en cada caso? 2- Determine mediante un cálculo matemático si el fumarato puede ser reducido a succinato por el NADH (ver tablas) en condiciones estándar. Diseñe un experimento que permita estudiar la evolución temporal de ese proceso, en caso de ser posible. 3. ¿Cuáles son los factores que justifican un ∆G de hidrólisis negativo para el ATP y para el fosfoenolpiruvato? Biomembranas 1- Defina efecto hidrofóbico 2- Describa la relación entre la curvatura espontánea y la geometría molecular. 3- Defina el efecto de la modificación en: a) la longitud y b) el grado de instauración de las cadenas hidrocarbonadas, d) el tamaño del grupo polar, d) el cambio de pH, c) el aumento en la concentración salina inducen sobre: i) la curvatura, ii) el radio de curvatura, iii) la microviscosidad de una biomembrana. 4- ¿Qué técnica permite poner en evidencia la difusión lateral de proteínas en una biomembrana? 5- ¿En qué consiste la asimetría lateral de una membrana y qué técnicas permite ponerla de manifiesto? Transporte a través de membranas 1- Clasifique los tipos de transporte según la necesidad de realizar gasto energético y de disponer de proteínas transportadoras. 2- Diseñe un experimento para distinguir entre transporte difusión simple y difusión facilitada. 3- Bomba de sodio y potasio. Describa su funcionamiento y su importancia Transducción de señales 1. En la vía de señalización desde la adrenalina hasta el AMPc ¿Dónde tiene lugar la mayor amplificación de la señal y porqué? 2. ¿Cuáles serían las características fundamentales que debiera tener un receptor celular involucrado en la vía de transducción de señales? 3. ¿Porque a las Proteínas G se las considera también GTPasas? ¿Cuál es la importancia de que posean esta actividad dentro de una vía de señalización? 4. La hidrólisis del fosfatidilinositol bifosfato da como resultado dos segundos mensajeros: ¿cuáles son y porqué razón se dice que actúan conjuntamente a pesar de que activan a distintas vías? 5. ¿A qué niveles de la estructura de proteínas afecta la activación de las proteína G? Fundamente. 6. ¿Qué tipo de características fisicoquímicas posee el ion Calcio que le permite ejercer un importante rol como mensajero? 6