Método Algebraico para la igualación de Ecuaciones químicas Este
Anuncio

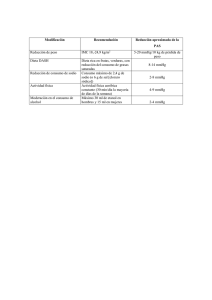
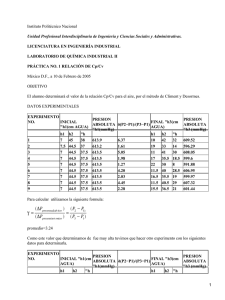
Método Algebraico para la igualación de Ecuaciones químicas Este método es un proceso matemático que consistente en asignar literales a cada una de las especies , crear ecuaciones en función de los átomos y al resolver las ecuaciones, determinar el valor de los coeficientes. Ecuación a balancear: FeS + O2 ( Fe2O3 + SO2 Los pasos a seguir son los siguientes: 1. Escribir una letra, empezando por A, sobre las especies de la ecuación: |A | |B | |C |FeS | |D |+ |O2 |à |Fe2O3 | |+ |SO2 | 2. Escribir los elementos y para cada uno de ellos establecer cuántos hay en reactivos y en productos, con respecto a la variable. Por ejemplo hay un Fe en reactivos y dos en productos, pero en función de las literales donde se localizan las especies (A y C) se establece la ecuación A = 2C . El símbolo produce (() equivale al signo igual a (=). Fe A = 2C S A=D O 2B = 3C + 2D 3. Utilizando esas ecuaciones, dar un valor a cualquier letra que nos permita resolver una ecuación (obtener el valor de una literal o variable) y obtener después el valor de las demás variables. Es decir se asigna un valor al azar (generalmente se le asigna el 2) a alguna variable en una ecuación, en este caso C = 2 , de tal forma que al sustituir el valor en la primera ecuación se encontrará el valor de A. Sustituyendo el valor de A en la segunda ecuación se encuentra el valor de D y finalmente en la tercera ecuación se sustituyen los valores de C y D para encontrar el valor de B. A | |B | |C | |D | |FeS |+ |O2 |à |Fe2O3 |+ |SO2 | | A= D 2B = 3C + 2D Fe A = 2C Sí C =2 S A=D O 2B = 3C + 2D A= 2C D=4 A= 2(2) 2B = (3)(2) + (2)(4) 2B = 14 A=4 B = 14/2 B=7 4. Asignar a cada una de las especies el valor encontrado para cada una de las variables: A | |B | |C | |D | |4 FeS |+ |7 O2 |à |2Fe2O3 |+ |4SO2 | | Método Algebraico para igualar Ecuaciones Químicas Reglas: 1.- Escribir correctamente “La ecuación química”. 2.- Colocar letras minúsculas del abecedario antes de cada fórmula química que conforman la reacción química. 3.- Formar las ecuaciones algebraicas para cada uno de los elementos presentes en la reacción química. 4.- Resolver las ecuaciones algebraicas propuestas por cualquier método matemático. *(Dar valor de la unidad a una de las letras; de tal forma que permita sacar las otras). Ejercicios: Balancear la ecuación química: Trisulfuro de hierro + Oxigeno molecular 1) FeS3 + O2 2) a FeS3 + bO2 SO2 + Fe2O3 cSO2 +dFe2O3 Anhídrido Sulfuroso + Oxido Ferrico 3) Fe: a= 2d S: a= c O: 2b= 3d + 2c 4) a= 1 1= 2d d=1/2 3(1)=c c=3 2b=2c+3d b=15/4 a= 1*4=4 b= 15/4*4=15 c=3*4=12 d=1/2*4=2 4FeS3 +15 O2 12SO2 + 2Fe2O3 Fe: 4 4 S: 12 12 O: 30 30 Estequiometria Fecha: 8, de diciembre del 2010 La estequiometria hace referencia a los cálculos matemáticos que se realizan en las ecuaciones químicas balanceadas, con el objeto de determinar las cantidades de reaccionantes y productos de la reacción en ella presente. Generalmente la unidad necesaria para los cálculos es la MOL o el MOL que es una unidad de cálculo. Reactivo límite y Reactivo en exceso: Reactivo límite: Es aquel que se agota totalmente en el proceso de la reacción. Reactivo exceso: Es aquel que sobra luego del proceso de la reacción. Problemas de Aplicación Para resolver los problemas de reactivos límite y exceso generalmente seguimos los siguientes pasos: 1) Se iguala la ecuación química. 2) Se realiza una comparación entre los reactivos y los productos obtenidos en Moles o en Gramos. 3) Analizar los resultados y determinar cual es el reactivo límite y reactivo exceso. Ejemplos: a) Para obtener sulfuro de Zinc se hacen reaccionar 240 gr. De Zinc con 130 gr. de Azufre. ¿Cuál es el reactivo límite y reactivo en exceso? 1) Zn 2) 65gr. + S ZnS 32gr. 97gr. S: 32gr. Zn: 240gr. Zn S 240gr. 130gr. X= x= 118,1 gr. (S) Reactivo en Exceso 130gr.(S) – 188,1gr.(S) =11,84gr. 3) 65gr 32gr X 130gr X= X= 264,06gr Reactivo límite 264,06gr – 240gr = 24,06gr(Zn) b) Se hacen reaccionar 15gr de hidróxido de sodio con 17gr de acido clorhídrico para producir agua y cloruro de sodio. ¿Cuál es el reactivo en exceso y cuál es el limitante? ¿Cuántos gramos de cloruro de sodio se obtiene? DATOS 15gr =NaOH (Hidróxido de sodio) Na= 23gr 17gr =HCl (Acido clorhídrico) O= 16gr (Agua) H= 1gr =H2O =NaCl (Cloruro de sodio) 1) NaOH + HCl 40gr 36gr 15gr x Cl= 35gr NaCl + H2O 58gr 18gr X=  X= 13,5 gr Reactivo en exceso 17gr – 13,5gr = 3,5gr(HCl) 2) 40gr 36gr X 17gr X= X= 18,8gr(NaOH) Reactivo límite 18,8gr – 15gr = 3,8gr faltante NOTA: Para calcular el rendimiento utilizamos el reactivo límite Rendimiento Fecha: 9, de diciembre del 2010 El reactivo límite es aquel que determina el rendimiento en una reacción química (proceso químico). Cuando se consume el 100% de reactivo límite estamos frente a la culminación del proceso. Podemos considerar dos tipos de rendimiento: a) Rendimiento teórico: nos indica el 100% de la producción. b) Rendimiento experimental o real: nos informa cuanto se produjo en el proceso realmente. El rendimiento es menor al 100%. Ejemplo: En un caldero se queman 200gr de caliza (carbonato de calcio) y se produjo CO2 y óxido de calcio. El residuo sólido de óxido de calcio pesa 80gr. ¿Cuál fue el porcentaje de rendimiento de la reacción? CaCo3 1) 100gr 200gr CO2 + CaO 56gr x Pesos moleculares CaCO3 CaO Ca: 40gr C: 12gr O3: 16gr x 3 Peso: 100gr X= 112gr CaO R. teórico 2)% Rendimiento=  R. Experimental= 80 %R=  x 100 %R= 71,42 Rendimiento Pureza En los procesos químicos es necesario que la materia prima sea de pureza total, para obtener productos totales de calidad (100% puros). De ahí la necesidad de conocer la manera de determinar las impurezas presentes para lograr resultados óptimos en la producción. Problemas de Aplicación 1) ¿Qué peso de cloruro de sodio se obtiene a partir de 50 gramos de Hidróxido de sodio al 90% de riqueza al reaccionar con ácido clorhídrico. NaOH + HCl NaCl + H2O NaOH Na=23g O = 16g. H = 1g. Peso: 40g 50 g. 100% X 90% X= 45 g. (NaOH) NaOH + HCl NaCl + H2O 40g. 58g 45g. x X= 65,25g. (NaCl) pesos moleculares 2) Se hace reaccionar cobre 2 con ácido clorhídrico para obtener la sal cloruro cúprico e hidrógeno gaseoso. Si se dispone 140g. de cobre y 76 g. de ácido clorhídrico. ¿Cuáles son los reactivos en exceso y limitante? HCL H = 1g Cl = 35g Peso: 36g Cu + 2HCl CuCl2 + H2 64g 134g 140g x pesos moleculares X = 293,1g 3) En una fábrica de cerámica se procesan 500g. de Carbonato de Calcio sometiéndole a calor. Producto de esta operación se obtiene óxido de calcio y anhídrido carbónico. El óxido de calcio producido pesa 170g. ¿Cuál fue el porcentaje de rendimiento de este proceso químico? CaCO3 Ca=40 gr C=12 gr O3= 16gr *3 Peso= 100gr CaCO3 CaO + CO2 500gr x 100gr 56gr pesos moleculares X=280gr R. teórico = = 60% de rendimiento Líquido – Sólidos y Gases Fecha: 5, de enero del 2011 Propiedades de los líquidos: Los líquidos tienen las siguientes propiedades: · Volumen constante. · Forma variable (adopta la del recipiente). · Incompresibles (no se comprimen sino en una inapreciable cantidad, ya que sus moléculas se encuentran muy cercanas). · Difusión (es lenta) · Evaporación (paso del estado líquido a vapor por aumento de energía cinética de la moléculas debido al aumento de la temperatura. Presión de vapor en equilibrio Cuando a un líquido que se encuentra en un recipiente cerrado, se le aumenta la temperatura la energía cinética de sus moléculas hace que estas choquen contra las paredes del recipiente produciendo la llamada presión de vapor. Ahora cuando la presión de las moléculas que se transforman en vapor, se equilibran con la presión de las que regresan en estado líquido, decimos que se ha llegado a una presión de vapor en equilibrio. Punto de ebullición. Ocurre cuando por acción de la temperatura aumenta la energía cinética de las moléculas pasando al estado de vapor. Propiedades de los sólidos. · Tienen forma propia · Volumen constante debido a la cohesión molecular. División de los sólidos Los sólidos se dividen en: 1. Sólidos cristalinos 2. Sólidos amorfos Sólidos cristalinos: son aquellos que tienen formas geométricas determinadas. Tales como: cúbicos, tetraedros, prismáticos, hexagonales. Sólidos amorfos: son los que no tienen una forma definida. Calentamiento de un sólido: Al suministrar temperatura a un sólido ocurre que las moléculas e iones, aumentan su movilidad y por tanto su energía cinética inclusive pudiendo pasar en algunos casos al estado líquido y gaseoso. Propiedades de los gases. Fecha: 6, de enero de 2011 Los gases tienen las siguientes propiedades: · Forma variable. · Volumen variable. · Muy compresibles. · Baja densidad. · Sus moléculas están separadas. Se comportan de una manera muy sencilla comparados con otros estados de la materia. Los gases pueden ser interpretados, mediante las siguientes magnitudes · (P) presión · (T) temperatura · (V) volumen Escalas de temperaturas y leyes de los gases. Escalas relativas son: · Centígrada o Celcius ºC · Farenheit. La escala centígrada fija el punto de congelación del agua en 0ºCy el punto de ebullición en 100 grados. La escala Farenheit fija el punto de congelación den 32 grados y el de ebullición en 212 grados. Escalas absolutas son: · Kelvin (ºK) · Rankine (ºR) La escala kelvin, fija el punto de congelación del agua en 273ºK y el punto de ebullición en 373 ºK. El punto de congelación del agua en la escala rankine es de 432ºR y de ebullición es 672 ºR Cero Absoluto. Se llama así a la temperatura de 273 ºC en la escala centígrada y 0ºK. En la escala Farenheit el 0 absoluto es -470ºF y en la escala Rankine corresponde 0ºR. Conversión de las escalas de temperatura. 1) ºC / 100 = ºF-32 / 180 2) ºK = ºC + 273 3) ºR = ºF + 460 Ejercicios: Convertir 20ºC en ºF. 20ºC / 100 = ºF – 32 / 180 180 (20ºC) = 100(ºF – 32) 3600ºC = 100ºF – 3200 100ºF = 3600ºC Presión atmosférica. Concepto: es el peso de una masa de aire sobre un punto determinado de la tierra. P = F/A Presión normal: Es la presión presente al nivel del mar y que corresponde a una atmósfera. 760 mm de mercurio. Conversión de una atmósfera (Factores) 1 atmósfera = 76cm. de mercurio 1 “ = 760 mm. de mercurio 1 “ = 14,7 libra/pulg2 1 “ = 1033,22g/cm2 1 “ = 1,03322 kg/cm2 Fecha: 14 de enero de 2011 Transforma r 20ºC a ºK ºK = ºC + 273 ºK = 20 + 273 ºK = 293 Transformar 50ºF a ºC Transformar 25ºC a ºR ºC/5 = ºF – 32/9 ºC/5 = ºF - 32/9 ºC = (ºF - 32)(5)/9 9(ºC/5) = ºF – 32 ºC = (50 – 32)(5)/9 9(25/5) + 32 = ºF ºC = 10 77 = ºF Convertir -4ºC a ºF ºR = ºF + 460 ºC/5 = ºF – 32/9 ºR = 77 + 460 9(ºC/5) = ºF – 32 ºR = 537 9 (-4/5) + 32 = ºF ºF = 28,8 Convertir la presión normal de 76cm. de mercurio a Dinas/cm2 1cm. de Hg. = 1,3322684x104 Dinas/cm2 76cm. Hg X 1,3322684x104 X = 1013252,398 Dinas/cm2 Fecha: 19 de enero de 2011 Ley de los gases Son tres leyes básicas: 1. Ley de Boile-Mariotte 2. Ley de Charles 3. Ley de Gay-Lussac 1.- Ley de Boile- Mariotte: Enunciado: Toda masa gaseosa que se encuentre a temperatura constante, su volumen varía inversamente proporcional a la presión. Fórmula matemática: V α 1/P V= K/P V1P1 = V2P2 V1 / V2 = P2 /P1 2.- Ley de Charles. VP = K T = Constante Ley Isotérmica Enunciado: a presión constante toda masa gaseosa, el volumen varía directamente proporcional a la temperatura absoluta. VαT V = KT K = V/T V1 / T1 = V2 /T2 P = constante Ley Isobárica. 3.- Ley de Gay-Lussac: Enunciado: a volumen constante, en toda masa gaseosa la presión varía directamente proporcional a la temperatura absoluta. PαT P = KT K = P/T P1 / T1 = P2 /T2 V = constante Ley Isométrica o Isocórica. Ecuación combinada de los gases. Hace referencia a la relación existente entre las leyes de Boyle – Mariotte, Charles y Gay Lussac, y se expresa matemáticamente de la siguiente forma. P1 V1 / T1 = P2V2 / T2 Equivalencias: P1 = Presión Inicial P2 = Presión final T1 = Temperatura Inicial T2 = Temperatura final V1 = Volumen Inicial V2 = Volumen final K = constante. Ejercicios. 1.- La presión que se ejerce sobre 50l. de un gas aumenta desde 20 atm. Hasta 80 atm. Calcular el volumen final si la temperatura permanece constante. DATOS: V1 = 50 ml. P1 V1 = P2V2 P1 = 20 atm. V2 = P1V1 / P2 P2 = 80 atm. V2 = 50 l. x 20 atm. V2 = ? T = constante. 80 atm. V2 = 12,5 l. 2.- Un gas ocupa el volumen de 1,5l. en condiciones normales. Determine el volumen que ocupará a 300ºC y a la presión de 25 atm. DATOS: V1 = 1,50 l. condiciones normales: 0ºC + 273 = 273ºK y 1 atm. P1 = 1 atm. P1 V1 /T1 = P2V2/T2 T1 = 273ºC V2 = P1V1T2/T1P2 P2 = 25 atm. V2 = 1 atm x 1,5l. x 573ºK V2 = ? T = 300ºC + 273 = 573ºC 273ºK x 25 atm. V2 = 0,12l. = 120ml. 3.- Una masa gaseosa a 20ºC tiene una presión de 800 mmHg. Calcular la nueva temperatura cuando la presión se reduce a 600 mmhg. Y el volumen permanece constante. P1 = 800 mmHg. P1 /T1 = P2/ T2 T1 = 293ºC T2 = P2T1/P1 P2 = 600 mmHg. T2 = 600mmHg x 293ºK 800mmHg. T2 = ? T2 = 219,75 ºK Fecha: 27 de enero de 2011 Ley de densidad de los gases. Los gases obedecen a la siguiente regla, en cuanto a la densidad o peso específico “la densidad de los gases varía inversamente a la temperatura absoluta y directamente a la presión” d1 P1 / T1 = d2 P2 / T2 Ejemplos: 1.- Un gas tiene la densidad de 1,42 g/l. a 20ºC y 1,5 atm. A partir de estos datos determinar la densidad en condiciones normales. Datos: d1 = 1,42g/l. d1 P1 / T1 = d2 P2 / T2 T1 = 20ºC d2 = d1 P1 T2 /T1 P2 P1 = 1,5 atm. d2 = (1,42g/l.)(1,5 atm.) (273ºK) d2 = ? T2 0ºC + 273 = 273ºK (273ºK)(1atm) d2 = 1,984 g/l. P2 = 1atm. 2.- La densidad del oxígeno es 1,430g/l. en condiciones normales. Determinar la densidad del oxígeno a 25ºC y 700 mmHg. Datos: d1 = 1,430 g/l. d1 P1 / T1 = d2 P2 / T2 T1 = 273 ºK d2 = d1 P1 T2 /T1 P2 P1 = 1 atm. d2 = (1,430 g/l.)(700 mmHg.) (298ºK) d2 = ? T2 = 25ºK + 273ºK = 298ºK. (273ºK)(760 mmHg) d2 = 1,69 g/l. P2 = 700 mmHg. Densidades de los gases. Fecha: 2 de febrero de 2011 Ley de Dalton – presiones parciales. En cualquier masa gaseosa la presión es igual a la suma de las presiones parciales. Pt = P1 + P2 + P3 … Ejemplo: 1.- un compuesto gaseoso contiene el 40% de cloro, el 35% de oxígeno y el 25% de carbono. Determine la presión parcial de cada gas a la presión total de 760 mmHg. DATOS: Pt = 760 mmHg. = 1atm. P1 = ? Razonamiento. 1) cloro : 40% P2 = ? Oxígeno: 35 % P3 = ? Carbono: 25% 760mmHg. 100% 760 mmHg. 100% X 40% X 35% X = 760mmHg x 40% X = 760mmHg x 35% 100 % 100% X = 304 mmHg. X = 266 mmHg. 760mmHg. 100% X 25% X = 760mmHg x 25% 100 % X = 190 mmHg. Pt =304 + 266 + 190 = 760 mmHg. Problemas de gases húmedos Cuando se trata de resolver problemas de gases húmedos la ley de Dalton dice: la presión de un gas seco es igual a la presión total de la mezcla gaseosa menos la presión de vapor de agua de dicha temperatura. 1.- Se recogió un gas sobre agua a 30ºC, el volumen de gas recogido es de 80 ml. y la presión de 800 mmHg. Calcular el volumen de gas seco en condiciones normales. Presión de vapor de agua a 30ºC es igual a 31,82 mmHg. a) determinar la presión del gas seco: Presión del gas seco = 800 mmHg. – 31,82 mmHg. Presión del gas seco = 768,18 mmHg. b) determinación del volumen a partir de la ecuación general de los gases. Datos: P1 = 768,18 mmHg. Razonamiento: V1 = 80 ml. P1 V1 / T1= P2V2 /T2 T1 = 30ºC + 273 = 303ªK P2 = 760 mmHg. V2 = P1V1T2 /P2T1 V2 = 72,8 ml. T2 = 0ºC + 273 = 273ºK 2.- Una muestra de oxígeno húmedo, que ocupan 400 ml. a 20ºC a una presión de 790 mmHg., está saturado de vapor y de agua. Calcular el volumen ocupado por el oxígeno seco a 30ºC y 700 mmHg. Presión de vapor de agua a 29ºC = 17,5 mmHg. Presión del gas seco: 790 mmHg. – 17,5 mmHg. = 772,5 mmHg. Datos P1 = 772,5 mmHg. Razonamiento: V1 = 400 ml. P1 V1 / T1= P2V2 /T2 T1 = 20ºC + 273 = 293ªK P2 = 700 mmHg. V2 = P1V1T2 /P2T1 V2 = 459,59 ml T2 = 30ºC + 273 = 303ºK 17,5 mmHg. 100% X 70% X = 12,25 mmHg Ejercicos propuestos de recapacitación PROBLEMA 1: un gas tiene 400 ml cuando su presion es 650mm de Hg calcular el nuevo volumen cuando la presion se eleva a 740mm de Hg, a temperatura constante DATOS: RAZONAMIENTO: V1 = 400 ml V1P1 = V2 P2 V2 = ? V2 = V1P1/P2 P1 = 650 mm de Hg V2 = 400ml * 650mm de Hg / 740m de hg P2 = 740 mm de Hg V2 = 351,35ml PROBLEMA 2: Un volumen de 480 cm3 de oxigeno se recolecto a 25 g C . Si la precion permanese constante cual sera el nuevo volumen a 150 g C DATOS: V1= 480 cm3 PROBLEMA 3: un tanque metalico contiene un gas a 30g C y a la precion de 800 ml de Hgcalcular la nueva precion cuando la temperatura esta a 120 gC y el volumen permanece constante una masa gaceosa esta representada por los siguientes porsentajes 50% de oxigeno 25% de nitrógeno y 25% de hidrogeno . Calcular la precion parcial de cada gas y la presion total de 760 mm de Hg PROBLEMA 4 : una masa gaceosa esta representada por los siguientes porsentajes 50% de oxigeno 25% de nitrógeno y 25% de hidrogeno . Calcular la precion parcial de cada gas y la presion total de 760 mm de Hg PROBLEMA 5 :En el interior de una habitacion se han difundido 900cm3 de gas sulfuroso durante media hora . Calcular el tiempo ke demora en difundirse 300cm3 de gas metano PROBLEMA 6: en igualdad de condiciones se difunden 2 litros de gas sulfuroso de densidad 2,93 g/l durante media hora . Calcular el tiempo que demora en difundirse 4 litros de cloro, cuya densidad es 3,24 g/l Problema 7 : para expulsar el gas carbonico de un deposito senesesitan 8 minutos , cual es el tiempo que se tardara el deposito si estuviera lleno de gas sulfuroso y las mismas condiciones anteriores PROBLEMA 8: el metano CH4 se difunde atrabes de una abertura a una velocidad de 140 ml por segundo. A que velocidad se difundira el gas sulfuroso atrabes de misma abertura y en condiciones semejantes