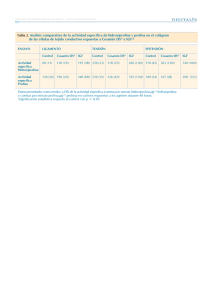
avances en las investigaciones farmacológicas y toxicológicas con
Anuncio

ARTÍCULO DE REVISIÓN AVANCES EN LAS INVESTIGACIONES FARMACOLÓGICAS Y TOXICOLÓGICAS CON EL EXTRACTO ACUOSO DE LA CORTEZA DEL ÁRBOL DE MANGO (Mangifera indica L.). (Advances in pharmacological and toxicological investigations with the stem bark aqueous extract of the mango tree (Mangifera indica L.) Gabino Garrido, Ph.D. y Marisela Valdés, M.Sc. Departamento de Ciencias Farmacéuticas, Facultad de Ciencias, Universidad Católica del Norte, Antofagasta, Chile. RESUMEN ‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ El extracto de Mangifera indica L se usa en la práctica etnomédica para la mejoría de la calidad de vida de pacientes con diferentes patologías. El presente estudio pretendió hacer una revisión de los avances que han tenido las investigaciones farmacológicas y toxicológicas llevadas a cabo con un extracto acuoso estandarizado de la corteza del árbol de mango. Se revisaron las publicaciones de la composición química principal, que comprende un total de nueve derivados polifenólicos y diferentes microelementos como zinc, cobre y selenio. El extracto demostró, fundamentalmente, actividades antioxidante, anti‐ inflamatoria e inmunomoduladora, analgésica y antialérgica, con un mecanismo de acción relacionado con la capacidad secuestradora de especies reactivas de oxígeno y de interacción con Fe2+, la inhibición de la producción de citocinas pro‐ inflamatorias, IgE y eicosanoides, de la actividad de fosfolipasa A2 y ciclooxigenasa 2 y de la activación del NF‐κB. Según los reportes revisados, el extracto es seguro para su administración en humanos debido a su bajo potencial de toxicidad. Se realizaron varios estudios clínicos aleatorizados, estudios piloto, serie y reporte de casos con diferentes formas farmacéuticas que corroboraron los hallazgos encontrados en la fase pre‐clínica o aportaron nuevos conocimientos que le atribuyen al extracto un valor agregado importante. Palabras claves: Mangifera indica, Mango, Vimang, Farmacología, Toxicología, Estrés oxidativo, Inflamación, Dolor Publicado por la Sociedad de Farmacología de Chile ‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ INTRODUCCIÓN El mango (Mangifera indica Linneo, Anacardiaceae) es uno de los frutos más importantes desde el punto de vista económico (FAO, 2012). El producto principal del árbol de mango es el fruto maduro entero, que puede ser consumido crudo o procesado en una variedad de productos que garantizan un suministro constante del fruto durante todo el año (Singh, 1990). Industrialmente, hay tres partes de interés del fruto del mango a saber: la pulpa, la cáscara y la semilla. Tradicionalmente la pulpa de mango es el principal punto focal de la utilización del fruto a escala industrial. Esta es un intermediario importante para la producción de bebidas, como un ingrediente saborizante en la industria láctea y en formulaciones de alimentos para bebés (Nanjundaswamy, 1998). Su composición química varía dependiendo de muchos factores como la variedad, la localidad, el clima, y la etapa de madurez. En el proceso industrial del fruto se obtienen subproductos como la piel y la semilla (carozo y nuez o almendra), que representan aproximadamente el 35‐60% del fruto. ‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐‐ Correspondence to: Dr. Gabino Garrido,Q.F., Departamento de Ciencias Farmacéuticas, Facultad de Ciencias, Universidad Católica del Norte, Angamos 0610, Antofagasta, Chile. Tel.: 56‐55‐355631, Correo electrónico: [email protected] Rev. Farmacol. Chile (2012) 5(2): 63 Estos se descartan como desechos y se convierten en una fuente de contaminación debido a las altas concentraciones de compuestos fenólicos residuales (y el alto costo que representa su tratamiento), que pueden tener efectos ambientales perjudiciales, principalmente debido a que estos compuestos podrían inhibir la germinación de las semillas. Recientemente (Maisuthisakul & Gordon, 2009), se mostró que la cáscara constituye aproximadamente entre el 15‐20% de la fruta, mientras que las semillas representan del 20‐60% del peso de la fruta entera, dependiendo de la variedad de mango, y el núcleo interior de la semilla de 45‐75% de la semilla entera. Estos subproductos del mango se han estudiado como antioxidante (Abdalla et al., 2007; Dorta et al., 2012), antibacteriano (Vaghasiya et al., 2011), hipoglucemiantes (Rajesh et al., 2008; Gupta & Gupta, 2011), anti‐ hipercolesterolémico (Anila & Vijayalakshmi, 2002) e inductor de apoptosis (Kim et al., 2012), entre otros. Por ejemplo, la cáscara de mango es una fuente rica de compuestos bioactivos como los polifenoles, carotenoides, vitaminas C y E, fibra dietética y enzimas. Además, la cáscara de mango podría ser una fuente rica de compuestos bioactivos, y enzimas tales como proteasa, peroxidasa y polifenol oxidasa (Mehrnoush et al., 2012). Esta cáscara, si es convenientemente procesada, podría proporcionar productos útiles con los que se pudieran equilibrar los costes de tratamiento de residuos y también disminuir el costo del producto principal. Por lo tanto, existe un margen para el aislamiento de estos ingredientes activos y también el uso de cáscara de mango como un ingrediente en productos alimentarios procesados. Asimismo, la almendra de la semilla contiene aminoácidos esenciales, proteínas, grasas, carbohidratos, fibra, y es una buena fuente de polifenoles, fitoesteroles como campesterol, β‐sitosterol y tocoferoles y está libre de materiales tóxicos como el ácido cianhídrico (Ajila et al., 2007). Debido a las investigaciones anteriores, se ha sugerido que la almendra de la semilla de mango podría ser utilizado como una fuente potencial de ingredientes alimentarios funcionales (Khammuang & Sarnthima, 2011), que pudieran ser comercialmente valiosos en la industria del aceite vegetal y en confitería, entre otros (Pereira et al., 2011). Las hojas y la corteza del árbol también han sido utilizadas para diferentes fines, fundamentalmente medicinales y sus aplicaciones cubren un amplio espectro de enfermedades, pero las citadas con mayor asiduidad son los dolores (menorrágicos, dentales, musculares y articulares), las infecciones cutáneas (escabiosis, epidermofitosis, micosis), las diarreas, la sífilis, la tuberculosis y algunas enfermedades crónicas, tales como la diabetes y la anemia. El uso de la corteza del árbol de mango como materia prima vegetal para la preparación de extractos acuosos por diferentes vías (maceración, percolación, decocción e infusión), forma parte de la cultura popular en más de 30 países, fundamentalmente de los llamados del Tercer Mundo, según reportes documentados desde hace más de 200 años (Napralert, 2007). En los últimos 12 años ha habido un auge en las publicaciones relacionadas con las actividades farmacológicas de diferentes extractos, obtenidos de diversas partes del árbol de mango, pero ha sido el extracto acuoso de la corteza del árbol el que más ha llamado la atención de un grupo de científicos que ha publicado cerca de 80 artículos relacionados con la tecnología química y farmacéutica, la composición química y, principalmente, la evaluación farmacológica pre‐clínica, la toxicología y los estudios clínicos; así como el papel que desempeña en la actividad farmacológica del extracto la xantona glicosilada mangiferina, que constituye el componente mayoritario dentro de éste. En esta revisión se analizarán los avances realizados en las investigaciones farmacológicas y toxicológicas llevadas a cabo con el extracto acuoso de la corteza del árbol de la especie Mangifera indica (mango) y su utilidad potencial en diferentes patologías. Esta hipótesis es soportada por evidencias pre‐clínicas y clínicas importantes, tanto para el extracto como para la mangiferina presente en éste. ESTUDIOS ETNOBOTÁNICOS Y ETNOMÉDICOS El árbol del mango es perenne y alcanza de 15‐30 m de altura, puede vivir por más de 100 años y desarrollar un tronco con más de 4 m de diámetro. El origen del mango ha sido establecido en Asia, particularmente en la región Indo‐Burmese, en las laderas del Himalaya (Tjiptono et al., 1984). El fruto se cultiva desde los tiempos prehistóricos, hace más de 6 000 años, siendo considerado como el fruto tropical más antiguamente cultivado por el hombre. Aparecen referencias al mango en las Sagradas Escrituras en Sánscrito, las leyendas y el folklore hindú 2 000 años a.C. y se refieren a él como de origen antiguo. En la India, el árbol de mango ha sido objeto de gran veneración (Sawangchote et al., 2009). Las raíces del vocablo, por un lado se señala que la palabra en sánscrito para el mango es amra, lo que significa "de la gente" o "del pueblo", y se señala así porque fue registrado en ese idioma por primera vez en la historia de la humanidad hace más de 4 000 años. Por otra parte, se dice que el nombre del fruto, así como del árbol, deriva del portugués "manga" que se refiere a un término malayo que se pronuncia "mangga" o "mangka", asonancias que se encuentran sobre los pendientes del Himalaya y como consecuencia, la transposición en las diferentes lenguas modernas conserva la radical "mango". Rev. Farmacol. Chile (2012) 5(2): 64 Por tanto, las diversidades de nombres para el mango en todo el mundo reflejan las culturas y los idiomas hablados por las personas que lo cultivan (Bally, 2006). Muchos de los nombres tienen derivaciones comunes, lo que refleja los orígenes y la propagación del árbol de mango junto con el crecimiento de las comunidades humanas. Por ejemplo, en las islas del Pacífico esta especie es conocida comúnmente como idele (Palau), kangit (Chuuk, Pohnpei), mago (Niue, Samoa, Tuvalu), manako (Hawaii), manggo, am (Fiji), mangko (Kiribati), mango (Inglés), mango (Tonga), mangot, mangue, manguier (Francés), mangueira (Yap) y en otras regiones como aam, am, amb (Hindi), ampleam (Tamil), bobbie manja, kanjanna manja, maggo, manggaboom, manja (Holandés), ma muang (Indochina), mamung (Tailandia), manga, mango (Español), manga, (Portugués), manga, mempelam, ampelam (Malasia), mangga (Tagalog), mangga, mempelam (Indonesia), mango (Ilokano), mango (Nueva Guinea, Pidgin), Mangobaum (Alemán), mwàngx (Laos), paho (Bisaya, Filipinas), svaay (Cambodia), tharyetthi (Myanmar), xoài (Vietnam). Entre los frutos tropicales comercializados internacionalmente, el mango ocupa el tercer lugar sólo superado por el plátano y la piña, tanto en cantidad como en valor (Yaacob & Subhadrabandhu, 1995) y el quinto de la producción total de los cultivos frutales más importantes del mundo (FAO, 2012). La producción mundial de mangos se estima en más de 26 millones de toneladas por año. La India ocupa el primer lugar entre los países productores del fruto de mango en el mundo, que representan el 54,2% del total de estos frutos producidos en todo el mundo y es comercialmente el cultivo frutícola más importante de este país, con más de mil variedades conocidas hasta la fecha. Durante el período 2008‐2009 este país produjo alrededor de 13,6 millones de ton., el segundo lugar lo ocupó China (~4 millones ton.), seguido de Tailandia (2,5 millones de ton.), Indonesia (2,2 millones ton., México (~1,9 millones ton.), Pakistán (~1,8 millones ton.) y Brasil (~1,2 millones toneladas). Otros países productores importantes de mango son: en Asia, China y Filipinas; en África, Nigeria, Egipto, Congo, Costa de Marfil, Sudáfrica y Ghana y en América Latina, Haití, Cuba, Colombia, Venezuela, Ecuador y Perú (FAO, 2012). Las diferentes partes del árbol de mango también se han utilizado por sus propiedades medicinales. Alrededor del 80% de la población mundial, principalmente de los países no desarrollados, tienen en los extractos de productos naturales y sus derivados su primera opción para el tratamiento terapéutico en la Atención Primaria de Salud (Mahadi, 2001). Las hojas de mango en Tonga se usan como infusiones y se utilizan junto con la naranja y otras especies para hacer una poción para el tratamiento de las recaídas durante alguna enfermedad (Thaman & Whistler, 1996). En Ghana se hierven las hojas con frutas cortadas de Citrus aurantifolia contra la malaria (Asase et al., 2010). También en Nigeria se utilizan las hojas contra esta enfermedad (Aiyeloja & Bello, 2006, Ene et al., 2010), como febrífugo (Idu & Onyibe, 2007) y contra la diabetes (Gbolade, 2009). En la India, la diabetes también ha sido tratada con una bebida hecha a partir de la infusión de las hojas frescas (Natarajan et al., 2010). Estas hojas frescas también se utilizan para combatir los vómitos, la diarrea, el dolor estomacal, el agrietamiento de pies (Rout & Panda, 2010) y el cólera (Kar & Borthakur, 2008). El jugo de éstas se aplica localmente en los ojos para la conjuntivitis (Upadhyay et al., 2010), problemas gástricos, úlceras y diarrea. (Das et al., 2008). También la diarrea y la disentería son tratadas con extracto de las hojas (Kalita & Bora, 2008; Biradar & Ghorband, 2010; De Wet et al., 2010; Upadhyay et al., 2010). Además, éstas son usadas para las erupciones de la lengua (Jain et al., 2010), en cataplasma para cicatrizar heridas recientes o crónicas (Agyare et al., 2009) y en forma de polvo para aumentar la fortaleza de los dientes (Natarajan et al., 2010). Hervidas en agua se usan como estimulante, aplicadas en el baño después del parto (Rajith et al., 2010) o para tratar el reumatismo (Silja et a., 2008) y mezcladas con hojas de Ficus bengalensis y Ficus religiosa se usan contra el sangramiento (Ponnusamy et al., 2009). En Brasil se emplean contra infecciones vaginales, sífilis, gripe con tos y congestión (Coelho‐ Ferreira, 2009). En Camerún la decocción de las hojas tiernas se aplica contra la tos, el dolor de garganta y el asma (Focho et al., 2009b; Noumi, 2010). En la India y Pakistán se utiliza la pulpa del fruto contra la ictericia y el hepatitis (Khan‐Marwat et al., 2012; Pawar, 2012). También en la India, la pulpa del fruto se reporta para tratar la malnutrición y el desbalance en la dieta (Singh et al., 2007; Pushpangadan & George, 2010), el estreñimiento (Satapathy, 2010), la tos (Gupta et al., 2010) y la picadura de escorpión y como remedio para el agotamiento y el golpe de calor (Upadhyay et al., 2010). La mitad del fruto muy maduro se come con sal y miel y se utiliza para el tratamiento de trastornos gastrointestinales, biliares, de la sangre y el escorbuto. Los mangos maduros son una rica fuente de vitamina A y se utilizan para tratar la deficiencia de esta vitamina, como la ceguera nocturna (Pushpangadan & George, 2010). Muchos de los usos tradicionales medicinales del mango en la India implican comer el fruto verde. Debe tenerse en cuenta que el fruto verde contiene una gran cantidad de la savia tóxica (Rozas‐ Muñoz et al., 2012) que cuando se consume en exceso puede causar dermatitis alérgica, irritación de la garganta, indigestión, disentería y cólicos. La resina del árbol también se aplica en la India sobre las encías y los dientes dos veces al día contra la piorrea (Shukla et al., 2010), el agrietamiento de pies y piel, vómitos, diarrea y dolor estomacal (Natarajan et al., 2010; Rout & Panda, 2010), extracción de diente (Patil & Patil, 2010), picadura de Rev. Farmacol. Chile (2012) 5(2): 65 escorpión (Kulkarni & Adwit, 2011) y desórdenes de la piel (Prashantkumar & Vidyasagar, 2008). Desde el punto de vista etnomédico, en la India, la almendra de la semilla se emplea para tratar la diarrea crónica (Tetali et al., 2009), el asma, para expulsar lombrices y otros gusanos en las úlceras (Rajendran et al., 2008a) y para problemas urinarios (Ballabh et al., 2008). Además, se ha reportado para curar los vómitos y la disentería (Silja et al., 2008). Se ha observado que tradicionalmente en las tribus de la India comen la almendra de la semilla del mango asada durante algún período de inanición, por su contenido de almidón. El polvo de la almendra también es usado como astringente en sangramientos. Por lo tanto, se supone que es adecuado para el consumo humano (Ramteke et al., 1999). La corteza del árbol en Samoa, ha sido un remedio tradicional, como infusión, para las infecciones de la boca en los niños (Thaman & Whistler, 1996). En la India, los extractos acuosos de la corteza se utilizan para la diarrea y en gargarismos para los trastornos de garganta, úlceras bucales y olor fétido bucal (Ganesan, 2008). También la corteza se usa como anticonceptivo (Henry et al., 1996; Bhogaonkar & Kadam, 2006), astringente, aperitivo, antihelmíntico, contra la gonorrea, el asma, afrodisíaco, para prolongar la eyaculación (Kadavul & Dixit, 2009; Jain et al., 2010) y mezclada con otras plantas contra la insolación y el cólera (Pooman & Singh, 2009). La decocción de la corteza fresca (Upadhyay et al., 2010) o seca se emplea contra la diarrea y la disentería (Nath & Choudhury, 2010; Purkayastha et al., 2007) y la difteria (Pawar & Patil, 2007a). El jugo de la corteza se utiliza contra la ictericia (Sarkar & Das, 2010) y la corteza del tallo como cicatrizante (Kuvar & Bapat, 2010). En Camerún, la corteza del tallo se usa contra el asma (Noumi, 2010), el reumatismo (Jiofack et al., 2008) y la sífilis (Focho et al., 2009a), en Nepal contra los dolores abdominales, disentería, diarrea, hepatitis, enfermedades de la piel, como antiparasitario y antiespasmódico (Ghimire & Bastakoti, 2009), en Ghana como cataplasma en heridas recientes o crónicas (Agyare et al., 2009), en Uganda contra la tuberculosis y el VIH‐SIDA (Lamorde et al., 2010; Tabuti et al., 2010), en Nigeria la decocción se usa contra la malaria (Ene et al., 2010) y en Brasil la infusión se aplica en quistes de ovario, mioma uterino y contra la tos (Coelho‐ Ferreira, 2009). USO ETNOMÉDICO EN CUBA. Como se ha visto, existe un conocimiento etnomédico documentado del uso de la corteza del árbol de mango en varios países y, en particular, de la experiencia acumulada durante más de 30 años en la población cubana (Guevara‐ García et al., 2004). El uso específico del extracto acuoso de la corteza del árbol de mango (ECAM) en Cuba se ha realizado de manera empírica y mediante la experiencia acumulada por practicantes de la medicina natural y tradicional (Guevara‐García et al., 2004), cuyo trabajo ha sido el punto de partida para las investigaciones y el desarrollo de una la línea de productos naturales ® denominada Vimang . A partir de dicho extracto y en dependencia del estado del paciente que se somete a este tratamiento popular, las personas han empleado formulaciones artesanales del ECAM como la decocción con el 2% de sólidos totales, para su ingestión por vía oral en dosis de 30 mL, 3‐4 veces al día; la loción tópica hidro‐ alcohólica (alrededor del 5% de etanol), a partir de la decocción, que se aplica sobre las lesiones de la piel, 3‐4 veces al día, con un tiempo de aplicación alrededor de los 30 min; la solución hidro‐alcohólica (alrededor del 2% de etanol), a partir de la misma decocción, que se aplica como un lavado vaginal o un enema rectal (entre 3 y 5 mL), 3‐4 veces al día; y el ungüento hidrófilo que contiene alrededor del 30% de la decocción y que se aplica de forma independiente o posterior a la loción tópica sobre las lesiones de la piel. El tiempo de tratamiento ha sido variable y depende del paciente, con un promedio entre los seis meses y varios años, según el tipo de enfermedad. Estudios etnomédicos, publicados de forma parcial (Tamayo et al., 2001; Núñez‐Sellés, 2005), han reportado que el extracto fue efectivo en patologías como diabetes mellitus tipo II, hiperplasia prostática benigna, dermatitis, Lupus eritematoso, diferentes tipos de neoplasias, polineuropatías, hemorroides, cervicitis, así como infertilidad (fundamentalmente femenina), en algunos casos con remisión total de la enfermedad. COMPOSICIÓN QUÍMICA DEL EXTRACTO ACUOSO DE LA CORTEZA DEL ÁRBOL DE MANGO. El extracto es preparado por decocción por una hora y posteriormente es concentrado por evaporación y secado por spray died para obtener un polvo fino de color café (ECAM), el cual funde a 210‐215 °C con descomposición (Acosta‐Esquijarosa et al., 2009). El ECAM es el ingrediente farmacéutico activo estandarizado que se utiliza para la fabricación de las formulaciones Vimang® (Arús‐Pampin et al., 2003; Lemus‐Rodríguez et al., 2006). La composición química del extracto ha sido caracterizada por métodos cromatográficos (planar, líquido y gas), espectrometría de masa y espectrofotometría UV‐Vis (Núñez et al., 2002; 2007a,b; Núñez‐Sellés, 2005) y se podría resumir de la manera siguiente: • Polifenoles (35‐45%): mangiferina (componente mayoritario), catequina, epicatequina, ácido gálico, propil éster, ácido gálico, metil éster, ácido benzoico, propil éster, ácido 3,4‐ dihidroxibenzoico, ácido benzoico y ácido gálico. • Terpenoides (25‐30%): β‐elemeno, β‐selineno, α‐ guaieno, aromandreno, hinesol, β‐edesmol, Rev. Farmacol. Chile (2012) 5(2): 66 • cicloartranoles, ledol, taraxerol, β‐chamigreno y bulnesol. • Esteroides (1‐3%): β‐Sitosterol y campestrol. • Azúcares libres (5‐8%): galactosa, glucosa, arabinosa y fructosa. • Polialcoholes (3‐5%): sorbitol, mioinositol y xilitol. • Ácidos grasos (1‐3%): mirístico, palmítico, linoleico, oleico, esteárico, eicosatrienoico, succínico y malónico. • Elementos (1%): calcio, magnesio, potasio, hierro, selenio, cobre y zinc. EVIDENCIAS FARMACOLÓGICAS PRE‐CLÍNICAS REPORTADAS PARA EL EXTRACTO ACUOSO DE LA CORTEZA DEL ÁRBOL DE Mangifera indica. Del total de las publicaciones relacionadas en el área de Farmacología y Toxicología, encontradas en la BD de ISI Web of Knowledge, desde 1988 hasta junio de 2012, alrededor del 35% corresponde a los estudios llevados a cabo con el ECAM, que constituye el ingrediente farmacéutico activo de las formulaciones farmacéuticas que se comercializan en Cuba bajo la marca Vimang® y registradas como nutracéutico y medicamento de origen natural para su uso en procesos inflamatorios y de dolor. Para la obtención de una cobertura más amplia del total de publicaciones relacionadas con el ECAM, también se realizó una búsqueda de artículos en las BD PubMed, Scielo y DOAJ. ACTIVIDAD ANTIOXIDANTE Los resultados de la evaluación de las propiedades antioxidantes del ECAM han sido publicados ampliamente (Martínez Sánchez et al., 2000a,b; 2001a,b; 2003; Loy et al., 2002; Garrido et al., 2008). Han sido reportadas acciones de ECAM como: captura de ácido hipocloroso, captura del radical superóxido, captura de radical hidroxilo, acción quelante de hierro, efecto anti‐ oxidante sobre ADN, inhibición de la peroxidación lipídica (IPL) espontánea, IPL catalizada por hierro, IPL microsomal (IPLM), IPLM catalizada por hierro, protección a la pérdida de grupo sulfhidrilo (SH) proteicos, protección a la aparición de grupo carbonilo (CO) proteicos e inhibición del daño por isquemia/reperfusión hepática en ratas y en cerebro de Gerbil. Todas estas acciones fueron logradas a bajas concentraciones del extracto. La comparación de la actividad antioxidante de ECAM con relación a otros compuestos antioxidantes reconocidos tales como las vitaminas C y E, así como el beta‐caroteno, demostró que el extracto es similar (inhibición a la peroxidación lipídica) o superior (protección al daño oxidativo) a dichos compuestos (Martinez‐Sanchez et al., 2000b). La posible explicación del mecanismo molecular a través del cual el ECAM ejerce su efecto antioxidante se muestra en la Figura 1. Figura 1. Efecto del extracto de la corteza del árbol del mango (ECAM) sobre el balance redox. Rev. Farmacol. Chile (2012) 5(2): 67 Muchos polifenoles fundamentan su actividad antioxidante no sólo en la capacidad de secuestrar radicales libres, sino en su habilidad de acomplejar el hierro (Perron & Brumaghim, 2009; Chobot & Hadacek, 2010). El hierro es uno de los microelementos de mayor importancia para el organismo humano. Su capacidad de transitar por varios estados de valencia lo convierte en elemento esencial para la actividad biológica de un número relevante de moléculas, de forma particular, aquellas que participan en reacciones de transferencia de electrones. Al mismo tiempo, esta habilidad lo transforma en un elemento con un peligro potencial, al catalizar la formación de ERO, especialmente el radical hidroxilo, a través de la reacción de Fenton‐Haber‐Weiss. El organismo ha desarrollado un mecanismo sensible para regular las concentraciones de hierro y evitar su participación en procesos redox no deseados. En un número importante de patologías, esta delicada maquinaria regulatoria se ve afectada por factores endógenos y exógenos y se producen acumulaciones del metal en tejidos y órganos, con el consiguiente daño oxidativo y alteración de la función de la célula. En estudios recientes (Pardo‐Andreu et al., 2005a), se demostró que el ECAM protegió las membranas 2+ mitocondriales del daño oxidativo inducido por Fe . La CI50 del extracto frente a la peroxidación lipídica inducida por Fe2+ fue más de 10 veces inferior a la CI50 cuando en lugar del hierro se utilizó, como inductor, el peróxido de ter‐ butilo (TBOOH). De la misma manera, el ECAM estimuló la autoxidación del Fe2+ a Fe3+ e impidió la reducción de la forma férrica a la ferrosa por el ácido ascórbico. La interacción del ECAM con el hierro, incapacita al metal de participar en la generación del radical libre hidroxilo a través de la reacción de Fenton. Además, el ECAM mostró una potente inhibición de la degradación de la 2‐ 3+ deoxiribosa mediada por Fe /EDTA‐ascorbato ó 3+ Fe /EDTA‐hipoxantina/xantina oxidasa. El incremento en la concentración de los ligandos utilizados (EDTA o citrato) causó una disminución significativa en el efecto protector del ECAM (Pardo‐Andreu et al., 2006a). Cuando el ascorbato se reemplazó por el radical anión superóxido (formado por la actividad de la enzima xantina oxidasa/hipoxantina), la eficiencia protectora del ECAM estuvo inversamente relacionada con la concentración de EDTA. Estos resultados indicaron que el ECAM no solo bloqueó la degradación de la 2‐deoxiribosa a través del “secuestro” de radicales hidroxilos, sino que parece actuar principalmente a través del acomplejamiento de iones hierro, lo que previene su participación catalítica en la reacción de Fenton‐Haber‐Weiss. La MF, por su abundancia relativa dentro del ECAM, parece ser la responsable principal de este comportamiento del extracto (Pardo‐Andreu et al., 2005b; 2006a). El complejo 3+ MF‐Fe (2:1) incrementó la capacidad secuestradora del radical superóxido y la citoprotección de hepatocitos aislados expuestos a hipoxia‐reoxigenación en comparación con la MF sola. Además, estudios in vivo de sobrecarga de hierro (Pardo‐Andreu, et al., 2008) mostraron que el ECAM y la MF mejoran los indicadores séricos de capacidad antioxidante y daño oxidativo en ratas sometidas a la administración i.p. de Fe‐dextrana; al mismo tiempo que disminuyeron la acumulación hepática de este 3+ metal. Tanto el ECAM como el complejo MF‐Fe también fueron capaces de aumentar la viabilidad celular cuando células de túbulo proximal HK‐2 fueron expuestas a diferentes concentraciones de As (Garrido et al., 2012). Además, se sabe que parte del mecanismo de daño que provoca el As es a través de un componente de estrés oxidativo importante (Flora, 2011). En otro estudio (Remírez et al, 2005), se demostró que el ECAM no resultó citotóxico en hepatocitos aislados de ratas en el rango de concentraciones de 5‐1 000 μg/mL después de 24 h de exposición de las células a éste. En ese modelo celular sólo se observó un efecto citotóxico moderado a las concentraciones de 500 y 1 000 μg/mL cuando los hepatocitos fueron expuestos al extracto durante 72 h. Posteriormente, se publicó el potencial antioxidante del ECAM sobre los hepatocitos en cultivo lo que permitió evidenciar la actividad antioxidante del extracto en ese modelo experimental, como forma de evaluar su efecto sobre dicho órgano (Rodeiro et al., 2007). El ECAM fue capaz de reducir la peroxidación lipídica en el cultivo y revertió significativamente la peroxidación inducida por TBOOH, lo que se comprobó por la disminución de la producción de MDA y un incremento de las concentraciones de GSH a nivel celular. Por otra parte, otros estudios (Pardo‐Andreu et al., 2005c) han mostrado que la acumulación de productos de oxidación de la MF (productos generados a partir de su acción antioxidante) induce la transición de permeabilidad mitocondrial (TPM), debido a la capacidad que tienen de disminuir el contenido de grupos tiólicos de la membrana mitocondrial, así como del glutatión. Estos productos, de posible naturaleza quinónica, son electrófilos débiles con la capacidad de reaccionar con los grupos SH. Resultados similares se obtuvieron también para el ECAM (Pardo‐ Andreu et al., 2006c). Este comportamiento debe beneficiar a aquellas células expuestas a una sobreproducción de ERO, como sucede en algunos tipos de células cancerígenas, en las cuales el desencadenamiento de la apoptosis mediada por TPM podría representar un mecanismo de defensa significativo para el organismo portador. También se ha reportado que la MF manifestó un efecto hepatoprotector contra el daño hepático inducido por tetracloruro de carbono. En este mismo estudio, la MF presentó una fuerte actividad antioxidante mediante el ensayo del 1,1‐difenil‐2‐picrilhidracilo (DPPH) (Pauletti et Rev. Farmacol. Chile (2012) 5(2): 68 al., 2003; Dar et al., 2005), lo que fundamentó los hallazgos de las propiedades secuestradoras de radicales libres in vitro de este polifenol. Por otra parte, MF ha demostrado efecto secuestrador del radical superóxido producido por los sistemas hipoxantina‐ xantina oxidasa y metosulfato fenazina‐NADH; pero no fue capaz de inhibir la actividad de la xantina oxidasa, determinada por la producción de ácido úrico como sustrato, ni modificar la respuesta contráctil inducida por fenilefrina o ésteres de forbol (como PMA) en anillos aórticos de rata (Leiro et al., 2003). Sin embargo, su aglicona noratiriol inhibió la generación del anión superóxido inducida por formilmetionil‐leucil‐fenilalanina (fMLP) y el consumo de O2 en neutrófilos de rata (Hsu et al., 1997). En un sistema libre de células, generador de radicales de oxígeno, noratiriol inhibió la generación de superóxido durante la autoxidación del ácido dihidroxifumárico y en el sistema xantina‐xantina oxidasa. Noratiriol inhibió el aumento de Ca2+ inducido por fMLP y la formación de inositol trifosfato, así como las actividades de la fosfolipasa C citosólica de neutrófilos y la NADPH oxidasa. Los autores afirmaron que el noratiriol contribuye a la reducción de radicales superóxido atribuida al bloqueo de la vía fosfolipasa C, la atenuación de la fosforilación de la proteína de tirosina inducida por fMLP y a la supresión de la NADPH oxidasa a través de la interrupción del transporte de electrones. ACTIVIDAD ANTI‐INFLAMATORIA E INMUNOMODULADORA Existen múltiples evidencias que señalan la relación existente entre el balance oxidativo a nivel celular y tisular, la respuesta al dolor y el desarrollo de la inflamación, en la que se muestra que las ERO activan las proteína‐cinasas y fosfatasas, así como factores de transcripción que promueven la biosíntesis de citocinas pro‐inflamatorias (Kyriakis & Avruch, 1996; Cuzzocrea et al, 2001). Las citocinas, a su vez, promueven la aparición de nuevas ERO a partir de la activación de diversos factores de regulación transcripcional, entre los que se encuentra el NF‐κB (Karin & Neriah, 2000; Li & Verma, 2002). En estudios recientes se ha comprobado que el ECAM redujo la inflamación inducida por carragenano, en ratas y cobayos, y formalina, en ratones, como modelos agudos inflamatorios (Garrido et al., 2001). En un modelo de inflamación tópica en el que se indujo el edema por agentes irritantes (como el ácido araquidónico o el PMA) en la oreja del ratón, ECAM, administrado de forma tópica (oreja), inhibió la inflamación con una reducción de la actividad de la enzima mieloperoxidasa en el tejido de las orejas tratadas con PMA + ECAM (Garrido et al., 2004a). De la misma manera, en un modelo de enfermedad peridontal inducida en perros (García‐Triana et al., 2005), el ECAM (1%, disuelto en solución salina fisiológica), aplicado dos veces al día durante tres semanas, redujo de manera significativa el índice gingival, la profundidad del surco gingival y la pérdida ósea, por lo que la administración tópica del extracto atenuó el desarrollo de la enfermedad peridontal. Por otra parte, el ECAM inhibió la quimiotaxis de leucocitos polimorfonucleares, lo que permite regular la migración de células inflamatorias al sitio de inflamación e inhibir la expresión de moléculas de adhesión, relacionadas con los procesos de activación del endotelio vascular y los procesos de trasmigración de leucocitos y otras células inflamatorias al tejido inflamado. Además, se pudo comprobar que ECAM inhibe la expresión de la molécula de adhesión ICAM‐1 cuando las células endoteliales son estimuladas con IL‐1 (Delgado et al., 2001; Beltrán et al., 2003). La capacidad quimiotáctica de macrófagos peritoneales de rata también fue inhibida por ECAM (García et al., 2002). También, el ECAM inhibió la producción de eicosanoides tales como prostaglandina E2 (PGE2) y leucotrieno B4 (LTB4), mediadores de procesos inflamatorios relacionados con la activación de la vía metabólica del ácido araquidónico, en macrófagos RAW264.7 y J774 (Garrido et al., 2004a; 2006). Este efecto podría deberse, al menos en parte (PGE2), a que ECAM inhibe la expresión de la enzima inducible encargada de la síntesis de estos mediadores, la ciclooxigenasa 2 (COX‐2), mediante la inhibición del proceso de transcripción de los genes que codifican para esta enzima en macrófagos peritoneales murinos estimulados con lipopolisacárido bacteriano (LPS) e interferón gamma (IFNγ) (Leiro et al., 2004b). En este estudio, ECAM solo redujo, de forma significativa, la concentración de ARNm de la enzima COX‐1 con la mayor concentración evaluada (400 μg/mL), lo que pudiera indicar que el extracto es capaz de inhibir selectivamente la isoforma COX‐2 que se induce en el proceso inflamatorio sin alterar la función biológica de la enzima COX‐1. Adicionalmente, el ECAM inhibió la actividad de la fosfolipasa A2 (PLA2) de secreción sinovial humana (Garrido et al., 2004a). En sistemas experimentales, en los que se emplearon células de musculatura lisa vascular, aisladas de arterias mesentéricas de ratas normotensas y espontáneamente hipertensas, se lograron demostrar los efectos de ECAM y la MF sobre la expresión de las isoformas inducibles de COX‐2 y de iNOS, ambos sistemas enzimáticos involucrados en la hipertensión arterial como enfermedad inflamatoria crónica, en la que desempeñan un papel protagónico los diversos procesos e intermediarios asociados a las funciones básicas del endotelio vascular y la musculatura lisa vascular. Se comprobó que ECAM inhibió con mayor efectividad la expresión de iNOS inducida por IL‐1 en ratas hipertensas respecto a las normotensas, mientras que el Rev. Farmacol. Chile (2012) 5(2): 69 efecto inhibidor sobre la COX‐2 fue más acentuado en las ratas normotensas (Beltrán et al., 2004). El ECAM redujo la contracción inducida por noradrenalina y otro agente vasoconstrictor (U46619) en arteria mesentérica de rata (Beltrán et al., 2004), efecto este que no se justifica a partir de sus propiedades anti‐ inflamatorias. Sin embargo, la MF no mostró actividad vasodepresora, lo cual sugiere que el efecto de ECAM sobre la vasoconstricción mediada por la expresión de COX‐2 e iNOS, está relacionada con la presencia de otros componentes del ECAM, cuyo efecto aún está por demostrar. En un modelo murino de choque endotóxico inducido por lipopolisacárido (LPS), el ECAM inhibió la producción de TNFα tanto en un modelo de administración aguda como cuando se administró durante una semana por vía oral. Se pudo comprobar que esta inhibición está dada por la acción de ECAM sobre el trascripto primario de esta proteína (ARNm) tanto en hígado como en pulmones de los animales tratados (Garrido et al., 2004b). En los modelos de inducción de edemas auriculares por ácido araquidónico y PMA, por administración aguda oral de ECAM, se obtuvo una inhibición de las concentraciones séricas de TNFα (Garrido et al., 2004a). Además, ECAM y MF inhibieron la producción de esta citocina pro‐inflamatoria en macrófagos RAW 264.7 y N9 activados con LPS e IFNγ (Garrido et al., 2004b). La acción de MF sobre macrófagos residentes del SNC en microglia (como la línea celular N9) pudiera explicar la actividad neuroprotectora detectada en un modelo de neuroinflamación y daño oxidativo inducido por estrés en el cerebro de ratas inmovilizadas (Máquez et al., 2012). El tratamiento previo con esta xantona, por vía oral durante siete días, previno todos los efectos inducidos por el estrés como fueron: el incremento en las concentraciones plasmáticas de glucocorticoides e IL‐1β; la pérdida del balance redox y la reducción de las concentraciones de catalasa cerebral; el incremento de los mediadores pro‐inflamatorios, tales como TNFα y su receptor TNF‐R1, el NF‐κB y la síntesis de enzimas, como iNOS y COX‐2; y el incremento de la peroxidación lipídica. Estos resultados sugieren que la administración de MF (o los extractos ricos en esta xantona) podría constituir una nueva estrategia terapéutica en patologías neurológicas‐ neuropsiquiátricas en las cuales exista una desregulación del eje hipotalámico‐pituitario‐adrenal, neuroinflamación y un daño oxidativo. Por otra parte, se investigaron los efectos del ECAM en un modelo de colitis ulcerativa inducida por sulfato sódico de dextrano (DSS) en ratas (Márquez et al., 2010). Para ello, el ECAM se administró en dos protocolos diferentes: en el primero se administró el ECAM por vía rectal, durante 7 días en co‐tratamiento con DSS, y en el segundo ECAM se administró una vez al día durante 14 días (por sonda oral, 7 días antes de la administración de DSS y rectal por 7 días durante la administración de DSS). Los resultados demostraron que el ECAM tiene propiedades anti‐ inflamatorias que mejoran los signos clínicos, la reducción de la ulceración y la reducción de la actividad MPO cuando se administra antes de DSS. Además, la administración del extracto por 14 días resultó en un aumento de GSH y la reducción de las concentraciones de las sustancias reactivas de ácido tiobarbitúrico (TBARS) y de iNOS y la expresión de COX‐2, TNF‐α y TNF R‐2 en tejido colónico, y una disminución de las concentraciones séricas de IL‐6 y TNFα. Los autores declararon que la administración preventiva de ECAM, en un modelo de colitis inducida por DSS, parece ser el protocolo más efectivo para disminuir el estrés oxidativo y la inflamación en este modelo. Existe una estrecha relación entre la inflamación, el desbalance oxidativo y la respuesta inmune. La producción de ERO puede modular la expresión de numerosas moléculas (citocinas, anticuerpos, factores de transcripción y otras) involucradas en la respuesta inmune, lo que ha permitido relacionar algunos trastornos en la inmunidad con el estrés oxidativo y los mecanismos de defensa antioxidante con las propiedades inmunomoduladoras de los fármacos (Matés et al., 2000). La respuesta inflamatoria es parte y consecuencia de algunos tipos de respuesta inmune y varias de las citocinas producidas por macrófagos, células T y mastocitos conducen al reclutamiento celular, el incremento de la permeabilidad vascular, la vasodilatación y otros eventos característicos de la inflamación. Otro punto en común entre estos fenómenos lo constituye la actividad del propio macrófago, pues es una de las principales fuentes de producción de ERO, de mediadores pro‐inflamatorios y es uno de los ejes centrales en la activación de la respuesta inmune adaptativa que inducen la coestimulación para la activación de las células T. En macrófagos murinos, aislados y estimulados con LPS e IFNγ, ECAM redujo las concentraciones de ARNm de las citocinas TNFα, IL‐1β y GM‐CSF, sin afectar las de IL‐6, e incrementó las de TGFβ. Además, redujo la concentración de TNFα en el sobrenadante de cultivo de macrófagos peritoneales, lo que permitió correlacionar la inhibición del ARNm con la reducción de la proteína (García et al., 2002). Por su parte, la MF inhibió el aumento de iNOS y TNFα en macrófagos de rata estimulados in vivo con tioglicolato y después in vitro con LPS e interferón gamma (Guha et al., 1996). A concentración de 100 mM redujo las concentraciones de sus ARNm. Sin embargo, a esta concentración aumentaron los valores del transcripto primario del factor de crecimiento tumoral‐beta (TGF‐β) (Leiro et al., 2003). El hallazgo de que MF aumente la expresión génica de TGF‐β sugiere que este polifenol, o extractos que lo contengan, podría tener algún valor en lo prevención del cáncer, enfermedades autoinmunes, aterosclerosis y otras afecciones cardiovasculares. Rev. Farmacol. Chile (2012) 5(2): 70 Por otra parte, el ECAM inhibió la producción de óxido nítrico (NO) en macrófagos RAW264.7 (Garrido et al., 2004b), así como en macrófagos peritoneales (García et al., 2002) estimulados con LPS e IFNγ. Se comprobó que esta acción de ECAM está asociada a la reducción de la concentración de ARNm que codifica para la iNOS, lo que conduce a la inhibición de la expresión de esta enzima, encargada de la producción del NO a partir de L‐arginina (Leiro et al., 2004b). El ECAM también inhibió la activación inducida por TNFα del factor de transcripción nuclear NF‐κB en células Hela y Jurkat, con lo cual se impidió la degradación del inhibidor citoplasmático del NF‐κB, o sea IκB. Por tanto, la translocación del NF‐κB al núcleo de la célula y su posterior unión a elementos específicos en regiones promotoras de genes dianas para la producción de proteínas pro‐ inflamatorias, tales como citocinas, moléculas de adhesión y enzimas, entre otros, también fue inhibida (Garrido et al., 2005). Por otra parte, se comprobó que ECAM redujo las concentraciones de ARNm del NF‐κB en macrófagos peritoneales murinos estimulados con LPS e IFN‐γ sin afectar la concentración de IκB, lo que explica que, además de inhibir su activación, reduce la disponibilidad de NF‐κB en el citoplasma celular y garantiza la presencia del inhibidor IκB (Leiro et al., 2004a). Se piensa que uno de los componentes en el ECAM responsable de los efectos anti‐inflamatorio e inmunomodulador sea la MF, por lo que se realizó un estudio para demostrar los mecanismos de acción por los cuales esta xantona ejerce tales efectos (Leiro et al., 2004a). Todo ello se realizó a través de la medición del efecto sobre la expresión de diversos genes relacionados con la vía de señalización del NF‐κB, por lo que se demostró que ésta inhibe la expresión de dos genes de la familia de Rel/NF‐κB/IκB, RelA y RelB, lo que indica un efecto inhibitorio sobre la señal de transducción mediada por NF‐κB; del factor 6 asociado al receptor de TNF (Traf6), lo que pudiera indicar un probable bloqueo de la activación de NF‐κB vía LPS, TNFα o IL‐1; de otras proteínas involucradas en las respuestas a TNF y a la vía apoptótica disparada por daño al ADN, la que incluye el receptor de TNF (TNF‐R), el dominio de muerte asociado al receptor del TNF (TRADD) y la proteína que interactúa con el receptor (RIP); del ligando extracelular de IL‐1α, lo que indica, posiblemente, interferencia con la respuesta a IL‐1; de las citocinas pro‐inflamatorias IL‐1, IL‐6, IL‐12, TNFα y RANTES y citocinas producidas por monocitos y macrófagos como el factor estimulante de colonias de granulocitos (G‐CSF), el factor estimulante de colonias de granulocitos‐macrófagos (GM‐CSF) y el factor estimulante de colonias de macrófagos (M‐CSF); de otras proteínas de receptores toll‐ like (además de Traf6) tales como JNK1, JNK2 y Tab1; de Scya2 (Small Inducible Cytokine A2), una proteína similar a la proteína quimioatrayente de monocitos‐1 (MCP‐1); y de varias moléculas de adhesión intracelular (ICAM) y la molécula de adhesión celular vascular VCAM‐1, la cual se encuentra aumentada en ateromas. La inhibición de JNK1, unido a la estimulación de c‐JUN y a la actividad secuestradora de superóxido anteriormente mencionada, sugiere que la MF podría proteger a las células contra el daño oxidativo y la mutagénesis. Además, MF bloqueó la activación de NF‐κB inducido por TNF y los genes dependientes de NF‐κB como ICAM‐1 y COX‐2 (Sarkar et al., 2004). El efecto estuvo mediado por la inhibición de la activación de IKK y subsiguiente bloqueo de la fosforilación y degradación de IκBα. De igual forma, la MF inhibió la fosforilación de p65 inducida por TNF, así como la translocación al núcleo y la activación de NF‐κB inducida por otros agentes pro‐inflamatorios como PMA, ceramide y LPS. También, inhibió la generación de ERO inducida por TNF e incrementó al doble las concentraciones de GSH (un modulador de las concentraciones de NF‐κB) en comparación con otros antioxidantes. Al mismo tiempo, decrecieron las concentraciones de GSSG e incrementó la actividad de catalasa. MF y, por tanto, el ECAM, podría constituir un fuerte candidato para la terapia antioxidante y anti‐ inflamatoria debido a su capacidad para inhibir la activación de NF‐κB y al incremento de las concentraciones intracelulares de GSH. Todas estas evidencias, tanto de experimentos a nivel molecular como en modelos animales, demostraron la influencia de ECAM sobre especies intermediarias de la reacción inflamatoria, tales como moléculas de adhesión (ICAM‐1), citocinas pro‐inflamatorias (TNFα y sus receptores TNF R‐1 y R‐2, IL‐1, GM‐CSF y TGFβ), enzimas (COX‐2, iNOS, PLA2), mediadores de la cascada del ácido araquidónico (PGE2 y LTB4) y factores de transcripción (NF‐ κB) que constituyen señales de activación intercelular muy relevantes de la respuesta inflamatoria y del sistema inmune, asociadas a los procesos de daño tisular y activación celular que producen la mayor parte de las ERO. De otra parte, los estudios llevados a cabo con MF indican que ésta es un inhibidor de la expresión de genes como iNOS TNFα y NF‐κB, lo que sugiere que esta xantona presenta un valor potencial en el tratamiento de desórdenes inflamatorios y(o) neurodegenerativos. Estos resultados también indican que la MF modula la expresión de un considerable número de genes que participan en la replicación viral, la regulación de la apoptosis, la tumorogénesis, la inflamación y enfermedades autoinmunes por lo que pudiera ser, en parte, la responsable de las actividades anti‐inflamatoria e inmunomoduladora del ECAM. Un resumen de los efectos de ECAM sobre algunos de los mediadores pro‐inflamatorios e inmunológicos se puede apreciar en la Figura 2. Rev. Farmacol. Chile (2012) 5(2): 71 Figura 2. TNFα NF-κB ECAM ICAM-1 ADHESIÓN CELULAR Citoplasma NF-κB Núcleo Fosfolípidos Membrana ADN ECAM GM-CSF PLA 2 AA Mediadores Proinflamatorios ECAM LOX COX-2 ECAM LTB 4 PGE 2 iNOS IL-1β TNFα NO . O 2- ECAM ONOO - CHOQUE ENDOTÓXICO INFLAMACIÓN Mecanismo de acción anti‐inflamatoria del extracto de la corteza del árbol del mango (ECAM). El proceso de inducción de señales, resultado de la activación del factor de transcripción nuclear κB (NF‐κB) por el factor de necrosis tumoral alfa (TNFα) se inhibe por el ECAM. Bajo condiciones patológicas, la activación de NF‐ κB inducida por TNFα estimula la degradación del inhibidor citoplasmático (IκB) del NF‐κB. Después de ese evento, NF‐κB se trasloca al núcleo de la célula para inducir la síntesis de ARNm de algunos mediadores pro‐inflamatorios tales como el TNFα, la óxido nítrico sintasa inducible (iNOS), la ciclooxigenasa 2 (COX‐2), la interleucina 1 (IL‐1) y el factor estimulante de colonias de granulocitos‐macrófagos (GM‐CSF); así como moléculas de adhesión que participan en el proceso de la adhesión celular (como ICAM‐1). El ECAM también es capaz de inhibir otros mediadores importantes del proceso inflamatorio como la fosfolipasa A2 (PLA2), la prostaglandina E2 (PGE2) y el leucotrieno B4 (LTB4). En otros modelos experimentales, se demostró que ECAM moduló la respuesta inmune humoral en ratones, mediante la inhibición de la IgG2a y la IgG2b, inmunoglobulinas características de la respuesta Th1 activadora de macrófagos, pero sin afectar la producción de IgM (García et al., 2003a). Este resultado se corresponde con el efecto inhibitorio de la actividad de macrófagos (García et al., 2002; Leiro et al., 2004b), e indica que ECAM pudiera utilizarse en enfermedades caracterizadas por la sobreproducción de inmunoglobulinas. La activación de los linfocitos T es una etapa crucial de la respuesta inmune que conduce a un incremento rápido en la expresión de genes relacionados con la proliferación y diferenciación de estas células. La desregulación de estos procesos conduce a estados inmunopatológicos como las enfermedades autoinmunes y la inflamación. Cuando los mecanismos de activación de células inmunocompetentes, como los macrófagos y las células T, persisten por permanencia del estímulo antigénico o por desregulación de los mecanismos inhibitorios, se produce un estado de sobreactivación celular que conlleva a la excesiva producción de mediadores inflamatorios, lo que conduce a un proceso inflamatorio tal que puede terminar en una lesión tisular. Dichos procesos están altamente implicados en la fisiopatología de enfermedades tales como la artritis reumatoide, las enfermedades inflamatorias intestinales y el lupus eritematoso sistémico, entre otras (Issekutz et al., 1988; Ali et al., 1997). El ECAM también inhibió la proliferación de células T humanas estimuladas por un superantígeno de Rev. Farmacol. Chile (2012) 5(2): 72 enterotoxina B de Staphylococcus aureus (Garrido et al., 2005). La activación de los linfocitos T ha sido estudiada, tanto en la inflamación crónica como en la aguda, ya que diferentes poblaciones de células T alteran el balance entre el aclaramiento o eliminación del patógeno y la inducción de daño tisular, lo que depende de los mediadores citocínicos que ellos secretan. La activación por citocinas conduce a un incremento rápido en la expresión de genes relacionados con el crecimiento, la adhesión y diferenciación de estas células. El tratamiento con ECAM inhibió la proliferación celular mediada por el receptor de células T e inducida por SEB. Además, fue estudiado el efecto del extracto sobre la expresión en la superficie celular de los marcadores de activación CD25 en células T primarias, estimuladas con SEB. El extracto inhibió la expresión de este marcador en la superficie celular de los linfocitos T. Como consecuencia de la activación celular, las células T primarias progresan a las fases S y G2‐M del ciclo celular, y en este estudio se evaluó el efecto del ECAM sobre la progresión del ciclo celular en estas células T estimuladas. El tratamiento con el extracto previno la entrada de las células en la fase S del ciclo celular. La muerte celular inducida por activación (AICD, Activation Induced Cell Death) es esencial para la homeostasis del sistema inmune (Krammer et al., 1994) y su desbalance está relacionado con diversas enfermedades tales como las inmunodeficiencias y las autoinmunes (Rieux‐Laucat et al., 2003). La elevada expresión del CD95L asociada al incremento en la sensibilidad a la AICD que se observa en los individuos infectados con el virus de la inmunodeficiencia humana evidencia que este tipo de muerte celular contribuye, en parte, a la pérdida progresiva de linfocitos T CD4+ infectados y no infectados que conduce a la desregulación del sistema inmune en estos pacientes (Dockrell et al., 1999; Badley et al., 2000; Alimonti et al., 2003). Los resultados experimentales demostraron que ECAM puede regular la sobrevivencia de linfocitos T humanos al inhibir la AICD in vitro. Este efecto se ejerce al disminuir las 2+ concentraciones intracelulares de ERO y Ca , señales tempranas inducidas que estimulan al TCR (T cell receptor). La capacidad de inhibir las ERO se demostró además, por la reducción en la expresión de la enzima manganeso‐ superóxido dismutasa (Mn‐SOD), involucrada en la regulación de los procesos de estrés oxidativo e inducida por la estimulación del TCR (Hernández et al., 2006a). También, el ECAM actuó sobre factores transcripcionales involucrados en la AICD. La disminución de las concentraciones constitutivas de NF‐κB en presencia del extracto determina una menor disponibilidad de este factor en la cascada de señales necesaria para la inducción del CD95L (Hernández et al., 2006b). Por otra parte, el extracto disminuyó la fosforilación de la cinasa de c‐Jun (JNK), lo que repercute en su activación y en consecuencia, en la activación del factor AP‐1 (Hernández et al., 2006a). El conjunto de efectos descritos conduce a la inhibición observada de la expresión del ARNm del CD95L y determina que ECAM inhiba la AICD. En otro estudio (Hernández et al., 2007) se demostró que los principales polifenoles que componen el ECAM, como MF, catequina y epicatequina son responsables, en parte, de la capacidad del extracto de regular la AICD en células T. Esto pudiera explicarse a través de un mecanismo que involucra la disminución de las concentraciones de ERO y Ca2+ inducidos por la activación del TCR. En todos los casos el efecto fue inferior al mostrado por ECAM, lo que fortalece la hipótesis del efecto sinérgico que pudiera ejercer la mezcla de componentes que conforman el extracto. En la Figura 3 se muestra un esquema de los blancos potenciales de acción del ECAM sobre la cascada de señalización del CD95L estimulada durante la AICD en linfocitos T humanos. ACTIVIDAD ANALGÉSICA Los ensayos desarrollados con la finalidad de evaluar la acción anti‐inflamatoria del ECAM, en modelos in vitro e in vivo, mostraron actividad anti‐inflamatoria y analgésica. De forma específica, el ECAM redujo el dolor inducido por formalina en la fase tardía de la reacción dolorosa (Garrido et al., 2001, 2004a,b, 2005, 2006). En la prueba de la formalina se acepta que la primera fase resulta de la activación directa de las fibras aferentes primarias nociceptivas y refleja un dolor de tipo fisiológico o nociceptivo (Vyklicky, 1979; Ren & Dubner, 1999; Wilson et al., 2006). Sin embargo, existen aún dificultades en la comprensión de los mecanismos de la segunda fase. Estudios recientes sugieren que dicha fase resulta de un incremento de la excitabilidad de las neuronas del cuerno dorsal espinal (CDE) y se ha demostrado que la fase I es necesaria para el desarrollo de la fase II (Ren & Dubner, 1999). Este ensayo es considerado como un excelente modelo de dolor persistente de moderada intensidad, que se asemeja al dolor clínico en humanos (Ortega et al., 2002). La actividad del ECAM quedó demostrada para la fase II, de ahí sus potencialidades para el tratamiento del dolor patológico y su acción antihiperalgésica. En el modelo de dolor inducido por la aplicación i.p. de ácido acético se obtuvo un resultado similar al reducir el número de las contorsiones abdominales (Garrido et al., 2001). Este modelo estudia el dolor visceral o mixto provocado por este irritante que causa inflamación peritoneal e hiperalgesia (Reichert et al., 2001). También la MF ha mostrado efecto analgésico en este modelo y en el del plato caliente en ratones, sin exhibir la actividad anti‐ inflamatoria (Dar et al., 2005). Ambos estudios (mediante la inducción de estímulos nociceptivos por formalina y ácido acético) sugieren la potencialidad del ECAM para tratar las alteraciones del procesamiento nociceptivo en circunstancias patológicas. Rev. Farmacol. Chile (2012) 5(2): 73 Figura 3. TCR ZAP70 Lck PLCγ2 RE Rho/Rac Rho/Rac MnSOD MnSOD ROS ERO 3 ECAM 1 Æ Æ Æ 2 Ca2+ MKK MKK 4/7 4/7 4 ECAM Mi ECAM Calmodulina Calm odulina p Calcineurina Calcineurina JNK p ECAM NF κB NF-κB NFAT Jun ECAM 6 Transcripción promotor CD95L Apoptosis 5 Núcleo ECAM Blancos potenciales de la acción del extracto de la corteza del árbol del mango (ECAM) sobre la cascada de señalización del CD95L estimulada durante la muerte celular inducida por activación (AICD) en linfocitos T humanos. (1) Disminución de las concentraciones de ERO; (2) Disminución de las concentraciones de Ca2+; (3) inhibición de la expresión de Mn‐SOD; (4) inhibición de la fosforilación de JNK; (5) inhibición de la expresión de ARNm del gen CD95L; (6) inhibición de la AICD. RE: retículo endoplasmático. Como se ha mencionado, los resultados en otros modelos in vivo de inflamación complementan los hallazgos anteriormente expuestos ya que el ECAM inhibe el edema de la oreja inducido por ácido araquidónico y los ésteres de forbol (Garrido et a., 2004a), que exploran con cierta selectividad las vías de la lipooxigenasa (LOX) y la COX, respectivamente. Además, estudios bioquímicos adicionales en estos modelos demostraron una reducción sistémica del TNFα (Garrido et al., 2004b), el cual participa primariamente en el establecimiento de la hiperalgesia. La expresión de esta citocina pro‐inflamatoria favorece la liberación de IL‐1, IL‐6 e IL‐8, reduce el umbral de activación de fibras C, induce la liberación de neuropéptidos como la sustancia P (SP) y el péptido relacionado al gen de la calcitonina (PRGC) y desencadena las vías dependientes de la COX, para la formación de prostaglandinas (García et al., 2001; Covey et al., 2002; Wood, 2005; Xu et al., 2006). Además, conjuntamente con el IFNγ, el TNFα amplifica la producción de aniones superóxido por los neutrófilos y la biosíntesis de NO, por aumento de la actividad de todas las isoformas de la NOS (Eliav et al., 2001; Zelenka et al., 2005). En los estudios in vitro (Garrido et al., 2004b), diseñados para profundizar en el mecanismo de acción de los efectos descritos anteriormente, el ECAM inhibió la producción de TNFα y NO en líneas celulares de macrófagos RAW264.7 y de manera interesante el mismo resultado fue observado en macrófagos residentes del SNC en microglia (células N9). En macrófagos murinos después de la estimulación con LPS e IFNγ redujo las concentraciones de iNOS y de su ARNm, así como de COX‐2 y su ARNm (sin efectos marcados sobre COX‐1), TNFα; así como PGE2, que posee un reconocido papel como mediador de la hiperalgesia (Kress, 2005), e IL‐ 1β. La IL‐1β es considerada una molécula muy importante en el desarrollo de la hiperalgesia inflamatoria, por sus mecanismos indirectos sobre la liberación de PG, la inducción de receptores de bradicinina y el aumento en las Rev. Farmacol. Chile (2012) 5(2): 74 concentraciones locales del factor de crecimiento nervioso (Eliav et al., 2001; Zelenka et al., 2005). Se ha documentado que el NO producido por la óxido nítrico sintasa neuronal (nNOS) y la iNOS, difunde fácilmente a través de las membranas celulares y viaja a neuronas vecinas, glias y a la terminal nerviosa presináptica, donde puede activar sistemas de segundos mensajeros, con el consiguiente aumento del GMPc que activaría a las proteínas cinasas dependientes de GMPc y estas favorecerían la liberación de glutamato (Vetter et al., 2001). Por otra parte, la PGE2 puede activar a la adenil ciclasa, vía receptor EP2, y aumentar las concentraciones de AMPc, el que activaría a sus proteínas cinasas dependientes, como la proteína cinasa A, la cual induce mayor liberación de glutamato (Lui & Lee, 2004). De esta forma, los procesos presinápticos y postsinápticos se retroalimentan y exageran la señal excitatoria en el CDE. Asimismo, existe una elevación de las concentraciones de PGD2, PGE2, PGF2α, de la COX‐2 y del ácido araquidónico en el SNC. También, existen evidencias en animales y humanos que confirman los efectos antihiperalgésicos centrales de los anti‐inflamatorios no esteroidales durante la inflamación o el daño nervioso (Shi et al., 2006). Estos antecedentes sugieren la posibilidad para la utilización terapéutica del ECAM en estos estados. La evidencia de que el ECAM previno la activación del NF‐ κB inducida por TNFα y que no afecta la expresión de IκB (Garrido et al., 2005), unificó y dio soporte a todos los resultados anteriores. El ECAM pudiera utilizarse en el tratamiento de las alteraciones del procesamiento nociceptivo con las consecuentes implicaciones beneficiosas sobre la inhibición de la cascada inflamatoria y la hiperalgesia. Estudios recientes in vitro (Lemus‐Molina et al., 2009) en oligodendrocitos y en neuronas (muchas de ellas son interneuronas inhibitorias) apoyan los efectos favorecedores en la prevención de la muerte neuronal excitotóxica inducida por receptores N‐metil‐D‐aspartato (NMDA) (Baymgärtner et al., 2002). En estos experimentos se observó una disminución de las concentraciones de glutamato, en presencia del extracto y su xantona aislada, que lo hacen menos biodisponible para la interacción con sus receptores, en especial el NMDA. Múltiples evidencias soportan la participación de la vía postsináptica receptor NMDA‐NO‐GMPc en el proceso de hiperexcitabilidad del CDE que promueve el establecimiento de los estados dolorosos crónicos (Gao et al., 2005, Xu et al., 2007). Además, se ha podido demostrar el decrecimiento de la muerte celular inducida por glutamato en cultivo de concentraciones neuronas, en presencia de submicromolares de MF, las cuales atenuaron la entrada 2+ de Ca mediada por receptores, el estrés oxidativo y la apoptosis (Gottlieb et al., 2006). MF disminuyó la generación de ERO y la pérdida neuronal en células de hipocampo CA1 de ratas que fueron sometidas a isquemia. Las ratas con isquemia y tratadas con MF tuvieron significativamente mejor comportamiento en tres pruebas de conducta dependientes de hipocampo en comparación con las ratas isquémicas no tratadas. En estos estudios (Ibarretxe et al., 2006), se utilizaron concentraciones nanomolares de MF, las que protegieron de forma parcial a los oligodendrocitos; así como a las neuronas corticales de un daño mediano, pero no de uno intenso mediado por receptores AMPA (alfa‐amino‐3‐hidroxi‐5‐metilisoxazol‐4‐ propionato). Además, MF atenuó la sobrecarga intracelular de Ca2+ subsiguiente a la activación de los receptores AMPA, un mecanismo que puede contribuir a sus propiedades neuroprotectoras. La Figura 4 resume los posibles blancos moleculares de acción del ECAM sobre el evento nociceptivo. Figura 4. Estímulos nociceptivos periféricos PKA GMPc Terminación nociceptiva C cinasa [Ca2+] AMPc GMPc AC GLUT GC EP2 ECAM PLA2 NMDA Neurona de proyección cuerno dorsal medular ECAM ECAM [Ca2+] AA iNOS PGE2 nNOS COX-2 NO ECAM Posibles blancos moleculares susceptibles al extracto de la corteza del árbol del mango (ECAM) en el dolor crónico. ECAM podría disminuir la liberación del glutamato (Glu) por la terminal nociceptiva a nivel del cuerno dorsal espinal (CDE); inhibir la activación de la óxido nítrico neuronal (nNOS) promovida por el aumento de las concentraciones del Ca2+ citosólico generado por la apertura del canal del receptor NMDA que aumenta la magnitud de la despolarización y por la activación de los receptores NK1 por la sustancia P (SP); activar la guanilato ciclasa, la cual aumenta las concentraciones de GMPc, cierra canales de K+ y activa cinasas dependientes de GMPc que promueven la liberación de Glu; inhibir la activación de la fosfolipasa A2 (PLA2) y la síntesis de metabolitos del ácido araquidónico (AA), en especial la PGE2 que en estas condiciones interactúa con receptores EP2 presinápticos que aumentan la actividad de adenilato ciclasa con la consiguiente formación de AMPc que activa la PKA, dependiente de AMPc, la cual también induce liberación de Glu; inhibir la síntesis o expresión de citocinas, la iNOS y la COX‐2 mediada por el NF‐κB; e inhibir la activación de NF‐κB. De esta manera ECAM podría inhibir la respuesta neuroinmune y la participación glial en la hiper‐ excitabilidad central. Rev. Farmacol. Chile (2012) 5(2): 75 ACTIVIDAD ANTI‐ALÉRGICA En un modelo preclínico de alergia inducida por un nemátodo (Trichinellas spiralis) en ratones se demostró el efecto antialérgico y antihelmíntico del ECAM y la MF, la reducción en suero de los anticuerpos IgE específicos, y la actividad inhibitoria sobre la desgranulación de las células mastoides, evaluado mediante ensayos de anafilaxia pasiva cutánea (García et al 2003b). Otros estudios permitieron comprobar con mayor claridad el efecto del ECAM y la MF, sobre diferentes parámetros de la respuesta alérgica, como la producción de IgE, la respuesta anafiláctica, la respuesta cutánea al incremento de la permeabilidad vascular inducida por histamina y OVA, la liberación de histamina de células mastocitarias, mediante un modelo de inflamación alérgica inducido por ovoalbúmina (OVA). Ambos productos demostraron una reducción significativa del edema plantar en un modelo in vivo de inflamación alérgica mediada por mastocitos y la proliferación linfocitaria en respuesta a la OVA en ratones inmunizados. Tanto ECAM como MF inhibieron la liberación de histamina inducida por 48/80 en los mastocitos peritoneales de ratas (García et al., 2006). Además, con el objetivo de estudiar los efectos del ECAM y la MF sobre la respuesta a la inflamación pulmonar y la producción de citocinas Th2 se desarrolló un modelo de asma alérgica inducida por OVA en ratones (García‐Rivera et al., 2011). Tanto ECAM como MF produjeron una marcada reducción de la inflamación de las vías aéreas alrededor de los vasos y los bronquios, inhibieron las citocinas IL‐4 e IL‐5 en el fluido broncoalveolar, las concentraciones de IgE y la proliferación de linfocitos. Estos resultados experimentales demostraron las propiedades antialérgicas del ECAM y la MF, como consecuencia de la inhibición de mediadores como la IgE, la histamina y de la capacidad de los linfocitos B y T para contribuir a la respuesta alérgica. EFECTOS PROTECTORES SOBRE LA MOLÉCULA DE ADN (ESTUDIOS DE ANTIMUTAGÉNESIS Y ANTIGENOTOXICIDAD) El potencial antimutagénico de ECAM fue realizado tanto in vitro como ex vivo mediante el ensayo de Ames. En el ensayo in vitro se evaluó la protección del ECAM frente a diferentes compuestos con reconocida actividad mutagénica. Por otro lado, en el estudio ex vivo los animales fueron tratados durante 30 días con dosis orales del ECAM y, a partir de estos animales, se obtuvo la fracción microsomal hepática empleada como activador metabólico en el ensayo de Ames (Morffi et al., 2012). Como resultado de estos estudios se demostró que el ECAM presentó actividad antimutagénica frente a diferentes mutágenos a los cuales se expone comúnmente el hombre (bleomicina, ciclofosfamida, mitomicina C, cisplatino, dimetilnitrosamina, benzo(a)pireno, 2‐ acetilaminofluoreno, azida sódica, ácido picrolínico y 1‐ nitropireno). Además, el ECAM inhibió la actividad microsomal de CYP1A1, por lo que los autores manifestaron que, además de la potente actividad antioxidante que presenta el extracto, éste pudiera ejercer su efecto quimiopreventivo debido a su capacidad de inhibir la actividad de algunas isoformas del citocromo P450. Además, en un estudio in vivo en el que se evaluaron los efectos de ECAM sobre el daño al ADN inducido por la bleomicina (Ensayo Cometa) en ratones NMRI, se demostró que la administración del ECAM durante siete días protegió del daño primario al ADN (Cancino et al., 2001). El efecto radioprotector del ECAM frente a la radiación gamma también ha sido evaluado (Rosario‐Fernández et al., 2010). En esta ocasión se utilizó el ensayo bacteriano SOS Chromotest (dosis de radiación de 150 Gy), así como se evaluó la peroxidación lipídica y la actividad enzimática mitocondrial en eritrocitos (dosis de radiación 250 Gy), que son las células más afectadas durante las sesiones de radioterapia. El ensayo SOS Chromotest indicó que el extracto no fue genotóxico en presencia o no de activación metabólica. Además, se determinó que el ECAM presenta actividad radioprotectora del material genético. Los autores afirmaron que estos resultados demuestran que el extracto es capaz de proteger la estructura celular de los daños inducidos por la radiación gamma a varios niveles: material nuclear, membranas celulares y sistemas enzimáticos mitocondriales. Posiblemente, la MF sea la responsable de la radioprotección demostrada por el extracto, por lo que se diseñó un estudio en el que los ratones se trataron con diferentes dosis de MF, una hora antes de la administración de 10 Gy de radiaciones gamma. La xantona redujo los síntomas de la enfermedad por irradiación y demoró la aparición de la mortalidad comparado con el grupo no tratado e irradiado (Jagetia & Baliga, 2005). La acción radioprotectora de la MF se incrementó de manera dependiente de la dosis hasta 2 mg/kg y declinó posteriormente hasta 100 mg/kg (dosis máxima utilizada). También se calculó la dosis letal 50 (DL50) para este polifenol, la cual alcanzó los 400 mg/kg p.c. De esta forma MF protegió a los ratones de la enfermedad y la muerte inducidas por irradiación con una dosis protectiva óptima de 2 mg/kg, la cual constituyó 1/200 de la DL50. Asimismo, MF ha sido estudiada por su capacidad para reducir la frecuencia de células binucleadas‐ micronucleadas inducidas por radiación en linfocitos de sangre periférica humana (Jagetia & Venkatesha, 2005). MF elevó, de forma significativa, el índice de proliferación de las células irradiadas y redujo la peroxidación lipídica inducida por H2O2 de modo dependiente de la concentración. De la misma manera, en un sistema libre de células, MF inhibió la inducción de los radicales hidroxilo, superóxido, DPPH y ABTS. Por tanto, se demostró que MF Rev. Farmacol. Chile (2012) 5(2): 76 posee propiedades radioprotectoras al suprimir los efectos de los radicales libres que se inducen durante las radiaciones. Por otra parte, el arsénico (As) altera múltiples vías celulares que incluyen la expresión de factores de crecimiento, la supresión de proteínas checkpoint del ciclo celular, promoción y resistencia a la apoptosis, la inhibición de la reparación del ADN, las alteraciones en la metilación del ADN, disminución de la inmunovigilancia, y el aumento de estrés oxidativo, por la alteración del equilibrio prooxidante‐antioxidante (Flora, 2011). Teniendo en cuenta las acciones demostradas tanto para ECAM como MF, sobre el estrés oxidativo y su posible protección contra el daño inducido por As, se diseñó un estudio en el que fueron analizados los posibles efectos protectores del extracto y algunos de sus derivados fenólicos (ácido gálico, catequina, quercetina y MF) sobre la citotoxicidad inducida por arsénico (As3+) en la línea celular de túbulo proximal renal HK‐2 (Garrido et al., 2012). En células cultivadas durante 24 h en presencia de As3+, ocurrió una pérdida de la viabilidad celular, dependiente de la concentración, que fue significativamente recuperada por ECAM, seguido de ácido gálico, catequina y MF. El 3+ complejo mangiferina‐Fe demostró ser más eficaz ante dicha problemática que MF sola. Tanto ECAM como los fenoles aumentaron significativamente la fracción de células supervivientes. En las células pretratadas con ECAM o fenoles durante 72 h, la protección conferida por ECAM resultó disminuida en comparación con los experimentos más cortos (24 h). Las células pretratadas con una cantidad sub‐citotóxica de As3+ o cultivadas en presencia continua de baja concentración de MF demostraron ser más 3+ resistentes a As y mostraron un incremento tanto en la cantidad de P‐gp como del ARNm de ABCB1, mientras que las células cultivadas en presencia de albúmina resultaron más sensible. Los autores manifiestan que, debido a que todos los cambios anteriores comparten condiciones con la expresión‐actividad de glicoproteína P (P‐gp), un transportador potencialmente implicado en la resistencia a arsénico, la capacidad de ECAM y sus fenoles para modular 3+ la citotoxicidad inducida por As sería, al menos en parte, dependiente de sus interacciones con P‐gp. ACTIVIDAD ANTICANCERÍGENA Existen reportes en la literatura relacionados con la actividad anticancerígena de extractos de mango que demuestran especificidad celular, aunque pocos que relacionen al ECAM con esta actividad a pesar que el extracto se utiliza en Cuba, desde el punto de vista etnomédico, para el tratamiento del cáncer (Guevara‐ García et al., 2004). Una posible validación de este uso la ha realizado un grupo de investigadores (Delgado‐ Hernández et al., 2012) que evaluaron tanto al ECAM como a la MF en modelos de angiogénesis, teniendo en cuenta que los procesos angiogénicos son esenciales para el crecimiento y la proliferación tumoral (De la Vega et al., 2012). ECAM y MF se evaluaron en dos ensayos antiproliferativos de células endoteliales y tres modelos in vitro de angiogénesis humana como son los explantes de vasos sanguíneos de placenta humana, el gel sobre gel (gel‐over‐gel, tipo sándwich) y ensayos en Matrigel. Tanto el extracto como la xantona inhibieron la formación de tubos capilares en los dos primeros ensayos, mientras que MF abolió la neovascularización en el ensayo tipo sándwich. Ambos productos redujeron la producción de TNFα y la angiogénesis inducida en células B16F10 en un modelo de angiogénesis inducida en Matrigel en ratones. Por otra parte, otros extractos de mango han mostrado protección contra cáncer de próstata en modelos in vivo e in vitro (Prasad et al, 2008) e inhibición del ciclo celular en la fase G0/G1 de células HL‐60 (Percival et al., 2006), mientras que no han sido efectivos contra células de cáncer de mama MCF‐7 (García‐Solís et al., 2009). Posiblemente, la MF o el lupeol (triterpeno), presentes en estos extractos, sean los responsables de esta actividad. La MF ha mostrado protección contra cáncer de pulmón inducido por benzo(a)pireno en ratones (Rajendran et al., 2008b), lo que podría estar relacionado con la inducción de la permeabilidad mitocondrial (Pardo‐Andreu et al., 2006c). Por otra parte, en un estudio a corto plazo, la MF administrada en la dieta de las ratas inhibió el desarrollo de lesiones pre‐neoplásicas inducidas por el carcinógeno azoximetano (Yoshimi et al., 2001). En un estudio a largo plazo tuvo baja incidencia sobre la multiplicidad de la neoplasia intestinal inducida por dicho carcinógeno. Además, la proliferación celular en la mucosa del colon fue reducida en las ratas tratadas con esta xantona. Estos experimentos sugieren que MF constituye un potencial agente quimiopreventivo. En otros estudios, MF tuvo una actividad inhibitoria del crecimiento de fibrosarcoma ascítico en ratones (Guha et al., 1996). Mediante tratamientos con MF, tanto in vivo como in vitro, aumentó la citotoxicidad contra células esplénicas y macrófagos de ratones normales y con tumores implantados. El tratamiento in vitro con MF de las células esplénicas de ratones a los que se les implantó el tumor aumentó la citotoxicidad de estas células tumorales, tanto en aquellas sensibles como en las resistentes a células naturales asesinas (NK). De la misma manera, la administración de MF protegió a células N2A (línea celular de neuroblastoma murino) contra la citotoxicidad inducida por MPP+ (el metabolito activo de 1‐metil‐4‐fenil‐1,2,3,6‐tetrahidropiridina), el cual induce síndrome parkinsoniano en animales y humanos a través de un mecanismo de neurotoxicidad comprometido con el estrés oxidativo (Amazzal et al., 2007). MF restauró el contenido de GSH y reguló la expresión del ARNm de la superóxido dismutasa y la catalasa, por lo que los autores Rev. Farmacol. Chile (2012) 5(2): 77 plantearon que la MF podría utilizarse en la terapia de enfermedades neurodegenerativas, tales como el Parkinson, en las cuales el estrés oxidativo desempeña un papel crucial. Por otra parte, los terpenoides, como el lupeol y otros relacionados también ejercen una variedad de actividades citotóxicas contra varios tipos de células tumorales como el melanoma murino B16 2F2, leucemia HL‐60, U937, K562, melanoma G36, carcinoma de pulmón humano A‐549 y adenocarcinoma de colon humano DLD‐1 (Chaturvedi et al., 2008), así como en modelos in vivo como la carcinogénesis bucal inducida por 7,12‐ dimetilbenz(a)antraceno en el cachete del hámster (Palanimuthu et al., 2012). Probablemente, el potencial quimiopreventivo del lupeol radica en su actividad antioxidante y secuestradora de radicales libres y moduladora de los posibles efectos sobre las enzimas metabolizadoras de xenobióticos de fases I y II a favor de la excreción de metabolitos carcinogénicos. Además, esta molécula es capaz de actuar sobre otros mediadores moleculares involucrados en esta patología como son: el factor NF‐κB, las enzimas glutatión S‐transferasa, glutatión reductasa, COX‐2, metaloproteinasa de matriz 2 y catalasa, receptor andrógeno, proteína cinasa C alfa, forma celular de la proteína inhibitoria FLICE (cFLIP), receptor de muerte 3 (DR3), entre otros (Siddique & Saleem, 2011). Por otra parte, los ácidos fenólicos como el ácido gálico, que también se han reportado en los extractos de mango (Núñez‐Sellés et al., 2002), han mostrado inhibición del crecimiento celular en líneas celulares humanas de esófago, gástrica, cérvix, mama (MCF‐7), colon (HT‐29, Col201) y murinas como Colon 26 (Faried et al., 2007). De la misma forma, se sabe que los galotaninos presentan actividad contra el cáncer de colon (células T‐84 y HCT‐116) (Gali‐Mahtasib et al., 2001; Oh et al., 2001; Chen & et al., 2003; Chen & Lin, 2004; Al‐Ayyoubi & Gali‐Muhtasib, 2007), células de cáncer de mama (MCF‐7), así como en células T Jurkat (Chen & et al., 2003; Chen & Lin, 2004). ACTIVIDAD SOBRE CITOCROMO P450 Y GLICOPROTEÍNA P. POSIBILIDADES DE INTERACCIÓN CON FÁRMACOS El metabolismo de los fármacos es el mayor determinante del aclaramiento de los medicamentos, las diferencias individuales en la farmacocinética e, indirectamente, la eficacia clínica y la toxicidad de los fármacos. La industria farmacéutica está llamada a comercializar los fármacos más seguros con pocos efectos adversos, propiedades farmacocinéticas predecibles e interacciones cuantificables fármaco‐fármaco, fármaco‐producto herbal o fármaco‐ alimento. El riesgo potencial de las interacciones entre derivados de plantas y fármacos es de particular interés en la actualidad, justamente por el incremento del uso de los primeros. De esta forma, los hepatocitos representan el modelo más apropiado para la evaluación del metabolismo integrado de fármacos, productos herbales o alimentos, las correlaciones metabolismo‐toxicidad, mecanismos de hepatotoxicidad y las interacciones (inhibición e inducción) de xenobióticos y enzimas que metabolizan fármacos. También son más rentables los estudios del perfil y la tasa metabólicas, la identificación de los citocromos P450 involucrados, las interacciones potenciales fármaco‐ fármaco o el papel de las enzimas polimórficas antes del inicio de los ensayos clínicos (Gómez‐Lechón et al., 2010). Estudios recientes (Rodeiro et al., 2008a,b) demostraron que la incubación del ECAM con las células hepáticas no modificó la actividad de diferentes citocromos del sistema del CYP‐450 (CYP3A, 2E, 2D6, 2B6, 2C9 y 2C19). Sólo se observó una inhibición significativa, dependiente de la concentración del CYP1A1/2, lo que se puede considerar como un resultado que puede fundamentar una posible actividad quimiopreventiva del ECAM, ya que este citocromo ha sido asociado con la activación de diferentes mutágenos y carcinógenos en el organismo. Además, el ECAM provocó una inducción dos veces mayor de la actividad del CYP2B6 en este sistema celular. Mientras que en otro estudio (Rodeiro et al., 2012) se examinaron los efectos del ECAM y la MF sobre varias enzimas P450 y UDP‐glucuronosiltransferasas (UGTs) en hepatocitos humanos cultivados en el que se observó una disminución, dependiente de la concentración de ambos productos, de la actividad de las cinco enzimas P450 medidas (CYP1A2, 2A6, 2C9, 2D6 y 3A4). Para todas las actividades se observó una reducción de al menos 50% a la concentración más alta (250 mg/mL). Además, el ECAM redujo considerablemente la actividad UGT1A9 (alrededor de 60% a 250 mg/mL) y tuvo menos efectos sobre las otras UGTs. En contraste, MF (250 mg/mL) tuvo efectos mayores sobre UGT1A1 y 2B7 que sobre UGT1A9 (aproximadamente 55% frente a 35% de reducción, respectivamente). La cuantificación de ARNm específicos reveló una reducción en el contenido de ARNm de los CYP3A4 y 3A5, y un aumento de los ARNms de CYP1A1, CYP1A2, UGT1A1 y UGT1A9. No fueron observados efectos notables en las concentraciones de CYP2A6, 2B6, 2C9, 2C19, 2D6 y 2E1. Los autores sugirieron que la actividad y(o) expresión de las principales enzimas P450 y UGT es modulada por el ECAM y que pudieran surgir interacciones potenciales con fármacos después de una ingesta combinada de este extracto con los fármacos convencionales. Por lo tanto, si bien es cierto que no siempre se manifiestan estas posibles interacciones cuando se pasa de modelos in vitro a in vivo, deben ser examinados los riesgos potenciales de seguridad del ECAM cuando se co‐administre con otros fármacos. Por otra parte, muchos compuestos derivados de plantas, incluyendo los polifenoles, son capaces de afectar la función de MDR‐1/glicoproteína P (P‐gp ABCB1) transportador de múltiples fármacos, lo que conduce a posibles interacciones hierba‐fármaco (Chieli & Romiti, 2008). Por ello, se realizó un estudio para evaluar los efectos de ECAM y algunos fenoles presentes en él sobre la Rev. Farmacol. Chile (2012) 5(2): 78 actividad de P‐gp en una línea celular de túbulo proximal HK‐2, en una sub‐línea celular Caco‐2 (seleccionada por su resistencia a vincristina, Caco‐2/VCR) y la sobreexpresión de P‐gp (Chieli et al., 2009). Todos los compuestos investigados, a excepción de catequina y ácido gálico, inhibieron la actividad de P‐gp en células HK‐2, en el orden de mangiferina <noratiriol <quercetina <ECAM. Efectos similares se obtuvieron en células Caco‐2/VCR resistentes, pero fueron insignificantes en los de tipo salvaje, expresando bajas cantidades de P‐gp. Para profundizar en el mecanismo por el cual ocurre esta inhibición se realizó un estudio en el que se determinó la capacidad potencial de los compuestos en estudio sobre el gen ABCB1 y la expresión de P‐gp en las células HK‐2 que expresan constitutivamente este transportador (Chieli et al., 2010). Mediante western blot se demostró que hubo una disminución dependiente de la concentración de P‐gp en células cultivadas en presencia de ECAM durante 72 h. El ácido gálico y la quercetina también disminuyeron las concentraciones de P‐gp a todas las concentraciones estudiadas, mientras que la catequina fue casi ineficaz. Sin embargo, en las células expuestas a MF la cantidad de P‐gp mostró un incremento dependiente de la concentración y del tiempo, por lo que fue dos veces mayor que los controles después de 72 h. También, noratiriol indujo P‐gp a bajas concentraciones pero el efecto disminuyó a concentraciones superiores. Los cambios en la cantidad de proteína P‐gp se correlacionaron con cambios relativos en el contenido de ARNm de ABCB1 y con la actividad de flujo de salida del transportador. El inhibidor transcripcional 1‐ d‐ribofuranosilbenzimidazole (DRB) inhibió el aumento de la expresión de ABCB1 inducido por MF, lo que sugiere que el aumento podría ser debido a la regulación transcripcional del ARNm de ABCB1. Las células tratadas con MF, que sobreexpresaron el transportador, estaban protegidas frente a la citotoxicidad de ciclosporina A, un sustrato conocido de la P‐gp. El efecto protector también se observó en las células pretratadas con ECAM. Estos resultados demuestran que ECAM y los polifenoles presentes en él también pueden interactuar con ABCB1/P‐ gp a nivel de expresión. Estos resultados demostraron, por primera vez, que ECAM y los polifenoles presentes en el extracto pueden afectar a la actividad del transportador de múltiples fármacos P‐gp ABCB1, lo que sugiere la posibilidad de interacciones hierba‐fármaco que debían ser estudiadas en profundidad, fundamentalmente en modelos in vivo. EVIDENCIAS TOXICOLÓGICAS Estudios de Toxicidad Estudios, realizados en roedores (ratas y ratones), demostraron que el ECAM es un producto que clasifica como No tóxico cuando se administra por dosis única por las vías oral (DL50 > 5000 mg/kg p.c.) y tópica (DL50 > 2000 mg/kg p.c) (Garrido et al., 2009). Mientras que la toxicidad por dosis única, vía intraperitoneal (i.p.), en ratas permitió clasificar al producto como Tóxico, con una toxicidad diferencial entre los sexos, de modo tal que mientras la DL50 en las hembras fue de 166,48 mg/kg p.c en los machos fue > 500 mg/kg p.c., lo que indica que las hembras son más sensibles al producto bajo estas condiciones experimentales. El estudio en ratones demostró que la DL50 para las hembras fue de 273,14 mg/kg y en los machos de 219,67 mg/kg, sin mostrar, en este caso, diferencia entre los sexos. En estos ensayos los síntomas clínicos detectados seguidos a la administración de ECAM fueron consistentes con la clasificación del producto. Estudios de Genotoxicidad El potencial mutagénico y genotóxico del ECAM se realizó mediante una batería de pruebas que incluyeron los estudios propuestos comúnmente por las agencias nacionales e internacionales para investigar los efectos tóxicos del producto de ensayo sobre el material genético. El ECAM fue evaluado en el ensayo de Ames con el empleo de las cepas TA 1535, TA 1537, TA 1538, TA 98 y TA 100, en presencia y ausencia de activación metabólica, pero éste no indujo efecto mutagénico hasta concentraciones de 5 000 μg/placa, límite máximo de evaluación propuesto para este ensayo (Rodeiro et al., 2006). El potencial genotóxico in vivo del ECAM fue determinado por la administración por vía oral (20 ‐ 2 000 mg/kg p.c.) a ratones NMRI de ambos sexos. En este estudio de detección de daño primario al ADN no existieron evidencias de toxicidad en el hígado, principal órgano que ha sido demostrado metaboliza la mayoría de los compuestos presentes en el extracto como son los polifenoles, los terpenos y los ácidos grasos (Walle, 2004). A diferencia de lo observado in vitro, el ECAM no indujo daño primario al ADN en leucocitos de sangre periférica, ni en células hepáticas de los animales tratados, a pesar de la dosis máxima utilizada, límite máximo aceptado para este tipo de ensayos. Tampoco se observaron efectos genotóxicos cuando el ECAM se administró por vía i.p. (50 ‐ 200 mg/kg), lo que demostró que tampoco induce daño primario al ADN en leucocitos de sangre periférica, ni en células hepáticas de ratones NMRI de ambos sexos por esta vía de administración, bajo esas condiciones de ensayo (González et al., 2007). El estudio de los efectos del ECAM sobre la inducción de micronúcleos fue realizado en linfocitos humanos de sangre periférica en el que se demostró que el extracto presentó un efecto citotóxico a la concentración máxima ensayada (1 500 μg/mL), pero no indujo clastogenicidad en el rango de concentraciones estudiado (150 ‐ 1 500 μg/mL) después de 3 y 20 h de exposición, en presencia y ausencia de activación metabólica, respectivamente (Rodeiro et al., 2006). En los estudios realizados in vivo se corroboró que el ECAM, administrado por vía oral produjo una ligera citotoxicidad a la dosis máxima evaluada (2 000 mg/kg Rev. Farmacol. Chile (2012) 5(2): 79 p.c.). Este evento no presentó repercusión clínica para los animales en el estudio y puede interpretarse como un indicador de evidencias de exposición del órgano diana. Al analizar la frecuencia de MN no existió relación con la dosis de ECAM administrada, por lo que es posible afirmar que, de igual manera que en los ensayos in vitro, el extracto no indujo clastogenicidad a nivel de la médula ósea de ratones NMRI, por lo que el nivel de dosis al que no se observan efectos adversos (NOAEL), bajo estas condiciones de ensayo, fue 2 000 mg/kg/día (González et al., 2007). En adición, la administración i.p. de ECAM (50 ‐ 200 mg/kg) a ratones NMRI de ambos sexos indujo una citotoxicidad moderada sobre el proceso de eritropoyesis a nivel de la médula ósea, pero no sobre los leucocitos de sangre periférica de los animales tratados con el producto y tampoco indujo clastogenicidad en la médula ósea, por lo que el NOAEL en este ensayo fue de 200 mg/kg/día. De manera general, puede apreciarse que no existe relación entre las dosis de ECAM administradas en los estudios realizados y la frecuencia de micronúcleos observada, ni tampoco en la respuesta de daño primario al ADN y el porcentaje de nucleoides altamente dañados en los leucocitos de los animales tratados, lo que soporta la hipótesis que la inducción de daño primario observada, in vitro en el ensayo Cometa, pudiera estar relacionada con la generación de H2O2 en las condiciones de incubación empleadas. La ausencia de genotoxicidad in vivo coinciden, además, con lo observado para otros polifenoles como la quercetina (Metodiewa et al., 1999) y la estrecha relación entre el ambiente redox y la actividad genotóxica descrita para algunos polifenoles (Skibola & Smith, 2000; Collins, 2005). De acuerdo a estos resultados, los autores sugirieron que el ECAM presenta un bajo potencial mutagénico y genotóxico in vitro y no es genotóxico in vivo. Estudios de Teratogénesis El potencial teratogénico y(o) embriotóxico del ECAM, administrado por vía oral, fue ensayado durante la organogénesis de ratas Sprague‐Dawley, período de mayor susceptibilidad para la producción de perturbaciones en la morfogénesis normal de los órganos y tejidos del embrión. El ECAM no produjo muertes maternas ni signos clínicos relevantes en los diferentes grupos de tratamiento. Los análisis estadísticos del consumo de alimentos y los incrementos de peso materno durante la gestación no evidenciaron diferencias significativas entre los animales del grupo control y los administrados con ECAM. En relación con los efectos del extracto sobre el desarrollo embrionario, no se obtuvo un incremento de las muertes en útero, retardo en el crecimiento, ni teratogenicidad. El número de madres con fetos no viables y el tamaño de la camada no mostraron diferencias estadísticamente significativas entre las madres administradas con ECAM y las controles. Tampoco las pérdidas post‐implantación (reabsorciones embrionarias como las muertes fetales) ni el peso de los fetos difirieron de forma significativa entre esos grupos. El análisis de los esqueletos no evidenció malformaciones en el grupo de control, ni en los grupos tratados (González et al., 2007). De acuerdo a estos resultados, el ECAM no es un agente inductor de aberraciones cromosómicas que no provoca alteraciones en la división celular, ni inducción de apoptosis a un nivel tal que cause embriotoxicidad en las condiciones experimentales expuestas, por lo que su NOAEL fue de 2 000 mg/kg/día. En estos estudios el ECAM presentó un bajo potencial teratogénico; sin embrago, es necesario enfatizar que la demostración de la inocuidad de un producto sobre el proceso de la reproducción involucra no sólo la evaluación de su potencial teratogénico, también involucra el estudio de sus posibles efectos sobre otros indicadores como son: el ciclo estral, la conducta en el apareo, la fertilidad, y el desarrollo pre y postnatal de las crías (incluidos los estudios sobre la descendencia) y una evaluación de su función reproductora, lo que permitiría, unido a sus propiedades farmacológicas, definir su posible utilización en mujeres gestantes y niños. Otros estudios toxicológicos Los estudios de irritabilidad, tanto del ECAM como de las ® formulaciones Vimang , demostraron que se está en presencia de un producto que clasifica como No Irritante por vía oral, tópica, rectal, vaginal y ocular (Garrido et al., 2009). El resumen de los resultados de los estudios toxicológicos realizados al ECAM se muestra en la Figura 5. EVIDENCIAS DE FARMACOLOGÍA CLÍNICA Teniendo en cuenta la efectividad demostrada por el ECAM en el tratamiento y(o) prevención de enfermedades humanas asociadas al estrés oxidativo, inflamación y dolor, sustentada por modelos in vitro e in vivo, así como del conocimiento el perfil toxicológico del extracto, se reportan también los estudios sobre la tecnología química (Acosta‐Esquijarosa et al., 2009a,b, 2010; Nuevas‐Paz et al., 2012) y farmacéutica (Arús‐Pampin et al., 2003; Lemus‐ Rodríguez et al., 2006) que no sólo facilitaron la realización de los ensayos anteriores, también permitieron obtener las diferentes formulaciones que se usarían en la realización de los estudios clínicos (Núñez‐Selles et al., 2007c). Ensayo clínico aleatorizado, a doble ciego, para medir el efecto sobre los indicadores séricos de estrés oxidativo y la calidad de vida en el adulto mayor en la Atención Primaria de Salud. Rev. Farmacol. Chile (2012) 5(2): 80 El objetivo del estudio (Pardo‐Andreu et al., 2006d) fue evaluar la mejoría de la calidad de vida mediante la ® suplementación con Vimang en el Adulto Mayor en la Atención Primaria de Salud, de forma ambulatoria, para lo cual se incluyeron 31 adultos mayores de 65 años, aparentemente sanos (Grupo 1), de forma aleatorizada, a ® los cuales se les suministró Vimang (tableta, 300 mg, tres veces al día) y se controlaron siete parámetros del estrés oxidativo: la capacidad total antioxidante sérica (CTA), GSH (peroxidasa, reducido y total), sustancias reactivas al ácido tiobarbitúrico (TBARS), superóxido dismutasa (SOD) y potencial de peroxidación (PP). Los resultados de la evolución del estrés oxidativo en este grupo se compararon con los de un grupo de 30 adultos no ® suplementados con Vimang (Grupo 2) y un grupo de 30 jóvenes sanos (Grupo 3), con edades entre 25 y 30 años a quienes se le realizaron las mismas determinaciones. Al Grupo 1 se le aplicó el Cuestionario de Salud SF‐36, validado internacionalmente para evaluar la calidad de vida, que contempla nueve funciones: Función física, Rol físico, Rol social, Dolor corporal, Salud general, Vitalidad, Rol emocional y Salud mental. Las determinaciones se realizaron a los tiempos cero (inicio del ensayo), 15, 30 y 60 (final del ensayo) días. Figura 5. 9 NO TÓ XICO 9 NO TÓXICO (oral, 90 días, ratas) Dosis 2 000 m g/kg 9 NO TÓXICO (oral, 180 días, ratas) Dosis 2 000 m g/kg (oral y tópica) 9 TÓXICO (i.p) (ratas y ratones) SUB-CRÓNICOS CRÓNICOS AGUDOS ECAM IRRITABILIDAD TERATOGÉNESIS GENOTOXICIDAD 9 NO TERATOGÉNICO (oral, ratas) Dosis 2 000 m g/kg 9 NO GENOTÓXICO in vivo (oral, i.p., ratones) Dosis 150 m g/kg (i.p.) 2 000 m g/kg (oral) 9 9 NO IRRITANTE (piel, recto y ojos) IRRITABILIDAD MÍNIMA (vagina) Conejos Resumen de los estudios toxicológicos realizados al extracto de la corteza del árbol del mango (ECAM). Rev. Farmacol. Chile (2012) 5(2): 81 La suplementación con Vimang® modificó en el Grupo 1, de forma significativa, cuatro de los siete marcadores del estrés oxidativo evaluados, al ser comparados con el grupo ® control (Grupo 2) no suplementado con Vimang a los 60 días de tratamiento: incrementó la actividad de la SOD extracelular y la CTA; al mismo tiempo redujo las concentraciones de TBARS y de glutatión oxidado (GSSG). Fue significativo que los valores de esos marcadores del estrés oxidativo en el grupo tratado alcanzaron los mismos valores que el Grupo 3 (jóvenes entre 25 y 30 años). Con relación a la evaluación de la calidad de vida, la ® suplementación con Vimang mejoró la autopercepción de la salud en los adultos tratados en ocho de los nueve parámetros evaluados del Cuestionario SF‐36. Lo más significativo de esta evaluación fue la mejoría en el parámetro “Dolor corporal”. Dicho parámetro fue el primero que mostró una diferencia significativa, a los 15 días de iniciado el tratamiento, y tuvo la mayor diferencia al final del ensayo de todos los parámetros evaluados. Sólo un parámetro del Cuestionario SF‐36 (“Rol emocional”) no mostró una diferencia significativa al término del estudio. Los autores manifestaron que la reducción del estrés oxidativo en el adulto mayor, mediante la suplementación con Vimang® implicó una mejoría de la calidad de vida, reflejado, sobre todo, en el alivio de los dolores corporales, una mayor autopercepción de mejoría en el estado general de salud y un desempeño superior de la actividad física. Ensayo clínico aleatorizado, a doble ciego y controlado, para determinar el efecto sobre marcadores de estrés oxidativo y la progresión de la enfermedad VIH‐SIDA. El objetivo de este estudio fue evaluar la evolución del estrés oxidativo en pacientes seropositivos VIH en condiciones de atención sanatorial y dieta controlada y su efecto en la progresión de los marcadores inmunológicos de la enfermedad y la evolución clínica de los pacientes (Gil del Valle et al., 2002; Pérez et al., 2003). Para ello, se diseñó un ensayo clínico aleatorizado, a doble ciego y controlado, en el que se evaluó el efecto de las tabletas Vimang® (ocho tabletas de 300 mg, diarias durante seis meses) vs. placebo. Al finalizar el ensayo se pudo evaluar el comportamiento de 68 sujetos: 36 suplementados con ® tabletas Vimang y 32 que recibieron placebo en los que se evaluaron variables de estrés oxidativo, hemoquímicas, inmunológicas y nutricionales. Estos resultados se compararon con los obtenidos para un grupo de seronegativos (28 sujetos). El grupo suplementado con las tabletas Vimang® tuvo un incremento en plasma de TAS (Total Antioxidant Status), GSH y GPx y una reducción en el potencial de peroxidación, MDA, hidroperóxidos totales en plasma, porcentaje de fragmentación del ADN y SOD. Todas estas variables tuvieron una diferencia estadísticamente significativa respecto al grupo placebo. La mejoría en el estado redox en el grupo suplementado con Vimang® fue del 56,3% con relación al 3,7% del grupo placebo. No hubo diferencias significativas en las variables hemoquímicas y no se observaron efectos tóxicos a nivel plasmático, renal, ni hepático. De las siete variables estudiadas, tres mostraron tendencia a la disminución: eritrosedimentación, transaminasa y ácido úrico. Tampoco se detectaron diferencias significativas entre el conteo de CD4 y CD8/CD38 del grupo tratado respecto al grupo placebo y hubo una tendencia hacia la reducción en el receptor de CD95, aunque no se observó diferencia estadísticamente significativa (p=0,08). En este ensayo, la dieta fue controlada y monitoreada para ambos grupos. El índice nutricional de la ingesta de macro y micronutrientes durante el período de ensayo no mostró diferencias significativas entre los grupos. El aporte de nutrientes dentro de la dieta se mantuvo estable durante el tiempo del estudio, por lo que los autores aseguraron que los resultados sólo se pueden adscribir al efecto del tratamiento. Estos no detectaron reacciones adversas en el ® grupo suplementado con las tabletas Vimang . Reporte de casos en asma bronquial. Estudios recientes han mostrado evidencias de que las ERO producidas por las células inflamatorias de las vías aéreas desempeñan un papel esencial en la patogénesis del asma bronquial (Nadeem et al., 2003) y que decrece la capacidad endógena antioxidante en pacientes con esta patología (Bowler & Crapo, 2002). Por lo tanto, se administraron ® cápsulas Vimang (300 mg, tres veces al día antes de las comidas, durante 12 semanas) a dos pacientes con grados de asma diferentes (Álvarez‐León et al., 2009). El diagnóstico se estableció mediante interrogatorio, examen físico y confirmado por pruebas de ayuda en las que se demostró la presencia de obstrucción bronquial por espirometría basada en el cumplimiento del criterio de FEV1/FVC < 80%. El paciente I (femenina, 39 años) se diagnosticó como asma moderada persistente y el paciente II (masculino, 43 años) se diagnosticó como asma severa persistente. A estos pacientes también se les determinaron inmunoglobulina E (IgE) total en suero, proteína catiónica de eosinófilo (ECP) y la actividad de la metaloproteinasa‐9 (MMP‐9) a las 0, 6 y 12 semanas de tratamiento. Se pudo observar una disminución de la actividad enzimática de MMP‐9 de forma proporcional al tiempo de tratamiento en ambos pacientes. Un comportamiento similar se obtuvo también para la IgE y la ECP. Desde el punto de vista funcional, se logró el mismo comportamiento para el volumen expiratorio forzado (FEV1). Hubo una mejoría clínica evidente, dada por el espaciamiento de los síntomas diurnos (disnea, opresión torácica y sibilancia) y nocturnos (tos y sibilancia) a partir de la tercera semana de tratamiento. El paciente II no presentó síntomas agudos durante el estudio y tuvo necesidad de usar el salbutamol sólo dos veces (una vez a la segunda semana y otra a la quinta semana). Resultó significativo que ninguno de los Rev. Farmacol. Chile (2012) 5(2): 82 dos pacientes consumió esteroides durante las 12 semanas de tratamiento. Estudio piloto para determinar la eficacia en el tratamiento de afecciones dermatológicas de alta incidencia en la Atención Primaria de Salud. La piel, como órgano, no escapa a la acción deletérea que pueden ejercer las ERO a nivel subcelular, celular y tisular, cuando por la presencia de patógenos o por alteraciones de su fisiología, se rompe el equilibrio redox, toda vez que existe una íntima relación entre los procesos inflamatorios crónicos o agudos, el envejecimiento, el estrés oxidativo y la protección que ejercen los polifenoles (Afaq & Katiyar, 2011). Teniendo en cuenta estos antecedentes, se estudió la evolución clínica de 345 pacientes portadores de afecciones dermatológicas, atendidos en la Atención Primaria (Guevara et al., 2007) los que usaron la crema Vimang® 1,2%, tres veces al día, en las zonas lesionadas, con el fin de conocer datos que permitieran un diseño más adecuado y establecer su viabilidad en afecciones dermatológicas de alta frecuencia. En este estudio se siguió la evolución de 158 pacientes con patologías de etiología micótica. De ellos, 66 pacientes presentaron pitiriasis versicolor, 34 otras variedades de epidermofitosis, fundamentalmente en los pies; 34 presentaron intertrigo y 24 otras micosis que afectaban la piel y las mucosas ótica, nasal, bucal, vaginal o rectal. La evolución de las micosis, en general, tuvo una tendencia significativa en el 39,2% de los pacientes hacia la Remisión Completa (RC, desaparición de los síntomas y signos de la enfermedad en el curso del tratamiento, remisión completa de la crisis en el caso de afecciones crónicas) y en el 52,2% de ellos Remisión Parcial (RP, alivio significativo de los síntomas y signos de la enfermedad con reducción en más de un 70% de la extensión de las lesiones o regreso de los signos y síntomas a niveles inferiores a los del inicio de la consulta, en el caso de las afecciones crónicas), frente a un 9% de casos en que la afección tuvo una No Remisión (NR, mantenimiento de los signos y síntomas de la enfermedad iguales a los existentes al inicio de la consulta o reducción de la extensión de las lesiones en menos del 70%). Cada patología en particular evolucionó con la misma tendencia hacia la RC o RP. Este resultado podría atribuirse al efecto anti‐inflamatorio de la crema Vimang®. Las atopias y el eczema, como reacciones de hipersensibilidad, tuvieron una tendencia hacia la RC en no más de tres meses y sólo pocos casos evolucionaron hacia la cronicidad. En este estudio, también se siguieron 35 pacientes con dermatitis atópica, de los cuales 22 tuvieron ® RP, 10 RC y 3 NR con el empleo de la crema Vimang . Además, de los 21 pacientes con psoriasis 15 evolucionaron hacia una RP y de 10 pacientes con eczema, cinco evolucionaron hacia la RC. De modo general, el 59,1% de los pacientes con patologías dermatológicas de etiología inmunológica evolucionó hacia la RP, el 30,3% evolucionó hacia la RC y el 10,5% NR, lo cual se corresponde con las tendencias publicadas acerca de la evolución de estas patologías con el uso de esteroides. Existe, por tanto, la posibilidad de reducir o evitar el empleo de corticoesteroides en estas patologías, con un efecto económico y social muy beneficioso, por los efectos colaterales de este tipo de medicamentos. Por otra parte, en 27 pacientes con acné juvenil, 17 presentaron RP y 7 RC, para un 100% de mejoría en plazos de tratamiento que oscilaron entre los 25 y 60 días. De los 10 pacientes con piodermitis, cinco evolucionaron hacia RP y cuatro hacia RC, para un 90% de mejoría en esta patología. Todos los pacientes con herpes simplex y herpes zoster remitieron parcial o totalmente la enfermedad. Esto corrobora resultados anteriores en los que se demostró in vitro (Carballo et al., 2002), la actividad anti‐viral del ECAM frente al herpes simplex tipo 1 (HSV‐1), no así para el tipo 2 (HSV‐2), así como la evolución satisfactoria registrada en un reporte de caso de una paciente con Herpes zoster (Álvarez et al., 2002). En general, de 49 pacientes con afecciones de origen bacteriano o viral, el 63,3% evolucionó hacia RP y el 30,6% hacia RC, lo cual resultó elevado de forma significativa. En los trastornos de la pigmentación, las arrugas y las quemaduras se observó una evolución favorable hacia la RP o RC de las lesiones hipercrómicas e hipocrómicas (incluyendo el cloasma), en las que el origen es muy diverso y no existe medicación específica. En el caso de las arrugas, de 18 casos tratados, 15 tuvieron RP y 3 RC. De los 345 casos comprendidos en este estudio el 52,5% evolucionó hacia la RP, el 39,7% hacia la RC y el 7,8% NR. Los efectos adversos por la utilización de la crema fueron escasos y fundamentalmente se manifestaron en piel dañada. Los autores consideraron importante señalar que la terapéutica anti‐inflamatoria y antioxidante es inespecífica de estas patologías y puede accionar de modo facilitador sobre su evolución, por lo que los resultados expuestos deben ser interpretados en el sentido de confirmar el importante sustrato inflamatorio y de estrés oxidativo que puede existir en cualquier afección dermatológica o no, con independencia de su etiología. Reporte y serie de casos en el tratamiento del dolor. Hay algunas evidencias que involucran a TNFα en la sensibilización central (Garrido‐Suárez et al., 2010). Las concentraciones de esta citocina pro‐inflamatoria aumentan exponencialmente después de una lesión del nervio y su aplicación intra‐ciática en ratas produce descargas ectópicas en fibras C y Aβ, además, anticuerpos neutralizantes anti‐TNFα o inhibidores de la síntesis de TNFα alivian el dolor neuropático en la lesión de constricción crónica y modelos de ligadura del nervio siático (Zelenka et al., 2005). Rev. Farmacol. Chile (2012) 5(2): 83 Por otra parte, los ensayos clínicos han comenzado a demostrar que la inhibición de TNF alivia algunos tipos de dolor neuropático (Rajkumar et al., 2003). TNFα promueve la síntesis de la sustancia P (SP), la adenosina, péptidos relacionados con genes de la calcitonina y el factor de crecimiento nervioso (NGF), así como, modula genes implicados en la expresión de otras citocinas (IL‐1, IL‐2, IL ‐ 6, IL‐8 e IFNγ) e induce su síntesis. También, IL‐1β puede contribuir indirectamente al estado excitotóxico, a través de la liberación de NO, ERO, eicosanoides y glutamato. Del mismo modo, se ha reconocido que las ERO, el TNFα y la IL‐ 1 pueden inducir daño por inhibir la capacidad de las células gliales para eliminar el glutamato de la hendidura sináptica (De Leo, et al., 2006). Por tanto, las acciones del ECAM y la MF sobre la expresión de TNFα e IL‐1β, previamente demostradas (Garrido et al., 2004b; Leiro et al., 2004a,b), podrían explicar el efecto antialodínico y la disminución de la frecuencia de dolor paroxístico en estudios experimentales (Álvarez et al., 2002; Garrido‐ Suárez et al., 2009). TNFα induce la potenciación a largo plazo de fibras C en el cuerno dorsal espinal en ratas con daño de nervio y los inhibidores de NF‐κB bloquean este efecto (Lin et al., 2007). NF‐κB es expresado constitutivamente en el cerebro; sin embargo, su expresión se incrementa después de una lesión de la médula espinal y puede activarse por diferentes estímulos como citocinas proinflamatorias, NGF, PKC y glutamato. También, NF‐κB regula la expresión de varias proteínas involucradas en la nocicepción y la plasticidad neural tales como citocinas proinflamatorias, quimiocinas, iNOS, COX‐2 y pro‐dinorfina (Romano et al., 2006). La dinorfina podría modular la función immune de la microglia y el astrocito, así como interactuar con el receptos de NMDA en neuronas y producir alodinia (Laughlin et al., 2000). El NF‐κB es también un elemento clave en la regulación de los procesos inflamatorios de células gliales reactivas, su inhibición transgénica atenúa el dolor y la inflamación después del daño nervioso periferal (Fu et al., 2010). Por tanto, los efectos inhibitorios del ECAM, sobre la activación del NF‐κB inducida por TNF (Garrido et al., 2005), podría sugerir un efecto antialodínico del extracto. Además, las ERO también están involucradas en la sensibilización central y se ha supuesto que las concentraciones elevadas de ellas desempeñan un papel importante en la fosforilación de la subunidad 1 del receptor NMDA (pNR1), a través de la activación de PKC y PKA en la médula espinal (Kim et al., 2006; Gao et al., 2007). Todos estos antecedentes, unidos a las actividades farmacológicas demostradas para el ECAM y MF podrían inferir una actividad analgésica importante en ensayos clínicos (Garrido‐Suárez et a., 2010). Para ello, se estudió el caso de una paciente con diagnóstico de Síndrome Doloroso Regional Complejo (SDRC) tipo II, secundario a una lesión del plexo braquial, con sección del nervio radial a nivel humeral que fue provocada por el desplazamiento de la fractura del húmero izquierdo (Garrido‐Suárez et al., 2007). Al acudir a la consulta, la paciente presentaba cuatro meses de evolución, con síntomas sensoriales, dolor persistente quemante y paroxístico, alodinia mecánica, edema, cambios vasomotores hacia la hiperhemia y mano en flexión por pérdida de la función motora de los músculos extensores del antebrazo, con el compromiso de la articulación del carpo y hombro de limitación severa y dolor de valor 5 en una escala numérica de Likert. El estudio de conducción nerviosa mostró alteraciones mielínico‐axonales discretas del nervio mediano y mielínico‐axonales severas del nervio radial. Se instauró el tratamiento con Vimang® (2 tabletas de 300 mg, cada 8 h y aplicación local de crema 1,2%, 3 veces al día) por 4 meses, asociado a los bloqueos simpáticos y somáticos para miembro superior y a la fisioterapia. La evolución clínica y electrofisiológica fue muy favorable. Mediante el seguimiento post‐tratamiento, a los dos meses del alta, después de concluir las 10 sesiones de bloqueos y el tratamiento sistémico con Vimang, no se observó edema ni cambios de coloración en la zona dañada, mejoró el trofismo de la piel, se conservó la flexo‐extensión de los dedos y la flexo‐extensión del carpo fue limitada pero posible. Por otra parte, se determinó la actividad analgésica de la suplementación con formulaciones Vimang® en 15 pacientes con SDRC y la posible mejoría de la capacidad funcional postratamiento (Garrido‐Suárez et a., 2009). Para ello, los pacientes recibieron Vimang® tabletas (1 800 mg, dos tabletas de 300 mg, tres veces al día, antes de las comidas), crema (1,2% en el miembro afectado 3 veces/día) y un bloqueo simpático semanal durante 4 meses. Se introdujo la fisioterapia al mes de tratamiento. Las variables evaluadas fueron las puntuaciones diarias medias de dolor (PDMD) mediante una escala de Likert, el área e intensidad de la alodinia mecánica dinámica, la alodinia al frío, somática profunda y la frecuencia del dolor paroxístico. En los 15 pacientes las PDMD y el resto de las alteraciones sensoriales se redujeron significativamente desde la semana 2‐3 de comenzado el tratamiento con respecto a los valores iniciales. La funcionalidad del miembro afectado, medida por la escala de Ennenking et al. modificada, aumentó desde 22,7 a 78,7%. Por otra parte, se realizó un estudio de reporte de casos en el que se determinó el efecto de las formulaciones Vimang® en pacientes con Herpes zoster (Garrido‐Suárez, et al., 2011a). Los pacientes (n=12) recibieron tabletas recubiertas (1 800 mg, dos tabletas de 300 mg, tres veces al día, antes de las comidas, por 30 días) asociadas con bajas dosis de amitriptilina (10‐25 mg/d) y fueron controladas las dosis de rescate del analgésico utilizado (dipirona). Además de las tabletas, ellos utilizaron compresas que contenían una dilución al 2% de Vimang® en las lesiones de la piel. Fueron determinadas las PDMD mediante la escala de Likert y también fueron Rev. Farmacol. Chile (2012) 5(2): 84 determinadas las variaciones en las dosis diarias de los fármacos usados concomitantemente. El efecto analgésico fue observado desde la primera semana en relación con los parámetros iniciales y ninguno mostró neuralgia post‐ herpética. También hubo una disminución significativa en la reducción de la medicación antidepresiva y la dosis de rescate analgésica con respecto a las dosis diarias iniciales. No fueron reportados eventos adversos. En otro estudio de serie de casos (Garrido‐Suárez et al., 2011b) fueron analizados los efectos de tabletas Vimang® (1 800 mg, dos tabletas de 300 mg, tres veces al día, antes de las comidas, por 120 días) en 12 pacientes con dolor asociado a zoster (seis con neuralgia herpética subaguda y seis con neuralgia post‐herpética). La terapia complementaria consistió en bajas dosis de amitriptilina (10‐25 mg/día) y crema Vimang® 1,2% aplicada tópicamente. En este estudio se registraron las PDMD a través de la escala de Likert, el área y la intensidad de la alodinia, la intensidad de la alodinia térmica y la frecuencia de ardor espontáneo. Las puntuaciones de dolor y alteraciones sensoriales disminuyeron significativamente desde la cuarta semana, con respecto a los datos iniciales. Tampoco se reportaron eventos adversos. Los autores concluyeron que estos resultados que estas formulaciones de Vimang® podrían ser beneficiosas en el tratamiento del dolor neuropático, pero es necesario la realización de un ensayo clínico controlado para confirmar esta hipótesis. Los autores manifestaron que los resultados obtenidos, tanto en el reporte como en la serie de casos, sugieren que la suplementación con Vimang® sería beneficiosa para prevenir y tratar el dolor neuropático, aunque resulta necesaria la realización de un ensayo clínico controlado para aceptar esta hipótesis. En otro reporte de casos se estudió la actividad analgésica de las tabletas y crema Vimang® en pacientes portadores de osteoartritis (OA) de rodilla y la posible mejoría de la capacidad funcional postratamiento (Valverde et al., 2009). Para ello, se estudiaron 10 pacientes con diagnóstico clínico de imagen de OA de rodilla. La semana previa al inicio del tratamiento sus PDMD eran mayores de 4, según una escala de Likert de 11 puntos. Se aplicó el índice de capacidad funcional de WOMAC (The Westerm Ontario and Mc Master Universities Osteoarthritis Index) en la consulta inicial y al concluir el estudio. Los pacientes fueron asignados aleatoriamente a tres grupos (grupo Vimang® tabletas 900 mg/día [n = 4], grupo Vimang® tabletas 1 800 mg/día [n = 3] y grupo Vimang® tabletas 900 mg/día + crema Vimang 1,2% [n = 3]). La administración de las tabletas se repartió en tres tomas cada 8 h y la crema se aplicó tres veces al día con el mismo intervalo en la rodilla afectada durante tres meses. Todos los pacientes mostraron analgesia satisfactoria a partir de los 15‐21 días hasta los tres meses. Este efecto se relacionó, al menos en parte, con la disminución de la efusión sinovial que se observó en la mayoría de las articulaciones afectadas, pero fue independiente de la disminución del grosor de la sinovial constatada por ultrasonografía. Se observaron ambos efectos, promoción e inhibición de la proliferación sinovial, independientemente de la analgesia. La inhibición de la proliferación de la membrana sinovial con respecto a los valores iniciales sólo fue significativa en el grupo Vimang 900. Los 10 pacientes mejoraron su calidad de vida en relación con el alivio del dolor y el aumento de la capacidad funcional según el índice de WOMAC. De la misma manera que en los reportes o serie de casos anteriores resulta necesaria la realización de ensayos clínicos controlados para confirmar los hallazgos descritos en esas publicaciones. CONCLUSIONES La presencia de una mezcla determinada de polifenoles, terpenoides, ácidos grasos y microelementos, unido a un proceso de estandarización del extracto acuoso de la corteza del árbol de mango (ECAM) le otorgan a este ingrediente farmacéutico activo de las formulaciones Vimang® un importante perfil antioxidante, anti‐ inflamatorio, inmunomodulador y analgésico manifestado en una inhibición de la peroxidación lipídica y una protección al daño oxidativo de la cadena de ADN mediante el mecanismo de secuestro de ERO, probablemente a través de la acción de flavonoides y otros polifenoles. También a través de la disminución de la acumulación de Fe2+ mediante la reacción de acomplejamiento con la mangiferina (MF), lo que puede ejercer un mecanismo preventivo de protección a diferentes órganos. El ECAM protege a la mitocondria celular mediante la acción sobre diversos sistemas enzimáticos, en los que pueden estar involucrados diversos componentes químicos del ECAM que impiden o disminuyen la formación de ERO. Desde el punto de vista de la actividad sobre el sistema inmune, el ECAM inhibe la producción de moléculas pro‐ inflamatorias, tales como NO, PGE2 y LTB4; enzimas involucradas en este proceso, tales como la PLA2, la iNOS y la COX‐2 y la expresión de moléculas de adhesión como la ICAM‐1 e incrementa TGFβ. Todo ello vinculado con su efecto modulador sobre la inhibición de importantes funciones como la quimiotaxis; la expresión de las citocinas TNFα y sus receptores TNF R‐1 y R‐2, GM‐CSF e IL‐1β mediante la inhibición de la transcripción de los genes que las codifican, la inhibición de la producción de isotipos específicos de inmunoglobulinas, como la IgG2a y la IgG2b sin afectar la producción de IgM; la inhibición de la proliferación celular mediada por el receptor de IL‐2 en células T, a través de la inhibición de la expresión del marcador de activación CD25 en la superficie de células T primarias; y la inhibición de las vías de señalización intracelular mediadas por NF‐κB en linfocitos T y en macrófagos, lo que conduce a la inhibición de la Rev. Farmacol. Chile (2012) 5(2): 85 producción de mediadores moleculares que participan en los procesos inmunológicos, nociceptivos e inflamatorios. El ECAM inhibió la muerte celular inducida por activación (AICD) en células T primarias mediante la disminución de 2+ las concentraciones de ERO y Ca inducidas por la activación del receptor de la célula T, la inhibición de la fosforilación de la cinasa de c‐Jun (JNK) que participa en la activación del factor transcripcional AP‐1, la disminución de la expresión del factor transcripcional NF‐κB y la disminución de la expresión del ligando de muerte CD95L. Estos resultados demuestran que el ECAM puede contribuir a prolongar la sobrevivencia de poblaciones de linfocitos T, lo que fundamenta la utilización de las ® formulaciones Vimang en el tratamiento de patologías en las que el fenómeno de la AICD este incrementado, como es el caso de la inmunodeficiencia asociada al VIH. La actividad analgésica del ECAM quedó manifestada por la inhibición de la fase II de la prueba de la formalina al 1%, lo que sugiere que el ECAM pudiera actuar sobre el proceso de sensibilización periférica, específicamente sobre el componente capsaicina‐sensitivo‐neurogénico; la disminución de la concentración de glutamato y el aumento del número de neuronas viables en un modelo de muerte neuronal excitotóxica inducida por NMDA, lo que sugiere que el ECAM pudiera inhibir la vía postsináptica glutamato‐receptor NMDA‐NO‐GMPc implicada en el proceso de sensibilización central que subyace en los estados dolorosos crónicos. El efecto antialérgico del ECAM también fue evidenciado mediante la reducción de la producción de IgE, la inhibición de la desgranulación de las células mastocitarias, la reducción de la permeabilidad vascular inducida por histamina, así como la liberación de histamina de células mastocitarias, la reducción de la respuesta proliferativa linfocitaria antígeno‐específica y la inhibición de IL‐4 e IL‐5 en un modelo de asma alérgica. Las evidencias clínicas con el uso de formulaciones ® Vimang , en ensayos clínicos a doble ciego, en estudios pilotos como en series o reportes de casos han demostrado que existe una correlación significativa entre la disminución de los marcadores del estrés oxidativo y de la inflamación, el alivio de los síntomas clínicos, la recuperación de marcadores hemoquímicos y la mejoría de la calidad de vida en varias enfermedades crónicas, así como en la atención al Adulto Mayor. Los resultados de los estudios toxicológicos pre‐clínicos y la ausencia de eventos adversos significativos en los estudios clínicos han demostrado que se trata de un producto que no presenta efectos tóxicos, mutagénicos, genotóxicos, ni teratogénicos en las condiciones experimentales a que ha sido sometido. Resulta necesaria la realización de ensayos clínicos controlados en patologías que transitan por un componente de estrés oxidativo, inflamación o dolor para asegurar la eficacia de las formulaciones que contengan como ingrediente farmacéutico activo al ECAM. BIBLIOGRAFÍA: Abdalla A.E.M., Darwish S.M., Ayad E.H.E., El‐Hamahmy R.M. (2007) Egyptian mango by‐product 2: Antioxidant and antimicrobial activities of extract and oil from mango seed kernel. Food Chem. 103, 1141– 1152. Acosta‐Esquijarosa J., Jáuregui‐Haza U., Amaro‐González D., Sordo‐Martínez L. (2009b) Spray drying of aqueous extract of Mangifera indica L (Vimang): Scale up for the process. World Appl. Sci. J. 6(3), 408‐412. Acosta‐Esquijarosa J., Nuevas‐Paz L., Amaro‐González D. & Álvarez‐De Leon J.C. (2009a) Estudio del proceso de lixiviación de la corteza vegetal de Mangifera indica L. Lat. Am. J. Pharm. 28(1), 27‐31. Acosta‐Esquijaroza J., Jáuregui‐Haza U. and Carillo‐Le Roux G. (2010) Modelling of humidity isotherms of Mangifera indica L (Vimang®) powder. World Appl. Sci. J. 11(12), 1504‐1509. Afaq F., Katiyar S.K. (2011) Polyphenols: skin photoprotection and inhibition of photocarcinogenesis. Mini Rev. Med. Chem. 11(14), 1200‐1215. Agyare C., Asase A., Lechtenberg M., Niehues M., Deters A., Hensel A. (2009) An ethnopharmacological survey and in vitro confirmation of ethnopharmacological use of medicinal plants used for wound healing in Bosomtwi‐Atwima‐Kwanwoma area, Ghana. J. Ethnopharmacol. 125, 393–403. Aiyeloja A. and Bello O.A.( 2006) Ethnobotanical potentials of common herbs in Nigeria: A case study of Enugu state. Educ. Res. Rev. 1(1), 16‐ 22. Ajila C.M., Bhat S.G., Rao U.J.S.P. (2007) Valuable components of raw and ripe peels from two Indian mango varieties. Food Chem. 102, 1006‐ 1111. Al‐Ayyoubi S., Gali‐Muhtasib H. (2007) Differential apoptosis by gallotannin in human colon cáncer cells with distintic p53 status. Mol. Carcinog. 46(3), 176‐186. Ali H., Haribabu B., Richardson R.M., Snyderman R. (1997) Mechanisms of inflammation and leukocyte activation. Adv. Reumatol. 81, 1‐28. Alimonti J.B., Ball T.B. and Fowke K.R. (2003) Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS. J. Gen. Virol. 84, 1649–1661. Álvarez A., Guevara M., Riaño A., Garrido G., Delgado R. (2002) Eficacia del tratamiento con extracto de corteza de Mangifera indica L (Vimang) (crema 1,2% y tabletas 150 mg) sobre el herpes zoster. Presentación de un caso. Rev. Cubana Farmacia 36, 170‐172. Álvarez‐León A., Sánchez‐Baldoquín C., García‐Rivera D., Rodríguez‐Morales J., Lemus‐Molina Y., Jane‐Lara A., Rodríguez‐Cutting J.M., Izquierdo‐ González M., Morales‐Paneque C.I., Garrido‐Garrido G. (2009) Treatment of bronchial asthma with an aqueous extract of Mangifera indica L. (VIMANG®): two cases report. Bol. Latinoam. Caribe Plant. Med. Aromat. 8(2), 63‐66. Amazzal L., Lapôtre A., Quignon F., Bagrel D. (2007) Mangiferin protects against 1‐methyl‐4‐phenylpyridinium toxicity mediated by oxidative stress in N2A cells. Neurosci. Lett. 418, 159‐164. Rev. Farmacol. Chile (2012) 5(2): 86 Anila L., Vijayalakshmi N.R. (2002) Flavonoids from Emblica officinalis and Mangifera indica‐effectiveness for dyslipidemia. J. Ethnopharmacol. 79, 81–87. Arús‐Pampín L., Paneque‐Quevedo A., García‐Pulpeiro O., Boza‐Rivera A., Sordo‐Martinez L. y Nuñez‐Sellés A. (2003) Estabilidad de la crema elaborada a partir del extracto seco de la corteza de Mangifera indica L. (Vimang). Lat. Am. J. Pharm. 22(4), 335‐338. Asase A., Akwetey G.A., Achel D.G. (2010) Ethnopharmacological use of herbal remedies for the treatment of malaria in the Dangme West District of Ghana. J. Ethnopharmacol. 129, 367–376. Badley A.D., Pilon A.A., Landay A., Lynch D.H. (2000) Mechanisms of HIV‐ associated lymphocyte apoptosis. Blood 96, 2951‐2964. Ballabh B., Chaurasia O.P., Ahmed Z., Singh S.B. (2008) Traditional medicinal plants of cold desert Ladakh—Used against kidney and urinary disorders. J. Ethnopharmacol. 118, 331–339. Balli I.S.E. (2006) Mangifera indica L. (mango). Anacardiaceae (cashew family). In. Traditional Trees of Pacific Islands: Their Culture, Environment, and Use. Elevitch C.R. ed. Permanent Agriculture Resources, 816 pp. Baymgärtner U., Magerl W., Magerl W., Klein T., Hopf H.C., Treede R.D. (2002) Neurogenic hyperalgesia versus painful hypoalgesia: two distinct mechanisms of neuropathic pain. Pain 96, 141‐151. Chen W.J., Chang C.Y., Lin J.K. (2003) Induction of G1 phase arrest in MCF human breast cancer cells by pentagalloylglucose through the down‐ regulation of CDK4 and CDK2 activities and up‐regulation of the CDK inhibitors p27(Kip) and p21(Cip). Biochim. Pharmacol. 65(11), 1777‐ 1785. Chieli E. and Romiti N. (2008). Kidney proximal human tubule HK‐2 cell line as a tool for the investigation of Pglycoprotein modulation by natural compounds. Bol. Latinoam. Caribe Plant. Med. Aromat. 7(6), 281‐295. Chieli E., Romiti N., Rodeiro I., Garrido G. (2009) In vitro effects of Mangifera indica and polyphenols derived on ABCB1/P‐glycoprotein activity. Food Chem. Toxicol. 47, 2703‐2710. Chieli E., Romiti N., Rodeiro I., Garrido G. (2010) In vitro modulation of ABCB1/P‐glycoprotein expression by polyphenols from Mangifera indica. Chem. Biol. Interact. 186, 287‐294. Chobot V., Hadacek F. (2010) Iron and its complexation by phenolic cellular metabolites: from oxidative stress to chemical weapons. Plant Signal Behav. 5(1), 4‐8. Coelho‐Ferreira M. (2009) Medicinal knowledge and plant utilization in an Amazonian coastal community of Marudá, Pará State (Brazil). J. Ethnopharmacol. 126, 159–175. Collins A.R. (2005) Assays for oxidative stress and antioxidant status: applications to research into the biological effectiveness of polyphenols. Am. J. Clin. Nutr. 81, 261S‐267S. Beltrán A., Ledón N., Romay C., Sironi M., Quintero G., Garrido G., Delgado R. (2003) Extracto acuoso de Mangifera indica L. (Vimang) y mangiferina inhiben la expresión de ICAM‐1 en células endoteliales estimuladas con citocinas pro‐inflamatorias. Rev. Cubana Invest. Biomed. 22, 164‐172. Covey W., Ignatowski T.A., Renauld A.E., Knight P.R., Nader N.D., Spengler R.N. (2002) Expression of neuron‐associated tumor necrosis factor alpha in the brain is increased during persistent pain. Reg. Anesth. Pain Med. 27, 357‐366. Beltrán A.E., Alvarez Y., Xavier F.E., Hernanz R., Rodríguez J., Nuñez‐Sellés A.J., Alonso M.J., Salaices M. (2004) Vascular effects of the Mangifera indica L. extract (Vimang). Eur. J. Pharmacol. 499, 297‐305. Cuzzocrea S., Riley D.P., Caputi P.A., Salvemini D. (2001) Antioxidant therapy: a new pharmacological approach in shock, inflammation, and ischaemia/reperfusion injury. Pharmacol. Rev. 53, 135‐159. Bhogaonkar P.Y. & Kadam V.N. (2006) Ethnopharmacology of Banjara tribe of Umarkhed taluka, district Yavatmal, Maharashtra for reproductive disorders. Indian J. Trad. Know. 5(3), 336‐341. Dar A., Faizi S., Naqvi S., Roome T., Zikr‐Ur‐Rehman S., Ali M., Firdous S., and Moin S.T. (2005). Analgesic and antioxidant activity of mangiferin and its derivatives: the structure activity relationship. Biol. Pharm. Bull. 28, 596‐600. Biradar S.D. & Ghorband D.P. (2010) Ethnomedicinal wisdom of tribal of Kinwast forest of Nanded district (Maharashtra). Indian J. Nat. Prod. Res. 1(2), 254‐257. Bowler R.P., Crapo J.D. (2002) Oxidative stress in allergic respiratory diseases. J. Allergy Clin. Immunol. 110, 349‐356. Cancino L., Leiva A., Garrido G., Cossio M., Prieto E. (2001) Vimang: Los efectos antigenotóxico y modulador de las enzimas glutatión peroxidasa y glutatión S‐transferasa. Rev. Cubana Invest. Biomed. 20, 48‐53. Carballo M.T., Echemendia O., García M., Bolaños G., Monteagudo R., Lago V., Márquez L., Garrido G., Delgado R. (2002) Estudio antiviral in vitro de un extracto proveniente de la corteza de Mangifera indica L frente al Herpes simple tipo 1. Rev. Cubana Farmacia 36, 71‐73. Chaturvedi P.K., Bhui K., Shukla Y. (2008) Lupeol: Connotations for chemoprevention. Cancer Lett. 263(1), 1‐13. Chen W.J. & Lin J.K. (2004) Induction of G1 arrest and apoptosis in human jurkat T cells by pentagalloylglucose through inhibiting proteasome activity and elevating p27Kip1, p21Cip1/WAF1, and Bax proteins. J. Biol. Chem. 279(14), 13496‐13505. Das A.K., Dutta B.K. & Sharma G.D. (2008). Medicinal plants used by different tribes of Cachar district, Assam. Indian J. Trad. Know. 7(3), 446‐454. De la Vega M., Díaz‐Cantón E., Alvarez R.H. (2012) Novel targeted agents for the treatment of advanced breast cancer. Future Med. Chem. 4(7), 893‐914. De Leo J.A., Tawfik V.L., La Croix‐Fralish M.L. (2006) The tetrapartite synapse: Path to CNS sensitization and chronic pain. Pain 122, 17‐21. De Wet H., Nkwanyana M.N., vanVuuren S.F. (2010) Medicinal plants used for the treatment of diarrhea in northern Maputaland, KwaZulu‐Natal Province, South Africa. J. Ethnopharmacol. 130(2), 284–289. Delgado R., Garrido G., González D., Herrera B., Beltrán A., Lemus Y., Rodríguez J., Quintero G., Lodeiro L., Tamayo D., Sironi M., Ledón N., Romay C., García D., Núñez‐ Sellés A.J. (2001) Mangifera indica L. extract (Vimang) as a natural antioxidant with antinociceptive and anti‐ inflammatory properties. Minerva Med. 92, 98‐102. Delgado‐Hernandez R., Magariño Y., Hernandez‐Balmaseda I., Rodeiro‐ Guerra I., Rodriguez J.C., Acosta J., Romero J.A., Gato del Monte A., Salomon S., Rodriguez C., Nuevas L., Lopez O.D., PortoVerdecia M. (2012) Anti‐angiogenic effects of Mangifera indica L. stem bark extract Rev. Farmacol. Chile (2012) 5(2): 87 and its natural glucoxilxanthone, mangiferin. Proceedings of the British Pharmacological Society at http://www.pA2online.org/abstracts/Vol10Issue3abst089P.pdf García D., Escalante M., Delgado R., Leiro J. (2003b) Antihelminthic and antiallergic effects of aqueous extract of Mangifera indica l. (Vimang) stem bark components and mangiferin. Phytother. Res. 17, 1203‐1208. Dockrell D.H., Badley A.D., Algeciras‐Schimnich A., Simpson M., Schut R., Lynch D.H., Paya C.V. (1999) Activation‐induced CD4+ T cell death in HIV‐positive individuals correlates with Fas susceptibility, CD4+ T cell count, and HIV plasma viral copy number. AIDS Res. Hum. Retroviruses 15, 1509‐1518. García D., Hernández I., Álvarez A., Cancio B., Márquez L., Garrido G., Cuzzocrea S., Delgado R. (2006) Antiallergic properties of Mangifera indica L. extract (VIMANG®) and contribution of its compound mangiferin. J. Pharm. Pharmacol. 58, 385‐392. Dorta E., Lobo G., González M. (2012) Using drying treatments to stabilise mango peel and seed: Effect on antioxidant activity. LWT ‐ Food Sci. Technol. 45, 261‐268. Eliav E., Benoliel R., Tal M. (2001) Inflammation with no axonal damage of rats saphenos nerve trunk induces ectopic discharge and mechanosensitivity in myelinated axons. Neurosc. Lett. 311, 49‐52. Ene A.C., Atawodi S.E., Ameh D.A., Kwanashie H.O. & Agomo P.U. (2010) Locally used plants for malaria therapy amongst the Huasa, Yoruba and Ibo communities in Maiduguri, Northeastern Nigeria. Indian J. Trad. Know. 9(3), 486‐490. FAO. http://faostat.fao.org/site/567/DesktopDefault.aspx?PageID=567#anc or [accessed June 15, 2012]. Faried A., Kurnia D., Daried L.S., Usman N., Miyasaki T., Kato H., Kuwano H. (2007) Anticancer effects of gallic acid isolated from Indonesian herbal medicine, Phaleria macrocarpa (Scheff.) Boerl, on human cancer cell lines. Int. J. Oncol. 30(3), 605‐613. Flora SJ. (2011) Arsenic‐induced oxidative stress and its reversibility. Free Radic. Biol. Med. 51(2), 257‐281. Focho D.A., Nkeng E.A.P., Lucha C.F., Ndam WT and Afegenui A. (2009a) Ethnobotanical survey of plants used to treat diseases of the reproductive system and preliminary phytochemical screening of some species of malvaceae in Ndop Central Sub‐division, Cameroon. J. Med. Plant Res. 3(4), 301‐314. Focho D.A., Nkeng E.A.P., Fonge B.A., Fongod A.N., Muh C.N., Ndam T.W. and Afegenui A. (2009b) Diversity of plants used to treat respiratory diseases in Tubah, northwest region, Cameroon. Afr. J. Pharm. Pharmacol. 3(11), 573‐580. Fu E.S., Zhang Y.P., Sagen J., Candiotti K.A., Morton P.D., Liebl D.J., Bethea J.R., Brambilla R. (2010) Transgenic inhibition of glial NF‐kappa B reduces pain behavior and inflammation after peripheral nerve injury. Pain 148, 509‐518. Gali‐Muhtasib H.U., Younes I.H., Karchesy J.J., El‐Sabban M.E. (2001) Plant tannins inhibit the induction of aberrant cript foci and colonic tumors bt 1,2‐dimethylhydrazine in mice. Nutr. Cancer 39(1), 108‐116. Ganesan S. (2008) Traditional oral care medicinal plants survey of Tamil Nadu. Nat. Prod. Rad. 7(2), 166‐172. Gao X., Kee H., Chung J.M., Chung K. (2005) Enhancement of NMDA receptor phosphorylation of the spinal dorsal horn and nucleus gracilis neurons in neuropathic rats. Pain 116, 62‐72. Gao X., Kim H.K., Chung J.M., Chung K. (2007) Reactive oxygen species (ROS) are involved in enhancement of NMDA‐receptor phosphorylation in animal models of pain. Pain 131, 262‐271. García D., Delgado R., Ubeira F.M., Leiro J. (2002) Modulator effects of rat macrophage function by Mangifera indica L extract (Vimang) and mangiferin. Int. Immunopharmacol. 2, 797‐806. García D., Leiro J., Delgado R., San Martín M.L., Ubeira F.M. (2003a) Mangifera indica L. extract (Vimang) and mangiferina modulate mouse humoral immune response. Phytother. Res. 17, 1182‐1187. García L.E., Martínez M.P., González H.L. (2001) Inflamación y dolor: cambios en el sistema nervioso periférico y central. MEDUNAB 4, 1‐14. García‐Triana B., García‐Piñeiro J.C., de la Peña‐Pino R., García‐Montes de Oca A.L., Saldaña‐Bernabeu A., Rodríguez‐Sosa V., Riesgo‐Lovaina N., Osorio‐Núñez M. (2005) Efecto de un extracto de Mangifera indica L (Vimang) sobre la enfermedad peridontal por ligadura en perros Beagle. Rev. Cubana Invest. Biomed. 24, 14‐19. García‐Rivera D., Hernández I., Merino N., Luque Y., Álvarez A., Martín Y., Amador A., Nuevas L. and Delgado R. (2011) Mangifera indica L. extract (Vimang) and mangiferin reduce the airway inflammation and Th2 cytokines in murine model of allergic asthma. J. Pharm. Pharmacol. 63, 1336–1345 García‐Solís P., Yahia E.M., Morales‐Tlalpan V, Díaz‐Munoz M. (2009) Screening of antiproliferative effect of aqueous extracts of plant foods consumed in Mexico on the breast cancer cell line MCF‐7. Int. J. Food Sci. Nutr. 60(S6), 32‐46. Garrido G., Blanco‐Molina M., Sancho R., Macho A., Delgado R., Muñoz E. (2005) An aqueous stem bark extract of Mangifera indica (Vimang®) inhibits T cell proliferation and TNF‐induced activation of nuclear transcription factor NF‐kappaB. Phytother. Res. 19, 211‐215. Garrido G., Delgado R., Lemus Y., Rodríguez J., García D., Núñez‐Sellés A.J. (2004b) Protection against septic shock and suppression of tumor necrosis factor alpha and nitric oxide production on macrophages and microglia by a standard aqueous extract of Mangifera indica L. (Vimang®). Role of mangiferin isolated from the extract. Pharmacol. Res. 50, 165‐172. Garrido G., González D., Delporte C., Backhouse N., Quintero G., Núñez‐ Sellés A.J., Morales M.A. (2001) Analgesic and anti‐inflammatory effects of Mangifera indica L. extract (Vimang). Phytother. Res. 15, 18‐ 21. Garrido G., González D., Lemus Y., Delporte C., Delgado R. (2006) Protective effects of a standard extract of Mangifera indica L. (VIMANG®) against mouse ear edemas and its inhibition of eicosanoid production in J774 murine macrophages. Phytomedicine 13, 412–418. Garrido G., González D., Lemus Y., García D., Lodeiro L., Quintero G., Delporte C., Núñez‐Sellés A.J., Delgado R. (2004a) In vivo and in vitro anti‐inflammatory activity of Mangifera indica L. extract (VIMANG®). Pharmacol. Res. 50, 143‐149. Garrido G., González D., Romay C., Núñez‐Selles A.J., Delgado R. (2008) Scavenger effect of a mango (Mangifera indica L.) food supplement’s active ingredient on free radicals produced by human polymorphonuclear cells and hypoxanthine–xanthine oxidase chemiluminescence systems. Food Chem. 107(3), 1008‐1014. Garrido G., Rodeiro I., Guerra E., Hernández I., González R.M., García G., Pérez G., Delgado R. (2009) In vitro and in vivo acute studies of Mangifera indica L. extract (Vimang®), a new antioxidant natural product. Drug Chem. Toxicol. 32 (01), 53‐58. Rev. Farmacol. Chile (2012) 5(2): 88 Garrido G., Romiti N., Tramonti G., de la Fuente F., Chieli E. (2012) Polyphenols of Mangifera indica modulate arsenite‐induced cytotoxicity in a human proximal tubule cell line. Braz. J. Pharmacog. 22(2), 325‐334. Garrido‐Suárez B., Bosch F., Garrido‐Garrido G., Delgado‐Hernández R., Porro J.N., Manero J.M. (2007) Utilidad del extracto de mangifera indica L (VIMANG) en el síndrome doloroso regional complejo. A propósito de un caso. Rev. Soc. Esp. Dolor 7, 494‐500. Garrido‐Suárez B., Garrido G., Delgado G., Bosch F., Rabí M.C. (2011b) Case series in patients with zoster‐associated pain using Mangifera indica L. extract. Forsch Komplementmed 18, 345–350. Garrido‐Suárez B., Garrido G., Delgado R., Bosch F., Rabí M.C., Hernández C.E. (2011a) Report of cases in patients with acute herpetic neuralgia using a Mangifera indica extract. Braz. J. Pharmacog. 21(6), 1111‐1117. Garrido‐Suárez B., Rabí M.C., Fosch F., Garrido‐Garrido G. y Delgado‐ Hernández R. (2009) Introducción de la suplementación con formulaciones Vimang® en el síndrome doloroso regional complejo: experiencia en 15 pacientes. Rev. Soc. Esp. Dolor 16(2), 87‐96. Garrido‐Suárez B.B., Garrido G., Delgado R., Bosch F., and Rabí M.C. (2010) A Mangifera indica L. extract could be used to treat neuropathic pain and implication of mangiferin. Molecules 15, 9035‐9045. Gbolade A.A. (2009) Inventory of antidiabetic plants in selected districts of Lagos State, Nigeria. J. Ethnopharmacol. 121, 135–139. Ghimire K, Bastakoti RR. (2009) Ethnomedicinal knowledge and healthcare practices among the Tharus of Nawalparasi district in central Nepal. Forest Ecol. Manag. 257, 2066–2072. Gil del Valle L., Martínez G., Gonzalez Blanco I., Tarinas A., Alvarez A., Molina R., Robaina M., Tapanes R., Perez Avila J., Guevara M., Nuñez Selles A., Leon O.S. (2002) Effects of Vimang on oxidative stress and marker of disease progression in HIV‐AIDS patients. Free Radic. Res. 36, 107‐108. Gómez‐Lechón M.J., Castell J.V., Donato M.T. (2010) The use of hepatocytes to investigate drug toxicity. Methods Mol. Biol. 640, 389‐415. González J.E., Rodríguez M.D., Rodeiro I., Morffi J., Guerra E., Leal F., García H., Goicochea E., Guerrero S., Garrido G., Delgado R., Núñez‐Selles A.J. (2007) Lack of in vivo embryotoxic and genotoxic activities of orally administered stem bark aqueous extract of Mangifera indica L. (Vimang®). Food Chem. Toxicol. 45, 2526‐2532. Gottlieb M., Leal‐Campanario R., Campos‐Esparza M.R., Sánchez‐Gómez M.V., Alberdi E., Arranz A., Delgado‐García J.M., Gruart A., Matute C. (2006) Neuroprotection by two polyphenols following excitotoxicity and experimental ischemia. Neurobiol. Dis. 23, 374‐386. Guevara‐García M., González Laime S., Álvarez León A., Riaño Montalvo A., Garrido Garrido G., Nuñez Selles A.J. (2004) Uso etnomédico de la corteza de Mangifera indica L. en Cuba. Rev. Cubana Plant. Med. 9, 1‐9. Guevara M., Garrido G., Rodríguez P.C., Riaño A., Álvarez A., Grupo de APS del Policlínico “Elpidio Berovides”, Delgado R., Núñez Sellés A.J. (2007) Efecto de la crema antioxidante Vimang® en enfermedades dermatológicas. Latin Amer. J. Pharm. 26, 237‐242. Guha S., Ghosal S., Chattopadhyay U. (1996) Antitumor, immunomodulatory and anti‐HIV effect of mangiferin, a naturally occurring glucosylxanthone. Chemotherapy 42, 443‐451. Gupta R., Gupta R.S. (2011) Antidiabetic efficacy of Mangifera indica seed kernels in rats: a comparative study with glibenclamide. Diabetol. Croatica 40, 107‐112. Gupta R., Vairale M.G., Deshmukh R.R., Chaudhary P.R. & Wate S.R. (2010) Ethnomedicinal uses of some plants used by Gond tribe of Bhandara district, Maharashtra. Indian J. Trad. Know. 9(4), 713‐719. Henry A.N., Hosagoudar V.B. & Ravikumar K. (1996) in Ethnobotany in human welfare, by Jain SK. Deep Publications, New Delhi, 173‐180. Hernandez P., Delgado R., Walczak H. (2006a) Mangifera indica L. extract protects T cells from activation‐induced cell death. Intern. Immunopharmacol. 6, 1496‐1505. Hernandez P., Rodriguez P.C., Delgado R., Walczak H. (2007) Protective effect of Mangifera indica L. polyphenols on human T lymphocytes against activation‐induced cell death. Pharmacol. Res. 55, 167‐173. Hernandez P., Rodriguez P.C., Delgado R. (2006b) Mangifera indica L. extract modulates NF‐KappaB signaling pathway in the course of activation‐ induced T cell death. Pharmacologyonline 3, 549‐555. Hsu M.F., Raung S.L., Tsao L.T., Lin C.N., Wang J.P. (1997) Examination of the inhibitory effect of norathyriol in formylmethionyl‐leucyl‐phenylalanine induced respiratory burst in rat neutrophils. Free Radic. Biol. Med. 23, 1035‐1045. Ibarretxe G., Sánchez‐Gómez M.V., Campos‐Esparza M.R., Alberdi E., Matute C. (2006) Differential oxidative stress in oligodendrocytes and neurons after excitotoxic insults and protection by natural polyphenols. Glia 53, 201‐211. Idu M. and Onyibe H.I. (2007) Medicinal plants of Edo State, Nigeria. Res. J. Med. Plant 1(2), 32‐41. Issekutz T.B., Stoltz J.M., Van Der Meide P. (1988) Lymphocytes recruitment in delayed type hypersensitivity. J. Immunol. 140, 2989‐2983. Jagetia G.C., Baliga M.S. (2005) Radioprotection by mangiferin in DBAxC57BL mice: a preliminary study. Phytomedicine 12, 209–215. Jagetia G.C., Venkatesha V.A. (2005) Effect of mangiferin on radiation‐ induced micronucleus formation in cultured human peripheral blood lymphocytes. Environ. Mol. Mutagen. 46, 12‐21. Jain D.L., Baheti A.M., Jain S.R. & Khandelwal K.R. (2010) Use of medicinal plants among tribes in Satpuda region of Dhule and Jalgaon districts of Maharashtra‐An ethnobotanical survey. Indian J. Trad. Know. 9(1), 152‐ 157. Jiofack T., Fokunang C., Kemeuze V., Fongnzossie E., Tsabang N., Nkuinkeu R., Mapongmetsem P.M. and Nkongmeneck B.A. (2008) Ethnobotany and phytopharmacopoea of the South‐West ethnoecological region of Cameroon. J Med. Plant Res. 2(8), 197‐206, Kadavul K. & Dixit A.K. (2009) Ethnomedicinal studies of the woody species of Kalrayan & Shervarayan Hills, Eastern Ghats, Tamil Nadu. Indian J. Trad. Know. 8(4), 592‐597. Kalita D. & Bora R.L. (2008) Some folk medicines from Lakhimpur district, Assam. Indian J. Trad. Know. 7(3), 414‐416. Kar A. & Borthakur S.K. (2008) Medicinal plants used against dysentery, diarrhea and cholera by the tribes of erstwhile Kameng district of Arunachal Pradesh. Nat. Prod. Rad. 7(2), 176‐181. Karin M., Neriah B. (2000) Phosphorilation meets ubiquitination: the control of NF‐ B activity. Annu. Rev. Immunol. 18, 621‐663. Rev. Farmacol. Chile (2012) 5(2): 89 Khammuang S. and Sarnthima R. (2011) Antioxidant and antibacterial activities of selected varieties of thai mango seed extract. Pak. J. Pharm. Sci. 24(1), 37‐42. Khan‐Marwat S., Fazal‐Ur‐Rehman and Ullah‐Khan I. (2012) Tracing the useful ethnophytomedicinal recipes of angiosperms used against jaundice and hepatitis in Indo‐Pak subcontinent. World Appl. Sci. J. 18 (9), 1243‐1252. Kim H., Kim H., Mosaddik A., Gyawali R., Ahn K.S., Cho S.K. (2012) Induction of apoptosis by ethanolic extract of mango peel and comparative analysis of the chemical consists of mango peel and flesh. Food Chem. 133, 416‐422. Kim H.K., Kim J.H., Gao X., Zhou J.L., Lee I., Chung K., Chung J.M. (2006) Analgesic effect of vitamin E is mediated by reducing central sensitization in neuropathic pain. Pain 122, 53‐62. Krammer P.H., Behrmann I., Daniel P., Dhein J., Debatin K.M. (1994) Regulation of apoptosis in the immune system. Curr. Opin. Immunol. 6, 279‐289. Kress M. (2005) Role of Inflammatory Mediators and the Response of Primary Afferents. In: Flor H et al. IASP Scientific Program Committee. Pain‐2005 an Updated Review: Refresher Course Syllabus. Seattle: IAPS PRESS, pp. 197‐205. Kulkarni C.G. & Adwit D. (2011) Folk therapies of Katkaris from Maharashtra. Indian J. Trad. Know. 10(3), 554‐558. Kuvar S.D. & Bapat U.C. (2010) Medicinal plants used by Kokani tribals of Nasik district Maharashtra to cure cuts and wounds. Indian J. Trad. Know. 9(1), 114‐115. Kyriakis J.M., Avruch J. (1996) Protein kinase cascades activated by stress and inflammatory cytokines. Bioassays 18, 567‐577. Lamorde M., Tabuti J.R.S., Obua C., Kukunda‐Byobona C., Lanyero H., Byakika‐Kibwika P., Bbosa G.S., Lubega A., Ogwal‐Okeng J., Ryan M., Waako P.J., Merry C. (2010) Medicinal plants used by traditional medicine practitioners for the treatment of HIV/AIDS and related conditions in Uganda. J. Ethnopharmacol. 130, 43–53. Laughlin T.M., Bethea J.R., Yezierski R.P., Wilcox G.L. (2000) Cytokine involvement in dynorphininduced allodynia. Pain 84, 159‐167. Leiro J., Arranz J.A., Yáñez M., Ubeira F.M. Sanmartín M.L., Orallo F. (2004a) Expression profiles of genes involved in the mouse nuclear factor‐ kappa B signal transduction pathway are modulated by mangiferin. Int. Immunopharmacol. 4, 763–778. Leiro J., García D., Arranz J.A., Delgado R., Sanmartín M.L., Orallo F. (2004b) An Anacardiaceae preparation reduces the expression of inflammation‐ related genes in murine macrophages. Int Immunopharmacol. 4, 991‐ 1003. Leiro J.M., Álvarez E., Arranz J.A., González Siso I., Orallo F. (2003) In vitro effects of mangiferin on superoxide concentrations and expression of the inducible nitric oxide synthase, tumour necrosis factor‐ and transforming growth factor‐ genes. Biochem. Pharmacol. 65, 1361– 1371. Lemus‐Molina Y., Sánchez‐Gómez M.V., Delgado‐Hernández R., Matute C. (2009) Mangifera indica L. extract attenuates glutamate‐induced neurotoxicity on rat cortical neurons. NeuroToxicol. 30, 1053–1058. Lemus‐Rodríguez Z., Hung‐Arbelo M., Chong‐Quesada A. y Rodríguez‐ Antomarchi M. (2006) Formulación de tabletas a partir del extracto de Mangifera indica L (Vimang®). MEDISAN 10(4), 1‐8. Li Q., Verma M.I. 2002 NF‐ B regulation in the immune system. Nature Rev. 2, 725‐734. Lin Y.L., Zhou L.J., Hu N.W., Xu J.T., Chang Y.W., Zhang T., Li Y.Y., Liu X.G. (2007) Tumor necrosis factor α induces long‐term potentiation of C‐ fiber evoked field potentials in spinal dorsal horn in rats with nerve injury: the role of NF‐kappa B, JNK and p38 MAPK. Neuropharmacology 52, 708‐715. Loy S., Simón R., Delgado R. (2002) Vimang: Un potencial protector de la peroxidación lipídica en lipoproteínas de baja densidad. Rev. Cubana Invest. Biomed. 21, 167‐170. Lui P.W., Lee C.H. (2004) Preemptive effects of intrathecal cyclooxygenase inhibitor or nitric oxide synthase inhibitor on thermal hypersensitivity following peripheral nerve injury. Life Sci. 75, 2527‐2538. Mahady G.B. (2001) Global harmonization of herbal health claims. J. Nutr. 131, 20S‐23S. Maisuthisakul P. and Gordon M.H. (2009). Antioxidant and tyrosinase inhibitory activity of mango seed kernel by product. Food Chem. 117, 332‐341. Márquez L., García‐Bueno B., Madrigal J.L., Leza J.C. (2012) Mangiferin decreases inflammation and oxidative damage in rat brain after stress. Eur. J. Nutr. 51(6), 729‐739. Márquez L., Pérez‐Nievas B.G, Gárate I., García‐Bueno B., Madrigal J.L.M, Menchén L., Garrido G. and Leza J.C. (2010) Antiinflammatory effects of Mangifera indica L. extract in a model of colitis. World J. Gastroenterol. 16(39), 4922‐4931. Martinez‐Sanchez G., Delgado R., Pérez Davison G., Garrido G., Núñez Sellés A.J. and León Fernández O.S. (2000a) Evaluation of the in vitro antioxidant activity of Mangifera indica L. Extract (Vimang). Phytother. Res. 14, 424‐427. Martínez‐Sánchez G., Giuliani A., León Fernández O.S., Pérez Davison G., Núñez Sellés A.J. (2001a) Effect of Mangifera indica L. extract (Vimang) on protein and hepatic microsome peroxidation. Phytother. Res. 15, 581‐585. Martínez‐Sanchez G., Rodriguez M.A., Giuliani A., Nuñez‐Sellés A.J., Pons N., Leon O.S., Re L. (2003) Protective effect of Mangifera indica L extract (Vimang) on the injury associated with hepatic ischaemia reperfusion. Phytother. Res. 17, 197‐201. Martínez‐Sánchez G., Candelario Jalil E., Giuliani A., León Fernández O.S., Ram S., Delgado Hernández R., Núñez Sellés A.J. (2001b) Mangifera indica L. extract (Vimang) reduces ischaemia‐induced neuronal loss and oxidative damage in Gerbil brain. Free Radic. Res. 35, 465‐473. Martínez‐Sánchez G., Re L., Giuliani A., Núñez Sellés A.J., Pérez Davison G. and León Fernández O.S. (2000b) Protective effects of Mangifera indica L. extract, mangiferin, and selected antioxidants against TPA‐induced biomolecules oxidation and peritoneal macrophage activation in mice. Pharmacol. Res. 42, 565‐573. Matés J., Perez‐Gómez C., Blanca M. (2000) Chemical and biological activity of free radical ‘scavengers’ in allergic diseases. Clin. Chim. Acta 296, 1– 15. Mehrnoush A., Mustafa S., Sarker M.Z.I., and Yazid A.M.M. (2012) Optimization of serine Protease purification from mango (Mangifera indica cv. Chokanan) peel in polyethylene glycol/dextran aqueous two phase system. Int. J. Mol. Sci. 13(3), 3636‐3649. Rev. Farmacol. Chile (2012) 5(2): 90 Metodiewa D., Jaiswal A.K., Cenas N., Dickancaité E., Segura‐Aguilar J. (1999) Quercetin may act as a cytotoxic prooxidant after its metabolic activation to semiquinone and quinoidal product. Free Radic. Biol. Med. 26, 107‐116. Morffi J., Rodeiro I., Hernández S.L., González L., Herrera J., Espinosa‐ Aguirre J.J. 2012. Antimutagenic properties of Mangifera indica L. stem bark extract and evaluation of its effects on hepatic CYP1A1. Plant Foods Hum. Nutr. DOI: 10.1007/s11130‐012‐0304‐2. Nadeem A., Chhabra S.K., Masood A., Raj H.G. (2003) Increased oxidative stress and altered levels of antioxidants in asthma. J. Allergy Clin. Immunol. 111, 72‐78. Nanjundaswamy A.M. (1998) Processing. In The Mango. Botany, Production and Uses; Litz, R.E.; Ed.; CAB International: Wallingford, UK, 509–544. Naparalert Database, Univ. Illinois, Chicago, IL, http://www.ag.uiuc.edu/ffh/narra.html. Suscripción http://stneasy.cas.org (Acceso en abril 12, 2007). USA. en Natarajan D., Balaguru B., Nagamurugan N., Soosairaj S. & Natarajan E. (2010) Ethno‐medico‐botanical survey in the Malligainatham village, Kandarvakottai Taluk, Pudukottai district, Tamil Nadu. Indian J. Trad. Know. 9(4), 768‐774. Nath M. & Choudhury M.D. (2010) Ethno‐medico‐botanical aspects of Hmar tribe of Cachar district, Assam (Part I). Indian J. Trad. Know. 9(4):760‐ 764. Noumi E. (2010) Ethno‐medico‐botanical survey of medicinal plants used in the treatment of asthma in the Nkongsamba region, Cameroon. Indian J. Trad. Know. 9(3), 491‐495. Nuevas‐Paz L., Álvarez‐de León J.C, Suárez‐Torras A., Sordo‐Martínez L., González‐Hernández L., Acosta‐Esquijarosa J. (2012) Estabilidad físico‐ química y microbiológica de la corteza fresca de Mangifera indica L. Rev. Cubana Plant. Med. 17(2), 125‐133. Núñez‐Sellés A.J., Delgado‐Hernández R., Garrido‐Garrido G., García‐Rivera D., Guevara‐García M., Pardo‐Andreu G.L. (2007b) The paradox of natural products as pharmaceuticals. Experimental evidences of a mango stem bark extract. Pharmacol. Res. 55, 351‐358. Núñez‐Sellés A.J., Durruthy Rodríguez M.D., Rodríguez Balseiro E., Nieto González L., Nicolais V., Rastrelli, L. (2007a) Comparison of major and trace elements concentrations in sixteencvarieties of Cuban mango stem bark (Mangifera indica L.). J. Agric. Food Chem. 55, 2176‐2181. Núñez‐Sellés A.J., Vélez Castro H.T., Agüero Agüero J., González González J. (2002) Isolation and quantitative analysis of phenolic constituents, free sugars, and polyols from mango (Mangifera indica L.) stem bark aqueous decoction used in Cuba as nutritional supplement. J. Agric. Food Chem. 50, 762‐766. Núñez‐Sellés A.J. (2005) Antioxidant theraphy: Myth or reality? J. Braz. Chem. Soc. 16, 699‐710. Núñez‐Sellés A.J., Guevara‐García M., Álvarez‐León A., y Pardo‐Andreu A.L. (2007c) Experiencias de la terapia antioxidante con Vimang en la atención primaria de salud en Cuba. Rev. Cubana Salud Pública 33(3), 1‐20. Oh G.S., Pae H.O., Oh H., Hong S.G., Kim I.K., Chai K.Y., Yun Y.G., Kwon T.O., Chung H.T. (2001) In vitro anti‐proliferative effect of 1,2,3,4,6‐penta‐O‐ galloyl‐beta‐D‐glucose on human hepatocellular carcinoma line, SK‐ HEP‐1 cells. Cancer Lett. 174(1), 17‐24. Ortega A., Roca A., Micó J.A. (2002) Modelos animales de dolor. Una visión crítica. Rev. Soc. Esp. Dolor 9, 447‐453. Palanimuthu D., Baskaran N., Silvan S., Rajasekaran D., Manoharan S. (2012) Lupeol, a bioactive triterpene, prevents tumor formation during 7,12‐ imethylbenz(a)anthracene induced oral carcinogenesis. Pathol. Oncol. Res. DOI: 10.1007/s12253‐012‐9541‐9. Pardo‐Andreu G., Delgado R., Núñez‐Sellés A.J., Vercesi A.E. (2006a) Mangifera indica L. extract (Vimang) inhibits 2‐deoxyribose damage induced by Fe (III) plus ascorbate. Phytother. Res. 20, 120‐124. Pardo‐Andreu G., Delgado R., Velho J., Inada N.M., Curti C., Vercesi A.E. (2005a) Mangifera indica L. extract (Vimang) inhibits Fe2+‐citrate‐ induced lipoperoxidation in isolated rat liver mitochondria. Pharmacol. Res. 51, 427‐435. Pardo‐Andreu G., Delgado R., Velho J.A., Curti C., Vercesi A.E. (2005c) Mangiferin, a natural occurring glucosyl xanthone, increases susceptibility of rat liver mitochondria to calcium‐induced permeability transition. Arch. Biochem. Biophys. 439, 184‐193. Pardo‐Andreu G.L., Delgado R., Núñez‐Sellés A.J., Vercesi A.E. (2006a) Dual mechanism of mangiferin protection against iron‐ induced damage to 2‐deoxyribose and ascorbate oxidation. Pharmacol. Res. 53, 253‐260. Pardo‐Andreu G.L., Delgado R., Velho J.A., Curti C., Vercesi A.E. (2005b) Iron complexing activity of mangiferin, a naturally occurring glucosylxanthone, inhibits mitochondrial lipid peroxidation induced by Fe2+–citrate. Eur. J. Pharmacol. 513, 47‐55. Pardo‐Andreu G.L., Junqueira‐Dorta D., Delgado R., Cavalheiro R.A., Santos A.C., Vercesi A.E., Curti C. (2006c) Vimang (Mangifera indica L. extract) induces permeability transition in isolated mitochondria, closely reproducing the effect of mangiferin, Vimang's main component. Chem. Biol. Interact. 159, 141‐148. Pardo‐Andreu G.L., Philip S.Jn, Riaño A., Sánchez C., Viada C., Núñez‐Sellés A.J., Delgado R. (2006d) Natural extract from stem bark of Mangifera indica L. (Vimang) protects against serum oxidative stress related with age in elderly humans. Arch. Med. Res. 37, 158‐164. Pardo‐Andreu G.L., Forrellat Barrios M., Curti C., Hernández I., Merino N., Lemus Y., Martínez I., Riaño A., Delgado R. (2008) Protective effects of Mangifera indica L extract (Vimang), and its major component mangiferin, on iron‐induced oxidative damage to rat serum and liver. Pharmacol. Res. 57, 79–86. Patil S.L. & Patil D.A. (2007) Ethnomedicinal plants of Dhule district, Maharashtra. Nat. Prod. Rad. 6(2), 148‐151. Pauletti P.M., Castro‐Gamboa I., Siqueira Silva D.H., Young M.C., Tomazela D.M., Eberlin M.N., da Silva Bolzani V. (2003) New antioxidant C‐ glucosylxanthones from the stems of Arrabidaea samydoides. J. Nat. Prod. 66, 1384‐1387. Pawar S. & Patil D.A. (2007) Ethnomedicinal uses of barks in Jalgaon district. Nat. Prod. Rad. 6(4), 341‐346. Pawar S. (2012) Plant based folk recipes for treatment of hepatitic disorders in Jalgaon District (M.S.) India. Life Sci. Leaflets 5, 61‐65. Percival S.S., Talcott S.T., Chin S.T., Mallak A.C., Lounds‐Singleton A., Pettit‐ Moore J. (2006) Neoplastic transformation of BALB/3T3 cell and cell cycle of HL‐60 cells are inhibited by mango (Mangifera indica L.) juice and mango juice extracts. J. Nutr. 136(5), 1300‐1304. Pereira A.L.F., Vidal T.F., Teixeira M.C., Oliveira P.F., Pompeu R.C.F.F., Vieira M.M.M., Zapata J.F.F. (2011) Antioxidant effect of mango seed extract Rev. Farmacol. Chile (2012) 5(2): 91 and butylated hydroxytoluene in bologna‐type mortadella during storage. Ciênc. Tecnol. Aliment. Campinas 31, 135‐140. Rieux‐Laucat F., Fischer A., Deist F.L. (2003) Cell‐death signaling and human disease. Curr. Opin. Immunol. 15, 325‐331. Pérez L., Resik S., Cancio R., Robaina M., Gil L. (2003) Efectos del Vimang sobre algunos marcadores de progresión de la infección por VIH‐1 en pacientes cubanos. Rev. Cubana Med. Trop. 55, 115‐118. Rodeiro I., Cancino L., González J., Morffi J., Garrido G., González M.R., Núñez A., Delgado R. (2006) Evaluation of genotoxic potential of Mangifera indica L. extract (Vimang), a new antioxidant product with antioxidant activity. Food Chem. Toxicol. 44, 1707‐1713. Perron N.R., Brumaghim J.L. (2009) A review of the antioxidant mechanisms of polyphenol compounds related to iron binding. Cell Biochem. Biophys. 53(2), 75‐100. Ponnusamy K., Gupta J. & Nagarajan R. (2009) Indigenous technical knowledge (ITK in dairy enterprise in coastal Tamil Nadu. Indian J. Trad. Know. 8(2), 206‐211. Poonam K., Singh G.S. (2009) Ethnobotanical study of medicinal plants used by the Taungya community in Terai Arc Landscape, India. J. Ethnopharmacol. 123, 167–176. Prasad S., Kalra N., Shukla Y. (2008) Induction of apoptosis by lupeol and mango extract in mouse prostate and LNCaP cells. Nutr. Cancer 60(1), 120‐130. Prashantkumar P. & Vidyasagar G.M. (2008) Traditional knowledge on medicinal plants used for the treatment of skin diseases in Bidar district, Karnataka. Indian J. Trad. Know. 7(2), 273‐276. Purkayastha J., Dutta M. & Nath S.C. (2007) Ethnomedicinal plants from Dibru‐Saikhowa biosphere reserve, Assam. Indian J. Trad. Know. 6(3), 477‐480. Pushpangadan P. & George V. (2010) Ethnomedical practices of rural and tribal populations of India with special reference to the mother and chilcare. Indian J. Trad. Know. 9(1), 9‐17. Rajendran K., Balaji P. & Basu M.J. (2008a) Medicinal plants and their utilization by villagers in southern districts of Tamil Nadu. Indian J. Trad. Know. 7(3), 417‐420. Rajendran P., Ekambaran G., Sakthisekaran D. (2008b) Effect of mangiferin on benzo(a)pyrene induced lung carcinogenesis in experimental Swiss albino mice. Nat. Prod. Res. 22(8), 672‐680. Rodeiro I., Donato M.T., Jiménez N., Garrido G., Delgado R., Gomez‐Lechon M.J. (2007) Effects of Mangifera indica L. aqueous extract (Vimang) on primary culture of rat hepatocytes. Food Chem. Toxicol. 45, 2506‐2512. Rodeiro I., Donato M.T., Lahoz A., González‐Lavaut J.A., Laguna A., Castell J.V., Delgado R., Gómez‐Lechón M.J. (2008) Modulation of P450 enzymes by Cuban natural products rich in polyphenolic compounds in rat hepatocytes. Chem. Biol. Interact. 172, 1–10. Rodeiro I., Donato M.T., Lahoz A., Garrido G., Delgado R., Gómez‐Lechón M.J. (2008b) Interactions of polyphenols with the P450 system: possible implications on human therapeutics. Mini Rev. Med. Chem. 8(2), 97‐106. Rodeiro I., Gómez‐Lechón M.J., Perez G., Hernandez I., Herrera J.A., Delgado R., Castell J.V., and Donato M.T. (2012) Mangifera indica L. extract and mangiferin modulate cytochrome P450 and UDPglucuronosyltransferase enzymes in primary cultures of human hepatocytes. Phytother. Res. DOI: 10.1002/ptr.4782. Romano A., Freudenthal R., Merlo E., Routtenbert A. (2006) Evolutionary‐ conserved role of the NF‐κB transcription factor in neural plasticity and memory. Eur. J. Neurosci. 24, 1507‐1516. Rosario‐Fernandez L.A., Guerra I., Almeida‐Valera E., Leyva‐Pelaez O., Alonso A., Rodriguez Y. (2010) Evaluation in vitro of the radioprotector effect of the aqueous extract of Mangifera indica L. (Vimang). Toxicology Lett. 196S, S156. Rout S.D. & Panda S.K. (2010) Ethnomedicinal plant resources of. Indian J. Trad. Know. 9(1), 68‐72. Rozas‐Muñoz E., Lepoittevin J.P., Pujol R.M., Giménez‐Arnau A. (2012) Allergic contact dermatitis to plants: Understanding the chemistry will help our diagnostic approach. Actas Dermosifiliogr. 103(6), 456‐477. Rajesh M.S., Harish M.S., Raghuram setty A., Bhanumathi M., Pattanashetty S., Hanumantharayappa B, Satish H., Sathya prakash R.J.and Shivananda T.N. (2008) Antihyperglycemic activity in the seed kernel of Mangifera indica. Phcog. Mag. 4, S69‐S72. Sarkar A. & Das A.P. (2010) Ethnobotanical formulations for the treatment of jaundice by the Mech tribe in Duars of West Bengal. Indian J. Trad. Know. 9(1), 134‐136. Rajith N.P., Navas M., Thaah AM.., Manju M.J., Anish N., Rajasekharan S. & George V. (2010) A study on traditional mother care plants of rural communities of South Kerala. Indian J. Trad. Know. 9(1), 203‐208. Sarkar A., Sreenivasan Y., Ramesh G.T., Manna S.K. (2004) beta‐D‐Glucoside suppresses tumor necrosis factor‐induced activation of nuclear transcription factor kappaB but potentiates apoptosis. J. Biol. Chem. 279, 33768‐33781. Rajkumar S.V., Fonseca R., Witzing T.E. (2003) Complete resolution of reflex sympathetic dystrophy with thalidomide treatment. Arch. Intern. Med. 163, 1487‐1488. Satapathy K.B. (2010) Ethnoveterinary practices in Japur distric of Orissa. Indian J. Trad. Know. 9(2), 338‐343. Ramteke R.S., Vijayalakshmi M.R., Eipeson W.E. (1999) Processing and value addition of mangoes. Indian Food Ind. 18, 155‐163. Reichert J.A., Dauyhterrs R.S., Rivard R., Simone D.A. (2001) Peripheral and preemptive opioid antinociception in a mouse visceral pain model. Pain 89, 221‐277. Remírez D., Shahrzard T., Delgado R., Sarandi A., O’Brien P. (2005) Preventing hepatocyte oxidative stress cytotoxicity with Mangifera indica L. extract (Vimang). Drug Metab. Drug Inter. 21, 19‐29. Sawangchote P., Grote P.J., and Dilcher D.L. (2009) Tertiary leaf fossils of Mangifera (Anacardiaceae) from Li Basin, Thailand as examples of the utility of leaf marginal venation characters. Am. J. Bot. 96(11), 2048‐ 2061. Shi L., Smolders I., Umbrain V., Lauwers M.H., Sarre S., Michotte Y., Zizi M., Camu F. (2006) Peripheral inflammation modifies the effect of intrathecal IL‐1β on spinal PGE2 production mainly through cyclooxygenase‐2 activity. A spinal microdialysis study in freely moving rats. Pain 10, 307‐314. Ren K., Dubner R. (1999) Inflammatory models of pain and hyperalgesia. ILAR J 40, 111‐118. Rev. Farmacol. Chile (2012) 5(2): 92 Shukla A.N., Srivastava S. & Rawat A.K.S. (2010) An ethnobotanical study of medicinal plants of Rewa distric, Madhya Pradesh. Indian J. Trad. Know. 9(1), 191‐202. Siddique H.R., Saleem M. (2011). Beneficial health effects of lupeol triterpene: a review of preclinical studies. Life Sci. 88(7‐8), 285‐293. Silja V.P., Varma K.S. & Mohanan K.V. (2008) Ethnomedical plant knowledge of the Mullu kuruma tribe of Wayanad distric, Kerala. Indian J. Trad. Know. 7(4), 604‐612. Singh R.K., Singh A. & Sureja A.K. (2007) Sustainable use of ethnobotanical resources. Indian J. Trad. Know. 6(3), 521‐530. Singh R.N. (1990) Marketing and storage in Mango; Indian Council of Agricultural Research (ICAR): New Delhi, India, 72 pp. Skibola C.F., Smith M.T. (2000) Potential health impacts of excessive flavonoid intake. Free Radic. Biol. Med. 29, 375‐383. Tabuti J.R.S., Kukundab C.B., Waakoc P.J. (2010) Medicinal plants used by traditional medicine practitioners in the treatment of tuberculosis and related ailments in Uganda. J. Ethnopharmacol. 127, 130–136. Tamayo D., Mari E., Guevara M., Garrido G., Delgado R., Marchioli R., Núñez Sellés A.J. (2001) Vimang as natural antioxidant supplementation in patients with malignant tumors. Minerva Med. 92, 95‐97. Tetali P., Waghchaure C., Daswani P.G., Antia N.H., Birdi T.J. (2009) Ethnobotanical survey of antidiarrhoeal plants of Parinche valley, Pune district, Maharashtra, India. J. Ethnopharmacol. 123, 229–236. Valverde S., Duarte E.M., Ducangé D., Garrido G., García‐Rivera D., Jáuregui U., Garrido B. (2009) Utilidad de las formulaciones Vimang® en pacientes con osteoartrosis de rodilla. Rev. Soc. Española Dolor 16, 32‐ 41. Vetter G., Geisslinger G., Tegeder I. (2001) Release of glutamate, nitric oxide and prostaglandin E2 and metabolic activity in the spinal cord of rats following peripheral nociceptive stimulation. Pain 92, 213‐218. Vyklicky L. (1979) Techniques for the study of pain in animals. In: Bonica JJ, Liebeskind JC, Albe‐Fessard DG, editors. Advances in Pain Research and Therapy. Vol 3. New York NY: Raven Press, p 727‐745. Walle T. (2004) Absorption and metabolism of flavonoids. Free Radic. Biol. Med. 36, 829‐837. Wilson A.W., Medhurst S.J., Dixon C.I., Bontoft N.C., Winyard L.A., Brackenborough K.T., De Alba J., Clarke C.J., Gunthorpe M.J., Hicks G.A., Bountra C., McQueen D.S., Chessell I.P. (2006) An animal model of chronic inflammatory pain: Pharmacological and temporal differentiation from acute models. Eur. J. Pain 10, 537‐549. Wood J.N. (2005) Molecular Mechanisms of Nociception and Pain. In: Flor H et al. IASP Scientific Program Committee. Pain‐2005 an Updated Review: Refresher Course Syllabus. Seattle: IAPS PRESS, pp. 179‐186. Xu J.T., Xin W.J., Zhang Y., Wu Ch.Y., Liu X.G. (2006) The rol of necrosis factor‐alpha in the neuropathic pain induced by Lumbar 5 ventral root transaction in rat. Pain 123, 306‐321. Xu M., Kim C.J., Neubert M.J., Heinricher M.M. (2007) NMDA receptor‐ mediated activation of medullary pro‐nociceptive neurons is required for secondary thermal hyperalgesia. Pain 127, 253‐262. Thaman R.R. and Whistler W.A. (1996) A review of uses and status of trees and forests in land‐use systems in Samoa, Tonga, Kiribati and Tuvalu with recommendations for future action. South Pacific Forestry Development Programme, Suva, Fiji. Yaacob O., Subhadrabandhu S. (1995) The Production of Economic Fruits in South‐East Asia; Oxford University Press: Kuala Lumpur, 419. Tjiptono P., Lam P.E., Mendoza D.B., Kosiyachinda S. (1984) Status of the Mango Industry in ASEAN In: Mango Fruit Development, Postharvest Physiology and Marketing in ASEAN; Mendoza, D. B.; Wills, R .B. H.; Eds.; ASEAN Food Handling Bureau: Kuala Lumpur, Malaysia, 1–11. Yoshimi N., Matsunaga K., Katayama M., Yamada Y., Kuno T., Qiao Z., Hara A., Yamahara J., Mori H. (2001) The inhibitory effects of mangiferin, a naturally occurring glucosylxanthone, in bowel carcinogenesis of male F344 rats. Cancer Lett. 163, 163‐170. Upadhyay B., Parveen, Dhaker A.K., Kumar A. (2010) Ethnomedicinal and ethnopharmaco‐statistical studies of Eastern Rajasthan, India. J. Ethnopharmacol. 129, 64–86. Zelenka M., Schäfers M., Sommer C. (2005) Intraneural injection of interleukin‐1β and TNFα into rat sciatic nerve at physiological doses induces signs of neuropatic pain. Pain 116, 257‐263. Vaghasiya Y., Patel H. and Chanda S. (2011) Antibacterial activity of Mangifera indica L. seeds against some human pathogenic bacterial strains. Afr. J. Biotechnol. 10(70), 15788‐15794. Rev. Farmacol. Chile (2012) 5(2): 93