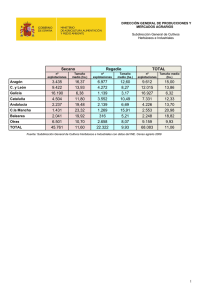
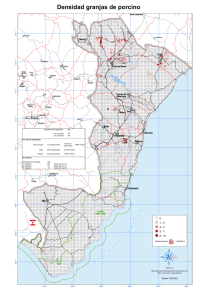
629102 - Academica-e - Universidad Pública de Navarra
Anuncio

Universidad Pública de Navarra Universidad Pública de Navarra Nafarroako Unibertsitate Publikoa Nafarroako Unibertsitate Publikoa ESCUELA ESCUELATECNICA TÉCNICASUPERIOR SUPERIOR INGENIEROS AGRONOMOS DE INGENIEROS AGRÓNOMOS NEKAZARITZAKO INGENIARIEN DE NEKAZARITZA INGENIARIAREN GOI MAILAKO ESKOLA TEKNIKOA GOI ESKOLA TEKNIKOA METODOLOGÍA PARA EL DIAGNÓSTICO DE LA TRICOMONOSIS BOVINA Y ESTUDIO DE LA PREVALENCIA EN LA ZONA DE URBASA Y ANDÍA Presentado por NEREA AZPILICUETA JUANENA k aurkeztua INGENIERO TÉCNICO AGRÍCOLA EN EXPLOTACIONES AGROPECUARIAS NEKAZARITZAKO INGENIARI TEKNIKOA NEKAZARITZA ETA ABELTZAINTZA USTIAPENAK BEREZITASUNA Febrero, 2014 / 2014, Otsaila UNIVERSIDAD PÚBLICA DE NAVARRA ESCUELA TÉCNICA SUPERIOR DE INGENIEROS AGRÓNOMOS Departamento de Producción Agraria Trabajo Fin de Carrera: METODOLOGÍA PARA EL DIAGNÓSTICO DE LA TRICOMONOSIS BOVINA Y ESTUDIO DE LA PREVALENCIA EN LA ZONA DE URBASA Y ANDÍA Autora Nerea Azpilicueta Juanena Director José Manuel Úriz Olaiz Tutora Kizkitza Insausti Barrenetxea Titulación Ingeniería Técnica Agrícola Convocatoria Febrero 2014 ÍNDICE RESUMEN………………………………………………………………..……...… 1 INTRODUCCIÓN……………………………………………………………...….. 3 CAPÍTULO I. ANTECEDENTES…………………………………………...….... 5 1.- Parasitología veterinaria……………………………………………….............. 6 1.1.- Concepto de parasitología………………….…………………….…..... 6 1.2.- Parásito, huésped y ciclo biológico……………………………….…….. 8 1.3.- Clasificación taxonómica de los endoparásitos que afectan al ganado doméstico………………………………………………...………................ 10 1.3.1.- Endoparásitos pertenecientes al Reino Protista…………….. 11 1.3.2.- Endoparásitos pertenecientes al Reino Animalia……….…. 13 1.4.- Principales enfermedades endoparasitarias del ganado vacuno…...…. 20 1.4.1.- Enfermedades producidas por parásitos gastrointestinales…. 21 1.4.2.- Enfermedades producidas por parásitos pulmonares …….… 23 1.4.3.- Enfermedades producidas por parásitos hemáticos………… 23 1.4.4.- Enfermedades producidas por parásitos en el tracto reproductor......................................................................................... 23 2.- Tricomonosis bovina………………………………..………………………… 24 2.1.- Agente etiológico………………..………………...………………….. 25 2.2.- Epidemiología……..………………..………………………………… 26 2.2.1.- Prevalencia………………………………………….………. 26 2.2.2.- Transmisión………………………………………………… 27 2.2.3.- Factores de riesgo………………………………………...… 27 2.3.- Patogenia y respuesta inmune……………………..………….. …….. 28 2.3.1.- En el macho…………………………………..…………….. 28 2.3.2.- En la hembra………………………………………………... 28 2.3.3.- Respuesta inmune natural a la infección por T. foetus……... 29 2.4.- Cuadro clínico……………………….……………………………….. 29 2.4.1.- Individual…………...………………………………………. 29 2.4.2.- De rebaño………………...…………………………………. 30 2.5.- Diagnóstico…………………………………………………………… 30 2.6.- Prevención y control……………………….…………………………. 31 OBJETIVOS…………………………………………………………...…………. 33 CAPÍTULO II. FAMILIARIZACIÓN CON LA METODOLOGÍA PARA EL DIAGNÓSTICO DE LA TRICOMONOSIS BOVINA…………………..……. 35 1.- Introducción…………………………………………………………………… 36 2.- Toma de muestras……………………….……………………………………. 37 3.- Análisis de laboratorio…………………………………………………..……. 42 3.1.- Cultivo e identificación microscópica del agente………..…………… 42 3.2.- Confirmación por PCR…………………………………….…………. 46 3.2.1.- Extracción del ADN…………………………………..……. 46 3.2.2.- Amplificación del ADN………………………………..…… 48 3.2.3.- Electroforesis por la técnica de microfluidos………….…… 50 CAPÍTULO III. ESTUDIO DE LA PREVALENCIA Y DE LOS FACTORES DE RIESGO DE LA TRICOMONOSIS BOVINA EN EXPLOTACIONES QUE PASTOREAN EN LA SIERRA DE URBASA Y ANDÍA……………….. 53 1.- Introducción…………………………………………………………………… 54 2.- Material y métodos…………………………………………………………. 55 3.- Resultados………………………………………………………………...…… 56 4.- Discusión…………………………………………………………………...….. 60 CAPÍTULO IV. CONCLUSIONES…..………………………………………… 62 CAPITULO V. TERMINOLOGÍA…………………………………..…………. 64 BIBLIOGRAFÍA……….………………………………………………………… 71 ANEXO I. MATERIAL EMPLEADO…………………………………………. 75 ANEXO II. RESOLUCIÓN 298/2013, POR LA QUE SE PROHIBE EL ACCESO DE LOS TOROS A LOS PASTOS DE LA SIERRA DE URBASA Y ANDÍA…………………………………………………………………………….. 82 ANEXO III. ENCUESTA REALIZADA A LOS GANADEROS....................... 85 ANEXO IV. RESULTADOS DE LAS ENCUESTAS…………….………….… 88 ÍNDICE DE IMÁGENES ÍNDICE DE IMÁGENES: Capítulo I. Antecedentes. Imagen 1. Diferentes tipos de relaciones simbióticas: Relación depredador-presa (1), foresis (2), mutualismo (3), comensalismo (4) y parasitismo (5)…………………… 7 Imagen 2. Parásitos que afectan a los animales…………………………….……… 10 Imagen 3. Ciclo bilógico de Fasciola hepática, trematodo digenético………..…... 15 Imagen 4. Ciclo biológico de teniasis en humanos producida por T. saginata y T.solium………………………………………………………………………….… 16 Imagen 5. Ciclo biológico de un falso verme plano………………………..……… 18 Imagen 6. Ciclo de vida directo de un nematodo, sin hospedador intermediario…. 20 Imagen 7. Tritrichomonas foetus………………………………………………..…. 25 Imagen 8. La transmisión de la enfermedad es venérea y ocurre durante la cópula. 27 Imagen 9. La enfermedad cursa con fallo reproductivo (izda.), acompañado de escasos signos clínicos como una descarga vulvo-vaginal mucopurulenta (dcha.)… 30 Capítulo II. Familiarización con la metodología para el diagnóstico de la tricomonosis bovina. Imagen10. Pata trasera del semental atada a una barra para evitar que dañe al veterinario clínico encargado de tomar la muestra………………………………… 37 Imagen 11. Toro atrapado con una bola de paja y una valla, preparado para ser muestreado………………………………………………………………………..... 38 Imagen 12. Tricotomía y limpieza de la zona prepucial para evitar incorporar suciedad a la muestra………………….……………………………………..……. 38 Imagen 13. Masaje en la cavidad prepucial con el fin de que las trichomonas presentes en las criptas glandulares se desprendan…………………………...…… 39 Imagen 14. Anatomía del aparato reproductor del toro……………………………. 39 Imagen 15. Introducción del raspador por el orificio prepucial………...…………. 40 Imagen 16. Lavado del raspador en el tubo con la solución de PBS………………. 40 Imagen 17. Secuencia del aislamiento de trichomonas. De izda. a dcha.: se toma 1ml de la solución de PBS con el esmegma prepucial, se introduce en la cámara superior del sobre In Pouch, se pasa todo el contenido a la cámara inferior……… 41 Imagen 18. Incubador en el que se mantienen las muestras a 37ºC para el cultivo.. 42 Imagen 19. Preparación de las muestras para ser observadas al microscopio. De arriba a abajo y de izda. a dcha.: en el interior de una campana de flujo laminar, se homogeniza el contenido del sobre; se toman 30 µL con una pipeta; se pasan a un portaobjetos y se cubren con un cubreobjetos……………………………..………. 43 Imagen 20. Microscopio con contraste de fases con el que son examinadas las muestras……………………………………………………………………………. 44 Imagen 21. Observación de la muestra directamente desde el sobre In Pouch……. 45 Imagen 22. Imagen del control de T. foetus disponible en el Laboratorio de Calidad Agroalimentaria, para poder identificar el parásito en la muestras………………... 45 Imagen 23. Se trabaja sobre hielo picado para mantener el frío, ya que los reactivos que se emplean son muy sensibles……………………………………………...…. 46 Imagen 24. Una vez añadida la proteinasa K a la muestra, se mete a un termobloque para acelerar el proceso de lisis………………………………………………...….. 47 Imagen 25. El proceso de purificación del ADN se realiza mediante la centrifugación con distintitos buffers de lavado………………………………………………...… 48 Imagen 26. La amplificación del fragmento de ADN tiene lugar en el termociclador. 49 Imagen 27. Perfil térmico de la PCR…………………………………………...….. 50 Imagen 28. El gel se añade en el pocillo coloreado de verde (derecha). Tras introducir el chip en la plataforma de cebado, el gel invade los microcanales (izquierda)….... 51 Imagen 29. Se añaden los reactivos a los pocillos correspondientes del chip: gel (1), buffer de carga (2), ladder (3) y muestras con el ADN amplificado (4)…………... 51 Imagen 30. El voltaje aplicado hace que las moléculas cargadas migren hacia el canal de separación………………………………………………………………….…… 52 Capítulo III. Estudio de la prevalencia y de los factores de riesgo de la tricomonosis bovina en las explotaciones que pastorean en la Sierra de Urbasa y Andía. Imagen 31 Mapa de las explotaciones de vacuno de carne que tienen relación con el foco de tricomonosis bovina declarado en Lezaun.…………………………….….. 56 Anexo I. Material. Imagen 32. Raspador de plástico (derecha) y detalle del extremo posterior en el que 76 se aprecian las ranuras que hacen las veces de raspador (izquierda)……………... Imagen 33. Medio de transporte y de cultivo In PouchTM TF…………………..…. 77 Imagen 34. Agitador tipo vortex o mezclador de vórtice…………………..……… 78 Imagen 35. Columna de extracción y tubo colector………………………..……… 79 Imagen 36. Qiagen Kit DNeasy Blood & Tissue (50), con el que se realiza la extracción del ADN…………………………………………………………...…… 79 Imagen 37. Sistema de electroforesis automatizado Experion……………….……. 81 ÍNDICE DE TABLAS ÍNDICE DE TABLAS: Capítulo I. Antecedentes. Tabla 1. Principales enfermedades endoparasitarias del ganado vacuno……….……. 21 Tabla 2. Enfermedades parasitarias de declaración obligatoria en animales terrestres.. 24 Capítulo II. Familiarización con la metodología para el diagnóstico de la tricomonosis bovina. Tabla 3. Fechas para la toma de muestras………………………………….……… 41 Capítulo III. Estudio de la prevalencia y de los factores de riesgo de la tricomonosis bovina en las explotaciones que pastorean en la Sierra de Urbasa y Andía. Tabla 4. Datos relativos al manejo de las explotaciones…………………………... 57 Tabla 5. Datos reproductivos de las explotaciones…………………………….…... 58 Tabla 6. Datos relativos a los animales muestreados…………………………….... 59 Anexo IV. Resultados de las encuestas. Tabla 7. Datos relativos al manejo de las explotaciones que respondieron a la encuesta……………………………………………………………………………... 90 Tabla 8. Datos reproductivos de las explotaciones que respondieron a la encuesta… 93 Tabla 9. Datos de relativos a los animales muestreados………………………...…. 97 RESUMEN METODOLOGÍA PARA EL DIAGNÓSTICO DE LA TRICOMONOSIS BOVINA Y ESTUDIO DE LA PREVALENCIA EN LA ZONA DE URBASA Y ANDÍA La tricomonosis bovina es una enfermedad de transmisión venérea, causada por el protozoo flagelado Tritrichomonas foetus, que cursa con fallo reproductivo temprano. Es frecuente en los sistemas de explotación extensivos que comparten pastos comunales y donde la monta natural es la principal técnica reproductiva. Los toros se infectan al cubrir vacas infectadas quedando como portadores asintomáticos y constituyendo la principal fuente de infección. En Europa, esta enfermedad se creía prácticamente erradicada gracias al uso de la inseminación artificial. Sin embargo, ciertas prácticas de manejo en las explotaciones en régimen extensivo están favoreciendo la reemergencia de la enfermedad. Prueba de ello es el foco detectado recientemente en una explotación de vacuno de carne de Lezaun, que aprovecha los pastos comunales de la sierra de Urbasa. Consecuentemente, el Gobierno de Navarra inició una campaña para analizar todos los toros de las explotaciones relacionadas con el foco, con el fin de conocer la prevalencia de la enfermedad en la zona y determinar su origen. Todo esto hace interesante la realización del presente trabajo final de carrera Así, con la realización de este trabajo se pretende la familiarización con la técnica de diagnóstico de dicha enfermedad. Para ello, en primer lugar, se asistió a una charla informativa acerca de la parasitosis. Posteriormente, se acudió a una explotación para ver como se recogían las muestras y al laboratorio encargado de realizar la analítica laboratorial. Todo ello permitió redactar el protocolo para la recogida de muestras, el cultivo del agente a partir de las mismas y el análisis de laboratorio mediante observación al microscopio y confirmación por PCR. Un segundo objetivo es determinar la prevalencia y los posibles factores de riesgo en las explotaciones que pastorean en la sierra de Urbasa y Andía. Aplicando la metodología recomendada, se analizaron todos los toros de las explotaciones de la zona y se analizaron los distintos factores de riesgo asociados a la enfermedad. Los resultados obtenidos concluyeron que el foco declarado en Lezaun se trata de un hecho aislado cuyo origen no se puede determinar. A pesar de ello, ciertas explotaciones presentan algunas características similares a aquellas con una prevalencia alta de la enfermedad. 2 INTRODUCCIÓN Los procesos parasitarios son unas de las principales causas de enfermedad y de pérdida de productividad en las explotaciones ganaderas de todo el mundo, lo que consecuentemente afecta al rendimiento económico de las mismas. El parasitismo, es un proceso complejo y multifactorial, de modo que los daños que los parásitos ocasionan al ganado varían según el número de parásitos, las condiciones ambientales del momento y las condiciones particulares del manejo de la explotación afectada, que pueden o no favorecer el desarrollo de los parásitos (Pardo, 1996). Por poner un ejemplo, aquellos parásitos que necesitan de hospedadores intermediarios ligados al medio ambiente para poder reproducirse, no pueden tener repercusión en un sistema de producción intensivo en el que los animales no han tenido contacto directo con el medio ambiente. En la actualidad, la disponibilidad de antiparasitarios de alta eficacia y la mejora de las condiciones higiénico-sanitarias y de manejo, han permitido un control aceptable de los parásitos en las explotaciones ganaderas. Sin embargo, en el caso del ganado bovino de carne, las prácticas de cría y manejo en los sistemas de producción extensiva están favoreciendo la reemergencia de algunas enfermedades parasitarias que se creían desaparecidas o, en todo caso poco importantes económicamente, como es el caso de la tricomonosis bovina (Ortega-Mora et al., 2011). Se trata de una enfermedad venérea causada por el protozoo Tritrichomonas foetus, que cursa con fallo reproductivo temprano originando importantes pérdidas económicas en la explotación afectada. Los toros se infectan cuando cubren vacas infectadas, quedando éstos como portadores asintomáticos y constituyendo la principal fuente de infección en los rebaños. Recientemente se ha detectado un foco de tricomonosis bovina en una explotación de vacuno de carne de Lezaun que aprovecha los pastos comunales de la sierra de Urbasa. Como consecuencia del foco declarado, desde el Gobierno de Navarra se puso en marcha una campaña para analizar todos los toros de las explotaciones que pastorean en la Sierra de Urbasa y Andía, con el fin de conocer su situación en la zona, pues se trata de una enfermedad cuya prevalencia es poco conocida. Por todo ello, este trabajo final de carrera tiene por objeto la familiarización con la metodología empleada para el diagnóstico de la enfermedad, así como el estudio de la prevalencia y de los factores de riesgo de dicha enfermedad en las explotaciones que pastorean en la Sierra de Urbasa y Andía relacionadas con el foco. 4 CAPÍTULO I ANTECEDENTES 1.- PARASITOLOGÍA VETERINARIA. 1.1.- Concepto de parasitología. El término simbiosis viene del griego y significa “vivir juntos” (Sym significa “juntos” y biosis significa “vida”). Por lo tanto, una relación simbiótica es aquella que describe cualquier asociación entre, al menos, dos organismos vivos de especies diferentes, los cuales reciben el nombre de simbiontes. De acuerdo con los resultados de esa asociación, se pueden distinguir cinco tipos diferentes de relaciones simbióticas (Hendrix, 1999): depredador-presa, foresis, mutualismo, comensalismo y parasitismo (Imagen 1). En la asociación depredador-presa se establece una relación extremadamente breve, entre una especie, el depredador, que persigue, mata y consume a ejemplares de otra especie, la presa. Un ejemplo de esta relación, es el león que mata a la cebra que le sirve como alimento. En la foresis (fore significa “transportar”), un organismo brinda transporte o protección a otro de diferente especie y menor tamaño, denominado foronte. Un ejemplo es Musca domestica, que transporta entre sus patas o tórax bacterias y protozoarios que actúan como forontes, y los traslada hacia un sitio en el que pueden ser foco de infección para el ser humano. La asociación que se da entre dos organismos de diferentes especies en la cual ambos obtienen un beneficio mutuo, se conoce con el nombre de mutualismo. En el líquido del rumen de una vaca nadan millones de protozoos ciliados unicelulares. La vaca les proporciona a los ciliados un ambiente favorable en el que vivir, y estos a cambio, degradan la celulosa para la vaca y contribuyen a sus procesos digestivos. En el comensalismo uno de los simbiontes (denominado comensal), se beneficia de otro (llamado huésped), sin causarle daño. El comensal es de menor tamaño que su huésped. Como ejemplo de comensalismo cabe citar la relación que se establece entre el tiburón y la rémora. Ésta se fija al abdomen del tiburón y come los restos y desechos de su comida, obteniendo un beneficio de la relación mientras que el tiburón no sale beneficiado ni perjudicado. El parasitismo se da cuando existe una asociación entre organismos de distintas especies, en la cual un organismo llamado parásito vive a expensas de otro denominado huésped al que le produce daño. El parásito depende metabólicamente del huésped. 6 Imagen1. Diferentes tipos de relaciones simbióticas: Relación depredador-presa (1), foresis (2), mutualismo (3), comensalismo (4) y parasitismo (5). Así pues, se define parasitología como la parte de la biología que se encarga de estudiar el parasitismo. Para un análisis más específico, su campo de investigación se divide en tres ramas: parasitología médica cuando se trata de parásitos que afectan al ser humano, zooparasitología o parasitología veterinaria si éstos son capaces de inducir enfermedades en los animales y fitiparasitología si los parásitos afectan a plantas. Tanto virus, bacterias como hongos, pueden actuar como parásitos, pero de su estudio se encarga la microbiología, centrándose por tanto la parasitología en los organismos eucariotas como son los platelmintos, nematodos, artópodos y protozoos. Hay enfermedades que se transmiten desde animales vertebrados al hombre bajo condiciones naturales, y viceversa, que se conocen como zoonosis. Algunas zoonosis, son causadas por parásitos y tienen gran trascendencia tanto para la salud humana como para la salud animal El presente trabajo se va a centrar en la parasitlogía veterinaria, es decir, la que trata las enfermedades que afectan a los animales. 7 1.2.- Parásito, huésped y ciclo biológico. Se define parásito como aquel organismo que depende de otro para poder desarrollarse, ocasionándole daños pero no la muerte. Considerando diversos criterios, los parásitos pueden clasificarse en las siguientes categorías, teniendo en cuenta que una misma especie parasitaria puede pertenecer a varias de ellas. Según su localización en relación al huésped los parásitos se pueden agrupar de la siguiente manera: Ectoparásitos: aquellos que viven sobre la superficie externa o en cavidades que comunican directamente con el exterior. El ectoparasitismo es el parasitismo externo. Endoparásitos: aquellos que viven dentro del cuerpo de los huéspedes hallándose en el tubo digestivo, pulmones, hígado y otros órganos internos. El endoparasitismo es el parasitismo interno. Las relaciones parásito/hospedador tienen lugar por la exigencia de nutrientes por parte del parásito. Atendiendo a la obligatoriedad de parasitismo, estos se pueden clasificar en: Parásitos facultativos: cuando los organismos que viven libremente (no parásitos), pueden volverse parásitos en determinados huéspedes. Parásitos obligados: cuando tienen dependencia metabólica estricta y selectiva; son incapaces de vivir libremente. La mayoría de parásitos que afectan a los animales domésticos son parásitos obligados (Hendrix, 1999). La duración de la estancia en el hospedador y la fase parasitaria implicada, permiten distinguir: Parásitos temporales: aquellos que visitan al huésped únicamente en busca de su alimento y una vez satisfecho, lo abandonan. Parásitos estacionarios: aquellos que requieren del huésped casi en la mayoría de su vida o en un periodo importante de ella. Se clasifican a su vez en: - Parásitos periódicos: si sólo es parásita una de las fases del ciclo. - Parásitos permanentes: si todas las fases son parásitas excepto, cuando cambian de huésped. Considerando el número de huéspedes que emplean para completar el ciclo bilógico, se distinguen: Parásitos monoxenos: si sólo requieren de un huésped para completar su ciclo. Parásitos polixenos o heteroxenos: cuando el ciclo biológico exige la participación obligada de varios huéspedes. 8 Además, cuando un parásito se encuentra en un hospedador en el que habitualmente no vive, recibe el nombre de parásito accidental. Cuando alcanzan el estado adulto, los parásitos tienen una localización fija en el organismo, de manera que aquellos que no se encuentran en situación habitual se denominan parásitos erráticos o aberrantes. Los huéspedes son los organismos que albergan a los parásitos. Se diferencian en dos tipos fundamentales: huésped definitivo, en el que el parásito alcanza la madurez sexual o se reproduce sexualmente; y el huésped intermediario, en el que el parásito lleva a cabo las fases inmaduras de su ciclo de vida o se reproduce asexualmente. Cuando un mismo hospedador actúa como definitivo e intermediario, se conoce con el nombre de huésped completo. Asimismo, existen otras denominaciones de los huéspedes no menos importantes: Huésped paraténico: organismo que aloja una fase evolutiva de un parásito, pero no puede expulsarla debido a que se encuentra enquistada. Huésped reservorio: organismo vertebrado en el que de forma natural, se alberga un parásito o una enfermedad y constituye una fuente de infección para el hombre y los animales domésticos. Huésped accidental: organismo en el cual un parásito pude desarrollarse pero no es normal o habitual. El ciclo biológico consiste en los cambios por los que pasa un parásito desde el comienzo de la vida, hasta que alcanza la madurez, se reproduce y muere. De igual modo, a los ciclos biológicos se les designa con diferentes nombres atendiendo a distintos criterios. Según el número de huéspedes que un parásito necesita para desarrollarse completamente, el ciclo puede ser: directo, cuando el parásito requiere de un sólo huésped; o indirecto, cuando el parásito necesita dos o más huéspedes. En caso de que un parásito desarrolle su ciclo tanto de forma directa como indirecta, el ciclo se denomina diheteromonógeneo. Con relación a la reproducción, el ciclo puede ser monogenético si el parásito sólo tiene un tipo de reproducción en su ciclo biológico, bien sea sexual o asexual; siendo heterogenético cuando el parásito presenta en su ciclo una etapa sexual y otra asexual. 9 1.3.- Clasificación taxonómica de los endoparásitos que afectan al ganado doméstico. Los parásitos que afectan a los animales, según el esquema de clasificación de Linneo, pertenecen al reino Animalia y al reino Protista. Dentro del primer reino, se incluyen los platelmintos (vermes planos: trematodos y cestodos), nematodos (vermes redondos), acantocéfalos (vermes con cabeza espinosa), anélidos (sanguijuelas), y artrópodos (insectos, ácaros, garrapatas, arañas, pentastómidos y otras criaturas con apéndices articulados), todos ellos pluricelulares. En el segundo, se incluyen los protozoos, organismos unicelulares (Hendrix, 1999). Parásitos animales Reino Animalia (pluricelulares) Reino Protista (unicelulares) - Platelmintos: trematodos y cestodos, vermes planos. - Nematodos: vermes redondos. - Acantocéfalos: vermes con cabeza espinosa. - Anélidos: sanguijuelas. - Artrópodos: insectos, ácaros, garrapatas, arañas, pentastómidos y otras criaturas con apéndices articulados. Protozoos Imagen 2. Parásitos que afectan a los animales. Aquellos parásitos que producen parasitosis internas y tienen más importancia en el ganado doméstico son los platelmintos, los nematodos y los protozoos. A continuación se detallan las características de cada grupo. 10 1.3.1.- Endoparásitos pertenecientes al Reino Protista. Características Los protozoos son organismos unicelulares, es decir, están formados por una sola célula. La mayoría de ellos viven libremente; no obstante, los que son parásitos pueden causar importantes problemas de salud en los animales domésticos (Hendrix, 1999). La forma y tamaño de los protozoos varía mucho, pero la mayor parte de ellos son microscópicos (desde unas micras a varios cientos). A pesar de su pequeño tamaño, los ciclos vitales que presentan son complejos y pueden producir cambios patológicos importantes en sus huéspedes. En los protozoos se distingue una forma activa que se conoce con el nombre de trofozoito, en la cual se alimenta, se reproduce, se moviliza y ejerce su acción patógena. En muchos casos, el trofozoito tiene capacidad de transformarse en quiste, una forma de resistencia para hacer frente a las condiciones adversas que se producen en el ambiente (desecación, cambios de temperatura, pH, humedad, concentración de oxígeno, etc). También es la forma de transmisión de la enfermedad (etapa infectante) y la de multiplicación (Quiroz, 2005). En cuanto a la estructura, el componente fundamental del cuerpo del protozoo es el protoplasma, el cual está diferenciado en núcleo y citoplasma. Los núcleos tienen formas, tamaños y estructuras variadas. La mayoría de los protozoos contienen un solo núcleo, pero hay muchos que tienen dos o más. El citoplasma es la parte extranuclear del cuerpo del protozoo. En su interior se encuentran distintas formaciones citoplasmáticas que cumplen con las distintas funciones vitales y que se conocen con el nombre de organelas (Gállego, 2006). La reproducción en los protozoarios puede ser sexual o asexual. La forma más común de reproducción asexual es la fisión binaria, en la cual cada individuo se divide en dos. La esquizogonia consiste en la división del núcleo celular en varios núcleos secundarios. Al tercer tipo se le conoce con el nombre de gemación, proceso por el que se desarrolla una célula hija a partir de su progenitor, hasta alcanzar el tamaño del adulto separándose después. En la gemación interna o endodiogenia, se forman dos células hijas por brotamiento interno (Quiroz, 2005). En los parásitos protozoarios se dan dos tipos de reproducción sexual. En el proceso que se conoce como conjugación, son únicamente los núcleos los que intervienen, de forma que los individuos portadores de los núcleos se adosan temporalmente durante el mismo, para separarse una vez completado. En la singamia, dos gametos se fusionan y forman un zigoto (Gállego, 2006). 11 Clasificación El reino Protista se divide en varios filos, los cuales difieren según los distintos tipos de orgánulos de locomoción que presentan. Los filos con más trascendencia en sanidad animal son: Sarcomastigophora, que engloba los flagelados y las amebas, Ciliphora, que comprende los ciliados, y Apicomplexa, que incluye los coccidios (Hendrix, 1999). Filo Sarcomastigophora Dentro de este filo, existen dos subfilos con interés para el ganado: subfilo Mastigophora y subfilo Sarcodina. Subfilo Mastigophora (flagelados) Los protozoos pertenecientes a este grupo son piriformes y se mueven por medio de flagelos, un largo apéndice en forma de látigo, que permite los movimientos del protozoo en un medio líquido como la sangre, la linfa o el líquido cefalorraquídeo del hospedador. La patogenicidad de estos organismos puede variar mucho. Algunos géneros importantes de parásitos flagelados que afectan a los animales domésticos son: Leishmania, Trypanosoma, Trichomonas, Histomonas y Giardia. Subfilo Sarcodina (amebas) Las amebas son protozoos de forma mal definida o globosa, que se mueven gracias a seudópodos (falsos pies). En su forma de trofozoito, se deslizan a lo largo de una superficie sólida, normalmente la superficie que se encuentra en el fondo de un medio líquido. Pueden adoptar una forma quística resistente para hacer frente a condiciones adversas. Algunas amebas son muy patógenas, mientras que otras no parecen lesionar al hospedador. Un género representativo de ameba es Entoameba Histolytica. Filo Ciliophora La superficie corporal de los ciliados, está recubierta en su mayor parte, por una especie de pelos que reciben el nombre de cilios, gracias al movimiento ondulante de los cuales se mueven. La forma y tamaño de los ciliados puede variar mucho, y una característica exclusiva de los mismos, es que poseen dos tipos de núcleo, un macronúcleo y un micronúcleo. Al igual que las amebas, presentan dos formas: el trofozoito móvil, en la cual se mueven rápidamente en el medio líquido, y la forma resistente de quiste. 12 Algunos ciliados, como B. coli y Ichthyophthirius multifiliis, son muy patógenas para sus hospedadores, mientras que otros ciliados, como los que se encuentran en el rumen de las vacas y ovejas, tienen un papel beneficioso. Filo Apicomplexa Los apicomplexans representan los más complejos y diversificados de todos los protozoos. Sus organelas locomotoras no son visibles, son internas y se mueven mediante ondulaciones. Suelen tener forma de plátano, coma o búmeran. En los animales domésticos se encuentran principalmente en el epitelio del aparato digestivo, en las células hemáticas y en las células del sistema reticuloendotelial. Los ciclos vitales de estos protozoos varían mucho según los distintos géneros; pero como rasgo común, son muy complejos y se hallan íntimamente integrados en la fisiología del organismo hospedador. Algunas de las especies más importantes de apicomplexans parásitos pertenecen a los géneros: Eimeria, Isospora, Toxoplasma, Satcocystis, Cryptosporidium, Plasmodium, Babeisa y Theileria. 1.3.2.- Endoparásitos pertenecientes al Reino Animalia. Los parásitos que abarca este reino, a diferencia de los protozoos, son pluricelulares. Aquellos que infestan al ganado doméstico, son los pertenecientes al filo Platelmintos, en concreto a la clase Trematoda y la clase Cestoda; y al filo Nematoda (Hendrix, 1999). Filo Platelmintos Los miembros del filo Platelmintos se conocen con el nombre vulgar de vermes planos, ya que la característica morfológica que tienen en común es que presentan un aplanamiento dorsoventral. Su cuerpo es sólido, sin celoma, con sus órganos embebidos en el parénquima. Normalmente son hermafroditas y su ciclo de vida es indirecto. El filo incluye dos clases de importancia veterinaria: Trematoda y Cestoda. Clase Trematoda Características Dentro de esta clase se pueden diferenciar dos subclases: la subclase Monogenea que suele parasitar peces, anfibios y reptiles; y la subclase Digenea que se asocia con los animales domésticos y el hombre. Los trematodos digenéticos, también conocidos con el nombre de duelas, son anchos, con forma de hoja y aplanados, aunque algunos son gruesos y carnosos. 13 El borde anterior presenta la ventosa oral, en cuyo fondo se encuentra la boca que continúa con la faringe, que a su vez conduce a un esófago el cual se bifurca en dos ciegos sin salida (no tienen ano). Poseen un órgano muscular de fijación, denominado acetábulo o ventosa ventral. La mayoría de las duelas son hermafroditas, es decir, poseen un aparato reproductor completo tanto masculino como femenino localizado en los laterales. Lo más común es que se dé la autofecundación, pero también puede darse una fecundación cruzada entre dos duelas adultas. Ciclo biológico El ciclo biológico de los trematodos es indirecto (Imagen 3). La parte femenina del aparato reproductor produce huevos operculados (característicos de esta subclase) que una vez fertilizados, salen del útero de la duela y son expulsados al exterior del hospedador con sus heces (1). En el exterior, cuando entran en contacto con el agua (2), se incuban y dan lugar a un estadio móvil, denominado miracidio (3). Éste está recubierto de cilios que le permiten nadar en el agua. Ocasionalmente, penetrará en un caracol (4), el primer hospedador intermediario, y en su interior se desarrollará al siguiente estadio, el esporocisto (4a). El esporocisto es un saco en el que se desarrolla el siguiente estadio, la redia (4b). Cada uno da lugar a muchas redias. Éstas a su vez, originan muchas cercarías las cuales están provistas de una cola que le permiten abandonar el caracol (4c). En este punto, y en función del tipo de duela, se pueden dar tres casos: 1. La cercaria penetra en la piel del huésped definitivo donde migra hacia su sitio predilecto y se desarrolla hasta estadio adulto. 2. La cercaria se fija en la vegetación (5), secreta una gruesa pared quística alrededor de sí misma y se transforma en metacercaria (6). Junto con la vegetación, es ingerida por el hospedador definitivo, donde se libera la duela juvenil (7). Ésta migra hacia su localización favorita y se desarrolla hasta el estadio adulto (8). 3. La cercaria penetra en el segundo hospedador intermediario, donde se transforma en metacercaria. Éste es ingerido por el hospedador definitivo, donde se libera la duela juvenil que, posteriormente migra hacia su localización preferida y se transforma en duela adulta. La localización más común de las duelas guarda relación con el tracto digestivo, aunque también se encuentran en los pulmones o en el árbol vascular. 14 Imagen 3. Ciclo bilógico de Fasciola hepática, trematodo digenético. (http://www.cdc.gov/) Clase Cestoda Dentro de la clase Cestoda, existen dos subclases con importancia para el ganado: Eucestoda (verdaderos vermes planos) y Cotyloda (falsos vermes planos). o Subclase Eucestoda (verdaderos vermes planos) Características Son parásitos alargados, aplanados, segmentados y con forma de cinta. En el extremo anterior se encuentran los órganos de fijación, conocidos como escólex o cabeza. El escólex posee cuatro ventosas llamadas acetábulos, que le sirven para sujetarse a la mucosa del intestino delgado, hábitat de la mayoría de los cestodos. Los nutrientes los absorben por medio de su tegumento o pared corporal, ya que no poseen boca. Algunos pueden presentar una organela en forma de gancho, denominada róstelo que también les permite anclarse al intestino. En la zona posterior al escólex se encuentra la región germinal o de crecimiento, el cuello, a partir del cual se origina el resto del cuerpo o estróbilo. Éste está formado por diversas proglotis, siendo las más jóvenes o inmaduras las más próximas al escólex y al cuello; las que se encuentran a 15 media distancia, las proglotis maduras; y las que están más alejadas, las proglotis viejas o grávidas. Cada proglotis contiene un grupo completo de órganos reproductores masculinos y femeninos, por lo que son hermafroditas. Conforme las proglotis se van alejando del escólex, van perdiendo su capacidad reproductiva. Ciclo biológico El ciclo biológico de los verdaderos vermes planos es indirecto (Imagen 4). Las proglotis grávidas alcanzan el medio externo y liberan miles de embriones hexacantos o huevos (1). Éstos son ingeridos por un hospedador intermediario (vertebrado o invertebrado), donde se transforman en metacestodos, que pueden adoptar diferentes formas dependiendo del hospedador escogido, la estructura, lugar de elección y patogenicidad sobre el hospedador intermediario (2). Cuando el hospedador intermediario es un mamífero, el metacestodo se transforma en cisticerco, que se desarrolla en el interior de sus tejidos (3). El hospedador definitivo se infecta al ingerir al hospedador intermediario que contiene el cisticerco (4), donde se desarrolla a adulto, alcanza sus órganos predilectos (5) y comienza a producir nuevos segmentos (6). Dos ejemplos de verdaderos vermes planos son Taenia saginata en vacuno y Taenia solium en porcino. Imagen 4. Ciclo biológico de teniasis en humanos producida por T. saginata y T.solium. (http://www.cdc.gov/) 16 o Subclase Cotyloda (falsos vermes planos) Características Estos parásitos también son alargados, aplanados, segmentados y con forma de cinta. Al igual que los verdaderos vermes planos están formados en el extremo anterior por el escólex, en cambio para fijarse al intestino delgado poseen dos organelas en hendidura denominadas botrios, que constituyen dos surcos longitudinales a lo largo del escólex. No tienen boca y en su lugar, absorben los nutrientes a través del tegumento. El estóbilo es similar al de los verdaderos vermes planos. El cuello se encuentra inmediatamente después del escólex, y el cuerpo se origina a partir de éste. Está formado por proglotis inmaduras, maduras y grávidas. Son hermafroditas y cada proglotis está formada por un grupo completo de órganos reproductores masculinos y femeninos localizados en el centro. Existe un poro uterino, a través del cual se eliminan los huevos operculados al exterior. Ciclo biológico Durante su ciclo bilógico, utilizan dos hospedadores intermediarios, por lo que es indirecto (Imagen 5). Liberan los huevos operculados directamente del útero, alcanzando el medio exterior por medio de las heces del hospedador definitivo (1). Cuando entran en contacto con el agua (2), liberan un embrión hexacanto ciliado. Este estadio se denomina coracidio, que es ingerido por un crustáceo microscópico acuático, primer hospedador intermediario (3). En su interior evoluciona a un estadio llamado procercoide (4). El primer hospedador intermediario es ingerido junto con el procercoide, por el segundo hospedador intermediario, donde evolucionarán a plerocercoides (5 y 6). El hospedador definitivo se infecta al ingerir al segundo hospedador intermediario, que contiene los plerocercoides (7), los cuales se convierten a metacestodos que se unen a la mucosa del intestino y comienzan a producir estróbilos (8). Comienza de nuevo el ciclo (9). Existen dos especies importantes de falsos vermes planos: Diphyllobothrium latum, el verme plano transmitido por los peces, y Spirometra mansonoides, el verme plano en cremallera. 17 Imagen 5. Ciclo biológico de un falso verme plano. (http://www.cdc.gov/) Filo Nematoda Características Los miembros del filo Nematoda son el grupo de animales más numeroso y con mayor diversidad de la Tierra. Se distinguen tres tipos de nematodos: los que residen en aguas dulces, en el mar y en el suelo; los que parasitan plantas; y los nematodos que parasitan a los animales y al hombre. La mayoría de los nematodos son alargados, no segmentados, redondeados en ambos extremos y circulares en una sección transversal, por lo que se les conoce con el nombre de vermes redondos. Su tamaño puede variar mucho, desde algún milímetro hasta varios centímetros de largo. También existen nematodos con otras formas, por ejemplo esféricos o en forma de látigo. Están cubiertos por una delgada cutícula que recubre toda la superficie corporal externa del parásito y se extiende a todos los orificios corporales como boca, esófago, recto y genitales. Las dos únicas modificaciones de la cutícula externa que presentan los nematodos son las alas cervicales en las hembras y la bolsa copulatoria en los machos. Las primeras, son expansiones aplanadas laterales. Las segundas, son 18 expansiones laterales en el extremo posterior, que le sirven al macho para sostener a la hembra durante el apareamiento. Por debajo de la hipodermis, se encuentra la capa somática muscular, que facilita la movilidad del parásito. Los nematodos presentan cavidad corporal, se trata de un seudoceloma, recubierto por una membrana seudocelomática. En su interior, se encuentra el aparato digestivo y el reproductor. El tracto digestivo consiste en un tubo largo y recto que se extiende desde la boca hasta el ano. La boca puede estar rodeada por labios en algunos casos, en otros por papilas que en conjunto forman lo que se conoce como corona radiata. La boca conecta con una cavidad bucal a la que le sigue el esófago, que comunica con un largo intestino, para finalizar con el recto en las hembras y la cloaca en los machos. Los nematodos presentan dimorfismo sexual, es decir, existen nematodos macho y hembra. Los nematodos son muy prolíficos, una sola hembra puede producir varios miles de huevos cada día. Éstos son de diversos tipos: el tipo ascaroide o ascáride (Toxocara canis), tricostrongílidos, estróngilo o verme ganchudo (Srongylus vulgaris de los caballos), espirurórido o espirúrido (Spirocerca lupi de los perros) y tricoroide (Trichuris vulpis de los perros). Ciclo biológico El ciclo biológico de los nematodos es más simple que el de los platelmintos (Imagen 6). La hembra adulta produce huevos que poseen una sola fase celular en el interior de su cubierta y que son expulsados al exterior a través de las heces (B). La célula original evoluciona a la fase de mórula que a su vez evoluciona a una primera fase de larva completamente desarrollada (L1). La larva emerge de la cubierta del huevo lo que se conoce con el nombre de muda (cambia la cutícula externa) y evoluciona al segundo estadio larvario (L2). Éste, muda a la tercera fase larvaria, que se denomina estadio larvario infeccioso, ya que es infecciosa para el hospedador definitivo (L3) Una vez alcanzado el tercer estadio larvario infeccioso, ésta debe regresar al hospedador definitivo (A). En su interior, L3 muda al cuarto estadio larvario (L4), el cual muda al quinto estadio larvario (L5). Este último finalmente, migra hacia su órgano predilecto y evoluciona al estadio adulto sexualmente maduro. Los nematodos macho y hembra procrean y comienza el ciclo de nuevo. Si el ciclo es directo, las larvas evolucionan a L3 en el medio externo y posteriormente, penetran directamente al interior del hospedador definitivo, donde maduran hasta convertirse en adultos. Si el ciclo es indirecto, los nematodos necesitan de un hospedador intermediario para completar su ciclo, en el cual evolucionan a L3. El hospedador definitivo 19 ingiere al hospedador intermediario que contiene el parásito, donde completa su ciclo hasta transformarse en adulto. Imagen 6. Ciclo de vida directo de un nematodo, sin hospedador intermediario. (http://cal.vet.upenn.edu/projects/merialsp/trichosp/trich6bsp.htm) 1.4.- Principales enfermedades endoparasitarias del ganado vacuno. Los parásitos provocan un trastorno del bienestar animal, alterando el funcionamiento orgánico y el comportamiento animal. Como consecuencia de ello puede haber una presentación clínica del proceso que se expresa como enfermedad parasitaria; o pasar inadvertido al presentarse de forma subclínica, incidiendo de forma sigilosa sobre la producción animal, con repercusiones negativas sobre los índices productivos (Habela et al., 2009). Dependiendo del sistema de explotación tendrán más importancia unas parasitosis u otras. En los sistemas intensivos, algunas parasitosis sólo se presentan de forma esporádica, debido a la dificultad de que los animales entren en contacto con las formas infectivas del parásito. Sin embargo, otros procesos aparecen con mayor frecuencia como consecuencia del hacinamiento de los animales (Elvira et al., 2008). A continuación, se detallan las principales enfermedades endoparasitarias que afectan al ganado vacuno según los sistemas y aparatos que infectan (Tabla 1). 20 Tabla1. Principales enfermedades endoparasitarias del ganado vacuno. Sistema o aparato afectado Agente etiológico Protozoo Trematodo Tracto gastrointestinal Enfermedad Cryptosporidium Criptosporidiosis Género Eimeria Coccidiosis Fasciola hepática Fasciolosis Dicrocoelium dendriticum Dricoceliosis Géneros Paramphistomum, Cotylophoron, Gigantocotyle y Calicophoron Paranfistomosis Moniezia expansa y M. benedini Cestodo Cysticercus bovis (Taenia saginata) Géneros Ostertagia, Nematodirus, Nematodo Cooperia, Trichostrongylus, Bunostomum, Oesophagostomum y Trichuris Sistema respiratorio Nematodo Sangre Protozoo Tracto reproductor Protozoo Teniasis Cisticercosis bovina Nematodosis Dictyocaulus viviparus Bronquitis verminosa B. bigemina, B. divergens y B. Bovis Babesiosis Género Theileria Theileriosis Tritrichomonas foetus Tricomonosis 1.4.1.- Enfermedades producidas por parásitos gastrointestinales. Los parásitos gastrointestinales son aquellos que se encuentran a lo largo del tracto digestivo afectando según el caso esófago, estómago, hígado, conductos biliares e intestino delgado y grueso de los animales. Entre las enfermedades producidas por protozoos intestinales se encuentran la cristoporidiosis y la coccidiosis. Cristoporidiosis: se trata de una zoonosis cuyo agente etiológico es el coccidio Cryptosporidium, que parasita el intestino delgado. Cursa con diarrea amarillenta acuosa y normalmente afecta a terneros de entre dos y tres semanas de vida, siendo los animales adultos normalmente asintomáticos. La transmisión es de tipo fecal-oral, con lo que una buena higiene de las camas, evitando la contaminación de los bebederos y los comederos, y una limpieza estricta y diaria de los mismos, será fundamental para controlar la enfermedad. (Elvira et al., 2008). 21 Coccidiosis: esta enfermedad está producida por numerosas especies del género Eimeria. Se presenta a partir de las tres semanas de edad y afecta a animales menores de seis meses, estando muy influida por el sistema de explotación intensivo y régimen de estabulación. En este caso, el cuadro clínico es diarrea inicialmente grisácea y espesa, que evoluciona hacia hemorrágica. La transmisión es fecal-oral, por lo que para controlar la enfermedad se procederá del mismo modo que en el caso de la criptosporidiosis (Elvira et al., 2008). Dentro de los trematodos cabe destacar tres enfermedades que afectan a algunos de los órganos del tracto gastrointestinal: Fasciolosis: el parásito responsable de esta afección es Fasciola hepática. Es quizás el trematodo más importante en medicina veterinaria desde el punto de vista económico, debido a que produce la destrucción del hígado (Hendrix, 1999), produciendo pérdidas económicas directas por muertes y decomisos de hígados en el matadero; e indirectas, debidas a una disminución de las producciones del ganado (Elvira et al., 2008). También se trata de una zoonosis. Dricoceliosis: producida en España por Dicrocoelium dendriticum, trematodo cuyas formas maduras parasitan los conductos hepáticos y la vesícula biliar de los rumiantes pudiendo producir hiperplasia en el epitelio glandular de estos conductos (Hendrix, 1999). Paranfistomosis: causada por parásitos del género Paramphistomum Cotylophoron, Gigantocotyle y Calicophoron, siendo este último el género más habitual en Europa. Los bóvidos se infectan mediante la ingestión de metacercarias que se desenquistan en el intestino. Las fases juveniles migran a través de la mucosa intestinal, provocando hemorragias por la acción de las espículas presentes en su tegumento, hasta alcanzar el rumen, retículo e incluso abomaso donde se transforman en parásitos adultos (del Cura, 2009). En el caso de los cestodos, una de las especies que produce alteraciones en la salud del vacuno, es Moniezia, concretamente Moniezia expansa y M. benedini, que habita en el intestino delgado de las vacas. Son extremadamente largos, están formados por múltiples segmentos (proglotis) repletos de huevos que salen con las heces al exterior contaminando el suelo. Éstos son ingeridos por un huésped intermediario, que a su vez es ingerido por los animales al alimentarse de pastos contaminados (Hendrix, 1999). Los daños ocasionados son diarreas y problemas digestivos, dando como resultado animales anémicos, con presencia de edema y pérdida de peso progresiva (Elvira et al., 2008). La cisticercosis bovina es producida por el cisticerco (estadio larvario) del cestodo Taenia saginata, denominado Cysticercus bovis. Los cisticercos se localizan en la musculatura del ganado vacuno. Los seres humanos se infectan al ingerir carne de ternera insuficientemente cocida (Hendrix, 1999). La importancia de esta enfermedad radica en el hecho de ser una zoonosis, en la que el ganado vacuno actúa como hospedador intermediario y de agente transmisor. 22 En cuanto a los nematodos, son muchos los que son capaces de producir nematodosis en los bovinos. Dentro de éstos se incluyen especies de capacidad patogénica diferente, como los géneros Ostertagia, Nematodirus, Cooperia, Trichostrongylus, Bunostomum, Oesophagostomum y Trichuris. Todos ellos afectan principalmente, el cuajar y los primeros metros de intestino delgado. Para controlar las enfermedades producidas por nematodos, no conviene la esterilización del ambiente, sino mantener los pastos con tasas de inefectividad bajas (Elvira et al., 2008). 1.4.2.- Enfermedades producidas por parásitos pulmonares. En el caso de la parasitosis que afectan al sistema respiratorio de los bovinos, cabe mencionar la que causa el nematodo Dictyocaulus viviparus, que parasita la tráquea y los bronquios de los mismos. Es frecuente en animales de entre 6 y 24 meses de edad, y se caracteriza clínicamente por tos, disnea, taquipnea, anorexia y pérdida de peso. Como en el caso de los nematodos gastrointestinales, no conviene la esterilización del ambiente, para estimular el desarrollo de la inmunidad (Elvira et al., 2008). 1.4.3.- Enfermedades producidas por parásitos hemáticos. Los protozoos que se localizan en la sangre de los bovinos pertenecen al género Babesia y Theileria. Babesiosis: puede ser producida por tres especies, B. bigemina, B. divergens y B. Bovis. Los animales que la padecen sufren de fiebre elevada, anorexia, depresión y caída de la producción láctea. También ictericia en las mucosas y hemoglobinuria. Theileriosis: presentan fiebre elevada, agalaxia y depresión, además de taquicardia y disnea intensa. El control de estas enfermedades, se basa en controlar a los vectores (garrapatas) mediante desparasitación y tratar las enfermedades clínicas (Elvira et al., 2008). 1.4.4.- Enfermedades producidas por parásitos en el tracto reproductor. La tricomonosis es una enfermedad causada por el protozoo flagelado Tritrichomonas foetus, que se encuentra en el aparato genital tanto de machos como de hembras. Las vacas parasitadas presentan celos repetidos con el consiguiente retraso entre partos. Los toros una vez infectados, quedan como portadores asintomáticos de por vida. Esta enfermedad se describirá con más detalle en el siguiente apartado del presente trabajo. 23 2.- TRICOMONOSIS BOVINA. La tricomonosis bovina, también llamada tricomonosis genital bovina o aborto tricomoniásico, es una enfermedad sexual de transmisión venérea (Quiroz, 2005), que afecta al ganado bovino y está causada por el protozoo flagelado Tritrichomonas foetus. Presenta una distribución mundial y repercute de manera importante, sobre todo en el vacuno de carne, en aquellos lugares donde los sistemas de explotación son extensivos y la monta natural es la principal estrategia reproductiva. Esta enfermedad puede ser causa de pérdidas económicas muy importantes en la explotación afectada, ya que produce una reducción importante de la fertilidad, muertes embrionarias tempranas, y como consecuencia, un alargamiento en el intervalo entre partos (Serrano, 2013). Está incluida en la Lista de enfermedades de declaración obligatoria de la Organización Mundial de Sanidad Animal (OIE) (Tabla 2). Asimismo, está englobada en la Directiva Europea que regula el comercio de semen bovino, y la OIE establece una serie de recomendaciones en relación a esta enfermedad para la importación de animales de cría, sementales y semen de origen bovino (Rojo-Montejo et al., 2010). Tabla 2. Enfermedades parasitarias de declaración obligatoria en animales terrestres. (Fuente: elaboración propia). 24 2.1.- Agente etiológico. El agente etiológico es Tritrichomonas foetus, un parásito protozoario flagelado del género Tritrichomonas, perteneciente a la familia Trichomonadidae, subfilo Mastigophora y filo Sarcomastigophora (Campero et al., 2006). Se distinguen dos formas del parásito, una en estado de trofozoito que constituye la mayor parte de la población normal; y otra forma seudoquística, oval e inmóvil, que aparece como fenómeno de adaptación al huésped en condiciones desfavorables del medio ambiente (Campero et al., 2006). La forma y las dimensiones del trofozoito pueden variar según el medio y las condiciones de desarrollo, pero por lo general es de aspecto piriforme y mide aproximadamente de 10 a 25 micras de largo por 3 a 15 micras de ancho. Presenta tres flagelos anteriores y uno posterior situado sobre la membrana ondulante la cual recorre todo el cuerpo formando de 2 a 5 ondulaciones (Imagen 7). Imagen 7. Tritrichomonas foetus. Presenta unas organelas únicas, los hidrogenosomas, que tienen doble membrana y le permiten al protozoo adaptarse a vivir en condiciones de anaerobiosis o microaerofilia (Cobo y Campero, 2002). Por lo tanto, tensiones elevadas de oxígeno actuarían como un factor limitante en su crecimiento. Es capaz de sobrevivir en condiciones de temperatura compatibles con las utilizadas para mantener el semen congelado para la inseminación artificial (Aramberri et al., 2013). La reproducción de T. foetus es por fisión binaria longitudinal. Se desplaza mediante un movimiento rotatorio entrecortado, siendo a 37ºC muy móvil (OIE, 2008). 25 Tiene un ciclo biológico directo, no presenta formas de vida libre, ni hospedadores intermediarios. El huésped de T.foetus es el bovino, aunque ha sido ocasionalmente aislado en otras especies incluyendo búfalo, equino, cerdo, roedores, felinos y perros. En la hembra, se localizan en la vagina, cérvix, útero y oviducto. En el macho, T. foetus coloniza el pene y el prepucio, sin afectar a los órganos genitales internos, localizándose la mayor concentración en el glande del pene y el fórnix del prepucio (Rojo-Montejo et al., 2010). 2.2.- Epidemiología. 2.2.1.- Prevalencia. En Europa, durante la década de los cincuenta del siglo pasado la tricomonosis bovina ocasionó graves problemas. No obstante la introducción de la inseminación artificial (IA) y el establecimiento de ciertas medidas de manejo y diagnóstico contribuyó a su estabilización (Ortega-Mora et al., 2011). Sin embargo, esta enfermedad es endémica en las zonas donde el ganado bovino se explota en régimen extensivo y se utiliza la monta natural, como ocurre en diferentes zonas de Estados Unidos y Sudamérica, donde se han descrito prevalencias de rebaño hasta del 30% (Ortega-Mora et al., 2011). En España, los últimos datos pertenecientes a un estudio en el norte de la provincia de León en el año 1998, indicaban una prevalencia del 2,9% de toros infectados con esta parasitosis. También hay referencias de la presencia de la infección en explotaciones situadas al oeste peninsular (Cáceres, Badajoz, Salamanca y Ávila), donde el ganado se mantiene en condiciones de extensivo en sistema de dehesa, con una tasa de infección individual del 18,8% y de rebaño del 34,8% (Mendoza, 2013). Por el contrario, estudios más recientes realizados en sementales bovinos seleccionados al azar en una raza representativa de la cría en zonas de montaña como es la Asturiana de Montaña, elevan estos datos hasta niveles de prevalencia individual y del rebaño del 31,1% y 41,5%, respectivamente. En las explotaciones infectadas se observó un incremento de la repetición de celos (50% en rebaños infectados frente al 16% en los rebaños negativos) y un aumento medio de 55 días en el intervalo entre partos en las explotaciones con toros positivos (479 días en los infectados frente a 424 en los negativos) (Ortega-Mora et al., 2011). Es por ello que se considera una enfermedad reemergente. 26 2.2.2.- Transmisión. La transmisión natural de este patógeno se considera estrictamente venérea y ocurre durante la cópula entre animales infectados y no infectados (Imagen 8), resultando suficiente de 200 a 80.000 flagelados para establecer la infección en el prepucio de un toro (Cobo et al., 2002). Los toros se infectan cuando cubren vacas infectadas, quedando éstos como portadores asintomáticos y transmitiendo a su vez la infección a otras vacas no infectadas (Rojo-Montejo et al., 2010). Sin embargo, también puede difundirse por inseminación artificial, si el semen utilizado está contaminado, ya que el parásito puede permanecer viable en el semen congelado (Cobo et al., 2002). Por otra parte, puede tener lugar la transmisión mecánica mediante los instrumentos de inseminación o por el examen del aparato genital de las vacas si no se emplean las medidas de bioseguridad adecuadas (OIE, 2008). Imagen 8. La transmisión de la enfermedad es venérea y ocurre durante la cópula. 2.2.3.- Factores de riesgo. Existen diversos factores que contribuyen a la infección por T. foetus en una explotación. Edad El porcentaje de toros infectados aumenta con la edad debido, por un lado, al mayor número de contactos sexuales y por tanto una mayor exposición al agente etiológico. Por otro lado, los toros de más edad desarrollan criptas glandulares más profundas en la mucosa prepucial, proporcionando así un ambiente microaerlofílico a los patógenos, que favorece su implantación y desarrollo (Mendoza, 2013). 27 Estado de portador La existencia de portadores asintomáticos, principalmente los machos mayores de tres años, aunque también un pequeño porcentaje de hembras, permiten el mantenimiento de la infección en los rebaños afectados. En los machos, dada la baja capacidad de desarrollar una respuesta inmunitaria, la infección persiste durante periodos largos de tiempo. Del mismo modo, como se ha mencionado anteriormente, la presencia de criptas más profundas en el epitelio prepucial de toros mayores, favorecen el desarrollo de T. foetus (Mendoza, 2013). Prácticas ganaderas Determinados hábitos de manejo de los animales facilitan la transmisión de la infección y dificultan su control. Desde la incorporación de España a la Unión Europea, la normativa europea ha sido la que ha marcado las directrices en la evolución del mercado agroganadero español. En el ámbito del ganado bovino, la Política Agraria Común (PAC) ha intentado frenar los excedentes alimentarios, moderando la tendencia a la producción intensiva mediante la introducción de la prima a la vaca nodriza y a la extensificación. Todo ello, ha supuesto la vuelta al uso de métodos tradicionales de explotación de los recursos como los pastos comunales, el uso de la monta natural frente a la IA, así como la importación de sementales de razas foráneas más seleccionadas, por la necesidad de incrementar la productividad de las razas autóctonas mediante el cruce industrial (Ortega-Mora et al., 2011). Todos estos cambios suponen un incremento de posibles factores de riesgo como son la monta natural, los pastos compartidos y la libre circulación de animales con estado sanitario incierto. 2.3.- Patogenia y respuesta inmune. 2.3.1.- En el macho. En el macho, el microorganismo no invade el epitelio, por lo que la infección no cursa con lesiones en el pene ni prepucio. Aunque en algunos casos, al comienzo de la infección, puede aparecer una leve balanopostitis (inflamación del prepucio) que estimula la producción de anticuerpos de forma local, sin embargo esto no es suficiente para evitar la infección (Aramberri el al, 2013). Así pues, la tricomonosis bovina en los machos transcurre de forma asintomática y sin afectar a la calidad del semen o la libido, quedando infectados de por vida y actuando como portadores de la enfermedad. 2.3.2.- En la hembra. En la hembra, la infección progresa rápidamente, pudiendo alcanzar en dos semanas las diferentes partes del aparato genital, localizándose preferentemente en los pliegues del cérvix y en el mucus cérvico-vaginal (Rojo-Montejo et al., 2010). 28 A pesar de que el establecimiento de la infección ocurre en las primeras 72 horas del desarrollo embrionario, no parece interferir con la fertilización del óvulo ni con el desarrollo temprano del embrión. De modo que la mayoría de las pérdidas de gestación ocurren a partir del día 60 de gestación, siendo la endometritis la responsable del aborto. Aunque con menos frecuencia, pueden darse abortos posteriores e incluso en gestaciones a término. Los mecanismos patogénicos relacionados con la pérdida del embrión/feto no se conocen con exactitud (Mendoza, 2013). La infección en las vacas es autolimitante, desapareciendo a los 90 días post-infección. Aquellas que se recuperan adquieren una inmunidad parcial frente a la reinfección. 2.3.3.- Respuesta inmune natural a la infección por T. foetus. En toros infectados naturalmente, se han detectado anticuerpos específicos (IgG1, IgM, IgA e IgG2) en las secreciones prepuciales, sin embargo esta respuesta inmune específica es poco protectora, lo que explicaría el hecho de que los machos sean portadores durante toda su vida (Rojo-Montejo et al., 2010). A diferencia del toro, las vacas son capaces de desarrollar una respuesta inmunitaria efectiva frente a T. foetus. Por ello, el principal mecanismo defensivo del huésped hacia el patógeno, es la inmunorespuesta de las mucosas en el área genital. Así, en las hembras se desarrolla una respuesta a nivel genital caracterizada por la presencia de IgA e IgG1 y una leve respuesta sistémica caracterizada por la presencia de IgG2 e IgG1 (Cobo et al., 2002). Sin embargo, la inmunidad no persiste y esta respuesta sólo es efectiva si la reinfección ocurre dentro de los 15 meses siguientes a una primoinfección, por lo que la vaca podría ser sensible a la reinfección en la siguiente etapa reproductiva (Mendoza, 2013). 2.4.- Cuadro clínico. 2.4.1.- Individual. La enfermedad cursa con fallo reproductivo temprano acompañado de escasos signos clínicos consistentes en vaginitis, cervicitis y/o endometritis moderada (Imagen 9). En ocasiones, se observa una descarga vulvo-vaginal mucosa o mucopurulenta, aunque lo habitual es que no existan signos clínicos manifiestos de la enfermedad (Rojo-Montejo et al., 2010). Al ocurrir el aborto, el feto es expulsado y debido al escaso desarrollo del mismo pasa desapercibido en condiciones de ganadería extensiva. Esporádicamente, puede ser retenido, macerarse o momificarse y originar una piómetra (Campero, 2006). 29 Imagen 9. La enfermedad cursa con fallo reproductivo (izda.), acompañado de escasos signos clínicos como una descarga vulvo-vaginal mucopurulenta (dcha.). 2.4.2.- De rebaño. A nivel de rebaño, la principal observación consiste en la disminución de la fertilidad, con alargamiento del período entre partos y como consecuencia la disminución del número de terneros por año. Según Rojo-Montejo et al., (2010), se estima una reducción en el porcentaje de terneros nacidos al año del 14% al 50% cuando la tasa de toros infectados por T. foetus aumenta del 20% al 40%, respectivamente. Las pérdidas económicas que ocasiona esta enfermedad son muy importantes y pueden medirse indirectamente por varios factores. Entre ellos se encuentran las pérdidas de terneros por muerte embrionaria o aborto, las pérdidas ocasionadas por infertilidad de hembras y reemplazo de toros enfermos. A todo esto, debe sumarse terneros de menor peso al destete, así como el aumento de costos en tratamientos para el control y eliminación de la enfermedad (Campero et al., 2006). 2.5.- Diagnóstico. El diagnóstico provisional de la enfermedad como causa de la ausencia de reproducción en el rebaño, se basa en el historial clínico, los síntomas de aborto prematuro o los ciclos de celo irregulares (OIE, 2008). Para un diagnóstico definitivo, la técnica de referencia para el diagnóstico de rutina y control de la enfermedad es la identificación morfológica del parásito en cultivo y confirmación por PCR (RojoMontejo et al., 2010). 30 2.6.- Prevención y control. La utilización de la inseminación artificial con semen libre de T. foetus es la medida más eficaz para la prevención de la enfermedad, sobre todo en rebaños lecheros y en los de carne de pequeño tamaño. Para aquellos toros destinados a IA se exige la realización de diagnósticos periódicos que garanticen la sanidad de los mismos, y cuarentena para los animales de nueva adquisición (Rojo-Montejo et al., 2010). En aquellos rebaños donde no es posible el empleo de la IA, como es el caso de muchos rebaños de vacuno de carne en extensivo, se recomiendan las siguientes medidas preventivas (Rojo-Montejo et al., 2010): Control del movimiento de los animales, tanto machos como hembras, prestando especial atención al estado de las cercas. Evitar el uso de pastos comunales. En caso de no ser así, se recomienda realizar un diagnóstico periódico de los sementales. Evitar el uso de toros comunales. Usar toros o novillas vírgenes como reposición. Mantener la edad media de los toros tan baja como sea posible, ya que los toros viejos pueden ser portadores permanentes de la enfermedad. Diagnóstico de los toros adquiridos. No mezclar las vacas o novillas de estado sanitario desconocido durante la temporada de cría. Cuando la enfermedad ha sido diagnosticada en una explotación, se deben adoptar diferentes medidas de control para reducir el impacto y eliminar la enfermedad (Rojo-Montejo et al., 2010): Análisis de los toros antes de la temporada de cría y sacrificio de los infectados. Cuando se compren toros, se deben adquirir de rebaños negativos y con certificado de diagnóstico. Reducir la edad promedio de los toros, ya que disminuye la probabilidad de la presencia de portadores. Separar el rebaño en un grupo de bajo riesgo formado por hembras vírgenes. Éstas deben ser cubiertas por toros vírgenes o jóvenes que tampoco estén infectados. El resto de reproductoras pueden pasar al grupo de animales de bajo riesgo, una vez hayan eliminado la infección. Eliminar aquellas vacas que no se queden preñadas durante mucho tiempo y las que abortan de manera repetida, ya que pueden ser portadoras de la enfermedad. Cruzar el mismo grupo de hembras con el mismo macho hasta que la enfermedad esté controlada. Reducir la duración de la temporada de cría a no más de 90 a 120 días, puesto que una larga temporada de cría puede enmascarar la pérdida de productividad atribuible a esta infección. Realizar diagnóstico de gestación a los 45 ó 60 días, de modo que se puedan colocar las vacas vacías en el grupo de alto riesgo. 31 La vacunación frente a T. foetus a día de hoy, aunque en proceso de estudio y desarrollo, todavía no es una herramienta eficaz para el control de la enfermedad. La única vacuna comercial disponible está en Estados Unidos, y es una vacuna muerta frente a T. foetus preparada a partir de organismos enteros. La vacunación es eficaz sólo en el caso de las hembras, y a pesar de que no previene la infección, reduce la gravedad y su duración, permitiendo la desaparición de la infección en hembras vacunadas antes de que sea un riesgo para el feto (Rojo-Montejo et al., 2010) y consiguiendo así disminuir las pérdidas económicas asociadas. En Europa, en cambio, todavía no se han desarrollado vacunas para el control de la tricomonosis bovina. A pesar de haberse probado numerosos tratamientos hasta la actualidad, hoy en día todavía no existen agentes terapéuticos eficaces frente a la tricomonosis bovina. Se han probado derivados del nitroimidazol administrados por vía sistémica o local, pero además de que han mostrado una eficacia reducida, su uso está totalmente prohibido en bovinos por no estar exentos de cierta toxicidad (Rojo-Montejo et al., 2010). 32 OBJETIVOS 33 Los objetivos que se persiguen con la realización del presente trabajo son los siguientes: 1. Familiarización con la metodología para el diagnóstico de la tricomonosis bovina. Las técnicas empleadas para el diagnóstico de la tricomonosis bovina que se venían empleando en los últimos años han quedado fuera de uso. El primer objetivo del presente trabajo es familiarizarse con la metodología empleada tanto para la toma de muestras como para el diagnóstico de la enfermedad. Para ello, se ha hecho un seguimiento exhaustivo en una explotación de Lezaun. 2. Estudio de la prevalencia y de los factores de riesgo de la tricomonosis bovina en explotaciones que pastorean en la Sierra de Urbasa y Andía. Como consecuencia del foco de tricomonosis bovina detectado en abril de 2013 en una explotación de Lezaun, el Gobierno de Navarra inició una campaña para analizar todos los toros de las explotaciones que pastorean en la Sierra de Urbasa y Andía relacionados con el foco. El segundo objetivo es estudiar la prevalencia de la enfermedad en la zona así como los posibles factores de riesgo. 34 CAPÍTULO II FAMILIARIZACIÓN CON LA METEDOLOGÍA PARA EL DIAGNÓSTICO DE LA TRICOMONOSIS BOVINA CAPITULO II. FAMILIARIZACIÓN CON LA METODOLOGÍA PARA EL DIAGNÓSTICO DE LA TRICOMONOSIS BOVINA. 1.- Introducción La técnica de referencia para el diagnóstico de rutina y control de la tricomonosis bovina es la identificación morfológica del parásito en cultivo y confirmación por PCR (Rojo-Montejo et al., 2010). Cuando se dio el brote de tricomonosis bovina en Lezaun, en Navarra no se disponían de los medios para su diagnóstico, por lo que las muestras fueron enviadas a un laboratorio de Madrid, donde contaban con más experiencia en estos casos. Los métodos que se emplean en el diagnóstico y detección de la enfermedad, se conocen gracias al asesoramiento del grupo Saluvet. Es un grupo de investigación de la Universidad Complutense de Madrid que está formado por profesores e investigadores especialistas en Sanidad Animal. La investigación que desarrollan se centra en aquellas enfermedades infecciosas y parasitarias que afectan a la reproducción de rumiantes y suidos, y también en algunas zoonosis de transmisión alimentaria. Para una mayor información al respecto se asistió, con fecha 25 de Junio de 2013, a la conferencia impartida por Esther Collantes, veterinaria del grupo Saluvet de la Universidad Complutense de Madrid, en las instalaciones del INTIA en Villava. Además, se acudió a hablar con el ganadero y con el veterinario encargado de la explotación afectada por la enfermedad, con el fin de obtener información sobre el caso. Antes de la recogida de las muestras, se fue a una explotación para ver cómo se recogían las muestras por un veterinario clínico. Asimismo, se acudió al Laboratorio de Calidad Agroalimentaria del Departamento de Desarrollo Rural, Medio Ambiente y Administración Local, para seguir todo el proceso de analítica laboratorial Para la realización de este trabajo, se hizo un seguimiento exhaustivo en una explotación de Lezaun, tanto en la toma de muestras como en la analítica de laboratorio. Todo ello, permitió redactar el protocolo para la recogida de muestras, el cultivo del agente a partir de las mismas y el análisis de laboratorio para el diagnóstico de la enfermedad, que sigue a continuación. 36 2.- Toma de muestras. Para el diagnóstico de la infección en un rebaño, debido a la condición de portador del toro y a la naturaleza de la infección temporaria de la hembra, lo aconsejable es muestrear los sementales. El material más fiable es el esmegma prepucial, que se obtiene por raspado, succión o lavado, usando un raspador o una pipeta de inseminación artificial (Rojo-Montejo et al., 2010). En este caso se utilizó el raspador, ya que se ha demostrado que presenta ciertas ventajas frente a la recogida de la muestra utilizando una pipeta de inseminación artificial, como una mayor rapidez y facilidad en la toma de muestras y la obtención de una muestra más concentrada y con menor contaminación (Mendoza, 2013). La población de T. foetus en la cavidad prepucial sufre fluctuaciones, además, esta concentración se ve disminuida cada vez que monta a una vaca. Por ello, antes de realizar el muestreo, el toro debe permanecer en reposo sexual durante dos semanas para maximizar el número de organismos presentes (Rojo-Montejo et al., 2010). Una vez que el toro pasó por el periodo de reposo sexual, se procedió a tomar la muestra de esmegma prepucial. Para ello, el ganadero concretó el día y la hora con el veterinario, que es quien debe tomar las muestras. Éste previamente, recogió en el Laboratorio de Calidad Agroalimentaria del Departamento de Desarrollo Rural, Medio Ambiente y Administración Local, el material necesario: raspador, tubo con PBS, medio de cultivo In Pouch y pipeta de plástico graduada. Para la obtención de la muestra, hay que tener en cuenta que se trata de un animal de grandes dimensiones, por lo que se extremaron las precauciones para evitar que la persona encargada de tomar la muestra sufriera algún daño. Para ello, lo más conveniente es el uso de mangas de manejo. Si no se dispone de las mismas, como fue el caso (Imagen 10), se hará uso de sogas para atar la pata trasera, vallas o cualquier otro elemento que sirva para sujetar el animal, no produciendo daño al mismo (Imagen 11). Imagen 10. Pata trasera del semental atada a una barra para evitar que dañe al veterinario clínico encargado de tomar la muestra (Fuente: elaboración propia). 37 Imagen 11. Toro atrapado con una bola de paja y una valla, preparado para ser muestreado (Fuente: elaboración propia). Antes de la toma de la muestra es aconsejable realizar una tricotomía, para lo que se recortó el pelo del saco prepucial con unas tijeras y se retiró toda la suciedad presente como heces o barro (Imagen 12). Es importante evitar la contaminación fecal, pues se pueden introducir protozoos intestinales que den lugar a falsos positivos. Para la limpieza se utilizó una toalla de papel seco, ya que el uso de jabón u otros desinfectantes pueden afectar a la viabilidad del agente y disminuir la sensibilidad del diagnóstico (Rojo-Montejo et al., 2010). Imagen 12. Tricotomía y limpieza de la zona prepucial para evitar incorporar suciedad a la muestra. (Fuente: elaboración propia). 38 Posteriormente, con el fin de que las trichomonas presentes en las criptas glandulares se desprendiesen de la mucosa, se realizó un masaje vigoroso en la zona caudal de la cavidad del prepucio (Imagen 13). Al estimular la zona prepucial el animal puede orinar, si esto ocurre se debe volver a repetir todo el proceso de limpieza nuevamente, evitando incluir orina en la muestra. Imagen 13. Masaje en la cavidad prepucial con el fin de que las trichomonas presentes en las criptas glandulares se desprendan (Fuente: elaboración propia). A continuación, se introdujo el raspador por el orificio prepucial hasta el fondo de la cavidad prepucial (Imagen 14 y 15), y se realizó un raspado vigoroso a ambos lados de la cavidad (unas 15 ó 20 veces aproximadamente). Se sacó el raspador lentamente procurando no ensuciarlo, comprobando que las ranuras del mismo estaban impregnadas de esmegma prepucial. Imagen 14. Anatomía del aparato reproductor del toro. 39 Imagen 15. Introducción del raspador por el orificio prepucial. (Fuente elaboración propia). Inmediatamente después, el raspador se lavó vigorosamente en el tubo con la solución de PBS (Imagen 16). La muestra ideal deberá quedar sin suciedad, y de un color blanquecino que indica que se ha recogido esmegma prepucial. Imagen 16. Lavado del raspador en el tubo con la solución de PBS. (Fuente: elaboración propia). 40 Seguidamente, se aisló el agente (Imagen 17). Para ello, se rasga la parte superior del sobre In Pouch a lo largo de la zona dentada y se abre tirando de las lengüetas. Con la pipeta plástica graduada se coge 1ml de la solución de PBS con el esmegma prepucial, y se introduce en el interior de la cámara superior del sobre. Con la ayuda de los dedos, se pasa el contenido de la cámara superior a la parte inferior. Para prevenir que se salga el contenido del In Pouch, se enrolla la parte superior del sobre y se doblan las pestañas para sellarlo. Imagen 17. Secuencia del aislamiento de Trichomonas. De izquierda a derecha: se toma 1ml de la solución de PBS con el esmegma prepucial, se introduce en la cámara superior del sobre In Pouch, se pasa todo el contenido a la cámara inferior. (Fuente: elaboración propia). Finalmente, se rellenó la etiqueta del sobre con los datos de la explotación y del animal muestreado. La muestra se conserva en posición vertical a temperatura ambiente y protegida de la luz, para ser enviada en 24-48 horas al laboratorio para ser procesada. Se ha descrito que la probabilidad de detectar un animal positivo es del 85% si se analiza una única muestra, mientras que es del 99% si se analizan tres (Rojo-Montejo et al., 2010). Por ello, a los 15 días de la primera toma de muestras, con el fin de garantizar un resultado más fiable, se realizó un segundo muestreo siguiendo el mismo procedimiento (Tabla 3). Tabla 3. Fechas para la toma de muestras. Fecha 19 de Agosto de 2013 2 de Septiembre de 2013 16 de Septiembre de 2013 Observaciones Comienzo del periodo de reposo sexual de 15 días. Fin del reposo sexual y primer muestreo. Segundo muestreo tras 15 días. 41 3.- Análisis de laboratorio. Una vez obtenidas las muestras, se enviaron al Laboratorio de Calidad Agroalimentaria del Departamento de Desarrollo Rural, Medio Ambiente y Administración Local, donde se encargan de procesarlas y analizarlas. 3.1.- Cultivo e identificación microscópica del agente. En la mayoría de los casos, el número de microorganismos no es suficientemente grande para hacer un diagnóstico positivo mediante un examen directo (OIE, 2008), por lo que los parásitos se cultivan in vitro. Existen una gran variedad de medios para el crecimiento del parásito, en este caso se utilizó el medio comercial In Pouch TF. Mendoza (2003) observó una sensibilidad del 95% utilizando el medio In Pouch TF. Además, señaló que se necesita un menor número de trofozoitos para su detección y la presencia de contaminaciones por bacterias y hongos también es menor en comparación con otros medios. El cultivo se hizo en el interior del sobre In Pouch, en atmósfera aerofílica y a 37ºC, para lo que se introdujeron en un incubador (Imagen18). Imagen 18. Incubador en el que se mantienen las muestras a 37ºC para el cultivo. (Fuente: elaboración propia). 42 Las muestras cultivadas, fueron examinadas diariamente durante 7 días utilizando un microscopio con contraste de fases, para comprobar la presencia de T. foetus en la muestra. Para ello, en primer lugar, se prepararon las muestras como sigue a continuación (Imagen 19). En una campana de flujo laminar, para mantener el área de trabajo estéril y evitar la contaminación, primeramente, se homogenizó el medio de cultivo del sobre, ya que en caso de haber Trichomonas se van al fondo por sedimentación. A continuación, se tomaron 30 µL del sobre In Pouch con una pipeta y se pasaron a un portaobjetos que posteriormente se cubrió con un cubreobjetos. En caso de tener que analizar un número grande de muestras, la preparación de las mismas se hace de tres en tres, para mantenerlas a la temperatura adecuada. Imagen 19. Preparación de las muestras para ser observadas al microscopio. De arriba a abajo y de izda. a dcha.: en el interior de una campana de flujo laminar, se homogeniza el contenido del sobre; se toman 30 µL con una pipeta; se pasan a un portaobjetos y se cubren con un cubreobjetos. (Fuente: elaboración propia). 43 Seguidamente, las muestras preparadas se pusieron al microscopio (Imagen 20) y se observaron a 100 o 200 aumentos. Si en las muestras se percibe la presencia de células epiteliales, implica que las muestras están bien cogidas, es decir se ha raspado lo suficiente, y en caso de estar el toro infectado, se apreciarían Trichomonas en la muestra. Imagen 20. Microscopio con contraste de fases con el que son examinadas las muestras. (Fuente: elaboración propia). Lo ideal es que las muestras se tomen el lunes por la mañana, para que puedan ser examinadas a lo largo de toda la semana, como se procedió en este caso. El segundo o tercer día del cultivo, son los más apropiados para la observación al microscopio, ya que el primer día todavía no hay un número suficiente de protozoos; y a partir del quinto día, comienza a haber mucha proliferación de bacterias y hongos que crecen en el medio de cultivo y pueden dificultar la observación. También se observó la muestra directamente desde el sobre In Pouch (Imagen 21). Se coloca una especie de pinza en la parte inferior del sobre, de modo que una parte de la muestra queda retenida en la superficie que abarca la pinza, y se observa al microscopio. Ambos métodos se emplean alternativamente con una misma muestra, para evitar que un resultado negativo sea consecuencia de no haber empelado correctamente una de las técnicas. 44 Imagen 21. Observación de la muestra directamente desde el sobre In Pouch. (Fuente elaboración propia). La identificación del parásito al microscopio, se basa en el tamaño y forma del protozoo, la existencia de tres flagelos anteriores y uno posterior, la membrana ondulante que recorre todo su cuerpo, y su característico movimiento rotatorio entrecortado. El Laboratorio encargado de analizar las muestras, dispone de una muestra control del parásito cedida por el laboratorio del grupo Saluvet, para facilitar la identificación del mismo (Imagen 22). Imagen 22. Imagen del control de T. foetus disponible en el Laboratorio de Calidad Agroalimentaria, para poder identificar el parásito en la muestras. (Fuente: elaboración propia). Es de suma importancia realizar correctamente la recogida de muestras, el transporte y el cultivo del agente para poder efectuar un diagnóstico fiable. Sin embargo, incluso las mejores condiciones de muestreo, transporte y cultivo, no garantizan que las muestras tomadas de un toro infectado den un resultado positivo (Rojo-Montejo et al., 2010). 45 3.2.- Confirmación por PCR. En algunos casos, se han aislado en los medios para T. foetus otros protozoarios del orden de los tricomonádidos de gran similitud morfológica, dando lugar a falsos positivos. La fuente más probable de estos microorganismos es la contaminación fecal de la muestra durante su obtención o bien la conducta homosexual del toro (RojoMontejo et al., 2010). A diferencia de lo que ocurre en microscopía, la PCR puede detectar al parásito en muestras con un número bajo o con parásitos muertos, así como en muestras con contaminación bacteriana elevada (Mendoza, 2013). Se ha determinado una sensibilidad de 67,8% para el cultivo, 65,9% de la técnica de PCR y 78,3% para ambas técnicas en combinación (Mendoza, 2013). Es por ello que, para la confirmación del resultado, se realizó la técnica de PCR específica para T. foetus en cada una de las muestras, independientemente de si el resultado en la identificación morfológica del parásito mediante el examen microscópico fuera positivo o negativo. La técnica de PCR se realizó a partir de la muestra de esmegma prepucial recogida en el tubo con PBS, que también se conserva en el incubador a 37ºC. En primer lugar, se debe de realizar la extracción del ADN, para poder llevar a cabo la amplificación de un fragmento y su posterior análisis mediante electroforesis. 3.2.1.- Extracción del ADN. La extracción del ADN consta de una etapa de lisis, que consiste en romper las membranas celulares del protozoo para liberar el ADN; y otra de purificación, que implica la retirada de la solución final de la mayoría de elementos que pueden interferir en la PCR, para finalmente recuperar el ADN. Todo este procedimiento se llevó a cabo con el Kit DNeasy Blood & Tissue (50). Se trabajó en una campana de flujo laminar para evitar la contaminación, y sobre hielo picado para mantener el frío, puesto que los reactivos que se emplean son muy sensibles (Imagen 23). Imagen 23. Se trabaja sobre hielo picado para mantener el frío, ya que los reactivos que se emplean son muy sensibles. (Fuente: elaboración propia). 46 En todas las series, se puso un control positivo de extracción y un blanco, para una vez terminado el proceso de extracción, poder comparar. Para que tuviera lugar la lisis celular: 1. Con una pipeta se tomaron 200 µL del PBS que contiene la muestra y se echaron al tubo de microcentrífuga. 2. Se añadieron 20 µL de proteinasa K para que se produjese la lisis, se agitó con un agitador vortex y se metió en un termobloque a 56 ºC durante 10 minutos para acelerar el proceso (Imagen 24). 3. Pasado ese tiempo, se agitó durante 15 segundos. Se agregaron 200 µL del buffer AL y se agitó de nuevo. Por último, se añadieron otros 200 µL de etanol para precipitar el ADN y se agitó nuevamente. Imagen 24. Una vez añadida la proteinasa K a la muestra, se mete a un termobloque para acelerar el proceso de lisis. (Fuente: elaboración propia). A continuación, se comenzó con el proceso de purificación eliminando los restos celulares e inhibidores, con distintos buffers de lavado (Imagen 25): 4. Se pipeteó la mezcla anterior en una columna de extracción que estaba colocada en un tubo colector. Se centrifugó a 13.000 rpm durante un minuto. Se desechó el tubo colector y el filtrado. 5. Se colocó la columna en un nuevo tubo y se añadieron 500 µL del buffer AW1. Se centrifugó a 13.000 rpm durante un minuto. Se desechó el tubo colector y el filtrado. 6. Se repitió el mismo procedimiento, pero en este caso se añadieron 500 µL del buffer AW2 y se centrifugó a 13.000 rpm durante 4 minutos. Se desechó el tubo colector y el filtrado. 7. Se volvió a centrifugar durante un minuto para eliminar el etanol residual (sin añadir nada a la columna). 47 Imagen 25. El proceso de purificación del ADN se realiza mediante la centrifugación con distintitos buffers de lavado. (Fuente: elaboración propia). Por último, se recuperó el ADN de la membrana de la columna de extracción: 8. Se colocó la columna en un tubo de microcentrífuga y se añadieron 200 µL del buffer AE para la elución del ADN. Se dejó durante un minuto a temperatura ambiente y se vuelvió a centrifugar durante un minuto En el tubo de microcentrífuga quedó recogido el ADN, que se conservó congelado a una temperatura de -20ºC hasta realizar la amplificación. 3.2.2.- Amplificación del ADN. La reacción en cadena de la polimerasa (PCR) permite el diagnóstico específica del ADN de T. foetus mediante la amplificación enzimática de un fragmento del genoma del protozoo, delimitado por una pareja de cebadores específicos. Es importante trabajar en campanas de flujo laminar para evitar la contaminación, ya que la PCR es muy sensible. Asimismo, durante todo el proceso los componentes y la mezcla de reacción se mantuvieron en una gradilla congelada con el fin de evitar su degradación. En una primera campana, se preparó la mezcla de reacción. En este orden, se añadieron a un vial, la Master Mix y después los cebadores (R y F). La cantidad a añadir se calculó en función del número de muestras, sin olvidar que se debe incluir un control positivo de extracción, otro control positivo de amplificación y un blanco. Una vez 48 preparada, se distribuyeron 15 µL de la misma a los viales donde luego se incluyen las muestras. Con el fin de evitar una posible contaminación, en otra campana se agregaron 10 µL de la muestra de ADN, consiguiendo un volumen total de 25 µL. Una vez preparados los tubos de reacción, se introdujeron en el termociclador (Imagen 26). El proceso de PCR se completa gracias a la repetición de 35 ciclos en los que se suceden tres fases a distinta temperatura (Imagen 27). Imagen 26. La amplificación del fragmento de ADN tiene lugar en el termociclador. (Fuente: elaboración propia). Previamente a los ciclos de la PCR, se lleva a cabo una desnaturalización inicial durante 3 minutos a una temperatura de 95ºC, que consiste en la separación de las dos cadenas de las cuales está constituido el ADN. Cada ciclo está compuesto de tres fases de 15 segundos de duración: 1. Desnaturalización: separación de las cadenas de ADN elevando la temperatura hasta los 95ºC. 2. Hibridación: descenso de la temperatura hasta 67ºC, para permitir que los cebadores se unan por complementariedad al ADN molde. 3. Elongación o extensión: la enzima polimerasa Taq incorpora nucleótidos complementarios a partir del extremo 3´ libre de la región en que han hibridado los cebadores. La temperatura a la que se lleva a cabo esta fase es de 72ºC. 49 La reacción se completa con una elongación final que dura 15 minutos. Y pasado este tiempo, se baja la temperatura hasta los 4ºC para la conservación de la muestra. Imagen 27. Perfil térmico de la PCR. (Fuente: elaboración propia). 3.2.3.- Electroforesis por la técnica de microfluidos. Una vez concluida la amplificación del ADN, se procedió a su análisis mediante electroforesis por la técnica de microfluidos. La electroforesis es el movimiento de partículas cargadas bajo la influencia de un campo eléctrico. La técnica permite la separación de los fragmentos de ADN basándose en el tamaño de los mismos, a través de un gel teñido. En este caso se utiliza la técnica de microfluidos, que permite realizar todos los pasos en un solo dispositivo. Antes de comenzar, se lavaron los electrodos de la estación de electroforesis evitando así una posible contaminación de las muestras. Para ello, se añadió una solución jabonosa a un chip especialmente diseñado para limpiar los electrodos y se insertó en la estación de electroforesis Experion durante 15 minutos. Después, se aclaró con agua destilada que se añadió a otro chip durante otros 15 minutos. En primer lugar, se preparó el chip en el que luego se incluyen las muestras. Se preparó la solución de gel teñido y se añadieron 9 µL de la misma al pocillo del chip diseñado para tal fin. Después, se introdujo en la plataforma de cebado durante un minuto (Imagen 28). 50 Imagen 28. El gel se añade en el pocillo coloreado de verde (derecha). Tras introducir el chip en la plataforma de cebado, el gel invade los microcanales (izquierda). Pasado el minuto, se añadieron 9 µL del gel a los otros tres pocillos GS, 5 µL del buffer de carga al pocillo L y en cada pocillo de muestras. A continuación, se echó 1 µL del marcador Ladder al pocillo L. Por último, se añadió 1 µL de cada muestra a los pocillos numerados del 1 al 11, y se agitó el chip en la estación Vortex Experion durante 1 minuto (Imagen 29). Imagen 29. Se añaden los reactivos a los pocillos correspondientes del chip: gel (1), buffer de carga (2), ladder (3) y muestras con el ADN amplificado (4). A la hora de añadir todos los reactivos al chip, hay que tener mucho cuidado de que nos se formen burbujas, ya que podrían entorpecer el proceso y dar lugar a falsos resultados. Una vez preparado el chip, se introdujo en la estación de electroforesis para que comenzase el proceso de separación. Al cerrar la tapa, los electrodos entran en contacto con la solución de los pocillos. El voltaje aplicado hace que las moléculas cargadas migren hacia el canal de separación (Imagen 30). En su interior, la solución de gel teñido hace que las moléculas se muevan a diferentes velocidades en función de su tamaño. Durante la separación, el colorante fluorescente se intercala entre las bases de ADN. 51 Imagen 30. El voltaje aplicado hace que las moléculas cargadas migren hacia el canal de separación. Cuando las moléculas migran hacia el final del canal de separación, un láser excita el colorante de modo que el sistema detecta el ADN marcado con fluorescencia. En función de la intensidad de la fluorescencia, se genera un electroferograma (fluorescencia en función del tiempo), a partir del cual se crea el gel virtual comparando la migración de cada muestra con la del Ladder. El software, muestra además del electroferograma y la imagen de gel virtual, los resultados de los análisis de los datos en una tabla. 52 CAPÍTULO III ESTUDIO DE LA PREVALENCIA Y DE LOS FACTORES DE RIESGO DE LA TRICOMONOSIS BOVINA EN LAS EXPLOTACIONES QUE PASTOREAN EN LA SIERRA DE URBASA Y ANDÍA. CAPÍTULO III. ESTUDIO DE LA PREVALENCIA Y DE LOS FACTORES DE RIESGO DE LA TRICOMONOSIS BOVINA EN LAS EXPLOTACIONES QUE PASTOREAN EN LA SIERRA DE URBASA Y ANDÍA. 1.- Introducción En abril de 2013 se declaró un foco de tricomonosis bovina en una explotación de vacuno de carne en Lezaun. Se trata de un municipio situado en las inmediaciones de la Sierra de Urbasa y Andía, donde la mayor parte de los vecinos se dedica a la agricultura y a la ganadería. Existen varias explotaciones de vacuno de carne, gran parte de las cuales utilizan la monta natural como técnica reproductiva y aprovechan los pastos comunales tanto del municipio como de la Sierra de Urbasa y Andía, factores de riesgo para el contagio de enfermedades venéreas, como es el caso de la tricomonosis bovina. El régimen de explotación de la granja afectada es semiextensivo. Las vacas en la época estival, suben a pastar a la sierra de Urbasa, y cuando se acerca la época de parición en el otoño, regresan a la explotación. El toro permanece durante todo el año en la explotación, por lo que no hay posibilidad de contacto con hembras de otra explotación. Además, nunca antes había servido como semental. El propietario no había detectado ningún problema reproductivo en su explotación, aparentemente las vacas a las que había montado el toro, habían quedado gestanes. Fue en el momento de realizar el diagnóstico de gestación (a los 45- 50 días después de la monta) cuando se detectó la primera incoherencia. El veterinario afirmaba que alguna de las vacas tenía una preñez de 4 meses, cuando según el ganadero, hacía 2 meses como mucho que el toro había cubierto a las vacas. Entonces, el veterinario examinó a las vacas con el ecógrafo y comprobó que lo que creía que era un feto de 4 meses, en realidad se trataba de pus, consecuencia de la piómetra que habían desarrollado las vacas. Ante este cuadro, se tomaron varias muestras de flujo vaginal de la zona del cuello uterino de 6 de las 18 vacas a las que había montado el toro, así como lavados prepuciales y semen del toro. Estas muestras se enviaron a un laboratorio de Madrid, donde lograron identificar T. foetus, como agente causal de la enfermedad que afectaba a la explotación. La primera medida que se tomó fue la retirada del toro y su sustitución por la inseminación artificial, pues todas las vacas que habían sido montadas por el toro estaban infectadas, ya que ninguna de ellas consiguió quedarse gestante. Del mismo modo, se aisló el rebaño prohibiendo la salida de las vacas al exterior para evitar el contagio a otras explotaciones. 54 Posteriormente el toro fue sacrificado, y como medida preventiva mediante Resolución 298/2013 de 10 de mayo, del Director General de Agricultura y Ganadería (Anexo II), se prohibió el acceso de machos bovinos con edad superior a los seis meses, a los pastos comunales del ayuntamiento de Lezaun y de Urbasa-Andía, de los ayuntamientos y concejos limítrofes con los mismos, y de otros ayuntamientos o concejos no limítrofes en los que al menos uno de sus ganaderos de vacuno haya aprovechado los pastos de Urbasa-Andía en la campaña 2012. Sí se autoriza en caso de vacuno, el pastoreo de las hembras de cualquier edad. Se exceptúa la prohibición en aquellos comunales que sean aprovechados por un sólo ganadero. Asimismo, tuvieron lugar charlas informativas dirigidas a los ganaderos, donde se explicaban las características de la enfermedad así como la repercusión de esta en las explotaciones. 2.- Material y métodos Como consecuencia del foco declarado, desde el Gobierno de Navarra se puso en marcha una campaña para analizar todos los toros de las explotaciones que pastorean en la Sierra de Urbasa y Andía, con el fin de conocer su situación en la zona, pues se trata de una enfermedad cuya prevalencia es poco conocida. Para ello se tomaron muestras de todos los toros de las explotaciones relacionadas con el foco, entre las que se encuentran las situadas en los ayuntamientos y concejos limítrofes con la Sierra de Urbasa y Andía y Lezaun, así como aquellas situadas en ayuntamientos y concejos no limítrofes que al menos uno de sus ganaderos de vacuno haya aprovechado los pastos de Urbasa-Andía en la campaña de 2012 (Imagen 31). La realización de esta analítica fue obligatoria puesto que será condición necesaria para poder acceder a los pastos de los comunales la próxima campaña. La toma de muestras la efectuó el veterinario clínico de cada explotación y el material empleado para realizarla fue administrado por el Laboratorio de Calidad Agroalimentaria del Departamento de Desarrollo Rural, Medio Ambiente y Administración Local situado en Villava, lugar donde también fueron analizadas (Anexo I). Las técnicas tanto de obtención de muestras como de análisis laboratorial empleadas fueron las descritas en el apartado anterior del presente trabajo. Los ganaderos rellenaron una encuesta (Anexos III y IV) en la que se valoraron distintos parámetros relacionados con datos de manejo de la explotación, los datos reproductivos, así como los datos del animal o animales muestreados, con el fin de evaluar los posibles factores de riesgo asociados a la enfermedad. 55 Imagen 31. Mapa de las explotaciones de vacuno de carne que tienen relación con el foco de tricomonosis bovina declarado en Lezaun. 3.- Resultados. Un total de 110 toros que servían a un total de 3.018 vacas procedentes de 68 explotaciones diferentes fueron muestreados, resultando todos ellos negativos a la infección por T. foetus en la analítica laboratorial y en la confirmación por PCR, tanto en el primer muestreo como en el segundo realizado a los 15 días. De las 68 explotaciones sometidas al estudio, 61 ganaderos respondieron a las encuestas aportando datos relativos al manejo de sus explotaciones (Tabla 4), a los datos reproductivos de las mismas (Tabla 5) e información de los animales muestreados (Tabla 6). Un 67,2% de los ganaderos afirmaba tener conocimiento sobre la tricomonosis bovina, no obstante ninguno de ellos había realizado antes pruebas para el diagnóstico de dicha enfermedad. 56 Tabla 4. Datos relativos al manejo de las explotaciones. Variable Categoría Nº explotaciones Carne 61 ( ) *% 100 0 0 0 0 3,3 96,7 73,8 23 3,3 24,6 68,9 21,3 75,4 Leche 0 Doble Propósito 0 Lidia 0 Intensivo 0 Sistema explotación Extensivo 2 Semiextensivo 59 Buena 45 Calidad de las cercas Regular 14 Mala 2 Si 15 Compra de hembras reproductivamente activas No 42 Si 13 Compra de machos reproductivamente activos No 46 0-3 meses 1 1,6 3-6 meses 0 0 Tiempo de permanencia de los machos con las hembras 6-9 meses 19 31,1 9-12 meses 39 63,9 90,2 Si 55 Pastos comunales 8,2 No 5 ( ) * El porcentaje se obtiene teniendo en cuenta las 61 explotaciones, a pesar de que algunas de las preguntas no han sido respondidas por los ganaderos Aptitud En cuanto al manejo de las explotaciones, todas ellas son de aptitud cárnica y son explotadas en régimen extensivo (3,3%) o semiextensivo (96,7%). La calidad de las cercas es buena en el 73,8% de los casos, siendo regular y mala en el 23% y 3,3% de los casos respectivamente. Respecto a la compra de animales nuevos, cuando se trata de las hembras sólo un 24,6% opta por la compra de animales reproductivamente activos, mientras que si se trata de lo machos este número es algo menor (21,3%). En un 63,9% de las explotaciones, los toros permanecen con las hembras durante la mayor parte del año (9-12 meses), durante 6-9 meses en un 31,1% de ellas y tan sólo una de ellas durante 3 meses. Por regla general, los rebaños aprovechan los pastos comunales (90,2%). 57 Tabla 5. Datos reproductivos de las explotaciones. Variable Categoría Nº explotaciones ( ) *% Buena 44 72,1 Regular/mala 0 0 <12 meses 1 1,6 Intervalo entre partos 12 meses 20 32,8 >12 meses 22 36,1 Si 25 41 Uso IA No 36 59 Si 61 100 Monta natural No 0 0 Si 44 72,1 Contacto de hembras con toros de otras explotaciones No 17 27,9 Si 12 19,7 Presencia de abortos No 49 80,3 Si 0 0 Incremento de la presencia de abortos No 60 98,4 Si 24 39,3 Presencia de repetición de celos No 37 60,7 Si 0 0 Incremento de la presencia de repetición de celos No 60 98,4 Si 21 34,4 Controles reproductivos No 40 65,6 Si 2 3,3 Pruebas diagnósticas a toros de reciente incorporación No 59 96,7 Si 5 8,2 Vacuna contra enfermedades reproductivas No 46 75,4 Si 25 41 Suplementos alimenticios en la época reproductiva No 33 54,1 ( ) * El porcentaje se obtiene teniendo en cuenta las 61 explotaciones, a pesar de que algunas de las preguntas no han sido respondidas por los ganaderos. Fertilidad En relación a los datos reproductivos, un 72,1% de los ganaderos asegura que la fertilidad de sus explotaciones es buena. Todos ellos emplean como técnica reproductiva la monta natural y un 41% la combinan con el uso de la inseminación artificial. La gran mayoría (72,1%) afirma la posibilidad de contacto de sus hembras con machos de otras explotaciones. La presencia de abortos y de repetición de celos se observa en el 19,7% y 39,3% de las explotaciones, pero en ninguna se aprecia un incremento de estos casos durante el último año. En 21 de las explotaciones se realizan controles reproductivos, 5 vacunan contra enfermedades reproductivas y tan sólo en dos de ellas se realizan pruebas diagnósticas a toros de reciente incorporación. Algo menos de la mitad suministran suplementos alimenticios en la época reproductiva. 58 Tabla 6. Datos relativos a los animales muestreados. Variable Categoría Nº explotaciones ( ) *% < 3 años 18 19,6 ≥ 3 años 74 80,4 Pirenaica 58 63 Blonde d'Aquitaine 22 23,9 Raza Mestizo 7 7,6 Limousin 3 3,3 Charolais 2 2,2 Si 20 21,7 Reposición propia No 72 78,3 ( ) Si 11 15,3 ** Había montado con anterioridad No 59 81,9 ( ) Si 1 1,4 ** Se le habían realizado pruebas diagnósticas No 71 98,6 Si 13 14,1 Ha servido de semental en otras explotaciones No 73 79,3 Si 18 19,6 Toro comunal No 74 80,4 Si 82 89,1 Permanece siempre con el mismo grupo de hembras No 10 10,9 Si 0 0 Problemas de fertilidad No 89 96,7 ( ) * El porcentaje se obtiene teniendo en cuenta los 92 toros muestreados, a pesar de que algunas de las preguntas no han sido respondidas por los ganaderos ( **)Los sementales que no son de reposición propia. Edad toro La mayor parte de los toros muestreados (80,4%) iguala o supera los 3 años de edad, siendo tan sólo el 19,9% menor de 3 años. La raza predominante es la Pirenaica (63%), seguida de la Blonde d’Aquitaine (23,9%), Mestiza (7,6%), Limousin (3,3%) y Charolais (2,2%). Del total de los sementales, sólo el 21,7% son de reposición propia y el resto proceden de otras explotaciones. De éstos, un 15,3% había montado con anterioridad y tan sólo a uno de ellos se le había realizado pruebas diagnósticas. El 14,1% ha servido de semental en una explotación ajena y 19,6% es toro comunal. La gran mayoría (89,1%) permanece siempre con el mismo grupo de hembras y ninguno de ellos ha dado lugar a problemas de fertilidad. 59 4.- Discusión. Los resultados obtenidos en este estudio, indican que los rebaños que pastan en las Sierra de Urbasa y Andía están libres de la infección por T. foetus. Por lo tanto, se concluye que el foco declarado en Lezaun se trata de un hecho aislado en la zona estudiada. Como se ha comentado en apartados anteriores, la trasmisión de la enfermedad tiene lugar mediante la cópula. Los toros se infectan cuando cubren vacas infectadas, quedando como portadores y transmitiendo a su vez la enfermedad al resto de vacas que monta. En este caso, la posibilidad de contagio de las vacas al toro se descarta, ya que a pesar de que éstas pastan en los pastos comunales de la sierra Urbasa y cabe la posibilidad de que hayan estado en contacto con machos de otras explotaciones, los análisis indican que ninguna otra explotación está infectada. En cuanto al contagio de la enfermedad por parte del toro a las vacas, también se descarta puesto que se trata de un semental que nunca antes había servido en otra explotación. Por lo tanto y según la información de la que se dispone, no es posible aclarar el origen de la infección. En muchas zonas de Europa se ha logrado un control eficaz de la tricomonosis bovina gracias sobre todo al uso de la inseminación artificial. No obstante, se dispone de datos de la presencia de la infección en Francia, Alemania, Italia y España entre 2005 y 2010 (Mendoza, 2013). En España, los datos de la prevalencia de la tricomonosis bovina son escasos, y entre los que existen, muchos ya están obsoletos y la metodología diagnóstica empleada fuera de uso. Pese a ello, diferentes estudios demuestran que la enfermedad está presente en el ganado vacuno criado en condiciones de extensivo, y que la prevalencia puede variar dependiendo de las prácticas ganaderas utilizadas en los rebaños. A pesar de que las explotaciones sometidas a este estudio hayan resultado negativas a la tricomonosis bovina, muchas de ellas presentan ciertas características que favorecen el desarrollo de la misma y el contagio a otros rebaños. Como se ha comentado en otros apartados, el uso de la IA es el método más eficaz para prevenir la enfermedad, puesto que la transmisión del agente tiene lugar mediante la cópula. En un 41% de las explotaciones analizadas se hace uso de la IA, pero todas ellas tienen la monta natural como principal técnica reproductiva. Mendoza (2013) en un estudio reciente señala una prevalencia individual y de rebaño del 31,1% y 41,5% respectivamente, en una raza representativa de la cría en sistemas de montaña como es la Asturiana de la Montaña. Las condiciones de manejo eran muy similares a las que se dan en la zona de Urbasa y Andía, sistemas extensivos basados en el aprovechamiento de recursos pastables, entre ellos comunales, y el uso de la monta natural como sistema de cubrición. El único factor de riesgo asociado a la enfermedad identificado en esta zona de Asturias, fue la edad del toro, siendo la infección más frecuente en toros mayores de 3 años de edad. En nuestro caso, un 80, 4% de los toros analizados igualaba o superaba los tres años de edad, hecho que incrementa 60 el riesgo de infección en un rebaño, debido a que estos animales actúan como portadores asintomáticos. En un estudio en Estados Unidos, el uso de pastos comunales resultó ser el factor de riesgo más importante, seguido de la falta de pruebas diagnósticas antes de la temporada de reproducción y una mayor proporción de machos mayores de tres años (mendoza, 2013). En nuestro caso, de las explotaciones sometidas al estudio, el 90,2% hace uso de los pastos comunales de la Sierra de Urbasa y Andía, donde conviven animales de distinto origen y estado sanitario. Ninguna de ellas había realizado pruebas para diagnosticar la enfermedad. En muchos estados de Estados Unidos, el diagnóstico de la tricomonosis bovina es obligatorio, mientras que en España es de carácter voluntario (Mendoza, 2013). De cara a evitar el contagio de una explotación a otra y para que los rebaños puedan continuar con el sistema de aprovechamiento de pastos comunales, es recomendable que los usuarios analicen todos los toros de sus explotaciones de forma anual. 61 CAPÍTULO IV CONCLUSIONES Con la realización del presente Trabajo Final de Carrera, se han obtenido las siguientes conclusiones: Objetivo 1. Familiarización con la metodología para el diagnóstico de la tricomonosis bovina. La metodología recomendada y empleada tanto para la obtención de las muestras en este trabajo, así como para la analítica laboratorial ha sido correcta, siendo el resultado de la explotación muestreada negativo. Objetivo 2. Estudio de la prevalencia y de los factores de riesgo de la tricomonosis bovina en las explotaciones que pastorean en la Sierra de Urbasa y Andía. En Navarra existía un desconocimiento total tanto de la enfermedad como de su prevalencia, aún tratándose de una enfermedad de declaración obligatoria. El foco de tricomonosis bovina declarado en Lezaun se trata de un hecho aislado, y según la información de la que se dispone, no se puede determinar su procedencia. Las medidas tomadas por las autoridades sanitarias oficiales para la valoración de la tricomonosis ha sido rápida y eficaz, así como acertada la prohibición del acceso de los toros a los comunales como medida preventiva. Pese a los resultados negativos, las explotaciones que pastan en la Sierra de Urbasa y Andía, presentan características similares a aquellas con una prevalencia alta de la enfermedad. 63 CAPÍTULO V TERMINOLOGÍA A ACETÁBULO: Ventosa musculosa ventral de los trematodos y de algunos cestodos, con la que se fijan al huésped. AGENTE ETILÓGICO: Entidad biológica, física o química capaz de causar enfermedad. ANAEROBIO: Organismo que no necesita oxígeno en forma libre para vivir. Muchos anaerobios son sensibles al oxígeno libre. Los anaerobios obligados crecen sólo en ausencia de oxígeno; en cambio, los anaerobios facultativos pueden crecer en presencia o ausencia de oxígeno molecular. ANTICUERPOS: Sustancias defensivas creadas por el organismo cuando actúan sobre él los denominados antígenos. Atendiendo a su estructura se conocen con el nombre de inmunoglobulinas (Ig). AUTOFECUNDACIÓN: Fusión de células sexuales masculinas y femeninas producidas por un mismo individuo. B BOTRIO: Surco longitudinal presente en el escólex de algunos cestodos, que les sirve como elemento de fijación al huésped. BUFFER: Ver PBS. C CELOMA: Cavidad revestida de epitelio, que en el hombre y ciertos grupos de animales, se desarrolla entre la pared del cuerpo y las vísceras. CERCARIA: Forma larvaria de los trematodos digenéticos, que poseen una cola que les permite abandonar el caracol, su huésped intermediario. CILIO: Filamento que poseen los protozoos pertenecientes al filo Ciliphora, como elemento de propulsión. CISTICERCO: Larva de tenia (Cestodo) que vive enquistada en los tejidos musculares de algunos mamíferos, los cuales actúan de huéspedes intermediarios, y que después de haber pasado al intestino del hombre que ha comido la carne del animal, se transforma en tenia o solitaria adulta. 65 COCCIDIO: Protozoos intracelulares ubicados en el Phylum Apicomplexa, que parasitan el intestino y otros órganos y sistemas. Entre ellos se encuentran Isospora, Cyclospora, Poxoplasma. CONJUGACIÓN: Forma de reproducción sexual de los protozoos, en la que son únicamente los núcleos los que intervienen, de forma que los individuos portadores de los núcleos se adosan temporalmente durante el proceso, para separarse una vez completado. CORACIDIO: Larva ciliada de los denominados falsos vermes planos (Cestodos), que una vez liberada de los huevos, es ingerida por un crustáceo microscópico. CORONA RADIATA: Conjunto de labios o papilas que rodean la boca de los nematodos. CUADRO CLÍNICO: Conjunto de signos y síntomas que presenta un enfermo o que caracterizan una enfermedad. CUARENTENA: Restricción de las actividades de personas y animales sanos que han estado expuestos a un individuo con una enfermedad transmisible durante el periodo de incubación o contagio, con el fin de evitar la transformación de la enfermedad en caso de manifestarse la infección. CULTIVO IN VITRO: Aquel realizado sobre un medio nutritivo en condiciones estériles. D DUELA: Nombre común con el que se designa a los trematodos, con aspecto aplanado y forma de hoja. E ELUIR: Extraer, mediante un líquido apropiado, una sustancia del medio sólido que la ha absorbido. EMBRIÓN HEXACANTO: Larva con tres pares de ganchos propia de los cestodos. ENDODIOGENIA: Forma de reproducción asexual propia de los protozoos, en la que se forman dos células hijas por brotamiento interno. ENFERMEDAD CLÍNICA: Se dice de la enfermedad que comienza con cambios anatómicos y fisiológicos que son suficientes para generar signos y síntomas reconocibles. 66 ENFERMEDAD ENDÉMICA: La presencia constante de una enfermedad o agente infeccioso en una zona geográfica determinada; también se refiere a la prevalencia usual de una enfermedad dada dentro de esa área. ENFERMEDAD SUBCLÍNICA: Se dice de la enfermedad, trastorno o alteración que carece de manifestaciones clínicas evidentes. ENFERMEDAD VENÉREA: Enfermedades infecciosas que se transmiten principalmente a través del contacto sexual, atacan los órganos genitales y, en algunas ocasiones, también dañan otros órganos. EPIDEMIOLOGÍA: Estudio de la distribución y de los factores determinantes de las enfermedades. ESCÓLEX: Órgano de fijación o “cabeza” de un cestodo. Se adhiere a la pared intestinal del huésped mediante ventosas y en algunas ocasiones mediante ganchos. ESMEGMA PREPUCIAL: Secreción blanquecina que suele acumularse en los genitales de los mamíferos, tanto en machos como en hembras. ESPOROCISTO: Estadio larvario de os trematodos parásitos, con forma de saco que permanece en el interior de un caracol, su huésped intermediario, en cuyo interior se desarrolla el siguiente estadio larvario. ESQUIZOGONIA: Forma de reproducción asexual propia de los protozoos, que consiste en la división del núcleo celular en varios núcleos secundarios. ESTRÓBILO: Conjunto de segmentos por los que está formado el cuerpo de los cestodos. EUCARIOTA: Célula con núcleo verdadero, separado del citoplasma por una doble membrana, y en cuyo interior se encuentra el material genético; más grandes y complejas que las procariotas. Poseen diversos organelas rodeados de membranas. F FISIÓN BINARIA LONGITUDINAL: Forma de reproducción asexual propia de los protozoos, en la cual cada individuo se divide en dos. FLAGELO: Largo apéndice en forma de látigo, que poseen los protozoos pertenecientes al subfilo Mastigophora, que les permite desplazarse. H HERMAFRODITA: Organismos que poseen ambos sexos en un mismo individuo. 67 HIDROGENOSOMA: Estructura subcelular de doble membrana presente en algunos organismos eucariotas, amitocondriados, que habitan ambientes deficientes de oxígeno. Responsable de cubrir requerimientos energéticos. Ejemplo: Trichomonas vaginalis. I INFECCIÓN AUTOLIMITANTE: Se dice de aquella que se resuelve sola con el tiempo. INFECCIÓN: Penetración y desarrollo de microorganismos patógenos en el organismo causando enfermedad. INMUNORESPUESTA: Respuesta inmunitaria de un organismo frente a un antígeno. L LISIS: Proceso de ruptura de la membrana celular mediante un agente específico o un agente físico, que produce la salida del contenido intracelular. M MEDIDAS DE BIOSEGURIDAD: Medidas preventivas que tienen como objeto proteger la salud y la seguridad humana, así como la conservación del medio ambiente, frente a diferentes riesgos producidos por agentes bilógicos, físicos, químicos y mecánicos. MEDIO DE CULTIVO: Solución que cuenta con los nutrientes necesarios para recuperar, multiplicar, aislar e identificar microorganismos bajo condiciones favorables e temperatura y pH. METACERCARIA: Forma larvaria infectante de los trematodos, que generalmente se encuentra enquistada en la vegetación. METACESTODO: Forma larvaria de los cestodos. MICROAEROFILIA: Condiciones de baja y estricta concentración de oxígeno que requieren determinados organismos para su desarrollo, conocidos como microaerófilos. MIRACIDIO: Larva ciliada de los trematodos parásitos que emerge de los huevos operculados al entrar en contacto con el agua. Sólo puede sobrevivir penetrando y desarrollándose en un caracol, su huésped. 68 MÓRULA: Masa de células que se origina a partir de la segmentación de la célula original, dentro del desarrollo embrionario de los nematodos. N NEMATODOSIS: Enfermedades parasitarias causadas por los nematodos. O OIE: Siglas de Organización Mundial de Sanidad Animal. Organismo creado en 1924 con el propósito de combatir las enfermedades de los animales a nivel mundial. OPÉRCULO: Cubierta o tapa localizada en uno de los extremos de los huevos de algunos platelmintos e insectos, a través de la cual escapa la larva. ORGANELAS: Diferentes estructuras contenidas en el citoplasma de las células eucariotas delimitadas por una o dos membranas. Cada una de ellas realiza una función determinada permitiendo la vida de la célula. P PARÉNQUIMA: Tejido de los órganos glandulares. PATOGENIA: Parte de la medicina que estudia el origen y el desarrollo de las enfermedades. PATOGENICIDAD: Capacidad de u agente infeccioso de producir enfermedad en un huésped susceptible. PBS: Siglas en inglés de Tampón Fosfato Salino. Mezcla en concentraciones relativamente elevadas de un ácido débil y su base conjugada. Tiene la propiedad de mantener estable el pH de una disolución frente a la adición de cantidades relativamente pequeñas de ácidos o bases fuertes. PLEROCERCOIDE: Último estadio larvario de los falsos vermes planos (cestodos), que infecta al hospedador definitivo. PLURICELULAR: Organismo formado por más de una célula. PORTADOR ASINTOMÁTICO: Se dice del individuo que no presenta signos o síntomas de la enfermedad y es capaz de transmitirla. PREVALENCIA: Proporción de individuos de una población que presentan una enfermedad en un momento, o periodo de tiempo, determinado. 69 PRIMOINFECCIÓN: Infección que se origina por primera vez en el organismo. PROCERCOIDE: Estadio larvario de los falsos vermes planos (cestodos), que se desarrolla al ser ingerido por el primer hospedador intermediario. PROFILAXIS: Prevención o conjunto de medidas para evitar una enfermedad. PROGLOTIS: Cada uno de los segmentos en los que aparece dividido el cuerpo o estróbilo de los cestodos. PROTOPLASMA: Componente fundamental del cuerpo de los protozoos, el cual está diferenciado en núcleo y citoplasma. Q QUISTE: Forma de resistencia de algunos protozoos para hacer frente a las condiciones adversas que se producen en el ambiente (desecación, cambios de temperatura, pH, humedad, concentración de oxígeno). También es la forma de transmisión de la enfermedad y la de multiplicación. R RESPUESTA INMUNE: Actuación integrada de un gran número de mecanismos heterogéneos de defensa de los animales frente a sustancias y agentes externos extraños, conocidos con el nombre de antígenos. RÓSTELO: Organela en forma de gancho que poseen los verdaderos vermes planos, que les permite anclarse al intestino del hospedador. S SEUDÓPODO: Extensión protoplasmática del citoplasma de ciertas células y seres unicelulares, a los que sirve para desplazarse y para apresar alimentos. SINGAMIA: Forma de reproducción sexual de los protozoos, en la que dos gametos se fusionan y forman un zigoto. SUIDOS: Se dice de la familia de los mamíferos artiodáctilos, paquidermos, con hocico bien desarrollado, caninos largos y fuertes que sobresalen de la boca, entre los que se encuentran los cerdos y los jabalíes. 70 T TRICOTOMÍA: Rasurado del vello púbico, especialmente para la preparación de una intervención quirúrgica. TROFOZOITO: Forma activa de los protozoos, en la cual se alimenta, se reproduce, se moviliza y ejerce su acción patógena. U UNICELULAR: Organismo formado por una sola célula, como es el caso de los protozoos. V VACA NODRIZA: Hembra de la especie bovina de raza cárnica, que forma parte de un rebaño destinado a la cría de terneros para la producción de carne o animales para la reposición. VENTOSAS: Órgano que tienen ciertos animales en los pies, la boca u otras partes del cuerpo, para adherirse o agarrarse mediante el vacío, al andar o hacer presa. Z ZOONOSIS: enfermedad del animal que es transmisible al ser humano en condiciones naturales y viceversa. 71 BIBLIOGRAFÍA ARAMBERRI, M.; LÁRSEN, R.; DOUMECQ, L. (2013). Análisis de establecimientos positivos a Trichomonosis. Facultad de Ciencias Veterinarias de Argentina. BIO RAD (2010). ExperionTM Automated Electrophoresis System. Instruction Manual. BIO RAD. ExperionTM Automated Electrophoresis System. BIO RAD. ExperionTM DNA 1K Analysis Kit Quick Guide. BIO RAD. ExperionTM DNA 1K and 12K Analysis Kits. Automated Electrophoresis. CAMPERO, C.M.; COBO, E.R. (2006). Tritrichomonas foetus: patogénesis de la mortalidad embrionaria/fetal, caracterización de antígenos vacunales y respuesta inmune inducida. Revista de Medicina Veterinaria, Buenos Aires (Argentina), 87, 4756. CIATA (1999). La tricomoniasis. Boletín informativo CIATA (Centro de Investigación Aplicada y Tecnología Agroalimentaria) Asturias, 70. COBO, E.R.; CAMPERO, C.M. (2002). Nuevos aspectos inmunológicos y vacunales de la tricomoniasis bovina. Revista de Medicina Veterinaria, 83, 203-208. DEL CURA, A. (2009). Trematodosis en ganado vacuno. Cría y Salud, 24, 28-31. GÁLLEGO, J. (2006). Manual de parasitología: morfología y bilogía de los parásitos de interés sanitario. Publicaciones y ediciones de la Universidad de Barcelona. GARCÍA, C. (2002). Control de las parasitosis en el ganado bovino de Galicia. Revista Ganadería. (15), 62-69. HABELA, M.; MORENO, A.; CASERO, A. (2009). Recomendaciones para el control de parásitos. MG Mundo ganadero, 20(217), 22-26. HENDRIX, C. M. (1999). Diagnostico parasitológico veterinario. 2 Ed. Elsevier Science Health Science Division. MENDOZA, J.A. (2013). Epidemiología, impacto económico y control de la tricomonosis bovina en los sistemas extensivos de montaña. Tesis Doctoral. Universidad Complutense de Madrid. MICROBIAL NEWSLETTER (2009). La extracción y purificación del ADN para el análisis por PCR. Mitos y realidades. Informaciones sobre Análisis Microbiológicos por PCR. OIE (2008). Tricomonosis. Manual de la OIE sobre animales terrestres. ORTEGA-MORA, L.M.; COLLANTES-FERNÁNDEZ, E.; FERRE, I.; ÁLVAREZGARCÍA, G. (2011). Enfermedades parasitarias y intensificación en el ganado bovino en la UE: nuevas situaciones conllevan viejos problemas. XII Congreso Ibérico de Parasitología (Zaragoza), 22-23. 73 PARDO, M. A. S. (1996). Procesos parasitarios del ganado vacuno y su control. MG Mundo ganadero, (76), 44-45. PARTIDA, E.; VILLALOBOS, N. (2008). Principales parásitos de interés que afectan al ganado vacuno en España. Ganadería, (54), 20-27. PÉREZ DE CASTRO, A.M. Reacción en Cadena de la Polimerasa (Polymerase Chain Reaction, PCR). Universidad Politécnica de Valencia. QIAGEN (2006). DNeasy® Blood & Tissue Handbook. QUIROZ, H. (2005). Parasitología y enfermedades parasitarias de los animales domésticos. Ed. Limusa. ROJO-MONTEJO, S.; PEDRAZA-DÍAZ, S.; GARCÍA-PEÑA, F.J.; MENDOZAIBARRA, J.A.; OSORO, K.; ORTEGA-MORA, L.M.; COLLANTES-FERNÁNDEZ, E. (2010). La Tricomonosis y la Campilobacteriosis genital bovina: dos enfermedades importantes en el diagnóstico del fallo reproductivo en explotaciones con monta natural. Boletín ANEMBE, 86, 34-45. SERRANO, M. (2013). Tricomoniasis bovina. Revista Albaitaritza, 58, 16-20. 74 ANEXO I MATERIAL EMPLEADO MATERIAL PARA LA TOMA DE MUESTRAS. El material empleado para realizar la toma de muestras fue administrado por el Laboratorio de Calidad Agroalimentaria de Villava y es el que se detalla a continuación. Manga de manejo del ganado, vallas, sogas o cualquier otro elemento que sirva para sujetar al animal. Guantes de látex desechables que deben ser utilizados como medida profiláctica. Tijeras metálicas con las que realizar la tricotomía. Toalla de papel seco para la limpieza de la zona prepucial. Raspador de plástico. Se trata de una especie de tubo de plástico de aproximadamente un metro de longitud, que en su extremo posterior tiene unas ranuras que hacen la vez de raspador, en las que se queda impregnado el esmegma prepucial. Imagen32. Raspador de plástico (derecha) y detalle del extremo posterior en el que se aprecian las ranuras que hacen las veces de raspador (izquierda). (Fuente: elaboración propia). Tubo con solución PBS. Es una solución tampón salina que sirve para mantener constante el pH de las células. Medio de transporte In PouchTM TF. Será el medio de cultivo que también hará las veces de medio de transporte. Pipeta Pasteur graduada. Encuesta que deben de rellenar los propietarios de las explotaciones en las que se toman las muestras. 76 MATERIAL Y EQUIPOS PARA EL ANÁLISIS DE LABORATORIO. El material con el que se llevan a cabo los análisis de las muestras en el laboratorio son los siguientes. Cultivo e identificación del parásito: Medio de cultivo In PouchTM TF. Se trata de un sistema para el diagnóstico de Trichomonas foetus a partir de muestras prepuciales o vaginales bovinas, del fabricante BioMed Diagnostics, Inc. El propio medio es selectivo para el transporte y el crecimiento de T. foetus, mientras que inhibe el crecimiento de otros organismos como levaduras, mohos o bacterias que pueden interferir con un diagnóstico fiable. Consiste en una especie de sobre de plástico dividido en dos cámaras en forma de V comunicadas entre sí por un estrecho pasaje. La cámara inferior contiene el medio de cultivo, y la superior es donde se introduce la muestra de esmegma prepucial. Tiene dos pestañas que, una vez introducida la muestra, se cierran para sellar el sobre (Imagen12). Imagen 33. Medio de transporte y de cultivo In PouchTM TF. 77 El medio de cultivo contiene peptonas, extracto de levadura, maltosa y otros nutrientes, aminoácidos, sales, agentes antifúngicos y antimicrobianos. Todo ello en una solución salina tamponada con fosfato de base elaborada para asilar el diagnóstico positiva del agente. Es compatible con PCR, además permite el transporte, el cultivo y la observación directa de la muestra en un mismo dispositivo. Tiene una vida útil de un año, por lo que se debe de conservar a temperatura ambiente (18ºC – 25ºC), nunca se debe de refrigerar ni congelar, y ha de mantenerse en posición horizontal y en oscuridad. Incubador para mantener las muestras a 37ºC. Pipetas y puntas de pipetas. Porteobjetos y cubreobjetos. Microscopio con contraste de fases que permite observar células vivas y sin colorear. Extracción del ADN: Tubos de microcentrífuga (comúnmente llamados eppendorf). Pequeño contenedor cilíndrico de plástico, con un fondo cónico y una tapa unida al cuerpo del tubo. Pipetas y puntas de pipeta. Gradilla para sujetar los tubos de microcentrífuga. Incubador donde se mantiene el tubo de PBS con las muestras a 37ºC. Termobloque. Es un sistema de calentamiento en seco para bloques metálicos con un amplio rango de temperatura de hasta 150 ºC, cuyo funcionamiento se caracteriza por la ausencia de líquido como elemento transmisor de calor. Microcentrífuga para tubos de 150 ó 200µL. Etanol (96-100%) para precipitar el ADN del material extraído. Agitador tipo Vortex o mezclador de vórtice es un dispositivo que se usa para agitar pequeños tubos o frascos de líquido. Imagen 34. Agitador tipo vortex o mezclador de vórtice. (Fuente: elaboración propia). 78 Qiagen Kit DNeasy Blood & Tissue (50): contiene el conjunto de reactivos necesarios para realizar la extracción del ADN. - - Columnas de extracción: pequeño contenedor equipado con una membrana de sílice en la parte inferior, que retiene específicamente el ADN permitiendo el paso de las moléculas y sales que acompañan la reacción de lisis. Tubos colectores (2 ml): en ellos se colocan las columnas de extracción para recoger el fluído que se desecha. Imagen 35. Columna de extracción y tubo colector. - Proteinasa K: enzima que cataliza la descomposición de proteínas celulares y las divide en pequeños péptidos y aminoácidos. Buffer AL: solución tampón de lisis celular que rompe la célula abierta y las membranas nucleares. Buffer AW1 y AW2: soluciones tampón que lavan de contaminantes el ADN unido a la membrana de la columna. Buffer AE: solución tampón que eluye el ADN de la membrana de la columna y permite el almacenamiento estable del ADN durante años en la nevera o en el congelador. Imagen 36. Qiagen Kit DNeasy Blood & Tissue (50), con el que se realiza la extracción del ADN. 79 Realización de la PCR: Pipetas y puntas de pipetas. Gradillas congeladas, que mantienen baja la temperatura de los reactivos. Viales o microtubos. ADN molde: contiene la región de ADN que se va a amplificar. Master Mix: preparación premezclada, que incluye los reactivos necesarios para realizar la PCR. - - ADN polimerasa: la más común es la polimerasa Taq, asilada de la bacteria Thermus aquaticus. Se trata de una enzima termoestable capaz de generar una copia de ADN a partir del ADN molde Solución tampón o buffer: mantiene el pH adecuado para el funcionamiento de la polimerasa. Cofactores de la polimerasa: cationes divalentes, generalmente en forma de cloruro de magnesio (MgCl2), necesarios para la acción de la enzima. Nucleótidos libres: en forma de desoxirribonucleósidos trifosfato (dNTPs). Las DNA polimerasas crean una cadena complementaria a la cadena molde mediante la incorporación de los nucleótidos que forman el ADN: la adenina (A), la guanina (G), la timina (T) y la citosina (C). Cebadores o primers: fragmentos cortos de ADN de cadena sencilla que contienen un grupo 3’ hidroxilo libre. Son complementarios a los extremos del fragmento de ADN a amplificar y sirven como punto de partida para que la polimerasa inicie la adición de nucleótidos con el fin de copiar la hebra molde. Delimitan el fragmento de ADN que se va a amplificar. Termociclador. Aparato que permite realizar los cambios de temperatura necesarios para cada etapa de la amplificación del ADN. La mayoría hacen uso del efecto Peltier, que permite calentar y enfriar los tubos de reacción rápidamente, invirtiendo la corriente eléctrica aprovechando las propiedades de los semiconductores. Análisis por electroforesis: El análisis de las muestras por electroforesis se realiza con el sistema de electroforesis automatizado Experion, que está formado por los siguientes componentes. 1. Chips de microfluidos: cada chip contiene 16 pocillos de plástico unidos sobre una pequeña placa de vidrio, la cual está grabada con una red de microcanales, una de las cuales interseca con cada uno de los pocillos, el canal de separación 2. Kits de análisis Experion: contiene los chips de microfluidos y los reactivos necesarios para realizar la separación de ADN y análisis. 80 - Gel: matriz en la que se separan las moléculas. Colorante fluorescente: permite identificar las moléculas separadas. Buffer de carga: confiere peso a la muestra para que el ADN se precipite al fondo de los pocillos. Marcador Ladder: mezcla de moléculas de tamaño conocido que sirve como referencia para cuantificar las muestras. 3. Plataforma de cebado Experion: sistema que aplica presión para que el gel que se introduce en uno de los pocillos, llene la red de microcanales con la solución de gel. 4. Estación Vortex Experion: garantiza la mezcla completa del contenido de los pocillos. 5. Estación de electroforesis Experion: permite realizar automáticamente todos los pasos para llevar a cabo la separación, tinción, detección y cuantificación de bandas de hasta 12 muestras en un solo paso. Contiene 16 electrodos de platino, que al cerrar la tapa de la estación entran en contacto con el contenido de los pocillos de los chips. 6. Software Experion: incluye todos controles necesarios para el funcionamiento de la estación de electroforesis, así como las herramientas de análisis de datos necesarias para evaluar los resultados. Imagen 37. Sistema de electroforesis automatizado Experion. 81 ANEXO II RESOLUCIÓN 298/2013 POR LA QUE SE PROHIBE EL ACCESO DE LOS TOROS A LOS PASTOS DE LA SIERRA DE URBASA Y ANDÍA 83 84 ANEXO III ENCUESTA REALIZADA A LOS GANADEROS Encuesta Trichomonas 1. DATOS GENERALES DE LA EXPLOTACIÓN Nº Explotación: ________________________ Fecha del Muestreo: ____________________ Propietario: __________________________________________________________________ Localidad: ___________________________________________________________________ Dirección: ___________________________________________________________________ Censo de la explotación: Sementales: Vacas: Novillas: Terneras: Aptitud: Carne Leche Doble propósito Lidia Sistemas de Explotación: Intensivo Extensivo Semi extensivo Calidad de las cercas (1): Buena Regular Mala ¿Se realizan incorporaciones de animales nuevos activos reproductivamente (2)? Machos SI NO Hembras SI NO Tiempo de permanencia de los sementales con las hembras 0-3 meses 3-6 meses 6-9 meses 9-12 meses Detallar meses: _______________________________________________________________ ¿Se comparten pastos con otras explotaciones? SI NO Mencione las explotaciones: _______________________________________________ Localización concreta de los pastos: _________________________________________ (1) Si la cerca permite el paso de animales fácilmente será considerada mala, si lo permite con dificultad será considerada regular, y si lo restringe será considerada buena. (2) Se entenderá por “animales nuevos activos reproductivamente”, aquéllos que hayan montado previamente a su incorporación a la explotación actual. 86 Encuesta Trichomonas 2. DATOS REPRODUCTIVOS Fertilidad: __________________________________________________________________ Intervalo entre partos: _________________________ ¿Utiliza Inseminación Artificial? SI NO ¿Utiliza Monta Natural? SI NO ¿Posibilidad de contacto de hembras con toros de otras explotaciones? SI NO ¿Se han presentado abortos? SI NO ¿Ha incrementado el número de abortos durante el último año? SI NO ¿Se presenta repetición de celos? SI NO ¿Ha notado un aumento en la frecuencia de la repetición de celos? SI NO ¿Se hacen controles reproductivos regularmente? SI NO ¿Realizan pruebas diagnósticas a los toros de reciente incorporación? SI NO Vacuna contra enfermedades reproductivas SI NO SI NO ¿Tiene conocimiento sobre Trichomonas? SI NO ¿Se han realizado anteriormente el diagnóstico de Trichomonas? SI NO En caso afirmativo, ¿los resultados del diagnóstico fueron positivos? SI NO Cuales: _____________________________________________ ¿Se administran suplementos alimenticios en época reproductiva? 3. OTROS DATOS 87 Encuesta Trichomonas 4. DATOS DE ANIMALES MUESTREADOS 4.1 MACHOS Identificación: ________________________ Edad: ______________________ Raza: ______________________________ Condición corporal: Mala Regular Buena ¿Macho de reposición propia? SI NO ¿Había montado con anterioridad? SI NO ¿Se le realizaron pruebas diagnósticas? SI NO SI NO En caso negativo: Procedencia: _____________________________ ¿Ha servido de semental en otra(s) explotación(es)? ¿Cuantas veces en el último periodo reproductivo? ____________________________ ¿Ubicación de esa(s) explotación(es)? _____________________________________ ¿Toro comunal? SI NO Zonas en las que se comparte ____________________________________________ ¿Permanece siempre con el mismo grupo de hembras? SI NO Numero aproximado de hembras que monta __________________________________ Tiempo de permanencia con las hembras 0-3 meses 3-6 meses 6-9 meses 9-12 meses ¿Ha observado problemas de fertilidad en las hembras que cubre este toro? SI NO En caso afirmativo, ¿ha tomado alguna medida? NO SI ¿Cual? ______________________________________________________________ 88 ANEXO IV RESULTADOS DE LAS ENCUESTAS Tabla 7. Datos relativos al manejo de las explotaciones que respondieron a la encuesta. Expl. Censo explotación Localidad Sementales 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Abárzuza Abárzuza Abárzuza Aizpun Aranarache Arizaleta Arizaleta Arróniz Arteta Bakaiku Baríndano Baríndano Eguiarreta Eguiarreta Eraul Errotz Etxarri-Aranatz Etxarri-Aranatz Gollano Goñi Goñi Guembe 2 2 1 3 1 2 1 2 2 2 1 1 4 3 2 1 2 1 2 4 1 1 Vacas Novillas Aptitud Sistema explotación Calidad cercas C C C C C C C C C C C C C C C C C C C C C C SE SE SE SE SE SE SE SE SE SE SE SE E SE SE SE SE SE SE E SE SE R B B B B B B B B R B B B B B B B B B B R B Terneras 120 65 36 120 33 60 13 30 60 55 10 30 15 6 25 13 15 2 4 15 8 6 15 10 3 15 2 20 2 0 10 25 5 110 80 50 23 65 110 35 150 31 49 12 10 4 20 90 0 50 5 25 12 10 5 40 50 9 20 0 90 Incorporación animales nuevos activos reproduct. Machos Hembras SI NO NO SI NO SI NO SI NO NO NO NO SI NO SI NO NO SI SI SI NO NO Tiempo permanencia semanales con hembras SI NO NO NO NO NO NO SI NO SI NO 9-12 meses 9-12 meses 9-12 meses 0-3 meses 6-9 meses 6-9 meses 9-12 meses 9-12 meses 9-12 meses 3 meses 6-9 meses NO NO SI NO NO SI NO SI NO NO 9-12 meses 6-9 meses 9-12 meses 9-12 meses 9-12 meses 6-9 meses 9-12 meses 9-12 meses 6-9 meses 6-9 meses Pastos compartidos SI SI SI SI SI SI SI NO SI SI SI SI SI NO SI NO SI SI SI SI SI SI Expl. 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 Censo explotación Localidad Guembe Iruñela Irurtzun Iturgoyen Iturgoyen Iturgoyen Iturgoyen Iturgoyen Lakuntza Larraona Larraona Legaria Lezaun Lezaun Lezaun Lezaun Lezaun Lezaun Munarriz Murieta Olazti Olazti Olazti Olejua Sementales Vacas Novillas Terneras 1 1 1 2 2 1 2 2 2 1 1 1 1 1 1 1 1 1 2 6 1 1 2 2 32 70 23 25 75 15 100 55 80 22 22 29 19 35 22 60 60 36 55 130 8 11 40 75 3 3 4 5 15 3 20 36 20 3 2 4 5 10 1 10 20 10 0 2 18 5 4 10 20 4 10 0 0 5 10 15 0 0 0 0 0 13 40 0 3 7 14 12 Aptitud Sistema explotación Calidad cercas C C C C C C C C C C C C C C C C C C C C C C C C SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE B B B B M B B R B B B R B B B B B R R R B B R B 91 Incorporación animales nuevos activos reproduct. Machos Hembras NO NO NO NO SI NO NO NO NO NO NO NO NO NO NO SI NO NO NO NO NO NO SI SI NO NO NO NO NO NO NO NO SI NO NO SI SI SI NO SI NO NO NO NO Tiempo permanencia sementales con hembras 6-9 meses 6-9 meses 9-12 meses 9-12 meses 9-12 meses 6-9 meses 9-12 meses 6-9 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 6-9 meses 9-12 meses 6-9 meses 9-12 meses 6-9 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 6-9 meses 9-12 meses Pastos compartidos SI SI SI SI SI SI SI SI SI SI SI SI SI SI SI SI SI SI SI NO SI SI SI Expl. Censo explotación Localidad Aptitud Sistema Calidad explotación cercas Sementales Vacas Novillas Terneras 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 Ollo Ollo San Martin de Améscoa Sarasate Sarasate Ultzurrun Ultzurrun Ultzurrun Ultzurrun Urdanoz Urdanoz Urdanoz Viloria Viloria Ziordi 3 1 1 1 1 1 1 1 1 1 1 1 1 3 5 62 50 40 36 14 16 44 45 20 38 26 10 52 60 150 12 20 9 6 2 4 7 11 4 2 8 0 12 2 0 0 10 5 7 2 3 11 0 15 20 5 60 C C C C C C C C C C C C C C C Aptitud: C, carne; LE, leche; DP, doble propósito; LI, lidia. Sistema de explotación: I, intensivo; E, extensivo; SE, semiextensivo. Calidad de las cercas: B, buena; R, regular; M, mala. 92 SE SE SE SE SE SE SE SE SE SE SE SE SE SE SE B M B B B B B B B B R R R R R Incorporación Tiempo animales nuevos permanencia Pastos activos reproduct. sementales con compartidos hembras Machos Hembras NO NO NO NO NO NO SI NO NO NO NO NO NO SI NO NO NO NO NO NO NO NO NO NO NO NO SI SI NO 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 6-9 meses 6-9 meses 6-9 meses 6-9 meses 9-12 meses 9-12 meses 9-12 meses SI SI SI SI SI SI SI SI SI SI NO SI SI SI SI Tabla 8. Datos reproductivos de las explotaciones que respondieron a la encuesta. Expl. Intervalo Fertilidad entre partos 1 2 Buena 3 Buena 4 Buena 12 meses 12 meses 13 meses 5 6 Buena 13 meses 7 8 Buena 9 Buena 10 Buena 13 meses 12 meses 10-11 meses 11 12 13 Buena 14 Buena 14 meses 12 meses IA Monta natural Contacto de hembras con toros de otra explotación Abortos SI SI SI SI NO SI NO NO NO NO NO NO SI SI NO NO NO NO NO NO NO NO NO SI NO NO NO NO NO NO NO SI (BVD) NO NO SI SI SI NO SI NO NO NO SI (IBR y BVD) SI SI SI SI NO NO SI NO NO NO NO NO SI SI NO NO NO NO NO SI NO NO SI SI SI SI SI NO SI NO NO NO NO NO NO SI NO NO NO NO NO NO NO NO SI NO SI NO NO NO NO NO SI NO SI SI NO SI SI NO NO SI NO SI NO NO NO NO NO SI SI SI SI NO SI NO NO NO NO NO NO NO NO NO NO SI SI SI SI NO NO NO SI NO SI NO NO SI NO SI NO NO NO NO NO NO NO NO NO Aumento Pruebas Suplementos Incremento Vacuna Repetición frecuencia Controles diagnósticas alimenticios número contra enf. celos repetición reproductivos toros reciente época abortos reproductivas celos incorporación reprod. 93 Expl. Fertilidad Intervalo entre partos IA Monta natural Contacto de hembras con toros de otra explotación 15 Buena 13 meses NO SI SI NO NO NO NO SI NO 16 Buena 12 meses NO SI NO NO NO NO NO NO NO Abortos Aumento Pruebas Suplementos Incremento Vacuna Repetición frecuencia Controles diagnósticas alimenticios número contra enf. celos repetición reproductivos toros reciente época abortos reproductivas celos incorporación reprod. SI (IBR y BVD) SI NO NO SI (IBR y BVD) SI (IBR y BVD) 17 Buena 12 meses SI SI SI NO NO NO NO SI NO NO 18 Buena 12-13 meses SI SI SI NO NO SI NO SI NO 19 Buena 12 meses NO SI NO NO NO NO NO SI NO NO SI 20 Buena SI SI SI NO NO SI NO SI NO NO SI 21 SI SI SI SI NO SI NO NO NO NO NO 22 SI SI SI SI NO SI NO NO NO NO NO 23 SI SI SI SI NO SI NO NO NO NO NO 24 SI SI SI SI NO SI NO SI NO SI NO SI 25 Buena 12 meses SI SI NO NO NO SI NO NO NO SI (IBR y BVD) NO 26 Buena 13 meses NO SI NO NO NO NO NO NO NO NO SI SI SI SI SI NO SI NO NO NO NO NO 27 28 Buena 13 meses NO SI NO NO NO NO NO SI NO NO SI 29 Buena 13 meses SI SI SI NO NO NO NO SI SI SI SI NO SI SI SI NO SI NO NO NO NO NO 30 31 Buena 13 meses SI SI NO NO NO NO NO SI NO SI (IBR y BVD) SI 32 Buena 13 meses NO SI SI NO NO NO NO NO NO NO SI 33 Buena 13 meses NO SI SI NO NO NO NO SI NO NO SI 94 Intervalo entre partos Expl. Fertilidad 34 Buena 35 Buena 12-14 meses 12 meses 36 Buena 13 meses 37 38 Buena 13 meses 39 IA Monta natural Contacto de hembras con toros de otra explotación NO SI SI NO NO NO NO NO NO NO NO NO SI SI NO NO NO NO NO NO NO SI SI SI SI NO NO NO NO SI NO NO SI SI SI SI NO NO NO NO NO NO SI SI NO NO NO NO NO SI NO NO SI SI NO NO SI NO NO NO SI NO SI SI SI NO NO NO NO NO SI NO NO NO SI NO NO NO SI NO SI NO NO NO NO SI SI NO NO NO NO NO NO NO NO NO SI SI NO NO NO NO NO NO NO NO Abortos Aumento Pruebas Suplementos Incremento Vacuna Repetición frecuencia Controles diagnósticas alimenticios número contra enf. celos repetición reproductivos toros reciente época abortos reproductivas celos incorporación reprod. SI (IBR y BVD) SI (IBR y BVD) NO SI 40 Buena 41 Buena 42 Buena 43 Buena 12-14 meses 12 meses 12-13 meses 11 meses 44 Buena 12 meses NO SI SI NO NO NO NO NO NO NO NO 45 Buena 12 meses NO SI SI NO NO NO NO NO NO NO NO 46 Buena 13 meses NO SI SI NO NO NO NO SI NO SI SI 47 Buena 13 meses NO SI SI NO NO NO NO NO NO NO SI 48 Buena 12 meses NO SI SI NO NO NO NO NO NO NO NO 49 Buena 12 meses NO SI NO NO NO SI NO NO NO NO NO 50 Buena 13 meses NO SI SI NO NO NO NO NO NO NO SI 51 Buena 13 meses NO SI NO NO NO NO NON NO NO NO SI 52 Buena 12 meses NO SI SI NO NO NO NO NO NO NO NO 95 Expl. Fertilidad Intervalo entre partos IA Monta natural Contacto de hembras con toros de otra explotación 53 Buena 12 meses SI SI SI NO NO SI NO SI NO NO SI 54 Buena 12 meses NO SI SI NO NO NO NO SI NO NO NO 55 Buena 12 meses NO SI SI NO NO NO NO NO NO NO NO SI SI SI SI NO SI NO NO NO NO NO SI SI NO NO NO NO NO SI NO NO SI SI SI SI SI NO SI NO NO NO NO NO SI SI SI NO NO SI NO NO NO NO NO NO SI SI NO NO NO NO NO NO NO NO NO SI SI NO NO NO NO NO NO SI (IBR y BVD) SI 56 57 Buena 12 meses 58 12-13 meses 59 60 61 Buena 12 meses Abortos Aumento Pruebas Suplementos Incremento Vacuna Repetición frecuencia Controles diagnósticas alimenticios número contra enf. celos repetición reproductivos toros reciente época abortos reproductivas celos incorporación reprod. 96 Tabla 9. Datos de relativos a los animales muestreados. ¿Había Condición Reposición montado con corporal propia anterioridad? Expl. Semental Edad Raza 1 1 2 3,5 8,9 Pirenaica Pirenaica B B SI SI 3 1,5 Blonde d'Aquitaine B SI 4 4,5 Blonde d'Aquitaine B NO 5 6 7 8 9 2 11 8 3 4 Mestizo Pirenaica Pirenaica Pirenaica Pirenaica B B B B B SI NO NO NO NO 10 4 Blonde d'Aquitaine B NO NO 11 12 13 14 15 8 4 6 4 5 Pirenaica Charolais Charolais Pirenaica Pirenaica B B B B B SI NO NO NO NO SI NO NO NO 2 3 4 5 *6 7 8 9 ¿Problemas ¿Se le ¿Permanece Nº de Tiempo ¿Semental en fertilidad realizaron Toro siempre con hembras permanencia otras en hembras pruebas comunal mismo nº que con las explotaciones? que cubre diagnósticas? hembras? monta hembras el toro? NO NO SI SI NO NO NO NO 70 50 9-12 meses 9-12 meses NO NO NO NO NO SI 65-75 9-12 meses NO NO NO NO NO SI SI NO SI SI SI SI SI SI 65-76 36 40 33 9-12 meses 9-12 meses 0-3 meses 9-12 meses 9-12 meses 6-9 meses NO NO NO NO NO NO SI NO NO NO NO NO NO NO NO NO NO NO NO NO NO SI 60 6-9 meses NO NO NO NO NO NO SI SI SI SI SI 13 NO NO NO NO NO NO NO NO NO 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses NO NO NO NO NO 97 40 20 Expl. 10 11 12 15 16 *17 ¿Problemas ¿Se le ¿Permanece Nº de Tiempo ¿Semental en fertilidad realizaron Toro siempre con hembras permanencia otras en hembras pruebas comunal mismo nº que con las explotaciones? que cubre diagnósticas? hembras? monta hembras el toro? Semental Edad Raza 16 17 18 19 1,5 7 5 1,5 Pirenaica Pirenaica Pirenaica Pirenaica B B B B NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO SI SI SI SI 0 20 10 3-6 meses 3-6 meses 6-9 meses NO NO NO 20 5 Blonde d'Aquitaine B NO NO NO NO NO NO 20 9-12 meses NO 21 10 Blonde d'Aquitaine B NO SI NO SI SI NO 20 9-12 meses NO 22 6 Blonde d'Aquitaine B NO NO NO NO NO NO 45 9-12 meses NO 23 1 Blonde d'Aquitaine B NO NO NO NO NO NO 8 9-12 meses NO 24 25 26 27 28 29 30 8 4 2 3 8 8 10 Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica B B B B B B B NO NO NO NO NO NO NO NO NO NO NO NO NO SI NO NO NO NO NO NO NO NO NO NO NO NO NO SI NO NO NO NO NO NO NO SI SI SI SI SI SI NO 40 25 15 6-9- meses 6-9- meses 6-9- meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses NO NO NO NO NO NO NO 13 14 ¿Había Condición Reposición montado con corporal propia anterioridad? 98 23 30 ¿Había Condición Reposición montado con corporal propia anterioridad? ¿Problemas ¿Se le ¿Permanece Nº de Tiempo ¿Semental en fertilidad realizaron Toro siempre con hembras permanencia otras en hembras pruebas comunal mismo nº que con las explotaciones? que cubre diagnósticas? hembras? monta hembras el toro? Expl. Semental Edad Raza 18 31 6 Blonde d'Aquitaine B NO NO NO NO NO NO 32 2 Blonde d'Aquitaine B NO NO NO NO NO SI 33 7 Blonde d'Aquitaine B NO NO NO NO NO SI 34 8 Blonde d'Aquitaine B NO SI NO SI NO 35 8 Blonde d'Aquitaine B NO NO NO NO 36 3 Blonde d'Aquitaine B NO NO NO 37 3 Blonde d'Aquitaine B NO NO 38 39 40 41 42 43 6,5 3 2,5 6 5 2,5 Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica B B B B B B NO SI NO NO NO SI 19 20 21 22 23 24 25 *26 6-9 meses NO 9-12 meses NO 35 9-12 meses NO SI 50 9-12 meses NO NO SI 50 9-12 meses NO NO NO SI 50 9-12 meses NO NO NO NO SI 50 9-12 meses NO NO NO NO NO NO NO NO NO NO NO NO SI SI SI SI SI SI 26 NO NO SI NO NO NO SI SI NO 6-9 meses 6-9 meses 6-9 meses 6-9 meses 9-12 meses 9-12 meses NO NO NO NO NO NO 99 50 30 70 27 Expl. 27 28 29 *30 31 32 33 34 35 36 37 38 39 40 *41 ¿Había Condición Reposición montado con corporal propia anterioridad? Semental Edad Raza 44 45 46 47 48 49 1 4,5 6 4 4 5 Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica B B B B B B SI NO NO NO NO SI 50 51 52 53 54 55 56 57 58 59 60 61 4 4 4 5 2,5 2 4 4 2 1,8 6 3,5 Pirenaica Pirenaica Mestizo Pirenaica Mestizo Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica B B B B B B B B B B B B NO NO SI NO SI NO SI NO NO SI NO NO ¿Problemas ¿Se le ¿Permanece Nº de Tiempo ¿Semental en fertilidad realizaron Toro siempre con hembras permanencia otras en hembras pruebas comunal mismo nº que con las explotaciones? que cubre diagnósticas? hembras? monta hembras el toro? NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO SI NO NO NO SI NO NO NO 100 NO NO NO NO NO NO NO NO NO NO NO NO SI SI SI SI SI SI 0 75 15 50 9-12 meses 9-12 meses 6-9 meses 9-12 meses 9-12 meses 6-9 meses NO NO NO NO NO NO NO NO NO NO NO NO SI NO NO NO NO NO NO NO NO NO SI NO SI NO NO NO SI NO SI SI SI SI SI SI NO SI SI SI SI SI 40 40 22 22 30 25 40 22 60 60 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 6-9 meses 9-12 meses 6-9 meses 9-12 meses 6-9 meses 9-12 meses 9-12 meses NO NO NO NO NO NO NO NO NO NO NO NO 30 Expl. *42 43 44 47 ¿Problemas ¿Se le ¿Permanece Nº de Tiempo ¿Semental en fertilidad realizaron Toro siempre con hembras permanencia otras en hembras pruebas comunal mismo nº que con las explotaciones? que cubre diagnósticas? hembras? monta hembras el toro? Semental Edad Raza 62 63 64 65 4 3 11 7 Mestizo Mestizo Mestizo Mestizo B B B B SI SI SI SI 66 67 5 6 Limousin Pirenaica B B NO NO NO NO NO NO 68 1,5 Blonde d'Aquitaine B NO NO 69 8,5 Blonde d'Aquitaine B NO 70 4 Blonde d'Aquitaine B 71 3 Blonde d'Aquitaine 72 3 73 8 45 *46 ¿Había Condición Reposición montado con corporal propia anterioridad? SI SI SI SI SI SI SI SI 9-12 meses 9-12 meses 9-12 meses 9-12 meses NO NO NO NO NO NO NO SI SI SI 8 16 9-12 meses 9-12 meses NO NO NO NO NO SI 12 6-9 meses NO SI NO SI NO SI 30 6-9 meses NO NO NO NO NO NO SI 9-12 meses NO B NO NO NO NO NO SI 50 9-12 meses NO Blonde d'Aquitaine B NO NO NO SI SI NO 50 9-12 meses NO Blonde d'Aquitaine B NO NO NO SI NO SI 60 9-12 meses 101 ¿Había Condición Reposición montado con corporal propia anterioridad? Expl. Semental Edad Raza 48 74 4,5 Blonde d'Aquitaine B NO 49 75 7 Blonde d'Aquitaine B SI 50 51 52 53 54 55 56 57 58 59 76 78 79 80 81 82 83 84 85 86 87 88 3 3 2,5 3 3,5 2,5 5 5 7,5 3 2 6 Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica Limousin Limousin B B B B B B B B B B B B NO NO SI NO NO NO NO SI NO NO NO NO *60 ¿Problemas ¿Se le ¿Permanece Nº de Tiempo ¿Semental en fertilidad realizaron Toro siempre con hembras permanencia otras en hembras pruebas comunal mismo nº que con las explotaciones? que cubre diagnósticas? hembras? monta hembras el toro? NO NO NO NO NO NO NO NO NO NO NO NO SI NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO NO 102 SI SI 60 9-12 meses NO NO SI 40 9-12 meses NO NO NO SI SI NO NO NO NO NO SI SI SI SI SI SI SI SI SI SI SI SI SI SI SI 36 14 16 40 45 20 35 20 10 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses 6-9 meses 6-9 meses 6-9 meses 6-9 meses 9-12 meses 9-12 meses 9-12 meses NO NO NO NO NO NO NO NO NO NO NO NO 55 Expl. Semental Edad Raza 61 89 90 91 92 93 6 9 4 3 9 Pirenaica Pirenaica Pirenaica Pirenaica Pirenaica ¿Había Condición Reposición montado con corporal propia anterioridad? B B B B B NO NO NO NO NO NO SI NO NO SI ¿Problemas ¿Se le ¿Permanece Nº de Tiempo ¿Semental en fertilidad realizaron Toro siempre con hembras permanencia otras en hembras pruebas comunal mismo nº que con las explotaciones? que cubre diagnósticas? hembras? monta hembras el toro? NO NO NO NO NO * Explotaciones con más de un semental, de las que faltan datos de algunos de ellos. Condición corporal: B, buena; R, regular; M, mala. 103 NO SI NO NO SI NO NO NO NO NO SI SI SI SI SI 40 30 40 45 40 9-12 meses 9-12 meses 9-12 meses 9-12 meses 9-12 meses NO NO NO NO NO