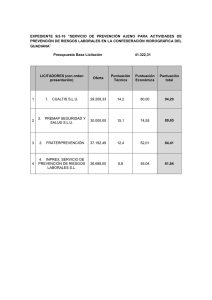
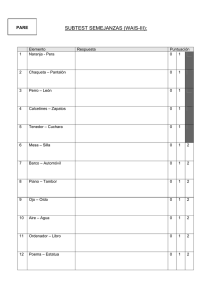
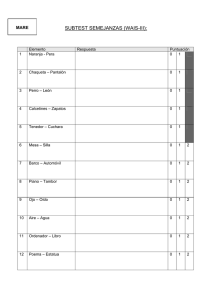
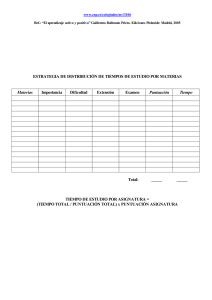
Tesis - Dirección General de Servicios Telemáticos
Anuncio

UNIVERSIDAD DE COLIMA Facultad de Medicina Eficacia de la Alimentación Enteral con una Fórmula con Triglicéridos de Cadena Media en la Prevención de Desnutrición en Lactantes con Atresia de Vías Biliares Tesis para obtener el grado de DOCTORA EN CIENCIAS MÉDICAS Presenta M en NH María del Carmen Rocío Macías Rosales Asesores Básico: DCSP Alfredo Larrosa Haro Clínico: D en C Benjamín Trujillo Hernández Colima, Colima, México. Julio de 2010. Colima, Colima, Julio de 2010 D en C Xóchitl A. Rosío Trujillo Trujillo Coordinadora del Posgrado en Ciencias Médicas Facultad de Medicina, Universidad de Colima P r e s e n t e. Con relación a la tesis que presenta la M en NH María del Carmen Rocío Macías Rosales titulada: “Eficacia de la alimentación enteral con una fórmula con triglicéridos de cadena media en la prevención de desnutrición en lactantes con atresia de vías de biliares”, la consideramos concluida y damos nuestra aprobación para que esta sea presentada examen doctoral y defendida a fin de obtener el grado de Doctor en Ciencias Médicas. Atentamente _________________________ ______________________________ DCSP Alfredo Larrosa Haro Hernández Asesor (Básico) D en C Benjamín Trujillo Asesor (Clínico) _____________________________ D en C Genaro Gabriel Ortiz Co-Asesor APORTACIONES a) Información del marco teórico, técnica antropométrica y resultados del presente trabajo se utilizaron para la elaboración de un capítulo de un manual de antropometría por invitación de uno de los líderes mundiales de antropometría del King’s College Hospital de Londres:Larrosa-Haro A, Hurtado-López EF, Macías-Rosales R, Vásquez-Garibay EM. Liver damage severity evaluated by liver function tests and the nutritional status estimated by anthropometric indicators. En: Preedy V. The Handbook of Anthropometry: Physical Measures of Human Form in Health and Disease. (en prensa), 2010. b) Trabajo aceptado en la Reunión Anual de la North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Octubre de 2010, Nueva Orleans EUA. AGRADECIMIENTOS Al Consejo Nacional de Ciencia y Tecnología y al Instituto Mexicano del Seguro Social por la beca otorgada para la realización de estudios de doctorado, con número de registro: 207560. Este trabajo recibió financiamiento de Fondos Sectoriales de CONACYT 2008-1 con número 87492. A las siguientes instituciones: Centro Universitario de Investigaciones Biomédicas de la Universidad de Colima; al Servicio de Gastroenterología y Nutrición, Unidad Médica de Alta Especialidad Hospital de Pediatría, Centro Médico Nacional de Occidente; al Instituto Mexicano del Seguro Social; a la Unidad de Investigación Médica, Unidad Médica de Alta Especialidad Hospital de Pediatría, Centro Médico Nacional de Occidente, Instituto Mexicano del Seguro Social. ÍNDICE Resumen 1 Abstract 2 Introducción 3 Marco teórico 5 Antecedentes 5 Enfermedad hepática crónica y desnutrición 5 Ensayos clínicos de tratamiento nutricio en niños con EHC. 7 Fundamentación de la teoría y métodos 11 Atresia de vías biliares 11 Tratamiento nutricio en la atresia de vías biliares 15 Fórmulas con triglicéridos de cadena media 16 Fórmulas con aminoácidos de cadena ramificada 16 Aporte de proteínas y encefalopatía hepática 17 Planteamiento del problema y justificación 18 Objeto de estudio 18 Magnitud 18 Trascendencia y justificación 18 Vulnerabilidad 19 Pregunta de investigación 20 Hipótesis y objetivos 21 Objetivo general 21 Objetivos específicos 21 Objetivo secundario 21 Material y Métodos 22 Diseño del estudio 22 Universo 22 Unidad de observación 22 Criterios de inclusión 22 Criterios de no inclusión 22 Criterios de exclusión 22 Tamaño de la muestra 22 Muestreo 23 Variables 23 Definición de las variables 25 Técnicas y procedimientos 32 Instrumentos de medición y técnicas 36 Captura y procesamiento de datos 37 Análisis estadístico 37 Aspectos éticos 37 Resultados 39 Variables socio-demográficas 39 Variables clínicas 39 Variables hematológicas y bioquímicas 40 Variables nutrimentales 40 Variables antropométricas 42 Evaluación del estado nutricio 42 Talla para la edad 43 Circunferencia cefálica para al edad 45 Peso para la talla 46 Circunferencia media del brazo para la edad 48 Pliegue cutáneo tricipital 49 Área total del brazo 51 Área muscular del brazo 52 Área grasa del brazo 54 Índice grasa del brazo 55 Efectos adversos 57 Discusión 59 Conclusiones 68 Perspectivas 69 Referencias bibliográficas 70 Anexos 78 Anexo 1. Cálculo del tamaño de muestra 78 Anexo 2. Variables socio-demográficas 79 Anexo 3. Variables hematológicas, bioquímicas y clínicas 81 Anexo 4. Contenido de energía, macronutrimentos, vitaminas y nutrimentos de la formula que se va a utilizar 84 Anexo 5. Ecuaciones de composición corporal 85 Anexo 6. Hoja de colección de datos 86 Anexo 7. Carta de consentimiento informado 94 Anexo 8. Registro de ensayos clínicos 97 Anexo 9. Autorización del proyecto por el Comité Local de Investigación del HP 99 Anexo 10. Variables socio-demográficas, clínicas, hematológicas y bioquímicas. 100 Anexo 11. Variables antropométricas con su medida de dispersión y 103 comparación intra e intergrupo Anexo 12. Seguridad 106 ÍNDICE DE TABLAS Tabla 1. Estudios que identifican desnutrición y otros trastornos nutricios en niños con enfermedad hepática crónica 6 Tabla 2. Ensayos clínicos de intervención nutricia en niños con enfermedad hepática crónica 10 Tabla 3. Sensibilidad y especificidad de métodos de diagnóstico de la atresia de vías biliares. 13 Tabla 4. Eficacia de las diversas opciones terapéuticas empleadas en niños con atresia de vías biliares. 14 Tabla 5. Dosis y frecuencia de nutrimentos empleados en pacientes con atresia de vías biliares. 15 Tabla 6. Fórmulas infantiles que contienen triglicéridos de cadena media 16 Tabla 7. Distribución aleatoria de la asignación a los grupos A (alimentación enteral) y grupo B (alimentación oral a libre demanda) 23 Tabla 8. Variables socio-demográficas 24 Tabla 9. Aporte de energía como % de los requerimientos ideales por Kg. de peso corporal de acuerdo a la edad 33 Tabla 10. Requerimientos de energía en niños de ambos sexos alimentados con seno materno, fórmula o con alimentación mixta los primeros 12 meses de vida. 33 Tabla 11. Estadísticos de distribución central y de dispersión del aporte de energía (kcal) en 15 lactantes con atresia de vías biliares. 40 Tabla 12 Estadísticos de distribución central y de dispersión del porcentaje de la ingestión diaria recomendada (IDR) en 15 lactantes con atresia de vías biliares. 41 Tabla 13. Estadísticos de distribución central y de dispersión del aporte de proteínas (g) en 15 lactantes con atresia de vías biliares 41 Tabla 14. Estadísticos de distribución central y de dispersión aporte de proteínas g/kg/día en 15 lactantes con atresia de vías biliares. 42 Tabla 15. Frecuencias y porcentajes de casos con desnutrición (z <2DE) con los indicadores talla para la edad, circunferencia cefálica para la edad, peso para la talla, circunferencia media del brazo para la edad y pliegue cutáneo tricipital para la edad 43 Tabla 16. Estadísticos de distribución central y de dispersión de la talla para la edad expresada en puntuación z en 15 lactantes con atresia de vías biliares 43 Tabla 17. Estadísticos de distribución central y de dispersión de la talla para la edad expresada como la diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. 44 Tabla 18. Estadísticos de distribución central y de dispersión de la circunferencia cefálica para la edad expresada en puntuación z en 15 lactantes con atresia de vías biliares 45 Tabla 19. Estadísticos de distribución central y de dispersión de la circunferencia cefálica expresada en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares 46 Tabla 20. Estadísticos de distribución central y de dispersión del peso para la talla expresado en puntuación z en 15 lactantes con atresia de vías biliares 47 Tabla 21. Estadísticos de distribución central y de dispersión del peso para talla expresada en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares 47 Tabla 22. Estadísticos de distribución central y de dispersión de la circunferencia media del brazo expresada en puntuación z en 15 lactantes con atresia de vías biliares. 48 Tabla 23. Estadísticos de distribución central y de dispersión de la circunferencia media del brazo expresada en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. 49 Tabla 24. Estadísticos de distribución central y de dispersión del pliegue cutáneo tricipital expresado en puntuación z en 15 lactantes con atresia de vías biliares 50 Tabla 25. Estadísticos de distribución central y de dispersión del pliegue cutáneo tricipital expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares 50 Tabla 26. Estadísticos de distribución central y de dispersión del área total del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares. 51 Tabla 27. Estadísticos de distribución central y de dispersión del área total del brazo expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares 52 Tabla 28. Estadísticos de distribución central y de dispersión del área muscular del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares. 53 Tabla 29. Estadísticos de distribución central y de dispersión de la diferencia del área muscular del brazo de la medición basal con las mediciones subsecuentes en 15 lactantes con atresia de vías biliares 53 Tabla 30. Estadísticos de distribución central y de dispersión del área grasa del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares 54 Tabla 31. Estadísticos de distribución central y de dispersión de las diferencias de la resta del valor inicial con los subsecuentes del área grasa del brazo expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares 55 Tabla 32. Estadísticos de distribución central y de dispersión del índice grasa del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares. 56 Tabla 33. Estadísticos de distribución central y de dispersión del índice grasa del brazo expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. 56 ÍNDICE DE FIGURAS Figura 1. Puntaje z de la talla para la edad en 10 lactantes con atresia de vías biliares manejados con fórmula láctea a libre demanda (control histórico) y de 9 pacientes manejados con una fórmula de hidrolizados de proteína y triglicéridos de cadena media por sonda nasogástrica en infusión continua. 8 Figura 2. Estandarización antropométrica de la medición del peso en 9 lactantes. Correlaciones intra e inter-grupo por medio de correlación de Pearson 31 Figura 3. Estandarización antropométrica de la medición de longitud en 9 lactantes. Correlaciones intra e inter-grupo por medio de correlación de Pearson. 31 ÍNDICE DE ABREVIATURAS TCM Triglicéridos de cadena media AVB Atresia de vías biliares EHC Enfermedad hepática crónica HP Unidad de Alta Especialidad Hospital de Pediatría del Centro Medico nacional de Occidente Instituto mexicano del Seguro Social TH Trasplante Hepático IDR Ingestión diaria recomendada PELD Pediatric end-state liver disease OMS Organización Mundial de la Salud FAO/OMS/UNU Organización de las Naciones Unidas para la Agricultura y Alimentación, Organización Mundial de la Salud, Universidad de las Naciones Unidas. Kg Kilogramo G Gramos g/kg Gramos por kilo kcal. Kilocalorías Ml Mililitros RIC Rango intercuartílico RESUMEN Objetivo. Comparar la eficacia de la alimentación enteral versus oral con una fórmula con triglicéridos de cadena media (TCM) en la prevención de desnutrición en lactantes con atresia de vías de biliares (AVB). Material y métodos. Diseño: ensayo clínico. Lugar y periodo: un hospital pediátrico de referencia, 2007-2009. Inclusión: 3-9 meses de edad con AVB. Variables independientes: alimentación oral y enteral. Variable dependiente: estado nutricio. Tamaño muestral: n=7 por grupo. Muestreo: Aleatorio simple. Intervención: Fórmula con TCM, infusión naso-gástrica, kcal ~140 de la ingestión diaria recomendada. Grupo control: Fórmula con TCM, alimentación oral a libre demanda. Evaluación del estado nutricio: indicadores antropométricos. Patrones de referencia: OMS 2006, Sann. Resultados. Pacientes: 8 casos y 7 controles. Diez (66.7%), fueron niñas, mediana de la edad 5 meses. Antropometría: La puntuación z de la longitud y de la circunferencia cefálica incrementó sus valores negativos en el grupo oral y se mantuvo estable en el enteral. Los indicadores antropométricos del brazo revelaron pérdida de reservas de grasa en el grupo oral e incremento en el de intervención. El área muscular disminuyó en el grupo oral y se mantuvo estable en el enteral. La frecuencia de infecciones respiratorias, diarrea y distensión abdominal fue mayor en el grupo de intervención. Al final del estudio los valores de hemoglobina y el amonio fueron mayores en el grupo enteral; la gama glutamil-transferasa, fosfatasa alcalina y cuenta de leucocitos fueron mayores en el grupo oral. Conclusiones. La alimentación enteral preservó el crecimiento longitudinal, cefálico y el área muscular además de incrementar la masa grasa. El principal efecto adverso de la intervención nutricia fue infección respiratoria. 1 ABSTRACT Objective: To compare the efficacy of enteral versus oral nutrition of a medium chain triglyceride (MCT) formula to prevent malnutrition in infants with biliary atresia (BA). Material and methods: Design: clinical trial. Setting: a pediatric referral hospital, 2007-2009. Inclusion: Infants 3-9 months old with BA. Independent variables: enteral and oral nutrition. Outcome variable: nutritional status. Sample size: n=7 per group. Sampling: random simple. Intervention: MCT formula, naso-gastric infusion, ~140% of daily recommended intake; control group, ad libitum formula by mouth. Evaluation of the nutritional status: Z-scores of anthropometric indicators. Reference patterns: 2006 WHO, Sann. Results: Patients: 8 cases and 7 controls. Ten (66.7%) were females, median age 5 months. Anthropometrics: Length and head circumference z-scores increased negative values in the controls while they were preserved in the enteral group. Arm anthropometrics showed significant loss of fat stores in the oral group while they improved in the intervention group; the muscle arm area decreased in the control group while it kept preserved in the intervention group. The frequency of respiratory infections, diarrhea and abdominal distension was higher in the intervention group. At the end-point, hemoglobin and ammonia increased in the enteral group; gamma glutamyltransferase, alkaline phosphatase and leukocyte count were higher in the control group. Conclusions: Enteral nutrition preserved linear and head circumference growth and arm muscle area besides increasing fat stores. The main adverse effect of the nutritional intervention was respiratory infection. 2 INTRODUCCIÓN El hígado juega un papel central en la fisiología del organismo. Participa en funciones de digestión, absorción, metabolismo intermedio relacionado a la producción y almacenamiento de energía, almacén de micronutrimentos, regulación de diferentes funciones a través de hormonas, síntesis de una gran cantidad de moléculas que se utilizan en órganos distantes; transformación inactivación, detoxificación y excreción de diversas sustancias y producción de eritrocitos fetales en las etapas iniciales del embarazo entre otras. En este contexto, es posible entender las evidentes manifestaciones clínicas y las alteraciones en el crecimiento y en el estado de nutrición de los niños con enfermedades del hígado, particularmente en los primeros meses de vida en que la afectación de una o varias de las funciones mencionadas interfiere con el organismo en el período de crecimiento más acelerado de la vida intrauterina y en el cual se presentan cambios en el desarrollo psicomotor como en ninguna otra etapa pediátrica (1-4). Existe una estrecha relación entre la función hepática, el crecimiento y el estado nutricio, a tal grado que es posible predecir el comportamiento de indicadores antropométricos que estiman el crecimiento y la composición corporal a partir de algunos indicadores bioquímicos que evalúan cuantitativamente la función hepática, como la bilirrubina conjugada, la albúmina y enzimas como la fosfatasa alcalina y la gama glutamil-transferasa (4). Bajo este supuesto, los niños menores de 18 meses con enfermedades hepáticas asociadas a daño importante de la glándula como la atresia de vías biliares y algunas enfermedades metabólicas, tienen un alto riesgo de presentar desaceleración del crecimiento y desnutrición aguda (4). Se ha observado que en forma paralela al proceso de desnutrición aguda y crónica ocurre desaceleración del incremento de la circunferencia cefálica, lo que en última instancia se considera como secundario a disminución en el crecimiento -aumento en el número de células de un organismo lo que conlleva al aumento de tamaño- del encéfalo, con todo lo que esto pueda implicar para la función neurológica en el mediano y largo plazo (4). La identificación de las alteraciones en el estado nutricio que se presentan en los niños con enfermedades del hígado y los diversos intentos por modificar esta 3 condición, se han llevado a cabo por diversos expertos de la pediatría y la nutrición, particularmente por gastroenterólogos pediatras (2). Tomando esta experiencia como fundamento teórico y sumado a la experiencia de 3 décadas en el diagnóstico y tratamiento de enfermedades del hígado en los dos principales hospitales pediátricos del Instituto Mexicano del Seguro Social en este período, se propone un trabajo de intervención nutricia que pueda modificar la historia natural de estas severas alteraciones del crecimiento y la composición corporal. 4 MARCO TEÓRICO ANTECECEDENTES Enfermedad hepática crónica y desnutrición. Los niños con enfermedad hepática crónica (EHC) tienen una elevada probabilidad de presentar desnutrición proteínico-energética, retraso en el crecimiento lineal y deficiencia de vitaminas liposolubles (1-3). Estos trastornos nutricios se han considerado secundarios a la interacción entre factores como reducción en la ingestión energética y proteínica, malabsorción de grasas y de vitaminas liposolubles, incremento en el gasto energético, alteración en el metabolismo intermedio, alteración hormonal y anemia crónica relacionada con hiperesplenismo e hipertensión portal (4-12). En la EHC existe una indiscutible correlación directa entre la magnitud del daño hepático evaluada por diversas pruebas de funcionamiento hepático o por clasificaciones como la de Malatack y el estado nutricio (3-4,13,14). Las enfermedades hepáticas asociadas a mayor daño hepático se presentan en niños menores de 2 años debido a que en este período se presentan la atresia de vías biliares y la mayor parte de enfermedades metabólicas (2,4,15-17). Cywes realizó en 1990 un estudio en pacientes con atresia de vías biliares y demostró que estos pacientes tienen desaceleración en el crecimiento, además de deficiencia de micronutrimentos y vitaminas. La evaluación antropométrica mostró que todos los pacientes evaluados presentaron peso, talla y circunferencia cefálica por debajo del percentil 3 y deficiencia en los niveles séricos de vitaminas liposolubles y de nutrimentos como zinc y cobre (24). Shepherd en 1991 llevó a cabo un trabajo de evaluación bioquímica y de composición corporal en 37 pacientes con enfermedad hepática crónica con niños de 6 meses a 14 años de edad en lista para trasplante hepático. Observó que durante el tiempo de espera para el trasplante ocurrió deterioro nutricio identificado por medición de la masa celular por medio de potasio corporal total, y puntuación z <-2 DE para la talla; la estimación promedio de la ingestión de energía por vía oral a libre demanda fue 63 ± 5% de la ingestión diaria recomendad para la edad (25). En Italia, Roggero en 1997 realizó un estudio similar al de Shepherd en 49 pacientes con enfermedad hepática crónica a los que se les realizó encuesta de la dieta y evaluación antropométrica; en este trabajo se evidenció la presencia de 5 desnutrición secundaria aguda y crónica con puntuación z <-2DE para el peso, la talla, y las áreas grasa y muscular; sin embargo, la ingestión de energía obtenida de las encuestas fue adecuada para las recomendaciones diarias aunque evidentemente insuficiente para este tipo de pacientes (13 ). Tabla 1. Estudios que identifican desnutrición y otros trastornos nutricios en niños con enfermedad hepática crónica. Autor Sede n Larrosa 1983 (23 ) Hospital de Pediatría 8 Cohorte descriptiva Pacientes con atresia de vías biliares operada manejados con alimentación normal tuvieron desaceleración de la velocidad de crecimiento Cywes 1988 Sudáfrica 11 Transversal descriptivo Percentiles bajos en talla y peso por debajo de la 3, CC menor a la percentil 5 y deficiencia de vitaminas y elementos traza. Denver C 56 Transversal descriptivo Disminución de las puntuaciones Z de los índices T/E, P/T CMB/E Francia 6 Ensayo clínico abierto Incremento en peso y peso como porcentaje del ideal, CC IMC, CMB en el segundo tiempo con diferencias estadísticas cuando se comparan con el primer tiempo. Australia 19 Ensayo Clínico Mejoría y diferencia estadística de peso y talla, incremento en K corporal total, CMB y PCT Requirieron menos aplicaciones de albúmina Australia 37 Transversal descriptivo Italia 75 Trasversal descriptivo Afectación del peso -1.4, talla -2.2, menor área grasa y depleción de masa celular evaluada por potasio corporal total. Y el promedio de energía a libre demanda por vía oral fue de 63% + - 5% de acuerdo a los IDR recomendados. Pacientes con hepatitis B sin datos bioquímicos y antropométricos de desnutrición. Wasserman 1999 (77) USA 13 Casos y controles Afectación de peso talla, CMB y PCT de niños con Síndrome de Alagille al compararse con niños sanos Rabindera 1997 India 33 Casos y controles Pacientes con hipertensión portal con afectación de la talla y disminución de hormona de crecimiento. (24) Sokol 1990 (9) Moreno 1991 (28) Chin 1992 Diseño (27) Shepherd 1991 (25) Vegnete 1992 (8) Resultados En la Unidad Médica de Alta Especialidad Hospital de Pediatría del Centro Médico Nacional de Occidente (HP), en 44.3% de una serie de 79 niños con EHC se identificó al indicador talla para la edad en valores negativos mayores a 2 DE; dos terceras partes de estos niños eran menores a 5 años de edad (4). Los trabajos que han utilizado indicadores del brazo son escasos y la proporción identificada de casos de desnutrición varía de 48.3 a 65.5% (18,19); en la serie del HP la proporción de casos con el indicador circunferencia media del brazo con valores negativos mayores a -2 DE fue 43%, siendo otra vez los niños 6 menores de 5 años los más afectados. Las publicaciones que identifican la proporción de casos con alteraciones en el estado nutricio por diversos indicadores se presentan en la Tabla 1. En un estudio multicéntrico realizado por el Consorcio de Investigación en Atresia de vías Biliares se analizaron de manera retrospectiva 100 pacientes con diagnóstico de atresia de vías biliares (AVB) en 9 centros de referencia de 1997 a 2000 con el fin de de establecer la historia natural de la falla del crecimiento y el efecto del trasplante hepático. La realización del trasplante hepático (TH) después de los 24 meses de edad se identificó como variable de mal pronóstico y el realizado antes de este tiempo y con cifras de bilirrubina < 6mg/dL se consideraron de buen pronóstico. El retraso en el crecimiento se asoció con trasplante después de los 24 meses o muerte. La puntuación z del peso para la talla en valores bajos en los 3 primeros meses de evolución post-TH fue una variable de mal pronóstico (20). Ensayos clínicos de tratamiento nutricio en niños con enfermedad hepática crónica. La EHC, junto con otras entidades patológicas entre los que se incluyen las cardiopatías, las enfermedades renales, la uropatía obstructiva y los síndromes con afección al sistema nervioso central, en particular parálisis cerebral infantil, se asocian con una elevada frecuencia a desnutrición (21). En el Servicio de Gastroenterología Pediátrica y Nutrición del HP, las EHC corresponden a la entidad asociada con mayor frecuencia a desnutrición grave (22). Esta asociación -conocida desde hace más de 3 décadas- ha dado lugar a diferentes intentos de intervención para mejorar el estado nutricio y prevenir la desnutrición en pacientes pediátricos con EHC. Aunque el consenso de los gastroenterólogos pediatras, los cirujanos pediatras y los grupos dedicados a TH en niños es que la intervención nutricia puede mejorar el estado nutricio y que este influye en el pronóstico de estos pacientes -particularmente cuando son sometidos a TH- los ensayos clínicos realizados en este terreno son escasos y la mayor parte de ellos son ensayos clínicos abiertos sin un grupo control. En un estudio realizado en el Hospital de Pediatría en la década de los 90s, el manejo de lactantes con atresia de vías biliares con nutrición enteral utilizando una fórmula de hidrolizados de proteínas con triglicéridos de cadena media, aparentemente permitió disminuir la magnitud de la afectación de la talla; sin 7 embargo, este trabajo fue un ensayo clínico abierto y el grupo de comparación fue una serie histórica estudiada los 3 años previos al ensayo (23) (Figura 1). Puntaje Z (tala/edad) 4 2 0 -2 -4 -6 0 3 6 9 12 15 18 21 24 Control 0.3 -1.6 -2.8 -3.1 -2.7 -2.3 -2.1 -2 -1.9 N Enteral 0.4 -0.9 -0.8 -0.2 0.4 0.8 0.85 Edad (meses) Figura 1. Puntuación z de la talla para la edad en 10 lactantes con atresia de vías biliares manejados con fórmula láctea a libre demanda (control histórico) y de 9 pacientes manejados con una fórmula de hidrolizados de proteína y triglicéridos de cadena media por sonda naso-gástrica en infusión continua. Se han realizado ensayos clínicos en lactantes con AVB con el propósito de incrementar el aporte de energía y de otros nutrimentos en un intento por modificar la historia natural de la desaceleración del crecimiento y el deterioro en las reservas de grasa y masa magra, particularmente ante la alternativa de trasplante hepático. Chin y colaboradores en un ensayo clínico abierto con pacientes en espera de trasplante hepático en el que un grupo recibió alimentación enteral y otro alimentación oral a libre demanda demostró que en los pacientes que recibieron alimentación enteral no existió desaceleración en el peso y talla evaluado por puntuación Z en relación a mayor aporte de energía en comparación con el grupo de vía oral que presentó desaceleración en la velocidad de incremento del peso y la talla y menor ingestión de energía (26). Dos años después el mismo autor realizó otro estudio con 19 pacientes con (EHC) en donde se les ofreció alimentación enteral a dos grupos de pacientes con el propósito de evaluar dos tipos de fórmula una semi-elemental estándar y otra adicionada con aminoácidos de cadena ramificada; observó que con esta última fórmula la eficacia fue mayor en los indicadores antropométricos evaluados al compararlos con el grupo que 8 recibió fórmula semi-elemental estándar (27). En Francia en el hospital pediátrico de Lille, Moreno y colaboradores realizaron otro estudio en 6 pacientes con colestasis y daño hepático importante, en el cual se evalúo el estado nutricio por antropometría y antes y después de un ciclo de alimentación enteral nocturna por 8 a 10 horas, con lo que se consiguió mejoría de los indicadores antropométricos; en este trabajo se aportó de 180 a 200 % de las recomendaciones diarias recomendadas (28). Charlton en 1992 evaluó indicadores antropométricos como peso, pliegue cutáneo tricipital, circunferencia media del brazo, área muscular y determinación de amonio y aminograma en 10 pacientes con cirrosis. Posteriormente estos pacientes recibieron un ciclo de alimentación enteral por 8 semanas con lo que se observó mejoría en los indicadores antropométricos comparados con los valores previos que se obtuvieron antes de la intervención nutricia. Se observó discreto incremento en el amonio plasmático, aunque no existió la misma tendencia con los aminoácidos plasmáticos; estos hallazgos no tuvieron trascendencia clínica ya que ninguno de los pacientes desarrollo encefalopatía (29). Los ensayos clínicos en los cuales se ha evaluado la intervención nutricia en niños con EHC a partir de 1990, se resumen en la Tabla 2. 9 Tabla 2. Ensayos clínicos de intervención nutricia en niños con enfermedad hepática crónica. Autor Roggero P,et al (13) Sede n Diseño Objetivo Resultados Dept of 49 Pediatrics, University Medical School of Milan, Italy. Institute of Child 10 Health, University Cirrosis of Birmingham. avanzada 4-8 semanas Transversal analítico Antropometría en Diferencias significativas niños con EHC en puntuación z en talla, área lista de espera para muscular y grasas. IDR ⇓ TH Ensayo clínico abierto Chin SE, et al. (27) Queensland Liver Transplant Service, Royal Children's Hospital, Brisbane, Australia. Ensayo clínico Evaluación pre y post intervención con NE Indicadores antropométricos peso, talla y brazo, amonio y aminograma Evaluar eficacia de las formulas Moreno LA, et al. (28) Service de 6 Pédiatrie, Hôpital Alimentación Huriez, CHU de VO y Lille, France alimentación a enteral nocturna 180 a 200 % por IDR Queensland Liver 37 Transplant En lista de Programme, espera TH Royal Children's Hospital, Brisbane, Queensland, Australia. Charlton CP, et al (29) Shepherd RW , et al. (25) Cywes C, et al. (24) Chin SE, et al (26) 19 en espera de TH N Enteral Fórmula con aa de cadena ramificada fórmula estándar Todos los indicadores antropométricos mejoraron de manera significativa y ningún paciente desarrollo encefalopatía. Mejoría y diferencia estadística de peso y talla, incremento en K corporal total, CMB y PCT Requirieron menos aplicaciones de albúmina, Ensayo clínico abierto Evaluar los cambios Incremento en peso y peso en los dos tiempos como porcentaje del ideal, del estudio CC IMC, CMB en el segundo tiempo con diferencias estadísticas cuando se comparan con el primer tiempo. Transversal Evaluación clínica Existió afectación del peso analítico bioquímica y 1.4 , talla -2.2, menor área composición grasa y depleción de masa corporal antes del celular evaluada por potasio trasplante y su corporal total. Y el promedio evolución de energía ad libitum por vía oral fue de 63% + - 5% de acuerdo a los IDR para la edad Nutrition 11 Longitudinal Antropometría Percentiles bajos en talla y Research 1.5 meses a 7 analítico Peso, talla CC y peso por debajo de la 3, CC Project, años medición de menor a la percentil 5 y University of Vitaminas AED y deficiencia de vitaminas y Stellenbosch elementos traza elementos traza. cobre y zinc Department of 28 Ensayo Evaluar las NE: Mantuvieron puntuación Gastroenterology En espera de clínico diferencias en Z peso y talla no así los de and Nutrition, TH Duración 90 ambos grupos VO los cuales declinaron Royal Children's Enteral vs. oral días demostradas por puntuaciones Z de manera Hospital, cantidad de energía significativa. Brisbane, ingerida y Energía NE de 120 a 150% Australia. evaluación de acuerdo a IDR y VO 58 antropométrica a 100% 10 FUNDAMENTACIÓN DE LA TEORÍA Y MÉTODOS Atresia de vías biliares. Concepto y epidemiología. La AVB es la causa más frecuente de enfermedad hepática crónica, cirrosis y trasplante de hígado en niños. Ocurre en 1 caso entre cada 5000 a 18,000 nacimientos. Se caracteriza por ictericia persistente y colestasis progresiva que aparece en las primeras semanas después del nacimiento, lo cual se debe a una obstrucción fibro-obliterativa de los conductos biliares intra-hepáticos y extra-hepáticos (30,31). Es la primera causa de colestasis crónica y es la primera indicación de trasplante hepático en el ámbito global. Fisiopatogenia. La AVB es el resultado de una obstrucción inflamatoria y fibrosa de los conductos biliares intra y extra-hepáticos en los primeros meses de la vida. Su etiología es desconocida; una teoría vigente es la ocurrencia de una infección viral hepatobiliar primaria y secundariamente la generación de un proceso autoinmune que ocasiona el daño a los ductos biliares. Hay estudios en humanos y en animales de experimentación que apoyan a la infección colangiotrópica como gatillo iniciador del daño en los ductos biliares y de la repuesta de adaptación inmunológica y fenómenos auto-inmunes que ocurren en la progresión de la enfermedad (32). Se han identificado factores de riesgo para desarrollar AVB que incluyen hijos de madres hispánicas negras al ser comparadas con madres hispánicas blancas, niños concebidos en primavera vs. los concebidos en el invierno, baja ingestión de micronutrimentos como vitamina E, cobre, fósforo, vitamina D y hierro. Se ha sugerido que la ocurrencia estacional se podría relacionar a la presencia estacional de agentes infecciosos (33). La mutación CFC1 heterocigoto puede representar una predisposición genética al síndrome de poliesplenia en niños con AVB (34). La patogénesis de esta enfermedad es desconocida, recientemente en estudios de experimentación en animales se ha visto la interacción de agentes infecciosos y circuitos o vías de inflamación que pueden ser mecanismos patogénicos de la enfermedad (31). Diagnóstico. Los trabajos de mayor trascendencia y actualidad que constituyen el estado del arte respecto al diagnóstico de la AVB se presentan en la Tabla 3. El grupo de entidades nosológicas que conforman la EHC en los lactantes es 11 heterogéneo y su comportamiento clínico es similar, por lo que un enfoque razonable es considerarlas inicialmente como un síndrome; estos pacientes tienen en común la presencia de colestasis, por lo que puede denominarse como síndrome de ictericia colestásica del lactante el que se integra por ictericia con incremento bilirrubina directa en el suero, coluria, en ocasiones acolia, hepatomegalia, esplenomegalia y en algunos casos manifestaciones de hipertensión portal en forma de sangrado del tubo digestivo alto por várices esofágicas, ascitis y red venosa colateral. El comportamiento clínico en las etapas tempranas de estas entidades es tan similar, que en la mayor parte de los casos es imposible establecer alguna sospecha clínica en el primer contacto. Debido al gran número de entidades nosológicas con las que se tiene que establecer el diagnóstico diferencial del lactante con EHC y colestasis, se requiere un protocolo sistemático que identifique los problemas en orden de gravedad y frecuencia. Dado que la atresia de vías biliares es el diagnóstico que ocupa el primer lugar en frecuencia en lactantes con síndrome de ictericia colestásica y a la vez la causa más importante de daño hepático grave y temprano considerando a todas las edades pediátricas, el protocolo propuesto se dirige a descartar esta entidad. El diagnóstico definitivo de AVB es de anatomía macroscópica y lo establece el cirujano en el momento de realizar una laparoscopia o laparotomía exploradora o el patólogo en el estudio post-mortem. Los estudios que se realizan para la identificación de la AVB establecen la sospecha de la misma e indican la exploración quirúrgica (laparoscópica o abierta) del hilio hepático. Estos estudios histológicos o de gabinete tienen una sensibilidad que suele ser mayor a 90% y la preferencia para su empleo parece depender de la experiencia de cada equipo clínico-quirúrgico con un procedimiento específico. Las pruebas que miden la excreción de la bilis hacia el duodeno son el gamagrama radioisotópico con IDA marcado con Tc99 y la prueba de la sonda duodenal (35-37). La evaluación morfológica de las vías biliares y la disminución de su calibre puede evaluarse por estudios de imagen particularmente con el ultrasonido; existe alguna experiencia con la colangiografía endoscópica retrógrada pero es un procedimiento poco utilizado por sus dificultades técnicas y por el requerimiento de equipo especial que suele ser poco accesible (38-41). La experiencia con tecnología de punta –resonancia magnética- de empleo reciente en este tipo de 12 pacientes se encuentra en fase de aprendizaje aunque probablemente constituya una herramienta diagnóstica eficaz en el futuro inmediato (42,43). Algunos grupos pediátricos utilizan a la biopsia hepática percutánea o laparoscópica para establecer el diagnóstico de AVB; la eficacia de este procedimiento depende de la habilidad del patólogo por una parte y del momento evolutivo de la entidad en que se realice, ya que en etapas tempranas puede ser indistinguible de otras causas de colestasis y etiquetarse como “hepatitis neonatal” (44-48). Tabla 3. Sensibilidad y especificidad de métodos de diagnóstico de la atresia de vías biliares. Autor y estudio Diseño n Sensibilidad Especificidad Humphrey TM, et al. (38) (Ultrasonido) Estudio de prueba diagnóstica 90 Cordón triangular 100% Pared anormal de vesícula 95% Ausencia del conducto biliar 92% La AVB puede distinguirse de otras causas de ictericia colestásica por Eco en el 98% de los pacientes Larrosa-Haro A, et al (35) (Sonda en duodeno) Meisheri IV, et al (36) (Sonda en duodeno) Esmaili J, et al. (37) (Centellograma) Norton KI, et al (39). (Colangiografía) Transversal analítico 254 Cordón triangular 73% Pared anormal de vesícula 91% Ausencia del conducto biliar 93% 97.3% Transversal analítico 30 96.1% 92.5% Transversal analítico 46 90% 80% Transversal 26 90% 77% 93.7 Tratamiento. La AVB es una enfermedad cuya historia natural es la rápida progresión y muerte por falla hepática alrededor de los 18 meses de edad. Las únicas opciones de modificar esta historia natural son la porto-enteroanastomosis y el trasplante hepático. En la primera al restablecerse el flujo biliar pueden revertirse los mecanismos de daño al hígado y alargarse la sobrevida por años a décadas; los factores que determinan su eficacia son la edad en la que se realiza la cirugía, la experiencia del centro, la coexistencia de anormalidades congénitas, y la presencia de eventos de colangitis posteriores a la cirugía. El TH es una segunda alternativa de modificar la historia natural de 13 estos niños pero con lleva todas las desventajas y co-morbilidades de un procedimiento de esta naturaleza (30,49-51). El tratamiento médico es un coadyuvante del tratamiento quirúrgico y se puede dividir en: a) soporte nutricio en forma de suplementos o alimentación enteral en un intento para restituir las deficiencias nutrimentales que ocurren como consecuencia de la producción disminuida de bilis y de sales biliares que condicionan malabsorción de grasas de vitaminas liposolubles, b) fármacos para modificar los fenómenos inflamatorios que ocurren en el hígado y en las vías biliares, particularmente en las primeras semanas de evolución de la enfermedad, y c) intervenciones farmacológicas o endoscopicas dirigidas al manejo de complicaciones como infecciones –particularmente colangitis- , ascitis y sangrado del tubo digestivo por várices esofágicas.(52-55) Los principales trabajos publicados que actualiza y resumen el estado del arte en el tratamiento de la AVB se presentan en la Tabla 4. Tabla 4. Eficacia de las diversas opciones terapéuticas empleadas en niños con atresia de vías biliares. Autor Diseño n Resultados No hay consenso en el drenaje posterior a la porto-enteroanastomosis, la aplicación de esteroides el uso e antibióticos profilácticos y en el tratamiento de de la colangitis. La dosis promedio de esteroide fue de 1.31±0.8/kg/día. Existió correlación entre la dosis promedio de esteroide y el período de ictericia p=0.021. La conclusión fue que altas dosis de esteroides pueden acortar el periodo de ictericia en los pacientes con AVB que se les realizó porto-enteroanastomosis Los esteroides pueden ser de beneficio en disminuir los niveles de bilirrubina cuando la cirugía se realiza antes de los 70 días de vida y no disminuyen la necesidad del trasplante de hígado La laparoscopia puede ser una opción en el manejo quirúrgico de la AVB es una opción segura, factible con baja mortalidad y que se puede comparar con la técnica de cirugía abierta. Opción que requiere destreza. Se requieren más pacientes y estudios. Davenport M, et al .(49) Revision - Shimadera S, et al.(50 ) Serie de casos 23 Davenport M, et al.(51) Ensayo clínico doble ciego Transversal 71 Dutta S, et al. (53) Gupta DK, et al.(54) Serie de casos 10 Kelly DA, et al.(55) Revisión Aspelund G, et al.(52) 9 29 El empleo de células madre en pacientes con cirrosis y meningocele ha demostrado Buenos resultados, sin embargo se requieren ensayos clínicos controlados para establecer conclusiones adecuadas. Se requiere de diagnostico temprano, para facilitar que la cirugía portoenteroanastomosis se requiere de suplementos de vitaminas liposolubles , acido urso-desoxicólico, y tratamiento nutricio El que la cirugía se realice en centros especializados ha incrementado la sobrevida de esta enfermedad hasta un 90% en RU). La mitad de los pacientes de los pacientes que les realizó porto-enteroanastomosis y que tuvieron buen flujo de bilis (80%) de ellos tiene buena calidad de vida y no requieren de trasplante. 14 Tratamiento nutricio en la AVB. El soporte nutricio en forma de suplementos o alimentación enteral es una técnica para restituir las deficiencias nutrimentales que ocurren como consecuencia de la producción disminuida de bilis y de sales biliares que condicionan malabsorción de grasas y de vitaminas liposolubles y de los otros mecanismos de desnutrición secundaria referidos con anterioridad. La absorción de vitaminas liposolubles depende de la concentración adecuada de ácidos y sales biliares. Los pacientes con enfermedad hepática como atresia de vías biliares deberán recibir suplementación para evitar deficiencias (55-57). En la Tabla 5 se presentan los nutrimentos dosis y vía de administración. Tabla 5. Dosis y frecuencia de nutrimentos empleados en pacientes con atresia de vías biliares. Nutrimento Dosis Frecuencia Vitamina A Cada 24 horas Vitamina D 5,000 a 25,000 IU 3 a 10 x recomendación diaria Vía de administración Oral Cada 24 horas Oral Vitamina E 15 a 25 IU /kg Cada 24 horas Oral Vitamina K 2.5 mg Intramuscular Vitamina K Calcio Cada 24 horas Oral Magnesio 5 mg 25 a 100 mg/kg ó 800 a 1200 mg 25 50 mg/kg ó 500 mg 1 a 2 meq/kg Dos veces por semana Cada 24 horas Cada 24 horas Cada 24 horas Oral Zinc Selenio Hierro 10 mg 1 a 2 µg/kg 5 a 6 µg/kg Cada 24 horas Cada 24 horas Cada 24 horas Oral Oral Oral Fósforo Comentarios Presentación hidrosoluble 3 a 5 microgramos kg día como 25 – OHD sí hay raquitismo Presentación hidrosoluble Intramuscular Oral Presentación en Oxido de magnesio Zinc elemental Hierro elemental Fórmulas con triglicéridos de cadena media. Se han diseñado fórmulas que contienen aproximadamente la mitad de sus grasas como triglicéridos de cadena media (TCM) que están constituidos por ácidos grasos de cadenas C8 a C12, que proveen un mejor balance positivo de energía en presencia de colestasis. Los triglicéridos de cadena larga requieren de sales biliares y de formación de micelas para su solubilización. Los TCM son relativamente solubles en agua y 15 se absorben directamente a la circulación portal. Por esta razón los TCM pueden ser utilizados en la dieta en pacientes con colestasis para reducir la esteatorrea, mejorar el balance de energía y favorecer el crecimiento y la recuperación nutricia. Las fórmulas con TCM que se utilizan en pacientes con colestasis contienen aproximadamente de 60 a 50% que los aportan como energía en forma de grasas. Los pacientes que están alimentados en forma exclusiva con leche materna deberán suplementarse con fórmulas de este tipo si el crecimiento no es adecuado (58). En la Tabla 6 se presentan fórmulas infantiles que contienen triglicéridos de cadena media. Tabla 6. Fórmulas infantiles que contienen triglicéridos de cadena media. Nombre comercial Alfaré Pregestimil % de TCM Origen de las grasas 50% 45% Pepti Junior 50% Alimentum 33% Aceite maíz y grasa butírica Aceite vegetal con alto contenido de acido oleico. Acido araquidónico y docohexanóico Aceite de maíz, ácido arquidonico y docoexanoico Aceite de soya y girasol, ácido araquidónico y docohexanóico Fórmulas con aminoácidos de cadena ramificada. La cuantificación de aminoácidos en el plasma en pacientes con colestasis crónica y cirrosis como los pacientes con atresia de vías biliares son anormales, con niveles bajos de aminoácidos de cadena ramificada y elevados de aminoácidos aromáticos. Estos cambios reflejan una cinética anormal de aminoácidos en la que ocurre un incremento de utilización de aminoácidos de cadena ramificada promovida por hiperinsulinemia como substrato alternativo de gluconeogénesis, lo que daña el proceso enzimático de los aminoácidos aromáticos. Esta evidencia apoya el empleo de dietas suplementadas con aminoácidos de cadena ramificada en pacientes con enfermedad hepática. Estas fórmulas solo se utilizan en protocolos de investigación por su alto costo (59-60). Aporte de proteínas y encefalopatía hepática. La postura de que los pacientes con encefalopatía deben manejar proteínas de 0.5 a 1 g/kg/día se ha mantenido por décadas; sin embargo diversos estudios han demostrado que se pueden manejar cantidades mayores que varían de 2 a 4 g/kg/día de proteínas en 16 pacientes con enfermedad hepática grave incluso con hiperamonemia sin provocar encefalopatía ni condicionar progresión del daño hepático. Charlton utilizó alimentación enteral por 8 semanas y 4-5 gramos por kilo/día de proteínas en pacientes pediátricos con cirrosis, sin incremento de los niveles de amonio de manera significativa; en este estudio, tampoco se demostró alteración del aminograma además de que ningún paciente desarrollo encefalopatía durante el tratamiento con nutrición enteral (55). 17 PLANTEAMIENTO DEL PROBLEMA Y JUSTIFICACIÓN Objeto de estudio. Eficacia de una técnica alimentación enteral con una fórmula con triglicéridos de cadena media versus vía oral a libre demanda en la prevención de la desaceleración del crecimiento y el deterioro de el estado nutricio en lactantes con atresia de vías biliares en un periodo de 12 semanas. Magnitud. La AVB es la EHC más frecuente y grave en niños y constituye la principal indicación de TH pediátrico (15-16,30-31). El daño hepático en esta entidad se caracteriza por un proceso inflamatorio que destruye aceleradamente la vía biliar intra y extra-hepática y que desde los primeros meses de evolución se asocia a cirrosis biliar (15-16, 30,32). La historia natural de la AVB conforma un modelo predecible con daño hepático progresivo y muerte entre los 15 a 24 meses de edad por insuficiencia hepática y sangrado del tubo digestivo por hipertensión portal (20). Las opciones terapéuticas para modificar esta historia natural son la cirugía de derivación biliar hacia el intestino (porto-enteroanastomosis) y el trasplante hepático; con estas opciones terapéuticas es posible conseguir una sobrevida de duración y calidad variable dependiendo de factores como el tiempo del diagnóstico y la cirugía, la habilidad del equipo quirúrgico, la variedad de AVB y la magnitud del daño hepático al momento de la intervención (61). Una condición que sin excepción acompaña la evolución de los lactantes con AVB es la desnutrición, manifestada como desaceleración del crecimiento y pérdida de las reservas corporales de grasa y músculo (6,10). La afectación al estado nutricio habitualmente ocurre en los meses subsiguientes a la portoentero-anastomosis, suele ser progresiva y paralela al deterioro hepático, e incluso ocurre en los casos que tienen una respuesta favorable a la cirugía (6063). La etapa de la vida de los niños con AVB en que se presentan estos eventos de desnutrición aguda y crónica probablemente sea determinante en la “programación” final de déficit de condiciones como la circunferencia cefálica, la talla y la composición corporal, que sin duda serán factores determinantes de su calidad de vida (6,9 ,20,23,66-69). Trascendencia y justificación. El abordaje preventivo o terapéutico relacionado a la desnutrición que ocurre en los meses siguientes al diagnóstico de AVB se suele concretar en la administración de fórmula de inicio o fórmula con 18 triglicéridos de cadena media a libre demanda y suplementación de vitaminas liposolubles A, D, E y K. Diversos estudios han demostrado que la ingestión de energía y macronutrimentos en lactantes con AVB es inferior a la ingestión recomendada para su edad y sexo mientras que otros han demostrado que es adecuada de acuerdo a la ingestión diaria recomendada (IDR) para un lactante sano, pero no es suficiente para favorecer el crecimiento y el estado nutricio normales (23-29,56,69). A esta ingestión disminuida se suman condiciones como malabsorción de grasas, de vitaminas liposolubles (1-3), gasto energético incrementado (8,56), alteraciones en el metabolismo intermedio (6-7), desregulación hormonal, anemia crónica originada por hiperesplenismo y sangrado del tubo digestivo micro y/o macroscópico por hipertensión portal (12). Estas complejas condiciones adversas hacen poco probable que la ingestión oral a libre demanda sea suficiente para cubrir los requerimientos energéticos de estos pacientes, que se han estimado en alrededor de 140% de sus requerimientos normales. Al considerar este enfoque, la alimentación enteral ciclada en infusión continua constituye una alternativa para incrementar el aporte de energía, macronutrimentos, vitaminas y nutrimentos inorgánicos con objeto de prevenir o cuando menos disminuir la magnitud y duración de la desnutrición secundaria que ocurre en los meses subsiguientes al diagnóstico de AVB. La trascendencia de demostrar que la nutrición enteral con una fórmula con triglicéridos de cadena media tiene una mayor eficacia que la administración de la misma fórmula por vía oral para prevenir el episodio de desnutrición que habitualmente ocurre en los primeros 4 a 12 meses de vida de estos lactantes, independientemente de su manejo quirúrgico, podría modificar el criterio de intervención nutricia enteral en el sentido de constituirse en un procedimiento preventivo habitual en esta etapa de la vida en niños con AVB. Vulnerabilidad. Desde el punto de vista del problema a vulnerar, esta sería la falta de información consistente respecto a la eficacia preventiva de nutrición enteral preventiva en los primeros meses de la vida en lactantes con AVB. Desde el punto de vista de los aspectos vulnerables de un estudio como el planteado, este sería el relativo pequeño número de casos anual que son evaluados en hospitales de referencia pediátrica, lo que obliga a realizar el diseño de investigación con una muestra pequeña. 19 Pregunta de investigación. ¿Es mayor la eficacia de una técnica de alimentación enteral que la administrada por vía oral a libre demanda con una fórmula con triglicéridos de cadena media en la prevención de la desaceleración del crecimiento y en el deterioro de el estado nutricio corporal en lactantes con atresia de vías de biliares en un período de 12 semanas? 20 HIPÓTESIS Y OBJETIVOS Hipótesis. La eficacia de una técnica de alimentación enteral con una fórmula con triglicéridos de cadena media es mayor que la administrada por vía oral a libre demanda en la prevención de la desaceleración del crecimiento y el deterioro de el estado nutricio en lactantes con atresia de vías de biliares en un período de 12 semanas. Objetivo general. Comprar la eficacia de una técnica de alimentación enteral con una fórmula con triglicéridos de cadena media con alimentación oral a libre demanda en la prevención de la desaceleración del crecimiento y en el deterioro de el estado nutricio en lactantes con atresia de vías de biliares en un período de 12 semanas. Objetivos específicos 1. Evaluar longitudinalmente los indicadores antropométricos talla para la edad, peso para la talla e indicadores directos e indirectos de brazo en lactantes con atresia de vías biliares alimentados con una técnica de alimentación enteral con una fórmula con triglicéridos de cadena media por un período de 12 semanas. 2. Evaluar longitudinalmente los indicadores antropométricos talla para la edad, peso para la talla e indicadores directos e indirectos de brazo en lactantes con atresia de vías biliares alimentados por vía oral a libre demanda con una fórmula con triglicéridos de cadena media por un período de 12 semanas. 3. Comparar los indicadores antropométricos talla para la edad, peso para la talla e indicadores directos e indirectos de brazo entre los lactantes manejados con alimentación enteral y con alimentación oral a libre demanda. 4. Comparar los valores de los indicadores antropométricos obtenidos en cada uno de los tiempos de evaluación dentro de cada grupo de estudio. 5. Comparar los valores hematológicos, de las pruebas de funcionamiento hepático y de la química sanguínea entre y dentro de los grupos de estudio al inicio y al final del ensayo. 21 MATERIAL Y MÉTODOS Diseño del estudio. Ensayo clínico controlado, aleatorizado, no cegado. El grupo de intervención se conformó con pacientes manejados con una técnica de alimentación enteral y el grupo control por los manejados con alimentación oral a libre demanda. La variable de desenlace fue el estado nutricio evaluado por los diferentes indicadores antropométricos. El estudio no tuvo cegamiento ya que tanto los pacientes como sus familiares y los investigadores conocieron la técnica de alimentación seleccionada aleatoriamente. Universo. El universo estuvo conformado por los pacientes atendidos en la Clínica de Hígado del HP. Unidad de observación. Lactantes con diagnóstico de AVB atendidos en el Servicio de Gastroenterología del HP de marzo 2007 a marzo 2009. Criterios de inclusión 1. Pacientes con diagnóstico de AVB. 2. Edad de 2 a 9 meses. 3. Uno u otro sexo. 4. Con o sin porto-entero-anastomosis 5. Consentimiento por los padres o tutores. Criterios de no inclusión 1. Enfermedades graves asociadas (malformaciones congénitas patología del SNC, cardiopatía, neumopatía aguda o crónica, genopatía). 2. Peso al nacimiento < 2500g. 3. Sangrado de tubo digestivo 4. Insuficiencia hepática Criterios de exclusión 1. Decisión de los padres de retirar al paciente del estudio Tamaño de la muestra. Para el cálculo del tamaño muestral se utilizaron datos de 2 ensayos clínicos abiertos realizados en el HP lactantes con AVB (23,70). En el primer estudio un grupo de pacientes se manejó con nutrición enteral (grupo A) y las variables antropométricas de desenlace se compararon con las de grupo histórico de niños manejados con alimentación oral a libre demanda (grupo B) ambos evaluados periódicamente con antropometría. En el segundo se estudió a 22 un grupo de lactantes con AVB candidatos a trasplante hepático que fueron manejados con nutrición enteral por varios meses (23,70). Al considerar el puntaje z de la circunferencia media del brazo a las 16 semanas, la mediana en el grupo manejado con alimentación enteral fue -0.43 y en el grupo alimentado por vía oral a libre demanda -1.61; la diferencia de estos valores fue –1.19, lo que se consideró el valor δ. La desviación estándar de las medias de estos dos grupos fueron 0.77 y 0.45. Con los valores anteriores se consideró un nivel de significancia α <0.05 (Zα 1.96), β=0.8 con poder de Z1-β=-0.842 y el cálculo del tamaño muestral se realizó con una fórmula para ensayos clínicos Jeyaseelan, 1989 (70). La n obtenida fue de 6.5 por grupo. El desglose del cálculo se presenta en el Anexo 1. Muestreo. La muestra fue de casos consecutivos y se obtuvo de los pacientes con diagnóstico de atresia de vías biliares de la clínica de hígado del HP. La asignación a los grupos de alimentación oral a libre demanda (grupo A) y de alimentación enteral (grupo B), se realizó mediante una tabla de números aleatorios (71). La secuencia de asignación a ambos grupos se presenta en la Tabla 7. Tabla 7. Distribución aleatoria de la asignación a los grupos A (alimentación enteral) y grupo B (alimentación oral a libre demanda) Grupo de estudio Secuencia aleatoria A 2, 3, 5, 6, 8, 10, 15, 17, 19, 20. B 1, 4, 7, 9, 11, 12, 13, 4, 16, 18 Variables. 1. Dependiente. Estado nutricio evaluado por antropometría. a) Talla para la edad. b) Peso para la talla. c) Indicadores directos del brazo: Circunferencia media del brazo para la edad. Pliegue cutáneo tricipital para la edad. d) Indicadores indirectos del brazo: Área total del brazo para la edad Área muscular del brazo para la edad 23 Área grasa del brazo para la edad Índice grasa del brazo 2. Independiente. Tipo de alimentación. a) Alimentación enteral. b) Alimentación oral a libre demanda vía oral. 3. Variables sociodemográficas. El grupo de variables sociodemográficas que se incluyeron en el presente trabajo para describir a la población de estudio se presenta en la Tabla 8. La mayoría de ellas se consideraron como variables descriptivas y no como co-variables. Su operacionalización se presenta en el Anexo 2. Tabla 8. Variables socio-demográficas -Edad -Edad de los padres -No. de miembros de la familia -Grupo etario -Escolaridad de los padres -No. de hijos -Sexo o género -Ocupación de los padres -Estado civil -Estado civil -Tipo de familia -Ingreso familiar mensual 4. Variables clínicas. La evaluación de las variables clínicas al inicio del estudio se realizó con el objeto de comparar inicialmente los grupos de estudio para certificar la aleatoriedad de la asignación de los grupos de estudio. Las variables clínicas evaluadas fueron: ictericia, hepatomegalia, esplenomegalia, ascitis, red venosa, palmas hepáticas, telangectasias, varices esofágicas, biopsia hepática y calificación PELD (pediatric endsatage liver disease ). La operacionalización de estas variables se presenta en Anexo 3. 5. Variables bioquímicas. El grupo de variables bioquímicas que se incluyó en el presente trabajo fue con objeto de comparar inicialmente los grupos de estudio para certificar la aleatoriedad de la asignación de los grupos y para evaluar la seguridad de la intervención, al compararlas dentro y entre los grupos al inicio y al final del estudio. Las variables bioquímicas evaluadas fueron en los dominios de biometría hemática, reactantes de inflamación, 24 química sanguínea y pruebas de función hepática. La operacionalización de estas variables se presenta en el Anexo 3. Definición de variables a) Alimentación enteral Conceptual: Técnica de soporte nutricio que consistió en administrar los nutrientes directamente en el tracto gastrointestinal mediante una sonda. Operacional: Alimentación enteral. Tipo de variable: Cualitativa nominal. Indicadores de la medición: 1= Alimentación enteral. 0= Alimentación por vía oral a libre demanda. b) Alimentación por vía oral a libre demanda Conceptual: Fórmulas para lactantes y alimentos que se ingieren por la boca, que se administran de acuerdo a los criterios vigentes de alimentación para lactantes en cuanto a tipo de alimento, horario y a cantidad que espontáneamente ingiere el lactante.1 Operacional: Alimentación por vía oral a libre demanda. Tipo de variable: Cualitativa nominal. Indicadores de la medición: 1= Alimentación enteral. 0= Alimentación por vía oral a libre demanda. c) Talla para la edad Definición conceptual: Indicador antropométrico obtenido de la medición de la longitud y del cálculo de la puntuación z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. Definición operacional: Puntuación z como variable cuantitativa y clasificación de la OMS (Organización Mundial de la Salud) como variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y > + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. 1 0 a 6 meses: Leche materna o fórmula. 6 a 12 meses: Fórmula + frutas + verduras +carnes 25 d) Peso para la talla Definición conceptual: Indicador antropométrico obtenido de la medición del peso y del cálculo de la puntuación z con la utilización de un patrón de referencia. Definición operacional: Puntuación z como variable cuantitativa y clasificación de la OMS como variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. e) Circunferencia cefálica para la edad Definición conceptual: Indicador antropométrico obtenido de la medición de la circunferencia cefálica y del cálculo de la puntuación z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. Definición operacional: Puntuación z como variable cuantitativa y clasificación de la OMS como variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. f) Circunferencia media del brazo para la edad Definición conceptual: Indicador antropométrico obtenido de la medición de la circunferencia media del brazo y del cálculo de la puntuación z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. Definición operacional: Puntuación z como variable cuantitativa y se va considerar < -2 DE afectación moderada del estado nutrición afectación grave del estado nutricio <-3 DE de esta manera será variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. f) Pliegue cutáneo tricipital para la edad 26 Definición conceptual: Indicador antropométrico obtenido de la medición del pliegue cutáneo tricipital y del cálculo de la puntuación z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. Definición operacional: Puntuación z como variable cuantitativa y se va considerar < -2 DE afectación moderada del estado nutrición afectación grave del estado nutricio <-3 DE de esta manera será variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. g) Área total del brazo para la edad Definición conceptual: Indicador antropométrico obtenido de la medición de la circunferencia media del brazo elevada al cuadrado y multiplicada por una constante (4) x π (3.1416) y del cálculo de la puntuación Z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. Definición operacional: Puntuación z como variable cuantitativa y se va considerar < -2 DE afectación moderada del estado nutrición afectación grave del estado nutricio <-3 DE de esta manera será variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. h) Área muscular del brazo para la edad Definición conceptual: Indicador antropométrico obtenido de la medición de la circunferencia media del brazo menos el pliegue cutáneo tricipital multiplicado por π (3.1416) el resultado se eleva al cuadrado y se divide entre el resultado obtenido de multiplicar la constate (4) x π (3.1416) y del cálculo de la puntuación Z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. 27 Definición operacional: Puntuación z como variable cuantitativa y se va considerar < -2 DE afectación moderada del estado nutrición afectación grave del estado nutricio <-3 DE de esta manera será variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. i) Área grasa del brazo para la edad Definición conceptual: Indicador antropométrico obtenido de la medición del área total del brazo menos el área muscular del brazo y del cálculo de la puntuación Z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. Definición operacional: Puntuación z como variable cuantitativa y se va considerar < -2 DE afectación moderada del estado nutrición afectación grave del estado nutricio <-3 DE de esta manera será variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. j) Índice grasa del brazo Definición conceptual: Indicador antropométrico obtenido de la medición del área grasa del brazo dividido entre el área total del brazo multiplicado por 100 y del cálculo de la puntuación Z con la utilización de un patrón de referencia de acuerdo a la edad y al sexo. Definición operacional: Puntuación z como variable cuantitativa y se va considerar < -2 DE afectación moderada del estado nutrición afectación grave del estado nutricio <-3 DE de esta manera será variable cualitativa. Tipo de variable: Cuantitativa continua y cualitativa ordinal. 28 Escala de medición: puntuación z. Indicadores de la medición: Estado nutricio normal: a entre -2DE y + 2DE. Desnutrición: z < -2.1 DE. Desnutrición moderada: z < -2.1 a -3 DE. Desnutrición grave: z < -3.1 DE. k) Eficacia. Para fines del presente trabajo se consideró la eficacia de la intervención nutricia con los siguientes criterios: En las comparaciones dentro de los grupos, se consideró eficacia a la no diferencia estadística entre las mediciones o a la diferencia estadística con incremento de valores positivos de la puntuación z con respecto a la medición basal; se consideró que la intervención no fue eficaz cuando hubo incremento de los valores negativos de la puntuación z con respecto a la medición basal con diferencia estadística. En las comparaciones entre los grupos se considero que la intervención nutricia fue eficaz cuando se incrementaron los valores negativos de la puntuación z del grupo control o cuando disminuyeron los valores negativos de la puntuación z en el grupo de intervención en relación al grupo de intervención. l) Seguridad. La evaluación de la seguridad relacionada a efectos indeseables de la variable de intervención en sus dos modalidades oral y enteral, se realizó a través de la pesquisa longitudinal de manifestaciones clínicas relacionadas a los aparatos digestivo y respiratorio, así como de variables hematológicas y bioquímicas relacionadas a evaluación de la función renal, hepática, hematopoyética y concentración sérica de glucosa. 29 Diagrama CONSORT. La información facilitada en las publicaciones de ensayos clínicos suele ser insuficiente o inexacta y ciertos problemas metodológicos se asocian a estimaciones exageradas del efecto de las intervenciones de estos diseños. Para mejorar la calidad de la comunicación de los (Consolidated Standards of Reporting Trials), una guía de 22 puntos y un diagrama de flujo, que pueden utilizar autores, editores, revisores y lectores. Tras su publicación en 1996, diversas revistas y grupos editoriales adoptaron la guía CONSORT. En 1999 se elaboró una segunda versión revisada que se publicó en 2001. Se presenta un diagrama CONSORT relacionado al presente ensayo clínico: Evaluación de elegibilidad: (pacientes con AVB) Excluidos Aleatorizados 14 Vía enteral Vía oral Asignados 7 Asignados 7 Analizados Analizados Excluidos Excluidos 30 Estudios piloto, validez y confiabilidad de los instrumentos de evaluación Estandarización antropométrica. Se realizó un estandarización antropométrica para medición de la talla, el peso, la circunferencia media de brazo y el pliegue cutáneo tricipital con el autor como estándar de oro y 3 colaboradoras, hasta conseguir una correlación de Pearson superior a 0.85 en mediciones interobservador e intra-observador (Figuras 2,3). Peso Sujeto A vs. estándar de oro Validez (r= 0.9) Peso engramos 3 estándar de oro Peso Sujeto A vs. sujeto A Consistencia (r= 0.9) Linear Regression Peso en gramos 3 estándar de oro = -48.59 + 1.00 * Peso1Kary R-Square = 1.00 35000 Linear Regression Peso en gramos 2 = -65.94 + 1.00 * Peso1Kary R-Square = 1.00 35000 n= 9 30000 25000 Peso en gramos 2 30000 25000 20000 20000 20000 25000 30000 35000 20000 Peso e n gra mos 1 25000 30000 35000 Peso e n gra mos 1 Fgura 2. Estandarización antropométrica de la medición del peso en 9 lactantes. Correlaciones intra e inter-grupo por medio de correlación de Pearson, Peso Sujeto A vs. estándar de oro Validez (r= 0.9) Peso engramos 3 estándar de oro Peso Sujeto A vs. sujeto A Consistencia (r= 0.9) Linear Regression Peso en gramos 3 estándar de oro = -48.59 + 1.00 * Peso1Kary R-Square = 1.00 35000 30000 25000 20000 Peso en gramos 2 n= 9 25000 20000 35000 30000 Linear Regression Peso en gramos 2 = -65.94 + 1.00 * Peso1Kary R-Square = 1.00 20000 25000 30000 Peso e n gra mos 1 35000 20000 25000 30000 35000 Peso e n gra mos 1 Figura 3. Estandarización antropométrica de la medición de longitud en 9 lactantes. Correlaciones intra e inter-grupo por medio de correlación de Pearson. 31 Técnicas y procedimientos Estandarización del método antropométrico. Previamente al inicio del estudio se realizó un procedimiento piloto de estandarización de las técnicas antropométricas para obtener la consistencia o habilidad para conseguir mediciones similares del mismo operador, correlación intra-individuo, y validez o habilidad para conseguir mediciones similares a las de un control de referencia considerando como “estándar de oro”, correlación inter-grupo. Con los datos obtenidos se realizó correlación de Pearson, cuando la “r” se encontró por arriba de 0.8 se consideró satisfactoria y cuando el valor fue menor a esta cifra se procedió a revisar la técnica y a repetir las mediciones antropométricas. Reclutamiento de pacientes. A todos los pacientes con diagnóstico de atresia de vías biliares que fueron atendidos en el Servicio de Gastroenterología y Nutrición en el período de estudio y que llenaron los criterios de inclusión se les invitó a participar en el estudio, previa explicación del objetivo del trabajo y de los procedimientos a realizar. Cuando aceptaron participar en el estudio se solicitó la firma de la carta consentimiento informado. Selección aleatoria de los grupos de estudio. La asignación al grupo A (alimentación enteral) y B (alimentación oral a libre demanda) se realizó en base a la secuencia referida en la sección de muestreo (Tabla 8) de acuerdo al número progresivo de atención en la consulta externa o en la sala de hospitalización. Alimentación enteral. El procedimiento de alimentación enteral se realizó por medio de una sonda naso-gástrica de silastic 8 French en infusión continua, con una fórmula de hidrolizados de proteínas con triglicéridos de cadena media. El contenido de energía, macronutrimentos, vitaminas y nutrimentos inorgánicos de la fórmula referida se presenta en el Anexo 4. La técnica de administración fue de infusión continua ciclada por 18 horas diarias (de 6 AM a 24 PM), con 6 horas de descanso (de las 24 PM a 6 AM). La infusión se reguló por medio de una bomba de infusión enteral. El aporte de energía se calculó como % de los requerimientos normales para el peso para la edad a partir del momento de ingreso al estudio y se presenta en la Tabla 9. Los requerimientos de energía fueron calculados de acuerdo al Criterio del Comité de Expertos de la FAO/OMS/UNU 2004 y se presentan en la Tabla 10 (72). 32 Tabla 9. Aporte de energía como % de los requerimientos ideales por kilogramo (kg) de peso corporal de acuerdo a la edad. Día 1 2 3 4 % de aporte de energía 80 90 100 110 Día 5 6 7 % de aporte de energía 120 130 140 El aporte de proteínas se ajustó de 4 a 5 g/kg de peso real; este ajuste por medio de un incremento gradual de la cantidad de fórmula hasta alcanzar 4 a 5 g/kg de proteínas y a partir de este momento con incremento de la densidad calórica por medio de energía no proteica con aceite de maíz y miel de maíz en relación 1:2. Tabla 10. Requerimientos de energía en niños de ambos sexos alimentados con seno materno, fórmula o con alimentación mixta los primeros 12 meses de vida. (kcal = kilocalorias) Niños Edad (meses) kcal/día kcal/kg/día Edad (meses) Kcal/día kcal/kg/día 0-1 1-2 2-3 3-4 4-5 5-6 518 570 596 569 608 639 113 104 95 82 81 81 6-7 7-8 8-9 9-10 10-11 11-12 653 680 702 731 752 775 79 79 79 80 80 81 Niñas| Edad ( meses) kcal/día kcal/kg/día Edad (meses) kcal/día kcal/kg/día 0-1 1-2 2-3 3-4 4-5 5-6 464 517 550 537 571 599 107 101 94 84 57 82 6-7 7-8 8-9 9-10 10-11 11-12 604 629 652 676 694 712 78 78 78 79 79 79 Cuando el paciente alcanzaba los 6 meses de edad se ofrecieron alimentos complementarios a partir de los 6 meses con fruta (1 porción/día) de 6 a 7 meses, fruta + verdura (1 porción de cada una) de los 7 a los 8 meses y fruta + verdura + carne blanca (pollo) y cereales (una porción de cada uno) de los 8 a 33 los 9 meses igual que el anterior agregando carnes rojas (res) y leguminosas una porción, 10 a 12 meses ampliar variedad de grupos de alimentos e integrarlo gradualmente a dieta familiar (73). El paciente permaneció hospitalizado de 3 a 5 días para el procedimiento de intervención nutricia durante el cual se adiestró a los familiares en la preparación de la fórmula, en el manejo de la sonda y de la bomba de infusión. Si en este momento se consideró que los padres están adecuadamente entrenados en el manejo de la sonda y de la bomba, el paciente se dio de alta hospitalaria para continuar el protocolo de intervención nutricia en su domicilio. Si en la opinión del investigador principal no se cumplía esta condición, la hospitalización se prolongó por 1 semana hasta conseguir este adiestramiento. El seguimiento como externo fue con una evaluación quincenal en la Unidad de Investigación del Hospital de Pediatría para realizar la evaluación antropométrica; durante las 12 semanas del procedimiento de intervención nutricia los padres o tutores del los pacientes estuvieron en contacto con el investigador responsable en cualquier momento para resolver dudas o problemas relacionados al mismo. Los criterios para detener el incremento en la cantidad de fórmula durante la primera semana de intervención nutricia fueron: a) vómito (dos o más vómitos cada 24 horas, precedidos de arqueo, de contenido gástrico o duodenal, cantidad estimada > 1 onza); b) diarrea (> 3 evacuaciones líquidas en 24 horas con la identificación en más de 2 ocasiones de sustancias reductoras en concentración > 0.5%); c) distensión abdominal (incremento de > 30mm del perímetro abdominal en relación al ingreso, tomado a nivel del ombligo o abdomen a tensión determinado por exploración física por el responsable del proyecto). En el caso de presentarse una o más de estas contingencias el aporte se disminuyó al porcentaje inmediato previo (- 10%) y así sucesivamente hasta alcanzar el aporte tolerado. En experiencia previa de manejo con alimentación enteral en lactantes aproximadamente una tercera parte de casos requirieron disminuir 10 a 20% el aporte nocturno la infusión enteral; esta información se incluyó en el adiestramiento hospitalario inicial a los padres. Las complicaciones infecciosas que se consideraron relacionadas al empleo de la sonda son y que se buscaron en cada entrevista fueron: a) rinitis purulenta (secreción amarillenta verdosa de las narinas); b) otitis media (otorrea o identificación de otitis en la exploración que se realizó cada 2 semanas al 34 paciente) y c) bronquitis o bronconeumonía (fiebre, síndrome de insuficiencia respiratoria, sibilancias y estertores broncoalveolares). Para la identificación de estas posibles condiciones en ambos grupos de estudio se instruyó a los padres para el registro de los síntomas, y se les solicitó se pusieran en contacto con el investigador responsable en caso de que se presentaran. Alimentación oral a libre demanda. En este brazo del estudio se ofreció a los pacientes la misma fórmula con triglicéridos de cadena media. La cantidad sugerida fue de 5 a 7 onzas por toma administrada en 6 biberones en 24 horas; sin embargo, la cantidad ingerida y eventualmente el horario de tomas se estableció por el propio paciente y sus padres. En este grupo los padres o tutores fueron adiestrados en la preparación de la fórmula y en el procedimiento de alimentación. Cuando el paciente alcanzó los 6 meses de edad se ofrecieron alimentos complementarios con el siguiente esquema: 6 a 7 meses fruta (1 porción/día), de los 7 a los 8 meses y fruta + verdura + carne blanca (pollo) y cereales (una porción de cada uno) de los 8 a los 9 meses igual que el anterior agregando carnes rojas (res) y leguminosas una porción, 10 a 12 meses ampliar variedad de grupos de alimentos e integrarlo gradualmente a dieta familiar (73). El seguimiento como externo fue con una evaluación quincenal en la Unidad de Investigación del Hospital de Pediatría para realizar la evaluación antropométrica; durante las 12 semanas del procedimiento de intervención nutricia los padres o tutores del paciente estuvieron en contacto con el investigador responsable en cualquier momento para resolver dudas o problemas relacionados al mismo. Evaluación del estado nutricio por antropometría. La evaluación del estado nutricio se realizó por medio de antropometría. Las mediciones antropométricas incluyeron peso, talla, perímetro cefálico, circunferencia del brazo y pliegue cutáneo tricipital. El cálculo de índices se realizó por medio de la puntuación z. Se calcularon los indicadores antropométricos peso para talla, talla para la edad, circunferencia cefálica para la edad; circunferencia del bazo, pliegue cutáneo tricipital; áreas total, muscular y grasa del brazo y porcentaje de grasa del brazo para la edad. Pruebas de laboratorio. De acuerdo al protocolo habitualmente seguido en estos pacientes se realizó una toma de muestra por punción venosa para extraer 4-5 35 mL de sangre al inicio y al final del ensayo clínico para pruebas de función hepática (bilirrubina directa e indirecta, AST, ALT, GGT, fosfatasa alcalina, proteínas séricas, albúmina, globulina, colesterol total, TP, TTP) biometría hemática, proteína c reactiva, velocidad de sedimentación globular, glucosa, urea creatinina, amonio. Instrumentos de medición y técnicas Peso. La medición del peso en niños menores de 36 meses se realizó sin ropa, en una báscula mecánica con capacidad de 16 kg (Health O Meter) que permitiera una lectura mínima de 5g. Longitud. La medición de la longitud se llevó a cabo con un infantómetro como el descrito por Fomon (72). Un observador detuvo la cabeza del niño con la porción del plano vertical de Frankfort firme contra la parte vertical del infantómetro. Un segundo observador deflexionó las rodillas del niño y aplicó los pies con los dedos hacia arriba contra el área móvil del infantómetro, haciendo un ángulo de 90 grados. Circunferencia cefálica. Se midió con una cinta métrica metálica o de fibra de vidrio de 6mm de ancho. La cinta se aplicó firmemente alrededor de la cabeza en la región supraciliar, de tal modo que corría por la parte más prominente del área frontal (nasion) y protuberancia occipital (occipucio). Circunferencia del brazo. Las mediciones se realizaron en el brazo izquierdo manteniendo al niño sentado en las rodillas de alguno de sus padres o tutores. Un observador flexionó y mantuvo su brazo en un ángulo de 90 grados con el antebrazo, se marcó el punto medio de la distancia que va del acromion al olécranon. La medición se realizó con el brazo extendido en la parte media del brazo con una cinta metálica de 6mm de espesor. Se utilizó para el cálculo de las áreas total, muscular y grasa del brazo (74,75) (Anexo 5). Pliegues cutáneos. La medición del pliegue cutáneo tricipital se realizó de acuerdo a la técnica descrita por Fomon para lactantes de un año de edad con un plicómetro marca Lange (Cambridge Scientific Industries, Inc., Maryland USA). (75) (Anexo 5). Interpretación de Indicadores antropométricos. Una vez obtenidas las mediciones antropométricas se realizó la evaluación antropométrica del estado 36 nutricio utilizando los indicadores directos, indirectos e índices antropométricos. Se realizaron los cálculos para obtener la puntuación z de los índices peso/edad, talla/edad; los indicadores circunferencia cefálica y circunferencia del brazo se evaluaron con el criterio de normalidad de -2 a +2 DE. Para los indicadores antropométricos indirectos área total del brazo, área muscular del brazo, área grasa del brazo e índice de grasa del brazo se utilizaron los patrones de referencia de Sann para niños menores de 1 año (76). Captura y procesamiento de datos. Las formas y la secuencia de captura de datos se presentan el Anexo 6. (Hoja de colección de datos). La redacción del proyecto se realizó con el procesador de palabras Word y el programa de gráficos Power Point 2007. La captura inicial se realizó en las hojas de captura. El análisis se realizará con el programa SPSS-17 y EPI-2000, 3.5.1 Análisis estadístico. a) Los estadísticos empleados en la descripción de las variables cualitativas fueron frecuencias y porcentajes y de las variables cuantitativas fueron medianas y rangos intercuartílicos. b) La normalidad de distribución de las variables se evaluó con las pruebas Kolmogorov-Smirnov y prueba F (Levene). c) La comparación inicial de las variables socio-demográficas, clínicas y de laboratorio entre los grupos de estudio se realizó para las variables cualitativas con χ2 o con la prueba exacta de Fisher cuando alguno de los valores esperados fue menor a 5 y para las variables cuantitativas con U de Mann-Whitney o t de Student ajustada con la prueba F. d) La comparación de las variables nutrimentales y de los indicadores antropométricos entre los grupos de estudio incluyendo los diferentes tiempo del estudio se realizó con la prueba Kruskal-Wallis y con ANOVA ajustada con la prueba F. e) La comparación intra-grupos de las variables nutrimentales y de los indicadores antropométricos se realizó con prueba de Friedman. Aspectos éticos. Se trató de un ensayo clínico y de acuerdo a la Ley General de Salud en Materia de Investigación para la Salud Titulo II, Capítulo I, Artículos 17y 23 (1997) el presente estudio se ubica en la categoría III y se establece que 37 requiere ser evaluado por el Comité Local de Investigación y requiere carta de consentimiento informado por escrito (Anexo 7). Por un acuerdo de la OMS (WHO, abril de 2005) los ensayos clínicos requieren ser registrados en una base de datos certificada con un mínimo de los ítems referidos en el Anexo 8, por lo que realizará el registro correspondiente. El protocolo fue evaluado y aceptado por el Comité Local de Investigación en Salud del HP con el número de registro R-2008-1302-17.(Anexo 9) 38 RESULTADOS VARIABLES SOCIO-DEMIOGRÁFICAS Edad y sexo. Se estudiaron 15 pacientes, 7 conformaron el grupo control y 8 el de intervención. Diez pacientes (66.7%) fueron del sexo femenino y 5 (33.3%) del masculino. La mediana de la edad. La comparación de la edad entre los grupos de estudio no mostró diferencia estadística (p=0.517). La comparación de las frecuencia del sexo entre los grupos de estudio tampoco mostró diferencias (p=0.714). Variables socio-demográficas de las familias. Los estadísticos de distribución central y de dispersión de variables socio-demográficas de las familias que incluyeron edad y escolaridad de los padres, ingreso familiar mensual, ocupación de los padres, estado civil y tipo de familia se presentan en el Anexo 10. Se trató de padres en la tercera década de la vida, con escolaridad secundaria, con ingresos de alrededor de 4 salarios mínimos; la mayor parte de las madres eran amas de casa y alrededor de la mitad de los padres eran obreros, la mitad de las parejas estaban casadas y dos terceras partes de ellas conformaban familias nucleares. La comparación de estas variables entre los grupos de estudio no mostró diferencia estadística. VARIABLES CLÍNICAS Las frecuencias y porcentajes de las manifestaciones clínicas presentes en ambos grupos al inicio del estudio se presentan en el Anexo 10. Los datos clínicos más frecuentes fueron ictericia, hepatomegalia y esplenomegalia; alrededor de la mitad de los casos de ambos grupos presentaron ascitis. La comparación de frecuencias de manifestaciones clínicas entre los grupos de estudio no mostró diferencias significativas. La frecuencia de hipertensión portal y de cirrosis tampoco mostró diferencia estadística. La evaluación de la magnitud del daño hepático por medio de la clasificación pediatric end-satage liver disease -por sus siglas en inglés- en el grupo de alimentación oral fue 16 (mediana) y en el enteral 18, sin diferencia estadística (p=0.450); ambos valores corresponden a daño hepático grave. Al clasificar a los pacientes evaluados con la clasificación cualitativa de Malatack, la mediana de la puntuación en el grupo oral fue 45 y en el enteral 40, sin diferencia estadística 39 (p=0.126); esta clasificación también clasifica a los sujetos evaluados con daño hepático avanzado. VARIABLES HEMATOLÓGICAS Y BIOQUÍMICAS Los estadísticos de distribución central y de dispersión de las variables de laboratorio tomadas como pruebas basales a los sujetos de los dos grupos de estudio se presentan en el Anexo 10. La comparación entre los grupos de estudio de los valores de hemoglobina, cuenta total de leucocitos, cuenta de plaquetas, tiempo de protrombina, tiempo parcial de tromboplastina, velocidad de sedimentación globular y proteína C reactiva no mostró diferencias estadísticas. La comparación de las concentraciones de glucosa, urea y creatinina tampoco mostró diferencia estadística. La comparación de pruebas de función hepática (bilirrubinas, transferasas, gama glutamil-transferasa, fosfatasa alcalina, albúmina, amonio) entre los grupos de estudio tampoco mostró diferencias. El colesterol total y la concentración de triglicéridos inicial fue significativamente menor en el grupo de intervención. VARIABLES NUTRIMENTALES a) Energía. La ingestión de energía en el grupo de lactantes manejados con alimentación oral y su aporte en los pacientes manejados con alimentación enteral se presentan en la Tabla 11. La comparación del aporte de energía entre los grupos de estudio mostró valores mayores en el grupo enteral en todos los tiempos del ensayo. Tabla 11. Estadísticos de distribución central y de dispersión del aporte de energía (kcal) en 15 lactantes con atresia de vías biliares. Semanas 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC (kcal) 615 66 655 117 610 79 633 43 651 65 655 222 Alimentación enteral (n=8) Mediana RIC (kcal) 751 130 739 145 762 109 788 91 821 91 870 108 p1 0.008 0.004 0.001 0.001 0.001 0.001 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.231; alimentación enteral p<0.001. 40 El porcentaje de adecuación de energía de acuerdo a los requerimientos diarios recomendados para la edad (72) se presenta en la Tabla 12. En todos los tiempos del estudio este porcentaje fue mayor en los sujetos del grupo enteral. Tabla 12.Estadísticos de distribución central y de dispersión del porcentaje de la ingestión diaria recomendada (IDR) en 15 lactantes con atresia de vías biliares. Semanas 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC (% IDR) 109 6 108 36 98 17 105 17 107 19 104 37 Alimentación enteral (n=8) Mediana RIC (% IDR) 121 17 116 26 121 21 119 16 123 19 127 20 p1 0.021 0.131 0.004 0.008 0.008 0.032 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.578; alimentación enteral p<0.001. b) Proteínas. La ingestión de proteínas en el grupo de lactantes manejados con alimentación oral y su aporte en los pacientes manejados con alimentación enteral se presentan en la Tabla 13. La comparación del aporte de proteínas entre los grupos de estudio mostró valores mayores en el grupo enteral en todos los tiempos del ensayo. Tabla 13. Estadísticos de distribución central y de dispersión del aporte de proteínas (g) en 15 lactantes con atresia de vías biliares. Semanas 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC (g) 26 3 26 5 26 3 27 2 28 3 29 9 Alimentación enteral (n=8) Mediana RIC (g) 26 6 27 6 28 5 29 4 30 4 32 4 p1 0.011 0.004 0.001 0.001 0.001 0.001 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.231; alimentación enteral p<0.001. 41 El aporte de proteínas calculado en g/kg/día se presenta en la Tabla 14. En todos los tiempos del estudio esta proporción fue mayor en los lactantes del grupo enteral. Tabla 14. Estadísticos de distribución central y de dispersión aporte de proteínas g/kg/día en 15 lactantes con atresia de vías biliares. Semanas 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC (g/kg/día) 4.4 0.3 4.4 0.4 4.5 0.9 4.4 1.1 4.4 1.1 4.3 1.0 Alimentación enteral (n=8) Mediana RIC (g/kg/día) 4.9 0.9 4.5 0.9 4.8 1.1 4.6 0.8 4.8 1.0 4.7 1.1 p1 0.012 0.012 <0.001 <0.001 <0.001 0.012 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.645; alimentación enteral p=0.523 VARIABLES ANTROPOMETRICAS Evaluación del estado nutricio Para la clasificación del estado nutricio se empleó la clasificación de la OMS que se aplica a los indicadores talla para la edad y peso para la talla considerando como límites de normalidad -2 a +2 DE. Los casos que se ubicaron con valores negativos mayores a -2D se consideraron como desnutridos. Para el resto de los indicadores antropométricos (circunferencia cefálica, CMB y PCT), se consideró el mismo criterio de normalidad (-2 a +2 DE) y de desnutrición (<-2DE). En dos terceras partes de los casos se identificaron valores negativos mayores a -2DE en los indicadores talla para la edad y circunferencia media del brazo para la edad. En todos los lactantes evaluados los valores negativos del pliegue cutáneo tricipital fueron mayores a -2DE. Las frecuencias y porcentajes de los casos considerados como normales o desnutridos de acuerdo a indicadores y criterios referidos se presentan en la Tabla 15. 42 Tabla 15. Frecuencias y porcentajes de casos con puntuación z <-2DE con los indicadores talla para la edad, circunferencia cefálica para la edad, peso para la talla, circunferencia media del brazo para la edad y pliegue cutáneo tricipital para la edad. Indicador antropométrico Alimentación oral (n=7) Alimentación enteral (n=8) Total n % n % n % Talla para la edad 5 71.4 5 62.5 10 66.7 C cefálica para la edad 0 - 0 - 0 - Peso para la talla 0 - 0 - 0 - CMB para la edad 5 71.4 6 75.0 11 73.3 PCT para la edad 7 100 8 100 15 100 C cefálica: circunferencia cefálica. CMB: Circunferencia media del brazo. PCT: pliegue cutáneo tricipital. Talla para la edad Mediciones. Los estadísticos de tendencia central y de dispersión de cada una de las mediciones de longitud de los 15 lactantes estudiados se presentan en el Anexo 11. En ambos grupos se observó incremento en la longitud en el transcurso del ensayo. La comparación de medianas de la longitud entre grupos en los 7 tiempos el estudio mostró diferencia en las semanas 10 y 12. Puntuación z. Las medidas de tendencia central y de dispersión de la puntuación z de la talla para la edad en los grupos de estudio se presentan en la Tabla 16. Tabla 16. Estadísticos de distribución central y de dispersión de la talla para la edad expresada en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC -2.4 1.5 -2.6 1.7 -2.8 0.8 -2.9 0.7 -3.1 0.6 -3.1 0.5 -3.2 0.4 Alimentación enteral (n=8) Mediana RIC -2.4 1.8 -2.5 2.1 -2.6 2.1 -2.2 2.1 -2.2 2.1 -2.3 2.2 -2.2 2.6 p1 0.862 0.643 0.908 0.487 0.354 0.298 0.297 RIC: Rango inter-cuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo en columnas, alimentación oral p < 0.001, alimentación enteral p=0.697. 43 En ambos grupos de estudio el promedio de la puntuación z inicial se ubicó por debajo de -2DE. En el grupo con alimentación oral se identificó una pérdida de 0.8 DE en el período de estudio. En el grupo de intervención el valor de la z se mantuvo estable a lo largo de las 12 semanas del ensayo. La comparación de la puntuación z en la medición basal y en las evaluaciones subsecuentes entre los grupos de estudio no mostró diferencia estadística. La comparación dentro de cada grupo de la medición basal con las mediciones subsecuentes no mostró diferencias en el grupo de intervención; sin embargo, en el grupo que recibió alimentación oral la diferencia fue significativa. Diferencia de z. Con objeto de evaluar los cambios en la puntuación z de la talla para la edad en los grupos de estudio a lo largo del ensayo se realizó una resta del valor basal de cada uno de los valores registrados y cada una de las evaluaciones bisemanales y se realizó el mismo análisis estadístico de los valores de z (Tabla 17). En el análisis entre grupos s encontró diferencia significativa en los tiempos 0-8, 0-10 semanas y 0-12 semanas. En la comparación dentro de cada grupo se observó diferencia significativa en el grupo control. Tabla 17. Estadísticos de distribución central y de dispersión de la talla para la edad expresada como la diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semana s 0-2 0-4 0-6 0-8 0-10 10-12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RI Mediana RI 0.26 0.40 0.64 0.84 1.00 1.10 0.30 0.43 0.68 0.55 0.33 0.65 0.11 0.07 0.16 0.24 0.45 0.50 -0.2 0.6 -0.1 0.5 -0.1 0.7 P1 0.271 0.118 0.073 0.015 0.009 0.011 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo en columnas, alimentación oral p=0.001, alimentación enteral p=0.912. 44 Circunferencia cefálica para la edad Mediciones. Los estadísticos de tendencia central y de dispersión de la circunferencia cefálica en cm en los grupos de estudio se presentan en el Anexo 11. En ambos grupos, los valores de circunferencia cefálica se incrementaron en el transcurso del ensayo. La comparación entre grupos no mostró diferencia estadística. En la comparación dentro de cada grupo se demostró diferencia significativa en ambos. Puntuación z. Los estadísticos de tendencia central y de dispersión de la puntuación z de la circunferencia cefálica para la edad en los grupos y en los diferentes tiempos del estudio se presentan en la Tabla 18. En el grupo con alimentación oral el valor promedio inicial se ubicó en -1.8DE y se identificó una pérdida de 0.6 DE en el transcurso del ensayo. En el grupo de intervención el valor de la z inicial fue -2DE y se mantuvo estable a lo largo de las 12 semanas del ensayo. La comparación de la puntuación z en la medición basal y en las evaluaciones subsecuentes entre los grupos de estudio no mostró diferencia estadística. La comparación dentro de cada grupo de la medición basal con las mediciones subsecuentes no mostró diferencia estadística en el grupo de intervención; sin embargo, en el grupo que recibió alimentación oral la diferencia fue significativa. Tabla 18. Estadísticos de distribución central y de dispersión de la circunferencia cefálica para la edad expresada en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC -1.5 3.17 -1.5 3.27 -1.7 2.81 -1.8 2.54 -1.9 2.31 -2.0 2.15 -2.1 2.15 Alimentación enteral (n=8) Mediana RIC -1.9 2.0 -2.1 2.2 -1.9 1.5 -1.9 1.9 -2.1 2.0 -2.0 2.3 -2.1 2.2 p1 0.954 0.862 0.862 0.728 0.563 0.643 0.728 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo en columnas, alimentación oral p< 0.001, alimentación enteral p=0.650. Diferencia de z. Con objeto de evaluar los cambios en la puntuación z de la circunferencia cefálica para la edad en los grupos de estudio a lo largo del 45 ensayo se realizó una resta del valor basal de cada uno de los valores registrados en la evaluación bisemanal y se realizó el mismo análisis estadístico de los valores de z (Tabla 19). La comparación entre estos valores entre grupos fue significativa a partir del tiempo 0-4 hasta 0-12. En la comparación dentro de cada grupo en los pacientes con alimentación enteral no se encontraron diferencias mientras que en el grupo oral la diferencia estadística fue significativa. Peso para la talla Mediciones. Los estadísticos de tendencia central y de dispersión de las mediciones de peso en los grupos y en los diferentes tiempos del estudio se presentan en el Anexo 11. En ambos grupos los valores del peso se incrementaron a lo largo de las 12 semanas del ensayo. La comparación de la medición basal del peso y en las evaluaciones subsecuentes entre los grupos de estudio no mostró diferencia estadística. La comparación dentro de cada grupo de la medición basal con las mediciones subsecuentes en ambos grupos tampoco mostró diferencia significativa. Tabla 19. Estadísticos de distribución central y de dispersión de la circunferencia cefálica expresada en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0-2 0-4 0-6 0-8 0-10 10-12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RI Mediana RI 0.16 0.39 0.46 0.54 0.61 0.77 0.25 0.45 0.61 0.62 0.78 0.88 0.15 0.12 0.12 0.04 0.06 0.03 0.1 0.6 0.6 0.6 0.4 0.4 p1 0.908 0.017 0.027 0.017 0.005 0.021 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.001, alimentación enteral p=0.721. Puntuación z. Los estadísticos de tendencia central y de dispersión del peso para la talla expresados en puntuación z se presentan en la Tabla 20. En ambos grupos los valores se mantuvieron dentro del los límites de -2 a +2 DE. La comparación de los valores de z entre los grupos y en los diferentes tiempos 46 del estudio no mostró diferencia estadística. La comparación dentro de cada grupo de la medición basal con las mediciones subsecuentes tampoco reveló diferencia significativa. Tabla 20. Estadísticos de distribución central y de dispersión del peso para la talla expresado en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RIC Mediana RIC -1.1 -0.8 -1.3 -1.0 -1.1 -1.1 -0.6 0.67 1.62 1.19 1.78 1.98 2.18 1.60 -0.70 -0.75 -0.70 -0.48 -0.28 -0.46 -0.30 1.9 1.1 1.1 1.1 0.5 0.6 0.4 p1 0.418 0.862 0.355 0.908 0.643 0.417 0.487 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.475, alimentación enteral p=0.995 Tabla 21. Estadísticos de distribución central y de dispersión del peso para talla expresada en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0-2 0-4 0-6 0-8 0-10 10-12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RI Mediana RI -0.0 0.1 0.0 0.2 0.0 -0.1 1.22 1.58 1.76 2.25 2.14 1.87 -0.15 0.0 -0.0 -0.0 -0.1 0.0 0.42 0.72 1.59 1.59 1.45 1.73 p1 0.817 1.000 1.000 0.563 0.862 0.728 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.475, alimentación enteral p=0.995. Diferencia de z. Con objeto de evaluar los cambios en la puntuación z del peso para la talla edad en los grupos de estudio a lo largo del ensayo se realizó una resta del valor basal de cada uno de los valores registrados en la evaluación bisemanal y se realizaron comparaciones entre grupos y dentro de cada grupo (Tabla 21). No se encontraron diferencias estadísticas en ambas evaluaciones. 47 Circunferencia media del brazo Mediciones. Los estadísticos de tendencia central y de dispersión de la circunferencia media del brazo se presentan en el Anexo 11. En el grupo de alimentación oral se observó tendencia a la disminución de los valores de las medianas, mientras que en el grupo de intervención la tendencia fue de incremento a lo largo del ensayo. Al realizar la comparación entre los grupos se observó una diferencia casi significativa en los tiempos de medición 6 y 12 semanas. La comparación dentro de cada grupo mostró diferencia significativa en el grupo de alimentación enteral. Puntuación z. Lo estadísticos de tendencia central y de dispersión de la puntuación z de la circunferencia media del brazo para la edad en los grupos de estudio se presentan en la Tabla 22. En el grupo con alimentación oral el valor de z incrementó sus valores negativos mientras que el grupo de intervención se observó tendencia de disminución de la puntuación z también en valores negativos. La comparación de la puntuación z entre los grupos de estudio en la medición basal y en las evaluaciones subsecuentes no mostró diferencia estadística. La comparación dentro de los grupos tampoco mostró diferencias. Tabla 22. Estadísticos de distribución central y de dispersión de la circunferencia media del brazo expresada en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RIC Mediana RIC -3.0 -3.4 -3.2 -3.6 -3.7 -3.9 -3.7 2.07 2.15 1.56 1.32 0.88 0.68 1.18 -3.2 -3.3 -2.8 -2.7 -3.0 -3.3 -2.7 2.32 2.57 2.21 2.05 2.85 3.00 3.32 p1 0.954 1.000 0.355 0.182 0.247 0.355 0.203 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.906, alimentación enteral p=0.141 Diferencia de z. Con objeto de evaluar los cambios en la puntuación z de la circunferencia media del brazo para la edad en los grupos de estudio a lo largo 48 del ensayo se realizó una resta del valor basal de cada uno de los valores registrados en la evaluación bisemanal y se realizó el mismo análisis estadístico de los valores de z (Tabla 23). No se encontró diferencia estadística. Tabla 23. Estadísticos de distribución central y de dispersión de la circunferencia media del brazo expresada en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0-2 0-4 0-6 0-8 0-10 0-12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RIC Mediana RIC 0.1 0.5 1.0 1.6 1.9 1.5 0.3 1.54 2.4 3.14 3.6 4.18 0 -0.1 -0.5 -0.2 -0.4 -0.7 0.18 0.79 0.96 1.22 0.80 2.16 p1 0.297 0.132 0.132 0.247 0.298 0.165 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.952, alimentación enteral p=0.221. Pliegue cutáneo tricipital Mediciones. Los estadísticos de tendencia central y de dispersión del pliegue cutáneo tricipital en los grupos de estudio se presentan en el Anexo 11. En el grupo control la tendencia fue a la disminución de estos valores, mientras que el grupo de intervención con alimentación enteral se observó una tendencia al incremento de los valores promedio a lo largo del ensayo. Al realizar la comparación entre los grupos se observó una diferencia casi significativa en la medición basal y diferencia estadística a las 12 semanas. La comparación dentro de cada grupo reveló diferencia significativa en el grupo de alimentación enteral. Puntuación z. Los estadísticos de tendencia central y de dispersión de la puntuación z del pliegue cutáneo tricipital para la edad en los grupos de estudio se presentan en la Tabla 24. En el grupo con alimentación oral el valor de la z incremento sus valores negativos mientras que el grupo de intervención los valores de z disminuyeron dentro del área de valores negativos. La comparación de la puntuación z en la medición basal y en las evaluaciones subsecuentes entre los grupos de estudio mostró diferencia estadística a partir de las 10 semanas del estudio. La comparación dentro de cada grupo de la medición 49 basal contra las mediciones subsecuentes mostró diferencia estadística en el grupo intervención. Tabla 24. Estadísticos de distribución central y de dispersión del pliegue cutáneo tricipital expresado en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC -3.7 1.62 -3.3 1.16 -3.5 0.44 -3.3 1.42 -3.7 0.62 -3.9 1.28 -3.8 1.36 Alimentación enteral n (8) Mediana RIC -4.0 1.21 -3.7 0.88 -3.6 1.02 -2.9 1.05 -2.7 1.07 -3.0 1.12 -2.6 1.69 p1 0.385 0.325 0.862 0.247 0.056 0.043 0.011 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0.972, alimentación enteral p<0.001. Diferencia de z. Para evaluar los cambios en la puntuación z del pliegue cutáneo tricipital en los grupos de estudio a lo largo del ensayo se realizó una resta del valor basal de cada uno de los valores registrados en le evaluación bisemanal y se realizó el mismo análisis estadístico de los valores de z (Tabla 25). Se encontró diferencia estadística a partir de la 6° s emana del estudio cuando se compararon los grupos de estudio. La comparación dentro de cada grupo mostró diferencia estadística en el grupo de intervención. Tabla 25. Estadísticos de distribución central y de dispersión del pliegue cutáneo tricipital expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0-2 0-4 0-6 0-8 0-10 0-12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RIC Mediana RIC 0.16 0.39 0.46 0.54 0.61 0.77 0.25 0.45 0.61 0.62 0.78 0.88 0.15 0.12 0.12 0.04 0.06 0.03 0.1 0.6 0.6 0.6 0.4 0.4 p1 0.320 0.247 0.018 0.015 0.037 0.008 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.858, alimentación enteral p= <0.001. 50 Área total del brazo Área. Los estadísticos de tendencia central y de dispersión del área total del brazo de los grupos de estudio se presentan en el Anexo 11. En el grupo de alimentación oral la tendencia fue a la disminución de las medias con pérdida de 1cm2 mientras que en el grupo de intervención la tendencia fue inversa con incremento de 1.5cm2. La comparación entre los grupos mostró diferencia significativa en la sexta semana. La comparación dentro de cada grupo fue significativa en el grupo de intervención. Puntuación z. Los estadísticos de tendencia central y de dispersión de la puntuación z del área total del brazo para la edad en los grupos de estudio se presentan en la Tabla 26. En el grupo con alimentación oral el valor de la z incrementó sus valores negativos en más de 1DE, mientras que el grupo de intervención los valores de z se mantuvieron estables a lo largo del ensayo. Con alimentación enteral hay tendencia a disminuir la puntuación z en valores negativos. La comparación de la puntuación z entre los grupos y en los diferentes tiempos del estudio no mostró diferencia estadística. La comparación dentro de cada grupo tampoco mostró diferencia estadística. Tabla 26. Estadísticos de distribución central y de dispersión del área total del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RIC Mediana RIC -3.0 -3.0 -3.3 -3.5 -3.8 -4.0 -4.0 0.92 1.27 0.9 0.63 0.94 0.81 1.58 -3.2 -3.5 -3.4 -3.1 -3.5 -3.6 -3.2 1.97 2.1 1.65 1.66 2.34 2.83 2.62 p1 0.563 0.772 1.000 0.487 0.418 0.418 0.165 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p=0.545, alimentación enteral p=0.651 Diferencia de z. Con objeto de evaluar los cambios en la puntuación z del área total del brazo en los grupos de estudio a lo largo del ensayo, se realizó una resta del valor basal de cada uno de los valores registrados en la evaluación 51 bisemanal y se realizó el mismo análisis estadístico de los valores de z (Tabla 27). Cuando se comparó entre grupos y dentro de cada grupo no se encontró diferencia estadística. Tabla 27. Estadísticos de distribución central y de dispersión del área total del brazo expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semanas Alimentación oral (n=7) 0-2 0-4 0-6 0-8 0-10 0-12 Alimentación enteral (n=8) Mediana RI Mediana RI 0.1 0.5 0 0.8 1.2 1.3 0.48 0.79 1.2 1.78 1.98 2.85 0.12 0.25 0 0.1 0 0 0.17 0.38 0.44 0.35 0.59 1.05 p1 0.323 0.297 0.165 0.148 0.165 0.064 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0. 545, alimentación enteral p= 0.651. Área muscular del brazo Área. Los valores de tendencia central y de dispersión del área muscular del brazo de los grupos de estudio se presentan en el Anexo 11. En el grupo de alimentación oral la tendencia fue la disminución de valores promedio a lo largo del ensayo con pérdida de 0.6cm2. En el grupo de intervención la tendencia al incremento de los valores promedio con ganancia de 0.7cm2. La comparación entre los grupos no identificó diferencias significativas. La comparación dentro de cada grupo tampoco mostró diferencia estadística. Puntuación z. Las medidas de tendencia central y de dispersión de la puntuación z del área muscular del brazo para la edad se presentan en la Tabla 28. En el grupo con alimentación oral los valores de z se ubicaron por debajo de -2DE y su valor negativo se incrementó -0.9DE. En el grupo de intervención la tendencia fue de mantenimiento de los valores de z por arriba de -2DE. La comparación de la puntuación z en la medición basal y en las evaluaciones subsecuentes no mostró diferencia estadística. La comparación dentro de cada grupo tampoco mostró diferencias. 52 Tabla 28. Estadísticos de distribución central y de dispersión del área muscular del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC Alimentación enteral (n=8) Mediana RIC p1 -1.5 1.72 -1.9 1.99 0.862 -1.7 1.52 -2.3 2.22 0.954 -2.3 0.59 -1.8 1.69 0.165 -2.4 0.47 -2.1 1.99 0.247 -2.5 0.72 -2.1 2.11 0.165 -2.5 0.75 -2.2 2.90 0.452 -2.6 1.45 -1.9 2.38 0.165 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0.874, alimentación enteral p= 0.710 Diferencia de z. Para evaluar los cambios en la puntuación z de el área muscular del brazo en los grupos de estudio a lo largo del ensayo se realizó una resta del valor basal de cada uno de los valores registrados en le evaluación bisemanal y se realizó el mismo análisis estadístico de los valores de z (Tabla 29). La comparación entre grupos y dentro de cada grupo no identificó diferencia estadística. Tabla 29. Estadísticos de distribución central y de dispersión de la diferencia del área muscular del brazo de la medición basal con las mediciones subsecuentes en 15 lactantes con atresia de vías biliares. Semanas 0-2 0-4 0-6 0-8 0-10 0-12 Alimentación oral n (7) Alimentación enteral n (8) Mediana RI Mediana RI 0.12 0.61 0.53 0.91 1.31 1.06 0.34 0.82 1.33 1.88 2.09 2.87 0.11 0.07 -0.11 0.05 -0.12 -0.35 0.34 0.77 1.01 1.04 1.21 1.26 p1 0.451 0.105 0.247 0.298 0.247 0.355 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0.928, alimentación enteral p= 0.549. 53 Área grasa del brazo Áreas. Los estadísticos de tendencia central y de dispersión del área muscular del brazo de los grupos de estudio se presentan en el Anexo 11. En el grupo oral se observó tendencia a la disminución de los valores promedio a lo largo del ensayo con pérdida de 0.5cm2. En el grupo enteral se observó incremento de los valores en 0.8cm2. Al realizar la comparación entre los grupos se observó diferencia significativa en las semanas 6 y 12. La comparación dentro de cada grupo demostró diferencia estadística significativa en el grupo de intervención. Puntuación z. Las medidas de tendencia central y de dispersión de la puntuación z del área grasa del brazo para la edad en los grupos de estudio se presentan en la Tabla 30. En el grupo con alimentación oral el valor de z incrementó sus valores negativos mientras que el grupo de intervención la tendencia observada fue la de disminución de sus valores negativos. La comparación de la puntuación z en la medición basal y en las evaluaciones subsecuentes entre los grupos de estudio no mostró diferencia estadística. La comparación entre cada grupo de la medición basal con las mediciones subsecuentes no mostró diferencia estadística. Tabla 30. Estadísticos de distribución central y de dispersión del área grasa del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC -2.8 1.29 -2.9 1.1 -2.9 0.97 -3.0 0.72 -2.9 0.24 -3.0 0.67 -2.9 0.67 Alimentación enteral n (8) Mediana RIC -3.0 0.94 -2.8 0.83 -2.7 0.98 -2.5 0.79 -2.5 0.99 -2.5 1.20 -2.2 1.74 p1 0.563 0.908 0.563 0.083 0.247 0.247 0.224 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0. 679, alimentación enteral p=0.304 Diferencia de z. Con objeto de evaluar los cambios en la puntuación z de el área grasa del brazo en los grupos de estudio a lo largo del ensayo se realizó una resta del valor basal de cada uno de los valores registrados en la evaluación bisemanal y se realizó el mismo análisis estadístico de los valores de z (Tabla 54 31). La comparación de estas diferencias entre grupos mostró diferencia estadística en la semanas 0-2 y 0-6. La comparación dentro de cada grupo no mostró diferencia estadística. Tabla 31. Estadísticos de distribución central y de dispersión de las diferencias de la resta del valor inicial con los subsecuentes del área grasa del brazo expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0-2 0-4 0-6 0-8 0-10 0-12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RI Mediana RI 0.1 0.1 0.1 0.2 0.3 0.5 0.49 1.08 1.31 1.38 1.6 1.65 0 -0.2 -0.4 -0.4 -0.4 -0.2 0.39 0.46 0.80 1.01 1.25 1.51 p1 0.049 0.105 0.021 0.148 0.165 0.203 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0.779, alimentación enteral p=0.443. Índice grasa del brazo Índices. Los estadísticos de tendencia central y de dispersión del índice grasa del brazo en los grupos de estudio se presentan en la Anexo 11. En el grupo de alimentación oral la tendencia fue a la disminución de los valores a lo largo del ensayo con una diferencia de más de 6 puntos porcentuales mientras que en el grupo de intervención esta tendencia fue inversa con incremento de más de 6 puntos porcentuales. La comparación entre los grupos se observó diferencia significativa en la evaluación basal. La comparación dentro de cada grupo mostró diferencias estadísticas en ambos grupos. Puntuación z. Las medidas de tendencia central y de dispersión de la puntuación z del índice grasa del brazo para la edad en los grupos de estudio se presentan en la Tabla 32. En el grupo oral el valor de la z incrementó sus valores negativos mientras que el enteral disminuyeron los valores negativos. La comparación entre los grupos de estudio mostró diferencia estadística en la semana 0 y la comparación dentro de cada grupo mostró diferencias en el grupo de intervención. 55 Tabla 32. Estadísticos de distribución central y de dispersión del índice grasa del brazo expresado en puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0 2 4 6 8 10 12 Alimentación oral (n=7) Mediana RIC -1.5 0.97 -1.6 1.07 -2.0 1.37 -2.0 0.56 -1.9 1.1 -1.9 0.83 -2.2 0.68 Alimentación enteral (n=8) Mediana RIC -2.7 1.56 -2.6 1.30 -2.4 1.46 -2.0 1.21 -1.6 0.99 -2.0 1.41 -1.7 1.11 p1 0.021 0.183 0.247 0.908 0.203 0.354 0.073 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0.112, alimentación enteral p=0.005. Diferencia de z. Con objeto de evaluar los cambios en la puntuación z del índice grasa del brazo en los grupos de estudio a lo largo del ensayo, se realizó una resta del valor basal de cada uno de los valores registrados en le evaluación bisemanal y se realizó el mismo análisis estadístico de los valores de z (Tabla 33). La comparación entre grupos mostró diferencias a partir de la 6° semana. La comparación dentro cada grupo identificó diferencia significativa en el grupo de alimentación enteral. Tabla 33. Estadísticos de distribución central y de dispersión del índice grasa del brazo expresado en diferencia de la puntuación z en 15 lactantes con atresia de vías biliares. Semanas 0-2 0-4 0-6 0-8 0-10 0-12 Alimentación oral (n=7) Alimentación enteral (n=8) Mediana RI Mediana RI 0.1 0.4 0.4 0.5 0.5 0.5 0.49 1.14 1.44 0.5 0.64 1 0 -0.2 -0.5 -1.0 -1.0 -1.0 1.30 1.29 1.92 1.49 1.66 1.92 p1 0.298 0.105 0.021 0.003 0.005 0.001 RIC: Rango intercuartílico. Comparación entre grupos (p1) en filas. Comparación dentro de cada grupo, alimentación oral p= 0.501, alimentación enteral p=0.020. 56 EFECTOS ADVERSOS a) Infección respiratoria. En el grupo manejado con alimentación oral dos pacientes (14%) presentaron infección respiratoria alta leve que por datos clínicos se consideró de etiología viral. En el grupo de intervención se observó rinitis purulenta en 5 de los 8 pacientes (40%) pacientes; fue necesario retirar la sonda de alimentación por un período de 3 a 7 días y dar tratamiento médico con antibiótico oral e irrigaciones nasales con solución salina 0.9%; en un caso (12.5%) se identificó bronconeumonía diagnosticada por datos clínicos y radiológicos, evento que ameritó hospitalización por una semana para tratamiento con antibióticos intravenosos e inhaloterapia. En todos los casos de infección respiratoria identificados en ambos grupos de estudio el evento se resolvió satisfactoriamente en el transcurso de aproximadamente una semana. La comparación de la frecuencia de infección respiratoria entre los grupos de estudio no mostró diferencia estadística. b) Diarrea. De los 7 pacientes que recibieron alimentación oral, 3 (21%) presentaron diarrea (disminución en consistencia e incremento en número de de las evacuaciones, pH neutro y sustancias reductoras en heces negativas); en los ocho pacientes (100%) del grupo de intervención se identificó diarrea con las mismas características descritas para el grupo de alimentación oral. En ninguno de los dos grupos se identificó repercusión en sus condiciones de hidratación ni se requirió manejo específico como administración de solución de hidratación oral o soluciones intravenosas de reposición. La comparación de la frecuencia de diarrea entre los grupos de estudio mostró diferencia estadística (0.025). c) Distensión abdominal y vómitos. En el grupo alimentado oral a libre demanda se identificó distensión abdominal en 3 niños (48.2%) en el transcurso del ensayo clínico, que se atribuyó a ascitis. En el grupo de intervención, la distensión ocurrió en 4 pacientes (32%) y se asoció a la presencia de vómitos durante la infusión nocturna; estos casos correspondieron a los de mayor edad y con presencia de ascitis al inicio del estudio por lo que fue necesario reducir el aporte de energía. La comparación de la frecuencia de distensión abdominal entre los grupos de estudio no mostró diferencia estadística. 57 d) Biometría hemática. Los estadísticos de distribución central y de dispersión de los valores de la biometría hemática evaluados al inicio y al final del estudio se presentan en el Anexo 12. En la comparación entre los grupos de estudio al final del ensayo, en el grupo de intervención el valor de la hemoglobina fue mayor y la cuenta de leucocitos fue menor (p=0.040, p=0.021 respectivamente). e) Indicadores de inflamación. Los estadísticos de distribución central y de dispersión de velocidad de sedimentación globular y proteína C reactiva evaluados al inicio y al final del estudio se presentan en el Anexo 12. En la comparación entre los grupos de estudio al final del ensayo no se encontró diferencia estadística. f) Química sanguínea. Los estadísticos de distribución central y de dispersión de los valores de la química sanguínea evaluados al inicio y al final del estudio se presentan en el Anexo 12. En la comparación entre los grupos de estudio al final del ensayo no se observaron diferencias en las concentraciones de glucosa, urea y creatinina. g) Pruebas de función hepática. Los estadísticos de distribución central y de dispersión de los valores de la química sanguínea evaluados al inicio y al final del estudio se presentan en el Anexo 12. En la comparación entre los grupos de estudio al final del ensayo en el grupo de intervención la concentración de amonio fue mayor (p=0.009); los valores de gama- glutamil-transferasa y fosfatasa alcalina fueron menores que el grupo de intervención (p=0.028 y p=0.040 respectivamente). h) Lípidos séricos. Los estadísticos de distribución central y de dispersión de los valores lípidos séricos evaluados al inicio y al final del estudio se presentan en el Anexo 12. En la comparación entre los grupos de estudio al final del ensayo no se observaron diferencias estadísticas. 58 DISCUSIÓN La evaluación antropométrica inicial del estado nutricio ratificó la impresión de trabajos publicados por otros autores y por nuestro grupo de la UMAE Hospital de Pediatría en el sentido de una afectación temprana y severa del crecimiento y del estado nutricio en lactantes con atresia de vías biliares (9,23-25,27-28). En alrededor de dos terceras partes de los lactantes estudiados el indicador talla para la edad se ubicaba por debajo de -2DE, lo que traduce una desaceleración del crecimiento considerando que todos los casos estudiados fueron producto de embarazos a término con peso y longitud normales al nacimiento. La proporción de casos con circunferencia cefálica para la edad con valores negativos mayores a -2DE estaba presente en un poco menos de la mitad de los casos al inicio del estudio, lo que corresponde a un indicador de la gravedad de la afectación temprana de sistemas vitales en lactantes con atresia de vías biliares. Al inicio del ensayo clínico en prácticamente todos los niños, se identificó afectación moderada a severa del estado nutricio evaluado por indicadores directos del brazo como el pliegue cutáneo tricipital. Sin embargo, como se ha demostrado en otros estudios de nuestro grupo, el indicador peso para la talla no fue sensible para identificar desnutrición aguda ya que en todos los lactantes estudiados y en los 7 tiempos del estudio sus valores se mantuvieron dentro de los límites de normalidad sin diferencias en las comparaciones dentro y entre los grupos (4). La explicación para estos hallazgos negativos es el sesgo que se introduce por la retención periférica de líquidos, la presencia de ascitis y el crecimiento de vísceras como el hígado y el bazo. Por la severidad de la afectación del crecimiento, la composición corporal y las diferentes proporciones identificadas de alteración de los indicadores antropométricos, la secuencia fisiopatológica que se puede plantear como hipótesis causal de desnutrición secundaria es inicialmente el consumo de reservas de energía almacenada en forma de grasa seguida de una desaceleración del crecimiento lineal con cierta protección al sistema nervioso central y a las masas musculares y finalmente una afectación sistémica. Las implicaciones de esta alteración extrema y temprana del crecimiento y de la composición corporal para la vida futura, crecimiento y desarrollo de los niños 59 con atresia de vías biliares parecen obvias e indudables y en algunas condiciones probablemente sean irreversibles (2,4,20,68). La evaluación de las variables socio-demográficas de los pacientes y de sus familias no demostró diferencias estadísticas entre los grupos control y de intervención, lo que desde el punto de vista metodológico para un diseño de ensayo clínico, es conveniente ya que permite controlar la participación de este tipo de variables en los resultados, particularmente porque la mayor parte de la intervención se realizó en los hogares de los niños incluidos en el estudio. Se trató de familias típicas atendidas en la seguridad social mexicana, pequeñas, nucleares, integradas, de padres jóvenes, amas de casa y obreros, con escolaridad media e ingresos bajos. La comparación de las variables clínicas y bioquímicas que permitieron evaluar en forma puntual la condición orgánica de los niños estudiados tampoco mostró diferencia estadística, lo que permitió considerar a los grupos de estudio como comparables. El cuadro clínico siempre fue conspicuo ya que la ictericia y la hepatomegalia son manifestaciones evidentes de daño hepático desde edades tempranas. Las pruebas de funcionamiento hepático revelaron alteraciones importantes en las condiciones evaluadas en ambos grupos de estudio que incluyó las funciones de conjugación, excreción y síntesis, características de este tipo de enfermos (2,4, 30-31,55, 68-69). La elección de una fórmula semi-elemental con alrededor de 50% de sus lípidos en forma de triglicéridos de cadena media se realizó por la propiedad de estos nutrimentos de absorberse en ausencia de enzimas pancreáticas y particularmente en situaciones en las que hay deficiencia de bilis y sales biliares, lo que impide la formación de micelas. Este tipo de fórmulas son las habitualmente indicadas en niños menores de 24 meses de edad con enfermedades del páncreas como la fibrosis quística y en enfermedades hepáticas especialmente la de variedad colestásica. En el HP constituye la fórmula empleada en este tipo de pacientes desde hace 3 lustros. Aunque se ha considerado a la ingestión insuficiente de fórmula y otros alimentos como uno de los factores generadores de desnutrición secundaria en los niños pequeños con enfermedades del hígado, en un estudio reciente en el 60 que se evaluó la ingestión de energía y el volumen ingerido, se demostró que los lactantes menores de18 meses tienen una ingestión de fórmula equiparable a la de un grupo control y dentro de los límites de la ingestión diaria recomendada por diferentes instancias (79). En los niños del grupo control del presente estudio la ingestión promedio de energía que se ubicó alrededor del 100% de la ingestión diaria recomendada para niños normales. La variabilidad observada en la ingestión de fórmula que se refleja en los rangos intercuartílicos presentados en los resultados, se explicaron por diferentes condiciones clínicas, ya que hubo niños que presentaron hiporexia moderada y/o su ingestión se limitó probablemente por restricción del volumen gástrico por la presencia de ascitis y probablemente por el crecimiento excesivo del hígado y del bazo. Sin embargo, ante la presencia de un trastorno grave de la salud que condiciona malabsorción de grasas y de vitaminas liposolubles además de un consumo incrementado de energía, es inadecuado considerar los requerimientos normales para lactante sanos, como un parámetro para estimar los requerimientos de energía y nutrimentos en los pacientes con atresia de vías biliares. (2,4, 68,70). Con fundamento en estudios que han evaluado el consumo calórico, pérdidas por heces y respuesta clínica al aporte controlado de energía y nutrimentos la posición vigente respecto a las necesidades aumentadas en estos niños es de entre 130% y 140% de sus requerimientos (26,28). Se ha discutido si este cálculo se debe realizar para su edad o para su peso actual y no se ha llegado a una postura universal (15,16,25-27,29); la opinión de los autores de este trabajo –y de hecho esta propuesta es uno de los aspectos que lo justifican- es que los lactantes con atresia de vías biliares tienen una ingestión de fórmula que probablemente es adecuada considerando su peso para la talla, pero este aporte no es suficiente para cubrir sus necesidades de energía y nutrimentos para crecer y desarrollarse adecuadamente. Desde este enfoque, la alternativa para aportar la energía y los nutrimentos adecuados para dichas funciones solo puede realizarse a través de técnicas de soporte nutricio especializado como la alimentación enteral. Para el presente protocolo se seleccionó la técnica de infusión continua o ciclada, esta última de acuerdo a la disposición de la familia, lo que permitió administrar una cantidad significativamente mayor de energía, 61 macro y micronutrimentos en el grupo de intervención que en el grupo control; la estimación del aporte en exceso en relación al grupo control es alrededor de 20%. Dado que el aporte de macronutrimentos, vitaminas y nutrimentos inorgánicos en buena medida giran alrededor del aporte de energía, se podría afirmar que el aporte incrementado de macro y micronutrimentos fue mayor también alrededor de 20%. La excepción a esta situación fue el aporte de proteínas, el cual se calculó de acuerdo al peso real y se consideró como límite máximo 5g/kg/día (23,29); en estos casos, al ajuste de energía para alcanzar el teórico 140% de requerimientos para su edad se realizó añadiendo polímeros de glucosa (miel de maíz) y lípidos (aceite de maíz) en proporción 2:1 al aporte calculado de la fórmula. Un aspecto importante a considerar es que el manejo de la fórmula con triglicéridos de cadena media en ambos grupos de estudio se realizó esencialmente en el hogar de los pacientes a cargo de sus padres o cuidadores y que el registro de las cantidades ingeridas se realizó por ellos en libretas individuales, lo que puede establecer un sesgo de información. Sin embargo, esta condición es aplicable a ambos grupos de estudio y la obtención de datos de las libretas de cada paciente y su análisis mostró resultados congruentes para cada grupo de estudio. Aunque en un ensayo clínico la condición ideal es que las variables independientes sean controladas directamente por el investigador, el tiempo requerido para la intervención –que fueron 12 semanashizo que no fuera factible ni razonable realizarlo como un estudio hospitalario por riesgo para al paciente, dificultades para las familias y costos. En última instancia, la alimentación enteral en casa es el escenario real en el cual se podrían aplicar los resultados del presente ensayo clínico. La observación de los valores de la longitud a lo largo de las 6 semanas del estudio mostró que en ambos grupos se identifica crecimiento lineal, es decir que en ambos grupos hubo crecimiento; en las mediciones de las 8 a las 12 semanas se identificó diferencia estadística al comparar las medias con mayores valores de longitud en el grupo de niños manejados con alimentación enteral. Al ajustar las mediciones de longitud como puntuación z de la talla para la edad resulta evidente que en el grupo de intervención los valores de z se mantienen estables inmediatamente por debajo -2DE mientras que en el grupo control hay 62 pérdida de más de 1DE en el transcurso del ensayo nuevamente con diferencia estadística a partir de las 8 semanas. Estos resultados permiten afirmar que en los pacientes manejados con alimentación enteral se impidió el deterioro de la talla aunque no fue posible recuperarla en el sentido de llevarla a la zona de normalidad en todos los casos mientras que en el grupo oral el deterioro fue rápido y progresivo, ubicando al grupo como desnutrición crónica grave al finalizar el ensayo. El comportamiento de la circunferencia cefálica para la edad fue similar al de la longitud en el sentido de que en ambos grupos hubo incremento de la medición a lo largo del ensayo sin diferencia estadística entre los valores crudos en las 7 mediciones. Sin embargo, al ajustar las mediciones con puntuación z se hizo evidente un mayor deterioro de la velocidad crecimiento en el grupo de alimentación oral a libre demanda. Estos hallazgos permiten afirmar que la intervención nutricia fue eficaz para evitar el deterioro del crecimiento del sistema nervioso central, lo que puede tener implicaciones trascendentes para el desarrollo en el mediano y largo plazo. La respuesta a la intervención nutricia evaluada por la circunferencia media del brazo y el área total del brazo, indicador directo e indirecto respectivamente que evalúan globalmente las áreas grasa y muscular muestra en la evaluación ajustada por puntuación z una clara tendencia de mantener un valor estable en el grupo de intervención contrastando con un incremento de valores negativos de z, lo que puede interpretarse como una pérdida gradual de tejido graso o muscular, condición que teóricamente no puede ser discriminada por estos indicadores. La evaluación de la respuesta a la intervención nutricia con indicadores que estiman el compartimento de grasa (pliegue cutáneo tricipital, área grasa e índice de grasa) y muscular (área muscular) son consistentes en identificar una tendencia estadísticamente significativa en direcciones opuestas: el grupo oral pierde gradualmente tejido graso mientras que el grupo enteral lo gana con una magnitud de alrededor de una desviación estándar, lo cual además de ser significativo desde el punto de vista estadístico lo es desde el punto de vista clínico ya que los indicadores incluso rebasan el límite de -2DE. La implicación de estos hallazgos es que la alimentación enteral con una fórmula con triglicéridos de cadena media resultó eficaz no solo para evitar el deterioro 63 nutricio en el compartimento de reservas de grasa sino además permitió incrementarlo y llevar a los niños a valores cercanos a la normalidad o a la normalidad cuando se la evaluación se realizó con el indicador índice grasa del brazo. La tendencia del área grasa del brazo a lo largo del ensayo clínico fue similar a la de los indicadores de crecimiento en el sentido de que en el grupo de intervención los valores de z se mantuvieron estables en la parte inferior del área de normalidad mientras que en el grupo control hubo una pérdida gradual que alcanzo una desviación estándar. La interpretación de estos resultados podría ser que la intervención nutricia permitió mantener la masa muscular dentro de valores aceptables al ser estimadas por este indicador. En un intento de evaluar globalmente los hallazgos antropométricos que se usaron para estimar la respuesta a la intervención nutricia al contrastarlos con un grupo control, se podría afirmar que la nutrición enteral previene la desaceleración de velocidad de crecimiento longitudinal y de la circunferencia cefálica, previene el consumo del tejido muscular y favorece el incremento de las reservas de grasa. Estudios recientes realizados por nuestro grupo en lactantes con atresia de vías biliares han permitido validar la antropometría del brazo a través de absorciometría de doble fotón como estándar de oro, en el sentido de obtener correlaciones significativas de los indicadores antropométricos del brazo con una elevada fuerza de asociación con los compartimentos corporales masa magra y reservas de grasa (78). Esta experiencia permitiría asumir que los resultados obtenidos en el presente estudio y las conclusiones expresadas tienen validez razonable en el terreno clínico que es en última instancia en donde se debieran aplicar como un recurso terapéutico. Los grandes centros pediátricos de los países desarrollados cuentan con sistemas nacionales de donación de órganos y en algunos casos con programas de donador vivo (61,66), situación que condiciona disminución de la probabilidad de que los lactantes con enfermedad hepática presenten retraso en el crecimiento y desnutrición de la magnitud de la encontrada en el presente trabajo. Por lo anterior la indicación de intervención nutricia sería en casos seleccionados en quienes se identifiquen factores de riesgo de desnutrición. Sin 64 embargo, en hospitales como el HP, con recursos limitados para programas de donación y trasplante –y que probablemente sea similar a la mayor parte de hospitales pediátricos en el ámbito mundial-, la alimentación enteral puede jugar un papel central en aportar reservas energéticas que le permitan a estos niños afrontar tanto su enfermedad y sus complicaciones como procedimientos invasivos de los cuales el trasplante hepático sería su máxima expresión. Además de una mayor disponibilidad de reservas energéticas, la alimentación enteral permitiría prevenir desaceleración del crecimiento longitudinal y del crecimiento del sistema nervioso estimado por los valores de la circunferencia cefálica. La preservación de la masa muscular permitiría especular que el mayor aporte de proteínas y la no utilización de las reservas proteínicas corporales en la generación de energía permitiría incrementar la disponibilidad de aminoácidos para la síntesis de proteínas para diferentes funciones orgánicas. En este contexto, la propuesta de manejo nutricio en niños menores de 12 meses de edad con atresia de vías biliares –independiente si se ha realizado porto-entero anastomosis- sería la de manejar alimentación enteral por el mayor tiempo posible. El análisis de los efectos secundarios observados en el presente ensayo clínico se puede plantear en el marco del objeto de estudio que corresponde a la causa más grave de daño hepático que puede ocurrir en niños y adolescentes. Desde hace más de una década diversos autores han observado como un hallazgo consistente la asociación de retraso en el crecimiento, desnutrición proteínico energética y déficit de vitaminas y de nutrimentos inorgánicos en niños con AVB, particularmente en menores de 36 meses de edad (2,4,20,23-24,30,55-56). La información publicada relacionada a las consecuencias de estas alteraciones nutricias sobre el crecimiento y desarrollo y a la calidad de vida de estos pacientes es mucho menos abundante pero demuestran habilidades psicomotoras, coeficiente intelectual y del lenguaje en límites inferiores normales (20,79,80). En la experiencia empírica de más de dos décadas de atención médica de niños con AVB en el HP, se podría afirmar que los efectos de la enfermedad hepática y la desnutrición son evidentes en el sentido de retraso de habilidades psicomotoras. Por otra parte, en los últimos años se ha publicado una sólida serie de evidencias que relacionan a la desnutrición fetal o de los 65 primeros meses de la vida con la “programación” de enfermedades crónicodegenerativas del adulto, lo que ha hecho evidente la trascendencia de los problemas nutricios sobre la salud futura de quienes la padecieron (81). La evaluación de los efectos secundarios atribuibles al procedimiento de intervención nutricia debiera ser enmarcada en el contexto de un intento de modificar la historia natural del crecimiento y la composición corporal en niños con AVB. El efecto secundario más significativo fue la ocurrencia de infección respiratoria purulenta atribuible a la presencia prolongada de la sonda de alimentación a través de las fosas nasales y la faringe. En un caso del grupo de intervención se documentó neumonía, la que podría considerarse facilitada por la sonda naso-gástrica; aunque solo se trató de un caso, la proporción dentro del grupo de estudio fue mayor a 10%, lo que se puede considerar como significativo desde el punto de vista clínico. En el resto de los casos con rinitis purulenta, el problema se resolvió sin mayores consecuencias para los pacientes. Desde el punto de vista de los autores de este trabajo, los efectos obtenidos con la intervención nutricia sobre el crecimiento lineal, el crecimiento del sistema nervioso central, la masa muscular y las reservas de grasa, son suficientemente trascendentes para justificar el riesgo de infección respiratoria como un riesgo calculado en el procedimiento. Los niños menores de dos años de edad que se manejan con una fórmula con hidrolizados de proteínas y/o que se alimentan con sonda naso-gástrica en infusión continua suelen tener diarrea como un efecto secundario y casi nunca se considera como un problema clínico. Este fue el caso en el grupo de pacientes manejados con alimentación enteral, en quienes la diarrea no constituyó un problema que requiriera atención especial. La distensión abdominal es una manifestación asociada a un mayor volumen de fórmula en la luz intestinal en niños con ascitis y de manera similar al manejo de alimentación enteral en otros problemas se emplea como un indicador clínico para ajustar la cantidad de fórmula infundida; en los pacientes estudiados la distensión fue el indicador para disminuir el volumen infundido, lo que habitualmente se realizó por las noches, con lo que se corrigió el síntoma sin otras consecuencias para los pacientes. 66 La comparación basal de las variables de laboratorio entre los grupos de estudios mostró diferencia entre los valores de colesterol y triglicéridos, mayores en el grupo control. Estas diferencias se ubicaron dentro del área de normalidad, no fue posible darles una explicación clínica y se consideró sin trascendencia clínica en la comparación inicial de los grupos de estudio. La comparación de los valores hematológicos al finalizar el estudio reveló una cifra discretamente mayor en el grupo de intervención que podría considerarse como un efecto de la intervención nutricia. Otro grupo de diferencias entre los grupos de estudio en la evaluación a las 12 semanas fue un mayor valor de amonio el cual probablemente traduzca el mayor aporte de proteínas en el grupo enteral. Aunque los valores de las pruebas de función hepática gama glutamiltransferasa y fosfatasa alcalina se encontraron más altos en el grupo control con diferencia estadística al compararlos con el grupo de intervención –lo que establece una probabilidad alta de que esta diferencia no se deba al azar- se ubicaron dentro de los valores habituales de este tipo de pacientes y tampoco se consideraron de trascendencia clínica. 67 CONCLUSIONES 1. Se demostró la eficacia de la intervención nutricia para mantener el crecimiento longitudinal y de la circunferencia cefálica durante el periodo de alimentación enteral. 2. Se demostró la eficacia de la intervención nutricia para incrementar la reserva de grasa estimada por los indicadores de adiposidad del brazo. 3. Se identificó la tendencia a mantener la masa muscular estimada por el área muscular del brazo en el grupo de intervención nutricia. 4. El indicador peso para la talla se mantuvo entre los límites de normalidad a lo largo del estudio y la comparación entre y dentro de los grupos de estudio no identificó diferencias relacionadas a la intervención nutricia. 5. La mayor frecuencia de infecciones respiratorias, diarrea y distensión abdominal, se consideraron efectos adversos, atribuibles a la intervención nutricia. 6. Los valores de hemoglobina y amonio mayores al final del ensayo en el grupo enteral se pueden atribuir a la intervención nutricia. Las diferencias en niveles de gama glutamil-transferasa, fosfatasa alcalina y cuenta de leucocitos, mayores en el grupo oral se consideraron sin trascendencia clínica. 68 PERSPECTIVAS 1. La perspectiva más trascendente de un trabajo en el que se demostró que es posible modificar la historia natural del crecimiento longitudinal, del crecimiento del sistema nervioso central y de la composición corporal en lactantes con la enfermedad hepática más grave posible en niños, sería demostrar si es posible modificar la talla final y el desarrollo neurológico a través de estudios longitudinales a mediano y a largo plazo. 2. El desconocimiento del efecto de la intervención nutricia en lactantes con AVB sobre el estado nutricio de vitaminas y nutrimentos inorgánicos en nuestro medio abre la posibilidad de realizar nuevos estudios de evaluación específica de estos micronutrimentos con técnicas diferentes a la antropometría. 3. En nuestro medio el período habitualmente prolongado entre la indicación del trasplante hepático y su realización, plantearía un ensayo clínico de mediano plazo que compare la intervención nutricia enteral con el manejo convencional por vía oral considerando como variables de desenlace el éxito del procedimiento quirúrgico y a las condiciones de crecimiento y desarrollo post-trasplante. 69 BIBLIOGRAFIA 1. Baker JP, Detsky AS, Wesson DE, Wolman SL, Stewart S, Whitewell J, Langer B. Nutritional assesment. N Engl J Med. 1982; 306:969-70. 2. Kelly DA. Nutrition and growth in patients with chronic liver disease. Indian J Pediatr. 1995; 62:533-44. 3. Pawłowska J, Socha P, Socha J. Nutrition in pediatric patients before liver transplantation. Rocz Panstw Zakl Hig. 2007; 58:111-8. 4. Hurtado-López E, Larrosa- Haro A, Vásquez-Garibay Edgar M, MacíasRosales R, Troyo- Sanromán R, Bojórquez-Ramos MC. Liver function test results predict nutritional status evaluated by arm anthropometric indicators. J Pediatr Gastroenterol Nutr. 2007; 45:451-7. 5. Klooster MJ, Gregg DJ, Darrel MK, Heubi JE, Suchy FJ, Balisteri WE. Characterization of nutritional status in children with chronic liver disease. Pediatr Res. 1986; 20:24-8. 6. Pierro A, Koletzko B, Carnielli V, Superina RA, Roberts EA, Filler RM, Smith J, Heim T. Resting energy expenditure is increased in infants and children with extrahepatic biliary atresia. J Pediatr Surg. 1989; 24:534. 7. Weisdorf SA, Freese DK, Fath JJ, Tsai MY, Cerra FB. Amino acid abnormalities in infants with extrahepatic biliary atresia and cirrhosis. J Pediatr Gastroenterol Nutr. 1987; 6: 860-4. 8. Vegnente A, Guida S, Di Costanzo, Fusco C, Iorio R, Toscano P. Nutitional status and growth in children with chronic hepatitis B. J Pediatr Gastroenterol Nutr. 1992; 14: 123-7. 9. Sokol RJ, Stall C. Anthropometric evaluation of children with chronic liver disease. Am J Clin Nutr. 1990; 52: 203-8. 10. Porayko MK, DiCecco S, O'Keefe SJ. Impact of malnutrition and its therapy on liver transplantation. Semin Liver Dis. 1991; 11:305-10 11. Weber A, Roy CC. The malabsorption associated with chronic liver disease in children. Pediatrics. 1972;50:73-8 70 12. Ramaccioni V, Soriano HE, Arumugam R, Klish WJ. Nutritional aspects of chronic liver disease and liver transplantation in children. J Pediatr Gastroenterol Nutr. 2000; 30: 361-7. 13. Roggero P, Cataliotti E, Ulla L, Stuflesser S, Nebbia G, Bracaloni D, et al . Factors influencing malnutrition in children waiting for liver transplants. Am J Clin Nutr. 1997; 65: 1852-7. 14. Malatack J, Schaid DJ, Urbach AH, Gartner JC, Zitelli BJ, Rockette H, et al. Choosing a pediatric recipient for orthotopic liver transplantation. J Pediatr. 1987; 111: 479-89. 15. Suchy FJ, Sokol R, Balistreri WF. Liver disease in children. 2nd edition Philadelphia: Lippincott Williams and Wilkins 2001: p. 89; 95-96; 157-63; 209-24. 16. Kelly DA. Diseases of the liver and biliary system in children. Oxford: Blacwell Science; 1999. p. 4-8; 97-121; 187-98. 17. United Network for Organ Sharing. [Home page on the internet]. Available from http://www.unos.org/resources/MeldPeldCalculator.asp?index=99 18. Protheroe SM. Feeding the child with chronic liver disease. Nutrition. 1998;14:796-800. 19. Campillo B, Richardet JP, Scherman E, Bories PN. Evaluation of nutritional practice in hospitalized cirrhotic patients: results of a prospective study. Nutrition. 2003:19:515-21. 20. DeRusso PA, Ye W, Shepherd R, Haber BA, Shneider BL, Whitington PF, et al. Growth failure and outcomes in infants with biliary atresia: a report from the Biliary Atresia Research Consortium. Hepatology. 2007; 46:1632-8. 21. Macías- Rosales R, Vásquez- Garibay E,Larrosa-Haro A, Rojo Chávez M, Bernal- Virgen A, Romo- Rubio H. Secondary malnutrition and overweight in a pediatric referral hospital: associated factors J Pediatr Gastroenterol Nutr.2009;48;226-32. 22. Larrosa-Haro, Macías-Rosales R, Hurtado-López E, Cámara López ME, Rodríguez -Anguiano K, Luna-Pech A. Secondary malnutrition in GI and 71 Nutrition department of a pediatric referral hospital J Pediatr Gastroenterol Nutr. 2006.; 43 Suppl: E 61. 23. Larrosa-Haro A, Bonal-Pérez MA, Rodríguez-Álvarez TH, Martínez-Puente EO, Zavala-Ocampo J, Vázquez-Camacho G. Atresia de vías biliares: Estudio prospectivo de manejo con nutrición enteral con una fórmula semielemental con triglicéridos de cadena media. Rev Gastroenterol Mex. 1996; 61:39. 24. Cywes C. Assessment of the nutritional status of infants and children with biliary atresia. S Afr Med J. 1990;77:131-5 25. Shepherd RW, Chin SE, Cleghorn GJ, Patrick M, Ong TH, Lynch SV, et al. Malnutrition in children with chronic liver disease accepted for liver transplantation: clinical profile and effect on outcome.J Paediatr Child Health.1991; 27:295-9. 26. Chin SE, Shepherd RW, Cleghorn GJ, Patrick M, Ong TH, Wilcox J, et al. Pre-operative nutritional support in children with end-stage liver disease accepted for liver transplantation: an approach to management. J Gastroenterol Hepatol. 1990 5:566-72. 27. Chin SE. The nature of malnutrition in children with end-stage liver disease awaiting orthotopic liver transplantation. Am J Clin Nutr. 1992; 56:164-8. 28. Moreno LA. Improvement of nutritional status in cholestatic children with supplemental nocturnal enteral nutrition. J Pediatr Gastroenterol Nutr 1991; 12: 213-6. 29. Charlton CP, Buchanan E, Holden CE, Preece MA, Green A, Booth IW, et al. Intensive enteral feeding in advanced cirrhosis: reversal of malnutrition without precipitation of hepatic encephalopathy. Arch Dis Child. 1992; 67:603-7. 30. Sokol RJ, Shepherd RW, Superina R, Bezerra JA, Robuck P, Hoofnagle JH. Screening and outcomes in biliary atresia: summary of a National Institutes of Health workshop. Hepatology. 2007; 46:566-81. 31. Petersen C. Pathogenesis and treatment opportunities for biliary atresia. Clin Liver Dis. 2006 ; 10:73-88. 72 32. Mack CL. The pathogenesis of biliary atresia: evidence for a virus-induced autoimmune disease. Semin Liver Dis. 2007; 27:233-42. 33. The NS, Honein MA, Caton AR, Moore CA, Siega-Riz AM, Druschel CM; National Birth Defects Prevention Study. Risk factors for isolated biliary atresia, National Birth Defects Prevention Study, 1997-2002. Am J Med Genet A. 2007 ; 143:2274-84. 34. Davit-Spraul A, Baussan C, Hermeziu B, Bernard O, Jacquemin E. CFC1 gene involvement in biliary atresia with polysplenia syndrome. J Pediatr Gastroenterol Nur.2008; 46: 111-2. 35. Larrosa-Haro A, Caro-López AM, Coello-Ramírez P, Zavala-Ocampo J, Vázquez-Camacho G. Duodenal tube test in the diagnosis of biliary atresia. J Pediatr Gastroenterol Nutr. 2001; 32:311-5. 36. Meisheri IV, Kasat LS, Kumar ABahety G, Sawant V, Kothari P. Duodenal intubation and test for bile: a reliable method to rule out biliary atresia. Pediatr Surg Int. 2002 ; 18:392-5. 37. Esmaili J, Izadyar S Karegar I, Gholamrezanezhad A. Biliary atresia in infants with prolonged cholestatic jaundice: diagnostic accuracy of hepatobiliry scintigraphy. Abdom Imaging. 2007; 32:243-7. 38. Humphrey TM, Stringer MD. Biliary atresia: US diagnosis. Radiology. 2007 244:845-51. 39. Norton KI, Glass RB, Kogan D, Lee JS, Emre S, Shneider BL. MR cholangiography in the evaluation of neonatal cholestasis: initial results. Radiology. 2002; 222:687-91. 40. Takaya J, Nakano S, Imai Y, Fujii Y, Kaneko K. Usefulness of magnetic resonance cholangiopancreatography in biliary structures in infants: a fourcase report. Eur J Pediatr. 2007; 166:211-4. 41. Meyers RL, Book LS, O'Gorman MA, White KW, Jaffe RB, Feola PG, et al. Percutaneous cholecysto-cholangiography in the diagnosis of obstructive jaundice in infants. J Pediatr Surg. 2004; 39:16-8. 73 42. Fitoz S, Edren A, Boruban S.Magnetic resonance cholagiopacreatography of biliary system abnormalities in children. Clin Imaging.2007; 31:93-101-5. 43. Avni FE, Segers V, De Maertelaer V, Cadranel S, Dassonville M, Delaet MH,et al. The evaluation by magnetic resonance imaging of hepatic periportal fibrosis in infants with neonatal cholestasis: preliminary report.J Pediatr Surg. 2002; 37:1128-33. 44. Ahmad M, Afzal S, Roshan E, Mubarik A, Bano S, Khan SA, et al. Usefulness of needle biopsy in the diagnosis of paediatric liver disorders. J Pak Med Assoc. 2005; 55:24-8. 45. Aktas S, Diniz G, Ortac R. Quantitative analysis of ductus proliferation, proliferative activity, Kupffer cell proliferation and angiogenesis in differential diagnosis of biliary atresia and neonatal hepatitis. Hepatogastroenterology. 2003; 50:1811-3. 46. Takahashi A, Masuda N, Suzuki M, Shimura T, Nomoto K, Suzuki N, et al. Evidence for segmental bile drainage by hepatic portoenterostomy for biliary atresia: Cholangiographic, hepatic venographic, and histologic evaluation of the liver taken at liver transplantation. J Pediatr Surg. 2004 39:1-5. 47. Nayak NC, Vasdev N. Neonatal cholestasis syndrome: identifying the disease from biopsy.IndianPediatr. 2002; 39:421-5. 48. Guideline for the Recommendation Evaluation of the of North Cholestatic American Jaundice Society in for Infants: Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2004; 39: 115-28. 49. Davenport M, Ure BM, Petersen C, Kobayashi H Surgery for biliary atresia is there a European consensus? Eur J Pediatr Surg. 2007; 17180-3. 50. Davenport M, Stringer MD, Tizzard SA, McClean P, Mieli-Vergani GHadzic N. Randomized, double-blind, placebo-controlled trial of corticosteroids,after Kasai portoenterostomy for biliary atresia. Hepatology. 2007; 46:1821-7. 51. Shimadera S, Iwai N, Deguchi E, Kimura O, Fumino S, Ono S The significance of steroid therapy after hepatoportoenterostomy in infants with biliary atresia. Eur J Pediatr Surg. 2007 ;17:100-3 74 52. Aspelund G, Ling SC, Ng V, Kim PC. A role for laparoscopic approach in the treatment of biliary atresia and choledochal cysts. J Pediatr Surg. 2007; 42:869-72. 53. Dutta S, Woo R, Albanese CTMinimal access portoenterostomy: advantages and disadvantages of standard laparoscopic and robotic techniques.J Laparoendosc. Adv Surg Tech A.2007;17:258-64 54. Gupta DK, Sharma S, Venugopal P, Kumar L, Mohanty S, Dattagupta S. Stem cells as a therapeutic modality in pediatric malformations.Transplant Proc. 2007; 39:700-2. 55. Kelly DA, Davenport M . Current management of biliary atresia. Arch Dis Child. 2007: 92;1132-5. 56. Kaufman SS, Murray ND, Wood RP, Shaw BW Jr., Venderhoof JA. Nutritional support of the infant with extrahepatic biliary atresia. J Pediatr. 1987; 110: 679-86. 57. Weber A, Roy CC. The malabsorción associated with chronic liver disease in children. Pediatrics. 1972:50;73-83. 58. Cohen MI, Gartner LM. The use of medium-chain triglycerides in the management of biliary atresia. J Pediatr 1971: 79; 378-84. 59. Marchesini G, Bianchi G, Rossi B, Brizi M, Melchionda N. Nutritional treatment with branched-chain amino acids in advanced liver cirrhosis. J Gastroenterol. 2000;35 Suppl 12:7-12 60. Mager DR, Wykes LJ, Roberts EA, Ball RO, Pencharz PB Branched-chain amino acid needs in children with mild-to-moderate chronic cholestatic liver disease. J Nutr. 2006 ;136:133-9 61. Utterson, Ross W, Shepherd R, Sokol R, Bucuvalas G, Magee A, et al and the SPLIT Research Group. Biliary atresia: Clinical profiles risk factors,and outcome of 755 patients listed for a liver transplantation. J Pediatr. 2005;147:180-5 62. Wildhaber BE, Coran AG, Drongowski RA, Hirschl RB, Geiger JD, Lelli JL, et al. The Kasai portoenterostomy of a 27-year experience with 81 patients. J Pediatr Surg, 2003:38:1480-5. 75 63. Hadzic N, Davenport M, Tizzard S, Singer J, Howard ER, Mieli- ergani G. Long –term survival Following Kasai portoenterostomy: is chronic liver disease inevitable? J Pediatr Gastroenterol Nutr. 2003; 37:430-3. 64. Subramaniam R, Doig CM, Bowen J, Bruce J. Initial response to portoenterostomy determines long-term outcome in patients with biliary atresia . J Pediatr Surg. 2000;35:593-7. 65. Ohhama Y, Shinkai M, Fujita S, Nishi T, Yamamoto H. Early prediction of long-term survival and the timing after the operation. J Pediatr Surg. 2000; 35:1031-34. 66. Shneider BL, Brown MB, Haber B, Whitington PF, Schwarz K, Squires R et al. A multicenter study of the outcome of biliary atresia in the United States, 1997 to 2000.J Pediatr. 2006; 148:467-74. 67. Sokol RJ, Mack D, Narkewicz MR, Karrer FM. Pathogenesis and outcome of biliary atresia: Current conceps. J Pediatr Gastroenterol Nutr. 2003; 37:4-21. 68. Greer R, Lehnert M, Lewindon P, Cleghorn GJ, Shepherd RW. Body composition and components of energy expenditure in children with endstage liver disease. J Pediatr Gastroenterol Nutr. 2003; 36:358-63. 69. Macías-Rosales R, Larrosa-Haro A, Bojórquez-Ramos MC. Value of arm anthropometric indexes in the diagnosis of the nutritional status on infants with biliary atresia (BA) and end-stage liver disease awaiting for a liver transplant. J Pediatr Gastroenterol Nutr. 2004;39 (Suppl 1):S-198 70. Jeyaseelan L, Rao PSS. Methods of determining sample sizes in clinical trials. Indian Ped. 1989; 26:115-21. 71. Celis de la Rosa, A. Bioestadística. México D.F. Editorial El Manual Moderno ,S.A de C.V,2004:51. 72. Díaz B Erik. Nuevos requerimientos de energía Comité de expertos FAO/OMS/UNU 2004.Rev Chil Pediatr. 2006; 77:285-9. 73. American Academy of Pediatrics. Pediatric Nutrition Hand Book 5ta Edition. USA: American Academy of Pediatrics.2004. 76 74. Fomon SJ, Nelson SE. Size and growth. En: Fomon SJ, editor. Nutrition of normal infants. St Louis: Mosby Year Book, Inc.; 1993. p. 36-83. 75. Fomon SJ. Crecimiento normal desmedro y obesidad En: Fomon SJ, editor. Nutrición infantil. México D.F: ed Interamericana; 1976. p 32-89.. 76. Sann L, Durand M, Picard J, Lasne Y, Bethenod M. Arm and muscle areas in infancy. Arch Dis Child. 1988; 63:256-60. 77. Fernández Fonseca BA. Ingestión de energía, macronutrimentos, nutrimentos inorgánicos y vitaminas en niños menores de 24 meses con enfermedad hepática crónica atendidos en la UMAE Hospital de Pediatría del Centro Médico Nacional de Occidente.(Tesis recepcional Maestría en Nutricion Humana) Universidad de Guadalajara, Guadalajara. 2008. 78. Hurtado López EF. Predicción de la composición corporal evaluada por absorciometría de doble fotón a partir de indicadores antropométricos en niños con enfermedad hepática crónica. XII Curso de Nutrición Infantil. Hospital Civil de Guadalajara Dr. Juan I Menchaca y Universidad de Guadalajara. Guadalajara. Septiembre de 2009. 79. Stewart SM, Uauy R, Waller DA, Kennard BD, Andrews WS. Mental and motor development correlates in patients with end-stage biliary atresia awaiting liver transplantation. Pediatrics. 1987 ;79:882-8 80. van Mourik ID, Beath SV, Brook GA, Cash AJ, Mayer AD, Buckels JA, Kelly DA. Long-term nutritional and neurodevelopmental outcome of liver transplantation in infants aged less than 12 months. J Pediatr Gastroenterol Nutr. 2000; 30:269-75. 81. Sullivan EL, Grove KL. Metabolic imprinting in obesity. Forum Nutr. 2009; 63:186-194. 77 ANEXO 1. Calculo del tamaño de la muestra de acuerdo a la fórmula para ensayos clínicos (68) n= 2 [(Zα - Z 1-β) (σ)] 2 δ Zα = (1.96) , β = 0.8 con poder de Z1-β = -0.842. En donde: Zα = 1.96 Z1-β = -0.842 σ = 0.77 δ = -1.19 n= 2 [(1.96 - (-0.842) (0.77)] 2 -1.19 1.96 + 0.842= 2.8 x 0.77= 2.156 /-1.19 = -1.811 x-1.811 = 3.28 x 2 = 6.5 n= 6.5 (7) por grupo 78 ANEXO 2. Variables socio-demográficas Variables Tipo de variable Escala Grupo etario Cuantitativa Razón Unidad de medición Meses Estadístico y análisis estadístico Definición operacional Mediana, Rango intercuartílico, U de Mann-Withney Frecuencias, porcentajes, Exacta de Fisher Mediana, Rango intercuartílico, U de Mann-Withney Mediana, Rango intercuartílico, U de Mann-Withney Frecuencias, porcentajes, Exacta de Fisher Frecuencias, porcentajes, Exacta de Fisher Lactantes Número de Cuantitativa Razón Número de miembros de miembros la familia Estado civil Cualitativa Nominal Condición de estado civil Mediana, Rango intercuartílico, U de Mann-Withney Frecuencias, porcentajes, Exacta de Fisher Número de miembros Tipo de familia Frecuencias, porcentajes, Exacta de Fisher Sexo o género Cualitativa Edad del padre Cuantitativa Razón Años Edad de la madre Cuantitativa Razón Años Ocupación del padre Cualitativa Ocupación de la madre Cualitativa Cualitativa Nominal Fenotipo Nominal Ocupación Nominal Ocupación Nominal Condición de la familia Sexo femenino Sexo masculino Edad en años Edad en años * * Civil, religioso, civil y religioso, unión libre, separado, divorciado, madre o padre soltero, otros. Nuclear, extensa, compuesta, otras. 79 * CLASIFICACION MEXICANA DE OCUPACIONES (INEGI) 0) 1) 2) 3) 4) 5) 6) 7) 8) 9) 10) 11) 12) 13) 14) 15) 16) 17) 18) 19) Profesionistas Técnicos Trabajadores de la educación Trabajadores del arte, espectáculos y deportes Funcionarios y directivos de los sectores público, privado y social Trabajadores en actividades agrícolas, ganaderas, de caza y pesca Jefes, supervisores y otros trabajadores de control en la fabricación artesanal e industrial y en actividades de reparación y mantenimiento Artesanos y trabajadores fabriles en la industria de la transformación y trabajadores en actividades de reparación y mantenimiento (obreros) Operadores de maquinaria fija de movimiento continuo y equipos en el proceso de fabricación industrial (obreros calificados) Ayudantes, peones y similares en el proceso de fabricación artesanal e industrial y en actividades de reparación y mantenimiento Conductores y ayudantes de conductores de maquinaria móvil y medios de transporte (choferes) Jefes de departamento, coordinadores y supervisores en actividades administrativas y de servicios Trabajadores de apoyo en actividades administrativas (empleado de oficina) Comerciantes, empleados de comercio y agentes de ventas Vendedores ambulantes y trabajadores ambulantes en servicios Trabajadores en servicios personales Trabajadores en servicios domésticos Trabajadores en servicios de protección, vigilancia y fuerzas armadas Otros trabajadores con ocupaciones no especificadas Ama (o) de casa 80 ANEXO 3. Variables hematológicas, bioquímicas y clínicas. Variables hematológicas: Tipo Escala de medición Unidad de medición Estadístico y análisis estadístico. Definición operacional Cuantitativa De razón g/dl Mediana, Rango intercuartílico, U de MannWhitney g/dl Variable Hemoglobina TP Segundos Segundos TPT Segundos Leucocitos Miles/µl Plaquetas Miles/µl miles/µl VSG Mm Mm PCR Mg/L Mg/L Glucosa mg/dl mg/dl Urea mg/dl mg/dl Creatinina mg/dl mg/dl Segundos miles/µl Hemoglobina: Hb: Pigmento rojo de la sangre y sus variantes:HbA1 que se encuentra dentro de los hematíes principalmente en los eritroblastos y reticulocitos constituye hat un 98% de la hemoglobina total y la HbA2 hemoglobina fetal, Tiempo de protrombina: (TP) es el lapso que tarda en formarse el coágulo después que se agrega protrombina tisular reactiva y calcio al plasma citratado. Se utiliza para vigilar la respuesta al tratamiento con warfarina o para detectar disfunción del sistema extrínseco a causa de enfermedad hepática ó deficiencia de vitamina K Tiempo parcial de tromboplastina:(TPT) Es la cantidad de tiempo que le toma coagular al plasma recalcificado y citratado después de que se agrega tromboplastina. Este es anormal en 90% de los trastornos de la coagulación y detecta deficiencias e inhibidores de todos los factores, excepto el VII y XIII. Por lo general se utiliza para vigilar la eficacia del tratamiento con heparina y para detectar trastornos de la coagulación. Leucocitos: Término colectivo para las células blancas de la sangre. Plaquetas: Pequeños corpúsculos sanguíneos procedentes de los megacariocitos de la medula ósea Velocidad de sedimentación globular: ((VSG) Determinación de la velocidad de sedimentación de los glóbulos sanguíneos en una muestra de sangre. Proteína C reactiva (PCR): Proteína de fase aguda que en presencia de iones calcio reacciona con el polisacárido C y provoca precipitación. Su concentración suele guardar relación con VSG , se incrementa su formación en la mayoría de las enfermedades inflamatorias y neoplásicas. Glucosa : Fuente primordial de energía, monosacárido, que en la naturaleza se encuentra como polvo cristalino, soluble en agua, e incoloro C6H12O6 Urea: Diamida, del ácido carbónico, producto final, incoloro, inodoro cristalizable y soluble en agua del metabolismo proteíco en el hombre y mamífero formada por dos moléculas de NH3. Se elimina a través de los riñones. Creatinina: Producto metabólico que se elimina con la orina y que se forma de manera irreversible como anhídrido de creatinina. 81 Variables Bioquímicas. Pruebas funcionales hepáticas. Tipo Variable Bilirrubinas Cuantitativa Escala de Unidad de medición medición De razón mg/dl Estadístico Definición operacional Mediana, Rango intercuartílico, U de MannWhitney mg/dl ALT U/l U/l AST U/l GGT U/l FA U/l U/l Albúmina g/dl g/dl Colesterol mg/dl mg/dl Triglicéridos mg/dl mg/dl Amonio umol/L umol/L U/l U/l Bilirrubinas: Es un pigmento biliar pardo-amarillento que resulta del desdoblamiento de la hemoglobina Alaninotranferasa (ALT): Es una enzima que se produce primordialmente en el hígado y se encuentra en ciertos líquidos corporales (bilis, líquido cefalorraquídeo, plasma y saliva). Esta enzima se utiliza para evaluar lesiones hepáticas en las que los valores pueden elevarse hasta 50 veces de los límites normales Aspartatoamino transferasa (AST): Esta es una enzima que se produce en varios tejidos como el corazón el riñón páncreas y en pocas cantidades en el hígado por lo que no es muy específica para daño hepático Gamaglutamiltranferasa.: (GGT) es una enzima microsomal que se encuentra en los ductos biliares, en los hepatocitos y en algunos otros tejidos como el cerebro, bazo y en el intestino delgado. Aunque se encuentra en otros tejidos se considera un indicador sensible para enfermedad hepatobiliar Fosftasa alcalina Es una enzima que se encuentra en el hueso, hígado, intestino y placenta. Se eleva durante periodos de crecimiento óseo, enfermedad hepática y obstrucción de vías biliares Albumina Es una de las dos principales fracciones proteicas del suero. Su función consiste en mantener la presión oncótica y el transporte de bilirrubina, ácidos grasos, medicamentos, hormonas y otras sustancias insolubles en agua. Se sintetiza en el retículo endoplásmico rugoso del hepatocito a razón de 150mg/kg/día con una vida media de 20 días. La hipoalbuminemia es un signo frecuente de enfermedad hepática crónica ( Colesterol: Compuesto lípidico que se encuentra en forma ibre y en forma de esteres de colesterol , en todo el organismo humano. Consituye la etapa previa a la sistesis de acidos biliares y e las hormonas esteroideas. Es un costituyente esencial de la membrana celular, y de la la vaina de mielina. Triglicéridos: Subclase de grasa neutras en las cuales el glicerol se halla esterificado, con tres moléculas de ácidos grasos, Amonio: Ion que se forma como resultado de la disolución del amoniaco, en agua. 82 Definición operacional de variables clínicas Ictericia: Coloración amarillenta de la piel y mucosas por el trasvase de colorantes biliares de la sangre hacia los tejidos corporales Hepatomegalia. Aumento agudo a crónico del tamaño del hígado. Esplenomegalia: Aumento agudo o crónico del tamaño del bazo. Ascitis: Acumulación de líquido seroso claro, generalmente como trasudado peritoneal, en la cavidad peritoneal que normalmente es capilar, a consecuencia de congestión cardiaca, y/o portal. Red venosa colateral: Trama de vasos sanguíneos (venas) generalmente en tórax y abdomen. Palmas hepáticas: Hipotrofia de la región tenar e hipotenar. Telangectasias: Dilatación de vasos terminales (arteriolas, ramas capilares, arteriales y venosas) en sentido estricto de los vasos cutáneos, sobre todo en la cara y se caracteriza por una finísima trama vascular simétrica en las mejillas. Varices esofágicas: Dilataciones permanentes en el esófago, de un vaso en forma de huso de saco, de columna o de nódulo, normalmente a causa de insuficiencia de la pared o de las válvulas venosas. Biopsia de hígado: Análisis microscópico de una muestra de tejido hepático extraído del organismo con ayuda de un instrumento adecuado. PELD Clasificación para pacientes con enfermedad hepática en espera de trasplante hepático indica en forma numérica magnitud del daño hepático Malatack: Clasificación para evaluar el daño hepático que incluye cifras de colesterol> 100, bilirrubina indirecta >6, Billirrubina directa > 6 Tiempo parcial de tromboplastina y ascitis puntuación mayor de 40 puntos indica alto riesgo. 83 ANEXO 4. Contenido de energía, macronutrimentos, vitaminas y nutrimentos inorgánicos de la fórmula de hidrolizados que se va a utilizar. COMPOSICIÓN MEDIA Contenido nutrimental Contenido energético Lípidos del cual: Ácido linoleico* Hidrolizado de proteínas Equivalente proteico (N x 6.38) Agua fijada Hidratos de carbono de los cuales: Maltodextrina Almidón de papa Lactosa (máx.) Minerales (cenizas) Sodio Potasio Cloro Calcio Fósforo Magnesio Humedad Vitamina A Vitamina D Vitamina E Vitamina K1 Vitamina C Tiamina (B1) Riboflavina (B2) Niacina Vitamina B6 Ácido fólico Ácido pantoténico Vitamina B12 Biotina Colina Inositol Taurina Carnitina Hierro Yodo Cobre Zinc Manganeso Unidad Por 100 kcal Por 100 g Utilizables de polvo kcal/(kJ) g g g g g g 100 (424) 4.9 0.5 3.7 3.3 0.3 10.5 g g g g Mg Mg Mg Mg Mg Mg G U.I. mcg ER U.I. Mcg U.I. Mcg Mg Mg Mg Mg Mg Mcg Mg Mcg Mcg Mg Mg Mg Mg Mg Mcg Mg Mg Mcg 9.1 1.2 0.1 0.6 59 122 102 81 51 12 0.6 286 87 59 1.4 1.1 7 7 0.05 0.13 0.7 0.07 8 0.4 0.2 2 7 4 7 2.8 1.1 4 0.05 0.7 6 Por litro de fórmula diluida a: 650 kcal/l* 720 kcal/l** 489 (2,071) 24.0 2.8 18.2 16.5 1.7 51.7 660 (2,796) 32.4 3.7 24.5 22.2 2.2 69.7 733 (3,107) 36.0 4.2 27.3 24.7 2.5 77.5 44.8 6.0 0.9 3.1 290 600 500 400 250 60 3.0 1,400 430 290 7.2 5.8 39 38 0.29 0.65 3.6 0.36 43 2.2 1.1 11 36 22 38 14.0 5.8 24 0.29 3.6 34 60.4 8.1 1.2 4.18 391 810 675 540 337 81 904.0 1,890 580 391 9 7.8 52 51 0.39 0.8 4.8 0.48 58 2.9 1.4 14 48 29 51 18 7 32 0.39 4.8 45 67.2 9.0 1.3 4.65 435 900 750 600 375 90 904.5 2,100 645 435 10 8.7 58 57 0.43 0.9 5.4 0.54 64 3.3 1.6 16 54 33 57 21 8 36 0.4 5 51 * Preparado con 135 g de polvo y 900 ml de agua.** Preparado con 150 g de polvo y 900 ml de agua. 84 ANEXO 5. Ecuaciones de composición corporal. Ecuación 1 ATB = (Cb)2 (4 x π) Donde: ATB = Área total del brazo Cb= Circunferencia del brazo π = 3.1416 Ecuación 2 AMB = [(Cb-Pct x π ) ] 2 / (4 x π ) Donde: AMB = Área muscular del brazo Pct = Pliegue tricipital Ecuación 3 AGB = (Cb)2 (4 x π ) – AMB ATB- AMB Donde : AGB = Área grasa del brazo. IGB = AGB / ATB x 100 Donde : IGB =Índice de grasa del brazo. 85 ANEXO 6. Hoja de colección de datos Datos generales Nombre Número de afiliación Fecha de llenado Clínica de adscripción y hora de ingreso Sexo Fecha de nacimiento Edad Dirección Ciudad y Estado donde vive Teléfono de casa Teléfono celular Femenino Masculino Variables bioquímicas (30) días BHC Hb Mononucleares Leucocitos PCR VSG TP TPT NeutrófilosTotales Plaquetas Glucosa Creatinina Urea Proteínas totales Albúmina Relación AG TGO TGP GGT Bilirrubinas FA Colesterol y triglicéridos Amonio 86 Variables bioquímicas (90) días BHC Hb Mononucleares Leucocitos PCR VSG TP TPT NeutrófilosTotales Plaquetas Glucosa Creatinina Urea Proteínas totales Albúmina Relación AG TGO TGP GGT Bilirrubinas FA Colesterol y triglicéridos Amonio 87 Datos socio-demográficos Edad del padre ( años) Edad de la madre ( años) Escolaridad del padre ( a) analfabeta b) primaria Número de hijos ( c) 31-45 d) > 45 años a) <20 b) 20-30 c) 31-45 d) > 45 años c) secundaria c) preparatoria d) carrera técnica e) profesional Escolaridad de la madre ( años) c) secundaria c) preparatoria d) carrera técnica e) profesional ( Ocupación de la madre b) 20-30 años) a) analfabeta b) primaria Ocupación del padre a) < 20 ) Según INEGI ( ) INEGI ) a) <2 b) 2-4 c) >4 Estado civil del padre a) soltero b) casado c) divorciado d) unión libre e) separado f) otro Estado civil de la madre a) soltera b) casada c) divorciada d) unión libre e) separada f) otro Tipo de familia a) nuclear d) compuesta Años de casados a) < 1 Ingreso familiar mensual b) monoparental b) 1-5 ( c) extensa c) 6-10 d) > 10 ) 88 Variables antropométricas Medición 0 15 30 45 60 75 90 Peso (g) Longitud (cm) CC ZCC/e Z t/e Zp/t CMB ZCMB PCT Z PCT ATB ZATB AMB ZAMB AGB ZAGB IGB ZIGB 89 Nutrición enteral (efectos adversos) Día Volumen Gramos (polvo) Calorías Miel Aceite Proteínas Vómitos Distensión Rinitis Otitis Diarrea Polvo 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 90 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 Nutrición a libre demanda vía oral (efectos adversos) Día Volumen Gramos (polvo) Calorías Miel Aceite Proteínas Vómitos Distensión Rinitis Otitis Diarrea Polvo 1 2 3 4 5 6 7 8 9 10 11 12 13 14 91 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 92 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 93 ANEXO 7. CARTA DE CONSENTIMIENTO INFORMADO PARA PARTICIPACIÓN EN PROYECTOS DE INVESTIGACION CLINICA Lugar y Fecha: ____________________________________________________ Por medio de la presente autorizo a que mi hijo(a) _________________________ ________________________________________________________________ participe en el proyecto de Investigación titulado: “Eficacia de la alimentación enteral con una fórmula con triglicéridos de cadena media en la prevención de desnutrición en lactantes con atresia de vías de biliares”,registrado en el Comité Local de Investigación en Salud con el número R-2008-1302-17. El objetivo de este estudio es: Comprar la utilidad de una fórmula que contiene grasas de fácil absorción (triglicéridos de cadena media) administrada con biberón en la cantidad que su hijo tome de acuerdo a su apetito o por medio de una sonda colocada en el estómago a través de su nariz (técnica de alimentación enteral) para prevenir que se presente desnutrición en los tres meses siguientes a su operación del hígado. Se me ha explicado que la participación de mi hijo (a) consistirá en que reciba una de estas 2 modalidades de tratamiento durante estos 3 meses. En caso de que reciba tratamiento recibiendo alimentación solo por biberón, una vez concluido 3 meses pasará si así lo requiere y si ustedes están de acuerdo a recibir alimentación por sonda colocada en el estomago a través de su nariz por el tiempo necesario. La forma de evaluar su nutrición será pesándolo(a) y realizando mediciones como la estatura, el tamaño de su cabeza y su brazo. Los exámenes de laboratorio con tomas de muestras de sangre que se realizarán en este período serán los que regularmente se realizan en niños con atresia de vías biliares como su hijo(a) por lo que este estudio no implica estudios especiales de sangre. Aunque con ambos tipos de tratamiento se espera prevenir en algún grado la desnutrición que suele ocurrir en estos niños es probable que aquellos en los que se coloque la sonda la prevención de la desnutrición sea mayor. La administración de la 94 fórmula especial ya sea con biberón o con sonda se realizará en su domicilio y se le solicitará registre en una libreta que se le proporcionará la cantidad de fórmula que haya recibido. En caso de que su hijo (a) se maneje con sonda puede presentar algunos efectos indeseables como escurrimiento nasal, dolor de oído con secreción a través del mismo y elevación de la temperatura. Las molestias por la sonda son mínimas y los niños se adaptan completamente a la misma en unos cuantos días. El investigador principal se ha comprometido a darme información oportuna sobre cualquier procedimiento alternativo adecuado que pudiera ser ventajoso para su tratamiento, así como a responder cualquier pregunta y aclarar dudas que le plantee la persona responsable del paciente acerca de los procedimientos que se llevaran a cabo, los riesgos, beneficios o cualquier otro asunto relacionado con la investigación o con su tratamiento. Entiendo que conservo el derecho de retirar a mi hijo(a) del estudio en cualquier momento en que lo considere conveniente, sin que ello afecte la atención médica que recibe del Instituto. El Investigador principal ha dado seguridades de que no se identificará a mi hijo(a) en las presentaciones o publicaciones que deriven de este estudio y de que los datos relacionados con su privacidad serán manejados en forma confidencial. También se ha comprometido ha proporcionarme la información actualizada que se obtenga durante el estudio, aunque ésta pudiera hacerme cambiar de parecer respecto a su permanencia en el mismo. Nombre dirección y firma de la madre __________________________________ Nombre dirección y firma del padre _____________________________________ 95 Nombre dirección y firma del tutor o representante legal ____________________ __________________________ Testigo __________________________ Testigo _____________________ Investigador responsable En caso de dudas o comentarios comunicarse con los responsables del proyecto Dra. Macías ℡ 36170060 Ext 31627 y 31628 y ℡ celular 044 333 1158941 o Dr. Larrosa ℡ 36170060 Ext 31627 y 31628 y℡ ℡ 044 333 6676260 96 ANEXO 8. Registro ensayos clínicos (WHO abril 2005). 1.-Número único de registro El ensayo clínico deberá tener un registro único (CLIS) 2.-Registro de datos del Los datos de registro deberán ser establecidos por el registro único(CLIS) ensayo 3.-Identificación secundaria Podrá ser asignada por los responsables del proyecto 4.-Fondos económicos IMSS, FIS, CONACYT 5.-Responsable principal M en C María del Carmen Rocío Macías Rosales 6.-Responsable secundario M en C María del Carmen Rocío Macías Rosales 7.- Persona Contacto M en C María del Carmen Rocío Macías Rosales 8.-Persona contacto en la investigación M en C María del Carmen Rocío Macías Rosales 9.-Titulo del estudio Eficacia de la alimentación enteral con una fórmula con triglicéridos de cadena media en la prevención de desnutrición en lactantes con atresia de vías de biliares. 10.-Titulo científico del estudio Eficacia de la alimentación enteral con una fórmula con triglicéridos de cadena media en la prevención de desnutrición en lactantes con atresia de vías de biliares. 11.-Aspectos éticos Se trata de un ensayo clínico y de acuerdo a la Ley General de Salud en Materia de Investigación para la Salud Titulo II, Capítulo I, Artículos 17y 23 (1997) el presente estudio se ubica en la categoría III y se establece que requiere ser evaluado por Comités de Investigación CLIS y requiere carta de consentimiento informado escrito (Anexo 7). 12.-Condición Pacientes con diagnóstico de atresia de vías biliares 13.-Intervención Alimentación enteral por sonda nasogástrica y vía oral a libre demanda. 14.-Criterios de inclusión y exclusión . Criterios de Inclusión Pacientes con diagnóstico quirúrgico de AVB. Edad de 3 a 6 meses. Uno u otro sexo. Con o sin porto-entero-anastomosis Consentimiento por los padres o tutores. Criterios de no Inclusión Enfermedades graves asociadas (malformaciones congénitas patología del SNC, cardiopatías, neumopatías agudas o crónicas, genopatías). Peso al nacimiento < 2500g. Sangrado de tubo digestivo Insuficiencia hepática Criterios de exclusión Decisión de los padres de retirar la paciente del estudio 15.-Tipo de estudio Ensayo clínico 97 16.-Datos anticipados del NO estudio 17.-Tamaño de la muestra 7 pacientes por grupo 18.-Reclutamiento de Pacientes de la clínica de hígado del Servicio de Gastroenterología UMAE Hospital de Pediatría pacientes 19.-Variables de desenlace principales 1. Dependiente. Estado nutricio evaluado por antropometría. Talla para la edad. Peso para la talla. Circunferencia media del brazo para la edad. Pliegue cutáneo tricipital para la edad. 2 .Independiente. Tipo de alimentación. Alimentación enteral. Alimentación oral a libre demanda vía oral. 20.-Variables de desenlace secundarias NO 98 ANEXO 9. Carta de autorización del proyecto de investigación por el Comité Local de Investigación 99 ANEXO 10. Variables socio-demográficas, clínicas, hematológicas y bioquímicas Variables socio-demográficas cuantitativas de los 15 pacientes estudiados y de sus familias. Variables Alimentación Oral (n=7) Alimentación enteral (n=8) p Mediana RIC Mediana RIC Edad del paciente 5.0 2 5.0 2.5 0.536 Edad de la madre 21.0 7 26.0 11.7 0.152 Edad del padre 23.0 7 28.0 12 0.397 Escolaridad de la 9.0 1 7.5 5.5 0.463 9.0 1 9.0 5 0.536 6,000.00 3,0000 6,750.00 3,3750 0.336 madre Escolaridad del padre Ingreso mensual Variables socio-demográficas cualitativas de los 15 pacientes estudiados y de sus familias. Comparación con prueba exacta de Fisher. Variables Sexo Pacientes Ocupación de la madre Ocupación del padre Estado civil Tipo de familia Femenino Masculino Técnico Empleada Doméstica Ama de casa Técnico Agricultor Obrero Chofer Empleado Comerciante Casado Unión libre Nuclear Extensa Alimentación oral (n=7) N % 5 71.4 2 28.6 0 0 0 0 0 0 7 100 1 14.3 0 0 4 57.1 1 14.3 1 14.3 0 0 4 51.1 3 48.9 5 71.4 2 28.6 Alimentación enteral (n=8) N % 5 62.5 3 37.5 1 12.5 1 12.5 1 12.5 5 62.5 1 12.5 1 12.5 4 50.0 0 0 0 0 2 25.0 5 62.5 3 37.5 6 75.0 2 25.0 p 0.573 0.350 0.434 0.622 0.661 100 VARIABLES CLÍNICAS Frecuencia y porcentaje de signos, síntomas, hallazgos de endoscopia y de biopsia hepática en 15 lactantes con atresia de vías biliares Comparación de frecuencias con prueba Exacta de Fisher. Variables Ictericia Hepatomegalia Esplenomegalia Ascitis Red venosa Palmas hepáticas Telangectasias Varices esofágicas Biopsia hepática Sí No Sí No Sí No Sí No Sí No Sí No Sí No Sí No Cirrosis Fibrosis Alimentación oral (n=7) N % 6 85.7 1 14.3 7 100 0 0 7 100 0 0 4 57.1 3 42.9 4 57.1 3 42.9 3 42.9 4 57.1 1 14.3 6 85.7 4 57.1 3 42.9 5 71.4 2 28.6 Alimentación enteral (n=8) N % 8 100 0 0 8 100 0 0 8 100 0 0 4 50 4 50 5 62.5 3 37.5 3 37.5 5 62.5 3 37.5 5 62.5 6 75 2 25 5 62.5 3 37.5 p 0.466 0.595 0.622 0.622 0.338 0.426 0.573 101 VARIABLES HEMATOLÓGICAS Y BIOQUÍMICAS Descriptivos solo datos iniciales variables hematológicas Variables Hb inicial Alimentación oral (n=7) Mediana RIC 10.7 2.4 Alimentación enteral (n=8) Mediana RIC 11.1 1.6 p 0.536 TP inicial 11.4 13 15.5 3.8 0.336 TPT inicial 39.7 13 40.7 19 0.779 Leucocitos inicial 16,600 15,200 12,650 18,137 0.955 Plaquetas inicial 349,000 440,000 274,000 108,250 0.397 VSG inicial 14.2 14.5 10.4 4.2 0.189 PCR inicial 5.6 6.8 5.4 6.5 0.955 Glucosa inicial 80 6 80.1 5.5 0.423 Urea inicial 10 3 11 5 0.567 Creatinina inicial 0.2 0.5 0.3 0.4 0.456 Comparación de variables bioquímicas al inicio del ensayo. Variables Alimentación oral (n=7) Alimentación enteral (n=8) p Mediana RIC Mediana RIC BD inicial 8.1 3.9 6.9 4.8 0.397 BI inicial 1.9 2 1.2 0.9 0.072 ALT inicial 215 158 166 187 0.694 AST inicial 379 228 255 277 0.694 GGT inicial 645 694 295 380 0.189 FA inicial 591 402 483 524 0.189 Albúmina inicial 3.3 0.6 3.2 0.2 0.613 Colesterol inicial 248 78 179 110 0.021 TGC inicial 190 62 124 47 0.001 Amonio inicial 54 56 59 86 0.94 BD: bilirrubina directa. BI: bilirrubina indirecta. ALT: aspartato alanino-transferasa. AST: aspartato amino-transferasa. GGT: gama glutami-transferasa. FA: fosfatasa alcalina. TGC: triglicéridos. 102 Anexo 11. Variables antropométricas con su medida de dispersión y comparación dentro de cada grupo y entre cada grupo. Longitud (cm) Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 59.0 7.5 59.6 8.0 60.0 9.0 60.2 7.8 60.8 7.0 61.1 6.1 61.5 5.2 Alimentación enteral n (8) Mediana RIC 58.8 2.2 59.3 1.1 60.0 1.3 60.4 1.1 60.8 0.9 61.2 2.2 61.6 2.9 p1 0.163 0.182 0.161 0.132 0.104 0.049 0.028 p2 Comparación dentro de cada grupo, alimentación oral p= < 0.001; alimentación enteral p=<0.001. Circunferencia cefálica (cm) Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 40.0 6.5 40.0 6.3 40.0 6.0 40.0 5.8 40.0 5.6 40.1 5.3 41.0 5.3 Alimentación enteral n (8) Mediana RIC 39.9 40.4 39.7 40.5 40.4 41.1 40.7 41.5 41.0 41.8 41.1 41.8 41.5 42.3 p1 0.728 0.772 0.352 0.324 0.270 0.220 0.245 p2 Comparación dentro de cada grupo, alimentación oral p=,<0.001 alimentación enteral p=<0.001 Peso kilogramos Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 5.0 1.7 5.2 0.8 5.5 0.8 5.2 1.7 5.3 1.2 5.4 1.1 5.7 1.2 Alimentación enteral n (8) Mediana RIC 5.1 1.1 5.4 1.0 5.5 0.8 5.7 0.6 5.9 0.6 6.1 0.8 6.5 0.9 p1 0.908 0.163 0.524 0.246 0.164 0.118 0.105 p2 Comparación dentro de cada grupo, alimentación oral p=0.002 alimentación enteral p=0.000. 103 Circunferencia media del brazo cm Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 10.2 2.0 10.0 3.0 10.5 2.5 10.5 1.3 10.0 0.6 10.0 1.0 10.0 1.3 Alimentación enteral n (8) Mediana RIC 10.5 1.9 10.5 2.1 11.0 1.7 10.9 1.2 10.9 2.3 10.9 2.8 11.2 2.9 p1 0.771 0.815 0.202 0.031 0.129 0.119 0.802 p2 Comparación dentro de cada grupo, alimentación oral p=0.974, alimentación enteral p=0.006 Pliegue cutáneo tricipital mm Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 5.0 1 5.0 1 4.5 1 5.0 1 4.0 1 4.5 2 4.0 2 Alimentación enteral n (8) Mediana RIC 4.0 1.5 4.2 0.8 4.5 1.7 5.0 0.3 5.0 0 5.0 0.8 5.2 1.2 p1 0.067 0.217 0.860 0.295 0.084 0.140 0.015 p2 Comparación dentro de cada grupo, alimentación oral p= 0.647, alimentación enteral p=0.001 Área total del brazo cm2 Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 8.3 3.5 7.9 5.0 8.7 2.4 7.9 2.1 7.9 0.9 7.9 1.6 7.9 2.1 Alimentación enteral n (8) Mediana RIC 8.9 3.3 8.8 3.7 9.6 3.0 9.8 2.3 9.4 4.2 9.4 5.2 10.1 5.4 p1 0.563 0.772 1.000 0.487 0.418 0.418 0.165 p2 Comparación dentro de cada grupo, alimentación oral p= 0.974 alimentación enteral p=0.006. 104 Área muscular del brazo cm2 Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 6.3 3.0 6.5 4.2 6.2 1.2 6.4 1.3 6.0 0.9 6.1 1.1 6.0 1.2 Alimentación enteral n (8) Mediana RIC 7.0 1.9 6.7 2.2 7.7 1.6 7.0 1.9 6.9 2.1 6.8 2.9 7.5 2.3 p1 0.354 0.524 0.105 0.063 0.297 0.298 0.271 p2 Comparación dentro de cada grupo, alimentación oral p= 0.988, alimentación enteral p= 0.117 Área grasa del brazo cm2 Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 2.3 3.0 2.3 4.2 2.0 1.2 2.4 1.3 1.9 0.9 2.0 1.1 1.8 1.2 Alimentación enteral n (8) Mediana RIC 2.0 1.0 2.2 0.6 2.4 1.0 2.5 0.3 2.5 0.5 2.6 0.9 2.8 1.2 p1 0.246 0.685 0.485 0.027 0.064 0.064 0.013 p2 Comparación dentro de cada grupo, alimentación oral p= 0.873, alimentación enteral p= 0. 002 Índice grasa del brazo % Semanas 0 2 4 6 8 10 12 Alimentación oral n (7) Mediana RIC 27.3 4.4 27.0 4.4 26.4 7.4 26.5 2.7 23.5 4.9 26.0 6.0 23.5 2.9 Alimentación enteral n (8) Mediana RIC 21.3 6.0 24.0 3.8 23.1 7.0 25.4 3.0 26.0 3.7 25.0 4.5 25.7 5.1 p1 0.008 0.118 0.247 0.908 0.203 0.354 0.073 p2 Comparación dentro de cada grupo, alimentación oral p= 0.029, alimentación enteral p= 0.035 105 ANEXO 12. Seguridad. Valores hematológicos, de indicadores de inflamación y de química sanguínea en 15 pacientes con atresia de vías biliares. Variables Alimentación oral (n=7) Alimentación enteral (n=8) P Mediana RIC Mediana RIC Hb inicial 10.7 2.4 11.1 1.6 0.536 Hb final 10.1 1.7 10.8 1.4 0.040 TP inicial 11.4 13 15.5 3.8 0.336 TP final 16.3 7.3 14.1 3.2 0.613 TPT inicial 39.7 13 40.7 19 0.779 TPT2 final 42.4 12.5 42.0 9.6 0.694 Leucocitos inicial 16,600 15,200 12,650 18,137 0.955 Leucocitos final 12,600 6,180 9,729 3,087 0.021 Plaquetas inicial 349,000 440,000 274,000 108,250 0.397 Plaquetas final 198,000 323,000 180,500 167,750 0.779 VSG inicial 14.2 14.5 10.4 4.2 0.189 VSG final 14.6 10.4 11.3 3.7 0.121 PCR inicial 5.6 6.8 5.4 6.5 0.955 PCR final 4.8 13.6 4.3 5.8 0.779 Glucosa inicial 80 6 80.1 5.5 0.478 Glucosa final 81 5 81.9 6 0.673 Urea inicial 10 3 11 5 0.521 Urea final 11 7 10.5 6 0.769 Creatinina inicial 0.2 0.5 0.3 0.4 0.689 Creatinina final 0.2 0.7 0.2 0.6 0.496 Hb: hemoglobina. TP: Tiempo de protrombina. TPT: Tiempo parcial de tromboplastina. VSG: velocidad de sedimentación globular. PCR: Proteína C reactiva. 106 Valores de bilirrubinas, transferasas, gama glutamil-transferasa, fosfatasa alcalina, albúmina, amonio, colesterol y triglicéridos en 15 pacientes con atresia de vías biliares. Variables Alimentación oral (n=7) Alimentación enteral (n=8) P Mediana RIC Mediana RIC BD inicial 8.1 3.9 6.9 4.8 0.397 BD final 10.2 4,5 11.2 5.2 0.613 BI inicial 1.9 2 1.2 0.9 0.072 BI final 2.3 3.1 1.4 0.5 0.462 ALT inicial 215 158 166 187 0.694 ALT final 236 153 201 257 0.955 AST inicial 379 228 255 277 0.694 AST final 268 290 240 134 0.955 GGT inicial 645 694 295 380 0.189 GGT final 358 525 160 203 0.029 FA inicial 591 402 483 524 0.189 FA final 622 643 437 358 0.040 Albúmina inicial 3.3 0.6 3.2 0.2 0.613 Albúmina final 3.0 1.2 2.8 0.3 0.779 Colesterol inicial 248 78 179 110 0.021 Colesterol final 202 25 122 151 0.281 TGC inicial 190 62 124 47 0.001 TGC final 164 78 104 91 0.397 Amonio 1 54 56 59 86 0.094 Amonio 2 55 20 59.5 23 0.009 BD: bilirrubina directa. BI: bilirrubina indirecta. ALT: aspartato alanino-transferasa. AST: aspartato amino-transferasa. GGT: gama glutami-transferasa. FA: fosfatasa alcalina. TGC: triglicéridos. 107