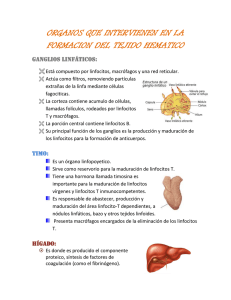
Micro-Inmunoterapia Acción de las Citoquinas
Anuncio

Micro-Inmunoterapia Acción de las Citoquinas Guía de referencia sobre la acción de las principales citoquinas utilizadas en MicroInmunoterapia Nota Importante: Versión española traducida del francés; texto no definitivo pendiente de relectura. 0 ÍNDICE Introducción P. 3 Capitulo 1 : Las interleuquinas, interferones y TNF P. 4 IFNα, IFNβ, IFNγ, P. 4 IL1, P. 5 IL1 Ra, IL2, IL3, IL4, P. 6 IL5, IL6 P. 7 IL7, IL8, IL9, P. 8 IL10, IL11, IL12, P. 9 IL13, IL14, IL15, P. 10 IL16, IL17, IL18, IL20, IL25, P. 11 TNFα,TNFβ P. 12 Capitulo 2 : Citoquinas y factores de crecimiento P. 13 Adiponectina, BDNF P. 13 bFGF, BMP, P. 14 Bombesina, CCK, CNTF P. 15 EGF, EPO P. 16 GCSF, GDNF, P. 17 Grelina,GMCSF, ICAM-1, P. 18 IGF-1, P. 19 Leptina, LIF, MIF, P. 20 Neuroglobina, Neurotensina, NGF, NPY P. 21 NT3, NT4, Oncostatina, P. 22 OPG, OPGL, PDECGF, PDEF, PREG’S, P. 23 Resistina, SCF, SS, P. 24 Sustancia P, TGFα, TGFβ P. 25 VEGF, VIP P. 27 Capitulo 3 : Quimioquinas o quemoquinas P. 28 Abreviaturas P. 30 1 Introducción Las citoquinas intervienen en todas las reacciones inmunitarias y en todos sus niveles, individualmente o conjuntamente entre ellas. El centenar de citoquinas que actualmente se conocen pueden dividirse en cinco grupos: a) Las interleuquinas : mensajeros intercelulares. b) Los IFN, responsables de la inhibición viral y en ocasión desempeñan un papel antitumoral. c) Los factores de crecimiento hematopoyéticos. d) Los factores de crecimiento de otros tejidos. e) Las quimioquinas, reguladoras de la migración de los leucocitos. 2 Capítulo 1. Las interleuquinas, los interferones y TNF IFN α (Interferón α) Es denominado IFN leucocitario (monocitos/Linfocitos B) y se produce en las células hematopoyéticas. Presenta una actividad antiviral y antitumoral, especialmente en los melanomas (IFNα-2b alta dosis). Estimula la actividad de los macrófagos con secreción de IL1 y también estimula las células NK. -IFNα α recombinante: 2a (Roféron) - 2b (Intron A) Se utiliza en las hepatitis crónicas B y C y en los síndromes mieloproliferativos crónicos. La pegilación del IFNα permite obtener, con una única inyección por semana, unas concentraciones séricas estables y asegurar una presión antiviral constante. Este IFN pegilado, es el doble de eficaz que el IFN estándar. En la actualidad existen dos moléculas diferentes: el IFNα2a pegilado (Pégasys, Productos Roche) y el IFNα-2b pegilado (Viraféron Peg, ScheringPlough). IFN β (Interferón β) Denominado fibroblástico en razón de su origen, se ha clasificado de tipo I junto con el IFNα. Ambos potencian la expresión de las moléculas de histocompatibilidad de clase I e inducen la evolución de los NK a LAK( Linfocitos T y células NK activadas). Para el IFNβ, esta modulación HLA se refiere a las enfermedades autoinmunes, entre otras la ESCLEROSIS EN PLACAS, donde estas moléculas se encuentran sobreexpresadas. Por el contrario, aumenta la presentación HLA de clase II en los macrófagos activados. Todas las células son capaces de producir IFNβ bajo la influencia del ARN bicatenario, de todos los virus, así como de IL1, IL2 y TNFα. Por tanto, tiene una actividad antiviral. Bloquea la parte Th2, estimula los CD8+, los NK y los TIL. -IFNβ β -1b recombinante (Bétaferon) se utiliza en la ESCLEROSIS EN PLACAS así como el IFN β-1a, resultando el primero más eficaz que el IFNβ-1a (Avonex, Rébif). IFNγγ (Interferón γ) Denominado IFN inmune (Linfocitos T activados), se incluyó como tipo II en la antigua 3 clasificación. Se produce en los Th0, TCD4 y T8c, los NK y los monocitos / macrófagos. Presenta una actividad antiviral y antifibrosante y ayuda a la IL12 en la polarización hacia Th1, inhibiendo los Linfocitos que producen IL4. Aumenta la presentación de los Ag (antígenos) de clase I y de los receptores del TNF en las células diana. También estimula la presentación de los Ag de clase II en los macrófagos, activa las NK, los Tc, los Monocitos/Macrófagos y favorece la respuesta de los T8c. Los IFNγ y α frenan la producción de las IgE e IL10 por los Macrófagos. Se utiliza en las enfermedades granulomatosas crónicas. IL1 (Interleuquina 1) Puede proceder de diversas fuentes: Monocito/Macrófago, células dendríticas, células epiteliales, células endoteliales, fibroblastos, polinucleares, Linfocitos T y B. Es un mediador central de la inflamación. La IL1 activa los linfocitos T, B, NK, Monocitos, Macrófagos, células endoteliales así como los hepatócitos donde favorece la producción de las Hsp (las proteínas de fase aguda de la inflamación), y disminuye la síntesis de la albúmina. La IL1 tiene un efecto pirógeno y una acción agravante en la reabsorción ósea, e incrementa la hematopoyesis. En el cerebro, se sintetiza en la microglía y en los astrocitos. Actúa como factor de crecimiento de la astroglía y asegura la reparación de los daños de la barrera hematoencefálica (BHE). En las neuronas, induce la expresión de los HLA (Human Leucocyt Antigen) de clase I. Bajo su influencia, los astrocitos aumentan la expresión de los HLA de clase II. Aumenta la biosíntesis del NGF y la producción de la PgE2 Junto con el TNFα, induce la síntesis de las integrinas, moléculas de adhesión que permiten el paso de los linfocitos y monocitos activados a través de la membrana endotelial de las vénulas postcapilares del cerebro. Recordemos su acción sobre el hipotálamo donde induce la producción de CRF (Corticotropin Releasing Factor), punto de partida de la ACTH. IL1 estimula también la producción de la hormona de crecimiento (GH) y de la hormona luteinizante (LH) así como la de TSH (Thyroïde Stimulating Hormone) y prolactina (PRL). Provoca somnolencia y disminuye el apetito y la actividad locomotora. La IL1 es un protector neuronal y un activador del eje hipotálamo-hipofisario. En los órganos periventriculares, en donde se interrumpe la barrera hematomeníngea, la IL1 parece actuar sobre las células endoteliales. Por esta vía del órgano vascular de la lámina terminal es por donde pasa la señal de la IL1 que, a través de las neuronas del hipotálamo, desencadena la fiebre con la somnolencia y la pérdida de apetito mencionadas anteriormente. Por último, señalemos el papel del factor de crecimiento de la IL1 sobre los fibroblastos, los queratinocitos, las células musculares lisas y sobre ciertas células tumorales. Además, la IL1 4 puede actuar como factor agravante en el desarrollo de las metástasis, especialmente favoreciendo la adhesión de las células tumorales sobre las células endoteliales sensibilizadas por la IL1. La IL1α y la IL1β presentan las mismas actividades biológicas y actúan sobre los mismos receptores. IL1 Ra (Interleuquina 1 Ra) Es el receptor antagonista de la IL1, por lo tanto, un inhibidor de la IL1. Impide la acción de la IL1, fijándose sobre su receptor de tipo 1 sin activarlo pero bloqueando el acceso de la IL1 a su receptor. (La IL1 Ra recombinante es la anakinra). IL2 (Interleuquina 2) Se produce en los Linfocitos CD4 y Th0. Es producida exclusivamente por los Linfocitos T y su acción se dirige principalmente a los linfocitos siempre que estos últimos estén previamente activados, pues en caso contrario no expresan el receptor funcional. Así es cómo se establecen la respuesta immune y la memoria inmunológica. A las NK les corresponde este receptor que les permite, bajo la acción de la IL2, su transformación en efectores de las células LAK . Es un factor de crecimiento y de diferenciación de los linfocitos T4 activados, Monocitos, NK, PNN y ciertos linfocitos B. Inicia la respuesta citotóxica de los linfocitos CD8. No afecta la evolución hacia Th1 o Th2. Como peculiaridad podemos mencionar que sólo se encuentra en el cerebro lesionado. Estimula la formación de β endorfina y de ACTH e inhibe la liberación de acetilcolina. IL3 (Interleuquina 3) Es producida por los Linfocitos T CD4 y los mastocitos activados. Estimula la hematopoyesis (es un multi CSF) y es un factor de crecimiento de las células dendríticas. IL4 (Interleuquina 4) Procede de los Linfocitos Th2, de las células NK-T, de los basófilos y de los mastócitos. Estimula la diferenciación de los Th2, activa la proliferación de los NK y de las células dendríticas. Estimula la producción de la IL1 Ra. Es esencial para la síntesis de las IgE, es anti-inflamatoria en la artritis pero está implicada en los procesos alérgicos. Al igual que la IL5, recluta eosinófilos. 5 IL5 (Interleuquina 5) Se produce en los Linfocitos Th2 (T4), en los eosinófilos activados y en los Th0.Estimula los PNE y la producción de IgM, IgG e IgA. Se puede considerar más como testigo que de actor en el mecanismo de la alergia. IL6 (Interleuquina 6) La IL6 se produce en los Th2 y bajo la influencia de IL1, por los monocitos, fibroblastos, sinoviócitos y células endoteliales. Activa los plasmocitos. Es un factor de crecimiento autocrino para las células mielomatosas de la enfermedad de Kahler. Por el contrario, presenta una acción antitumoral y antiviral; sin embargo, su acción antitumoral es controvertida en ciertos tipos de cáncer, especialmente en el de riñón. La IL6 activa los linfocitos B, NK, Tc, los hepatocitos (síntesis de las proteínas de fase aguda) así como la producción de IgG, A y E. Activa la migración de los neutrófilos. Por el contrario, IL6 estimula la secreción de receptores solubles del TNF y del antagonista del receptor de la IL1 β, lo que le confiere también una actividad antiinflamatoria. La IL6 es una citoquina esencial para la organización de la respuesta inflamatoria y para la comunicación bilateral entre los sistemas inmunitario y neuroendocrino, en particular por la regulación del eje hipotálamo-hipofiso-corticosuprarrenal (estimulación de los glucocorticoides y por los CRF y ACTH). MRA, un Ac-humanizado anti-receptor de la IL6, bloquea el acoplamiento del receptor con la gp130 por lo que produce un efecto anti-inflamatorio con una notable inhibición de la producción del VEGF. El MRA estaría indicado principalmente en la enfermedad de Still del adulto y del niño. Además del mieloma múltiple, la IL6 esta implicada en la glomerulonefritis mesangial proliferativa, la osteoporosis, la artritis reumatoide, la Esclerosis en Placas, la MDA y el sida. También puede afectar a la hematopoyesis, a la actividad neuronal e incluso al comportamiento. Las IL6R se expresan en todo el cerebro y su producción se acentúa en presencia de moléculas inflamatorias. Al contrario que los del TNFα y la IL1, el receptor soluble de la IL6 es un potente agonista de esta citoquina. Fisiológicamente, es secretada por las células hipofisarias productoras de FSH. Desde su descubrimiento, la IL6 se ha llamado “B cell stimulating factor 2” por su implicación en la maduración de los linfocitos B en plasmocitos secretores, y “hepatocyt stimulating factor” por su papel primordial en la inducción de las hsp pero que tiene la contrapartida de inhibir la formación de albúmina. 6 La síntesis de IL6 está inhibida por las IL4, IL10 e IL13. Está estimulada por IL1, TNFα, TGFβ, PDGF y, por supuesto, por las infecciones ,así como por la parathormona. Por último, la IL6 estimula la proliferación de las células infectadas por el EBV, particularmente en la enfermedad de Sjögren y en la PR, por lo que con frecuencia estas dos afecciones presentan carácter tumorígenico. Además de esta intervención en el desarrollo tumoral, hay que citar su impacto en la aparición de una amiloidosis. IL7 ((Interleuquina 7) Proviene de las células del estroma del timo y de la médula ósea. Estimula la hematopoyesis y sobre todo la linfopoyesis. Por tanto, su administración podría corregir la disminución de la capacidad de proliferación linfocitaria que se observa en los sujetos de edad avanzada. La IL7 activa los Linfocitos B, Linfocitos T y los LAK. Es una de las pocas citoquinas que se producen espontáneamente. IL8 (Interleuquina 8) Es de origen Monocito/Macrófago y PNN. Desempeña un papel quimiotáctico sobre los PNN. Es una citoquina proinflamatoria al mismo nivel que la IL2. Favorece el quimiotactismo de los Linfocitos así como la producción de los fibroblastos de la piel, de los queratinocitos, de los melanocitos, de los hepatocitos y de las células tumorales. Libera histamina de los basófilos y aumenta la infiltración por los neutrófilos y los linfocitos. Por su acción inflamatoria está implicada en la destrucción sinovial. Se han encontrado IL8 en las placas de psoriasis. La IL8 es un factor de angiogénesis. IL9 (Interleuquina 9) Son producidos por los Th2. Activa los mastócitos y la eritropoyesis. En el asma y en las alergias se observa un número anormalmente alto de mastócitos a nivel respiratorio e intestinal en el ratón. Los Ac anti IL9 impiden la aparición del síndrome asmático. La IL9 presenta una actividad anti-apoptótica sobre los linfomas T murinos. En humanos, se observa una sobreexpresión de la IL9 en los linfomas de Hodgkin y en los linfomas anaplásicos de células pequeñas. 7 IL10 (Interleuquina 10) Procede de los Th2, Linfocitos B, Monocitos/Macrófagos y de los Linfocitos B CD5. También se producen en numerosas células del tejido linfoide intestinal. Los linfomas B por EBV producen una gran cantidad de IL10 viral. Es producida por las células deciduales e interviene en la tolerancia feto-maternal con la ayuda de la IL4 y de la IL5. Frena la producción de las citoquinas Th1 e inhibe especialmente el IFNγ, disminuyendo la presentación del Ag. No se trata de una inhibición directa de las células Th1 sino que actúa sobre el Monocito / Macrófago y frena la producción de IL1, IL6 y TNF mediante los Monocitos. Junto a la IL4, es la principal citoquina antiinflamatoria. También es antiaterógena y antitrombótica. El efecto antifibrosante de la IL10 y de la IL2 se podría utilizar en las cirrosis. Es un factor de proliferación de los Linfocitos B y de su diferenciación en plasmocitos. Existe una alta homología de estructura entre la IL10 y un gen del EBV que utiliza este gen capturado para asegurar su supervivencia en el huésped. La IL10 viral, al igual que la IL10 humana, inhibe la producción de IFNγ por los linfocitos y sobre todo la producción de IL12 por los macrófagos. Esta inhibición implica un aumento del crecimiento de los Linfocitos B y bloquea la maduración de las células dendríticas. La IL10 desempeña un papel inhibidor importante en la hipersensibilidad de contacto. Compensa en parte los efectos estimulantes de la IL4 en la alergia y las secretarían las células reguladoras del mantenimiento de la tolerancia. Se puede mencionar que la IL10 es una de las citoquinas reguladoras más importantes; disminuye la proliferación linfocitaria y la secreción de citoquinas mediante los macrófagos y los linfocitos. Disminuye especialmente el IFNγ en los cultivos de células mononucleadas de pacientes que presentan vaginitis candidiásicas recidivantes y que se conocen por la ausencia de producción de IFNγ. Un anti-IL10 restaura una respuesta inmunitaria normal en estas pacientes portadoras de candida albicans. IL11 (Interleuquina 11) Se produce en el mesenquima. Estimula la producción de las CPA, la hematopoyesis y diferencia los linfocitos B, por lo que actúa sobre la eritropoyesis y no sobre los LT. Su síntesis está inducida por IL1 y TGFβ. Se secreta por los fibroblastos de la médula, los condorcitos; en general, por los fibroblastos. IL12 (Interleuquina 12) Desempeña un papel determinante en la diferenciación de las células T de tipo Th1 y en la 8 inhibición de la diferenciación de las células T de tipo Th2. Inhibe la diferenciación de las células productoras de IL1. Se produce principalmente en los linfocitos B, los Monocitos/Macrófagos, las células dendríticas y los granulócitos, así como en los linfomas B por EBV. En sinergia con la IL2, estimula la actividad citotóxica de los NK e induce la diferenciación de los Tc (linfocitos T citotóxicos) y de los T4 específicos del Ag. Estimula la síntesis de IFNγ, TNF, CSF, IL10, IL8, IL3 y IL2 así como del SCF (stem cell factor: factor de estimulación de las células madre pluripotentes). Por tanto, la IL12 tiene una acción estimuladora sobre las líneas mieloides. Aumenta la resistencia a la toxoplasmosis. Constituye un inmunoestimulante en la infección VIH por inducción de la producción de IFNγ. Por su capacidad de inducir la diferenciación de los Th1, la IL12 desempeña un papel en la inducción de ciertas enfermedades autoinmunes experimentales, como la encéfalo mielitis alérgica experimental (EAE). Las IL4 e IL10 tienen un efecto antagonista a la IL12. La IL12 inhibe el desarrollo de las metástasis, puede inducir las alteraciones de las mucosas gástricas y bronco pulmonares. IL 13(Interleuquina 13) Producida por los linfocitos T4, tipo Th2, su acción es antiinflamatoria por bloqueo de IL1, IL6, y TNFα. Producida también por los Linfocitos T8, los Linfocitos B y los mastócitos, actúa sobre las células monocitarias y los Linfocitos B. En los macrófagos, aumenta la expresión de los HLA de clase II. La IL13 reduce la gravedad de la EAE (modelo animal de estudio de la esclerosis en placas). En el marco Th2, presenta una acción proalergizante y estimula la producción de IgE, especialmente en la hiperreactividad bronquial, y la producción de IgA. IL14(Interleuquina 14) Producida por los Linfocitos T, es un factor de crecimiento para los Linfocitos B. Interviene en la respuesta inmune pero sus propiedades aún no están bien precisadas. IL15 (Interleuquina 15) Se produce en los Monocitos/Macrófagos, pero también en otras muchas células epiteliales, musculares y fibroblásticas. Favorece la proliferación de los Linfocitos T preactivados y estimula la función citotóxica de las NK. Sus propiedades coinciden bastante con las de la IL2. Los macrófagos y los fibroblastos reumatoides producen mucha IL15. Las IL12 en HDS (alta dosis 9 secuencial) e IL15 en HDS se asocian a los TNFα en HDS en el tratamiento de la PR y de las manifestaciones reumáticas autoinmunes. IL16 (Interleuquina 16) Procede de los T8, mastócitos y células epiteliales. Presenta una acción antiviral y activa los T4. IL17 (Interleuquina 17) Se produce en los T4. Estimula las células estromales proinflamatorias e induce la producción de IL6, IL8 y ICAM-1 por los fibroblastos. IL18 (Interleuquina 18) Proviene de los Linfocitos T y sobre todo de los macrófagos activados. Favorece la producción de IFNγ y de GMCSF. Por tanto, la IL18 es una citoquina proinflamatoria y las HDS se utilizarían en la enfermedad de Crohn y en la artritis reumatoide. Producida por los osteoblastos, inhibe la diferenciación de los osteoclastos. Esta citoquina proinflamatoria de la familia de la IL1β estimula, en sinergia con la IL12, la producción de IFN por los Linfocitos Th1 en los que amplifica la producción en colaboración con la IL12. Ahora bien, a nivel vascular, el IFNγ es uno de los factores proinflamatorios implicados en la aterosclerosis. La IL2, IFNγ, IL12 e IL18 constituyen la base de la inmunidad celular. IL20 (Interleuquina 20) In vitro, potencia el efecto proinflamatorio de IL1, EGF y TNFα. Su sobreexpresión por transgénesis provoca anomalías de la piel (aumento del grosor, hiperproliferación, expresión aberrante de ciertas queratinas) como en la psoriasis, pero sin los infiltrados de células inmunes de la psoriasis humana. Por el contrario, la IL10 se expresa anormalmente poco en la psoriasis humana. Señalemos que la IL19 y la IL21 están patentadas. IL25 (Interleuquina 25) Es una citoquina proinflamatoria. Aumenta las IgE, IgG1 e IgA. Provoca alteraciones de la mucosa gástrica y pulmonar con hiperplasia epitelial e hipersecreción de moco. Es una consecuencia de la inducción por IL25 , una síntesis aumentada de citoquinas Th2 y, entre ellas, de IL5 que induce los eosinófilos, de la IL4 que induce la síntesis de las IgE y de la IL12 responsable de las alteraciones de las mucosas. 10 TNFα α (Tumoral Necrosis Factor α; Factor de Necrosis Tumoral α) Está producido por los Linfocitos T, los T8c y los Monocitos/Macrófagos. Presenta una actividad antiviral y antitumoral. Estimula los linfocitos T, los Monocitos/Macrófagos, las células dendríticas y los PNN. Desempeña un papel fundamental en el proceso de destrucción cartilaginosa y ósea de la poliartritis reumatoide. Controla varios niveles de la reacción inflamatoria; en HDS, disminuye los efectos de IL1 - IL6 IL8 y GMCSF. Es secretado por los astrocitos y la microglía bajo la influencia de la IL1, del IFNγ y en la infección viral conjuntamente con la IL1. El TNFα induce la síntesis de las integrinas, las moléculas de adhesión que permiten el paso de los linfocitos y monocitos activados a través la membrana endotelial de las vénulas postcapilares del cerebro. Su producción está inhibida por las IL4, IL6, IL10, IL13, TGFβ, IFNα, los glucocorticoides, la serotonina, la histamina, la adrenalina y el glutatión. En los pacientes tratados con un anti-TNFα (infliximab) por PR o Enfermedad de Crohn, se constata un riesgo de desarrollo de tuberculosis. El TNFα parece jugar un papel en el control de una tuberculosis latente. Esto no ocurre con otro antiTNF, el etanercept, que parece no incluir este riesgo. Por el contrario, estos dos anti-TNFα son responsables de sintomatologías de esclerosis en placas, con un estado confusional en una proporción de ¼ de los casos, cuadro que no se observa en la esclerosis en placas. TNFβ β (Tumoral Necrosis Factor β ; Factor de Necrosis Tumoral β ) Proviene de los Linfocitos, especialmente de los T8c. Además de su actividad antiviral, el TNFβ activa los Monocitos/Macrófagos. 11 Capítulo 2 Citoquinas y factores de crecimiento Adiponectina Es una citoquina secretada sobre todo por los adipocitos, y sin embargo, está correlacionada negativamente con el índice de masa corporal: su nivel disminuye en caso de exceso de tejido adiposo, en la diabetes tipo II complicada con aterosclerosis y en la lipodistrofia. La secreción de adiponectina está modulada por la insulina. Desempeña un papel antiinflamatorio sobre la pared vascular al infiltrarse en las zonas dañadas donde inhibe la producción de TNFα por los macrófagos, y reduce la expresión y la adhesión de VCAM-1 y ICAM-1. Por tanto, la adiponectina es una citoquina anti-ateroesclerosis y anti insulinoresistencia. La disminución de su concentración precede la progresión hacia la diabetes tipo II y la insulinoresistencia; por el contrario, una mejoría de la receptividad a la insulina tras la pérdida de peso se acompaña de un aumento de sus concentraciones plasmáticas; esta adipoquina tiene, sin embargo, otras implicaciones. Se encuentra en la sinovial reumatoide donde se expresa con más de 40% de fibroblastos. Su presencia estimula los sinoviocitos y provoca la secreción de IL6 BDNF (Brain Derived Neurotrophic Factor; Factor Neurotrófico Derivado de Cerebro) Interviene en la supervivencia de las neuronas periféricas y sensoriales. Se han podido observar los receptores de las neurotrofinas BDNF-NGF-NT3 y NT4 que controlan la proliferación, la diferenciación y la supervivencia neuronal. Se trata de proto-oncogenes, de los receptores tirosín-quinasas (Trk). Mientras que Trk A está activado específicamente por el NGF y Trk C mediante NT3, Trk B puede estar activado por BDNF y NT4, e incluso por NT3 en ciertos casos. Trk B se expresa en el SNC y el SN periférico durante el desarrollo embrionario del ratón. En el ratón adulto, Trk B se expresa preferentemente en el cerebro. Existe un segundo receptor, la p75 LNTR. Aunque de baja afinidad, es un mediador esencial de las neurotrofinas puesto que controla la actividad de los Trk y participa en el transporte axonal retrógrado de estas neurotrofinas. En especial en el periodo perinatal, la apoptosis inducida por la p75 permite ajustar el número de neuronas aferentes al número de células diana. La unión previa de NGF a la p75 permite a las neuronas escapar de la muerte en función de la cantidad limitada de esta neurotrofina. BDNF es importante para la supervivencia de ciertas neuronas sensoriales. Está muy relacionado con el NGF y aumenta la supervivencia de las neuronas sensoriales y periféricas. También puede intervenir en la supervivencia de la motoneurona. Tiene un efecto neuroprotector sobre las neuronas colinérgicas centrales. 12 bFGF (basic Fibroblast Growth Factor; Factor de Crecimiento Fibroblástico Básico) Prolonga la supervivencia de las neuronas de la retina. Su expresión en las neuronas de la retina aumenta con la diferenciación y se mantiene elevada en el adulto. Presenta una acción trófica sobre los oligodendrocitos y estimula la remielinización. Tiene una acción profibrosante pero, por el contrario, favorece la neoangiogénesis. bFGF : -Favorece la formación del granuloma inflamatorio -Aumenta la re-epitelización, el crecimiento de los osteoblastos y condrocitos -Disminuye la degeneración de las fibras sensitivas (ESCLEROSIS EN PLACAS) aumenta el crecimiento tumoral y metastático del cáncer de próstata y de mama. BMP (Bone Morphogenic Protein; Proteína Morfogénica de Hueso) Las diferentes BMP pertenecen a la superfamilia del TGFβ. Se han individualizado más de 40. Se producen en los osteoblastos y desempeñan un papel fundamental en la formación ósea. Citemos la BMP-2, que actúa principalmente sobre la morfogénesis cartilaginosa, en el desarrollo de la dentina y en la consolidación de las fracturas de los huesos largos, incluyendo la amenaza de pseudartrosis. En el ratón, las estatinas estimulan a la BMP-2, lo que implica un aumento de la osteoformación. Este hecho no se ha comprobado con estudios clínicos en el hombre. La BMP-3, la osteogenina desempeña un papel importante en la formación ósea. También es el caso de la BMP-8. La BMP-4 nos ha parecido, no obstante, la más interesante para integrarla, en una primera etapa, entre los factores de crecimiento de la Micro-Inmunoterapia. Esta proteína tiene la propiedad de producir hueso a partir de tejido sano. Este factor de crecimiento óseo se utiliza en MicroInmunoterapia con buenos resultados, en 5 CH, en la consolidación de fracturas así como en la prevención y el tratamiento de la osteoporosis. Además, la BMP-4 presenta la propiedad de inhibir la proliferación del mieloma múltiple (MM) reduciendo la síntesis de IL6 que inhibe la apoptosis de las células malignas de la enfermedad de Kahler. Por el contrario, la BMP-4 induce la apoptosis en cultivos de células dependientes de la IL6. La BMP (que existe en diferentes variedades) es un ligando que aparentemente, interviene en 13 diversas funciones. La alternancia BMP-2 y BMP-4, un día una y otro día otro, proporciona excelentes resultados en las patologías óseas de cualquier tipo. Aumentan la masa ósea en casos de colocación de implantes dentales, que se anclan en el hueso en un tiempo récord. Las BMP fijan los dientes oscilantes. En la osteoporosis avanzada es preferible prescribir todos los días tanto BMP-2 como BMP-4, en diferentes momentos. Bombesina (BBS o GRP) Es un péptido neuroendocrino aislado en los anfibios cuyo equivalente humano es el GRP (gastrin-releasing peptide; péptido liberador de gastrina), cuyo decapéptido carboxiterminal (neuromedina c) es casi idéntica a la bombesina. El GRP está presente en la pared del tubo digestivo y en el SNC. La expresión del receptor BBS / GRP se encuentra en las líneas tumorales de muchos tipos de cáncer y especialmente en el 100% de los cánceres de pulmón de células pequeñas; en el 90% de los tumores colorectales; el 85% de los glioblastomas, incluyendo páncreas, mama, próstata, sarcoma de Ewing... CCK (colecistoquinina) Sus funciones se pueden en los siguientes apartados: - Indica al cerebro la llegada de alimentos al estómago y desencadena el mecanismo de saciedad. - Estimula la secreción pancreática y la contracción de la vesícula biliar. - Proporciona una analgesia 8.000 veces más potente que la morfina. - Es un factor que estimula la memoria. - Está implicada en los ataques de pánico. -Asegura una neuroprotección durante un AVC por su efecto antirradical. -En la regulación de la dopamina, potencia la acción inhibidora de la dopamina (aplicación en la hiperprolactinemia). -El litio y las xantinas (cafeína) aumentan la liberación de CCK. CNTF (Ciliary Neurotrophic Factor; Factor Neurotrófico Ciliar) Mejora la diferenciación y la supervivencia de las neuronas centrales y periféricas, en particular las neuronas dopaminérgicas de la sustancia negra y las motoneuronas que protege de la degeneración que sucede a la axotomía. También es un factor trófico para los músculos esqueléticos durante la denervación o durante el envejecimiento, donde puede desempeñar un papel de mantenimiento de la integridad muscular. 14 Es sintetizado por dos poblaciones de células gliales, los astrocitos y las células de Schwann. Se excretaría únicamente durante los episodios traumáticos o cualquier otro estado de sufrimiento. Pertenece a la familia de las citoquinas neuropoyéticas, llamada de la IL6 y a la que también pertenecen el LIF, la IL11, la oncostatina M (OSM) y la cardiotrofina-like citoquina (CLC o CT1). Las actividades neuroprotectoras del CNTF han dirigido los ensayos clínicos hacia la esclerosis lateral amiotrófica (ELA). Se tuvieron que abandonar debido a los importantes efectos secundarios (fiebre elevada, pérdida muscular, tos rebelde) provocados por la administración con inyecciones sistémicas. La administración en el estriado de CNTF en un modelo animal de enfermedad de Huntington mostró su eficacia para bloquear la degeneración de las neuronas gabaérgicas. El CNTF previene la apoptosis de los oligodendrocitos tras la axotomía. Es un factor de crecimiento para las células gliales, los astrocitos y los oligodendrocitos. Ahora bien, los astrocitos de la sustancia blanca desempeñan un papel importante en el metabolismo neuronal. El CNTF reduce de forma específica y duradera el peso corporal y la ingesta de alimento de los ratones ob/ob y de los ratones convertidos en obesos con un régimen hipercalórico. Disminuye la hiperinsulinemia en los ratones ob/ob y db/db, y reduce la glucemia en estos últimos. El CNTF estimula la expresión de las hsp. EGF (Epidermal Growth Factor; Factor de Crecimiento Epidérmico) Basta con saber que el sistema nervioso embriológicamente forma parte del ectodermo para comprender la importancia del EGF, su papel trófico a nivel neurológico y su papel intempestivo como factor de crecimiento en los tumores malignos, e incluso benignos, del SNC. Favorece el desarrollo de las células gliales y de las neuronas. El EGF inhibe la secreción gástrica, activa la regeneración de la piel y del hígado, aumenta el crecimiento tumoral y favorece la extensión de la psoriasis. EPO (Eritropoyetina) Las propiedades de esta citoquina se conocen universalmente por sus efectos sobre la hematopoyesis. Aquí sólo comentaremos sus propiedades a nivel cerebral, que se conocen desde que en 1991 se demostró la producción de EPO por las células de tumores cerebrales. Su producción se garantiza por los astrocitos, y por las propias neuronas, bajo la influencia de la hipoxia que aumenta la producción de HIF-1 (Factor-1 inducible de Hipoxia), factor de trascripción que estimula la expresión del gen de la EPO. Por tanto, es el mismo mecanismo a nivel cerebral que a nivel sistémico, donde la producción de EPO está básicamente asegurada por el riñón. 15 Parece que la EPO podría atravesar la BHE. Veamos las propiedades que presenta a nivel cerebral: - efecto neurotrófico: aquí se trata de un factor de crecimiento neuronal; - efecto protector en la isquemia global y focal en caso de hemorragia subaracnoidea o de crisis de epilepsia o en la encefalitis autoinmune experimental, el modelo experimental de la esclerosis en placas; - protege contra la muerte neuronal provocada por una activación excesiva de los receptores glutamatérgicos o por un estrés oxidativo secundario a un exceso de NO; - disminuye la producción excesiva de NO en la isquemia cerebral y la limita únicamente a nivel de la zona de los daños cerebrales; - frena el proceso inflamatorio que acompaña la isquemia cerebral; - posiblemente controle la síntesis de la neuroglobina, vector de O2 a nivel cerebral; -favorecería la diferenciación de los precursores del SNC en neuronas dopaminérgicas (Parkinson). Los receptores de la EPO se expresan en las células endoteliales in vitro, y en la isquemia cerebral por los vasos sanguíneos de la zona dañada. La expresión de la EPO y de su receptor en las células nerviosas se conoce desde 1993. En la actualidad, la acción anti-apoptótica de la EPO sobre estas células está bien establecida. La EPO también puede proteger de la apoptosis a las motoneuronas de la médula espinal. En realidad, la EPO puede fijarse sobre diferentes receptores. Gracias a ello, manifiesta propiedades protectoras en los tejidos sometidos a agresiones isquémicas, tóxicas, traumáticas o inflamatorias, especialmente a nivel de las neuronas o del miocardio. La EPO carbamilada (CEPO) conserva estas propiedades protectoras sin intervenir en la eritropoyesis. GCSF (Granulocyte Colony Stimulating Factor; Factor estimulante de las colonias de granulocitos) Es, por tanto, un factor de crecimiento específico para los granulocitos. GDNF (Glial cell-line Derived Neurotrophic Factor; Factor Neurotrófico derivado de Líneas Celulares Gliales) No debemos de confundir con el GGF (Glial Growth Factor; Factor de Crecimiento Glial), que es un factor de crecimiento de los oligodendrocitos jóvenes. Forma parte de la familia del TGFβ, que se describirá posteriormente. Protege las motoneuronas in vitro y también in vivo en los modelos de axotomía. Se encuentra en 16 la periferia de las motoneuronas y se transporta por los axones de forma retrógrada. Sólo estimula las neuronas productoras de dopamina y protege las neuronas mesencefálicas intoxicadas por MPTP. Inyectado en el cerebro de monos intoxicados con MPTP (Metil fenil Tetrahidro Pirimidina), que es el modelo animal para el estudio del Parkinson, el GDNF mejora la rigidez, la bradiquinesia y la inestabilidad postural tal y como lo han demostrado ciertos autores americanos (ver Nature, 21 Marzo 96). GRELINA Descubierta en el fundus gástrico de la rata, este péptido está relacionado con la motilina. Está implicado en la regulación de la secreción de la hormona de crecimiento (GH), en el equilibrio energético y en la regulación del vaciado gástrico. La inyección de grelina aumenta los niveles de GH e implica un aumento de peso al incrementar la ingesta de alimento y disminuir el gasto energético. Un antagonista de la grelina provoca un efecto anoréxico muy marcado en el ratón, una disminución de peso corporal y la disminución de las concentraciones de glucosa en los ratones obesos ob/ob. GMCSF (Granulocyte Monocyte Colony Stimulating Factor;Factor Estimulante de la Colonia Granulocito/Monocito) Este factor de crecimiento, específico de los granulocitos y monocitos, es muy valioso en las leucopenias y especialmente en las neutropenias de las secuelas de quimioterapia. ICAM-1 (intercellular adhesion molecule; Molécula de Adhesión Intercelular) Esta molécula de adhesión intercelular cuenta, entre otras propiedades, con un papel en el paso por los endotelios. Se encuentra en primer plano en MICRO-INMUNOTERAPIA oncológica. Bajo la influencia de la IL10, desaparece de la superficie de las células dendríticas y de los monocitos/macrófagos. Este mecanismo, asociado a la pérdida de presentación de los CMHI y CMHII por la acción de la IL10, disminuye con fuerza su función de presentación del Ag y de coestimulación. Por tanto, paradójicamente la ICAM-1 se encuentra asociada a los tumores de rápido desarrollo. También cuenta con la propiedad angiogénica y de desarrollo tumoral exacerbado. Esta potencia de la ICAM-1 se ha podido reproducir experimentalmente. Las moléculas ICAM-1 solubles obtenidas de sueros de pacientes portadores de melanoma inhiben la función efectora citolítica. IGF-1 (Insulin-like Growth Factor I; Factor de Crecimiento 1 parecido a la Insulina) 17 El factor de crecimiento insulinomimético de tipo I, se caracteriza por desempeñar las siguientes funciones: • Estimula la cicatrización de la mielina, la multiplicación de los fibroblastos y la síntesis de colágeno, por lo que hay que tener prudencia en la neurofibromatosis. • Se puede utilizar en los trastornos de crecimiento, en el tratamiento de la osteoporosis y de la diabetes así como en los estados de catabolismo acelerado, por ejemplo, en los gastos energéticos elevados. • A nivel del sistema nervioso central (SNC): - Estimula la división, la diferenciación y la supervivencia de las células neuronales - Protege las neuronas contra diversas acciones tóxicas - Influye en la producción de los neurotransmisores - Interviene en la síntesis de la mielina y de los neurofilamentos; es un factor anti-apoptótico para los oligodendrocitos - Interfiere en el metabolismo de la glucosa - Disminuye el temblor de los ratones Wobbler. • A nivel de la médula: - Reduce la apoptosis de las neuronas, las regenera y estimula el crecimiento de las motoneuronas. En caso de traumatismos medulares se tendrá en cuenta que : - protege contra las agresiones de la quimioterapia. • A nivel del músculo: - Refuerza la actividad muscular (propiedad utilizada por algunos atletas) - Interviene favorablemente en las funciones neuromusculares, pues puede penetrar en las extremidades distales de las motoneuronas periféricas, y por ello se ha realizado un estudio en intramuscular en la ELA. Por sus propiedades, presenta un uso potencial en : • La esclerosis lateral amiotrófica (ELA), la esclerosis en placas, la encefalopatía autoinmune, la enfermedad de Alzheimer, el Parkinson, los traumatismos craneales y las secuelas de accidentes cerebrovasculares (AVC) • La neuritis autoinmune, la enfermedad de Duchesne, la distrofia miotónica, las neuropatías y la neurofibromatosis. El IGF1, en el estado “normal”, no atraviesa la barrera hematoencefálica. Se sintetiza en los astrocitos, las células de Schwann y, en caso de lesiones, en los monocitos que invadan la zona. 18 Hay que tener en cuenta su acción estimulante sobre el crecimiento de los gliomas malignos. Además, IGF1 estimula la proliferación de las células epiteliales mamarias tumorales. Los sujetos que presentan altos niveles de IGF1, esencialmente sintetizado por el hígado, presentan un mayor riesgo de desarrollar cáncer de próstata. La inyección de IGF1 aumenta el peso, provoca un edema, hipoglucemia e hipotensión ortostática. El IGF1 actúa por fosforilación de las proteínas IRS (insuline receptor substrate; Substrato receptor de Insulina) expresadas en el tejido adiposo, el músculo, el hígado y el cerebro. Los ratones IRS-/- son estériles y presentan una disminución de las gonadotrofinas plasmáticas. Cuadros similares se encuentran en el carnero diabético y en C. elegans. Las amenorreas de las pacientes anoréxicas también se observan en las atletas de alto nivel y en la malnutrición en general. También está implicada la leptina, responsable de una estimulación hormonal gonadotrófica cuando las reservas son suficientes. Leptina Citoquina producida mayoritariamente por el tejido adiposo, la leptina asegura su control, y su secreción es proporcional a la masa adiposa. La unión de la leptina a su receptor hipotalámico disminuye el apetito y, por vía del sistema nervioso autónomo, disminuye la producción hepática de glucosa y la secreción de insulina. La existencia de altos niveles circulantes de leptina al mismo tiempo que una obesidad por hiperfagia demuestra la posibilidad de leptino- resistencia. La leptina interviene en la inducción de la pubertad por acción sobre el eje gonadotropo que conserva hasta influir en la fertilidad. Tiene una acción ambivalente en la artrosis. LIF (Leukemia Inhibitory Factor; Factor Inhibitorio de Leucemia) Su receptor está relacionado con los receptores de la prolactina, de la GH y del CNTF. Esto explica que favorezca la supervivencia de las motoneuronas, en simbiosis con otras citoquinas. Desempeña un papel en el crecimiento placentario, donde inhibe la replicación del VIH. El LIF es una citoquina de la familia de la IL6 como la IL11, OSM y CNTF. Sus receptores se expresan en numerosos tejidos y estas citoquinas tienen una acción pleiotrópica, por lo que intervienen en la síntesis de las proteínas de fase aguda de la inflamación. MIF (macrófago migration inhibitory factor; Factor Inhibitorio de la Migración de Macrófagos) En realidad se trata de una citoquina proinflamatoria producida por los macrófagos y los monocitos. Su cinética es más lenta que la de otras citoquinas inflamatorias. 19 Estimula la secreción del TNFα por los macrófagos. Neuroglobina (Ngb) La Ngb protege contra los AVC, disminuye un 50% el volumen cerebral infartado en la rata. El mecanismo de esta acción neuroprotectora pasaría, como con la mioglobina, por la difusión de O2 y la captación de radicales libres tóxicos; además, estaría conectada con el factor HIF-1 (hipoxia inducible factor – 1), factor de transcripción que estimula la expresión del gen de la EPO. Posiblemente la EPO controle la síntesis de la neuroglobina, vector de O2 en el cerebro. Neurotensina (N.T.) Este neuropéptido pertenece a la familia de la bombesina. Existe una alta concentración en el hipotálamo, lo que sugiere que interviene en la termorregulación y en la tensión arterial. La mayor concentración (95%) se encuentra en el tracto gastrointestinal. La N.T. está implicada en la esquizofrenia, donde encontramos una disminución de los niveles de N.T. La misma situación se encuentra en la enfermedad de Parkinson y en la corea de Huntington. Los antipsicóticos, como el haloperidol y la clorpromazina, aumentan las concentraciones de N.T. NGF (Nerve Growth Factor; Factor de Crecimiento Nervioso) El receptor de esta neurotrofina es el protooncogen Trk A. Su síntesis aumenta por la IL1 y la IL6. NGF es un factor de crecimiento en el cáncer de mama. Es el principal candidato para el tratamiento de la enfermedad de Alzheimer. Las únicas neuronas colinérgicas de las que asegura la supervivencia son las del cerebro anterior basal implicadas en la enfermedad. NGF estimula la supervivencia de las neuronas simpáticas y sensoriales. NPY (Neuropéptido Y) Existe una importante concentración en el cerebro y en la médula espinal. En la periferia, se encuentra en los ganglios simpáticos, las fibras simpáticas perivasculares y en la médula suprarrenal. La inyección de NPY en el hipotálamo produce un efecto orexígeno con disminución de las defensas. También se han observado sus efectos ansiolíticos, anti-epilépticos y vasoconstrictores. El NPY, vía su receptor Y1, aumenta el umbral de sensibilidad a los estímulos dolorosos térmicos, mecánicos y químicos. Ejerce efectos analgésicos en el caso de dolores neuropáticos. Se encuentra en altas concentraciones en el Alzheimer. El magnesio inhibe la unión entre el NPY y su receptor. Podemos dividir las funciones de NPY en: 20 - Interviene en la sincronización de los ritmos circadianos. - Aumenta la liberación de CRH, adrenalina y cortisol en la respuesta la estrés. - Aumenta el apetito, sobre todo hacia los glúcidos, con riesgo de obesidad además de inhibir la secreción de insulina. NPY es un eslabón importante en la cadena de acontecimientos bioquímicos que desembocan en la obesidad. - Disminuye su concentración a nivel cerebral en las depresiones graves y en riesgo de suicidio, así como en la ansiedad en general. El aumento del NPY por antidepresivos podría explicar el aumento de peso con estos medicamentos. - Aumenta la secreción de hormonas tiroideas. NT3 (Neurotrofina 3) Posee un receptor específico, la TrkC. Asegura la supervivencia de las neuronas propioceptivas in vitro. Se ha visto que la implantación, en el ventrículo cerebral de ratas viejas, produce los siguientes síntomas: - NGF + NT3 mejora claramente su memoria - NT4 da una menor mejoría - BDNF no mejora la memoria. NT3 parece interesante en el tratamiento de las neuropatías periféricas (diabetes, quimio). NT3 estimula la división de los progenitores de los oligodendrocitos. NT4 (Neurotrofina 4) Asegura in vivo la supervivencia de las motoneuronas. Es el agente de la plasticidad cerebral, aumenta la eficacia neuro-muscular. Puede asegurar ella sola una cierta mejora de la memoria en las ratas viejas. Oncostatina M (OSM) Esta citoquina ha demostrado propiedades antiinflamatorias en modelos murinos de artritis y de esclerosis en placas sin inducir inmunosupresión. Estimula la síntesis de las hsp, la diferenciación de las células leucémicas y la proliferación de las células plasmocitarias. 21 OPG (Osteoprotegerina) Es un receptor soluble de la familia de los receptores del TNF. Se une al ligando de la OPG secretado por los osteoblastos. Inhibe la diferenciación y la actividad de los osteoclastos. La OPG reduce de forma considerable los dolores óseos producidos por el movimiento y la presión mientras que tiene menor influencia en los dolores espontáneos. Por tanto, estaría indicada en los dolores más definitivos de los cánceres óseos primitivos o metastásicos. OPGL (Ligando de la osteoprotegerina) Combinado con el CSF1, es un potente estimulador de los osteoblastos. Los Linfocitos T y otras células inmunitarias también expresan este ligando. El OPGL y su receptor Rank son indispensables para el desarrollo de la glándula mamaria durante el embarazo y para su correcto funcionamiento durante la lactancia. PDECGF (Platelet Derived Endothelial Cell Growth Factor; Factor de crecimiento endotelial derivado de plaquetas). Induce la angiogénesis, inhibe el crecimiento de los astrocitos y de las células gliales y estimula la regeneración neuronal. No obstante, la inhibición de los astrocitos podría ser desfavorable en el envejecimiento cerebral visto el importante papel que desempeñan los astrocitos de la sustancia blanca en el metabolismo de las neuronas. PDEF (Pigment Epithelial-Derived Factor; Factor Derivado del Pigmento Epitelial) Es un inhibidor biológico de la angiogénesis que se encuentra de forma natural en la retina y en el cuerpo vítreo. El PDEF es susceptible en BDS de inhibir la neoangiogénesis retiniana. PREG’S (Sulfato de pregnenolona) No se trata de un factor de crecimiento sino de un neuroesteroide relacionado con las hormonas sexuales. Es un estimulador de los factores de crecimiento y parece desempeñar un papel en la protección de las neuronas. Inyectado en el hipocampo de las ratas viejas, mejora sus efectos mnésicos. El profesor Beaulieu (CNRS París) y el profesor Le Moal (CNRS Burdeos) han mostrado el interés de esta molécula. Aumenta la secreción de acetilcolina, de la que se conoce su importante papel en los procesos de la memoria y, a la inversa, el déficit parece ser uno de los elementos clave de la degradación neurológica en el Alzheimer. Recordemos que persiste una posibilidad de 22 neurogénesis en el hipocampo; posiblemente se trate de uno de los mecanismos por el que el PREG’S puede manifestar su impacto positivo en los procesos de memorización. Resistina Debe su nombre al hecho de que puede inducir una insulino-resistencia grave. En el ratón que presenta obesidad genética se encuentran altas concentraciones de resistina. En el hombre, la resistina está expresada en el tejido adiposo, en especial a nivel de la grasa abdominal y visceral, lo que podría explicar la asociación de esta forma de obesidad con la insulino-resistencia y sus complicaciones cardiovasculares. SCF (Stem Cell Factor o Stem Cell Growth Factor; Factor de Crecimiento de Células Madre o Factor de Crecimiento) Esta molécula es el ligando de un receptor de superficie codificado por el proto-oncogen c-kit. Este último codifica una quinasa transmembranal, el receptor del SCF que, por una parte pertenece a la familia de los receptores para el MCSF y el PDGF y que, al presentar en su porción extracelular dominios Ig-like, también pertenecería a la superfamilia de las Ig. Este c-kit está expresado por las células precursoras de las líneas mieloide y mastocitoide. El SCF es un factor de crecimiento, de diferenciación y de supervivencia de los mastocitos. Estimula las células hematopoyéticas en sinergia con los factores de crecimiento de las líneas mieloide, eritroide y linfoide (GM-CSF, G-CSF, IL3, EPO). Aumenta el contenido en precursores sensibles a la IL3 y en CFU-S (en el origen de las colonias mieloides). Induce la aparición de las células mieloides no maduras y de blastos en la sangre. Los blastos de la leucemia aguda mieloblástica expresan receptores para el CSF. Así pues, esta molécula podría contribuir a la promoción de una proliferación celular anormal. SS (o SRIH-somatostatina) Las siguientes funciones se relacionan con la SS: - Regula la neurotransmisión, la secreción glandular, la contractilidad de los músculos lisos y la proliferación celular. - Está implicada en la mayoría de las enfermedades neurológicas. - Aumenta en todos los procesos inflamatorios y proliferativos; Por ejemplo: meningitis, encefalopatías metabólicas, tumores cerebrales. - Aumenta en todas las formas de epilepsia. Los antiepilépticos como la carbamazepina o la difantoína disminuyen los niveles de SS cerebral. 23 - Está disminuida de forma definitiva en el Alzheimer con correlación entre esta disminución y la afectación neuronal. - Está disminuida, transitoria y reversiblemente, en los episodios graves. - SS inhibe la GH, la tiroides vía TSH, el aparato digestivo [gastrina y HCL (secreción pancreática exo y endocrina), la contracción vesicular y motilidad intestinal,] los riñones y las glándulas suprarrenales. - SS se utiliza en el tratamiento de urgencia de roturas de varices esofágicas. Sus derivados se utilizan en la acromegalia y en el tratamiento de los tumores carcinoides. Sustancia P Hay deficiencia de este neuromediador en el Alzheimer. Las terminaciones nerviosas libres aferentes secretan ciertos neuropéptidos, como la sustancia P. Ésta provoca la desgranulación de los mastocitos con edema y vasodilatación, y la liberación de histamina que estimula los nervios próximos, liberando a su vez sustancia P. Así, se establece una reacción inflamatoria neurogena local en cadena. La primera neurona nociceptiva dirige los impulsos nerviosos desencadenados por el estímulo algogeno y secreta la sustancia P que servirá de neuromediador para la transmisión de la señal dolorosa a la segunda neurona nociceptiva en las inervaciones dorsales de la médula. Si la sustancia P interviene en los dolores inflamatorios o neurógenos (ciática, por ejemplo), la OPG, por el contrario, interviene en los dolores óseos más definitivos que espontáneos. TGFα α (Transforming Growth Factor α; Factor de Crecimiento Transformante α) El TGFα estimula la proliferación de las células del tubo proximal por activación del receptor del EGF en los RCC (carcinoma renal de células claras). El caso más notable es el de la enfermedad de Von Hippel-Lindau, con tumores vasculares del SNC, de la retina y del riñón, en la que también desempeñan un importante papel el VEGF y el TGFβ. TGFβ β (Transforming Growth Factor β ; Factor de Crecimiento Transformante β ) Desempeña un importante papel en la supresión local de las reacciones inmunitarias. Secretado por la mayoría de los tumores, el TGFβ les permite escapar a la inmuno-vigilancia inhibiendo la expresión de las moléculas HLA y protegerse oponiéndose a la acción de los Tc de las NK y de las LAK. Este efecto inmunosupresor local se amplifica mediante la propiedad que presenta el TGFβ de neutralizar la producción de las citoquinas por las células inmunocompetentes. Inhibe a los Tc, la actividad NK y la expresión de las moléculas de clase II. Es secretado por el 24 astrocito, inhibe el crecimiento de los macrófagos y de los linfocitos B y T. Aumenta la proliferación de las células de Schwann (incremento de neuronas que rodean el axón). El TGFβ mejora la supervivencia de las motoneuronas. Disminuye la producción de los linfocitos T8c mediante la disminución de síntesis del TNFα. También disminuye la expresión de los HLA DR especialmente en los gliomas. Neutraliza la acción nociva del TNFα y del IFNγ. Por tanto, el TGFβ es inmunosupresor. Mejora la cicatrización pero, en caso de un exceso de producción, puede provocar una fibrosis tisular. El TGFβ es un factor inhibidor de crecimiento, pero por el contrario, polariza la producción de las IgA. Por su acción antifibrosante en HDS, podría utilizarse en casos de fibrosis intercelular; tras un infarto, se podría administrar en HDS. Una subpoblación de células ThCD4, independiente de los Th1 y Th2, desempeña el papel de células reguladoras utilizando el TGFβ para inhibir las respuestas inmunitarias mediadas por las células Th1 y Th2. A nivel Th1, se encuentra el caso de la tolerancia obtenida con la administración oral de MBP en la EAE (experimental allergic encephalitis). Este aporte alimentario de MBP, antes de las inyecciones inmunizantes de MBP, previene el desarrollo la encefalitis mediante el TGFβ secretado por estas células TCD4 reguladoras. En la competición entre célula neoplásica y célula sana, el TGFβ podría desempeñar un papel importante en la adquisición de una supremacía neoplásica. Ya en sus inicios, esta batalla de la célula cancerosa primaria afectaría a otras células transformadas de su entorno que ha estado expuesto a las mismas condiciones carcinógenas. Esto explicaría la causa por la que no existen dos o más cánceres evolutivos diferentes a la vez en el mismo órgano. Además de este efecto de inhibición que realiza en la competición, el TGFβ también presenta un papel de estimulación de las células sanas, por ejemplo, las de los endotelios vasculares, lo que permite la vascularización y la nutrición del tumor que se desarrolla en un auténtico volcán de vida funesto para la supervivencia del organismo. Además presenta una acción supresora sobre los linfocitos B, T, NK. Por tanto, hay que tener en cuenta esta tendencia inmunodepresiva. El TGFβ presenta una actividad pro-osteoblástica. El caso se plantea en las metástasis óseas. En efecto, se secreta por las células tumorales del cáncer de próstata; además, se libera a partir de la matriz ósea por la acción de la uroquinasa y del PSA secretados por estas mismas células tumorales. Paradójicamente, en el cáncer de próstata también existe una osteolisis asociada a las metástasis osteocondensantes, en la que está implicada la PTH-rP. En efecto, el TGFβ es un péptido, factor de crecimiento, relacionado con la paraTh0rmona. Además, TGFβ, TNFα, IL6 e IGF1 aumentan la secreción de PTH-rP en ciertas líneas tumorales del cáncer de mama. La reabsorción ósea 25 posterior libera TGFβ. El TGFβ polariza la producción de las IgA. En esta vía desempeña un papel inmunomoderador favoreciendo la síntesis de las IgA e induciendo una tolerancia oral. Este es el caso del recién nacido y de la fase postnatal precoz, donde la síntesis endógena del TGFβ por el intestino se encuentra muy reducida pero compensada por el aporte de leche materna cuya concentración en TGFβ se puede reforzar con la toma de probióticos. Se ha podido establecer que esta concentración de TGFβ determina la capacidad del niño para producir IgA específicas contra los Ag alimentarios. Esta concentración de TGFβ en la leche materna aumenta con la ingesta diaria de probióticos (Lactobacillus rhamnosus) al final del embarazo y durante la lactancia. Por ello, el riesgo de dermatitis atópica en el hijo de madre atópica disminuye al 15% en caso de toma de probióticos frente al 47% en el grupo placebo. Este beneficio también es válido en el caso de que las madres no sean atópicas. VEGF (Vascular Endothelial Growth Factor; Factor de Crecimiento Vascular Endotelial) = VPF (vascular permeability factor; Factor de Permeabilidad Vascular) = vasculotropina No se trata ni de una neurotrofina ni de un factor de crecimiento neuronal. Aquí se incluye en el marco de un tratamiento sensorial, en este caso retiniano. La isquemia de la retina provoca una neovascularización anárquica por la producción masiva de ese factor angiogénico por el epitelio pigmentario y los pericitos retinianos. Podría ser beneficioso frenar este proceso con una alta dilución de VEGF. En la práctica, una HDS incluso podría resultar reactiva, especialmente en caso de riesgo de una reacción hemorrágica: prescribir con prudencia. Comparar con el interés de una BDS de IFNα y β. El VEGF podría favorecer la circulación de las zonas en isquemia. En la periferia, experimentalmente se puede favorecer la circulación colateral administrando in situ copias de los genes del VEGF pero, en el cerebro las arterias son terminales. El VEGF aumenta el paso plasmático mientras que la angiopoyetina se opone a este fenómeno y a la formación del edema inflamatorio. VIP (Vasoactive Intestinal Peptide; Péptido Intestinal Vasoactivo) Se caracteriza por las siguientes funciones: - Está ampliamente extendido en el intestino, páncreas, útero y cerebro. - Presenta una acción neuronal y astrocitaria, aumenta el consumo de glucosa en las neuronas y provoca una vasodilatación. - En la periferia, produce la vasodilatación (inducción de la erección), hiperglicemia y diarrea. La somatostatina puede disminuir la producción de VIP por los vipomas. 26 Capitulo 3 Las quimioquinas o quemoquinas (contracción de « chemotactic cytokine ») Estos polipéptidos de bajo peso molecular regulan la migración y la activación de las células inmunocompetentes. Existen 4 familias en función de la posición de sus 4 residuos de cisteína: a) las α quimioquinas, las CXC L (L para ligando o R para receptor) b) las β quimioquinas, las CCL como eotaxina (CCL-11), RANTES (CCL-5) y MCP-3 (CCL-7) interactúan con CCR-3 presente en los eosinófilos, los basófilos y las células Th2. c) las γ quimioquinas, las CL que sólo tienen un residuo cisteína d) las δ quimioquinas, las CX3CL que están representadas por la fractalquina. Existen unos cincuenta para una quincena de receptores. El Th2 expresa diferentes receptores CCR-3, CCR-4, CCR8. Las quimioquinas aseguran el reclutamiento, por ejemplo: IL8 presenta una acción quimiotáctica sobre los PNN Rantes: - producido por los linfocitos T, NK - recluta: 1) los Monocitos y Linfocitos T de memoria y favorece el granuloma de hipersensibilidad retardada. 2) los eosinófilos, y de ahí su papel en el asma. • Su acción quimiotáctica está incrementada por TNFα e IFNγ y disminuida por las citoquinas Th2. MIP 1α y 1β se producen por los linfocitos T, B, Monocitos y Macrófagos y tienen un efecto quimiotáctico sobre los leucocitos sanguíneos, sobre los monocitos y los Linfocitos T. MIP 1α tiene efecto sobre todo en los linfocitos T4 y Linfocitos B; MIP 1β únicamente sobre T8. • IP-10: la proteína 10 activada par el IFN (IFN-Induced Protein 10) tiene un poder quimiotáctico sobre los monocitos y los Linfocitos T. • MIG: monoquina inducida por IFNγ. Estas quimioquinas se producen en los puntos de inflamación, bajo la influencia del IFNγ, TNFα e IL1, por los macrófagos y los fibroblastos. Los leucocitos que colonizan la zona también 27 son productores de quimioquinas. Estos últimos son reclutadores especializados. Por ejemplo, la IL8 se produce bajo la influencia de la toxina estafilocócica y recluta los PNN. El BK desencadena la formación de TNFα e IFNγ que estimulan los macrófagos y los linfocitos T y, por el contrario, no afectan a los polinucleares. Por todos estos mecanismos la inflamación suele ser generalmente un problema local, excepto en el caso del shock séptico por los super Ag. 28 LISTA DE ABREVIATURAS A.A.N. auto anticuerpo (llamado) natural A.A.V. actividad antiviral A.A.T. actividad antitumoral Ac anticuerpo Acm anticuerpos monoclonales A.Ch acetilcolina ACR American College of Rheumatology : por ej. Criterios ACR o respondedores ACR50 (con una reducción de al menos el 50% de los criterios ACR) ACTH hormona adrenocorticotropa ADCC citotoxicidad de mediación celular dependiente de la presencia de anticuerpos ADN ácido desoxirribonucléico ADS algodistrofia simpática refleja Ag antígeno AGRT agouti-related transcript AINEs antiinflamatorios no esteroideos AIT accidente isquémico transitorio AKA Ac antiqueratina (o más bien, anti-stratum corneum) ANCA antineutrophil cytoplasm antibodies c - ANCA antineutrophil cytoplasm antibodies (c = citoplásmico) p - ANCA antineutrophil cytoplasm antibodies (p = periférico o perinuclear) ANTI Sa se trata de las iniciales del primer paciente APC célula que presenta el Ag APC proteína c activada ARN ácido ribonucléico ARNi ARN de interferencia ARNm ácido ribonucléico mensajero ARTM artemina AS antisuero ASLO antiestreptolisina o ATP adenosín trifosfato 29 AVC accidente cerebrovascular B linfocito B BBS bombesina Bcl2 B cell lymphoma / leukemia 2 BCG bacilo de Calmette-Guérin BcR B cell Receptor BDNF brain derived neurotrophic factor BDV Borna Disease Virus bFGF basic fibroblast growth factor BHE (M) barrera hematoencefálica (o meningea) Blys B Lymphocyt Stimulator βMAA β N metil amino-alanina BMI body mass index BMP2 – BMP4 Bone morphogenic protein – Proteína morfogénica ósea BRCA Breast cancer CA Cancer Antigen CART cocaïne and amphetamine-regulated transcript CASPASA Cisteína – ASPartato – proteASA CCK colecistoquinina CCP Ac antipéptidos cíclicos citrulinados – citrullinated peptide antibodies CD cluster of differentiation (clase de diferenciación), moléculas de superficie de las células de origen hematopoyético características de las subpoblaciones funcionales CD4 molécula de superficie característica de los linfocitos T auxiliares CD8 molécula de superficie característica de los linfocitos T citotóxicos cel. célula CIDP polirradiculoneuropatías inflamatorias desmielinizantes crónicas CID coagulación intravascular diseminada CLC (o CT1) cardiotrophine-like cytokine o cardiotrofina 1 CMH I y II complejo mayor de histocompatibilidad de clase I y II CMV citomegalovirus CNTF ciliary neurotrophic factor Cox ciclooxigenasa CPA célula presentadora de antígeno 30 CPK (o CK) creatinfosfoquinasa (o creatina quinasa) CRF corticotropin releasing factor CRP C reactive protein - proteína C reactiva CSF colony stimulating factor CT1 véase CLC CTL linfocito T citotóxico CTLA 4 cytotoxic T lymphocyte – associated antigen 4 CyA ciclosporina A DC 1 y 2 célula dendrítica 1 y 2 DHEA dihidroepiandrosterona DMARDs Disease Modifying Antirheumatic Drugs: antimaláricos, Azatioprina, crisoterapia, ciclosporina A, d-penicilamina, metotrexato, sulfasalazina. DS dilución-sucusión EA early antigen (EBV) EA espondilartritis anquilosante EAE encefalitis autoinmune experimental EB enfermedad de Behçet EBNA Epstein - Barr nuclear antigen EBO endobraquiesófago o esófago de Barrett EEB encefalopatía espongiforme bovina EBV virus de Epstein – Barr EC enfermedad celiaca ECJ enfermedad de Creutzfelt-Jakob ECJnv enfermedad de Creutzfelt-Jakob nueva variante (se transmite de bovino a humano) EGF epidermal growth factor EICI enfermedad inflamatoria crónica intestinal EITD enfermedad inflamatoria del tubo digestivo ELA esclerosis lateral amiotrófica ELISA enzyme-linked immunosorbent assay EMG electromiografía e NOS NO sintetasa endotelial – endothelial nitric oxide synthase 31 EORTC Organización Europea para la Investigación y Tratamiento del Cáncer EPO eritropoyetina ER especies radicalarias ES cells embryonic stem cells Fab fragment antigen-binding FAN factor antinuclear Fc fragmento cristalizable o constante (de las inmunoglobulinas) FcR receptor de la fracción constante de los Ac FGF (α α y β) fibroblast growth factor FILAGGRIN Filament Aggregating Protein FN factor neurotrófico FT factor tisular GABA ácido gammaaminobutírico GALT gut-associated lymphoïd tissue GCSF granulocyte colony stimulating factor GDNF glial cell-line derived neurotrophic factor GH growth hormone GIP-1 glucose dependent insulinotrope polypeptide-1 GLP-1 glucagon like peptide-1 GMCSF granulo-monocyte colony stimulating factor GRP gastrin-releasing peptide (equivalente humano de la bombesina) GvHD graft versus host disease : enfermedad de injerto contra huesped HCL ácido clorhídrico HDL high density lipoprotein HIF-1 hypoxia-inductible factor -1 HIV human immunodeficiency virus HLA human leucocyt antigen HMG-1 high mobility group-1 HP helicobacter pylori HPV human papilloma virus HRI hiperreactividad inmunitaria HSC haematopoietic stem cells : células madre hematopoyéticas hsp 60 y/o 65 proteína de choque térmico - heat shock protein o PPA: proteína de fase aguda 32 HSV-1 herpès simplex virus -1 5 HT 5 hidroxitriptamina = serotonina HTA hipertensión arterial ICAM-1 molécula de adhesión intercelular -1, intercellular adhesion molecule IDI Inmunoterapia a Dosis Infinitesimales (o Inductoras) IEC Inhibidor de la enzima de conversión IFN interferón Ig inmunoglobulina IGF1 insuline growth factor type I IL interleuquina IL1 Ra IL1 receptor antagonist i NOS – e NOS NO sintetasa inducible – NO sintetasa endotelial INR International Normalized Ratio IP-10 proteína 10 activada por el IFNγγ (IFN-Induced Protein 10) IBP inhibidor de la bomba de protones IRM imágen por resonancia magnética IRS insuline receptor substrate KIR killing inhibitory receptor o k.c. immunoglobin - like receptor LAK lymphocyt activated killers LDL low density lipoprotein LED lupus eritematoso diseminado LH hormona luteinizante LIF leukemia inhibitory factor LPS lipopolisacáridos (= endotoxina de las bacterias Gram negativas) LTC (CTL) linfocito T citotóxico LTP ver PLP, long-term potentiation LinfT - LinfB linfocito T - B LT virgen linfocito T que no se ha activado previamente por el antígeno LT αβ γδ población minoritaria de linfocitos T caracterizada por un receptor para el antígeno compuesto por cadenas α y β o γ y δ mab del inglés, esta terminación significa « monoclonal antibody » (Ac monoclonal) Malt tejido linfoide asociado a mucosas (Mucosal associated lymphoïd tissue) 33 MBP myelin basic protein – proteína básica de la mielina MC4-R receptor de melanocortinas del tipo 4 MCH melanin concentrating hormone MCP-1 proteína quimiotáctica de monocitos 1 - monocyte chemotactic protein-1 (o quimioatractante). MCP-2 = Rantes MCSF monocyte colony stimulating factor MGUS Monoclonal Gammapathy of Undetermined Significance MIP macrophage inflammatory protein 1a o 1b MI Micro-Inmunoterapia MIF macrophage migration inhibitory factor MIG monokine induced by IFNγγ Mn monocito MM mieloma múltiple MOG glicoproteína mielínica de los oligodendrocitos Mf macrófago α y β MSH melanocyt stimulating hormone MSRV multiple sclerosis associated retrovirus NFKB nuclear factor KB Ngb neuroglobina NGF nerve growth factor NK natural killer NMDA N-metil-D-aspartato NO monóxido de nitrógeno NOD diabético no obeso NOS NO sintetasa NP neuropéptido NPY neuropéptido y NRTN neurturina NT neurotensina NT3 (4) neurotrofina 3 (4) OGM organismo genéticamente modificado OPG osteoprotegerina OPGL ligando de la osteoprotegerina OR odds Ratio (intervalo de confianza al 95%) 34 OSM oncostatina M OVLT organum vasculasum laminae terminalis PAF platelet activating factor o platelet aggregating factor PAI-1 inhibidor del activador del plasminógeno - 1 PAMP paTh0gen-associated molecular patterns PAN periarteritis nodosa PBCF Pre B-cell Colony Enhancing Factor PBM proteína básica de la mielina PBEF Pre B-cell Colony Enhancing Factor PBSC peripheral blood stem cells: células madre de la sangre periférica PCR polymerase chain reaction - amplificación enzimática del ADN pDC 1 o 2 precursor de las células dendríticas 1 o 2 PDECGF plateled derived endothelial cell growth factor PDEF Pigment Derived Epithelial Factor PDGF plateled derived growth factor PEH periartritis escapulo-humeral PFA proteína de fase aguda Pg prostaglandina PLP potencialización a largo plazo (« long-term potentiation ») PNE polinucleótido eosino PNN polinucleótido neutro Poly I:C poly inosinicum : polycidicum acidum (ARN sintético bicatenario) PPARγγ peroxysome proliferator activated receptor γ PPR pseudopoliartritis rizomélica PR poliartritis reumatoide pro-i proinflamatorio Pr Pres proteína prión proteasa-resistente PRR pattern recognition receptor PRRS pattern recognition receptors PSA prostate specific antigen PSPN persefina PTH paraTh0rmona PTHrp parathyroïd hormone related peptide RAA reumatismo articular agudo 35 Rantes Regulated on Activation Normal cell Expressed and Secreted RIP (receptor interacting protein). Rantes = MCP-2 RCC carcinoma renal de células claras RCH (o RCUH) RCT rectocolitis hemorrágica (o rectocolitis ulcerohemorrágica) receptor para el antígeno de los linfocitos T, distribuído de forma clonal, y compuesto bien por cadenas α y β , bien por cadenas γ y δ RG reflujo gastro-esofágico R.I. respuesta inmune RP reumatismo psoriásico SCF Stem Cell Factor SS síndrome de Sjögren SERMS selective estrogen receptor modulators SFC síndrome de fatiga crónica SGB síndrome de Guillain-Barré SGS síndrome de Gougerot-Sjögren SGSP SGS primario SNC sistema nervioso central SS (o SST o SRIH) somatostatina TAA tumor associated antigens TCR receptor celular T TGFβ β tumor growth factor β Th T helper cells Thp T helper precursor THS tratamiento hormonal sustitutivo TIL tumor infiltrating lymphocytes TIMP tissue inhibitor of metalloproteases TLR toll like receptor TNF tumor necrosis factor TNK natural killers con receptor T TPO trombopoyetina Trk tropomyosine-related kinase TrL linfocito T regulador TSH thyroïde stimulating hormone Tγγ : δ o Tγγδ linfocito T que posee un receptor para el Ag formado por una cadena γ y una 36 cadena δ UAE uveitis autoinmune experimental u PA uroquinasa activadora del plasminógeno VCA viral capsid antigens VCAM-1 molécula de adhesión vascular -1, vascular cell adhesion molecule - 1 VEGF vascular endothelial growth factor VIP polipéptido intestinal vasoactivo VRS virus respiratorio sincitial 37