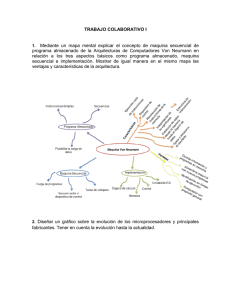
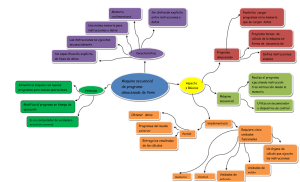
- Ninguna Categoria
UNIVERSIDAD “ DR. JOSE MATIAS DELGADO”.
Anuncio
UNIVERSIDAD “ DR. JOSE MATIAS DELGADO”. FACULTAD DE AGRICULTURA E INVESTIGACION AGRICOLA “JULIA HILL DE O’SULLIVAN”. INGENIERIA AGROINDUSTRIAL. TRABAJO DE GRADUACION: “EVALUACION FISICA Y QUIMICA PARA EVITAR LA OXIDACION EN LA PASTA DE AGUACATE MINIMAMENTE PROCESADA” PREVIA A LA OPCION DEL TITULO DE: Ingeniería en Agroindustria. PRESENTADA POR: Br. Dalia Iris Villalobos Portillo. ASESOR: Lic. Guillermo Bonilla. La Libertad El Salvador Centro América. INDICE. Pagina I INTRODUCCION 1 II GENERALIDADES 2 2.1 Planteamiento de la investigación 2 2.2 Delimitacion de la Investigación 3 2.3 Justificación de la Investigación 3 2.4 Objetivos 5 2.4.1 Objetivo General 2.4.2 Objetivos Especificos 5 5 III REVISION DE LITERATURA 6 3.1 Antecedentes 6 3.2 Generalidades del fruto 6 3.3 Desarrollo y mejoramiento genético del fruto 6 3.4 Manejo Post cosecha 8 3.4.1 Almacenamiento del fruto 3.5 Composición Nutricional del fruto 3.5.1 Lípidos del Aguacate 3.6 Pardeamiento no enzimático (causas y efectos) 8 11 12 12 3.6.1 Proceso de Caramelización 13 3.6.2 Oxidación del acido ascórbico 14 3.6.3 Reacción de Maillard 14 3.6.4 Factores que afectan el pardeamiento no enzimático 14 3.6.5 Temperatura y duración del tratamiento térmico 15 3.6.6 Actividad del agua 15 3.6.7 Acidez del medio 16 3.6.8 Composición del medio 16 3.7 Oscurecimiento o pardeamiento enzimático 17 3.7.1 Estructura de las polifenoloxidasas 18 3.7.2 Reacción de Pardeamiento enzimático 19 3.7.3 Sustratos 19 3.7.4 Control de la reacción de pardeamiento 3.7.5 Otras enzimas relacionadas IV 20 21 22 METODOLOGIA DE LA INVESTIGACION 4.1 Metodología. 22 4.2 Técnicas de Industrialización , aplicación de tratamiento térmico y químico como método de conservación. 4.2.1 Método físico 4.2.2 Método químico V 23 24 25 ANALISIS E INVESTIGACION DE RESULTADOS 5 METODO FISICO 5.1.1 Resultados de estudios microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 75º C por 10 minutos, almacenado en refrigeración 27 27 29 5.1.2 Resultados de estudios Colorimetricos obtenidos al aplicar el mêtodo de esterilizado a 75º C por 10 minutos, almacenado en refrigeración 31 5.1.3 Resultados de estudios bromatológicos obtenidos al aplicar el mêtodo de esterilizado a 75º C por 10 minutos, almacenados en refrigeración 32 5.1.4 Resultados de estudios microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 80º C por 8 minutos, almacenado en temperatura ambiente 32 5.1.5 Resultados de estudios Colorimétricos obtenidos al aplicar el mêtodo de esterilizado a 80º C por 8 minutos, almacenado en refrigeración 33 5.1.6 Resultados de estudios Bromatológicos obtenidos al aplicar el mêtodo de esterilizado a 80º C por 8 minutos, almacenados en refrigeración 34 5.1.7 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 85º C por 6 minutos, almacenado en refrigeración 35 5.1.8 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 85º C por 6 minutos, almacenado en refrigeración 36 5.1.9 Resultados de estudios Bromatológicos obtenidos al aplicar el mêtodo de esterilizado a 85º C por 6 minutos, almacenados en refrigeración 37 5.1.10 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 90º C por 4 minutos, almacenado en refrigeración 37 5.1.11 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 90º C por 4 minutos, almacenado en refrigeración 38 5.1.12 Resultados de estudios Bromatológicos obtenidos al aplicar el mêtodo de esterilizado a 90º C por 4 minutos, almacenados en refrigeración 40 5.1.13 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 75º C por 10 minutos, almacenado a temperatura ambiente 40 5.1.14 Resultados de estudios Colorimétricos obtenidos al aplicar el mêtodo de esterilizado a 7º5 C por 10 minutos, almacenado a temperatura ambiente 41 5.1.15 Resultados de estudios Bromatológicos obtenidos al aplicar el mêtodo de esterilizado a 75º C por 10 minutos, almacenados a temperatura ambiente 42 5.1.16 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 80º C por 8 minutos, almacenado en temperatura ambiente 43 5.1.17 Resultados de estudios Colorimétricos obtenidos al aplicar el mêtodo de esterilizado a 80º C por 8 minutos, almacenado a temperatura ambiente 44 5.1.18 Resultados de estudios Bromatológicos obtenidos al aplicar el mêtodo de esterilizado a 80º C por 8 minutos, almacenados a temperatura ambiente 44 5.1.19 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 85º C por 6 minutos, almacenado a temperatura ambiente 45 5.1.20 Resultados de estudios Colorimétricos obtenidos al aplicar el mêtodo de esterilizado a 85º C por 6 minutos, almacenado a temperatura ambiente 46 5.1.21 Resultados de estudios Bromatológicos obtenidos al aplicar el mêtodo de esterilizado a 85º C por 6 minutos, almacenados a temperatura ambiente 46 5.1.22 Resultados de estudios Microbiológicos obtenidos al aplicar el mêtodo de esterilizado a 90º C por 4 minutos, almacenado a temperatura ambiente 5.1.23 Resultados de estudios colorimétricos obtenidos al aplicar el mêtodo de esterilizado a 85º C por 4 minutos, almacenado a temperatura ambiente 47 47 5.1.24 Resultados de estudios Colorimétricos obtenidos al aplicar el mêtodo de esterilizado a 90º C por 4 minutos, almacenados a temperatura ambiente 5.2 RESULTADOS DE PROCESO QUIMICO, APLICACIÓN DE ACIDOS ORGANICOS 5.2.1 TRATAMIENTO CON ACIDO CITRICO, ALMACENADO AL MEDIO AMBIENTE 48 49 49 5.2.1.1 Evaluacion de analisis bromatológicos en el tratamiento con 0.03% de acido citrico, almacenado a temperatura ambiente. 50 5.2.1.2 Evaluacion de analisis microbiologicos en el tratamiento con 0.03% de acido citrico, almacenado a temperatura ambiente. 51 5.2.1.3 Evaluacion de colorimetria, aplicada al tratamiento con 0.03% de acido citrico, almacenado a temperatura ambiente. 51 5.2.2 TRATAMIENTO CON ACIDO CITRICO, ALMACENADO EN REFRIGERACION 52 5.2.2.1 Evaluacion de analisis bromatologicos, aplicados al tratamiento con 0.03% de acido citrico, almacenado en refrigeracion. 52 5.2.2.2 Evaluacion de analisis microbiologicos, aplicados al tratamiento con 0.03% de acido citrico, almacenado en refrigeracion. 53 5.2.2.3 Evaluacion de colorimetria, aplicada al tratamiento con 0.03% de acido citrico, almacenado en refrigeracion. 54 5.2.3 TRATAMIENTO CON ACIDO ASCORBICO,. ALMACENADO AL MEDIO AMBIENTE 55 5.2.3.1 Evaluacion de analisis bromatologicos, tratamiento con 0.03% de acido ascorbico, almacenado a temperatura ambiente. 55 5.2.3.2 Evaluacion de analisis microbiologicos, tratamiento con 0.03% de acido ascorbico, almacenado a temperatura ambiente. 56 5.2.3.3 Evaluacion de colorimetri, tratamiento con 0.03% de acido ascorbico, almacenado a temperatura ambiente. 57 5.2.4 TRATAMIENTO CON ACIDO ASCORBICO,. ALMACENADO EN REFRIGERACION 5.2.4.1 Evaluacion de analisis bromatologicos con el 0.03% de acido ascorbico , almacenado en refrigeracion. 58 58 5.2.4.2 Evaluacion de analisis microbiologicos con el 0.03% de acido ascorbico , almacenado en refrigeracion. 59 5.2.4.3 Evaluacion de colorimetria en el tratamiento con 0.03% de acido ascorbico , almacenado en refrigeracion. 60 CONCLUSIONES 61 VII RECOMENDACIONES 62 VIII FUENTES CONSULTADAS 63 VI GLOSARIO 64 ANEXOS 70 1 INTRODUCCION El oscurecimiento o pardeamiento enzimático constituyen uno de los principales durante la conservación y procesamiento industrial de algunas frutas y hortalizas. Paralelamente con la alteración de color, se producen cambios en el sabor y pérdidas apreciables del valor nutricional de estos alimentos. Este proceso indeseable es debido a la oxidación de compuestos fenólicos, en reacción catalizada por la enzima Polifenol Oxidasa (PFO). El efecto de la polifenol oxidasa en el proceso oxidativo en frutas como manzanas, peras, duraznos y otros han sido adecuadamente estudiadas; por el contrario, hay muy poca investigación acerca del pardeamiento causado en frutas tropicales, como el caso del aguacate. Para conocer las causales de pardeamiento en el procesamiento del aguacate, se evaluaron los cambios bromatológicos que este sufre en dicho proceso: pH y % de Peróxidos; asimismo se evaluó la calidad microbiológica de dichas muestras para validar el proceso bajo el cual fueron trasformadas. Es por ello que dicha investigación se oriento a la evaluación de métodos aplicables en el procesamiento de la pasta de aguacate utilizando técnicas físico químicas que permitan la transformación de dicho fruto obteniendo la mayor calidad posible y los cambios mínimos durante los procesos. Durante la investigación se evaluó el método físico, el cual consistió en la aplicación de diferenciales de temperatura y tiempo obteniendo así un proceso térmico capaz de inhibir los procesos de oxidación y rancidez sin alterar la calidad sensorial del fruto, así mismo se evaluó el método químico que consistió en la aplicación de ácidos orgánicos a distintas concentraciones, permitiéndonos concluir el proceso mas adecuado para el procesamiento del fruto. 2 II. GENERALIDADES. 2.1 Planteamiento de la Investigación. El aguacate es un fruto que en la actualidad se ha destacado por sus altos índices de consumo, relacionándose directamente con el campo de la investigación e innovación de los alimentos, pues es un fruto perecedero que al aplicarle la tecnología adecuada puede ser explotado y disfrutado en cualquier época del año. Durante el procesamiento de la pasta de aguacate, es necesario tomar en cuenta las características físicas, químicas, nutricionales y microbiológicas del fruto, ya que uno de los objetivos fundamentales del procesamiento de alimentos es la conservación de las características naturales de las materias primas procesadas a través de la aplicación de sustancias adicionales (aditivos, antioxidantes, preservantes etc.) y metodologías que ayuden a la perpetuación de las mismas alargando la vida útil del producto procesado. Por tal razón en la siguiente investigación se estudiaron los métodos aplicables para el procesamiento del fruto del aguacate y se analizaron las condiciones de oxidación y rancidez durante el procesamiento del fruto. Para ello, se analizo la combinación de técnicas fisco-químicas que contribuyen a la conservación del fruto sin opacar o alterar las características naturales del mismo, evaluando las características físicas, químicas, microbiológicas, sensoriales y nutricionales originales de la materia prima procesada, Para llevar a cabo dicha investigación se ha considerado utilizar frutas de bajo valor comercial (NORMA DEL CODEX PARA EL AGUACATE, CODEX STAN 197-1995), pues el objetivo de este es el rescate de aquellas unidades que por si mismas no son capaces de venderse a precios premium. Por tanto, en base a lo anterior, nos planteamos la siguiente incógnita: ¿Cuál seria el proceso más viable y factible para disminuir el proceso de oxidación (oscurecimiento) durante la transformación industrial del aguacate? 2.2. Delimitación de la Investigación 3 El presente trabajo de investigación se delimita a la evaluación físico-química para evitar la oxidación en la pasta de aguacate mínimamente procesada, realizando análisis de técnicas y metodologías aplicables en este procesamiento), utilizando frutos que no pueden clasificarse en categorías superiores de calidad , pero que satisfacen los requisitos mínimos del consumidor para ser considerados como frutos de buena calidad.; se adquirieron en mercados locales ( Antiguo Cuscatlan, Santa Tecla, Mercado Central). A partir de la compra se realizaran las pruebas de procesamiento y conservación en el laboratorio de control de calidad de una empresa procesadora de alimentos. Esta investigación busca aplicar y evaluar métodos físicos y químicos que ayuden a conservar las cualidades: físicas, químicas y microbiológicas, sin alterar las características originales del fruto, y que a la vez, permitan prolongar la vida útil del mismo y llevarlo hasta el consumidor en condiciones óptimas. Después del proceso de conservación fue sometido a análisis sensoriales (color, sabor, textura, olor y apariencia). El panel fue conformado por Jueces entrenados de la empresa antes mencionada. La finalidad de la investigación es validar la mejor técnica de conservación para el fruto del aguacate mínimamente procesado. 2.3 Justificación de la Investigación. La tendencia en el consumo del aguacate a nivel mundial se ha incrementado en los últimos años, debido a sus características nutricionales, pues se ha demostrado que beneficia a la salud humana. Siendo El Salvador uno de los mayores importadores de aguacate en los últimos años (2005-2008), con una importación promedio de 4.8 millones de dólares anuales; equivalentes a 12.20 TM, implica que El Salvador es un importante mercado de consumo para este fruto. Para el año 2008 el consumo per cápita del mismo llego a 3.0 libras. Estos datos muestran que en el país existe un amplio mercado de consumo, por la demanda que este tiene en la población; puede servir como incentivo para productores nacionales al implementar poblaciones comerciales manejadas industrializar el fruto ampliando el mercado nacional e internacional. adecuadamente e 4 Un dato importante es que en países como EEUU se concentran grandes cantidades de Salvadoreños y Centroamericanos, que son amantes al consumo de este fruto, dando la pauta para abarcar mercados internacionales, lo que hace aun mas factible y adecuado el procesamiento del fruto y así poder brindárselo (a todos aquellos que lo deseen), sin importar distancias o tiempos de distribución, puesto que a través de la técnica de conservación físico-química, se estará facilitando y asegurando que se contara con un producto de perfecta calidad, con bajo grado de perecida. Algunos argumentos explican que el aumento en el consumo del aguacate es debido a: el incremento de la población hispana, el interés por la comida étnica y el apogeo de culturas naturistas con bases vegetarianas. Actualmente el Servicio de Mercadeo Agrícola (AMS) de los Estados Unidos, esta conduciendo un programa para incrementar el consumo interno de aguacate en estado fresco y procesado; lo que beneficiara, no solo a los productores americanos, sino también a aquellos países abastecedores de estos productos. Si bien, el aguacate, se consume y se comercializa en estado fresco, este puede potencializar su consumo al industrializarse en diversos productos derivados como: Puré de aguacate congelado, guacamol, aceite comestible, shampoo, mascarillas faciales y capilares, entre otros. Desde el punto de vista comercial, el aguacate constituye una de las frutas de mayor demanda, debido a su versatilidad en el preparado, ya que se puede consumir como fruto, verdura o en combinaciones con otros alimentos; formando con este una amplia variedad de exquisitos platillos, tanto en hogares como en el sector institucional. Es por ello que se considera al fruto del aguacate una materia prima potencialmente procesable a través del uso de técnicas físicas, químicas o combinadas. 5 2.4. Objetivos de la Investigación. 2.4.1. Objetivo General. Establecer procesos físico químicos capaces de disminuir la oxidación enzimática (oscurecimiento), para la elaboración de pasta de aguacate procesado, sin afectar sus características sensoriales, manteniendo su calidad nutritiva, química, física, microbiológica. 2.4.2 Objetivos Específicos. 1. Implementar el método mas adecuado de conservación físico y químico para la elaboración de puré de aguacate mínimamente procesado. 2. Proponer procedimientos factibles para el procesamiento de la pasta de aguacate mínimamente procesada- 3. Efectuar análisis físico químicos y microbiológicos que garanticen la inocuidad de la pasta de aguacate mínimamente procesada y que sirvan como estándares de calidad en el procesamiento de la misma. 4. Evaluar la vida de anaquel de la pasta de aguacate procesado 6 III. REVISIÓN DE LITERATURA. 3.1 Antecedentes. El nombre de aguacate (Persea gratísima, Persea americana), deriva de la palabra nativa “aoacatl” o “ahuacatl” y recibe otros nombres como palta en Sudamérica, abocado en lengua inglesa, evocatier en lengua francesa y abocate en portugués. A partir de pruebas arqueológicas encontradas en Tehuacan (Puebla) con una antigüedad de 12000 años se ha determinado concretamente que es originaria de México. Las perspectivas económicas del aguacate han demostrado ser positivas. Actualmente es un cultivo en expansión. Las principales variedades comerciales de exportación han sido FUERTE, HASS y Nabal ( de origen Guatemalteco y Mexicano), además de la Lula. El aguacate posee valiosísimas propiedades alimenticias por su alto contenido de aceite (12 a 30%) y proteínas (3 a 4 %), además de su contenido de hidratos de carbono, vitaminas y minerales. Estas características le consideran grandes posibilidades en el aumento de su consumo en la dieta humana. Actualmente se esta desarrollando su industrialización en la producción de alimentos , extracción de aceites y productos farmacológicos. 3.2 Generalidades del fruto El aguacate es un fruto que se usa como alimento, procede de un árbol perteneciente a la familia de las lauráceas. La palabra de aguacate procede del termino “aoacatl” que significa testículo, por la apariencia del mismo. Es de color verde oscuro y en ocasiones morados en distintas tonalidades. En México se usa para preparar guacamol. En Perú se usa para preparar palta rellena con camarones y otros. El frió daña a los árboles, por lo que este cultivo se encuentra en países tropicales, y subtropicales. (wikipedia). 7 3.3 Desarrollo y mejoramiento genético del fruto El aguacate es una dicotiledónea perteneciente al orden de las Ranales y la familia de las Laureaceaes. Es un árbol originario de América Central, es decir que en esta región se encuentra el banco genético natural de su población fundamental en la elaboración de los planes de mejoramiento filogenético de esta especie. Los estudios sistemáticos han clasificado mas de 500 variedades, de las cuales la mayoría han sido descartadas para la creación de variedades comerciales, es decir, aquellas que poseen comportamiento adaptado a la producción en escala comercial. De este gran número de variedades la mayoría presentaba problemas en su productividad ( Tiempo de producción, ciclo total, cantidad), y calidad ( contenido de grasa, proteínas, etc.), y en su manejo comercial (Resistencia de transporte y otras características). El hábitat del árbol corresponde a las características ecológicas de las especies subtropicales – tropicales. La mayoría de las variedades comerciales en los países productores , como EEUU, Israel, México, Islas Canarias y en otros, se clasificaron basándose en tres variedades básicas: la mexicana, guatemalteca y antillana. La época de floración en el hemisferio norte puede ser: temprana ( Enero-Febrero), Intermedia (Febrero-Mazo), Tardía (Marzo-Abril). En México , la floración temprana ocurre desde Octubre hasta Diciembre. El período de recolección puede variar de 5 a 15 meses. El peso de la fruta tiene un rango bastante amplio, que en las variedades comerciales oscila entre los 120 grs. a los 2.5 Kgrs. La corteza del mismo va de delgada a gruesa y de arrugada a lisa. Las variedades comerciales mas difundida en la actualidad son resultado de la selección de las tres razas existentes. En El Salvador la especie que más se conoce es la Persea Americana Mill, es originaria de Nuevo México, América Central y el Caribe, aunque existe abundancia de variedades y tipos acordes a diferentes condiciones. Para el país en condiciones bajas ( 500-600 msnm.),”Ereguayquin”; zonas intermedias (400-900 m.s.n.m.), “juguete”, “sitio del niño”, y “Beneke” y para zonas altas ( superiores a 1000 m.s.n.m. se a introducido la variedad “Hass” , que goza de amplia aceptación en el mercado local e internacional. 8 De acuerdo a las variedades el promedio de producción de frutas por árbol varia en: Beneke: 150-200, Ereguayquin: 500; Sitio del niño: 650-800 y Hass 400-800, con poco Manejo (Frutal ES/IICA 2002). 3.4 Manejo Poscosecha. Considerando que el fruto del aguacate tiene un mayor porcentaje de agua en estado inmaduro y aumenta su concentración de aceite cuando esta maduro, se puede considerar la concentración de aceite como un indicador de madurez y por tanto de momento optimo se cosecha. Aunque estas características de concentración fluctúan según la variedad, zona de producción y manejo que se haya realizado. Es decir, la investigación que se haga respecto a lo antes mencionado, es de suma importancia para contar con un indicador ajustado a la zona de producción. Una característica del aguacate, es que una vez cosechado se produce un aceleramiento de la maduración, que lo hace altamente perecible. Sin embargo, el fruto puede estar muchos meses en el árbol, lo que favorece la implementación de adecuados planes de cosecha que consideran la estacionalidad y el momento adecuado de comercialización. La calidad del aguacate, no solo es producto del manejo de la cosecha, sino que un buen manejo precosecha es determinante para el mismo. El Calcio, se constituye en un elemento importante del cultivo del aguacate, debido a que se reduce el proceso de maduración del fruto y el daño por frió. En la medida que el aguacate tenga una mayor concentración de calcio, el proceso de maduración se hace mas lento, además, los desordenes fisiológicos producidos por el frió disminuyen. En la medida que la cosecha se retrase, la concentración de calcio en los aguacates tendera a disminuir y considerando que el contenido de humedad, es también mas bajo, el fruto será mas sensible a los desordenes fisiológicos. Por esta razón, es de suma importancia, que para el proceso de cosecha, se consideren aquellos aspectos que tengan relación con el contenido de calcio en el fruto. 3.4.1 Almacenamiento del fruto 9 La temperatura de almacenamiento es un factor que tiene que ser debidamente controlado. Tanto las altas, como las bajas temperaturas, afectan la calidad del fruto. Si se tienen altas temperaturas un elevado porcentaje de humedad, el proceso de maduración se acelera y se favorece el desarrollo de hongos. A su vez, temperaturas bajas, dificultan la maduración del fruto y provocan daños a la epidermis, algunos en forma de manchas que hacen que el fruto no cumpla con los estándares de calidad exigidos por los mercados demandantes. Lo anteriormente mencionado, dependerá de las variedades y de los tiempos de exposición. Los límites de temperatura para el almacenamiento varían según diversas fuentes: la maduración y la pérdida de firmeza pueden ser retrazadas con un preenfriamiento del fruto recién cosechado y al guardar los frutos en una bodega libre de etileno y con óptima temperatura. Los síntomas comunes de daño por frió son: pulpa café-grisosa, escaldadura, huecos en la cáscara y que el fruto no se ablande apropiadamente al salir del cuarto frió. Variedades sensibles al frió pueden presentar daños incluso a 12.5 ºC; son altamente susceptibles a sufrir daños de temperaturas por debajo de los 10 ºC. Variedades tolerantes al frió son susceptibles a sufrir daños a temperaturas menores a 4.4 ºC y eventualmente a 4.4ºC a temperatura de 7.2 ºC y mayores pueden presentar enfermedades comunes en el aguacate. La composición atmosférica, también se constituye en un factor determinante en la conservación y obtención de un producto de calidad. Referente a esto, un ambiente bajo de etileno, permite demorar la maduración del fruto. Cabe recordar que el aguacate una vez cosechado, acelera el proceso de maduración considerablemente y esto es relevante, máximo si se pretende exportar el producto y considerando que la llegada del producto a los mercados de destino, puede tomar un par de semanas. La atmósfera modificada, consiste en producir cambios en la consistencia normal de la atmósfera (reducir la cantidad de oxigeno y aumentar la participación de anhídrido 10 carbónico) , permite una mejor conservación de los frutos. Los resultados que se obtienen con este tipo de atmósfera en semanas de almacenaje y obtención de frutos de buena calidad, se pueden observar en el cuadro. Tabla Nº 1. Tiempo de conservación de aguacates bajo ambiente controlado. Cultivar Oxigeno Fuerte Hass Gwen Tiempo de Anhídrido Temperatura almacenaje o Comercialización carbónico Ambiente transporte 3 al 5 % 5 al 10% 6º C 2 al 5% 5% 6º C 2 al 5% 5% 6º C 35 días 35 días 35 días 5 días 5 días 5 días Fuente: Frutal ES/ IICA (2008). Una atmósfera que contiene de 3 a 5 % de oxigeno y de 3 a 5 % de dióxido de carbono , retarda el ablandamiento de los aguacates Fuerte que están a 4.4 º C o 7 º C y reduce la velocidad a la cual maduran cuando son trasladados al aire a 15 º C. Una atmósfera que contiene 1% de oxigeno y 9 % de dióxido de carbono a 10 º C, mantiene los aguacates Lulu en condición aceptable para comer y buena apariencia por 60 días. Una presión atmosférica reducida a 60 mm Hg. Retarda la maduración del aguacate Hass por 70 días a 6 º C y el fruto madurara normalmente a 14 º C (7). Los beneficios por reducción de la presión atmosférica son bajos para el aguacate Booth 8, Lula y Waldin a temperaturas frías. Es importante tomar en cuenta que en todo proceso artificial de conservación, también pueden existir alteraciones que produzcan perdidas en la calidad del fruto, como decoloraciones, perdida de sabor o color natural. En general, los problemas físicos típicos que afectan al aguacate corresponden a decoloraciones, manchas, tanto en la parte externa como interna y oscurecimiento de la 11 pulpa. La mayoría de estos ocurren por exposición a temperaturas extremas bajas o por mantener la fruta en ambientes de conservación por tiempos prolongados. Finalmente, las mejores temperaturas para madurar aguacates son de 15.5 ºC a 24 ºC, 15.5 º C es la temperatura ideal para una mejor calidad, sin embargo a esta temperatura la maduración es comparativamente lenta. La maduración a temperaturas de 25 º C y mayores provocan un ablandamiento acelerado , descomposición excesiva, perdida de sabor y color. Etileno puede ser usado para estimular la maduración , así como se usa en los bananos. (Frutal.ES/ IICA.2002) 3.5 Composición Nutricional del fruto. El aguacate es un fruto de origen tropical, aunque actualmente esta disponible en nuestros supermercados durante todo el año. Esta compuesto ( Tabla 1) por grasa, principal componente tras el agua, por lo que su valor calórico es superior al de cualquier otra fruta. Aporta una baja cantidad de hidratos de carbono y menor aun en proteínas. En cuanto a la grasa que contiene, esta es en mayor medida la monoinsaturada; el 72% del total de grasas es el ácido oleico, característico del aceite de oliva. Así mismo es rico en minerales como el potasio, el magnesio y pobre en sodio. Destaca su contenido de provitamina A, Vitamina E, y ciertas vitaminas hidrosolubles del grupo b, como B6 o piroxidina, importante para el funcionamiento del sistema nervioso. Debido a la calidad de su grasa su consumo esta especialmente recomendado en dietas de control de colesterol, aunque debido a su elevado aporte calórico se debe cuidar especialmente la cantidad a consumir. Tabla Nº 2. Composición Nutricional ( 100 g. de aguacate). Kcal. Agua Proteína grasas Hidratos Fibra (ml) s(g) (g.) de C (g.) (g.) K (g.) Mg (g) Provit Vit. C Fosfat Vit. A (Mg) o E (mg) (Mg. ) 12 161 74,3 1,9 15,3 2,4 5 599 39,8 61 7,9 61,9 2,3 Fuente: Consumidor. 3.5.1 Lípidos del aguacate. Por su contenido graso y de vitamina E, se recomienda su consumo a persona con riesgo cardiovascular; pero por ser bastante calórico, se ha de moderar en caso de sobrepeso u obesidad. A continuación se puede observar ( tabla 2) los lípidos que puede aportar el aguacate comparado con un aceite. Tabla No. 3 Lípidos aportados por el aguacate. EN 100 GR. DE AGUACATE. EN 100 GR. DE ACEITE. Fuente Saturados Monoinsaturados Poliinsaturados Saturados Monoinsaturados Polinsaturados. A.R.S. (1) 20 gr. 9,0 gr. 2,0 gr. MAZLIAC (2) 1,7 gr. 10,7 gr. 1,3 gr. 12,3 gr. 78,6 gr 8,6 gr MONTES 0 0 0 7,3 gr. 773, gr. 10,8 gr. Valor promedio 6,1 gr. 6,5 gr. 1,1 gr. 9,8 gr. 77,9 gr. 9,7 gr. Fuente: 1. Departamento de Agricultura de los Estados Unidos. 2. Mazliak y Haendier “ composición del aceite de palta” 1965. 3. Bromatología. Adolfo L. Montes. 1969 3.6 Pardeamiento no enzimático ( Causas y Efectos). El color de los alimentos se debe a diferentes compuestos, principalmente orgánicos o a pigmentos naturales o colorantes sintéticos añadidos. Cuando son sometidos a tratamientos térmicos, los alimentos generan tonalidades que van desde un amarillo ligero 13 hasta un intenso café, mediante las reacciones de Maillard (Braverman, 1988, Yaylan, 1990) y de caramelización. En otras ocasiones, los pigmentos que contienen se alteran y cambian de color. La mayoría de las frutas y vegetales deben su color a diferentes pigmentos, que son sustancias con una función biológica muy importante en el tejido. Existe una gran cantidad de pigmentos relacionados a frutas y vegetales, entre ellos las clorofilas, los carotenoides, las antocianinas, las flavonoides, los taninos, las betalainas, y otros ( Bafui, 1999). El escaldado es una operación previa al procesamiento, que se realiza en frutas y hortalizas y tiene como principal objetivo llevar a cabo la in activación de las enzimas, eliminación de aire ocluido, fijación de color y reblandecimiento del tejido. Una alternativa de escaldado mediante agua caliente es el efectuado con microondas. La energía que proporcionan los microondas origina la fricción de las moléculas debido a la rápida oscilación en el campo magnético y por consiguiente el calentamiento de las misma ( Giese,1992; IFT,1989; Decareu, 1986). Para su aplicación en alimentos, las frecuencias utilizadas oscilan en 2450 y 915 Mhz. Entre sus ventajas esta la rapidez y uniformidad en el tratamiento sin provocar pérdidas de los componentes nutricionales. Según se ha visto anteriormente, tanto los cromogenados como los zumos clarificados son sometidos, a lo largo de todo su proceso de elaboración, a tratamientos térmicos de mayor o menor intensidad, tales como la pasteurización, esterilización o concentración. Estos tratamientos, si bien necesarios, tienen efectos no deseados sobre el producto final, provocando cambios de color, aparición de aromas desagradables, modificaciones en el sabor y perdida o degradación de algunos de sus componentes nutricionales, como vitaminas, azucares y aminoácidos, y además conducen a la formación de productos resultantes de las reacciones de Maillard , 5-hidoximetilfulfural (HMF) y melanoidinas, que confieren al producto final coloraciones oscuras englobadas bajo el termino de pardeamiento no enzimático. En los alimentos estas sustancias no coloreadas pueden formarse principalmente por reacciones de “ caramelización”, oxidación del ácido ascórbico y por la reacción de Maillard. 14 3.6.1 Proceso de caramelización. La caramelización o pirolisis de los azucares monosacáridos se da cuando se calientan por encima de su temperatura de fusión, con reacciones de enolización, deshidratación y fragmentación, formándose derivados furánicos que por polimerización forman pigmentos oscuros. Si se trata de disacáridos debe de existir hidrólisis previa. Los citados derivados furánicos, como el furfural y el 5-hidroximetifurfural (HMF) pueden a su vez reaccionar con compuestos amínicos ( reacción de Maillard). 3.6.2 Oxidación del ácido ascórbico. Esta sustancia se oxida con facilidad en presencia del aire, pasando a furfural con la consiguiente liberación de CO2. Este proceso se da en alimentos ácidos ( pH .=2-3.5), y al calentarse se puede producir tanto en presencia como en ausencia de oxigeno. Esta oxidación tiene lugar en frutas en las que los grupos amino pueden reaccionar con el ácido ascórbico, y son relativamente escasas. Tal es el caso de los cítricos en especial el limón y el pomelo. 3.6.3 Reacción de Maillard. Bajo la denominación de reacciona de Maillard se incluye un complejo sistema de reacciones químicas que tienen lugar durante tratamientos térmicos, entre los grupos carbonilo y amino libre presentes en los alimentos, induciendo la formación de pigmentos pardos y componentes aromáticos en las ultimas etapas de reacción. Muchos autores afirman que la reacción de Maillard es el mecanismo predominante en el pardeamiento no enzimático que tiene lugar durante la elaboración y almacenamiento de zumos y derivados de la fruta, especialmente si se trata de frutas dulces. (tdx. .cosco). 3.6.4 Factores que afectan al pardeamiento no enzimático. La reacción de pardeamiento no enzimático no se desarrolla siempre de la misma forma, y tanto su velocidad como los productos finales que de ella se obtienen dependen de numerosos factores; los mas importantes son: temperatura, actividad del agua y la composición del alimento o medio, al enumerar los principales factores que afectan a las 15 reaccione de pardeamiento no enzimático, coinciden con la relación anterior, aunque dentro del factor composición del medio destacan factores como factores mas importantes el contenido y la naturaleza de los azucares, de los aminoácidos y proteínas y el contenido de metales. 3.6.5 Temperatura y duración del tratamiento. Bajo las mismas condiciones, la temperatura de tratamiento es el factor que influye sobre la velocidad de reacción. Además, también influye en la composición de los productos finales. En general un aumento de la temperatura de tratamiento provoca un aumento en la velocidad de reacción del pardeamiento no enzimático, incluso en ausencia de catalizadores amino. La duración de tratamiento influye en el número y diversidad de los productos finales de la reacción. Estudios realizados en zumo de manzana concentrado de 75º Brix, reflejan que para obtener un incremento del color inicial del 100 % es necesario almacenar el zumo durante mas de 100 días a una temperatura de 20 º C, mientras que si la temperatura de almacenamiento aumentara a 37ºC , el tiempo necesario para obtener el mismo incremento de color se reduce a 20 días. Esto da una idea de la influencia de la temperara en la velocidad del pardeamiento no enzimático en los zumos de las frutas. El pardeamiento no enzimático, como cualquier reacción química, sigue una cinética de reacción cuya constante de velocidad varia con la temperatura siguiendo el modelo de Arrhenius. En el zumo concentrado de melocotón, el pardeamiento, determinado mediante la variación de la absorbancia a 420 mm, presenta una dependencia con la temperatura que puede expresarse según el citado modelo. En estos modelos, la energía de activación indica el grado de dificultad con que una reacción se desarrolla, así como su sensibilidad frente a la temperatura. ( tdx. Cosco). 3.6.6 Actividad del agua. La actividad del agua también tiene una gran influencia sobre la velocidad de reacción de Maillard. A valores altos de aw la velocidad de reacción es baja debido a que los 16 reaccionantes se encuentran diluidos en el agua del medio; a valores de aw bajos, como en alimentos sólidos, la reacción se realiza debido a la reducida movilidad de los reaccionantes. Por lo tanto, la velocidad de reacción es máxima cuando la actividad del agua se encuentra en el rango de 0.6-0.7. Toribio y Cols (1984), tras estudiar la velocidad de pardeamiento no enzimático a distintas concentraciones de sólidos solubles en zumos de manzana, proponen que la máxima velocidad de reacción tiene lugar cuando la aw del medio es 0.55, que corresponde a zumos con una concentración en sólidos solubles en torno a 81 º Brix ( tdx. cosco). 3.6.7 Acidez del medio. Acerca del efecto pH en la reacción de Maillard, algunas investigaciones, en sistemas modelo y en alimentos, han demostrado que en general la reacción es inhibida por valores pH bajos y favorecida por valores altos, sin embargo, en zumos concentrados de manzana se observo un comportamiento opuesto, al estudiar el efecto pH en los distintos modelos de azúcar/ aminoácido, encontró que una disminución del pH provocaba un aumento del tiempo de retardo o inducción. 3.6.8 Composición del medio. La velocidad de la reacción de Maillard depende también de la composición del medio y en especial, de las características de los diferentes azucares y aminoácidos que lo forman, así como la proporción entre ellas. Entre los cuales tenemos (tdx. cosco): a) Naturaleza del azúcar. Young-Hye et al . (1986), estudiaron la capacidad de reacción de los azucares en sistemas modelo, a pH 5.8 , calentados a 100ºC durante 10 horas. Como resultado de sus investigaciones concluyen que la glucosa era más reactiva que la fructosa, esta mas que la lactosa y que la sacarosa era la menos reactiva de los cuatro azucares. La sacarosa, como azúcar no reductora, solo interviene en la reacción una vez que se ha producido su hidrólisis, que se ve favorecida por pH ácidos y elevadas temperaturas. En el caso de muchos zumos y cremogenados de fruta hay que destacar su notable contenido 17 en sacarosa, la cual, a las temperaturas de tratamiento durante el proceso de estos productos, puede hidrolizarse dando glucosa y fructuosa y por tanto, aumente el contenido en azucares reductores que pueden intervenir en las reacciones de Maillard. b) Aminoácidos y proteínas del medio. El tipo de aminoácido influye en la composición de los productos aromáticos finales. El aminoácido mas reactivo es la lisina, mientras que el ácido glutámico y el aspartico parecen tener un efecto inhibidor de la reacción. Han comparado la reactividad de diferentes aminoácidos con algunos azucares reductores, calentando sistemas modelos de azúcar /aminoácido a 121 º C durante 10 minutos. Como resultado de su estudio concluyeron que la lisina es muy reactiva, la alanina tiene una reactividad media y la arginina es poco reactiva. Además, la constante de reacción aumenta cuando el contenido en aminoácidos del medio aumenta. En 1992 encontraron que la presencia de aminoácidos en soluciones modelo que imitaban la composición de zumos concentrados de kiwi tenia una importancia considerable en el pardeamiento. Numerosos autores han investigado la eliminación de aminoácidos de varios zumos de fruta usando resinas de intercambio iónico y el efecto que esta eliminación de aminoácidos tiene sobre los niveles posteriores de pardeamiento. Así , se han observado que la eliminación de aminoácidos provoca reducciones en el nivel de pardeamiento no enzimático en zumo de manzana, zumo concentrado de pero , en zumo de limón , zumo de naranja etc. ( tdx. cosco). 3.7 Oscurecimiento o Pardeamiento enzimático. El pardeamiento enzimático es una reacción de oxidación en la que interviene como sustrato el oxigeno molecular, catalizado por un tipo de enzimas que se puede encontrar en prácticamente todos los seres vivos, desde las bacterias al hombre. En el hombre es la responsable de la formación de pigmentos del pelo y la piel. En los cefalópodos produce el pigmento de la tinta y en los artrópodos participa en el endurecimiento de las cutículas del 18 caparazón, al formar quinonas que reaccionan con las proteínas, insolubilizándolas. En los vegetales no se conoce con precisión cual es su papel fisiológico. La enzima responsable del pardeamiento enzimático recibe el nombre de polifenoloxidasa, fenolasa o tirosinasa, en este último caso especialmente cuando se hace referencia a animales, ya que ellos la tirosina es el principal substrato. También se a utilizado el termino cresolasa, aplicado a la enzima de los vegetales, descubierto primero en los champiñones, en los que el efecto de pardeamiento tras un daño mecánico, como el corte, es muy evidente. En el campo de los alimentos, el pardeamiento enzimático puede ser un problema muy serio en frutas , champiñones, patatas, y otros vegetales y también en algunos crustáceos, e incluso en la industria del vino, al producir alteraciones en el color que reducen el valor comercial de los productos, o incluso los hacen inaceptables para el consumidor. Estas perdidas son muy importantes en el caso de las frutas tropicales y de los camarones, productos trascendentales para la economía de muchos países poco desarrollados. A pesar del nombre genérico de “pardeamiento”, los colores formados son muy variables, marrones, rojizos o negros, dependiendo del alimento y de las condiciones del proceso. En algún caso, como las pasas, otras frutas secas, la sidra, el te o el cacao, el pardeamiento enzimático contribuye al desarrollo de los colores característicos de estos productos, aunque como se a indicado, en otro muchos constituye un problema grave. Además de la alteración del color, los productos formados pueden reaccionar con las proteínas, insolubilizándolas. Por otra parte, puede producirse una perdida nutricional, ya que aunque la polifenoloxidasa no oxida directamente el ácido ascórbico, esta vitamina puede destruirse al reaccionar con intermedios de la reacción. ( milkci.unizar). 3.7.1 Estructura de las polifenoloxidasas. La polifenoloxidasa (E.C. 1.14.18.1) tiene dos actividades enzimáticos, una hidroxilando monofenoles (creolasa) y otra oxidando difenoles a quinonas ( catecolasa). Dependiendo de la fuente, la actividad creolasa es mayor o menor, incluso inexistente en algunos casos. En cambio, todas las enzimas tienen actividad catecolasa. 19 La característica estructural mas importante de estas enzimas es la presencia en su centro activo de dos átomos de cobre unidos cada uno de ellos a tres histidinas, que se han conservado a lo lago de la evolución de todas las enzimas de este tipo, desde las bacterias al hombre. En su entorno se sitúan una serie de aminoácidos hidrofóbicos, con anillos aromáticos, que también son importantes en su actividad, para la unión de sustratos. La forma de la actuación de la enzima, con dos actividades distintas, ha sido un misterio, aclarado en parte hace relativamente pocos años. La enzima cataliza dos reacciones porque en el estado nativo se encuentra en dos formas distintas, la llamada met-tirosina, que es activa solamente sobre monofenoles y la oxitirosinasa. Estas formas se ínter convierten entre ellas de forma acoplada al desarrollo de las reacciones que catalizan. En los crustáceos y en los insectos, la polifenoloxidasa se encuentra en forma de proenzima, inactiva, que es activada por proteolisis por una proteasa endógena. Diversas sustancias producidas por microorganismos activan la proteolisis del proenzima y la formación de enzima activo. ( mikci.unizar) 3.7.2 . Reacción de pardeamiento enzimático. El pardeamiento enzimático es un conjunto completo de reacciones catalizadas en forma enzimático. La primera de ellas, cuando el sustrato presente es un monofenol. Es su transformación en difenol. La segunda, la transformación del difenol en quinona. En el caso de la tirosina (monofenol) se forma primeramente la dopa (difenol) y luego la dopaquinona (quinona). A partir de la formación de la quinona, la reacción progresa de forma espontánea. Las quinonas se pueden convertir en trifenoles por reacción en el agua y posteriormente oxidarse a hidroxiquinonas. Todas estas sustancias son muy reactivas, dando lugar a polímeros y reaccionando con otras sustancias presentes en el alimento, especialmente proteínas. Los productos finales, llamados melaninas, son de color muy oscuro, o negro, e 20 insolubles en el agua. Estos polímeros tienen propiedades antimicrobianas y podrían ser un mecanismo de defensa de los vegetales contra infecciones ( milkci.unizar). 3.7.3 Sustratos. Los sustratos de la reacción pueden ser monofenoles o difenoles. La tirosina es el sustrato principal de la polifenoloxidasa en los crustáceos, y también se encuentra presente en vegetales como la lechuga o en los champiñones. En los vegetales, el sustrato mas extendido es probablemente el ácido clorogenico, en el que el grupo fenolico se encuentra unido a un resto de azúcar que se encuentra entre otros en manzanas, peras, melocotones, aguacates y patatas. En algunos vegetales se encuentran además DOPA, dopamina, p-creso, ácido cafeico y otros fenoles. Las polifenoloxidas son también en muchos casos capaces de oxidar aminas aromáticas para formar o-aminofenoles. (milkci.unizor). 3.7.4 Control de la reacción de pardeamiento. El control natural de la actividad de la polifenoloxidasa se produce fundamentalmente mediante la compartímentalización de los sustratos. La enzima se encuentra en los plásticos y cloroplastos (vegetales superiores), y también en el citoplasma celular, mientras que los compuestos fenolicos que pueden servir de sustratos se acumulan en vesículas. Cuando se rompe la compartí mentalización por un daño mecánico, como el triturado, corte o congelación y descongelación, la reacción de pardeamiento se puede producir. También se produce la inhibición de la enzima por los productos de la reacción. Además de mantenimiento la compartí mentalización, la reacción de pardeamiento se puede frenar actuando sobre diferentes factores: Evitando el contacto del oxigeno con la superficie del corte. Bajando la temperatura. Reduciendo el pH. Desnaturalizando la enzima. 21 Aplicando choques térmicos en el proceso de industrialización. Generalmente estos factores actúan de forma combinada. Así, el descenso de pH puede actuar inicialmente reduciendo la actividad de la enzima. (Su pH optimo esta entre 5 y 7) pero también, si es suficientemente bajo, desnaturalizándola de forma irreversible. Los reductores pueden actuar de varias formas, entre ellas revirtiendo la reacción de quinonas a fenoles. También pueden actuar directamente sobre el centro activo de la enzima, transformando el cobre 2 en cobre 1, que se disocia más fácilmente. El sulfito y la cisteina, además de reaccionar con las quinonas reduciéndola a difenoles, inactiva en la enzima. Los sulfitos presentan el problema de su toxicidad diferenciada para algunas personas, un pequeño porcentaje de los asmáticos, que pueden sufrir crisis severa con cantidades inferiores a lo limites legales. Consecuentemente, existe una tendencia a reducir la utilización de sulfitos aunque no siempre es posible. Un inhibidor muy eficiente en la actividad de la polifenoloxidasa de los crustáceos es ácido bórico, aunque actualmente esta prohibido su uso, dado los riesgos de su toxicidad. El ácido ascórbico, es un inhibidor de la reacción muy eficaz al principio , al reconvertir las quinonas en fenoles, pero la inhibición es solamente temporal, al agotarse el ácido ascórbico con el transcurso de la reacción. Además posteriormente puede causar problemas, ya que el dehidroascorbico formado pueda dar lugar a una reacción de pardeamiento especifica. Dependiendo de las condiciones de uso, el ácido ascórbico puede también destruir la enzima al modificar las histidinas del centro activo o reacciones mediadas por radicales libres. Los agentes quelantes, capaces de eliminar los átomos de cobre del centro activo de la enzima, y consecuentemente inactivarla, son inhibidores muy eficientes. Puede utilizarse EDTA, pirofosfato, y especialmente el ácido cítrico que combinan el efecto de acidez con la capacidad secuestrante de metales. 3.7.5 Otras enzimas relacionadas. Las lacasas (E.C. 1.10.3.2) son capaces de oxidar difenoles con los grupos OH en posición para. Estas enzimas tienen un centro semejante al de la polifenoloxidasa, también 22 con iones de cobre unidos a la histidina, pero el mecanismo de actuación es distinto. En la reacción se generan radicales libres, que pueden inducir otras reacciones de oxidación. Son glicoporteinas con un importante contenido de glucidos y generalmente son muy poco específicas en cuanto a sustrato. Se encuentran en algunos vegetales superiores, pero sobre todo en algunos hongos fitopatogenos. Pueden representar un problema en caso de la contaminación de las uvas. (milkci. Unizar). IV. METODOLOGÍA DE LA INVESTIGACION. 4.1 Metodología. El aguacate es producto tropical con muchas bondades nutricionales, por ser altamente perecederos, el fruto del aguacate exige un mejor manejo en poscosecha por parte de los actores del proceso de producción, comercialización y consumo. Por lo anterior surge la necesidad de buscar alternativas para su conservación, que permitan prolongar la vida útil sin alterar las características sensoriales del mismo. Esta investigación evaluó los métodos físicos y químicos que eviten la oxidación de la pasta de aguacate mínimamente procesada. Para ello la investigación se desarrollo en las siguientes etapas: Primera etapa: Se compilo información acerca de la naturaleza del fruto del aguacate y de los métodos aplicados actualmente para el procesamiento del mismo para verificar las posibles mejoras en los procesos actuales. Segunda etapa: Esta etapa consistió en la elaboración y presentación del anteproyecto de dicha investigación. Tercera etapa: ya planteada la metodología se efectuó la selección de la materia prima que se utilizo para elaborar la pasta de aguacate, la cual fue sometida a diferentes métodos de conservación ( físicos y químicos); de aquí se planteo procesar la variedad mas consumida por la población salvadoreña, ya que estas tienen preferencias de uso, en diferentes platillos: Hass. 23 Cuarta etapa: Ya seleccionadas las materias primas , se procedió a realizar los productos de acuerdo a los métodos antes mencionados, por otra parte se buscaron métodos combinados para evaluar la efectividad en la conservación de la pasta minimamente procesada. Las muestras se sometieron en dos condiciones de almacenamiento: refrigeración (2-3ºC) , a temperatura Ambiente (23 º C) . Durante el procesamiento de las muestras se evaluaron los cambios de los productos escaldados, para confirmar la hipótesis que el choque térmico, inhibe la actividad enzimático de la polifenoloxidasa y peroxidasa . Quinta etapa: Después de elaborar los productos fue necesario evaluarlos para confirmar su composición, se realizaron análisis bromatológicos (pH, % de peróxidos), y cambios calorimétricos cualitativos, Factores esenciales para medir su composición y calidad. Otro parámetro evaluado fue el microbiológico donde se determinaron:, Unidades formadoras de colonia, Recuento de Hongos y levaduras, E. colli y Salmonella. La vida de anaquel del puré de aguacate varió de acuerdo a las condiciones de proceso y almacenamiento, por lo que este fue uno de los objetivos primordiales durante la investigación. Sexta etapa: Se elaboro un documento que detalla cada uno de los pasos utilizados para la realización de la investigación, con el fin de brindar Información didáctica, sencilla y práctica para quien lo requiera. 4.2 Técnicas de Industrialización, aplicación de tratamiento térmico y químico como método de conservación. Materia Prima: se puede definir como pulpa o pasta y será obtenida de los frutos sanos de aguacate de la variedad Hass 24 Obtención de Materias Primas: Los aguacates comerciales, se seleccionaron bajo la norma CODEX STAN 197-1995 con esto se trató de darle un mejor valor agregado a los frutos de menor tamaño ya son catalogados como de menor calidad como el caso del aguacate Hass, estos fueron adquiridos en el mercado de Santa Tecla y Lourdes. Clasificación: En esta etapa se hizo una clasificación de los aguacates maduros; ya que estos nos aportaran las características deseadas del fruto para su procesamiento. Índice de Madurez: Se escogieron aquellos frutos que al apretarse cedían suavemente a la palma de la mano, pero que eran firmes y que carecían de manchas en la cáscara. Proceso: El aguacate fue sometido a la extracción de la pulpa y separación de la cáscara y semilla. Una vez extraída la pulpa o carne fue molido en un procesador de alimentos, obteniendo un puré firme. 4.2.1. Método físico. 1. Los aguacates maduros se lavaron con el objetivo de eliminar materias extrañas y para evitar contaminaciones (microorganismos). 2. Se extrajo 5 libras de pulpa de aguacate, utilizando una espátula de acero inoxidable, previamente sanitizada con Divosan NH10. 3. Posteriormente fueron escaldadas por 120 segundos en agua a una temperatura de 90 C y luego se molieron en un procesador de alimentos casero (previamente sanitizado con Divosan NH 10) , Marca White Westinhouse Modelo WCH0100-mini choper, capacidad de 1 lb., Deposito Plástico, con cuchillas de acero inoxidable a una velocidad de 120Hz , hasta obtener un puré firme , aprox. 2 min. por cada batch. 4. Luego se envasaron en bolsas retortables de Pet/Naylon/Rcpp con una capacidad de 227 gr. Se sometieron a distintos procesos térmicos, procesando cinco muestras para cada condicional de tiempo y temperatura, estas condiciones fueron basadas en las condiciones mínimas de tratamiento térmico para lograr esterilidad comercial; luego Fueron almacenadas en dos condiciones diferentes, a temperatura ambiente (23ºC) y refrigerado (2-3ºC) 25 Tabla No. 4 Aplicación de procesos térmicos. BATCH DE PRODUCCION TEMPERATURA (ºC) Muestra A Muestra B Muestra C Muestra D 75 80 85 90 TIEMPO (minutos) 10 8 6 4 5 Posterior al proceso térmico, se inicia el periodo de evaluación. 6 Se identificaron las muestras para ser analizadas bromatológica y microbiologicamente; Las cuales se almacenaron en dos condiciones: T. Ambiente (23º C) y refrigeración (3ºC). Estas fueron evaluadas a los 15 ,30 y 45 días. Una vez abierto se evaluó la muestra con estabilidad comercial a los 3 días. 4.2.2 Método químico. El aguacate es un fruto que se obscurece rápidamente, por lo que se aplico un método químico que ayudara a retardar el deterioro enzimático y no enzimático a través de la aplicación de ácidos orgánicos. Para ello se utilizaron dos ácidos orgánicos en diferentes concentraciones para conocer cual de ellos y a que concentración es el que evita que actúe la enzima en el oscurecimiento. A continuación se muestran las concentraciones de ácidos orgánicos a aplicar al puré de aguacate para extraer una muestra sin alteraciones sensoriales, la cual fue procesada y evaluada. Tabla No. 5: Aplicación de ácidos orgánicos. PORCENTAJES A UTILIZAR Reactivo Ácido cítrico Muestra 1 0,01% Muestra 2 0,03% Muestra3 0,05% Muestra 4 1% 26 Ácido ascórbico 0,01% 0,03% 0,05% 1% Se elaboró un panel sensorial (Jueces entrenados) con 10 participantes, de los cuales el 87% no indicó diferencia y el 13% indicó deferencias sensoriales a las muestras del tratamiento con el 0.05% de ácidos) tomando en cuenta dichos resultados se pudo concluir que las características sensoriales empezaban a cambiar a partir del 0.05% de aplicación de ácidos en general, por lo que se decidió utilizar la concentración anterior que es del 0.03% Las muestras fueron preparadas de la siguiente manera: 1. Los aguacates maduros se lavaron con el objetivo de eliminar materias extrañas y para evitar contaminaciones (microorganismos). 2. Se extrajo 1 libra de pulpa de aguacate, utilizando una espátula de acero inoxidable, previamente sanitizada con Divosan NH10, utilizando una balanza digital de Precisión Ohaus ARC 210, con precisión de 0.01. 3. Posteriormente fue escaldada por 120 segundos en agua a 90 Cy molida en un procesador de alimentos casero, Marca White Westinhouse Modelo WCH0100-mini choper, capacidad de ½ lb., Deposito Platico, con cuchillas de acero inoxidable a una velocidad de 60Hz , hasta obtener un puré firme , aprox. 1 min. por cada batch. Cuando se tenía la mitad del procesamiento (0.30 segs, estimados por prueba de procesamiento), se agrego el 0.03% de ácido ascórbico (sin dejar de procesar) , para pesar el ácido se utilizó una balanza analítica Ohaus adventure ARC120 de 0.0001 de precisión. Cálculos: (Peso puré * 0.03)/100. 27 4. Luego se envasaron en frascos de vidrio de 4 Oz. 5. Se almacenaron en dos condiciones diferentes. T. Ambiente (23˚ c) y Refrigeración (3˚ C). 6. Se analizaron bromatológica y sensorialmente a los 15, 30,33 y 35 días. V. ANÁLISIS E INTERPRETACION DE RESULTADOS. 5.1 Método físico. Como se refirió en la etapa de la metodología de la investigación, se ha hecho uso del método físico, aplicando el proceso de esterilización en distintos lapsos de tiempo, esto con el fin de inactivar las enzimas peroxidasa y polifenoloxidasa que son los causantes de la oxidación en los vegetales, así como la inhibición de bacterias, hongos, levaduras y otros microorganismos contaminantes y deterioradores de los alimentos. Los análisis bromatológicos (pH y % peróxidos) fueron realizados en el laboratorio de Bon Appetit. S.A. de C.V., así como los análisis Microbiológicos (UFC, Hongos y Levaduras, e. Colli, Salmonella). a) Variables: 1. Madurez del aguacate. 2. Temperatura 3. Tiempo de procesamiento (Esterilidad) 4. Almacenamiento. b) Presentación de los resultados. Para el caso del Método físico, se consideraron 4 variables, que afectan al puré de aguacate como producto terminado, entre estas podemos mencionar: 28 * La Madurez del aguacate, Esta incide directamente en la calidad del producto procesado ya que si este es de inmaduro a medianamente inmaduro la tendencia de coloración con el transcurso del tiempo es amarillenta, sin embargo el aguacate es muy maduro la tendencia en la pigmentación tiende café a pardo (gris-vino). * Al aplicar mayores temperaturas por tiempos más cortos, la inactividad de las enzimas se mantiene constante, ya que no hay cambios de pigmentación a los 15,30 y 33 días. El tratamiento térmico inhibe el oscurecimiento de la pulpa del aguacate Hass, pero este no debe ser muy severo, ya que esto induce el sabor amargo y la decoloración * Se pudo notar que las muestras almacenadas en refrigeración (3-5 C) mostraron mayor estabilidad microbiológicas a los 15, 30 y 33 días. Resultados de la Aplicación de Métodos físicos sometidos a 4 tratamientos Térmicos. La aplicación de métodos físicos consistió en el sometimiento de las muestras a 4 tratamientos Térmicos: 1) 75 º C por 10 minutos, 2) 80 º C por 8 minutos 3)85 º C por 6 minutos y 4) 90 º C por 4 minutos, luego se almacenaron en refrigeración y a temperatura ambiente, obteniendo los siguientes resultados: Tabla No. 6: Resultados Aplicación de procesos físicos almacenados en refrigeración. pH % Peróxidos Meq/ kg grasa UFC SALMO NELLA CONDICIONAL EVAL. MUEST. HyL E.colli (Grs) 15 dias 1 TEMP . 75˚ C 30 dias 1 75˚ C 10 minutos 5.10 0.25 2100 0 0 0 45 dias 1 75˚ C 10 minutos 4.10 0.32 2800 0 0 0 15 dias 2 80˚ C 8 minutos 6.80 0.65 0 0 0 0 30 dias 2 80˚ C 8 minutos 6.70 1.32 0 0 0 0 45 dias 2 80˚ C 8 minutos 6.70 1.97 0 0 0 0 15 dias 3 85˚ C 6 minutos 7.10 0.20 0 0 0 0 30 dias 3 85˚ C 6 minutos 7.10 0.30 0 0 0 0 TIEMPO 10 minutos 6.00 0.18 1500 0 0 0 29 45 dias 3 85˚ C 6 minutos 7.10 0.32 0 0 0 0 15 dias 4 90˚ C 4 minutos 7.60 0.30 0 0 0 0 30 dias 4 90˚ C 4 minutos 7.50 0.40 0 0 0 0 45 dias 4 90˚ C 4 minutos 7.50 0.41 0 0 0 0 5.1.1 Resultados de estudios Bromatológicos obtenidos al aplicar el método esterilizado a 75 º C por 10 minutos. almacenado en refrigeración. ANALISIS DE PH Y % DE PEROXIDOS. VALORES 8 PH 6 4 2 0 15 DIAS 30 DIAS 45 DIAS % PEROXIDOS ( meq/kg gras a) TIEMPO EVALUADO Figura No. 1: Evaluación de pH y Peróxidos tratamiento 75º C por 10 minutos, almacenado en refrigeración. de 30 En la gráfica se puede observar que los valores de pH son inestables, obteniendo a los 15 días un valor de 6, a los 30 días 5.1 y a los 45 días 4.1; esto causado por contaminación microbiológica, ya que se presentó abombamiento en 3 unidades. En cuanto al porcentaje de peróxidos tiende al aumento, lo que indica que el proceso de oxidación continúa con su curso obteniendo resultados de 0.18 meq/kg de grasa a los 15 días, 0.25 meq/kg de grasa a los 30 días y 0.32 meq/kg de grasa a los 45 días. 5.1.1 Resultados de estudios microbiológicos obtenidos al aplicar el método de esterilizado a 75º C por 10 minutos, almacenado en refrigeración. Valores UFC. UNIDADES FORMADORAS DE COLONIAS. 3000 2500 2000 1500 1000 500 0 UFC (unidades formadoras de colonias) 15 DIAS 30 DIAS 45 DIAS Periodo evaluado Figura No. 2: UFC tratamiento 75º C por 10 minutos, almacenado en refrigeración. 31 Valores Salmonella, E. colli, Hongos y Levaduras. 1 0.5 Salmonella 0 15 DIAS 30 DIAS 45 DIAS Periodo evaluado HyL E. colli Figura No. 3: Análisis Microbiológicos, tratamiento 75º C por 10 minutos, almacenado en refrigeración. Se puede observar que la muestra procesada por 10 minutos a una temperatura de 75º C, No es microbiológicamente estable, ya que hay crecimiento de unidades formadoras de colonias a los 15 días, se presentaron 3 unidades abombadas , No hay presencia de Salmonella, E. colli y Hongo y levaduras. Podemos concluir que el proceso térmico no es capaz de inhibir el crecimiento bacteriano. 5.1.2 Resultados de estudios colorimétricos obtenidos al aplicar el método de esterilizado a 75 º C por 10 minutos, almacenado en refrigeración. 32 Figura No. 4: Puré de aguacate minimamente procesado, tratamiento 75º C por 10 minutos, almacenado en refrigeración. La coloración de la pasta de aguacate tiende al verde oscuro, el proceso de oxidación inicia a los 2 días. 5.1.3 Resultados de estudios Bromatológicos obtenidos al aplicar el método de tratamiento a 80º C por 8 minutos, almacenado a temperatura ambiente. 33 ANALISIS DE PH Y % DE PEROXIDOS. VALORES 8 PH 6 4 2 0 15 DIAS 30 DIAS 45 DIAS TIEM PO EVALUADO % PEROXIDOS (meq/kg grasa) Figura No. 5: Evaluación de pH y % de peróxidos , tratamiento 80 º C por 8 minutos, almacenado en refrigeración. Se puede observar que el Ph tiende a la estabilidad, sin embargo aun hay aumento el porcentaje de índices de peroxido, lo que indica que no se ha detenido el proceso de oxidación ya que a los 15 días hay 0.65 meq/kg grasa, a los 30 días 1.32 meq/ kg grasa y a los 45 días 1.97 meq/kg grasa. 5.1.4 Resultados de estudios Microbiológicos, obtenidos al aplicar el método de esterilizado a 80ºC por 8 minutos, almacenado en refrigeración UFC. UNIDADES FORMADORAS DE COLONIA.. Valores 500 UFC (unidades formadoras de colonias) 0 15 DIAS 30 DIAS 45 DIAS Periodo evaluado Figura No. 6: UFC , tratamiento 80 º C por 8 minutos, almacenado en refrigeración. 34 Valores Salmonella, E. colli, Hongos y levaduras. 1 0.5 Salmonella HyL 0 15 DIAS 30 DIAS 45 DIAS E. colli Pe riodo e valuado Figura No. 7: Análisis microbiológicos, tratamiento 80 º C por 8 minutos, almacenado en refrigeración. Se puede observar que no hay crecimiento de unidades formadoras de colonias, y no hay presencia de hongos y levadura, E. Colli, ni salmonella. La muestra es microbiológicamente estable a los 15, 30 y a los 45 días. Por lo que se puede concluir que el proceso térmico fue capaz de inhibir el crecimiento microbiano. 5.1.5 Resultados de estudios colorimétricos obtenidos al aplicar el método de esterilizado a 80 º C por 8 minutos, almacenado en refrigeración. 35 Figura No. 8: Puré de aguacate mínimamente procesado, tratamiento 80 º C por 8 minutos, almacenado en refrigeración. La variación de la pigmentación tiende a un verde pardo más leve que la muestra procesada a 75 C, sin embargo, aun no se ha controlado el proceso de oxidación. 5.1.6 Resultados de estudios Bromatológicos obtenidos al aplicar el método de esterilizado a 85 º C por 6 minutos. almacenado en refrigeración. ANALISIS DE P Y % DE PEROXIDOS. VALORES 8 PH 6 4 2 0 15 DIA S 30 DIA S 45 DIAS TIEM PO EVALUADO % PEROXIDOS( meq/kg grasa) Figura No. 9: Evaluación de pH y % de peróxidos, tratamiento 85º C por 6 minutos, almacenado en refrigeración. El pH es estable, a los 15, 30 y 45 días (Es necesario destacar que el proceso térmico tiende a aumentar el pH del producto procesado); tiende a la estabilidad. el porcentaje de peróxidos 36 5.1.7 Resultados de estudios microbiológicos obtenidos al aplicar el método de esterilizado a 85º C por 6 minutos, almacenado en refrigeración. UFC. UNIDADES FORMADORAS DE COLONIAS. Valores 500 UFC (unidades formadoras de colonias) 0 15 DIAS 30 DIAS 45 DIAS Periodo evaluado Figura No. 10: UFC (Unidades formadoras de colonia)s, tratamiento 85º C por 6 minutos, almacenado en refrigeración. Salmonella, E. colli, Hongos y Levaduras. Valores 1 Salmonella 0.5 HyL E. colli 0 15 DIAS 30 DIAS 45 DIAS Pe riodo evaluado Figura No. 11: Analisis microbiologicoss, tratamiento 85º C por 6 minutos, almacenado en refrigeración. No se presenta crecimiento microbiológico, no hay presencia de unidades formadoras de colonia, hongos y levaduras, E. collie, Salmonella. El producto es microbiológicamente estable. 37 5.1.8 Resultados de estudios colorimétricos obtenidos al aplicar el método de esterilizado a 85 º C por 6 minutos, almacenado en refrigeración. Figura No. 12: Puré de aguacate mínimamente procesado, tratamiento 85º C por 6 minutos, almacenado en refrigeración. La muestra procesada a 85˚ C por un lapso de 6 minutos, presenta muy buena estabilidad colorimétrica a los 15 días, no hay variación perceptible en el color, sin embargo a los 30 días hay una leve variación de color, con tendencia a un verde claro. Esta muestra ha demostrado tener estabilidad físico química, microbiológica y colorimétrica. Sensorialmente es aceptable. (Según resultado de análisis sensorial el 6% percibió notas ligeramente amargas, resabio). 38 5.1.9 Resultados de estudios Bromatológicos obtenidos al aplicar el método de esterilizado a 90 º C por 4 minutos. almacenado en refrigeración. ANALISIS DE PH Y % DE PEROXIDOS. pH VALORES 8 6 4 2 0 15 DIAS 30 DIAS 45 DIAS TIEM PO EVALUADO % DE PEROXIDOS (meq/kg grasa) Figura No. 13: Evaluación de pH y % de peróxidos, tratamiento 90º C por 4 minutos, almacenado en refrigeración. Se puede verificar que el pH y el % de peróxidos se mantienen estables, el proceso térmico aplicado fue capaz de estabilizar la química del producto terminado. 5.1.10 Resultados de estudios microbiológicos obtenidos al aplicar el método de esterilizado a 90º C por 4 minutos, almacenado en refrigeración. UFC. UNIDADES FORMADORAS DE COLONIAS. Valores 10 UFC. (Unidades formadoras de colonia) 5 0 15 DIAS 30 DIAS 45 DIAS Periodo evaluado Figura No. 14: UFC , tratamiento 90º C por 4 minutos, almacenado en refrigeración. 39 Sa lmone lla, E. colli, Hongos y Le vadura s. 1 Valores Salmonella 0.5 HyL E. colli 0 15 DIA S 30 DIA S 45 DIAS Pe riodo e valuado Figura No. 15: Análisis microbiológicos, tratamiento 90º C por 4 minutos, almacenado en refrigeración. Se puede observar que la actividad microbiana ha sido estabilizada y este producto es seguro para consumo humano; no hubo crecimiento de UFC a los 15, 30 y 45 días, de igual manera no hubo conteo de salmonella , hongos y levaduras, y E. colli, el proceso térmico es capaz de inhibir el crecimiento microbiano, el tiempo de residencia del producto en el autoclave y la temperatura del tratamiento fueron capaces de inhibir el crecimiento y reproducción de agentes microbianos, haciendo de este un producto inocuo y seguro para consumo. 5.1.11 Resultados de estudios colorimétricos obtenidos al aplicar el método de esterilizado a 90º C por 4 minutos, almacenado en refrigeración. Figura No. 16: Puré de aguacate minimamente procesado, tratamiento 90º C por 4 minutos, almacenado en refrigeración. 40 Se puede observar que hay una mínima variación de color , la pigmentación tiene leves variantes amarillentas claras, que no son significativas , sin embargo sensorialmente el sabor ha variado, ya que hay presencia de notas amargas que se atenúan con el paso del tiempo, Esta muestra es bromatológica, microbiológica y colorimetricamente estable, sin embargo la tendencia palatal es al cambio ( se hizo análisis sensorial con panel de jueces entrenados y el 75% encontró la muestra amarga) por lo que no se recomienda utilizar este proceso térmico ya que afecta las características sensoriales del aguacate. RESULTADOS DE METODOS FISICOS EXPUESTOS A TEMPERATURA AMBIENTE. Tabla No. 7 Resultados de la aplicación de métodos físicos almacenados a temperatura ambiente. CONDICIONAL EVAL. MUESTRA PH TEMP. TIEMPO %PEROXIDOS SALMO ufc/g meq/kg grasa NELLA HyL (Grs) E. CO LLI 15 dias 1 75˚ C 10 minutos 6.00 0.190 1300 0 0 0 30 dias 1 75˚ C 10 minutos 5.70 0.270 2700 0 0 0 45 dias 1 75˚ C 10 minutos 5.40 0.330 3400 0 0 0 15 dias 2 80˚ C 8 minutos 6.20 0.210 1000 0 0 0 30 dias 2 80˚ C 8 minutos 6.00 0.298 2300 0 0 0 45 dias 2 80˚ C 8 minutos 5.80 0.397 2900 0 0 0 15 dias 3 85˚ C 6 minutos 6.40 0.145 0 0 0 0 30 dias 3 85˚ C 6 minutos 6.34 0.173 0 0 0 0 45 dias 3 85˚ C 6 minutos 7.10 0.200 0 0 0 0 15 dias 4 90˚ C 4 minutos 6.70 0.420 0 0 0 0 30 dias 4 90˚ C 4 minutos 6.40 0.479 0 0 0 0 45 dias 4 90˚ C 4 minutos 6.20 0.523 0 0 0 0 41 5.1.12 Resultados de estudios Bromatológicos obtenidos al aplicar el método de esterilizado a 75 º C por10 minutos, almacenado temperatura ambiente. ANALISIS DE PH Y % DE PEROXIDOS. Valores 8 6 pH 4 % Peroxidos 2 0 15 DIAS 30 DIAS 45 DIAS tie m po e valuacion Figura No. 17: Evaluación de pH y % de peróxidos o , tratamiento 75º C por 10 minutos, almacenado en temperatura ambiente. El análisis bromatológico indica que hay disminución en el pH, y el porcentaje de peróxidos tiende a incrementarse, por lo que podemos mencionar que el proceso de oxidación no se ha detenido. 5.1.13 Resultados de estudios microbiológicos obtenidos al aplicar el método esterilizado a 75 º C por10 minutos, almacenado temperatura ambiente. Valores UFC. UNIDADES FORMADORAS DE COLONIAS.. 6000 3000 0 15 DIAS 30 DIAS 45 DIAS UFC (unidades formadoras de colonias) Periodo evaluado Figura No. 18: UFC , tratamiento 75º C por 10 minutos, almacenado en temperatura ambiente. de 42 V alores Salmonella, Hongos y Leva duras y E. colli 1 0.5 Salmonella 0 HyL 15 DIA S 30 DIA S 45 DIA S E. colli Pe r iodo e valuado Figura No. 19: Análisis Microbiológicos, tratamiento 75º C por 10 minutos, almacenado en temperatura ambiente. Se puede observar que La muestra procesada por 10 minutos a una temperatura de 75º C, no es microbiológicamente estable, pues se evidencia crecimiento de UFC, Hongos y levaduras; No hay presencia de E. colli y Salmonella. El proceso térmico al que fue sometido no es capaz de inhibir el crecimiento microbiano. 5.1.14 Resultados de estudios colorimétricos obtenidos al aplicar el método esterilizado a 75 º C por10 minutos, almacenado temperatura ambiente. Figura No. 20: Puré de aguacate minimamente procesado, tratamiento 75º C por 10 minutos, almacenado en temperatura ambiente. de 43 Se puede observar que esta muestra la variación de color tiende a un verde oscuro, a los 3 días, por lo que no es colorimetricamente estable, demostrando que el proceso de oxidación de la pasta continua a pesar del proceso térmico aplicado. 5.1.15 Resultados de Estudios Bromatológicos obtenidos al aplicar el metodo de esterilizado a 80º C por 8 minutos, almacenado a temperatura ambiente. ANALISIS DE PH Y % DE PEROXIDOS Valores 8 6 pH 4 % Peroxidos 2 0 15 DIAS 30 DIAS 45 DIAS tie m po e valuacion Figura No. 21: Evaluación de pH y % de peróxidos, tratamiento 80º C por 8 minutos, almacenado en temperatura ambiente. Se puede observar que hay disminución en el pH de la pasta, los porcentajes de peróxidos tienden a la alza, lo que indica que el proceso térmico aplicado y el método de almacenaje no son capaces de inhibir el proceso de oxidación. 44 5.1.16 Resultados de Estudios Microbiológicos obtenidos al aplicar el método de esterilizado a 80 C por 8 minutos, almacenado a temperatura ambiente. UFC. UNIDADES FORMADORAS DE COLONIA. Valores 6000 CS (unidades formadoras de colonias) 3000 0 15 DIAS 30 DIAS 45 DIAS Periodo evaluado Figura No. 22: UFC , tratamiento 80º C por 8 minutos, almacenado en temperatura ambiente. Sa lmone lla , Hongos y Le va dura s, E. colli. V alores 1 Salmonella 0.5 HyL E. colli 0 15 DIA S 30 DIA S 45 DIA S Pe r iodo e valuado Figura No. 23: Análisis Microbiológicos, tratamiento 80º C por 8 minutos, almacenado en temperatura ambiente. Se puede observar que no hay estabilidad microbiológica, ya que hay crecimiento de UFC, no hay crecimiento de Salmonella, Hongos y levaduras y E. colli. En el cuadro de crecimiento de UFC podemos ver el incremento en el crecimiento de las mismas, lo que nos indica que el tiempo de residencia y la temperatura a la que fue sometido el producto no fue la necesaria para alcanzar el índice de letalidad microbiana en el producto terminado. 45 5.1.17 Resultados de estudios colorimétricos obtenidos al aplicar el método de esterilizado a 80 ºC por 8 minutos, almacenado a temperatura ambiente. Figura No. 24:Puré de aguacate mínimamente procesado, tratamiento 80º C por 8 minutos, almacenado en temperatura ambiente. Se puede verificar que hay variación de color, la tendencia es a un color verde oscuro con menor intensidad que la muestra procesada 75 C por 10 minutos. No hay estabilidad en el proceso oxidativo, ya que el proceso térmico al que fue sometido no fue capaz de estabilizar la química del producto terminado. 5.1.18 Resultados de Estudios Bromatológicos obtenidos al aplicar el método de esterilizado a 85º C por 6 minutos, almacenado a temperatura ambiente. Valores ANALISIS DE pH Y % DE PEROXIDOS. 8 6 pH 4 2 % Peroxidos 0 15 DIAS 30 DIAS 45 DIAS tiempo evaluacion Figura No. 25: Análisis de pH y % de peróxidos, tratamiento 85º C por 6 minutos, almacenado en temperatura ambiente. 46 Se puede observar que hay estabilidad en el pH de la muestra, hay aumento en el porcentaje de peróxidos pero no es significativo. La muestra es químicamente estable a los 45 días. 5.1.19 Resultados de estudios Microbiológicos obtenidos al aplicar el método de esterilizado a 85º C por 6 minutos, almacenado a temperatura ambiente. Valores UFC. UNIDADES FORMADORAS DE COLONIAS. 3000 CS (unidades formadoras de colonias) 0 15 DIAS 30 DIAS 45 DIAS Periodo eva luado Figura No. 26: UFC , tratamiento 85º C por 6 minutos, almacenado en temperatura ambiente. 5.1.20 Resultados de estudios Colorimetricos obtenidos al aplicar el método de esterilizado a 85º C por 6 minutos, almacenado a temperatura ambiente. Salmonella, Hongos y levaduras , E. colli. V alores 1 Salmonella 0.5 HyL E. colli 0 15 DIAS 30 DIA S 45 DIAS Pe riodo e valuado Figura No. 27: Análisis microbiologicos, tratamiento 85º C por 6 minutos, almacenado en temperatura ambiente. 47 Se puede notar que el proceso térmico ha sido capaz de controlar el crecimiento microbiológico, la muestra es microbiológicamente estable, no hay crecimiento de Unidades formadoras de colonias, salmonella, E. colli y hongos y levaduras. 5.1.21 Resultados de estudios bromatológicos obtenidos al aplicar el método de esterilizado a 85 ºC por 6 minutos, almacenado a temperatura ambiente. . Figura No. 28: Puré de aguacate mínimamente procesado, tratamiento 85º C por 6 minutos, almacenado en temperatura ambiente. La coloración se mantuvo a los 15 días, luego inicio el proceso de oxidación teniendo cambios amarillentos claros, a los 30 días la pigmentación había variado totalmente. La muestra es bromatológica y microbiologicamente estable, sin embargo, la vida útil es menor ya que hay cambios de coloración y se perciben notas levemente amargas, casi imperceptibles. 48 5.1.22 Resultados de estudios microbiologicos obtenidos al aplicar el método de esterilizado a 90º C por 4 minutos, almacenado en refrigeración. ANALISIS DE PH Y % DE PEROXIDOS. Valores 8 6 4 2 0 pH % Peroxidos 15 DIA S 30 DIAS 45 DIA S tie m po e valuacion Figura No. 29: pH y % de peróxidos, tratamiento 90 º C por 4 minutos, almacenado en temperatura ambiente. La muestra procesada a 90 C por 4 minutos, es bromatologicamente estable, hay aumento mínimo en el % de peroxido, no sensible, el pH tiene a disminuir por efecto del tratamiento térmico. 5.1.23 Resultados de estudios colorimétricos obtenidos al aplicar el método de esterilizado a 85º C por 4 minutos, almacenado a temperatura ambiente. Valores UFC. UNIDADES FORMADORAS DE COLONIA. 5 4 3 2 1 0 UFC (unidades formadoras de colonias) 15 DIAS 30 DIAS 45 DIAS Periodo e valuado Figura No. 30: UFC , tratamiento 90º C por 4 minutos, almacenado en temperatura ambiente. 49 Sa lmone lla, Hongos y le va dura s, E. colli. V alores 1 Salmonella 0.5 HyL E. colli 0 15 DIA S 30 DIAS 45 DIAS Pe r iodo e valuado Figura No. 31: Microbiologia, tratamiento 90º C por 4 minutos, almacenado en temperatura ambiente. Se puede observar que hay estabilidad microbiológica, no hay conteo de unidades formadoras de colonia y no hay presencia de crecimiento de hongos y levaduras, E. coolí, salmonella . 5.1.24 Resultados de estudios Colorimétricos obtenidos al aplicar el método de esterilizado a 90 ºC por 4 minutos, almacenado a temperatura ambiente. Figura No. 32: Puré de aguacate mínimamente procesado, tratamiento 90º C por 4 minutos, almacenado en temperatura ambiente. Podemos observar que a los 15 días inició el deterioro de color, la tendencia es a pigmentarse de un color verde amarillento, esto causado por la exposición al proceso térmico. 50 La muestra es estable física, química y microbiológicamente, sin embargo, la coloración no es estable y hay notas amargas perceptibles, por lo cual no es apta para el consumo. 5.2 RESULTADOS DE PROCESO QUIMICO, APLICACIÓN DE ACIDOS ORGANICOS. Tabla No. 8 : Resultados de la aplicación de métodos químicos , aplicación de ácidos orgánicos. CONDICIONAL MUE STRA REACTIVO PH CONC ENTR ACIO N T. AMBI ENTE (23˚ C) REFRIGE RACION 3.10˚C PEROXIDOS MEQ/KGR GRS T. REFRIGE AMBI RACION ENTE (23˚ 3.10˚C C) UFC T. AMBIE NTE REFRIGE RACION (23˚ C) 3.10˚C HONGOS Y T. REFRIGE AMBI RACION ENTE (23˚ 3.10˚C C) 1 A. CITRICO 0.03 5.967 5.78 0.33 0.18 300 100 0 0 1 A. CITRICO 0.03 5.72 5.65 0.42 0.27 900 500 0 0 1 A. CITRICO 0.03 5.48 5.42 0.68 0.39 1500 900 0 0 1300 0 0 1 2 2 2 2 A. CITRICO A. ASCORBICO A. ASCORBICO A. ASCORBICO A. ASCORBICO 0.03 5.31 5.27 0.78 0.47 INCON TABLE 0.03 5.78 5.69 0.29 0.17 50 1 2 0 0.03 5.54 5.60 0.31 0.21 175 3 7 0 0.03 5.38 5.59 0.54 0.35 500 7 12 0 0.03 5.18 5.50 0.57 0.41 1000 9 34 5 5.2.1 TRATAMIENTO CON ACIDO CITRICO, ALMACENADO AL MEDIO AMBIENTE 5.2.1.1 Evaluación de Análisis bromatológicos en el cítrico, almacenado en temperatura ambiente. Tratamiento con 0.03% de acido 51 Tratam ie nto de Acido citrico , alm ace nado en T Am bie nte. 6.2 6 5.8 5.6 pH 5.4 5.2 5 4.8 1 2 3 4 t i e mpo Figura No. 33: Variación de pH aplicación de acido cítrico al 0.03% Tratam ie nto Acido Citrico, Alm ace nado e n T Am bie nte 1 0.8 0.6 %Peroxidos 0.4 0.2 0 1 2 3 4 Ti e m p o Figura No. 34: Variación de % de peróxidos aplicación de acido cítrico al 0.03% , almacenada a temperatura ambiente. Se puede observar que el tratamiento con Acido cítrico no es bromatologicamente estable, hay variación significativa en pH y % de Peróxidos. 52 5.2.1.2 Evaluación de Análisis Microbiológicos en el tratamiento con 0.03 % de acido cítrico, Almacenado en temperatura ambiente. Tratam iento Acido citrico, Alm ace nado en T Am bie nte 2000 1500 1000 UFC 500 0 1 2 3 Ti e mpo Figura No. 35: UFC, aplicación de acido cítrico al 0.03%, almacenada en temperatura ambiente. No se encontró presencia de E. colli y Salmonella, No hay presencia de Hongos y levaduras, sin embargo el crecimiento de unidades formadoras de colonias es significativo, sobrepasando los límites permitidos para consumo humano. 4 unidades presentaron deterioro microbiano. 5.2.1.3 Evaluación de Colorimetría, aplicada al tratamiento con 0.03% de Acido cítrico, almacenado a temperatura ambiente. 53 Figura No. 36: Puré de aguacate minimamente procesado, aplicación de acido cítrico al 0.03%, almacenada a temperatura ambiente. Se evaluó colorimetría, observando cambios de un color verde a un color pardo, por lo que no se ha inactivado el proceso de oxidación. 5.2.2 TRATAMIENTO CON REFRIGERACION 5.2.2.1 ACIDO CITRICO, ALMACENADO EN Evaluación de análisis Bromatológicos, aplicados al tratamiento con 0.03% de Acido cítrico, almacenado en refrigeración. Tratam iento con AcidoCitrico, alm acenado e n refrige racion 6 5.8 5.6 pH 5.4 5.2 5 1 2 3 4 T ie mp o Figura No. 37: Variación de pH aplicación de acido cítrico al 0.03% refrigeración %Peroxidos tratam ie nto Acido citrico,Alm ace nado e n Re frige racion. 0.6 0.4 % Peroxidos 0.2 0 1 2 3 4 Tie m po Figura No. 38: % de peróxidos aplicación de acido cítrico al 0.03% refrigeración Se puede observar que bromatologicamente hay variaciones significativas en el pH y el % de peróxidos, por lo que podemos apreciar que el proceso de oxidación continua, 54 las muestras almacenadas en refrigeración, presentan un mejor comportamiento que las almacenadas en temperatura ambiente, sin embargo no es comercialmente viable. 5.2.2.2 Evaluación de análisis Microbiológicos, aplicados al tratamiento con 0.03% de Acido cítrico, almacenado en refrigeración. Tratam ie nto Acido Citrico , alm ace nado e n Re frigeracion 1500 1000 UFC 500 0 1 2 3 4 T i e m po Figura No. 39: UFC, aplicación de acido cítrico al 0.03% , almacenado en refrigeración No hay crecimiento de E. colli, ni salmonella, Hay crecimiento de UFC, no es microbiologicamente estable. El crecimiento de UFC en este tratamiento es menor que el almacenado en T. ambiente. 55 5.2.2.3 Evaluación de Colorimetría, aplicada al tratamiento con 0.03% de Acido cítrico, almacenado en refrigeración. Figura No. 40: Puré de aguacate mínimamente procesado aplicación de acido cítrico al 0.03% refrigeración Se evaluó colorimetría, observando cambios de un color verde a un color verde un poco más oscuro. La degradación del color es más lenta que el tratamiento almacenado a T. ambiente. 56 5.2.3 TRATAMIENTO CON ACIDO ASCORBICO, ALMACENADO AL MEDIO AMBIENTE 5.2.3.1 Evaluación de Análisis bromatológicos, tratamiento con 0.03% de Acido Ascórbico, almacenado a temperatura ambiente. Tratam iento Acido Ascorbico, alm acenado en T Am biente 6 5.4 pH 4.8 1 2 3 4 Ti e mpo Figura No. 41: Variación de pH aplicación de acido ascórbico al 0.03% ambiente Tratamiento acido ascorbico, ambiente 0.6 0.5 0.4 0.3 %Peroxidos 0.2 0.1 0 1 2 3 4 Ti e m p o Figura No. 42: % peróxidos aplicación de acido ascórbico al 0.03% ambiente 57 Se puede observar que el pH tiende a bajar minimamente, y el porcentaje de peróxidos aumenta levemente, esta muestra es mas estable que las tratadas con acido cítrico. 5.2.3.2 Evaluación de Análisis Microbiológicos, tratamiento con 0.03% de acido ascórbico, almacenado a temperatura ambiente. Tratamiento con acido ascorbico, Almacenado a Tº ambiente 1200 1000 800 600 400 UFC 200 0 1 2 3 4 Tiempo Figura No. 43: UFC , aplicación de acido ascórbico al 0.03% ambiente No hay presencia de E.Colli y Salmonella, Hay crecimiento de UFC, no es microbiologicamente estable, el # de UFC, sobrepasan el limite permitido para consumo humano. 58 5.2.3.3 Evaluación de Colorimetría, tratamiento con 0.03% de acido ascórbico, almacenado a temperatura ambiente. Figura No. 44: Puré de aguacate mínimamente procesado, aplicación de acido ascórbico al 0.03% ambiente Se observo variación de color, del tono verde a un verde oscuro con tonos pardos, no hay estabilidad colorimétrica. 59 5.2.4 TRATAMIENTO CON REFRIGERACION 5.2.4.1 ACIDO ASCORBICO, ALMACENADO EN Evaluación de Análisis Bromatológicos con el 0.03% de acido ascórbico almacenado en refrigeración. Tratam ientocon Acido Ascorbico, alm acenado en refrigeracion pH 6 pH 5.4 1 2 3 4 Tiem po Figura No. 45: Evaluación de pH, aplicación de acido ascórbico al 0.03% refrigeración. Tratam ie nto Acido As corbico, Alm ace nado e n re frige racion 0.5 0.4 0.3 %Peroxidos 0.2 0.1 0 1 2 3 4 T i emp o Figura No. 46: Evaluación % de peróxidos, aplicación de acido ascórbico al 0.03% refrigeración. Se puede observar que esta muestra, tiende a la estabilidad bromatológica, no hay variaciones significativa en el pH y el % de peróxidos producidos es poco, la concentración de Acido ascórbico y el mantenimiento en refrigeración, le permite al producto mantener la estabilidad microbiológica y físico química necesaria. 60 5.2.4.2 Evaluación de Análisis Microbiológicos con el 0.03% de Acido Ascórbico almacenado en refrigeración. Tratam iento Acido ascorbico, alm acenado en refrigeracion 10 8 6 UFC 4 2 0 1 2 3 4 Ti e mpo Figura No. 47: UFC, aplicación de acido ascórbico al 0.03% refrigeración. No hay presencia de E. colli y Salmonella, el crecimiento de UFC ha disminuido considerablemente y se mantiene dentro de los límites permitidos para consumo humano. 61 5.2.4.3 Evaluación de colorimetría en el tratamiento con 0.03% de acido Ascórbico, almacenado en refrigeración. Figura No. 48: Puré de aguacate mínimamente procesado, aplicación de acido ascórbico al 0.03% refrigeración Se observa cambios de un verde a un verde levemente más oscuro, sin embargo la diferencia no es significativa, si es necesario destacar que a los tres días de abierto, inicio su etapa de oxidación normal, tornándose la superficie del producto a café parda oscura. 62 VI. CONCLUSIONES. El tratamiento térmico aplicando una temperatura de 85 C por 6 minutos almacenado en refrigeración muestra la mayor estabilidad de producto terminado. Al incrementar la temperatura de 85º C se producen notas amargas en el producto terminado. El almacenamiento en refrigeración es una condicional importante en el alargamiento de la vida útil del producto terminado, pues aunque hay estabilidad físico química y microbiológica, el tiempo de estabilidad colorimetrica es menor. La muestra no es estable en función del tiempo. Al incrementar el tiempo de exposición y la temperatura del tratamiento, el pardiamiento tiende a notas amarillentas. El escaldado incrementa el color del producto y lo mantiene por mayor tiempo. El tratamiento químico al 0.03% de ácido ascórbico almacenado en refrigeración, mantiene características físico químicas y microbiológicas por 30 días, sin embargo la degradación después de abierto es mucho mayor, durando solamente tres días. 63 VIII. RECOMENDACIONES. En dicho estudio se concluyo que el proceso térmico aplicando una temperatura de 85 grados centígrados por un tiempo de residencia de 6 minutos , en una bolsa con un grosor de 1 pulgada , y dimensiones: 30 centímetros de largo por 12.5 de ancho, es capaz de inhibir el crecimiento y reproducción microbiológica de el puré de aguacate mínimamente procesado, recomendando tal proceso como base para análisis de termodinámica en alimentos poco ácidos y con un alto grado de incidencia oxidativo, con características físico químicas similares a la composición del aguacate. El tratamiento químico al 0.03% de ácido ascórbico almacenado en refrigeración, mantiene características físico químicas y microbiológicas por 30 días, y aunque su vida de anaquel es limitada, dicha aplicación es recomendada como base para el procesamiento mas tradicional del puré de aguacate, pudiendo optar por el uso combinado de antioxidantes naturales como el aceite esencial de romero o una base acidificada que homologue las características palatales del fruto. 64 VIII. FUENTES CONSULTADAS Abdul G.A. (2006). “Sterilization of food ”. Editorial Springer. Barderas A.V. (1999). “ Problemas de balance de materia y energía en la industria alimentaria”. Editorial Limusa Mexico D.F. Desrocier, N. w. (1997) “ Elementos de Tecnología de alimentos), Editorial CECSA. Mazliak y Haendiere (1965), “ Composición del aceite de palta” Editorial Limusa Mexico D. F. Montes, A. (1969), “Bromatología” Editorial CECSA. Weaber, R. (1999), Molecular Biology” Internacional Edition. www.agronegocios.gob.sv/comoproducir/guias/aguacate www.agroindustrias.org/procesos www.camagro.com/frutales/centro-de-documentacion www.consumer.es/webes/nutricion.aprender_a_comer_bien/alimentops/3521 www.ipfsaph.org.servelet/binarydownloadservert?filename+kopool_data/218.pdf www.mag.gob.cr/biblioteca_virtual_ciencia/tec_aguacate.pdf 65 www.redpav_fpolar.info.ve/fagro/v09_4/v094m002,html www.milkci.unizar.es/bioquimica/temas/enzimas/tirosina.htmal GLOSARIO Aditivos: Sustancias añadidas intencionalmente a los alimentos por sus propiedades físicas, sabor color. Acidos: Se añaden a los alimentos naturales o procesados con el objeto que puedan cumplir algunas funciones: Fijar un pH determinado. Inhibidores de microorganismos Agentes quelantes Favorecedores de geles sépticos Antiespumantes Emulsionantes Agentes coagulantes Agentes acidificantes. Activadores: Algunas enzimas necesitan para su actividad iones inorgánicos específicos que reciben el nombre de activadores. Los activadores que se necesitan con más frecuencia son los iones de hierro, cobre, manganeso, magnesio, cobalto y zinc. De ordinario, sólo un ion funciona con una determinada enzima, pero en ciertos casos se pueden sustituir ciertos iones por otros, persistiendo una actividad enzimática satisfactoria. Actividad acuosa (denominada también actividad de agua)se define como la relación que existe entre la presión de vapor de un alimento dado en relación con la presión de vapor 66 del agua pura a la misma temperatura. Se denomina por regla general como aw del idioma inglés Water activity, aw ). La actividad acuosa es un parámetro estrechamente ligado a la humedad del alimento lo que permite determinar su capacidad de conservación, de propagación microbiana, etc. La actividad acuosa de un alimento se puede reducir aumentando la concentración de solutos en la fase acuosa de los alimentos mediante la extracción del agua (liofilización) o mediante la adición de nuevos solutos. La actividad acuosa junto con la temperatura, el pH y el oxígeno son los factores que más influyen en la estabilidad de los procesos alimenticios. Agentes quelantes: son secuestradores de iones metálicos. Estabilizan alimentos retardando el proceso de deterioro, pardeamiento, oxidación, perdidas de nutrientes etc. Antioxidantes: Retrazan o inhiben el proceso de oxidación. Acido Ascórbico: Acido orgánico que contiene sales sodicas y potasitas que inhiben el crecimiento de mohos y levaduras. Acido benzoico: sus sales actúan con el fin de conservar un alimento. Antiespumante: Sustancia usada para reducir la espuma producida por proteínas, gases o materiales nitrogenados, que puede interferir procesos industriales. Aplicaciones: En investigación de laboratorios científicos es empleado principalmente para eliminar microorganismos de los elementos de trabajo, evitando así la contaminación de la muestra, recipientes y material de trabajo. En la industria alimentaría se emplea para aumentar la vida útil de los alimentos. Los alimentos esterilizados más comunes son los enlatados. 67 Se usa también para la conservación y alargamiento de la vida de libros, muebles, obras de arte y otros bienes Conservación: La conservación puede tener diversos objetivos, puede realizarse con el objeto de impedir el crecimiento de las bacterias (método de conservación bactericidas) o simplemente con el objeto de impedir su desarrollo (método de conservación bacteriostáticos) Conservación por frío: Los métodos se caracterizan por la disminución de temperaturas hasta que cesa la actividad de reproducción bacteriana y de vida de los microorganismos, posee además como característica que detiene la descomposición del alimento. Se caracterizan por tener que mantener lo que se denomina cadena del frío. Estos métodos pueden ser: Refrigeración - Se suele entender por refrigeración al intervalo que va desde los 2 y 5 ºC en frigoríficos industriales y entre 8 y 15ºC en los frigoríficos domésticos Congelación - Es la congelación de los alimentos hasta llegar a temperaturas de 30ºC Ultracongelación - Se entiende así a un proceso de congelación que debe alcanzar temperaturas inferiores a -40ºC en un periodo no mayor de dos horas. Conservación por calor El método de conservación de alimentos mediante calor es menos efectivo que el de frío. Por regla general la idea es detener el crecimiento de la población de bacterias mediante el uso de calor. Los métodos empleados en este caso son: Escaldado - En el caso de verduras interrumpe la acción enzimática Cocción Pasteurización - Uperización 68 Esterilización - Esterilización es el proceso de eliminación de toda forma de vida, incluidas las esporas. Es un término absoluto que implica pérdida de la viabilidad o eliminación de todos los microorganismos contenidos en un objeto o sustancia, acondicionado de tal modo que impida su posterior contaminación. Se trata de un término probabilístico, de modo que tras un adecuado proceso de esterilización, se debe llegar a una probabilidad de encontrar microorganismos igual o menor que una unidad contaminada en un millón de unidades sometidas a un proceso de esterilización. Inhibidores: Las moléculas que regulan la actividad enzimática inhibiendo su actividad pueden clasificarse en reversibles e irreversibles. Las irreversibles se unen covalentemente a la enzima y son útiles en farmacología (penicilina, aspirina). Las reversibles pueden clasificarse, a su vez, en competitivas y no competitivas. Las competitivas modifican la Km del enzima ya que se unen al centro activo de éste e impiden la unión con el sustrato (se necesitará más para activar las enzimas). Las no competitivas, se unen a otro lugar de la enzima, modificando la Vmáx. (velocidad en que se forma producto por unidad de tiempo) ya que al unirse, el enzima queda inactivada. Lípidos: Es difícil proporcionar una definición científica acerca de las substancias denominadas lípidos. Antiguamente las definiciones se centraban en definir mediante la discriminación de aquellas substancias que son solubles en solventes orgánicos como puede ser el benceno, el cloroformo y que no es soluble en agua (esta propiedad se emplea en la separación de los lípidos de las proteínas). Algunas de las definiciones hacen énfasis en el carácter central de los ácidos grasos, debido en parte a que los lípidos son compuestos derivados de estos últimos. Cada definición posee algunas limitaciones, por ejemplo los monoglicéridos de cadena corta son indudablemente lípidos, pero no se ajustan a la 69 definición dada anteriormente sobre la solubilidad debido a que son más solubles en agua que en los disolventes orgánicos. No obstante se puede ver que la mayoría de los lípidos son ésteres de los ácidos grasos y del glicerol. Casi el 99% de los lípidos en las plantas y los animales consiste en este tipo de ésteres, denominados a veces de forma popular como grasas o también aceites animales. Métodos químicos: Los métodos químicos de esterilización son aquellos que involucran el empleo de sustancias letales para los microorganismos, tales como el óxido de etileno y el etanol. Métodos físicos :Los métodos físicos son aquellos que no involucran el empleo de sustancias letales para los microorganismo, sino procedimientos físicos como la radiación ionizante, el calor o la ultrafiltración de soluciones con membranas que impiden el paso de microorganismos, incluyendo virus. Métodos térmicos: Los métodos térmicos suelen englobar todos los procedimientos que tienen entre sus fines la destrucción de los microorganismos por el calor. Nos estamos refiriendo tanto a la Pasteurización y a la Esterilización, cuya finalidad principal es la destrucción microbiana, como al Escaldado y a la Cocción, procesos en los que también se consigue una cierta reducción de la flora microbiana, pero que sus objetivos principales son la variación de las propiedades físicas. Procesado y conservación de los alimentos: es conjunto de procesos realizados en las diferentes partes de la cadena de producción, transporte, venta y consumo realizados con el objeto de garantizar la vida y e higiene de los alimentos. Se parte de la idea inicial de que los alimentos son productos perecederos y es necesario poseer ciertas condiciones y realizar ciertos tratamientos para que sea posible su conservación. 70 Química de alimentos es el estudio, desde un punto de vista químico, de los procesos e interacciones existentes entre los componentes biológicos (y no biológicos) que se dan en la cocina cuando se manipulan alimentos. Las sustancias biológicas aparecen en algunos alimentos como las carnes y las verduras (y hortalizas), y en bebidas como la leche o la cerveza. Este estudio es muy similar al de la bioquímica desde el punto de vista de los ingredientes principales, como los carbohidratos, las proteínas, los lípidos, etc. Además incluye el estudio del agua, las vitaminas, los minerales, las enzimas, los sabores, y el color.1 Se estudia principalmente en el procesado de alimentos, y en la nutrición. Algunos autores definen la química de los alimentos como una ciencia interdisciplinaria entre la bacteriología y la química.2 Un ejemplo de estudio de la química de los alimentos se puede ver en la reacción de Maillard, que define el color tostado de ciertos alimentos.3 71 ANEXOS 72 EVALUACIONES FISICO QUIMICAS PARA EVITAR LA OXIDACION EN LA PASTA DE AGUACATE. Presentado por: Dalia Iris Villalobos Portillo. PLANTEAMIENTO DEL PROBLEMA. • ¿Cuál es el proceso mas viable y factible para combatir el proceso de oxidación durante la transformación del aguacate? JUSTIFICACION DE LA INVESTIGACION. • Desde el punto de vista comercial, el aguacate constituye una de las frutas de mayor demanda, debido a su versatilidad en el preparado, ya que se puede consumir como fruto, verdura o en combinaciones con otros alimentos ; formando con este una amplia variedad de exquisitos platillos, tanto en hogares como en el sector institucional. INTRODUCCION. • El oscurecimiento o pardeamiento enzimatico constituyen uno de los principales problemas durante la conservación y procesamiento industrial de algunas frutas y hortalizas. Paralelamente con la alteración de color, se producen cambios en el sabor y pérdidas apreciables del valor nutricional de estos alimentos. DELIMITACION DE LA INVESTIGACION. • El presente trabajo de investigación se delimito al análisis de Técnicas y metodologías aplicables para el procesamiento de una pasta de aguacate, mediante la implementación de procesos físicos y químicos ( o combinadas), utilizando frutos de que no pueden clasificarse en las categorías superiores , pero que satisfacen los requisitos mínimos para ser considerado como frutos de buena calidad.; OBJETIVO GENERAL • Establecer procesos físico químicos capaces de disminuir la oxidación enzimática ( oscurecimiento), para la elaboración de Pasta de aguacate procesado, sin afectar sus características sensoriales, manteniendo su calidad nutritiva, química, física, microbiológica. 73 OBJETIVOS ESPECIFICOS. • • • • Conocer él método mas adecuado de procesamiento para la elaboración de puré de aguacate procesado. Ofrecer alternativas viables para el proceso y conservación en el puré de aguacate procesado Ofrecer nuevas alternativas de procesamiento de pasta de aguacate procesado de manera inocua, que incremente su disponibilidad todo el año. Evaluar características físicas, químicas y microbiológicas en el producto terminado. REVISION DE LITERATURA. Antecedentes: Generalidades del Fruto Desarrollo y mejoramiento genetico Manejo Post cosecha Almacenamiento del aguacate Composicion nutricional Pardeamiento, Proceso oxidativo. METODOLOGIA • Aplicacion de metodos fisicos y quimicos : Proceso termico y aplicacion de acidos organicos. METODO FISICO. • El método físico aplicado es el proceso de esterilización comercial en el cual el producto es sometido a diferentes grados de temperatura por distintos lapsos de tiempo, esto con el fin de Inhibir el proceso oxidativo y de rancidez ; así como la inhibición de bacterias, hongos, levaduras y otros microorganismos contaminantes y deterioradores de los alimentos. • Los análisis bromatologicos (pH y % peroxidos ) fueron realizados en el laboratorio de Bon Appetit. S.A. de C.V., así como los análisis Microbiológicos ( UFC, Hongos y Levaduras, e. Colli, Salmonella). a) Variables: • Madurez del aguacate. • Temperatura • Tiempo de procesamiento (Esterilidad) • Almacenamiento. EVALUACION DE RESULTADOS. TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN REFRIGERACION. CONDICIONAL EVALUACION MUESTRA Tº 15 DIAS 1 75 C 30 DIAS 1 75 C 45 DIAS 1 75 C 15 DIAS 2 80 C 30 DIAS 2 80C 45 DIAS 2 80 C 15 DIAS 3 85 C 30 DIAS 3 85 C 45 DIAS 3 85 C 15 DIAS 4 90 C 30 DIAS 4 90 C 45 DIAS 4 90 C TIEMPO 10 minutos 10 minutos 10 minutos 8 minutos 8 minutos 8 minutos 6 minutos 6 minutois 6 minutos 4 minutos 4minutos 4 minutos PH 6 5.1 4.1 6.8 6.7 6.7 7.1 7.1 7.1 7.6 7.5 7.5 %PEROXIDOS (meq/kg grasa) 0.18 0.25 0.32 0.65 1.32 1.97 0.2 0.3 0.32 0.3 0.4 0.41 UFC SALMONELLA HyL (Gr) E. COLLI 1500 0 0 0 2100 0 0 0 2800 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 En la grafica se puede observar que los valores de pH son inestables, obteniendo a los 15 días un valor de 6, a los 30 días 5.1 y a los 45 días 4.1 ; esto causado por contaminación microbiológica, ya que se presento abombamiento en 3 unidades. En cuanto al porcentaje de peróxidos tiende al aumento, lo que indica que el proceso de oxidación continúa con su curso obteniendo resultados de 0.18 meq/kg de grasa a los 15 días, 0.25 meq/kg de grasa a los 30 dias y 0.32 meq/kg de grasa a los 45 días. 74 TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN REFRIGERACION. Se puede observar que la muestra procesada por 10 minutos a una temperatura de 75º C, No es microbiologicamente estable, ya que hay crecimiento de unidades formadoras de colonias a los 15 días, se presentaron 3 unidades abombadas TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN REFRIGERACION. La coloración de la pasta de aguacate tiende al verde oscuro, el proceso de oxidación inicia a los 2 días. TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN REFRIGERACION. Se puede observar que no hay crecimiento de unidades formadoras de colonias, la muestra es microbiologicamente estable. TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN REFRIGERACION. No hay presencia de Salmonella , E. colli y Hongo y levaduras. TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN REFRIGERACION. Se puede observar que el Ph tiende a la estabilidad, sin embargo aun hay aumento el porcentaje de índices de peroxido, lo que indica que no se ha detenido el proceso de oxidación ya que a los 15 días hay 0.65 meq/kg grasa, a los 30 días 1.32 meq/ kg grasa y a los 45 días 1.97 meq/kg grasa . TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN REFRIGERACION. Se puede observar que no hay crecimiento de Salmonella, E. colli y Hongos y levaduras. 75 TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN REFRIGERACION. Se puede observar que no hay crecimiento de Salmonella, E. colli y Hongos y levaduras. TRATAMIENTO III. ESTERELIZADO 85° C POR 6 MINUTOS, ALMACENADO EN REFRIGERACION. El pH es estable, a los 15, 30 y 45 días (Es necesario destacar quee l proceso térmico tiende a aumentar el pH del producto procesado); el porcentaje de peróxidos tiende a la estabilidad. TRATAMIENTO III. ESTERELIZADO 85° C POR 6 MINUTOS, ALMACENADO EN REFRIGERACION. No se presenta crecimiento de Salmonella, Hongos y levaduras y E. colli, La muestra es microbiologicamente estable. TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN REFRIGERACION. La variación de la pigmentación tiende a un verde pardo mas leve que la muestra procesada a 75 C, sin embargo, aun no se ha controlado el proceso de oxidación. TRATAMIENTO III. ESTERELIZADO 85° C POR 6 MINUTOS, ALMACENADO EN REFRIGERACION. No se presenta crecimiento microbiologico, no hay presencia de unidades formadoras de colonia TRATAMIENTO III. ESTERELIZADO 85° C POR 6 MINUTOS, ALMACENADO EN REFRIGERACION. Esta muestra presenta muy buena estabilidad colorimetrica a los 15 días, no hay variación perceptible en el color, sin embargo a los 30 días hay una leve variación de color, con tendencia a un verde claro a la vez a presentado estabilidad físico química, microbiológica y colorimétrica. Sensorialmente es aceptable.( Según resultado de análisis sensorial el 6% percibió notas ligeramente amargas, resabio) . 76 TRATAMIENTO IV. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN REFRIGERACION. TRATAMIENTO IV. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN REFRIGERACION. El pH y el % de peroxidos se mantiene estable en el transcurso de la evaluacion. Se puede observar que la actividad microbiana ha sido estabilizada y este producto es seguro para consumo humano; no hubo crecimiento de UFC a los 15, 30 y 45 días TRATAMIENTO IV. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN REFRIGERACION. TRATAMIENTO IV. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN REFRIGERACION. No hubo crecimiento de salmonella, HyL y E. colli. Muestra microbiologicamente estable. Se puede observar que hay una mínima variación de color , la pigmentación tiene leves variantes amarillentas claras, que no son significativas , sin embargo sensorialmente el sabor ha variado, ya que hay presencia de notas amargas que se atenúan con el paso del tiempo, Esta muestra es bromatológica, microbiológica y colorimetricamente estable, sin embargo la tendencia palatal es al cambio ( se hizo análisis sensorial con panel de jueces entrenados y el 75% encontró la muestra amarga) por lo que no se recomienda utilizar este proceso térmico ya que afecta las características sensoriales del aguacate. EVALUACION DE RESULTADOS. TRATAMIENTO I. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN T. AMBIENTE. CONDICIONAL EVALUACION MUESTRA Tº 15 DIAS 1 75 C 30 DIAS 1 75 C 45 DIAS 1 75 C 15 DIAS 2 80 C 30 DIAS 2 80C 45 DIAS 2 80 C 15 DIAS 3 85 C 30 DIAS 3 85 C 45 DIAS 3 85 C 15 DIAS 4 90 C 30 DIAS 4 90 C 45 DIAS 4 90 C TIEMPO 10 minutos 10 minutos 10 minutos 8 minutos 8 minutos 8 minutos 6 minutos 6 minutos 6 minutos 4 minutos 4minutos 4 minutos PH %PEROXIDOS (meq/kg grasa) ufc/ g SALMONELLA HyL (Gr) E. COLLI 6 0.19 1300 0 0 0 5.7 0.27 2700 0 0 0 5.4 0.33 3400 0 0 0 6.2 0.21 1000 0 0 0 6 0.298 2300 0 0 0 5.8 0.397 2900 0 0 0 6.4 0.145 0 0 0 0 6.34 0.173 0 0 0 0 6.29 0.2 0 0 0 0 6.7 0.42 0 0 0 0 6.4 0.479 0 0 0 0 6.2 0.523 0 0 0 0 Se puede observar que la actividad microbiana ha sido estabilizada y este producto es seguro para consumo humano; no hubo crecimiento de UFC a los 15, 30 y 45 días 77 TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN T AMBIENTE. El análisis bromatológico indica que hay disminución en el pH, y el porcentaje de peróxidos tiende a incrementarse, por lo que podemos mencionar que el proceso de oxidación no se ha detenido. TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN T AMBIENTE. No hay crecimiento de Salmonella, E. colli y HyL. TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN T AMBIENTE. Se puede observar que hay disminución en el pH de la pasta, los porcentajes de peróxidos tienden a la alza, lo que indica que el proceso térmico aplicado y el método de almacenaje no son capaces de inhibir el proceso de oxidación. TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN T AMBIENTE. No hay estabilidad microbiologica, se puede evidenciar crecimiento de UFC desde los 15 dias. No es microbiologicamente estable. TRATAMIENTO I. ESTERELIZADO 75° C POR 10 MINUTOS, ALMACENADO EN T AMBIENTE. Se puede observar que esta muestra la variación de color tiende a un verde oscuro, a los 3 días, por lo que no es colorimetricamente estable, demostrando que el proceso de oxidación de la pasta continua a pesar del proceso térmico aplicado. TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN T AMBIENTE. Se puede observar que no hay estabilidad microbiológica, ya que hay crecimiento de UFC 78 TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN T AMBIENTE. No hay crecimiento de Salmonella, Hongos y levaduras y E. colli. TRATAMIENTO II. ESTERELIZADO 80° C POR 8 MINUTOS, ALMACENADO EN T AMBIENTE. Se puede verificar que hay variación de color, la tendencia es a un color verde oscuro con menor intensidad que la muestra procesada 75 C por 10 minutos. No hay estabilidad en el proceso oxidativo. TRATAMIENTO III. ESTERELIZADO 85 ° C POR 6 MINUTOS, ALMACENADO EN T AMBIENTE. TRATAMIENTO III. ESTERELIZADO 85 ° C POR 6 MINUTOS, ALMACENADO EN T AMBIENTE. Se puede observar que hay estabilidad en el pH de la muestra, hay aumento en el porcentaje de peróxidos pero no es significativo. La muestra es químicamente estable a los 45 días. Se puede notar que el proceso térmico ha sido capaz de controlar el crecimiento microbiológico, la muestra es microbiologicamente estable, no hay crecimiento de Unidades formadoras de colonias, salmonella, E. colli y Hongos y levaduras. TRATAMIENTO III. ESTERELIZADO 85 ° C POR 6 MINUTOS, ALMACENADO EN T AMBIENTE. TRATAMIENTO IV. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN T AMBIENTE. Valores ANALISIS DE PH Y % DE PEROXIDOS. 8 6 4 2 0 pH % Peroxidos 15 DIA S 30 DIA S 45 DIA S La coloración se mantuvo a los 15 días, luego inicio el proceso de oxidación teniendo cambios amarillentos claros, a los 30 días la pigmentación había variado totalmente. La muestra es bromatológica y microbiologicamente estable, sin embargo, la vida útil es menor ya que hay cambios de coloración y se perciben notas levemente amargas, casi imperceptibles. tie m po e valuacion La muestra procesada a 90 C por 4 minutos, es bromatologicamente estable, hay aumento mínimo en el % de peroxido, no sensible, el pH tiene a disminuir por efecto del tratamiento térmico . 79 TRATAMIENTO IV. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN T AMBIENTE. UFC. UNIDADES FORMADORAS DE COLONIA. Salmonella, Hongos y levaduras, E. colli. Salmonella Hy L E. colli 0 Valores Valores 1 0.5 TRATAMIENTO IV. ESTERELIZADO 90° C POR 4 MINUTOS, ALMACENADO EN T AMBIENTE. 5 4 3 2 1 0 UFC (unidades formadoras de colonias) 15 DIAS 30 DIAS 45 DIAS 15 DIAS 30 DIAS 45 DIAS Per iodo e valuado Periodo evaluado Se puede observar que hay estabilidad microbiológica, no hay conteo de unidades formadoras de colonia y no hay presencia de crecimiento de hongos y levaduras, E. coolí, Salmonella . • Podemos observar que a los 15 días inicio el deterioro de color, la tendencia es a pigmentarse de un color verde amarillento, esto causado por la exposición al proceso térmico. • La muestra es estable físico químico y microbiológico, sin embargo la coloración no es estable y hay notas amargas perceptibles, por lo cual no es comercial. METODO QUIMICO. • ANALISIS SENSORIAL Se utilizaron dos ácidos orgánicos en diferentes concentraciones para conocer cual de ellos y a que concentración es el que evita que actué la enzima en el oscurecimiento. A continuación se muestran las concentraciones de ácidos orgánicos a aplicar al puré de aguacate para extraer una muestra sin alteraciones sensoriales, la cual fue procesada y evaluada.. • Reactivo Ácido cítrico Ácido ascórbico • PORCENTAJES A UTILIZAR Muestra 1 Muestra 2 Muestra3 Muestra 4 0,01% 0,03% 0,05% 1% 0,01% 0,03% 0,05% 1% Los análisis bromatologicos (pH y % peroxidos ) fueron realizados en el laboratorio de Bon Appetit. S.A. de C.V., así como los análisis Microbiológicos ( UFC, Hongos y Levaduras, e. Colli, Salmonella). Variables: • Madurez del aguacate. • Tipo y concentracion de acido • Almacenamiento. TRATAMIENTO CON ACIDO CITRICO AL 0.03% ALMACENADO A T AMBIENTE Tratam ie nto Acido Citrico, Alm acenado e n T Am biente Tratam ie nto de Acido citrico , alm ace nado e n T Am biente. • Se elaboro un panel sensorial (Jueces entrenados) con 10 participantes , de los cuales el 87% no indico diferencia y el 13% indico deferencias sensoriales a las muestras del tratamiento con el 0.05% de ácidos ) tomando en cuenta dichos resultados se pudo concluir que las características sensoriales empezaban a cambiar a partir del 0.05% de aplicación de ácidos en general, por lo que se decidió utilizar la concentración anterior que es del 0.03% TRATAMIENTO CON ACIDO CITRICO AL 0.03% ALMACENADO A T AMBIENTE Tr atam ie nt o Acido cit r ico, Alm ace nado e n T Am bient e 200 0 6 .2 1 6 150 0 0. 8 5 .8 5 .6 100 0 0. 6 pH 5 .4 5 .2 UFC %Pe roxid os 0. 4 50 0 0. 2 5 0 0 4 .8 1 2 3 t i e mp o 4 1 2 3 4 Ti e mp o Se puede observar que el tratamiento con Acido cítrico no es bromatologicamente estable, hay variación significativa en pH y % de Peróxidos. 1 2 3 T i em p o Se puede observar que el tratamiento con Acido cítrico no es bromatologicamente estable, hay variación significativa en pH y % de Peróxidos 80 TRATAMIENTO CON ACIDO CITRICO AL 0.03% ALMACENADO A T AMBIENTE TRATAMIENTO CON ACIDO CITRICO AL 0.03% ALMACENADO EN REFRIGERACION Tratamiento con AcidoCitrico, almacenado en refrigeracion tratamiento Acido citrico,Almacenado en Refrigeracion. % P e ro xid o s 6 5.8 5.6 pH 5.4 5.2 0.6 0.4 % Peroxidos 0.2 0 1 5 1 2 3 4 3 4 Tiempo T iempo • Se evaluó colorimetría, observando cambios de un color verde a un color pardo, por lo que no se ha inactivado el proceso de oxidación. 2 Se puede observar que bromatologicamente hay variaciones significativas en el pH y el % de Peróxidos, por lo que podemos apreciar que el proceso de oxidación continua, las muestras almacenadas en refrigeración, presentan un mejor comportamiento que las almacenadas en temperatura ambiente, sin embargo no es comercialmente viable. TRATAMIENTO CON ACIDO CITRICO AL 0.03% ALMACENADO EN REFRIGERACION TRATAMIENTO CON ACIDO CITRICO AL 0.03% ALMACENADO EN REFRIGERACION Tratam ie nto Acido Citrico , alm acenado en Refrigeracion 1500 1000 UFC 500 0 1 2 3 4 • Se evaluó colorimetría, observando cambios de un color verde a un color verde un poco más oscuro. La degradación del color es más lenta que el tratamiento almacenado a T. ambiente, sin embargo este tratamiento no es capaz de inhibir el proceso oxidativo. T i e m po No hay crecimiento de E. colli, ni salmonella, Hay crecimiento de UFC, no es microbiologicamente estable. El crecimiento de UFC en este tratamiento es menor que el almacenado en T. ambiente TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T EMBIENTE TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T EMBIENTE Tratam ie nto Acido As corbico, alm ace nado en T Am bient e T ratam ie nto acido ascorbico, am bie nte Tratam iento con acido ascorbico, Alm acenado e n T am biente 0.6 0.5 6 0.4 5.4 pH 0.3 %Perox idos 0.2 1200 1000 0. 1 4.8 1 2 3 4 800 0 1 2 3 4 Ti e m po T ie mp o 600 400 UFC 200 0 1 2 3 4 Ti e mp o Se puede observar que el pH tiende a bajar minimamente, y el porcentaje de peróxidos aumenta levemente, , esta muestra es mas estable que las tratadas con acido cítrico. No hay presencia de E.Colli y Salmonella, Hay crecimiento de UFC, no es microbiologicamente estable, el # de UFC, sobrepasan el limite permitido para consumo humano. 81 TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T EMBIENTE TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T REFRIGERACION Tratamie ntocon Acido Ascorbico, almace nado e n re frigeracion Tratam iento Acido Ascorbico, Alm acenado en refrigeracion 6 0.5 pH 0.4 pH 0.3 %Peroxidos 0.2 5.4 1 2 3 0.1 4 0 1 Tiempo 2 3 4 T i emp o • Se observo variación de color, del tono verde a un verde oscuro con tonos pardos , no hay estabilidad colorimetrica. Se puede observar que esta muestra, tiende a la estabilidad bromatologica, no hay variaciones significativa en el pH y el % de peróxidos producidos es poco. TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T EMBIENTE TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T REFRIGERACION Tratamientocon Acido As corbico, almace nado e n refrige racion Tratam iento Acido Ascorbico, Alm acenado en refrigeracion 6 0.5 pH 0.4 pH 0.3 %Peroxidos 0.2 5.4 1 2 3 4 0.1 0 Tie mpo 1 2 3 4 T i emp o • Se observo variación de color, del tono verde a un verde oscuro con tonos pardos , no hay estabilidad colorimetrica. TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T REFRIGERACION Se puede observar que esta muestra, tiende a la estabilidad bromatologica, no hay variaciones significativa en el pH y el % de peróxidos producidos es poco. TRATAMIENTO CON ACIDO ASCORBICO AL 0.03% ALMACENADO EN T REFRIGERACION Tratam iento Acido ascorbico, alm acenado en refrige racion 10 8 6 UFC 4 2 0 1 2 3 4 Ti e m po No hay presencia de e. Colli y Salmonella, el crecimiento de UFC ha disminuido considerablemente y se mantiene dentro de los limites permitidos para consumo humano. • Se observa cambios de un verde a un verde levemente mas oscuro, sin embargo la diferencia no es significativa, si es necesario destacar que a los tres días de abierto, inicio su etapa de oxidación normal, tornándose la superficie del producto a café parda oscura. 82 CONCLUSIONES • • • • • • El tratamiento térmico aplicando una temperatura de 85 C por 6 minutos almacenado en refrigeración muestra la mayor estabilidad de producto terminado. Al incrementar la Temperatura de 85 C se producen notas amargas en el producto terminado. El almacenamiento en refrigeración es una condicional importante en el alargamiento de la vida útil del producto terminado, pues aunque hay estabilidad físico química y microbiológica, el tiempo de estabilidad colorimetrica es menor. La muestra no es estable en función del tiempo. Al incrementar el tiempo de exposición y la temperatura del tratamiento, el pardiamiento tiende a notas amarillentas. El escaldado incrementa el color del producto y lo mantiene por mayor tiempo. El tratamiento químico al 0.03% de Acido ascórbico almacenado en refrigeración, mantiene características físico químicas y microbiológicas por 30 días, sin embargo la degradación después de abierto es mucho mayor, durando solamente tres días.
Anuncio
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados