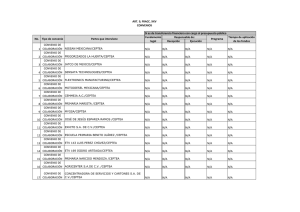
Controversias en la prevención de la enfermedad tromboembólica
Anuncio

Monografías de la Asociación Española de Cirujanos N.º 01 Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico Coordinador: Juan Ignacio Arcelus Martínez Asociación Española de Cirujanos Monografías de la Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico © Copyright 2015. ARÁN EDICIONES, S.L. Reservados todos los derechos. Ninguna parte de esta publicación puede ser reproducida, transmitida en ninguna forma o medio alguno, electrónico o mecánico, incluyendo fotocopias, grabaciones o cualquier sistema de recuperación de almacenaje de información, sin la autorización por escrito del titular del Copyright. El contenido del documento refleja las opiniones, criterios, conclusiones y/o hallazgos propios de sus autores. Cualquier producto mencionado deberá ser estrictamente prescrito y utilizado de acuerdo con la ficha técnica autorizada del producto en España. La Editorial declina toda responsabilidad sobre el contenido de los artículos que aparezcan en esta publicación. ISSN: 2444-6947 ARÁN EDICIONES, S.L. 28006 MADRID - Castelló, 128, 1.º - Telf.: 91 782 00 35 - Fax: 91 561 57 87 e-mail: [email protected] - http://www.grupoaran.com Monografías de la Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico Coordinador: Juan Ignacio Arcelus Martínez Comité Editorial Eduardo Mª Targarona Soler José Vicente Roig Vila José Mª Jover Navalón Elena Martín Pérez Pablo Moreno Llorente Salvador Navarro Soto Juan Carlos Ruiz de Adana Belbel José Luis Salvador Sanchís José Mª Enríquez Navascués Introducción Apreciado socio: Una de las misiones de la AEC es la diseminación y actualización de los avances en el desarrollo de la cirugía a todos los niveles. Desde hace años la AEC se ha caracterizado y ha favorecido la publicación de obras en diversos formatos que ha permitido conseguir este objetivo. La revista Cirugía Española se puede considerar como el escaparate de mayor calidad de la sociedad: en la revista, una vez indexada, evaluada por pares y con factor de impacto es donde se publican los avances o los resultados de los estudios más actuales de nuestra actividad. El libro de Cirugía, con el proyecto de desarrollar la tercera edición, pretende ser la referencia obligada ante cualquier duda o necesidad de información para el cirujano en formación o ya formado. Las Guías Clínicas, obra de especial éxito y reconocidas por todos los cirujanos, pretenden ofrecer de una forma concisa las bases y esquemas de tratamiento de un área concreta de la cirugía y, finalmente, cada año publicamos obras menores que intentan completar de forma más general algunos temas de actualidad. ¿Hacen falta más publicaciones…? Algún lector podrá decir que no, especialmente ante la plétora de información de la que disponemos en la actualidad, ante el éxito de Internet y la facilidad en la diseminación de la información. La Junta Directiva que tengo el honor de presidir considera que sí, que hay lugar para un modelo intermedio, y este son las Monografías de la AEC que pretenden, en un formato reducido, tipo revista, abordar de forma exhaustiva temas de especial interés y actualidad, con una presentación ágil que permita al lector la puesta al día tras su lectura. Este formato permite ser de rápida creación y publicación, y dar cabida a cualquier tema que cualquier miembro de la Junta Directiva, de las secciones o miembro de la sociedad pueda proponer. Prueba de ellos son los tres temas que presentamos en estos tres primeros números: ERAS, controversias en prevención ETV y manejo paciente anticoagulado y cirugía robótica. Se puede argumentar que la calidad de la publicación no está bien contrastada al no ser revisada por pares, pero la confianza en la profesionalidad del editor responsable, y la supervisión y corrección por parte del Comité Científico de la AEC permiten asegurar el rigor de su contenido. Me gustaría agradecer a diversas personas y entidades el desarrollo de este proyecto: a la Junta Directiva que confió y dio crédito a esta propuesta, a los editores y autores, que aceptaron el reto de desarrollar el proyecto en menos de 5 meses, incluyendo el verano, y a Arán Ediciones que, con la eficacia a la que ya nos tiene acostumbrados, ha dado cuerpo al proyecto. También agradecer a los sponsors que de forma ágil y generosa han dado soporte al proyecto. Estas Monografías se publicarán de forma electrónica y también estarán disponibles en la app de la AEC. No se prevé una periodicidad regular en la publicación pero, tras esta prueba piloto, se invita a todos los miembros de la AEC a proponer temas, títulos y editores; tampoco existe un temario cerrado y circunscrito, es un modelo únicamente uniforme en cuanto a su formato que da cabida a cualquier tema de actualidad. Espero que esta obra que tienes en tus manos sea de tu interés y será tu opinión la que definirá si el camino elegido ha sido el adecuado. E.M. Targarona Presidente de la AEC Sumario Estratificación del riesgo del tromboembolismo venoso en el paciente quirúrgico......... 11 Juan Ignacio Arcelus Martínez Cuándo empezar y cuánto tiempo mantener la profilaxis en pacientes quirúrgicos de alto riesgo............................................................................................................................ 22 Eloy Espín Basany Controversias en la prevención de la enfermedad tromboembólica venosa en grupos especiales: cirugía bariátrica, cirugía mayor ambulatoria y politrauma......................................................................................................... 29 Francisco S. Lozano Sánchez Manejo perioperatorio del paciente anticoagulado.............................................................. 42 Juan Vicente Llau Pitarch y Raquel Ferrandis Comes Estratificación del riesgo del tromboembolismo venoso en el paciente quirúrgico Juan Ignacio Arcelus Martínez Hospital Universitario Virgen de las Nieves y Departamento de Cirugía, Universidad de Granada RESUMEN La enfermedad tromboembólica venosa (ETV) postoperatoria constituye una grave complicación que puede afectar al 15-30 % de los pacientes quirúrgicos generales cuando no se adoptan medidas para su prevención. La probabilidad de presentación de ETV depende de la presencia de factores de riesgo relacionados con el paciente, así como del tipo de intervención quirúrgica practicada y las circunstancias durante el ingreso. La correcta valoración preoperatoria del riesgo tromboembólico, utilizando modelos diseñados para tal efecto, permite agrupar a los pacientes en diferentes categorías de riesgo e instaurar la profilaxis más adecuada en cada caso. Existen algunos modelos propuestos para poder estimar el riesgo de ETV tras cirugía mayor ambulatoria, así como para predecir la aparición de ETV postoperatoria tras el alta hospitalaria. También se han propuesto y evaluado sistemas de alerta electrónica vinculados a modelos de estratificación del riesgo trombótico. El riesgo de trombosis hay que medirlo con el potencial riesgo hemorrágico, que también depende de las características del paciente y de la intervención quirúrgica a realizar. En los pacientes en los que el riesgo hemorrágico contraindique la utilización de profilaxis con fármacos anticoagulantes habría que recurrir a la utilización de medios mecánicos. Palabras clave: trombosis venosa profunda, embolismo pulmonar, factores de riesgo, estratificación de riesgo, cirugía general. IMPACTO DE LA ENFERMEDAD TROMBOEMBÓLICA VENOSA POSTOPERATORIA La ETV postoperatoria, en su forma de presentación como trombosis venosa profunda (TVP) y especial- mente cuando se produce una embolia pulmonar (EP), constituye una complicación postoperatoria potencialmente grave que afecta a un porcentaje importante de pacientes cuando no se adoptan medidas adecuadas para su prevención. Así, esta enfermedad se considera la principal causa de muerte evitable entre los pacientes ingresados en un hospital1. En este sentido, hay que destacar que entre el 10 % y el 20 % de los pacientes que sufren ETV fallecen en el primer mes tras su presentación, siendo la mortalidad mayor en los pacientes con EP que en aquellos con TVP2. En muchos casos la EP causa una muerte súbita, sin que haya tiempo de realizar pruebas diagnósticas, por lo que solo son correctamente identificadas si se lleva a cabo un estudio autópsico. En la actualidad, la mayoría de los estudios epidemiológicos demuestran que la incidencia de ETV sintomática postoperatoria se sitúa alrededor del 2 % tras intervenciones consideradas de alto riesgo, como cirugía ortopédica mayor, cirugía oncológica y cirugía bariátrica. Sin embargo, esta incidencia depende del periodo de seguimiento de los pacientes ya que, como comentaremos más adelante, la mayoría de las ETV postoperatorias se detecta pasadas entre 2 y 4 semanas tras la intervención de los pacientes de alto riesgo. Además de la morbimortalidad en fase aguda de la ETV, no debemos olvidar sus complicaciones y secuelas a largo plazo: recidivas tromboembólicas, síndrome postrombótico o desarrollo de una hipertensión pulmonar crónica3. Dado que la ETV postoperatoria permanece asintomática en muchos pacientes y cuando provoca síntomas de TVP o EP estos se atribuyen en muchas ocasiones a otros diagnósticos alternativos, es importante analizar su incidencia desde varias perspectivas, que incluyen la detección sistemática o cribado mediante I 11 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico pruebas diagnósticas objetivas realizadas a todos los casos, los resultados de series de autopsias y los registros y bases de datos administrativas, que se centran sobre todo en los casos sintomáticos. Detección de la enfermedad tromboembólica venosa mediante métodos diagnósticos objetivos Numerosos estudios llevados a cabo durante los últimos 30 años en los que se realizó un cribado de la TVP con métodos diagnósticos de elevada sensibilidad, como la flebografía o pruebas isotópicas, han permitido conocer la incidencia de la ETV en pacientes sometidos a diferentes intervenciones quirúrgicas. Los grupos de mayor riesgo son los de pacientes sometidos a cirugía ortopédica mayor (artroplastia de cadera y rodilla, y cirugía de fractura de cadera), politraumatizados y los operados por cáncer. Los estudios prospectivos llevados a cabo en un gran número de pacientes utilizando los mencionados métodos diagnósticos para detectar la ETV postoperatoria de forma sistemática pusieron de manifiesto que la mayoría de las TVP postoperatorias tienen su origen en las válvulas venosas de las venas profundas de la pantorrilla, quedando muchas limitadas a ese ámbito y no ocasionando apenas síntomas. No obstante, el 1020 % de estos trombos distales, cuando no se tratan, se extienden a sectores proximales del territorio venoso femoropoplíteo, aumentando el riesgo de provocar una EP, que puede producir la muerte en el 0,87 % de los pacientes. Estudios autópsicos De acuerdo con los resultados de un estudio autópsico llevado a cabo en Escandinavia en pacientes que fallecieron en los 30 días siguientes a una intervención quirúrgica, el 32 % de los cadáveres presentaban una EP y se consideró que esta complicación había sido la causante de la muerte en el 9,28 % de los pacientes4. Otro estudio similar realizado en la ciudad de Sheffield, en el Reino Unido, demostró que la EP fue responsable del 10 % de los fallecimientos ocurridos en el hospital5. Es destacable que el 25 % de los pacientes habían sido intervenidos quirúrgicamente una media de 13 días antes de sufrir la EP mortal. Por otra parte, solo presentaban síntomas de ETV el 19 % de los casos antes del fallecimiento, lo que pone de manifiesto que la mayoría de las TVP que desencadenan una EP masiva no presentan síntomas antes de provocar esta grave complicación y, cuando lo hacen, estos síntomas no son correctamente interpretados. Otro aspecto destacable es el de la rapidez con la que se presenta la EP, debutando muchas veces como una muerte súbita. En este sentido, el estudio llevado a cabo por Stein y colaboradores en Detroit puso de evidencia que en el 65 % de los pacientes que fallecieron por una EP la muerte se produjo durante la primera hora tras sufrir los pacientes los primeros síntomas6. En este estudio tan solo se sospechó la existencia de una ETV en el 30 % de los fallecidos por EP, lo que resalta la necesidad de prevenir esta complicación tan prevalente y difícil de diagnosticar y tratar a tiempo. Registros prospectivos y bases de datos Dado que los ensayos clínicos proporcionan información sobre pacientes seleccionados, excluyendo los casos más “difíciles”, en la actualidad se han revalorizado los registros prospectivos que incluyen a todos los pacientes observados en la práctica clínica real. Los datos del registro RIETE, que se inició en 2011 y recoge en la actualidad cerca de 60.000 casos consecutivos de ETV sintomática diagnosticados en los más de 130 hospitales participantes (la mayoría españoles), revelan que el 12 % de todos los casos habían sido intervenidos quirúrgicamente en las 8 semanas previas al diagnóstico. Aproximadamente la mitad de los casos presentaron clínica de EP y la otra mitad síntomas de TVP. En los primeros 3 meses tras el diagnóstico de ETV la incidencia de EP recurrente mortal fue 0,3 % en cirugía ortopédica mayor, 0,5 % tras cirugía oncológica y 0,4 % tras otras intervenciones7. En otro registro llevado a cabo en Estados Unidos, que incluyó 5.451 pacientes con TVP sintomática, se observó que el 38 % de los pacientes se habían intervenido en los 3 meses previos a sufrir la trombosis y el 65 % estaban ingresados en el hospital en el momento del diagnóstico8. ETIOPATOGENIA Y FACTORES DE RIESGO DE ENFERMEDAD TROMBOEMBÓLICA VENOSA EN CIRUGÍA La etiopatogenia de la ETV en general, y de la postoperatoria en particular, es compleja y multifactorial. A mediados del siglo xix, Rudolph Virchow postuló la clásica (y en parte todavía vigente) tríada etiopatogénica de la trombosis: activación de la coagulación, estasis y lesión en la pared vascular. Varios estudios experimentales han confirmado que se provocan trombos cuando se obstruye el flujo en una vena y se activa localmente la coagulación, o cuando se genera estasis al flujo y se lesiona la pared venosa. Clínicamente suele ser también necesario que coexistan al menos dos I 12 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico factores de esta tríada para que se produzca una ETV. En general, en la mayoría de los pacientes quirúrgicos la ETV se produce en relación con una situación de inmovilización y activación de la coagulación, por cáncer, sepsis o trombofilia. Por su parte, en los pacientes sometidos a cirugía pélvica y ortopédica mayor además suele producirse una lesión directa en las venas próximas a la zona operatoria. La hipercoagulabilidad es habitual en los pacientes quirúrgicos, como parte de la respuesta del organismo a la agresión. Además, situaciones como la sepsis, el cáncer o la presencia de trombofilias incrementan dicha hipercoagulabilidad. La disminución del flujo o estasis en el sistema venoso profundo predispone la aparición de la trombosis venosa, al permitir el acúmulo local de factores de la coagulación activados que no son adecuadamente diluidos por la sangre circulante ni pueden ser neutralizados por los inhibidores fisiológicos de la coagulación, que no llegan en condiciones normales al estar el flujo muy enlentecido. Además, las peculiares características físicas de la sangre hacen que cuando se reduce el flujo venoso aumente su viscosidad, empeorando aún más la estasis. Por otra parte, en situaciones de estasis se produciría hipoxia local y lesión endotelial a nivel de las válvulas venosas9. En condiciones fisiológicas el flujo venoso se acelera por la contracción de los músculos de las extremidades inferiores durante la deambulación. Por el contrario, en situaciones de inmovilización (habituales en los pacientes quirúrgicos hospitalizados) o cuando existe obstrucción al flujo venoso por compresión tumoral de sectores venosos proximales, se puede iniciar una trombosis venosa. La importancia de la inmovilización en la etiopatogenia de la ETV se pone de manifiesto por la elevada frecuencia de TVP y EP detectada en estudios autópsicos en pacientes inmovilizados. En los pacientes sometidos a cirugía abdominal esofagogástrica, hepatobiliar, pancreática o sobre el colon no suelen traumatizarse las venas iliacas ni de las extremidades inferiores, siendo la inmovilización y la hipercoagulabilidad los factores determinantes en la formación de los trombos venosos, que suelen originarse en las válvulas venosas de las venas de la pantorrilla. Por el contrario, en la cirugía oncológica pélvica (resecciones de recto, histerectomías, cistectomías, etc.), en la que se llevan a cabo maniobras de disección sobre las venas iliacas, se pueden producir desgarros endoteliales con exposición de la matriz subendotelial, muy trombogénica, y expresión de factor tisular, que resultan en la formación de trombos en ese ámbito. Además, se ha demostrado recientemente que en situaciones de sepsis y en pacientes con cáncer en tra- tamiento quimioterápico se produce inflamación en la pared venosa, mediada por la activación de las células endoteliales y leucocitos. Los hallazgos de investigaciones recientes sugieren que, cuando se producen pequeñas lesiones en al ámbito endotelial venoso, los neutrófilos y las plaquetas se adhieren al trombo y se activan liberando mediadores procoagulantes y proinflamatorios10,11. Entre estos destacan la trombina y algunas citocinas, como el TNF y las interleucinas 6 y 8. A medida que el trombo crece, los neutrófilos al principio y, posteriormente, los monocitos provocan una reacción inflamatoria en la pared venosa. Es importante entender bien los mecanismos etiopatogénicos antes descritos para poder correlacionarlos con los factores de riesgo de tipo clínico y permitir su identificación. Así, el riesgo de sufrir una ETV postoperatoria depende tanto de las características del paciente y de la intervención quirúrgica practicada como de otros factores relacionados con su ingreso hospitalario: inmovilización y aparición de complicaciones postoperatorias, entre otros. En general, los factores clínicos de riesgo de trombosis se dividen en dos grandes grupos: predisponentes y desencadenantes. Entre los factores predisponentes, intrínsecos o asociados al paciente y que son los que suele presentar a su ingreso en el hospital, destacan edad avanzada, presencia de cáncer, obesidad, trombofilia congénita o adquirida e historia previa de ETV. Entre los factores desencadenantes o extrínsecos, relacionados con su estancia en el hospital destacan la inmovilización, la intervención quirúrgica y su duración, traumatismos y canalización de vías centrales. Estudios llevados a cabo en la última década han puesto de manifiesto que las complicaciones perioperatorias aumentan el riesgo trombótico, particularmente infecciones del tracto urinario, neumonías, utilización de transfusiones e insuficiencia renal aguda. En definitiva, la ETV es una enfermedad multifactorial y muchos pacientes presentan varios factores de riesgo simultáneamente, sin que entendamos en la actualidad como interactúan entre ellos12. Para poder conseguirlo harían falta estudios que incluyan un gran número de pacientes en los que, mediante análisis estadísticos de regresión logística múltiple, se pudiesen identificar los factores predictivos independientes y su posible sinergia. ESTRATIFICACIÓN DEL RIESGO DE ENFERMEDAD TROMBOEMBÓLICA VENOSA POSTOPERATORIA Una correcta valoración de la presencia de los factores antes comentados es necesaria para poder estimar el riesgo potencial de cada paciente de sufrir ETV y así I 13 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico adoptar las medidas profilácticas más adecuadas en función de dicho riesgo. Durante los últimos años se han propuesto tres categorías de riesgo tromboembólico, bajo, moderado y alto, para los pacientes quirúrgicos. Sin embargo, en su última edición (9.ª), las guías del American College of Chest Physicians (ACCP) establecen cuatro nuevas categorías de riesgo para los pacientes sometidos a cirugía no ortopédica: muy bajo, bajo, moderado y alto13. Actualmente existen dos enfoques prácticos para la estimación del riesgo potencial de sufrir ETV de un paciente quirúrgico. El primero, más sencillo de aplicar, consiste en asignar el riesgo agrupando a los pacientes en función de la intervención quirúrgica que se va a realizar. El segundo enfoque, más complejo, consiste en una evaluación individualizada de los factores de riesgo predisponentes y desencadenantes que presenta cada paciente y, en función del número y su relevancia, obtener una puntuación o score que sitúa al paciente en el nivel de riesgo correspondiente. Estratificación del riesgo trombótico basada fundamentalmente en el tipo de intervención quirúrgica Para simplificar el proceso de predicción del riesgo trombótico se propusieron modelos relativamente simples, como el contenido en las guías de 2004 del ACCP, en el que la estimación de riesgo para pacientes quirúrgicos se basaba fundamentalmente en la edad del paciente, el tipo de cirugía y la presencia de factores de riesgo adicionales, si bien este último aspecto era algo impreciso14. Basándose en la aplicación de este modelo, un estudio epidemiológico (ENDORSE) en el que se han revisado más de 68.000 historias clínicas de pacientes hospitalizados en más de 30 países, ha puesto de manifiesto que el 64 % de todos los pacientes quirúrgicos encamados estaban considerados de alto riesgo, aunque solo recibieron profilaxis adecuada el 59 %15. Posteriormente, las guías del ACCP de 2008, en un intento (a nuestro juicio excesivo) de simplificar la estratificación de riesgo de ETV postoperatoria, limitaron la decisión al tipo de intervención practicada, de tal forma que se consideraban pacientes de alto riesgo aquellos sometidos a cirugía ortopédica mayor de artroplastia de cadera o rodilla o a cirugía de fractura de cadera1. En este modelo se consideraba que los pacientes sometidos a cirugía general pertenecerían mayoritariamente a la categoría de riesgo moderado. Es llamativo que no se incluyera a los pacientes sometidos a cirugía oncológica en el nivel de alto riesgo. La principal ventaja de este enfoque es que simplifica mucho el proceso, al no tener que valorar la presen- cia de un número considerable de factores de riesgo, como en los modelos que comentaremos en el próximo apartado. Sin embargo, esta simplificación puede subestimar el riesgo real de un paciente con varios factores intrínsecos de riesgo que se someta a una intervención de “riesgo bajo o moderado”. Así, por ejemplo, si un paciente de 60 años, obeso, con varices en las extremidades inferiores e historia de ETV previa se somete a una colecistectomía laparoscópica, de acuerdo con las guías del ACCP de 2008, sería de riesgo moderado, cuando en realidad se trata de un caso de muy elevado riesgo. La tendencia actual es a individualizar el riesgo, ponderando la presencia en cada paciente de factores predisponentes y desencadenantes, utilizando para ello alguno de los modelos de estratificación del riesgo se detallan a continuación. Estratificación del riesgo trombótico individualizada basada en la obtención de un score o puntuación La 9.ª edición de las guías del ACCP, publicada en 2012, incorpora dos modelos de estratificación basados en el cálculo de una puntuación en función de la presencia de factores de riesgo13. El primero, propuesto por Rogers y colaboradores, se obtuvo a partir de los datos de más 180.000 pacientes sometidos a cirugía general, vascular y torácica, incluidos en un registro. Analizando las variables independientes predictivas de ETV sintomática se obtiene un sistema de puntuación o score que asigna los pacientes a categoría de muy bajo, bajo o moderado riesgo de ETV16. Este modelo tiene la ventaja de haber sido validado internamente, pero no se ha sometido a validación externa y es complejo de utilizar, ya que precisa algunos resultados de pruebas de laboratorio. Además, no incluye una categoría de alto riesgo, lo que podría llevar a muchos clínicos a subestimar el riesgo de los pacientes. El otro modelo incorporado por el ACCP en su 12.ª edición es el propuesto por Caprini y colaboradores hace más de 20 años, que ha experimentado diversas modificaciones desde entonces17-19. Aunque este modelo estratificaba originalmente los pacientes en categorías de bajo, moderado, alto y muy alto riesgo en función de la puntuación total, la 9.ª edición del ACCP lo ha adaptado a las siguientes categoría de riesgo de ETV en función de la puntuación total: muy bajo (0-1 puntos), bajo (2 puntos), moderado (3-4 puntos) y alto riesgo (5 o más puntos) (Tabla 1)13. El desarrollo de este modelo se basó en un análisis detallado de la literatura científica con respecto a la influencia de los diferentes factores de riesgo en la incidencia de ETV postoperatoria. De esta forma, el modelo de Caprini contempla la mayoría de los factores de riesgo conocidos y es rela- I 14 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico tivamente sencillo de utilizar, habiendo sido adoptado en numerosos hospitales de varios países. La principal ventaja de este modelo es que ha sido validado externamente en varios estudios, destacando el de Bahl y colaboradores, que revisan de forma retrospectiva más de 8.000 pacientes quirúrgicos generales a los que se había aplicado este modelo y evalúan la incidencia de ETEV sintomática en función de la categoría de riesgo20. Los resultados del estudio demuestran una buena discriminación entre las categorías de riesgo. Hay que destacar que ninguno de los 79 pacientes considerados de bajo riesgo (puntuación de 0-1) sufrió ETV, mientras que alrededor del 2 % de los pacientes con una puntuación mayor de 4 sufrieron esta complicación, que llegó a afectar al 6,5 % de aquellos casos con una puntuación de 9 o más. El modelo de Caprini también ha sido validado en cirugía plástica y reconstructora con buenos resulta- dos21,22. Incluso se han comparado las versiones del modelo de Caprini de 2005 con la de 2010 en este tipo de cirugía, consiguiendo una mejor correlación entre la puntuación y la incidencia de ETV en la versión de 200523. También se ha validado en otorrinolaringología24 y cirugía ginecológica oncológica25. Más recientemente, Lobastov y colaboradores han correlacionado la puntuación con la incidencia de ETV detectada de forma prospectiva mediante ecodoppler seriado de las venas profundas de las extremidades inferiores en un grupo de 140 pacientes sometidos a cirugía abdominal y neurocirugía26. Es destacable que la incidencia global de TVP ascendió al 28 %; de acuerdo con el modelo de Caprini, esta fue del 2 % en pacientes con 5-8 puntos, 26 % en aquellos con 9-11 puntos y 65 % si la puntuación era superior a 11. Las diferencias entre estas tasas tan elevadas de ETV y las obtenidas en los otros Tabla 1. Modelo de estratificación de Caprini basado en la presencia y ponderación de factores de riesgo y asignación de riesgo según adaptación de la 9.º Guía del ACCP 1 PUNTO 2 PUNTOS 3 PUNTOS 5 PUNTOS Edad 41-60 años 61-74 años > 75 años Ictus (< 1 mes) Cirugía menor Cirugía artroscópica Historia ETV Artroplastia programada de cadera o rodilla IMC > 25 kg/m2 Cirugía abierta mayor (> 45 minutos) Historia familiar ETV Fractura de pierna, cadera o pelvis Tumefacción MMII Cirugía laparoscópica (> 45 minutos) Factor V Leiden Daño espinal agudo (< 1 mes) Varices Cáncer Gen de la protrombina 20210A Embarazo o puerperio Encamamiento (> 72 horas) Anticoagulante lúpico Historia de abortos espontáneos inexplicados o recurrentes Férula de escayola Anticuerpos anticardiolipina Anticonceptivos o terapia hormonal Acceso venoso central sustitutiva Aumento niveles homocisteína Sepsis (< 1 mes) Trombocitopenia inducida por heparina Enfermedad pulmonar grave, incluida neumonía (< 1 mes) Otras trombofilias hereditarias o adquiridas Función pulmonar disminuida Infarto agudo de miocardio Insuficiencia cardiaca congestiva (< 1 mes) Enfermedad inflamatoria intestinal Paciente inmovilizado por enfermedad médica IMC: índice de masa corporal; ETV: enfermedad tromboembólica venosa. Estratificación de riesgo según la puntuación total Riesgo muy bajo: 0 puntos Riesgo bajo: 1-2 puntos Riesgo intermedio: 3-4 puntos Riesgo alto: ≥ 5 puntos I 15 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico estudios mencionados radican en que en el estudio de Lobastov se llevó a cabo, como se ha comentado, una detección prospectiva de la ETV mediante un cribado sistemático, mientras que en los otros estudios solo se incluyeron los casos sintomáticos que suelen representar el 10-20 % del total. La Tabla 2 muestra la incidencia estimada de ETV sintomática en función de la categoría de riesgo de la adaptación que hace el ACCP del modelo de Caprini. Como se aprecia en dicha tabla, el riesgo de ETV sintomática en los pacientes sometidos a cirugía general (incluyendo cirugía digestiva, urología, vascular, de la mama y tiroides) de alto riesgo de acuerdo con el modelo de Caprini (> 4 puntos) asciende al 2 %. Por su parte, este riesgo se eleva hasta el 2,7 % en los pacientes sometidos a cirugía plástica y reconstructiva con una puntuación de 7-8.13 ESTIMACIÓN DEL RIESGO DE ENFERMEDAD TROMBOEMBÓLICA VENOSA TRAS EL ALTA HOSPITALARIA La mayoría de los métodos de estratificación de riesgo hasta ahora comentados se diseñaron para intentar estimar el riesgo de ETV postoperatoria, fundamentalmente durante el ingreso hospitalario. Sin embargo, en las dos últimas décadas se ha puesto de manifiesto que un porcentaje importante de trombosis y embolias postoperatorias se detectan tras el alta, lo que es hasta cierto punto lógico, dado que la estancia hospitalaria de los pacientes quirúrgicos es cada vez menor. Así, de acuerdo con los datos del registro RIETE, antes comentado, el tiempo medio transcurrido entre la intervención y el momento de presentación de la ETV ascendió a 21 y 24 días tras cirugía ortopédica mayor y oncológica, respectivamente. De hecho, más de la mitad de los casos se diagnosticaron tras haber suspendido la profilaxis7. Estos datos, así como otros estudios recientes, ponen de manifiesto que el riesgo trombótico postoperatorio se prolonga durante varias semanas tras el alta hospitalaria, especialmente en pacientes operados por cáncer27,28. La mayoría de las guías actuales de prevención de ETV postoperatoria recomiendan prolongar la profilaxis farmacológica durante al menos 4 semanas tras la intervención en caso de cirugía ortopédica mayor o cirugía oncológica abdominopélvica13,29. Esta recomendación se basa en los resultados de varios ensayos clínicos aleatorizados y doble ciego y metaanálisis en los que se demuestra que dicha prolongación de la administración de heparina de bajo peso molecular (HBPM) reduce significativamente la incidencia de TVP (proximal y distal) al mes de la cirugía en comparación con su administración durante 7-10 días30,31. Una limitación de esta recomendación es que se basa en el tipo de cirugía y la presencia de cáncer, soslayando la influencia de otros factores. En este sentido, sería importante poder estimar el riesgo de presentación de ETV tras el alta hospitalaria de forma más individualizada en todos los pacientes (incluyendo a los operados por patología no neoplásica), teniendo en cuenta para ello no solo los factores de riesgo que presenta el paciente en el momento de su ingreso y el tipo de cirugía que se va a realizar, sino también la posible influencia de otros factores relacionados con su evolución postoperatoria. Para tratar de responder a esta cuestión, Iannuzzi y colaboradores han llevado a cabo recientemente un estudio en una serie de más de 560.000 pacientes quirúrgicos incluidos en la base NSQIP del American College of Surgeons, con objeto de identificar variables que se relacionan con la aparición de ETV tras el alta hospitalaria y durante el primer mes postoperatorio32. Una vez identificadas mediante un análisis de regresión logística las variables predictivas independientes, crearon un modelo de estratificación (Tabla 3) que validaron internamente en otros 280.000 pacientes procedentes de dicha base datos. Hay que destacar que, aparte de las variables como la edad > 57 años, la duración de la cirugía > 100 minutos, la Tabla 2. Estimación del riesgo de ETV sintomática en la práctica clínica actual de acuerdo con el modelo de Caprini en cirugía general (abdominopélvica, bariátrica, vascular), plástica y reconstructora Pacientes Cirugía general Cirugía plástica y reconstructora Puntuación Caprini Riesgo ETV sintomática % ETV sin profilaxis -- <0,5 % Categoría de riesgo Puntuación Caprini Riesgo ETV sintomática Muy bajo 0 0 % 0-2 Bajo 1-2 0,7 % 3-4 0,6 % 1,5 % Moderado 3-4 1,0 % 5-6 1,3 % 3 % Alto >4 1,9 % 7-8 2,7 % 6 % I 16 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico nes postoperatorias o la duración del ingreso hospitalario representan factores determinantes para la aparición de ETV tras el alta. Los resultados de este estudio, que adolece de validación externa independiente, son importantes porque plantean la necesidad de una estimación preoperatoria del riesgo global de ETV postoperatoria y una revaloración en el momento del alta para predecir qué pacientes presentan un riesgo trombótico prolongado y adaptar la duración de la profilaxis a dicho riesgo. Tabla 3. Modelo de Iannuzzi para la predicción de ETV tras el alta hospitalaria Variable Puntos Uso de esteroides 4 Edad > 57 años 2 Duración intervención > 100 minutos 2 Dependencia functional del paciente 2 Obesidad (IMC > 30 kg/m ) 2 Tabaquismo -1 0-1 Días de ingreso sin complicaciones* 0 Días de ingreso con complicaciones 5 1-3 Días de ingreso sin complicaciones 2 Días de ingreso con complicaciones 10 4-6 Días de ingreso sin complicaciones 6 Días de ingreso con complicaciones 12 7-8 Días de ingreso sin complicaciones 8 Días de ingreso con complicaciones 11 9-14 Días de ingreso sin complicaciones 8 Días de ingreso con complicaciones 10 2 ESTRATIFICACIÓN DEL RIESGO TRAS CIRUGÍA MAYOR AMBULATORIA *Complicaciones: infección intraabdominal, problemas cardiacos, dependencia de ventilación asistida, neumonía, reoperación, insuficiencia renal, accidente cerebrovascular, coma, shock, hemorragia y sepsis. Estratificación de riesgo de acuerdo con la puntuación: Bajo riesgo: -1 a 8 Riesgo moderado: 9 a 13 Alto riesgo: > 13 obesidad o el estado funcional de los pacientes, este estudio puso de manifiesto que la aparición de complicacio- El porcentaje de pacientes intervenidos en unidades de cirugía mayor ambulatoria (CMA) sin ingreso o de alta precoz ha aumentado considerablemente en los últimos años, hasta cerca del 60 %. La complejidad de estas intervenciones y la edad de los pacientes operados en estas unidades también se han incrementado, lo que podría conllevar mayor riesgo de presentación de ETV; sin embargo, existen muy pocos estudios prospectivos en cuanto a la incidencia de la ETV y su prevención en cirugía ambulatoria. En nuestro país, la Asociación Española de Cirugía Mayor Ambulatoria (ASECMA) actualizó en 2011 las recomendaciones de consenso para la prevención de la ETV en este tipo de cirugía33. Este documento incluye un modelo de estratificación de riesgo basado en la intervención que se va a practicar y las características del paciente. En la tablas 4 y 5 se muestra la adaptación de este modelo a los pacientes quirúrgicos generales ambulatorios y las recomendaciones en función del nivel de riesgo. Tabla 4. Modelo de estratificación de riesgo para pacientes sometidos a cirugía general ambulatoria o de corta estancia propuesto por la ASECMA Intervención quirúrgica Bajo riesgo – Laparoscópica < 60´ – Hernias de pared unilaterales – Cirugía perianal – Cirugía de la mama – Cirugía partes blandas extensas Riesgo moderado – Laparoscópica > 60´ – Hernias de pared bilaterales Niveles de riesgo en función de las características del paciente Nivel 1 (riesgo bajo) – Edad < 40 años – Embarazo y puerperio – Tratamiento con estrógenos – Insuficiencia cardiorrespiratoria – Varices – Enfermedad inflamatoria intestinal – Sobrepeso (IMC = 25-35 kg/m2) – Fumadores > 30 cigarrillos diarios Nivel 2 (riesgo moderado) – Edad 40-60 años – Obesidad – (IMC = 35-50 kg/m2 ) – Inmovilización > 3 días – Síndrome mieoproliferativo – Síndrome nefrótico – Trombofilias clínicamente relevantes – Parálisis extremidad inferior I 17 I Nivel 3 (alto riesgo) – Edad > 60 años – Historia ETV – Cáncer activo – Superobesidad – (IMC > 50 kg/m2) Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico Lozano y colaboradores han llevado a cabo un estudio en el que la profilaxis de la ETV con HBPM se adaptó al modelo de la ASECMA en un grupo de pacientes sometidos fundamentalmente a cirugía herniaria y de sinus pilonidal en una unidad de CMA, y en el que más del 60 % de los casos fueron considerados de riesgo moderado o alto34. Los autores buscaron la presencia de trombofilia, identificándola en el 28 % de los casos. No obstante, la incidencia de ETV postoperatoria fue mínima, lo que podría explicarse por la eficacia de la profilaxis utilizada según el modelo predictivo de ASECMA. En las últimas guías de recomendaciones de prevención de la ETV de la Asociación Española de Cirujanos se adopta dicho modelo para la CMA35. Analizando los datos de la base antes comentada del NSQIP, Pannucci y colaboradores identifican una serie de factores que se correlacionan con la presentación de ETV tras el alta en el primer mes del postoperatorio en pacientes sometidos a cirugía ambulatoria con estancia en el hospital inferior a 24 horas36. La incidencia global de ETV fue del 0,15 % y los factores predictivos independientes fueron la cirugía artroscópica, la cirugía de las varices, el embarazo, la edad > 59 años, la obesidad mórbida (IMC ≥ 40 kg/m2), la presencia de cáncer y la duración de la intervención superior a las 2 horas. Mediante un análisis de regresión logística diseñaron una escala de estratificación con cuatro categorías de riesgo. Una posible limitación de este estudio es que la influencia de la cirugía venosa resultó determinante, con odds ratios de hasta 15,61. Sirva como ejemplo que de los pacientes considerados de Tabla 5. Recomendaciones para la prevención de la ETV en pacientes de cirugía ambulatoria o de corta estancia (adaptada de las recomendaciones de la ASECMA) Riesgo de la intervención* Bajo Moderado Alto Riesgo del paciente* Profilaxis recomendada Nivel 1 Medidas físicas** Nivel 2 Medidas físicas + HBPM a dosis bajas (< 3.400 U) Nivel 3 Medias físicas + HBPM a dosis altas (> 3.400 U) Nivel 1 Medias físicas + HBPM a dosis bajas (< 3.400 U) Nivel 2 Medias físicas + HBPM a dosis altas (> 3.400 U) Nivel 3 Medias físicas + HBPM a dosis altas (> 3.400 U) No aplicable a CMA No aplicable a CMA *La valoración de estos riesgos está recogida en la Tabla 4. ** Deambulación precoz, medias elásticas o compresión neumática intermitente. muy alto riesgo, con una puntuación de más de 10, el 97 % se habían sometido a este tipo de cirugía. Aunque realizaron una validación interna del modelo en un subgrupo de pacientes procedentes de la mencionada base, sería necesaria una validación externa y tratar de obtener un modelo que no incluyese la cirugía venosa. SISTEMAS DE ALERTA ELECTRÓNICA BASADOS EN MODELOS SIMPLIFICADOS DE ESTRATIFICACIÓN DE RIESGO Uno de los primeros estudios que evaluó la utilidad de las alertas electrónicas para mejorar la utilización de la profilaxis en pacientes hospitalizados fue llevado a cabo por Kucher y colaboradores37. Para ello, se evaluó mediante asignación aleatoria la aplicación de un sistema informático que requería que los clínicos, antes de realizar la prescripción electrónica, llevasen a cabo una sencilla estimación de riesgo de ETV basada en la presencia de ocho factores de riesgo. En otro grupo no se usaron dichas alertas, dejando la utilización de profilaxis al criterio del médico responsable. En el primer grupo, cuando el programa estimaba que el paciente era de alto riesgo, el clínico recibía un aviso en pantalla recomendando la utilización de profilaxis. En los pacientes del grupo que recibía la alerta se redujo la incidencia de ETV en los 3 primeros meses, a contar desde el ingreso, del 8,2 % al 4,9 %. En nuestro país, Lecumberri y cols., han analizado el impacto de un sistema similar de alertas electrónicas basado en otro modelo de estratificación de riesgo trombótico38. Utilizando dicho sistema, los médicos de la Clínica Universitaria de Navarra recibieron una alerta electrónica cuando el programa identificaba un paciente de alto riesgo trombótico sin profilaxis, quedando a su criterio la prescripción de profilaxis antitrombótica. Por lo que se refiere a los pacientes quirúrgicos, más del 88 % recibieron profilaxis adecuada. Por su parte, la incidencia de ETV sintomática durante el ingreso hospitalario se redujo del 2,2 ‰ antes de introducir las alertas, al 1,3 ‰ y 1,8 ‰ en el primer y segundo año tras dicha intervención. Es destacable que dicha reducción fue mayor en el grupo de pacientes médicos, en los que la calidad de la profilaxis antes del estudio era peor. Otra potencial ventaja de estos sistemas de alertas vinculados a la prescripción electrónica es que podrían mejorar la profilaxis preoperatoria en pacientes que están ingresados algunos días antes de la intervención, así como la profilaxis durante el ingreso en pacientes que finalmente no son intervenidos, pero que debido a la presencia de varios factores de riesgo presentan un elevado riesgo trombótico39. Por ejemplo, un paciente I 18 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico obeso, de más de 60 años, ingresado 5 días por una diverticulitis aguda complicada que no se moviliza apenas, presenta un elevado riesgo potencial de ETV aunque no se intervenga. También el modelo de estratificación de Caprini ha sido vinculado a sistemas de alerta electrónica, con muy buenos resultados. Así, por ejemplo, un reciente estudio llevado a cabo en la Universidad de Boston requiere que se realice en el ordenador la estimación del riesgo con dicho modelo como paso previo a la prescripción electrónica, recibiendo el clínico un informe en pantalla sobre el riesgo potencial de ETV y la profilaxis recomendada, sin que sea obligatorio seguir dicha recomendación40. Tras la implantación de este sistema de alertas electrónicas, y de acuerdo con la base de datos del centro hospitalario, se ha reducido la incidencia de TVP y EP postoperatorias en un 85 % y 55 %, respectivamente. Esta reducción no se había conseguido hasta ahora con ningún otro modelo de estratificación de riesgo. En otro estudio llevado a cabo en una unidad de cuidados intensivos quirúrgicos que también utiliza un sistema similar basado en el modelo de Caprini, los autores demuestran que el sistema electrónico es más preciso que la estratificación manual utilizando la versión impresa del modelo, tendiendo este último a infravalorar el riesgo real41. De hecho, una infravaloración de más de 2 puntos en la puntuación final con el sistema manual resultó en una mayor incidencia de ETV durante el ingreso hospitalario (7,67 % frente a 4,59 %, p = 0,002). generales de los pacientes y con diferentes intervenciones quirúrgicas, que se detallan en la Tabla 6, tomada de la 9.ª edición de las guías del ACCP13. Hay que hacer una interpretación cuidadosa de esta tabla, sobre todo en lo que se refiere a los factores relacionados con la intervención practicada, ya que los que aparecen detallados no constituyen (en general) una contraindicación absoluta para llevar a cabo profilaxis farmacológica, sino Tabla 6. Factores de riesgo hemorrágico en función de las características del paciente y de la intervención, de acuerdo con la 9.ª edición de las guías del ACCP Factores de riesgo general Sangrado activo. Antecedentes de sangrado grave. Trastornos de la coagulación conocidos, no tratados. Insuficiencia hepática o renal graves. Trombocitopenia. Ictus agudo. Hipertensión arterial no controlada. Punción lumbar, anestesia espinal o epidural en las primeras 12 horas tras la administración de HBPM, o si se administra la HBPM en las primeras 6 horas tras la técnica neuroaxial. Uso concomitante de anticoagulantes, antiplaquetarios o trombolíticos. Factores dependientes del procedimiento/intervención Cirugía abdominal Varón, hemoglobina < 13 g/dL, cáncer y cirugía complicada definida por dos o más procedimientos, disección difícil o más de una anastomosis. Pancreatoduodenectomía Sepsis, fuga pancreática o sangrado centinela. ESTRATIFICACIÓN DEL RIESGO HEMORRÁGICO Al estimar el riesgo trombótico de un paciente con objeto de instaurar la mejor profilaxis posible, habitualmente mediante la administración de anticoagulantes, debemos siempre estimar simultáneamente el potencial riesgo hemorrágico del paciente o la intervención que se va a practicar. En este sentido, es hasta cierto punto sorprendente que el riesgo hemorrágico y su predicción no hayan sido tan estudiados como el riesgo trombótico. Los datos del estudio ENDORSE pusieron de manifiesto que el 10 % de los pacientes considerados de alto riesgo trombótico presentaban alguna contraindicación para la utilización de fármacos anticoagulantes. En estos casos habría que recurrir a los métodos mecánicos, como las medias elásticas o sistemas de compresión neumática intermitente, que no interfieren con la hemostasia15. Algunos estudios han identificado varios factores de riesgo hemorrágico relacionados con las características I 19 I Resección hepática Número de segmentos, resección extrahepática concomitante, hepatocarcinoma, anemia y plaquetopenia. Cirugía cardiaca Uso de aspirina. Uso de clopidogrel en los 3 días previos a la cirugía. IMC >25 kg/m2, cirugía urgente, colocación de 5 o más bypass. Edad avanzada, insuficiencia renal, cirugía distinta a la revascularización, mayor duración de circulación extracorpórea. Cirugía torácica Neumonectomía o resección extendida. Procedimientos en los que las complicaciones hemorrágicas pueden tener consecuencias graves Cirugía ocular. Craneotomía. Cirugía espinal. Trauma espinal. Procedimientos reconstructivos con colgajo libre. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico más bien para extremar las precauciones con una técnica quirúrgica cuidadosa y una hemostasia minuciosa. El problema radica en que es difícil estimar el riesgo hemorrágico real a partir de los grupos placebo o control de ensayos clínicos, puesto que muchos pacientes de alto riesgo hemorrágico son excluidos. Asumiendo estas limitaciones, un metaanálisis de la literatura revisa más de 30.000 pacientes incluidos en ensayos clínicos, demostrando que la incidencia de complicaciones hemorrágicas que requirieron reintervención fue del 1 % y 1,8 % en los pacientes que habían recibido heparinas de bajo peso molecular o heparina no fraccionada, respectivamente, y del 0,7 % en los que recibieron un placebo42. Estos datos ponen de manifiesto que existe un riesgo hemorrágico inherente a la cirugía y que los pacientes sufren complicaciones hemorrágicas incluso cuando no reciben profilaxis con anticoagulantes. BIBLIOGRAFÍA 1. Geerts WH, Bergqvist D, Pineo GF, et al. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133:381-453. 2. Beckman MG, Hooper C, Critchley SE, Ortel TL. Venous thromboembolism: a public health concern. Am J Prev Med. 2010;38:495s-501s. 3. Prandoni P, Lensing AW, Cogo A, et al. The long-term clinical course of acute deep venous thrombosis. Ann Intern Med. 1996;125:1-7. 4. Lindblad B, Sternby NH, Bergqvist D. Incidence of venous thromboembolism verified by necropsy over 30 years. BMJ. 1991; 302:709-11. 5. Sandler DA, Martin JF. Autopsy proven pulmonary embolism in hospital patients: are we detecting enough deep vein thrombosis? J Roy Soc Med. 1989;82:203-5. 6. Stein PD, Henry JW. Prevalence of acute pulmonary embolism among patients in a general hospital and at autopsy. Chest. 1995;108:978-81. 7. Arcelus JI, Monreal M, Caprini JA, et al. Clinical presentation and time-course of postoperative venous thromboembolism: Results from the RIETE Registry. Thromb Hamost. 2008;99:546-51. 8. Goldhaber SZ, Tapson VF. A prospective registry of 5,451 patients with ultrasound-confirmed deep vein thrombosis. Am J Cardiol. 2004;93:259-62. 9. Malone PC, Agtter PS. The aetiology of deep venous trombosis. QJM 2006;99:581-93. 10. Wakefield TW, Myers DD, Henke PK. Mechanisms of venous trombosis and resolution. Arterioscl Thromb Vasc Biol. 2008;28:387-91. 11. Furie B, Furie BC. Mechanisms of thrombus formation. N Engl J Med. 2008;359:938-49. 12. Laporte S, Mismetti P. Epidemiology of thrombotic risk factors: the difficulty in using clinical trials to develop a risk assessment model. Crit Care Med. 2010;38(Suppl):s10-s17. 13. Gould MK, García D, Wren SM, Karanicolas PJ, Arcelus JI, Heit JA, et al. Prevention of VTE in Non-orthopedic Surgical Patients. Chest. 2012;141(Suppl2):e227s-277s. 14. Geerts WH, Pineo GF, Heit JA, et al. Prevention of venous thromboembolism: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126(Suppl3):338S-400S. 15. Cohen AT, Tapson VF, Bergmann JF, et al. Venous thromboembolism risk and prophylaxis in the acute hospital care setting (ENDORSE study): a multinacional cross-sectional study. Lancet. 2008;371:387-94. 16. Rogers S, Kilaru RK, Hosokawa P, Henderson WG, Zinner MJ, Khuri SF. Multivariable predictors of postoperative venous thromboembolic events after general and vascular surgery: results from the Patient Safety in Surgery Study. J Am Coll Surg. 2007;204:1211-21. 17. Caprini JA, Arcelus JI, Hasty JH. Clinical assessment of venous thromboembolic risk in surgical patients. Semin Thromb Hemost. 1991;17(Suppl3):304-12. 18. Caprini JA, Arcelus JI, Reyna JJ. Effective risk stratification of surgical and nonsurgical patients for venous thromboembolic disease. Semin Hematol. 2001;38(2 Suppl5):12-9. 19. Caprini JA. Risk assessment as a guide for the prevention of the many faces of venous thromboembolism. Am J Surg. 2010;199(Suppl1):s3-s10. 20. Bahl V, Hu HM, Henke PK, et al. A validation study of a retrospective venous thromboembolism risk scoring method. Ann Surg. 2010;251:344-50. 21. Seruya M, Venturi ML, Iorio ML, Davison SP. Efficacy and safety of venous thromboembolism prophylaxis in highest risk plastic surgery patients. Plast Reconstr Surg. 2008;122:1801-708. 22. Hatef DA, Kenkel JM, Nguyen MQ, Farkas JP, Abtahi F, Rohrich RJ, et al. Thromboembolic risk assessment and the efficacy of Enoxaparin prophylaxis in excisional body contouring surgery. Plast Reconstr Surg. 2008;122:269-79. 23. Pannucci CJ, Barta RJ, Portschy PR, Dreszer G, Hoxworth RE, Kalliainen LK, et al. Assessment of post-operative venous thromboembolism risk in plastic surgery patients using the 2005 and 2010 Caprini risk score. Plast Reconstr Surg. 2012;130:343-53. 24. Shuman AG, Hu HM, Pannucci CJ, Jackson CR, Bradford CR, Bahl V. Stratifying the risk of venous thromboembolism in otolaryngology. Otorynolaryngology. 2012;146:719-24. 25. Stroud W, Whitworth JM, Miklic, Schneider KE, Finan MA, Scalici J, et al. Gynecologic Oncol. 2014;134:160-3. 26. Losbatov KV, Barinov VE, Schastlivtsev IV, Laberko LA. Caprini score as individual risk assessment model of postoperative venous thromboembolism in patients with high surgical risk. Khirurgiia. 2014;12: 16-23. 27. Sweetland S, Green J, Liu B, Berrington A, Canonico M, Reeves G, et al. Duration and magnitude of the postoperative risk of venous thromboembolism in middle aged women. BMJ. 2009;339:4583-90. 28. Alsubaie H, Leggett CY, Lambert P, Park J, Hochman D, Wirtzfeld D, et al. Diagnosis of VTE postdischarge for major abdominal and pelvic oncologic surgery: implications for a change in practice. Can J Surg 2015; DOI: 10.1503/cjs.012314. 29. Lyman GH, Khorana AA; Kuderer MM, et al. Venous thromboembolism prophylaxis and treatment in patients with cáncer: American Society of Clinical Oncology clinical practice update. J Clin Oncol. 2013;31:2189-204. 30. Bottaro FJ, Elizondo MC, Doti C, Bruetman JE, Pérez-Moreno PD, Bullorsky EO, et al. Efficacy of extended thromboprophylaxis in major abdominal surgery: what does the evidence show? A meta-analysis. Thromb HAemost. 2008;99:1104-11. I 20 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico 31. Kakkar VV, Balibrea JL, Martínez-González, Prandoni P, CANBESURE Study Group. Extended prophylaxis with bemiparin for the prevention of venous thromboembolism after abdominal or pelvic surgery for cancer. J Thromb Haemost. 2010;8:1223-9. 32. Iannuzzi JC, Young KC, Kim MJ, Gillespie DL, Monson JR, Fleming FJ. Prediction of postdischarge venous thromboembolism using a risk assessment model. J Vasc Surg. 2013;58:1014-20. 33. Raich M, Bustos F, Castellet E, Castillo J, Docobo F, Domenech P, et al. Actualización de las recomendaciones de tromboprofilaxis en cirugía mayor ambulatoria. Cir May Amb. 2011;16:23-9. 34. Lozano FS, Sánchez-Fernández J, Santos JA, García-Alovio J, Mateos R, González-Porras JR, et al. Venous thromboembolism risk stratification and thromboprophylaxis with low molecular weight heparin in patients undergoing major ambulatory surgery. Amb Surg. 2010;16:5-12. 35. Arcelus JI, Espín E. Prevención de la ETV en cirugía general mayor no oncológica y ambulatoria. En: Prevención de la Enfermedad Tromboembólica Venosa en Cirugía General y del Aparato Digestivo. Recomendaciones del Grupo de Trombosis de la Asociación Española de Cirujanos. Madrid: Esmon Publicidad; 2013. 36. Pannucci CJ, Shanks A, Moote MJ, Bahl V, Cederna PS, Naughton NN, et al. Identifyng patients at high risk for venous 37. 38. 39. 40. 41. 42. I 21 I thromboembolism requiring treatment after outpatient surgery. Ann Surg. 2012;255:1093-99. Kucher N, Koo S, Quiroz R, Paterno MD, Soukonnikov B, et al. Electronic alerts to prevent venous thromboembolism among hospitalized patients. N Engl J Med. 2005;352:969-77. Lecumberri R, Marqués, M, Díaz-Navarlaz MT, Panizo E, Toledo J, García-Mouriz A, et al. Manitainded effectiveness of an electronic alert system to prevent venous thromboembolism among hospitalized patients. Thromb Haemost. 2008;100:699-704. Kumar HR, Vavra AK, Kibbe M. The utility of venous thromboembolism risk assessment models in general and vascular surgery. J Vasc Surg. 2014;2:355-61. Cassidy MR, Rosenkranz P, McAneny D. Reducing postoperative venous thromboembolism complications with a standardized riskstratified prophylaxis protocol and mobilization program. J Am Coll Surg. 2014;218:1095-104. Pannucci CJ, Obi A, Álvarez R, Abdullah N, Nackashi A, Hu HM, et al. J Am Coll Surg. 2014;218:898-904. Leonardi MJ, McGory ML, Ko CY. The rate of bleeding complications after pharmacologic deep venous thrombosis prophylaxis. A systematic review of 33 randomized controlled trials. Arch Surg. 2006;141:790-9. Cuándo empezar y cuánto tiempo mantener la profilaxis en pacientes quirúrgicos de alto riesgo Eloy Espín Basany Unidad de Colon y Recto. Servicio de Cirugía General. Hospital Universitario Valle de Hebrón. Barcelona INTRODUCCIÓN La enfermedad tromboembólica venosa (ETV) es una complicación postoperatoria frecuente. Tan solo en Estados Unidos, más de 4 millones de pacientes quirúrgicos desarrollan al año una ETV, ya sea en forma de trombosis venosa profunda como de embolia pulmonar (EP)1. En nuestro país la incidencia e impacto de dicha complicación también se ha estudiado y es similar a la de nuestro entorno2. La incidencia de la ETV postoperatoria está directamente relacionada con dos factores: el tipo de cirugía llevada a cabo y los factores de riesgo presentes en cada paciente. Es muy importante, por tanto, valorar adecuadamente el riesgo trombótico de cada paciente en función de la intervención que se va a practicar y sus características personales. En la actualidad se aceptan tres categorías de riesgo de ETV en cirugía, con una incidencia 10 veces mayor en los pacientes de alto riesgo al compararlos con los de riesgo bajo3. En relación con la cirugía general, hay diversos factores de riesgo de sufrir ETV claramente identificados (insuficiencia venosa periférica, cirugía mayor, obesidad, edad avanzada, historia de ETV, etc.) ya detallados en el primer capítulo de esta monografía. De la misma manera, también se conoce el riesgo asociado al tipo de intervención, siendo la cirugía mayor (incluyendo la cirugía bariátrica) clasificada como de alto riesgo. Esta estratificación del riesgo ha sido también desarrollada en el primer capítulo de esta monografía. A pesar de tener plenamente reconocidos los factores de riesgo y formas de su estratificación, y de contar también con diferentes métodos de profilaxis tanto farmacológicos como mecánicos, la incidencia de esta complicación sigue siendo alta. Las principales recomendaciones sobre la prevención de la ETV están recogidas en diferentes guías clínicas, tanto nacionales4,5 como internacionales6-8. Tan importante es la decisión del tipo de medidas de profilaxis de ETV como su correcta aplicación en cuanto a tipo, tiempo de inicio y tiempo de finalización. Sin embargo, a pesar de la supuesta implementación de las recomendaciones recogidas en dichas publicaciones, las cifras de complicaciones trombóticas siguen siendo altas. La causa más probable de este fenómeno es la infrautilización o mala utilización de las medidas de prevención en alguno de los aspectos mencionados. De hecho, esto se ha observado ya en algunos estudios publicados, como el ENDORSE (Epidemiological International Day for the Evaluation of Patients at Risk of venous thromboembolism in the Acute Hospital Care Setting)9. En dicho estudio internacional, que incluyó una revisión de las historias de más de 68.000 pacientes ingresados en 358 hospitales de 32 países diferentes, se observó que únicamente el 71 % de los pacientes quirúrgicos calificados como de alto riesgo recibieron la profilaxis de manera adecuada, acorde con las guías del American College of Chest Physicians (ACCP), que representan las guías más influyentes en la actualidad. Tanto la ausencia de medidas de profilaxis como una duración inadecuada son las principales causas de aparición de estas complicaciones10-12. La duración adecuada de la profilaxis es especialmente importante en los pacientes de alto riesgo, de los cuales hay dos grupos de pacientes quirúrgicos: los ortopédicos y los pacientes sometidos a cirugía oncológica. Ambos constituyen una parte importante del volumen de asistencia de nuestros hospitales en la actualidad. En muchos de estos pacientes la ETV aparece semanas después de su alta hospitalaria. En una serie de 1.897 pacientes, en el 74 % la ETV se detectó tras el alta hospitalaria. De estos pacientes, la ETV se presentó I 22 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico en el primer mes del alta hospitalaria en el 66 %, en el 18 % ocurrió 2 meses después y en el 15 % a los 3 meses13. Sin embargo, y a pesar de que conocemos el riesgo prolongado de los pacientes de alto riesgo, las cifras de un mantenimiento adecuado de las medidas de profilaxis se sitúan solamente entre un 12 %10 y un 31 %12. Este hecho es tan frecuentemente observado que se ha implementado la correcta práctica de la profilaxis de la ETV como una variable de control de calidad en diferentes programas, como el SCIP (Surgical Care Improvement Program), el NQF (National Quality Forum) y las guías NICE (National Institute for Health and Clinical Excellence), entre otros. Esta ausencia de adherencia a las recomendaciones actuales no solo tiene un impacto sanitario en el número de pacientes con ETV en todas sus formas y sus cifras de mortalidad, morbilidad y alteraciones funcionales, sino que también tiene un impacto económico muy importante. En un estudio recientemente publicado14 se utilizaron los datos de los pacientes del registro ENDORSE9, antes mencionado, para estudiar únicamente los pacientes de los hospitales de los Estados Unidos de América. Se observó que el 51,1 % de los pacientes eran calificados de alto riesgo y que el 47,5 % recibieron la profilaxis de forma adecuada. La adecuada implementación de la profilaxis en todos los pacientes que lo requerían hubiera reducido el número de muertes: en 15.875 si se hubiera utilizado heparina de bajo peso molecular (HBPM) y en 10.201 si se hubiera utilizado heparina no fraccionada (HNF). De la misma manera, se hubieran reducido costes de tratamiento de complicaciones por un valor de 803 millones de dólares (con HBPM) y de 262 millones en el caso de la HNF. En cuanto a las medidas profilácticas mecánicas, hay varios estudios publicados en la literatura que muestran que la tromboprofilaxis mecánica tampoco se utiliza de forma adecuada15 a pesar de que las guías internacionales recomiendan su uso (ACCP), especialmente en aquellos pacientes que presentan contraindicaciones para el uso de profilaxis farmacológica. De hecho, dicho estudio internacional demostró la poca aceptación de estas medidas en los centros participantes que no formaban parte de los Estados Unidos de América. Las posibles razones por las que todavía se observa una inadecuada implementación de las recomendaciones son varias: la ausencia de protocolos en algunos centros, el bajo conocimiento de la evidencia al respecto16, la baja aceptación por parte de algunos pacientes a la autoadministración de la medicación ambulatoria inyectada, el coste de la profilaxis o la preocupación por parte de los facultativos por complicaciones derivadas del uso de dicha medicación (hemorragias, trombopenia, etc.), particularmente en el uso de HNF17, a pesar de que hay varias publicaciones que demuestran la seguridad del uso de la HBPM18-20. Aunque se han publicado varias estrategias para mejorar la implementación del uso de la tromboprofilaxis como son las auditorias, ordenes preformadas, o alertas electrónicas en historias informatizadas21,22, probablemente el mayor esfuerzo debe ser la formación médica continuada23. Métodos de profilaxis en pacientes de alto riesgo Los métodos de profilaxis en pacientes de alto riesgo son básicamente los farmacológicos, los mecánicos y la combinación de ambos (Tabla 1). Los pacientes de alto riesgo deben tener algún tipo de profilaxis siempre, a menos que exista una contraindicación clara para el uso de todos ellos (altamente improbable). El uso de filtro de vena cava no se contempla en algunas guías (como las de la ACCP). Sin embargo, se utiliza (especialmente los temporales) en casos muy seleccionados de pacientes traumatológicos o de cirugía bariátrica en los que existe contraindicación del uso de los métodos anteriormente mencionados. La elección del método de profilaxis en los pacientes de alto riesgo se realiza en función del tipo de cirugía y la presencia de comorbilidades. No comentaremos la cirugía bariátrica ni la traumatológica por haber sido tratados en otro capítulo de esta monografía, pero es en estos pacientes en los que generalmente se recomienda la combinación de métodos farmacológicos y mecánicos (por lo general, la compresión mecánica intermitente) frente a la utilización de métodos mecánicos únicamente24. Por lo general, todos los pacientes de alto riesgo que se van a someter a cirugía mayor, sea abierta o mínimamente invasiva, son tratados de forma profiláctica con HBPM. Hay algunos países en los que en el contexto de neurocirugía (especialmente en la cirugía craneal) se prefiere la utilización de warfarina o de métodos mecánicos únicamente, o de HBPM de forma tardía (de inicio al 4 día postoperatorio), por el temor a que el uso de medicación de inicio preoperatoria o en el postoperatorio I 23 I Tabla 1. Métodos de profilaxis antitrombótica Métodos farmacológicos Heparinas de bajo peso molecular. Heparina no fraccionada. Fondaparinux. Otros (hirudina, antiagregantes, dextranos, anticoagulantes orales). Métodos mecánicos Medidas de compresión elástica. Compresión neumática intermitente. Bomba de compresión plantar. Combinación de métodos Método farmacológico y mecánico. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico inmediato (HBPM) pueda aumentar el número de eventos hemorrágicos. Esto ocurre a pesar de que existen revisiones sistemáticas y metaanálisis (con 6 estudios randomizados) que demuestran la seguridad en el uso de HBPM: su uso en 1.000 pacientes evita 91 episodios de ETV (18 de ellos serán TVP o EP sintomática). Por otro lado, se producirán 7 hemorragias postoperatorias y 28 sangrados menores25. La HNF se utiliza en aquellos pacientes que no pueden utilizar la HBPM (por ejemplo en algunos casos de insuficiencia renal crónica). Los métodos farmacológicos diferentes a HNF y HBPM, como fondaparinux, warfarina, los inhibidores de trombina o del factor Xa y la aspirina no son utilizados en los pacientes de alto riesgo en procedimientos quirúrgicos habituales, a excepción del contexto de la ortopedia o traumatología, por lo que no se comentarán en este capítulo. Heparina no fraccionada La HNF o convencional se une a la antitrombina e inactiva la trombina (factor IIa) y al factor Xa en la misma proporción. Se administra mediante inyecciones subcutáneas, iniciando su aplicación entre 2 y 4 horas antes de la intervención (5.000 unidades) y continuando con la misma dosis cada 8-12 horas. Puede ser necesario monitorizar su uso y puede revertirse con el uso de protamina. Su coste es inferior a la HBPM. Existen varios metaanálisis y revisiones que confirman su eficacia en la reducción de la ETV (por ejemplo, TVP: reducción del 22 % al 9 %; EP sintomática: del 2 % al 1,3 %; y EP mortal: del 0,8 % al 0,3 % en uno de estos estudios)26,27. Sin embargo, hay un aumento de complicaciones hemorrágicas de hasta el 60 % que, aunque por lo general no tienen impacto clínico importante (en menos del 3 % de las ocasiones requiere su descontinuación), se debe controlar el número de plaquetas porque pueden producir trombocitopenia con mayor frecuencia que las HBPM. Estas potenciales complicaciones asociadas a su uso han hecho que en nuestro medio sean utilizadas de forma casi anecdótica como método de profilaxis quirúrgica. ción anti-Xa en general está ligada al peso del paciente, pero solamente se requiere ajustar la dosis en casos de embarazo, insuficiencia renal, obesidad mórbida o desnutrición grave. En la Tabla 2 se pueden ver las principales características de las HBPM que se utilizan en nuestro medio, ordenadas por su efecto anti-Xa. En la Tabla 3 se detallan las dosis utilizadas en los pacientes de alto riesgo. La HBPM se ha comparado con HNF28,29, warfarina, dextrano y con anticoagulantes orales3, principalmente en el contexto de cirugía ortopédica. Las HBPM han demostrado su seguridad en la administración, eficacia en la prevención y escasos eventos hemorrágicos o complicaciones derivados de su utilización. Fondaparinux El fondaparinux ha sido evaluado extensivamente en el contexto de la cirugía ortopédica donde, en general, ha demostrado resultados similares a la HBPM cuando se ha iniciado su utilización 6 horas después de Tabla 2. Heparinas de bajo peso molecular4 Efecto anti-Xa/IIa Peso molecular Vida media Bemiparina 8:1 3.600 5,3 h Enoxaparina 3,3:1 4.500 4,5 h Nadroparina 3:1 4.300 2,5 h Dalteparina 2,3:1 6.000 2h Tinzaparina 1,9:1 6.500 2h Fármaco (nombre comercial) Tabla 3. Heparinas de bajo peso molecular44 Fármaco (nombre comercial) Dosis Comienzo Bemiparina 3.500 UI/día 2 horas antes o 6 horas después de cirugía Enoxaparina 40 mg/día 12 horas antes de cirugía Nadroparina ≥ 3.800 UI/día* 12 horas antes y 12 horas después de la cirugía Dalteparina 2.500 UI/día ** 2-4 horas antes y 12 horas después de la cirugía Heparina de bajo peso molecular Tinzaparina 50 UI/kg peso/día ó 4.500 UI/día *** 2 o 12 horas antes de cirugía Las HBPM, o heparinas fracionadas, se obtienen a partir de la HNF mediante procesos químicos. Actúan también inactivando la trombina y el factor Xa. Sin embargo, su ventaja es una mayor actuación sobre el factor Xa que sobre el factor lla (trombina), por lo que tienen menor efecto hemorrágico. La eficacia de la fun- *La dosis puede variar de acuerdo al peso del paciente (< 70 kg: 2.850 UI, ≥ 70 kg: 3.800 UI) y a partir del 4º día postoperatorio (< 70 kg: 3.800 UI, ≥ 70 kg: 5.700 UI). ** La primera dosis sería de 2.500 UI, 2 -4 horas antes, seguida de 2.500 UI 12 horas después de la cirugía. Los días siguientes 5.000 IU/día. *** La dosis variará dependiendo del peso y de la pauta de inicio de la administración (60-90 kg: 4.500 UI 12 horas antes, < 60 kg o > 90 kg: 50 UI/kg/día; también se seguirá esta pauta si la profilaxis comienza 2 horas antes de la intervención). I 24 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico la cirugía30. En cirugía abdominal se ha comparado con dalteparina y ha demostrado una eficacia similar, pero también un aumento de episodios de hemorragia, especialmente en el grupo de pacientes oncológicos31. Aparte de las medidas profilácticas comentadas, es muy importante que los pacientes quirúrgicos se movilicen precozmente tras la intervención y que deambulen con frecuencia. Es también conveniente evitar que los pacientes permanezcan sentados en un sillón durante periodos prolongados puesto que, desde un punto de vista hemodinámico, dicha posición empeora la estasis venosa en las extremidades inferiores. Así, los pacientes deberían alternar esta posición con la de decúbito supino en la cama, con las piernas ligeramente elevadas. También se debe insistir en que los pacientes realicen movimientos activos de flexoextensión de las articulaciones de los tobillos de forma periódica, con objeto de movilizar la sangre de las venas profundas de la pantorrilla. Las medias elásticas de compresión decreciente son preferibles a los vendajes elásticos, ya que no se deforman ni se descolocan. No se ha demostrado que el uso de medias hasta el muslo sea superior a las que llegan hasta la rodilla y, además de un mayor coste, por lo general son peor toleradas, por lo que acaban utilizándose de forma incorrecta. En los pacientes en los que se indiquen las medias elásticas de compresión graduada decreciente (18-23 mm Hg en tobillo y 8-10 mm Hg en rodilla o muslo) es necesario descartar que exista una arteriopatía periférica, ya que la compresión podría provocar una isquemia arterial. Cuándo iniciar la profilaxis en pacientes de alto riesgo En la gran mayoría de los ensayos clínicos llevados a cabo evaluando la eficacia y seguridad de la profilaxis farmacológica con heparina y HBPM se inicia la profilaxis antes de la intervención. En el metaanálisis de Mismetti, que incluye 51 ensayos clínicos en los que se compara la HNF con la HBPM, en 50 estudios se inicia la profilaxis con estos fármacos 2 o 12 horas antes de la cirugía28. En España, todas las HBPM aprobadas para la tromboprofilaxis en cirugía contemplan en su ficha técnica el inicio preoperatorio excepto bemiparina, que es la única excepción que también la contempla en el inicio postoperatorio. La bemiparina puede administrarse tanto antes como después de la cirugía sin aumentar las complicaciones hemorrágicas32,33. En pacientes de alto riesgo las HBPM se inician 12 horas antes de la intervención, a dosis de más de 3.400 U, por vía subcutánea, siguiendo con la misma dosis cada 24 horas (Tabla 3). A este respecto, un estudio escandinavo demostró que el inicio de la profilaxis con 5.000 U de dalteparina 12 horas antes de la intervención resultó más eficaz y tan seguro como el inicio 2 horas antes con dosis de 2.500 U del mismo fármaco, en una población de pacientes sometidos a cirugía abdominal en la que dos terceras partes fueron operados por cáncer. Fue precisamente este grupo de cirugía oncológica en el que la dosis elevada resultó más eficaz y segura34. Sin embargo, en el caso de bemiparina, ya mencionada anteriormente, por su estructura y farmacocinética se recomienda su empleo 2 horas antes de la intervención o 6 horas después.. Un aspecto que no está suficientemente estudiado y que no se suele contemplar en las guías de práctica clínica es el referido a cuándo administrar la segunda dosis después de la intervención. En este sentido, parece razonable, en función de la farmacocinética de los fármacos, hacerlo pasadas unas 10-24 horas de finalizar la intervención en los pacientes de alto riesgo. Las pautas de utilización de profilaxis farmacológica (en concreto con HBPM) en pacientes en los que se utiliza anestesia o analgesia neuroaxial (subaracnoidea o epidural) han sido motivo de especial atención en los últimos años, dado el riesgo potencial de aparición de complicaciones hemorrágicas en el canal medular, con graves secuelas neurológicas. Deben transcurrir al menos 12 horas entre la administración preoperatoria de la HBPM y el momento de la punción raquídea y esperar al menos 6 horas tras esta última para administrar la primera inyección de HBPM postoperatoria35. La vía de abordaje (laparoscópica o abierta) no modifica las recomendaciones en cuanto a dosis, inicio o pauta en los pacientes de alto riesgo. La posición de las diferentes guías clínicas o recomendaciones publicadas son muy similares, aceptando que se sigan las pautas recomendadas en las respectivas fichas técnicas de cada HBPM. La diferencia principal entre unas guías y otras reside fundamentalmente en que las pautas postoperatorias aprobadas y utilizadas en Norteamérica son de inicio de la profilaxis pasadas 12-24 horas tras la cirugía, por lo que están muy alejadas del momento de la intervención y podrían tener una menor eficacia, lo que influye en que algunas guías Americanas se inclinen a favor de la pauta preoperatoria. Sin embargo, en Europa no se utilizan estas pautas postoperatorias tardías de 12-24 horas, ya que la única pauta postoperatoria aprobada es la de 6 horas tras la cirugía, y es con bemiparina. Es por esta razón que algunas guías europeas no se inclinan solo a favor de la pauta preoperatoria y también dejan abierta la posibilidad de iniciar la profilaxis en el postoperatorio inmediato4,5. El estudio CANBESURE ha demostrado que con bemiparina la pauta postoperatoria de 6 horas es eficaz y se- I 25 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico gura en cirugía oncológica36. También en la guía actual de la Sociedad Española de Oncología Médica (SEOM), publicada recientemente, se mencionan ambas pautas de inicio, recomendándose el inicio de la profilaxis en el preoperatorio o tan pronto como sea posible en el postoperatorio: esto incluiría la pauta postoperatoria de 6 horas frente a pautas más tardías como 12 y 24 horas después del procedimiento quirúrgico5. En el caso de que hubiera que asociar métodos mecánicos, o bien emplearlos como único método de profilaxis antitrombótica por existir contraindicación para la anticoagulación, debemos iniciar su aplicación en el mismo momento antes de iniciar la cirugía. ¿Cuánto tiempo se debe mantener la profilaxis en pacientes de alto riesgo? Tal y como se ha comentado, un alto porcentaje (más del 70 %) de complicaciones trombóticas se presentan semanas después de la cirugía. En nuestro medio se demostró que más del 50 % de los casos de ETV sintomática postoperatoria aparecieron después de interrumpir la profilaxis, cuya duración media fue de 12 (operados por patología benigna) a 13 días (cirugía oncológica)2. Esto ocurre, como es obvio, más frecuentemente en pacientes y cirugías de alto riesgo. La evidencia actual, sobre todo en el contexto de cirugía traumatológica, oncológica y mayor abdominal, apoya el uso prolongado de profilaxis para disminuir las posibilidades de ETV tanto a corto como medio plazo. El mencionado estudio CANBESURE es el ensayo clínico más extenso realizado hasta el momento en cirugía oncológica abdominal o pélvica con una HBPM (bemiparina) para valorar la extensión de la profilaxis en este tipo de pacientes36. En este estudio se consideró que la dosis más adecuada de bemiparina para este tipo de pacientes era la de alto riesgo de ETV y la pauta de inicio la postoperatoria, por lo que todos los pacientes recibieron 3,500 UI/día de bemiparina iniciada 6 horas tras la cirugía y durante 8 días para después ser aleatorizados a recibir placebo o bemiparina durante 20 días más hasta completar las 4 semanas. En los resultados se observó una reducción del riesgo relativo de la variable combinada de TVP, EP no fatal y muerte por todas las causas del 24,4% favorable a la extensión de la profilaxis sin llegar a alcanzarse diferencias significativas. En el tromboembolismo venoso (TEV) mayor si que hubo una reducción del riesgo relativo significativa del 82,4 % (p = 0,010). El TEV mayor incluía la TVP proximal a la rodilla, la EP y las muertes relacionadas con la ETV. No se encontraron diferencias significativas en los sangrados mayores y, en general, la incidencia de hemorragias fue bastante baja en ambos grupos y menor que la observada en otros estudios similares con otras HBPM. Más evidencias a favor de la prolongación de la profilaxis son otros estudios anteriores al CANBESURE, como ENOXACAN II37 con enoxaparina y el ensayo clínico de Rasmussen et al.38 con dalteparina. Ambos demuestran que en la cirugía oncológica abdominal la prolongación de la profilaxis con HBPM durante 4 semanas frente 8-10 días reduce significativamente la incidencia de ETV, sin aumentar las complicaciones hemorrágicas. Sin embargo, en aquellos pacientes oncológicos sometidos a cirugía fuera de la cavidad abdominopélvica, y que pueden ser movilizados precozmente, las guías de práctica clínica y las diferentes sociedades científicas recomiendan un mínimo de prolongación de la profilaxis de 7-10 días4,8,39 o hasta el alta hospitalaria. Esto se basa en que el riesgo de aparición de ETV suele ser más elevado durante la primera semana del postoperatorio. En los pacientes en los que se hubieran indicado medias elásticas durante el ingreso conviene que sigan utilizándolas tras el alta para completar al menos un periodo de 4 semanas, especialmente si la movilización va a estar limitada. En resumen, en la actualidad, la mayoría de las guías de práctica clínica recomiendan mantener la profilaxis hasta el alta hospitalaria en todos los pacientes quirúrgicos sometidos a cirugía mayor y prolongar la profilaxis con HBPM durante 4 semanas tras la cirugía en aquellos I 26 I Tabla 4. Recomendaciones actuales de la extensión de la profilaxis Guía Recomendación en pacientes de alto riesgo ASCO (2013)8 Al menos 7-10 días. Extender hasta 4 semanas en pacientes sometidos a cirugía mayor oncológica abdominal o pélvica. ISTH (2013)43 Al menos 7-10 días. La extensión hasta 4 semanas en pacientes después de una laparotomía y bajo riesgo hemorrágico. NCNN (2013)39 Extender hasta 4 semanas en pacientes sometidos a cirugía mayor oncológica abdominal o pélvica. ACCP (2012)6 Al menos 7 días y extender hasta 4 semanas en pacientes sometidos a cirugía mayor oncológica abdominal o pélvica. SEOM (2013)5 Al menos 7-10 días. Considerar extender hasta 4 semanas en pacientes sometidos a cirugía mayor oncológica abdominal o pélvica. Las mismas recomendaciones para cirugía laparoscópica. AEC (2013)4 Al menos 7-10 días. Considerar extender hasta 4 semanas en pacientes sometidos a cirugía mayor oncológica abdominal o pélvica. Las mismas recomendaciones para cirugía laparoscópica. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico casos de especial alto riesgo, como los operados por cáncer o con historia de ETV previa (Tabla 4). En referencia a la cirugía laparoscópica, debemos decir que si se trata de cirugía oncológica se aplica el mismo criterio que en cirugía convencional: prolongar la profilaxis durante 4 semanas. De hecho, ya existe evidencia que confirma este hecho, como en cirugía laparoscópica por cáncer colorrectal, en la que extender la profilaxis a 4 semanas comparada con 1 semana redujo significativamente la incidencia de TVP detectada por ecodoppler. Los episodios de ETV contabilizados hasta los 3 meses después de la cirugía fueron significativamente inferiores en el grupo de profilaxis extendida (0,9 %) al compararlos con el de profilaxis reducida (9,7 %)40. Hay que destacar que la incidencia de TVP detectada antes del alta con dicha técnica diagnóstica, realizada para asegurarse de que se analizaban pacientes sin ETV, al aleatorizarlos ascendió al 17 %, cifra inesperadamente elevada en pacientes que recibían HBPM, si bien la práctica totalidad de las trombosis eran asintomáticas. En el caso de cirugía laparoscópica no oncológica la escasa evidencia actual41 no apoya el uso prolongado de la profilaxis en todos los pacientes, y ésta deberá evaluarse de forma individual en función del riesgo del paciente. Sí hay evidencia en un grupo especial de riesgo, como es la obesidad. Si la tromboprofilaxis reduce de forma significativa (0 episodios de ETV a los 90 días de seguimiento) los episodios de ETV en pacientes de riesgo en cirugía laparoscópica bariátrica42, podemos extrapolar estos resultados y aconsejar, fuera de las guías actuales, que los pacientes con riesgo alto mantengan la tromboprofilaxis por un espacio de 4 semanas en cualquier cirugía mayor, sea laparoscópica o abierta, sea patología benigna o maligna. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. BIBLIOGRAFÍA 1. Anderson FA Jr, Zayaruzny M, Heit JA, et al. Estimated annual numbers of US acute-care hospital patients at risk for venous thromboembolism. Am J Hematol. 2007;82:777-82. 2. Arcelus JI, Monreal M, Caprini JA, et al. Clinical presentation and time-course of postoperative venous thromboembolism: results from the RIETE registry. Thromb Haemost. 2008;99:546-51. 3. Geerts WH, Bergqvist D, Pineo GF, et al. Prevention of venous thromboembolism. American College of Chest Physicians. Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008;133(Suppl6): 381S-453S. 4. Prevención de la enfermedad tromboembólica venosa en cirugía general y del aparato digestivo. Recomendaciones del Grupo de Trombosis de la Asociación Española de Cirujanos (AEC). Barcelona: Ed. Esmon; 2013. 5. Muñoz Martín AJ, Font Puig C, Navarro Martín LM, Borrega García P, Martín Jiménez M. Clinical guide SEOM on venous thromboembolism in cancer patients. Clin Transl Oncol. 2014;16:1079-90. 6. Gould MK, García DA, Wren SM, Arcelus JI, et al. Prevention 20. 21. 22. 23. 24. I 27 I of VTE in nonortophedic surgical patients. Antithrombotic therapy and prevention of thrombosis: American College of Chest Physicians evidence-based clinical practice guidelines (9th Edition). Chest. 2012;141:227S-74S. Prevention and treatment of venous thromboembolism. International consensus treatment. International Angiology. 2013;32:111-252. Lyman G, Bohlke K, Khorana A, Arcelus JL, et al. Venous thromboembolismprophylaxis and treatment in patients with cancer: American Society of Clinical Oncology clinical practice guideline update 2014. J Clin Oncol. 2015;33:1-5. Cohen AT, Tapson VF, Bergmann JF, et al. Venous thromboembolism risk and prophylaxis in the acute setting (ENDORSE study): a multinational cross-sectional study. Lancet. 2008;371:387-94. Yu HT, Dylan MI, Lin J, et al. Hospital’s compliance with prophylaxis guidelines for venous thromboembolism. Am J Health Syst Pharm. 2007;64:69-76. Rahne E, Dasgupta K, Burman M, et al. Postdischarge thromboprpphylaxis and mortality after hip or knee-replacement surgery. CMAJ. 2008;178:1545-54. Amin AN, Stemkowski S, Lin J, et al. Preventing venous thromboembolism in US hospitals: are surgical patients receiving appropriate prophylaxis? Throb Haemost. 2008;99:796-7. Spencer FA, Lessard D, Emery C, et al. Venous thromboembolism in the outpatient setting. Arch Intern Med. 2007;167:1471-5. Huang W, Anderson FA, Rushton-Smith SK, Cohen AT. Impact of thromboprophylaxis across the US acute care setting. PLoS One. 2015;10 (3):e0121429. DOI 10.1371/journal.pone.0121429 Tapson VF, Decousus H, Pini M, et al. Venous thromboembolism prophylaxis in acutelly ill hospitalized medical patients: findings from the International Medical Prevention Registry on Venous Thromboembolism. Chest. 2007;132:936-45. Bikdeli B, Sharif-Kashani B, Raeissi S, et al. Chest physicians’ knowledge of appropriate thromboprophylaxis insights form the PROMOTE study. Blood Coagul Fibrinolysis. 2011;22(8):667-72. Bradley CT, Brasel KJ, Miller JJ, Pappas SG. Cost-ffectivemess of prolonged thromboprophylaxis after cancer surgery. Ann Surg Oncol. 2010;17:31-9. Agnelli G. Prevention of venous thromboembolism in surgical patients. Circulation. 2004;110(SupplIV):4-12. Rasmussen MS, Jørgensen LN, Wille-Jørgensen P. Prolonged thromboprophylaxis with low molecular weight heparin for abdominal or pelvic surgery. Cochrane Database Syst Rev. 2009;(1)CD004318. Arcelus JI, Villar JM, Muñoz N. Should we follow the 9th ACCP guidelines for VTE prevention in surgical patients? Thromb Res. 2012;130(Suppl1):S4-6. Tooher R, Middleton P, Pham C, et al. A systematic review of strategies to improve prophylaxis for venous thromboembolism in hospitals. Ann Surg. 2005;241:397- 415. Baglin T. Defining the population in need for thromboprophylaxis - making hospitals safer. Br J Haematol. 2010;149:805-12. Al.Hameed F, Al-Dorzi HM, Aboelnazer E. The effect of a continuing medical education program on venous thromboembolism prophylaxis utilization and mortality in a tertiary-care hospital. Thromb J. 2014;Apr28:do:10.1186/1477-9569-12-9. Kakkos SK, Caprini JA, Gerolaukos G, Nicolaides AN, Standsby GP, Reddy DJ. Combined intermittent pneumatic leg compression and pharmacological prophylaxis for prevention of venous thromboembolism in hih-risk patients. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico 25. 26. 27. 28. 29. 30. 31. 32. 33. Cochrane Database Syst Rev. 2008;(4):CD005258. doi: 10.1002/14651858. Hamilton MG, Yee WH, Hull RD, Ghali WA. Venous thromboembolism prophylaxis in patients undergoing cranial neurosurgery: a systematic review and meta-analysis. Neurosurgery. 2011;68:571- 81. Koch A, Bouges S, Ziegler S, Dinkel H, Daures JP, Victor N. Low molecular weight heparin and unfractioned heparin in thrombosis prophylaxis after major surgical intervention:update of previous meta-analyses. Br J Surg. 1997;84:750-9. Leonardi MJ, McGory ML, Ko CY. The rate of bleeding complications after pharmacologic deep venous thrombosis prophylaxis: a systematic review of 3 randomized controlled trials. Arch Surg. 2006;141:790-9. Mismetti P, Laporte S, Darmon JY, et al. Meta-analysis of low molecular weight heparin in the prevention of venous thromboembolism in general surgery. Br J Surg. 2001;88:13-30. Haas S, Wolf H, Kakkar A, et al. Prevention of fatal pulmonary embolism and surgical mortality in surgical patients. A randomized double-blind comparison of LMWH with unfractioned heparin. Thromb Haemost. 2005;94:814-9. Turpie AG, Bauer KA, Eriksson BI, Lassen MR. Fondaparinux vs enoxaparin for the prevention of venous thromboembolism in major orthopedic surgery: a meta-analysis of 4 randomized double-blind studies. Arch Intern Med. 2002;162:1833-40. Agnelli G, Bergqvist D, Cohen AT, Gallus AS, Gent M, PEGASUS investigators. Randomized clinical trial of postoperative fondaparinux versus perioperative dalteparin for prevention of venous thromboembolism in high-risk abdominal surgery. Br J Surg. 2005;92:1212-20. Balibrea JL, Altimiras J, Larruzea I et al. Optimal dosing of bemiparin as prophylaxis against venous thromboembolism in surgery for cancer: an audit of practice. Int J Surg. 2007;5:114-9. Andreas L, Patrick V, Grohs JG. A prospective, active-control, non-inferiority study of the effectiveness of low molecular weight heparin in the prophylaxis of postoperative thrombotic events in patients undergoing spinal surgery. Orthop Muscul Syst. 2015;4:185. 34. Bergqvist D, Burmark US, Flordal PA et al. Low molecular weight heparin started before surgery as prophylaxis against deep vein thrombosis: 2500 versus 5000 WaI units in 2070 patients. Br J Surg. 1995;82:496-501. 35. Llau JV, DeAndrés J, Gomar C, Gómez-Luque A, Hidalgo F, Torres LM. Anticlotting drugs and regional anaesthetic and analgesic techniques comparative update of the safety recommendations. European J Anesthesiol. 2007;24:387-98. 36. Kakkar VV, Balibrea JL, Martínez-González J, et al. Extended prophylaxis with bemiparin for the prvention of venous thromboembolism after abdominal or pelvic surgery for cancer: the CANBESURE randomized study. J Thromb Haemost. 2010;8:1223-9. 37. Bergqvist D, Agnelli G, Cohen AT, Eldor A, Nilsson PE, Le Moigne-Amrani A, et al. Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N Engl J Med. 2002;346:975-80. 38. Rasmussen MS, Jorgensen LN, Wille-Jørgensen P, et al. FAME Investigators. Prolonged prophylaxis with dalteparin to prevent late thromboembolic complications in patients undergoing major abdominal surgery: a multicenter randomized open-label study. J Thromb Haemost. 2006;4:2384-90. 39. NCCN. Practice guidelines in Oncology. Venous Thromboembolic Disease. V.2.2008. http://www.nccn.org 40. Vedovati MC, Becattini C, Rondelli F et al. A randomized study on 1-week versus 4-week prophylaxis for venous thromboembolism after laparoscopic surgery for colorectal cancer. Ann Surg. 2014;259:665-9. 41. Tincani E, Piccolo M, Turini F, et al. Video laparoscopic surgery. Is out-of-hospital tromboprophylaxis necessary? J Thromb Haemost. 2005;3:216-20. 42. Magee CJ, Barry J, Javed S, Macadam R, Kerrigan D. Extended thromboprophylaxis reduces incidence of postoperative venous thromboembolism in laparoscopic baratric surgery. Surg Obes Relat Dis. 2010;6:322-5. 43. Farge D, Debordeau P, Beckers M, et al. International clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. J Thromb Haemost. 2013;11:56-70. 44. http://www.aemps.gob.es/cima (fecha de acceso 1 de septiembre de 2015) I 28 I Controversias en la prevención de la enfermedad tromboembólica venosa en grupos especiales: cirugía bariátrica, cirugía mayor ambulatoria y politrauma Francisco S. Lozano Sánchez Hospital Universitario. Instituto de Investigaciones Biosanitarias. Universidad de Salamanca. INTRODUCCIÓN Incidencia y factores de riesgo La enfermedad tromboembólica venosa (ETV) es una entidad frecuente que ocasiona importante morbilidad y mortalidad. Entre sus factores desencadenantes, la cirugía y los traumatismos son situaciones preferentes de riesgo. También es conocido, que una vez identificado el riesgo de ETV, es obligado indicar una eficaz medida profiláctica. Cirugía bariátrica (CB), cirugía mayor ambulatoria (CMA) y politrauma (PT) son entidades de gran impacto clínico y socioeconómico. En lo que respecta a la ETV, y a diferencia de otros tipos de cirugía en los existe consenso sobre su riesgo y profilaxis, en CB, CMA y PT persisten numerosas controversias relacionadas con la heterogeneidad de pacientes y técnicas empleadas. Por ello, la incidencia (y grado de riesgo) de ETV varía notablemente según las circunstancias; conjuntamente, cuando está indicada la profilaxis, las peculiaridades de CB, CMA y PT dificultan la elección del método óptimo y su metodología (inicio, dosis y duración). El presente trabajo revisa la literatura y resalta las evidencias disponibles para el correcto manejo de estos pacientes. La incidencia de TVP (1,2-1,6 %), EP (0,8-3,2 %), EP fatal (0,03-0,3 %) y mortalidad global (0,1-2 %) oscila en esos intervalos después de CB4. Dichos porcentajes varían en las distintas series y según si la cirugía es abierta o laparoscópica. La revisión sistemática de Rocha y cols.5 afirma que existe evidencia de que la CB por sí misma, sin otros factores asociados, debe ser considerada de alto riesgo de ETV. Pero en la CB pueden concurrir un buen número de factores que incrementan el riesgo de ETV. Según Hamad y Bergqvits6, se resumen en: a) la propia agresión anestésico-quirúrgica abierta o laparoscópica; b) la patología que motiva la intervención; c) la edad generalmente avanzada de estos pacientes; y d) la presencia de factores de riesgo adicionales, algunos más frecuentes en los pacientes obesos (apnea obstructiva del sueño, varices, infección, etc.) y otros generales (historia previa de ETV, inmovilización, etc.). Se han identificado factores de riesgo independientes de ETV tras CB: insuficiencia venosa crónica, IMC > 60 kg/m2, obesidad abdominal, síndrome de apnea del sueño, historia previa de TVP, tabaquismo, fuga anastomótica, edad > 50 años y varones7,8. El valor de la trombofilia en la CB ha sido recientemente investigado, llegando a la conclusión de que su presencia, máxime la deficiencia de proteína S, es más frecuente en obesos9. La presencia de factores de riesgo hace que la CB pase de alto a muy alto riesgo de ETV. Riesgos de la laparoscopia: persiste la controversia acerca del impacto de la laparoscopia en la ETV postcirugía laparoscópica (CL). La CL, respecto de la abierta, comporta menor agresión y más rápida movilización y recuperación de los pacientes, por ello podría ser con- CIRUGÍA BARIÁTRICA Un grupo de pacientes con problemas respecto a la ETV son los obesos mórbidos sometidos a CB. Por un lado, la obesidad es un factor de riesgo de ETV; así, la incidencia de trombosis venosa profunda (TVP) y embolia pulmonar (EP) sintomática se duplica en la población obesa1. Por otro lado, existe un incremento de cirugía por obesidad. Por ambos motivos, es sencillo comprender la asociación CB-ETV y sus consecuencias2; según el registro internacional, la EP es la principal causa de mortalidad en CB3. I 29 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico siderada menos trombogénica. Por el contrario, la CL suele requerir tiempos quirúrgicos más prolongados que la cirugía abierta, lo cual es un factor predictivo independiente de EP10. Con respecto a la propia técnica de CL, tanto el neumoperitoneo (y grado de presión intraabdominal) como la posición anti-Trendelenburg disminuyen el retorno venoso de las extremidades inferiores, creando una estasis venosa que es directamente proporcional a la edad del paciente y la duración de la cirugía11. Aunque la CL requiere una estancia hospitalaria más breve, puede que estos pacientes no se movilicen en su domicilio. Finalmente, la CL, aunque menos traumática que la cirugía abierta, también se asocia a hipercoagulabilidad postoperatoria12. Una revisión de la literatura revela que la incidencia de EP sintomática fue más elevada tras cirugía abierta (0,8 %) que mediante CL (0,4 %)13. Por el contrario, en más de 3.800 pacientes sometidos a CB, durante 24 años, la incidencia de EP sintomática fue similar en los operados por vía abierta (0,84 %) y laparoscópica (0,88 %)14. Profilaxis Tanto la American Society for Metabolic and Bariatric Surgery15 como el American College of Chest Physicians (ACCP)16 consideran la CB de alto riesgo de ETV y recomiendan profilaxis de forma rutinaria a todos los pacientes operados. No obstante, las cosas no son tan sencillas, al no existir total consenso sobre cuál es la profilaxis más efectiva y segura. • Los métodos farmacológicos son superiores, en eficacia, a los métodos mecánicos (compresión neumática intermitente, CNI, y medias de compresión elástica, MCE). • Los métodos mecánicos no se recomiendan como método profiláctico aislado. • La profilaxis farmacológica (heparina de bajo peso molecular o HBPM y heparina no fraccionada, HNF, o fondaparinux), en caso de no existir contraindicaciones para su uso, es considerada de elección. Las HBPM y HNF tienen igual eficacia, si bien las HBPM presentan numerosas ventajas. El fondaparinux tiene muy pocos estudios en CB. • La asociación HBPM y un método físico es una excelente combinación en pacientes de muy alto riesgo (CB + factores de riesgo adicionales). • Existen situaciones, en pacientes sometidos a CB, que desaconsejan el empleo de anticoagulantes. En dichos pacientes la alternativa son los métodos mecánicos o, en situaciones de muy alto riesgo, la colocación de un filtro en la vena cava inferior (VCI). La inserción profiláctica de un filtro de VCI en pacientes de muy alto riesgo, sobre todo en aquellos con contraindicación formal a los anticoagulantes, es una opción que valorar. La existencia de filtros extraíbles hace que esta opción sea teóricamente más atractiva. Pero los filtros no previenen totalmente la posibilidad de EP, incluso mortal14. Además, el filtro puede aumentar el riesgo de trombosis17. Una revisión sistemática y un metaanálisis18 evaluando la efectividad y seguridad de los filtros para prevenir el ETV en pacientes sometidos a CB identificaron 5 estudios (ninguno aleatorizado). No encontraron pruebas suficientes que apoyaran la hipótesis de que los filtros reducen el riesgo de EP y hubo pruebas, de baja calidad, de que los filtros se asocian a mayor mortalidad y mayor TVP. Una posterior revisión sistemática19 que incluyó 18 estudios (sin detectar ensayos controlados aleatorios) informó de que la eficacia y seguridad del uso preoperatorio del filtro de VCI, en pacientes sometidos a CB, son muy heterogéneas y que no hay evidencia que sugiera que los beneficios potenciales superen los riesgos significativos de esta terapia. Por todo ello, el empleo de filtros sigue siendo un tema controvertido y la mayoría de sociedades, que han emitido informes al respecto, concluyen que la evidencia es insuficiente para recomendar los filtros de VCI para la prevención primaria de ETV en CB. Se pueden consultar las posibles indicaciones en la Tabla 1. Aspectos prácticos de la profilaxis con HBPM: inicio, dosis y duración La gran mayoría de los estudios clínicos realizados con HBPM en CB son no aleatorizados y de pobre calidad, I 30 I Tabla 1. Indicaciones del filtro de VCI (Tomado de las recomendaciones del Grupo de Trombosis de la AEC)4 CIRUGÍA BARIÁTRICA Posibles indicaciones: • Historia previa de ETV. • Insuficiencia venosa crónica grave. • IMC > 50 kg/m2. • Trombofilia. • Síndrome de hipoventilación. • Pacientes que sufren complicaciones postoperatorias. • Contraindicación para la anticoagulación. • Pacientes con movilidad muy reducida. POLITRAUMA Indicaciones absolutas: • ETV diagnosticada y contraindicada la anticoagulación. • Complicación hemorrágica durante el tratamiento de una ETV. • EP en un paciente correctamente anticoagulado. Indicación relativa a casos seleccionados: • Muy alto riesgo de ETV y sin posibilidad de profilaxis adecuada. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico por lo que el nivel de evidencia es bajo16. Una encuesta de la Society of American Gastrointestinal and Endoscopic Surgeons reveló que el 92,4 % utilizan profilaxis farmacológica en CB. La mayoría que emplea HNF la inician preoperatoriamente y el 49 % que utiliza HBMP la inician postoperatoriamente. El 43 % mantienen la profilaxis con HNF/HBPM tras el alta y el 28 % utiliza filtros20. Un metaanálisis18 también evaluó la efectividad y seguridad de diferentes estrategias farmacológicas para prevenir la ETV en pacientes CB, identificando 8 estudios. Uno mostró que la HBPM es significativamente más eficaz que la HNF en la prevención de ETV, sin diferencias en el sangrado. Otro sugiere que la terapia prolongada con HBPM (después del alta) previene mejor la trombosis respecto al tratamiento únicamente intrahospitalario. No hubo pruebas suficientes para apoyar que mayores dosis de HBPM sean más eficaces que las dosis estándar para profilaxis de alto riesgo, con una tendencia al aumento de hemorragia. El reciente estudio EFFORT 21, aleatorizado y doble ciego, evaluó enoxaparina preoperatoria (40 mg/12 horas) frente a fondaparinux iniciado en el postoperatorio (5 mg/24 horas) en pacientes sometidos a CB. Aunque fondaparinux alcanzó niveles profilácticos anti-Xa superiores a enoxaparina, ambos regímenes fueron igualmente similares en cuanto a la incidencia de eventos trombóticos y hemorrágicos. A pesar de que disponemos de numerosa bibliografía sobre tromboprofilaxis farmacológica con HBPM en CB, persisten controversias sobre el método óptimo que es preciso señalar: • Inicio. En CB no existen estudios prospectivos. Siguiendo las fichas técnicas, para las dosis de HBPM de alto riesgo (> 3.400 UI) se recomienda la administración preoperatoria 12 horas antes de la cirugía para la mayoría de las HBPM o la pauta postoperatoria, dependiendo de la HBPM. En este sentido, la bemiparina tiene autorización en España para el inicio postoperatorio en cirugía ortopédica y general. • Dosis. Tema particularmente controvertido en obesos sometidos a CB, pues no existe un acuerdo sobre la dosis óptima. En principio parece lógico elevar la dosis en los obesos. ¿Con dosis fijas o ajustadas al peso del paciente? La 8ª edición de la guía ACCP consideraba dosis tromboprofilácticas mayores (en torno al 25% de aumento) en pacientes con cirugía bariátrica, pero la 9ª edición ha eliminado esta recomendación y no se realizan otras recomendaciones específicas en cuanto a la dosificación y la duración de la profilaxis en I 31 I cirugía bariátrica, y esta se equipara a los pacientes con riesgo quirúrgico alto16. En este sentido, es preciso recordar que no existe una respuesta lineal del efecto anti-Xa con la dosis de HBPM administrada; así, dosis elevadas (ajustadas al peso) podrían provocar hemorragias, especialmente en pacientes con pesos muy elevados. Por el contrario, las dosis fijas, independientes del peso, pueden resultar insuficientes en muchos casos con elevado peso corporal22. El tema ha sido motivo de varios estudios. Kalfarentzos y cols.23 compararon dos dosis fijas de nadroparina; las más elevadas (9.500 UI/24 horas) fueron tan eficaces como las más reducidas (5.700 UI/24 horas), pero ocasionaron más hemorragias. Un estudio posterior mostró que la dosis de 40 mg/12 horas de enoxaparina fue superior en eficacia a la de 30 mg/12 horas (0,6 % vs. 5,4 % de ETV), sin aumentar el riesgo de hemorragia24. Cuando las dosis de 30 mg/12 horas de enoxaparina se cambiaron a 40 mg/12 horas, los niveles anti-Xa aumentaron significativamente y el porcentaje de niveles adecuados también. Sin embargo, más de la mitad de pacientes que recibieron 40 mg/12 horas no alcanzaron niveles terapéuticos, aunque tampoco supraterapéuticos. Por ello, la dosis de 40 mg/12 horas podría no ser suficiente para todos los pacientes sometidos a CB25. Intentando contrarrestar lo dicho, Borkgren-Okonek y cols.26 compararon 40 mg/12 horas de enoxaparina en pacientes sometidos a CB con IMC ≤ 50 kg/m2 con otra pauta de 60 mg/12 horas si tenían un IMC > 50 kg/m2. Al alta recibieron 40 y 60 mg c/24 horas respectivamente. El 74 % de los pacientes en ambos grupos alcanzó niveles anti-Xa plasmáticos adecuados, con un 1,7 % de hemorragias, sin que estas se correlacionaran con niveles anti-Xa supraterapéuticos, presentes en el 8 % de los que recibieron 60 mg. Solo hubo 1 ETV (0,45 %) en el grupo que recibió 40 mg. Recientemente se ha observado que 40 mg/12 h para IMC ≤ 50 kg/m2 y 60 mg/12 h para IMC ≥ 50 kg/m2 inducen una actividad anti-Xa suficiente para logar una profilaxis adecuada en adolescentes sometidos a CB27. En el caso de bemiparina, en un estudio observacional en el que se pretendía evaluar la mejoría en la función respiratoria en 209 pacientes sometidos a CB, se utilizaron dosis de alto riesgo de 3.500 UI/día, sin que se observaran complicaciones tromboembólicas durante el mismo28. En otro estudio posterior, realizado en pacientes obesos aunque en cirugía ortopédica, se compararon 2 dosis de bemiparina (3.500 UI/ Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico día y 5.000 UI/día), siendo la incidencia de ETV sintomática muy baja con ambos regímenes de dosificación, y no se detectaron diferencias significativas entre ambos (0, 392 por persona-año, 95% IC: 0,055-2,780 en el grupo de 3.500 UI y 0,099 por persona-año, 95% IC: 0,025-0,397 en el de 5.000 UI) y tampoco en cuanto a la incidencia de hemorragias (no hubo ninguna hemorragia mayor). Sin embargo, se observó una asociación entre la incidencia de ETV y el peso corporal, habiendo una leve evidencia de que la dosis más alta podría proporcionar un mayor beneficio a medida que aumenta el peso de la población29. Insistimos en que se trataba de pacientes sometidos a cirugía ortopédica y no a CB, por lo que hay que tener cuidado en la extrapolación de los resultados, al tratarse de poblaciones de pacientes diferentes. Becattini y cols.30, revisando la literatura sobre CB por CL, concluyen que la utilización de dosis fijas de HBPM es preferible a dosis ajustadas al peso del paciente, en las que el riesgo de hemorragia se elevaría en caso de IMC muy elevados. Por el contrario, una posterior revisión sistemática y metaanálisis31, que también se ocupa del tema de las dosis de HBPM ajustadas al peso del paciente, concluyen que en CB el ajuste de la dosis parece estar asociado con una menor tasa de ETV en el hospital en comparación con una estrategia de no ajustar la dosis, aunque ello no alcanzó significación estadística; esta práctica, sin embargo, aumenta los eventos hemorrágicos importantes. Finalmente, otra revisión crítica, más reciente, concluye que la determinación rutinaria de anti-Xa en pacientes obesos para monitorizar la efectividad de la HBPM no se justifica actualmente. Las concentraciones anti-Xa no están fuertemente asociadas con la trombosis o la hemorragia, aunque pueden existir circunstancias especiales, ya sea en pacientes obesos o no obesos, en casos donde se altera la eliminación de HBPM o hay una respuesta clínica inesperada32. Para tratar de aunar criterios acerca de la controversia entre dosis fijas y ajustadas al peso, el estudio de Nutescu y cols.33 recomienda incrementar la dosis de HBPM aproximadamente un 30 % y plantearse la monitorización de los niveles anti-Xa plasmáticos en pacientes con peso > 190 kg. • Duración. No existe acuerdo sobre el mantenimiento óptimo de la HBPM, pero parece evidente que debe continuarse después del alta hospitalaria. Varios estudios en CB demuestran que muchos pacientes presentan ETV sintomática tras el alta hospitalaria y después de haber interrumpido la profilaxis14,34. En la serie de Froehling y cols.35, la TVP acumulativa después de CB fue 0,3 %, 1,9 %, 2,1 % y 2,1 %, a 7, 30, 90 y 180 días. Raftopoulos y cols. 36 fueron de los primeros en recomendar tromboprofilaxis extendida a 10 días de la CB frente a la profilaxis intrahospitalaria. Magee y cols.37, en 735 pacientes CB que recibieron 2.500 UI de dalteparina antes de la intervención, seguidas de 5.000 UI/24 h durante 1 semana en pacientes con banda gástrica ajustable y 3 semanas en el resto de intervenciones, no observaron, con un seguimiento de 6 meses, ningún ETV sintomático. La mortalidad a 90 días fue nula. Tres pacientes sufrieron hemorragias en el postoperatorio inmediato. Por su parte, Woo y Kim38 proponen, sobre 200 CB, una profilaxis extendida con enoxaparina de 2 semanas, no evidenciado ETV sintomáticas y 2 casos de hemorragia menor. Por tanto, y aunque existen pocos estudios prospectivos al respecto, se recomienda prolongar la HBPM 3-4 semanas tras la CB, máxime en casos con factores de riesgo39. En la Figura 1 se aprecia un resumen de recomendaciones sobre profilaxis de la ETV para la CB. CIRUGÍA MAYOR AMBULATORIA Nadie discute la eficacia y seguridad de la CMA, pero sí la necesidad de emplear profilaxis antitrombótica, como es práctica habitual en la cirugía convencional. Sobre el binomio CMA-ETV hay escasez de datos. Su consecuencia es incertidumbre y variabilidad en la práctica clínica. Figura 1. Prevención de la enfermedad tromboembólica venosa (ETV) en cirugía bariátrica. I 32 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico Incidencia y factores de riesgo A pesar de la elevada frecuencia y relevancia de la CMA, sorprende la escasa información sobre la ETV en este tipo de cirugía. No obstante, cada vez más guías y consensos recomiendan la necesidad de identificar pacientes de riesgo y emplear en ellos profilaxis farmacológica. La incidencia y riesgo de ETV después de CMA no se conoce con precisión. Diferentes estudios, todos retrospectivos41-43, señalan una baja incidencia de ETV en pacientes sometidos a CMA. Sin embargo, estudios prospectivos con cribado sistemático de ETV reflejan índices nada despreciables de TVP; no obstante, estos estudios, recogidos por Ahonen44, se refieren únicamente a la artroscopia de rodilla. Es cierto que la CMA incluye técnicas quirúrgicas menos invasivas y de corta duración, lo que supone una recuperación más rápida del paciente, pero también es cierto que cada vez se operan pacientes de más edad, mayor comorbilidad y jóvenes con factores de riesgo de ETV44-46. También las técnicas anestésicas han cambiado y, aunque la anestesia neuroaxial pueda tener un efecto protector frente a la ETV, dicha técnica, unida al carácter ambulatorio de la CMA, puede dificultar la aplicación de la profilaxis47,48. El metaanálisis sobre el riesgo de la ETV tras colecistectomía laparoscópica realizado por Rondelli y cols.49 puso en evidencia que la incidencia de ETV fue un 50 % menor tras CL que abierta. Pero la CMA engloba muchos procedimientos quirúrgicos, algunos muy frecuentes (por ejemplo hernia inguinal); por ello, obligatoriamente deben existir pacientes con riesgo de ETV (mayores, historia previa de ETV, obesos, etc.). Es bien conocido que los beneficios-riesgos se optimizan al máximo cuando se estratifican bien los pacientes. Con estos precedentes, la Asociación Española de Cirugía Mayor Ambulatoria (ASECMA) realizó (2006) y actualizó (2011) un consenso para la prevención de la ETV en CMA50,51. El documento recomienda un modelo de estratificación del riesgo basado en la intervención a practicar y las características del paciente. La combinación de ambos factores de riesgo permiten estratificar los pacientes en tres grupos: bajo, moderado y alto riesgo; en los dos últimos se contempla la administración de HBPM (Figura 2). Este consenso ha sido asumido, con modificaciones, por la Associaçao Portuguesa de Cirurgia Ambulatoria (APCA)53. Posteriormente, la British Association of Day Surgery54 señala los factores de riesgo relativos a la CMA (duración > 90 minutos o 60 minutos en cirugía de pelvis o extremidad inferior) o de índole personal (reducción de la movilidad, cáncer activo, edad > 60 Figura 2. Cálculo del riesgo tromboembólico en cirugía mayor ambulatoria y decisión del método profiláctico a emplear según ASECMA. Riesgo de la cirugía: bajo (la mayoría de procedimientos); moderado (por ejemplo, laparoscopia > 60 m; hernias de pared bilaterales). Riesgo del paciente: nivel 1 (bajo): edad < 40 años, embarazo/ puerperio, estrógenos, insuficiencia cardiorrespiratoria, varices, enfermedad inflamatoria intestinal, IMC 25-35 kg/m2, fumadores > 30 c/día; nivel 2 (moderado): edad 40-60 años, IMC 35-50 kg/ m2, inmovilización > 3 días, síndrome mieloproliferativo, síndrome nefrótico, trombofilias relevantes, parálisis extremidades inferiores; nivel 3 (alto): edad > 60 años, historia previa de ETV, cáncer activo, IMC > 50 kg/m2. HBPM (m) = heparina de bajo peso molecular a dosis moderadas (< 3.400 UI/día). HBPM (a) = heparina de bajo peso molecular a dosis altas (> 3.400 UI/día). años, deshidratación, trombofilia, obesidad, diferentes comorbilidades, historia previa de ETV, hormonoterapia, anticonceptivos orales y venas varicosas con flebitis). En la misma dirección está el informe emitido posteriormente por el comité de Northampton General Hospital-National Health System (NHS)55. Finalmente, un consenso internacional refiere que la cirugía menor (definida como cirugía abdominal inferior a 45 minutos) en pacientes de 40-60 años, sin factores de riesgo, se considera de bajo riesgo de ETV. Son de moderado riesgo, los pacientes de edad > 60 años, o pacientes de 40-60 años con historia de ETV previa u otros factores de riesgo56. Profilaxis La evidencia sobre tromboprofilaxis en CMA es limitada. Existen pocos estudios, máxime si excluimos procedimientos ortopédicos o laparoscópicos. De I 33 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico hecho, no conocemos ningún ensayo aleatorizado y controlado sobre tromboprofilaxis en cirugía general-CMA. Disponemos de datos de cuatro ensayos no aleatorizados: el primero, realizado con 114 pacientes operados por hernia inguinal y tratados con HNF, pero con el objetivo de valorar la influencia de la inyección subcutánea en la aparición de complicaciones en la zona de la herida operatoria56; un segundo estudio observacional empleó bemiparina en 203 pacientes sometidos a cirugía de la pared abdominal (hernias y eventraciones) por vía abierta o laparoscópica, con factores de moderado (81,1 %) o alto riesgo (26,1 %) según el consenso THRIFT, pero el mayor problema del estudio fue que no realizaron cribado sistemático de la TVP57; el tercero es un estudio retrospectivo realizado en 1.854 pacientes operados de hernia y que recibieron heparina profiláctica, si bien no refieren el motivo de su indicación (estratificación del riesgo) ni la metodología empleada43. Finalmente, un estudio prospectivo sobre 402 pacientes sometidos mayoritariamente a cirugía de la pared abdominal, con la finalidad de validar el referido consenso ASECMA. Los resultados apoyan la hipótesis de que el grupo de pacientes con bajo riesgo (35,1 %) no precisan HBPM. Complementariamente, al estratificar el riesgo encontraron sorprendentemente que casi dos tercios de pacientes presentan riesgo (56,7 % moderado y 8,2 % alto); en ellos la bemiparina, a dosis de 2.500 o 3.500 UI/día según el riesgo, mostró efectividad y seguridad en la prevención de la ETV58. Conjuntamente, en el referido metaanálisis de Rondelli y cols. 49, se pone de manifiesto la ausencia de ensayos clínicos randomizados y controlados que analicen la eficacia de la profilaxis tras colecistectomía laparoscópica. No obstante, en tres estudios abiertos en los que se comparó la profilaxis con HBPM y con métodos mecánicos no hubo diferencias significativas. Los autores concluyen que los beneficios de la profilaxis farmacológica precisa estudios de más calidad, recomendando una estratificación de cada caso. La escasez de datos y su fiabilidad lógicamente propician inquietud entre los cirujanos, como lo demuestran las encuestas realizadas al respecto en diferentes países45,59-62. El debate existe: unos estratifican el riesgo de sus pacientes, otros no; existen quienes emplean HBPM y quienes no. Es cierto que el número y complejidad de la CMA aumenta, y no extraña que la mayoría de encuestas concluyan solicitando un consenso de actuación. Desde hace años muchas sociedades científicas y grupos de expertos han emitido recomendaciones sobre la prevención de la ETV en pacientes quirúrgicos; sin embargo, hasta muy recientemente han sido inexistentes o muy breves las específicas para CMA. ¿Qué dicen las guías o consensos sobre la prevención de la ETV en CMA? La última guía del ACCP recomienda que los pacientes sometidos a CMA/cirugía menor, máxime si son menores de 40 años, deben ser considerados de bajo riesgo de ETV y por ello no precisan profilaxis farmacológica16; “regla” que siguen otros63,64. En estos pacientes solo se recomienda deambulación precoz y agresiva. Por el contrario, hay numerosas guías o consensos que recomiendan detectar pacientes de riesgo para emplear HBPM (individualizar la profilaxis). Los grupos español (ASECMA) y portugués (APCA) estratifican riesgos y en aquellos pacientes de moderado y alto riesgo indican HBPM a dosis de moderado o alto riesgo respectivamente51,52. Una guía francesa recomienda, en pacientes con factores de riesgo sometidos a cirugía de la pared abdominal, HBPM o medias elásticas65. La guía escocesa SIGN, Scottish Intercollegiate Guidelines Network66, en los procedimientos denominados “Minimal Access Surgery”, con factores de riesgo adicionales o procedimientos prolongados, recomienda HBPM/HNF. Diferentes guías británicas se posicionan igualmente; así, la guía NICE (Nacional Institute for Health and Clinical Excelence)67 recomienda que en pacientes sometidos a CMA de riesgo de ETV, y bajo riesgo de hemorragia, se debe añadir una HBPM (o HNF). La British Association of Day Surgery53, el comité de trombosis del Northampton General Hospital54 o la guía Worcesterhire, ambas del NHS68, informan en igual dirección. Finalmente, un consenso más lejano, procedente de Australia y Nueva Zelanda69, también considera la administración de HBPM en pacientes de CMA con factores de riesgo. En lo que todos los consensos o guías coinciden es en ofrecer profilaxis mecánica al ingreso, a todos los pacientes sometidos a CMA, la cual debe continuar hasta la deambulación normal del paciente. No existen ensayos ni recomendaciones sobre los nuevos anticoagulantes orales en CMA, si bien es de esperar que sus ventajas y buen perfil riesgo-beneficio deparen en el futuro un lugar en la CMA70. Aspectos básicos en relación con la profilaxis con HBPM (inicio, dosis y duración) Si no disponemos de datos objetivos sobre la indicación de las HBPM en CMA, todavía son menos los existentes sobre la metodología de su empleo. I 34 I • Inicio. El momento óptimo para iniciar la HBPM en CMA es 12 horas antes o 6 horas postcirugía Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico Figura 3. Prevención de la ETV en cirugía mayor ambulatoria. (postanestesia neuroaxial)44,58. Así lo recomiendan la mayoría de las guías51,54. • Dosis. Según nivel de riesgo, habitualmente moderado (< 3.400 UI/día)51,58,65. En cualquier caso, inyectar la HBPM en una zona alejada de la incisión quirúrgica56. • Duración. Tampoco existe evidencia de calidad con respecto a la prolongación óptima. Una vez iniciada la HBPM debe mantenerse 7 días51,58 o hasta la movilización total del paciente, por ello algunos reducen este tiempo a 5-7 días65 o incluso a 3-5 días52. Las recomendaciones se pueden encontrar en la Figura 3. POLITRAUMA Los politraumatizados (PT) son un grupo de pacientes que plantean ciertos problemas para la prevención de la ETV. La relación PT-ETV es bien conocida; de hecho; en estos pacientes es habitual encontrar todos los componentes de la tríada de Virchow (desencadenantes de ETV). Así pues, no debe extrañar que tras sepsis y fracaso multiorgánico, la ETV constituya la tercera causa de muerte hospitalaria en PT que sobreviven las primeras 24 horas71. Incidencia y factores de riesgo La incidencia de ETV en los PT es muy variable (758 %), dependiendo de las características del paciente (tipo de lesiones, gravedad, edad, etc.), el método diagnóstico empleado, su frecuencia (por ejemplo, ecografías seriadas) y la profilaxis empleada72. Además muchas TVP y/o EP son silentes o asintomáticas. Los PT que no reciben profilaxis desarrollan con alta probabilidad una ETV (hasta 60 % de TVP y 1 % de EP mortales)73-75. La base de datos de la German Society for Trauma Surgery refleja que la ETV sintomática tiene baja frecuencia (1,8 %) si los pacientes reciben profilaxis. La EP más que frecuente es grave; si aparece suele ser fatal en el 25,7 % de los casos77. El ACCP considera todos los PT como de alto riesgo de ETV78. Conjuntamente, diversos estudios han puesto de manifiesto la existencia de factores de riesgo entre los PT71-73,75, 79. La base de datos sobre trauma del American College of Surgeons identificó como factores de alto riesgo la edad > 40 años, las fracturas de piernas o pelvis, el shock al ingreso, la lesión medular con déficit neurológico y el trauma craneoencefálico; conjuntamente son pacientes de muy alto riesgo la cirugía mayor, la lesión venosa, la ventilación mecánica > 3 días y presentar 2 o más de los factores de alto riesgo referidos. Así, los pacientes PT se clasifican en alto y muy alto riesgo de ETV79. En este sentido, existe un modelo matemático predictivo de ETV, denominado Risk Assessment Profile81, que incluye: a) edad (3 intervalos); b) tipo de trauma (cabeza, tórax, abdomen, columna, pelvis, extremidades, médula espinal) y escala de Glasgow; c) factores iatrogénicos (catéteres, transfusiones, cirugía, reparación venosa); y d) enfermedades asociadas (obesidad, cáncer, trombofilia y ETV previa). Cada aspecto tiene una puntuación y su suma permite obtener una puntuación total que define el perfil de riesgo individual. Tiene dos inconvenientes: carece de validación externa y compleja aplicación. Finalmente, el Injury Severiry Score (ISS) constituye por sí mismo otro factor predictivo de riesgo (a más ISS más riesgo de ETV); del 1,2 % (ISS > 25) pasa al 2,1 % (ISS = 25-34), 2,8 % (ISS = 35-49), hasta el 4,1 % de ETV con ISS entre el 50-75 %75. Profilaxis Las opciones profilácticas en los PT son las mismas que en la mayoría de los pacientes quirúrgicos (mecánicos, farmacológicos y filtro de VCI). Los dos motivos que van a condicionar su uso son el tipo de lesiones del paciente y la presencia o riesgo de hemorragia. Métodos mecánicos Los métodos mecánicos disponibles son las MCE, los dispositivos de CNI y las bombas venosas plantares. Sus principales beneficios son que no aumentan el riesgo de sangrado, que su empleo no necesita monitorización, que son relativamente baratos y tolerados por I 35 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico el paciente. Sus limitaciones más importantes vienen dadas por la existencia de lesiones en las piernas o la presencia de escayolas o fijadores externos que hacen que no puedan utilizarse; la bomba plantar se puede aplicar en estos casos. Las MCE y CNI tampoco pueden utilizarse en enfermos con patología vascular periférica grave, insuficiencia cardiaca congestiva y con trombosis confirmada, ya que puede favorecer el desprendimiento del trombo (CNI). No existe evidencia de que la utilización de las MCE, como única medida, reduzca la incidencia de la ETV en PT79. Sin embargo, parecen tener un efecto sinérgico beneficioso junto a otros métodos de tromboprofilaxis. Tampoco existe evidencia de que la utilización aislada de la CNI sea útil como profilaxis de la ETV en PT, aunque en pacientes quirúrgicos un metaanálisis demostrara una reducción del riesgo relativo de la TVP del 47 % a favor de la CNI82. En el metaanálisis de Velmahos y cols.83,84 específico para PT, la utilización de la CNI no encontró beneficio en la reducción de la ETV al compararlo con ningún tipo de profilaxis. Finalmente, Knudson e Ikossi76 observaron que la CNI solo era efectiva en el grupo de pacientes con traumatismo craneoencefálico, si se comparaba frente a un grupo sin profilaxis. A pesar de la poca evidencia, el uso de dispositivos mecánicos como única medida de profilaxis de la ETV está recomendado por el ACCP en pacientes PT en dos situaciones78: hemorragia intraocular y coagulopatía. Son contraindicaciones relativas: traumatismo craneoencefálico sin evidencia de sangrado, las laceraciones o contusiones de órganos internos (por ejemplo, bazo) y los hematomas retroperitoneales asociados a fractura de pelvis o lesión completa de médula espinal79,86. Aspectos prácticos respecto a la profilaxis farmacológica: método profiláctico, dosis, inicio y duración • Cuando la profilaxis farmacológica está contraindicada por sangrado activo o riesgo de hemorragia. Preferiblemente utilizar los dispositivos de CNI. • Como método complementario de profilaxis junto a las HBPM, especialmente en los politraumatizados de muy alto riesgo trombótico, incluyendo las lesiones de columna vertebral y cráneo. Métodos farmacológicos Los fármacos utilizados en la profilaxis de la ETV en PT son los habituales. La profilaxis farmacológica se asocia a un riesgo de sangrado del 1-3 %, dependiendo del fármaco85. Las HBPM constituyen la base de la profilaxis en PT y su indicación está bien recogida en las guías del ACCP76 y de la Eastern Association for the Surgery of Trauma (EAST)86. Las contraindicaciones absolutas para el empleo inicial de anticoagulantes en PT son: sangrado no controlado, sangrado intracraneal, lesión de la médula espinal con presencia o sospecha de hematoma, I 36 I • Método. En la mayoría de PT sin riesgo de sangrado las HBPM constituyen la primera opción profiláctica, por sus conocidas ventajas sobre la HNF, aunque no hay ninguna HBPM con indicación específica en el paciente politraumatizado. Knudson e Ikossi76 aleatorizaron 487 PT de alto riesgo entre CNI y HBPM (seguidos mediante ecografías); la incidencia de TVP fue 2,5 % en el grupo CNI y 0,8 % en el HBPM. Geerts y cols.87 aleatorizaron 265 PT a HNF o enoxaparina (seguidos mediante flebografías); la incidencia de TVP en el grupo HNF fue del 41 %, frente al 31 % del grupo HBPM. La hemorragia fue del 2,9 % (HBPM) y el 0,6 % (HNF), sin significación estadística. Actualmente el empleo de HNF en el PT es infrecuente y discutido. La EAST86 señala que la HNF no ofrece protección frente a la ETV en PT. Por el contrario, el ACCP78 la recoge con recomendación similar a HBPM. La HNF puede jugar un papel junto con la profilaxis mecánica en pacientes con alto riesgo de sangrado por la posibilidad de revertir su efecto con sulfato de protamina en caso de sangrado activo79. Respecto a fondaparinux, en pacientes PT existen pocos estudios88; el ACCP no recoge su indicación en PT78. Los anticoagulantes orales antivitamina K plantean numerosos problemas y no se emplean. Finalmente, no existe experiencia con los nuevos anticoagulantes orales. • Inicio. Los métodos mecánicos, si no están contraindicados, deben aplicarse al ingreso. El inicio de la HBPM es un tema relevante y controvertido. Relevante, porque un estudio multicéntrico puso de manifiesto que la omisión de la HBPM, sin razones obvias, en las primeras 24 horas del ingreso del PT está asociada a un incremento de la mortalidad89. Abundando en los efectos nocivos de su retraso, Nathens y cols.90 constataron que solo el 25 % de pacientes inició la profilaxis en las primeras 48 horas, y observaron que un retraso superior a 4 días multiplicaba por tres el riesgo de ETV. Controvertido porque la HBPM puede estar inicialmente contraindicada por la Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico presencia de sangrado o riesgo de hemorragia. Su inicio se debe demorar hasta que no existan contraindicaciones formales. Por ello, el momento para iniciar la profilaxis de la ETV en pacientes PT en ocasiones es difícil de determinar, aunque siempre debe ser lo más precoz posible. El comienzo estará determinado tanto por las lesiones del paciente (diagnosticadas o sospechadas) y riesgo o presencia de sangrado como por la necesidad de cirugía urgente. El momento de iniciar la HBPM en el PT no está claro en la mayoría de guías o consensos y deberá ser individualizado. Esta se podría iniciar cuando el paciente está hemodinámicamente estable, no precise drogas vasoactivas, tratamiento intensivo con fluidoterapia o transfusiones sanguíneas y, lógicamente, sin evidencia de hemorragia activa91. En PT con riesgo de hemorragia el tiempo de evaluación se puede centrar entre 24 y 48 horas92,92. Tras este periodo los pacientes se podrían reevaluar y valorar si existe alguna contraindicación formal para la HBPM. • Dosis. Mientras que en Europa la dosis estándar de HBPM de alto riesgo utilizada en estos pacientes es cada 24 horas, la FDA recomienda en general, en Estados Unidos, dosis cada 12 horas. Así, por lo que se refiere a la enoxaparina, el protocolo en Europa consiste en 40 mg diarios, mientras que en Estados Unidos es de 30 mg/12 horas. Aunque en pacientes de alto riesgo ambas dosis son equivalentes en cuanto a resultados, en los PT existe controversia y parece más recomendable ajustar la dosis en función de las características del enfermo. Pero, ¿en qué pacientes?, ¿con qué test y su frecuencia? Aunque el nivel de evidencia no sea alto, se recomienda ajustar la dosis en niños, ancianos, obesos y pacientes con insuficiencia renal, pues la respuesta a la HBPM es más difícil de predecir. Investigaciones en PT, que ajustan dosis de HBPM con niveles de anti-Xa, señalan que muchos pacientes (hasta el 70,5%) reciben una inadecuada profilaxis con 30 mg/12 horas93,94. Pero la determinación del anti-Xa tiene algunos problemas; no hay consenso sobre si las determinaciones se deben realizar en su pico o en su valle y sobre cuáles son los rangos profilácticos idóneos. Conjuntamente en muchos hospitales no está disponible. La dalteparina (5.000 UI/día) también se ha empleado como profilaxis de la ETV en PT, con resultados similares a enoxaparina95. Dos tercios de pacientes de la base de datos de la German Society for Trauma Surgery que presentaron una ETV lo hicieron en la tercera semana del ingreso y por ello recomiendan prolongar en el tiempo la profilaxis77. • Duración. Es imprecisa la duración óptima de HBPM en estos pacientes, pues existe gran dispersión de datos en relación con el tipo de lesiones, pequeñas muestras de pacientes y seguimiento limitado. Se recomienda que la profilaxis debe mantenerse mientras permanezcan activos los factores de riesgo y debe ser individual, a tenor de la revisión de Yenna y Robers95. Estos pacientes deben recibir profilaxis mientras no consigan una movilidad adecuada, hecho que va a depender del tipo de lesiones, el tratamiento realizado y las secuelas78. En caso de que el paciente necesite profilaxis de la ETV de forma prolongada por el tipo de lesiones (por ejemplo, lesión medular) o complicaciones de las mismas, se evaluaría la posibilidad de pasar de la HBPM a una anticoagulación oral. Filtro de vena cava inferior Los filtros son una alternativa en la estrategia profiláctica de la ETV en PT, sobre todo en pacientes de muy alto riesgo, fundamentalmente cuando existe contraindicación para la profilaxis farmacológica91. En los último años su empleo se ha incrementado, especialmente en EE.UU., favorecido por los desarrollos técnicos (colocación percutánea, incluso en la propia UCI y la existencia de filtros extraíbles), aspecto este último particularmente interesante en los PT, ya que la fase de riesgo suele estar limitada en el tiempo; a pesar de ello, un trabajo multicéntrico, observó que cerca del 80 % no fueron retirados por diversas causas96. No parece que los filtros profilácticos hayan mejorado los resultados en cuanto a supervivencia o menores índices de EP respecto de la profilaxis farmacológica91. No obstante, una reciente revisión sistemática y metaanálisis concluyen que existe evidencia, aunque baja, sobre la reducción de EP y EP mortales en los PT con filtros vs. PT sin filtros; por el contrario, no se apreciaron diferencias en la incidencia de TVP y mortalidad97. Junto a la discutida efectividad, los filtros presentan diversos problemas: I 37 I • Lógicamente no previenen la TVP, e incluso pueden aumentar su incidencia por debajo del filtro. • Su empleo no está exento de riesgos y la incidencia de complicaciones está alrededor del 2,5 %. • El acceso a la técnica no está disponible en todos los centros hospitalarios. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico • Otro problema es el momento idóneo para indicar su colocación. Hasta un 6 % de EP en PT se producen en las primeras 24 horas tras el traumatismo; por tanto, para que los filtros fueran realmente efectivos su colocación se debería indicar precozmente76,81,91. No existen ensayos clínicos aleatorizados con un alto nivel de evidencia que avalen su empleo. Velmahos y cols.84,85 señalan que los filtros en PT seleccionados de alto riesgo pueden disminuir la incidencia de EP. Las guías no llegan a estar de acuerdo. La EAST85, bastante liberal, considera que los filtros pueden estar indicados en PT de alto riesgo donde la anticoagulación está contraindicada. El ACCP78 sugiere que en los pacientes con traumatismos graves no deben implantarse filtros para la prevención primaria de la ETV. A la vista de todo ello, parece que la indicación profiláctica de un filtro de VCI en PT debe ser individualizada según el paciente y las lesiones que este presenta (Tabla 1). Se puede consultar un resumen de las recomendaciones en las Figuras 4 y 5. Figura 4. Riesgo tromboembólico en pacientes politraumatizados y decisión del método profiláctico que se va a emplear. BIBLIOGRAFÍA 1. Stein PD, Beemath A, Olson RE. Obesity as a risk factor in venous thromboembolism. Am J Med. 2005;118:978-80. 2. Stein PD, Matta F. Pulmonary embolism and deep venous thrombosis following bariatric surgery. Obes Surg. 2013;23:663-8. 3. International Bariatric Surgery Registry. www.asbs.org/html/ rationale/rationale.htm. 4. Arcelus JI, Ramos JL. Prevención de la ETV en Cirugía General y del Aparato Digestivo. Recomendaciones del Grupo de Trombosis de la AEC. Barcelona: Ed. Esmon; 2013. Figura 5. Prevención de la ETV en pacientes con politraumatismo. 5. Rocha AT, De Vasconcellos AG, Da Luz Neto ER, Araújo DM, Alves ES, Lópes AA. Risk of venous thromboembolism and efficacy of thromboprophylaxis in hospitalized obese medical patients and in obese patients undergoing bariatric surgery. Obes Surg. 2006;16:1645-55. 6. Hamad GG, Bergqvist D. Venous thromboembolism in bariatric surgery patients: an update of risk and prevention. Surg Obes Relat Dis. 2007;3:97-102. 7. Sapala JA, Wood MH, Schuhknecht MP, Sapala MA. Fatal pulmonary embolism after bariatric operations for morbid obesity: a 24-year retrospective analysis. Obes Surg. 2003;13:819-25. 8. González R, Haines K, Nelson LG, Gallagher SF, Murr MM. Predictive factors of thromboembolic events in patients undergoing Roux-en-Y gastric bypass. Surg Obes Relat Dis. 2006;2:30-5. 9. Holländer SW, Sifft A, Hess S, Klingen HJ, Djalali P, Birk D. Identifying the Bariatric Patient at Risk for Pulmonary Embolism: Prospective Clinical Trial Using Duplex Sonography and Blood Screening. Obes Surg. 2015; Mar 26. [Epub ahead of print]. 10. Chan MM, Hamza N, Ammori BJ. Duration of surgery independently influences risk of venous thromboembolism after laparoscopic bariatric surgery. Surg Obes Relat Dis. 2013;9:88-93. 11. Maillo CL, Martín E, López J, Jover JM, Martínez J, Margalet I, et al. Effect of pneumoperitoneum on venous hemodynamics during laparoscopic cholecystectomy. Influence of patients’ age and time of surgery. Med Clin (Barc). 2003;120:330-4. 12. Milic DJ, Pejcic VD, Zivic SS, Jovanovic SZ, Stanojkovic ZA, Jankovic RJ, et al. Coagulation status and the presence of postoperative deep vein thrombosis in patients undergoing laparoscopic cholecystectomy. Surg Endosc. 2007;21:1588-92. 13. Podnos YD, Jimenez JC, Wilson SE, Stevens CM, Nguyen NT. Complications after laparoscopic gastric bypass: a review of 3464 cases. Arch Surg. 2003;138:957-61. 14. Carmody BJ, Sugerman HJ, Kellum JM, Jamal MK, Johnson JM, Carbonell AM, et al. Pulmonary embolism complicating bariatric surgery: detailed analysis of a single institution’s 24-year experience. J Am Coll Surg. 2006;203:831-7. 15. American Society for Metabolic and bariatric Surgery: www. asmbs.org I 38 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico 16. Gould MK, García DA, Wren SM, Karanicolas PJ, Arcelus JI, Heit JA, et al; American College of Chest Physicians. Prevention of VTE in nonorthopedic patients. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012;141(Suppl2):e227s-77s. 17. Vaziri K, Bhanot P, Hungness ES, Morasch MD, Prystowsky JB, Nagle AP. Retriavable inferior vena cava fi lters in highrisk patients undergoing bariatric surgery. Surg Endosc. 2009;23:2203-7. 18. Brotman DJ, Shihab HM, Prakasa KR, Kebede S, Haut ER, Sharma R, et al. Pharmacologic and mechanical strategies for preventing venous thromboembolism after bariatric surgery: a systematic review and meta-analysis. JAMA Surg. 2013;148:675-86. 19. Rowland SP, Dharmarajah B, Moore HM, Lane TR, Cousins J, Ahmed AR, et al. Inferior vena cava filters for prevention of venous thromboembolism in obese patients undergoing bariatric surgery: a systematic review. Ann Surg. 2015;261:35-45. 20. Pryor HI, Singleton A, Lin E, Lin P, Varizi K. Practice patterns in high-risk bariatric venous thromboembolism prophylaxis. Surg Endosc. 2013;27:843-8. 21. Steele KE, Canner J, Prokopowicz G, Verde F, Beselman A, Wyse R, et al. The EFFORT trial: Preoperative enoxaparin versus postoperative fondaparinux for thromboprophylaxis in bariatric surgical patients: a randomized double-blind pilot trial. Surg Obes Relat Dis. 2015;11:672-83. 22. Celik F, Huitema AD, Hooijberg JH, van de Laar AW, Brandjes DP, Gerdes VE. Fixed-dose enoxaparin after bariatric surgery: the influence of body weight on peak anti-Xa levels. Obes Surg. 2015;25:628-34. 23. Kalfarentzos F, Stavropoulou F, Yarmenitis S, Kehagias I, Karamesini M, Dimitrakopoulos A, et al. Prophylaxis of venous thromboembolism using two different doses of low-molecular-weight heparin (nadroparin) in bariatric surgery: a prospective randomized trial. Obes Surg. 2001;11:670-6. 24. Scholten DJ, Hoedema RM, Scholten SE. A comparison of two diff erent prophylactic dose regimens of low molecular weight heparin in bariatric surgery. Obes Surg. 2002;12:19-24. 25. Rowan BO, Kuhl DA, Lee MD, Tichansky DS, Madan AK. Anti-Xa levels in bariatric surgery patients receiving prophylactic enoxaparin. Obes Surg. 2008;18:162-6. 26. Borkgren-Okonek MJ, Hart RW, Pantano JE, Rantis PC Jr, Guske PJ, Kane JM Jr, et al. Enoxaparin thromboprophylaxis in gastric bypass patients: extended duration, dose stratification, and antifactor Xa activity. Surg Obes Relat Dis. 2008;4:625-31. 27. Mushtaq A, Vaughns JD, Ziesenitz VC, Nadler EP, van den Anker JN. Use of Enoxaparin in Obese Adolescents During Bariatric Surgery-a Pilot Study. Obes Surg. 2015; Feb 26. [Epub ahead of print]. 28. Martí-Valeri C, Sabaté A, Masdevall C, Dalmau A. Improvement of associated respiratory problems in morbidly obese patients after open Roux-en-Y gastric bypass. Obes Surg 2007;17:1102-10. 29. Vavken P, Lunzer A, Grohs JG. A prospective cohort study on the effectiveness of 3500 IU versus 5000 IU bemiparin in theprophylaxis of postoperative thrombotic events in obese patients undergoing orthopedic surgery. Wien Klin Wochenschr 2009;121(13-14):454-8. 30. Becattini C, Agnelli G, Manina G, Noya G, Rondelli F. Venous thromboembolism after laparoscopic bariatric surgery for morbid obesity: clinical burden and prevention. Surg Obes Relat Dis. 2012;8:108-15. 31. Ikesaka R, Delluc A, Le Gal G, Carrier M. Efficacy and safety of weight-adjusted heparin prophylaxis for the prevention of acute venous thromboembolism among obese patients undergoing bariatric surgery: a systematic review and meta-analysis. Thromb Res. 2014;133:682-7. 32. Egan G, Ensom MH. Measuring anti-factor xa activity to monitor low-molecular-weight heparin in obesity: a critical review. Can J Hosp Pharm. 2015;68:33-47. 33. Nutescu EA, Spinler SA, Wittkowsky A, Dager WE. Low-molecular-weight heparins in renal impairment and obesity: available evidence and clinical practice recommendations across medical and surgical settings. Ann Pharmacother. 2009;43:1064-83. 34. Hamad GG, Choban PS. Enoxaparin for thromboprophylaxis in morbidly obese patients undergoing bariatric surgery: findings of the prophylaxis against VTE outcomes in bariatric surgery patients receiving enoxaparin (PROBE) study. Obes Surg. 2005;15:1368-74. 35. Froehling DA, Daniels PR, Mauck KF, Collazo-Clavell ML, Ashrani AA, Sarr MG, et al. Incidence of venous thromboembolism after bariatric surgery: a population-based cohort study. Obes Surg. 2013;23:1874-9. 36. Raftopoulos I, Martindale C, Cronin A, Steinberg J. The effect of extended post-discharge chemical thromboprophylaxis on venous thromboembolism rates after bariatric surgery: a prospective comparison trial. Surg Endosc. 2008;22:2384-91. 37. Magee CJ, Barry J, Javed S, Macadam R, Kerrigan D. Extended thromboprophylaxis reduces incidence of postoperative venous thrombembolism in laparoscopic bariatric surgery. Sur Obes Relat Dis. 2010;6:322-5. 38. Woo HD, Kim YJ. Prevention of venous thromboembolism with enoxaparin in bariatric surgery. J Korean Surg Soc. 2013;84:298-303. 39. Gugliotti DV. What is the optimal venous thromboembolism prophylaxis for patients undergoing bariatric surgery? IMPACT consults. Proceedings of the 2nd Annual Cleveland Clinic Perioperative Medicine Summit. Cleveland Clinic J Med. 2006;73(Electronic Suppl1):S17-8. 40. Riber C, Alstrup N, Nymann T, Bogstad JW, Wille-Jørgensen P, Tønnesen H. Postoperative thromboembolism after day-case herniorrhaphy. Br J Surg. 1996;83:420-1. 41. Wessel N, Gerner T. Thromboembolic complications in ambulatory surgery. A retrospective study of 1691 patients. Tidsskr Nor Laegeforen. 1996;116:615-6. 42. Enoch S, Woon E, Blair SD. Thromboprohylaxis can be omitted in selected patient undergoing varicose vein surgery and hernia repair. Br J Surg. 2003;90:818-20. 43. Engbaek J, Bartholdy J, Hjortso NC. Return hospital visits and morbidity within 60 days after day surgery: retrospective study of 18,736 day surgical procedures. Acta Anaesthesiol Scand. 2006;50:911-9. 44. Ahonen J. Day surgery and thromboembolic complications: time for structured assessment and prophylaxis. Curr Opin Anaesthesiol. 2007;20:535-59. 45. Wasowicz-Kemps DK, Biesma DH, Schangen van Leeuwn J, Van Ramshorst B. Prophylaxis of venous thromboembolism in general and gynecological day surgery in the Netherlands. J Thomb Haemost. 2006;4:269-71. 46. Lozano FS, Sánchez J, González JR, García J, Santos JA, Mateos R, et al. Slow femoral venous flow and venous thromboembolism following inguinal hernioplasty in patients without or with low molecular weight heparin prophylaxis. Hernia. 2015; Feb 8. I 39 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico 47. Roderick P, Ferris G, Wilson K, Halls H, Jackson D, Collins R, et al. Towards evidence-based guidelines for the prevention of venous thromboembolism: systematic reviews of mechanical methods, oral anticoagulation, dextran and regional anaesthesia as thromboprophylaxis. Health Technology Assessment. 2005;49:1-78. 48. Chelly JE. Thromboprophylaxis and regional anesthesia in the ambulatory setting. Int Anesthesiol Clin. 2011;49:166-73. 49. Rondelli F, Manina G, Agnelli G, Becattini C. Venous thromboembolism after laparoscopic cholecystectomy: clinical burden and prevention. Surg Endosc. 2013;27:1860-4. 50. Raich M, Bustos F, Castellet F, Castillo J, Gómez JA, Jiménez B, et al. Recomendaciones de tromboprofilaxis en cirugía mayor ambulatoria. Cir May Amb. 2006;11:11-7. 51. Raich M, Bustos F, Castellet E, Castillo J, Dacobo F, Domenech P, et al. Actualización de las recomendaciones de tromboprofilaxis en cirugía mayor ambulatoria. Cir May Amb. 2011:16:23-9. 52. Pinho C, Campos M, Ramos M, Céu Lourenco M, Teixeira S. Recomendacoes de tomboprofilaxia em cirurgia ambulatoria. Associacao Portuguesa de Cirurgia Ambulatoria. 2013. 53. British Association of Day Surgery (2007) BADS directory of procedures 2007. 54. Thrombosis Committee. Northampton General Hospital. NHS. Thromboprofilaxis Guidelines for Adult Patient. NGHGU-187; 2012. 55. Nicolaides AN, Fareed J, Kakkar AK, Comerota AJ, Goldhaber SZ, Hull R, et al. Prevention and treatment of venous thromboembolism. International Consensus Statement. Int Angiol. 2013;32:111-260. 56. Wright DM, O’Dwyer PJ, Pateson CR. Influence of inyection site for low dose heparin on wound complication rates after inguinal hernia repair. Ann R Coll Surg Engl. 1998;80:58-60. 57. Hidalgo M, Figueroa JM. Prophylaxis of venous thromboembolism in abdominal wall surgery. Hernia. 2000;4:242-7. 58. Lozano FS, Sánchez J, Santos JA, García J, Mateos R, González, JR, et al. Venous thromboembolism risk stratification and thromboprophylaxis with low molecular weight heparin in patients undergoing major ambulatory surgery: an observational prospective study. Amb Surg. 2010;16:5-12. 59. Anwar S, Scott P. Current practice for anticoagulation prophylaxis in inguinal hernia surgery: a questionnaire survey. NZ Med J. 2003;116:U583. 60. Raich M, Martínez J, Bustos F. Encuesta nacional sobre la prevención de la enfermedad tromboembólica venosa en cirugía mayor ambulatoria. Cir May Amb. 2004;9:31-6. 61. Shabbir J, Ridgway PF, Shields W, Evoy D, O’Mahony JB, Mealy K. Low molecular weight heparin prophylaxis in day case surgery. Ir J Med Sci. 2006;175:26-9. 62. Sanjay P, Woodward A. A survey of inguinal hernia repair in Wales with special emphasis on laparoscopic repair. Hernia. 2007;11:403-7. 63. Squizzato A, Venco A. Thromboprophylaxis in day surgery. Int J Surg. 2008;6(Suppl1):S29-30. 64. Muntz JE, Michota FA. Prevention and management of venous thromboembolism in the surgical patient: options by surgery type and individual patient risk factors. Am J Surg. 2010;199(Suppl1):S11-20. 65. Samama CM, Gafsou B, Jeandel T, Laporte S, Steib A, Marret E, et al; French Society of Anaesthesia and Intensive Care. Guidelines on perioperative venous thromboembolism prophylaxis. Update 2011. Short text. Ann Fr Anesth Reanim. 2011;30:947-51. 66. Scottish Intercollegiate Guidelines Network (SIGN). Prevention and management of venous thromboembolism: a national clinical 67. 68. 69. 70. 71. 72. 73. 74. 75. 76. 77. 78. 79. 80. 81. 82. 83. 84. I 40 I guideline. Edinburgh: SIGN; 2010. (SIGN publication no. 122). [cited 10 Dec 2010]. Available from URL: http://www.sign.ac.uk National Institute for Health and Clinical Excelence (NHS). Venous thromboembolism: reducing the risk. NICE clinical guidelines 92. January 2010. www.nice.org Worcesterhire. NHS. Guideline for thromboprofilaxis in adult (18 years and older) in general medical patients and inpatients undergoing surfgery. Guideline reviewed and aproved on 17th April 2014. Prevention of Venous Thromboembolism. The Australia & New Zealand Working Party on the management and Prevention of Venous Thromboembolism. 4th Edition, 2007. Squizzato A, Romualdi E, Dentali F, Ageno W. The new oral anticoagulants, do they change the benefit vs. risk for thromboprophylaxis in association to ambulatory surgery? Curr Opin Anaesthesiol. 2010;23:722-5. Geerts WH, Code KI, Jay RM, Chen E, Szalai JP. A prospective study of venous thromboembolism after major trauma. N Engl J Med. 1994;331:1601-6. Krasiński Z, Urbanek T, Krasińska B, Kaczmarczyk J. Thromboprophylaxis in patients with multiple organ injuries--is there an alternative to low-molecular-weight heparins (LMWH)? Ortop Traumatol Rehabil. 2011;13:229-40. Shackford SR, Davis JW, Hollingsworth-Frielund P, Brewer NS, Hoyt DB, Mackersie RC. Venous thromboembolism in patients with major trauma. Am J Surg. 1990;159:365-9. Knudson MM, Collins JA, Goodman SB, McCrory DW. Thromboembolism following multiple trauma. J Trauma. 1992;92:2-11. Rogers FB. Venous thromboembolism in trauma patients: a review. Surgery 2001;130:1-12. Knudson MM, Ikossi DG. Venous thromboembolism after trauma. Curr Opin Crit Care. 2004;10:539-48. Paffrath T, Wafaisade A, Lefering R, Simanski C, Bouillon B, Spanholtz T, et al; Trauma Registry of DGU. Venous thromboembolism after severe trauma: incidence, risk factors and outcome. Injury. 2010;41:97-101. Guyatt GH, Akl EA, Crowther M, Gutterman DD, Schuünemann HJ; American College of Chest Physicians Antithrombotic Therapy and Prevention of Thrombosis Panel. Executive summary: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141(Suppl2):7S-47S. Bendinelli C, Balogh Z. Postinjury thromboprophylaxis. Curr Opin Crit Care. 2008;14:673-8. Knudson MM, Ikossi DG, Khaw L, Morabito D, Speetzen LS. Thromboembolism after trauma. An analysis of 1602 episodes from the American College of Surgeons National Trauma Data Bank. Ann Surg. 2004;240:490-8. Greenfield LJ, Proctor MC, Rodríguez JL, Luchette FA, Cipolle MD, Cho J. Posttrauma thromboembolism prophylaxis. J Trauma. 1997;42:100-3. Vanek VW. Meta-analysis of effectiveness of intermittent pneumatic compression devices with a comparison of thigh-high to knee-high sleeves. Am Surg. 1998;64:1050-8. Velmahos GC, Kern J, Chan LS, Oder D, Murray JA, Shekelle P. Prevention of venous thromboembolism after injury: an evidence-based report--part I: analysis of risk factors and evaluation of the role of vena caval filters. J Trauma. 2000;49:132-8. Velmahos GC, Kern J, Chan LS, Oder D, Murray JA, Shekelle P. Prevention of venous thromboembolism after injury: an evidence-based report--part II: analysis of risk factors and evaluation of the role of vena caval filters. J Trauma. 2000;49:140-4. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico 85. Norwood SH, McAuley CE, Berne JD, Vallina VL, Kerns DB, Grahm TW, et al. A potentially expanded role for enoxaparin in preventing venous thromboembolism in high risk blunt trauma patients. J Am Coll Surg. 2001;192:161-7. 86. Rogers FB, Cipolle MD, Velmahos G, Rozycki G, Luchette FA. Practice management guidelines for the prevention of venous thromboembolism in trauma patients: the EAST practice management guidelines work group. J Trauma. 2002;53:142-64. 87. Geerts WH, Jay RM, Code KI, Chen E, Szalai JP, Saibil EA, et al. A comparison ol low-dose heparin with low molecular-weight heparin as prophylaxis against venous thromboembolism after major trauma. N Engl J Med. 1996; 335:701-7. 88. Lu JP, Knudson MM, Bir N, Kallet R, Atkinson K. Fondaparinux for prevention of venous thromboembolism in high-risk trauma patients: a pilot study. J Am Coll Surg. 2009;209:589-94. 89. Ho KM, Chavan S, Pilcher D. Omission of early thromboprophylaxis and mortality in critically ill patients: a multicenter registry study. Chest. 2011;140:1436-46. 90. Nathens AB, McMurray MK, Cuschieri J, Durr EA, Moore EE, Bankey PE, et al. The practice of venous thromboembolism prophylaxis in the major trauma patient. J Trauma. 2007;62:557-62. 91. Dossett LA, Adams RC, Cotton BA. Unwarranted national variation in the use of prophylactic inferior vena cava filters 92. 93. 94. 95. 96. 97. I 41 I after trauma: an analysis of the National Trauma Databank. J Trauma. 2011;70:1066-70. Adams RC, Hamrick M, Berenguer C, Senkowski C, Ochsner MG. Four years of an aggressive prophylaxis and screening protocol for venous thromboembolism in a large trauma population. J Trauma. 2008;65:300-6. Malinoski D, Jafari F, Ewing T, Ardary C, Conniff H, Baje M, et al. Standard prophylactic enoxaparin dosing leads to inadequate anti-Xa levels and increased deep venous thrombosis rates in critically ill trauma and surgical patients. J Trauma. 2010;68:874-80. Costantini TW, Min E, Box K, Tran V, Winfield RD, Fortlage D, et al. Dose adjusting enoxaparin is necessary to achieve adequate venous thromboembolism prophylaxis in trauma patients. J Trauma Acute Care Surg. 2013;74:128-33. Yenna ZC, Roberts C. Thromboprophylaxis after multiple trauma: what treatment and for how long? Injury. 2009;40(Suppl4):S90-4. Karmy-Jones R, Jurkovich GJ, Velmahos GC, Burdick T, Spaniolas K, Todd SR, et al. Practice patterns and outcomes of retrievable vena cava filters in trauma patients: an AAST multicenter study. J Trauma. 2007;62:17-24. Haut ER, Garcia LJ, Shihab HM, Brotman DJ, Stevens KA, Sharma R, et al. The effectiveness of prophylactic inferior vena cava filters in trauma patients: a systematic review and meta-analysis. JAMA Surg. 2014;149:194-202. Manejo perioperatorio del paciente anticoagulado Juan Vicente Llau Pitarch1, Raquel Ferrandis Comes2 Jefe de Sección. Servicio de Anestesiología, Reanimación y Terapéutica del Dolor. Hospital Clínico Universitario de Valencia. Profesor Asociado de Fisiología. Universidad de Valencia. 2 FEA. Servicio de Anestesiología, Reanimación y Terapéutica del Dolor. Hospital Clínico Universitario de Valencia. Profesora Asociada de Fisiología. Universidad de Valencia 1 INTRODUCCIÓN El manejo de la terapia anticoagulante durante el periodo perioperatorio es una situación clínica frecuente que debe equilibrar el riesgo trombótico del paciente con el riesgo hemorrágico inherente a la propia cirugía. Este último puede verse incrementado por el tratamiento anticoagulante y suponer un sangrado mayor que, eventualmente, puede poner en riesgo el resultado del propio acto quirúrgico e incluso la vida del paciente. El balance más adecuado de anticoagulación-hemostasia sigue presentando cuestiones no resueltas y de difícil consenso1, como el tiempo óptimo de retirada de un fármaco antes de la cirugía, la conveniencia o no de la realización de la “terapia puente” o cuál es la mejor forma de gestionar los nuevos anticoagulantes orales de acción directa (ACOD) como apixabán, dabigatrán o rivaroxabán. Para la mejor comprensión del tema, consideramos importante comentar, en primer lugar, la necesidad de valoración de los riesgos trombótico y hemorrágico de forma individualizada en cada paciente, según sus características personales y el tipo de cirugía al que va a ser sometido, para desarrollar después el manejo perioperatorio de los distintos fármacos. Finalmente, y a partir de los datos obtenidos, se hará un resumen de las recomendaciones más importantes. VALORACIÓN DE RIESGOS TROMBÓTICO Y HEMORRÁGICO El manejo perioperatorio de los pacientes en tratamiento anticoagulante se basa en una correcta valoración de los riesgos trombótico y hemorrágico. Hasta la fecha no se ha validado un método de estratificación específico para el periodo perioperatorio, por lo que ha sido necesario adaptar las escalas generales propuestas y utilizadas en otros contextos. El riesgo trombótico (Tabla 1) clasifica a los pacientes en bajo, moderado y alto riesgo, suponiendo un riesgo anual inferior al 5 %, entre el 5 % y el 10 % o superior al 10 %, respectivamente, de sufrir un evento tromboembólico2-4. Este riesgo sería el asumido en un paciente al que se suspende el antagonista de la vitamina K (AVK) y no recibe terapia puente con heparina de bajo peso molecular (HBPM). No obstante, esta escala es orientativa, porque puede no considerar circunstancias personales que aumenten el riesgo trombótico y que deben valorarse individualmente (como por ejemplo el riesgo trombótico asociado a la cirugía). Respecto al riesgo hemorrágico, cabe diferenciar el riesgo de sangrado inherente a la propia cirugía del eventual incremento del sangrado esperado a causa del efecto de un fármaco anticoagulante o antiagregante. Siguiendo esta premisa, se puede establecer una relación de procedimientos quirúrgicos y no quirúrgicos en los que la asociación con el tratamiento anticoagulante puede determinar un incremento del sangrado (Tabla 2). Más allá de un simple listado de procedimientos, existen dos propuestas interesantes que se aproximan a la idea de estratificación de riesgo hemorrágico en los pacientes en tratamiento antitrombótico. En uno de los casos5, la estratificación del riesgo hemorrágico perioperatorio se basa en cuatro factores predictivos: los antecedentes de sangrado del paciente, ser portador de válvula mitral mecánica, tener una neoplasia activa y recuento bajo de plaquetas, denominándose genéricamente “BleedMAP”. La otra propuesta se denomina puntuación “HASBLED”, e incluye como predictores de sangrado la hipertensión, la función renal y/o hepática alterada, los antecedentes de ictus o de sangrado previo, tener un INR lábil, I 42 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico Tabla 1. Modelo de estratificación del riesgo trombótico en pacientes sometidos a procedimientos quirúrgicos* Portadores de válvula cardiaca mecánica Riesgo alto Cualquier prótesis mitral Antiguas válvulas aórticas ACV < 6 meses Riesgo moderado Bioprótesis cardiaca con alguno de los siguientes: FA, ACV previo, HTA, DM, ICC, > 75 años Riesgo bajo Fibrilación auricular Tromboembolismo venoso Puntuación CHA2DS2-VASc > 4 ACV < 3 meses Patología valvular reumática ETV reciente (< 3 meses) Trombofilia tipo: déficit de proteína C, S o antitrombina, anticuerpos antifosfolípidos o alteraciones múltiples Puntuación CHA2DS2-VASc 2-4 ETV hace 3-12 meses TVP recurrente Enfemedad neoplásica activa Trombofilia tipo: factor V Leiden heterozigoto, mutación heterozigota del factor II. Bioprótesis cardiaca sin FA ni otros Puntuación CHA2DS2-VASc 0-1 sin otro factores de riesgo para ACV factor de riesgo ni ACV previo ETV > 12 meses sin otro factor de riesgo ACV: accidente cerebrovascular; FA: fibrilación auricular; HTA: hipertensión arterial; DM: diabetes mellitus; ICC: insuficiencia cardiaca congestiva; CHA2DS2-VASc: congestive heart failure/left venricular dysfunction, hypertension, age > 75 (doubled), diabetes mellitus, stroke (doubled), vascular disease, age 65-74, sex cathegory (female); ETV: enfermedad tromboembólica venosa. *Adaptado y modificado de: Douketis JD, Spyropoulos AC, Spencer FA, Mayr M, Jaffer AK, Eckman MH, et al. Perioperative management of antithrombotic therapy. Chest. 2012;141(Suppl2):e326S-e350S. Llau JV, Ferrandis R, López-Forte C. Antiagregantes y anticoagulantes – Manejo del paciente quirúrgico anticoagulado. Cir Esp. 2009;85(Suppl1):7-14. Baron TH, Kamath PS, McBane RD. Management of antithrombotic therapy in patients undergoing invasive procedures. N Engl J Med. 2013;368:2113-24. MANEJO PERIOPERATORIO DE LOS PACIENTES EN TRATAMIENTO CON FÁRMACOS ANTAGONISTAS DE LA VITAMINA K Tabla 2. Procedimientos quirúrgicos y no quirúrgicos en los que puede haber un incremento del sangrado si se asocian con la terapia antitrombótica Grupo de procedimiento Tipo de procedimiento Cirugía urológica Resección transuretral de próstata o vejiga Nefrectomía Biopsia renal Cirugía general (en órganos de gran vascularización) Cirugía renal de cualquier tipo Cirugía hepática Cirugía esplénica Cirugía general (riesgo hemorrágico local) Cirugía intestinal con riesgo de hemorragia en la anastomosis Cirugía mayor Cirugía neoplásica Artroplastia de cadera o rodilla Reconstrucción extensa en cirugía plástica Cirugía de riesgo si hay incremento del sangrado Cirugía cardiaca Cirugía intracraneal Cirugía espinal Endoscopia digestiva Polipectomía de pólipo sésil > 1-2 cm Otros Colocación de marcapasos o desfibrilador subcutáneos El manejo perioperatorio de los AVK se basa en la decisión de realizar o no un protocolo de terapia puente. Es decir, si se va a suspender el fármaco y sustituir por otro anticoagulante de vida media más corta, o simplemente se va a suspender el fármaco durante unos días sin sustitución. Esta decisión debe estar basada en los riesgos trombótico y hemorrágico de cada paciente en su circunstancia particular perioperatoria, evitando realizar la terapia puente de forma sistemática e idéntica en todos los pacientes. Suspensión del AVK previo a la cirugía edad > 65 años y la historia de consumo de drogas o el alcoholismo. Un resultado igual o superior a 3 en pacientes crónicamente anticoagulados por fibrilación auricular (FA), o por otra razón, se catalogó como un predictor independiente de sangrado en el estudio prospectivo-observacional-multicéntrico original6. Con objetivo de minimizar el riesgo de hemorragia perioperatoria, parece recomendable suspender el AVK antes de un procedimiento invasivo o una cirugía, aunque, en determinadas circunstancias con muy bajo riesgo de sangrado, esta suspensión puede no ser necesaria. El tiempo de suspensión debe ser el adecuado para garantizar la competencia hemostática en relación con el INR alterado, considerándose adecuado un INR inferior a 1,5 en el momento de la cirugía. El tiempo medio que se ha estimado depende del fármaco, situándose en 5 días en el caso de warfarina y siendo suficiente 2-3 días en el caso de acenocumarol7. Este intervalo puede acortarse en aquellos casos asociados a menor riesgo hemorrágico, en los que se puede permitir un INR 1,5-1,8. I 43 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico Reanudación del fármaco tras la cirugía Tras la mayoría de las cirugías, la primera dosis del AVK se puede administrar a partir de las 24 horas del postoperatorio si ha sido posible iniciar la tolerancia oral. De este modo, el INR se encontrará en rango terapéutico en torno al quinto día, sin aumentar el riesgo de sangrado8. En los casos en que no sea posible iniciar la tolerancia oral de forma precoz se debe considerar la administración de una HBPM durante los primeros días del postoperatorio hasta asegurar que la ingesta oral puede permitir una anticoagulación adecuada con el AVK. Monitorización perioperatoria del AVK Dada la variabilidad farmacodinámica que presentan los AVK, se sugiere la realización de una prueba de monitorización de la coagulación unas 12 horas antes de la cirugía, de forma que aquellos casos en los que el INR siga elevado pueda administrarse vitamina K (1-2 mg por vía oral) y evitar así la necesidad de reversión directa del efecto del AVK con la administración de plasma o de concentrado de complejo protrombínico (CCP), o la suspensión de la cirugía9. Necesidad de terapia puente durante la interrupción del AVK La necesidad o no de terapia puente es un tema muy debatido actualmente. La decisión debe basarse fundamentalmente en la estratificación del riesgo trombótico1, 2 . Sin embargo, en los últimos meses se han publicado diversos artículos sobre la mayor incidencia de sangrado en los pacientes que reciben una HBPM como terapia puente antes de la cirugía10, 12. El más reciente de todos es un ensayo clínico en pacientes con fibrilación auricular (FA) que recibieron terapia puente con una HBPM a dosis terapéuticas administrada cada 12 horas12. El manejo de pacientes con elevado riesgo trombótico se ha realizado tradicionalmente con terapia puente con HBPM, aunque hay algunos estudios con HNF. En estos casos el uso de terapia puente está ampliamente aceptado. Con este régimen el riesgo trombótico es bajo (alrededor del 1-2 %). Mucho más controvertido es el manejo de los pacientes de moderado riesgo trombótico. Clásicamente estos pacientes se han manejado de forma similar a los de elevado riesgo, aunque son precisamente estos pacientes los que más se beneficiarían, al menos según los estudios recientemente publicados y citados anteriormente10-12, de no recibir terapia puente: la incidencia de eventos trombóticos no parece estar incrementada al retirar el AVK y la inciden- cia de sangrado parece mayor en los casos en que se administra una HBPM. Ya la 9.ª Conferencia del ACCP2 propuso la no realización de terapia puente para pacientes con moderado riesgo trombótico que fueran a ser sometidos a cirugía con elevado riesgo hemorrágico (como la cirugía cardiaca o la endarterectomía carotídea). En estos casos, cabría plantear el uso exclusivamente de HBPM o HNF a dosis de tromboprofilaxis postoperatoria. En la misma línea (evitar la terapia puente), se propone el manejo de aquellos pacientes en los que la indicación de la anticoagulación prolongada con AVK hubiera sido un antecedente de trombosis venosa11. En pacientes con bajo riesgo trombótico la terapia puente parece innecesaria. Por tanto, se ha propuesto la no interrupción de los fármacos AVK en procedimientos de bajo riesgo hemorrágico y trombótico, y la suspensión sin terapia puente cuando el riesgo hemorrágico sea elevado (5 días para warfarina y 3 días para acenocumarol). Protocolos de realización de terapia puente Resulta muy interesante revisar la propuesta de diferentes dosis de HBPM en los tres protocolos de administración descritos (Tabla 3). Apoyándose en el corto espacio de tiempo que un paciente se encuentra “no anticoagulado” cuando se suspende la administración crónica de un AVK, y en que la dosificación a dosis altas (terapéuticas) de HBPM parece implicar un incremento del sangrado perioperatorio, la propuesta de administrar dosis intermedias o profilácticas debe ser tenida muy en cuenta, sobre todo en los pacientes que no presentan un elevado riesgo trombótico. Por otra parte, sí debe remarcarse que, en todo caso, la administración de la última dosis de HBPM se deberá siempre realizar 24 horas antes de la cirugía, evitan- I 44 I Tabla 3. Propuesta de regímenes de administración de heparina de bajo peso molecular para la realización de la terapia puente Tipo de protocolo Fármaco y dosis Dosis altas (terapéuticas) Bemiparina 115 UI/kg/24 h Enoxaparina 1,5 mg/kg/24 h o 1 mg/kg/12 h Dalteparina 200 UI/kg/24 h o 100 UI/kg/12 h Tinzaparina 175 UI/kg/24 h Dosis intermedias Enoxaparina 40 mg/12 h Dosis bajas (profilácticas) Bemiparina 3.500 UI/24 h Enoxaparina 40 mg/24 h Dalteparina 5.000 UI/24 h HNF: heparina no fraccionada; TPTA-ratio: tiempo parcial de tromboplastina activado en relación al basal. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico do la administración la tarde anterior, sea cual sea el protocolo elegido. Esta cuestión, además de ser importante para minimizar el riesgo de hemorragia perioperatoria, también lo es para poder realizar técnicas anestésicas neuroaxiales para aquellos procedimientos quirúrgicos en los que estén indicadas, cumpliendo así con la ventana de seguridad que se recomienda entre la última administración de HBPM y la punción neuroaxial13. Por último, también es interesante destacar la recomendación de disminuir a la mitad la última dosis de HBPM (o incluso administrar sólo una dosis profiláctica) cuando se ha elegido un protocolo de terapia puente con dosis terapéuticas de administración diaria; esta práctica no tiene influencia en el riesgo trombótico y sí puede tenerla en el hemorrágico relacionado con la cirugía porque, siguiendo esta recomendación, los niveles plasmáticos anti-Xa en el momento de la cirugía serían inferiores y fuera de rango de anticoagulación completa. el riesgo es moderado la decisión final se basará en la valoración individual de los factores personales y quirúrgicos en cada caso. Se deben tener en cuenta las siguientes consideraciones: – La dosis de HBPM que se administrará a los pacientes que reciban terapia puente dependerá del riesgo individual de trombosis y de sangrado, habiendo tres propuestas fundamentales: dosis terapéuticas, dosis intermedias o dosis profilácticas. – En los pacientes que reciban una dosis terapéutica de HBPM en la terapia puente se recomienda administrar la última dosis 24 horas antes de la intervención. – La reintroducción de la anticoagulación en los pacientes en los que se haya realizado terapia puente se realizará a partir del día siguiente a la cirugía, con HBPM a dosis intermedias o profilácticas. Se sugiere incrementar las dosis de HBPM a partir de las 48 horas tras la cirugía, manteniéndolas hasta alcanzar un INR de al menos 2,0 tras la reintroducción del AVK. Recomendaciones de manejo en cirugía programada Podemos plantear las siguientes recomendaciones, extraídas y adaptadas a partir de las propuestas de los artículos de referencia1-4,14-16: • Cirugía menor: en los pacientes que van a ser intervenidos de una cirugía dental o dermatológica menor, en aquellos pacientes programados para cirugía de cataratas o que se van a someter a un procedimiento endoscópico sin polipectomía, la mejor alternativa es el mantenimiento de la administración de los AVK. Se recomienda, el día antes de la cirugía, realizar un control de INR, que debe encontrarse en rango bajo. • Cirugía sin terapia puente: en los pacientes en los que sea necesario interrumpir el tratamiento anticoagulante con AVK antes de la cirugía y en los que no se considera necesaria la terapia puente, se recomienda dejar de tomar el AVK 3 o 5 días antes de la misma (acenocumarol o warfarina respectivamente), reiniciando su administración en las primeras 24 horas tras la cirugía, una vez alcanzada la competencia hemostática. En los pacientes en los que no se pueda iniciar la anticoagulación oral se recomienda valorar la administración de una HBPM en el periodo postoperatorio hasta el momento de la introducción del AVK; la dosis de la HBPM se valorará en función del riesgo trombótico y hemorrágico. • Cirugía con terapia puente: en pacientes con alto riesgo trombótico se recomienda la administración de terapia puente con una HBPM. Si Manejo de los AVK en cirugía urgente Para revertir el efecto de los AVK de forma urgente (< 6 horas) se han empleado varias posibilidades terapéuticas: plasma fresco, concentrado de complejo protrombínico (CCP) y factor VIIa, además de la administración de vitamina K (5-10 mg iv)17. En los casos en que sea posible retrasar la reversión 18-24 horas, puede ser suficiente la acción de la vitamina K administrada de forma intravenosa, pero si la reversión debe realizarse en un plazo menor el tratamiento será la administración de plasma o de CCP (los CCP son más eficaces y rápidos en la reversión del efecto de los AVK que el plasma)17. El factor VIIa no se debe emplear en primera elección. Una de las cuestiones que más controversias despierta, y sobre la que no es fácil alcanzar un acuerdo, es con qué INR es seguro intervenir quirúrgicamente a un paciente. Evidentemente, la respuesta inicial es que depende del tipo de cirugía, y más concretamente del riesgo inherente a una intervención quirúrgica determinada. Sin embargo, las recomendaciones más habituales establecen que con un INR inferior a 1,5 la intervención quirúrgica se puede realizar, en general, sin riesgo hemorrágico (con excepción de determinadas situaciones como neurocirugía o las intervenciones del polo vascular del ojo, en los que el INR objetivo debe ser 1,2)14. Otra cuestión básica es la estrategia que se debe seguir en caso de necesidad de administración de he- I 45 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico moderivados para su reversión inmediata. En general, se puede afirmar que la administración de CCP producirá una reversión más rápida y con menos cantidad de volumen administrado que si se emplea plasma fresco18,19. Aunque se han propuesto regímenes de administración con dosis fijas14, en general la dosis de CCP necesaria depende sobre todo del INR de partida, contando también con el INR objetivo que se plantee para el inicio de la cirugía. Así, las dosis oscilan entre 25 UI/ kg para los casos de INR entre 2 y 4 a 50 UI/kg para los pacientes con un INR superior a 6; en todos los casos se recomienda la adición de vitamina K intravenosa (10 mg) tanto para potenciar el efecto del CCP como para, fundamentalmente, prolongar su efecto hemostático18. Si se decide la administración de plasma como estrategia de reversión, el volumen necesario será de 15-30 ml/kg, lo cual puede llegar a suponer hasta 2 litros de plasma para conseguir el objetivo. Finalmente, caben unos comentarios respecto a los aspectos de seguridad en la reversión de los efectos de los AVK. Es necesario dejar constancia de lo siguiente: fundamentalmente en los riesgos hemorrágicos de la intervención quirúrgica a la que va a ser sometido el paciente y trombótico de la situación clínica por la que el paciente ha sido anticoagulado (Tabla 1)2-4. No es este el lugar ideal para hacer una revisión completa de los mismos, pero sí para, al menos, recoger algunos de sus datos esenciales (Tabla 4)23,24. Entre sus indicaciones actuales como anticoagulantes para tratamiento crónico, en función de cada uno de los ACOD, podemos encontrar la prevención de complicaciones tromboembólicas en pacientes en pacientes en FA, tratamiento de la enfermedad tromboembólica venosa (trombosis venosa profunda o embolismo pulmonar) y prevención de las complicaciones tromboembólicas tras un episodio de trombosis. Las dosis en cada caso son diferentes, debiendo destacar que en función del fármaco se administrarán una o dos veces al día (Tabla 5). A partir de lo publicado hasta el momento, y a pesar de las discrepancias entre las diferentes publicaciones, se pueden hacer las siguientes recomen- • La reversión de los AVK con cualquier hemoderivado conlleva un riesgo trombótico, dado que el paciente que se encuentra anticoagulado lo está por razones obvias de necesidad. • La administración de CCP, de efecto más rápido, se ha relacionado con un leve incremento de las complicaciones trombóticas en relación con el empleo de plasma fresco (3,9 % frente a 2,8 %, respectivamente20). • Las precauciones de seguridad en la administración de CCP incluyen la evaluación de la enfermedad de base que determina la necesidad de anticoagulación, si el paciente padece una patología hepática, y evitar dosis repetidas y dosis demasiado elevadas según lo recomendado21,22. Tabla 4. Aspectos esenciales de la farmacocinética de los ACOD Apixabán Rivaroxabán Dabigatrán Mecanismo de acción Anti-Xa Anti-Xa Anti-IIa Pico de acción (Tmáx) 3-4 h 2-4 h 1/2-2 h Metabolización hepática / excreción fecal-biliar 75 % 66 % 20 % Excreción renal de fármaco activo 25 % 33 % 80 % Vida media plasmática 8-15 h 7-11 h 14-17 h Tabla 5. Dosis de los ACOD en función de sus indicaciones Apixabán Rivaroxabán Dabigatrán MANEJO PERIOPERATORIO DE LOS PACIENTES QUE RECIBEN ANTICOAGULANTES ORALES DIRECTOS Tromboprofilaxis 2,5 mg /12 h 10 mg/24 h 220 mg/24 h en cirugía (12-24 postop.) (6-10 h postop.) (1-4 h postop.) ortopédica Los ACOD tienen como características esenciales no solo su administración oral, sino, más importante, su mecanismo de acción directa sobre una diana específica de la coagulación. Así, sin mediación de la antitrombina como en el caso de las HBPM, los ACOD se pueden clasificar en inhibidores directos de la trombina (dabigatrán) o inhibidores directos del factor Xa (los denominados genéricamente “xabanes”, que en el momento actual están representados por rivaroxabán, apixabán y edoxabán). Sus características farmacocinéticas hacen que precisen un apartado especial en las recomendaciones de su manejo, basándose Prevención de ictus en fibrilación auricular I 46 I Tratamiento de ETV: Primera semana Primeros 6 meses 6-12 meses 5 mg/12 h 20 mg/24 h 110-150 mg/12 h 10 mg/12 h 15 mg/12 h* 150 mg/12 h** 5 mg/12 h 20 mg/24 h 2,5-5 mg/12 h 20 mg/24 h (*) Durante las primeras 3 semanas. (**) Misma dosis durante todo el tratamiento después de al menos 5 días de tratamiento con un anticoagulante parenteral. ETV: Enfermedad tromboembólica venosa Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico daciones globales y “de consenso” de manejo de los ACOD, basándonos en la farmacocinética de cada ACOD, en los análisis post-hoc de algunos ensayos clínicos y en los datos preliminares de algunos registros ya publicados23-35. si el aclaramiento de creatinina se sitúa entre 3050 ml/min, se sugiere incrementar el tiempo de supresión de los ACOD: rivaroxabán y apixabán 2 días, dabigatrán 3 días. • En pacientes que van a ser sometidos a una cirugía de moderado-alto riesgo hemorrágico el esquema de supresión se realizará de la siguiente forma: – Aclaramiento de creatinina > 50 ml/min: 2 días para apixabán o rivaroxabán, 3 días para dabigatrán. – Aclaramiento de creatinina < 50 ml/min: 3 días para apixabán o rivaroxabán, 4 días para dabigatrán. – En pacientes que vayan a ser intervenidos de un procedimiento neuroquirúrgico los intervalos de supresión serán al menos los mismos anteriormente citados, pudiendo incrementarse en 24 horas en función de la valoración individual de cada caso. • A pesar de que se ha publicado que la terapia puente parece incrementar el riesgo hemorrágico sin disminuir el riesgo trombótico en estos pacientes y hay autores que no la recomiendan36,37, la evidencia de esta práctica específicamente en pacientes de alto riesgo trombótico (CHA2DS2VASc superior a 5) es muy baja. Por ello, en estos momentos se puede sugerir que en aquellos pacientes con alto riesgo trombótico se valore la realización de terapia puente con una HBPM, suprimiendo el ACOD 5 días antes de la cirugía y administrando la HBPM durante 3-4 días antes de la misma, en función del aclaramiento de creatinina. La reintroducción del ACOD se hará en los días siguientes a la cirugía, manteniendo la anticoagulación con HBPM hasta ese momento. Función renal A los pacientes en tratamiento crónico con alguno de los ACOD, particularmente con dabigatrán, que vayan a ser sometidos a una intervención quirúrgica, se les deberá valorar la función renal en función de su aclaramiento de creatinina. Manejo de los ACOD en cirugía programada (Tabla 6) Para el manejo habitual se recomienda la estratificación del riesgo trombótico y hemorrágico (Tabla 1). • En los pacientes que van a ser intervenidos de una cirugía de riesgo hemorrágico mínimo, como cirugía dental o dermatológica menor, en aquellos pacientes programados para cirugía de cataratas o que se van a someter a un procedimiento endoscópico sin polipectomía, se sugiere mantener el tratamiento anticoagulante con el ACOD hasta 24 horas antes de la cirugía y reiniciarlo lo antes posible. • E n pacientes con bajo riesgo trombótico (CHA2DS2-VASc inferior a 2) y hemorrágico, y en los que además la función renal no esté alterada (aclaramiento de creatinina > 50 ml/min) se sugiere la supresión del ACOD en base al siguiente esquema: rivaroxabán y apixabán 24 horas, dabigatrán 2 días. En estos mismos supuestos, Tabla 6. Intervalos de supresión de cada uno de los ACOD en el periodo perioperatorio, basados en la función renal y en el riesgo hemorrágico de la intervención quirúrgica Tiempo mínimo sugerido de supresión desde la última toma del ACOD Fármaco ClCr (ml/min) Apixabán Rivaroxabán Dabigatrán > 50 30-50 > 50 30-50 Riesgo hemorrágico bajo* 1 día 2 días 2 días 3 días Riesgo hemorrágico moderado/alto 2 días 3 días 3 días 4 días Riesgo trombótico alto Valorar terapia puente con una HBPM Manejo de los ACOD en cirugía urgente no demorable Un aspecto esencial del manejo de los ACOD es la cirugía urgente no demorable. Es importante tener en cuenta las siguientes sugerencias esenciales: • El inicio de la cirugía se demorará, si es posible, al menos 24-36 horas desde la administración de la última dosis del fármaco correspondiente (dos vidas medias). • No se recomienda administrar ningún componente hemostático (plasma fresco, concentrado de complejo protrombínico, factor VIIa) de forma profiláctica. En el caso de que el paciente presente una hemorragia vital como consecuencia *En pacientes con función renal normal sometidos a procedimientos de “muy bajo riesgo hemorrágico”, los ACOD no se interrumpirán, aunque la última toma se deberá hacer un mínimo de 24 horas antes de la cirugía. I 47 I Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico directa o indirecta del tratamiento anticoagulante (por ejemplo, hemorragia cerebral espontánea o traumática) hay que valorar la administración de alguno de los componentes hemostáticos que se consideran a continuación para tratamiento del sangrado. • Se sugiere el inicio de la cirugía con un manejo del eventual sangrado empleando el tratamiento hemostático habitual si fuera necesario. Como guía para el mismo no es adecuado el empleo de los test de coagulación. Sin embargo, su normalidad asegura la competencia hemostática. • No existe, en el momento actual, ningún antídoto comercializado para los ACOD ni ningún hemostático capaz de revertir de forma completa su acción anticoagulante. El control local de la hemorragia (incluyendo la actuación quirúrgica) y el tratamiento de soporte estándar deben ser los aspectos fundamentales para el manejo de la hemorragia asociada a la administración de cualquiera de los ACOD. • Entre los distintos hemostáticos se ha propuesto la administración de concentrado de complejo protrombínico (especialmente en el caso de rivaroxabán o apixabán, a dosis inicial de 25 UI/kg, pudiendo repetirse en caso necesario) o factor VIIa (escasa evidencia). El dabigatrán es dializable, por lo que se puede plantear como opción en su caso. BIBLIOGRAFÍA 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 1. Patel JP, Arya R. The current status of bridging anticoagulation. Br J Haematol. 2014;164:619-29. 2. Douketis JD, Spyropoulos AC, Spencer FA, Mayr M, Jaffer AK, Eckman MH, et al. Perioperative management of antithrombotic therapy. Chest. 2012;141(Suppl2):e326S-e350S. 3. Llau JV, Ferrandis R, López-Forte C. Antiagregantes y anticoagulantes – Manejo del paciente quirúrgico anticoagulado. Cir Esp. 2009;85(Suppl1):7-14. 4. Baron TH, Kamath PS, McBane RD. Management of antithrombotic therapy in patients undergoing invasive procedures. N Engl J Med. 2013;368:2113-24. 5. Tafur A, McBane R, Wysokinski WE, Litin S, Daniels P, Slusser J, et al. Predictors of periprocedural bleeding among patients on chronic anticoagulation. J Thromb Haemost. 2012;10:261-7. 6. Omran H, Bauersachs R, Rübenacker S, Goss F, Hammeerstingl C. The HAS-BLED score predicts bleedings during bridging of chronic oral anticoagulation: results from the national multicenter BNK Online bRiDging REgistRy (BORDER). Thromb Haemost. 2012;108:65-73. 7. Kovacs MJ, Kearon C, Rodger M, Anderson DR, Turpie AG, Bates SM, et al. Single-arm study of bridging therapy with low-molecular-weight heparin for patients at risk of arterial embolism who require temporary interruption of warfarin. Circulation. 2004;110:1658-63. 8. Douketis JD, Johnson JA, Turpie AG. Low-molecular-weight heparin as bridging anticoagulation during interruption of 19. 20. 21. 22. 23. 24. 25. I 48 I warfarin: assessment of a standardized periprocedural anticoagulation regimen. Arch Intern Med. 2004;164:1319-26. Woods K, Douketis JD, Kathirgamanathan K, Yi Q, Crowther MA. Low-dose oral vitamin K to normalize the international normalized ratio prior to surgery in patients who require temporary interruption of warfarin. J Thromb Thrombolysis. 2007;24:93-7. Steinberg BA, Peterson ED, Kim S, Thomas L, Gersh BJ, Fonarow GC, et al. Use and outcomes associated with bridging during anticoagulation interruptions in patients with atrial fibrillation. Circulation. 2015;131:488-94. Clark NP, Witt DM, Davies LE, Salto EM, McCool KH, Douketis JD, et al. Bleeding, recurrent venous thromboembolism, and mortality risksduring warfarin interruption for invasive procedures. JAMA Intern Med. 2015;175:1163-68. Douketis JD, Spyropoulos AC, Kaatz S, Becker RC, Caprini JA, Dunn AS, et al. Perioperative bridging anticoagulation in patients with atrial fibrillation. NEJM DOI: 10.1056/NEJMoa1501035. Gogarten W, Vandermeulen E, Van Aken H, Kozek S, Llau JV, et al. Regional anesthesia and antithrombotic agents: recommendations of the European Society of Anesthesiology. Eur J Anesth. 2010;27:999-1015. Kozek-Langenecker SA, Afshari A, Albaladejo P, Aldecoa C, De Robertis E, Filipescu DC, et al. Management of severe perioperative bleeding - Guidelines from the European Society of Anaesthesiology. Eur J Anesthesiol. 2013;30:1-112. Douketis JD. Perioperative management of patients who are receiving warfarin therapy: an evidence based and practical approach. Blood. 2011; 117: 5044-9. Wysokinski W, McBane II RD. Periprocedural bridging management of anticoagulation. Circulation. 2012;126:486-90. Ageno W, Gallus AS, Wittkowsky A, Crowther M, HylekEM, Palareti G. Oral anticoagulant therapy. Chest. 2012;141(Suppl2):e44S-e88S. Colomina MJ, Diez-Lobo A, Garutti I, Gómez-Luque A, Llau JV, Pita E. Perioperative use of prothrombin complex concentrates. Minerva Anestesiol. 2012;78:358-68. Garcia DA, Crowther MA. Reversal of warfarin: case-based practice recommendations. Circulation. 2012;125:2944-47. Sarode R, Milling TJ, Refaai MA, Mangione A, Schneider A, Durn BL, et al. Efficacy and safety of a 4-Factor Complex Concentrate in patients on vitamin k antagonists presenting with major bleeding: a randomized, plasma-controlled, phase IIIb study. Circulation. 2013;128:1234-43. Sorensen B, Spahn DR, Innherhofer P, Spannagl M, Rossaint R. Clinical review: prothrombin complex concentrates – evaluation of safety and thrombogenicity. Critical Care. 2011;15:201. Rodgers GM. Prothrombin complex concentrates in emergency bleeding disorders. Am J Hematol. 2012;87:898-902. Llau JV, Ferrandis R, Castillo J, De Andrés J, Gomar C, Gómez-Luque A, et al. Manejo de los anticoagulantes orales de acción directa en el periodo perioperatorio y técnicas invasivas. Rev Esp Anestesiol Reanim. 2012;59:321-31. Ferrandis R, Castillo J, De Andrés J, Gomar C, Gómez-Luque A, Hidalgo F, et al. Perioperative management of new direct oral anticoagulants: a question without answers. Thromb Haemost. 2013;110:515-22. Weltermann A, Brodmann M, Domanovits H, Eber B, Gottsauner-Wolf M, Halbmayer WM, et al. Dabigatran in patients with atrial fibrillation: perioperative and periinterventional management. Wien Klin Wochenschr. 2012;124:340-7. Controversias en la prevención de la enfermedad tromboembólica venosa y manejo perioperatorio de los fármacos anticoagulantes en el paciente quirúrgico 26. Sié P, Samama CM, Godier A, Rosencher N, Steib A, Llau JV, et al. Surgery and invasive procedures in patients on long-term treatment with direct oral anticoagulants: thrombin or factor-Xa inhibitors. Recommendations of the Working Group on Perioperative Haemostasis and the French Study Group on Thrombosis and Haemostasis. Arch Cardiovasc Dis. 2011;104:669-76. 27. Pengo V, Crippa L, Falanga A, Finazzi G, Marongiu M, Palareti G, et al. Questions and answers on the use of dabigatran and perspectives on the use of other new oral anticoagulants in patients with atrial fibrilation. Thromb Haemost. 2011;106:868-76. 28. Llau JV, Ferrandis R. Letter by Llau and Ferrandis Regarding Article, “Bridging Evidence-Based Practice and Practice-Based Evidence in Periprocedural Anticoagulation”. Circulation. 2013;127:e616. 29. Gallego P, Apostolakis S, Lip GY. Bridging evidence-based practice and practice-based evidence in periprocedural anticoagulation. Circulation. 2012;126:1573-6. 30. Levy JH, Faraoni D, Spring JL, Douketis JD, Samama CM. Managing new oral anticoagulants in the Perioperative and Intensive Care Unit Setting. Anesthesiology. 2013;118:1466-74. 31. Hidalgo F, Gómez-Luque A, Ferrandis R, Llau JV, De Andrés J, Gomar C, et al. Manejo perioperatorio de los anticoagulantes 32. 33. 34. 35. 36. 37. I 49 I orales directos en cirugía urgente y sangrado. Monitorización y tratamiento. Rev Esp Anestesiol Reanim. 2015;doi: 10.1016/j. redar.2015.01.002. Ferrandis R, Llau JV. Old and new anticoagulants: what are the guidelines saying? Reg Anesth Pain Med. 2014;39(Suppl1) :e63-e65. Faraoni D, Samama CM, Ranucci M, Dietrich W, Levy JH. Perioperative management of patients receiving new oral anticoagulants. Clin Lab Med. 2014;34:637-54. van Veen JJ, Makris M. Perioperative management of anti-thrombotic therapy. Anaesthesia. 2015;70(Suppl 1):58-67. Breuer G, Weiss DR, Ringwald J. “New” direct oral anticoagulants in the perioperative setting. Curr Opin Anesthesiol. 2014;27:409-19. Beyer-Westendorf J, Forster K, Pannach S, Ebertz F, Gelbricht V, Thieme C, et al. Rates, management and outcome of rivaroxaban bleeding in daily care: results from the dresden NOAC Registry. Blood. 2014:124:955-62. Schulman S, Carrier M, Lee AYY, Shivakumar S, Bklostein M, Spencer FA, et al. Perioperative management of dabigatrán: a prospective cohort study. Circulation. 2015;132:167-73. Patrocinado por: Investigamos para crecer en salud