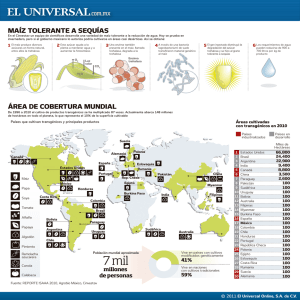
Descargar - Universidad de Córdoba
Anuncio

Organismos modificados genéticamente El maíz proviene del Teosinte, una hierba incomestible que los antiguos norteamericanos cultivaron durante siglos hasta lograr las características actuales Soy natural. Mi padre es una mazorca ¡Acéptalo, eres un mutante! ¡YO SOY TU PADRE! ¡NOOOOOOOOO! José J. Aguilar Gavilán Departamento de Microbiología La 1ª bacteria productora de insulina humana (Escherichia coli transgénica) se comercializó en 1982. Biotecnología ü Organismos modificados genétcamente (OMGs) ü Proteínas recombinantes ü Genomas recombinantes Tabaco resistente a glifosato (1ª planta transgénica, cultivada en 1986 en Francia y en los EE.UU.). Recombivax-HB (1º vacuna humana recombinante autorizada -1986-). El antígeno de superficie del virus B de la hepatitis que incluye se obtiene a partir de una levadura (Saccharomyces cerevisiae) transgénica. Tomates Flavr Savr, ARN inhibidor gen poligalacturonasa (Calgene, 1994) Colza productora de ácido estearidónico (18:4n-3) (gen de Cerdos productores de acido - la ∆6 desaturasa de Borago linolénico (18:3n-3) (gen fat de officinalis). Monsanto, 2008. Caenorhabditis elegans), Harvard Medical School, 2006 Microorganismos de diseño y proteínas recombinantes de interés médico Hormonas (insulina) Páncreas La insulina humana fue la 1ª molécula recombinante introducida en el mercado con fines terapéuticos (Escherichia coli transgénica, 1982. Duodeno Se extrae un plásmido (doble cadena de ADN circular) de E. coli Se aísla el gen de la insulina humana (1922) Se introduce el gen en el plásmido, que se convierte en un ADN recombinante (1982) La insulina útil para tratar la diabetes El ADN recombinante se introduce de nuevo en E. coli Al multiplicarse las células bacterianas liberan gran cantidad de insulina humana recombinante Antígenos vacunales (HBsAg, antígeno de superficie del virus de la hepatitis B) Virus de la hepatitis B (HBV) 1981 1986 1990 La 1ª vacuna humana recombinante frente a la hepatitis B fue autorizada en 1986. El antígeno de superficie del virus B de la hepatitis (HBsAg), que se ensambla en partículas esféricas de 16-25 nm. parecidas a virus, se obtiene a partir de la levadura Sacharomyces cerevisiae transgénica. Organismos remodelados genéticamente Sitio de clonación múltiple (lugar de inserción del transgen de interés) n Se denomina organismo modificado genéticamente (OMG) Promotor a “cualquier ser vivo cuyo material genético ha sido modi- del gen de ficado mediante técnicas de Ingeniería Genética”. Según la interés modificación genética experimentada se establecen 3 tipos de OMGs, a saber: los “transgénicos”, que expresan genes que pertenecen a otra u otras especies distantes y no compatibles sexualmente; los “cisgénicos”, que albergan en su genoma genes provenientes de especies relacionadas y sexualmente compatibles, y los “intragénicos”, sin portar genes extraños en su genoma, muestran modificado o suprimido el paOrigen de trón de expresión de alguno o varios de sus genes. replicación n Entre las aplicaciones de los OMGs figuran: autónomo Ø La posibilidad de estudiar a nivel molecular el desarrollo embrionario y su regulación. Ø Estudiar la función de genes específicos. Ø Manipular de forma específica la expresión génica in vivo para incrementar la síntesis de determinada proteína. Ø Su uso como centros de producción de proteínas humanas. Ø Resistencia a infecciones, herbicidas, metales pesados, etc. Ø Tratamiento del cáncer (viroterapia). Ø Alimentos saludables y/o más nutritivos. Ø Vacunas comestibles. Ø La corrección de errores innatos de metabolismo mediante terapia génica. Ø Donación de órganos para xenotrasplantes. Ø Perpetuación de especies amenazadas con extinguirse. Promotor del gen de selección Vector de clonación Gen de selección Trangénesis etiquetada: genes de selección n Genes de resistencia a antibióticos (gen KanR –a kanamicina-) n Genes de enzimas (gen LacZ, β-Galactosidasa) 5-bromo-4-cloro-3-indolgalactopiranósido (incoloro) 5-bromo-4-cloro-3hidroxindol -D- 5,5'-dibromo-4,4'-dicloro-índigo (azul insoluble) Galactosa n Genes de bioluminiscencia (gen GFP) Ratones portadores del gen GFP (Mayo 1999) Roger Tsien, Martin Chalfie y Osamu Shimomura (Nobel de Química 2008, estudios sobre el gen GFP de la medusa Aequorea victoria). ANDi (macaco que lleva Titíes portadores del el gen GFP, Enero 2001) gen GFP (Mayo 2009) Gato doméstico en cuyo genoma, se introdujeron dos genes: uno de resistencia frente al Virus de la inmunodeficiencia felina (FIV), gen TRIMCy del macaco rhesus, y el gen GFP, como marcador del éxito de la transgénesis (Septiembre de 2011). Técnicas de utilidad para crear nuevas variedades de plantas Hibridación convencional Mutagénesis natural Transgénesis Combinaciones de genes de otras especies Radiación Mutágenos químicos Cultivo célular / tisular Planta o cultivo de células o tisular Estrategias de ingeniería genética vegetal: transgénesis, intragénesis y cisgénesis CISGÉNESIS TRANSGÉNESIS Transferencia de genes desde especies distantes, no compatibles sexualmente Cultivo INTRAGÉNESIS Transferencia de genes desde especies relacionadas, compatibles sexualmente Especie distante Modificación directa del gen diana o de su expresión a través de ARNs reguladores Cultivo Cultivo CRISPR-Cas9 Tipo silvestre Modificación intragénica del ADN Cultivo celular/ tisular Nuevo cultivo Cultivo celular/ tisular Nuevo cultivo Cultivo celular/ tisular Nuevo cultivo Caracterización del sistema CRISPR n En agosto de 2003, Juan Francisco Martínez Mojica (Elche, 1963), que firma sus trabajos como “Francis Mojica”, investigador de la Universidad de Alicante, observando cultivos microbianos procedentes de las salinas de Santa Pola, tras años de estudiar las secuencias cortas palindrómicas que aparecen de forma regular dispersas en el ADN de procariotas (conocidas como secuencias CRISPR, siglas de “Clustered Regularly Interspaced Short Palindromic Repeats” –mostradas en el esquema inferior del locus 1 CRISPR de la cepa SF370 de S. pyogenes-), secuencias que otros investigadores simplemente se limitaron a describir, se percató de la presencia entre ellas de otras secuencias –conocidas como “espaciadoras”- que eran trozos de ADNbc vírico y de otros genomas de invasores que habían infectado la célula. De pronto, Mojica comprendió que las bacterias utilizaban esta estrategia como método para inmunizarse. Su grupo de investigadores llevaba desde 1995 detrás de esa respuesta, que publicaron en 2005 y que hoy se cita por los mejores especialistas mundiales en Microbiología como un hito imprescindible para que las aplicaciones en manipulación genética derivadas del sistema CRISPR mereciesen, tras ser 2 años finalista, que la revista científica estadounidense Science declarase como “descubrimiento del 2015” a esta revolucionaria técnica de edición genética. n A pesar de que el Dr. Mojica figuró en las quinielas de candidatos al Nobel de 2015, no lo obtuvo, aunque son muchos colegas los que defienden su candidatura por la enorme repercusión de su descubrimiento Locus 1 CRISPR de la cepa SF370 de Streptococcus pyogenes Cortas repeticiones directas tracrRNA Cas9 Espaciadores Cas1 Cas2 Csn2 1.Transcripción de pre-crRNA pre-crRNA 2.Maduración por RNasa III y otra(s) nucleasa(s) desconocida(s) Protoespaciador 4.Rotura de PAM ADNbc por crRNA maduro Cas9 Cas9 t r a c r R N A3.Reconocimiento procesado del ADNbc diana El sistema remodelado de edición génica CRISPR-Cas9 A sgRNA (crRNA + horquilla de unión + tracrRNA) horquilla de unión crRNA B tracrRNA ADN diana protoespaciador región adyacente al protoespaciador La técnica, patentada en 2012 por la francesa Emmanuelle Charpentier (A), en la Universidad de Umeå (Suecia), y por la estadounidense Jennifer Doudna (B), en la Universidad de California en Berkeley (EE.UU.), consiste en sustituir el par tracrRNA: crRNA por un único ARN guía (sgRNA, siglas de “single guide RNA”) ARN de diseño generado al fusionar la secuencia protoespaciadora (en verde) del extremo 5’ del crRNA –que actuará como guía encargada de interaccionar con el ADN a editar- con la región del ARN de tracrRNA (en marrón) -encargada de asegurar la interacción de CRISPR con Cas9-, cuyos nucleótidos corresponden al tracrRNA codificado por Streptococcus pyogenes, utilizando como nexo de unión una corta secuencia –conocida como horquilla de unión (en púrpura)-. De esta forma, la secuencia protoespaciadora puede modificarse a voluntad para poner en contacto a Cas9 con cualquier secuencia del ADN a editar. La técnica CRISPR-Cas9, es simple, barata, eficaz y fiable, y confiere al ser humano la capacidad de manipular su propio código genético y el de cualquier otro ser vivo, con una facilidad sin precedentes. Al permitirnos cortar fragmentos defectuosos de ADN, abre la puerta, tanto a la posible curación de un sinfín de enfermedades hereditarias, como a su prevención antes de que aparezcan. Utilidad del sistema CRISPR/Cas9 para hacer bioingeniería* El trabajo con el sistema CRISPR, es similar a la labor de edición de un procesador de textos: “puedes cambiar a voluntad desde una letra –una base nucleotídica- hasta un párrafo -un gen-”. Secuencia de ADN Los dos extremos del ADN se vuelven a pegar a través de una unión final no homóloga (via non-homologous end joining – NHEJ-) El hueco se rellena usando un molde por reparación directa homóloga (via homology directed repair – HDR-) * La técnica CRISPR está revolucionando no solo a los laboratorios de biotecnología vegetal sino a cualquier laboratorio de genética, por su simplicidad y enorme eficacia. Se conoce, sobre todo, porque permite manipular el genoma humano. Es la gran esperanza actual para corregir las 5.000 enfermedades hereditarias humanas descritas, entre las que se incluyen enfermedades raras que, a pesar de afectar cada una de ellas a pocas personas, suponen en conjunto un grave lastre sanitario para una fracción significativa de la población. Cerdos transgénicos aptos para xenotrasplantes n Desde que, Christiaan Barnard realizó en 1967 el primer trasplante de un órgano a un humano, la cada vez mayor demanda de órganos para trasplantes en humanos y la escasez de donantes llevó a considerar el xenotrasplante (empleo de órganos provenientes de otra especie). Entre los animales donantes destacan los cerdos: son fáciles de criar y manejar; el tamaño de sus órganos (como por ejemplo, hígado, corazón, riñones y pulmones) es similar al de los órganos humanos y también tienen una gran semejanza inmunológica con nosotros. ¿Es el rechazo hiperagudo de órganos porcinos un problema solucionable? En la ciudad del Cabo, el cirujano surafricano Christiaan Barnard realizó el 3 de diciembre de 1967 el 1er transplante de corazón a un varón negro compatriota suyo, llamado Naki. Ø PPL Therapeutics (Edimburgo, Escocia) logró el 5 de marzo de 2000 el nacimiento de Millie, Christa, Alexis, Carrel y Dotcom, los primeros cerdos clónicos del mundo aptos como donantes. Mediante Ingeniería Genética se introdujo en el óvulo fecundado de una cerda, el gen antisentido específico para el ARN mensajero del gen GGTA1 (gen implicado en la producción del rechazo hiperagudo) y luego éste se implantó en el útero de una cerda preparada hormonalmente para la gestación. Ø En julio de 2011, científicos surcoreanos crearon un cerdo, de nombre Somang-i, diseñado genéticamente para producir un antígeno que minimiza el riesgo de que el paciente humano receptor sufra un rechazo hiperagudo al recibir cualquiera de sus órganos. El xenotrasplante de órganos de cerdo a humanos, cada vez más viable ! Incluso en España, el país líder en trasplante de órganos, hay siempre más demanda que oferta de ese material vital, y el problema es aún peor en otros países. El cerdo se considera una de las fuentes más prometedoras de órganos, pero las investigaciones están paradas porque existe un grave problema: su genoma contiene docenas de retrovirus que pueden activarse e infectar al receptor del trasplante. Ø El genetista George Church y sus colegas de la Facultad de Medicina de Harvard, el Instituto Wyss de Ingeniería Inspirada en la Biología (ambos en Boston) y la Universidad de Zhejiang en Hangzhou (China), han utilizado la técnica CRISPR-Cas9 de edición genómica para inactivar todas las copias de los posibles 62 genomas retrovirales que están integradas en el genoma del cerdo. Presentan sus resultados en octubre de 2015 en Science. La CRISPR-Cas9 borra de un plumazo los 62 retrovirus del cerdo, rompiendo una secuencia extremadamente conservada en los 62 retrovirus porcinos, presente en la región central del gen pol (es, junto a los genes gag y env, uno de los 3 genes que permiten a cualquier retrovirus perpetuarse en su hospedador) –la secuencia GATACCA delecionada corresponde al centro catalítico de la actividad enzimática que permite a los retrovirus convertir su ARNmc genómico en ADNbc-, un paso esencial para los proyectos de utilizar ese animal como fuente de órganos para trasplantes. Esos retrovirus están integrados en el genoma del cerdo como provirus, y pueden reactivarse tras un trasplante. Gracias a CRISPR, eso ya no será un problema. n Además de su potencial uso para manipular el genoma humano, el sistema de edición génica CRISPR/Cas9 también tiene muchos otros usos. El gran poder de CRISPR es que se basa en el mismo centro lógico de la genética, la complementariedad entre las bases del ADN (A con T, C con G), que le permite dirigirse contra una secuencia concreta (como por ejemplo, GATACCA...) para modificarla o destruirla. OMGs, problemas legales, éticos y morales n Siempre que se habla de manipulación genética surgen dudas legales, y reparos éticos y morales, a los que se une la “guerra” de patentes desatada por la tecnología usada, alrededor de la cual, como por ejemplo ocurre con el sistema CRISPR-Cas9, puede haber enormes intereses económicos. , En abril de 2014, Feng Zhang y el Broad Institute obtuvieron la 1ª entre varias patentes generales que cubren el uso de CRISPR: ella les otorga los derechos de uso en animales y humanos, y en cualquier criatura que no sea una bacteria. A partir de ahí, se ha desatado una batalla legal que “podría retrasar la llegada de los importantes beneficios que esta técnica puede aportar a la salud humana”. n Aunque hasta la fecha no se ha autorizado ningún cultivo remodelado genéticamente con el sistema CRISPR-Cas9, su versatilidad ha abierto la polémica de si los cultivos generados no solo por esta sono por cualquier otra técnica diferente a la transgénesis deben ser considerados o no OMGs. La “cisgénesis” y la “intragénesis” se vislumbran como alternativas válidas a la “transgénesis”, frente a las que cabría esperar que se estableciesen procesos de regulación menos estrictos que los que afectan a la transgénesis. La respuesta a ambas alternativas, por el Departamento de Agricultura de los EE.UU. (USDA, siglas de “United States of American Department of Agriculture”) y por la Autoridad Europea de Seguridad Alimentaria (EFSA, siglas de “European Food Safety Authority”), ha sido diferente. Ø El USDA, coincidiendo con la propuesta hecha en 2011 por la Agencia de Protección Ambiental (EPA, siglas de “Environmental Protection Agency”) de EE.UU., admite que “los riesgos de las plantas obtenidas por cisgénesis son similares a los de las obtenidas por mejora convencional”, por lo que defiende que “los cultivos cisgénicos que expresen agentes fitoprotectores no deben someterse a regulación”. Por lo que respecta a la intragénesis, el USDA dice: “como no se puede distinguir una mutación programada ligada a un proceso de intragénesis de una mutación natural, los cultivos surgidos de ambas mutaciones no son OGMs”. También afirma que “si un gen es retirado usando los propios mecanismos de reparación celulares, la variedad intragénica surgida tampoco es un OMG”. Ø La EFSA considera: que “los riesgos de las plantas obtenidas por cisgénesis son similares a los de las obtenidas por mejora convencional”, coincidiendo con el USDA, pero discrepa en lo referente a los cultivos intragenéticos: “los riesgos inherentes a la intragénesis sí se deben tener en cuenta, y se han de someter a una regulación tan estricta como la aplicada a los transgénicos”. n El 7 de diciembre de 2014, el Departamento de Agricultura de EE.UU. (USDA, siglas de “United States of Americam Department of Agriculture”) comunicaba que la patata “Innate” no debía ser considerada como un producto “regulado” por la normativa aplicada a los OMGs que potencialmente pueden provocar problemas ambientales o de salud humana. De esta forma, en EE.UU. –contrariamente a lo que ocurriría en la UEInnateTM “Innate” es considerada como una patata cultivable y apta para el consumo humano sin ningún otro tipo de regulación especial. En marzo de 2015, la Administración de Drogas y Alimentos de EE.UU. –FDA- recordaba que, tanto la Convencional patata “Innate” como la manzana “Artic”, son tan seguras y nutritivas para el consumo humano como lo son sus respectivas variedades convencionales. Convencional ArticTM n “Innate”, aprobada en EE.UU. en enero de 2013, no es una patata transgénica, pues no lleva genes de otras especies: se ha obtenido modificando genes propios mediante intragénesis, por tecnología de ARN interferente. Entre sus propiedades destaca el que, además de poder cultivarse en las mismas condiciones que la patata convencional, aventaja a esta en varios aspectos, a saber:1º) No pardea al exponerla al oxígeno; 2º) es menos susceptible a mostrar oscurecimientos (ligados a la actuación de la polifenol oxidasa), ocasionados por golpes o presión durante la recolección o almacenamiento, y 3ª) muestra niveles más bajos de azúcares reductores y de asparagina, una cualidad que sin dudas es su mejor baza (cuando la patata se fríe, la asparagina se convierte en acrilamida, una sustancia potencialmente cancerígena que se forma en el cocinado de productos con almidón). Ø La empresa que desarrolló esta patata, JR. Simplot, importante proveedor de patata congelada de McDonalds, pensó que a su cliente le encantaría ofertar una patata frita menos cancerígena. El caso es que a McDonalds no le convenció que se les asociara con transgénicos y no aceptó a Innate. Simplot decidió que, aprovechando el que no se pardea al oxidarse, la venderían precortada en paquetitos. En vista de que vender salud no les dio mucho resultado, Simplot desarrolló una nueva versión de Innate, conocida como “Innate 2”, una patata que incorpora otra cualidad muy interesante desde el punto de vista agronómico: su resistencia al tizón tardío, una enfermedad devastadora causada por el protista peronosporáceo Phytophthora infectans, haciéndola atractiva a agricultores que, al fin y al cabo, son los que compran la semilla. en los EE.UU. Alimentos y cultivos transgénicos n La modificación genética de los organismos que constituyen la dieta cotidiana de la humanidad ya es un hecho, aunque no falta controversia al respecto: frente a los que defienden sus múltiples beneficios, los llamado pro-transgénicos, se alza la voz de los anti-transgénicos, personas y colectivos (mayoritariamente organizaciones ecologistas) que cuestionan su eficacia y les atribuyen varios peligros, no solo para la salud sino para el medio ambiente (incluidos la intoxicación con residuos del herbicida frente al que son tolerantes o con el bioinsecticida que producen). Aunque, en general, podemos afirmar que los alimentos modificados genéticamente (alimentos MGs) se consideran seguros (no existen informes científicamente contrastados de enfermedades o lesiones debido a estos alimentos), no ha habido pruebas suficientes para garantizar la total seguridad. Cada alimento MG nuevo tendrá que evaluarse de manera individual. n En la década de los 90 aparecen en los mercados de varios países alimentos MGs, ello suscitó temores y reticencias por parte de los consumidores, ciertas organizaciones no gubernamentales (ONGs) y algunos estados (particularmente los miembros de la UE). n Los alimentos transgénicos pueden ser clasificados en dos grupos: Ø Los que llegan a la mesa del consumidor en su forma original (actualmente se encuentran en el mercado tomates, patatas, hortalizas, yogures y otros lácteos fermentados). Ø Los que son utilizados como materia prima para elaborar otros alimentos (los que se nutren de los productos y/o aditivos derivados de la soja y del maíz modificada genéticamente son un buen ejemplo de esta segunda categoría). AquAdvantage ¿el 1er animal transgénico apto para el consumo humano? Ø MetaMorphix Incorp. (Universidad Johns Hopkins, Baltimore, EE.UU.). Manipulación del gen regulador de la miostatina: en 2011 obtienen pollos transgénicos con una masa muscular un 50% superior al pollo silvestre. n El salmón transgénico AqAdvantage, desarrollado por la compañía de biotecnología acuática AquaBounty Technologies (Waltham, Massachusetts, EE.UU.), con el mismo sabor, textura y propiedades nutritivas que el salmón común o del Atlántico del que deriva, con la ventaja de crecer el triple de rápido y alcanza su tamaño final en la mitad de tiempo: 1,5 años vs. 3 años. Ø Se creó usando 3 especies: el salmón común (Salmo salar), el abadejo del océano (Zoarces americanus, llega a medir más de 1 m. y pesar más de 5 kg), y el salmón chinook del Pacífico (Oncorhynchus tshawytscha), la especie de salmón más grande conocida. Salmón Chinook Gen de crecimiento rápido Abadejo Gen de crecimiento a cualquier temperatura Óvulo fertilizado Salmón del Atlántico Salmón transgénico n A pesar de la gran variedad de animales transgénicos obtenidos (ratones, gatos, ovejas, cerdos, terneros e incluso simios) tras 23 años de investigación, hubo que esperar hasta noviembre de 2015 para que la Administración de Drogas y Alimentos de los EE.UU. (FDA, siglas de “Food and Drug Administration”) aprobara el 1er animal transgénico destinado al consumo humano. Se trata de “AquaBounty (AquAdvantage® GE Salmon)”, un salmón común 3 veces más grande y que crece 2 veces más rápido que su similar natural. Es un pez híbrido, de aspecto similar al salmón común, con dos genes ajenos, uno de la hormona del crecimiento del salmón real (para que crezca más rápido) y otro del pez anguila (para que crezca todo el año), estos dos genes son los que permiten acelerar su crecimiento. Ø La FDA, en septiembre de 2010, admitió que no había ninguna razón científicamente válida para prohibir la producción y consumo del pez. Ø El 19 de noviembre de 2015, la FDA autorizó la venta y consumo de este salmón en los EE.UU. Ese mismo día, el CFS (siglas de “Centre for Food Safety”) denunció tal autorización, aduciendo que se trataba de un peligroso contaminante medioambiental. n En la actualidad son 27 los cultivos transgénicos autorizados. Estos se utilizan para fines diversos, a saber: alimentarios (soja, maíz, arroz, trigo, patata, tomate, remolacha, judías, endivia, berenjena, calabacín, papaya, melón, ciruelo, remolacha y caña azucarera), forrajeros (alfalfa y Agrostis), textiles (algodón y lino), oleaginosos (distintas variedades de colza), flores (clavel, petunia, rosa) y otros, como la pimienta dulce, el chopo o el tabaco. Vegetales transgénicos Desde 1983 (obtención de la 1ª planta cultivada transgénica:un tabaco resistente a la kanamicina), hasta la actualidad, son muchos los cultivos que han recibido el visto bueno para ser explotados comercialmente. Entre los objetivos a cumplir figuran: n Aumentar la productividad de los cultivos convertidos en resistentes a plagas, enfermedades, herbicidas, sequías, suelos de elevada salinidad, etc. Patatas Bt (productoras del bioinsecticida Cry del Bacillus thuringiensis, 1995). Soja transgénica (resistente al gliofosato, 1996) Algodón Bt (resistente al gusano del algodón, Helicoverpa zea, 1996). n Incrementar la calidad nutricional del producto mediante la mejora de su aspecto, de su contenido nutricional o retrasando la maduración de frutos para ampliar el tiempo de almacenamiento. ü El 1 de Julio de 1994 se aprueba en los EE.UU. la comercialización del 1er alimento modificado genéticamente, los tomates Flavr Savr, creados por la compañía biotecnológica californiana Calgene. n Hacer posible la regeneración de suelos contaminados por metales pesados, transfiriendo a las plantas genes microbianos de tolerancia a concentraciones elevadas de estos elementos. n Producir medicamentos (anticuerpos monoclonales, vacunas y otras proteínas terapéuticas). n En la actualidad entre las plantas transgénicas cultivadas en todo el mundo destacan el tabaco, la soja, el maíz, el algodón, la alfalfa, la colza, la patata, la papaya, el tomate, la berenjena, la remolacha, la caña de azúcar, el arroz, el pimentonero dulce y el calabacín. Bt-Brinjal (1ª berenjena transgénica autorizada en Bangladesh -octubre 2013-). Contiene el gen Cry1Ac procedente de la bacteria Bacillus thuringiensis, que confiere resistencia a una de las plagas más terribles para este cultivo en Asia, el taladro, plaga causada por la oruga de Cortyna xanthenes, que ataca tanto al tallo de la planta como a la berenjena. Tabaco resistente a glifosato (1ª planta transgénica, cultivada en 1986 en Francia y EE.UU.). ¿Es el tomate Raf un alimento transgénico? Propiedades: Ø Resistencia a Fusarium oxysporum lycopersici. Ø Tolerancia al agua salina. Ø Adaptado a crecer en invernaderos. Tomate Raf Ø Excelente sabor y textura. El tomate “Raf” no es un transgénico: es una variedad o cultivar de tomate (Solanum lycopersicum) obtenida por selección artificial sobre los tomates naturales que en la Vega de Almería se plantan desde 1969, concretamente sobre la variedad de tomate conocida como “muchamiel”. Obtención en horticultura de variedades coloreadas imposibles de lograr mediante cruzamiento o hibridación Tomate azul (gen de la antocianina, del arándano azul). Inst. Biología Molecular y Celular de Plantas de Valencia, 2006 Rosa azul (gen de la delfidina de la petunia y gen silenciador de la cianidina, responsable del color rojo natural de Rosa gallica). Florigene, 2004 Fresa azul (resistente al frío, expresa el gen AFP de la platija del Atlántico –Liopsetta glacialis-). Universidad de Cornell (Ithaca, Nueva York), 2012 Clases de plantas transgénicas: tolerancia a herbicidas n Aunque a las plantas convencionales se les podrían conferir al remodelarlas genéticamente nuevas propiedades (tolerancia frente a un herbicida; resistencia frente a una enfermedad/plaga; resistencia a la sequía; mejorar su calidad o su valor nutritivo; incrementar la productividad de sus cultivos, etc.-), la resistencia a herbicidas es la modificación genética más común en las plantas transgénicas empleadas en agricultura comercial, pues controlar las malas hierbas es vital para la productividad y la salud del cultivo. Ø Las plantas resistentes a herbicidas forman parte de una nueva manera de controlar las malas hierbas: la utilización de un herbicida, junto con las semillas de un cultivo resistente a ese herbicida. El producto utilizado es generalmente no selectivo y resulta eficaz con 1 o 2 aplicaciones. Este sistema simplifica mucho el trabajo (sobre todo si el agricultor opta por un monocultivo resistente a herbicida) y permite el ahorro de combustible, al disminuir las labores de lucha contra las malezas (malas hierbas). El uso de herbicidas no es ni mucho menos exclusivo de los cultivos transgénicos: de hecho, es ampliamente utilizado en el “laboreo de conservación”, nombre dado a las prácticas agrícolas que buscan una producción sostenible. Ø Actualmente, el ingrediente activo de los herbicidas que más se utilizan es el glifosato (patentado en 1990 por Monsanto y comercializado como Roundup®) –absorbido por las hojas y no por las raíces, mata a la planta debido a que suprime su capacidad de generar aminoácidos aromáticos– o el glufosinato amónico –fosfinotricina- N-(fosfonometil) glicina (glifosato) (ingrediente activo de diversos herbicidas no selectivos que fabrica Bayer CropScience, como Basta®, Finale®, Rely® y Liberty®) -inhibe irreversiblemente a la glutamina sintetasa, una enzima necesaria para la producción de glutamina y para la detoxificación del amonio, por lo que su aplicación reduce en las plantas tratadas los niveles de glutamina y eleva los de amonio en los tejidos, deteniendo (RS)-2-amino-4-(hidroximetil fosfonoil) ácido butanoico (glufosinato amónico) la fotosíntesis, lo que provoca la muerte de la planta-. Ø Algunos microorganismos codifican en su genoma una enzima que degrada e inactiva al glifosato, la 5-enolpiruvil-shiquimato-3-fosfato sintetasa (EPSPS), lo que les confiere resistencia frente al herbicida. La versión del gen EPSPS usada en cultivos vegetales modificados por Ingeniería Genética se aisló de la cepa de Agrobacterium tumefaciens CP4 (CP4 EPSPS) resistente a glifosato. Este gen CP4 EPSPS fue clonado y transfectado a la soja, patentada por Monsanto como evento “40-30-2”, una soja resistente al glifosato (soja RR, de “Roundup Ready”) cuya comercialización comenzó en 1996. Agrobacterium tumefaciens N-(fosfonometil) glicina (glifosato) Ø Algunos microorganismos codifican en su genoma una enzima conocida como “fosfinotricina acetil transferasa” (PAT, de “Phosphinothricin acetyl transferase”), que convierte al L-glufosinato del glufosinato amónico en una forma acetilada sin actividad herbicida, lo que les confiere tolerancia frente al herbicida. Dos microorganismos del suelo, Streptomyces hygroscopicus y Streptomyces viridochomogenes, albergan en su genoma el gen que codifica la PAT, se trata, respectivamente del gen bar y del gen pat: de esta forma se protegen frente a la acción tóxica de la fosfinotricina que ellos mismos producen. La versión del gen bar usada en cultivos vegetales modificados por Ingeniería Genética (cultivos HR, de “Herbicide Resistence”) proviene de la cepa ATCC21705 de S. hygroscopicus, o se trata de la versión pat procedente de la cepa Tu 494 de S. viridochromogenes. Streptomyces hygroscopicus (RS)-2-amino-4-(hidroximetil fosfonoil) ácido butanoico (glufosinato amónico –fosfinotricina-) n BASF diseñó en 2009 la soja BPS-CV127-9, una soja MG tolerante a herbicidas de la familia de las imidazolinonas (como el imazetapir, registrado por BASF como PIVUT®). Esta soja se ha obtenido por medio de la introducción del gen csr1-2, de la planta Arabidopsis thaliana: gen que codifica una proteína que le confiere tolerancia porque induce una mutación sustitutiva (la serina de la posición 653 se sustituye por asparagina) en la acetolactato sintetasa, la enzima inhibida por las imidazolinonas, esencial en el proceso de síntesis en la planta de los aminoácidos de cadena ramiÁcido 5-etil-2-(4-isopropil,4-metil, 5-oxo-2ficada (valina, leucina e isoleucina). imidazolin 2 il nicotínico (Imazetapir) Absorbidas por las raíces y las hojas de las plantas, las imidazolinonas vinculan su toxicidad con el déficit de aminoácidos de cadena ramificada: este provoca una reducción del crecimiento de las plantas susceptibles y de la elongación de las hojas, clorosis, necrosis y su muerte. n En Canadá Monsanto desarrolló una soja tolerante al herbicida Dicamba (ácido 3,6-dicloro-2-metoxibenzoico), patentada como MON87708, a partir de variedad comercial de soja (A3525) en la que -por ingeniería genética- se introdujo el gen DMO (gen de la monooxigenasa dicamba), procedente de la bacteria Stenotrophomonas maltophilia. Esta enzima cataliza la desmetilación de Dicamba, para generar dos compuestos sin poder herbicida: ácido 3,6diclorosalicílico y formaldehido. Dicamba es un herbicida postemergente sistémico selectivo, que se absorbe por hojas y raíces, trasladándose vía floemática y xilemática. Controla malezas de hoja ancha resistentes a los 2 herbicidas más utilizados en su control, 2,4-D (ácido 2,4-diclorofenoxiacético) y MCPA (sal sódica del ácido 2-metil-4-cloro-fenoxi-acético). Puede utilizarse solo o en mezclas con otros herbicidas sobre diferentes cultivos en distintos estados de desarrollo. Ácido ácido 3,6-dicloro-2metoxibenzoico (Dicamba) Clases de plantas transgénicas: resistencia a plagas n Las portadoras de una modificación que hace que segreguen sustancias dañinas para las plagas que las amenazan (albergan un gen extraño que libera una toxina que mata al agente causal de la plaga). Un ejemplo destacado es el maíz Bt que alberga el gen bacteriano Bt (el gen de la toxina Cry, del Bacillus thuringiensis: el componente del cuerpo parasporal, una estructura cristalina tóxica eficaz como bioinsecticida) que le confiere resistencia frente al taladro del maíz (plaga causada por el ataque a la mazorca y al tallo del maíz por las orugas de los lepidópteros Ostrinia nubilalis y Sesamia nonagrioides), considerada como una de las plagas más feroces del maíz y la de mayor repercusión económica para la producción del maíz en España (sobre todo en el valle del Ebro). Bacillus thuringiensis Cuerpo parasporal –cristal(toxina Bt –toxina Cry-) A. Cristal (toxina Bt) Endospora B. Disolución del cristal y activación de toxinas -endotoxina Protoxina Espora El gen Bt se inserta en el maíz Toxina activada C. Las toxinas se unen a receptores del epitelio digestivo Receptor Toxina Bacillus thuringiensis Perforación del epitelio D. Germinación de esporas y proliferación de la bacteria El cultivo es atacado por el barrenador o taladrado europeo del maíz (Ostrinia nubilalis) El insecto muere cuando se alimenta de alguna parte de la planta n La creencia de que las plantas transgénicas rinden mucho más y a un coste relativamente más bajo que el de los cultivos tradicionales no es compartida por muchos científicos (entre ellos incluso figuran algunos no alineados con Greenpeace, el bando ecologista). n Hay una crítica a los cultivos transgénicos difícil de rebatir: desde que en 1994 se aprueba la comercialización del 1er alimento modificado genéticamente, los tomates Flavr Savr, los transgénicos no han cumplido las expectativas respecto al mundo pobre. Se admite que, al menos hasta hace poco tiempo, el avance transgénico se ha guiado más por intereses comerciales que por la vieja promesa de combatir la hambruna en el mundo. n En los últimos años, la biotecnología de cultivos transgénicos ha centrado su interés en cultivos MGs de primera necesidad, que sean capaces de: paliar el hambre y la enfermedad; que se adapten a las necesidades de los agricultores y a sus condiciones climáticas y de suelo, para ser más productivos y competitivos, al tiempo que más sostenibles con el ambiente. Así mismo, la denominada biotecnología agrícola moderna persigue el desarrollo de cultivos/alimentos MGs que tengan un mayor contenido nutricional y que contribuyan a mejorar la calidad de vida de los consumidores. Como ejemplos destacados podríamos señalar: el maíz fitasa; los arroces trangénicos (incluidos los Bt y el Golden Rice), y las naranjas y bananas enriquecidas en carotenos. La fitasa es un aditivo para piensos animales obligatorio por razones ambientales en la UE, el Sureste Asiático, Corea del Sur, Japón y otras partes del mundo. Se utiliza para degradar el ácido fítico, la forma de almacenamiento natural del fósforo (P) en plantas. La fitasa puede aumentar hasta en un 60% la absorción del P en los animales. Con este cultivo transgénico, ya no es necesario comprar la fitasa y el maíz por separado. Este maíz rico en fitasa también reduce la contaminación por fosfatos generada por los residuos animales y por la excesiva utilización de fertilizantes. ¿Cómo paliar el impacto medioambiental de las purinas? Los granos de los cereales de los que un cerdo se alimenta (incluidos maíz, soja y cebada) contienen entre el 50 y el 75% de su fósforo en forma de ácido fítico, que al no poder ser digerido por el animal, se termina concentrando en sus heces, con un impacto ambiental desfavorable cuando contamina los acuíferos. Para hallar solución a los problemas medioambientales que ocasiona la gestión de las purinas (parte líquida que rezuma del estiércol) en las granjas de cerdos, científicos de la Universidad de Guelph (Guelph, Ontario, Canadá) desarrollaron en 2007 el primer animal no rumiante productor de fitasa (enzima producida por sus glándulas salivares): un cerdo Yorkshire, al que llamaron “Enviropig” (término que, en traducción libre al castellano, equivale a “Ecocerdo”), portador de ADN murino –región promotora del gen de una proteína segregada por la glándula parótida- y ADN de E. coli, el que codifica la fitasa. Enviropig pone en entredicho el estereotipo de los cerdos como animales sucios, capaz de crecer al ritmo de un cerdo normal, necesita menos comida y produce menos desechos (incluyendo entre un 20 y un 60% menos fitato en las heces), lo que disminuye el impacto ambiental de las purinas. La Universidad de Guelph es la propietaria de los derechos del Enviropig, y desde 2007 está en el proceso de aprobación en su país para consumo humano por parte de la Health Canada, que ha dado el visto bueno en lo que respecta al efecto sobre el medio ambiente, pero que ha solicitado mucha más documentación en lo que respecta a la seguridad para el consumo humano, y por la FDA en los EE.UU., que aún no se ha pronunciado. Se estima que la aprobación para el consumo humano del Ecopig, si se consigue, tardará en producirse unos años. n En 2020 China, que en Abril de 2016 ya tenía censados a 1.377 millones de habitantes, necesitará un 25% más de arroz que en la actualidad para cubrir la demanda de su población. El arroz es el cultivo alimentario más importante del mundo y la fuente principal de alimentación para más de la mitad de la humanidad. China es el mayor productor mundial con más de 145,7 millones de toneladas de arroz en 2015. El país contaba con unos 110 millones de familias productoras, lo que implica que más de 440 millones de personas se benefician directamente de esta tecnología. Desde Noviembre de 2009 China apostó por el arroz transgénico, un producto más asequible, capaz de superar limitaciones y problemas como la sequía, las plagas o la salinidad: la Comisión de Bioseguridad del gobierno de China concedió el primer certificado de seguridad como alimento humano a dos tipos de arroz modificados genéticamente, el arroz Bt Hua-Hui 1 y el arroz híbrido Bt Shanyou-63. Su aprobación fue todo un hito (un arroz que ya se cultiva ilegalmente: de hecho, en 2008 años, las alarmas europeas se activaron al descubrir la también ilegal entrada en el mercado europeo de ese tipo de arroz chino). n En la India, al igual que en otros países de extremo oriente como Filipinas y Bangladesh, se esperaba para el 2013-2014 comercializar el “arroz dorado” (Golden Rice). Es un arroz modificado genéticamente para que contenga más micronutrientes (incluido hierro) y para producir provitamina A o -caroteno (lo logra sobreexpresando 2 transgenes: el gen del maíz de la fitoeno sintasa y el gen de la caroteno reductasa de la bacteria Erwinia uredovora). Se estima que 50 g de peso seco de dicho arroz podrían proporcionar un 60% del requerimiento diario de vitamina A. La deficiencia de vitamina A, que se manifiesta en el Sudeste de Asia y ciertas áreas de África y Latinoamérica, zonas en las que el arroz es un alimento básico, es la causa principal de ceguera prevenible en los niños en todo el mundo. Se estima que entre 250.000 y 500.000 niños se quedan ciegos cada año debido a debido a que, entre otras dificultades, no reciben suficiente vitamina A en su dieta. De ellos la mitad mueren al año de perder su visión. En África subsahariana, hasta un 30% de los menores de 5 años están en riesgo de quedarse ciegos. n En 2015 se han aprobado varios transgénicos en América Latina. Una de las aprobaciones más polémicas fue la de los cultivos de Dow AgroScience –maíz, algodón y soja- con resistencia al Enlist DuoTM (herbicida que combina el 2,4D –ácido 2,4 diclorofenoxiacético, uno de los principios activos del Agente Naranja, un exfoliante usado durante la Guerra de Vietnam, considerado como arma química potencial- y la N-fosfonometilglicina –glifosato-) tanto en EE.UU. como en Argentina y Brasil, Sudáfrica. Una acción legal interpuesta por el Centre for Food Safety de EE.UU. ha frenado tal aprobación hasta que se hagan estudios que demuestren la inocuidad de estos cultivos. Plantas modificadas genéticamente aprobadas 1992-2015 Alimento Pienso Cultivo Ácido 2,4-diclorofenoxiacético N-fosfonometilglicina (glifosato) Según el Servicio Internacional para la adquisición de aplicaciones agrobiotecnológicas (ISAAA, siglas de “International Service for the Acquisition of Agri-Biotech Applications”), el 5 de febrero de 2016, ascendía a 388 el número total de plantas GMs aprobadas en el mundo (en Taiwán lo fueron las últimas 3: la soja MON87751; un algodón MON88701, resistentes a insectos (IR), y el algodón COT102 + MON15985 + MON88913, un evento IR y HR (resistente a insectos y a herbicidas). Legislación sobre organismos modificados genéticamente (OMGs) n La regulación en materia de OMG viene marcada por la existencia en este ámbito de un convenio internacional. Se trata del Protocolo de Cartagena sobre Seguridad de la Biotecnología del Convenio sobre Diversidad Biológica de 1992. Fue adoptado en 2000, entrando en vigor en 2003. España lo ratificó en 2002. En la actualidad, forman parte del mismo 163 Estados miembros de la ONU, entre los que no se encuentra EE.UU. Tiene por objeto fijar unas normas básicas generales en el uso de los OMGs que garantice la protección de la salud y el cuidado del medio ambiente, así como controlar los movimientos transfronterizos. n La Administración de Drogas y Alimentos de los EE.UU. (FDA, siglas de “Food and Drug Administration”) regula la producción y etiquetado de alimentos transgénicos. Además de la FDA, la Agencia de Protección Ambiental (EPA, siglas de “Environmental Protection Agency”) y el USDA regulan también las plantas y animales MGs. En enero de 2001, el Centro para la Nutrición Aplicada y la Seguridad en los Alimentos de la FDA (CSFA, siglas en inglés de “Center for Food Safety and Applied Nutrition”) propuso que quienes desarrollen alimentos procesados genéticamente presenten información científica y de seguridad a la FDA al menos 120 días antes de que el producto salga a la venta. n La Comisión Europea aprobó, el 25 de julio de 1997, unas directrices generales (IP/97/700) sobre etiquetado de productos elaborados a partir de organismos modificados genéticamente (OMGs), con objeto de garantizar en la UE un planteamiento coherente en los diferentes sectores que regulan el uso de los OMGs en la cadena alimentaria. De acuerdo con este planteamiento, la Comisión propondría medidas que abarquen todos los productos que se comercializan en el mercado, previa aprobación de seguridad, tanto OMGs “vivos” como productos elaborados a partir de OMGs, garantizando así un etiquetado coherente en la cadena de producción. Con objeto de responder adecuadamente a la demanda legítima de etiquetado, de favorecer la transparencia y de salvaguardar el mercado interior, la Comisión anunciaba que iba a preparar una propuesta de normativa. n En la Unión Europea (UE) para la evaluación del riesgo que supone cualquier OMG que vaya a introducirse en el mercado y la autorización previa a su comercialización, se establecen procedimientos específicos, que están limitados en el tiempo y son transparentes. La evaluación del riesgo, en la que debe demostrarse que, con arreglo a las condiciones de uso previstas, el producto es seguro para la salud humana y animal y el medio ambiente, se basa en criterios armonizados, que se ha reconocido que se encuentran entre los más estrictos del mundo. La Autoridad Europea de Seguridad Alimentaria (EFSA, siglas de “European Food Safety Authority”), en colaboración con organismos científicos de los Estados Miembros, es la que se ocupa de realizar dicha evaluación del riesgo. Las conclusiones de la evaluación del riesgo sirven como base a la Comisión Europea -CE- para proponer una decisión a los Estados Miembros, por la que se acepta o se rechaza la autorización de comercialización del OMG evaluado. n El Reglamento (CE) nº 1829/2003 sobre alimentos y piensos MGs establece en la UE un procedimiento para emitir decisiones de concesión o denegación de autorizaciones para la comercialización de alimentos y piensos MGs, así como para su cultivo. Ø En primer lugar, y en cumplimiento de lo dispuesto en el Reglamento (CE) nº 503/2013, relativo a las solicitudes de autorización de alimentos y piensos MGs, la solicitud se presenta por la persona o empresa interesada en comercializar en la UE su nuevo alimento o pienso MG a la autoridad competente de un Estado Miembro. En la solicitud debe definirse claramente su alcance, y tiene que ir acompañada de un expediente en el que se incluyen los estudios realizados (o a realizar) y los protocolos seguidos para obtener datos que demuestren la seguridad del producto, se ha de indicar qué partes son confidenciales y se debe incluir un plan de seguimiento, una propuesta de etiquetado y un método de detección. Ø A continuación, la documentación presentada por el solicitante se pone a disposición de la EFSA, el organismo responsable de realizar una evaluación científica del riesgo potencial, tanto para el medio ambiente como para la salud humana y animal, del OGM evaluado. Una vez recibido, el expediente es evaluado por EFSA, en colaboración con los organismos científicos de los Estados Miembros. La EFSA puede solicitar nuevos estudios o datos a la empresa si no está satisfecha con los que se le han presentado. Ø La evaluación del riesgo finaliza con la publicación por la EFSA de un dictamen en el que se llega a conclusiones sobre la seguridad del alimento o el pienso MG. Estas sirven como base a la Comisión Europea –CE- para proponer una decisión a los Estados miembros, por la que se acepta o se rechaza la autorización de comercialización del OMG evaluado. Ø Acto seguido, se inicia una consulta pública de un mes de duración, con el fin de que el público tenga la oportunidad de formular observaciones sobre el dictamen de la EFSA antes de que se tome cualquier decisión de gestión del riesgo. Ø Al mismo tiempo, la EFSA envía su dictamen a la Comisión Europea para que, en un plazo de 3 meses, elabore un proyecto de decisión de ejecución para la concesión o la denegación de la autorización en trámite. La Comisión puede disentir del dictamen de la EFSA, pero, en ese caso, debe justificar su posición. Ø El proyecto de decisión de la Comisión se somete a votación en el seno del Consejo de Ministros Europeos. En caso de que, en un período de tiempo determinado, no consigan adoptar la decisión por mayoría cualificada, corresponde a los miembros del Comité de Representantes Permanentes adoptar la decisión final. n La regulación a la que se ven sometidos los OMGs en la UE impone un seguimiento de publicaciones científicas que pudieran tener un impacto en la seguridad sobre la salud y el medio ambiente de los OMGs autorizados, ello permite a la Comisión y a los Estados miembros tomar las medidas apropiadas en caso de que se surja cualquier efecto adverso imprevisto. Normativa europea en materia de OMGs n La normativa comunitaria regula la utilización de OMG, al objeto de que el marco regulatorio en la UE sea uniforme y queden garantizadas las debidas salvaguardias de seguridad y protección para las personas y el medio ambiente. La normativa comunitaria hace reposar en cada Estado Miembro el ejercicio de las diferentes potestades autorizadoras, inspectoras y de control sobre las distintas actividades derivadas del uso de los OMG. Esto significa que, a la postre, depende de cada Estado Miembro que dichas actuaciones se realicen o no en su territorio. Ø La Directiva (UE) 2015/412 sobre “liberación intencional en el medio ambiente de organismos modificados genéticamente”, sustituye el Art.23 de la Directiva 2001/18/CE y concede a los Estados miembros el poder de decidir si prohíbe o restringe el cultivo de plantas MGs en su territorio: cualquier Estado, además de porque puede causar perjuicios para la salud humana o el medio ambiente, puede aducir que tal cultivo va contra los objetivos de su política medioambiental o agraria, o incluso otros motivos imperiosos, como la ordenación urbana y rural, el uso del suelo, las repercusiones socioeconómicas, la coexistencia y el orden público. Las empresas que trabajan con cultivos transgénicos disponen del plazo de un mes para aceptar o rechazar estas cláusulas de exención, sin tener que justificar su respuesta. Los gobiernos también pueden legislar para prohibir, individualmente o en grupo, cultivos transgénicos aprobados en la UE, siendo en definitiva los que tienen la última palabra sobre si prohibir un cultivo o no. Ø No obstante, en lo concerniente a “la comercialización de los transgénicos o los productos que los contengan”, la situación es distinta: se mantiene vigente el Art.22 de la Directiva 2001/18/CE, que dice: “Los Estados Miembros no podrán restringir o impedir la comercialización de productos que se ajusten a la normativa”, esto significa que la autorización otorgada por la UE para la comercialización de un OMG o de un producto que la contenga tiene validez en todo el territorio comunitario. Ø La Directiva 2009/41/CE, de 6 de mayo de 2009, relativa a “la utilización confinada de microorganismos modificados genéticamente”, que deroga la Directiva 90/219/CEE, creando una versión refundida. Ø El Reglamento (CE) nº 1829/2003, de 22 de septiembre de 2003, regula “cómo se autorizan y supervisan los organismos modificados genéticamente (OMG) y cómo se etiquetan los alimentos y los piensos MGs”. Ø El Reglamento (CE) nº 1830/2003, de 22 de septiembre de 2003, relativo a “trazabilidad y etiquetado de organismos modificados genéticamente y a la trazabilidad de los alimentos y piensos producidos a partir de estos”, que modifica la Directiva 2001/18/CE. Ø El Reglamento (CE) nº 1946/2003, de 15 de julio de 2003, relativo al “movimiento transfronterizo de organismos modificados genéticamente”, que completa el contenido de las directivas 2001/18/CE y 2002/53/CE. Normativa española en materia de OMGs n La regulación española viene contenida en el Real Decreto 191/2013, de 15 de marzo, por el que se modifica el Real Decreto 178/2004, de 30 de enero (que, a su vez, derogó el Reglamento de la anterior Ley de 1994, el Real Decreto 951/1997, de 20 de junio). En el se aprueba el Reglamento general para el desarrollo y ejecución de la Ley 9/2003, de 25 de abril, por la que “se establece el régimen jurídico de la utilización confinada, liberación voluntaria y comercialización de organismos modificados genéticamente”. Se trata de una ley de carácter básico que responde a la normativa comunitaria y que sustituyó a la Ley 15/1994, de 3 de junio, que fue la 1ª ley española reguladora de los transgénicos. n A su vez, las Comunidades Autónomas (CC.AA.) tienen la capacidad de desarrollar la legislación básica estatal. Hasta la fecha, varias CC.AA. han ejercido esta capacidad: Andalucía, Aragón, Asturias, Baleares, Castilla-La Mancha, Castilla y León, Cataluña, Extremadura, Madrid, Navarra y Valencia. Ø En Andalucía, tal regulación aparece explicitada en el Decreto 320/2010, de 29 de junio, por el que se “regulan los órganos competentes y los procedimientos administrativos en materia de utilización confinada y liberación voluntaria de organismos modificados genéticamente”. n En España, “el etiquetado y la trazabilidad de los organismos modificados genéticamente y de los alimentos y piensos producidos a partir de estos” están promovidos por la Confederación de Consumidores y Usuarios (CECU). El 18 de abril de 2004, en cumplimiento del Reglamento (CE) nº 1830/2003, la UE aprobó la obligatoriedad de etiquetar como MG a “todo alimento y pienso que se componga de un OMG, lo contenga o se haya producido a partir de él, excepto en el caso de que su presencia sea inferior al 0,9 % del alimento, el pienso o el ingrediente, y sea accidental o técnicamente inevitable”. n El marco legal vigente en España no ampara a los agricultores, ya que no existe un registro público de cultivos transgénicos como obliga la Directiva Europea 2009/41/CE, impidiendo conocer el origen de las contaminaciones. Ø La legislación tampoco ampara a las personas consumidoras en su derecho a una alimentación libre de transgénicos. Solo obliga a incluir una etiqueta con un texto que advierta la presencia de componentes transgénicos (que suele ser: “Este producto contiene OGMs”) en los productos destinados al consumo animal o humano que en su composición lleven más de un 0,9% de transgénicos. Además, no hay obligación de etiquetar los productos como carne, leche o huevos procedentes de animales alimentados con transgénicos. n La obligación impuesta por la UE de etiquetar cualquier producto derivado de OGMs ocasiona a veces problemas discriminatorios comerciales, con respecto a los productos importados. Podríamos citar lo ocurrido en España con la dextrosa, un edulcorante rico en fructosa, obtenida a partir del maíz transgénico MON810 Ø En realidad, aunque Syral Iberia (Zaragoza) lo extraiga del maíz MON810, el azúcar no es transgénico porque el producto no depende ni de genes ni de proteínas, por lo que no habría que etiquetarlo como transgénico. Sin embargo, la normativa europea obliga a marcarlo. Esto hace que ciertas empresas rechacen este azúcar, para evitar etiquetar sus productos como contenedores de transgénicos. Prefieren comprar el azúcar a los EE.UU. o América latina, un azúcar que aunque proceda del mismo maíz transgénico por ley no está obligado a hacerlo constar en su etiqueta. n Cada transgénico dispone de un código asociado que se transmite a lo largo de la cadena alimentaria (producción, transformación y distribución) y permite su seguimiento. Además, el nuevo reglamento obliga a que todos los eslabones de la cadena productiva informen de la utilización de OGMs, que es lo que se ha llamado “trazabilidad” aún cuando no se detecte en el producto final. Muchos explotadores de empresas alimentarias han tomado la decisión de no vender alimentos MGs. Esto puede estar relacionado con las obligaciones en materia de etiquetado del marco legal de los OMGs, así como con la disponibilidad de alternativas no MGs. Empresas que se oponen a etiquetar la presencia de organismos modificados genéticamente en sus productos La revolución verde y los cultivos transgénicos n En 1798 el economista inglés y político británico Thomas R. Malthus en su famoso “Ensayo sobre el principio de la población” especulaba, en tono fatalista, que el crecimiento de la población mundial humana superaría muy pronto la producción y suministro de alimentos, lo que se convertiría en el mayor problema de la humanidad: “las poblaciones humanas no pueden crecer indefinidamente, aunque tengan potencial para hacerlo, pues los recursos no son ilimitados”, decía. Malthus no tuvo en cuenta ni la capacidad humana ni el poder de la tecnología, que traerían la denominada “revolución verde”, debida al trabajo de muchos científicos, entre los que destaca el estadounidense Norman Ernest Borlaug, reconocido como el “padre de la revolución verde”. Este fenómeno se inició en 1943, en Sonora (México), y se basaba en obtener variedades de trigo enano de alto rendimiento, que evitan el encamado original, y en un cambio de paradigma en las prácticas agrícolas (al incluir riego, mecanización y fertilización). También se mejoraron el arroz, el maíz, y otros cultivos. Los esfuerzos de Borlaug en los años 1960 para introducir las semillas híbridas a la producción agrícola en Pakistán e India provocaron un incremento notable de la productividad agrícola, y algunos lo consideran responsable de haber salvado más de 1.000 millones de vidas humanas. A pesar de los muchos detractores de la revolución verde, Borlaug recibió el Nobel de la Paz en 1970. La revolución verde y los cultivos transgénicos n La primera fase de la globalización de la agricultura iniciada a mediados del S-XX fue la revolución verde, gracias a ella el suelo rinde más, hay más alimentos y son más baratos. Un handicap es la cada vez mayor contaminación química, ligada a los cultivos intensivos. n Los cultivos transgénicos vienen a ser el último capítulo de la revolución verde. El empleo de semillas transgénicas crece de forma inexorable, principalmente debido a los beneficios que aporta: disminución de los costos laborales del cultivo y de producción; reducción del uso de productos químicos y ganancias económicas. Ø El Dr. James Dale (Director del Centro para Cultivos y Bioproductos Tropicales, Universidad Tecnológica de Queensland, Brisbane, Australia) afirma lo siguiente: “en el periodo 1996-marzo de 2014, la Biotecnología ha incrementado el rendimiento de los cultivos en un 21,6%, lo que se relaciona más con la contención eficaz de plagas y con la reducción de los daños, que con un mayor poder productor ligado a la transformación genética; el incremento de los cultivos resistentes a plagas de insectos es casi un 7% superior al incremento experimentado por los cultivos resistentes a herbicidas; al mismo tiempo, la introducción de cultivos MGs ha permitido reducir la cantidad de pesticidas (plaguicidas y herbicidas) en un 37% y su coste en un 39%, siendo mayor la reducción de gastos en los cultivos resistentes a insectos que en los tolerantes a herbicidas. Los costes de producción se incrementan en un 3,3% debido al mayor precio de las semillas MGs, aunque estos se sufragan con el menor gasto en el control de plagas y malas hierbas”. Ø Para un agricultor que apuesta por cultivos “biotecnológicos”, los beneficios medios han crecido en promedio un 68%, siendo un 14% superiores en países en vía de desarrollo. n Tal y como tenemos planteada la agricultura hoy en día, no nos da para abastecernos. Por eso para alimentar al ganado que nos comemos, los europeos nos vemos obligados a importar soja y maíz transgénicos de países como EE.UU. o Brasil, donde la inmensa mayoría de estos cultivos son MGs porque dan más beneficios al agricultor. Necesitamos estos productos, entre otras cosas, porque desde la crisis de las vacas locas el ganado no puede alimentarse con proteínas de origen animal. La mejor fuente vegetal de proteína de calidad es la soja y el maíz. Toda la UE, incluida España, es deficitaria en cultivos de proteína vegetal, especialmente de soja. La UE necesita más de 36 millones de toneladas de equivalente de soja al año para alimentar a su ganado. La producción mundial de este cultivo en 2014/2015 estaría en torno a los 320 millones de toneladas, mientras que la cantidad obtenida de soja en la UE rondaría los 1,34 millones, de las que 3.000 toneladas se cultivaron en España, es decir, el 0,22% de la UE y el 0,0009% a nivel mundial. La UE importó entre 2014 y 2015 más de 14,6 millones de toneladas de habas de soja -el 16% de la producción mun-dial-. Convendría destacar que los principales países cultivadores de soja, como EE.UU., Argentina, Bra-sil, China o India, no diferencian entre soja convencional y soja MG, porque la mayoría de la que exportan es ya transgénica. Por tanto, el panorama para los ganaderos españoles y europeos sería muy negro si se derogase, como solicitan muchos colectivos, el Art.22 de la Directiva 2001/18/CE, que impide que se restrinjan o prohíban estas importaciones a título individual por alguno de los Estados miembros de la UE. La actitud de Europa hacia los cultivos transgénicos n Europa vive sumergida en la hipocresía. Son muchos los países que prohíben cultivar transgénicos en sus tierras (19 de los actuales 28 miembros de la UE) y que, a la vez, importan al año millones de toneladas. ¿Por qué no cultivarlos pero sí consumirlos? El miedo de los políticos a la opinión pública, tiene mucho que ver con esta incoherencia. n Para justificar el no cultivo de transgénicos sin dar la cara, la UE ha ideado un sistema de regulación que atrapa a las compañías en un atasco burocrático que roza la parodia. n Hasta ahora, tras años de trabajo, la conclusión ha sido siempre la misma: los transgénicos son seguros. Sin embargo, la decisión final la tienen los comités políticos, que nunca logran la mayoría necesaria para dar luz verde al nuevo producto. Así, la UE ha llegado a acumular décadas de retrasos en la aprobación de transgénicos que tienen el visto bueno de la EFSA, como ejemplos podemos citar lo ocurrido con la patata Amflora (BASF) y con el maíz 1507 (Monsanto) Ø La patata Amflora tuvo que esperar 12 años para que la Comisión Europea (CE) autorizase en marzo de 2010 su “comercialización para su cultivo y usos industriales”. Sorprendentemente, tal autorización fue revocada por el Tribunal de Justicia de la UE (TJUE) el 13 de diciembre de 2013. Ø El maíz 1507, un cultivo resistente al taladro del maíz y al glufosinato, lleva más de 13 años (como se observa en el gráfico adjunto) esperando la decisión de la CE, que ha vulnerado claramente los plazos impuestos por la legislación vigente en la UE. n Aunque la UE aprobó una moratoria no oficial en 1998 a los cultivos transgénicos, el 24 de abril de 2015 ya había autorizado 64 OMGs (algodón -10-, maíz -37-; colza -4-; soja -12- y 1 de remolacha azucarera) para su uso en alimentos y piensos: ese día se incorporaron a la lista los 17 últimos autorizados (destacando un maíz resistente a la sequía y 3 colzas bajas en linolénico -2 con una alta producción de oleico y otra productora de ácido estearidónico-). Por entonces, se tramitaban 19 expedientes de solicitud con dictamen favorable de la EFSA; 7 estaban sometidos a una posible prohibición, y otros 7 tenían expirada su autorización. Hasta la fecha, la decisión final sobre la aprobación continúa siendo una prerrogativa de la Comisión Europea: de hecho, los últimos 17 OGMs aprobados lo fueron contra la opinión de la mayoría de los Estados miembro. n En contraste con las casi 90 variedades de transgénicos (OGMs) autorizadas para su cultivo en los EE.UU. y las 30 autorizadas en Brasil, la UE hasta diciembre de 2014 solo cultivaba dos OGMs: el maíz Bt (de los casi 40 cultivares comercializados, uno de ellos –el maíz 1507, de Pionerfue vetado el 16 de enero de 2014 por el Pleno del Parlamento Europeo), cuyo cultivo aún persiste, y la patata Amflora de BASF, cuya autorización fue revocada el 13 de diciembre de 2014 por parte del Tribunal de Justicia de la UE, dejando de cultivarse desde entonces. Ø El cultivo del maíz MON810, autorizado por la Agencia de Drogas y Alimentos (FDA) de EE.UU. en 2004, obtuvo ese mismo año el beneplácito de la EFSA, que se pronunció a favor de la renovación de su autorización en Julio de 2009, con una decisión más política que científica. Ø En marzo de 2010, el presidente de la Comisión José Manuel Durao Barroso -con el apoyo de sólo 4 de los 27 miembros de la UE- aprobó el cultivo de Amflora, una patata creada por la empresa alemana BASF para uso industrial y para alimentación animal (lleva silenciado el gen responsable de la producción de amilosa, para que contenga solo amilopectina, un almidón de utilidad para ciertas aplicaciones industriales, cuyo procesamiento requiere menos energía, menos agua y menos productos químicos. Países de la UE libres de transgénicos n En Noviembre de 2012 eran ya 8 los países de la UE (Austria, Luxemburgo, Grecia, Hungría, Francia, Alemania, Bulgaria y Suiza) los que, acogiéndose a las Directivas 2001/18/CE y 2002/53/CE, habían vetado el cultivo del maíz MON810 en su territorio. n Enrico Brivio, portavoz de la Comisión Europea afirmó el 4 de octubre de 2015 que 19 de los 28 países de la UE, presentaron los documentos necesarios bajo las nuevas reglas que facilitan a los gobiernos prohibir OMGs -Directiva 2015/412-. Los solicitantes representan el 65% de la población de la UE y el 66,2% de su superficie agrícola. Ø Los países que quieren impedir cultivos MGs son: Austria, Bulgaria, Croacia, Chipre, Dinamarca, Francia, Grecia, Hungría, Italia, Letonia, Lituania, Luxemburgo, Malta, Holanda, Polonia, Eslovenia y Alemania, aunque esta última está de acuerdo en permitir el cultivo con fines de investigación. Bélgica y el Reino Unido, en tanto, pidieron el bloqueo sólo para partes de su territorio, como la región de Valonia -en el caso de Bélgica-, y Escocia, Gales e Irlanda del Norte -en el de Reino Unido-. n España, el país con mayor superficie de cultivos transgénicos dentro de los 9 Estados Miembros que siguen apostando por ellos en la UE y el que más ensayos experimentales (70%) realiza en sus campos. Una sentencia del Tribunal de Justicia Europeo (diciembre, 2010) ampara “el derecho a que sea conocida por el público la ubicación de los campos experimentales con transgénicos, antes confidencial”. Así, nos hemos enterado de que existen o han existido en Andalucía, entre ellos los de la provincia de Córdoba en los términos municipales de Almodóvar del Río y de Fuente Palmera. n Aunque España es el único Estado miembro de la UE que permite el cultivo de transgénicos a una escala importante, comunidades autónomas como el País Vasco, Asturias, Islas Canarias, Islas Baleares y Galicia aprobaron en el pasado resoluciones para prohibir el cultivo de transgénicos y otras, como Cantabria y Castilla y León (la primera productora de maíz de España), siguen sin sembrar el maíz MOM810. n La UE actualmente es dependiente de las importaciones para alimentar a sus ciudadanos y, en muchos casos, importa productos MG cuyo cultivo tiene prohibido dentro de sus fronteras. Una postura sin sustento científico, que sitúa a los agricultores europeos en una posición de desigualdad respecto a sus competidores, lo que les lleva a una pérdida de competitividad en sus explotaciones. Una propuesta en la UE sobre OGMs hace saltar las alarmas n El Pleno del Parlamento Europeo rechazó el 28 de octubre de 2015 la propuesta de “modificar el Art. 22 de la Directiva 2001/18/CE”, para dejar en manos de los Estados Miembros la decisión final de restringir o prohibir en su territorio productos MGs. La propuesta que hizo saltar las alarmas en múltiples sectores, en especial en el sector ganadero, en el que España, como uno de los principales productores, sería uno de los más perjudicados. Somos el 2º productor comunitario de carne y exportamos a la UE por valor de 6.265 millones de euros. La ganadería (producción e industria) supone un 1,5% del PIB de España. Ø Francisco J. Areal (Universidad de Reading, Reino Unido) afirmaba que el mero intento de sustitución de las importaciones de soja MG supondría una “falta de abastecimiento de esta materia prima para la industria de fabricación de piensos”, lo que acarrearía un aumento en los precios a corto plazo: en las habas de soja y en la harina de soja, de un 291% y un 301%, respectivamente. Areal recordaba que era inviable sustituir la soja por otros cultivos energéticos (como habas, guisantes, altramuces o girasol), debido a la enorme cantidad de tierras de cultivo que se necesitarían para cubrir esta demanda. Como ejemplo, señala que sustituir la soja por altramuces obligaría a cultivar 16 millones de ha, es decir, prácticamente toda la superficie agrícola española. El intento de sustituir soja transgénica por convencional dispararía los costes de los ingredientes de producción de piensos para vacuno, cerdo y aves en un 49%, 54% y 85%, respectivamente. Ø Durante el periodo 2000-2014, la importación de soja MG respecto a la convencional ha supuesto, según la fundación Antama (Fundación para la Aplicación de Nuevas Tecnologías en la Agricultura, el medio ambiente y la alimentación), un ahorro de 55.000 millones de euros y una reducción en la emisión de CO2 es equivalente a retirar más de 12 millones de vehículos de la circulación. Ø El director gerente de la Asociación Española de Comercio Exterior de Cereales y Productos Análogos (Aecec), Diego Pazos, cree que “la producción de cereal en España es insuficiente”, con un déficit medio de 11,5 millones de toneladas que se cubren vía importaciones. En el caso de harinas proteicas, la carencia es de 5 millones de toneladas. Por ello, se sustituye por habas y harina de soja. Afirma “que no hay alternativa para la soja MG y no se puede sustituir por soja convencional”. Pro-trangénicos vs. Anti-transgénicos: el debate persiste n Los anti-transgénicos se frotaron las manos cuando la revista PNAS (Proceeding of the National Academy of Sciences), en el otoño de 2001, publicó trabajos que denunciaban las muertes causadas en la población de mariposas monarca (Danaus plexippus) por la alta concentración en el polen del maíz Bt176 de la toxina Cry, más conocida como Bt, algo no observado cuando dichas mariposas contactaban con el polen de otros híbridos del maíz. Con todo, habría que recordar que el crecimiento de zonas urbanas y cultivadas en el largo recorrido que realizan cada año desde Canadá a México (su enclave de hibernación) – la mariposa monarca es el insecto conocido que realiza la migración más larga y masiva (en otoño, tras recorrer miles de kilómetros, para alejarse del frío invierno del norte de EE.UU. y Canadá, infinidad de estos hermosos ejemplares se dejan ver mientras juguetean en los bosques de pino y oyamel en Michoacán y el estado de México)-, de por sí causa extinciones masivas de esta mariposa: se calcula que unos 970 millones de ejemplares han perdido la vida desde 1990. Pero, lo más curioso de todo, es que la proteína Bt producida por el maíz Bt 176 se usa para fumigar en agricultura convencional y que el Bacillus thuringiensis, la bacteria que la produce, se emplea como agente de control biológico en agricultura ecológica desde hace tiempo. Transgénesis y Salud n Al supuesto riesgo de intoxicaciones alimentarias, ligadas a la presencia de residuos de los plaguicidas producidos por la propia planta transgénica y/o de los herbicidas empleados para acabar con las malas hierbas, en las propias plantas o en el material utilizado de ellas como alimento para los animales –piensos- o como comida para humanos, algunos detractores de los transgénicos añaden sus dudas sobre si los genes de un alimento que se insertan en otro pueden causar reacciones alérgicas. n En Septiembre de 2012 la prensa informaba de que un estudio llevado a cabo por un grupo de investigadores franceses, dirigido por Gilles-Eric Séralini, profesor de Biología Molecular de la Universidad de Caen (Baja Normandía, Francia) y experto del Gobierno francés en organismos modificados genéticamente, ha demostrado la peligrosidad de los alimentos transgénicos. No ha sido un estudio de 3-4 semanas de duración como los que habitualmente presentan las empresas biotecnológicas. Se apoya en 2 años de experimentación con un grupo de 200 roedores a los que se ha alimentado con el maíz transgénico NK603, también conocido como maíz RR (de “Roundup Ready”), un maíz patentado por Monsanto capaz de soportar la acción del herbicida Roundup®. Ø El estudio tenía como finalidad determinar los efectos en la salud de la ingesta del maíz NK603 y del herbicida Roundup®, para ello los investigadores dividieron a los roedores en grupos, a cada uno se le alimentó con una dieta de maíz comparable a la que toma un ciudadano estadounidense en su dieta, en la que se variaban las proporciones del contenido de maíz RR que había sido tratado con Roundup®. Un 1er grupo recibió en su dieta diaria un 11% de maíz; el 2º un 22%, y el 3º un 33%. También se formó un 4º grupo de control en el que la dieta era normal, es decir, se les alimentó exclusivamente con maíz convencional (i.e., maíz no modificado genéticamente). A los 17 meses de iniciarse el estudio se constató que los roedores macho alimentados con maíz transgénico tratado con Roundup, tenían una mortalidad 5 veces superior en comparación al grupo de control alimentado con productos sin modificaciones genéticas, una mortalidad que redujo su expectativa de vida en un año. En el caso de los roedores hembra también se detectó una mortalidad precoz, que hizo que su expectativa de vida se redujera en 8 meses en comparación con el grupo de control. A estos datos hay que añadir que en los roedores alimentados con maíz transgénico tratado con Roundup también se formaron tumores enormes del tamaño de una pelota de ping-pong, éstos aparecen en los machos 600 días antes que en los roedores del grupo de control y se producen en los riñones o en la piel; en roedores hembra aparecen 94 días antes que en los roedores alimentados con maíz normal y se localizan el 93% de ellos en las glándulas mamarias. Ø El estudio de Séralini suponía la 1ª vez que se investigaba el efecto en la salud del Roundup® con la totalidad de sus componentes, haciéndose además a largo plazo. Anteriormente se realizaron estudios similares pero sólo con su principal componente activo, el glifosato, y de menor duración, por lo que los resultados no tenían porqué ser los mismos. Ø El artículo del grupo de Séralini, aparecido el 7 de Noviembre de 2012 en Food and Chemical Toxicology (una revista en la se habían publicado estudios previos abogando por la inexistencia de riesgos toxicológicos con el maíz Roundup Ready), una publicación, ilustrada con fotografías de ratas con tumores grandes, que asegura que las ratas alimentadas con maíz transgénico sufren cáncer y mueren antes, causó alarma social en Europa y relanzó la polémica sobre los transgénicos. n Los resultados del grupo de Séralini fueron contestados por la industria biotecnológica, que se pronunció aludiendo a los múltiples estudios presentados que constatan la seguridad de los alimentos, aunque ninguno de ellos se ha realizado a largo plazo. Ø Stéphane Le Foll, ministro de Agricultura de Francia, solicitó la UE procedimientos más estrictos y, a su vez, la UE encargó a la Autoridad Europea de Seguridad Alimentaria (EFSA) que analizase los resultados de Séralini. La EFSA ha ratificado en varias ocasiones los estudios presentados por las empresas biotecnológicas afirmando que eran alimentos seguros, pero estas nuevas conclusiones la obligaban a hacer una revisión y determinar sus procedimientos y validez. La EFSA, que tras su 1ª evaluación a principios de octubre de 2012 manifestó dudas sobre el estudio y pidió información suplementaria al autor, rechazó definitivamente el 28 de Noviembre de 2012 las conclusiones del polémico informe del francés Gilles-Eric Séralini, que afirmaba que “el maíz transgénico NK 603 y el herbicida Roundup® del grupo Monsanto son tóxicos”. “Las conclusiones del estudio no se apoyan con datos”, dijo la EFSA en su evaluación final. La agencia europea enumera las omisiones identificadas en la metodología, según observaron los 6 miembros del Comité de Expertos. Entre ellas, citan: los objetivos del estudio son poco claros; el escaso número de ratas usadas en cada grupo de tratamiento; la falta de detalles sobre la alimentación y el tratamiento de las ratas, y la ausencia de datos estadísticos claves. n Subyacía el temor de que, el rechazo del estudio de Séralini, fuese el argumento para que la Comisión Europea retomara las conversaciones para plantear la autorización del cultivo en la UE de hasta 7 transgénicos (6 variedades de maíz –incluido el único admitido, con plazo ya caducado, el MON810– y un tipo de soja) y la comercialización de otros 50 productos destinados a la alimentación animal y humana. Ø La UE en ese momento (noviembre de 2012) tenía autorizados en total 46 transgénicos importados (26 variedades de maíz, 8 de algodón, 7 de soja, 3 de colza, una de patata y otra de remolacha), 44 para su comercialización y 2 para su cultivo (patata Amflora y maíz MON810). Estos transgénicos importados se usan para alimentación animal y para fabricar alimentos para humanos. Se trata, por ejemplo, de harina o sémola de maíz, aceite de soja o de colza. Estos ingredientes se pueden encontrar potencialmente en cereales para desayuno, galletitas de aperitivo, pan rallado, platos preparados, salsas, fiambres, cremas de postre, sopas, pasteles, etc. También provienen del maíz y la soja muchos aditivos alimentarios, como almidón oxidado (E1404) y fosfatos de almidón (E1410, E1412 a E1414); lecitina de soja (E322) o aceite de soja oxidado (E479b) y sorbitol (E420). n Los alimentos pueden ser mejores si con la modificación genética se busca optimizar su valor nutritivo, pero también se puede ir en detrimento del valor nutritivo si lo que se busca es destacar otras virtudes, como una mejor conservación. El caso más ilustrativo es el del tomate transgénico Flavr Savr® (Calgene), cuya modificación genética retrasa su maduración, pero compromete su valor nutritivo: de hecho, tuvo que ser retirado del mercado el 1 de Julio de 1996, justo dos años después de su autorización en EE.UU. por la FDA. n Lo que parece no tener una respuesta definitiva por parte de la clase científica y de la administración es la repercusión de estos alimentos y de los cultivos transgénicos en la salud y en la naturaleza a medio y largo plazo. Ø La crítica más habitual es que esta tecnología se está introduciendo muy rápido, bajo la presión de las empresas interesadas, sin un análisis suficiente de los riesgos, sin el debate social razonable y prescindiendo de controles democráticos. Ø El hecho de que la Ley 26/2007 de 23 de octubre de Responsabilidad Medioambiental, aprobada mediante Real Decreto 2090/2008, el 22 de diciembre, Ley cuyo Reglamento fue modificado por Real Decreto 183/2015, de 13 de marzo, incluya la comercialización de OGMs entre las prácticas con daños ambientales (plantea que sólo la liberación intencional de los mismos estaría sujeta a responsabilidad) demuestra que los riesgos no se descartan. Este hecho obligará a las empresas que los producen a suscribir un seguro millonario para responder por los posibles daños causados a los seres humanos o a la naturaleza. n Ante este panorama, la única opción para consumir alimentos no manipulados con seguridad pasa por recurrir a los alimentos con aval biológico o alimentos lo menos elaborados posible. n Por el momento, los beneficios que aportan los alimentos transgénicos no son tan evidentes para el consumidor como lo son para el productor y para el medio ambiente. Ø Los vegetales transgénicos disponibles permiten reducir la utilización de pesticidas y herbicidas; de esta forma, además de minimizar el riesgo de intoxicaciones alimentarias indeseadas (ligadas a residuos en los piensos de herbicidas y/o plaguicidas empleados durante su cultivo de las plantas de donde proceden, es posible bajar los costos y aumentar la productividad de la tierra. La provincia del Chaco (NE de Argentina, entre el rio Paraguay y el Paraná), una provincia identificada por el cultivo de algodón, siempre ha referido tasas extremadamente altas de cáncer y defectos congénitos entre los recolectores de algodón y sus descendientes, relacionados con el uso de plaguicidas en estos cultivos; la introducción de variedades transgénicas de algodón resistentes a plagas permitirá evitar tan costosas secuelas para la salud de estos trabajadores. Un estudio a gran escala, realizado en 2014 por Van Eenennaam y Young, confirmó que el empleo de piensos MGs, no solo no afecta para nada la salud de las poblaciones de ganado (el supuesto riesgo de intoxicaciones alimentarias resultó ser mínimo), sino que además contribuye a mejorar tanto la producción como los ingresos de los agricultores, que ven reducidos los gastos en agentes fitosanitarios. Ø Los especialistas coinciden en que el impacto medioambiental de los cultivos MGs no debe ser medido en relación con un ecosistema virgen o ideal, sino que debe ser comparado con la situación real de las tierras que se hallan cultivadas en la actualidad: el habitual cambio de paisaje natural que ocasionan es el inherente a cualquier otro tipo de agricultura. Ya el sólo hecho de reducir el empleo de sustancias tóxicas para el ser humano y los demás integrantes del ecosistema, como lo son los herbicidas y los plaguicidas que se utilizan rutinariamente en la actualidad, constituye un paso positivo. n En cuanto a los beneficios de los alimentos MGs para los consumidores, se opina que se verán pronto: la biotecnología agrícola moderna, además de incrementar la producción de alimentos básicos, está mejorando las propiedades nutricionales/saludables de los mismos. Ø La modificación mediante ingeniería metabólica de la ruta de síntesis de carotenoides presenta muchas posibilidades, dado que genera productos entre los que figuran compuestos con propiedades antioxidantes, vitamínicas, analgésicas, antitumorales, etc., que podrían conferir al OMG propiedades profilácticas o terapéuticas. La cantidad de carotenos se puede incrementar, tanto evitando su transformación en otros compuestos (como se ha hecho en naranjas) como estimulando su síntesis, al incrementar la concentración de metabolitos precursores (como por ejemplo, el fitoeno, por sobreexpresión de la fitoeno sintasa, como se ha hecho en maíz, arroz y plátanos). Ø También serán útiles los alimentos con menor contenido en grasas, o los que produzcan un aceite o una carne con mayor proporción de grasas monoinsaturadas. En 2012, en EE.UU. se obtuvieron plantas de tomates modificados genéticamente capaces de producir un péptido que funciona como proteína principal del colesterol bueno. Un estudio, presentado en las Sesiones Científicas de la Asociación Americana del Corazón, confirmó que los ratones que se alimentaron con estos tomates transgénicos desarrollaron menos inflamación y aterosclerosis (trastorno que ocurre cuando se acumula grasa, colesterol y otras sustancias en las paredes de las arterias). Ø Se está experimentando con la creación de alimentos que contengan productos medicinales, los alimentos que contengan vacunas son un buen ejemplo de ello (como ejemplo, las patatas transgénicas, obtenidas en 2011 por investigadores del Instituto de Biotecnología del INTA Castelar -Buenos Aires, Argentina-, aptas como vacunas orales para combatir en aves de corral la enfermedad de Newcastle, una patología que causa graves pérdidas económicas en avicultura). Alimentos transgénicos saludables OMS (2015) Cardiovasculares 7 millones (11,2%) Cerebrovasculares 6,2 millones (10,6%) 26,7 millones (48,6%) 3,2 millones (6,7%) 3 millones (5,8%) 1,2 millones (1,9%) Respiratorias EPOC Diarreas HIV (SIDA) Cáncer respiratorio Diabetes Accidentes tráfico 1,9 millones (4,7%) 1,3 millones (2,2%) 1,4 millones 1,6 millones (2,6%) (3%) 1,5 millones (2,7%) Muertes prematuras Otras Transgénicos, ¿una forma de evitar el agotamiento de los caladeros de peces y la potencial contaminación con mercurio inherente al consumo de peces? n En 2012, científicos de la Universidad de Harvard (Cambridge, Massachussets, EE.UU.) crean tomates transgénicos productores de un péptido que favorece en nuestro cuerpo la formación de la lipoproteína HDL (el colesterol “bueno”). n En abril de 2014 se cultivaron semillas transgénicas de la planta Camelina sativa, con un contenido en ácidos grasos omega-3 (12% de EPA y un 14% de DHA) similar al de los del aceite del pescado graso. ¿Es posible crear animales de granja transgénicos productores de ácidos grasos omega-3? Caenorhabditis elegans Gen fat-1 humanizado Promotor P2 murino FAD2 de Spinacia Región de splicing y poli(A) de SV40 Microinyección del gen en óvulos fertilizados Transgénico Fat-1 n En abril de 2004, investigadores de la Universidad de Kinki (Fukusaki, Japón), después de haber insertado el gen de la 12 ácido graso desaturasa (gen FAD2) procedente de la espinaca (Spinacia oleracea) en su genoma, crean un cerdo cuya carne tiene un 20% menos de grasa saturada que la de un cerdo no transgénico. n En febrero de 2004 investigadores del Hospital General de Massachussets (California) crean un ratón transgénico (portador del gen Fat-1 del gusano Caenorhabditis elegans, que expresa la enzima Fat-1) capaz de transformar los ácidos grasos omega-6 presentes en su dieta en los más beneficiosos omega-3. n En marzo de 2006 investigadores de la Universidad de Pittsburg (Pennsylvania) obtuvieron 6 cerdos transgénicos portadores del gen Fat-1 de C. elegans: su carne está enriquecida con los ácidos grasos omega-3 del salmón y del atún. Transgénicos y vacunas comestibles n Se han desarrollado plantas transgénicas como fuente de vacunas comestibles. la mayoría de ellas aún se encuentran en proceso de desarrollo y evaluación, por lo que se deberá esperar un tiempo para que estén disponibles en el mercado. Se espera que, en pocos años, las patatas, los tomates, los plátanos, la lechuga, el arroz y la espinaca, entre otras plantas, puedan prevenir distintas enfermedades infecciosas como: la diarrea infantil (virus Norwalk, rotavirus, etc.); el síndrome urémico hemolítico (E. coli O157:H7); las hepatitis B y C; el SIDA; el SARS -Síndrome respiratorio agudo sistémico-; la fiebre aftosa, etc. Una forma de lograrlo consiste en acudir a la bacteria Agrobacterium tumefaciens para introducir genes de antígenos bacterianos o víricos en la planta (en este caso el tabaco), para que ésta los exprese y quien se alimente de ella desarrolle una respuesta inmune frente al agente infeccioso, Gen antigénico Plásmido Gen R (resistencia a un antibiótico) 1. Cortar una hoja C É L U L A C É L U L A VEGETAL BACTERIANA ADN Transferencia génica S u s p e n s i ó n Célula bacteriana Callo muerta 2. Poner en contacto la hoja con un cultivo de la bacteria. Permitir el paso del plásmido a las células vegetales. Medio con antibiótico 3. Exponer la hoja al antibiótico para matar a las células vegetales no transformadas por el plásmido. 5. Plantarlo en el suelo. P a t a t a vacunal 4. Dejar que el callo brote En 3 meses produce patatas “vacuna” n Con respecto a los riesgos que la modificación genética de los alimentos acarrea para la salud humana, no se ha de ocultar que si bien toda nueva tecnología conlleva riesgos potenciales, los alimentos modificados genéticamente son tan seguros que, por el momento, sus riesgos para la salud son comparables a los de los alimentos convencionales. Ø Los alimentos genéticamente modificados que han sido aprobados para su comercialización tienen casi la misma composición que los productos convencionales; en otras palabras: son nutricionalmente equivalentes. Las proteínas producidas en estos alimentos por los genes modificados o introducidos se encuentran presentes en el organismo vegetal en niveles extremadamente bajos, que van del 0,001 al 0,002 % del peso total del cultivo. Ø En cuanto a la preocupación de que la nueva proteína desencadene alergias alimentarias, se puede evitar y predecir siempre y cuando se realicen en forma exhaustiva los distintos tests destinados a evaluar el potencial alergénico de un nuevo producto alimenticio, y lógicamente se refleje su presencia en la etiqueta preceptiva. Ø La posibilidad de que el gen que se le ha adicionado al vegetal sea transferido al genoma de un ser humano es extremadamente baja, aunque no por ello inexistente. Esta opinión se basa en que el propio procesamiento de la materia prima del vegetal reduce la cantidad de ADN intacto en el alimento; pero aunque el alimento no sea procesado, existen muchos otros procesos que degradan los alimentos en el aparato digestivo humano, destruyendo su ADN. ¿Transgénicos contaminantes? n Un motivo de debate es el riesgo derivado del flujo o migración de genes desde OMGs, al que los anti-transgénicos catalogan como “contaminación genética”: insisten en el riesgo que representa dicho escape de genes desde los OMGs, y denuncian que la adquisición de transgenes por cruzamiento espontáneo representa una amenaza para la “biodiversidad” de los ecosistemas. En el caso concreto de las plantas, se trata de que el polen de una planta transgénica fecunde una flor de una planta no transgénica, una posibilidad que sin ser anti-transgénico no se ha de ignorar, ya que acaece de forma natural y es parte de la evolución y diversificación que, desde su origen, han experimentado no solo las plantas sino cualquier ser vivo (incluidos los seres humanos). n Cuando, en febrero de 2001, se presentó el “libro de la vida” (i.e. secuencia completa de los 3.164 millones de pares de bases del genoma humano), uno de los datos más chocantes y polémico fue el hallazgo de 17 genes bacterianos intercalados entre los humanos, atribuida a un posible error experimental. El 12 de marzo de 2015, Alastair Crisp y sus colegas de la Universidad de Cambridge, en un estudio publicado en Genome Biology, no solo confirmaron que no se trataba de un error (los 17 genes sospechosos eran ciertamente bacterianos), sino que además nuestro genoma alberga otros 128 genes de procedencia muy diversa. Aunque uno de estos 145 genes “no humanos” es el gen bacteriano ABO (responsable del grupo sanguíneo), los demás se relacionan con procesos muy diversos e importantes (como por ejemplo, con el metabolismo de los ácidos grasos -13 genes-; con la modificación de grandes biomoléculas -15 genes-; con la respuesta inmune -7 genes-; con actividades antioxidantes de la célula -5 genes-). Como se ve, buena parte de nuestra interacción con el mundo microbiano se basa en genes adquiridos de los propios microbios. El gen que nos permite sintetizar ácido hialurónico es de origen fúngico, mientras que el gen que gobierna la masa corporal y la obesidad parece proceder de un alga. Además portamos 40 genes procedentes de gusanos. Hace millones de años, dichos genes eran para nuestros antepasados “transgenes”, similares a los que desde hace 20 años confieren a variedades biotecnológicas poder insecticida o resistencia a herbicidas, y que tanto rechazo generan, transgenes que para los humanos han terminado convirtiéndose en indispensables. En el mundo animal la transferencia horizontal ha sido hasta ahora polémica, salvo en casos muy especiales (los gusanos nematodos han adquirido genes de bacterias y hasta de plantas; algunos escarabajos (G. Phyllophaga) han importado genes bacterianos, que les permiten digerir las semillas de café; miembros de la familia de los ápidos -las abejas- han captado genes para la síntesis de los carotenoides -los colorantes del tomate y la zanahoria-, que les confieren una coloración naranja útil en su entorno. n Los grupos anti-transgénicos denuncian con frecuencia que la 1ª contaminación genética con un OMG se dio a conocer en 2001, afectando a variedades autóctonas de maíz en las montañas de Oaxaca (México). El trabajo que denunció tal hecho, publicado en Nature (Quist y Chapela, 2001), fue retractado por falta de rigor y al demostrarse la inexistencia de ADN de construcciones transgénicas en 153.746 muestras de las mismas variedades locales de maíz (Ortiz García et al., 2005). Ø En el 2010 se denunció una contaminación con semillas del arroz de grano largo transgénico Liberty Link, tolerante al glufosinato de amonio, desarrollada por Bayer CropScience AG, que según los denunciantes- en 2007 ya había afectado a 1/3 del arroz cultivado EE.UU. El juzgado de distrito de San Luis concedió una indemnización cercana a 2 millones de dólares a dos agricultores cuya cosecha arrocera resultó contaminada por variedades transgénicas de Bayer. Este proceso se puede considerar como un primer ensayo de las 3.000 demandas de los cultivadores de arroz damnificados en los estados de Missouri, Arkansas, Texas y Mississippi. En marzo de 2011, Bayer perdió un pleito interpuesto por la Riceland Food, una molienda de arroz de EE.UU., a la que tuvo que indemnizar 136,8 millones de dólares. Una nueva demanda, interpuesta en abril de ese mismo año, recordaba que “la pérdida económica global, relacionada con la contaminación por el Liberty Link de Bayer, había alcanzado entre 741 y 1.285 millones de dólares”, incluida la derivada del veto al arroz de EE.UU. impuesto por la UE. W. Wenning (Presidente del Consejo de Dirección) n Se sabe que la contaminación genética, debida al flujo o migración horizontal de genes, es un problema que no es exclusivo de los transgénicos sino de la agricultura en general. De cualquier forma, para que ocurra, las plantas han de ser sexualmente compatibles. Para que tenga algún impacto, se requiere que el transgén movilizado se exprese en el nuevo hospedador, convertida de esa forma en una nueva variedad híbrida (los transgenes solo tendrán un impacto significativo si pueden aumentar en frecuencia) y que logre persistir en las poblaciones naturales a las que accede. El impacto medioambiental de tal contaminación será positivo, si confiere ventajas competitivas frente a condiciones concretas (sequía, estrés salino, presencia de un herbicida, etc.). n En mayo de 2015 la revista PNAS publicaba un artículo del grupo del Dr. Jan F. Kreuze del Centro Internacional de la Papa (Perú), que confirmaba la presencia en la patata dulce (batata) cultivada “huachano” de secuencias de ADN-T de Agrobacterium rhizogenes, a pesar de no ser transgénico ni estar infectado por esta bacteria. La ausencia del ADN-T en parientes silvestres estrechamente relacionados con esta batata, sugiere que, en algún momento del pasado, tal vez coincidiendo con la domesticación de esta planta en América Latina, una infección por Agrobacterium le proporcionase con su ANT-T el rasgo o los rasgos seleccionados. n La hibridación de OMGs con plantas compatibles puede ser preocupante, en especial para cultivos que producen muchas semillas (por eso, para evitarlo, se diseñan OMGs estériles, como la banana productora de -caroteno o la colza resistente a herbicidas): puede afectar a cultivos convencionales, a parientes silvestres de la misma especie o de especies emparentadas. Sin embargo, hay factores que limitan la aparición de híbridos trangénico/no transgénicos. Entre individuos de la misma especie (silvestre o cultivada), se erige en limitante la distancia que los separa y la que puede recorrer el polen; entre especies diferentes, también entran en juego la sincronización de la floración, su compatibilidad genética, la viabilidad de la descendencia y la producción de semillas fértiles y, naturalmente, que el transgén se exprese o no en esa descendencia. n Respecto a la influencia ejercida por los OMGs sobre la biodiversidad de los ecosistemas, ocurre todo lo contrario de lo denunciado por los anti-transgénicos: cuando se hace biotecnología, en realidad no se pierde biodiversidad sino que se mantiene e incluso se mejora. La biotecnología, además de ayudar a preservar y mantener los recursos filogenéticos en bancos de germoplasma, crea seres vivos con genes que antes no tenían, acelerando un proceso que ocurre en la naturaleza. n En la actualidad se admite que la contaminación genética de las plantas se produce allí donde se cultivan plantas transgénicas, sin importar quién las desarrolle. El polen del maíz transgénico llega al maíz ecológico y las semillas que surgen a partir de esta unión son transgénicas. n Según datos de la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN), el 15% de los alimentos a la venta que contienen soja o maíz están ya contaminados por transgénicos. n Ante las acusaciones de contaminación por parte de los agricultores en general, y especialmente de los que practican la “Agricultura Ecológica”, Monsanto defiende su interés argumentando lo siguiente: “Nuestros productos han cambiado la forma en que se cultivan los alimentos y así se beneficia tanto a los agricultores como a los consumidores”. n Las distancias entre cultivos ecológicos y cultivos transgénicos no están reguladas. Los afectados por esta contaminación tenían la opción de denunciar a los propietarios de los cultivos transgénicos pero, para algunos, no era fácil denunciar a un vecino. A pesar de ello, las administraciones no han visto aumentado el número de denuncias entre agricultores. Los agricultores no denuncian porque eso significa tener problemas con un vecino. n Si las semillas de cultivo ecológico están contaminadas por transgénicos, pasan a ser semillas de cultivos convencionales. La contaminación es suficiente para que se descalifiquen de agricultura ecológica pero normalmente no deberían ser lo bastante como para que sean etiquetadas como transgénicas. El contagio de las semillas perjudica al agricultor ecológico ya que el cultivo convencional es menos rentable. Además, la contaminación del cultivo ecológico ha hecho que la superficie dedicada al maíz ecológico haya disminuido su extensión. Cada vez se cultiva menos maíz ecológico debido a que la contaminación está asegurada. Producir maíz ecológico, según las organizaciones ecologistas, es casi misión imposible. En la polinización, el viento no entiende de parcelas o de vallas. n En fincas que Monsanto tiene en Sevilla se producen las semillas europeas del maíz MON810 a unos metros de los cultivos de girasoles. En el maíz no hay abejas, es el viento el que lleva a cabo la polinización (arranca el polen del penacho que corona cada planta de maíz y lo transporta hasta la especie de cabellera –las sedas- que sobresale de cada mazorca). n España es el país europeo donde se han hecho los estudios más prolongados sobre coexistencia entre cultivos transgénicos y tradicionales. Se trata de aclarar si el maíz transgénico MON810 (enviado al valle del Ebro para luchar contra el taladro) se cruza en el campo con el maíz convencional (es el que prefieren utilizar los agricultores de Galicia, donde no existe la amenaza del taladro), que en la finca de Sevilla se cultiva en una parcela vecina. Se afirma que basta una separación de 20 m. para que no haya cruces por encima del 0,9%, umbral establecido para “etiquetar” un alimento como “transgénico”. § Monsanto ha admitido que sus productos contaminaban los cultivos naturales. Debe ser por eso que modificó hace poco su Acuerdo de Administración de Tecnología, de modo que transfiere la responsabilidad de sus productos a los agricultores que los compran. Paradójicamente, incluso los agricultores cuyos cultivos fueron contaminados por transgénicos, han sido demandados, a su vez, por Monsanto. La demanda afirma lógicamente que la contaminación genética constituye una infracción hecha a los agricultores que no quieren plantar semillas transgénicas y que sufren los daños económicos por culpa de ello. § La demanda afirma que, ya que “la contaminación es razonablemente previsible”, Monsanto debería perder sus patentes cada vez que venda sus semillas transgénicas. Eso no impediría la venta de sus semillas sino que permitiría a los agricultores guardar las semillas de los cultivos transgénicos. Y, puesto que la contaminación genética no se limita a las semillas de Monsanto, todas las empresas de semillas biotecnológicas se enfrentarían a la pérdida de sus derechos de propiedad intelectual. n Los daños de la industria biotecnológica no se limitan a las semillas de Monsanto y al uso de productos químicos. Con la finalidad de protegerse de la industria biotecnológica de alimentos, que toca incluso a los animales, se opina que habría que prohibir la posibilidad de patentar lo vivo. El juicio podría llevar a una prohibición de esa norma legal, como sucedía antes de que se pronunciase el Tribunal Supremo, en el 2001 (J.E.M. Ag Supply vs. Pioneer Hi-Bred International). § Farm Advantage, una industria estadounidense líder en innovaciones agrícolas, presentó infructuosamente una demanda de anulación de patente, con el argumento de que las plantas que se reproducen sexualmente, como el maíz 1507 de Pioneer-DuPont Company, no son patentables en acuerdo con el artículo 101. El demandante sostuvo que la Ley de Patentes Vegetales de 1930 (PPA) y la Ley de Protección de Variedades Vegetales (PVPA) en EE.UU. definen los medios legales exclusivos para proteger la vida de las plantas”. Cultivos transgénicos n Según el informe del Servicio Internacional para la Adquisición de Aplicaciones Agrobiotecnológicas –ISAAA- desde que empezaran a sembrarse por 1ª vez las semillas modificadas genéticamente (MGs), la apuesta global por estas variedades ha crecido cada temporada, acumulando 19 años de crecimiento estable: se ha pasado de 1,7 millones de hectáreas (ha) dedicadas a cultivos transgénicos en 1996, a 181,5 millones en 2014 (algo más del 1% respecto a las 175,2 millones sembradas en 2013). n Un total de 18 millones de agricultores de todo el mundo sembraron semillas MGs en 2014. El 90% eran pequeños agricultores de países en vías de desarrollo. De los 28 países que apostaron por estas semillas en 2014, un total de 20 correspondieron a países emergentes y en vías de desarrollo y tan sólo 8 a países industrializados. Es el 3er año consecutivo en el que la superficie cultivada en países en vías emergentes supera a la de los países industrializados. En 2014 se sumó a la lista de países Bangladesh, país en el que 120 agricultores apostaron por el cultivo de la berenjena Bt brinjal después de que este cultivo MG se aprobara en octubre de 2013. n EE.UU. fue el país que más aumentó la siembra de cultivos MG en 2014, arrebatando el liderato a Brasil, el país que registraba el mayor incremento mundial en los últimos 5 años. Esto se debe al récord en plantación de soja registrado en EE.UU. en 2014: un 11% más que en 2013. El 40% de cultivos MG del mundo se registraron en EE.UU. La figura adjunta muestra, entre 1996 y 2014, la evolución del área en acres (2,471 acres equivalen a 1 hectárea) con cultivos transgénicos en EE.UU. Cultivos modificados genéticamente (MGs) Millones de agricultores con cultivos MGs Pequeños agricultores de países en desarrollo Superficie cultivada con OGMs 19 Años (1996-2014) Millones de hectáreas (M) Mayoría para países en desarrollo (20) Países del mundo con cultivos MGs Billones de hectáreas Cosechas de cultivos MGs desde 1996 Países líderes en cultivos MGs EE.UU. Brasil Argentina 73,1 M 42,2 M 24,3 M India 11,6 M Canadá 11,6 Millones de hectáreas (M) Primer cultivo comercial en Bangladesh de berenjena Bt Brinjal Ø La berenjena es una hortaliza muy consumida en Bangladesh, y popular entre los pequeños agricultores y los consumidores de pocos recursos. Su problema es ser muy vulnerable a la larva de Leucinodes orbonalis, una polilla que se come sus frutos y brotes, por lo que su cultivo precisa un uso intensivo de insecticida. Los daños en frutos pueden ser del 95% y se han registrado pérdidas del 70% en plantaciones comerciales. Colza 7% Algodón 13% Maíz 29% Otros 1% Soja 50% Cultivos principales Soja Maíz Algodón Colza (canola) Otros cultivos Caña de azúcar Alfalfa Papaya Ø Para luchar contra esta plaga, además de los insecticidas y de los métodos de control biológico, se inTolerancia a herbicidas Rasgo dominante en La iniciativa política y los soja, maíz, colza, algodón, caña de azúcar y tentaron desarrollar cultivares recolaboradores privados han alfalfa sistentes mediante mejora tradiciohecho posible este éxito nal, pero con poco éxito, ya que no Mayor rendimiento Reduce la huella ecológica tenían a mano variedades o parienagrícola Más alimentos Contribuye a paliar tes resistentes que le prestaran sus Cultivos Reduce emisión de CO2 la pobreza y el genes. Así, fue una bacteria, el BaAyuda a conservar MG hambre Ayuda a mitigar el cambio la biodiversidad Mejor forma de vivir cillus thuringiensis, y la biotecnoloclimático Evita deforestar gía las que permitieron la berenjena Menor emisión de gases de “Bt Brinjal” resistente al taladro. efecto invernadero VENTAJAS Bolivia 1,0 Evolución de los principales cultivos modificados genéticamente (Dale, James. “Global status of comercial Biotech/GM crops 2014”, ISAA Brief, 4, 2014. ISAA, Ithaca, Nueva York) James Dale, Director del Centro para Cultivos y Bioproductos Tropicales (Universidad Tecnológica de Queensland, Brisbane, Australia) n Los 4 cultivos fundamentales de OMGs son: la soja, el maíz, el algodón y la colza. En 2014 era transgénica el 82% (90,7 Mha) de la soja; el 68% (25,1 Mha) del algodón; el 30% (55,2 Mha) del maíz, y el 25% (9 Mha) de la colza. Es decir, casi la mitad de los 378 Mha ocupadas en 2014 por estos 4 cultivos eran transgénicas. n En la carrera tecnológica y comercial la Unión Europea (UE) se ha quedado aislada. Los cultivos biotecnológicos europeos representan menos del 1% del total mundial sembrado en 2014. Europa se ha aislado en la apuesta por la tecnología agraria con el índice de adopción más rápido de la historia. El maíz transgénico en la UE en 2013 (en hectáreas) n España, Portugal, República Checa, Eslovaquia y Rumanía, los 5 países que en la UE apostaron por el cultivo de maíz Bt en 2013, se mantuvieron en 2014. La siembra en territorio europeo disminuyó un 3% respecto al 2013 (143.016 ha vs. 148.013 ha), una caída que también afectó a la siembra de variedades convencionales de maíz, y que es imputable a los bajos precios de venta y a las condiciones climatológicas. Portugal, Rumanía y Eslovaquia aumentaron la superficie de cultivos con maíz Bt, registrándose descensos mínimos en España y la República Checa. n España se mantiene como líder europeo destacado en la apuesta por el cultivo de maíz Bt MON810: en 2014, según estimaciones del Ministerio de Agricultura, Alimentación y Medio Ambiente, se cultivaron 131.538 ha -unas 83.000 según la información de las comunidades autónomas-. El 92% del total del maíz MG cultivado en la UE crece en nuestro país. n En España, el cultivo de maíz MG se inició en 1998 con la aprobación de una variedad de maíz transgénico Bt conocida como E176 (comercializado como NaturGard KnockOutTM). A partir de 2003, comenzó a comercializarse otra variedad de maíz Bt, el llamado MON810 (comercializado como YieldGardTM). Desde la retirada del mercado del maíz E176 en el año 2005, el maíz MOM810 es la única variedad que se cultiva. n Según datos del “Informe de la Evolución de la superficie estimada de siembra de maíz modificado genéticamente” (maíz Bt, en gráfica inferior) correspondiente al 2014, en España, publicado por el Ministerio de Agricultura, Alimentación y Medio Ambiente (MAGRAMA), a partir de su autorización, la superficie de maíz MG se ha incrementado a lo largo de los años en detrimento de los cultivos tradicionales. En efecto, desde su autorización en 1998, la superficie estimada de siembra de maíz Bt en España ha seguido una tendencia generalmente ascendente en comparación con la dedicada al cultivo de maíz convencional. Aunque 2014 fue un año en el que, tanto la superficie total de maíz cultivado, como la de maíz MON810 se redujeron respecto al 2013, la caída afectó menos a las siembras de maíz Bt -un 4,1% (131.538 vs. 136.962 ha)- que al maíz convencional –un 5,7% (285.462 vs 302.726 ha)-. Así, en 2014 la contribución porcentual del maíz MON810 al total de maíz sembrado continuó su tendencia al alza, incrementándose un 0,4% en relación al año anterior (31,6 vs. 31,2%). Evolución del cultivo de maíz transgénico en España (en hectáreas) La apuesta de los agricultores españoles por las semillas de maíz MG para protección frente a plagas de taladros se ha mantenido en 2014, año en el que prácticamente 1 de cada 3 hectáreas sembradas de maíz se dedican a este cultivo. Un total de 131.538 ha fueron sembradas en 2014 con variedades de maíz Bt ofrecidas por alguna de las 8 empresas que disponen de variedades MON810 registradas en sus catálogos comerciales. Porcentaje de cultivos de maíz MON810 en España España tiene 17 millones de hectáreas de terreno cultivable, de las cuales 417.000 (un 2,7% del total) están dedicadas al cultivo de las distintas variedades de maíz. Dentro de los cultivos de maíz, un 31,6% usan el maíz trasgénico MON810. Este dato se calcula en función de las semillas de MON810 vendidas, teniendo en cuenta la siembra de unas 85.000 semillas por hectárea. 0% 0%-10% ≥10% n En 2014, Aragón continuaba un año más como la comunidad autónoma con mayor superficie sembrada de maíz Bt con 54.040 ha. Le siguen: Cataluña (36.381 ha), Extremadura (13.814 ha) y Andalucía (10.692 ha). Los mayores incrementos se han registrado en Cataluña y Navarra, con 614 y 251 ha más que en 2013, respectivamente. n En 2015, según el Ministerio de Agricultura, Alimentación y Medio Ambiente (MAGRAMA) un total de 107.749,24 hectáreas fueron sembradas con maíz MON810, de Monsanto, representando el 31,6% del total de maíz sembrado en España (unas 340.000 ha). A la caída generalizada de la siembra de maíz (unas 77.000 ha menos que en 2014), se ha unido un claro descenso del maíz MG (23.790 ha menos, lo que a pesar de suponer una fuerte caída, del 18,2%, es un 0,3% inferior a la experimentada por los cultivos de maíz convencional). n La apuesta de los agricultores españoles, desde 1998, por el maíz Bt confirma la confianza y los beneficios económicos, medioambientales y sociales que estas variedades aportan para el desarrollo de una agricultura más sostenible, que permite incrementar la producción del cultivo, reduciendo el consumo de recursos por unidad de producción (menos suelo, menos agua, y menos energía). Se cree que si los agricultores europeos pudieran cultivar las variedades MG aprobadas en los países competidores podrían tener un ingreso extra de entre 443 y 929 millones de euros al año. Municipio declarado libre de MON810 Municipio con cultivo de MON810 (período 2010-2012) Municipio declarado libre de MON810 pero con cultivo de MON810 (período 2010-2012) n Este cultivo también permitió en sus primeros 15 años una producción extra de 853.201 toneladas. Para conseguir esta producción adicional con cultivos convencionales habría sido necesario incrementar la superficie de cultivo, lo que conllevaría un consumo añadido de agua, equivalente a la que se precisa para abastecer anualmente a 59 ciudades de 10.000 habitantes. n La producción de maíz en España no cubre las necesidades internas de consumo y es necesario importar cada año unos 6 millones de toneladas de maíz (más de la mitad de todo el consumo). Sin embargo, el aumento en la producción por hectárea local del maíz Bt, debido a menores pérdidas por ataque de las plagas de taladro, mejora la balanza de comercio para este cereal y disminuye la dependencia de importaciones: su cultivo ha permitido reducir las importaciones españolas de maíz en más de 853.000 toneladas entre 1998 y 2013, con un ahorro derivado de 156 millones de euros. Una contribución clave para el comercio exterior español, deficitario en este cultivo. El desarrollo de cultivos GMs no es exclusivo de las grandes industrias multinacionales ni de los países industrializados Multinacionales productoras de cultivos transgénicos: cuota de mercado en el Mundo Programas de MG de Monsanto en España n Monsanto gasta 8,8 millones de euros al año en I+D en Murcia y Almería. En 55 hectáreas, de las que el 50% corresponden a invernaderos, repartidas entre 4 centros (en La Mojonera*, El Ejido y Cuevas de los Úbedas∆ –Almería- y Miranda –Murcia-), unos 50 investigadores y 20 técnicos de campo desarrollan nuevas variedades para Monsanto. n En cultivos de invernadero Monsanto tiene en marcha un total de 13 programas de mejora genética, entre los que destacan los proyectos en tomates, pepinos, pimientos, melón, berenjena y calabacín. * ∆ n Especial interés tienen las investigaciones en el tomate, el producto más importante de la huerta ibérica. España vende fuera más de 1.200 millones de euros en tomates al año, lo que representa un 0,5% de las exportaciones del país. Monsanto persigue obtener variedades adaptadas a diferentes zonas de la Península, cada una de ellas con su evolución de las temperaturas y sus fechas específicas de siembra. Todas deben resistir a las enfermedades y a los procesos de envasado y transporte. Y, lo que más importa, hacerlo manteniendo su sabor. n Un objetivo similar tienen las investigaciones en nuevas variantes de pepino, orientadas especialmente hacia la exportación a EE.UU. El consumidor del país americano prefiere la variedad “holandesa” del vegetal, larga y sin espinas. Monsanto busca una variante que crezca bien bajo las temperaturas elevadas del sur de España y que, a la vez, sea capaz de tolerar el frío durante los meses de otoño e invierno, con el fin de llegar en buen estado a los mercados importadores. n Entre los cultivos al aire libre que investiga la multinacional estadounidense, destacan el melón, la lechuga, la cebolla, la sandía, la zanahoria, la espinaca, el puerro y la judía verde. En lo que se refiere al melón, uno de los principales productos para la exportación, se han logrado variedades para cubrir todo el ciclo de cultivo. n El objetivo final es que el agricultor obtenga mejores rentas a través de productos de mayor calidad, más competitivos, adaptados a los gustos de los consumidores y desarrollados con respeto al medio ambiente. n Gracias a esa apuesta por la innovación -que le cuesta al año alrededor de 10 millones de dólares (8,8 millones de euros) en España y 1.725 millones en todo el mundo, casi el 11% de su facturación-, Monsanto ha roto el tradicional predominio de las empresas holandesas en los huertos de España. Muchas adquiridas por Monsanto, que en el terreno hortifrutícola opera sobre todo con las enseñas Seminis y De Ruiter. n Ni siquiera en el desarrollo de nuevas variedades de hortalizas “naturales”, Monsanto puede escapar de la polémica. La empresa afirma que el desarrollo de una variedad de vegetal puede tardar entre 8 y 12 años y que hace un uso intensivo de mano de obra y capital, por lo que tiene derecho a beneficiarse de los rendimientos económicos de ese esfuerzo patentando el producto resultado de esas investigaciones. Diversas organizaciones ecologistas y de consumidores se han movilizado en contra de esas intenciones. n La batalla se libra sobre todo en la Oficina Europea de Patentes (OEP). El artículo 53 de la legislación comunitaria prohíbe el registro comercial de “variedades de plantas y animales o procesos esencialmente biológicos”. Aún así, la OEP tiene pendientes de resolución 2 casos: uno sobre una variedad de brécol genéticamente modificada para tener propiedades anticancerígenas, y el otro, sobre una cultivo del melón cuyos melones son más resistentes al virus del amarilleamiento de las cucurbitáceas (CYSDV, de “Cucurbit Yellow Stunting Disorder Virus”). Este último proceso, desarrollado en parte en Aguadulce (Almería), es propiedad de Monsanto. n Constituida en 1901 en el sector de la industria química y farmacéutica, Monsanto hizo su apuesta por el sector agrario hace más de 50 años. La facturación de la multinacional en la Península es de 84 millones de euros, entre semillas y herbicidas. El mercado europeo es relativamente pequeño en las cuentas de la empresa estadounidense, que incluye los resultados en el continente con los obtenidos en África; aún así, no superan el 14% de los ingresos totales. n A su vez, el negocio de las hortalizas es relativamente menor dentro de las múltiples actividades de Monsanto. En 2014, las ventas de semillas de verduras representaron 867 millones de dólares, un 5,5% de los ingresos del grupo. La parte de este negocio en el beneficio bruto es aún menor: 401 millones de dólares, un 4,6% del total. Pese a su escaso tamaño en el grupo, las cifras impresionan. 4.000 empleados de Monsanto están trabajando en más de 2.500 variedades de más de una veintena de cultivos de hortalizas, que se comercializan en más de 160 países. Una cuarta parte de estos empleados trabajan en los departamentos de innovación y desarrollo (I+D). Transgénesis y clonación n Por "clonación" se entiende el conjunto de técnicas utilizadas para la obtención de clones. El término "clon" se refiere a líneas celulares u organismos genéticamente idénticos, obtenidos por medio de la multiplicación asexual de un solo individuo y que, por lo tanto, son fenotípicamente similares a éste. n Al contrario de lo que pudiera parecer, los clones son bastante frecuentes en la naturaleza. n Los organismos unicelulares, como las bacterias, protozoos o levaduras, se reproducen generalmente de forma asexuada; son, por lo tanto, clones unos de otros. n Otros clones también comunes son las plantas que proceden de la reproducción vegetativa, es decir, asexual, entre las que se incluyen, por supuesto, aquellas que en nuestras casas y jardines multiplicamos por esquejes. Por lo general, los clones resultan de la reproducción asexual de un organismo, es decir, derivan de uno de los padres. n En animales superiores, incluidos los humanos, también se producen clones de forma natural, aunque son más raros; es el caso de los llamados gemelos univitelinos (gemelos auténticos). Transferencia nuclear de células somáticas (1987) Transmisión 100% 100% Transgénicos Ovocito enucleado Donante de la célula somática Raza Finn Dorset En 1997, científicos escoceses uti- Proveedora del ovocito lizan células adultas (de una oveja Raza Scottish de 6 años de edad, de la raza Finn Blackface Dorset) para crear un cordero genéticamente idéntico: llamado Dolly. Era la 1ª vez que se clonaba un vertebrado acudiendo a la “activación de ovocitos mediante transferencia nuclear de células somáticas adultas”. 1) Una célula de sus ubres fue situada en un medio donde se mantenían en fase G0, convirtiéndose en una célula no especializada. 4) La célula forma un embrión, que es implantado en el útero de una madre de alquiler. Madre de alquiler Raza Scottish Blackface 2) Con una micropipeta se retiró el núcleo del ovocito. Dolly y su creador Ian Wilmut (Roslin Institute, Edimburgo, 3) Las células de las 2 ove- Escocia) jas se fusionaron mediante una descarga eléctrica, obteniéndose una célula híbrida (con el núcleo y los genes de una oveja y el citoplasma de la otra). Dolly, el clon Raza Finn Dorset 5) La madre de alquiler parió 5 meses más tarde (el 5 de Julio de 1996) un cordero que era un duplicado genético (un clon) de la oveja donante Finn Dorset. Dolly y su madre de alquiler Granjas farmaceúticas: animales de diseño Secuencia promotora para la síntesis de una proteína presente en la leche (lactoglobulina) Gen humano (proteína C) Gen híbrido r e g i ó n codificante humana Óvulos de cerda fecundados región reguladora murina n Primer animal transgénico (R. Palmiter y R. Brinster, 1982): ratón portador del gen de la hormona humana de crecimiento (somatotropina). Inyección del gen híbrido en el núcleo n Genie, cerda transgénica creada en 1991 del cigoto porcino por W. Velander (Virginia Polytechnic Insti- tute, Blacksburg, Virginia), producía en su leche 1 g/l de proteína C humana (cantidad 200 veces superior a la detectada en nuestra sangre), enzima que degrada ciertos factores de coagulación. 300 litros de leche al año n En 1992 y 1993 se obtuvieron cerdos transgénicos productores de hemoglobina humana, útil como sustituto de la sangre humana: un cerdo podría aportar 20 unidades de sangre al año, 5 veces más que un donante humano. 2. Óvulo de vaca enucleado (sin núcleo) Gen humano (lactoalbúmina) 3. Fusion celular (descarga eléctrica) 1. Se inserta el gen en una célula bovina de la raza Jersey Transgénicos clónicos Óvulo activado con núcleo transgénico Célula bovina con núcleo transgénico 5. El embrión transgénico se inserta en una vaca nodriza n La vaca Rosita ISA (Instituto Nacional de Tecnología, Universidad de San Martín, Buenos Aires, Argentina), nacida el 6 de abril de 1997, fue el 1er bovino transgénico capaz de expresar en sus células mamarias un gen humano: producía leche enriquecida con lactoalbumina humana (2,4g/l). 4. El embrión transgénico se cultiva in vitro n En 1998, José B. Cibelli (Universidad de Massachussets, Amherst, Ma., EE.UU.) cre terneras cuya leche estaba enriquecida en somatotropina humana (40 g/l.). 6. Nace una ternera transgénica 7. Leche con lactoalbúmina humana n En 2003 se obtuvieron 11 vacas clónicas capaces de dar leche con un 8-10% más de caseína. Ellas no expresan un gen extraño sino uno propio, aunque de forma distinta, mejorando la producción de caseína. Transgénesis y fitorremediación n La fitorreparación o fitorremediación es el empleo de plantas con capacidad (natural o adquirida por transgénesis mediante ingeniería genética) para limpiar ambientes contaminantes. Se basa en la capacidad que tienen algunas plantas para absorber, acumular y/o tolerar altas concentraciones de contaminantes (metales pesados, compuestos orgánicos, etc.).n Según para qué se empleen las plantas, el proceso de fitorremediación es diferente (figura adjunta), conociéndose como: § Fitoextracción (la planta actúa como acumulador de contaminantes, que ella extrae del suelo e incorpora a sus tejidos). § Fitodegradación (la planta libera sustancias que estimulan el crecimiento microbiano, un proceso de fitoestimulación que hace posible la degradan simultánea -cometabolismo- de dichas sustancias y los contaminantes orgánicos de su entorno). Ø Las plantas pueden usarse como bombas extractoras de bajo costo para depurar los suelos, las aguas y el aire. Lo pueden hacer § Rizofiltración (la raíz de la planta absorbe y solas o con la inestimable colaboración de cieradsorbe contaminantes, principalmente metales tos microorganismos. del agua y de corrientes de agua contaminadas). § El girasol (Helianthus annuus) absorbe grandes cantidades del uranio depositado § Fitoestabilización (la planta reduce la biodispoen el suelo. nibilidad de contaminantes del entorno). § Los álamos o chopos (Populus spp.) absor§ Fitovolatilización (la planta volatiliza contamiben selectivamente níquel, cadmio y zinc. nantes del entorno). Biotecnología de transgénicos aplicada a solucionar problemas medioambientales n Se ha eliminado el mercurio contaminante del suelo (por ejemplo, metil-mercurio) con la ayuda de plantas transgénicas de Arabidopsis thaliana, que fueron transformadas con dos genes provenientes de microorganismos (el gen de la ión mercúrico reductasa, gen MerA, y el gen de la organomercurial-liasa, el gen MerB). n Plantas transgénicas de tabaco con genes provenientes de bacterias (como por ejemplo, el gen de la tetranitrato reductasa de Pseudomonas spp.) capaces de detoxificar trinitrotolueno (TNT) y nitroglicerina en suelos de campos minados. n La compañía biotecnológica Aresa, a finales de 2008, inició en Serbia ensayos con plantas modificadas genéticamente para detectar explosivos ubicados en el suelo (como por ejemplo, minas antipersona). Se trata de una variante de Arabidopsis thaliana capaz de actuar como biosensor de dióxido de nitrógeno (O2N) en el suelo: cuando crece en el entorno de minas anti-persona, cambia su color, que pasa de verde a rojo (plántulas de la parte inferior de la foto adjunta). Esta tecnología se denomina RedDetect. Plantas transgénicas productoras de plásticos biodegradables PHA Alcaligenes eutrophus Ralstonia eutropha Enzimas Gen de PHA síntesis (pha C1-A-B1) de Ralstonia eutropha Arabidopsis thaliana Brassica napus Estructura general PHA (m, igual a 1, 2 o 3; m, oscila entre 100 y varios miles)