VALORACIóN RADIOLógICA DE LAS ARTROpLASTIAS
Anuncio

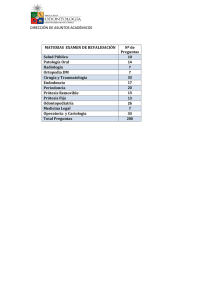
Valoración radiológica de las artroplastias Radiological aspects of Arthroplasties Sara Eugenia García1 John Henry Barragán1 Jorge Andrés Narváez1 Jorge Alberto Carrillo Bayona2 Resumen Palabras clave (DeCS) Artroplastia Prótesis e implantes Falla de prótesis Infección Key words (MeSH) Arthroplasty Prosthesis and implants Prosthesis failure Infection El perfeccionamiento de técnicas quirúrgicas; el desarrollo de nuevos materiales protésicos; el aumento en la expectativa de vida, y la mayor cobertura de salud han aumentado la realización de reemplazos articulares en nuestro país. El radiólogo debe estar familiarizado con los diferentes tipos de cirugía y elementos utilizados, la valoración de los componentes y el diagnóstico de complicaciones asociadas. En general, las principales artroplastias que se realizan en nuestro medio son de hombro, codo, cadera y rodilla. En este artículo se revisan los elementos protésicos utilizados, la valoración radiológica de las artroplastias y las complicaciones derivadas de estos procedimientos. Summary The development of new surgical techniques, of new prosthetic materials, and the increase in life expectancy with greater coverage of health services has augmented the performance of hip replacements in our country.The radiologist should be familiar with the different surgical techniques and prosthetic devices, the evaluation of it´s components and associated complications. The most frequently performed arthroplasties are: shoulder, elbow, hip and knee replacement. This article reviews the most frequent prosthetic devices used , the radiological aspects of arthroplasties and their most common complications. Introducción 1 Residente de tercer año de Radiología. Hospital de San José. Fundación Universitaria de Ciencias de la Salud (FUCS). Bogotá, Colombia. 2 Médico radiólogo. Hospital de San José. Fundación Universitaria de Ciencias de la Salud. (FUCS). Bogotá, Colombia. 2454 Las artroplastias comprenden todos los procedimientos quirúrgicos destinados a sustituir total o parcialmente una articulación, con el fin de disminuir el dolor, aumentar la movilidad, la estabilidad, y brindar una mejor calidad de vida al paciente con lesión articular degenerativa, traumática o inflamatoria (1-3). A medida que la población mundial se hace más longeva, es más frecuente la realización de este tipo de cirugías. Las articulaciones que requieren artroplastias con mayor frecuencia son: cadera, rodilla, hombro y codo (2,4). Se calcula que en el mundo se realizan alrededor de 800.000 reemplazos de cadera anuales, sin tener en cuenta las artroplastias de rodilla que ocupan el segundo lugar en frecuencia y las de otras articulaciones menores, cuya cifra continúa en aumento (5). El radiólogo desempeña un papel fundamental en la valoración pre y postquirúrgica del paciente con reemplazo articular, por lo cual debe estar familiarizado con los tipos de prótesis, la valoración de sus componentes y las posibles complicaciones asociadas. Indicaciones y valoración prequirúrgica Las indicaciones para cada uno de los tipos de prótesis varían según la articulación que se va a reemplazar, la patología de base y la edad del paciente. La osteoartrosis es la causa más frecuente de lesión articular que requiere reemplazo, seguida por artritis reumatoidea, artropatía postraumática, necrosis avascular, deformidades congénitas, y en pacientes jóvenes el salvamento de extremidad en casos de neoplasia (2,6-8) Los factores relacionados con el paciente son importantes para escoger el mejor tipo de artroplastia según la edad y el peso. La edad determina el tiempo de duración de la prótesis y la frecuencia de complicaciones intraoperatorias (3). Contrario a los primeros informes, no hay estudios que demuestren que el género influye en el tipo artículos de revisión de prótesis a usar o en la duración de la misma (9). El peso del paciente determina el tipo de material que se debe utilizar, metálico (cromo, cobalto, titanio) o polietileno. La presencia de osteoporosis hace necesario el uso de cemento para aumentar la resistencia del hueso que entra en contacto con la prótesis (6). Condiciones especificas como insuficiencia vascular, inmunosupresión, disfunción neurológica e infección articular contraindican la realización de artroplastias (2). Evaluación radiológica de las artroplastias El abordaje inicial del paciente con reemplazo articular se hace con la radiografía convencional. Se deben obtener proyecciones perpendiculares de la articulación, adecuadamente centradas y penetradas, que permitan evaluar la relación entre la prótesis y el hueso subyacente, así como la presencia de complicaciones (1,2,8). La atención inicial debe dirigirse hacia las superficies y relaciones articulares, para comprobar la posición adecuada de los componentes protésicos. Luego, se debe evaluar la alineación de la prótesis con respecto al hueso nativo (8). Artroplastia de cadera Los tipos de reemplazos más utilizados en la articulación de la cadera son: la hemiartroplastia unipolar, indicada en pacientes ancianos con fractura de fémur, y consiste en un vástago femoral con cabeza metálica que coincide con el acetábulo nativo; la hemiartroplastia bipolar, formada por un vástago femoral con anillo acetabular (Fig. 1) y el reemplazo total, que consta de un componente femoral metálico y uno acetabular metálico o de polietileno (Figs. 2a, 2b), (6,10). Valoración específica Se deben obtener proyecciones AP y lateral que permitan observar la totalidad de los componentes acetabular y femoral de la prótesis, el cemento y el hueso adyacente. Los elementos que debe incluir el análisis de las prótesis coxofemorales son: 1. Componente femoral. La cabeza femoral protésica debe encontrarse equidistante al reborde acetabular (signo de los anillos de Saturno), (Fig. 3). El ángulo cervicodiafisario entre la prótesis y la diáfisis femoral debe estar entre 135º y 155º. Ángulos menores de 135º indican deformidad en varo, que aumenta la frecuencia de aflojamiento protésico o fractura periprotésica. Ángulos mayores de 155º predisponen a luxación de la prótesis (Fig. 4). El componente femoral debe encontrarse alineado con la diáfisis del fémur (1-3,5). 2. Componente acetabular. Se valora con el ángulo de inclinación con respecto a la línea isquiática, cuyo valor normal debe encontrarse entre 30º y 55º. Valores mayores de 55º aumentan el riesgo de luxación del vástago femoral (Fig. 5), (1,5,6,11) 3. Posición de los componentes protésicos con respecto a la pelvis. La línea de Kohler permite determinar la migración de los componentes al interior de la pelvis (Fig. 6). En casos de migración del componente acetabular o del cemento de fijación, se observa material protésico medial a la línea de Kohler. Así mismo, el cambio en la distancia de esta línea al centro de la cabeza femoral (en estudios de control) es indicativo de migración del componente femoral (5,12). los casos y en el componente femoral varía entre el 5% y el 18%. El diagnóstico se establece por la presencia de una línea radiolúcida entre la prótesis y el hueso o entre el cemento y el hueso, mayor de 2 mm de espesor. La progresión de esta línea en estudios sucesivos también indica aflojamiento (2,3). La radiolucidez debe describirse de acuerdo con su localización en zonas acetabulares y femorales que avanzan de lateral a medial (Fig. 7) (14). La presencia de esta línea en una de las zonas acetabulares (principalmente la II) o dos femorales es indicativa de aflojamiento protésico (Figs. 8a, 8b). Otros signos de aflojamiento aséptico incluyen migración de los componentes hacia superior o medial, el cambio en la alineación y la fractura del cemento o de los elementos protésicos (1-3,6,15,16). 2. Infección. La frecuencia de esta complicación informada en la literatura se encuentra entre el 1% y el 5% en el primer año postquirúrgico. Los agentes causales que se aíslan más frecuentemente son Staphylococcus aureus y Staphylococcus epidermidis (2,3,15,17,18). La sensibilidad de la radiología convencional para el diagnóstico de infección protésica es baja (25% y 50%); sin embargo, la especificidad de signos como la reacción perióstica y la irregularidad cortical en el contexto clínico de un paciente con reemplazo articular es cercana al 90% (2,19). En casos dudosos, el seguimiento radiológico o la realización de estudios adicionales como la artrografía, la punción y aspiración del líquido articular y la gamagrafía son útiles para determinar la necesidad de reintervención (17). 3. Luxación. Es la complicación más fácil de diagnosticar en la radiología simple, y su incidencia está descrita entre el 0,4% y el 0,8% de los casos. Los factores asociados a luxación son: tipo de abordaje quirúrgico, género (mayor en el sexo masculino), edad (más frecuente en mayores de 70 años), mala alineación de los componentes (Fig. 9) y avulsión del trocánter mayor (20). Este último factor debe ser tenido en cuenta en pacientes que persisten con fractura del trocánter después de 12 semanas, a pesar de tener alambres de fijación (2,6,21,22). 4. Fracturas femorales periprotésicas. Esta complicación ha disminuido en frecuencia durante la última década, por el desarrollo de nuevos materiales protésicos. Se asocian con aflojamiento de la prótesis. La conminución y la pérdida de sustancia ósea son de mal pronóstico (1,2,6). Complicaciones Las principales complicaciones en artroplastias de cadera son: aflojamiento protésico, infección, luxación y fractura periprotésica. 1. Aflojamiento protésico. Se produce tanto en prótesis cementadas como en prótesis no cementadas. Los mecanismos incluyen inadecuada posición de los componentes y osteólisis secundaria a la reacción causada por el material protésico (13). En el componente acetabular tiene una frecuencia del 2% al 8% de Rev Colomb Radiol. 2008; 19(3):2454-60 Fig. 1. Artroplastia bipolar derecha y reemplazo total izquierdo con componente acetabular de polietileno. 2455 a b Figs 2a y 2b. Artroplastia total con componentes acetabular y femoral metálicos. Fig. 3. Artroplastia bipolar cementada que muestra la cabeza femoral en el centro del componente acetabular: signo de “anillos de Saturno”. Fig. 5. Angulo de Sharp para la valoración de la inclinación del componente acetabular. Fig. 4. Reemplazo total de cadera con ángulo cervicodiafisiario de 145º. Fig. 6. Línea de Kohler: su relación con la cabeza femoral y el borde del componente acetabular permite identificar la migración protésica al interior de la pelvis. a b Fig. 8. Signos de aflojamiento de los componentes femoral (a) en las zonas I, IV, V y VI y del componente acetabular (b) en las zonas I, II y III. Fig. 7. División de los componentes acetabular y femoral en zonas. 2456 Valoración radiológica de las artroplastias. García S, Barragán J, Narváez J, Carrillo J. artículos de revisión Fig. 9. Luxación de componentes femorales relacionada con aumento del ángulo de inclinación de los componentes acetabulares. Artroplastia de rodilla Las técnicas utilizadas incluyen la sustitución de uno, dos o de los tres compartimentos articulares (femorotibial medial, lateral y patelofemoral) con material protésico. Las prótesis unicompartimentales se utilizan con mayor frecuencia para reemplazar el compartimento medial (en ausencia de alteración del compartimento lateral), (23). Las prótesis bicompartimentales sacrifican el ligamento cruzado anterior, y pueden o no preservar el ligamento cruzado posterior. En casos de patología asociada de la rótula, se realiza la artroplastia tricompartimental o reemplazo total, que incluye una prótesis de polietileno en la patela (Figs. 10a, 10b, 10c) (2,10,14,24-26). Valoración específica estos signos están presentes se debe realizar gamagrafía ósea para confirmar el diagnóstico, y determinar la necesidad de reintervención. (1-3,7,17,35). 2. Aflojamiento protésico. Los signos radiográficos indicativos de aflojamiento incluyen la presencia de una línea radiolúcida de 2 mm, entre la prótesis y el hueso mayor; el desplazamiento de la prótesis y la fractura del cemento. Para confirmar el diagnóstico, los signos radiológicos deben acompañarse de dolor e inestabilidad articular. El componente tibial por ser el que más peso soporta tiene una mayor incidencia de aflojamiento. La desviación en varo de la prótesis (ángulo femorotibial menor de 2º) constituye un factor de riesgo para aflojamiento (Fig. 12) (1,2,7,36,37). 3. Fracturas periprotésicas. Se presentan en tibia, fémur y rótula (hasta en el 3% de los pacientes). Son más comunes en pacientes con osteopenia o con mala alineación de uno de los componentes (Fig. 13). Generalmente son de fácil diagnóstico en la radiología convencional; sin embargo, en pacientes con dolor crónico y radiografía normal, está indicada la resonancia magnética, por su capacidad para detectar fracturas no evidentes en la radiografía (2,7,24,38). 4. Inestabilidad articular y limitación para la extensión. Son complicaciones descritas en los reemplazos de rodilla, con una incidencia máxima del 13%. Se presentan después de uno o dos años de la cirugía, y son la causa principal de reintervención. Su diagnóstico se basa en el examen físico, y se confirma practicando proyecciones con estrés (2,7,24,36,37). Las proyecciones radiológicas importantes para la valoración de la artroplastia de rodilla son: lateral en flexión y anteroposterior en bipedestación, que permiten observar las relaciones articulares y la alineación de los componentes protésicos (27). Los puntos indispensables a considerar en la valoración de las artroplastias de rodilla son: 1. Proyección AP. Valora la relación entre los ejes femoral y tibial de las prótesis. El ángulo entre los ejes debe ser de 7º +/- 5º (1,7,24). La desviación en valgo es aceptable; sin embargo, la desviación en varo afecta la estabilidad de la articulación, y disminuye la duración de la prótesis. Los componentes femoral y tibial se deben encontrar perpendiculares a los ejes largos de fémur y tibia respectivamente, con una variación permitida hasta de 5º. Ángulos mayores se consideran en valgo y menores en varo. Estas alteraciones de la alineación condicionan mayor riesgo de aflojamiento (Fig. 11) (1,2,6,24,28,29). 2. Proyección lateral. La relación entre la diáfisis del fémur con el aspecto posterior de su componente protésico debe ser de 100º, y la de la tibia con su prótesis debe ser de 90º con igual variación. La patela debe encontrarse adecuadamente centrada en las proyecciones axiales (Fig. 11), (2,6,28). Artroplastia de hombro Complicaciones Complicaciones Las complicaciones postquirúrgicas tempranas (en los primeros 90 días) son comunes a otras cirugías mayores (infarto agudo de miocardio, tromboembolismo pulmonar, neumonía) o al apoyo temprano de la extremidad (luxación protésica) (30). En el periodo tardío (después de tres meses) se puede presentar infección, aflojamiento protésico, fractura de la patela, inestabilidad y dificultad para la extensión completa de la pierna (2,4,6,17,31-33). 1. Infección primaria de la prótesis (infección profunda). Tiene una incidencia del 1,2 % al 2%, y los gérmenes que se aíslan con mayor frecuencia son: S. aureus, S. epidermidis, P. aeruginosa y E. col. (18,34). Los signos radiológicos indicativos de infección son: aflojamiento y reacción perióstica. Cuando Rev Colomb Radiol. 2008; 19(3):2454-60 Existen dos tipos principales de prótesis de hombro. El primero corresponde a la hemiartroplastia, en la que se reemplaza únicamente el tercio proximal del húmero, y se mantiene la cavidad glenoidea nativa. El segundo tipo es el reemplazo total de la articulación, con un componente glenoideo que se fija a la escápula y un componente humeral. La decisión de usar únicamente el reemplazo humeral se basa en la integridad del cartílago glenoideo y del tendón del manguito de los rotadores. Se utilizan prótesis metálicas o de polietileno, y se fijan con o sin cemento (Figs. 14a, 14b) (2,6,39-42). Valoración específica Las prótesis de hombro se valoran mediante proyección oblicua posterior en rotación interna y proyección axilar. La valoración específica de estos reemplazos incluye: 1. Relación glenohumeral. La cabeza humeral debe encontrarse centrada o ligeramente descendida con respecto a la cavidad glenoidea. 2. Alineación protésica. El ángulo entre el eje de la prótesis y la diáfisis humeral debe ser menor de 5º, para evitar el aflojamiento y la presencia de fracturas periprotésicas (41,42). Las complicaciones incluyen: aflojamiento de los componentes glenoideo y humeral, luxación o subluxación, migración superior de la prótesis y fractura periprotésica. Se presentan en aproximadamente el 50% de los pacientes, aunque por lo general son de bajo impacto y sólo un tercio de ellas requiere corrección quirúrgica (2,6,43). La complicación más frecuente es el aflojamiento protésico (Fig. 15), con una incidencia entre el 7% y el 15%, y se observa como progresión de línea radiolúcida periprotésica en estudios de seguimiento (2). La luxación y subluxación de la prótesis se presentan en el 6% de los casos, y son más frecuentes en el postoperatorio temprano. 2457 a c b Fig. 10. Tipos de artroplastia de rodilla: (a) Prótesis unicompartimental medial. (b) Prótesis bicompartimental cementada. (c). Reemplazo total con componente patelar de polietileno. Fig. 11. Artroplastia de rodilla. Valoración de las proyecciones AP y lateral con ángulos normales. a Fig. 12. Prótesis bicompartimental de rodilla, con signos de aflojamiento: desplazamiento lateral y posterior del componente tibial, con línea radiolúcida adyacente mayor de 2 mm. b Fig. 14. (a) Prótesis total de hombro con componente glenoideo convexo. (b) Hemiartroplastia de hombro. Artroplastia de codo Para la artroplastia de codo se utilizan hemiartroplastias de cúbito o radio y reemplazos totales (Figs. 16a, 16b, 16c). Este último tipo está constituido por prótesis con componentes articulares de titanio o cobalto con recubrimiento de polietileno, reemplazando el húmero y el cúbito, y es el más frecuentemente utilizado, porque conlleva menor número de complicaciones (6,44-47). Valoración específica La evaluación radiológica comprende las proyecciones AP y lateral de codo, y debe incluir: 1. Superficies y relaciones articulares. Deben ser comparadas en estudios de seguimiento con respecto a la imagen obtenida en el postoperatorio temprano, para determinar si hay cambios en la 2458 Fig. 13. Fractura de la diáfisis femoral sobre el vástago protésico. Fig. 15. Artoplastia total con componente glenoideo de polietileno que muestra línea radiolúcida adyacente mayor de 2 mm de espesor, en relación con aflojamiento. posición relativa de las prótesis, que sugieran desgaste del componente de polietileno, alterando las relaciones articulares (48,49). 2. Alineación. Medir el ángulo formado entre la diáfisis de húmero y cúbito con el eje del componente protésico respectivo. El valor de este ángulo debe ser de 0º (neutro), aceptando variaciones hasta de 4º. Desviaciones mayores en varo o en valgo no aumentan el riesgo de aflojamiento, pero disminuyen la movilidad de la articulación en flexión (50,51). 3. Espesor de la capa de cemento óseo. Inicialmente se consideró un indicador importante de aflojamiento; sin embargo, se ha demostrado actualmente no tener valor pronóstico en este sentido, excepto cuando se observa una clara disminución del mismo en estudios de control (48,49). Valoración radiológica de las artroplastias. García S, Barragán J, Narváez J, Carrillo J. artículos de revisión a b c Fig. 16. (a) Artroplastia total de codo con componentes humeral y cubital. (b) y (c) Hemiartroplastia de radio. Fig. 17. Reemplazo total de codo que muestra fractura del húmero en región periprotésica, con reacción perióstica (osteomielitis). Aflojamiento del componente cubital con línea periprotésica radiolúcida. Complicaciones Las principales complicaciones de la artroplastia de codo son: aflojamiento con una frecuencia del 6% al 17%, infección hasta en el 8%, inestabilidad articular residual en el 7% al 19% de los pacientes y menos frecuentemente, lesión del nervio radial intraoperatoria y fractura de los componentes protésicos (Fig. 17), (2,6,51,52). En cuanto al aflojamiento protésico, de manera análoga a esta valoración en las prótesis de cadera, Goldberg y colaboradores han desarrollado una división de las prótesis totales de codo en zonas, que permite determinar la severidad del aflojamiento y establecer su pronóstico (48,49,51). La división se hace en cuatro zonas para cada uno de los componentes. La primera corresponde al reborde articular y las otras tres, al resto del vástago dividido de manera simétrica (Fig. 18). Se considera que el aflojamiento con línea radiolúcida en una o dos zonas es focal, y se asocia con desgaste normal de la prótesis, principalmente en las zonas periarticulares. Sin embargo, cuando la radiolucidez periprotésica o alrededor del cemento comprende tres o más zonas, se denomina aflojamiento difuso, y se asocia con mayor incidencia de fracturas periprotésicas. Conclusión La valoración del reemplazo articular tiene como pilar fundamental la radiografía convencional que (a un bajo costo y con fácil acceso) permite la valoración precisa de la artroplastia en el postoperatorio temprano, su seguimiento y la detección de complicaciones tardías, como infección y aflojamiento. Rev Colomb Radiol. 2008; 19(3):2454-60 Fig. 18. División en zonas de los componentes humeral y cubital. La primera zona corresponde al reborde articular y las otras tres zonas se dividen simétricamente en el resto del vástago. Referencias 1. Rabin DN, Smith C, Kubicka RA, Rabin S, Ali A, Charters JR, Rabin H. Problem prostheses: the radiologic evaluation of total joint replacement. Radiographics. 1987;7(6):1107-27. 2. Berquist TH. Imaging of joint replacement procedures. Radiol Clin North Am. 2006;44(3):419-37. 3. Weissman BN. Imaging of total hip replacement. Radiology. 1997;202(3):611-23. 4. St Clair SF, Higuera C, Krebs V, Tadross NA, Dumpe J, Barsoum WK. Hip and knee arthroplasty in the geriatric population. Clin Geriatr Med. 2006;22(3):515-33. 5. Batlle XT, Pomés J. Complicaciones de las prótesis osteoarticulares. En: Tardáguila FM, del Cura JL. Radiología ortopédica y radiología dental: una guía práctica. Madrid: Médica Panamericana; 2005. 6. Taljanovic MS, Jones MD, Hunter TB, Benjamin JB, Ruth JT, Brown AW, et al. Joint arhroplasties and prostheses. Radiographics. 2003;23(5):1295-314. 7. Frick MA, Collins MS, Adkins MC. Postoperative imaging of the knee. Radiol Clin North Am. 2006;44(3):367-89. 8. Berquist TH. Imaging atlas of orthopedic appliances and prostheses. New York: Raven Press; 1994. 9. Ritter MA, Wing JT, Berend ME, Davis KE, Meding JB. The clinical effect of gender on outcome of total knee arthroplasty. J Arthroplasty. 2008;23(3):331-6. 10. García S, Soriano A, Almela M, Tomas X. Diagnóstico y tratamiento de la prótesis total de cadera y rodilla. Clínica Osteoarticular. 2003;VI:7-12. 11. Weissman BN. Pruebas de imagen en las prótesis osteoarticulares. En: Resnik D, editor. Huesos y articulaciones en imagen. 2 ed. Madrid: Marban; 1998: 183-194. 12. Udomkiat P, Wan Z, Dorr LD. Comparison of preoperative radiographs and intraoperative findings of fixation of hemispheric porous-coated sockets. J Bone Joint Surg Am. 2001;83-A(12):1865-70. 13. Shanbhag A, Rubash HE, Jacobs JJ. Joint replacement and bone resorption : pathology, biomaterials, and clinical practice. New York: Taylor & Francis; 2006. 14. Gruen TA, McNeice GM, Amstutz HC. Modes of failure of cemented stem-type femoral components: a radiographic analysis of loosening. Clin Orthop Relat Res. 1979;(141):17-27. 2459 15. Beall DP, Martin HD, Ly JQ, Campbell SE, Anderson S, Tannast M. Postoperative imaging of the hip. Radiol Clin North Am. 2006;44(3):343-65. 16. Aliabadi P, Tumeh SS, Weissman BN, McNeil BJ. Cemented total hip prosthesis: radiographic and scintigraphic evaluation. Radiology. 1989;173(1):203-6. 17. Peterson JJ. Postoperative infection. Radiol Clin North Am. 2006;44(3):439-50. 18. Sampedro MF, Patel R. Infections associated with long-term prosthetic devices. Infect Dis Clin North Am. 2007;21(3):785-819. 19. Tigges S, Stiles RG, Roberson JR. Appearance of septic hip prostheses on plain radiographs. AJR Am J Roentgenol. 1994;163(2):377-80. 20. Berry DJ, Harmsen WS, Cabanela ME, Morrey BF. Twenty-five-year survivorship of two thousand consecutive primary Charnley total hip replacements: factors affecting survivorship of acetabular and femoral components. J Bone Joint Surg Am. 2002;84-A(2):171-7. 21. Hawker GA, Wright JG, Coyte PC, Williams JI, Harvey B, Glazier R, Badley EM. Differences between men and women in the rate of use of hip and knee arthroplasty. N Engl J Med. 2000 Apr 6;342(14):1016-22. 22. Jones CP, Lachiewicz PF. Factors influencing the longer-term survival of uncemented acetabular components used in total hip revisions. J Bone Joint Surg Am. 2004;86-A(2):342-7. 23. Berger RA, Meneghini RM, Jacobs JJ, Sheinkop MB, Della Valle CJ, Rosenberg AG, et al. Results of unicompartmental knee arthroplasty at a minimum of ten years of follow-up. J Bone Joint Surg Am. 2005;87(5):999-1006. 24. Chew F. Total knee replacement, part I – II: Radiographic evaluation. Comtemporary Diagnostic Radiology. 2006;29(20). 25. Pakos EE, Ntzani EE, Trikalinos TA. Patellar resurfacing in total knee arthroplasty. A meta-analysis. J Bone Joint Surg Am. 2005;87(7):1438-45. 26. Mukherjee K, Pandit H, Dodd CA, Ostlere S, et al. The Oxford unicompartmental knee arthroplasty: a radiological perspective. Clinical Radiology, In press. 27. Ewald FC. The Knee Society total knee arthroplasty roentgenographic evaluation and scoring system. Clin Orthop Relat Res. 1989;(248):9-12. 28. Patel DV, Ferris BD, Aichroth PM. Radiological study of alignment after total knee replacement. Short radiographs or long radiographs? Int Orthop. 1991;15(3):209-10. 29. Fehring TK. Rotational malalignment of the femoral component in total knee arthroplasty. Clin Orthop Relat Res. 2000;(380):72-9. 30. Ridgeway S, Moskal JT. Early instability with mobile-bearing total knee arthroplasty: a series of 25 cases. J Arthroplasty. 2004;19(6):686-93. 31. Rand JA, Trousdale RT, Ilstrup DM, Harmsen WS. Factors affecting the durability of primary total knee prostheses. J Bone Joint Surg Am. 2003;85-A(2):259-65. 32. Piraino D, Richmond B, Freed H, Belhobek G, Schils J, Stulberg B. Total knee replacement: radiologic findings in failure of porous-coated metal-backed patellar component. AJR Am J Roentgenol. 1990;155(3):555-8. 33. Fehring TK, Odum S, Griffin WL, Mason JB, Nadaud M. Early failures in total knee arthroplasty. Clin Orthop Relat Res. 2001;(392):315-8. 34. Oostenbroek HJ, van Roermund PM. Arthrodesis of the knee after an infected arthroplasty using the Ilizarov method. J Bone Joint Surg Br. 2001;83(1):50-4. 35. Tsukayama DT, Goldberg VM, Kyle R. Diagnosis and management of infection after total knee arthroplasty. J Bone Joint Surg Am. 2003;85-A Suppl 1:S75-80. 36. Chockalingam S, Scott G. The outcome of cemented vs. cementless fixation of a femoral component in total knee replacement (TKR) with the identification of radiological signs for the prediction of failure. Knee. 2000;7(4):233-238. 37. Vyskocil P, Gerber C, Bamert P. Radiolucent lines and component stability in knee arthroplasty. Standard versus fluoroscopically-assisted radiographs. J Bone Joint Surg Br. 1999;81(1):24-6. 38. Franklin J, Malchau H. Risk factors for periprosthetic femoral fracture. Injury. 2007;38(6):655-60. 39. Kumar S, Sperling JW, Haidukewych GH, Cofield RH. Periprosthetic humeral fractures after shoulder arthroplasty J Bone Joint Surg Am. 2004;86-A(4):680-9. 40. Mileti J, Boardman ND 3rd, Sperling JW, Cofield RH, Torchia ME, O’driscoll SW, et al. Radiographic analysis of polyethylene glenoid components using modern cementing techniques. J Shoulder Elbow Surg. 2004;13(5):492-8. 41. Sánchez-Sotelo J, Wright TW, O’Driscoll SW, Cofield RH, Rowland CM. Radiographic assessment of uncemented humeral components in total shoulder arthroplasty. J Arthroplasty. 2001;16(2):180-7. 42. Sánchez-Sotelo J, O’Driscoll SW, Torchia ME, Cofield RH, Rowland CM. Radiographic assessment of cemented humeral components in shoulder arthroplasty J Shoulder Elbow Surg. 2001;10(6):526-31. 43. Connor PM, Kuremsky MA. Clinical and radiographic outcomes of reverse total shoulder arthroplasty: a prospective evaluation of a consecutive series. J Shoulder Elbow Surg. 2007;16(2):e56-e57. 44. Ring D, Koris M, Jupiter JB. Instability after total elbow arthroplasty. Orthop Clin North Am. 2001;32(4):671-7. 45. Lee BP, Adams RA, Morrey BF. Polyethylene wear after total elbow arthroplasty. J Bone Joint Surg Am. 2005;87(5):1080-7. 46. Athwal GS, Morrey BF. Revision total elbow arthroplasty for prosthetic fractures. J Bone Joint Surg Am. 2006;88(9):2017-26. 47. King GJ. Management at radial head fracture with implant arthroplasty. J Am Soc Surg Hand. 2004;4(1):11-26. 48. Goldberg SH, Urban RM, Jacobs JJ, King GJ, O’Driscoll SW, Cohen MS. Modes of wear after semiconstrained total elbow arthroplasty. J Bone Joint Surg Am. 2008;90(3):609-19. 49. Figgie HE 3rd, Inglis AE, Mow C. A critical analysis of alignment factors affecting functional outcome in total elbow arthroplasty. J Arthroplasty. 1986;1(3):169-73. 2460 50. Shah BM, Trail IA, Nuttall D, Stanley JK. The effect of epidemiologic and intraoperative factors on survival of the standard Souter-Strathclyde total elbow arthroplasty. J Arthroplasty. 2000;15(8):994-8. 51. van der Lugt JC, Geskus RB, Rozing PM. Limited influence of prosthetic position on aseptic loosening of elbow replacements: 125 elbows followed for an average period of 5.6 years. Acta Orthop. 2005;76(5):654-61. 52. Morrey BF. Complications of elbow replacement surgery. In: Morrey BF, editor. The elbow and its disorders. Philadelphia: WB Saunders; 2000. p. 667-77. Correspondencia Jorge Alberto Carrillo Bayona Hospital de San José Calle 10 No. 18-75 Bogotá, Colombia [email protected] Recibido para evaluación: 19 de julio del 2008 Aprobado para publicación: 26 de agosto del 2008 Valoración radiológica de las artroplastias. García S, Barragán J, Narváez J, Carrillo J.