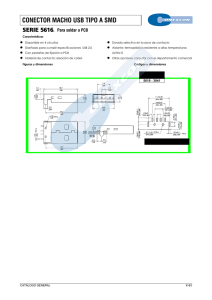
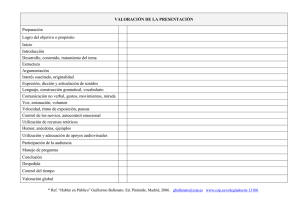
Informe Final - Instituto Nacional de Ecología y Cambio Climático
Anuncio

Dirección General de Investigación sobre la Contaminación Urbana y Regional Dirección de Investigación sobre Sustancias Químicas y Riesgos Ecotoxicológicos Estudio “Monitoreo ambiental, determinantes de la exposición y efectos de contaminantes críticos en humanos y biota en Coatzacoalcos, Veracruz” Número de convenio: INE/A1-047/2007 Informe Final Dr. Jesús Mejía Saavedra M. en C. Miguel Ángel Martínez Cordero Fernando Díaz-Barriga Martínez Responsable técnico por parte del Investigadores responsables por la Instituto Nacional de Ecología Universidad Autónoma de San Luis Potosí Autores: Guillermo Espinosa-Reyes César A. Ilizaliturri Hernández Donaji J. González Mille Nadia A. Pelallo Arturo Torres-Dosal Jesús Mejía Saavedra Rogelio Costilla Salazar Antonio Trejo Acevedo Iván N. Pérez-Maldonado Fernando Díaz-Barriga Martínez Diciembre 2007 1 ÍNDICE 1 INTRODUCCIÓN..................................................................................................................................4 2 GUÍA DE MONITOREO Y BIOMONITOREO, Y DEL PROGRAMA DE MONITOREO..................................................6 2.1 CONVENIOS INTERNACIONALES EN MATERIA AMBIENTAL........................................................................6 2.2 COMPROMISOS ADQUIRIDOS POR MÉXICO...........................................................................................7 2.3 SITUACIÓN DE LOS COPS EN MÉXICO..................................................................................................7 2.4 LOS NUEVOS COP.........................................................................................................................7 2.5 INDUSTRIA QUÍMICA........................................................................................................................8 2.6 INDUSTRIA MINERA.........................................................................................................................9 2.7 ASPECTOS SOBRE LA INFORMACIÓN GENERAL DEL SITIO DE ESTUDIO......................................................11 2.7.1 GENERALIDADES.......................................................................................................................11 2.7.2 HISTORIA DEL SITIO...................................................................................................................12 2.7.3 INFORMACION BIÓTICA Y ABIÓTICA...............................................................................................13 2.7.4 INFORMACIÓN DEMOGRÁFICA.......................................................................................................17 2.7.5 VIVIENDA.................................................................................................................................18 2.7.6 ÁREAS DE RECREACIÓN..............................................................................................................18 2.7.7 ESPACIOS EDUCATIVOS...............................................................................................................18 2.7.8 VULNERABILIDAD DE LA COMUNIDAD............................................................................................19 2.7.9 FUENTES DE ALIMENTOS.............................................................................................................19 2.7.10 ASPECTOS MIGRATORIOS...........................................................................................................19 2.7.11 PREOCUPACIONES DE LA COMUNIDAD..........................................................................................20 2.8 MONITOREO AMBIENTAL................................................................................................................21 2.8.1 RUTAS DE EXPOSICIÓN................................................................................................................21 2.8.2 IDENTIFICACIÓN DE LAS RUTAS DE EXPOSICIÓN...............................................................................21 2.8.3 MATRICES AMBIENTALES ...........................................................................................................22 2.8.4 METALES Y METALOIDES............................................................................................................24 2.8.4.1 ANTECEDENTES GENERALES SOBRE COMPORTAMIENTO AMBIENTAL..................................................24 2.8.4.2 MÉTODO DE MUESTREO ..........................................................................................................25 2.8.4.3 CUANTIFICACIÓN DE METALES EN SUELO, SEDIMENTO Y POLVO.......................................................25 2.8.4.4 PROCEDIMIENTO DE DIGESTIÓN DEL SUELO, SEDIMENTO Y POLVO....................................................25 2.8.5 COMPUESTOS ORGÁNICOS PERSISTENTES Y STPB...........................................................................27 2.8.5.1 ANTECEDENTES GENERALES SOBRE COMPORTAMIENTO AMBIENTAL..................................................27 2.8.5.2 MÉTODO DE MUESTREO ..........................................................................................................28 2.8.5.3 CUANTIFICACIÓN DE STPB EN SUELO Y SEDIMENTO....................................................................28 2.8.6 COMPUESTOS ORGÁNICOS VOLÁTILES (BTEX)..............................................................................29 2.8.6.1 ANTECEDENTES GENERALES SOBRE COMPORTAMIENTO AMBIENTAL..................................................29 2.8.6.2 MÉTODO DE MUESTREO Y DE CUANTIFICACIÓN............................................................................30 2.8.6.3 MÉTODO ANALÍTICO................................................................................................................31 2.8.6.4 PREPARACIÓN DE LA MUESTRA..................................................................................................31 2.8.6.5 CALIBRACIÓN........................................................................................................................32 2.8.6.6 CUANTIFICACIÓN....................................................................................................................32 2.8.6.7 REPORTE DE RESULTADOS........................................................................................................32 2.8.6.8 CONDICIONES CROMATOGRÁFICAS RECOMENDADAS .....................................................................34 2.9 MONITOREO BIOLÓGICO.................................................................................................................36 2.9.1 EVALUACIÓN DE LA EXPOSICIÓN POBLACIÓN HUMANA......................................................................36 2.9.1.1 METALES Y METALOIDES.........................................................................................................36 2.9.1.2 SUSTANCIAS TÓXICAS PERSISTENTES BIOACUMULABLES STPBS EN PLASMA..................................37 2.9.1.3 COMPUESTOS ORGÁNICOS VOLÁTILES.......................................................................................37 2 2.9.1.4 MÉTODOS DE ANÁLISIS DE BTEXS EN MUESTRAS BIOLÓGICAS NORMADOS EN MÉXICO. ....................39 2.9.2 EVALUACIÓN DE LA EXPOSICIÓN BIOTA..........................................................................................42 2.9.2.1 MÉTODO DE MUESTREO...........................................................................................................42 2.9.2.2 METALES Y METALOIDES.........................................................................................................43 2.9.2.3 SUSTANCIAS TÓXICAS PERSISTENTES BIOACUMULABLES STPBS EN TEJIDOS...................................43 2.9.3 EFECTOS BIOLÓGICOS Y CONSIDERACIONES EN SU EVALUACIÓN..........................................................47 2.9.4 BIOMARCADORES ......................................................................................................................47 2.9.4.1 TIPOLOGÍA Y CARACTERÍSTICAS GENERALES DE LOS BIOMARCADORES DE EFECTO..............................47 2.9.4.2 CRITERIOS DE SELECCIÓN DE LOS BIOMARCADORES DE EFECTO.......................................................49 2.10 EFECTOS BIOLÓGICOS DE LOS CONTAMINANTES................................................................................52 2.10.1 EFECTOS GENOTÓXICOS............................................................................................................53 2.10.2 EFECTOS ENDOCRINOS..............................................................................................................55 2.10.3 RESPUESTAS HEMATOLÓGICAS Y FISIOLÓGICAS..............................................................................56 2.11 REFERENCIAS DE LA GUÍA DE MONITOREO Y BIOMONITOREO, Y DEL PROGRAMA DE MONITOREO...............58 3 RESULTADOS DEL ESTUDIO................................................................................................................63 3.1 SEDIMENTO Y SUELO.....................................................................................................................63 3.2 RESULTADOS EN ESPECIES SILVESTRES..............................................................................................75 3.2.1 IGUANAS..................................................................................................................................75 3.2.2 CANGREJOS..............................................................................................................................79 3.2.3 PECES......................................................................................................................................79 3.2.4 ANFIBIOS.................................................................................................................................82 3.2.5 PLOMO EN SANGRE DE NIÑOS.......................................................................................................90 3.2.6 METODOLOGÍAS DE LABORATORIO................................................................................................92 4 CONCLUSIONES Y DISCUSIÓN ............................................................................................................94 5 REFERENCIAS..................................................................................................................................96 6 ANEXO........................................................................................................................................102 3 1 INTRODUCCIÓN El Instituto Nacional de Ecología (INE) y la Universidad Autónoma de San Luis (UASLP) elaboraron, durante 2005, una metodología de evaluación de riesgo integrado que permitiera el análisis de riesgos tanto para la salud humana como para los componentes ecológicos. Dicha metodología fue diseñada con la participación de instituciones de reconocido prestigio y experiencia en el tema, a través de dos talleres de expertos, haciéndose énfasis en la necesidad de considerar limitaciones financieras y de recursos humanos propios de países con economías en desarrollo (INE, 2005a). Durante 2005, la propuesta metodológica se aplicó en el municipio de Villa de la Paz, en el estado de San Luis Potosí, localidad en la que la actividad minera desarrollada por más de 200 años ha dejado residuos de tipo terreros y jales que contienen concentraciones elevadas de arsénico y plomo. Esta primera aplicación de la propuesta metodológica mostró el riesgo potencial, tanto para la población humana como para la biota del sitio, al evaluar el daño al ADN en los niños habitantes del lugar y en roedores (Dipodomys merriami) (INE, 2005b). En 2006, el INE y la UASLP desarrollaron el estudio “Diseño y aplicación de una metodología para la evaluación integrada de riesgos ambientales en sitios contaminados de México - caso de estudio Coatzacoalcos, Veracruz.” (INE, 2006) aplicando la propuesta metodológica de evaluación integrada de riesgos en la población infantil y en la biota de Coatzacoalcos. Los contaminantes evaluados fueron algunos metales y compuestos orgánicos. Con el biomonitoreo realizado en el plasma de niños incluidos en el estudio se encontró que éstos habían estado expuestos a lindano, DDE, mirex (cuyo uso no está autorizado en México), y varios congéneres de bifenilos policlorados (PCB). Cabe destacar que se encontró que la concentración de plomo en sangre en más del 80% de los niños, de dos localidades, superaba los 10 µg/dl, es decir, la categoría I de la NOM-199SSA1-2000. En lo que se refiere a la biota, se detectó exposición a lindano, DDT, DDE, mirex, aldrín y varios congéneres de PCB como mostraron los biomarcadores de exposición en el plasma de peces, anfibios, iguanas, sapos y cocodrilos. Se encontró también daño genotóxico evidenciado por el ensayo cometa en lombrices, anfibios y en distintas especies de peces. El presente informe integra los resultados de la evaluación de la presencia y exposición de Compuestos Orgánicos Persistentes (COP) y metales pesados en diferentes matrices ambientales como sedimento y suelo y muestras biológicas de anélidos, crustáceos, peces, anfibios, reptiles y humanos, en la región de Coatzacoalcos, Veracruz. En esta zona se ubica una de las principales zonas industriales del país, la cual ha estado impactando el ambiente desde sus orígenes en la década de los 70. En la actualidad, el Río Coatzacoalcos y las zonas aledañas a los complejos industriales están considerados por diversos autores como uno de los sitios más contaminados del país debido a una gran cantidad de mezclas de diferentes agentes tóxicos registrados en diversos estudios ambientales y biológicos. 2 GUÍA DE MONITOREO Y BIOMONITOREO, Y DEL PROGRAMA DE MONITOREO Hasta principios de la década de los setenta, se pensaba que la contaminación era un fenómeno circunscrito a las zonas en que se generaban los contaminantes. Por ello, en cada país la preocupación se limitaba a las regiones en que la concentración de los contaminantes era más alta o mayor su peligrosidad. Sin embargo, poco a poco se ha cobrado conciencia de que la contaminación es un problema que a todos afecta y que, por lo mismo, su control es responsabilidad de todos, independientemente de la distancia de los sitios en donde se producen los contaminantes. Por lo tanto, el problema de la contaminación se ha vuelto un fenómeno global (Flores, 2004). Estos problemas son actualmente de tal magnitud que la Organización de las Naciones Unidas ha realizado varias reuniones de sus países miembros para lograr una disminución de las causas y efectos de la contaminación global. 2.1 Convenios internacionales en materia ambiental Entre los convenios y convenciones internacionales sobre sustancias químicas y residuos peligrosos más importantes están: La Convención de Basilea que establece el control transfronterizo de residuos y su disposición; esta se realizó en 1989, como respuesta a la incertidumbre de que los residuos tóxicos de los países desarrollados se enviaran para su disposición a países en vías de desarrollo o con economías en transición (Interim, 2002); La Convención de Rótterdam que se estableció en 1998, que constituye el procedimiento de consentimiento para el manejo de ciertas sustancias químicas peligrosas y plaguicidas, objeto del comercio internacional. Los esfuerzos de la convención se concentraron en los países carentes de infraestructura adecuada y suficiente para el monitoreo y uso de estas sustancias (Interim, 2002); El Convenio de Estocolmo establecido en mayo de 2001 en Estocolmo, Suecia; 127 países adoptaron el tratado de las Naciones Unidas para prohibir o minimizar el uso de doce de las sustancias tóxicas más utilizadas en el mundo, mismas que están consideradas como causantes de efectos adversos tanto en humanos como en biota. Las doce sustancias establecidas en el convenio incluyen ocho plaguicidas (Aldrina, Clordano, DDT, Dieldrina, Endrina, Heptacloro, Mirex, Toxafeno), dos productos industriales (Bifenilos Policlorados y Hexaclorobenceno) y dos subproductos de diversos procesos de combustión (Dioxinas y Furanos). El objetivo de la Convención de Estocolmo es eliminar o restringir la producción y uso de los Contaminantes intencionalmente. Además, se Orgánicos busca Persistentes minimizar la que se generación fabrican de los contaminantes producidos de manera no intencional (Yarto et al., 2003). 2.2 Compromisos adquiridos por México En el Artículo 7 de la Convención de Estocolmo se establece que los países signatarios deberán preparar Planes Nacionales de Implementación (PNI). Estos PNI deberán definir las líneas de acción para iniciar actividades tendientes a proteger la salud humana y del ambiente de los efectos de los Contaminantes Orgánicos Persistentes (COPs). Así como, construir un marco de referencia para desarrollar e implementar de forma sistemática y participativa una reforma regulatoria y establecer prioridades de política y finalmente, promover el fortalecimiento de capacidades y programas de inversión. 2.3 Situación de los cops en méxico Con la finalidad de cumplir con los convenios internacionales adquiridos por México se han realizado estudios sobre COPs, también se han negociado acuerdos en el seno de la Comisión de Cooperación Ambiental de América de Norte, con la finalidad de implementar Planes de Acción Regionales (PARAN) y se iniciaron diversas acciones de gestión y regulación. Actualmente México cuenta con un avance significativo en el control de varios de los compuestos establecidos en Estocolmo, sin embargo, aún quedan acciones por realizar, mismas que pueden formar parte de los Planes Nacionales de Implementación de la Convención de Estocolmo, que se encuentra en proceso de elaboración con la participación de diversas dependencias. 2.4 Los nuevos COP Debido a que se han venido realizando diversas investigaciones las cuales han revelado diferentes efectos atribuidos a contaminantes que no forman parte de la “docena sucia”, pero que tienen características similares en la Convención de Estocolmo se establece que cualquier gobierno puede, mediante una argumentación adecuada, proponer la adición de uno o mas contaminantes. Por lo tanto, es fundamental el desarrollo de actividades de investigación con la finalidad de identificar las sustancias candidatas y establecer cuales de ellas son de mayor importancia para México, determinar sus usos y lugares de acceso al país, así como definir mecanismos para lograr la disminución de su uso y el control de las otras sustancias tóxicas persistentes que no puedan ser sustituidas por alternativas menos riesgosas. Para lograr esto es necesario reunir suficiente evidencia científica que permita proponer una o mas de estas sustancias para su incorporación a la Convención de Estocolmo sobre contaminantes orgánicos persistentes. 2.5 Industria química Este es uno de los sectores más dinámicos de la economía nacional, esta incluida en el sector de la transformación. La competencia internacional, propia de una economía abierta, exige una industria con alto grado de tecnificación, eficiente en el uso de recursos y energía, con un mínimo impacto ambiental. El calentamiento global, la deforestación, la perdida de biodiversidad y otros problemas ambientales preocupan a la sociedad. En este sentido, se reconoce que los problemas de la protección ambiental, que gradualmente surgieron en los siglos anteriores, se agudizaron bruscamente en la segunda mitad del siglo XX a causa de la Revolución Científica y Tecnológica. Una de las causas mas importantes que va alterando nuestro medio de manera silenciosa y constante, es la presencia de diversos grupos de contaminantes como las Sustancias Tóxicas Persistentes y Bioacumulables (STPBs) que comprenden a los pesticidas (Aldrin, Clordano, DDT, Dieldrina, Endrina, Hexaclorobenceno, Heptacloro, Mirex, Toxafeno); Bifenilos Policlorados (PCBs); los compuestos no intencionales: Dioxinas (PCDD) y Furanos (PCDF); otras sustancias candidatas a la inclusión al convenio de Estocolmo como: Hidrocarburos Aromáticos Policíclicos (HAPs); Hexaclorociclohexanos; compuestos polibromados, compuestos organometálicos (plomo y mercurio) entre otros (Yarto et al., 2003; INE, 2004) son químicos muy estables propensos a viajar distancias considerables y resistentes a los procesos de degradación natural, la mayoría de ellos se producen para su uso como plaguicidas y algunos para ser usados como químicos en procesos industriales, y otros como subproductos que se generan de manera no intencional a partir de ciertas actividades humanas, tales como los procesos de combustión o generación de energía (PNUMA, 2005). En los países donde se han utilizado estos compuestos es frecuente encontrar residuos de ellos en alimentos, debido a su persistencia en el ambiente y a sus características de bioacumulación y biomagnificación a lo largo de la cadena alimentaría. Lo cual es preocupante debido a que se ha demostrado que varios de estos compuestos tóxicos generan efectos adversos tanto en población humana como en biota (ATSDR, 2002). 2.6 Industria minera La industria minera es una de las actividades que contribuye en mayor medida a la contaminación del ambiente. Esta actividad libera principalmente metales y metaloides como: As, Cd, Cr, Mg, Pb, Zn; no obstante, esta contribuye de manera significativa a la economía nacional de 158 países (UNEP, 2000), sin embargo, millones de personas están expuestas a los efectos adversos ocasionados por metales en las regiones mineras, por ejemplo, se estima que los mineros representan el 1% de la mano de obra global, esto es aproximadamente 30 millones de trabajadores (Joyce, 1998). Además, hay que tener en cuenta que entre 11 y 13 millones de personas practican la minería de forma tradicional (UNEP, 2000). La salud ocupacional se ha estudiado de manera intensa (Fisher, 1998), sin embargo, existen pocos estudios referentes a la salud de las personas que viven en sitios mineros, especialmente la de los niños. La mayoría de los trabajos que se han realizado con niños en sitios mineros u hornos de fundición evalúan la exposición (Díaz-Barriga et al., 1993, 1997; Hwang et al., 1997; Murgueytio et al., 1998; Yáñez et al., 2003) y se han registrado pocos efectos biológicos (Counter 1997; Calderón et al., 2001; Yáñez et al., 2003). Por lo tanto, si tomamos en cuenta que aproximadamente 40 millones de personas se dedican a la minería, una gran cantidad de niños podrían estar expuestos de manera directa a los impactos asociados a la industria minera, por lo que resulta necesario realizar estudios que evalúen los efectos biológicos en población infantil que habite en sitios mineros. Debido a los compromisos internacionales adquiridos por México en materia ambiental, la preocupación mundial y la necesidad de generar evidencia científica, este documento tiene como objetivo fungir como una guía de monitoreo ambiental que sea referencia para asistir en el cumplimiento de los tratados y convenios internacionales que México ha suscrito en materia de contaminación por sustancias tóxicas. Cabe mencionar que la presente guía no pretende ser un manual exhaustivo o ser aplicable a todos los contextos, sino que busca ser un elemento de apoyo para las partes interesadas y que son el resultado de nuestra experiencia en el estudio de sitios contaminados. Esta tiene un especial énfasis en el abordaje metodológico de nuestros trabajos previos realizados en la región de Coatzacoalcos, Veracruz. La estructura general del documento comprende cuatro grandes secciones: 1) Aspectos sobre la información general del sitio.- En esta sección se pretende enlistar aspectos y consideraciones importantes para el abordaje inicial del sitio de estudio, tomando en cuenta desde factores bióticos y abióticos hasta socioculturales. 2) Monitoreo ambiental.- Se describe de manera general el proceso metodológico desde la obtención de la muestra hasta la cuantificación de diferentes compuestos [(Metales, Sustancias Tóxicas Persistentes Bioacumulables (STPBs) y Compuestos Orgánicos Volátiles (COVs)] en varias matrices ambientales. 3) Monitoreo biológico.- Se describe de manera general el proceso metodológico desde la obtención de la muestra hasta la cuantificación de diferentes compuestos [(Metales y Sustancias Tóxicas Persistentes Bioacumulables (STPBs)] en varias matrices biológicas. 4) Información sobre algunos efectos biológicos y consideraciones en su evaluación. Esta sección comprende definiciones y consideraciones generales sobre el uso de biomarcadores así como la descripción general de algunos efectos biológicos (genotoxicidad, disrupción endocrina y respuestas fisiológicas) útiles para el biomonitoreo. 2.7 Aspectos sobre la información general del sitio de estudio La información debe buscarse en diversas fuentes, incluyendo las oficiales, las universitarias, las de consultorías privadas, etc. Durante la visita al sitio (ver más adelante), podrá corroborarse o completarse la información obtenida. 2.7.1 Generalidades Nombre del sitio. Deben incluirse el nombre oficial y la denominación popular. Ubicación del sitio. La información de este punto deberá complementarse anexando un mapa donde claramente se señale la localización y el área de influencia del sitio. Además de las coordenadas (georeferencia en unidades UTM y geográficas), siempre es importante referir la ubicación a un punto geográfico conocido, como una ciudad, un río, lago, etc. Tipo de sitio. Exponer la descripción que mejor se acerque a la realidad del sitio. Por ejemplo: campo agrícola; zona minera; área industrial; microindustria (especificando el tipo); depósito no controlado (de residuos sólidos o líquidos, de residuos industriales, urbanos, hospitalarios, etc.); área impactada por contaminación natural (especificando); etc. Información oficial sobre los tóxicos presentes en el sitio. Para la mayoría de los sitios, es poco probable que exista este tipo de información; sin embargo, en caso de que la hubiere, es de suma importancia que incluya datos que permitan establecer la calidad y por ende, la confiabilidad de la misma. En caso de no contarse con esta información, el evaluador deberá anotarlo en su reporte. Descripción del proceso contaminante ó del origen de la contaminación. En muchos casos será factible la identificación de la fuente contaminante y por ende, podrá establecer el proceso que da lugar al problema ambiental; sin embargo, es importante considerar que en algunos casos el origen de la contaminación se encuentra alejada del sitio. Por ejemplo, el origen de la contaminación de un lago puede estar gradiente arriba de algún río afluente de él. Actividades que se desempeñan en el sitio. Deberán incluirse todas las actividades que pudieren afectar de alguna manera el escenario de exposición, así por ejemplo, dentro de las económicas, habría que apuntar las actividades industriales, comerciales, agropecuarias, etc. Entre las actividades recreativas se pueden incluir natación en ríos, cacería, presencia de campos deportivos, etc. Para la evaluación de la exposición se requiere que las actividades incluyan temporalidad (por ejemplo, en épocas de vacaciones, sólo los fines de semana, ocho horas diarias, etc.). A fin de estimar el riesgo de la exposición, es necesario describir los usos del suelo pasados, presentes y futuros (zona industrial, residencial, comercial, recreativa, agrícola, etc.). Descripción de barreras que impidan el acceso al sitio. El libre acceso al área contaminada permite la exposición de la población a las sustancias químicas. Por ejemplo, en un lugar donde hubiese residuos industriales almacenados en tambos, los pobladores podrían entrar en contacto con los residuos al utilizar dichos tambos para almacenar agua potable. 2.7.2 Historia del sitio Esta sección tiene como objetivo la recopilación de información para contestar cuatro preguntas: ¿ Cuál es el origen de la contaminación ? ¿ Desde cuándo existe la contaminación en el sitio ? ¿ La contaminación ha sido siempre la misma ? ¿ Desde cuándo ha ocurrido la exposición humana a los contaminantes ? Inicio de operaciones de la fuente contaminante o de la contaminación. Probablemente en algunas ocasiones, la fecha de los eventos deberá obtenerse de entrevistas efectuadas con pobladores del lugar; en caso de que así ocurra, deberá verificarse la fecha mediante entrevistas con dos o más personas independientes. Eventos desde el inicio de operación (y de la contaminación). Deberán registrarse todos los acontecimientos significativos que hayan determinado el tipo de contaminación a través del tiempo. Por ejemplo: ¿La contaminación ha sido siempre del mismo tipo? ¿Han existido otras fuentes contaminantes, ahora clausuradas o abatidas? ¿El sitio ha tenido siempre el mismo uso de suelo? ¿Dónde almacenaban los residuos décadas atrás? ¿Han existido fugas del contaminante? Historia de actividades humanas relacionadas con el área contaminada. Deberán registrarse todos los acontecimientos que determinen el tipo de exposición humana a los contaminantes del sitio. Por ejemplo: ¿Existían áreas de recreación en las zonas contaminadas? ¿Había campos agrícolas en las áreas ahora urbanizadas? Acciones realizadas para remediar el problema de contaminación. En algunos sitios podrían haberse llevado a cabo acciones de restauración parcial o total que fueren importantes para definir el actual riesgo del sitio. Por ejemplo, pavimentación de zonas sobre suelo contaminado, confinamiento de tambos con material peligroso, etc. Las acciones de restauración deben tomarse en cuenta ya que pudieron haberse dado en situaciones de emergencia y por lo tanto, podrían no ser las más adecuadas. En uno de los anteriores ejemplos, el almacenamiento de los tambos en las celdas podría haberse dado en condiciones no controladas ó pudiera ocurrir que las celdas estuviesen construidas con material permeable que en el futuro facilitara la lixiviación de los residuos. 2.7.3 Informacion biótica y abiótica Para esta sección es de suma utilidad la información que pueda obtenerse de las Instituciones Oficiales (por ejemplo, en México sería el caso del Instituto Nacional de Estadística, Geografía, e Informática). Fisiografía. Deberá recopilarse información topográfica del sitio e información relevante para el transporte y destino de los contaminantes. Por ejemplo: presencia de fracturas geológicas que pudiesen conectar a la superficie con cuerpos de agua profunda; cavernas o deformaciones del terreno donde pudiese haber almacenamiento clandestino de residuos peligrosos o basura municipal; características del terreno que posibilitaran la generación de corrientes de agua en épocas de lluvia, etc. Se deberá hacer una descripción de las principales unidades fisiográficas y geomorfológicas. Las unidades deben de describir el tipo de geoforma (cerros, depresiones, laderas, etc.); ubicación, extensión, altitud, pendiente, factores erosivos predominantes, etc. El evaluador deberá realizar cartografía con la finalidad de sintetizar y contextualizar la información que ayudará a la realización del modelo conceptual. Geología. De forma general debe realizarse una descripción geológica del área, en la cual se deberán tomar en cuenta aspectos de geología: a) histórica – origen, desarrollo y procesos a través del tiempo que dieron forma a la geología local-, b) estratigráfica (composición, edad, profundidad, dureza y permeabilidad de los estratos, presencia de fallas y fracturas) y c) estructural (descripción litológica, composición mineralógica, etc.). Otro aspecto que debe presentarse en esta parte es la susceptibilidad de la zona a: sismos, deslizamientos, derrumbes u otros movimientos de suelo o roca y posible actividad volcánica. Suelo. Se deberán describir los tipos de suelo de acuerdo con la clasificación de FAO-UNESCO, así como sus principales características físico químicas como: la estructura, textura, materia orgánica, profundidad, fases, pH, bases intercambiables, porosidad, conductividad térmica e hidráulica, salinización y capacidad de saturación. Se deberá describir su susceptibilidad a la: erosión, acidificación, compactación, etc. Así como la estabilidad edáfica. El evaluador deberá realizar cartografía con la finalidad de sintetizar y contextualizar la información que ayudará a la realización del modelo conceptual. Hidrología. Se deben describir los aspectos geohidrológicos e hidrológicos de la(s) cuenca(s) en la(s) que se encuentra localizado el sitio. Se deben incluir aspectos de recarga de acuíferos, transporte y aprovechamiento de aguas subterráneas así como datos relativos a: profundidad de acuíferos, nivel freático, porosidad, tasas de infiltración, de calidad de agua subterráneas, presencia de fallas y fracturas, localización de pozos y norias. En cuanto a la hidrología superficial se deben señalar los cuerpos de aguas superficiales que puedan ser afectados por los contaminantes. Señalar además la calidad del agua de acuerdo a parámetros fisicoquímicos (pH, conductividad, sólidos suspendidos totales, DQO, y coliformes totales) y metales como Pb, Cd, Cu, Zn. Se deben de tomar en cuenta para esta descripción: la capacidad de transporte, migración y acumulación de los contaminantes hacia otras áreas, superficies o ecosistemas. Para la hidrología subterránea se deben describir aspectos como profundidad y dirección de acuíferos, principales usos y calidad del agua. En el caso de que el sitio se localice en una zona marina se deben de tomar en cuenta para la descripción: tipo de costa, ambientes, fisiografía y batimetría. Se debe hacer además la caracterización física de las masas de agua (salinidad, temperatura, oxígeno disuelto, características generales del ambiente abiótico). Si el sitio se localiza en una zona costera se deben de tomar en cuenta los márgenes del sistema lagunar, batimetría, calidad del agua (salinidad, oxígeno disuelto, nitritos, nitratos, fosfatos y amonio) Para ambos casos se deben considerar las condiciones generales y las variaciones estacionales. Agua Superficial. Se requiere su clasificación (arroyo intermitente, río, lago, etc.). Información sobre sus usos (consumo humano, agrícola, abrevadero, pesca, recreación, lavado de ropa, etc.). Datos sobre descargas industriales, agrícolas, urbanas, etc. Antecedentes sobre inundaciones en los últimos años. En caso de que las inundaciones sean frecuentes: ¿El sedimento ha contaminado el suelo? Agua Subterránea. Clasificación (acuífero no confinado, semiconfinado ó confinado). Dirección de la corriente subterránea. Antigüedad, localización, profundidad y usos de los pozos ubicados en la región. ¿Puede contaminarse el acuífero por el material presente en la superficie? ¿Existen datos de sobreexplotación del acuífero? ¿El acuífero superficial podría estar en contacto con el acuífero profundo a través de los pozos? En caso de que no hubiere antecedentes en la zona del sitio, habrá que examinar la información oficial que hubiere sobre la región. La dirección de la corriente subterránea puede estimarse con base al nivel del agua en los pozos profundos del área. Recursos Naturales. ¿Puede existir contaminación de la flora y fauna? ¿Pueden llegar los contaminantes a través de la cadena alimentaria hacia el hombre? ¿El recurso contaminado es fuente de alimento de la comunidad? ¿El recurso contaminado se emplea como cocción para las actividades del hogar (cocción de alimentos, baño diario)? Vegetación. Describir los tipos de vegetación terrestre y/o acuática y su distribución geográfica, de acuerdo con el sistema de clasificación INEGI (o a su sistema de clasificación) así como su estado de conservación. Se deberá de elaborar un listado de las especies presentes en el área de estudio así como resaltar las que estén bajo algún estado de protección (de acuerdo a la normativa nacional e internacional), así como aquellas que se puedan considerar de relevancia ecológica, cultural, científica o comercial. Es muy importante describir en este punto el uso de suelo y vegetación que represente las principales actividades productivas como ganadera, agricultura, minería. Fauna. Se deberá realizar un inventario de las especies o comunidades faunísticas terrestres, acuáticas y de humedal reportadas o avistadas en el sitio; se deberá indicar su distribución espacial, abundancia, así como aspectos fenológicos. Se identificarán aquellas especies que estén bajo algún estado de protección (de acuerdo a la normativa nacional e internacional), así como aquellas que se puedan considerar de relevancia ecológica, cultural, científica o comercial. Se deberán identificar los radios de actividad para aquellos grupos considerados como vulnerables, así como de las áreas sensibles como corredores biológicos, zonas de anidación, refugio, alimentación y crianza. También es relevante identificar y mencionar sucesos biológicos únicos como migraciones en masa, zonas de presencia de juveniles. Datos meteorológicos relevantes. Promedio anual de precipitación pluvial, época de máxima precipitación y época de estiaje (secas). Temperatura promedio anual, época de frío y época de calor. Dirección de vientos predominantes (rosa de vientos). Cambios de vientos según las épocas del año. Otros datos relevantes del sitio. Se deberán describir los principales tipos de clima según la clasificación de Köppen (o de acuerdo a su clasificación local o regional). Así como los principales datos meteorológicos del sitio como: precipitación- temperatura mensual, anual y extremas, humedad relativa y absoluta, balance hídrico (evaporación-evotranspiración), radiación e incidencia solar, vientos predominantes (dirección y velocidad) mensual y anual, época de estiaje, lluvia etc. El evaluador deberá realizar cartografía, diagramas ombrotérmicos y rosas de vientos, con la finalidad de resumir y contextualizar la información. Mientras más información histórica se recabe del área, se tendrá una mayor comprensión de los ciclos climáticos de la zona de estudio. Es importante describir fenómenos meteorológicos extremos como huracanes, nortes, tormentas tropicales, inundaciones, heladas y nevadas. 2.7.4 Información demográfica La información de esta sección debe obtenerse a partir de los datos censales. Sin embargo, siempre que sea posible, durante la visita al sitio habrá que verificar la información obtenida. Los objetivos de la información demográfica son: (1) definir la magnitud de la población mayormente expuesta; y (2) establecer con detalle la distribución por edades, sexo y grupos étnicos. En el Censo Mexicano la información demográfica está vertida en áreas denominadas AGEBs (Áreas Geoestadísticas Básicas), por lo tanto, es factible establecer la cantidad de individuos que viven a diferentes distancias de la fuente contaminante. Un hecho particularmente importante es el conocimiento de los grupos étnicos. Diversos factores toxicológicos afectan más a unos grupos que a otros (por ejemplo, el efecto endocrino del plomo se presenta más en mujeres afroamericanas (Selevan et al., 2003), en tanto, la excreción de creatinina por orina, un factor muy empleado para ajustar las concentraciones urinarias de tóxicos, es diferente entre grupos de edad, géneros y etnicidad (Canfield et al., 2003). Basten estos dos ejemplos para puntualizar la importancia de este tipo de conocimiento. 2.7.5 Vivienda Debe obtenerse conocimiento sobre: i) tipo de vivienda (material de construcción, tipo de piso, contar con patio doméstico de tierra, etc.); ii) localización del área residencial con respecto a la fuente (distancia, localización con respecto a la dirección de vientos predominantes, etc.); iii) antigüedad del área residencial; iv) presencia de contaminantes interiores (fumigación de insecticidas en zonas palúdicas, empleo de leña para la cocción de alimentos, etc.); v) proyectos de crecimiento del área residencial; vi) localización del dormitorio y del área de preparación de alimentos; vii) industria familiar localizada en la misma dirección de la vivienda (carpinterías, ladrilleras, invernaderos, etc.), viii) tiempo que pasa la mujer cocinando, el niño en interiores (cualquier información útil para establecer patrones de comportamiento en el interior de la vivienda) ; ix) otros. 2.7.6 Áreas de recreación Sobre las áreas donde juegan los niños es importante conocer: i) el material con el cual están construidos los juegos (en algunos casos de juegos de madera, la madera está tratada con insecticidas organoclorados o en base a la mezcla cromo-cobre-arsénico); ii) el tipo de piso del área de recreación (pasto, tierra, material sintético, trozos de llanta, etc.); iii) localización del área con respecto a la fuente (distancia, localización con respecto a la dirección de vientos predominantes, etc.); iv) antigüedad del área; v) eventos de restauración en el área (por ejemplo, cambio de suelo, plantar pasto, poner cemento, etc.); vi) frecuencia de juego (importantísimo para el momento de estimar el riesgo); vii) otros. Es muy importante establecer si los niños juegan donde existen tóxicos (residuos mineros, áreas agrícolas con plaguicidas, ríos contaminados, etc.). 2.7.7 Espacios educativos Debe obtenerse una información similar a la que se recopile para la vivienda, enfatizando tiempo de recreo y características del área de recreación. ¿Los niños tienen que caminar para llegar a la escuela, por dónde, a qué hora? 2.7.8 Vulnerabilidad de la comunidad Puede consultarse el índice de marginación de la CONAPO (Consejo Nacional de Población) que incluye entre otros a factores como el nivel socioeconómico, los tipos de vivienda, el nivel académico, el acceso a drenaje y agua potable, etc. Además, el evaluador podrá advertir otros factores como acceso a servicios médicos, disposición y manejo de basura doméstica (el quemar basura puede ser fuente de dioxinas, hidrocarburos aromáticos policíclicos, etc.), hacinamiento, consanguinidad, etc. Es decir, cualquier factor que pudiera incrementar la exposición a las sustancias químicas o que pudiere aumentar el número de tóxicos a los cuales pudieran estar expuestos los individuos de la comunidad. 2.7.9 Fuentes de alimentos ¿Los alimentos pudieran estar contaminados con los plaguicidas que se emplean en la zona (áreas agrícolas), o con polvo rico en metales (zonas mineras o metalúrgicas), etc.? ¿Los alimentos lácteos podrían estar contaminados con compuestos organoclorados, bromados, etc? ¿Preparan sopas, bebidas, alimento de bebé, etc., con el agua contaminada (áreas con fuentes de agua contaminada)? ¿Emplean barro vidriado (plomo)? ¿El pescado podría traer metales, contaminantes orgánicos persistentes u otros tóxicos? En fin, hay que obtener información sobre los alimentos, la procedencia, la variedad, la cantidad y la frecuencia de consumo. 2.7.10 Aspectos migratorios En México, en zonas marginadas es común que se presenten altos índices de migración, bien dentro del país para ir a trabajar a zonas urbanas o a campos agrícolas, bien fuera del país. Es importante considerar la migración porque abre opciones a cambiar patrones de exposición, pero además, puede incrementar la cantidad de basura compleja (empaques de material eléctrico, computadoras obsoletas, piezas de coches antiguos, etc.). En otro sentido, los materiales (bienes) que los trabajadores migrantes llevan a sus comunidades podrían ser materiales tratados con sustancias químicas producidas en el mundo desarrollado (por ejemplo, los retardantes de flama). 2.7.11 Preocupaciones de la comunidad La interacción con la comunidad es clave para el buen desarrollo del estudio. Los miembros de la comunidad afectada deben estar enterados de los trabajos que se realizarán en el sitio. Para ello, deberán buscarse las mejores estrategias de comunicación de riesgo; incluyendo desde luego, la honestidad y el uso de un lenguaje claro y franco. El evaluador debe establecer un listado de las preocupaciones comunitarias relacionadas con el sitio, en materia de contaminación, salud y estrategias de limpieza. Se recomienda la recopilación de la información publicada en los medios locales de comunicación (editando el amarillismo y las noticias sin sustento). Asimismo, deben efectuarse entrevistas con miembros de la comunidad, autoridades locales y personal médico de la región (poner atención en las clínicas rurales de salud). Si el evaluador realizó una buena labor en este punto, al final deberá contar con un listado de las preocupaciones de la comunidad en lo referente a los riesgos en salud asociados al sitio contaminado y con una visión clara del sentir comunitario sobre cómo debe manejarse la problemática del área en estudio. 2.8 Monitoreo ambiental 2.8.1 Rutas de exposición El concepto de ruta de exposición se refiere al camino que sigue el contaminante desde su fuente hasta la población. Toda ruta se constituye entonces de cinco componentes: 1. Fuente de contaminación. Fuente que emite contaminantes al ambiente. 2. Medio ambiental. Medio responsable de transportar los contaminantes desde la fuente hasta el punto de exposición: aire, agua, suelo, polvo, alimento, etc. 3. Punto de exposición. Lugar donde la población (humana o biota) entra en contacto con los contaminantes (pozos profundos, área de recreación infantil, grifos caseros, cuerpos de agua, madrigueras, etc.). 4. Vía de exposición. Inhalación (aire, partículas finas), ingesta (agua, suelo, alimento, polvo), absorción dérmica, etc. 5. Población receptora. Poblaciones (humanas o biota) que están expuestas a los contaminantes, la población receptora es entonces la población expuesta. 2.8.2 Identificación de las rutas de exposición La identificación de las rutas de exposición es un punto medular del método ya que, la ruta es el camino que utiliza el contaminante para llegar al receptor; por consiguiente, cualquier programa de restauración deberá centrarse en el abatimiento de las rutas más importantes. Identificando a los componentes de las rutas de exposición, pueden diseñarse barreras que impidan la exposición a los contaminantes críticos. El evaluador deberá identificar a las rutas por un nombre que claramente las distinga. En algunos casos, el nombre puede ser el medio del ambiente involucrado en la ruta, pero esto no es siempre aconsejable, ya que como se verá en el siguiente párrafo, dos rutas podrían compartir el mismo medio (por ejemplo: suelo superficial en una ruta dentro de un centro escolar y suelo superficial en una ruta en un patio casero). Dos ó más rutas pueden compartir elementos. Por ejemplo, es común que diferentes rutas compartan la misma fuente de contaminación. Pero de mayor importancia son las rutas que comparten idéntica población receptora. Un individuo podría estar expuesto a un mismo contaminante a través de diversas rutas. En este caso, la dosis total de exposición sería la sumatoria de la exposición a todas las rutas y dicha sumatoria podría llegar a superar el nivel tóxico del contaminante, lo cual entonces representaría un riesgo en salud para dicho individuo. Aunado a lo anterior, debe considerarse la posibilidad de que en algunos casos los elementos de una ruta pudiesen no estar bien definidos. Cuando a una ruta le falte alguno de sus elementos se le denominará ruta potencial y quedará a criterio del evaluador si debe considerarse como una ruta importante. Por ejemplo, el suelo contaminado en una zona sin población expuesta al momento del estudio es una ruta potencial. La importancia de su identificación es que esta zona contaminada no debiera tener vocación residencial (hecho que en un ejercicio real debería mencionarse en la sección de recomendaciones). Una vez seleccionados los contaminantes críticos en cada uno de los medios ambientales, el evaluador deberá señalar todas las rutas de exposición completas o potenciales con importancia, que pudieran existir en el sitio o fuera de él. 2.8.3 Matrices ambientales El suelo es un compartimiento ambiental que puede funcionar como depositario y fuente secundaria de diversos contaminantes. Es importante resaltar que el suelo representa una fuente importante de exposición para la población humana sobre todo para los niños que son quienes, por sus actividades de juego, se encuentran en contacto directo con este compartimiento ambiental. Aunado a lo anterior es importante resaltar el hecho de que por acción de la lluvia, los contaminantes presentes en suelo pueden ser arrastrados por escorrentía a los cuerpos de agua (lagos, lagunas, ríos, esteros e incluso llegar al mar). La contaminación del sedimento se ha convertido en un problema ambiental complejo y puede potencialmente ser una amenaza para los ecosistemas acuáticos. El sedimento es el depositario ambiental de diferentes sustancias tóxicas y es el hábitat natural de muchos organismos acuáticos, por lo que estos compuestos pueden ser biodisponibles para estos organismos y entrar así a la cadena alimentaria. Por tal razón, es importante determinar las concentraciones de los contaminantes en este compartimiento ambiental. La elección de la profundidad del sedimento a muestrear varía de acuerdo a los intereses del estudio. Para riesgo humano es suficiente el sedimento superficial (primeros diez centimetros desde la superficie del sedimento). Sin embargo, si lo que se quiere evaluar es el riesgo ecológico, preferentemente se debe recolectar el sedimento de las partes más profundas del cuerpo de agua. Para una mejor caracterización del sitio, la muestra de sedimento marino, de manglar y/o de río, debe ser recolectada de los mismos sitios donde se recolecten muestras de agua y en los puntos de captura de fauna (bivalvos, crustáceos, peces, etc.). El polvo representa una vía de exposición a metales importante en la población infantil, debido a que las partículas que lo forman podrían estar constituidas por el metal mismo o este estar adherido a ellas. Dependiendo el tamaño de partícula el riesgo podría incrementarse por vía inhalatoria y dérmica Se deberán tomar dos tipos de muestras de polvos, una en el interior de la vivienda y otra en el exterior de la misma. El procedimiento para la toma de las muestras depende del lugar que se elija. Sin embargo se deberán tomar muestras de superficies donde se acumula más polvo: piso de la entrada de la casa, recamaras, corredores, cornisas de las ventanas, muebles, etc. Como referencias finales y aplicando a todas las matrices descritas, las muestras deberán ser recolectadas de los puntos donde exista un riesgo potencial de exposición humana o ecológica. Se deben recolectar muestras representativas de la zona buscando un gradiente de contaminación o zonas con diferente grado de exposición. Una vez seleccionados los puntos de muestreo, se deberán georeferenciar y ubicar en un mapa para su localización exacta. En todos los casos se deberá realizar un registro de los principales datos de la zona y puntos de muestreo (ej. nombre de la comunidad, fecha y hora, tipo de muestra, etc.). 2.8.4 Metales y metaloides 2.8.4.1 ANTECEDENTES GENERALES SOBRE COMPORTAMIENTO AMBIENTAL Los metales son elementos conductores de la electricidad, flexibles y con brillo. Algunos de ellos son esenciales para los seres vivos ya que se utilizan como cofactores en moléculas biológicamente activas. Sin embargo pueden llegar a ser tóxicos en función de la concentración y de la forma química del metal. Algunos de los metales y metaloides considerados importantes desde el punto de vista del riesgo ambiental son: mercurio, plomo, cadmio, cromo, arsénico, cobre, níquel, plata, selenio, manganeso y zinc (Depledge et al., 1994). Los metales se encuentran en forma natural en la corteza terrestre. Estos se pueden convertir en contaminantes si su distribución en el ambiente se altera mediante actividades humanas. En general esto puede ocurrir durante la extracción minera, el refinamiento de productos mineros o por la liberación al ambiente de efluentes industriales y emisiones vehiculares. Además, la inadecuada disposición de residuos metálicos también ha ocasionado la contaminación del suelo, agua superficial y subterránea y de ambientes acuáticos (ibid). Los metales pueden bioacumularse, pero típicamente no se biomagnifican (excepto el mercurio). Los factores que controlan la biodisponibilidad de los metales son la cantidad del carbono orgánico, la salinidad, la cantidad de carbonatos y sulfuros, el pH y la temperatura (ibid). La acumulación de metales en biota puede ser resultado del contacto directo con el cuerpo –dérmico- o de las estructuras respiratorias –inhalatorio- y a través del consumo de alimento –oral(ibid). 2.8.4.2 MÉTODO DE MUESTREO Suelo Las muestras de suelo deberán ser recolectadas con una pala o espátula de plástico (aproximadamente 1 kg de suelo) y deben depositarse en una bolsa de plástico. Estas muestras deben mantenerse a 4°C hasta su análisis. Sedimento Las muestras se deben recolectar en bolsas de plástico (aproximadamente 1 kg), extraerle la mayor cantidad de agua posible y se deben mantener a temperatura baja (4°C) hasta su análisis. Polvo El área mínima de muestreo debe ser de 30 cm x 30 cm. En cada punto se recolectará la muestra “barriendo” el polvo superficial o con una toallita húmeda. En ambos casos la muestra se colocará en bolsas de platico. Las muestras deben mantenerse a 4° C hasta su análisis. 2.8.4.3 CUANTIFICACIÓN DE METALES EN SUELO, SEDIMENTO Y POLVO La cuantificación de metales en suelo, sedimento y polvos se realizará mediante espectrofotometría de absorción atómica. Para Pb y Cd se utiliza el horno de grafito, mientras que para As, Cu y Zn se utiliza generación de hidruros. 2.8.4.4 PROCEDIMIENTO DE DIGESTIÓN DEL SUELO, SEDIMENTO Y POLVO Se debe pesar 0.5 g de suelo, sedimento ó polvo, además se pesa 0.1 g del estándar de referencia (NIST 2710). Las muestras y estándares se colocarán en vasos de teflón del horno de microondas, y se le agregan 10 ml de ácido nítrico al 25%. Los vasos se taparán utilizando membranas de ruptura, se introducen en las camisas correspondientes, se colocan en la tornamesa para llevar a cabo la digestión. Para los estándares y muestras problema se procederá de la misma manera. Es necesario esperar que se enfríen los vasos y el contenido se filtra con papel filtro Watman No 1 cada tubo se etiqueta. Se lava el vaso con 5 ml de HNO3 al 25% y se guarda para su lectura. Se debe verificar que el volumen final sea de 15 ml. Como control de calidad se debe utilizar el Estándar de referencia 2710 del NIST (National Institute of Standards and Technology) Montana Soil. Concentración, 62600 ± 38 µg/g. 2.8.5 Compuestos orgánicos persistentes y STPB 2.8.5.1 ANTECEDENTES GENERALES SOBRE COMPORTAMIENTO AMBIENTAL De manera general, este es un grupo de compuestos que se caracterizan por ser: a) Persistentes. Resistentes en grado variable a la descomposición biológica, química y fotolítica, así como de mantenerse en el ambiente por grandes periodos de tiempo. Estos compuestos pueden alcanzar una vida media de hasta más de 2 meses en el agua y más de 6 meses en el sedimento. Son bioacumulables y biomagnificables, los factores de bioconcentración (BAF) pueden llegar a ser mayores de 5000 y con valores de Kow >5. Tienen la capacidad de transportarse por efecto saltamontes a lugares remotos de la fuente, principalmente por sus características fisicoquímicas y la vida media de estos compuestos, que en el aire, pueden llegar a ser superiores a los 2 días; b) Orgánicos. Su estructura esta basada en cadenas de carbono, típicamente en moléculas complejas y; c) Contaminantes. Tóxicos y presentes a niveles superiores a los naturales. Existe evidencia sobre los efectos (o potenciales efectos) de estos compuestos en humanos y en el ambiente (Albert, 2004). Los agentes tóxicos contemplados dentro de este grupo son: 1) Plaguicidas. Aldrin, dieldrin, endrin, heptaclor, hezaclorohexano, clordano, toxafeno y mirex; 2) Químicos industriales: Bifenilos policlorados (PCB´s) 3) Derivados de la producción: Policloro dibenzo-dioxinas y Policloro dibenzofuranos; 4) otros de creciente preocupación.: Compuestos polibromados e hidrocarburos aromáticos policíclicos. La distribución de estos compuestos en el ambiente esta determinada por las características fisicoquímicas del compuesto, las propiedades del compartimiento ambiental en donde esta presente, la susceptibilidad a la degradación y las características de la biota (o receptor). En general, en estos compuestos el número de cloros en su estructura molecular determina de forma directa la estabilidad, liposolubilidad, bioacumulación, solubilidad, volatilización, adsorción a partículas y lixiviacion del suelo y el sedimento. A causa de la baja polaridad y estabilidad en su estructura, estos compuestos son poco reactivos y muy resistentes a la degradación biológica y fotoquímica, sin embargo los productos de resultado del metabolismo pueden ser de mayor peligrosidad que el compuesto original (Albert, 2004). La absorción de los COP´s ocurre principalmente por vía inhalatoria, dérmica y oral. Los principales sitios de deposito son lo tejidos ricos en grasa, como el hígado, el sistema nervioso, la medula ósea y los riñones. La excreción de COP´s es lenta lo que contribuye a su acumulación. 2.8.5.2 MÉTODO DE MUESTREO Suelo Las muestras de suelo deberán ser recolectadas con una pala o espátula de metal (aproximadamente 1 kg de suelo) y deben depositarse en frasco de vidrio color ámbar de boca ancha de 250 ml, se debe colocar un pedazo de aluminio entre el frasco y la tapa. Estas muestras deben mantenerse a 4°C hasta su análisis. Sedimento Las muestras se deben recolectar (aproximadamente 1 kg), en frascos de vidrio color ámbar de boca ancha de 250 ml y extraerle la mayor cantidad de agua posible. Se debe colocar un pedazo de aluminio entre el frasco y la tapa asi como mantener a temperatura baja (4°C) hasta su análisis. Polvo El área mínima de muestreo debe ser de 30 cm x 30 cm. En cada punto se recolectará la muestra “barriendo” el polvo superficial o con una toallita húmeda. En ambos casos la muestra se colocará en aluminio. Las muestras deben mantenerse a 4° C hasta su análisis. 2.8.5.3 CUANTIFICACIÓN DE STPB EN SUELO Y SEDIMENTO Se deberá pesar un gramo de muestra (suelo o sedimento) y ésta se coloca en vasos de teflón, se añaden 14 ml de diclorometano para su posterior digestión en un horno de microondas. Se adiciona un estándar interno. Después de la extracción las muestras se evaporarán con una corriente de nitrógeno en un evaporador, durante el proceso las muestras se resuspenden con hexano. Finalmente, el extracto se limpiará a través del paso por una columna de Fluorisil añadiendo dietil-eter (6%), posteriormente mediante una corriente de nitrógeno se concentra a 1 ml. El análisis cuantitativo se realizará mediante un cromatógrafo de gases acoplada a un detector de masas. 2.8.6 Compuestos orgánicos volátiles (BTEX) 2.8.6.1 ANTECEDENTES GENERALES SOBRE COMPORTAMIENTO AMBIENTAL Hacia finales de los años 40, tiene lugar en EEUU, la primera obtención de hidrocarburos aromáticos procedentes del petróleo al inventarse el reformado catalítico de naftas; con esta tecnología se buscaba elevar el número de octano que existía en las gasolinas de aviación. Había nacido la moderna petroquímica basada en aftas del petróleo y procesos catalíticos (www.alcion.es/DOWNLOAD/ArticulosPDF/iq/gratis/11articulos.pdf). Las fuentes para la obtención de Benceno, Tolueno y Xileno (BTXs) básicamente son: 1. Crackers de etileno/propileno 2. El reformado catalítico de naftas en refinería 3. La desproporcionación y desalquilación del tolueno. Actualmente, la petroquímica basada en naftas de petróleo aporta más del 96% de la producción mundial de BTXs y permite soportar una muy diversificada y en constante crecimiento la industria petroquímica. En Europa juega un papel muy importante la producción industrial de BTXs con 20% de la capacidad mundial instalada, lo que significa una producción prevista para el 2002 de 18 millones de t/año y con un crecimiento previsto del 40% sobre su capacidad actual. La nafta es la materia prima para el proceso de manufactura de xileno es típicamente una corriente con punto de ebullición entre 120°C y 230°C. La nafta se carga en el reactor químico (reformer) a elevadas temperaturas y presión, en donde gran parte de la nafta ampliamente parafínica se convierte en moléculas aromáticas. Los productos aromáticos son una mezcla de benceno, tolueno, isómeros del xileno y aromáticos superiores. (www.temoq1unal.tripod.com/Introducción.pdf). En nuestro país existen cerca de 4,500 empresas que manejan disolventes orgánicos del tipo de benceno, tolueno y xileno, en las que laboran aproximadamente 300 mil trabajadores cuyo contacto con estos compuestos aumenta cada año, pues mientras en 1985 el volumen anual de benceno fué de 178,372 toneladas, el volumen de tolueno fue de 220,084 y el de xileno de 154,271, para 1987 el consumo de benceno fue de 281,842 toneladas, el de tolueno 313,745 y el de xileno de 255,193 toneladas, amén de que aproximadamente 92% de los xilenos mixtos son incorporados a las gasolinas. Debido a que estos disolventes, cuya vía de entrada es la respiratoria y la cutánea, representan un riesgo para la salud de los trabajadores pues son capaces de atravesar la barrera hematoencefálica y producir daño orgánico cerebral por su acción neurotóxica, es necesario proteger a las poblaciones especialmente susceptibles, tales como las mujeres en las primeras etapas del embarazo, los trabajadores menores de 18 años y los mayores de 65 años, pues en los primeros los mecanismos de defensa aún no están completamente desarrollados y en los segundos ya se encuentran muy deteriorados, así como las poblaciones en mal estado general, la mala nutrición, las enfermedades crónicas, la obesidad y la sensibilización por afecciones previas. Con base en lo anterior, resulta necesario identificar, evaluar y controlar el contacto y la exposición a estos agentes tóxicos (NOM-047-SSA1-1993). 2.8.6.2 MÉTODO DE MUESTREO Y DE CUANTIFICACIÓN Para el análisis de BTXs en muestras ambientales se cuenta con dos normas: 1. NORMA OFICIAL MEXICANA NOM-138-SEMARNAT/SS-2003, LÍMITES MÁXIMOS PERMISIBLES DE HIDROCARBUROS EN SUELOS Y LAS ESPECIFICACIONES PARA SU CARACTERIZACIÓN Y REMEDIACIÓN. Los recipientes deben ser nuevos o libres de contaminantes. La muestra se debe tomar en recipientes independientes del resto de las fracciones. El recipiente debe ser de vidrio boca ancha, con tapa y sello de teflón (cartucho con sello que asegura la representatividad de la muestra hasta su análisis), La temperatura de conservación debe ser 4°C. El tiempo máximo de conservación es de 14 días (desde el muestreo hasta la extracción del analito). 2.8.6.3 MÉTODO ANALÍTICO La determinación cuantitativa de benceno, tolueno, etilbenceno y xilenos (como la suma de los isómeros orto-, meta- y para-) se debe realizar en un equipo de cromatografía de gases con columnas capilares adecuadas. Pueden utilizarse cualquiera de los siguientes sistemas de detección: espectrometría de masas, o detectores de fotoionización y conductividad electrolítica colocados en serie o si no están en serie, el análisis con doble columna de polaridad diferente en forma simultánea, para la cuantificación y confirmación de los analitos de interés. El método de referencia es el EPA 8260B 1996 o versiones posteriores para Compuestos Orgánicos Volátiles por Cromatografía de gases de alta resolución con detector de espectrometría de masas (CGAR/EM) y Purga y Trampa o el EPA 8021B 1996 o versiones posteriores para Compuestos Volátiles Aromáticos y Halogenados por Cromatografía de Gases usando Detectores de Fotoionización y Conductividad Electrolítica y Concentrador de Purga y Trampa. 2.8.6.4 PREPARACIÓN DE LA MUESTRA Para el análisis es necesario extraer previamente los BTXs que están presentes en la muestra de suelo homogeneizada y cribada. Debe utilizarse un sistema de Purga y Trampa, el cual esta acoplado al cromatógrafo de gases/espectrómetro de masas con la finalidad de introducir los hidrocarburos directamente a la columna de separación, inmediatamente después de haber sido purgados del suelo y concentrados en una trampa especial, con lo cual se reduce la manipulación de la muestra y los tiempos entre la extracción y el propio análisis. La técnica de Purga y Trampa consiste en hacer pasar una corriente de gas inerte a temperatura ambiente, a través de la muestra suspendida en agua reactivo y calentado a 40°C. Los hidrocarburos ligeros se desorben del suelo, pasan a la fase gaseosa y son entonces captados por un material adsorbente en la trampa del equipo. Posteriormente, este material se calienta y se le hace pasar a contracorriente, un gas inerte que desorbe los hidrocarburos, arrastrándolos hacia la columna del cromatógrafo donde son separados y transferidos al espectrómetro de masas donde son identificados y cuantificados. 2.8.6.5 CALIBRACIÓN Para la calibración del equipo se deberán utilizar: benceno, tolueno, etilbenceno y xilenos (isómeros orto, meta y para) puros certificados o una mezcla de materiales de referencia con certificado de análisis. Se deberán cumplir con los requisitos de calidad para métodos analíticos establecidos por la normatividad correspondiente. La curva de calibración debe iniciar para cada compuesto en una concentración 10 veces menor al límite máximo permisible más bajo de la NOM138-SEMARNAT-2003 y hasta el rango lineal de trabajo del método. 2.8.6.6 CUANTIFICACIÓN No se debe utilizar el TIC para cuantificar, la cuantificación deberá realizarse considerando la técnica de Perfil de Extracto de Iones con el área bajo la curva del ión principal de cada compuesto a partir de la línea base. Se deberá confirmar la identidad de cada compuesto por medio de la comparación del espectro de masas con la biblioteca de espectros del equipo. 2.8.6.7 REPORTE DE RESULTADOS Se deberá reportar la concentración de los hidrocarburos de manera individual, benceno, tolueno, etilbenceno y xilenos (suma de isómeros), en mg/kg base seca, por lo cual será necesario determinar también la humedad de la muestra. Se deberán anexar los TIC de cada uno de los BTX identificados comparados con la biblioteca de espectros del equipo. 2. NMX-AA-141-SCFI-2007 SUELOS – BENCENO, TOLUENO, ETILBENCENO Y XILENOS (BTEX) POR CROMATOGRAFÍA DE GASES CON DETECTORES DE ESPECTROMETRÍA DE MASAS Y FOTOIONIZACIÓN – MÉTODO DE PRUEBA. Esta norma mexicana describe el método para determinar BTEX en suelos. Los compuestos a determinar son los siguientes: Benceno, Tolueno, Etilbenceno y Xilenos (Suma de isómeros). A) Para realizar este método se deben utilizar las siguientes técnicas de introducción de muestra, acopladas al sistema de cromatografía de gases con espectrometría de masas (CG/EM) o la cromatografía de gases con detector de fotoionización (CG/DFI): Purga y Trampa por sistema abierto y sistema cerrado. B) El método para determinar concentraciones bajas de BTEX en suelo, se aplica en el intervalo de 0,5 µg/kg a 200 µg/kg. El método para determinar concentraciones altas de BTEX en suelo se aplica a concentraciones mayores a 200 µg/kg. C) El límite de cuantificación estimado del método (LCM) para un compuesto individual depende del instrumento. Usando la técnica de PT acoplada a CG /EM cuyo analizador de masa es de tipo cuadrupolo, los límites deben aproximarse a 5 µg/kg (masa húmeda) para muestras de suelo. Pueden obtenerse límites menores utilizando un analizador de trampa iónica. Los contenedores de muestras específicos que se requieren para el muestreo de los compuestos orgánicos volátiles en suelos, dependerán del sistema de purga y trampa que vaya a ser empleado. Existen sistemas que utilizan viales de vidrio de 40 mL con tapa especial, equipados con septum de silicón y recubiertos con PTFE. Otros sistemas permiten el uso de cualquier vial de vidrio de buena calidad, que sea lo suficientemente largo para contener al menos 5 g de suelo o de material sólido y 10 mL de agua y que puedan ser sellados con tapa de rosca y con septum de silicón y recubiertos con PTFE. Consultar las instrucciones del sistema de purga y trampa referente al tipo de viales, de septa, tapas específicas y de dispositivos de agitación mecánica adecuados. También, puede emplearse una gran variedad de contenedores incluyendo viales de vidrio de 60 ml con taparosca y septum. Trampas para el sistema abierto y cerrado. La trampa sugerida para el desarrollo de este método es de 25 cm de longitud con un diámetro interno de 0,267 mm, y compuesta con las siguientes cantidades de adsorbentes: 1/3 del polímero óxido de 2,6difenileno, 1/3 de sílica gel, y 1/3 de carbón de coco. Para extender la vida de la trampa es recomendable insertar 1,0 cm de material de empaque recubierto con metil-silicona (malla 30/60, Davison grado 15 o equivalente) en la entrada (inlet). Sino es necesario analizar diclorodifluorometano u otros fluorocarbonos de volatilidad similar, el carbón se puede eliminar e incrementar el polímero a 2/3 de la trampa. Si sólo se van a analizar compuestos con puntos de ebullición arriba de 35°C, tanto la sílica gel como el carbón, pueden eliminarse y llenar la trampa completamente con el polímero. Antes de iniciar los análisis, la trampa deberá acondicionarse toda la noche a 180°C retrolavando ó venteando con un flujo de gas inerte de al menos 20 mL/minuto. Previo al uso rutinario, la trampa deberá ser acondicionada por 10 minutos a 180°C con venteo. La trampa debe ventearse a la columna analítica durante el acondicionamiento diario, no obstante, debe programarse una rampa de temperatura para la columna antes del análisis de las muestras. El dispositivo para la desorción debe ser capaz de calentar rápidamente la trampa a 180°C o a la temperatura recomendada por el fabricante. La sección del polímero en la trampa no deberá ser calentada por arriba de 180°C, y las secciones remanentes no deberán exceder los 220°C durante el modo de calentamiento. Inyección por purga y trampa. Este método se recomienda para muestras líquidas y muestras sólidas. La extracción se realiza con metanol (y otros disolventes miscibles en agua) para muestras de suelos y residuos de aceites de alta concentración. Tradicionalmente el sistema de purga y trampa para muestras líquidas es utilizado a temperatura ambiente, mientras que para muestras sólidas es purgada a 40 °C para mejorar la eficiencia de la purga. Las muestras líquidas o sólidas pueden ser purgadas por arriba de las temperaturas recomendadas. Las muestras líquidas purgadas a temperaturas elevadas (arriba de 40°C) pueden mejorar la purga de muchos de los compuestos solubles en agua, los cuales tienen baja eficiencia de purgado a temperatura ambiente. Es necesario que los estándares de calibración, muestras y muestras de control de calidad sean purgadas a la misma temperatura, usando materiales apropiados para manejar el exceso de agua y demostrar el aceptable desempeño del método en el laboratorio. 2.8.6.8 CONDICIONES CROMATOGRÁFICAS RECOMENDADAS Condiciones generales. Temperatura del inyector: 125 – 225 °C. Temperatura de la línea de transferencia: 250 – 300 °C. 10.2.1 Interfase directa con división: Columna 4: DB-624 (6% cianopropilfenil / 94% dimetil polisiloxano) de 60m x 0,32mm D.I., 1.8 µm de espesor de película o equivalente. Flujo del gas acarreador: 1,5 ml/min Temperatura inicial: 35 °C durante 2 min Programa de temperatura: 4 °C/mínimo hasta 50°C, después 10 °C/min hasta 220 °C, hasta que todos los compuestos esperados hayan eluído. Relación de split: 100:1 Temperatura del inyector: 125 °C 10.2.2 Inyección directa Columna 2:DB -624 (6% cianopropilfenil / 94% dimetil polisiloxano) de 75m x 0,53mm D.I., 3 µm de espesor de película o equivalente. Flujo del gas acarreador: 2,0 ml/minuto Temperatura inicial: 40 °C durante 3 minutos. Programa de temperatura: 8°C/minuto hasta 260 °C, hasta que todos los compuestos esperados hayan eluído Relación de split: 100:1 Temperatura del inyector: de 200 a 225 °C Temperatura de la línea de transferencia: de 250°C a 300 °C. Es posible determinar la concentraciones de otras matrices, como agua, y aire u otras matrices, para lo cual se tiene que apoyar en los métodos estandarizados por la EPA (http://www.epa.gov/epaoswer/hazwaste/test/9_series.htm), que para estos casos el método base sería el Método 8260b, con los respectivos métodos de preparación de muestra: Método 5035 (Suelo y Residuos sólidos), Método 5032 (aceites, tejidos, residuos acuosos), Método 5041 (aire), y el Método 5021 (suelos y matrices sólidas). 2.9 Monitoreo biológico Cuando se registra la presencia de contaminantes en matrices ambientales (suelo, sedimento, polvo, agua), definitivamente los organismos (población humana y biota) que ahí habiten estarán expuestos a éstos contaminantes, sin embargo, estas sustancias pueden no estar biodisponibles, por lo tanto la mejor forma de determinar si los contaminantes presentes son biodisponibles o no es cuantificarlos directamente en diversos tejidos (plasma, músculo, hepático, adiposo, etc.) de los organismos que se están estudiando. 2.9.1 Evaluación de la exposición población humana 2.9.1.1 METALES Y METALOIDES Cuantificación de plomo en sangre. El muestreo se realiza en ayuno. En un tubo Vacutainer® con EDTA como anticoagulante tomar sangre venosa. Etiquetar el tubo con los datos necesarios para su posterior identificación y anotar éstos mismos en la bitácora de campo. Las muestras se deben conservar a una temperatura de 4°C hasta su análisis. La concentración de plomo en sangre se determinará de acuerdo al método descrito por Subramanian (1987). Se debe preparar un blanco y una curva de calibración a partir de una solución stock de 1ppm de plomo. El contenido de plomo en las muestras se determina por espectrofotometría de absorción atómica, en un aparato Perkin Elmer 3110 acoplado a un horno de grafito. Todas las muestras se analizarán por duplicado. Cuantificación de arsénico en orina. Se debe recolectar la primera orina de la mañana en frascos de polietileno lavados previamente con HNO3 al 10% y enjuagados con agua desionizada. De la orina recolectada se tomarán alicotas en tubos de polipropileno de 5 ml y se congelarán a – 20°C hasta el momento de su análisis. La muestra se somete a digestión ácida para eliminar la materia orgánica presente en la muestra añadiendo ácidos concentrados (HNO3 y HClO4) y sometiendo a reflujo para finalmente llevar a sequedad. La muestra se resuspende en un volumen conocido en HCl al 10%. La concentración de arsénico en orina se cuantificará de acuerdo al método descrito por Cox (1980). Las muestras se analizarán con un espectrofotómetro de absorción atómica con generador de hidruros. El valor obtenido se debe corregir por el volumen de orina digerida y por la concentración de creatinina para eliminar el factor de dilución. Todas las muestras deben analizarse por duplicado. 2.9.1.2 SUSTANCIAS TÓXICAS PERSISTENTES BIOACUMULABLES STPBS EN PLASMA Se deben obtener por lo menos 5 ml de sangre completa en tubos Vacutainer® con heparina para evitar su coagulación. De ser posible las muestras de sangre se deben centrifugar de inmediato a 3000 rpm durante 10 min para separar el paquete globular del plasma, el cual se coloca en un vial de 4 ml. De preferencia se deben congelar las muestras de plasma hasta su análisis, sin embargo, para su traslado al laboratorio bastará con mantenerlas a una temperatura no mayor a 4°C. A partir de 2 ml de plasma se realiza una extracción de lípidos mediante una mezcla de sulfato de amonio/etanol/hexano (1:1:3). El extracto lipídico se limpia mediante una columna de fluorisil y se concentra a 1 ml. El volumen final del extracto es de 100 µl para posteriormente inyectar 1 µl en un cromatógrafo de gases acoplado a un detector de masas. A todas las muestras se les debe añadir un estándar interno. 2.9.1.3 COMPUESTOS ORGÁNICOS VOLÁTILES Benceno.- Los análisis de benceno en aire exhalado, fluidos y tejidos corporales se realiza principalmente por cromatografía de gases (CG) acoplado a detector de ionización de flama (DIF), detector de fotoionización (DFI) o de masas (SM). Se siguen rigurosos métodos para la recolección y preparación de la muestra para prevenir su contaminación. Existen métodos para determinar metabolitos de benceno en orina; los métodos más ampliamente utilizados son la cromatografía de gases con detector de ionización de flama (CG/DIF) o de espectrometría de masas (SM) y la cromatografía líquida de alta resolución (CLAR). Para determinar benceno en el aire (ambiente, ocupacional e industrial), agua, sedimento, suelo, alimentos, humo de cigarro, gasolina, en combustibles para avión; esencialmente se realiza por CG con DIF, DFI, SM, además de CLAR/UV y espectrometría. (ASTDR, 2005a). Tolueno.- El tolueno puede determinarse en fluidos y tejidos biológicos y en aire exhalado usando una variedad de métodos analíticos. La mayoría de los métodos para fluidos biológicos usan técnicas de cromatografía de gases. El aliento usualmente se recolecta en trampas adsorbentes o en bolsa para muestra o contenedores y se analizan por cromatografía de gases (CG). Se puede medir tolueno en sangre, en orina, en aire exhalado como un biomarcador de exposición, pero también se pueden determinar los metabolitos de tolueno para monitorear la exposición de la población a tolueno. El ácido hipúrico se forma en sangre como metabolito del tolueno y el conjugado de glicina se trasforma en ácido benzoico. La cromatografía líquida de alta resolución con detector de ultravioleta (CLAR/UV) se emplea para determinar la presencia de ácido hipúrico en orina. Además, se pueden determinar el o-Cresol, ácido bencilmercapturico o el ácido S-p-toluilmercapturico. También existen métodos disponibles para matrices como aire, agua, y residuos sólidos (ASTDR, 2000). Existe un numero limitado de métodos utilizados para determinar las concentraciones traza de xileno en tejidos y fluidos biológicos, estos incluyen la cromatografía de gases acoplado a espectrometría de masas (CG/SM), espectrometría de gases acoplado a un detector de ionización de flama con nitrógeno (CG/DIF) y la cromatografía líquida de alta resolución (CLAR). Básicamente la cromatografía de gases equipado con el detector adecuado es el instrumento analítico usado para la determinación de xileno en muestras ambientales. Se debe realizar con precaución el aislamiento, recolección y almacenamiento del xileno para evitar las perdidas del compuesto en el aire (ASTDR, 2005b) 2.9.1.4 MÉTODOS DE ANÁLISIS DE BTEXS EN MUESTRAS BIOLÓGICAS NORMADOS EN MÉXICO. Actualmente en México se cuenta con la Norma NOM-047-SSA1-1993, que Establece los Limites Biológicos Máximos Permisibles de Disolventes Orgánicos en el Personal Ocupacionalmente Expuesto (www.salud.gob.mx/unidades/cdi/nom/047ssa13.html). Límites biológicos de exposición industrial Benceno.- Fenoles totales en orina al final del turno de trabajo: 50 mg/g creatinina. Tolueno.- Acido hipúrico en orina al final del turno de trabajo: 2.5 g/g de creatinina. Tolueno en sangre venosa al final del turno de trabajo 1 mg/l Xileno.- Acido metilhipúrico en orina al final del turno de trabajo: 1.5 g/g de creatinina. Los métodos propuestos para el muestreo, tratamiento de la muestra y análisis de estos metabolitos son los publicados por el Instituto Nacional de Salud y Seguridad Ocupacional (NIOSH) (http://www.cdc.gov/niosh/nmam/). Método 8300 ácido hipúrico en orina (exposición a tolueno). Método 8301 ácido hipúrico y metilhipúrico en orina (exposición a tolueno y xileno). Método 8305 fenol p-Cresol en orina (exposición a fenol, benceno y pcresol). La vida media biológica del benceno es de 12 h, por lo que es importante tomaren cuenta el tiempo de toma de muestra en relación con la exposición. Es posible determinar benceno en aire exhalado, en sangre o en orina, además de los metabolitos: ácido S-fenilmercapturico (SPMA) y ácido t, t-mucónico en orina (www.estrucplan.com.ar/Producciones/imprimir.asp?IdEntrega=301). Ácido t, t- mucónico 1. Medir en 20 ml de orina emitida espontáneamente. 2. La muestra se colecta inmediatamente después de la jornada laboral y se refrigera a 4°C. 3. La orina se recolecta en envase de polietileno sin necesidad de previo tratamiento. 4. Método sugerido CLAR 5. Índice biológico de exposición: 500µ g/g de creatinina Ácido S-fenilmercapturico 1. Medir en 50 ml de orina emitida espontáneamente. 2. La orina se recolecta en envase de polietileno sin necesidad de previo tratamiento. 3. Método sugerido CLAR. 4. Índice biológico de exposición: 25µ g/g de creatinina. Ácido metil hipurico 1. Medir en 20 ml de orina emitida espontáneamente. 2. La muestra se recolecta media hora después de cesada la exposición al finalizar la jornada de trabajo del día. Debe ser recolectada en envases de polietileno limpio, luego se refrigera o se congela hasta su análisis. 3. Evitar tomar la muestra en lunes dado que los valores son significativamente más bajos que otros días. 4. Como técnica se sugiere la CLAR. Se acidifica la orina a pH 1.0 con HCl y se pasa a través de un cartucho Sep-Pak C18. Los cartuchos lavados con HCl diluido y una mezcla de agua/metanol/ácido ácetico y luego se eluye con cloroformo acidificado. El eluido se evapora y se reconstituye con un tampón fosfato, luego se pasa a través de un cartucho de intercambio aniónico (SAX), el cual es lavado con tampón y HCl diluido. El ácido S-fenilmercapturico es recuperado eluyendo con tampón concentrado y es transformado en S-fenilcisteína. Se derivativa con oftaldehído (OPA) y 2-mercaptoetanol (MCE). Se utiliza una columna Supelcosil C18, 150x 4.6 mm, 3µ m Con detector de fluorescencia: Longitud de onda de excitación 330nm, Longitud de onda de emisión 440 nm. Límite de detección: 0.5µ g/L 5. Índice biológico de exposición: 1.5g/g de creatinina. 2.9.2 Evaluación de la exposición biota Se deberán georeferenciar los sitios de captura en unidades Geográficas y en unidades UTM (Universal Transverse Mercator) con ayuda de un GPS (Global Positioning System). Los puntos registrados se habrán de ubicar en un mapa con la localización exacta del sitio de muestreo, así como también su registro en bitácora. Se deberá incluir en el registro de captura los datos como el nombre común y científico de la especie, el método de colecta. También se deberá tomar diversas medidas morfométricas de los especimenes como talla, peso, etc. Es importante identificar el estadio de desarrollo del organismo (cría, juvenil, adulto) y lo hábitos alimenticios de las especies muestreadas, la importancia de la especie analizada en su relación con la dieta humana o como especie típica de la zona de estudio. También se requiere de información sobre su abundancia a lo largo del año. En cuanto al tamaño de la muestra ATSDR solicita al menos 20 individuos de cada especie en el sitio de estudio y 20 individuos controles para obtener niveles basales. La colecta de 20 individuos no siempre es posible y al menos se deberá de buscar contar con un número de 10 organismos por especie por sitio. Los vertebrados muestreados serán aquellos que se consideran como especies útiles desde el punto de vista de riesgo (por ejemplo los peces que deben ser muestreados son aquellos que forman parte de la dieta normal de la comunidad en estudio o desde el punto de vista de riesgo ecológico, es importante colectar diversos vertebrados de acuerdo a su posición en la cadena trófica. Es de suma importancia contar con una licencia oficial de captura en especial cuando se desee trabajar con especies con algún estatus de protección especial o con especies en peligro de extinción. 2.9.2.1 MÉTODO DE MUESTREO Los métodos de captura para organismos silvestres variarán de acuerdo al grupo animal que se desee evaluar. Por ejemplo, los peces deben ser capturados con tarraya o electropesca; los anfibios se pueden capturar con la mano o con trampas de embudo y barrera; los reptiles con ganchos herpetológicos y pértigas; los pequeños mamíferos con trampas sherman ó tomahawk; sin embargo, cuando se va ha realizar un muestreo destructivo se pueden utilizar rifles de diábolos. En caso de no tener experiencia en la captura y manejo de organismos silvestres se recomienda asesorarse con biólogos de campo. 2.9.2.2 METALES Y METALOIDES Cuantificación de metales en tejido De ser posible se deben recolectar 3 g. de muestra y se colocan en frascos de vidrio color ámbar de 50 ml. Los organismos deberán sacrificarse y se obtendrán los órganos que sean de interés (hígado, riñón, cerebro, etc.) se prefundirán con una solución Tris 10mM a un pH de 7.2. Las muestras de tejido se colocarán por lo menos 9 horas en vasos de vidrio que contendrán una mezcla de solución ácida (ácidos nítrico y perclórico) para eliminar toda la materia orgánica. La cuantificación de metales se realizará por espectofotometría de absorción atómica. El metaloide arsénico se determinará usando un espectrómetro Perkin Elmer Analyst 100 por generación de hidruros. El plomo y cadmio se analizarán usando un espectrómetro Perkin Elmer modelo 3110 acoplado a un horno de grafito. Como control de calidad se debe utilizar un estándar de referencia (National Bureau of Standards bovine liver 1577a). Para cuantificar plomo en sangre se sigue el mismo método utilizado en humanos. La cuantificación de plomo en sangre se determina utilizando el mismo método que se mencionó en la sección de humanos. 2.9.2.3 SUSTANCIAS TÓXICAS PERSISTENTES BIOACUMULABLES STPBS EN TEJIDOS Colecta de la muestra de tejido Obtener la máxima cantidad de tejido (aproximadamente 10 g) y colocarlo en un frasco de vidrio color ámbar de boca ancha de 50 ml, al cual se le coloca papel aluminio entre la boca del frasco y la tapa del mismo, colocar otra capa mas de papel aluminio cubriendo la parte superior del frasco y sellar con parafilm. Etiquetar con los datos necesarios para su posterior identificación. Las muestras deben mantenerse frías durante el periodo de colecta y transporte. La muestra deberá congelarse a -15°C hasta su análisis. Método analítico para cuantificar COPs en tejido El método de extracción de COPs en tejido se basa en el método desarrollado y validado por Jensen et al., (2003), el cual se divide en tres etapas: 1) Extracción de los lípidos del tejido; 2) Extracción de los analitos de los lípidos; 3) Limpieza de la muestra. 1. Extracción de los lípidos del tejido. Se pesan 10 gramos de la muestra que son colocados en un embudo de vidrio, con filtro de vidrio (embudo de separación de fondo plano No. 1). Se adiciona el estándar interno (PCB-141) y se procede a la primera extracción líquido-líquido adicionando 25 ml de isopropanol y 10 ml de dietileter. Enseguida la muestra se muele durante 1 minuto y se deja reposar otro minuto. Posteriormente se abre la llave de paso del embudo No.1 y el solvente es colectado en un segundo embudo (de vidrio sin filtro) que contiene 50 ml de H3PO4 0.1 M disuelto en NaCl al 0.9 %. Se realiza una segunda extracción líquido-líquido del embudo No.1 adicionando 10 ml de isopropanol y 25 ml de una mezcla de hexano:dietileter (9:1), moler nuevamente por un minuto y reposar por otro minuto. El solvente es colectado en el embudo No. 2. Una tercera extracción se lleva a cabo añadiendo al embudo No. 1, 25 ml de hexano:dietileter (9:1), agitando con varilla de vidrio durante un minuto y dejar reposar por otro minuto mas. Finalmente se permite que el solvente baje al embudo No. 2. El embudo No. 2 se agita suavemente durante un minuto y se deja reposar hasta obtener dos fases, la orgánica (superior) y la acuosa (inferior). La fase acuosa se transfiere a un vaso de precipitado. La fase orgánica se colecta en un vaso de precipitado de 100 ml, previamente pesado. La fase acuosa se transfiere de nueva cuenta al embudo No. 2 para realizar una segunda extracción con 10 ml de una mezcla de hexano:dietileter (9:1). Se agita suavemente y se deja reposar hasta obtener las dos fases. Se vuelve a descartar la fase acuosa (inferior) y nuevamente se colecta la fase orgánica (superior) al vaso de precipitado que contiene el material obtenido en la primera extracción. Para determinar la cantidad de lípidos, se deja evaporar el solvente del vaso de precipitado que contiene las fases orgánicas (el vaso puede dejarse toda la noche en una campana de extracción y al día siguiente, si aún no se evapora el solvente, puede colocarse en baño de agua a 37°C por períodos de 30 minutos hasta alcanzar un peso constante). Cuando el solvente se ha evaporado se determina entonces el peso y por diferencia de pesos se obtiene el peso de los lípidos. 2. Extracción de los analitos de los lípidos. Los lípidos se disuelven con 1 ml de hexano y son transferidos a un tubo de ensaye (tubo No. 1). El vaso donde estaban los lípidos se lava tres veces con hexano empleando 0.5 ml cada vez. Los lavados son transferidos al tubo No. 1. Al final se ajusta el volumen de hexano hasta tener una proporción de 1 ml de solvente por cada 100 mg de lípidos. Adicionar al tubo de ensaye, el mismo volumen de H2SO4 concentrado que se haya adicionado de hexano y mezclar por inversión durante 2 minutos. Centrifugar a 3,000 rpm por 5 minutos. La fase orgánica (superior) se transfiere a un segundo tubo. La fase ácida (inferior) se lava con 3 ml de hexano, se agita por inversión durante dos minutos y se centrifuga a 3,000 rpm durante 5 minutos. La fase orgánica es transferida al segundo tubo. Las fases orgánicas colectadas en el segundo tubo son evaporadas hasta aproximadamente 0.5 ml empleando corriente de nitrógeno y calentamiento (37 °C) para posteriormente realizar la limpieza. 3. Limpieza de la muestra. a) Activación de la sílica gel. La sílica gel se activa en una estufa a 280°C durante 24h, se deja enfriar a temperatura ambiente y se transfiere a un frasco de vidrio ámbar, éste se coloca en un desecador para conservar la sílica activada. Ésta debe usarse por un periodo de no más de 7 días. b) Preparación de las columnas. Se preparan las columnas de la siguiente manera: en una pipeta Pasteur de punta larga se coloca un tapón de lana de vidrio silanizada, se agrega 0.1 g de una mezcla de SiO2act:KOH 1M (2:1), 0.9 g de una mezcla de SiO2act:H2SO4 conc. (2:1) y 0.1 g de sulfato de sodio anhidro. c) Limpieza de la muestra. La columna se acondiciona con 8 ml de una mezcla de DCM (dicloro metano):hexano (3:1). Se adiciona el extracto obtenido del segundo tubo y los analitos se eluyen con 8 ml de una mezcla de DCM:hexano (3:1). Se realiza un cambio de solvente de DCM a hexano por medio de una corriente suave de nitrógeno a 37°C en un evaporador y la muestra se concentra a 100 µ l, la cual se transfire a un vial para su posterior análisis cromatográfico. En biota la determinación de STPBs en plasma se realiza mediante el mismo método descrito para población humana. 2.9.3 Efectos biológicos y consideraciones en su evaluación 2.9.4 Biomarcadores Cuando el contaminante o grupo de contaminantes son biodisponibles para los organismos (población humana y biota) y se ha encontrado su presencia en tejidos o fluidos biológicos, es importante evaluar si se presentan efectos biológicos asociados a la exposición. Cabe señalar que además existen otros factores relacionados con la distribución por los tejidos, el metabolismo, los mecanismos de desintoxicación celulares y la excreción, que habrán de influir en la toxicidad del contaminante y por lo tanto en la aparición de efectos biológicos. Las respuestas biológicas hacia los contaminantes pueden ser observadas a través de la medición de biomarcadores. Shugart et al., (1992) define a los biomarcadores como “una alteración inducida por un xenobiótico en componentes o procesos, estructuras o funciones celulares o bioquímicas, que es susceptible de medición en un sistema o muestra biológica”. En toxicología existen tres diferentes tipos de biomarcadores: 1) Exposición.- se usan para predecir la dosis recibida por un individuo, el cual puede estar relacionado a cambios como resultado de una enfermedad, 2) Efecto.- son medidas bioquímicas, fisiológicas, etológicas, o alteraciones en el organismo, que dependiendo de su magnitud pueden ser reconocidas como deterioro de la salud o una enfermedad y; 3) Susceptibilidad.- indican el deterioro del estado fisiológico o bioquímico que puede predisponer al individuo a impactos de agentes químicos, físicos o infecciosos. 2.9.4.1 TIPOLOGÍA Y CARACTERÍSTICAS GENERALES DE LOS BIOMARCADORES DE EFECTO En general, los biomarcadores de efecto pueden ser considerados como medidas funcionales de exposición a un agente estresante (entre ellos la exposición a contaminantes), las cuales usualmente se expresan a nivel de organización molecular, celular y de organismo. Adams et al., (2001) sugiere que en general lo usos de los biomarcadores son: A) caracterizar los mecanismos de toxicidad implicados en las repuestas biológicas a altos niveles de organización, B) ayudar a establecer relaciones entre causa (agente estresante) y efecto (respuesta), C) indicar la presencia o ausencia de grupos específicos de contaminantes, D) establecer la ausencia de efectos biológicos o ecológicos significativos en las poblaciones, comunidades y ecosistemas, E) predecir respuestas de alto nivel (para biomarcadores que han sido relacionados semicuantitativamente con altos niveles de organización), F) como una señal para monitorear si se han excedido los umbrales fisiológicos o los límites de tolerancia, G) proporcionar un intervalo y diversidad de respuestas biológicas que pudieran ser la evidencia de peso para el proceso de evaluación de riesgo y; H) para monitorear la salud del ambiente y darle seguimiento a las mejoras resultantes de la evaluación de riesgo o mitigación. Los biomarcadores varían de los generales a los específicos, de los de relativamente poca sensibilidad a los de alta sensibilidad y desde los de nivel de organización molecular a los de nivel individual. Pueden ser clasificados de forma general en: A) biomarcadores moleculares, que miden las respuestas en los ácidos nucleicos como daños o alteraciones en el DNA, RNA, así como cambios en la expresión de los genes, B) biomarcadores bioquímicos, que miden la afectación de la estructura o función de las proteínas a través de la variación especifica de la actividad enzimática, de los niveles de proteínas específicas y por la presencia de proteínas de estrés, C) biomarcadores histocitopatológicos, que miden los cambios gruesos en la estructura y desarrollo de las células, tejidos, órganos y de organismos, D) biomarcadores fisiológicos, que miden las funciones fisiológicas básicas tales como la respiración, el crecimiento, la alimentación y la excreción, E) biomarcadores etológicos, que miden el cambio de comportamiento en los organismos, bajo el supuesto de que el organismo representa el resultado integral final de los procesos bioquímicos y fisiológicos. De acuerdo con su estado de validación, los biomarcadores más usados en la toxicología ambiental son: las proteínas de “shock” calórico o de estrés (HSP, por sus siglas en inglés), actividades enzimáticas como la oxigenasa de función mixta (MFO) o el citocromo P450, niveles de metalotioneínas, etc. También se analizan biomarcadores de genotoxicidad (ej. aducciones de ADN, aberraciones cromosómicas, fragmentación de ADN, micronúcleos, inmunotóxicas (ej. proliferación de linfocitos) y; etc.), respuestas medidas reproductivas (ej. vitelogenina y hormonas esteroideas en plasma). Finalmente, también son útiles las respuestas fisiológicas, los marcadores de expresión de ciertos genes, la integridad de la membrana lisosomal, etc. En general todos estos biomarcadores, buscan relacionar el grado de modificación del biomarcador con el grado del efecto adverso (Chambers et al., 2002). Es sumamente importante en este punto aclarar que la gran mayoría de los efectos biológicos no son específicos y por lo tanto, el análisis de confusores es útil para reducir la incertidumbre de la inespecificidad. Los efectos biológicos que pueden ser evaluados potencialmente son muchos. Por lo tanto, aquellos efectos que sean seleccionados para el estudio, deberán contar con antecedentes científicos de estar asociados con la exposición al contaminante presente en el sitio. Es muy importante que el trabajo incluya el análisis de una población control, apareada con la población del sitio contaminado en cuanto a los confusores, pero sin la exposición al contaminante o tener antecedentes bibliográficos de otras poblaciones que muestren valores “normales”. 2.9.4.2 CRITERIOS DE SELECCIÓN DE LOS BIOMARCADORES DE EFECTO De acuerdo con Chambers et al., (2002) existen una serie de criterios en la selección de biomarcadores y se enlistan continuación. a) Elección de sitios de muestreo.- Además del muestrear el área contaminada de interés, en algunas ocasiones será necesaria la evaluación de sitios de referencia o a lo largo de un gradiente de disturbio, la información permitirá la comparación apropiada de resultados y la eliminación de factores confusores. b) Selección de la especie o población a estudiar.- para el caso de biota, el organismo deberá de ser nativo y representativo (que no sea una especie rara) del área de estudio, además que la mayor parte, o toda su historia de vida la haya pasado en el sitio de interés. En el caso de elegir especies migratorias se debe de conocer muy bien sus patrones migratorios y su biología. El organismo debe de ser receptor de las principales rutas de exposición para ser considerado. Deben tomarse en cuenta las características de la historia de vida del organismo, como el sexo, edad, estado reproductivo, estrategia reproductiva; factores como estos pueden afectar la medida del biomarcador y complicar la interpretación de resultados (Ej. los organismos con tiempos generacionales cortos y altas tasas reproductivas son útiles para muestras grandes mientras que los de tiempos generacionales largos y tasas reproductivas cortas pueden ser utilizados para estudios de exposición crónica). Finalmente es mejor seleccionar una especie para la cual exista información sobre los efectos de los contaminantes que deseen evaluarse (absorción distribución, metabolismo, toxicidad y eliminación). En el caso de población humana, se deberá de escoger el grupo que se considere en mayor susceptibilidad (ej. mujeres embarazadas, niños, adultos mayores), que dependerá de factores como: la edad, sexo, estado de crecimiento, estado nutricio, enfermedades coadyuvantes (enfermedades crónicas degenerativas), hábitos de juego, periodo gestante, habitación en la cercanía de las fuentes, tiempos de residencia, exposición laboral, etc. La población de estudio deberá estar expuesta por lo que se es necesario realizar biomarcadores de exposición acordes a la toxicodinámica del contamínate, ya que esto determinará la medición en alguna matriz biológica especifica (ej. pelo, sangre, orina, heces, uña, leche materna). Al igual que la biota, es preferible utilizar biomarcadores con los que se cuenta con suficiente información disponible y se haya probado su relación con un toxico o grupos de tóxicos según sea el caso. c) Selección del biomarcador.- Además de los criterios descritos a continuación, se sugiere elegir un set jerárquico de biomarcadores, los primeros de fácil medición, rentables y generales para probar una gran cantidad de sitios; posteriormente en las siguientes etapas utilizar biomarcadores más específicos para profundizar en los sitios con resultados significativos en la etapa anterior. • Indicadores generales.- Algunos biomarcadores son indicadores en general y sólo sugieren el estrés en la población, pueden emplearse para identificar a los individuos o poblaciones afectadas por el agente estresante. Tales biomarcadores son de utilidad limitada para su uso en la evaluación de riesgo, ya que no identifican el grado de tensión que podría atribuirse a los tóxicos bajo los procedimientos de la evaluación de riesgo. • Sensibilidad relativa.- Un biomarcador altamente sensible podría ser útil en identificar rápidamente los cambios en la exposición. • Especificidad biológica.- La especificidad y por lo tanto la utilidad de un biomarcador puede existir solamente en ciertas especies o tejidos, porque las características fisiológicas o bioquímicas de esa especie o tejido son únicas. • Especificidad química.- Los biomarcadores que son específicos a un químico, a una clase de químicos, o por lo menos están muy limitados a cierto número de clases pueden ser de gran valor. • Claridad en la interpretación.- Los biomarcadores que respondan solamente a los tóxicos de interés y no a otros cambios en la fisiología o en el ambiente son de gran valor para la evaluación de riesgos. • Tiempo de la manifestación del efecto.- Un tiempo relativamente corto de respuesta de la exposición al cambio en el biomarcador será el más útil, aunque la evaluación de riesgo puede necesitar tratar efectos crónicos, tales como desarrollo del cáncer. • Permanencia de la respuesta.- Si la respuesta del biomarcador es transitoria, ésta puede limitar su utilidad en la evaluación de riesgo; sin embargo, con biomarcadores persistentes el curso de tiempo de cambio y recuperación del biomarcador tendrá que ser bien entendida. • Variabilidad inherente (confiabilidad).- La variabilidad puede resultar del grado inherente de respuesta del organismo o de los factores externos al organismo que influyen en su grado de respuesta. Si el biomarcador es demasiado susceptible a la variabilidad interna o externa, puede ser de poca utilidad para la evaluación de riesgo. • Acoplamiento a efectos de un nivel más alto de organización.- Un biomarcador ideal correlacionaría cambios directamente en una manera cuantitativa al efecto nocivo (ej. aberraciones cromosómicas -alteraciones reproductivas o patologías, etc.). Si el acoplamiento no puede ser hecho, el biomarcador sólo tendrá valor como índice de exposición y no de los efectos. • Aplicabilidad a las condiciones de campo.- Si el biomarcador no puede ser monitoreado en poblaciones verdaderas no es útil para la evaluación de riesgo. • Validación en el campo.- Se entiende como el establecimiento del mecanismo o relación causal entre la exposición al agente estresante y el cambio biológico o ecológico. Obviamente se requiere la validación antes de que el biomarcador pueda ser usado de manera oficial. • Consideraciones metodológicas.- La facilidad en la medición, la reproducibilidad de las medidas y el costo deben de ser considerados, a fin de establecer la utilidad del biomarcador en varios sitios. • Estado de la utilidad del método.- El biomarcador debe ser establecido y documentado lo suficiente para generar una base de datos amplia que indique consistencia y confiabilidad; esto inspirará confianza sobre la significación de los resultados al usarlo. • Metodología de muestreo y análisis.- El diseño del muestreo dependerá de las características fisicoquímicas y biológicas del contaminante, así como de la biología de la especie de prueba o población receptora, de la sensibilidad y persistencia de respuesta del biomarcador. También, deben considerarse factores abióticos que pudieran interferir con la respuesta del biomarcador (Ej. salinidad, estacionalidad, pH, etc.). El muestreo, la recolección, el almacenaje y el análisis pueden afectar la validez del resultado, por lo tanto deben seguirse las consideraciones y procedimientos analíticos para cada biomarcador, los aspectos importantes varían por tipo de prueba, por lo que tal vez sea necesario recoger muestras diferentes para cada biomarcador y también puede ser posible medir el biomarcador por diferentes métodos. 2.10 Efectos biológicos de los contaminantes Existe una gran variedad de efectos reportados en biota y población humana (Figura 1) asociados a la exposición de una amplia gama de contaminantes, la elección de los efectos a evaluar dependerá del objetivo del estudio, del contexto ambiental en el que este trabajando, el tipo o mezcla de contaminantes que se haya encontrado en el monitoreo ambiental, el presupuesto destinado y de las consideraciones antes mencionada en la selección de biomarcadores. A continuación se describen de forma general sólo algunos ejemplos de los más comúnmente evaluados por su relevancia en toxicología ambiental. Figura 1. Diversidad de efectos tóxicos 2.10.1 Efectos genotóxicos El genoma es el conjunto de información genética necesaria para el funcionamiento de un ser vivo, dicha información esta codificada en moléculas de ADN. Estas moléculas están constituidas por la integración de estructuras físicas denominadas cromosomas. Todos los componentes básicos del ADN (bases nitrogenadas, azucares y grupos fosfodiesteres) son posibles blancos de alteraciones químicas por agentes genotóxicos como compuestos orgánicos persistentes -ej. DDT, lindano-, hidrocarburos aromáticos policíclicos -ej. hidroxipireno- y metales -ej. cadmio- (Albert, 2004). La teoría de la mutación somática del cáncer establece que los daños del genoma que producen mutaciones son la base para el desarrollo de varios tipos de cáncer. De manera tal, que el ADN es el blanco para los cancerígenos y de que un sólo impacto en el ADN, en el sitio adecuado y que no sea reparado correctamente, puede tener consecuencias severas para la célula (Beringola, 1996). De manera general el daño genotóxico se puede subdividir en: 1) Mutagenesis puntual; 2) Roturas y aberraciones cromosómicas y, 3) daño y fragmentacion del ADN. Existe una gran variedad de parámetros genotóxicos que pueden ser evaluados en biota y población humana. Las cuantificaciones de daño genotóxico mas comúnmente usadas son: ensayo cometa, micronúcleos y aberraciones cromosómicas, entre otras. Para fines de ejemplificación se describirán continuación el ensayo cometa y los micronucleos. El ensayo cometa es una prueba capaz de detectar daños en el ADN y es aplicable a estudios de biomonitoreo (Lebailly et al. 1997). Se caracteriza por ser un método sensible, rápido, sencillo, de bajo costo y aplicable a varios tipos de células eucariotas (Mckelvey-Martin et al., 1993). La técnica de Singh et al., (1988) bajo condiciones de lisis y electroforesis alcalina (pH>13) permite analizar la migración del ADN debido a rupturas en la hebra simple del ADN y sitios álcalilábiles (Speit y Hartmann 1999). El ensayo cometa se utiliza ampliamente para detectar en células individuales, el daño in vitro o in vivo causado al ADN por agentes genotóxicos, ya sean químicos o físicos (Fairbairn et al., 1995, Rojas et al., 1999, Tice et al., 2000). La técnica ha sido principalmente utilizada en el estudio del daño genético inducido por plaguicidas y otros mutágenos ambientales en humanos, auque su uso en especies silvestre ha sido una de sus actuales aplicaciones (Fairbairn et al., 1995, Rojas et al., 1999). Con algunas modificaciones, esta técnica puede evaluar la inducción de enlaces cruzados, los mecanismos de reparación celular y de apoptosis (Fairbairn et al., 1995; Speit y Hartmann, 1999). Los micronúcleos son fragmentos de cromosomas o cromosomas completos que condensan y permanecen rezagados durante la anafase del ciclo celular; en las celulas hijas, estos toman forma de núcleos más pequeños que el núcleo principal, y de ahí su nombre de “micronúcleos” (Zúñiga y Gómez, 2006). Estos fragmentos son causados de manera espontánea o por causa de agentes tóxicos (agentes que se denominan clastógenos). Los micronúcleos son conocidos en el campo de la hematología como cuerpos de Howell-Jolly y su forma es generalmente redonda o almendrada, con un diámetro que varía desde 0.4 a 1.6 micras (Decordier y Kirsch-Volders, 2006). La prueba se realiza en diferentes tipos celulares como: eritrocitos policromáticos de la médula ósea, cultivos de linfocitos de sangre periférica, eritrocitos jóvenes y maduros de la sangre periférica, queratinocitos, células de la mucosa bucal, hepatocitos de rata, células germinales y células de descamación de la vagina de la rata, entre otros. El ensayo de micronúcleos es capaz de detectar indirectamente ruptura o pérdida cromosómica y actualmente se encuentra en gran auge dada su utilización en líneas de investigación sobre mutagénesis, también es útil para conocer in vitro el efecto genotóxico de nuevos agentes químicos tanto a nivel ambiental con nuevos plaguicidas y pesticidas, como en el ámbito sanitario con la utilización de nuevas drogas citostáticas en los tratamientos antitumorales (Kirsch-Volders y Fenech, 2001). Muller y Streffer (1994) propusieron cuatro diferentes modelos para la formación de micronúcleos, en los cuales se involucran clastogenicidad o rompimiento de ADN: 1) fragmentos acéntricos. 2) cromosomas multicéntricos. 3) daño al cinetocoro y 4) daño al aparato mitótico. 2.10.2 Efectos endocrinos Un disruptor endocrino es una sustancia o mezcla de ellas que altera una función del sistema endocrino y causa efectos en la salud del organismo, o a su progenie o a su población (IPCS, 2002). De acuerdo con Rendón (2005) el modo de acción de los moduladores o disruptores endocrinos no esta bien establecido, pero existen varios mecanismos propuestos como: 1) ser estructuralmente similares a las hormonas e interaccionar con receptores celulares “blanco” como las hormonas naturales, causando una actividad celular anormal e impredecible, 2) pueden bloquear los sitios de enlace impidiendo la unión con las hormonas naturales, 3) pueden inducir la creación de receptores extra, amplificando el efecto de las hormonas naturales, 4) pueden interactuar directa o indirectamente con las hormonas naturales cambiando su mensaje y; 5) pueden alterar el patrón natural de la síntesis hormonal y el metabolismo cambiando la cantidad de hormona circundante. El IPCS (2002) ha recopilado una gran cantidad de información sobre efectos endocrinos en fauna silvestre y población humana que están asociados o posiblemente asociados a la exposición a contaminantes. En vida silvestre destacan los casos de adelgazamiento del cascaron en aves de presa por exposición a DDT, anormalidades en el desarrollo en cocodrilos por exposición a compuestos organoclorados, declinamiento en las poblaciones de anfibios y masculinización en gasterópodos marinos expuestos a TBT y feminización en peces. Aunque en la población humana las relaciones causales no están bien esclarecidas, posiblemente el declinamiento de la calidad del esperma humana en varios países, el desajuste en la proporción de sexos, el aumento en la frecuencia de endometriosis y varios tipos de cáncer (endometrio, testicular, próstata, y tiroides) pueden ser resultado de la exposición a disruptores endocrinos. Además de lo presentado anteriormente es frecuente tanto para la población humana como para biota evaluar las concentraciones de diversas hormonas (ej. testosterona, estradiol, T3/T4, cortisol, etc), además para el caso particular en vida silvestre (vertebrados no mamíferos) la presencia de proteínas reguladas por control hormonal (ej. vitelogenina). La vitelogenina es una proteína regulada por control del estradiol en las hembras y es precursora de las proteínas de reserva del huevo. Es utilizada principalmente como biomarcador de efecto por exposición a compuestos estrogénicos en peces (principalmente evaluado machos); sin embargo se ha aplicado en otros taxas como reptiles y anfibios. El cambio en los niveles de vitelogenina en peces se ha asociado con la presencia de DDE, PCB’s, mirex, cadmio, nonilfenol y diversos farmacéuticos entre otros. 2.10.3 Respuestas hematológicas y fisiológicas La evaluación de este tipo de respuestas son más comúnmente utilizadas en biomonitoreos de la vida silvestre (en especial peces), sin embargo en población humana se ha demostrado causalidad entre este tipo de respuestas y contaminantes como el lindano, benzeno y plomo entre otros (para referencias en detalle se recomienda a lector los perfiles toxicológicos realizados por el ATSDR). Como respuestas hematológicas se incluyen medidas de hematocrito, concentración de hemoglobina, conteos diferenciales de células (eritrocitos, leucocitos, trombocitos, etc). Los procedimientos para la cuantificación de estos parámetros están bien estandarizados, son fáciles para aplicar en campo y requieren de poca cantidad de muestra biológica. Las respuestas hematológicas tienen poca influencia al estrés del manejo y diversos estudios han demostrado que existen ciertos contaminantes causan anemia o supresión del sistema inmune en los organismos (ej. Cadmio, plomo, plomo, cobre, aldrin, clordano, etc.) y, también han sido útiles en discriminar entre sitios de referencia y sitios contaminados (Heath,1995). En biota también es común el uso de índices somáticos y de condición, que podrían reflejar alteraciones sobre el crecimiento y desarrollo de los organismos. Los mas comúnmente usados son el índice gonadosomático, el hepatosomatico y el de condición (generalmente es una relación talla-peso), sin embargo cualquier órgano podría ser susceptible de evaluación (Heath, 1995). 2.11 Referencias de la guía de monitoreo y biomonitoreo, y del programa de monitoreo ATSDR. 2000. Profile for Tolueno. Agency for toxic Substances and Disease Registry. Toxicological Atlanta GA. Us Deparment of Health and Human Service. Public Health Service. 207-228 pp. ATSDR. 2005a. Profile for Benceno. Agency for toxic Substances and Disease Registry. Toxicological. Atlanta Ga. Us Deparment of Health and Human Service. Public Health Service. 289-309 pp. ATSDR. 2005b. Profile for Xileno. Agency for toxic Substances and Disease Registry. Toxicological Atlanta GA. Us Deparment of Health and Human Service. Public Health Service. 257- 273 pp. Adams M.; J. Giesy; L. Tremblay and C. Eason. 2001. The use of biomarkers in ecological risk assessment: recommendations from the Christchurch conference on Biomarkers in Ecotoxicology. Biomarkers. 6:1-6 Albert, L. 2004. Toxicologia ambiental. Universidad Autónoma de Juárez. Ciudad Juárez, Chih. 453 pp. Beringola, L.1996. Genotóxicidad de las aguas del rió Tajo. Tesis de Doctorado. Universidad complutense de Madrid. 222 pag. Calderón J, Navarro ME, Jiménez-Capdeville ME, Santos-Díaz MA, Golden A, Rodríguez-Leyva I, Borja-Aburto VH, Díaz-Barriga F. 2001. Exposure to arsenic and lead and neuropsychological development in Mexican children. Environmental Research, 85:69–76. Canfield, R.L.; C.R. Henderson; D.A. Cory-Slechta; C. Cox; T.A. Jusko; B.P. Lanphear. 2003. Blood Intellectual Impairment in Children with Blood Lead Concentrations below 10 ug per Deciliter. N. Engl. J. Med. 348:1517-1526 Chambers, J.E., J. S. Boone, R.L Carr., H.W. Chambers and D.L. Straus. 2002. Biomarkers as Predictors in Health and Ecological Risk Assessment. Human and Ecological Risk Assessment, 8:165-176 Counter SA, Vahter M, Laurell G, Buchanan LH, Ortega F, Skerfving S. 1997. High lead exposure and auditory sensory-neural function in Andean children. Environ Health Perspect, 105:522–526. Cox DH. 1980. Arsine evolution-electrothermal atomic absorption method for the determination of nanogram levels of total arsenic in urine and water. J Anal Toxicol, 4:207–211. Decordier I. y M. Kirsch-Volders. 2006. The in vitro micronucleus test: From past to future. Mutation Research, 607: 2–4. Deplegde, M., Weeks, J & P. Bjerregaard. Heavy metals. P 79-105. Calow, P (Ed). Handbook of ecotoxicology. Vol.2. Blackweell Scientific Publications. 416 p. Díaz-Barriga F, Batres L, Calderón J, Lugo A, Galvao L, Lara I, Rizo P, Arroyave ME, McConnell R. 1997. The El Paso smelter twenty years later: Residual impact on Mexican children. Environmental Research, 74:11–16. Díaz-Barriga F, Santos MA, Mejía JJ, Batres L, Yáñez L, Carrizales L, Vera E, Del Razo LM, Cebrian ME. 1993. Arsenic and cadmium absorption in children living near a smelter complex in San Luis Potosí, Mexico. Environmental Research, 62:242– 250. Fairbairn, D.W., P.L. Olive & K.L. O’ Neill. 1995. The comet assay: a comprehensive review. Mut. Res. 339: 37-59. Fisher BE. 1998. Between a rock and a healthy place. Environ Health Perspect 106:A544–A546. Flores, J. 2004. Efectos globales de la contaminación. 191-213 pp. En: Albert, L. Toxicología Ambiental. Universidad Autónoma de Ciudad Juárez. Ciudad Juárez, Chihuahua, México. 453 p. Heath, A. G. 1995. Water pollution and fish physiology. 2ª Edition. Lewis Publishers. E.U. 359 p. Hwang YH, Bornschein RL, Grote J, Menrath W, Roda S. 1997. Environmental arsenic exposure of children around a former copper smelter site. Environmental Research, 72:72–81. INE. 2004. Identificación de las capacidades y necesidades de investigación en México en materia de Contaminantes Orgánicos Persistentes. Informe preparado por: Convención de Basilea para el Control Transfronterizo de Residuos Peligrosos y su Disposición, la Convención de Rótterdam, La Convención de Estocolmo. Instituto Nacional de Ecología. México, D.F. 38 p. Interim Secretariat of the Basel Convention; Interim Secretariat of Rotterdam Convention; Interim Secretariat of the Stockholm Convention 2002. The Hazardous chemicals and wastes Conventions. United Nations Environmental Programme. Geneva, Switzerland. IPCS. 2002. Global Assessment of the State of the Science of Endocrine Disruptors. International. Program on Chemical Safety. 180 p. Jensen, S., Hägggerg, L., Jörundsdóttir, H., Odham, G. 2003. A quantitative lipid extraction method for residue analysis of fish involving nonhalogenated solvents. J. Agricultural and food chemistry. 51(19): 5607-5611. Joyce S. 1998. Major issues in miner health. Environ. Health Perspect, 106:A538-A543. Kirsch-Volders, M. y M. Fenech. 2001. Inclusion of micronuclei in non-divided mononuclear lymphocytes and necrosis/apoptosis may provide a more comprehensive cytokinesis block micronucleus assay for biomonitoring purposes. Mutagenesis, 16: 51-58. Lebailly, P., C. Vigreux, T. Godard, F. Sichel, E. Bar, J.Y. Letalaër, M. Henry & P. Gauduchon. 1997. Assesment of DNA damage induced in vitro by etoposide and two fungicides (carbendazim and chlorothalonil) in human lymphocytes with the comet assay. Mut. Res. 375: 205-217. Mckelvey-Martin, V.J., M.H.L. Green, P. Schmezer, B.L. Pool-Zobel, M.P. De Méo & A. Collins. 1993. The single cell gel electrophoresis assay (comet assay): A European review. Mut. Res. 288: 47-63. Muller, U.V. y C. Streffer. 1994. Chronic infections and inflamatory processes as cancer risk factors: posible role of nitric oxide in carceninogenesis. Mutation Research, 305:253-264. Murgueytio AM, Evans RG, Sterling DA, Clardy SA, Shadel BN, Clements BW. 1998. Relationship between lead mining and blood lead levels in children. Arch Environ Health, 53:414–423. PNUMA. 2005. Conferencia de las Partes en el Convenio de Estocolmo sobre contaminantes orgánicos persistentes. Primera reunión. Anexo 3. Medidas para reducir o eliminar las liberaciones derivadas de la producción no intencional: directrices técnicas para la gestión ambientalmente racional de los contaminantes orgánicos persistentes. Programa de las Naciones Unidas y Protección al Medio Ambiente. Rendón-Von Osten. 2005. Uso de biomarcadores en ecosistemas acuáticos. p 121140. En: A.V. Botello, J. Rendón-Von Osten, G. Gold-Bouchot y C. AgrazHernández (Eds). Golfo de México Contaminación e Impacto ambiental: Diagnostico y Tendencias. Universidad Autónoma de Campeche, Universidad Autónoma de México, Instituto de Ecología. 696 p. Rojas, E., M.C. López & M. Valverde. 1999. Single cell gel electrophoresis assay: methodology and applications. J. Chromatogr B., 722: 225-254. Selevan, S.G.; D.C. Rice; K.A. Hogan; S.Y. Euling; A. Pfahles-Hutchens and J. Bethel. 2003. Blood Lead Concentration and Delayed Puberty in Girls. N. Engl. J. Med., 348:1527-1536 Shugart, L.R. 1992. DNA damage as a biomarker of exposure. Ecotoxicology, 9:329340. Singh, N.P.; M.T. McCoy; R.R Tice; E.L. Schneider. 1988. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp. Cell Res., 175:184-191. Speit, G. & A. Hartmann. 1999. The comet assay (Single-cell gel test): a sensitive genotoxicity test for detection of DNA damage and repair. Method. Mol. Biol. 113: 203-212. Subramanian KS. 1987. Determination of lead in blood: Comparison of two GFAAS methods. At. Spectrosc, 8:7–14. UNEP. 2000. United Nations Environment Program, editor. Mining and sustainable development II: Mining—Facts, figures, and environment. Industry and Environ 23:4–8. Yáñez L, García-Nieto E, Rojas E, Carrizales L, Mejía J, Calderón J, Razo I, DíazBarriga F. 2003. DNA damage in blood cells from children exposed to arsenic and lead in a mining area. Environmental Research, 93:231–240. Yarto, M.A.; A. Gavilán; J. Barrera. 2003. EL Convenio de Estocolmo sobre contaminantes orgánicos persistentes y sus implicaciones para México. Gaceta Ecológica del Instituto Nacional de Ecología, 69:7-28 Zúñiga, G.M. y B.C. Gómez. 2006. La prueba de micronúcleos. La Ciencia y el Hombre, XIX (1) Páginas de Internet consultadas: http://www.alcion.es/DOWNLOAD/ArticulosPDF/iq/gratis/11articulos.pdf Petroquímica (Consultada 08/10/07) http://www.temoq1unal.tripod.com/Introducción.pdf Procesos de separación (Consultada 08/10/07) http://www.epa.gov/epaoswer/hazwaste/test/9_series.htm EPA Métodos de Prueba (Consultada 13/10/07) http://www.estrucplan.com.ar/Producciones/imprimir.asp?IdEntrega=301 Toxicología de substancias Benceno 2ª Parte. (Consultada 9/10/07) http://www.cdc.gov/niosh/nmam/ NIOSH. Manual de métodos (Consultada 13/10/07) www.salud.gob.mx/unidades/cdi/nom/047ssa13.html. NOM-138-SEMARNAT/SS-2003. Límites máximos permisibles de hidrocarburos en suelo y las especificaciones para su caracterización y remediación. Diario oficial de la federación 29 de marzo de 2005. //www.ordenjuridico.gob.mx/Federal/PE/APF/APC/SEMARNAT/Normas/Oficiales /29032005(1).pdf NOM-047-SSA1-1993. Establece Los Límites Biológicos Máximos Permisibles De Disolventes Orgánicos En El Personal Ocupacionalmente Expuesto. 3 RESULTADOS DEL ESTUDIO El método de cuantificación de COP que se aplicó en el presente estudio, permite la detección los siguientes compuestos (para una descripción completa de los métodos analíticos ver INE, 2006): Hexaclorobenceno (HCB) Hexaclorocicohexanos (HCH) como alfa-HCH, beta-HCH y lindano (isómero gama) aldrín, mirex heptaclorohepóxido oxiclordano, gamaclordano, alfaclordano, trans-nonaclor, cisnonaclor DDT, DDE Bifenilos Policlorados congéneres: PCB 52, PCB 49, PCB 44, PCB 74, PCB 70, PCB 95, PCB 101, PCB 99, PCB 87, PCB 110, PCB 151, PCB 82, PCB 149, PCB 118, PCB 153, PCB 132, PCB 105, PCB 138, PCB 158, PCB 187, PCB 183, PCB 128, PCB 177, PCB 171, PCB 156, PCB 180, PCB 191, PCB 169, PCB 170, PCB 201, PCB 208, PCB 195, PCB 194, PCB 205, PCB 206, PCB 209, PCB 18, PCB 17, PCB 31, PCB 28, PCB 33. 3.1 Sedimento y suelo En los Cuadros 1 y 2 se presentan los resultados de COP en sedimento y suelo respectivamente, obtenidas en los muestreos en época de lluvias y en época de estiaje. En los Cuadros 3 y 4 se presentan los resultados de metales en suelo y sedimento respectivamente, obtenidas en el primer muestreo (época de estiaje). En el muestreo realizado en época de lluvias no se recolectaron muestras de suelo y sedimento para analizar metales debido a que los resultados obtenidos del primer muestreo no revelaron concentraciones importantes de metales (ej. en suelo ningún metal rebasó la NOM-147-SEMARNAT/SSA-2004 (ver INE, 2006). Para el caso de las concentraciones de COP en suelo únicamente lindano y HCB rebasaron los límites establecidos por la guía canadiense de calidad ambiental (Canadian Environmental Quality Guidelines [CEQG]). En sedimento, un mayor número de compuestos: HCB, lindano, DDT, DDE, mirex y PCB totales rebasaron los niveles de protección al ambiente establecidos por estas mismas Guías (ver figuras 1 a 6). Cuadro 1. Concentraciones de COP en sedimento para los dos muestreos realizados en Coatzacoalcos, Veracruz. Sitio Pajaritos Isla Copalapa Intersección Punta Brava Terranova Ixhuatlán Puente II E. del Pantano L. del Ostión 1 L. del Ostión 2 B. Huatzutlán L. del Tepache 1 L. del Tepache 2 L. del Tepache 3 HCB 1er 2do 38.9 179.0 34.4 163.2 153.3 447.5 111.8 33.4 345.2 756.6 239.5 --260.2 48.6 1299.2 --125.3 --77.0 --134.4 ----44.4 --119.9 --252.1 α-HCH 1er 2do 161.6 297.5 112.8 643.8 558.3 252.1 467.2 272.2 780.5 281.8 761.3 --226.0 305.7 541.9 --309.9 --184.4 --107.5 ----367.7 --445.3 --379.4 β-HCH 1er 2do N.D. 27.5 25.4 62.5 N.D. 29.2 80.0 86.4 N.D. 31.8 63.2 --33.1 37.7 N.D. --57.8 --N.D. --N.D. ----71.1 --55.0 --30.5 Lindano 1er 2do 124.4 65.0 3.5 N.D. 122.5 33.6 91.6 N.D. 77.5 41.6 75.9 --2.3 N.D. 96.1 --42.9 --76.9 --78.1 ----46.2 --90.0 --37.8 DDT 1er 2do N.D. N.D. 7.1 N.D. N.D. 85.6 N.D. N.D. N.D. N.D. N.D. --N.D. N.D. 82.7 --N.D. --N.D. --50.7 ----N.D. --N.D. --N.D. DDE 1er 2do 4.2 3.9 6.2 N.D. 6.4 18.7 4.2 N.D. N.D. N.D. N.D. --5.8 N.D. 19.1 --3.7 --N.D. --8.5 ----4.0 --3.2 --2.8 Mirex PCB´s totales 1er 2do 1er 2do N.D. N.D. 2129.0 103.4 3.1 N.D. 85.6 N.D. N.D. 2.9 8337.2 636.1 N.D. N.D. 995.0 495.0 N.D. N.D. 121.6 1787.1 N.D. --76.7 --N.D. N.D. N.D. 90.3 N.D. --532.4 --N.D. --N.D. --N.D. --N.D. --N.D. --N.D. ----N.D. --268.3 --N.D. --218.4 --N.D. --79.2 Cuadro 2. Concentraciones de COP en suelo para los dos muestreos realizados en Coatzacoalcos, Veracruz. Localidad Isla Copalapa Intersección Punta Brava Terranova Puente II E. del Pantano L. del Ostión 1 HCB α-HCH 1er 2do 1er 2do 335.7 --98.9 ----225.9 --255.4 830.9 --464.4 --56.8 --508.3 --16.0 --110.3 --- β-HCH 1er 2do N.D ----- 24.4 64.1 --57.2 --25.2 --- Lindano DDT 1er 2do 1er 2do 88.2 --N.D ----73.1 --N.D 84.2 --N.D --2.8 --- 10.3 --4.1 --8.0 --- DDE Mirex 1er 2do 1er 2do 6.7 --- N.D ----3.1 --- N.D 4.5 --3.4 --3.4 --3.8 --5.0 --3.4 --- PCB´s totales 1er 2do 389.5 ----78.6 1261.4 --162.7 --383.8 --- --- 240.6 --- 237.9 --- 27.8 --- 33.1 --- 43.2 --- 4.2 --- N.D --- 12702.6 28.8 --- 209.6 --- N.D --- N.D --- N.D --- N.D --- N.D --- 12.7 --- B. Huatzutlán 208.3 --Mundo Nuevo --373.9 94.3 --- --N.D --- 120.6 --238.2 --- 28.7 --55.7 N.D --- --- N.D --- N.D --N.D. --- N.D. --- N.D. 140.7 --- --137.6 Cuadro 3.- Niveles de metales (mg/kg) de muestras de suelo obtenidas del primer muestreo en Coatzacoalcos, Veracruz. 2 4 6 7 9 11 Sitio Terranova Punta Brava Isla Copalapa Puente II Laguna del Ostión 1 Brazo Huatzutlán NOM-Uso agrícola/residencial* NOM-Uso industrial* Al% 1.26 0.47 1.63 2 0.91 3.4 NR NR As 5 <2 6 4 7 4 22 260 Be 0.5 <0.5 0.6 0.7 <0.5 <0.5 150 1900 Cd <0.5 <0.5 <0.5 <0.5 <0.5 <0.5 37 450 Cr VI 22 10 29 33 13 100 280 510 Cu 26 6 26 29 4 74 NR NR Hg 0.18 0.05 0.12 0.08 <0.01 0.24 23 310 Mn 78 45 230 491 162 115 Ni 10 4 16 25 11 35 1600 20000 Pb 13 6 11 19 2 6 400 750 Se NA NA NA NA NA NA 390 5100 Tl V 10 44 <10 15 <10 43 <10 52 <10 19 10 186 5.2 550 67 7200 Cuadro 4.- Niveles de metales (mg/kg) de muestras de sedimento obtenidas del primer muestreo en Coatzacoalcos, Veracruz. Sitio Al% As Be Cd Cr VI Cu Hg Mn Ni Pb V Estero del pantano 0.31 <2 <0.5 <0.5 9 10 0.05 86 7 10 15 Terranova 0.43 <2 <0.5 <0.5 11 7 0.03 205 5 5 17 Intersección 0.39 <2 <0.5 <0.5 11 3 0.01 154 5 3 19 Punta Brava 0.4 <2 <0.5 <0.5 9 5 0.04 116 5 4 14 Ixhuatlán 1.21 <2 0.5 <0.5 23 19 0.05 283 15 9 36 Isla Copalapa 1 <2 <0.5 <0.5 22 14 0.09 272 12 10 34 Puente II 1.2 3 <0.5 <0.5 37 19 0.03 455 138 22 45 Pajaritos 0.32 10 <0.5 <0.5 9 7 0.04 146 5 16 14 Laguna del ostión 1 1.01 5 <0.5 <0.5 24 12 0.03 362 16 5 35 Laguna del ostión 2 2.93 7 0.6 <0.5 73 43 0.09 1625 37 7 122 Brazo Huatzutlán 3.09 7 0.6 <0.5 93 52 0.06 1180 42 4 169 Guía Canadiense NR 5.9 NR 0.6 37.7 NR 0.17 NR 35 NR PEL** NR 17.9 NR 3.5 197 NR 0.486 NR 91.3 NR NOM-Uso agrícola/residencial* NR 22 150 37 280 NR 23 1600 400 550 NOM-Uso industrial* NR 260 1900 450 510 NR 310 20000 750 7200 ISQG** NR 5.9 NR 0.6 37.7 NR 0.17 NR 35 NR PEL** NR 17.9 NR 3.5 197 NR 0.486 NR 91.3 NR * Norma Oficial Mexicana NOM-147-SEMARNAT/SSA1-2004, que establece criterios para determinar las concentraciones de remediación de suelos contaminados por As, Be, Cd, Cr VI, Hg, Ni, Pb, Se, Tl, V. ** Guías ambientales de Canadian Sediment Quality Guidelines for the protection of Aquatic Life. 1 2 3 4 5 6 7 8 9 10 11 ***NOAAs National Ocean Service Office Of Response and Restauration Screening Quick Reference Tables of Inorganic in Solids NR: No referencias NA: No analizado para ese metal. En las Figuras 1 y 2 se presentan las concentraciones de metales en suelo y sedimento en cada uno de los sitios de muestreo. En las Figuras 3 - 6 se muestran las concentraciones de COP en suelo y sedimento en cada uno de los sitios de muestreo, del primer y segundo monitoreo. Metales en suelo 1er muestreo Valores se presentan en mg/kg As 22 mg/kg * Cr 280 mg/kg * Cu 63 mg/kg ** Hg 23 mg/kg* Ni 1600 mg/kg * Pb 400 mg/kg* V 78 mg/kg* Zn 200 mg/kg** * NOM-147-SEMARNAT/SSA-2004. ** CEQG: Canadian Sediment Quality Guidelines for the Protection of Aquatic Life Figura 1.- Concentraciones de metales en suelo para cada uno de los puntos de muestreo. 1er muestreo Metales en sedimento Valores se presentan en mg/kg As 5.9 mg/kg * Cr 37.3 mg/kg * Cu 35.7 mg/kg * Hg 0.17 mg/kg* Ni NR Pb 35.0 mg/kg* V NR Zn 123.0 mg/kg* * CEQG: Canadian Sediment Quality Guidelines for the Protection of Aquatic Life Figura 2- Concentraciones de metales en sedimento para cada uno de los puntos de muestreo 1er. Muestreo COP´s en suelo Valores se presentan en ng/g HCB 50 ng/g * α-HCH β-HCH Lindano 10 ng/g * DDT 700 ng/g * DDE Mirex PCBs tot 500.ng/g * * CEQG: Canadian Sediment Quality Guidelines for the Protection of Aquatic Life Figura 3.- Concentraciones de COP en suelo para cada uno de los puntos del primer muestreo realizado en Coatzacoalcos, Ver. 2do. Muestreo COP´s en suelo Valores se presentan en ng/g HCB 50 ng/g * α-HCH β-HCH Lindano 10 ng/g * DDT 700 ng/g * * CEQG: Canadian Sediment Quality Guidelines for the Protection of Aquatic Life DDE PCBs tot 500.ng/g * Figura 4.- Concentraciones de COP en suelo para cada uno de los puntos del segundo muestreo realizado en Coatzacoalcos, Ver. 1er. Muestreo COP´s en sedimento Valores se presentan en ng/g HCB 100 ng/g ** α-HCH β-HCH Lindano 0.94 ng/g * * CEQG: Canadian Sediment Quality Guidelines for the Protection of Aquatic Life DDT 1.19 ng/g * DDE 1.42 ng/g * Mirex 1.19 ng/g ** PCBs tot 34.1ng/g * ** NOAA: National Oceanic and Atmospheric Administration Screening Quick Reference Figura 5.- Concentraciones de COP en sedimento para cada uno de los puntos del primer muestreo realizado en Coatzacoalcos, Ver. 2do. Muestreo COP´s en sedimento Valores se presentan en ng/g HCB 100 ng/g ** α-HCH β-HCH Lindano 0.94 ng/g * * CEQG: Canadian Sediment Quality Guidelines for the Protection of Aquatic Life DDT 1.19 ng/g * DDE 1.42 ng/g * Mirex 1.19 ng/g ** PCBs tot 34.1ng/g * ** NOAA: National Oceanic and Atmospheric Administration Screening Quick Reference Figura 6.- Concentraciones de COP en sedimento para cada uno de los puntos del segundo muestreo realizado en Coatzacoalcos, Ver En los cuadros 5 y 6 se presenta un análisis estadístico comparativo entre los niveles de COP cuantificados en las muestras de suelo y sedimento obtenidas en el primer (estiaje) y segundo muestreo (lluvias). Los resultados obtenidos de este análisis sugieren que no hay una variación en las concentraciones ambientales asociadas a la época del año. Cuadro 5.- Comparación de muestras de sedimento entre el primer y segundo muestreo COP HCB a-HCH ß-HCH Lindano DDT DDE PCB totales Suma de rangos Sitio 1 115 113 40 115 Suma de rangos Sitio 2 95 97 65 56 67 61 38 59 Mann-Whitney U test 49 47 20 28 0 17 23 n 1er muestreo 11 11 5 11 3 8 7 n 2o muestreo 9 9 9 7 1 6 8 p 0.97 0.85 0.74 0.34 1.00 0.37 0.56 Cuadro 6.- Comparación de muestras de suelo entre el primer y segundo muestreo COP HCB a-HCH ß-HCH Lindano DDT DDE Mirex PCB totales Suma de rangos Sitio 1 26 27 13 24 Suma de rangos Sitio 2 19 18 8 12 17 4 31 14 Mann-Whitney U test 5 6 2 6 0 1 0 8 n 1er muestreo 6 6 3 5 2 4 3 6 n 2o muestreo p 3 3 3 3 1 2 0 3 0.30 0.44 0.28 0.65 1.00 0.16 1.00 0.80 3.2 Resultados en especies silvestres 3.2.1 Iguanas En la Figura 7 se muestran los valores de COP en ng/ml encontradas en el plasma de iguanas verde y negra (Iguana iguana y Ctenosaura pectinata). Se encontraron cuatro congéneres de PCB 52, 153, 180 y 170. No se han encontrado valores de referencia ni trabajos relacionados con estos contaminantes en estas especies para comparación en la literatura científica. Figura 7.- Valores de COP (ng/ml) en plasma registrados en iguanas capturadas en Coatzacoalcos Veracruz. En la Figura 8 se muestran las concentraciones de diferentes COP ajustados por gramo de lípido en tejido muscular, hepático y adiposo de iguanas. En la mayoría de los casos se observa mayor concentración de COP en el tejido muscular con respecto a los tejidos hepático y adiposo. Se compararon las concentraciones de los diferentes tejidos para determinar si existe diferencia estadísticamente significativa. La comparación se hizo con la prueba de Kruskall-Wallis (ANOVA no paramétrica). Los resultados se muestran en la Figura 9, se registraron diferencias estadísticamente significativas entre el tejido muscular y el tejido adiposo para los siguientes compuestos: alfa-HCH, lindano, DDE y mirex. Figura 8.- Concentración de COP (ng/g lip) en diversos tejidos de iguana. a b 600 1 06 00 0 * 500 80 500 60 400 b-HCH (ng/g lip) a-HCH (ng/g lip) a-HCH (ng/g lip) 400 300 40 300 20 200 200 0 * 100 0 M ú s c u lo H e p á tic o M Mú sú cs uc l uo l o Kruskall-Wallis p<0.05 * H eH pe áp t ái ct oi c o 4 6. 50 0 4 .0 40 500 * 500 3 .5 35 * 3 .0 400 DDE (ng/g lip) a-HCH (ng/g lip) 3 04 0 0 25 300 20 1 52 0 0 2 .5 2 3. 00 0 1 .5 200 1 .0 * 10 0 .5 100 100 5 0 A dA i dp iop so os o T eT j ei dj i od o d 4 56 0 0 Lindano (ng/g lip) a-HCH (ng/g lip) M ean ±SE ± 1 .9 6 * S E -4 0 0 A d ip o s o T e jid o c 100 -2 0 M ean ±SE ± 1 .9 6 * S E M ean ±SE ± 1 .9 6 * S E 0 M ú Ms cú us lco u l o H e Hp eá pt i ác ot i c o T e Tj i ed joi d o A dAi pd oi ps oo s o M ean ±SE ± 1 .9 6 *S E 0 .0 -0 .5 0 Kruskall-Wallis p<0.05 Figura 9.- Comparación de COP en diversos tejidos de iguana. * Diferencia estadísticamente significativa M Mú sú cs uc luo l o H He pe áp tái ct ioc o T eT jei dj i od o A dA i dp iop so os o Kruskall-Wallis p<0.05 e f 1 46 00 0 * 2 26 0 0 20 120 500 1 85 0 0 16 400 80 Suma PCB (ng/g lip) a-HCH (ng/g lip) Mirex (ng/g lip) a-HCH (ng/g lip) 100 63 00 0 40 200 * 14 400 12 10 300 8 6 4 20 200 2 * 100 0 01 0 0 M ean ±SE ± 1 .9 6 * S E -2 0 0 M Mú sú cs uc l uo l o H eH pe áp t ái ct oi c o T eT j ei dj iod o M ean ±SE ± 1 .9 6 * S E -2 -4 0 A dA i dp iop so os o Kruskall-Wallis p<0.01 Figura 9 (continuación).- Comparación de COP en diversos tejidos de iguana. * Diferencia estadísticamente significativa M ú Ms cú us lco u l o H e Hp eá pt i ác ot i c o T e Tj i ed joi d o A dAi pd oi ps oo s o 3.2.2 Cangrejos En el Cuadro 7 se muestran las concentraciones de COP ajustadas por gramo de lípido de cangrejos. En la Figura 10 se presenta el promedio de diferentes COP ajustadas por gramo de lípido en muestras compuestas de cangrejos (Uca rapax). Cuadro 7.- Concentraciones de COP (ng/g lip) en muestras compuestas de cangrejos (Uca rapax). Cangrejos Pool 1 Pool 2 a-HCH 23.88 38.68 b-HCH 103.21 ND Lindano 11.31 5.72 DDE 6.98 4.73 DDT 3.49 2.61 Mirex 100.28 92.79 PCB 170 ND 11.19 Figura 10.- Promedio de COP (ng/g lip) en “muestras compuestas” de cangrejos (Uca rapax). 3.2.3 Peces Se realizó el análisis de 38 muestras de tejido de peces y jaibas (Cuadro 8). Los resultados obtenidos se muestran en la Figura 11. Estos resultados no muestran un patrón general en las especies por lo que se realizó una clasificación de las especies de acuerdo a su hábito alimenticio. De esta manera se tiene al chucumite como carnívoro, la lisa y el bagre como detritívoros, la tilapia y la mojarra como omnívoros y la jaiba como omnívorodetritívoro (Figura 12). De acuerdo con esto se encontró una tendencia en las concentraciones de COP que señala que las especies carnívoras son las que cuentan con menores concentraciones y las detritívoras son las que presentan mayores concentraciones. Esto indica una posible asociación entre la exposición y los hábitos alimenticios de las especies. Cuadro 8. Número de muestras recolectadas para cada especie del sistema acuático. Grupo Especie Chucumite Tilapia Lisa Bagre Mojarra Peces Crustáceo s 30 Jaiba No. Muestras 9 6 7 3 7 6 muestras compuestas 350 a b 300 250 20 a-HCH ng/g lípido HCB ng/g lípido 200 150 100 10 50 Mean ±SE ±1.96*SE 0 Chucumite Tilapia Lisa Bag re Mojarra Jaiba 0 -50 Mean ±SE ±1.96*SE Chucumite Tilapia Lisa Bag re Mojarra Jaiba 100 d c 600 80 60 Lindano ng/g lípido b-HCH (ng/g lípido) 400 40 200 20 0 Mean ±SE ±1.96*SE 0 Chucumite Tilapia Lisa Bag re Mojarra Mean ±SE ±1.96*SE -20 Jaiba Chucumite Tilapia Lisa Bag re Mojarra Jaiba Figura 11.- Concentraciones de COP en tejido muscular de las especies capturadas en el sistema acuático. a) HCB, b) α-HCH, c) β-HCH. 50 e 20 f 45 40 35 30 DDE ng/g lípido DDT ng/g lípido 15 10 25 20 15 10 5 Mean ±SE ±1.96*SE 5 Mean ±SE ±1.96*SE Chucumite Tilapia Lisa Bagre Mojarra 0 Chucumite Jaiba 180 Tilapia Lisa Bagre Mojarra Jaiba 120 g 160 h 100 140 80 100 Suma PCB ng/g lípido Mirex ng/g lípido 120 80 60 40 60 20 40 0 20 0 Mean ±SE ±1.96*SE Chucumite Tilapia Lisa Bagre Mojarra Jaiba -20 Mean ±SE ±1.96*SE Chucumite Tilapia Lisa Bag re Mojarra Jaiba Figura 11(continuación).- Concentraciones de COP en tejido muscular de las especies capturadas en el sistema acuático. e) DDT, f) DDE, g) Mirex y h) PCB totales. b a 40 12 DDE ng/g lípido DDT ng/g lípido 30 8 20 10 4 M ean ±SE ± 1 .9 6 * S E M ean ±SE ± 1 .9 6 * S E D e tr itív o r o 240 D e t r it í v o r o C a r n ív o r o O m n ív o ra O m n ív o ra C a rn ív o ro In v . D e tr-O m n In v . D e tr- O m n d c PCB´s totales ng/g lípido α-HCH ng/g lípido 40 160 80 20 M ean ±S E ± 1 .9 6 * S E 0 D e t r it í v o r o C a rn ív o ro O m n ív o ra M ean ±SE ± 1 .9 6 * S E 0 In v . D e tr-O m n D e tritív o ro O m n ív o ra C a rn ív o ro In v . D e tr-O m n Figura 12.- Concentraciones de COP en tejido muscular de las especies del sistema acuático tomando en cuenta su hábito alimenticio. a) DDT, b) DDE, c) α-HCH, d) PCB's totales. 3.2.4 Anfibios Para el caso de anfibios se seleccionaron 17 individuos para la toma de muestras de sangre y 12 individuos (seis por sitio de muestreo) para la toma de muestras de tejidos, de los cuales se obtuvo: músculo (12 muestras); hígado (seis muestras compuestas, cada muestra proviene de dos organismos); tejido graso (seis muestras compuestas cada muestra proviene de dos individuos). Los valores de COP en plasma de anfibios se muestran en la Figura 13. 12 8 a 10 7 b 6 8 DDE (ng/ml) Lindano (ng/ml) 5 6 4 4 3 2 2 1 0 0 -2 -1 EP MN EP SITIO 7 6 8 c 7 5 d 6 PCB tot (ng/ml) 4 DDT (ng/ml) MN SITIO 3 2 5 4 3 1 2 0 Mean ±SE ±1.96*SE -1 EP MN SITIO 1 EP MN SITIO e Figura 13.- Valores de COP (ng/ml) en plasma registrados en sapos capturados en Coatzacoalcos Veracruz. Subfiguras: a) Lindano, b) DDE, c) DDT, d) PCB’s totales y; e) Clorados totales. EP= Estero del Pantano (Baja exposición, n= 8); MN= Mundo Nuevo (Alta exposición, n= 9). Los valores de COP en tejido muscular de anfibios se muestran en la Figura 14. 90 40 a 80 b 35 30 70 β-HCH (ng/g lip) α-HCH (ng/g lip) 25 60 50 40 20 15 10 30 5 20 0 10 -5 EP MUS MN MUS EP MUS Sitio 70 240 c 60 d 220 200 50 180 160 DDE (ng/g lip) 40 Lindano (ng/g lip) MN MUS Sitio 30 20 140 120 100 80 10 60 40 0 20 -10 0 -20 -20 EP MUS MN MUS EP MUS Sitio 12 MN MUS Sitio 42 e 40 10 f 38 36 34 Mirex (ng/g lip) DDT (ng/g lip) 8 6 4 32 30 28 26 24 2 22 20 0 18 -2 16 EP MUS MN MUS Sitio EP MUS MN MUS Sitio Figura 14.- Valores de COP (ng/g de lípido) en tejido muscular registrados en sapos capturados en Coatzacoalcos Veracruz. Subfiguras: a) α HCH, b) β HCH, c) Lindano, d) DDE, e) DDT, f) Mirex, EP= Estero del Pantano (Baja exposición, n= 6); MN= Mundo Nuevo (Alta exposición, n= 6). 7 10 h 5 6 PCB´s tot (ng/g lip) 8 4 3 2 4 2 0 1 -2 EP MUS MN MUS EP MUS Sitio MN MUS Sitio 340 320 300 i 280 260 Clorados tot (ng/g lip) HCB (ng/g lip) g 6 240 220 200 180 160 140 120 100 80 60 EP MUS MN MUS Sitio Figura 14. (Continuación)- Valores de COP (ng/g de lípido) en tejido muscular registrados en sapos capturados en Coatzacoalcos Veracruz. Subfiguras: g) Hexaclorobenceno, h) PCB’s totales y; i) Clorados totales. EP= Estero del Pantano (Baja exposición, n= 6); MN= Mundo Nuevo (Alta exposición, n= 6). Los valores de COP en tejido hepático de anfibios se muestran en la Figura 15. 160 50 140 a b 40 120 30 β-HCH (ng/g lip) α-HCH (ng/g lip) 100 80 60 40 20 10 20 0 0 -10 -20 -40 -20 EP HEP MN HEP EP HEP Sitio MN HEP Sitio 16 1400 c 14 d 1200 1000 12 DDE (ng/g lip) Lindano (ng/g lip) 800 10 8 6 600 400 200 0 4 -200 2 -400 0 -600 EP HEP MN HEP EP HEP Sitio MN HEP Sitio 40 180 e f 160 30 140 120 Mirex (ng/g lip) DDT (ng/g lip) 20 10 0 100 80 60 40 -10 20 -20 0 EP HEP MN HEP Sitio EP HEP MN HEP Sitio Figura 15.- Valores de COP (ng/g de lípido) tejido hepático registrados en sapos capturados en Coatzacoalcos Veracruz. Subfiguras: a) α HCH, b) β HCH, c) Lindano, d) DDE, e) DDT, f) Mirex, EP= Estero del Pantano (Baja exposición, n= 3); MN= Mundo Nuevo (Alta exposición, n= 3). 12 100 g h 10 80 PCB´s tot (ng/g lip) 60 6 4 40 20 2 0 0 -20 -2 -40 EP HEP MN HEP EP HEP Sitio MN HEP Sitio 1800 i 1600 1400 1200 Clorados tot (ng/g lip) HCB (ng/g lip) 8 1000 800 600 400 200 0 -200 -400 -600 EP HEP MN HEP Sitio Figura 15 (continuación).- Valores de COP (ng/g de lípido) tejido hepático registrados en sapos capturados en Coatzacoalcos Veracruz. Subfiguras: g) Hexaclorobenceno, h) PCB’s totales y; i) Clorados totales. EP= Estero del Pantano (Baja exposición, n= 3); MN= Mundo Nuevo (Alta exposición, n= 3). Los valores de COP en tejido adiposo de anfibios se muestran en la Figura 16. 120 14 a b 100 12 10 β-HCH (ng/g lip) α-HCH (ng/g lip) 80 60 8 40 6 20 4 0 2 EP ADI MN ADI EP ADI Sitio 60 500 450 c 50 d 400 350 40 300 DDE (ng/g lip) Lindano (ng/g lip) MN ADI Sitio 30 20 250 200 150 10 100 50 0 0 -10 -50 EP ADI MN ADI EP ADI Sitio 70 16 e 60 f 14 50 12 40 10 Mirex (ng/g lip) DDT (ng/g lip) MN ADI Sitio 30 20 10 8 6 4 0 2 -10 0 EP ADI MN ADI Sitio EP ADI MN ADI Sitio Figura 16.- Valores de COP (ng/g de lípido) tejido adiposo registrados en sapos capturados en Coatzacoalcos Veracruz. Subfiguras: a) α HCH, b) β HCH, c) Lindano, d) DDE, e) DDT, f) Mirex, EP= Estero del Pantano (Baja exposición, n= 3); MN= Mundo Nuevo (Alta exposición, n= 3). 16 45 g 14 35 12 30 PCB´s tot (ng/g lip) 10 8 6 4 25 20 15 10 2 5 0 0 -2 -5 EP ADI MN ADI EP ADI Sitio MN ADI Sitio 700 i 600 500 Clorados tot (ng/g lip) HCB (ng/g lip) h 40 400 300 200 100 0 EP ADI MN ADI Sitio Figura 16 (continuación).- Valores de COP (ng/g de lípido) tejido adiposo registrados en sapos capturados en Coatzacoalcos Veracruz. Subfiguras: a g) Hexaclorobenceno, h) PCB’s totales y; i) Clorados totales. EP= Estero del Pantano (Baja exposición, n= 3); MN= Mundo Nuevo (Alta exposición, n= 3). Una primera integración en cuanto a exposición de los grupos de especies evaluados en cada uno de los ambientes (tomando en cuenta los resultados presentados tanto en el presente informe así como en el Informe (INE, 2006) permite una clasificación preliminar de acuerdo al nivel trófico al que pertenecen (ver Figura 17). Se pueden observar los niveles de COP en los herbívoros: iguanas; carnívoros: peces; omnívoros: sapos y peces; detritívoros: peces, jaibas y cangrejos. De acuerdo con esto, las especies herbívoras son las que presentan menores concentraciones y en las especies omnívoras se encontraron las mayores concentraciones. Esto refleja una posible asociación entre el nivel trófico y la exposición a estos compuestos. 600 500 COP´s (ng/g lip) 400 300 200 100 0 Herbívoros Detritívoros Carnívoros Omnívoros Mean ±SE ±1.96*SE Clasif icacion por Nivel Tróf ico Figura 17. Concentraciones de COP en tejido considerando el nivel trófico de las especies recolectadas en Coatzacoalcos, Ver. 3.2.5 Plomo en sangre de niños Se obtuvieron un total de 58 muestras de sangre de niños que habitaban en las localidades de Allende, Coatzacoalcos y Mundo Nuevo que fueron analizadas para Plomo (Pb). En la etapa anterior al presente estudio, uno de los resultados de mayor preocupación fueron los niveles de Pb encontrados en la sangre de los niños muestreados en la zona de Coatzacoalcos. En la Figura 18 se presentan estos resultados. Se puede observar que el 100% de los niños muestreados presentan valores de plomo en sangre superiores a 5 µg/dl, concentración a la cual son posibles efectos neurológicos adversos (ATSDRd, 2004). Además más del 50% de los valores registrados de Pb en sangre de niños son superiores al límite de intervención (10 µg/dl) recomendado por el “Center for Disease Control” (CDC) de Atlanta. No se observó diferencia estadísticamente significativa (p>0.05) entre las poblaciones de los tres diferentes sitios de los cuales provenían los niños muestreados (Figura 18). En Mundo Nuevo casi el 96% de los niveles de Pb en sangre están por encima del límite de intervención de la CDC (10 µg/dl). Estas concentraciones están, además por encima de la media encontrada (4.64 µg/ dl) en un estudio previo realizado por el Instituto Nacional de Ecología y la Universidad Autónoma de San Luis Potosí (INE, 2004). 14.5 14.0 13.5 Pb (microg/dl) 13.0 12.5 12.0 11.5 11.0 10.5 10.0 9.5 9.0 1 2 Localidad 3 Mean ±SE ±1.96*SE Figura 18. Medias geométricas de Pb en sangre de niños en las localidades muestreadas. 1) Allende (n=12) , 2) Coatzacoalcos (n=22), 3) Mundo Nuevo (n=24) Sin embargo, lo que se puede observar es una ligera tendencia en la distribución del Pb en sangre entre las tres localidades. La Figura 19 muestra que existe una tendencia a incrementar las concentraciones en sangre en las localidades en el sentido de la dirección de los vientos (Figura 19a). Por otra parte, la distribución de los PCB totales tiene un patrón inverso, es decir hay una tendencia a disminuir los niveles de PCB’s en plasma en las tres localidades en la dirección de los vientos (figura 19b). No obstante la confirmación de estas tendencias tendría que realizarse incrementando la población de niños muestreados en cada uno sitios. Figura 19. a) Concentraciones de PCB’s totales en plasma (μg/l) b) Concentraciones de Pb en sangre (μg/dl) en las tres localidades (1. Allende, Ver.; 2. Col. Adolfo López Mateos, Coatzacoalcos, Ver.; 3. Mundo Nuevo Ver.) Por lo anterior, es necesario incrementar la n. Se recomienda además evaluar la exposición de los biomarcadores empleados anteriormente, determinar la exposición a otros contaminantes tales como Hidrocarburos Aromáticos Policíclicos (HAP) y Benceno, Xileno, Tolueno (BETX). Además, es recomendable el aplicar encuestas dirigidas que permitan elucidar las posibles rutas de cada uno de los contaminantes en las tres localidades. 3.2.6 Metodologías de laboratorio Uno de los objetivos del trabajo de evaluación de la exposición en humanos es implementar metodologías adicionales para la determinación de metabolitos de Benceno, Xileno y Tolueno en el sitio de estudio. Se han establecido las condiciones para la determinación de metabolitos de Xileno (ácidos metil-hipúrico y 2-metil hipúrico) y Tolueno (ácido hipúrico) así como para la cuantificación de ácido trans-trans mucónico, como biomarcador de exposición a Benceno. Se presentan los resultados obtenidos en el Anexo. Con los resultados obtenidos hasta el momento para los biomarcadores de exposición en niños son posibles efectos tales como: afecciones al sistema hematológico, neurológico, inmunológico, endocrinológico y daño al ADN, (Schwart y Landrigan, 1990; Jacobson y Mc Lean, 2003; Winn, 2003; ATSDRa, 2004; ATSDRb, 2004; ATSDRc, 2004; ATSDRd, 2004; ATSDRe, 2004; ATSDRf, 2004; ATSDRg, 2004; ATSDRh, 2004; Avogbe et al., 2005; Gaskell et al., 2005; Perez-Maldonado, 2005). El Cuadro 9 presenta de manera resumida los efectos asociados a cada uno de los contaminantes previamente cuantificados y los que se postulan para evaluación. Cuadro 9. Efectos relacionados con compuestos presentes en la zona de estudio 4 CONCLUSIONES Y DISCUSIÓN Los resultados obtenidos hasta el momento demuestran que en la zona de estudio existe la presencia de compuestos orgánicos y metales en matrices ambientales como son suelo y sedimento. Sin embargo, lo más relevante es la presencia de esos mismos compuestos en los organismos seleccionados que habitan en la zona. Se detectaron niveles de estos contaminantes en plasma y tejidos de los diferentes organismos estudiados incluido el ser humano. Con respecto a los resultados en matrices ambientales, las concentraciones cuantificadas para la mayoría de los contaminantes como αHCH, β-HCH, Lindano, DDE y DDT no permiten establecer patrones claros de diferenciación entre los sitios de menor exposición y los de mayor exposición, por lo que el área de Coatzacoalcos puede ser considerada como una zona generalizada de exposición a estos contaminantes. Sin embargo, existe un patrón muy claro de diferenciación entre sitios para los niveles de Hexaclorobenceno (HCB) en suelo y sedimentos, ya que tienden a ser más altos en las zonas cercanas a los complejos industriales. Este patrón podría deberse principalmente a que este contaminante está fuertemente asociado a la actividad industrial (principalmente a la producción de cloro), lo que ya ha sido observado en otras partes del mundo donde existe actividad petroquímica (ATSDRc, 2004). Los niveles de COP encontrados en suelos y sedimentos para las dos temporadas de muestreo (estiaje y lluvias), no mostraron diferencias estadísticamente significativas lo que podría explicarse porque estas dos temporadas presentan características ambientales similares. Respecto a la población infantil se recomienda evaluar la exposición de los biomarcadores empleados anteriormente (ver INE,2006) y determinar la exposición a otros contaminantes tales como HAP y Benceno, Xileno, Tolueno (BETX). Además, es recomendable aplicar encuestas dirigidas que permitan elucidar las posibles rutas de cada uno de los contaminantes, incluyendo al plomo, en las tres localidades estudiadas. Los resultados registrados en el presente estudio muestran de manera clara la existencia de contaminación por COP, y de algunos metales como Pb. Además la evidencia muestra que estos contaminantes se encuentran biodisponibles ya que se detectaron en los organismos seleccionados. En algunas especies se registró daño al ADN (ver INE, 2006.) Los resultados mencionados y resumidos en el Cuadro 10 son evidencia clara del riesgo ambiental que se está presentando en la región de Coatzacoalcos, Veracruz, y que se evidencia implementando la evaluación integrada de los riesgos ambientales propuesta en la realización del presente estudio. Cuadro 10.- Matriz de medición EXPOSICIÓN Metales COP Suelo Sedimento √ √ √ √ HUMANOS Niños Cangrejos Iguanas Lombrices Sapos BIOTA Tortugas Cocodrilos Peces Jaibas √ √ √ √ AMBIENTE √ √ √ √ √ √ EFECTO Daño al ADN √ √ √ Cabe resaltar que las condiciones meteorológicas prevalecientes en la zona del golfo han retrasado algunas campañas de muestreo y su correspondiente trabajo de campo en la región. Se han tomado las medidas necesarias para reagendar dichos trabajos en espera de que las condiciones del sitio lo permitan y asegurar la confiabilidad de los resultados. 5 REFERENCIAS ATSDRa, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Benzene. ATSDRb, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for DDT,DDE. ATSDRc, 2006 Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Hexachlorobenzene. ATSDRd, 2006 Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Lead. ATSDRe, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Policyclic Aromatic Hidrocarbures. ATSDRf, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Polichorinated Byphenils. ATSDRg, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Toluene. ATSDRh, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Xilene. Avogbe P. H., Ayi-Fanou L., Autrup H., Loft S., Fayomi B., Sanni A., Vinzents P. y Møller P., 2005. Ultrafine particulate matter and high-level benzene urban air pollution in relation to oxidative DNA damage. Carcinogenesis (26) no.3 pp.613—620. Aylward Lesa L., Hays Sean M, Karch Nathan J, and Paustenbach Dennis J. 1996. Relative Susceptibility of Animals and Humans to the Cancer Hazard Posed by 2,3,7,8-Tetrachlorodibenzo-pdioxin Using Internal Measures of Dose. Environ. Sci. Technol., 30:3534-3543 Blake, A. 2005. The next generation of POP´s: PBDE´s and Lindane. International POP´s Elimination Network (IPEN). Washington D.C. USA. 15 p. Boitani, L. y T. K. Fuller. 2000. Research techniques in animal ecology: Controversies and consequences. University Press Columbia. USA. 442 p. Bozada Robles, L. y Namihura-Santillan, p. 2005. El derrame de petróleo de 22 de diciembre de 2004 en la cuenca baja del rió Coatzacoalcos: estudio de caso. 681-696 pp. A.V. Botello, J. Rendón-Von Osten, G. Gold-Bouchot y C. Agraz-Hernández (Eds). Golfo de México Contaminación e Impacto ambiental: Diagnostico y Tendencias. Universidad Autónoma de Campeche, Universidad Autónoma de México, Instituto de Ecología. 696p. Bozada, L. M. y F. Bejarano. 2006. Los contaminantes orgánicos persistentes en el istmo mexicano. Red de Acción sobre Plaguicidas y Alternativas en México. RAPAM. México, D.F. 79 p. CDC. 2005. Centers for Disease Control and Prevention, Third National Report on Human Exposure to Environmental Chemicals CECODES. 1988. Medio Ambiente en Coatzacoalcos. Centro de Ecodesarrollo. D. F. México. 86 p. Celis, L., A.V. Botello, M. Mendelewicsz, y G. Díaz. 1987. Actividades del proyecto CARIPOL en a zona costera de México: 1. Hidrocarburos disueltos. Caribbean Journal of Science. 23(1):11-18. CONAPO. 2000. Consejo Nacional de Población. Índices de Marginación 2000. disponible on-line: http://www.conapo.gob.mx/00cifras/2000.htm DiGangi, J. y J. Petrlink, 2005. The egg report. International POP´s Elimination Network (IPEN). Washington D.C. USA. 52p. E. A.-UK. 2003. Ecological risk assessment. Environment Agency- United Kingdom. (E. A.-UK). 100 p. EPA1993a. Wildlife Exposure Factors Handbook Volume I of II. U.S. Environmental Protection Agency Washington, DC. EPA/600/R-93/187. December. EPA1993b. Wildlife Exposure Factors Handbook Volume II of II. U.S. Environmental Protection Agency Washington, DC. EPA/600/R-93/187. December. EPA-ECO Update. 1994a. Field Studies for Ecological Risk Assessment. ECO Update 2(3):1-13. U.S. Environmental Protection Agency. EPA-ECO Update. 1994b. Selecting and using Reference Information in Superfund Ecological Risk Assessments. ECO Update 2(4):1-6. U.S. Environmental Protection Agency. EPA. 1998. Guidelines for Ecological Risk Assessment. Environmental Protection Agency. USA. 112 p. EPA 1999. Screening Level Ecological Risk Assessment Protocol Appendix E: Toxicity Reference Values U.S. EPA Region 6. Multimedia Planning and Permitting Division Center for Combustion Science and Engineering. U.S. EPA. Office of Solid Waste. Flores, O y P. Geréz, 1994. Biodiversidad y conservación en México, Vertebrados, Vegetación y uso del suelo. Pág. 88. García, E. 1988. Modificaciones al sistema de clasificación climática de Köppen. 4ª Edición. Offset Larios. México. D. F. 218 p. Gaskell M., McLuckie K. I. E. y Farmer P. B. (2005) Comparison of the repair of DNA damage induced by the benzene metabolites hydroquinone and pbenzoquinone: a role for hydroquinone in benzene genotoxicity. Carcinogenesis. (26) no.3 pp.673—680. Gómez-Pompa, A. 1980. Ecología de la vegetación del estado de Veracruz. Ed. C.E.C.S.A. Xalapa, Veracruz, México. 91 p. INE. Instituto Nacional de Ecología. 2004. Metales y Contaminantes Orgánicos Persistentes en Niños y Muestras Ambientales de 10 Sitios Contaminados de México Informe Final. México, http://www.ine.gob.mx/dgicurg/sqre_estudios.html D.F. disponible en INE, 2005, "Diseño y aplicación de una metodología para la evaluación integrada de riesgos ambientales en sitios peligrosos de México" INE, 2006 , Diseño y aplicación de una metodología para la evaluación integrada de riesgos ambientales en sitios contaminados de México - caso de estudio Coatzacoalcos, Veracruz.” INEGI. 1994. XIV censo industrial, XI censo comercial y XI censo de servicios. Censos Económicos 1994 Veracruz. Instituto Nacional de Estadística, Geografía e Informática. INEGI. 2005. Principales resultados por localidad 2005 (ITER), Veracruz de Ignacio de la Llave. Instituto Nacional de Estadística Geografía e Informática (INEGI). http://www.inegi.gob.mx/est/contenidos/espanol/sistemas/conteo2005/locali dad/iter/default.asp IPEN. 2005. The Egg Report: Contamination of chicken eggs from 17 countries by dioxins, PCBs and hexachlorobenzene. The International POPs Elimination Network. 52 p. López-Portillo, E. 2000. Río Coatzacoalcos. (Serie Ríos de México). Instituto Latinoamericano de la Comunicación Educativa -Online CommunicationsMéxico. http://sepiensa.org.mx/contenidos/2004/coatzacalcos/coatzacoalcos.htm. Oakley G., Devanaboyina U., Robertson L. y Gupta R. (1996) Oxidative DNA Damage Induced by Activation of Polychlorinated Biphenyls (PCBs): Implications for PCB-Induced Oxidative Stress in Breast Cancer. Chemichal Research in Toxicology (9) 1285-1292 OPS 1999. Metodología de Identificación y Evaluación de Riesgos para la Salud en Sitios Contaminados. Ops/Cepis/Pub/99.34. Lima, Perú. 42 p. Pelcastre Villafuerte, L. y O. A. Flores Villela. 1992. Lista de especies y localidades de recolecta de la Herpetofauna de Veracruz, México. Publicación Especial Museo de Zoología “Alfonso L. Herrera” Fac. Ciencias UNAM. Pérez-Maldonado IN, Herrera C, Batres LE, González-Amaro R, Díaz-Barriga F, Yánez L. 2005. DDT-induced oxidative damage in human blood mononuclear cells. Environ Res 98(2):177–184. Romero-Almaráz, M.; C. Sánchez-Hernández; C. García-Estrada; R. Owen. 2000. Mamíferos pequeños: Manual de técnicas de captura, preparación, preservación y estudio. UNAM. México. D. F.151 p. Rosales L. y Carranza E. 2005. Estudio geoquímico de metales en el estuario del río Coatzacoalcos. p. 389-406. A.V. Botello, J. Rendón-Von Osten, G. Gold-Bouchot y C. Agraz-Hernández (Eds). Golfo de México Contaminación e Impacto ambiental: Diagnostico y Tendencias. Universidad Autónoma de Campeche, Universidad Autónoma de México, Instituto de Ecología. 696p. Rzedowski, J. 1978. Vegetación de México. Limusa. México. 432 pp. Sánchez, G.1994. Evaluación de riesgo en salud por exposición a hidrocarburos aromáticos policíclicos en la población de Coatzacoalcos Veracruz. Tesis de maestría. Instituto Nacional de Salud Pública. Cuernavaca, México. Schwartz J, Landrigan PJ, Baker EL. Lead-induced anemia: Dose-response relationships and search for a threshold. Am J Public Health 1990;80: 165168. Singh, N.P.; M.T. McCoy; R.R Tice; E.L. Schneider. 1988. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp. Cell Res. 175:184-191. Stringer, R.; I. Labunska; K. Bridgen. 2001. Organochlorine and heavy metals contaminants in the environmental around the Complejo Petroquímicos Paharitos, Coatzacoalcos, México. Nota técnica Greenpeace. University of Exeter. Unit Kingdom. 60 p. Suter II, G.W. 1993. Ecological Risk Assessment. Lewis Publishers. United Stated. 538 pp. Vázquez-Botello, A., y F. Páez. 1986. La contaminación: el problema crucial. Vol. 1. Centro de ecodesarrollo. México. 140 p. Vázquez-Botello, A.; S. Villanueva-Fragoso; L. Rosales-Hoz. 2004. Distribución y contaminación por metales en el Golfo de México. pp. 682-712. En: Diagnostico ambiental del Golfo de México. Compiladores: Caso, M. I. Pisanty; E. Ezcurra. Editado por: SEMARNAT-INE. Wayne R. Munns, Jr., Robert Kroes, Gilman Veith, Glenn W. Suter II, Terri Damstra, and Michael D. Waters. 2003. Approaches for Integrated Risk Assessment. Human and Ecological Risk Assessment. 9(1) 267-272. Winn L. M. (2003) Homologous Recombination Initiated by Benzene Metabolites: A Potential Role of Oxidative Stress. Toxicological Sciences. (72) 143–1 6 ANEXO Implementación y validación de metodologías de Laboratorio Metodología de evaluación de exposición a Benceno El ácido trans-trans mucónico, es un metabolito menor del benceno en animales y humanos (figura 1). Sin embargo, es un indicador sensible para evaluar la exposición a bajas dosis de benceno (ATSDR, 2004a; Boogard y van Sittert, 1996: Bee-Lan. et. al., 1993; Weaver et al, 2000; S. de Paula, et al, 2003) Figura 1. Metabolismo del Benceno en humanos (Ross, 1996) Para la cuantificación en el Laboratorio de Toxicología Ambiental de la Facultad de Medicina de la UASLP se han establecido las condiciones de laboratorio para el análisis de ácido trans-trans mucónico por la Técnica de Cromatografía de Líquidos de Alta Resolución (HPLC, por sus siglas en inglés). Se ha establecido lo siguiente: a) El protocolo de la toma de muestra b) Manejo de la muestra (condiciones de almacenamiento) c) Metodología de extracción de ácido trans-trans mucónico con sorbentes de intercambio aniónico d) Condiciones de análisis en el HPLC a) Protocolo de la toma de muestra Se colectará la primera orina de la mañana en botes de polipropileno (PP) previamente lavados con ácido. Se debe indicar a los participantes que no deberán ingerir jugos, bebidas embotelladas ni productos enlatados y/o envasados (mayonesas, margarinas, aderezos, frituras, pastelillos) que contengan ácido sórbico 48 horas previas a la toma de muestra. El ácido sórbico puede interferir en las mediciones de ácido trans, trans mucónico. b) Manejo y almacenamiento de la muestra La muestra se preserva a 4°C durante su traslado al laboratorio. Se deberá acidificar con ácido clorhídrico (HCl) 6 M añadiendo 100 μl por cada 10 ml de muestra colectada. Una vez en el laboratorio se centrifuga a 3000 rpm durante 15 minutos y deberá ser separada en alícuotas de 5 ml. Estas serán preservadas a -30°C hasta su análisis. c) Metodología de extracción de ácido trans-trans mucónico: Extracción con sorbentes de intercambio aniónico Fundamento: N+ (CH3) (SAX) es un intercambiador aniónico usado para la adsorción de ácidos. Las condiciones óptimas para la extracción requieren que el sorbente (intercambiador iónico) y el analito deben tener cargas opuestas, además de que la concentración del analito deber ser baja. El pH de la muestra deberá favorecer la forma ionizada del analito (dos unidades arriba del pKa) Lo cual favorece la completa adsorción del analito. Para la elusión, deberá emplearse un solvente que neutralice el ácido y compita con el analito en los sitios de intercambio. La selectividad en una columna de intercambio aniónico está relacionada a los siguientes factores: • pH • Counter ion • Fuerza iónica • Solventes orgánicos • Velocidad de flujo pH El pH debe ser bajado en el caso de analitos de comportamiento básico y aumentado para los ácidos en solución acuosa. El pH óptimo para la ionización está dado en función del pKa. Para un compuesto ácido, el pH se deberá ajustar dos unidades arriba del pKa. De esta manera se consigue el 99% de ionización. Cada unidad de pH cambia en % de las moléculas cargadas a no cargadas por un factor de 10. Para la elusión de un ácido en una columna SAX el pH deberá ajustarse dos unidades de pH abajo del pKa del ácido, para pasar a la forma no ionizada. Counter ion Para intercambiadores SAX: OH-, F- C2H3O2- son más fácilmente desplazables. H2PO4-, HCO3- son moderadamente desplazables Fuerza iónica La fuerza iónica mide la concertación total de especies iónicas en la matriz. Una fuerza iónica baja favorece la retención, mientras que una fuerza iónica alta facilita la elusión Solvente orgánico En algunos casos la solubilidad de la forma neutra del ácido o de la base es más baja en agua comparada con la forma iónica. Por o cual es útil utilizar un solvente orgánico miscible en agua para hacer más efectiva la elusión del compuesto. Estándar Interno: Se emplea como estándar interno el ácido Vanílico (figura 3) el cual es añadido a la orina en solución a una concentración conocida y con esto se estima si hubo pérdida o no del analito. O HO OH O Figura 2. Estructura Química del ácido trans-trans mucónico (pKa: 4.7) Figura 3. Estructura Química del ácido vanílico (pKa: 6.5) Soluciones: • Metanol, grado HPLC • Agua desionizada • Ácido Acético 1% • Ácido acético/Metanol al 20% • Solución buffer trisma 0.2 M pH: 8.5 + 15 ppm de ácido vanílico • Solución buffer trisma 0.05M pH: 8.5 Acondicionamiento de las columnas Columnas: SAX 500 mg; 6 ml; Strata; phenomenex. • Las columnas se colocan en la cámara de vacío. Se les agrega 4 ml de metanol. Durante 10 minutos. • Añadir 3 ml de agua desionizada • Añadir 2 ml de buffer trisma 0.05 Es importante que durante todo el procedimiento de acondicionamiento el material de la columna se mantenga húmedo. Extracción del analito • 1 ml de orina, se añaden 2 ml de buffer trisma 0.2M • Agitar • La muestra se hace pasar por las columnas previamente acondicionadas como se señaló anteriormente. • Se hacen pasar 2 ml de agua desionizada • Pasar 3 ml de ácido acético al 1% • Aplicar vacío durante 15 min. hasta secar las columnas • Eluir con 3 ml de ácido acético/metanol al 20%. La elusión se realiza en dos partes, aplicando 1.5 ml cada vez. • Aplicar vacío durante 20 minutos. • Filtrar el eluato • Inyectar 20 µl en el HPLC. Condiciones de análisis en el HPLC En la siguiente tabla se describen las condiciones del equipo bajo las cuales se realiza el análisis del ácido t-t mucónico. El Cromatógrafo es Hewlett Packard. Agilent serie 1100 el cual está equipado con una bomba cuaternaria. Cuadro 1 Condiciones del equipo para la determinación de ácido trans, trans mucónico Parámetro Matriz Condiciones Orina Pre-tratamiento: Acidificadas, sometidas a extracción en columnas de intercambio aniónico y filtrada (0.45 µm Ø) Detector UV-Vis (259 nm) Columna C-18 (Zorbax) Fase móvil Metanol/Acido acético al 1% (20:80) Flujo 1 ml/min Temperatura Columna 30°C Parámetros de validación del método. Se realizaron curvas de calibración en solvente y en matriz, para estas últimas se aplicó el método de extracción anteriormente descrito. Los resultados a continuación muestran los parámetros obtenido a partir de curvas preparadas y analizadas por triplicado analizadas bajo las condiciones de equipo descritas anteriormente. Los parámetros de linealidad: pendiente (m); intercepto (b); coeficiente de correlación (r); el rango lineal; los límites de detección (LDD) y Límites de cuantificación (LDC) se presentan en el cuadro 2 para la curva en solvente y el cuadro 3 para la curva en muestra de orina fortificada. Las figuras 4 y 5 muestran las curvas en solvente (validación de sistema) y en orina (validación de método), respectivamente. Cuadro 2 Parámetros de linealidad de curva de aguametanol m 252.44 b 2.42 r 1.00 Rango lineal (mg/L) 0.05-5.0 LDD (mg/l) 0.03 LDC (mg/l) 0.09 Cuadro 3. Parámetros de linealidad de en orina fortificada m b r Rango lineal (mg/L) LDD (mg/l) LDC (mg/l) 235.40 16.70 0.9999 0.05-5.0 0.03 0.10 Figura 4. Gráfica de ácido trans, trans mucónico en metanol-agua. Los puntos corresponden al promedio de una curva preparada por triplicado Figura 5. Gráfica de ácido trans, trans mucónico en orina fortificada. Los puntos corresponden al promedio de una curva preparada por triplicado Las condiciones establecidas en el laboratorio permiten evaluar la exposición a Benceno a concentraciones ambientales, pues el límite de detección nos permite cuantificar y detectar estas concentraciones en población posiblemente expuesta a benceno que habita en la zona industrial de Coatzacoalcos Ver. Metodología de evaluación de exposición a Xilenos y Tolueno Por otra parte, se han logrado obtener las condiciones para la determinación de metabolitos de Xilenos: ácido 2-metil hipúrico y ácido 4-metil hipúrico (Figura 6) y el metabolito de Tolueno: ácido hipúrico (Figura 7) por HPLC (Cromatografía de Líquidos de Alta Resolución, por sus siglas en inglés). En un Equipo: Hewlett Packard. Agilent serie 1100 con Bomba cuaternaria. Es posible la determinación de metabolitos para ambos compuestos en un solo análisis bajo las condiciones descritas a continuación Figura 6. Metabolismo del Xileno en humanos (IPCS, 1997). Figura 6. Metabolismo del Tolueno en humanos (IPCS, 1986) El cuadro 4 especifica las condiciones del cromatógrafo, la composición de la fase móvil y el pre-tratamiento de la muestra. Cuadro 4. Condiciones de análisis de metabolitos de Xilenos y Tolueno por HPLC Matriz: Pre-tratamiento: Centrifugada y filtrada (0.22µm Ø) Detector: UV-Vis (254 nm) Columna C-18 (Sorbax) Fase móvil: Metanol/Acido acético al 2.5% Gradiente lineal: De mayor polaridad a menor polaridad Flujo: 1 ml/min Temperatura Columna: 40°C Bajo estas condiciones se han logrado obtener los picos de elusión de los estándares de los tres metabolitos tanto en solvente como en muestras de orina fortificada. Se han construido además curvas de calibración tanto en solvente como en muestras de orina fortificada. Los resultados de los parámetros de las curvas se presentan en los cuadros 5 y 6. Cuadro 5. Parámetros de linealidad de curvas de calibración de metabolitos de Xilenos y Tolueno en agua metanol. Ác. hipúrico Ác. 2m-hipúrico Ác. 4m-hipúrico m 10.369 4.186 31.1169 b 690.313 -230.669 1995.75 r Rango lineal (mg/L) 0.9995 0.9988 0.9978 15-1000 15-3000 15-1000 Cuadro 6. Parámetros de linealidad de curvas de calibración de metabolitos de Xilenos y Tolueno en orina. Ác. hipúrico Ác. 2m-hipúrico Ác. 4m-hipúrico m 10.361 4.237 22.701 b 4056.1 222.3304 4739.3 r Rango lineal (mg/L) 0.9999 0.99954 0.9947 100-1000 100-2000 100-1000 La metodología aún está en fase de estandarización para la cuantificación de muestras problema, así como en la evaluación de la recuperación y exactitud. Con estos resultados de las condiciones establecidas para el análisis de metabolitos de Xilenos y Tolueno, es factible analizar la exposición a BETX (Benceno, Xileno, Tolueno) En el laboratorio de Toxicología Ambiental de la Facultad de Medicina de la UASLP. Referencias del Anexo ATSDRa, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Benzene. ATSDRb, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Toluene. ATSDRc, 2004. Department of Health and Human Services. Agency for Toxic Substances and Diseases Registry. Toxicological profile for Xilene. Bee-Lan L., New, L., Peng-Wai K., Her-Yam, O., Cheng-Yang, S., Choon-Nam O. 1993. Urinary trans,trans-Muconic acid determined by Liquid Chromatography: Application in biological monitoring of benzene exposure. Clinical Chemistry Vol. 39 No. 9. Boogard P.J. y Van Sittert N.J., 1996. Suitability of S-Phenyl Mercapturic Acid and trans-trans-Muconic Acid as Biomarkers for Exposure to Low Concentrations of Benzene Environmental Health Perspectives, Vol. 104, Supplement 6: Benzene Toxicity, Carcinogenesis, and Epidemiology pp. 1151-1157 INSHT. Instituto Nacional de Seguridad e Higiene en el Trabajo. 1995. Ministerio del Trabajo y asuntos sociales de España. MTA/MB-022/A25 Determinación de los ácidos fenilgioxílico, mandélico, hipúrico y orto y parametilhipúrico en orina. Método para fase reversa con detector de ultravioleta/Cromatografía líquida de alta resolución. IPCS (1997). Xylenes. Environmental Health Criteria 190. Publ: WHO, ISBN 92 IPCS (1986). Toluene. Environmental Health Criteria 52. Publ: WHO, ISBN 92. NIOSH. 2003. National Institute for Occupational Safety and Health. CDC. Hippuric and methyl hippuric acids in urine. Method 8301. (3) Manual of Analytical Methods. Paula de S. F.C., Silveira, J.N., Junqueira R.G., Alvarez, E. M. L. 2003 Assessment of urinary trans,trans-Muconic acid as a biomarker of exposure to benzene., Rev a Saúde Publica. Vol 37 No 6. Ross, 1996 Metabolic basis of benzene toxicity. Eur J Haematol 57:(suppl):111118. en Carcinogenic Effects of Benzene: an update,EPA, 1998. Weaver V.M.; Buckley T. and Groopman J. D. 2000. Lack of Specificity of trans,trans-Muconic Acid as a Benzene Biomarker after Ingestion of Sorbic Acid-preserved Foods. Cancer Epidemiology Biomarkers & Prevention Vol. 9, 749-755, July 2000.