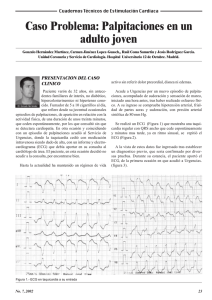
Bases de la electrocardiografía
Anuncio

09:32 Página 1 Bases de la electrocardiografía – Semiología electrocardiográfica II 21/7/06 1900710 ECG_2_portada CONSULTA DE CARDIOLOGÍA Bases de la electrocardiografía Semiología electrocardiográfica II: Patrones diagnósticos de crecimientos, bloqueos y preexcitación Antoni Bayés de Luna Curso_ECG_2.qxd 20/7/06 11:59 Página 2 Reservados todos los derechos. Queda prohibida la reproducción total o parcial de los contenidos de esta publicación por cualquier medio, incluida la traducción, así como su tratamiento informático, sin el permiso previo y por escrito del Editor. El uso de cualquier dato o material de esta publicación sin autorización podrá ser penalizado. A pesar de la recopilación y revisión cuidadosa de la información incluida en esta publicación, el Editor no se hace responsable de la actualización de la información ni de ningún error ni omisión de los datos contenidos en esta publicación. Los contenidos de esta publicación se presentan tal como han sido escritos por sus autores, sin ninguna garantía, incluida cualquier garantía implícita de adaptación para fines particulares. Los contenidos de esta publicación deben utilizarse exclusivamente con fines informativos y de investigación. Por el contrario, no deben usarse con fines diagnósticos ni terapéuticos, ni aplicarse de forma directa en la práctica médica diaria o en la atención a pacientes. Debido a la rapidez de los avances médicos, se recomienda verificar de manera independiente los diagnósticos. Igualmente, en el caso de que hubiera mención de productos o fabricantes, en ningún caso debe entenderse como prescripción, recomendación o sugerencia de ninguna clase. Asimismo, el Editor no será responsable de los daños personales ni materiales derivados de la aplicación de métodos, productos, directrices, ideas o cualquier otra información contenida en esta publicación. Del mismo modo, el Editor tampoco será responsable de las decisiones tomadas por cualquier individuo ni de las acciones realizadas a partir de la información incluida en esta publicación. Por último, el Editor no se hará responsable en ningún caso de la pérdida de beneficios ni de los daños asociados, ni siquiera en el caso de haber sido informado de la posibilidad de que éstos se produjesen. © 2006, Prous Science, S.A. Provenza 388, 08025 Barcelona Dep. legal: B-15239-06 Impreso en España Curso_ECG_2.qxd 20/7/06 11:59 Página 3 CONSULTA DE CARDIOLOGÍA Bases de la electrocardiografía Semiología electrocardiográfica II: Patrones diagnósticos de crecimientos, bloqueos y preexcitación Antoni Bayés de Luna Catedrático de Cardiología de la Universitat Autònoma de Barcelona y Director del Institut Català de Cardiologia - Hospital de Sant Pau Curso_ECG_2.qxd 20/7/06 11:59 Página 5 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A Índice Introducción 1 1. Criterios diagnósticos electrocardiográficos: concepto de sensibilidad, especificidad y valor predictivo 3 2. Alteraciones del auriculograma 7 2.1. Introducción ................................................................................................. 7 2.2. Criterios diagnósticos ................................................................................... 8 2.2.1. Crecimiento auricular derecho ......................................................... 8 2.2.2. Crecimiento auricular izquierdo ..................................................... 11 2.2.3. Crecimiento biauricular................................................................... 12 2.2.4. Bloqueo interauricular .................................................................... 12 2.3. Implicaciones clínicas ................................................................................ 13 17 3. Crecimientos ventriculares 3.1. Introducción ............................................................................................... 3.2. Criterios diagnósticos ................................................................................. 3.2.1. Crecimiento ventricular derecho .................................................... 3.2.2. Crecimiento ventricular izquierdo .................................................. 3.2.3. Crecimiento biventricular................................................................ 3.3. Implicaciones clínicas ................................................................................ 4. Trastornos de conducción intraventriculares 4.1. Introducción ............................................................................................... 4.2. Bloqueos del ventrículo derecho .............................................................. 4.2.1. Bloqueo de rama derecha avanzado ............................................. 4.2.2. Bloqueo de rama derecha de primer grado (parcial)................... 4.2.3. Bloqueo de rama derecha de segundo grado (intermitente) ................................................................................... 4.2.4. Diagnóstico diferencial ................................................................... III 17 22 22 33 37 41 43 43 45 45 49 49 51 Curso_ECG_2.qxd 20/7/06 11:59 Página 6 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 4.2.5. Trastornos de conducción parcelares del ventrículo derecho .................................................................... 4.3. Bloqueos del ventrículo izquierdo............................................................ 4.3.1. Bloqueo de rama izquierda avanzado ........................................... 4.3.2. Bloqueo de rama izquierda parcial (de primer grado) ................ 4.3.3. Bloqueo ventricular izquierdo de segundo grado 2 (intermitente) ................................................................................... 4.3.4. Hemibloqueos ................................................................................. 4.4. Bloqueos bifasciculares.............................................................................. 4.4.1. Bloqueo de rama derecha avanzado más hemibloqueo superoanterior .................................................. 4.4.2. Bloqueo ventricular derecho avanzado más hemibloqueo inferoposterior .................................................. 4.5. Bloqueos trifasciculares ............................................................................. 4.6. Implicaciones clínicas ................................................................................ 51 51 51 54 56 56 62 62 64 64 65 69 5. Preexcitación ventricular 5.1. Preexcitación tipo Wolff-Parkinson-White ................................................ 5.1.1. Criterios diagnósticos ...................................................................... 5.1.2. Cambios espontáneos o provocados de la morfología anómala............................................................... 5.1.3. El ECG en los pacientes con más de una vía accesoria .............. 5.1.4. Diagnóstico diferencial de la preexcitación tipo Wolff-Parkinson-White............................................................. 5.1.5. Implicaciones clínicas ..................................................................... 5.2. Preexcitación tipo Lown-Ganong-Levine o PR corto............................... IV 70 70 77 77 78 78 81 Curso_ECG_2.qxd 20/7/06 11:59 Página 1 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A Introducción Vamos a exponer en este libro cuáles son los patrones electrocardiográficos diagnósticos más característicos que se presentan en caso de alteraciones de las aurículas, crecimiento de los ventrículos, bloqueo intraventricular y síndrome de preexcitación. Utilizaremos a menudo dibujos de cómo serían las asas de P, QRS o T en los distintos procesos o incluso en varias ocasiones, trazados vectorcardiográficos auténticos para comprender bien cómo a través de la correlación entre asas y hemicampos se explican las formas electrocardiográficas. De forma muy especial comentaremos el valor real de los criterios diagnósticos electrocardiográficos de acuerdo con los conceptos de sensibilidad, especificidad y valor predictivo. En cambio, no vamos a detallar en este libro de introducción a los patrones electrocardiográficos de crecimientos, bloqueos y preexcitación, los mecanismos electrofisiológicos de los distintos patrones electrocardiográficos ni a comentar más que someramente aspectos de tipo clínico, de correlación con otras técnicas y del valor pronóstico de la electrocardiografía. Todo ello está descrito extensamente en nuestro libro “Electrocardiografía clínica” (Editorial Espaxs, Barcelona 1999), y en nuestro Curso de Electrocardiografía clínica por Internet (www.cursoecg.com) (Prous Science, 2004). Por otra parte, recomiendo al lector la consulta de otros textos de elecrocardiografía (McFarlane, 1989; Wagner, 2002; Gertsch, 2004). 1 Curso_ECG_2.qxd 20/7/06 11:59 Página 3 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 1. Criterios diagnósticos electrocardiográficos: Concepto de sensibilidad, especificidad y valor predictivo Existen alteraciones en las cuales la electrocardiografía es la prueba de mayor rendimiento diagnóstico, es decir, la que nos permite definir unos criterios que nos aseguren, más que otros cualesquiera, si existe o no una alteración determinada. La electrocardiografía de superficie, por sí misma, nos ofrece frecuentemente esta garantía, como ocurre con el diagnóstico de bloqueo auricular o ventricular, la preexcitación y muchas arritmias, o con el infarto tipo Q, sobre todo en fase aguda y cuando realizamos electrocardiogramas (ECG) secuenciales. Otras veces es necesario recurrir a ciertas técnicas electrocardiológicas o de imagen para conseguir esta seguridad; por ejemplo, en los crecimientos ventriculares, en algunos casos de taquicardia con QRS ancho en los que puede ser difícil, sólo con la electrocardiografía de superficie, distinguir si dicha taquicardia es supraventricular aberrante o ventricular, y lo mismo ocurre si queremos asegurar la localización de una vía anómala en caso de síndrome de Wolff-Parkinson-White. En resumen, pues, podemos afirmar que la electrocardiografía puede considerarse como la prueba por excelencia, es decir, el “patrón de referencia” para el diagnóstico de los bloqueos a nivel auricular y ventricular, la preexcitación ventricular, la mayoría de las arritmias cardiacas y el infarto tipo Q (ECG secuenciales). Sin embargo, en otros casos, como por ejemplo en los crecimientos auriculares y ventriculares, en las alteraciones de la repolarización debidas a insuficiencia coronaria crónica, en la interpretación de otras alteraciones de la repolarización o de determinadas arritmias, la electrocardiografía nos proporciona una información valiosa y puede sugerir el diagnóstico a partir de unos determinados criterios electrocardiográficos, pero éstos tienen un potencial diagnóstico menor que el de otras técnicas (la ecocardiografía, por ejemplo, para los crecimientos auriculares o ventriculares, etc.). Así pues, en aquellos procesos en los cuales la electrocardiografía es la técnica de referencia, los criterios electrocardiográficos que empleamos son diagnósticos de la enfermedad (por ejemplo bloqueos), mientras que en los demás (por ejemplo crecimientos) son sólo indicativos de ella. Por lo que respecta a los criterios de valoración de cualquier prueba diagnóstica, utilizados en la interpretación electrocardiográfica de rutina, en los casos en que la electrocardiografía no es la técnica de referencia para el diagnóstico 3 Curso_ECG_2.qxd 20/7/06 11:59 Página 4 C R I T E R I O S D I A G N Ó S T I C O S E L E C T RO C A R D I O G R Á F I C O S del proceso, por ejemplo los criterios de crecimiento auricular o ventricular, de necrosis antigua, de taquicardia ventricular, etc., es necesario que conozcamos cuál es su valor real. Para ello es imprescindible aplicar los conceptos de sensibilidad, especificidad y valor predictivo. • La sensibilidad de un criterio electrocardiográfico se define como el porcentaje de individuos con un trastorno concreto (por ejemplo hipertrofia del ventrículo izquierdo [HVI]) que presentan un criterio electrocardiográfico determinado (por ejemplo R ≥35 mm en V5). Si todos los individuos con la cardiopatía en cuestión tienen un criterio electrocardiográfico determinado, éste tendrá una sensibilidad del 100% (no habrá falsos negativos). • La especificidad de un criterio electrocardiográfico se define como el porcentaje de individuos normales que no presentan un criterio determinado, por ejemplo onda R ≥35 mm en V5, considerando que éste sea un criterio diagnóstico de crecimiento de ventrículo izquierdo. Un criterio electrocardiográfico será tanto más específico cuantos menos individuos normales lo presenten. Si no lo tiene ningún individuo normal, la especificidad es del 100% (no habrá falsos positivos). Como puede apreciarse, la especificidad se determina en un grupo control (pacientes sin la alteración a estudiar) y la sensibilidad en un grupo con dicho trastorno. Para ello es necesario utilizar otras técnicas de referencia (ecocardiografía u otra técnica de imagen, como la resonancia magnética, angiografía, etc.) que nos permitan definir estos dos grupos: con el trastorno en cuestión y sin él. • El valor predictivo representa el significado clínico de una prueba. Nos indica la probabilidad de que un resultado, tanto si es positivo como negativo, nos sea útil desde el punto de vista clínico. En resumen, nos muestra qué porcentaje de pacientes con un signo o síntoma presenta la enfermedad (valor predictivo para positivos) o qué porcentaje sin el signo o síntoma no la presenta (valor predictivo para negativos). Con tamaños de muestra escogidos por nosotros (por ejemplo 100 enfermos con crecimiento auricular izquierdo por ecocardiografía y 100 sin él, tal como hacemos normalmente para calcular la especificidad y la sensibilidad) no se puede calcular el valor predictivo, el cual depende de la prevalencia de la afección en la población en estudio. En el ejemplo que vamos a exponer a continuación se explica cómo se calcula la sensibilidad, la especificidad y el valor predictivo, y se pone de manifiesto la importancia que tiene para este último cálculo la realidad epidemiológica. 4 Curso_ECG_2.qxd 20/7/06 11:59 Página 5 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A Para conocer el valor real de los criterios diagnósticos ECG es imprescindible conocer su sensibilidad, especificidad y valor predictivo. Existen fórmulas que permiten realizar estos cálculos. Son las siguientes: Negativos auténticos (NA) Especificidad de un criterio (%) especificidad = ————————————— NA + PF (positivos falsos) Positivos auténticos (PA) Sensibilidad de un criterio (%) sensibilidad = ————————————— PA + NF (negativos falsos) PA Valor predictivo para positivos (%) = ———— PA + PF NA Valor predictivo para negativos (%) = ———— NA + NF Sin embargo, y con el fin de no tener que memorizar y entender mejor cómo se obtienen lo valores de sensibilidad, especificidad y valor predictivo, creemos que es más conveniente explicarlo con un ejemplo, tal como haremos a continuación (Tabla 1). Veamos: supongamos que queremos conocer la sensibilidad, la especificidad y el valor predictivo del signo ECG onda P ± en II, III y VF y de duración ≥120 ms Tabla 1. Forma de calcular la sensibilidad, la especificidad y el valor predictivo de un criterio electrocardiográfico*. Crecimiento auricular izquierdo por ecocardiografía P ± en II, III, VF y ≥120 ms 100 pacientes valvulares Sin P ± en II, III, VF Total Sí No Total 2 0 2 88 10 98 90 10 100 PA 2 Sensibilidad ———=—— ×100 = 2% PA+NF 2+88 PA 2 VPP = ——— = ——— ×100 2+0 PA+PF 100% NA 10 VPN = ——— = ——— ×100%>10% NA+NF 10+88 NA 10 Especificidad ———=——— ×100 = 100% NA+PF 10+0 *PA: positivos auténticos; NA: negativos auténticos; PF: positivos falsos; NF: negativos falsos; VPP: valor predictivo para positivos; VPN: valor predictivo para negativos. 5 Curso_ECG_2.qxd 20/7/06 11:59 Página 6 C R I T E R I O S D I A G N Ó S T I C O S E L E C T RO C A R D I O G R Á F I C O S en pacientes valvulares, para predecir o no la presencia de crecimiento auricular izquierdo detectado por ecocardiografía. La información obtenida de ambas pruebas, la prueba problema (ECG), es decir, la presencia o no de onda P ≥120 ms y ± en II, III, VF, y la de referencia, en este caso la evidencia o no de crecimiento auricular izquierdo comprobada por ecocardiografía, se coloca en una tabla de dos filas (prueba problema) y dos columnas (distribución real del proceso, en este caso crecimiento auricular izquierdo, por ecocardiografía) (Tabla de 2 × 2). En la Tabla 1 se puede ver cómo se calcula la sensibilidad, la especificidad y el valor predictivo para positivos y valor predictivo para negativos. Vamos a explicarlo: de cada 100 pacientes valvulares 90 tienen crecimiento auricular izquierdo, y de éstos sólo 2 presentan una onda P ± en II, III, y VF de duración ≥120 ms. En consecuencia, la sensibilidad para el diagnóstico de crecimiento auricular izquierdo de la onda P ± en II, III con ≥120 ms es muy baja (2%). En cambio, este signo es muy específico, pues ningún paciente sin crecimiento auricular izquierdo lo tiene (especificidad 100%). Por otra parte, el valor predictivo para positivos es muy alto (100%), ya que todos los que presentan este registro electrocardiográfico tienen crecimiento auricular izquierdo, pero, en cambio, el valor predictivo para negativos es bajo (>10%), pues muchos de los que no lo presentan tienen crecimiento auricular izquierdo (Tabla 1). Debemos tener presente que la sensibilidad y la especificidad de los distintos criterios electrocardiográficos varían de forma inversa, de tal manera que los muy específicos serán poco sensibles (por ejemplo P ± en II, III y VF con una duración ≥120 ms es muy específico para crecimiento auricular izquierdo, pues muy poca gente sin éste lo presenta, pero también es muy poco sensible, pues poca gente con él tiene una onda P de esta duración). Debido a esta relación inversa, que queda claro en el ejemplo expuesto en la Tabla 1, es difícil encontrar criterios que mantengan un grado de sensibilidad elevado sin sacrificar la especificidad. Para finalizar, es necesario comentar que la fiabilidad de una prueba (criterio electrocardiográfico) aumenta, de acuerdo con el teorema de Bayés, cuando se aplica a un grupo de población con una gran prevalencia de la cardiopatía o trastorno en cuestión (probabilidad a priori alta de presentar la enfermedad) y disminuye cuando se aplica a un grupo de población con una baja prevalencia de la cardiopatía o trastorno en cuestión (probabilidad a priori escasa de presentar la enfermedad). Así, el valor del descenso del ST como signo de cardiopatía isquémica es mucho mayor si aparece en un grupo de población con prevalencia elevada de cardiopatía isquémica (pacientes de mediana edad, con hipercolesterolemia, hipertensos y con dolor precordial) que en uno con una prevalencia baja (por ejemplo adultos jóvenes sin ningún factor de riesgo). 6 Curso_ECG_2.qxd 20/7/06 11:59 Página 7 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 2. Alteraciones del auriculograma 2.1. Introducción Con el término “alteraciones del auriculograma” englobamos todas las imágenes electrocardiográficas que se observan en los crecimientos auriculares y en los trastornos de conducción auricular, así como las situaciones en las cuales se puede detectar una alteración de la repolarización auricular. Conviene tener en cuenta los siguientes hechos (Bayés de Luna 1998, Puech 1964). 1. La onda P normal se explica por activación, primero de la aurícula derecha y después de la aurícula izquierda, con un periodo de tiempo intermedio en que se despolarizan ambas aurículas de forma conjunta (Fig. 1 A). 2. Las aurículas se dilatan más que se hipertrofian. A 3 mm - B - 2 mm - 2 mm - 2- - - - 1- 1- 1- - C - - Aurícula derecha Aurícula izquierda 0,10 s Onda P normal Aurícula derecha Aurícula izquierda 0,10 s Crecimiento auricular derecho Aurícula derecha Aurícula izquierda 0,12 s Crecimiento auricular izquierdo Figura 1. A) Arriba: esquema de la despolarización auricular en caso de P normal; abajo: ejemplo de onda P normal. B) Arriba: esquema de la despolarización auricular en caso de crecimiento auricular derecho; abajo: ejemplo de onda P de crecimiento auricular derecho. C) Arriba: esquema de la despolarización auricular en caso de crecimiento auricular izquierdo; abajo: ejemplo de onda P de crecimiento auricular izquierdo. 7 Curso_ECG_2.qxd 20/7/06 11:59 Página 8 A LT E R AC I O N E S D E L AU R I C U L O G R A M A 3. La morfología clásica de crecimiento auricular izquierdo (Fig. 1 C) se debe, más que a una dilatación auricular, al retraso de la conducción interauricular (Josephson, 1977). Es por ello que las imágenes electrocardiográficas de crecimiento auricular izquierdo y bloqueo auricular izquierdo pueden ser idénticas, aunque cuando hay crecimiento auricular izquierdo añadido el asa de P se va más atrás y se observa más a menudo un modo negativo evidente de la onda P en V1. 4. El voltaje de la onda P está muy influido por factores extracardiacos que lo aumentan (hipoxia, simpaticotonía, etc.) o disminuyen (enfisema, otros factores frontera, fibrosis auricular, etc.). 5. El concepto de bloqueo cardiaco significa que en algún lugar del corazón (unión sinoauricular, aurículas, unión auriculoventricular o ventrículos) el estímulo eléctrico encuentra dificultades de conducción más o menos importantes. Si el estímulo atraviesa la zona con conducción lenta hablamos de bloqueo de primer grado o parcial; si el estímulo queda completamente bloqueado se trata de bloqueo de tercer grado o avanzado, y si el estímulo unas veces pasa y otras no, el bloqueo es de segundo grado (aberrancia de conducción). En este apartado nos referiremos a los bloqueos auriculares y en el Capítulo 4 a los ventriculares. Los bloqueos sinoauriculares y de la unión auriculoventricular se estudian en el libro de esta colección dedicado a las arritmias. 6. En el bloqueo interauricular el retardo de conducción se produce entre las aurículas derecha e izquierda. El bloqueo puede ser parcial o avanzado. En el parcial el estímulo llega a la aurícula izquierda por la vía normal, pero con retraso. En el avanzado el estímulo no llega a la aurícula izquierda por la vía normal, sino a través de una activación retrógrada auricular izquierda. En raras ocasiones se puede encontrar un bloqueo auricular de segundo grado (aberrancia de conducción auricular). 7. En presencia de dilatación auricular brusca, como ocurre en el edema agudo de pulmón, puede verse de forma transitoria una morfología de la onda P en V1 (±). 8. En ausencia de afectación auricular la onda de repolarización auricular que sigue a la onda P debido a su bajo voltaje y larga duración suele quedar enmascarada dentro del complejo QRS, aunque puede verse en forma de descenso en general ligero, del intervalo PR y producir un ligero descenso del ST pero con pendiente ascendente, en casos de simpaticotonía (Fig. 2) o en algunos casos de bloqueo auriculoventricular de primer grado o avanzado. 8 Curso_ECG_2.qxd 20/7/06 11:59 Página 9 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A En ocasiones, en presencia de afectación auricular como gran crecimiento auricular, pericarditis o infarto auricular, puede observarse en algunas derivaciones, especialmente en VR, un descenso o un ascenso del intervalo PR (Fig. 3). A B Figura 2. A) ECG real (Holter) de un deportista durante una situación de extrema simpaticotonía. Obsérvese cómo da la impresión de que el segmento PR y el segmento ST forman parte del arco de una circunferencia cuyo centro estaría en la rama descendente de la onda R (B). III III Figura 3. Obsérvese el descenso del PR como expresión de lesión auricular (alteración de la repolarización auricular) en caso de infarto agudo diafragmático. Se aprecia también otra alteración (arritmias auriculares) frecuente en la propagación auricular del infarto. 9 Curso_ECG_2.qxd 20/7/06 11:59 Página 10 A LT E R AC I O N E S D E L AU R I C U L O G R A M A 2.2. Criterios diagnósticos 2.2.1. Crecimiento auricular derecho (Figs. 1 B, 4 B, 4 C y 5) 1. Criterios basados en alteraciones del QRS a) Morfología “qR” en V1 en ausencia de infarto (especificidad 100% para algunos autores) (Fig. 5). I II V1 III A V2 FP HP NL V1 +30º 120º B P Pulmonale V1 +30º 120º C P Congenitale V1 +30º 120º D P CAI V1 +30º 120º E P de CBA V1 +30º 120º Figura 4. Derivaciones I, II y III (plano frontal) y V1-V2 (plano horizontal) y morfologías de las asas de P en el plano horizontal en caso de: A) onda P normal; B) onda P de crecimiento auricular derecho (P pulmonale); ÂP derecho con P alta y picuda en II y III, y P de poco voltaje y a veces negativa en V1; C) onda P de crecimiento auricular derecho (P congenitale); ÂP izquierdo y P alta y picuda en V1; D) onda P ± en V1 de crecimiento auricular izquierdo (CAI); y E) onda P alta y ancha de crecimiento biauricular (CBA). 10 Curso_ECG_2.qxd 20/7/06 11:59 Página 11 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A b) Voltaje de QRS ≤4 mm en V1 y voltaje QRS en V2/voltaje QRS en V1 ≥5 (criterio muy específico, especificidad 90%) (Fig. 5). V1 V2 Figura 5. Cambios de P y del QRS que sugieren crecimiento auricular derecho (qR en V1 con voltaje QRS ≤4 mm y relación QRS V2/V1 ≥5). 2. Los criterios basados en alteraciones de la onda P (P ≥2,5 mm de altura en II y/o ≥1,5 mm en V1) son poco sensibles, aunque más específicos. 3. Eje de P: ÂP: de acuerdo con la dirección del ÂP pueden encontrarse la denominada P pulmonale (ÂP a la derecha, voltaje P en I <III) y P congenitale (ÂP a la izquierda, voltaje de P en 1>III) (Figs. 4 B y 4 C). 2.2.2. Crecimiento auricular izquierdo 1. Onda P en I o II≥0,12 s de duración, generalmente bimodal, pero de altura normal más onda P en V1 difásica, con negatividad final evidente de por lo menos 0,04 s de duración. En presencia de dilatación auricular brusca, como ocurre en el edema agudo de pulmón, la morfología de V1 (P ±) puede ser intermitente. Estos dos criterios juntos (Figs. 1 C y 4 D) tienen una buena especificidad (alrededor del 90%) (pocos casos falsos positivos), pero una escasa sensibilidad (menor del 60%) (bastantes casos falsos negativos). El simple hallazgo de una onda P de duración ≥0,12 sin un modo negativo evidente en V1 puede explicarse por un bloqueo interauricular aislado, sin crecimiento auricular asociado. 11 Curso_ECG_2.qxd 20/7/06 11:59 Página 12 A LT E R AC I O N E S D E L AU R I C U L O G R A M A 2. La morfología de la onda P ± en II, III y VF con P ≥0,12 s es muy específica (100% en valvulares y miocardiopatías), aunque muy poco sensible de crecimiento auricular izquierdo (Tabla 1). 2.2.3. Crecimiento biauricular (Fig. 4 E) 1. Onda P en II más alta (≥2,5 mm) y más ancha (≥0,12 s) de lo normal. En ocasiones es positiva-negativa en V1-V2 con un paso brusco de la positividad a la negatividad. 2. Signos de crecimiento auricular izquierdo con ÂP derecho. 2.2.4. Bloqueo interauricular 2.2.4.1 Bloqueo interauricular parcial o de primer grado 1. Onda P ≥0,12 s de duración en el plano frontal, con modo negativo variable en V1 que no necesariamente tiene que ser muy evidente. La morfología de la onda P debida a bloqueo interauricular aislado parcial puede confundirse con la onda P de crecimiento auricular izquierdo, aunque se ve en más ocasiones en V1 una onda P con un modo negativo poco marcado. En realidad, tal como hemos comentado, el retardo de conducción interauricular, más que la dilatación de la aurícula izquierda, explica en general la morfología de crecimiento auricular izquierdo. 2.2.4.2. Bloqueo interauricular de segundo grado 1. La morfología de la onda P varía en el mismo trazado (Fig. 6) o en trazos sucesivos, (Fig. 7) pero sin relación con la respiración ni como consecuencia de la presencia de latidos de fusión auricular (ver libro de arritmias de esta misma colección) o artefactos. Este tipo de bloqueo interauricular constituye la llamada aberrancia de conducción auricular. Figura 6. Obsérvese el cambio de forma de la onda P sinusal después de un complejo supraventricular prematuro y cómo más tarde vuelve a adquirir la previa. Se trata de un caso de aberrancia de conducción auricular ectópicamente inducida. 12 Curso_ECG_2.qxd 20/7/06 11:59 Página 13 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A I II III 4-I-84 15-II-84 2-III-84 Figura 7. Paciente con cor pulmonale subagudo que presenta cambios transitorios en la morfología de la onda P en el plano frontal y en el ÂP en ECG sucesivos debidos a un trastorno de conducción auricular transitorio (aberrancia de conducción auricular). 2.2.4.3. Bloqueo interauricular avanzado con activación retrógrada auricular izquierda (Fig. 8) 1. Onda P de duración ≥0,12 s y ± en II, III y VF (Bayés de Luna, 1988). En V1-V3-4 suele ser también ± (Figs. 8 y 9). Este tipo de bloqueo auricular se acompaña muy a menudo, sobre todo en presencia de valvulopatía o miocardiopatía, de arritmia paroxística supraventricular, especialmente flúter atípico, lo que constituye un síndrome arritmológico (Bayés de Luna, 1988) (Fig. 9). 2.3. Implicaciones clínicas La evidencia electrocardiográfica de crecimiento auricular derecho, sobre todo si se basa en criterios del QRS, indica cardiopatía avanzada, pues suele verse en casos de crecimiento auricular importante. Por otra parte, el diagnóstico de crecimiento auricular derecho se acompaña, excepto en la estenosis tricúspide, de un crecimiento ventricular derecho asociado, en general importante. 13 Curso_ECG_2.qxd 20/7/06 11:59 Página 14 A LT E R AC I O N E S D E L AU R I C U L O G R A M A Esquema activación auricular A B C 2 NL 1 2 1 2 1 Asa de P en el plano frontal E Bloqueo interauricular parcial E Bloqueo interauricular avanzado con CRAI E Onda P en la derivación VF x 0,10 x ≥0,12 x ≥0,12 y Bloqueo parcial Bloqueo avanzado –60º >0,12 s I 120º II III +60º VF Figura 8. Arriba: Esquema de la actividad auricular y características del asa de P en el plano frontal y de la onda P en la derivación VF en condiciones normales (A) y en caso de bloqueo interauricular parcial (B) y avanzado con conducción retrógrada auricular izquierda (BIA-CRAI) (C). Abajo: Ejemplo de onda P de bloqueo interauricular avanzado con conducción retrógrada auricular izquierda y forma de medir el ÂP de la primera y segunda parte de la onda P. En la historia natural de los pacientes con valvulopatía, sobre todo estenosis mitral con signos de crecimiento auricular izquierdo, es muy frecuente la aparición de fibrilación auricular. En presencia de onda P ± en II, III y VF como expresión de bloqueo interauricular avanzado con conducción retrógrada auricular izquierda es la regla, especialmente en pacientes con valvulopatía o miocardiopatía, la aparición a corto plazo (menos de un año) de arritmias paroxísticas, sobre todo flúter auricular atípico (Fig. 9). 14 Curso_ECG_2.qxd 20/7/06 11:59 Página 15 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A I II III I aVR V1 V4 II aVL V2 V5 III aVF V3 V6 Figura 9. Flúter atípico (B) en un paciente con bloqueo interauricular avanzado y conducción retrógrada auricular izquierda (A). 15 Curso_ECG_2.qxd 20/7/06 11:59 Página 16 A LT E R AC I O N E S D E L AU R I C U L O G R A M A Los pacientes con valvulopatía aórtica u otras cardiopatías con crecimiento auricular izquierdo tienen menos tendencia a presentar arritmias paroxísticas que las mitrales, de forma que si un paciente con valvulopatía aórtica no muy evolucionada presenta fibrilación auricular hay que descartar la existencia de una valvulopatía mitral acompañante. La existencia de onda P con morfología de crecimiento auricular izquierdo en un paciente coronario se ha considerado por parte de algunos autores un marcador de mal pronóstico. La morfología de P ± en V1 típica de crecimiento auricular izquierdo se puede ver de forma transitoria en el edema agudo de pulmón. Por último, la duración de la onda P <110 ms y una dispersión de la onda P <46 ms son marcadores de mantenimiento del ritmo sinusal en pacientes con fibrilación auricular de menos de tres meses de duración (Dagan, 2004). 1A. Criterios diagnósticos de crecimiento auricular derecho – Morfología qR en V1 en ausencia de infarto 123 a) Morfología del QRS: – Morfología en V1 y en V2 con QRS V2/QRS V1 ≥5 muy específicos >90%. b) Alteraciones de la onda P: P ≥2,5 mm II y/o ≥1,5 mm V1 (poco sensibles). 1B. Criterios diagnósticos de crecimiento auricular izquierdo c) P ≥0,12 s de duración + P ± con componente negativo ≥0,04 segundos en V1 (criterio con especificidad 90% y sensibilidad 60%). 2. Criterio diagnóstico de bloqueo interauricular parcial d) P ≥0,12 s de duración con modo negativo de la onda P en V1 no necesariamente evidente. 3. Bloqueo interauricular avanzado con activación retrógrada auricular izquierda e) P ≥0,12 s con morfología ± en II, III y VF y en general ± de V1 a V3. f) Asociación muy frecuente con arritmias supraventriculares, especialmente flúter atípico. 16 Curso_ECG_2.qxd 20/7/06 11:59 Página 17 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 3. Crecimientos ventriculares 3.1. Introducción El concepto electrocardiográfico de crecimiento de una cavidad engloba tanto la hipertrofia de la pared como su dilatación y, por supuesto, la asociación de ambas. Conviene recordar los siguientes hechos (Bayés de Luna, 1999): 1) Las morfologías de crecimiento ventricular se deben más a hipertrofia que a dilatación, al revés de lo que ocurre en las aurículas. Influye en ellas un cierto grado de fibrosis y de bloqueo homolateral acompañante al ventrículo crecido (Piccolo 1981). 2) Hemos demostrado que a mayor grado de fibrosis intersticial septal existe menos onda “Q” en V5-V6 (Fig. 10), lo cual puede explicar el retardo de activación ventricular izquierda que se ha demostrado que existe en estos casos (Bayés de Luna, Serra Genís 1983). 3) Por otra parte, una misma cardiopatía puede presentar un electrocardiograma más o menos alterado, lo que está más relacionado con el estadio evolutivo que con la gravedad de la lesión (Fig. 11), desempeñando la fibrosis (ver arriba) un papel importante en la presencia o no de onda “q” durante la evolución del proceso. A V1 B V6 V1 V6 Figura 10. Dos pacientes valvulares aórticos: A) menos evolucionado con onda “q” en V6 y T positiva todavía y B) más evolucionado sin onda “q” y con ST-T negativa. 17 Curso_ECG_2.qxd 20/7/06 11:59 Página 18 C R E C I M I E N TO S V E N T R I C U L A R E S 1962 1970 1978 1963 1972 1979 A B Figura 11. En las Figs. A y B se muestran dos ejemplos típicos de imágenes evolutivas: una estenosis aórtica importante (A) y una insuficiencia aórtica importante (B). Obsérvese cómo, a medida que evoluciona el ECG, la onda T primero se aplana y después el ST-T se opone al QRS. La onda Q tiende a disminuir y puede llegar a desaparecer, lo cual ocurre menos a menudo en la insuficiencia aórtica. Sin embargo, queremos recalcar que no siempre sucede así y que hay casos de estenosis aórtica evolucionada en que persiste una pequeña onda “q” y de insuficiencia aórtica evolucionada sin onda “q”. Ello se relaciona con el grado de fibrosis septal. 4) Además, hay que tener en cuenta qué grados ligeros o incluso moderados de crecimiento de cualquiera de los dos ventrículos, sobre todo el derecho o de ambos a la vez, pueden no alterar el ECG. 5) Clásicamente (Cabrera, 1952) se consideró que las cardiopatías con sobrecarga diastólica (por ejemplo comunicación interauricular en el lado derecho e insuficiencia aórtica en el izquierdo) tenían una repercusión electrocardiográfica distinta (rSR’ en V1 para la comunicación interauricular [CIA] y qR con T positiva en V6 para la insuficiencia aórtica), que las cardiopatías con sobrecarga sistólica (R alta con ST descendido y T negativa en V1 para la estenosis pulmonar, y R alta con ST descendido y T negativa en V5-6 para la estenosis aórtica). Hoy día se sabe que cualquiera que sea la cardiopatía subyacente, la imagen electrocardiográfica de crecimiento ventricular izquierdo con sobrecarga diastólica (morfología qR alta, a veces con una onda q evidente sobre todo en la insuficiencia aórtica con onda T alta y bastante picu18 Curso_ECG_2.qxd 20/7/06 11:59 Página 19 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A da), suele corresponder a fases ligeras o moderadas de crecimiento del ventrículo izquierdo, y la imagen de crecimiento ventricular izquierdo con sobrecarga sistólica (morfología R sola, a veces con q minúscula, con ST-T negativos y T asimétrica, morfología de sobrecarga [strain]), suele encontrarse en las fases avanzadas de crecimiento ventricular izquierdo de cualquier etiología (Fig. 11). En cuanto al ventrículo derecho, también tiene un significado parecido, pues la imagen de sobrecarga diastólica (rsr’ con T negativa en V1) representa una afectación menos grave y evolucionada que la de sobrecarga sistólica (R sola y ST-T negativa). 6) Por otra parte, todos los tipos de cardiopatía que cursan con crecimiento ventricular derecho (congénitas, valvulares y cor pulmonale) pueden presentar distintas formas de crecimiento ventricular derecho, especialmente desde poca a mucha onda R en V1, en general, respecto al tipo y grado evolutivo de su proceso (Fig. 12). 7) En las Figs. 13-15 se recogen los cambios que se producen en las asas de QRS en el crecimiento ventricular derecho (Figs. 13 y 14) e izquierdo (Fig. 15) como consecuencia del aumento de masa ventricular asociada a cierto retraso de conducción añadido. El retraso de conducción es especialmente importante en el crecimiento ventricular derecho para explicar la morfología del ECG, ya que en este caso el aumento de la masa ventricular raramente supera a la del ventrículo izquierdo. Por ello, el retraso de la activación ventricular derecha que llevan los vectores últimos de despolarización a la derecha se debe más que al aumento de masa al retraso de conducción ventricular derecho añadido. En las Figs. 13 y 14 podemos observar las formas típicas de las A B 1 2 C 3 4 5 6 Figura 12. Ejemplos de cómo en caso de crecimiento ventricular derecho de distintas etiologías A) valvulares (paciente mitrotricuspídeo), B) cor pulmonale (paciente con cor pulmonale subagudo), y C) congénitos (pacientes con estenosis pulmonar) pueden verse morfologías en V1 con poca onda R (1, 3 y 5) o con R exclusiva (2, 4 y 6) de acuerdo con el grado de evolución de la enfermedad. 19 Curso_ECG_2.qxd 20/7/06 11:59 Página 20 C R E C I M I E N TO S V E N T R I C U L A R E S asas de QRS y T en el crecimiento ventricular derecho, y en la Fig. 15 en el crecimiento ventricular izquierdo, así como su correlación con las morfologías electrocardiográficas. 8) La superioridad del ecocardiograma sobre la electrocardiografía para diagnosticar crecimientos ventriculares, sobre todo el izquierdo, tanto hipertrofia de la masa ventricular como dilatación de la cavidad, es evidente (sensibilidad mucho más elevada con similar especificidad). Sin embargo, el diagnóstico de crecimiento ventricular por electrocardiografía tiene A B I PF I V1 I VF V6 V6 D I VF VF PH C V1 V6 V1 V6 V1 V2 V2 VF V2 Figura 13. Obsérvense cuatro tipos de asa característicos de crecimiento ventricular derecho. A) Plano frontal (PF) normal, plano horizontal (PH) con asa más anterior; se ve a menudo en pacientes con estenosis mitral y corresponde a crecimiento ventricular derecho ligero; B) plano frontal con vector máximo derecho (ÂQRS tipo SI RII RIII) y plano horizontal con asa toda anterior y con rotación horaria. Corresponde a crecimiento ventricular derecho importante y se ve especialmente en pacientes con cardiopatías congénitas o gran hipertensión pulmonar. La morfología del asa de QRS en fases menos evolucionadas a menudo es algo distinta, con rotación en ocho, por ejemplo (ver Fig. 14 II); C) plano frontal con vector máximo derecho (ÂQRS tipo SI RII RIII) y plano horizontal con gran parte del asa posterior y a la derecha. Suele corresponder a crecimiento ventricular derecho moderado-grave y se observa a menudo en pacientes con cor pulmonale crónico; D) asa en el plano horizontal parecida a la anterior, pero con morfología S1, SII, SIII en el plano frontal; suele verse en crecimiento ventricular derecho moderado a grave. 20 Curso_ECG_2.qxd 20/7/06 11:59 Página 21 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A más valor pronóstico que la comprobación de crecimiento por ecocardiografía para predecir la evolución de la cardiopatía. 9) Nos referiremos aquí a los casos aislados de crecimiento ventricular. El diagnóstico de crecimiento ventricular derecho e izquierdo asociado a bloqueo ventricular se comentará brevemente más adelante. Normal V6 V1 Asa posterior Asa anterior V6 IV I V6 V1 V1 V6 V6 V II V1 V1 V6 III V1 Figura 14. En el crecimiento ventricular derecho con repercusión electrocardiográfica, el asa horizontal del QRS se dirige siempre a la derecha, pero a veces hacia delante y otras hacia atrás. Cuando el asa se dirige hacia delante puede adquirir distintas formas (de I a III se pueden ver algunos ejemplos), que representan cada vez grados más importantes de crecimiento ventricular derecho. Un mismo paciente puede pasar de una a otra forma en el curso evolutivo de su enfermedad. En general, las cardiopatías con crecimiento ventricular derecho leve o moderado dan morfologías tipo I o II, y aquéllas con crecimiento ventricular derecho importante, tipo III. Si el asa se va hacia atrás se adquieren formas parecidas a las de tipo IV o V, viéndose QS (IV) o rS o rSr’ (V) en V1, pero siempre con S importante en V6. 21 Curso_ECG_2.qxd 20/7/06 11:59 Página 22 C R E C I M I E N TO S V E N T R I C U L A R E S A B C D E VF VF VF VF VF PF V6 PH V6 V1 V6 V1 V6 V1 V6 V1 V1 Figura 15. Tipos de asa de QRS que se observan en el crecimiento ventricular izquierdo. A) Fase moderada de crecimiento ventricular izquierdo no muy evolucionada. El asa se dirige primero a la derecha, lo que explica la onda q inicial en V5-6 y el asa de T está dirigida a la izquierda (T+ en V5-6) (imagen de sobrecarga diastólica); B) y C) dos ejemplos de asas en caso de crecimiento ventricular izquierdo muy evolucionado con inicio del QRS a la izquierda y asa de T opuesta a QRS (imagen de sobrecarga sistólica – strain–); D) y E) ejemplo de asas en dos tipos de crecimiento ventricular izquierdo de la miocardiopatía hipertrófica, con “q” patológica (D) y con gran onda T negativa (miocardiopatía hipertrófica apical) (E) (ver texto). 3.2. Criterios diagnósticos 3.2.1. Crecimiento ventricular derecho En el crecimiento ventricular derecho, el asa de QRS y su vector máximo suele dirigirse a la derecha, a veces atrás y otras delante (Figs. 13 y 14). Ello explica, debido a la correlación entre asas y hemicampos, las distintas morfologías electrocardiográficas que se ven en dicho crecimiento que, a su vez, son la base para definir los correspondientes criterios diagnósticos. 3.2.1.1. Criterios diagnósticos En la Tabla 2 se exponen los criterios electrocardiográficos empleados con mayor frecuencia para el diagnóstico de crecimiento ventricular derecho, con su sensibilidad y especificidad. A continuación comentaremos algunas características de los más importantes, así como las alteraciones electrocardiográficas debidas a sobrecarga aguda de cavidades derechas. 22 Curso_ECG_2.qxd 20/7/06 11:59 Página 23 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A Tabla 2. Criterios electrocardiográficos de crecimiento ventricular derecho. Sensibilidad (%) Especificidad (%) 1. V1 Criterio R/S V1 ≥1 RV1 ≥7 mm qR en V1 S en V1 <2 mm TDI en V1 ≥0,35 s 6 2 5 6 8 98 99 99 98 98 2. R/S V5-V6 ≤1 R/S V5-V6 ≤1 RV5-V6 <5 mm SV5-S6 ≥7 mm 16 13 26 93 87 90 3. V1 + V6 RV1 + SV5-V6 >10,5 mm 18 94 4. ÂQRS ÂQRS ≥+110º SI, SII, SIII 15 24 96 87 MORFOLOGÍAS ELECTROCARDIOGRÁFICAS 1. Morfología de V1 (Tabla 2). La morfología con R alta en V1 es muy específica, pero muy poco sensible (<10%), de crecimiento ventricular derecho, pues no es frecuente que el asa del QRS, excepto en algunas cardiopatías congénitas evolucionadas y graves y en la hipertensión pulmonar importante y evolucionada del tipo que sea, se dirija hacia delante y la derecha –tipo III de la Fig. 14. Por otra parte hay que tener en cuenta que se pueden presentar ondas R predominantes en V1, en el bloqueo de rama derecha típico y atípico, el crecimiento ventricular derecho y biventricular, algunos tipos de preexcitación, el infarto lateral, algunas cardiopatías genéticamente inducidas y ciertas variantes de la normalidad. En la Tabla 3 se exponen todas estas causas de R exclusiva o dominante en V1 y las claves más importantes de su diagnóstico diferencial. 2. Morfología de V6. R/S ≤1 o SV5-6 ≥7 mm. Son signos algo más sensibles, pero algo menos específicos que pueden ir acompañados en V1 de morfologías tipo R predominante o tipo rS o incluso QS (IV y V) de la Fig. 14 (Tabla 2). 3. Eje eléctrico del QRS: ÂQRS Puede haber tres tipos de ÂQRS: a) ÂQRS a la derecha. En general más allá de +90º +100º. Debe descartarse el hemibloqueo inferoposterior, el corazón muy vertical y el infarto lateral. Es muy específico (>95%), pero poco sensible (<20%). 23 24 <0,12 s De <0,12 s a ≥0,12 s <0,12 s 5. Síndrome de Wolf-Parkinson-White 6. Infarto lateral P a menudo normal P normal–PR corto A menudo alta y picuda Normal A veces ≥0,12 s - Síndrome de Brugada 4. Crecimiento ventricular derecho o biventricular A menudo patológica A menudo ≥0,12 s - DAVD (displasia arritmogénica del ventrículo derecho) A menudo picuda y/o ± A menudo ≥0,12 s - Enfermedad de Ebstein 3. Bloqueo rama derecha atípico 3er grado 11:59 1er grado Normal De <0,12 s a ≥0,12 s 20/7/06 2. Bloqueo rama derecha clásico Normal <0,12 s Morfologías parecidas pueden verse en el Síndrome de Brugada Normal - Anormalidad torácica (pectus excavatus) 4 EID P – en 2o EID P + o ± en 4o EID Morfología “p” en V1 <0,12 s 2 EID <0,12 s Morfología en V1 con "R" dominante o R' (r') Anchura "QRS" - Variante normal. Hipermaduros. Menos fibras de Purkinje en la zona anteroseptal - Mala colocación de electrodos 1. No cardiopatía Situación clínica Tabla 3. Morfologías con R dominante o (r’) R’ en V1. Curso_ECG_2.qxd Página 24 C R E C I M I E N TO S V E N T R I C U L A R E S Curso_ECG_2.qxd 20/7/06 11:59 Página 25 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A b) SI SII SIII. Debe descartarse que se explique por cambio posicional o por simple bloqueo periférico ventricular derecho (sensibilidad 24% y especificidad 87%). c) Por otra parte, recordemos que a menudo el ÂQRS es normal en caso de crecimiento ventricular derecho. La asociación de más de uno de los criterios expuestos en la Tabla 2 aumenta las posibilidades diagnósticas, siendo especialmente sospechoso de crecimiento ventricular derecho la presencia de S evidente en V6 con ÂQRS derecho o SI SII SIII, sobre todo si hay R alta o RS en V1 y una onda P que sugiere crecimiento auricular derecho. Sin embargo, queremos recalcar que a menudo el ECG es prácticamente normal en casos de crecimiento ventricular derecho evidente. Esto ocurre sobre todo en pacientes con cor pulmonale crónico. Por último queremos recordar que en una misma cardiopatía la imagen electrocardiográfica varía de acuerdo a la evolución de la enfermedad, pudiendo en V1 pasar tanto en pacientes valvulares como en congénitos, o con cor pulmonale crónico en V1 de rS a R alta. Sin embargo, las ondas R más altas corresponden a pacientes con gran hipertensión pulmonar del tipo que sea (Fig. 12). CARACTERÍSTICAS ELECTROCARDIOGRÁFICAS DEL CRECIMIENTO VENTRICULAR DERECHO EN LAS DISTINTAS CARDIOPATÍAS En la Fig. 16 vemos un ejemplo típico de crecimiento ventricular derecho en un paciente con estenosis mitral y repercusión tricuspídea en fibrilación auricular, y en las Figs. 17-20 ejemplos de los tipos de cardiopatías congénitas que más frecuentemente presentan crecimiento ventricular derecho, a saber, estenosis pulmonar grave (R en V1 V2-3 con T negativa) (Fig. 17), tetralogía de Fallot (R con T negativa en V1 y rS con T positiva en V2) (Fig. 18), síndrome de Eisenmenger (R con T negativa en V1 y RS (rS) con T negativa en V2-V3) (Fig. 19) y comunicación interauricular tipo ostium secundum (Fig. 20 A) y ostium primum (Fig. 20 B). Por último, en las Figs. 21 y 22 vemos dos ejemplos de crecimiento ventricular derecho del cor pulmonale crónico con ÂQRS derecho (Fig. 21) y tipo SI SII SIII (Fig. 22 A). Esta morfología puede encontrarse en ocasiones como variante de la normalidad (ver antes y Fig. 22 B). 25 Curso_ECG_2.qxd 20/7/06 11:59 Página 26 C R E C I M I E N TO S V E N T R I C U L A R E S I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 16. Paciente mitrotricuspídeo avanzado con hipertensión pulmonar importante y fibrilación auricular. Obsérvese los siguientes signos sugestivos de crecimiento ventricular derecho importante: 1) ÂQRS derecho; 2) qr en V1 con rS profunda en V2; 3) R < S en V6. I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 17. Paciente de ocho años con estenosis pulmonar valvular importante, con gradiente superior a 100 mmHg. Presenta una típica imagen de crecimiento ventricular derecho con sobrecarga sistólica tipo barrera (R única con ST-T negativo en V1 y V2). La onda P alta y picuda sugiere crecimiento auricular derecho. 26 Curso_ECG_2.qxd 20/7/06 11:59 Página 27 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 18. Paciente de tres años con tetralogía de Fallot típica. El ECG corresponde al tipo llamado por la Escuela Mexicana de crecimiento ventricular derecho con sobrecarga sistólica tipo adaptación (R única en V1, con ST-T negativos y rS en V2 con T positiva). La onda P es típica congenitale (ÂP algo izquierdo y muy picuda en V1-V2). I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 19. ECG (todo el registro a medio voltaje) de un paciente de 15 años con síndrome de Eisenmenger muy evolucionado debido a un conducto arterioso con cortocircuito invertido y gran hipertensión pulmonar. Véase la onda R exclusiva en V1, con T negativa y la morfología RS en V2 con T negativa profunda, lo que lo distingue de la tetralogía de Fallot que, en general, también presenta rS o RS, pero con T positiva. 27 Curso_ECG_2.qxd 20/7/06 11:59 Página 28 C R E C I M I E N TO S V E N T R I C U L A R E S I VR II VL V1 V4 I VR V1 V4 II VL V2 V5 III VF V3 V6 V2 III V5 V3 VF V6 PF PH Figura 20. A) ECG y VCG de un paciente con comunicación interauricular tipo PFostium secundum. Obsérvese PH la morfología rsR´en V1 con T negativa y la correlación con la morfología del asa del VCG en el plano horizontal. B) Imagen típica de comunicación interauricular tipo ostium primum. Obsérvese la morfología rsR´en V1 con el ÂQRS en el plano frontal hiperdesviado a la izquierda y la correlación con la del VCG (abajo). I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 21. ECG típico de cor pulmonale crónico con hipertensión importante e hipoxia. Se aprecian signos de crecimiento de cavidades derechas, como la onda P alta y picuda en II, III y VF, y de morfología ± en V1-2 con cambio brusco de polaridad, ÂQRS muy derecho, S>R en V6, “qr” de pequeño voltaje en V1 y rS en V2. La presencia de signos de crecimiento evidente de la aurícula derecha, junto con la morfología SI, RII, RIII es uno de los marcadores electrocardiográficos de crecimiento ventricular derecho más evidentes. 28 Curso_ECG_2.qxd 20/7/06 11:59 Página 29 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A A B I II III VR VL VF V1 V2 V3 V4 V5 V6 I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 22. Dos ejemplos de ÂQRS de tipo SI, SII, SIII, A) con franca alteración del auriculograma que ayuda a pensar que la imagen SI, SII, SIII se debe a crecimiento ventricular derecho, pues la morfología de tipo SI, SII, SIII puede ser también una variante de normalidad. B). Así pues el diagnóstico de crecimiento ventricular derecho no puede a veces establecerse sólo por la morfología del QRS y lo apoya la presencia de una clara alteración del auriculograma y/o de la repolarización. SIGNOS ELECTROCARDIOGRÁFICOS DE SOBRECARGA AGUDA DERECHA Los signos electrocardiográficos más indicativos de sobrecarga aguda derecha (descompensación de un cor pulmonale o embolia pulmonar) son los siguientes: a) Cambio en el ÂQRS (más de 30º a la derecha de su posición habitual). b) Aparición de T aplanada o negativa en precordiales derechas (Fig. 23). c) Morfología SI QIII TIII negativa en el plano frontal y RS o rS en V6 (Fig. 24). d) Aparición de alteraciones del segmento ST (Fig. 25). e) Aparición de morfología de bloqueo de rama derecha (Fig. 25). Los tres últimos se ven especialmente en la embolia pulmonar importante (Figs. 24 y 25). 29 Curso_ECG_2.qxd 20/7/06 11:59 Página 30 C R E C I M I E N TO S V E N T R I C U L A R E S I II III V1 V2 V3 A 20-II-82 B 20-X-82 C 15-X-82 Figura 23. Ejemplo de cambios electrocardiográficos transitorios durante la descompensación de un paciente con cor pulmonale evolucionado (B). A) y C) ECG antes y después de la descompensación. Obsérvese cómo aparece de forma transitoria la onda P picuda y unos grandes cambios en la onda T en precordiales derechas. A B I VR V1 V4 I VR V1 V4 II VL V2 V5 II VL V2 V5 III VF V3 V6 III VF V3 V6 Figura 24. Paciente de 59 años que presentó en el curso de una embolia pulmonar una imagen típica de McGinn y White (SI, QIII, TIII negativa), (A) que cedió al solucionarse el cuadro (B). 30 Curso_ECG_2.qxd 20/7/06 11:59 Página 31 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A A B I VR V1 V4 II VL V2 V5 III VF V3 V6 I VR V1 V4 II VL V2 V5 III VF V3 V6 C Figura 25. A) ECG preoperatorio de una paciente de 58 años sin cardiopatía. B) En el curso del postoperatorio presentó embolia pulmonar masiva con ECG que mostraba ÂQRS muy derecho, bloqueo de rama derecha avanzado con ST elevado y taquicardia sinusal. C) La enferma murió a los pocos minutos (ECG en ritmo agónico). 31 Curso_ECG_2.qxd 20/7/06 11:59 Página 32 C R E C I M I E N TO S V E N T R I C U L A R E S SIGNOS ELECTROCARDIOGRÁFICOS DE CRECIMIENTO VENTRICULAR DERECHO EN EL LACTANTE a) R única en V1 con T positiva y/o voltaje de la R >20 mm. b) S en V6 >11 mm. c) T positiva en V1 y V6 (después del cuarto día de vida). d) Onda P de voltaje >4 mm. 3.2.2. Crecimiento ventricular izquierdo En general, en el crecimiento ventricular izquierdo, el asa de QRS y su vector máximo aumentan de voltaje y se dirige más hacia atrás de lo normal (Fig. 15). Esto explica, debido a la correlación asa-hemicampo, que en las precordiales derechas predomine la negatividad. En alguna ocasión, en relación probablemente con una levorrotación importante del corazón o con hipertrofia de la zona septal ventricular izquierda, más que de la zona de la pared libre, tal como ocurre en los casos de miocardiopatía hipertrófica apical, el vector máximo no está dirigido hacia atrás (se sitúa alrededor de 0º). Esto lleva consigo que se aprecie R alta incluso en V2 (Fig. 15 E). 3.2.2.1. Criterios diagnósticos DISTINTOS CRITERIOS DIAGNÓSTICOS (TABLA 4) Los criterios diagnósticos que presentan una buena especificidad (≥90%) con una aceptable sensibilidad (alrededor del 50%) son los relacionados con el criterio Tabla 4. Criterios electrocardiográficos de crecimiento ventricular izquierdo. Criterios de voltaje 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. RI + SIII >25 mm RVL >11 mm RVL >7,5 mm SV1 + RV5-6 >35 mm (Sokolow-Lyon) RV5-6 >26 mm Criterio de voltaje de Cornell: RVL + SV3 >28 mm (varones) o 20 mm (mujeres) Producto del criterio de voltaje de Cornell x duración del QRS >2400 mm/ms La onda S + la onda R de más voltaje en V1-V6 >45 mm Puntuación de Romhilt – Estes >4 puntos Puntuación de Romhilt – Estes >5 puntos 32 Sensibilidad (%) Especificidad (%) 10,6 11 22 22 25 100 100 96,5 100 98 42 96 51 45 55 35 94 93 85 95 Curso_ECG_2.qxd 20/7/06 11:59 Página 33 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A de Cornell, el sistema de puntuación de Rohmilt y Estes y la suma de S + R de mayor voltaje en precordiales >45 mm (Tabla 5). Existen además otros criterios de voltaje, como el de Sokolow, más específicos (>100%, pero mucho menos sensibles, <20%) (Sheridan, 1998). Tabla 5. Puntuación de Romhilt-Estes. Hay crecimiento ventricular izquierdo si se obtienen 5 puntos o más. El crecimiento ventricular izquierdo es probable si la puntuación es de 4. Criterios basados en modificaciones del QRS 1. Criterios de voltaje: R o S en el PF ≥30 mm S en V1-V2 ≥30 mm R V5-6 ≥30 mm 2. ÂQRS a –30º o más a la izquierda 3. Tiempo de deflexión intrinsicoide en V5-V6 ≥0,05 s 4. Duración del QRS ≥0,09 s Puntuación 3 puntos Criterios basados en cambios del ST-T 1. Vector ST-T opuesto al QRS en ausencia de digital 2. Vector ST-T opuesto al QRS en presencia de digital Puntuación 3 puntos 1 punto Criterios basados en alteraciones de la onda P 1. Onda P negativa terminal en V1 ≥1 mm de profundidad y de 0,04 s de duración Puntuación 3 puntos 2 puntos 1 punto 1 punto LIMITACIONES A ESTOS CRITERIOS DIAGNÓSTICOS Hay bastantes limitaciones que se deben, en parte, a que su valor es distinto según el grupo de población en que se aplica. De acuerdo con el teorema de Bayes, la posibilidad de que un ECG positivo para crecimiento ventricular izquierdo corresponda a crecimiento ventricular izquierdo auténtico es muy elevada en un grupo de hipertensos graves y baja en un adulto normotenso asintomático. El diagnóstico correcto de crecimiento ventricular izquierdo no es fácil debido a problemas metodológicos, constitucionales, etc. De hecho, con frecuencia, se hacen diagnósticos falsos positivos y negativos de crecimiento ventricular izquierdo, aunque se ve más a menudo un ECG aparentemente normal en presencia de crecimiento ventricular izquierdo que un ECG característico de crecimiento ventricular izquierdo en una persona sana. ECG EN LAS VALVULOPATÍAS CON HIPERTROFIA VENTRICULAR IZQUIERDA En la Fig. 11 hemos visto ejemplos evolutivos de pacientes con estenosis e insuficiencia aórtica, y en las Figs. 26 y 27 se exponen ejemplos típicos de insuficiencia aórtica no evolucionada, pero severa (qR con T alta en V5-V6) y de 33 Curso_ECG_2.qxd 20/7/06 11:59 Página 34 C R E C I M I E N TO S V E N T R I C U L A R E S I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 26. ECG típico de un joven de 22 años, con insuficiencia aórtica importante, pero poco evolucionada. Corresponde a crecimiento ventricular izquierdo moderado no evolucionado que cumple los criterios diagnósticos de acuerdo a la puntuación de Romhilt-Estes expuestos en este capítulo (Tabla 5). Efectivamente, la R de V5-V6 ≥30 mm: 3 puntos; tiempo de deflexión intrinsecoide (TDI) = 0,07 s: 1 punto; duración del QRS = 0,10 s: 1 punto; total = 5 puntos. I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 27. ECG típico de un hombre de 47 años con estenosis aórtica importante evolucionada. El crecimiento ventricular izquierdo es típico. R en V4-V5 >30 mm: 3 puntos; ST-T opuesto a la R en V4-V6: 3 puntos; TDI de 0,055 s: 1 punto; total = 7 puntos. 34 Curso_ECG_2.qxd 20/7/06 11:59 Página 35 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A estenosis aórtica avanzada (falta de “q” e imagen de sobrecarga (strain) -ST-T negativa en V5-V6). Recordemos que tanto la estenosis como la insuficiencia aórtica evolucionada y grave pueden presentar formas parecidas de la repolarización, pero en la insuficiencia aórtica suele haber más onda “q” (Figs. 11 A y B). Por otra parte, la presencia de grandes alteraciones de la onda P (P ± en V1 y/o de duración >120 ms), y sobre todo la fibrilación auricular, hacen pensar que existe una valvulopatía mitral asociada a la aórtica. ECG EN LAS MIOCARDIOPATÍAS CON HVI Y/O DILATACIÓN Queremos recordar que en la miocardiopatía hipertrófica el ECG puede presentar alteraciones muy típicas, como es el caso de la miocardiopatía hipertrófica apical (Fig. 28 A), o cuando aparecen “q” patológicas (Fig. 28 B), pero a menudo A I II III B VR VL VF V1 V2 V3 V4 I VR V1 V4 X II VL V2 V5 Y III VF V3 V6 V5 Z V6 Figura 28. A) ECG de un paciente asintomático al que se había diagnosticado una cardiopatía isquémica a causa de las ondas T negativas. Presenta una imagen muy característica de la miocardiopatía hipertrófica, con una afectación fundamentalmente apical (RS en V2 y R alta sin “q” en V5, V6, y T negativa y muy profunda en diversas derivaciones). B) ECG típico, aunque no se observa con mucha frecuencia, de miocardiopatía hipertrófica obstructiva en un paciente de 25 años. No hay criterios de voltaje de crecimiento ventricular izquierdo, pero la onda Q profunda y limpia en V5 y V6, el QS en precordiales intermedias junto con la onda “q” del plano frontal y la ausencia de alteraciones de la repolarización en las derivaciones con una onda Q patológica hicieron sospechar el diagnóstico, que fue confirmado por la ecocardiografía. 35 Curso_ECG_2.qxd 20/7/06 11:59 Página 36 C R E C I M I E N TO S V E N T R I C U L A R E S el ECG es indistinguible de una valvulopatía aórtica evolucionada y es necesaria la clínica, la auscultación y las técnicas de imagen para realizar el diagnóstico diferencial (Fig. 29). Por otra parte, la miocardiopatía dilatada origina una ECG característico con bajo voltaje en el plano frontal y grandes voltajes en precordia- I VR V1 V4 II VL V2 V5 III VF V3 V6 Figura 29. Arriba: ECG con imagen típica de crecimiento ventricular izquierdo importante, sin que nos oriente sobre el tipo de cardiopatía del cual se trata. Abajo: la RMN derecha manifiesta una hipertrofia asimétrica septal (asterisco) y nos proporciona el diagnóstico de miocardiopatía hipertrófica. A la izquierda, una imagen de RMN normal con fines comparativos. Hemos de considerar que mediante ecocardiografía podríamos llegar también al mismo diagnóstico. 36 Curso_ECG_2.qxd 20/7/06 11:59 Página 37 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A les derechas, trastornos de conducción intraventricular de mayor o menor grado, onda P anómala con taquicardia sinusal o a menudo fibrilación auricular (Fig. 30). ECG EN LA HIPERTENSIÓN ARTERIAL El diagnóstico de crecimiento ventricular izquierdo en la hipertensión arterial es aún más difícil que en otras cardiopatías. Los criterios más sensibles son los de la Tabla 4 y la suma del voltaje total del QRS en las 12 derivaciones >120 mm (Hernández Padial, 1991). Sin embargo, este último tiene una especificidad baja. Con cierta frecuencia, el ECG alterado del hipertenso mejora al reducirse la hipertrofia ventricular izquierda con el tratamiento correcto (Fig. 31). ECG EN LOS PACIENTES CORONARIOS CON HIV Los pacientes coronarios pueden presentar signos electrocardiográficos de HVI cuando existe hipertensión arterial o miocardiopatía asociada. En estos casos pueden verse ondas Q de necrosis. Es importante constatar que la insuficiencia coronaria puede modificar, debido a una alteración primaria de la repolarización consecuencia de la isquemia, la alteración secundaria de la misma debida a la hipertrofia (strain), originando una imagen que llamamos alteración mixta de la repolarización (Fig. 32). I VR V1 V4 II VL V2 V5 III VF V3 V6 Figura 30. ECG de un paciente con miocardiopatía dilatada idiopática (véase ecocardiograma a la derecha). Obsérvese la taquicardia sinusal, la onda P patológica picuda y/o ± en precordiales derechas, el bajo voltaje del QRS en el plano frontal y los grandes voltajes en precordiales derechas (V1-V3). 37 Curso_ECG_2.qxd 20/7/06 11:59 Página 38 C R E C I M I E N TO S V E N T R I C U L A R E S A A I II III VR VL VF V1 V2 V3 V4 V5 V6 II III VR VL VF V2 V3 V4 V5 V6 B B I V1 Figura 31. A) ECG de un paciente hipertenso con crecimiento ventricular izquierdo por ecocardiografía y ECG con imagen de sobrecarga sistólica. B) Después de varios meses de tratamiento correcto se redujo la masa ventricular y el ECG se normalizó. A B C + = Figura 32. ECG típico de un hombre de 47 años con estenosis aórtica importante evolucionada. El crecimiento ventricular izquierdo es típico. R en V4-V5 >30 mm: 3 puntos; ST-T opuesto a la R en V4-V6: 3 puntos; TDI de 0,055 s: 1 punto; total = 7 puntos. 38 Curso_ECG_2.qxd 20/7/06 11:59 Página 39 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 3.2.3. Crecimiento biventricular El diagnóstico electrocardiográfico de crecimiento biventricular es aún más difícil que el diagnóstico aislado del crecimiento de un ventrículo, pues a menudo las fuerzas crecidas opuestas de ambos ventrículos se contrarrestan, o bien el notable predominio del crecimiento de un ventrículo, en general el izquierdo, enmascara por completo el crecimiento del otro. Los siguientes criterios electrocardiográficos sugieren crecimiento biventricular (Figs. 33 y 34): I VR V1 V4 II VL V2 V5 III VF V3 V6 Figura 33. Paciente con valvulopatía mitroaorticotricuspídea y signos electrocardiográficos de crecimiento ventricular derecho e izquierdo y crecimiento auricular izquierdo. El ecocardiograma confirmó estos hallazgos. 39 Curso_ECG_2.qxd 20/7/06 11:59 Página 40 C R E C I M I E N TO S V E N T R I C U L A R E S I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 34. Ejemplo de crecimiento biventricular.Varón de 42 años en fibrilación auricular con doble lesión mitral y tricuspídea. Obsérvese el eje ÂQRS SI, SII, SIII, bajo voltaje de QRS en V1, pero con RS y S profunda en V2 y la morfología Rs con R de alto voltaje en V6 (véase texto). 1. R alta en V5, V6 con ÂQRS derecho ( ≥90º). Hay que descartar la presencia de hemibloqueo de la división inferoposterior asociado a crecimiento ventricular izquierdo, o bien que se trate de un individuo muy asténico. 2. R alta en V5, V6 con R alta o rSR’ en V1, V2. La onda P puede ser de crecimiento biauricular. Hay que descartar la preexcitación tipo WPW (Fig. 33). 3. Complejo QRS dentro de límites normales, pero con alteración importante de la repolarización (T negativa y descenso del ST), sobre todo si el paciente está en fibrilación auricular. 4. RS en V1 en general de poco voltaje, con S profunda en V2 y R dominante en V5 V6, junto con ÂQRS derecho en el plano frontal o morfología tipo SI, SII, SIII (Fig. 34). 5. Grandes voltajes en precordiales intermedias, con R altas en precordiales izquierdas (es frecuente en la comunicación interventricular). Se explica por la existencia de un asa de QRS ancha y redondeada en el plano horizontal, con parte final dirigida a la derecha. 3.3. Implicaciones clínicas Las cardiopatías que presentan más crecimiento ventricular derecho son las valvulopatías mitrales con repercusión derecha, las congénitas, como estenosis pulmonar o hipertensión pulmonar secundaria a cortocircuitos izquierda derecha tipo comunicación interventricular, aunque en este caso suele haber signos 40 Curso_ECG_2.qxd 20/7/06 11:59 Página 41 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A de crecimiento biventricular, el cor pulmonale y algunas miocardiopatías, como la displasia arritmogénica del ventrículo derecho. El diagnóstico de crecimiento ventricular derecho pasa a menudo inadvertido porque la sensibilidad de los criterios diagnósticos es, como hemos indicado, muy baja. Cuando éstos existen se trata, en general, de casos con crecimiento ventricular derecho importante. Es por ello que estos signos (por ejemplo R alta en V1) señalan un crecimiento ventricular derecho muy importante. El pronóstico de los pacientes con R alta en V1 suele ser bueno en los casos en que el QRS es ancho (bloqueo de rama derecha y WPW), mientras que es potencialmente peor cuando es estrecho (crecimiento ventricular derecho e infarto lateral). Por otra parte, en el cor pulmonale crónico son signos electrocardiográficos de mal pronóstico (junto con la hipoxia importante) la onda P con signos evidentes de crecimiento auricular derecho y la morfología tipo SI SII SIII (Incalzi, 1999). Por otra parte, presentan crecimiento ventricular izquierdo los pacientes hipertensos, los coronarios, sobre todo con miocardiopatía isquémica, los valvulares aórticos y con insuficiencia mitral, las miocardiopatías dilatadas e hipertróficas y algunas cardiopatías congénitas, como la estenosis aórtica y la coartación aórtica. En general, los pacientes hipertensos, coronarios (especialmente avanzados o candidatos a cirugía cardiaca), que presentan alteraciones de la repolarización, sobre todo descenso del ST y/o criterios sugestivos de crecimiento ventricular izquierdo tienen peor pronóstico a medio y largo plazo. Es más fácil encontrar pacientes con crecimiento ventricular izquierdo que presenten un ECG sin signos claros de esta afección, que pacientes con ECG característico de crecimiento ventricular izquierdo sin evidencia ecocardiográfica. La ecografía es más sensible que la ECG para diagnosticar HVI. Sin embargo, como ya hemos comentado (ver pág. 20), el diagnóstico de HVI por ECG tiene más valor como marcador pronóstico. 41 Curso_ECG_2.qxd 20/7/06 11:59 Página 43 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 4. Bloqueos ventriculares 4.1. Introducción El trastorno de la conducción del estímulo o bloqueo ventricular puede producirse en el lado derecho (Tabla 6) o en el izquierdo (Tabla 7) y puede afectar a todo el ventrículo (bloqueo global) o a una parte (parcelar o divisional). Tabla 6. Bloqueo ventricular derecho. A. Bloqueo de rama derecha 1. Localización: – En general en el tronco de la rama derecha y no tan a menudo a nivel hisiano o distal (afectación periférica y difusa de Purkinje) 2. Grado: – Avanzado (tercer grado): Corresponde al tipo III de la Escuela Mexicana (QRS ≥0,12 s) – Parcial (primer grado): corresponde a los tipos I y II de la Escuela Mexicana (QRS <0,12 s) – De segundo grado: corresponde a un tipo especial de aberrancia ventricular. Es poco frecuente B. Bloqueo parcelar del ventrículo derecho (ver Apartado 4.2.5) Tabla 7. Bloqueo ventricular izquierdo. A. Bloqueo de rama izquierda 1. Localización: – Proximal (a la altura del tronco de la rama izquierda y raramente a nivel hisiano) o distal (afectación periférica y difusa de Purkinje) 2. Grado: – Avanzado (tercer grado): Corresponde al tipo III de la Escuela Mexicana (QRS ≥0,12 s) – Parcial (primer grado): corresponde a los tipos I y II de la Escuela Mexicana (QRS <0,12 s) – De segundo grado: corresponde a un tipo especial de aberrancia ventricular. Es poco frecuente B. De las divisiones de la rama izquierda (hemibloqueos): • Superoanterior • Inferoposterior 43 Curso_ECG_2.qxd 20/7/06 11:59 Página 44 BLOQUEOS VENTRICULARES La zona bloqueada, cualquiera que sea, se despolariza con retraso, y en los casos de bloqueo global avanzado es la última zona del corazón que se despolariza. El bloqueo global ventricular tanto del lado derecho como del izquierdo se conoce con el nombre de bloqueo de rama, puesto que el retraso de la conducción del estímulo suele estar en la parte proximal de la rama derecha o izquierda, aunque también puede ocurrir en la zona distal periférica de la rama y, excepcionalmente, en las fibras hisianas que se dirigen a la rama derecha o izquierda (Sodi 1964, Van Dam 1974). Independientemente del lugar en donde esté el bloqueo la morfología del ECG es parecida. Los bloqueos de rama pueden ser como todos los bloqueos cardiacos (ver Apartado 2.1), avanzados o de tercer grado, parciales o de primer grado y de segundo grado cuando son intermitentes, en cuyo caso constituyen una morfología llamada aberrancia de conducción ventricular. En la génesis de muchas imágenes de crecimiento ventricular influye la presencia de cierto grado de bloqueo del estímulo, en general a nivel periférico, acompañando al crecimiento o dilatación ventricular. El grado de bloqueo no es muy grande y por ello el QRS mide <0,12 segundos. Los bloqueos de rama avanzados tanto derechos como izquierdos se caracterizan de acuerdo con la Escuela Mexicana (Sodi, 1964) por: 1. El diagnóstico se hace fundamentalmente por el plano horizontal (V1 y V6). 2. El QRS debe medir, como mínimo, 0,12 s. 3. Los empastamientos deben ser opuestos a la onda T. 4. La despolarización del ventrículo correspondiente a la rama bloqueada se lleva a cabo por vía transeptal a partir del ventrículo contralateral. Este fenómeno explica el ensanchamiento del QRS y la peculiar morfología del ECG, tanto en el caso de bloqueo derecho como izquierdo. 5. La repolarización del septo domina sobre la de la pared libre ventricular izquierda, y es la que causa los cambios del ST-T. 6. En general, la alteración anatómica es más difusa que la expresión electrocardiográfica. Los casos de bloqueo de rama parcial originan formas que a menudo son indistinguibles de los crecimientos ventriculares homónimos. Los bloqueos zonales o divisionales izquierdos (hemibloqueos) han sido mucho más estudiados, tanto desde el punto de vista anatómico como electrofisiológico, que los bloqueos parcelares derechos (Rosenbaum, Elizari, Lazzari 44 Curso_ECG_2.qxd 20/7/06 11:59 Página 45 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 1968). Éstos no se conocen tanto ni su diagnóstico está bien sistematizado, por lo que sólo los mencionaremos brevemente (ver Apartado 4.2.), (Bayés de Luna, 1982 y 1987; Cosín, 1983). Si consideramos que existen cuatro fascículos intraventriculares, a saber, rama derecha, tronco de la rama izquierda, división superoanterior y división inferoposterior, además de los bloqueos aislados de un solo fascículo pueden existir bloqueos de dos (bloqueo bifascicular) o de tres fascículos (trifascicular). 4.2. Bloqueos del ventrículo derecho En este libro hablaremos fundamentalmente de los bloqueos ventriculares derechos globales (bloqueo de rama derecha). Los bloqueos parcelares derechos se estudiarán sólo de forma muy somera (ver Apartado 4.2.5). 4.2.1. Bloqueo de rama derecha avanzado El bloqueo de rama derecha avanzado (Tabla 6) es un bloqueo total de la activación de todo el ventrículo (bloqueo global). La localización del bloqueo, tanto del avanzado como del parcial, suele ser en la rama derecha proximal, y la activación del ventrículo derecho se hace a través del septum desde el ventrículo izquierdo, lo cual explica, dada la escasez de Purkinje en esta zona, que la transmisión del estímulo se realiza lentamente y, en consecuencia, el QRS es ancho. En la Fig. 35 se puede ver cómo los cuatro vectores que se originan debido a esta activación anómala, configuran un asa de QRS que proyectada sobre los diferentes hemicampos explica las morfologías del QRS que encuentran en las distintas derivaciones, y en la Fig. 36 hay un ejemplo típico de bloqueo de rama derecha avanzado. La localización distal (periférica) del bloqueo da lugar a morfologías en general parecidas a las del bloqueo de rama proximal clásico avanzado o parcial. Se presenta en algunas cardiopatías congénitas (enfermedad de Ebstein [Fig. 37], poscirugía de la tetralogía de Fallot, embolia pulmonar [Fig. 24], displasia arritmogénica del ventrículo derecho [Fig. 38]), etc. Las morfologías suelen ser parecidas a las que acabamos de exponer, es decir, de bloqueo parcial o avanzado de rama derecha, dependiendo de la importancia del retraso (Tabla 6), aunque en algunos casos, como en la enfermedad de Ebstein o displasia arritmogénica del ventrículo derecho suelen presentar características peculiares (Figs. 37 y 38). 45 Curso_ECG_2.qxd 20/7/06 11:59 Página 46 BLOQUEOS VENTRICULARES A B Plano frontal VR VL 4 1 3 4 0,09s D1 0,12s 4 3 0,06s 1 2 1 2 3 D3 2 D2 VF 0,06s 3 4 V5 Plano horizontal V1 V2 >0,12 s V6 2 1 V3 V4 >0,12 sL Figura 35. A) Ejemplo de cómo se produce el asa de activación en caso de bloqueo de rama derecha de tercer grado, como consecuencia de la formación, a causa de la activación transeptal que ocurre en este tipo de bloqueo, de cuatro vectores de despolarización ventricular (véase texto). B) La proyección de los cuatro vectores sobre el plano frontal y horizontal configura unas asas de despolarización ventricular que, de acuerdo con la correlación asa-hemicampo, explican las morfologías que se pueden ver en las distintas derivaciones en este tipo de bloqueo (véase texto). 4.2.1.1. Criterios diagnósticos Los criterios diagnósticos de bloqueo de rama derecha avanzado (Sodi 1964) son (Fig. 36): a) QRS ≥0,12 s con empastamientos mediofinales. b) V1: rsR’ con cúspide de la R’ empastada y T negativa. c) I y V6: qRs con empastamientos evidentes de la S y T positiva. d) VR: QR con empastamientos evidentes de la R y T negativa. e) Onda T con polaridad opuesta a los empastamientos del QRS. 46 Curso_ECG_2.qxd 20/7/06 11:59 Página 47 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A I II III VR VL VF V1 V2 V3 V4 V5 V6 R´ R´ PFa PF PHa PH Figura 36. Ejemplo típico de un ECG con su correspondiente VCG de un caso de bloqueo de rama derecha avanzado. Como se puede apreciar, a partir del VCG se puede entender cómo será la imagen electrocardiográfica, y viceversa. Por ejemplo, la parte final del asa en el plano horizontal cae toda en el hemicampo positivo de V1 (R final en V1) y el el plano frontal en el hemicampo positivo de VR (r final en VR). I VR V1 V4 II VL V2 V5 III VF V3 V6 PF PH PFa PHa Figura 37. ECG de una niña de un año de edad con enfermedad de Ebstein. Obsérvese el PR algo largo, la onda P de gran voltaje (imitando morfología rS en V1) y la morfología de bloqueo de rama derecho atípico. Se aprecia una morfología rSR’s’ de V1 a V3. T R´ SENSI 2 47 SENSI 8 Curso_ECG_2.qxd 20/7/06 11:59 Página 48 BLOQUEOS VENTRICULARES I VR V1 V4 II VL V2 V5 100 uv III VF V3 V6 50 uv Figura 38. Ejemplo típico de ECG de displasia arritmogénica del ventrículo derecho. Véase el bloqueo de rama derecha atípico (R con muescas en la meseta y de bajo voltaje [ver Tabla 3]), los complejos ventriculares prematuros del ventrículo derecho (presentan morfología del bloqueo de rama izquierda) y la onda T negativa de V1 a V5. También se aprecia que la duración del QRS es más larga en V1-2 que en V6, porque en V1-2 se registra la despolarización retrasada de parte del ventrículo derecho. El paciente presentaba potenciales tardíos muy positivos (derecha). Abajo: Típica imagen ecocardiográfica de la distorsión de la contracción del ventrículo derecho (flecha). – V1 con R’ empastada – V6 con S empastada – VR con R’ empastada 123 Las derivaciones claves para el diagnóstico de bloqueo de rama derecha avanzado son: con QRS ≥0,12 s 48 Curso_ECG_2.qxd 20/7/06 11:59 Página 49 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 4.2.1.2. Diagnóstico de bloqueo de rama derecha avanzado asociado a crecimiento ventricular y cardiopatía isquémica • Crecimiento ventricular: ante el bloqueo de rama derecha avanzado los siguientes signos hacen pensar en un crecimiento ventricular derecho o ventricular izquierdo asociados (Vanderburg, 1985). – Crecimiento ventricular derecho asociado: a) La morfología rsR’ se registra por lo menos hasta V3; y b) el ÂQRS está hiperdesviado a la derecha. – Crecimiento ventricular izquierdo asociado (Vanderburg 1985): a) La presencia de R alta en V5-V6; y b) la morfología qRs se registra desde V3-V4. • Cardiopatía isquémica: En cuanto a la cardiopatía isquémica, en principio, el bloqueo de rama derecha no impide su diagnóstico en la fase crónica, pues al ser el inicio de la activación al igual que en condiciones normales se pueden registrar las alteraciones de la repolarización y la onda Q de necrosis de la misma forma que en los casos con activación ventricular normal. Por otra parte, en la fase aguda se aprecian bien las alteraciones de la repolarización, sobre todo el ascenso del ST (ver el libro dedicado a imágenes electrocardiográficas de isquemia, lesión y necrosis de esta misma colección e implicaciones clínicas). 4.2.2. Bloqueo de rama derecha de primer grado (parcial) (Fig. 39 y Tabla 6) En este caso, el retardo de activación de todo el ventrículo es menos importante. El QRS es inferior a 0,12 s, pero la morfología de V1 continúa siendo rsR’ o rsr’, pero con menos muescas y empastamientos (Fig. 39). Hay que descartar las falsas imágenes de r’ en V1 debidas, por ejemplo, a la mala colocación de los electrodos (Tabla 3). A menudo, un cierto grado de bloqueo de rama derecha parcial periférico explica en parte la imagen de crecimiento ventricular derecho que se puede ver en la comunicación interauricular (Fig. 20). 4.2.3. Bloqueo de rama derecha de segundo grado (intermitente) Como su nombre indica, la imagen ECG aparece de forma intermitente, sin cambios apreciables de la longitud, o más a menudo coincidiendo con cierta taquicardización del ritmo sinusal (Fig. 40). Constituye un típico ejemplo de aberrancia de conducción (Bayés de Luna, 2004). 49 Curso_ECG_2.qxd 20/7/06 11:59 Página 50 BLOQUEOS VENTRICULARES I II III VR VL VF V1 V2 V3 V4 V5 V6 D1 D2 D3 VR VL VF V1 V2 V3 V4 V5 V6 A B Figura 39. Dos ejemplos de bloqueo de rama derecha parcial. A) De menor grado con menos empastamientos finales en VR,V1 y V6 de menor grado que en B), y con onda R’ en V1, de menor voltaje. En ambos casos, sin embargo, el QRS es menor de 0,12 s. V1 Figura 40. V1. Trazo continuo. Un paciente de 55 años que presenta una imagen de bloqueo de rama derecha de primer grado (los cuatro primeros complejos); bruscamente, con cambios mínimos en el intervalo RR, aparece una imagen de bloqueo de rama derecha avanzado (tercer grado) durante cuatro complejos. Después, cinco complejos más de bloqueo de rama derecha de primer grado y, por fin, cinco complejos con morfología de bloqueo de rama derecha avanzado. Representa un ejemplo de bloqueo de rama derecha de segundo grado (algunos estímulos quedan ocasionalmente detenidos del todo en la rama derecha: aberrancia de conducción), aunque partiendo ya de la existencia de un bloqueo de primer grado. 50 Curso_ECG_2.qxd 20/7/06 11:59 Página 51 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 4.2.4. Diagnóstico diferencial del bloqueo de rama derecha Una onda R alta o r’ SR’ en V1 no debida a bloqueo de rama clásico puede verse en distintas situaciones, que ya se han expuesto anteriormente (ver Apartado 3.2 y Tabla 3). Cuando el bloqueo de rama derecha es parcial, ya hemos comentado que es a veces imposible distinguirlo de algunos tipos de crecimiento ventricular derecho, tal como ocurre en la comunicación interauricular o en algunos casos de estenosis pulmonar ligera, donde la alteración del ECG se debe en gran parte a cierto grado de bloqueo de rama derecha asociado. 4.2.5. Trastornos de conducción parcelares del ventrículo derecho Se han estudiado desde el punto de vista experimental (Bayés de Luna, 1982; Cosín, 1983), habiéndose demostrado que el bloqueo experimental de la zona parcelar superoanterior origina una morfología tipo SI SII SIII, y el de la zona inferoposterior un tipo SI RII RIII. Sin embargo, desde el punto de vista clínico estas imágenes son indistinguibles de algunos tipos de crecimiento ventricular derecho e incluso pueden verse en individuos normales con distintas rotaciones del corazón (ver libro ECG normal de esta misma colección). En realidad, en las morfologías electrocardiográficas de crecimiento ventricular influye siempre cierto grado de trastorno de conducción ventricular homólogo (ver Apartado 3.1.) 4.3. Bloqueos del ventrículo izquierdo El trastorno de conducción ventricular izquierdo puede ser global (bloqueo de rama izquierda) o divisional (hemibloqueos). 4.3.1. Bloqueo de rama izquierda avanzado (Tabla 7) Los bloqueos de rama izquierda avanzados se suelen presentar en cardiópatas y se trata de un bloqueo total de la activación de todo el ventrículo izquierdo (bloqueo global). La localización del bloqueo suele ser en la rama izquierda proximal y la activación del ventrículo izquierdo se hace a través del septum desde el ventrículo derecho, lo cual explica, dada la escasez de fibras de Purkinje en esta zona, que la transmisión del estímulo se realice lentamente, y en consecuencia que el QRS sea ancho. La morfología se explica por la correlación del asa de activación y los cuatro vectores de activación, y su proyección sobre los hemicampos correspondientes (Fig. 41). En la Fig. 42 vemos un ejemplo típico del bloqueo de rama izquierda global avanzado. 51 Curso_ECG_2.qxd 20/7/06 11:59 Página 52 BLOQUEOS VENTRICULARES Los bloqueos distales son menos frecuentes que los proximales. Presentan una morfología parecida a la del bloqueo de rama izquierda avanzado proximal, pero en general son más anchos y con más empastamientos a lo largo de todo el QRS (Fig. 43). En resumen, cualquiera que sea la localización del bloqueo global (proximal o distal), cuando el retardo es importante se origina una morfología R sola en V6 y QS en V1, con QRS ≥0,12 s (morfología de bloqueo rama izquierda avanzado) (Fig. 41). 2 A B 3 4 4 4 VL VR 3 4 1 2 4 3 2 1 3 2 I 1 VF 2 3 4 III 1 II V6 1 V5 V1 V2 V3 V4 Figura 41. A) Ejemplo de cómo se produce el asa de activación en caso de bloqueo de rama izquierda de tercer grado, como consecuencia de la formación, a causa de la activación transeptal en este tipo de bloqueo, de cuatro vectores de despolarización ventricular (véase texto e interior figura). B) La proyección de los cuatro vectores sobre el plano frontal y horizontal configura un asa de despolarización ventricular que, de acuerdo con la correlación asa-hemicampo, explica las posibles morfologías que se pueden ver en las distintas derivaciones en este tipo de bloqueo (véase texto). 52 Curso_ECG_2.qxd 20/7/06 11:59 Página 53 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A I II III VR VL VF V1 V2 V3 V4 V5 V6 PF PS PHa (asa T) PH PHa (vectores iniciales) Figura 42. Ejemplo típico de un ECG con su correspondiente VCG de un caso de bloqueo de rama izquierda avanzado. Como se puede apreciar, a partir del VCG se puede entender cómo será la imagen electrocardiográfica, y viceversa. Por ejemplo, en el plano horizontal ampliado se puede apreciar el inicio de la despolarización ventricular que se ve hacia la izquierda, lo que explica la falta de “r” inicial en V1 y de “q” en V6. I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 43. Paciente con hipercaliemia (K = 7,5 mep/l) y bloqueo de rama izquierda avanzado atípico distal. Obsérvese que el QRS mide 0,18 s. El ÂQRS está hiperdesviado a la izquierda, el ST parece que forma parte del final del QRS y existen empastamientos finales importantes (rama descendente de la r en I, VL y V6) (véase texto). 53 Curso_ECG_2.qxd 20/7/06 11:59 Página 54 BLOQUEOS VENTRICULARES 4.3.1.1. Criterios diagnósticos Los criterios diagnósticos de bloqueo avanzado de rama izquierda son (Sodi 1964) (Fig. 41): a) QRS ≥0,12 s con empastamientos medios o mediofinales. b) V1:QS, a veces “r” embrionaria, con empastamientos y T positiva. c) I y V6:R sola con cúspide de la R tardía (≥ 60 ms) con empastamientos y T negativa. d) VR:QS con empastamientos y T positiva. e) Onda T con polaridad casi siempre opuesta a los empastamientos del QRS (comentar Bayés de Luna 1998, 2004). V1=QS 123 Las morfologías claves para el diagnóstico son: V6=R sola VR=QS QRS ≥0,12 s con empastamientos medios 4.3.1.2. Diagnóstico de bloqueo de rama izquierda avanzado asociado a crecimiento ventricular o cardiopatía isquémica • Crecimiento ventricular: el crecimiento ventricular izquierdo suele estar muy a menudo presente en los pacientes con bloqueo de rama izquierda avanzado. El bloqueo de rama izquierda disminuye el voltaje del QRS en V5.6, pero lo aumenta en V1 V2, de manera que, en principio, los criterios de voltaje conjunto de V1-2 + V5-6 son también útiles para diagnosticar la asociación (Cockinos, 1978; Kulka, 1985). • Cardiopatía isquémica: en cuanto a la asociación de síndrome coronario agudo en presencia de bloqueo de rama izquierda se han descrito alteraciones de la repolarización que sugieren dicha asociación (Sgarbosa, 2001). En la fase crónica, el bloqueo de rama izquierda enmascara muchos casos de infarto Q, aunque pueden encontrarse ondas Q de necrosis ante un bloqueo de rama izquierda avanzado (Sodi, 1964). Por otra parte, el voltaje de la onda S en V3 suele ser mucho menor en casos de bloqueo de rama izquierda en pacientes con cardiopatía isquémica que idiopática (Bayés Genís, 2003) (Fig. 44) (ver Apartado 4.6), (ver libro de imágenes de isquemia, lesión, necrosis de esta misma colección). 54 Curso_ECG_2.qxd 20/7/06 11:59 Página 55 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A I Idiopática Isquémica Idiopática aVR Isquémica Idiopática V1 Isquémica Idiopática V4 II aVL V2 V5 III aVF V3 V6 Isquémica Figura 44. ECG de dos pacientes con miocardiopatía dilatada. A la izquierda de cada panel se muestra un caso de miocardiopatía dilatada de etiología idiopática, y a la derecha un caso de origen isquémico. El voltaje de V3 permite distinguir con una buena fiabilidad la etiología de la miocardiopatía dilatada. Si es isquémica, el voltaje suele ser menor. 4.3.2. Bloqueo de rama izquierda parcial (de primer grado) (Fig. 45) En esta situación, el retardo de activación ventricular izquierdo es menos importante. Probablemente se debe, por lo menos en parte, a la presencia de fibrosis septal (falta del primer vector) (Bayés de Luna, 1983). Presentan un QRS inferior a 0,12 s con QS en V1 o “r” embrionaria y R sola en I y V6. Es muy difícil el diagnóstico diferencial con la imagen de crecimiento ventricular izquierdo, con el que a menudo se acompaña tanto el bloqueo de rama izquierda parcial como el avanzado. 4.3.3. Bloqueo de rama izquierda de segundo grado (intermitente) (Fig. 46) Como en el caso del lado derecho, la imagen de bloqueo de rama izquierda de segundo grado puede aparecer con o sin cambios de la frecuencia cardiaca (Fig. 46) y constituye un tipo de aberrancia de conducción intraventricular (Bayés de Luna, 2004). 4.3.4. Hemibloqueos El estímulo queda bloqueado en una de las dos divisiones de la rama izquierda, la superoanterior o la inferoposterior (hemibloqueos). Comentaremos sólo los crite- 55 Curso_ECG_2.qxd 20/7/06 11:59 Página 56 BLOQUEOS VENTRICULARES A B I VR V1 V4 I VR V1 V4 II VL V2 V5 II VL V2 V5 III VF V3 V6 III VF V3 V6 Figura 45. Dos ejemplos de bloqueo de rama izquierda de primer grado. En los dos casos el QRS es menor de 120 ms y no se observa onda q en V6 ni r en V1 con QS en V1 y R sola en V6, que son los criterios más importantes para sospechar este diagnóstico (véase texto). HO Figura 46. Bloqueo de rama izquierda avanzado intermitente. El 3º y 6º complejos son conducidos con morfología de bloqueo de rama izquierda avanzado. También pasa lo mismo del 8º al 17º complejo, a partir del cual se bradicardiza el ritmo y desaparece la imagen. rios electrocardiográficos de los hemibloqueos superoanterior e inferoposterior bien establecidos (avanzados). Sólo queremos apuntar que no hay evidencias absolutas acerca de la repercusión electrocardiográfica del bloqueo de las fibras medias de la rama izquierda. Es posible que pueda explicar algunos casos de morfología RS en V1 debido a que la activación tardía de la zona septal anterior, que es donde se encuentran estas fibras, llevaría el asa de QRS algo más adelante de lo normal. Ello es prácticamente seguro si la imagen se presenta de forma intermitente en ausencia de isquemia aguda de la cara lateral (Bayés de Luna, 1998 y 2005). En ambos hemibloqueos, de acuerdo con Rosenbaum y Elizari (1968), existe un cambio en la activación intraventricular izquierda, como consecuencia de que la 56 Curso_ECG_2.qxd 20/7/06 11:59 Página 57 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A zona bloqueada se despolariza con retraso, lo que explica los típicos cambios electrocardiográficos que se observan, pero sin que se presente un QRS ≥120 ms al no existir retardo de activación transeptal. En las Figs. 47 y 51 se explica cómo es la activación en los hemibloqueos. 4.3.4.1. Hemibloqueo superoanterior (Figs. 47-50) El diagnóstico puede hacerse por las alteraciones electrocardiográficas que se explican por los cambios de activación ventricular. En la Fig. 47 puede verse la activación en caso de hemibloqueo superoanterior y la correlación asa-hemicampo en los planos frontal y horizontal. 22 A B 2 VR VL 2 D1 1 1 1 2 III VF II 2 Prous Science V6 1 V5 V1 V2 V3 V4 Figura 47. Hemibloqueo superoanterior. A) Ejemplo de cómo se produce la activación (el segundo vector se dirige tardíamente a la izquierda y arriba); y B) de cómo la correlación asa-hemicampo explica las morfologías de las distintas derivaciones (véase texto). 57 Curso_ECG_2.qxd 20/7/06 11:59 Página 58 BLOQUEOS VENTRICULARES I VR V1 V4 II VL V2 V5 III VF V3 V6 PF PH PS Figura 48. Paciente de 63 años, sin cardiopatía, con criterios electrocardiográficos típicos de hemibloqueo superoanterior aislado. Véase la correlación con las imágenes vectorcardiográficas típicas (véase texto). CRITERIOS DIAGNÓSTICOS Los criterios diagnósticos de hemibloqueo superoanterior avanzado son (Rosenbaum-Elizari 1968): a) Complejo QRS <0,12 s. 58 Curso_ECG_2.qxd 20/7/06 11:59 Página 59 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A b) ÂQRS hiperdesviado a la izquierda (sobre todo entre –45º y –75º). Hay que descartar la necrosis inferior, el síndrome de Wolff-Parkinson-White (WPW) tipo II y el patrón SI SII SIII (Fig. 50). c) I y VL: qR con empastamientos en la R, especialmente en la rama descendente, en los casos más avanzados de hemibloqueo superoanterior. d) II, III y VF: rS con SIII > SII y RII > RIII. e) Onda S hasta V6 con tiempo de deflexión intrinsecoide en V6 < VL. I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 49. Hemibloqueo superoanterior más crecimiento ventricular izquierdo. I III II HSA SISIISIII Figura 50. En caso de hemibloqueo superoanterior (arriba), SIII>SII y no hay SI. En caso de SI, SII, SIII (abajo), SII>SIII y sí hay SI. 59 Curso_ECG_2.qxd 20/7/06 11:59 Página 60 BLOQUEOS VENTRICULARES En las Figs. 48 y 49 se pueden ver dos ejemplos típicos de hemibloqueo superoanterior aislado y con crecimiento ventricular izquierdo añadido, respectivamente, y en la Fig. 50 se observan las diferencias que hay entre la morfología del hemibloqueo superoanterior y del tipo SI SII SIII en el plano frontal. II y III = SIII > SII RII > RIII V6 Rs = 14243 Las derivaciones clave para el diagnóstico de hemibloqueo superoanterior son: I y VL = qR con QRS <0,12 s 4.3.4.2. Hemibloqueo inferoposterior (Figs. 51 y 52) Para llevar a cabo este diagnóstico es necesario, además de la morfología electrocardiográfica típica, que existan condicionantes de tipo clínico, sobre todo ausencia de crecimiento ventricular derecho y de hábito asténico. Con toda probabilidad también es necesario una evidencia de afectación del ventrículo izquierdo. El diagnóstico es seguro si la imagen es transitoria. En la Fig. 51 se muestra cómo es la activación ventricular en caso de hemibloqueo inferoposterior y cómo la correlación asa-hemicampo en el plano frontal y horizontal explica la morfología del ECG. En la Fig. 52 se observa la morfología de hemibloqueo inferoposterior (B) que aparece de forma brusca (ver pie de figura). CRITERIOS DIAGNÓSTICOS Los criterios diagnósticos de hemibloqueo inferoposterior avanzado en presencia de los condicionantes clínicos antes expuestos son: a) Complejo QRS inferior a 0,12 s. b) ÂQRS desviado a la derecha (entre +90 y +140º); para algunos autores ≥110º. c) I y VL: RS o rS. d) II ,III y VF: qR, con empastamientos en la R en los casos más avanzados de hemibloqueo inferoposterior. e) Precordiales: S hasta V6, con tiempo de deflexión intrinsecoide en V6 > VL. f) El diagnóstico es seguro si la imagen aparece de forma brusca. 60 Curso_ECG_2.qxd 20/7/06 11:59 Página 61 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A A B VR VL 1 1 D1 1 2 III 2 VF D2 2 2 V6 1 V5 V1 V2 V3 V4 Figura 51. A) Ejemplo de cómo se produce la activación en caso de hemibloqueo inferoposterior (el segundo vector se dirige tardíamente abajo y algo a la derecha); y (B) de cómo la correlación asa-hemicampo explica las morfologías de las distintas derivaciones (véase texto). I, VL = RS,Rs II, III, VF = qR V6 = Rs 14243 Las derivaciones clave para el diagnóstico una vez considerados los condicionantes de tipo clínico necesarios son: con QRS <0,12 s 4.3.4.3. Diagnóstico diferencial El diagnóstico de hemibloqueo de la división superoanterior puede realizarse exclusivamente por la morfología del ECG (Figs. 47 y 48). En cambio, ante un 61 Curso_ECG_2.qxd 20/7/06 11:59 Página 62 BLOQUEOS VENTRICULARES ECG aislado que cumple con los criterios diagnósticos que acabamos de comentar para hemibloqueo inferoposterior es muy difícil realizar dicho diagnóstico, si no se excluye el hábito asténico, el crecimiento ventricular derecho y se confirma que hay afectación izquierda. Puede ser útil la imagen vectorcardiográfica en el plano frontal que tiene una forma más abierta que en el corazón vertical, aunque hoy día dicha técnica apenas se utiliza. Naturalmente, es definitivo que la imagen aparezca bruscamente (Fig. 52). A I VR V1 V4 II VL V2 III VF V3 B I VR V1 V4 V5 II VL V2 V5 V6 III VF V3 V6 Figura 52. Paciente con ÂQRS alrededor de +50º (A) que, sin cambio clínico alguno, presentó súbitamente un ECG con un ÂQRS de alrededor de +90º (B), con paso en VF de Rs a qR y en V6 de R sola a Rs. Este cambio súbito se debe explicar por la aparición de un bloqueo de la división inferoposterior. Aunque al paciente no le aqueja dolor precordial, el aumento de la onda T negativa de V4 a V6 permite sugerir que quizá presentó isquemia silente que dañó las fibras de la división inferoposterior. 4.4. Bloqueos bifasciculares Sólo comentaremos los criterios electrocardiográficos de los dos bloqueos bifasciculares más característicos: bloqueo de rama derecha avanzado más hemibloqueo superoanterior y bloqueo de rama derecha avanzado más hemibloqueo inferoposterior. 62 Curso_ECG_2.qxd 20/7/06 11:59 Página 63 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 4.4.1. Bloqueo de rama derecha avanzado más hemibloqueo superoanterior (Fig. 53) Criterios diagnósticos – Duración del QRS >0,12 s – Morfología del QRS: la primera parte dirigida como en el hemibloqueo superoanterior, hacia arriba y a la izquierda, y la segunda como en el bloqueo de rama derecha avanzado, hacia delante y a la derecha (Fig. 53). Si existe gran retraso izquierdo, el mismo puede contrarrestar las fuerzas derechas; esto origina unas fuerzas finales izquierdas, pero anteriores, por lo que se verá una R alta en V1, pero sin S en I y, en ocasiones V6. En esta situación, en el plano frontal parece que existe bloqueo de rama izquierda avanzado y en el plano horizontal un bloqueo de rama derecha avanzado (bloqueo disfrazado) (Fig. 54) (Bayés de Luna, 1989). 4.4.2. Bloqueo de rama derecha avanzado más hemibloqueo inferoposterior Criterios diagnósticos – Duración del QRS >0,12 s – Morfología QRS: la primera parte del QRS se dirige, como en el hemibloqueo inferoposterior, hacia abajo y la derecha, y la segunda, como en el bloqueo de rama derecha avanzado, hacia delante y a la derecha (Fig. 55). I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 53. Bloqueo de rama derecha avanzado más hemibloqueo superoanterior (véase texto). 63 Curso_ECG_2.qxd 20/7/06 11:59 Página 64 BLOQUEOS VENTRICULARES l VF V1 V4 lI VL V2 V5 lII VF V3 V6 Figura 54. Bloqueo de rama derecha avanzado (rsR’ en V1, con rS en V6), con morfología en plano frontal sin S en I y VL (R sola) y ÂQRS hiperdesviado a la izquierda. En el plano frontal parece un bloqueo de rama izquierda y en el horizontal un bloqueo de rama derecha. Se trata de un bloqueo bifascicular disfrazado (bloqueo de rama derecha más hemibloqueo superoanterior) (véase texto). 4.5. Bloqueos trifasciculares Las posibilidades son numerosas y escapa a la finalidad del contenido del presente manual enumerarlas todas, ni tan siquiera someramente (aconsejamos consultar Bayés de Luna, 1989 y 2005). Las más frecuentes son: a) Bloqueos de rama derecha alternando con bloqueo de de las dos divisiones de la rama izquierda (síndrome de Rosenbaum) (Fig. 56). b) Bloqueos bifasciculares con PR largo. Hay que tener en cuenta que el PR largo puede deberse a una lesión proximal, por lo que se necesitarán estudios electrofisiológicos intracavitarios para confirmarlo. 64 Curso_ECG_2.qxd 20/7/06 12:00 Página 65 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A I II III VR VL VF V1 V2 V3 V4 V5 V6 Figura 55. Bloqueo de rama derecha más hemibloqueo inferoposterior (véase texto). A I VR V1 V4 B I VR V1 V4 II VL V2 V5 II VL V2 V5 III VF V3 V6 III VF V3 V6 Figura 56. Típico ejemplo de bloqueo trifascicular. A) Bloqueo de rama derecha de tercer grado más hemibloqueo superoanterior. B) Al día siguiente, el eje del QRS frontal pasa de –60º a +130º como expresión de que ha aparecido un hemibloqueo de la división posterior en sustitución de hemibloqueo superoanterior. 4.6. Implicaciones clínicas En general, la imagen de bloqueo de rama derecha de tercer grado en ausencia de cardiopatía no evoluciona a bloqueo AV ni se asocia a una mayor incidencia de cardiopatía isquémica. 65 Curso_ECG_2.qxd 20/7/06 12:00 Página 66 BLOQUEOS VENTRICULARES En el curso de un infarto agudo anterior, la aparición de un bloqueo de rama derecha de tercer grado es un signo de mal pronóstico, pues sugiere que la oclusión se encuentra en la descendente anterior proximal a la primera septal, que es la arteria que irriga la rama derecha. Asimismo, su aparición en el curso de un cuadro clínico agudo compatible con embolia pulmonar sugiere que ésta es muy importante (Fig. 25). En otras cardiopatías, en fase crónica como el cor pulmonale, la comunicación interauricular o la estenosis mitral es un dato que apoya la presencia de crecimiento ventricular derecho asociado y la existencia de lesión grave y evolucionada. Los bloqueos de rama derecha posquirúrgicos (tetralogía de Fallot, etc.) pueden ser de origen proximal o distal. Estos últimos son más frecuentes, sobre todo si no hay hemibloqueo superoanterior asociado. Es posible conocer con estudios electrofisiológicos el origen proximal o distal según que la distancia desde el inicio de la despolarización ventricular hasta el ápex del ventrículo derecho (V-AVD) sea larga (proximal) o no (distal) (Bayés de Luna 1998). La morfología tipo bloqueo de rama derecha que se observa en la enfermedad de Ebstein, la displasia arritmogénica del ventrículo derecho y el síndrome de Brugada es, en general, atípica. El bloqueo de rama izquierda de tercer grado tiene peor pronóstico (más cardiopatía isquémica y evolución a bloqueo AV) que el bloqueo de rama derecha de las mismas características, aunque puede verse también en ausencia de cardiopatía (10% a 20% de los casos). Los casos que revisten peor pronóstico son los que presentan hiperdesviación del ÂQRS a la derecha o a la izquierda y tienen un QRS ≥0,14 s. La presencia de bloqueo de rama izquierda, sobre todo asociado a fibrilación auricular en pacientes con insuficiencia cardiaca, es un signo de mal pronóstico (Baldesaroni, 2002). Por otra parte, la morfología de V3 en pacientes con bloqueo de rama izquierda e insuficiencia cardiaca puede ayudar a distinguir si la etiología es isquémica (S en V3 de poco voltaje y con muescas) o idiopática (S en V3 de gran voltaje y fina) (Bayés-Genís, 2003) (Fig. 44). La aparición de un bloqueo de rama izquierda avanzado en el curso de una prueba de esfuerzo tiene diversas implicaciones pronósticas, según a la frecuencia en que se produce. Si es superior a 130/min, el pronóstico es bueno y no suele tratarse de pacientes coronarios. Si es a frecuencias más bajas suelen ser enfermos coronarios con importante afectación de la descendente anterior. Las imágenes de bloqueo de rama derecha o bloqueo de rama izquierda de segundo grado aparecen de forma intermitente y súbita, y corresponde a un tipo de aberrancia ventricular. 66 Curso_ECG_2.qxd 20/7/06 12:00 Página 67 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A La prevalencia de hemibloqueo superoanterior en la población general oscila, según las series, entre 0,9% y 1,4%, y es mucho más alta que la del hemibloqueo inferoposterior. Esto se debe a que la división superoanterior es más larga y estrecha y está sometida a presiones más altas (cámara de salida del ventrículo izquierdo) que la división inferoposterior. Los cambios electrocardiográficos típicos del hemibloqueo superoanterior no pueden explicarse, al revés de lo que ocurre en el hemibloqueo inferoposterior, por variantes de la normalidad o crecimiento ventricular. Tal y como hemos comentado, el diagnóstico de hemibloqueo inferoposterior nunca debe realizarse sólo por el ECG. Hay que descartar antes el corazón muy verticalizado y dextrorrotado, la afectación derecha y, para algunos autores, debe confirmarse que existe afectación izquierda. La prevalencia del hemibloqueo inferoposterior representa una afectación más extensa del sistema de conducción intraventricular, habida cuenta que la división inferoposterior es mucho más ancha que la superoinferior y, por tanto, su pronóstico es en principio peor que el de hemibloqueo superoanterior. Por otra parte, el hemibloqueo inferoposterior no suele verse en ausencia de cardiopatía. Puede observarse en pacientes con insuficiencia coronaria aguda con o sin bloqueo de rama derecha asociado y también en el curso de una prueba de esfuerzo, y en la insuficiencia aórtica avanzada porque el chorro de regurgitación se dirige hacia dicha división y la puede acabar dañando. La evolución a bloqueo AV avanzado de los bloqueos bifasciculares es variable, pero, en general, no demasiado frecuente. Los bloqueos bifasciculares disfrazados son los que más la presentan, sobre todo si hay cardiopatía importante asociada (Bayés de Luna 1989). La implantación de un marcapasos se basa, en general, en la clínica del enfermo, aunque en casos dudosos (por ejemplo clínica poco clara) puede ser de gran valor comprobar si el intervalo HV es muy largo y si se produce una prolongación posterior tras la administración de fármacos depresores de la conducción AV. Cuando se diagnostica un bloqueo trifascicular tipo síndrome de Rosenbaum es obligatorio implantar un marcapasos sin tener que realizar más estudios. 67 Curso_ECG_2.qxd 20/7/06 12:00 Página 69 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 5. Preexcitación ventricular Se considera que existe preexcitación ventricular cuando el estímulo eléctrico llega a los ventrículos antes (excitación precoz) de lo que lo haría normalmente a través del sistema específico de conducción. Ello se explica porque el estímulo alcanza los ventrículos por dos caminos, primero mediante unas vías anómalas de conducción acelerada que unen las aurículas con los ventrículos, los llamados haces de Kent (preexcitación tipo Wolff-Parkinson-White [WPW]) (1930), y algo más tarde a través del sistema específico de conducción normal (Fig. 57). En general hay sólo una vía accesoria, pero en ocasiones puede haber dos o más. Ello condiciona que la morfología del QRS sea un auténtico complejo de fusión (Fig. 58) que está modificado en su inicio por la excitación precoz que al ocurrir en una zona pobre en Purkinje es de inscripción lenta (onda delta). En ocasiones, la conducción desde la aurícula al haz de His se hace más rápidamente de lo normal sin necesidad de una vía anómala accesoria tipo Kent, sino como consecuencia de la existencia de una vía atriohisiana de conducción rápida o simplemente por la presencia de una conducción AV acelerada (preexcitación tipo Lown-Ganon-Levine (LGL) o PR corto) (1957) (Fig. 58). A B C D Figura 57. La vía anómala está señalada con una flecha. La despolarización ventricular se realiza por dos vías: la normal (a través del sistema específico de conducción) y la anómala. La zona despolarizada por la vía anómala corresponde a la rayada en B y C; el complejo resultante es de fusión, ya que parte de los ventrículos se despolariza por la vía normal (zona lisa) y parte por vía anómala (zona rayada). En A toda la despolarización se ha realizado mediante la vía normal y en D al revés, toda mediante la vía anómala (preexcitación máxima). 69 Curso_ECG_2.qxd 20/7/06 12:00 Página 70 P R E E XC I TAC I Ó N V E N T R I C U L A R A V5 Activación normal B V5 C V5 1) V4 Preexcitación tipo WPW 2) V4 Preexcitación tipo PR corto 3) Figura 58. Esquema de la preexcitación tipo Lown-Ganon-Levine o PR corto en relación con la activación normal y en caso de Wolff-Parkinson-White. En el caso de preexcitación tipo PR corto (abajo), la conducción AV, acelerada por la causa que sea, acorta o hace desaparecer el segmento PR, sin modificar la duración del QRS, lo cual no ocurre en la preexcitación tipo WPW. En consecuencia, el QRS en el caso del PR corto terminará antes que en el caso de conducción normal. En caso de WPW, finalizará al mismo tiempo (medio). 1) Distintos grados de onda delta. 2) Onda delta de grado medio. 3) Ejemplo de PR corto. 5.1. Preexcitación tipo Wolff-Parkinson-White 5.1.1. Criterios diagnósticos a) Intervalo PR corto (Fig. 58). Se explica porque el estímulo camina más deprisa por la vía anómala que por la normal. Generalmente el intervalo PR dura entre 0,08 s y 0,11 s. Puede existir preexcitación tipo WPW con PR normal en presencia de: • Preexcitación por vías de Mahaim que unen parte del sistema específico de conducción (nodo AV o fascículos intraventriculares) con los ventrículos (Attie 1989) (consultar Bayés de Luna, 1998 y 2005). 70 Curso_ECG_2.qxd 20/7/06 12:00 Página 71 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A • Bloqueo de la conducción en la vía anómala con conducción algo lenta en la vía normal. • Preexcitación lejos del nodo sinusal (lado izquierdo), a menudo con vía anómala larga. Sólo la comparación con el ECG de base sin preexcitación permite saber si el intervalo PR es más corto que el basal, lo que posibilita confirmar que el intervalo PR, aun siendo normal, es más corto de lo que le correspondería. b) Alteraciones del ventriculograma (Figs. 59-62). Los complejos QRS son de morfología anormal y presentan una anchura superior al complejo QRS de base (a menudo >0,11 s) y unos empastamientos iniciales característicos (onda delta) debidos al inicio de la activación en zonas del miocardio poco ricas en fibras de Purkinje. La importancia de los empastamientos depende del grado de preexcitación (Fig. 57), pudiendo ser desde mínima (Fig. 58-1A) hasta muy evidente (Fig. 58-1C). La morfología del complejo QRS en las distintas derivaciones del ECG de superficie depende de cuál sea la zona epicárdica de excitación más precoz. El vector de los 20 ms iniciales del ECG (primer vector de la onda delta que se puede apreciar claramente en el ECG) está ubicado en lugares distintos del plano frontal y horizontal, según el lugar donde se produzca dicha excitación epicárdica ventricular más precoz. De acuerdo con ello hemos dividido la preexcitación tipo WPW en cuatro tipos, dependiendo de si se produce en la zona anteroseptal derecha (tipo I), pared libre del VD (tipo II), zona posteroseptal (tipo III) y pared libre del VI (tipo IV) (Figs. 59-62). Existen distintos algoritmos (Yuan, 1992) para predecir la localización exacta de la vía anómala. En la Fig. 63 está expuesto el de Milstein (1987) que permite aproximarse mucho a la localización de la vía anómala en una de las cuatro áreas del corazón en donde se produce la activación precoz: tipo I anteroseptal derecha (ASD); tipo II pared libre del ventrículo derecho; tipo III posteroseptal; y tipo IV pared libre del ventrículo izquierdo. Sin embargo, son necesarios estudios electrofisiológicos para asegurar su situación. En la actualidad, la localización exacta de la vía anómala es clave para realizar una correcta ablación de ésta, con lo que se suprime la preexcitación y se evitan las recurrencias de taquicardias paroxísticas supraventriculares tan frecuentes en estos pacientes. c) Alteraciones de la repolarización. La repolarización está alterada excepto en los casos con preexcitación menor. Sus modificaciones son secundarias a 71 Curso_ECG_2.qxd 20/7/06 12:00 Página 72 P R E E XC I TAC I Ó N V E N T R I C U L A R I ASD +30o +120o I V1 II V2 III V3 VR V4 VL V5 VP V6 Figura 59. Inicio de la preexcitación en la zona anteroseptal (tipo I). Arriba: dirección más frecuente del vector de preexcitación en el plano frontal y horizontal, y morfologías más usuales que origina. Como se puede ver, la activación cardiaca se parece al bloqueo avanzado de rama izquierda con un eje QRS en el plano frontal en general entre +30º y +120º. Abajo: ejemplo de este tipo de preexcitación. 72 Curso_ECG_2.qxd 20/7/06 12:00 Página 73 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A -60o II PLD +30o I VR V1 V4 II VL V2 V5 III VF V3 V6 Figura 60. Inicio de la preexcitación en la pared libre del ventrículo derecho (tipo II). Arriba: dirección más frecuente del vector de preexcitación en el plano frontal y horizontal, y morfologías más usuales que origina. Como se puede ver, la activación cardiaca se parece al bloqueo avanzado de rama izquierda, pero en este caso con un ÂQRS en el plano frontal más izquierdo (entre +30º y –60º). Abajo: ejemplo de este tipo de preexcitación. 73 Curso_ECG_2.qxd 20/7/06 12:00 Página 74 P R E E XC I TAC I Ó N V E N T R I C U L A R V6 III PS Si la EP es derecha V1 V2 Si la EP es izquierda I VR V1 V4 II VL V2 V5 III VF V3 V6 Figura 61. Inicio de la preexcitación en la zona posteroseptal (tipo III). Arriba: dirección más frecuente del vector de preexcitación en el plano frontal y horizontal, y morfologías más usuales que origina. Como se puede ver, el vector de preexcitación origina, cuando la excitación precoz (EP) es izquierda, morfologías (RS, R en V1) que pueden confundirse con un infarto lateral, crecimiento ventricular derecho o bloqueo de rama derecha. Abajo: ejemplo de este tipo de preexcitación. EP: excitación precoz. 74 Curso_ECG_2.qxd 20/7/06 12:00 Página 75 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A V6 IV PLI V1 V2 I VR V1 V4 II VL V2 V5 III VF V3 V6 Figura 62. Inicio de la preexcitación en la pared libre del ventrículo izquierdo (tipo IV). Arriba: dirección más frecuente del vector de preexcitación en el plano frontal y horizontal, y morfologías más usuales que origina. También este tipo de preexcitación puede confundirse con un crecimiento ventricular derecho o bloqueo de rama derecha, y con un infarto, en este caso lateral, porque el vector de preexcitación huye de I y VL y, si es importante, originará Q de pseudonecrosis en estas derivaciones y R alta en V1V2. Abajo: ejemplo de este tipo de preexcitación. 75 Curso_ECG_2.qxd 20/7/06 12:00 Página 76 P R E E XC I TAC I Ó N V E N T R I C U L A R Onda δ negativa (Q) o isoeléctrica en I, VL o V6 SÍ No BRI Onda δ negativa (Q) o isoeléctrica en 2 de II, III o VF Sí No Sí No ASD PLI Rs o RS en V1, V2 o V2 BRI Sí No Sí No PS PLD Eje QRS >+30º Rs o RS en V1 o V2 Sí No Sí No Sí PLD PLI Indeterminado Figura 63. Algoritmo de localización de la vía anómala en una de las cuatro áreas quirúrgicas: anteroseptal derecha (ASD), pared libre ventrículo derecho (PLD), posteroseptal (PS) y pared libre ventrículo izquierdo (PLI); BRI: bloqueo de la rama izquierda (Milstein 1987). la alteración de la despolarización y se presentan como más patológicas (con polaridad más opuesta a la de R) cuanto mayor es la preexcitación (Fig. 58-1). El diagnóstico electrocardiográfico de la preexcitación tipo WPW clásico se lleva a cabo por la presencia de: – Un intervalo PR corto debido a la excitación precoz por la vía anómala. – Alteraciones del QRS, en especial la presencia de empastamientos en su inicio (onda delta) (Fig. 58). 76 Curso_ECG_2.qxd 20/7/06 12:00 Página 77 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A 5.1.2. Cambios espontáneos o provocados de la morfología anómala Los cambios en el grado de preexcitación son frecuentes. La preexcitación puede aumentar si se deprime la conducción de los estímulos por el nodo AV (maniobras vagales, fármacos, etc.) y disminuir si, por el contrario, se favorece la conducción por el nodo AV (ejercicio, etc.). También puede ser intermitente (Fig. 64). 5.1.3. El ECG en los pacientes con más de una vía accesoria (Wellens, 1990) El diagnóstico por ECG de superficie de la posible existencia de más de una vía anómala se puede sugerir en presencia de ritmo sinusal cuando: a) se aprecia una morfología qrS o qRs en V1; y b) cuando se aprecia el cambio de una morfología anómala a otra (Fig. 64 D). Holt. A B VL II C III D I Figura 64. A) Un ejemplo de desaparición progresiva de la preexcitación (efecto concertina) detectado con la técnica de Holter. B) Un caso de preexcitación tipo IV que simula un infarto lateral (Q en VL). La morfología de pseudonecrosis desaparece de un complejo al otro, al ser la preexcitación intermitente. C) Tira de ECG de Holter en la que se aprecian cambios bruscos, de conducción normal (complejos 2, 5 y 8) a preexcitación (resto de complejos). D) Preexcitación intermitente. En los tres primeros complejos hay una morfología típica de Wolff-Parkinson-White (PR corto más onda delta). En el resto de los complejos desaparece la onda delta, pero el PR es aún corto (0,10 s). Esto permite sugerir la existencia de dos vías anómalas, una tipo WPW y la otra tipo PR corto. 77 Curso_ECG_2.qxd 20/7/06 12:00 Página 78 P R E E XC I TAC I Ó N V E N T R I C U L A R En presencia de una taquicardia reciprocante, sugiere que hay más de una vía anómala: a) la alternancia entre QRS de distintas anchuras y RR de distinta duración; y b) la presencia de ondas ectópicas de distintas morfologías. 5.1.4. Diagnóstico diferencial de la preexcitación tipo Wolff-Parkinson-White Los tipos I y II se pueden confundir con un bloqueo de rama izquierda (Figs. 59 y 60), el tipo III con un infarto inferolateral, un bloqueo de rama derecha o un crecimiento de ventrículo derecho (Fig. 61), y el tipo IV con un infarto lateral, o con un crecimiento de ventrículo derecho (Fig. 62). En todos los casos, el intervalo PR corto y la presencia de onda delta son datos decisivos para el diagnóstico de preexcitación tipo WPW. En caso de duda (onda delta poco importante o PR normal), los estudios electrofisiológicos pueden valorar mejor la existencia o ausencia de preexcitación. 5.1.5. Implicaciones clínicas La importancia de la preexcitación tipo WPW reside en: 1) La posibilidad de que se confunda con otros procesos (crecimientos ventriculares, bloqueos de rama o necrosis) (ya hemos comentado estas posibilidades en el apartado 5.1.4). 2) Su asociación con taquiarritmias supraventriculares, generalmente taquicardias reciprocantes que suelen ser bien toleradas y poco peligrosas, y menos a menudo fibrilación o flúter auricular. Alrededor del 50% de los casos de taquicardias paroxísticas se explican por una reentrada en la que está incluida una vía anómala (Fig. 65). En general, para que exista reentrada se necesita (Bayés de Luna, 1998, y libro sobre taquiarritmias supraventriculares de esta misma colección, 2007): a) un circuito, en este caso grande (macrorreentrada), formado por el sistema específico de conducción y la vía anómala; b) una zona con bloqueo unidireccional que, en este caso suele estar en la vía anómala; y c) una velocidad de conducción adecuada para que el estímulo pueda circular por el circuito sin encontrar zonas aún en periodo refractario o ya despolarizadas por el estímulo siguiente. Las crisis de taquicardia paroxística del WPW pueden producir importantes trastornos hemodinámicos, pero, en general, son de buen pronóstico. Durante la crisis de taquicardia paroxística, la despolarización ventricular suele hacerse por vía nor- 78 Curso_ECG_2.qxd 20/7/06 12:00 Página 79 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A B A 1 * * Vía anómala * P P 2 1 P' A V 1 P' 2 P' 2 P' 2 P' P' Activación normal Vía anómala RP' R RP'< P'R Activación auricular retrógrada Figura 65. Esquema del corazón con una vía anómala AV derecha, que origina una conducción AV más rápida de lo normal (PR corto), con activación precoz de parte de los ventrículos y formación del QRS con morfología anómala (onda delta) (A). Todo esto está expresado en los dos primeros complejos PQRS del esquema. El QRS es un complejo de suma debido a la despolarización inicial a través de la vía anómala (trazo festoneado) y final mediante la vía normal (trazo discontinuo en la línea recta del esquema). La tercera onda P es adelantada (ectópica auricular P’) y encuentra a la vía anómala en periodo refractario, por lo que sólo se conduce por la vía normal (trazo discontinuo), en general con un P’R más largo, por encontrar a la unión AV en periodo refractario relativo, al ser más precoz. Al llegar a los ventrículos origina un QRS normal (1) y, al estar la vía anómala ya fuera de periodo refractario por no haber conducido el estímulo previo, la invade hacia atrás (festón) y se conduce después retrógradamente a las aurículas (línea continua), observándose una P’ visible después del QRS (en caso de taquicardia reciprocante intranodal, la P’ o está metida dentro del QRS o está al final, modificando su morfología) (ver Bayés de Luna 2004). Al mismo tiempo, el estímulo reentra y se conduce por los ventrículos por la vía normal (B-2). Ello permite que se perpetúe la taquicardia reentrante mediante un circuito de macrorreentrada. La conducción en dicho circuito es retrógrada por la vía anómala (festón) y anterógrada por la vía normal (trazo discontinuo). La relación RP’ es menor que P’R, lo que es característico de las taquicardias reciprocantes de la unión AV en las que participa una vía anómala. 79 Curso_ECG_2.qxd 20/7/06 12:00 Página 80 P R E E XC I TAC I Ó N V E N T R I C U L A R mal para utilizar la vía anómala como parte del circuito de reentrada (conducción retrograda a las aurículas) (Fig. 65). Ello explica que el QRS durante la taquicardia no presente preexcitación y sea estrecho (taquicardia ortodrómica). En la Fig. 65 se ve un ejemplo de esta taquicardia y se explica por qué la onda P’ de activación retrógrada está después, pero cerca, del QRS (RP’ < P’R), lo que lo diferencia de las taquicardias paroxísticas intranodales, las cuales presentan una P’ pegada al QRS o metida dentro del mismo (ver Bayés de Luna, libro sobre arritmias supraventriculares de esta colección, 2007). Sólo en menos del 10% de los casos de taquicardia paroxística en los que interviene la vía anómala, la despolarización ventricular se hace por ella y se utiliza la vía normal para la conducción retrógrada. Ello ocurre, en general, cuando hay dos o más haces. En esta situación, el QRS durante la taquicardia puede ser muy ancho (taquicardia antidrómica) (ver libro de arritmias supraventriculares de esta colección, 2007). Por otra parte, en ocasiones (≈ ≈20%) la vía anómala sólo conduce en sentido retrógrado. En consecuencia, en ritmo sinusal no se puede diagnosticar preexcitación tipo WPW (preexcitación oculta), pero el circuito puede funcionar y facilitar la aparición de taquicardias paroxísticas reentrantes. Ante una fibrilación auricular, debido a que la vía anómala puede conducir más estímulos a los ventrículos que la vía normal, la respuesta ventricular puede ser muy rápida (intervalos RR muy cortos <220 ms) y ello puede ser especialmente peligroso porque facilita la posibilidad de que uno de ellos caiga en periodo vulnerable ventricular y precipite una fibrilación ventricular y muerte súbita (Klein, 1979; Torner, 1991) (Fig. 66). Ello explica algunos casos, afortunadamente poco frecuentes, de muerte súbita sobre todo en jóvenes. Los marcadores de peligro de muerte súbita son: a) crisis de fibrilación auricular muy rápida con intervalos RR muy cortos (<220 ms); b) presencia de más de una vía anómala; y c) cardiopatía asociada. Es por ello que hoy día se aconseja la ablación por radiofrecuencia de la vía anómala en muchos casos de WPW y, por supuesto, en todos los que presentan arritmias paroxísticas. Figura 66. Paciente con crisis de fibrilación auricular con respuesta ventricular muy rápida (>300 x’) y a veces RR muy estrechos (<200 ms). Después de un intervalo RR muy corto se desencadenó una crisis de fibrilación ventricular (flecha), que se solucionó con cardioversión eléctrica. 80 Curso_ECG_2.qxd 20/7/06 12:00 Página 81 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A La fibrilación auricular de las crisis de WPW puede confundirse con una TV debido a que los QRS son también anchos (Fig. 67 arriba). A favor de la fibrilación auricular del WPW contamos con: a) la cadencia irregular de los QRS; b) los cambios frecuentes en la anchura del QRS; y c) que los QRS estrechos pueden ser precoces o tardíos, mientras que en la TV son siempre precoces (capturas). Aún es más difícil el diagnóstico diferencial con la TV en casos de flúter auricular conducido por la vía anómala (Fig. 67 abajo) (consultar Bayés de Luna, 2004 y libro de arritmias supraventriculares de esta colección, 2007). V1 V1 Figura 67. Paciente de 50 años con Wolff-Parkinson-White tipo IV que presentaba también crisis de fibrilación auricular (arriba) y flúter auricular (abajo) que parecía taquicardia ventricular. Respalda la existencia de fibrilación auricular del WPW (aparte de conocer que el paciente tiene WPW y otras características clínicas) los siguientes hechos: 1) los complejos anchos son muy irregulares en cuanto a frecuencia y pueden presentar más o menos preexcitación; 2) los complejos estrechos (5º y último de arriba) unas veces son precoces y otras no. En la taquicardia ventricular sostenida, los QRS son más regulares y si hay capturas (complejos estrechos) son siempre precoces. En caso, afortunadamente poco frecuente, de flúter con WPW (parte de abajo de la Figura), el diagnóstico con la taquicardia ventricular sostenida es más difícil por el ECG. 5.2. Preexcitación tipo Lown-Ganong-Levine o PR corto (1957) (Fig. 58 abajo) Este tipo de preexcitación se pone de manifiesto por un intervalo PR corto sin cambios en la morfología del QRS. Tal como ya hemos comentado (ver Apartado 5), por el ECG de superficie es imposible asegurar si se debe a una preexcitación por una vía atriohisiana que hace un bypass de la zona de conducción lenta del nodo AV y, por tanto, no modifica la morfología del QRS, o simplemente a un nodo AV hiperconductor. El mecanismo electrofisiológico exacto que explica el intervalo PR corto sólo se puede conocer mediante estudios electrofisiológicos. Su asociación con arritmias y muerte súbita es menor que en la preexcitación tipo WPW, probablemente con una relación 1 a 5. 81 Curso_ECG_2.qxd 20/7/06 12:00 Página 83 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A Bibliografía – Attie, J., Brugada, P., Wellens, H.J. Further support of the atrioventricular localization of the so-called Mahaim fibers. J Am Coll Cardiol 1989; 13: 232. – Baldasseroni, S., De Biase, L., Fresco, C. y cols. Cumulative effect of complete left bundle-branch block and chronic atrial fibrillation on 1-year mortality and hospitalization in patients with congestive heart failure. A report from the Italian network on congestive heart failure (in-CHF database). Eur Heart J 2002; 23: 1692. – Bayés de Luna, A., Cladellas, M., Oter, R. y cols. Interatrial conduction block and retrograde activation of the left atrium and paroxysmal supraventricular tachyarrhythmia. Eur Heart J 1988; 9: 1112-1118. – Bayés de Luna, A. Textbook of Clinical Electrocardiography. Futura Publishing, Armonk 1998. (Edición castellana en Editorial Expaxs, Barcelona 1999.) – Bayés de Luna, A. Curso de electrocardiografía clínica (internet). Prous Science, 2005. – Bayés de Luna, A. ECG normal. Prous Science, 2006. – Bayés de Luna, A., Carrió, I., Subirana, M.T. y cols Electrophysiological mechanisms of the SISIISIII electrocardiographic morphology. J Electrocardiol 1987; 20: 38. – Bayés de Luna, A., Cosín, J., Carrió, J. y cols. Right ventricular peripheral blocks: Diagnostic problems. En: Masoni, A., Alboni, P. (Eds.). Cardiac electrophysiology today. Academic Press, London, New York 1982; 401. – Bayés de Luna, A., Torner, P., Oter, R. y cols. Study of the evolution of masked bifascicular block. PACE 1989; 11: 1517. – Bayés de Luna, A., Serra-Genis, C., Guix, M. y cols. Septal fibrosis as determinant of Q waves in patients with aortic valve disease. Eur Heart J 1983; 4 (Supl. E): 86. – Bayés-Genís, A., López, L., Viñolas, X. y cols. Distinct left bundle branch block pattern in ischemic and non-ischemic dilated cardiomyopathy. Eur J Heart Fail 2003; 5: 165. 83 Curso_ECG_2.qxd 20/7/06 12:00 Página 84 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A – Cabrera, E. Teoría y práctica de la electrocardiografía. La Prensa Médica Mexicana, México, DF 1958. – Cokkinos, D.V., Demopoulos, J.M., Heimonas, E.T. y cols. ECG criteria of left ventricular hypertrophy in left bundle branch block. Br Heart J 1978; 40: 320. – Cosin, J., Bayés de Luna, A. y cols. Aproximación experimental al estudio de los bloqueos parietales del ventrículo derecho. Rev Esp Card 1983; 36: 125-132. – Dagan, A. y cols. P wave duration and dispersion for predicting maintenance of sinus rhythmn after cardioversion of atrial fibrillation. Am J Cardiol 2004; 93: 368. – Gertsch, M. The ECG: A two-time step approach to diagnosis. Springer, Berlin 2004. – Hernández Padial, L. Usefulness of total 12-lead QRS voltage for determining the presence of left ventricular hypertrophy in systemic hypertension. Am J Cardiol 1991; 68: 261-262. – Incalzi, R.A., Fuso, L., De Rosa, M. y cols. Electrocardiographic signs of chronic cor pulmonale: A negative prognostic finding in chronic obstructive pulmonary disease. Circulation 1999; 99: 1600. – Josephson, M.E., Kastorm, J.A., Morganroth, J. ECG left atrial enlargement. Electrophysiologic, echocardiographic and hemodynamic correlates. Am J Cardiol 1977; 39: 967. – Klein, G.J., Bashore, T.M., Sellers, T.D. Ventricular fibrillation in the WolffParkinson-White syndrome. N Engl J Med 1979; 1111: 300. – Kulka, E., Bringraff, G., Muliken, J. ECG diagnosis of left ventricular hypertrophy in the presence of left bundle branch block: An echocardiographic study. Am J Cardiol 1985; 55: 103. – Lown, B., Ganong, W.F., Levine, S.A. The syndrome of short PR interval, normal QRS complex and paroxysmal rapid heart beat. Circulation 1957; 6: 693. – McFarlane, P., Lawric, P.H. Comprehensive electrocardiography (3 vols.). Pergamon Press, Oxford 1989. – Milstein, S., Sharma, A.D., Guiraudon, G.M., Klein, G.J. An algorithm for the electrocardiographic localization of accessory pathways in the WolffParkinson-White syndrome. Pacing Clin Electrophysiol 1987; 10: 555. 84 Curso_ECG_2.qxd 20/7/06 12:00 Página 85 B A S E S D E L A E L E C T RO C A R D I O G R A F Í A – Piccolo, E. Elettrocardiografia e vettocardiographia. Piccin Edit, Padova 1981. – Puech, P. L’activité electrique auriculaire normal et patologique. Masson, Paris 1964 – Rosenbaum, M., Elizari, M., Lazzari, M. Los hemibloqueos. Paidos, Buenos Aires 1968. – Sgarbossa, E.B., Pinski, S.L., Barbagelata, A. y cols. Electrocardiographic diagnosis of evolving acute myocardial infarction in the presence of left bundlebranch block. GUSTO-1 (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries) Investigators. N Engl J Med 1996; 334: 481. – Sheridan, D.J. (ed). Left ventricular hypertrophy. Churchill Communications Europe, Ltd., London 1998. – Sodi, D., Bisteni, A., Medrano, G. Electrocardiografía y vectorcardiografía deductivas. La Prensa Médica Mexicana; México DF 1964. – Torner, P., Brugada, P., Smeets, J.L. y cols. Ventricular fibrillation in the WolffParkinson-White syndrome. Eur Heart J 1991; 12: 144-150. – Van Dam, R., Janse, M. Ventricular activation in canine and human bundle branch block. Circulation 1974; 50: 82. – Vanderburg, B., Sagar, K., Reomhilt, D. ECG criteria for the diagnosis of left ventricular hypertrophy in the presence of complete right bundle branch block. J Am Coll Cardiol 1985; 5: 511. – Wagner, G. Marriot’s practical electrocardiography. Lippincott-WilliamsWilliams, Philadelphia 2001. – Wellens, H.J.J., Attie, J., Smeets, J., Cruz, F., Gorgels, A., Brugada, P. The ECG in patients with multiple accessory pathway. J Am Coll Cardiol 1990; 16: 745751. – Wolff, L., Parkinson, J., White, D.D. Bundle branch block with short PR interval in healthy young people prone to paroxysmal tachycardia. Am Heart J 1930; 5: 685. – Yuan, S., Iwa, T., Tsubota, M., Bando, H. Comparative study of eight sets of ECG criteria for the localization of the accessory pathway in Wolff-ParkinsonWhite syndrome. J Electrocardiol 1992; 25: 203. 85 Curso_ECG_2.qxd 20/7/06 12:00 Página 86 Co-Vals Forte Co-Vals Forte 160 mg / 25 mg. Comprimidos recubiertos con película. 1. Nombre del medicamento. Co-Vals Forte 160 mg / 25 mg comprimidos recubiertos con película. 2. Composición cualitativa y cuantitativa. Un comprimido recubierto con película contiene 160 mg de valsartán y 25 mg de hidroclorotiazida. Excipientes, ver apartado 6.1. 3. Forma farmacéutica. Comprimidos recubiertos con película. Comprimidos recubiertos con película, ovaloides, de color pardo y con la marca HXH por un lado y NVR por el otro. 4. Datos clínicos. 4.1. Indicaciones terapéuticas. Tratamiento de la hipertensión esencial. La combinación de dosis fija Co-Vals Forte 160 mg / 25 mg (valsartán 160 mg/hidroclorotiazida 25 mg) está indicada en pacientes cuya presión arterial no está adecuadamente controlada con valsartán en monoterapia. 4.2. Posología y forma de administración. La dosis recomendada de Co-Vals Forte 160 mg / 25 mg es un comprimido recubierto con película al día (valsartán 160 mg e hidroclorotiazida 25 mg). Co-Vals Forte 160 mg / 25 mg puede administrarse en pacientes cuya presión arterial no está adecuadamente controlada con valsartán en monoterapia y cuya presión arterial diastólica sea igual o superior a 100 mmHg después de un tratamiento con valsartán 160 mg en monoterapia. El tratamiento deberá iniciarse siempre con la dosis más baja de valsartán 160 mg / hidroclorotiazida 12,5 mg y continuar como mínimo durante 4-8 semanas antes del inicio del tratamiento con Co-Vals Forte 160 mg / 25 mg. Se recomienda la titulación individual de la dosis de los componentes. El efecto antihipertensivo máximo de Co-Vals Forte 160 mg / 25 mg se observa a las 4 - 8 semanas. Si no se observa ningún efecto adicional relevante transcurrido este periodo, se debería considerar reducir la dosis y administrar un antihipertensivo adicional o alternativo. Co-Vals Forte 160 mg / 25 mg puede administrarse independientemente de las comidas y debe administrarse con líquido. Alteración de la función renal. No se requiere ningún ajuste posológico en los pacientes con alteración de la función renal leve a moderada (aclaramiento de creatinina ≥30 ml/min). Alteración de la función hepática. En pacientes con alteración hepática leve a moderada sin colestasis la dosis de valsartán no debe exceder los 80 mg. Por ello, no debe utilizarse Co-Vals Forte 160 mg / 25 mg comprimidos recubiertos con película en estos pacientes. Pacientes de edad avanzada. Co-Vals Forte 160 mg / 25 mg puede utilizarse independientemente de la edad del paciente. Niños y adolescentes (menores de 18 años). No se han establecido la seguridad ni la eficacia de Co-Vals Forte 160 mg / 25 mg en los niños ni adolescentes (menores de 18 años). Por ello, no se recomienda Co-Vals Forte 160 mg / 25 mg para uso pediátrico. 4.3. Contraindicaciones. Hipersensibilidad a valsartán, hidroclorotiazida, otros medicamentos derivados de la sulfonamida o a cualquiera de los excipientes. Embarazo y lactancia (véase sección 4.6. "Embarazo y lactancia"). Alteración de la función hepática grave, cirrosis biliar y colestasis. Insuficiencia renal grave (aclaramiento de creatinina <30 ml/min), anuria y pacientes sometidos a diálisis. Hipopotasemia refractaria, hiponatremia, hipercalcemia e hiperuricemia sintomática. 4.4. Advertencias y precauciones especiales de empleo. Alteraciones de las concentraciones séricas de electrólitos. El tratamiento concomitante con diuréticos ahorradores de potasio, suplementos de potasio, sustitutos de la sal que contengan potasio u otros medicamentos que puedan aumentar los niveles séricos de potasio (heparina, etc.) deberá realizarse con precaución. Se han observado casos de hipopotasemia durante el tratamiento con diuréticos tiazídicos, por lo que se recomienda monitorizar con frecuencia los niveles séricos de potasio. El tratamiento con diuréticos tiazídicos se ha asociado con hiponatremia y alcalosis hipoclorémica. Las tiazidas aumentan la excreción urinaria de magnesio, lo que puede conducir a una hipomagnesemia. La excreción de calcio disminuye con los diuréticos tiazídicos, lo que puede dar lugar a hipercalcemia. Se deberá llevar a cabo una determinación periódica de las concentraciones séricas de electrolitos a intervalos apropiados. Pacientes con depleción de sodio y/o de volumen. En los pacientes que reciben diuréticos tiazídicos debe observarse si aparecen signos clínicos de desequilibrio de líquidos o electrolitos. Los signos que indican desequilibrio de líquidos o electrolitos son sequedad de boca, sed, debilidad, letargia, somnolencia, inquietud, dolor muscular o calambres, debilidad muscular, hipotensión, oliguria, taquicardia y alteraciones gastrointestinales como náuseas o vómitos. Los enfermos con depleción grave de sodio y/o de volumen, como los que reciben dosis elevadas de diuréticos, pueden experimentar, en raras ocasiones, hipotensión sintomática después del inicio del tratamiento con Co-Vals Forte 160 mg / 25 mg. Así pues, la depleción de electrolitos y/o de volumen deberá corregirse antes de iniciar el tratamiento con Co-Vals Forte 160 mg / 25 mg. Pacientes con insuficiencia cardiaca crónica grave u otra condición con estimulación del sistema renina-angiotensina-aldosterona. En pacientes en los que la función renal pueda depender de la actividad del sistema renina-angiotensina-aldosterona (p.ej. pacientes con insuficiencia cardiaca grave), el tratamiento con inhibidores del enzima convertidor de la angiotensina se ha asociado con oliguria y/o azotemia progresiva y en casos raros con fallo renal agudo. No se ha establecido el uso de Co-Vals Forte 160 mg / 25 mg en pacientes con insuficiencia cardiaca grave. Por tanto, no puede excluirse que debido a la inhibición del sistema renina-angiotensina-aldosterona el uso de Co-Vals Forte 160 mg / 25 mg también pueda asociarse a la alteración de la función renal. Co-Vals Forte 160 mg / 25 mg no debe utilizarse en estos pacientes. Alteración de la función renal / Transplante renal. No es necesario ajustar la posología en los enfermos con alteración de la función renal con un aclaramiento de creatinina ≥ 30 ml/min (véase sección 4.3. Contraindicaciones). No se dispone de datos sobre el uso de Co-Vals Forte 160 mg / 25 mg en pacientes que hayan sufrido un transplante renal. Se recomienda un control periódico de los niveles séricos de potasio, creatinina y ácido úrico cuando se utilice Co-Vals Forte 160 mg / 25 mg en pacientes con alteración de la función renal. Estenosis de la arteria renal. No deberá utilizarse Co-Vals para tratar la hipertensión en pacientes con estenosis bilateral de la arteria renal o estenosis de la arteria en pacientes con un único riñón puesto que en estos pacientes pueden aumentar la urea en sangre y la creatinina sérica. Hiperaldosteronismo primario. Los pacientes con hiperaldosteronismo primario no deberían tratarse con Co-Vals Forte 160 mg / 25 mg ya que el sistema renina-angiotensina-aldosterona está afectado por la enfermedad primaria. Estenosis valvular aórtica y mitral, cardiomiopatía hipertrófica. Se recomienda especial precaución cuando se utilice Co-Vals Forte 160 mg / 25 mg en pacientes con estenosis aórtica o mitral, o con cardiomiopatía hipertrófica. Alteración de la función hepática. No se debe administrar Co-Vals Forte 160 mg / 25 mg en estos pacientes (véase sección 4.2. Posología y forma de administración). Lupus eritematoso sistémico. Se ha observado que los diuréticos tiazídicos exacerban o activan el lupus eritematoso sistémico. Diferencias étnicas. Valsartán es menos eficaz en la disminución de la presión arterial en pacientes de raza negra que en los de otras razas, posiblemente por la elevada prevalencia de renina baja en la población negra hipertensa. Otras alteraciones metabólicas. Los diuréticos tiazídicos pueden alterar la tolerancia a la glucosa y elevar las concentraciones séricas de colesterol, triglicéridos y ácido úrico. General. Deberá tenerse precaución en aquellos pacientes que hayan presentado hipersensiblidad previa a otro fármaco antagonista del receptor de la angiotensina II. Las reacciones de hipersensibilidad a hidrocloritiazida son más probables en pacientes con alergia y asma. 4.5. Interacción con otros medicamentos y otras formas de interacción. Otros fármacos antihipertensivos: Co-Vals Forte 160 mg / 25 mg puede aumentar el efecto hipotensor de otros fármacos antihipertensivos. Litio: Se han descrito aumentos reversibles de las concentraciones séricas de litio y de efectos tóxicos durante el uso concomitante de litio, inhibidores de la ECA y/o diuréticos tiazídicos. No existe experiencia con el uso concomitante de valsartán y litio. Por tanto, se recomienda el control periódico de las concentraciones séricas de litio durante el uso conjunto de litio y Co-Vals Forte 160 mg / 25 mg. Medicamentos que pueden aumentar los niveles de potasio o inducir hiperpotasemia: El uso concomitante de diuréticos ahorradores de potasio, suplementos de potasio, sustitutos de la sal que contengan potasio u otros medicamentos que puedan aumentar los niveles de potasio (p.ej. inhibidores de la ECA, heparina, ciclosporina), debe realizarse con precaución y controlando frecuentemente los niveles séricos de potasio (véase sección 4.4 Advertencias y precauciones especiales de empleo). El componente tiazídico de Co-Vals Forte 160 mg / 25 mg puede dar lugar a las siguientes interacciones farmacológicas: Medicamentos asociados con pérdida de potasio e hipopotasemia (p. ej. diuréticos caliuréticos, corticosteroides, laxantes, ACTH, anfotericina, carbenoxolona, penicilina G, ácido salicílico y salicilatos). Se recomienda controlar los niveles séricos de potasio si estos medicamentos deben prescribirse con la combinación hidroclorotiazida-valsartán. Estos medicamentos pueden potenciar el efecto de la hidroclorotiazida sobre el potasio sérico (véase sección 4.4 Advertencias y precauciones especiales de empleo). Medicamentos afectados por alteraciones de los niveles séricos de potasio: Se recomienda control periódico de los niveles séricos de potasio y del ECG cuando se administre Co-Vals Forte 160 mg / 25 mg junto con medicamentos que se ven afectados por alteraciones de los niveles séricos de potasio (p.ej. glicósidos digitálicos, antiarrítmicos) y medicamentos que inducen torsades de pointes (que incluyen algunos antiarrítmicos), siendo la hipopotasemia un factor de predisposición para las torsades de pointes. - Antiarrítmicos de Clase Ia (p.ej. quinidina, hidroquinidina, disopiramida) - Antiarrítmicos de Clase III (p.ej. amiodarona, sotalol, dofetilida, ibutilida) - Algunos antipsicóticos (p.ej. tioridazina, clorpromazina, levomepromazina, trifluoperazina, ciamemazina, sulpiride, sultopride, amisulpride, tiapride, pimozide, haloperidol, droperidol). - Otros (p.ej. bepridilo, cisapride, difemanilo, eritromicina i.v., halofantrina, ketanserina, mizolastina, pentamidina, sparfloxacino, terfenadina, vincamina intravenosa (i.v.). Glucósidos digitálicos: La hipopotasemia o la hipomagnesemia provocada por las tiazidas pueden presentarse como efectos indeseados, favoreciendo la aparición de arritmias cardíacas causadas por digitálicos. Sales de calcio y vitamina D: El uso concomitante de diuréticos tiazídicos con vitamina D o con sales de calcio puede potenciar el aumento de los niveles séricos de calcio. Medicamentos antidiabéticos (insulina y medicamentos orales): Puede ser necesario un ajuste posológico del medicamento antidiabético. Betabloqueantes y diazóxido: El uso concomitante de diuréticos tiazídicos con betabloqueantes puede aumentar el riesgo de hiperglucemia. Los diuréticos tiazídicos pueden incrementar el efecto hiperglucémico del diazóxido. Medicamentos usados para el tratamiento de la gota (probenecid, sulfinpirazona y alopurinol): Puede ser necesario un ajuste posológico de la medicación uricosúrica ya que la hidroclorotiazida puede elevar el nivel del ácido úrico sérico. Puede ser necesario aumentar la dosis de probenecid o sulfinpirazona. La administración concomitante de diuréticos tiazídicos puede aumentar la incidencia de reacciones de hipersensibilidad a alopurinol. Agentes anticolinérgicos (p.ej. atropina, biperideno): La biodisponibilidad de los diuréticos tiazídicos puede aumentar con los fármacos anticolinérgicos, debido a una disminución de la motilidad gastrointestinal y de la velocidad de vaciado del estómago. Aminas presoras (p.ej. noradrenalina, adrenalina): El efecto de las aminas presoras puede disminuir. Amantadina: Las tiazidas pueden elevar el riesgo de efectos indeseados debidos a la amantadina. Resinas de colestiramina y colestipol: La absorción de los diuréticos tiazídicos disminuye en presencia de resinas de intercambio aniónico. Fármacos citotóxicos (p.ej. ciclofosfamida, metotrexato): Las tiazidas pueden reducir la excreción renal de los medicamentos citotóxicos y potenciar sus efectos mielosupresores. Fármacos antiinflamatorios no esteroideos: La administración concomitante de fármacos antiinflamatorios no esteroideos (p. ej. derivados del ácido salicílico, indometacina) puede disminuir el efecto diurético y antihipertensivo del componente tiazídico. Una hipovolemia concomitante puede provocar una insuficiencia renal aguda. Relajantes del músculo esquelético no despolarizantes (p.ej. tubocuranina): Los diuréticos tiazídicos potencian la acción de los derivados del curare. Ciclosporina: El tratamiento concomitante con ciclosporina puede elevar el riesgo de hiperuricemia y de complicaciones de tipo gotoso. Tetraciclinas: La administración concomitante de tetraciclinas y diuréticos tiazídicos aumenta el riesgo de incremento de la urea inducido por tetraciclinas. Probablemente esta interacción no sea aplicable a la doxiciclina. Alcohol, anestésicos y sedantes: Puede potenciarse la hipotensión postural. Metildopa: Se han descrito casos aislados de anemia hemolítica en pacientes a los que se administraba de forma concomitante metildopa e hidroclorotiazida. 4.6. Embarazo y lactancia. Los antagonistas de la angiotensina II pueden causar lesiones fetales similares a los efectos fetales producidos por los inhibidores de la enzima convertidora de la angiotensina (IECA). Se ha observado que la exposición intrauterina durante el segundo y tercer trimestre de gestación a los inhibidores de la enzima convertidora de la angiotensina (IECA) provoca lesiones y muerte del feto en desarrollo. La hidroclorotiazida atraviesa la barrera placentaria y la exposición intrauterina a los diuréticos tiazídicos se asocia con trombocitopenia en el feto o en el recién nacido y puede acompañarse de otras reacciones adversas observadas en adultos. Como ocurre con cualquier otro medicamento con acción directa sobre el sistema renina-angiotensina-aldosterona (SRAA), el tratamiento con Co-Vals Forte 160 mg / 25 mg no debe utilizarse durante el embarazo. Si se produce un embarazo durante el tratamiento, debe interrumpirse la terapia con Co-Vals Forte 160 mg / 25 mg lo antes posible. Se desconoce si valsartán se excreta en la leche materna, aunque sí se excreta en la leche de las ratas que amamantan. La hidroclorotiazida se excreta en la leche materna, por lo que se desaconseja el uso de Co-Vals Forte 160 mg / 25 mg en madres lactantes (véase sección. 4.3 Contraindicaciones). 4.7. Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria. No se han realizado estudios sobre el efecto de Co-Vals Forte 160 mg / 25 mg en la capacidad de conducción y la utilización de maquinaria. Al conducir o utilizar maquinaria, debe tenerse en cuenta que ocasionalmente puede aparecer mareo o fatiga. 4.8. Reacciones adversas. Combinación a dosis fija. A continuación se presentan las reacciones adversas clasificadas por sistemas y órganos observadas más frecuentemente en los ensayos clínicos con valsartán e hidroclorotiazida frente a placebo o procedentes de informes independientes. Durante el tratamiento con Co-Vals Forte 160 mg / 25 mg pueden aparecer reacciones adversas debidas a la administración de solamente uno de sus componentes, a pesar de que no se hayan observado en los ensayos clínicos. Las reacciones adversas están ordenadas según su frecuencia utilizando la siguiente clasificación: muy frecuentes (>1/10), frecuentes (>1/100, <1/10), poco frecuentes (>1/1000, < 1/100), rara (>1/10000, < 1/1000), muy rara (< 1/10000) incluyendo casos aislados. Alteraciones hemáticas y del sistema linfático. Muy rara. Trombocitopenia, anemia. Alteraciones del oído y del laberinto. Rara. Vértigo, tinnitus. Alteraciones oculares. Poco frecuentes. Visión anormal. Alteraciones gastrointestinales. Frecuentes. Diarrea. Poco frecuentes. Náuseas, dispepsia, dolor abdominal. Alteraciones generales y condiciones en el lugar de administración. Frecuentes. Fatiga. Rara. Sudoración. Muy rara. Hemorragia, edema, alopecia. Alteraciones del sistema inmune. Muy rara. Reacciones de hipersensibilidad y alérgicas, enfermedad del suero. Infecciones e infestaciones. Frecuentes. Nasofaringitis. Poco frecuentes. Infecciones de las vías respiratorias altas, infecciones de las vías urinarias, infecciones virales, rinitis. Investigación. Poco frecuentes. Aumento de los niveles séricos de ácido úrico, bilirrubina y creatinina, hipopotasemia, hiponatremia. Alteraciones musculoesqueléticas, del tejido conectivo y óseas. Poco frecuentes. Dolor en las extremidades, luxaciones y esguinces, artritis. Rara. Mialgia, debilidad muscular. Alteraciones del sistema nervioso. Poco frecuentes. Mareo. Alteraciones respiratorias, torácicas y del mediastino. Poco frecuentes. Tos. Alteraciones de la piel y del tejido subcutáneo. Muy rara. Angioedema, erupción cutánea, prurito, vasculitis dérmica. Alteraciones del sistema urinario. Poco frecuentes. Micción frecuente. Alteraciones cardiovasculares. Poco frecuentes. Dolor torácico. Rara. Hipotensión. Muy rara. Arritmia cardiaca. Información adicional sobre los componentes por separado: Las reacciones adversas observadas anteriormente con la administración de uno de los componentes pueden ser reacciones adversas potenciales de Co-Vals Forte160 mg / 25 mg, a pesar de que no se hayan observado en los ensayos clínicos realizados con este medicamento. Valsartán. Poco frecuentes: artralgia; dolor de espalda, sinusitis. Raras: gastroenteritis, neuralgia, ECG_2_portada 21/7/06 09:32 Página 2 astenia, conjuntivitis, epistaxis, depresión, calambres en las piernas, calambres musculares, insomnio, vértigo. Los datos posteriores a la comercialización del producto muestran ocasionalmente angioedema, rash, prurito y otras reacciones alérgicas incluyendo enfermedad del suero y vasculitis. También se ha registrado muy raramente función renal deteriorada. En algunos casos se intensificó temporalmente el deterioro previo de la función renal. Se han observado elevaciones poco frecuentes de los valores de la función hepática en pacientes tratados con valsartán. Hidroclorotiazida. Se han observado las siguientes reacciones adversas en los pacientes tratados con diuréticos tiazídicos solos, incluyendo hidroclorotiazida, frecuentemente a dosis más elevadas que las contenidas en Co-Vals Forte 160 mg / 25 mg. Frecuentes: urticaria y otras formas de erupción cutánea, pérdida de apetito, ligeras náuseas y vómito, hipotensión postural, impotencia. Raras: fotosensibilización, estreñimiento, diarrea, malestar gastrointestinal, colestasis intrahepática o ictericia, arritmias cardíacas, cefalea, mareos o aturdimiento, trastornos del sueño, depresión, parestesias, trastornos de la visión y trombocitopenia, a veces con púrpura. Muy raras: vasculitis necrotizante y necrolisis tóxica epidérmica, reacciones similares al lupus eritematoso cutáneo, reactivación de lupus eritematoso cutáneo, pancreatitis, leucopenia, agranulocitosis, depresión de la médula ósea, anemia hemolítica, reacciones de hipersensibilidad, insuficiencia respiratoria incluyendo neumonitis y edema pulmonar. Trastornos electrolíticos y metabólicos: véase sección 4.4 Advertencias y precauciones especiales de empleo. 4.9. Sobredosis. No existe ninguna experiencia de sobredosis con Co-Vals Forte 160 mg / 25 mg.. El principal síntoma que cabría esperar por sobredosis sería una marcada hipotensión con mareo. Además, se pueden presentar los siguientes signos y síntomas debidos a una sobredosis por hidroclorotiazida: náusea, somnolencia, hipovolemia y alteraciones electrolíticas asociadas con arritmias cardíacas y espasmos musculares. Las medidas terapéuticas dependen del momento de la ingestión y del tipo y gravedad de los síntomas, siendo de suma importancia la estabilización hemodinámica. Debe administrarse siempre al paciente una cantidad suficiente de carbón activado. Si se produce hipotensión, se colocará al paciente en posición supina y se administrarán rápidamente suplementos de sal y de volumen. Valsartán no puede eliminarse por hemodiálisis debido a su fuerte unión a proteínas plasmáticas, pero la hidroclorotiazida sí puede depurarse por diálisis. 5. Propiedades farmacológicas. 5.1. Propiedades farmacodinámicas. Grupo farmacoterapéutico: Antagonistas de la angiotensina II y diuréticos, valsartán y diuréticos (código ATC: C09D A03). Valsartán. Valsartán es un antagonista específico de los receptores de la angiotensina II (Ang II) con actividad por vía oral. Esta sustancia actúa de manera selectiva sobre el receptor subtipo AT1, responsable de las acciones conocidas de la angiotensina II. La elevación de los niveles de angiotensina II tras el bloqueo del receptor AT1 con valsartán puede estimular al receptor AT2 que no está bloqueado, lo que parece compensar el efecto del receptor AT1. Valsartán no posee ninguna actividad agonista parcial en el receptor AT1 y muestra una afinidad muy superior (aproximadamente 20.000 veces mayor) por el receptor AT1 que por el receptor AT2. Valsartán tampoco inhibe la ECA, también conocida como quininasa II, que transforma la Ang I en Ang II y degrada la bradiquinina. No debe esperarse una potenciación de los efectos indeseados relacionados con la bradiquinina. La incidencia de tos seca resultó significativamente menor (p<0,05) en los pacientes tratados con valsartán durante los ensayos clínicos comparativos frente a un IECA (2,6% con valsartán frente a 7,9% con el IECA). En un ensayo clínico, en el que intervinieron enfermos con antecedentes de tos seca durante el tratamiento con IECA, el 19,5% y el 19,0% de los que recibieron valsartán o un diurético tiazídico respectivamente, experimentaron tos, frente al 68,5% de los tratados con el IECA (p<0,05%). Valsartán no se une ni tampoco bloquea otros receptores hormonales o canales iónicos que intervienen en la regulación cardiovascular. La administración de valsartán a los enfermos hipertensos reduce la presión arterial sin modificar la frecuencia cardiaca. Cuando se administra una dosis oral única, el inicio de la actividad antihipertensiva tiene lugar en las primeras dos horas en la mayoría de pacientes y la reducción máxima de la presión arterial se alcanza a las 4 - 6 horas. El efecto antihipertensivo persiste durante 24 horas después de la dosis. Cuando se administran dosis repetidas, la reducción máxima de la presión arterial suele ocurrir entre la 4 - 8 semanas con todas las dosis y se mantiene durante el tratamiento prolongado. Si se añade hidroclorotiazida, se observa una reducción adicional y significativa de la presión arterial. Hidroclorotiazida. El lugar de acción de los diuréticos tiazídicos es principalmente el túbulo contorneado distal renal. Se ha demostrado que en la corteza renal existe un receptor con una afinidad elevada que es el lugar de unión principal para la acción del diurético tiazídico y la inhibición del transporte de NaCl (cloruro sódico) en el túbulo contorneado distal. El mecanismo de acción de las tiazidas consiste en la inhibición del sistema de cotransporte Na+Cl-, tal vez compitiendo por el lugar del ión cloruro, por lo que se afectan los mecanismos de reabsorción de los electrolitos: de manera directa aumentando la excreción de sodio y de cloruro en una magnitud aproximadamente igual, e indirectamente, por su acción diurética, reduciendo el volumen plasmático y con aumentos consecuentes de la actividad de la renina plasmática, la secreción de aldosterona, la pérdida urinaria de potasio y una disminución del potasio sérico. El enlace renina-aldosterona está mediado por la angiotensina II, de manera que con la administración concomitante de valsartán, la reducción de potasio sérico es menos marcada que la observada con hidroclorotiazida sola. Valsartán/hidroclorotiazida. Un ensayo multicéntrico, aleatorizado, doble ciego, paralelo, con control activo ha demostrado una normalización de la presión arterial en pacientes no respondedores a hidroclorotiazida (definida como presión arterial diastólica en sedestación inferior a 90 mmHg), en el 42,6% de los pacientes tratados con Co-Vals 80 mg / 12, 5 mg. Un segundo ensayo aleatorizado, doble ciego, con control activo, paralelo ha demostrado que la combinación a dosis fija de valsartán 160 mg con hidroclorotiazida 12,5 mg o 25 mg mejora el control de la presión arterial en una proporción mayor de pacientes que la monoterapia con valsartán 160 mg. Además, la combinación a dosis fija con hidroclorotiazida 25 mg fue significativamente más eficaz que la combinación a dosis fija con la dosis más baja de hidroclorotiazida. Se observaron las siguientes tasas de respondedores: valsartán 160 mg: 49%; valsartán 160 mg + hidroclorotiazida 12,5 mg: 61,7%; valsartán 160 mg + hidroclorotiazida 25 mg: 68%. En estudios clínicos controlados con valsartán + hidroclorotiazida se observó hipopotasemia dependiente de la dosis. La hipopotasemia se presentó con mayor frecuencia en pacientes que recibieron 25 mg de hidroclorotiazida que en aquellos que recibieron 12,5 mg de hidroclorotiazida. En menos de un 1% de pacientes que recibieron una combinación de valsartán e hidroclorotizida se registraron reacciones posturales dependientes de la dosis. Desde dosis de valsartán 80 mg e hidroclorotiazida 12,5 mg a dosis de valsartán 160 mg e hidroclorotiazida 25 mg se observó un aumento dependiente de la dosis en la frecuencia de “mareo”. En un estudio no controlado en el que Co-Vals Forte 160 mg / 25 mg se administró durante 4 semanas a pacientes no tratados adecuadamente con valsartán 160 mg e hidroclorotiazida 12,5 mg el colesterol total aumentó de 209 a 220 mg/dl. Actualmente se desconocen los efectos beneficiosos de valsartán en combinación con hidroclorotiazida sobre la morbididad y mortalidad cardiovascular. Los estudios epidemiológicos han mostrado que el tratamiento a largo plazo con hidroclorotiazida reduce el riesgo de morbididad y mortalidad cardiovascular. Se están realizando estudios para investigar los efectos de valsartán y de valsartán combinado con hidroclorotiazida en morbididad y mortalidad cardiovascular. 5.2. Propiedades farmacocinéticas. Valsartán. La absorción del valsartán después de la administración oral tiene lugar rápidamente, si bien la cantidad absorbida es muy variable. La biodisponibilidad absoluta media de valsartán es del 23%. La cinética de eliminación de valsartán es multiexponencial (t1/2 a<1h y t1/2 b aprox. 9 h). Valsartán sigue una farmacocinética lineal en el rango de dosis estudiado. Tras administración repetida, la cinética sigue siendo lineal y la acumulación después de administrar una dosis diaria es muy escasa. Las concentraciones plasmáticas en personas de ambos sexos fueron similares. Valsartán presenta una elevada fijación a las proteínas séricas (94-97%), principalmente a la albúmina. El volumen de distribución, en estado estacionario, es de aprox. 17 l. El aclaramiento plasmático es relativamente bajo (aprox. de 2 l/hora) comparado con el flujo sanguíneo hepático (aprox. 30 l/hora). Valsartán se elimina principalmente como compuesto inalterado en la bilis y en la orina. Con una tasa de filtración glomerular normal (120 ml/min), el aclaramiento renal representa aprox. el 30% del aclaramiento plasmático total. Se ha identificado un metabolito hidroxi en plasma a concentraciones bajas (menos del 10% del AUC de valsartán). Este metabolito es farmacológicamente inactivo. Tras administración oral de valsartán, el 83% se excreta en heces y el 13% en orina, principalmente como compuesto inalterado. Si se administra valsartán con la comida, se reduce el área bajo la curva de la concentración plasmática (AUC) de valsartán en un 48%, aunque, a partir de la 8ª hora post-dosis, las concentraciones plasmáticas de valsartán en los grupos que recibieron la medicación en ayunas y con alimento son similares. Sin embargo, este descenso del AUC no se acompaña de una disminución clínicamente significativa del efecto terapéutico. Hidroclorotiazida. La absorción de la hidroclorotiazida es rápida (tmax de aprox. de 2 horas) después de una dosis oral, presentando las formulaciones en suspensión y en comprimidos características de absorción similares. La cinética de distribución y de eliminación ha sido generalmente descrita mediante una función biexponencial, con una vida media terminal de 6 a 15 horas. El aumento de la AUC media es lineal y proporcional a la dosis dentro del rango terapéutico. La cinética de la hidroclorotiazida no se modifica por la administración repetida y la acumulación es mínima cuando se administra una vez al día. El volumen aparente de distribución es de 4-8 l/kg. La hidroclorotiazida circulante se une a proteínas séricas (40-70%), principalmente a la albúmina sérica. La hidroclorotiazida también se acumula en los eritrocitos en aproximadamente 1,8 veces el nivel plasmático. Después de la administración oral, la biodisponibilidad absoluta de la hidroclorotiazida es del 60 al 80%, excretándose más del 95% de la dosis en la orina de forma inalterada. Se ha observado que la administración concomitante con comida puede tanto aumentar como disminuir la disponibilidad sistémica de la hidroclorotiazida en comparación con el ayuno. Estos efectos son leves y carecen de importancia clínica. Valsartán/hidroclorotiazida. La disponibilidad sistémica de la hidroclorotiazida disminuye en aproximadamente un 30% al administrarse de manera conjunta con valsartán. La cinética de valsartán no se modifica de manera marcada con la administración concomitante de hidroclorotiazida. Esta interacción no afecta el uso combinado de valsartán e hidroclorotiazida, ya que los ensayos clínicos controlados han demostrado un evidente efecto antihipertensivo, superior al que se obtiene con cada medicamento solo o con la administración de placebo. Poblaciones especiales. Pacientes de edad avanzada. Algunas personas de edad avanzada muestran una exposición sistémica a valsartán algo más elevada que los sujetos jóvenes; sin embargo, esta diferencia no ha mostrado tener ninguna relevancia clínica. Los limitados resultados de que se dispone sugieren que el aclaramiento sistémico de la hidroclorotiazida disminuye tanto en personas de edad avanzada sanas como hipertensas, cuando se compara con voluntarios sanos jóvenes. Alteración de la función renal. La dosis recomendada de Co-Vals Forte 160 mg / 25 mg no hace necesario ajustar la dosis en pacientes con un aclaramiento de creatinina de 30 a 70 ml/min. No se dispone de información sobre la administración de Co-Vals Forte 160 mg / 25 mg en pacientes que sufran una alteración renal grave (aclaramiento de creatinina <30 ml/min) y en pacientes sometidos a diálisis. Valsartán presenta una elevada fijación a las proteínas plasmáticas y no puede eliminarse por diálisis, mientras que la hidroclorotiazida sí. El aclaramiento renal de la hidroclorotiazida consiste en una filtración pasiva y una secreción activa en el túbulo renal. Por ello, es previsible que para un compuesto cuyo aclaramiento se efectúa casi exclusivamente por vía renal, la función renal posea un marcado efecto sobre la cinética de la hidroclorotiaz. ida (véase sección 4.3. Contraindicaciones). Alteración de la función hepática. En un ensayo farmacocinético en pacientes con disfunción hepática ligera (n=6) y moderada (n=5), la exposición a valsartán ha demostrado un aumento de aproximadamente el doble en los valores de AUC y Cmáx comparada con sujetos sanos. Por tanto, Co-Vals Forte 160 mg / 25 mg no debe utilizarse en estos pacientes (véase sección 4.2. Posología y forma de administración). No se dispone de datos sobre el uso de valsartán en pacientes con disfunción hepática grave (véase sección 4.3. Contraindicaciones). La enfermedad hepática no afecta significativamente la farmacocinética de la hidroclorotiazida. 5.3. Datos preclínicos sobre seguridad. Se investigó la toxicidad potencial de la combinación de valsartán e hidroclorotiazida tras la administración oral en ratas y titís en estudios de hasta seis meses de duración y no surgieron hallazgos que excluyeran su uso a dosis terapéuticas en el hombre. Los cambios producidos por la combinación en los estudios de toxicidad crónica parecen causados probablemente por valsartán. El órgano diana toxicológico era el riñón, siendo la reacción más marcada en titís que en ratas. La combinación dio lugar a una lesión renal (nefropatía con basofilia tubular, aumentos de la urea plasmática, la creatinina plasmática y el potasio sérico, aumentos del volumen de orina y de electrolitos urinarios desde 30 mg/kg/día de valsartán + 9 mg/kg/día de hidroclorotiazida en ratas y 10 + 3 mg/kg/día en titís), probablemente debido a una hemodinamia renal alterada. Dosis elevadas de la combinación de valsartán e hidroclorotiazida causaron disminuciones en los índices eritrocitarios (recuento de eritrocitos, hemoglobina, hematocrito, a partir de 100 + 31 mg/kg/día en ratas y 30 + 9 mg/kg/día en titís). En titís, se observó un deterioro de la mucosa gástrica (a partir de 30 + 9 mg/kg/día). La combinación también dio lugar a hiperplasia de las arteriolas aferentes renales (a 600 + 188 mg/kg/día en ratas y a partir de 30 + 9 mg/kg/día en titís). Los efectos mencionados parecen ser debidos a los efectos farmacológicos de las dosis elevadas de valsartán (bloqueo de la angiotensina II-inhibición inducida de la liberación de renina, con estimulación de las células productoras de renina), pero también se presentan con los inhibidores de la ECA. Parece que estos hallazgos carecen de relevancia para el uso de dosis terapéuticas de valsartán en el hombre. La combinación de valsartán e hidroclorotiazida no se estudió en cuanto a mutagenicidad, rotura cromosómica o carcinogénesis, puesto que no existe evidencia de interacción entre las dos sustancias. No obstante, estas pruebas se realizaron de forma separada con valsartán e hidroclorotiazida y no mostraron evidencia de mutagenicidad, rotura cromosómica ni carcinogénesis. 6. Datos farmacéuticos . 6.1. Lista de excipientes. Núcleo del comprimido: Celulosa microcristalina. Acido silícico coloidal. Crospovidona. Estearato de magnesio . Película: Hipromelosa. Macrogol 4000. Talco. Dióxido de titanio (E171). Rojo óxido de hierro (E172). Amarillo óxido de hierro (E172). Negro óxido de hierro (E172). 6.2. Incompatibilidades. No se han descrito. 6.3. Período de validez. 2 años. 6.4. Precauciones especiales de conservación. No conservar a temperatura superior a 30ºC. Conservar en el envase original para proteger de la humedad. 6.5. Naturaleza y contenido del recipiente. Blisters de Al/PVC/PE/PVDC. Envase con 14 (1x14), 28 (2x14), 56 (4x14) o 98 (7x14) comprimidos recubiertos con película. Envases de uso hospitalario: 98 (98x1 UD), 280 (10x28) y 280 (20x14) comprimidos recubiertos con película. No todas las presentaciones se encuentran comercializadas. Con receta médica. (PVP+IVA) 36,48€. Incluido en el Sisitema Nacional de Salud. Aportación normal. 6.6. Instrucciones de uso y manipulación. Sin requisitos especiales.. 7. Titular de la autorización de comercialización. Laboratorios Dr. Esteve, S.A. Avda. Mare de Déu de Montserrat, 221. 08041 Barcelona. 8. Número(s) de la autorización de comercialización. 9. Fecha de la primera autorización/ renovación de la autorización. 10. Fecha de la revisión (parcial) del texto. Enero 2005 © Laboratorios Dr. Esteve S. A. 2006 09:32 Página 1 Bases de la electrocardiografía – Semiología electrocardiográfica II 21/7/06 1900710 ECG_2_portada CONSULTA DE CARDIOLOGÍA Bases de la electrocardiografía Semiología electrocardiográfica II: Patrones diagnósticos de crecimientos, bloqueos y preexcitación Antoni Bayés de Luna