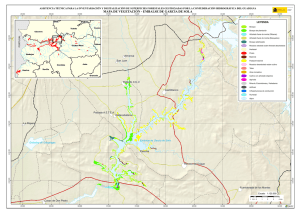
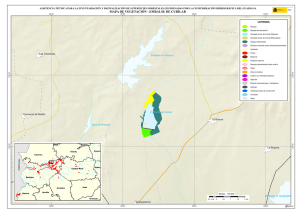
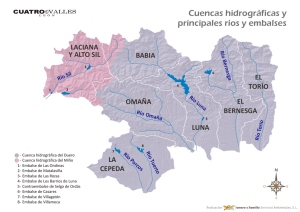
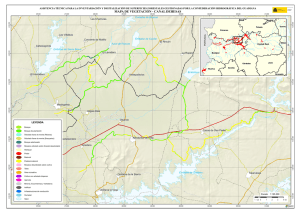
capítulo 1 - Departamento de Ecologia
Anuncio

Capítulo 1 ● Organismos como indicadores de la contaminación CAPÍTULO 1 EL USO DE ORGANISMOS COMO INDICADORES DE LA CONTAMINACIÓN Y EVALUACIÓN DEL RIESGO SOBRE EL ECOSISTEMA ACUÁTICO EN EL EMBALSE DE FLIX (CATALUNYA, NE DE ESPAÑA) Julio César López-Doval1,2, Carles Barata3 & Sergi Díez3 1 - Departament d’Ecología, Universitat de Barcelona, Barcelona, Catalunya, España. 2 - Laboratório de Limnologia, Departamento de Ecologia-Instituto de Biociências, Universidade de São Paulo, São Paulo, Brasil. 3- Departament de Química Ambiental, Institut de Diagnosi Ambiental i Estudis de l'Aigua, IDAEA-CSIC, Jordi Girona, Barcelona, Catalunya, España. E-mail: [email protected] RESUMO O reservatório de Flix se localiza na Catalunha (Espanha), na localidade do mesmo nome, e num trecho do rio Ebro afetado por uma fábrica química dedicada à produção de compostos derivados do cloro. É o último reservatório deste rio e se situa a uns 100 km a montante da foz. Tem uma área de 320 ha, uma profundidade média de 3,4 m, uma capacidade de 11 hm3 e um tempo de residência de 0,29 dias. A entrada de poluentes neste ponto tem sido continuada durante cerca de 100 anos deixando no reservatório um volume de sedimentos contaminados de cerca de 360.000 toneladas e uma área de 9 ha. Os poluentes mais importantes em termos de abundância são os metais pesados, os organoclorados e os radionuclídeos. Neste reservatório tem havido vários estudos, utilizando os organismos que ali habitam, a fim de determinar o risco desta contaminação sobre a biota. A análise dos tecidos de diferentes organismos revelou que compostos organoclorados e metais pesados foram incorporados aos organismos e foi demonstrada a transferência dos contaminantes ao longo da cadeia alimentar. A utilização de biomarcadores demonstrou alterações a níveis moleculares e histológicos devido à presença destes poluentes no meio. Estudos em pontos rio abaixo deste reservatório e em ecossistemas próximos demonstraram transporte dos contaminantes para fora do reservatório e afetando a fauna local. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 1 Capítulo 1 ● Organismos como indicadores de la contaminación 1 INTRODUCCIÓN 1.1 EL USO DE LOS ORGANISMOS COMO INDICADOREES DE ESTRÉS QUÍMICO Tanto la estructura de las poblaciones como el estado fisiológico de los organismos han sido usados como indicadores de la calidad de los medios acuáticos. El uso de organismos como indicadores de la calidad del agua para uso humano se inició en Alemania al final del siglo XIX (HYNES, 1960) pero no fue hasta 1970 cuando la preocupación por la conservación de los ecosistemas en sí mismos hizo cambiar el enfoque y se usaron los organismos como indicadores del estado ecológico del medio (BONADA et al., 2006). Algas, macrófitos, invertebrados bentónicos y peces son organismos comúnmente incluidos en los programas de monitorización de la calidad de las masas de agua. Otros organismos como protozoos, bacterias o anfibios también se han incluido en programas de monitoreo, pero de manera muy marginal debido a las dificultades que generan en su identificación y/o recolección. Estos organismos reflejan perturbaciones en el ecosistema a escalas temporales relativamente elevadas. Incluso cuando la perturbación en sí ha desaparecido, los organismos dan cuenta de ella en función de los efectos que dicha perturbación ha causado en sus poblaciones o su fisiología. Para que un grupo de organismos sea adecuado para ser usado como indicador debe cumplir unos requisitos mínimos, como tener una amplia distribución, una alta diversidad taxonómica y de respuestas a gradientes ecológicos, relevancia funcional y estructural en el ecosistema, ser de fácil captura e identificables a nivel taxonómico y, por último, un tiempo de generación suficiente para reflejar los efectos de las perturbaciones. En este sentido Resh (2008) ofrece un exhaustivo estudio de las ventajas y desventajas del uso de algas, invertebrados bentónicos, peces y zooplancton. Según el autor, la elección de uno u otro organismo depende de las características del área de estudio y los objetivos del programa de monitoreo. En la Unión Europea, la Directiva Marco del Agua (Directiva 2000/60/CE del Parlamento Europeo), legislación supranacional en materia de gestión y calidad de los recursos hídricos, recomienda el uso de la composición taxonómica y la abundancia de invertebrados bentónicos, peces, fitoplancton, fitobentos y macrófitos para la evaluación del estado ecológico de los embalses. En Cataluña la administración responsable de la gestión de los recursos hídricos recomienda el uso de peces y fitoplancton para evaluar la calidad biológica de los mismos (AGÈNCIA CATALANA DE L’AIGUA, 2006). En este capítulo mostraremos como el uso de diferentes organismos acuáticos ha proporcionado información científica relevante sobre el grado de afectación de un foco de contaminación en el ecosistema circundante. Como caso de estudio explicaremos la experiencia en el embalse de Flix. En los trabajos que expondremos, se usan aves, peces, moluscos, artrópodos, algas y macrófitos, como indicadores del riesgo toxicológico de los contaminantes presentes en el embalse. El rango de respuestas estudiado es amplio y comprende respuestas a nivel molecular hasta a nivel de organismo. En los siguientes apartados explicaremos cómo se han podido medir alteraciones de los parámetros estudiados respecto a valores considerados normales y cómo se han podido establecer relaciones entre la presencia de contaminantes y las respuestas observadas en los organismos. 1.2 EL EMBALSE DE FLIX Y LA FACTÓRIA QUÍMICA ERCROS: CONTEXTO, ANTECEDENTES HISTÓRICOS Y CARACTERIZACIÓN DE LA CONTAMINACIÓN El embalse de Flix se encuentra en Catalunya (España), en la localidad de mismo nombre, y en un tramo del río Ebro afectado por una factoría química dedicada a la producción de compuestos derivados del cloro. Es el último embalse de este río y está situado a unos 100 km aguas arriba de la desembocadura (Figura 1). El embalse se construyó en 1948 y posee una superficie de 320 ha, con una profundidad media de 3,4 m y una máxima de 16 m en la represa. Tiene una capacidad de 11 hm3 y un tiempo de residencia de 0,29 días (NAVARRO et al., 2006a). Esto se debe a que la Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 2 Capítulo 1 ● Organismos como indicadores de la contaminación finalidad de este embalse es fundamentalmente abastecer una pequeña central hidroeléctrica destinada a proveer energía eléctrica a la factoría química situada en la margen derecha del río. La velocidad media es de 100 m3/s en verano y 600 m3/s en invierno, por tanto tiene cierto poder erosivo sobre los sedimentos acumulados tanto en el lecho como en las orillas. La construcción de la factoría química Ercros Industrial S.A. de Flix y del embalse comportó una serie de cambios en la hidrografía de este tramo del río Ebro, tanto en el cauce como en el margen derecho. Algunos de los cambios a raíz de la construcción de la represa fueron un aumento del nivel del río en este punto, la desaparición de una isla natural que se situaba delante del complejo químico, la eliminación de un canal de navegación fluvial y de un antiguo azud, además de modificaciones en la orilla derecha para adecuarla a la instalación de las turbinas generadoras, los canales que las alimentan y un nuevo canal de navegación. Por su parte, la factoría desde su origen fue modificando la orilla derecha del embalse bien por ganancia de terreno al embalse para expansión de la fábrica (mediante el vertido de residuos sólidos provenientes de las calderas, como escorias de lignito y otros materiales de relleno), bien por el vertido de residuos de la actividad industrial (lodos o material en suspensión en las aguas de desecho) que sedimentaron en el lecho del embalse, proceso este último que ha durado hasta la instalación de plantas para el tratamiento de estos residuos. Como se explicará más adelante, estos vertidos contaminantes han generado deposiciones emergidas en la orilla de la factoría y sedimentos en el lecho del embalse. Con posterioridad a 1990 los responsables de las instalaciones realizaron alguna medida correctora en las zonas emergidas de los lodos con el fin de estabilizarlos. La construcción, aguas arriba, de otros embalses mucho más grandes y con tiempos de retención mayores (Mequinenza en 1966, capacidad 1534 hm3 y Riba-roja en 1969, 210 hm3) contribuyó también a modificar la hidrodinámica del río Ebro aguas abajo. Estos embalses al regular en gran medida en caudal del río Ebro aguas abajo, favorecen los procesos sedimentarios en el propio embalse de Flix. Figura 1: Situación de la localidad de Flix y su embalse en la Península Ibérica. Imágenes obtenidas del Institut Cartogràfic de Catalunya y Wikipedia. La factoría química inició su actividad en el año 1899. Su actividad principal era la producción de cloruros y sosa mediante electrolisis de la sal común. En 1949 esta factoría empezó a utilizar Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 3 Capítulo 1 ● Organismos como indicadores de la contaminación mercurio en el proceso de electrolisis para la obtención de cloro, tecnología que se sigue usando hoy en día. Históricamente esta factoría ha producido otros compuestos químicos como tricloroetileno (de 1928 a 1990), diclorodifeniltricloroetano (DDTs de 1945 a 1971), policlorobifenilos (PCBs de 1959 a 1983), clorobenceno (de 1947 a 1980) fosfato bicálcico (de 1973 hasta la actualidad), percloroetileno y tetracloruro de carbono (de 1972 hasta el presente), entre otros compuestos orgánicos e inorgánicos y derivados del cloro. A partir de 1950, con la construcción de la represa y la pequeña central eléctrica, la producción de la fábrica se intensifica y diversifica, manteniendo una alta actividad hasta finales de los años 80, llegando a producir 140.000 toneladas de cloro al año. En los años 1985 y 1986 la legislación española introduce una serie de normativas que incluyen límites cuantitativos y cualitativos en los vertidos y obligan a la implementación de elementos de control de la calidad de los mismos e instalaciones depuradoras. De esta manera entre los años 1988 y 1996 la factoría incorpora una serie de procesos (filtración de lodos, instalación de una planta depuradora y otra de eliminación de mercurio) para adecuar la calidad de sus vertidos a lo establecido por la ley, ya que previamente los residuos eran evacuados directamente al río. Por otra parte, en los años 80 y 90, la legislación prohíbe la síntesis de diferentes derivados organoclorados (PCBs, hexacloetano, cloruro de amonio, tricloetileno…). Esto comporta que en los años 90 se refuerce la producción de fosfato bicálcico, hipoclorito sódico y ácido clorhídrico llegando a una producción en la actualidad de 740.000 toneladas anuales. En los últimos tiempos, la coyuntura internacional hace que la producción de la factoría disminuya, lo que provoca el cierre gradual de líneas de producción y reducción de plantilla desde el año 2009 hasta nuestros días. Pese a estas medidas, en el embalse se han acumulado una serie de aportes sólidos contaminados por metales pesados, radionucleidos y compuestos orgánicos (GRIMALT et al., 2003). En diciembre de 2001 se produjo una gran mortandad de peces aguas abajo de la presa de Flix. A raíz de este episodio la Agencia Catalana del Agua (ACA) encontró unos niveles extremadamente altos de mercurio en el agua del río a la vez que la compañía proveedora de agua de boca de la región encontró valores por encima de 1 μg/L, valor máximo permitido. Con anterioridad a esta fecha la ACA y la Confederación Hidrográfica del Ebro (organismo estatal de gestión y control de los recursos hídricos de la cuenca del río Ebro) había encargado estudios sobre la calidad de los sedimentos acumulados en el embalse, los estudios evidenciaron contaminación por metales pesados y compuestos orgánicos. Montañés et al., (1990) y Swindlehurst et al. (1995) atribuyeron en sendos trabajos a la factoría de Flix la contaminación por organoclorados y metales pesados detectados en los sedimentos depositados en el embalse y aguas abajo y advertían de sus riesgos. Fernández et al., (1999) describió concentraciones de diferentes contaminantes orgánicos (plaguicidas organoclorados y PCB) varios órdenes de magnitud por encima de los valores encontrados en otros puntos del río Ebro. Estudios posteriores a este incidente (GRIMALT et al., 2003), encargados por la Administración Catalana, pusieron de manifiesto la antes citada contaminación histórica de los sedimentos del río debida a la actividad industrial. Se estimó un volumen de sedimentos contaminados de unos 186.000 m3 (o 200.000-360.000 toneladas) y una superficie de 9 ha. En el estudio de Grimalt et al., (2003), los investigadores observaron que la contaminación de los sedimentos de Flix es elevada y variada. Se encontraron cantidades significativamente elevadas de metales pesados, compuestos organoclorados y materiales radioactivos. Los metales pesados estudiados fueron Hg, Cr, Ni, Cu, Zn, As, Se, Cd, Pb, Mn y Ti. De ellos, Hg, Cr, Ni, Cd, Zn, As y Cu, (GRIMALT et al., 2003) presentaron concentraciones significativamente más altas, entre 1 y 2 órdenes de magnitud, 4 en el caso del Hg y entre 4 y 8 en el caso del Zn, que aquellas encontradas en sedimentos considerados no contaminados. Los valores oscilaron entre 0,067-440 μg/g para el Hg, entre 9,4-750 μg/g para Cr, los 23-160 μg/g para el Ni, 0,03-12 μg/g para el Cd, 2,89-394 μg/g para el Zn, 3,1-38 μg/g para el As y 12-106 μg/g para el Cu. La presencia de los metales Cd, Ni o Cr puede ser debida a residuos originarios del proceso de obtención de fosfato bicálcico. En el caso del Hg su presencia es debida a fugas o residuos en el Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 4 Capítulo 1 ● Organismos como indicadores de la contaminación proceso de electrólisis con celdas de cátodos de mercurio, mientras que para los metales Zn, As y Cu no se puede definir un origen claro. Los compuestos organoclorados estudiados fueron el pentaclorobenceno (PeCB), el hexaclorobenceno (HCB), los plaguicidas hexaclorociclohexanos (α-HCH, β-HCH, γ-HCH), los plaguicidas diclorodifeniltricloroetano (4,4’-DDE, 4,4’-DDT), los policlorobifenilos (PCB-28, PCB-52, PCB-101, PCB-118, PCB-153, PCB-138, PCB-180, PCB-209), los policloroestirenos (PeCE, α-hexaCE, Z-β-hexaCE, E-β –hexaCE, Z-α,β-heptaCE) y los policloronaftalenos (dicloro, tricloro, tetracloro, pentacloro, hexacloro, heptacloro, octacloro). Por lo general, las concentraciones encontradas en los sedimentos de Flix estaban varios órdenes de magnitud por encima de las concentraciones encontradas en otros sedimentos de áreas contaminadas por actividades industriales (GRIMALT et al., 2003). Para el PeCB se midieron concentraciones de entre 12 y 140.000 ng/g. Para el HCB valores de 15 a 74.000 ng/g, mientras que para los HCHs valores de 0 a 1.000 ng/g. Los diclorodifeniltricloroetanos presentaron valores entre 8,6 y 45.000 ng/g. Para los PCBs las concentraciones en sedimento fueron de entre 2,2 y 130.000 ng/g. Para los policloroestirenos y los policloronaftalenos se detectaron valores máximos de 3.400 y 6.700 ng/g respectivamente. La presencia de HCB y PeCB se puede explicar por el hecho de que estos compuestos son subproductos de la síntesis de disolventes organoclorados, actividad realizada en esta factoría recientemente. La presencia de policloroestirenos en el sedimento tiene su origen, posiblemente, en los residuos generados en la fabricación de cloro mediante electrodos de grafito. Los polinaftalenos pueden ser originados secundariamente en la síntesis de PCB o en los procesos de obtención de cloro mediante electrolisis. PCBs y diclorodifeniltricloroetanos fueron sintetizados en esta factoría antes de que fueran prohibidos por la legislación; es interesante remarcar que Grimalt et al. (2003) encontraron una disminución de sus concentraciones en los niveles superiores de los testigos de sedimento, reflejo del abandono de la producción de estos compuestos en esta factoría. En los sedimentos de Flix también se encontraron radionúclidos provenientes en su mayoría de la cadena de desintegración del 238U. El 238U tiene un proceso de desintegración que produce diferentes radionúclidos como el 226Ra, 232Th y 210Pb, todos ellos estudiados y detectados por Grimalt et al. (2003). El origen de estos materiales radioactivos se encuentra en la fosforita usada como materia prima para la obtención de fosfato bicálcico. Esta fosforita ya tiene en origen una radioactividad de 1003 Bq/kg para el 238U (CARVALHO, 1995). La acumulación en el río de los residuos generados en el proceso de obtención del fosfato bicálcico han generado esta contaminación radiológica. Además, los radionúclidos 137Cs, 60Co, 40K, también fueron estudiados y usados como trazadores de otras fuentes de radiación tanto natural como antrópica. Las actividades máximas medidas fueron de 3500 Bq/kg para 210Pb, 9400 Bq/kg para 226Ra y 12000 Bq/kg para 238 U. Estas actividades máximas medidas indican que estos sedimentos tienen concentraciones de radionúclidos propias de instalaciones radioactivas y deberían tratarse como residuos radioactivos. Con posterioridad, otros estudios han corroborado los resultados de Grimalt et al. (2003) o bien han descrito la presencia de otros contaminantes. Lacorte et al., (2006) estudiaron la presencia de contaminantes orgánicos en los sedimentos de Flix. Estos autores detectaron alquilfenoles, DDTs, hidrocarburos policíclicos aromáticos (PAHs), difeniléteres polibrominados (PBDEs) y clorobencenos en concentraciones iguales o menores a las encontradas en otros puntos del río Ebro. Por otro lado Navarro et al. (2006b) estudiaron la presencia de diferentes compuestos organoclorados, DDTs y PAHs, pero solo los DDTs y el HCB mostraron en Flix concentraciones significativamente más altas que en otros puntos de muestreo. En 2006 Olivares et al. (2010) muestrearon el embalse de Flix para estudiar la presencia de contaminantes organoclorados (PCBs, HCB, HCH y DDTs, estos autores encontraron concentraciones para ciertos compuestos por encima de los 100 μg/g en algunas muestras. Pereira et al., (2011), mediante el análisis de sedimentos recogidos en 2007, confirmaron la alta contaminación por metales pesados y organoclorados descrita en trabajos anteriores. Navarro-Ortega et al., (2010) encontraron plaguicidas (clorados y no clorados), alquilfenoles, plastificantes (bisfenol A, tributilfosfato) y PAHs aunque en concentraciones menores o iguales a las de otros puntos de muestreo a lo largo del Ebro. La presencia de alquilfenoles, plastificantes, algunos tipos de plaguicidas, PAHs o PBDEs, no se Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 5 Capítulo 1 ● Organismos como indicadores de la contaminación pueden relacionar directamente con los vertidos de la factoría de Flix y su presencia puede ser atribuida a la llegada de sedimentos transportados por el río. El origen de estos sedimentos puede encontrarse en otros tramos del río Ebro o afluentes aguas arriba, donde se sitúan grandes complejos industriales o superficies agrícolas. En la Tabla 1 comparamos los valores de metales y compuestos organoclorados en sedimentos muestreados en el embalse de Flix y en el de Riba-roja, otro embalse menos impactado del río Ebro. Tabla 1: Concentración de metales y compuestos organoclorados en los sedimentos del embalse de Flix y de Riba-roja según Bosch et al., (2009). Para metales, valores en μg/g de sedimento en peso seco y para organoclorados en ng/g de sedimento en peso seco metales y compuestos Cr Ni Cu Zn As Cd Hg PeCB HCB αHCH βHCH γHCH PCB28 PCB52 PCB101 PCB118 PCB153 PCB138 PCB180 2,4’-DDE 4,4’-DDE 2,4’-DDD 4,4’-DDD 2,4’-DDT 4,4’-DDT organoclorados metales Riba-roja 118 320 34 124 17 0,4 <0,5 0,6 3,1 0,1 <0,01 0,3 <0,02 <0,02 0,7 0,3 1,6 2,2 16,6 0,4 3,6 0,7 0,4 0,1 1,7 Flix 242 78,5 41 126 21,5 7,45 6,55 2451,5 3541,8 3,45 3,25 0,6 22,9 6,9 9,4 9,85 16,6 27 22,1 33,95 288,1 13,6 47,25 7,65 462 A finales del año 2004 el Gobierno Español junto con otras administraciones y gestores del agua, constituye una comisión de expertos con el objetivo de proponer soluciones técnicas para la eliminación de estos sedimentos contaminados del lecho del embalse de Flix y evitar riesgos sobre la biota y los seres humanos. Para ello se evaluaron diferentes proyectos y, finalmente, las obras de descontaminación empezaron en 2010. Dichas obras de descontaminación consisten en la extracción de los sedimentos del lecho del embalse, su tratamiento y su transporte a un vertedero autorizado para almacenar este tipo de residuos una vez hayan sido tratados (BOLETÍN OFICIAL DEL ESTADO, 2006; ACUAMED, 2007). 1.3 BIOINDICADORES Y BIOMARCADORES Los términos bioindicador y biomarcador se usan a veces de manera indistinta y existen múltiples definiciones en la bibliografía, siendo tema de amplio debate (VAN GESTEL; VAN BRUMMELEN, 1996; MARSHALL; ADAMS et al., 2001; BURGER, 2006; HEINK; KOWARIK, 2010). Van der Oost et al., (2005), define un biomarcador como cambios en respuestas biológicas (desde moleculares, celulares, histológicas, fisiológicas o comportamentales) inducidos por la exposición del organismo a contaminantes ambientales. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 6 Capítulo 1 ● Organismos como indicadores de la contaminación Aquí nosotros usaremos el término biomarcador para referirnos a las respuestas producidas en un nivel de organización biológica inferior al de organismo, como son las respuestas moleculares, celulares, fisiológicas o morfológicas. El término de bioindicador lo reservaremos para las respuestas en estructuras o procesos a niveles superiores al organismo (población, comunidad, ecosistema) acercándonos a la definición propuesta por Van Gestel y Van Brummelen (1996). Los efectos de los contaminantes a niveles mayores de organización están precedidos por efectos en niveles inferiores como el molecular o el celular. Dado que las respuestas de los biomarcadores son observables mucho antes de que el organismo expuesto manifieste enfermedad o se dé la muerte del mismo, éstas nos informan de los efectos de los contaminantes mucho antes de que se observen cambios irreversibles en la estructura de la población o a niveles mayores del ecosistema. En otras palabras, los biomarcadores servirían de señales tempranas de exposición, mientras que los bioindicadores, al reflejar efectos en niveles superiores, como la población o la comunidad, nos dan información de los efectos de estos contaminantes a nivel ecológico. Por otro lado, las respuestas de los biomarcadores son producidas por la fracción biodisponible de la mezcla de sustancias tóxicas en el medio, por tanto, son buenas herramientas para estimar el riesgo real que supone para los organismos la presencia de ciertas sustancias en el medio. Por este motivo los biomarcadores pueden ser muy útiles a la hora de evaluar impactos sobre comunidades y organismos (BURGER; GOCHFELD, 2001; VAN DER OOST et al., 2005), puesto que: a) permiten caracterizar los mecanismos de toxicidad implicados en las respuestas biológicas a niveles mayores de organización, b) permiten establecer relaciones de causa-efecto entre la presencia del contaminante/s y la respuesta/s observada/s, c) alertan sobre la presencia o ausencia de grupos específicos de contaminantes, y si lo están, si su concentración es potencialmente perjudicial para los organismos, d) ayudan a determinar la ausencia de efectos biológicos o ecológicos significativos en poblaciones, comunidades o ecosistemas, e) algunos biomarcadores permiten predecir efectos a nivel de población, comunidad o ecosistema, f) permiten saber si se han superado ciertos umbrales de tolerancia al tóxico en el organismo expuesto y g) permiten monitorizar el estado de un ecosistema y poder comprobar el progreso de medidas correctoras. Las respuestas de los biomarcadores integran un amplio abanico de factores, no sólo los toxicológicos, sino también ambientales y ecológicos. Por este motivo se puede obtener una información general sobre la calidad del medio donde los organismos habitan. Esto puede hacer que otros factores diferentes a los contaminantes ambientales (temperatura, pH, conductividad, estación del año, ciclo reproductor del organismo, edad, estado nutricional, sexo, estado de salud…) den respuestas confusas y no necesariamente ligadas a la presencia de contaminantes. Es por eso que es necesario conocer mediante análisis químicos la carga de contaminantes del lugar, para de esta manera poder establecer posibles relaciones causales y descartar otros factores como originarios de las respuestas observadas (BRACK, 2003; BRACK et al., 2009; VON DER OHE et al., 2009). De la misma manera, para descartar respuestas no vinculadas a la presencia de contaminantes, es necesario que los biomarcadores seleccionados tengan (BURGER; GOCHFELD, 2001, VAN DER OOST et al., 2005): a) poca variabilidad natural o que esta sea bien conocida, b) que las respuestas observadas puedan ser fácilmente atribuidas a los contaminantes antrópicos, c) que las respuestas sean proporcionales a la exposición al contaminante y que sean fácilmente medibles, Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 7 Capítulo 1 ● Organismos como indicadores de la contaminación d) que se conozcan bien los mecanismos moleculares o fisiológicos que producen la respuesta ante la exposición, e) que tengan relevancia ecológica y que su interpretación sea unívoca. Además los organismos seleccionados para aplicar los biomarcadores deben ser organismos de los cuales se conozca bien su fisiología, para poder interpretar las respuestas medidas, tener una amplia distribución, ser fácilmente capturables e identificables a nivel taxonómico y, por último, un tiempo de generación suficiente para reflejar los efectos de las perturbaciones. Más adelante veremos algunos ejemplos que ilustran esta forma de proceder. 1.4 BASES MOLECULARES Y FISIOLÓGICAS DE LOS BIOMARCADORES Como se ha explicado los biomarcadores se basan en respuestas a nivel molecular, celular o histológico, y son medidos en fluidos corporales, células o tejidos. Lo que se mide es la actividad de ciertas enzimas ligadas al metabolismo detoxificante (o los metabolitos derivados) o de respuesta a condiciones de estrés del organismo, cambios en parámetros hematológicos o inmunológicos, cambios en parámetros reproductivos o endocrinos, alteraciones en el material genético, en su expresión o en la síntesis de proteínas, alteraciones en la fisiología y alteraciones en la histología. Actividad de encimas de fase I y II. En el interior de la célula se dan diferentes procesos para disminuir la toxicidad de ciertas sustancias. El primer paso en el metabolismo celular es la adición de grupos funcionales reactivos al compuesto tóxico o xenobiótico para facilitar su excreción disminuyendo su hidrofobicidad. Para ello el metabolismo celular adiciona grupos reactivos al compuesto, mediante oxidación, reducción o hidrólisis. Este proceso lo llevan a cabo fundamentalmente las enzimas de fase I como las monooxigenasas microsomales. La actividad o la cantidad de estas enzimas pueden ser incrementadas o inhibidas por la exposición a diferentes compuestos y son unos de los biomarcadores más sensibles que existen. Las monooxigenasas microsomales también, llamadas enzimas CYP450 por tener el grupo funcional y dador de electrones citocromo P450, es un grupo bien estudiado y ampliamente usado como bioindicador de exposición a contaminantes orgánicos. Entre estas destacamos la actividad etoxi resorufin O deetilasa (EROD) implicada en la oxido-reducción de dioxinas, PCBs y PAH coplanares (WHYTE et al., 2000). Las de fase II agrupan a un conjunto de enzimas cuya principal actividad es conjugar los productos de la fase I con macromoléculas solubles como el glutatión (glutation sulfo transferasa, GST), ácido glucurónico (uridina difosfato glucuroniltransferasa-UDPGT), para de esta forma facilitar su excreción (VAN DER OOST et al., 2003). Parámetros de estrés oxidativo. Muchos contaminantes ambientales o sus metabolitos producen toxicidad asociada a actividad oxidativa dentro de la célula. Esta actividad oxidativa es debida a la producción secundaria de oxígeno molecular, del radical superóxido, del peróxido de hidrógeno o del radical hidroxilo. Todos ellos pueden reaccionar con otras moléculas de la célula impidiendo su actividad o alterando su estructura lo que puede llevar a disfunciones metabólicas y llevar a la muerte celular. La célula presenta ciertas enzimas para inhibir la formación de estos radicales, son las enzimas antioxidantes, como la superóxido dismutasa, la catalasa, la peroxidasa dependiente de glutatión, la glutatión reductasa; compuestos solubles como compuestos carotenoides, ácido úrico, glutatión, vitaminas A, C y E. La actividad/abundancia de estas enzimas/compuestos es usada como indicadora de exposición y efectos de los contaminates. Productos de transformación biológica. Como ya se ha explicado, los metabolismos de Fase I y II transforman las sustancias tóxicas para facilitar su excreción y reducir su toxicidad. Estos metabolitos como los compuestos hidroxilados de PAH, PCBs pueden usarse como biomarcadores de exposición reciente. Por otro lado, las vías metabólicas de detoxificación o los propios xenobióticos pueden inducir la síntesis de otros metabolitos que también pueden ser usados como biomarcadores (vitelogenina, glutatión, porfirinas u hormonas reproductivas). Estos biomarcadores pueden ser usados como indicadores de larga exposición y evidencia de toxicidad. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 8 Capítulo 1 ● Organismos como indicadores de la contaminación Proteínas de estrés y metalotioninas. Las proteínas de estrés o proteínas de shock térmico (HSP) son un grupo de proteínas involucradas en la protección y reparación de la célula ante condiciones nocivas o de estrés. Estas proteínas no se activan sólo ante la presencia de contaminantes como los metales pesados o compuestos teratogénicos o carcinógenos, sino también ante otro tipo de perturbaciones ambientales como extremos de temperatura, anoxia, alta conductividad, radiación UV o condiciones oxidativas. Las metalotioninas (MT) son un grupo de proteínas de la familia de las HSP implicadas en la regulación de metales esenciales como el Zn y el Cu y la detoxificación de estos u otros metales como el Hg o el Cd. Su uso ha sido discutido por la falta de especificidad en su inducción o por su amplia variabilidad natural. Parámetros hematológicos. La presencia de ciertas proteínas en sangre puede indicar exposición y efectos tóxicos de algunas sustancias en órganos. Su presencia es debida a la lisis celular y al vertido del contenido del citosol en el torrente sanguíneo, este es el caso de las transaminasas cuya presencia en sangre es indicativa de daños en tejidos. Otros parámetros hematalógicos, si bien son menos específicos, pueden ser sensibles a la exposición de ciertos tipos de contaminantes como por ejemplo el hematocrito o los niveles de hemoglobina, de proteína o de glucosa. Parámetros inmunológicos. Los tóxicos ambientales pueden deteriorar el sistema inmune y hacerlo ineficaz. Esto puede tener reflejo tanto a nivel molecular (niveles de anticuerpos, factores de inflamación) como a niveles superiores (niveles de células inmunes en sangre), y manifestarse en la resistencia del organismo a infecciones por parásitos u otros patógenos. Parámetros endocrinos y reproductivos. Los tóxicos ambientales pueden alterar el sistema endocrino. El más conocido es el reproductivo, como se ha visto en peces y moluscos (VOS et al., 2000). Como biomarcadores de estos posibles efectos se han usado la presencia de vitelogenina en machos de especies ovíparas, puesto que esta proteína solo se sintetiza en hembras y por tanto su presencia en machos es síntoma de efectos promovidos por contaminantes. También el citocromo P450 se usa como indicador puesto que está implicado en el paso de andrógenos a estrógenos. Alteraciones en este enzima se pueden traducir en diferencias en la expresión de caracteres sexuales. Los niveles de hormonas esteroideas o las proteínas inducidas por ella pueden ser usados para monitorizar la actividad de sustancias que alteren el sistema endocrino. Parámetros neuromusculares. La acetilcolinesterasa y las carboxilesterasas se usan como biomarcadores, especialmente de exposición a ciertos plaguicidas. Estas enzimas se encuentran en tejidos nerviosos (BARATA et al., 2004) y su actividad es mediar los niveles de neurotransmisores. De la correcta actividad de estos enzimas depende la comunicación entre neuronas y la correcta actividad del sistema nervioso. 2 EVIDENCIANDO LA POLUCIÓN Y SUS EFECTOS. CASOS PRÁCTICOS EN FLIX 2.1 PRESENCIA DE LOS CONTAMINANTES EN LOS ORGANISMOS Como se explicó en la introducción, diferentes estudios evidenciaron la presencia de altos niveles de contaminantes orgánicos y metales pesados en los sedimentos del embalse de Flix. Estas concentraciones están varios órdenes de magnitud por encima de las de otros puntos del mismo río o zonas declaradas como contaminadas en otras partes del mundo. Los contaminantes entran en los organismos acuáticos por el contacto con el agua circundante, el sedimento o por la dieta. Una vez incorporados, el metabolismo de detoxificación intentará eliminar del organismo estos compuestos xenobióticos o bien los inmovilizará en ciertos tejidos para minimizar su impacto. Cuando el organismo no puede eliminarlos por completo o los inmoviliza en sus tejidos se produce la bioacumulación. Cuando la concentración de contaminantes en el organismo es mayor que las del medio circundante o su fuente de alimentación, hablamos de bioconcentración. Debido a las relaciones tróficas, organismos que han bioconcentrado Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 9 Capítulo 1 ● Organismos como indicadores de la contaminación contaminantes y, por tanto, presentan en sus tejidos altas concentraciones de xenobióticos, pueden ser presas de otros. En este caso el depredador puede llegar a acumular concentraciones de contaminates mayores que las de sus presas, a esto se le llama biomagnificación. El lector puede encontrar en la literatura información más detallada sobre este proceso (RAINBOW, 2002; VAN DER OOST et al., 2003; VAN LEEUWEEN; VERMEIRE, 2007) Para saber si los compuestos contaminantes presentes en el embalse podían incorporarse en los organismos y la cadena trófica, diferentes estudios usaron una amplia variedad de organismos de este embalse y demostraron que ciertos metales (especialmente Hg) y otros contaminantes orgánicos se habían acumulado en los organismos. Soto et al., (2011) realizaron un estudio muy detallado analizando los niveles de metales pesados en diferentes organismos de este embalse. Se analizaron 16 compartimentos diferentes de la red trófica. El estudio se realizó en 2006 y se estudiaron dos zonas diferentes de este embalse, una influenciada por la factoría química y sus sedimentos (en adelante FQ, altamente contaminada) y otra cercana a una reserva natural, en la orilla opuesta a la del complejo (en adelante FR, menos contaminada, Figura 2). Los objetivos de este estudio fueron por un lado conocer en qué grado los organismos estaban contaminados por metales pesados y por otro conocer cuáles de ellos eran los más indicados para monitorizar este grado de contaminación. Figura 2: Imagen satélite del embalse de Flix dónde se puede distinguir la zona FQ afectada por la factoría química y la zona FR enfrente de la factoría. Imagen obtenida del Institut Cartogràfic de Catalunya. En este estudio se analizaron productores primarios (macrófitos y perifíton, compuesto principalmente por cianobacterias y diatomeas adheridas a superficies como piedras o sedimento), zooplancton, consumidores primarios (moluscos, insectos), consumidores secundarios (moluscos, insectos, peces) y organismos depredadores u omnívoros (peces, insectos, crustáceos). En ellos se midieron los niveles de Cr, Cu, Zn, As, Se, Cd, Hg y Pb. Los resultados evidenciaron que los diferentes componentes de la red trófica habían acumulado metales en sus tejidos pero que habían diferencias dependiendo de la especie o compartimento, del lugar donde fue capturado (FR o FQ) y tipo de metal analizado (ver Figura 3). Los organismos recolectados en la zona FQ, por lo general, tenían niveles de metales más elevados que los recolectados en FR, esto fue más notable con el Hg o el Cd cuyos valores fueron de 2 a 400 veces mayores dependiendo del organismo, en cambio para los otros metales analizados, por lo general, no hubo diferencias significativas debidas a la zona de muestreo. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 10 Capítulo 1 ● Organismos como indicadores de la contaminación Figura 3: Concentración de Hg y otros metales en macrófitos (Ma), perifiton (Pe), zooplankton (Zo), invertebrados bentónicos (In), mejillón cebra (Dreissenia polymorpha, MC), cangrejo de río americano (Procambarus clarkii, CR), gardí (Scardinus erythrophthalmus, P1) y gambusia (Gambusia holbrooki, P2) estudiados por Soto et al., (2011). Las barras representan el valor medio y las líneas la desviación estándar. Los asteriscos muestran las diferencias significativas entre componentes con un p-valor < 0,01 (**) o un p-valor < 0,05 (*). El perifíton fue el compartimento que experimentó mayores diferencias en las concentraciones de metales en función de la zona de recolección. Este compartimento fue también el que más metales acumuló por unidad de masa (tanto en la zona FQ como en la FR) y las concentraciones estaban un orden de magnitud por encima de las de otros compartimentos. El perifíton fue seguido por el mejillón cebra (Dreissena polymorpha) que también presentó diferencias significativas en la concentración de metales en función de si había sido recolectado en FR o en FQ. El perifíton recolectado en la zona contaminada presentaba unas concentraciones medias de metales pesados mayores que el recolectado en la reserva, las diferencias fueron significativas para todos los metales excepto Cr y Zn. Las concentraciones encontradas en el perifíton de FQ fueron de 42,75 (Hg), 19,11 (Pb), 0,23 (Cd), 1,4 (Se), 6,42 (As) y 13,9 (Cu) μg/g peso seco (p.s.), para el Hg este valor es 400 veces mayor que en el perifíton de FR mientras que para los otros metales entre 1 y 2 veces más. En el caso del mejillón presentó un patrón similar, siendo los metales Hg, Pb, Cd, As, Cu y Cr los que presentaban unas concentraciones significativamente más altas en los organismos de FQ respecto los de FR, en concreto 3,76 (Hg), 2,91 (Pb), 0,97 (Cd), 6,43 (As), 35,8 (Cu) y 7,4 (Cr) μg/g p.s., es decir unas 15 veces más altas para el Hg, unas 4 veces más altas para el Cu y 1,5 veces más altas para los otros metales. El perifíton se desarrolla sobre superficies (piedras, roca o restos vegetales) por tanto está altamente expuesto a los contaminantes de agua y sedimento. La matriz donde están embebidos los organismos componentes del perifíton (diatomeas y bacterias) está formada por elementos orgánicos (exopolisacaridos) e inorgánicos y facilita la acumulación por adsorción de los metales tanto libres como complejados a partículas. A su vez, los organismos componentes del perifíton Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 11 Capítulo 1 ● Organismos como indicadores de la contaminación pueden sufrir una bioconcentración pasiva de los metales debido a la adsorción a su superficie. El mejillón cebra tiene una alta tasa de filtración y tiene digestión intracelular. Por este motivo puede llegar a asimilar y concentrar metales disueltos, o complejados con partículas en suspensión, en la columna de agua; la digestión intracelular produce que los metales entren más fácilmente dentro de las células y se acumulen en el interior de los tejidos. Esto, según Soto et al., (2011), los hace buenos para biomonitorizar el proceso de contaminación en el embalse. Este potencial de D. polymorpha para la bioacumulación de metales pesados en Flix ya había sido descrito anteriormente en otros trabajos. Carrasco et al., (2008) se centraron en el estudio de diferentes poblaciones en el embalse de Flix (zona FQ y FR). El estudio se llevó a cabo en el verano del 2006 y los autores analizaron la concentración de Hg total y metilmercurio (MeHg) en tejidos homogeneizados del organismo. Los autores incluyeron el MeHg puesto que es más biodisponible que las formas oxidadas del Hg (Hg2+), es altamente bioacumulable y puede ser biomagnificado a través de la cadena trófica, además este compuesto es fácilmente producido en condiciones de anoxia (SICILIANO et al., 2002, CLARKSON et al., 2003; GRANDJEAN et al., 1999). Los resultados dieron concentraciones mucho mayores que las encontradas para este organismo y este metal en otras partes del mundo. Los autores encontraron un valor medio de Hg total de 0,5248 μg/g p.s. en los organismos capturados en los sedimentos contaminados (FQ), un valor 8 veces mayor que el obtenido en los organismos capturados en la reserva natural (FR), enfrente de la factorνa. Los autores sσlo analizaron el MeHg en los ejemplares provenientes de la zona FQ encontrando unos valores que oscilaban entre 0,220 y 0,589 μg/g de p.s. Se encontraron diferencias en la concentración de Hg total dependiendo del tamaño del organismo, siendo los más pequeños los que mostraban concentraciones mayores. Aunque la cantidad total de Hg encontrada sea mayor cuanto más grande sea el organismo, esto lo atribuyen a que el crecimiento del molusco es mayor a la tasa de acumulación de metal, lo que produce un efecto de dilución. Puesto que el mejillón cebra es un componente importante en la dieta de algunas especies de peces del embalse, existe el riesgo de transferencia y biomagnificación para niveles tróficos superiores. Otro componente de la red trófica estudiado por Soto et al., (2011) y que evidenció capacidad como bioindicador de bioacumulación fue el cangrejo de río americano (Procambarus clarkii). Este organismo omnívoro depreda sobre moluscos como el mejillón cebra, otros invertebrados del sedimento, detritos o perifíton. Si bien las diferencias en las concentraciones de metales pesados entre organismos recolectados en la zona FQ y la FR no fueron significativas, estos organismos tienen una capacidad ligeramente mayor que otros componentes de la red trófica de acumular metales pesados. Algunos de los cangrejos capturados en la reserva natural presentaron unos niveles de Hg ligeramente más elevados que otros componentes de la red trófica (1,19 μg/g p.s.). A diferencia del biofilm o el mejillón cebra, este componente de la red trófica no es sésil y es posible que los cangrejos habiten tanto la zona contaminada como la no contaminada, esto explicaría la ausencia de diferencias significativas entre los organismos de ambas orillas. Suárez-Serrano et al., (2010) también encontraron, en cangrejos capturados sobre los sedimentos de la zona FQ, elevados niveles de Hg y Pb (valor medio de 1,50 ± 0,97 y 0,41 ± 0,48 μg/g p.s. de músculo respectivamente) respecto a otros puntos no influenciados por la planta química. En cambio, los cangrejos capturados en la zona protegida (FR) mostraron concentraciones un orden de magnitud por debajo de estos valores para Hg y Pb. Los macroinvertebrados capturados en el estudio de Soto et al., (2011) también mostraron diferente contenido de Hg en su cuerpo dependiendo del lugar de captura. Los que estaban en la zona FQ tenían una concentración mayor que los capturados en FR, siendo el caracol de agua dulce (Physa sp.) el que presentaba unas concentraciones mayores (3,7 y 0,59 μg/g p.s. en FQ y FR respectivamente). Para los otros metales analizados (Pb, Cd, Se, As, Zn, Cu y Cr) este resultado no fue tan patente. Los altos niveles de Hg en Physa sp. pueden ser debidos a que este organismo se alimenta de perifíton y dado que el perifíton de la zona contaminada presentaba altos niveles de Hg estos organismos han podido incorporarlo por ingesta. Estos resultados podrían sugerir a los macroinvertebrados en general como buenos biomarcadores para el Hg, pero tienen el problema de la dificultad de captura y el poco material disponible para el análisis debido a su pequeño tamaño. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 12 Capítulo 1 ● Organismos como indicadores de la contaminación Las plantas acuáticas Myriophyllum spicatum y Ceratophyllum demersum también presentaron diferencias significativas en la concentración de Hg dependiendo del lugar de muestreo, mostrando mayor concentración de este metal las plantas recolectadas en la zona contaminada. Para otros metales como el Cu, Zn y Se también se observa este comportamiento aunque las diferencias son menos acusadas. Estas plantas captan los metales disueltos en la columna de agua o bien en el agua intersticial. La disolución de los metales en el agua depende de determinadas condiciones ambientales como el pH, el potencial redox o el contenido de materia orgánica. Por tanto estos organismos son indicadores de que existen unas condiciones ambientales en el embalse que favorece que los metales, en especial el Hg, puedan disolverse en la columna de agua y ser biodisponibles. El análisis del zooplancton lleva a conclusiones similares puesto que este compartimento de la red trófica también presenta bioacumulación de metales que, por la forma de vida de estos organismos, son asimilados de la columna de agua. De este estudio de Soto et al., (2011) se concluye que no hay un compartimento idóneo en la red trófica para ser usado como bioindicador de bioacumulación de metales pesados. La elección de un compartimento u organismo concreto debe basarse en cuestiones específicas. Una de esas cuestiones puede ser el área que se quiere monitorizar. Por ejemplo, el perifíon y el mejillón cebra reflejan muy bien las condiciones de un punto concreto del embalse, puesto que son sésiles, en cambio, el cangrejo de río, que tiene un mayor radio de movilidad integra información de todo el embalse. Otro criterio es determinar que matriz se quiere monitorizar, por ejemplo se ha visto que el mejillón cebra es bueno para monitorizar la biodisponibilidad de los metales disueltos o acomplejados al material en suspensión; en cambio, los macrófitos son adecuados para monitorizar la biodisponibilidad de las formas disueltas de los metales, tanto en la columna de agua como en el agua intersticial. Por otro lado para analizar la posible transmisión a través de la red trófica, es conveniente o bien monitorizar los macroinvertebrados o el zooplancton que sirven de alimento a niveles superiores de la red trófica, o bien analizar directamente los niveles superiores. Carrasco et al., (2011a) en el verano del 2006 realizó otro estudio centrándose en la bioacumulación de Hg total y MeHg en peces y cangrejos de río (P. clarkii). Los autores compararon el contenido en músculo y hepatopáncreas de ejemplares capturados en el embalse Flix (diferenciando zona FQ y FR) con el de ejemplares capturados en otro embalse (Riba-roja), situado 13 km aguas arriba y no afectado por los vertidos de la planta química. Las especies de peces estudiadas fueron el siluro (Silurus glanis), la carpa (Cyprinus carpio), el gardí (Scardinus erythrophthalmus) y el rutilo (Rutilus rutilus), representando así diferentes niveles tróficos, para poder estudiar la transferencia del mercurio a lo largo de la red trófica Respecto a P. clarkii el estudio reveló diferencias significativas en los contenidos de Hg total dependiendo de la zona de captura, siendo los capturados en el embalse de Riba-roja los que presentaban menos concentración y los capturados en el embalse de Flix, en la zona FQ los que presentaban una mayor concentración en sus tejidos. El MeHg sólo se analizó en los ejemplares capturados en la zona contaminada del embalse de Flix, encontrándose tanto en el hepatopáncreas como en el tejido muscular (0,419 μg/g de p.s. de músculo) y representando un 72% del Hg total en el tejido muscular. En el caso de los peces, los autores describen un aumento de los niveles de Hg total en los peces situados en niveles superiores de la red trófica (siluro >carpa>rutilo>gardí). El es siluro una especie depredadora que tiene como dieta otros peces y cangrejos de río. La carpa y el gardí son peces omnívoros que se alimentan de detritus, materia vegetal, perifíton y pequeños invertebrados y los rutilos se alimentan sobretodo de macrófitas y algas filamentosas. En cambio no encontraron el mismo patrón para el MeHg en los peces capturados en Flix. Basado en estudios anteriores (BLOOM, 1992), se asume que en el músculo de peces situados en niveles tróficos elevados la mayor parte del Hg total (90-99%) está en forma de MeHg. Por el contrario, los siluros de Flix presentaron unos niveles de MeHg en músculo menor que el predicho por la concentración de Hg total y por su posición en la cadena trófica (0,675 μg/g de p.s. de músculo cerca del 80% del Hg total). En cambio las especies no piscívoras como la carpa, presentaron una proporción mayor de MeHg a la esperada (cerca de un 90%). Esto puede ser debido a que el siluro, pese depredar otros Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 13 Capítulo 1 ● Organismos como indicadores de la contaminación peces, en este embalse se alimenta preferentemente de cangrejo de río americano. Los ciprínidos presentaban unas concentraciones de MeHg en músculo de 0.29 y 0.15 μg/g de p.s. (carpa y rutilo, respectivamente). Estos peces son omnívoros y en este embalse se alimentan preferentemente de zooplancton, mejillón cebra y perifíton. El mejillón cebra es uno de los organismos de Flix que mayores concentraciones de Hg total y MeHg presenta, incluso mayor que la del cangrejo de río (CARRASCO et al., 2008; SOTO et al., 2011). Por otro lado, como demostró Soto et al., (2011) el biofilm es un compartimento que acumula gran cantidad de Hg, y además, puede favorecer la metilación de este metal (CLECKNER et al., 1999; MAURO et al., 2002). Por último, decir que los ciprínidos remueven el sedimento para encontrar presas, con lo cual también pueden exponerse al Hg por esta vía. La concentración en estos peces tanto de Hg total como de MeHg hace que no sean aptos para consumo humano. Considerando las proporciones de MeHg en los organismos, este embalse es ciertamente peculiar en términos de bioacumulación de Hg y a causa de las relaciones tróficas entre los organismos que se dan en este embalse determinan los patrones de bioacumulación. Por tanto, es necesario tener claras cuáles son estas relaciones, para poder trazar con exactitud la bioacumulación del Hg. Por otro lado, estos estudios ponen de manifiesto que es preciso realizar análisis de especiación de Hg ya que estimar la concentración de MeHg a partir de los niveles de Hg total y aplicar la relación MeHg = 0.95 x THg, nos puede llevar a errores sobre la bioacumulación de MeHg en los organismos. Además, el conocimiento de las especies en las que se encuentra este metal y su nivel trófico nos puede permitir evaluar el riesgo de transferencia a otros niveles tróficos. Además de la concentración de metales en organismos del embalse otros autores han estudiado compuestos orgánicos. Faria et al., (2010a) analizaron metales y diferentes compuestos organoclorados en mejillones cebra y cangrejos de río capturados en la zona FQ y FR. Los compuestos orgánicos estudiados fueron el HCB, HCH, PCB y DDT. En el caso de los metales los resultados obtenidos coincidieron y corroboraron los explicados más arriba. Respecto a los organoclorados, los autores encontraron diferencias significativas en la concentración en los tejidos según la zona de captura. Para los organismos capturados en la zona FQ, los autores encontraron unos valores en los mejillones de 317 (DDT), 78 (HCB), 6 (HCH) y 104,5 (PCB) ng/g p.s., mientras que en los cangrejos estos valores fueron de 63 (DDT), 43 (HCB), 1,5 (HCH) y 44 (PCB) ng/g p.s. Las concentraciones medidas en los organismos capturados en FQ fueron entre 4 y 200 veces mayores que las medidas en organismos capturados en zonas no contaminadas. En estos organismos, la concentración de HCB era 2 o 3 veces más elevada en los organismos capturados en la zona FQ. Para el DDT lo era unas 7 veces más y unas 3-4 veces más en el caso del PCB. HCH presentaba una concentración unas 12 veces mayor en los mejillones cebra capturados en la zona FQ respecto a los de FR, mientras que en el caso del cangrejo la concentración era 1,5 veces mayor. Por otro lado, los valores analizados en organismos de la zona FQ son similares a los encontrados en otros lugares altamente contaminados (FERNANDES et al., 2002; GITAHI et al., 2002; BINELLI AND PROVINI, 2003; HANARI et al., 2004; RIVA et al., 2008). Lavado et al., (2006) estudió el contenido de PCBs, DDT, HCHs y alquilfenoles en músculo o bilis de carpas (C. carpio) capturadas en el embalse de Flix y otros puntos del río Ebro. Las carpas capturadas en el embalse presentaron unas concentraciones en músculo varios órdenes de magnitud mayores que las encontradas en otros puntos del río para los PCBs (95,4 ng/g peso húmedo), el DDT (3,57 ng/g p.h.), el DDE (25,75 ng/g p.h.) y el HCB (1,56 ng/g p.h.). Por el contrario, el contenido de alquilfenoles en bilis, aunque elevado (16,46 μg/g de bilis) no era diferente a otros puntos contaminados del río, por lo que no se puede establecer que este contaminante esté presente únicamente en el embalse. Todos estos estudios demuestran que los contaminantes orgánicos y los metales presentes en altas concentraciones en los sedimentos de Flix están también presentes en diferente medida en los organismos que habitan este embalse. Los autores demuestran que los contaminantes son biodisponibles y pueden incorporarse a diferentes compartimentos de la red trófica, pasando de unos a otros. Estos estudios vinculan claramente el grado de bioacumulación y la bioconcentración Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 14 Capítulo 1 ● Organismos como indicadores de la contaminación con las relaciones tróficas entre los organismos del embalse, aparte de las propias características fisiológicas de las especies. Los autores citados obtuvieron resultados diferentes a los obtenidos en otros lugares del mundo debido a las peculiaridades de las relaciones tróficas establecidas en este embalse (Tablas 2 y 3). En este caso el mejillón cebra podría ser una especie clave y responsable en la entrada de Hg en la red trófica y su transferencia a otros compartimentos debido a sus altos niveles Hg total y de MeHg y a que es la base de la dieta, tanto de diferentes especies de peces como de los cangrejos de río (CARRASCO et al., 2008, SOTO et al., 2011). Una evidencia de esta transferencia a lo largo de la red trófica y biomagnificación es descrita por Suárez-Serrano et al., (2010) en cangrejos de río capturados en el embalse de Flix. Estos cangrejos mostraron unos niveles de Hg total 6 veces mayores que en los mejillones cebra. Por otra parte, el biofilm puede ser otro punto de entrada de metales pesados en la red trófica, debido a su gran capacidad de bioacumulación y su posición como productor primario y base de alimentación para macroinvertebrados bentónicos (por ejemplo Physa sp.) y peces (CARRASCO et al., 2011a; SOTO et al., 2011). El análisis químico de los tejidos de los organismos del embalse junto al conocimiento de las relaciones tróficas entre ellos nos ha permitido evaluar el grado de contaminación de las diferentes especies y poder conocer el riesgo de transferencia de estos contaminantes a otros organismos tanto del embalse como de fuera del mismo. 2.2 EVIDENCIAS DE EFECTOS EN LOS ORGANISMOS En el apartado anterior expusimos evidencias de la incorporación de los contaminantes a los organismos del embalse de Flix. En este apartado explicaremos cómo el uso de biomarcadores evidenció efectos nocivos en los organismos de la cadena trófica de Flix. Los efectos nocivos de las sustancias contaminantes se han detectado a nivel molecular, celular, tisular e individual. Tabla 2: Comparación de la concentración de Hg total en el tejido de D. polymorpha (μg/g p.s.) en diferentes estudios lugar Flix Ríos de NY, USA Genesee Hudson Ontario Bajo Po Río Niágara NY, USA Autor Carrasco et al., (2008) Secor et al., (1993) Secor et al., (1993) Secor et al., (1993) Secor et al., (1993) Camusso et al., (1994) Richman; Somers (2005) Hg 4,37 0,1028 0,2466 0,0646 0,0700 0,08 0,0931 Tabla 3: Comparación de la concentración de metales en el tejido muscular de P. clarkii (μg/g p.s.) en diferentes estudios lugar Flix Estanque de riego, Lousiana, USA Vertido accidental, España Zona con contaminación por Hg, España Vertido accidental, España Vertido accidental, España Autor Suárez-Serrano et al., (2010) Richert; Sneddon (2008) Alcorlo et al., (2006) Higueras et al., (2006) Devesa et al., (2002) Sánchez-López et al., (2004) Hg 0,27–3,1 60–70 – 2,4–9,1 – – Zn 58,63–70 60–70 50–150 – – 5,5–63,25 Cu 22,31–45 – 25–40 – – 5,2–95,3 Pb 0,03–1,5 – 1,0–2 – 1,2–9,0 0,01–4,21 2.2.1 Efectos a nivel molecular Faria et al., (2010a) estudiaron la respuesta de diferentes biomarcadores en individuos de D. polymorpha y P. clarkii del embalse de Flix (zonas FQ y FR), en los de una zona menos contaminada (embalse de Riba-roja) y un punto 2 km aguas abajo del embalse de Flix. Los autores estudiaron la presencia de compuestos organoclorados y metales pesados en los tejidos de ambos organismos. Por un lado, en la glándula digestiva del mejillón cebra y en el hepatopáncreas del Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 15 Capítulo 1 ● Organismos como indicadores de la contaminación cangrejo de río, estudiaron la respuesta de biomarcadores del metabolismo de fase I, como el enzima etoxiresorufin-O-deetilasa (EROD), cuya actividad está correlacionada con la exposición a PCBs; la actividad del enzima de fase II glutatión S-transferasa (GST) y marcador general de exposición a xenobióticos; los niveles de glutatión (GSH) y glutatión reductasa (GR); los niveles de metalotioninas, relacionados con la exposición a metales; enzimas antioxidantes (catalasa, CAT), involucradas en la detoxificación de radicales de oxígeno reactivo y marcadores generales de respuestas a xenobióticos; marcadores de daño oxidativo en los tejidos (peroxidación de lípidos y rotura de cadenas de ADN). Por otro lado, en las branquias de los mejillones y en el músculo abductor del cangrejo, se estudió la actividad de las β -esterasas como marcadores de exposición a plaguicidas organofosforados. Los autores encontraron cantidades significativas de diferentes contaminantes en los tejidos de los organismos, mayores en los organismos capturados en la zona FQ que en los de otras zonas contaminadas. Los diferentes biomarcadores mostraron diferentes niveles de actividad según la especie y el lugar en el que fueron capturadas. Respecto a la respuesta de las metalotioninas en los mejillones, éstas solo mostraron niveles significativamente elevados en el punto aguas abajo del embalse de Flix, en cambio en los cangrejos de río, los valores más elevados se obtuvieron en los organismos recolectados en la zona FQ. La baja respuesta de estas proteínas en los mejillones, incluso en las zonas más contaminadas, puede ser debido a que, como se ha explicado más arriba (CARRASCO et al., 2008) el metal que presenta una mayor concentración en mejillones de esa zona es el Hg, pero mayoritariamente en su forma MeHg, que no induce la expresión de metalotioninas. Las enzimas y metabolitos relacionados con el glutatión, generalmente activos en las respuestas primarias a los xenobióticos, mostraron actividades inesperadas en relación con publicaciones previas (REGOLI; PRINCIPATO, 1995; BOCCHETTI et al., 2008). Los niveles de GSH bajaron en ambos organismos en las zonas contaminadas, posiblemente debido al aumento de la actividad de aquellas enzimas relacionadas con su oxidación, como la GST. Los autores también apuntan al MeHg como causante de estas incongruencias ya que puede limitar la actividad del enzima que produce la GSH. La actividad EROD sufrió disminución en los cangrejos de río recolectados en ambas zonas de Flix, probablemente debido a la presencia de Hg y organoclorados, que se han demostrado inhibidores (LAVADO et al., 2006; EDWARDS et al., 2007). Las β-esterasas no mostraron cambios significativos en los cangrejos de río recolectados en diferentes puntos, en cambio sí los mostraron en los mejillones cebra. Estas enzimas fueron inhibidas aguas arriba y abajo del embalse de Flix. Puesto que estos biomarcadores son sensibles a la presencia de plaguicidas en el medio, hemos de suponer actividad agraria intensa en las proximidades de estos puntos, pero no en Flix. Estas enzimas son especialmente sensibles en crustáceos (ESCARTIN; PORTE, 1997; BINELLI et al., 2006; VIOQUE-FERNÁNDEZ et al., 2007), por tanto la carencia de efectos puede ser debida a la ausencia de plaguicidas, pero también a la interferencia de otros factores como la presencia de los metales (FRASCO et al., 2005). La actividad de las enzimas antioxidantes como la CAT, para contrarrestar la aparición de especies químicas reactivas dentro de la célula como consecuencia de la exposición a los contaminantes, se incrementó en los organismos expuestos a las zonas con mayores concentraciones de metales y organoclorados (FQ y FR) que los capturados en las zonas control (Riba-roja). Puesto que el grado de estrés producido por los contaminantes supera la capacidad de las enzimas antioxidantes de disminuir la presencia de especies reactivas dentro de la célula, la peroxidación de lípidos y la acumulación de daños en el DNA a consecuencia de la alta presencia de especies reactivas, se incrementó en los mejillones cebra expuestos a contaminantes, en cambio en los cangrejos sólo se observaron diferencias significativas respecto al incremento de daño celular. En la siguiente Tabla 4 podemos ver los valores de algunos de los biomarcadores moleculares que mostraron diferencias significativas en P. clarkii. En otro estudio, Faria et al., (2010b), partiendo de la hipótesis de que las especies autóctonas son más tolerantes a los contaminantes, hicieron un estudio con diferentes especies de bivalvos para determinar su grado de tolerancia a los contaminantes. Los autores estudiaron tres especies de bivalvos, dos de ellas invasoras (el mejillón cebra D. polymorpha y la almeja asiática Corbicula Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 16 Capítulo 1 ● Organismos como indicadores de la contaminación fluminea) y la otra autóctona y protegida por la legislación (Psilunio littoralis). El estudio se llevó a cabo mediante trasplante, es decir, organismos recolectados en lugares no expuestos a los contaminantes se llevaron a los diferentes puntos de estudio y se incubaron durante 107 días. Se estudió la actividad antioxidante y de estrés oxidativo por medio de la actividad de la enzima GST, los niveles de glutatión (GSH), la peroxidación de lípidos y la rotura de DNA en los tejidos de la glándula digestiva. Los puntos de estudio fueron en el embalse de Riba-roja, Flix (zona FQ) y un punto aguas abajo del embalse. Al final del experimento, este estudio reveló que si bien la exposición a los sedimentos de la zona FQ producía señales en el metabolismo de estos organismos, P. litoralis parecía presentar una mayor resistencia a la presencia de los contaminantes. Su DNA fue el que menos daños sufrió de las tres especies estudiadas. Esto puede ser posible a la alta actividad basal del enzima GST en esta especie, tanto en organismos expuestos a la polución como los situados en zonas menos polucionadas. Su metabolismo antioxidante fue de los más activos, con altos niveles de CAT y de GST respecto a las otras especies expuestas a las mismas condiciones. También presentó bajos niveles de GSH, posiblemente porque este sustrato es usado por la GST. Por el contrario los marcadores del metabolismo antioxidante de D. polymorpha no mostraron respuestas tan agudas lo que se tradujo en daños en el DNA, alta peroxidación de lípidos y alta mortalidad respecto a P. litoralis. Esto indica que el metabolismo del mejillón cebra no es tan eficiente como el de P. litoralis a la hora de disminuir los daños de las especies reactivas originadas por la presencia de los xenobióticos en las células. Tabla 4: Valores (media ± desviación estándard) obtenidos en algunos de los biomarcadores estudiados en cangrejo de río americano y medidos como actividad observada (cantidad de sustrato transformado por unidad de tiempo y proteína en el caso de actividad EROD, GST y CAT) o cantidad obtenida (cantidad por unidad de proteína en el caso de MT y fragmentos de DNA). Comparación entre individuos de un punto poco impactado y dos zonas del embalse de Flix. Actividades y niveles medidos en tejido de hepatopancreas. Las letras indican diferencias significativas entre puntos según análisis ANOVA y posterior test de Tukey, (p < 0,05) biomarcadores EROD (fmol/min/mg prot.) GST (nmol/min/ mg prot.) MT (pmol/mg prot.) CAT (μmol/min/ mg prot.) Fragmentos DNA (μg/g peso húmedo) Riba-roja 166.9 ± 39.7 a 608.6 ± 29.6 a 476.4 ± 46.5 a 413.4 ± 56.0 a 630.7 ± 27.8 a FR 64.2 ± 5.6 b 731.8 ± 36.4 b 566.1 ± 59.8 ab 813. ± 84.0 b 789.3 ± 64.9 b FQ 62.1 ± 1.7 b 686.9 ± 44.9 b 625.8 ± 56.4 b 678.5 ± 68.2 b 841.0 ± 47.0 b Navarro et al., (2009) estudiaron el nivel de Hg en tejidos y la respuesta de diferentes biomarcadores en carpas (C. carpio). Los peces fueron capturados en el embalse de Riba-roja, en Flix y dos puntos situados 5 y 37 km aguas abajo. Los tejidos estudiados fueron hígado, riñon y músculo. Los biomarcadores estudiados fueron la síntesis de RNA mensajero (mRNA) para metalotioninas (medido también en las escamas), actividad de CAT y GST, niveles de glutatión (GSH), peroxidación de lípidos y daños en DNA. Respecto a los niveles de Hg en los tejidos, estos se correspondieron con el grado de contaminación del lugar de captura. Los peces capturados en Riba-roja presentaron las concentraciones más bajas en sus tejidos, mientras que incrementaba gradualmente en Flix y puntos aguas abajo. Navarro et al., (2009) no encontraron relación entre la concentración de Hg en los diferentes tejidos y las actividades de enzimas relacionados con estrés oxidativo (CAT, GST y peroxidación de lípidos) y daños en el DNA; las cuatro poblaciones estudiadas no presentaron diferencias significativas en sus valores. Por el contrario los niveles de GSH en el hígado presentaron variaciones significativas en las diferentes poblaciones en concordancia con los niveles de Hg en los tejidos, a mayor concentración de Hg mayores niveles de GSH en forma reducida. El número de copias de mRNA para las metalotioninas también mostraron diferencias entre poblaciones y tejido estudiado. En el hígado no se vio una relación clara entre concentración de Hg en este órgano y expresión de mRNA. En el riñón sí se vio relación, siendo los peces capturados en Riba-roja los que presentaban menor expresión de mRNA en riñón. Estos resultados eran de esperar puesto que el Hg en forma Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 17 Capítulo 1 ● Organismos como indicadores de la contaminación inorgánica se acumula en el riñón (ZALUPS, 2000; SATO; KONDOH, 2002; NECULITA et al., 2005). Así pues, dado el papel protector de las metalotioninas contra los metales, los autores consideran que los niveles de GSH en hígado y de mRNA para metalotioninas en riñón se pueden considerar buenos biomarcadores para los efectos del Hg inorgánico. También se estudiaron los niveles de mRNA en las escamas de los peces observándose una correlación débil pero significativa entre los niveles de mRNA y la concentración de Hg en los tejidos. El uso de este biomarcador es alternativa a los métodos invasivos y letales, puesto que el análisis de las escamas puede aportar información sobre la exposición y efectos de los metales sin necesidad de sacrificar el individuo. Otro estudio (QUIRÓS et al., 2007) realizado en este embalse y a lo largo del río Ebro, utilizó barbos (Barbus graellsii) para monitorizar los efectos de los metales pesados y compuestos orgánicos. Como biomarcadores, se desarrollaron técnicas moleculares para determinar los niveles de mRNA para metalotioninas y el citocromo P4501A (CYP1A) a la vez que se midió la actividad del enzima EROD. En los peces, los niveles de mRNA para CYP1A fueron significativamente elevados en los capturados en Flix respecto a los de peces de otros puntos del río Ebro y tributarios, probablemente esto evidencia los altos niveles de PCB y otros contaminantes orgánicos a los que están expuestos estos organismos. El número de copias de mRNA para metalotioninas en los peces no mostraron diferencias significativas dependiendo del punto de captura y los niveles no estaban correlacionados con las concentraciones de metales en sedimentos. En el caso de los barbos capturados en Flix, los niveles de mRNA eran similares a los de los barbos de puntos referenciales. La falta de sensibilidad puede ser debida a la interferencia de otros metales o a que una proporción importante del Hg total en el hígado esté en la forma orgánica de MeHg que no induce la síntesis de metalotioninas. Esta posibilidad fue postulada posteriormente por Navarro et al., (2009) el cual propone el riñón para el estudio de la expresión de estas proteínas, mientras que Carrasco et al., (2008 y 2011a) exponen la importancia de realizar análisis de especiación de Hg para una mayor comprensión del potencial tóxico del Hg y la interpretación de los resultados biológicos. Respecto a la actividad del enzima EROD, se mostró positivamente correlacionada con los niveles de mRNA para CYP1A y el gradiente de polución. En otro estudio, Eljarrat et al., (2008) analizaron la expresión de mRNA para la síntesis del CYP1A en hígado de barbos. Se encontró una gran disparidad de valores en los diferentes individuos capturados en Flix, aún así, la expresión de este gen fue mayor en los barbos de Flix que en los de otros puntos menos contaminados. Además los autores encontraron una correlación positiva y significativa con las concentraciones de PCBs en los tejidos de los peces capturados. Por otro lado, Lavado et al., (2006) obtuvieron una mayor actividad del enzima EROD en hígado y una reducción de la AChE en el músculo de carpas capturadas en Flix respecto a otros puntos menos contaminados por encima de este embalse. Como se ha explicado anteriormente, la actividad EROD está relacionada con la exposición a dioxinas o PCBs mientras que la disminución de la actividad de la AChE a plaguicidas organofosforados, aunque también los elevados niveles de metales pesados pueden ocasionar esta disminución. Por el contrario, al igual que Quirós et al., (2007) no se encontraron diferencias significativas entre los organismos capturados en diferentes puntos del río para los niveles de metalotioninas en hígado, mientras que tampoco se encontraron diferencias significativas para la enzima GST. Como hemos visto, los efectos de los contaminantes pueden ser detectados gracias a los niveles de ciertas moléculas, la actividad de determinadas enzimas y la integridad del DNA o la expresión de genes concretos. En cambio la elección del organismo y el tejido a estudiar es fundamental para poder monitorizar ya que, como se ha mostrado, la respuesta de los diferentes biomarcadores es variable en función de la especie y depende del tejido analizado. 2.2.2 Efectos a nivel celular y tisular Algunas evidencias de los efectos de los contaminantes en los tejidos de peces han sido recogidas en Flix. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 18 Capítulo 1 ● Organismos como indicadores de la contaminación En este sentido, Lavado et al., (2004) estudiaron diferentes puntos del Ebro, incluido el embalse de Flix, para detectar los posibles efectos de las sustancias contaminantes sobre el sistema endocrino de carpas. Los autores, aparte de parámetros moleculares, analizaron el tejido de las gónadas para detectar alteraciones inducidas por la exposición a los contaminantes. En las gónadas de las hembras se midió el índice gonadosomático, que relaciona el tamaño de la gónada con el del organismo; se contabilizó el número de oocitos y su madurez; y se evaluó la integridad general del tejido. En los machos se evaluó el índice gonadosomático, el grado de maduración de los espermatozoides en la gónada y la integridad general del tejido. Los autores partían de la hipótesis de que la mezcla de contaminantes podría tener efectos sobre el metabolismo y los órganos reproductores, es decir efectos de disrupción endocrina sobre los organismos. En las carpas capturadas en Flix se observaron alteraciones severas en las gónadas de algunos individuos capturados. En las hembras se observó un retraso de la maduración de los oocitos respecto a peces de otros puntos del mismo río y, en los machos, la espermatogénesis también se había retrasado. En los machos además se observó daño en el tejido gonadal con una alta proliferación de agregados de macrófagos. Tanto en machos como en hembras se detectó un bajo índice gonadosomático, es decir las gónadas presentaban bajo peso en relación con el cuerpo. Este índice, por sí solo, no es necesariamente un indicador de disrupción endocrina, puesto que otras presiones ambientales (p.e. disponibilidad de alimento) pueden interferir en el desarrollo de las gónadas, pero es un claro indicador de patologías (KINNBERG et al., 2000). Este conjunto de resultados, junto a otras evidencias bioquímicas (bajos niveles de testosterona y estradiol en el plasma de peces macho), ha llevado a los autores a suponer que los diferentes contaminantes orgánicos presentes en el embalse (alquilfenoles y organoclorados) son los responsables y que, por tanto, pueden tener efectos sobre el metabolismo reproductor de los peces. Resultados similares en este estudio sólo se observaron en carpas de otro punto del río Ebro influenciado por los efluentes de la estación depuradora de un importante centro urbano e industrial. Benejam et al., (2010) realizaron un estudio intensivo en el embalse de Flix, en el embalse de Riba-roja y puntos aguas abajo. Los investigadores se centraron en la estructura de los órganos reproductivos e indicadores generales de salud basados en el tamaño del hígado, tamaño y peso del organismo y la presencia de deformidades, lesiones en las aletas y tumores en diferentes partes del cuerpo (índice DELT, SANDERS et al., 1999). Las especies estudiadas fueron la carpa (C. carpio), el gardí (S. erythrophthalmus), el alburno (Alburnus alburnus), el rutilo (R. rutilus) y las especies exóticas perca sol (Lepomis gibbosus) y siluro (S. glanis). En estos resultados se muestra como en todos los puntos de muestreo las carpas son los peces con mayor presencia de deformidades, tumores u otras lesiones. Esto es especialmente notorio en Flix donde las carpas presentaron más alteraciones que en otras localidades. En las otras especies estudiadas, también se observa un incremento de deformidades, tumores u otras lesiones en aquellos individuos capturados en Flix. El tamaño del hígado en las especies estudiadas disminuyó aguas abajo de los puntos control. En el caso de las carpas, el valor mínimo se registró en Flix. Los autores vinculan esto a la exposición a la carga de contaminantes del embalse, especialmente PCBs y metales pesados, tal como se ha observado en otros lugares contaminados (HINCK et al., 2007; ROUSSEL et al., 2007). Por otra parte, puesto que el hígado es el órgano principal donde se almacena el glicógeno y grasas, su tamaño nos indica el estado nutricional del pez. También se observó una disminución en el tamaño de las gónadas. En las percas sol y las carpas se observaron valores mínimos en los individuos capturados en Flix. Los autores vinculan estas observaciones a la presencia de los contaminantes y sus posibles efectos directos de disrupción endocrina, pero tampoco descartan que se deba a efectos indirectos debidos a la baja condición física de los peces en las zonas expuestas. Según los autores, los organismos expuestos se verían obligados a reubicar recursos energéticos para hacer frente los daños que los contaminantes producen en el organismo, a expensas de la reproducción, lo que explicaría el menor tamaño gonadal. A pesar de que las carpas son unos peces cosmopolitas y altamente tolerantes a condiciones extremas de polución (CAROL et al., 2006), en este estudio presentaron una condición física menor Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 19 Capítulo 1 ● Organismos como indicadores de la contaminación que la de otras especies. Los autores atribuyen esto a su ecología, sus hábitos de alimentación (se alimenta del detritus del sedimento) y su preferencia por el bentos. Esto hace a esta especie mucho más expuesta a los contaminantes presentes en el sedimento y sus efectos. Como explicamos en el apartado 1.3., las alteraciones de los niveles normales de ciertas moléculas y la actividad de ciertas enzimas son indicadoras de alteraciones del metabolismo celular debido a una exposición a perturbaciones ambientales. En el presente caso, hemos demostrado que estas alteraciones son debidas a la presencia de xenobióticos en el embalse de Flix, y en consecuencia en los tejidos de los organismos. Una exposición continuada en el tiempo puede repercutir en la integridad y funcionalidad de estructuras superiores. Con los ejemplos explicados en este apartado hemos demostrado claras alteraciones en órganos como el hígado o las gónadas así como el incremento de lesiones en otros tejidos. Estas alteraciones pueden afectar a la viabilidad del individuo e incluso a la viabilidad de la población. En el siguiente apartado se exponen algunos ejemplos. 2.2.3 Efectos a nivel individual Dos estudios diferentes (BOSCH et al., 2009; PEREIRA et al., 2011) demostraron en el crustáceo cladócero Daphnia magna, que los fangos de Flix pueden llegar a causar mortalidad y reducir la reproducción de este organismo. Bosch et al., (2009) realizó varios test con D. magna y el alga Desmodesmus subspicatus cultivados en condiciones de laboratorio. Los autores recogieron sedimentos de Flix y diferentes puntos del río Ebro, aguas arriba y aguas abajo del embalse. Su intención era determinar qué fracción del sedimento era más tóxica y qué compuestos. Caracterizaron los compuestos presentes en el sedimento y analizaron mediante bioensayos la toxicidad de todo el sedimento y de las fracciones particulada y solubles del mismo. En los experimentos con el sedimento íntegro, los autores expusieron durante 10 días diferentes poblaciones de D. magna en recipientes con agua y muestras íntegras de los sedimentos de los diferentes puntos muestreados. Los autores usaron como indicadores de toxicidad el crecimiento (longitud de los organismos al final del experimento) y la capacidad reproductiva (medida como número de individuos nacidos al final del experimento). Los organismos expuestos a los sedimentos de Flix mostraron ausencia de reproducción y un crecimiento significativamente menor respecto al observado en los expuestos a los sedimentos de los otros puntos. Además los investigadores realizaron otros dos tipos diferentes de bioensayo. Por un lado expusieron durante 24 horas diferentes poblaciones de un clon de D. magna a partículas del sedimento en suspensión (fracción particulada, tamaño de partícula menor de 20 μm) de los diferentes tipos de sedimento. Por otro lado expusieron durante 24 horas otras poblaciones del mismo clon de D. magna a la fracción soluble del sedimento, esta fracción soluble se obtuvo a partir de filtrados de la fracción particulada. En estos bioensayos se estudió, como parámetro indicador de efectos subletales, la capacidad filtradora del organismo. Esta tasa de filtración fue medida como la capacidad de los individuos para alimentarse de un cultivo de algas unicelulares en suspensión, y se midió tanto durante la exposición a las diferentes fracciones de sedimento como después de la exposición. Cuando se midió la tasa de filtración en los organismos expuestos a las diferentes fracciones del sedimento se constató que ésta era significativamente menor en aquellos ensayos llevados a cabo con sedimentos de Flix. A su vez, cuando se midió la capacidad filtradora de los organismos después de ser expuestos a las diferentes fracciones, también se observó una significativa disminución de la misma en aquellos organismos expuestos a los sedimentos de Flix. Por el contrario, en los ensayos de crecimiento con D. subspicatus, expuesto a la fracción soluble de los diferentes sedimentos, no se observó un patrón claro de toxicidad de los sedimentos sobre el alga. El análisis químico de los sedimentos reveló resultados similares a los mostrados en otros estudios comentados a lo largo de este capítulo. No obstante, mediante bioensayos complementarios (control del pH y uso de quelantes para precipitar agregados orgánicos), los autores consideraron Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 20 Capítulo 1 ● Organismos como indicadores de la contaminación que la toxicidad observada en la fracción filtrada de los sedimentos de Flix fue debida a la alcalinidad producida por la presencia de compuestos como hidróxido de sodio o hidróxido de potasio, originados por la actividad de la fábrica. En el caso de la toxicidad observada en la fracción particulada, los autores consideran que son metales como el Cd o el Hg adsorbidos a estas partículas los principales responsables. La toxicidad de la materia particulada demuestra los posibles efectos adversos de la resuspensión del sedimento y la posibilidad de efectos en organismos aguas abajo del embalse debido al arrastre de estas partículas. Pereira et al., (2011) también evaluaron la toxicidad del sedimento de Flix sobre D. magna. Para ello mezclaron el sedimento de Flix con suelo no contaminado en diferentes proporciones y se extrajo de cada muestra la fracción soluble. Después, expusieron durante 48 horas varias poblaciones de un mismo clon de D. magna a la fracción soluble de estas mezclas y observaron los efectos sobre la supervivencia del cladócero según la proporción de sedimento contaminado. Los autores observaron una mayor mortalidad en aquellas poblaciones expuestas a las fracciones solubles de muestras con mayor proporción de sedimento contaminado. En este caso los autores también consideraron que la mortalidad podría ser debida en mayor parte a la presencia de hidróxidos de sodio o potasio en los sedimentos, puesto que el pH de la fracción disuelta era extremadamente alto (10,1-11,7). Hasta ahora hemos mostrado evidencias de que los sedimentos de Flix pueden causar efectos crónicos en los organismos expuestos a ellos. Como se vio en el apartado anterior Benejam et al., (2010) detectaron este tipo de efectos crónicos en peces de Flix como son la disminución de la fecundidad y una disminución del estado general de salud, manifestada por una mayor infección por parásitos y la presencia de erosiones en los tejidos. Por otro lado, de estos ensayos con D. magna podemos deducir que los sedimentos de Flix, en casos de resuspensión pueden llegar a causar toxicidad aguda (alta toxicidad en un breve periodo de exposición) como mortalidad o disminución de capacidad filtradora en D. magna. 2.3 MÁS ALLÁ DE FLIX: EXTENSIÓN DE LA CONTAMINACIÓN A OTROS SISTEMAS Los ríos mediterráneos sufren periodos de sequías y avenidas (GASITH; RESH, 1999). Estas últimas se producen en los meses de otoño e invierno, después de lluvias torrenciales. En este sentido el río Ebro es un río muy regulado y los embalses amortiguan las oscilaciones propias de este clima (BATALLA et al., 2004) y sirven de barrera para el transporte de material contaminado (LACORTE et al., 2006). Sin embargo, es inevitable que periódicamente sufra aumentos considerables y localizados de caudal (VERICAT; BATALLA, 2005), y puntualmente se producen arrastres de material río abajo. Esto ha sido ya observado por Gómez-Gutierrez et al., (2006) y Navarro-Ortega et al., (2010) en el río Ebro para diferentes contaminantes. En el caso de Flix, un embalse con muy poca profundidad media (3,4 m) y muy bajo tiempo de residencia (0,29 días) en comparación con otros embalses de esta misma cuenca, estos aumentos de caudal pueden suponer la resuspensión de los sedimentos contaminados y el transporte de los mismos aguas abajo, lo que supondría posibles efectos tóxicos en organismos aguas abajo, como comprobó Bosch et al., (2009) en bioensayos con D. magna. Cambios de densidad asociados a temperaturas ambientales extremas pueden ser también causa de resuspensión de los sedimentos mediante la formación de corrientes asociadas a estos cambios de densidad (HERRERO et al., 2010). Grimalt et al., (2003) encontraron niveles significativamente elevados de los metales Hg y Cd, así como de los compuestos organoclorados (PCBs, HCB, policloronaftalenos y policloroestirenos), aguas abajo del embalse. Por su parte Olivares et al., (2010) también encontraron presencia de compuestos organoclorados en puntos de muestreo aguas abajo. Estos autores atribuyen su presencia al arrastre de material sedimentario del embalse de Flix. Uno de los mayores problemas de un foco de contaminación es el grado en el que éste afecta a otros sistemas alejados del mismo. Esto sucede en la mayoría de ocasiones para aquellos contaminantes susceptibles de acumularse en la cadena trófica y Flix no es una excepción. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 21 Capítulo 1 ● Organismos como indicadores de la contaminación Diferentes trabajos han demostrado la presencia y los efectos de los contaminantes de Flix en organismos que habitan fuera de este embalse. Tres trabajos diferentes estudiaron la presencia de contaminantes y sus efectos en aves piscívoras del entorno de Flix (garza imperial, garcilla bueyera y garceta común). Quirós et al., (2008) estudiaron polluelos de estas aves. Midieron parámetros morfológicos y los niveles de micronúcleos en eritrocitos como respuesta a los posibles efectos de la contaminación del embalse de Flix, la hipótesis era que las aves piscívoras podían contaminarse mediante la ingesta de peces con alto contenido de contaminantes en sus tejidos. La presencia de micronúcleos en los eritrocitos es indicadora de contacto con agentes genotóxicos. Los micronúcleos se producen en la mitosis debido a un anafase anómalo con consiguiente rotura de la cromatina y su incorrecta distribución. El estudio se realizó en 2006 sobre diferentes poblaciones de garza imperial (Ardea purpurea), garcilla bueyera (Bubulcus ibis) y de garceta común (Egretta garzetta) nidificantes en el entorno de diferentes tramos del río Ebro (el embalse de Flix y el delta del Ebro) o sus afluentes (en l’Aiguabarreig, una zona poco impactada, donde confluyen el Cinca y el Segre). La única ave que nidifica en los tres puntos es la garza imperial, mientras que las otras especies se usaron para comparar resultados. De todos los parámetros estudiados solo los niveles de micronúcleos en eritrocitos parecían estar afectados por la presencia de contaminantes en el entorno. En el caso de la garza imperial, de la cual se recogieron muestras de sangre de los polluelos en las tres áreas de estudio, el número de eritrocitos con micronúcleos detectados fue significativamente mayor en Flix seguido del delta del Ebro, respecto al punto menos impactado aguas arriba (Aiguabarreig). Según los autores, los valores encontrados en las zonas contaminadas fueron similares a los encontrados en la bibliografía para otras especies que habitan en lugares contaminados. Pese a estos resultados los niveles no deben considerarse alarmantes. Los autores sostienen que estos valores en la garza imperial son debidos a la ingesta de peces contaminados con metales pesados o compuestos organoclorados con actividad genotóxica. Los resultados obtenidos en las otras especies corroboraron el impacto de la dieta en los niveles de micronúcleos. Barata et al., (2010) también realizó un estudio en 2006 sobre diferentes poblaciones de garza imperial nidificantes en el delta del Ebro, en l’Aiguabarreig y en las cercanías del embalse de Flix. Se analizaron huevos, plumas y muestras de sangre de polluelos, así como también se midieron diferentes parámetros biométricos en los polluelos. En las plumas se analizó el contenido de metales pesados y en los huevos se estudió el contenido de compuestos organoclorados. En la sangre se midieron las actividades de diferentes enzimas plasmáticas (lactato deshidrogenasa y beta esterasas), la presencia de especies reactivas y se cuantificó la presencia de micronúcleos en eritrocitos. Respecto a la presencia de metales y organoclorados en los organismos, estos estaban en menor concentración en el punto menos impactado (Aiguabarreig) respecto a los otros aguas abajo, excepto para el HCH, que presentó niveles más altos. En el caso del Hg, la concentración era significativamente mayor en las plumas de individuos de Flix. Estos valores fueron inferiores a los descritos en otras especies que habitan en lugares contaminados y estaban por debajo de valores letales. En el caso del Pb la concentración era mayor en las plumas de garza imperial nidificantes en Flix que en el punto referencia y aguas abajo. Las concentraciones de HCB y PCBs en huevos de garza imperial fueron mayores en las poblaciones próximas a Flix (entre 3 y 4 veces superiores a las otras zonas), los valores de DDT también fueron más elevados en Flix y el delta respecto a la zona menos impactada. Los autores encontraron estos valores similares a los publicados para esta especie u otras emparentadas y que habitan zonas contaminadas. En cambio estos niveles no son lo suficientemente altos para comprometer la viabilidad de los individuos, si bien sí pueden causar efectos subletales, tal como ha sido demostrado con el uso de biomarcadores. Los autores encontraron correlaciones significativas entre los niveles de Hg en las plumas y los niveles de determinados biomarcadores en sangre. En los polluelos de garzas que habitaban Flix y la zona del delta del Ebro, se detectó una disminución de los radicales peroxilo en el plasma (que demuestra la Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 22 Capítulo 1 ● Organismos como indicadores de la contaminación existencia de estrés oxidativo) y un incremento en los micronucleos de los eritrocitos (que demuestra genotoxicidad). Cotin et al., (2012) también estudiaron el contenido de metales en huevos y plumas de polluelos de garza imperial en los mismos lugares que los estudios anteriores durante tres años consecutivos (2006-2008). En las concentraciones de metales pesados, al igual que los estudios anteriores, se encontraron diferencias significativas en cuanto al punto de muestreo. Las concentraciones de Hg y Cr en plumas y huevos eran mayores en las muestras de Flix. Los valores de Hg en plumas estaban por debajo de los descritos en otras zonas con alta polución, si bien las concentraciones encontradas (13,6 μg/g) están en los umbrales de toxicidad. La presencia de contaminantes en tejidos de peces en puntos aguas debajo de Flix y la descripción de efectos en ellos ha sido detallada por algunos autores citados en apartados anteriores. Carrasco et al., (2011b), encontraron que las concentraciones de Hg total y MeHg en los tejidos de siluros y carpas se iban incrementando aguas abajo del embalse de Flix (Figura 4). Los valores en 2 estaciones de muestreo a 6 y 37 km de Flix fueron más del doble y el triple, respectivamente, de los registrados en el embalse. Figura 4: Concentraciones de MeHg en las dos especies de peces investigados en las estaciones de muestreo en la cuenca baja del río Ebro. En la gráfica se puede observar el incremento de las concentraciones de MeHg en el tejido de los peces y el patrón diferenciado de acumulación dependiendo de la especie. Las cajas representan los percentiles 25, 50 (mediana) y 75, y los bigotes los valores mínimo y máximo. Por su parte, en un estudio similar, Navarro et al., (2009) estudiaron únicamente carpas teniendo en cuenta el contenido de Hg y los niveles de ciertos biomarcadores en los tejidos del pez. Los autores encontraron los mismos resultados que Carrasco et al., (2011) respecto al contenido de Hg. Referente a los biomarcadores se encontró mayor cantidad de copias de mRNA para la síntesis de metalotioninas en el riñón de los peces de las dos estaciones aguas abajo que en los peces de Flix. Los niveles de glutatión reducido también se incrementaron respecto a Flix en estos puntos. Y s encontraron correlaciones significativas entre los valores de estos biomarcadores y el contenido de Hg en los tejidos. Olivares et al., (2010) también analizaron diferentes biomarcadores en carpas y relacionaron su actividad con la presencia de compuestos organoclorados en estaciones aguas abajo de Flix. La actividad EROD y la expresión de mRNA para el CYP1A fue significativamente alta en estas estaciones respecto la estación control. También encontraron indicios de genotoxicidad y alteraciones en el hígado de los peces. Existe una relación entre estas evidencias y el impacto de los contaminantes orgánicos, posiblemente provenientes de Flix. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 23 Capítulo 1 ● Organismos como indicadores de la contaminación Finalmente Benejam et al., (2010) evidenció una disminución en la fecundidad y un incremento de enfermedades y parásitos en diferentes especies de peces en diferentes puntos aguas abajo. En bivalvos también se ha observado acumulación de contaminantes y sus efectos. Faria et al., (2010a, b) estudió las concentraciones de diferentes contaminantes y sus efectos en poblaciones de bivalvos aguas abajo. Encontró concentraciones de organoclorados (HCB, HCH, DDT, PCBs) en los tejidos de mejillón cebra similares a las presentes en organismos recolectados en Flix. Para el Hg, las concentraciones fueron menores que en los organismos de Flix, pero mayores que en organismos de lugares de referencia. En cambio para metales como el Cu, el Zn o el Ni las concentraciones fueron similares a los organismos de Flix. Los autores encontraron para algunos biomarcadores valores iguales o mayores que los encontrados en organismos expuestos a los sedimentos de Flix. Por ejemplo para P. littoralis y D. polymorpha las respuestas para algunos biomarcadores sugerían un impacto mayor en poblaciones muestreadas 6 km aguas abajo, estas especies mostraron mayor evidencia de daños en el DNA en esta localidad. Carrasco et al., (2008) estudió las concentraciones de Hg total y MeHg en mejillones cebra recolectados en un punto pocos kilómetros aguas debajo de la presa. Los valores encontrados fueron menores que los de los mejillones capturados en la zona FQ del embalse pero similares a los de los mejillones capturados en la zona FR y mayores que los de la zona referencia. Alcaraz et al., (2011) confirma los resultados de los anteriores estudios. Los autores encontraron niveles de Hg, Ti, Mn y Cu, en mejillones cebra recolectados 30 km aguas abajo, mayores que los de las zonas control y mayores que los citados en la bibliografía para esta especie. También se observó un gradiente de concentración a lo largo del río, incrementándose significativamente la concentración de metales en los tejidos de los mejillones a partir de Flix. Cid et al., (2010) estudió el contenido de metales en los tejidos de dos insectos acuáticos de hábitos filtradores (Ephoron virgo e Hydropsyche spp.). Los autores demostraron que las concentraciones de Hg en estos insectos eran mayores en un orden de magnitud que aguas arriba del embalse. Los metales Cd, Cr y Zn también presentaron concentraciones significativamente elevadas en insectos aguas abajo del embalse. La acumulación de metales, por otro lado variaba según el estado de desarrollo de los organismos y la especie estudiada, siendo E. virgo la especie con mayor capacidad de bioacumulación. Puesto que estos organismos son filtradores la asimilación de metales es debida a la ingesta de materia particulada con metales adsorbidos. Los trabajos de Carrasco et al., (2008 y 2011b), Navarro et al., (2009), Barata et al., (2010); Faria et al., (2010 a,b), mostraron que la forma más biodisponible del Hg (MeHg) así como el Hg inorgánico se acumulaba aguas abajo del embalse de Flix en diferentes especies. Carrasco et al., (2011b) encontraron que las carpas muestreadas a unos 40 Km del embalse de Flix en la localidad de Xerta tenían más Hg que aquellas muestreadas en Flix. Estos resultados indican que posiblemente el mercurio inorgánico vertido por la planta de química en Flix se metila aguas abajo y su biodisponibilidad aumenta. Esta metilación y biodisponibilidad puede variar según el lugar de muestreo puesto que depende de factores tales como el potencial redox, el pH o la actividad bacteriana. También existe la hipótesis de que el Hg que se encuentra en el lecho del embalse de Flix puede ser transportado pasivamente aguas abajo, por ejemplo en el biofilm al desprenderse éste de los sedimentos contaminados (SOTO el al., 2011), en el mismo material sedimentario en suspensión (BOSCH et al., 2009) o mediante transporte de invertebrados en casos de avenidas, para finalmente acumularse aguas abajo. En las Figuras 5 y 6 se esquematizan los efectos encontrados en los anteriores trabajos en cuanto a efectos en enzimas de biotransformación directamente relacionados con la presencia de compuestos semejantes a dioxinas así como de daño oxidativo (Figura 5) e inducción de la metalotionenina causada por mercurio (Figura 6). En la Figura 5 se aprecia claramente que la actividad EROD o expresión génica de CYP1A1 en carpas y siluros presenta un máximo en Ascó, así como los marcadores de daño oxidativo en mejillones cebra y peces, tales como pérdida de integridad del ADN y presencia de micronúcleos en sangre. En la Figura 6 se observa con claridad Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 24 Capítulo 1 ● Organismos como indicadores de la contaminación que los niveles máximos de Hg encontrado en carpa así como la expresión del gen de metalotionina presentan un máximo en Xerta. 3 DISCUSIÓN Y CONCLUSIONES GENERALES - La factoría química de Flix, a causa de sus vertidos, ha acumulado residuos en el embalse durante más de 100 años. Figura 5: Comparación de la actividad de diferentes biomarcadores en siluros, carpas y mejillón cebra en cuatro puntos diferentes del río Ebro, incluyendo el embalse de Flix. Se puede comprobar cómo la actividad de los diferentes biomarcadores es mayor en Ascó, punto situado 6 km abajo del embalse. EROD, actividad etoxi resorufin O de-etilasa; MN, frecuencia de eritrocitos con micronúcleos en sangre; CYP1A1, actividad citocromo P4501A; SOD, actividad superóxido dismutasa; CAT, actividad catalasa; LPO, niveles de peroxidación de lípidos; daño DNA, nivel de cadenas de DNA dañadas. Figura 6: Relación entre expresión de mRNA para metalotioninas (MT1 con trazo continuo y MT2 con trazo discontinuo) en riñón (rojo), hígado (verde) y escamas (azul) de carpas capturadas en diferentes puntos del río Ebro y la concentración de Hg en sus tejidos. Se puede observar bioacumulación del Hg aguas abajo del embalse de Flix y una mayor expresión de mRNA para las metalotioninas. - El embalse de Flix presenta una alta concentración de contaminantes en forma de metales pesados, compuestos orgánicos organoclorados y radionúclidos. Las concentraciones para algunos compuestos superan las registradas en otros lugares con importante contaminación, como es el caso del Hg. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 25 Capítulo 1 ● Organismos como indicadores de la contaminación - Diferentes estudios han demostrado la transferencia de estos contaminantes a los organismos que habitan dicho embalse y su acumulación, especialmente el Hg. - Diferentes estudios han demostrado que estos contaminantes han producido alteraciones, a diferentes niveles, en los organismos que habitan el embalse. - Algunos trabajos han demostrado la posibilidad de efectos letales debidos a la exposición a fracciones de los sedimentos de Flix, aunque las evidencias recopiladas en campo demuestran predominancia de efectos crónicos. - La contaminación del embalse de Flix puede extenderse aguas abajo. Evidencias del transporte y presencia de los contaminantes en tramos inferiores del río Ebro han sido documentadas en muestras de sedimento y tejidos de organismos. - El riesgo para organismos acuáticos aguas abajo del embalse y para organismos de ecosistemas próximos al embalse han sido demostrados en diferentes estudios. - La caracterización química del sedimento y los tejidos de los organismos, junto con el uso de biomarcadores, han permitido determinar el riesgo sobre los organismos de la carga contaminante. Los resultados obtenidos sobre el transporte, acumulación y efectos de los contaminantes presentes en Flix en el tramo final del río Ebro muestran claramente como éstos son biodisponibles tanto en el mismo embalse como aguas abajo. De todos los contaminantes analizados, el Hg y su forma metilada (MeHg) son posiblemente los más preocupantes por los niveles alcanzados en organismos, sedimentos y su capacidad de transferencia en la cadena trófica. Sólo los niveles de mercurio encontrados en las especies de peces de Flix y aguas abajo del embalse sobrepasó los niveles permitidos para su consumo humano, lo cual constata que el mercurio es el contaminante que tiene mayor riesgo. Curiosamente el mercurio es el único contaminante cuyo vertido es constante y está permitido por la Confederación Hidrográfica del Ebro siempre que su valor en agua no supere los valores permitidos por la Directiva Marco del Agua, pero que alcanza en determinadas zonas del embalse de Flix valores cercanos a 1 μg/g. Respecto a la modelización del transporte y acumulación de contaminantes a través de la red trófica acuática en Flix, cabe destacar que los autores citados observaron diferentes patrones de acumulación de los contaminantes según el tejido y el organismo estudiado (como en el caso del Hg y el MeHg según Carrasco et al., 2011a y 2011b). Por tanto, éstos recomiendan estudiar la acumulación de los contaminantes en diferentes tejidos y organismos y efectuar un análisis de especiación de los metales pesados para evitar interpretaciones erróneas. Aun así, los resultados obtenidos no concuerdan con los esperados, si bien hay un claro patrón de biomagnificación de PCBs, DDTs y mercurio desde los productores primarios, consumidores, depredadores, en cambio su relación con el nivel trófico no es obvia y no responde a lo observado en la bibliografía. Hay varios motivos que justifican este comportamiento. El primero de ellos responde al hecho de que el embalse de Flix no es un lago cerrado sino una represa con un tiempo de residencia muy corto, lo que hace que los contaminantes sean transportados rápidamente aguas abajo. Por otra parte la contaminación en el embalse de Flix es heterogénea lo que hace que exista una gran variabilidad entre la concentración de contaminantes en productores primarios según su localización en el embalse, y por tanto entre consumidores y depredadores. Como se expuso anteriormente, el perifíton y organismos sésiles como el mejillón cebra presentan concentraciones de metales diferentes según su ubicación en el embalse y, por consiguiente, su grado de exposición a los fangos contaminados. Existe así mismo una gestión incontrolada de determinadas especies de peces objeto de pesca como los siluros que son transportados aguas arriba o aguas abajo según su necesidad para ser pescados. Esto hace que determinados peces capturados aguas arriba en zonas supuestamente exentas de contaminación posean una elevada carga de contaminantes y viceversa. En el caso del Hg los procesos de metilación que se producen por mediación de microorganismos en condiciones anaeróbicas facilitan la biodisponibilidad y bioacumulación de este metal. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 26 Capítulo 1 ● Organismos como indicadores de la contaminación Esto refuerza el uso de aproximaciones interdisciplinares en la evaluación de riesgo ecotoxicológico en los ecosistemas y organismos, puesto que a los propios aspectos fisiológicos se añaden aspectos ambientales a tener en cuenta. El análisis de los biomarcadores en diferentes organismos ha revelado la existencia de exposición de los organismos a los xenobióticos presentes en el medio, aunque también se ha visto que esta respuesta no es homogénea, mostrándose diferentes patrones de sensibilidad según la especie. Por otra parte, la mayoría de los efectos moleculares-bioquímicos observados en mejillones, cangrejos y peces fueron mayores aguas abajo del embalse de Flix. Ello no significa necesariamente que existan efectos a nivel individual y poblacional, aunque si la exposición es constante y de cierta magnitud los organismos pueden ver comprometida su salud y viabilidad. Los resultados de Benejan et al. (2011) indican un menor índice de condición física, menor fecundidad y mayor incidencia de parasitismo en los peces muestreados en Flix que en aquellas aguas arriba o aguas abajo del embalse. Esta aparente diferencia entre efectos sub-individuales y las respuestas individuales es común en la mayor parte de estudios y se fundamenta en el hecho de que los biomarcadores nos indican principalmente exposición al contaminante pero no efectos en el mismo. Por ello en cualquier estudio de monitorización ambiental es necesario estudiar efectos a nivel molecular, fisiológico e individual o poblacional. AGRADECIMIENTO Durante la elaboración de este capítulo, Julio César López Doval disfrutó de una beca post doctoral FAPESP (proceso 2012/1640-6) REFERENCIAS ACUAMED. Informe de viabilidad de la actuación 4.d. Limitación de la contaminación química del embalse de Flix 1º fase (Tarragona). Aguas de las Cuencas Mediterráneas, S.A. Madrid. 2007. ADAMS, S. M. J. P.; GIESY, L. A.; TREMBLAY C. T. E. The use of biomarkers in ecological risk assessment: recommendations from the Christchurch conference on Biomarkers in Ecotoxicology. Biomarkers, v. 6, p. 1–6. 2001 ALCARAZ, C.; CAIOLA, N.; IBÁÑEZ, C. Bioaccumulation of pollutants in the zebra mussel from hazardous industrial waste and evaluation of spatial distribution using GAMs. Science of the Total Environment, v. 409, p. 898– 904. 2011. ALCORLO, P.; OTERO, M.; CREHUET, M.; BALTANÁS, A.; MONTES, C. The use of the red swamp crayfish (Procambarus clarkii, Girard) as indicator of the bioavailability of heavy metals in environmental monitoring in the River Guadiamar (SW, Spain). Science of the Total Environment, p.380–390. 2006. BARATA, C.; SOLAYAN, A.; PORTE, C. Role of B - esterases in assessing toxicity of organophosphorous (chlorpyrifos, malathion) and carbamate (carbofuran) pesticides to Daphnia magna. Aquatic Toxicology, v. 66, p. 125– 139. 2004. BARATA, C.; FABREGAT, M.C.; COTÍN, J.; HUERTAS, D.; SOLÉ, M.; QUIRÓS, L.; SANPERA, C.; JOVER, L.; RUIZ, X.; GRIMALT, J.O.; PIÑA, B. Blood biomarkers and contaminant levels in feathers and eggs to assess environmental hazards in heron nestlings from impacted sites in Ebro basin (NE Spain). Environmental Pollution, v. 158, p. 704–710. 2010. BATALLA, R. J.; GÓMEZ, C.M.; KONDOLF, G.M. Reservoir-induced hydrological changes in the Ebro River basin (NE Spain). Journal of Hydrology, v. 290, p. 117–136. 2004. BENEJAM, L.; BENITO, J.; GARCÍA-BERTHOU, E. Decreases in condition and fecundity of freshwater fishes in a highly polluted reservoir. Water, Air, and Soil Pollution, v. 210, p. 231–242. 2010. BINELLI, A.; PROVINI, A. DDT is still a problem in developed countries: the heavy pollution of Lake Maggiore. Chemosphere, v. 52, p. 717–723. 2003. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 27 Capítulo 1 ● Organismos como indicadores de la contaminación BINELLI, A.; RICCIARDI, F.; RIVA, C.; PROVINI, A. New evidences for old biomarkers: effects of several xenobiotics on EROD and AChE activities in zebra mussel (Dreissena polymorpha). Chemosphere, v. 62, p. 510–519. 2006. BLOOM, N. S. On the chemical form of mercury in edible fish and marine invertebrate tissue. Canadian Journal of Fisheries and Aquatic Sciences, v. 49, p. 1010–1017. 1992. BOCHETTI, R.; FATTORINI, D.; PISANELLI, B.; MACCHIA, S.; OLIVEIRO, L.; PILATO, F.; PELLEGRINI, D.; REGOLI, F. Contaminant accumulation and biomarker responses in caged mussels, Mytilus galloprovincialis, to evaluate bioavailability and toxicological effects of remobilized chemicals during dredging and disposal operations in harbour areas. Aquatic Toxicology, v. 89, p. 257–266. 2008. BOLETIN OFICIAL DEL ESTADO. Resolución de 25 de octubre de 2006, de la Secretaría General para la Prevención de la Contaminación y el Cambio Climático, por la que se formula declaración de impacto ambiental sobre la evaluación del proyecto «Eliminación de la contaminación química del embalse de Flix (Tarragona)». BOE, Madrid, n.275, p. 40516-40523. 17 de noviembre, 2006. BONADA, N.; PRAT, N.; RESH, V. H.; STATZNER, B. Developments in aquatic insect biomonitoring: a comparative analysis of recent approaches. Annual Review of Entomology, v. 51, p. 495–523. 2006. BOSCH, C.; OLIVARES, A.; FARIA, M.; NAVAS, J. M.; DEL OLMO, I.; GRIMALT, J. O.; PIÑA, B.; BARATA, C. Identification of water soluble and particle bound compounds causing sublethal toxic effects. A field study on sediments affected by a chlor-alkali industry. Aquatic Toxicology, v. 94, p. 16–27. 2009. BRACK, W. Effect-directed analysis: a promising tool for the identification of organic toxicants in complex mixtures? Analytical and Bioanalytical Chemistry, v. 377, p. 397–407. 2003. BRACK, W.; APITZ, S. E.; BORCHARDT, D.; BRILS, J.; CARDOSO, A. C.; FOEKEMA, E. M.; VAN GILS, J.; JANSEN, S.; HARRIS, B.; HEIN, M.; HEISE, S.; HELLSTEN, S.; DE MAAG, G. J.; MULLER, D.; PANOV, V. E.; POSTHUMA, L.; QUEVAUVILLER, P.; VERDONSCHOT, P. F. M.; VON DER OHE, P. C. Toward a holistic and risk-based management of European river basins. Integrated Environmental Assessment and Management, v. 5, p. 5–10. 2009. BURGER, J. Bioindicators: a review of their use in the environmental literature 1970–2005. Environmental Bioindicators, v. 1, p. 136–144. 2006. BURGER, J.; GOCHFELD, M. On developing bioindicators for human and ecological health. Environmental Monitoring and Assessment, v. 66, p. 23–46. 2001. CAMUSSO, M.; BALESTRINI, R.; MURIANO, F.; MARIANI, M. Use of fresh-water mussel Dreissena polymorpha to assess trace-metal pollution in the lower River Po (Italy). Chemosphere, v. 29, p. 729–745. 1994. CAROL, J.; BENEJAM, L.; ALCARAZ, C.; VILA-GISPERT, A.; ZAMORA, L.; NAVARRO, E.; ARMENGOL, J.; GARCIA-BERTHOU, E. The effects of limnological features on fish assemblages of 14 Spanish reservoirs. Ecology of Freshwater Fish, v. 15, p. 66–77. 2006. CARRASCO, L.; BENEJAM, L.; BENITO, J.; BAYONA, J. M.; DÍEZ, S. Methylmercury levels and bioaccumulation in the aquatic food web of a highly mercury-contaminated reservoir. Environment International, v. 37, p. 1213–1218. 2011a. CARRASCO, L.; BARATA, C.; GARCÍA-BERTHOU, E.; TOBIAS, A.; BAYONA, J. M.; DÍEZ, S. Patterns of mercury and methylmercury bioaccumulation in fish species downstream of a long-term mercury-contaminated site in the lower Ebro River (NE Spain). Chemosphere, v. 84, p. 1642–1649. 2011b. CARRASCO, L.; DÍEZ, S.; SOTO, D. X.; CATALÁN, J.; BAYONA, J. M. Assessment of mercury and methylmercury pollution with zebra mussel (Dreissena polymorpha) in the Ebro River (NE Spain) impacted by industrial hazardous dumps. Science of the Total Environment, v. 407, p. 178-184. 2008. CARVALHO, F. P. 210Po and 210Pb intake by the Portuguese population: the contribution of seafood in the dietary intake of 210Po and 210Pb. Health Physics, v. 69, p. 469–480. 1995. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 28 Capítulo 1 ● Organismos como indicadores de la contaminación CID, N.; IBÁÑEZ, C.; PALANQUES, A.; PRAT, N. Patterns of metal bioaccumulation in two filter-feeding macroinvertebrates: Exposure distribution, inter-species differences and variability across developmental stages. Science of the Total Environment, v. 408, p. 2795–2806. 2010. CLARKSON, T. W.; MAGOS, L.; MYERS, G. J. Human exposure to mercury: the three modern dilemmas. Journal of Trace Element in Experimental Medicine, v. 16, p. 321–343. 2003. CLECKNER, L. B.; GILMOOUR, C. C.; HURLEY, J. P.; KRANBBEHOFT, D. P. Mercury methylation in periphyton of the Florida Everglades. Limnology and Oceanography, v. 44, p. 1815–1825. 1999. COTÍN, J.; GARCÍA-TARRASÓN, M.; JOVER, L.; SANPERA, C. Are the toxic sediments deposited at Flix reservoir affecting the Ebro river biota? Purple heron eggs and nestlings as indicators. Ecotoxicology, v. 21, p. 1391–1402. 2012. DEVESA, V.; SÚNER, M. A.; LAI, V. W. M.; GRANCHINHO, S. C. R.; MARTÍNEZ, J. M.; VÉLEZ, D.; CULLEN, W. R.; MONTORO, R. Determination of arsenic species in a freshwater crustacean Procambarus clarkii. Applied Organometallic Chemistry, v. 16, p. 123–132. 2002. EDWARDS, P. R.; HRYCAY, E. G.; BANDIERA, S. M. Differential inhibition of hepatic microsomal alkoxyresorufin O-dealkylation activities by tetrachlorobiphenyls. Chemico-Biological Interactions, v. 169, p. 42–52. 2007. ELJARRAT, E.; MARTÍNEZ, M. A.; SANZ, P.; CONCEJERO, M. A.; PIÑA, B.; QUIRÓS, L.; RALDÚA, D.; BARCELÓ, D. Distribution and biological impact of dioxin-like compounds in risk zones along the Ebro River basin (Spain). Chemosphere, v. 71, p. 1156–1161. 2008. ESCARTIN, E.; PORTE, C. The use of cholinesterase and carboxylesterase activities from Mytilus galloprovincialis in pollution monitoring. Environmental. Toxicology and Chemistry, v. 16, p. 2090–2095. 1997. FARIA, M.; HUERTAS, D.; SOTO, D. X.; GRIMALT, J. O.; CATALAN, J.; RIVA, M. C.; BARATA, C. Contaminant accumulation and multi-biomarker responses in field collected zebra mussels (Dreissena polymorpha) and crayfish (Procambarus clarkii), to evaluate toxicological effects of industrial hazardous dumps in the Ebro river (NE Spain). Chemosphere, v. 78, p. 232–240. 2010a. FARIA, M.; LÓPEZ, M. A.; DÍEZ, S.; BARATA, C. Are native naiads more tolerant to pollution than exotic freshwater bivalve species? An hypothesis tested using physiological responses of three species transplanted to mercury contaminated sites in the Ebro River (NE, Spain). Chemosphere, v. 81, p. 1218–1226. 2010b. FERNANDES, D.; POTRYKUS, J.; MORSIANI, C.; RALDÚA, D.; LAVADO, R.; PORTE, C. The combined use of chemical and biochemical markers to assess water quality in two low-stream rivers (NE Spain). Environmental Research, v. 90, p. 169–178. 2002. FERNANDEZ, M. A.; ALONSO, C.; GONZÁLEZ, M. J.; HERNANDEZ, L. M. Occurrence of organochlorine insecticides, PCBs and PCB congeners in waters and sediments of the Ebro river (Spain). Chemosphere, v. 38, p. 33– 43. 1999. FRASCO, M. F.; FOURNIER, D.; CARVALHO, F.; GUILHERMINO, L. Do metals inhibit acetylcholinesterase (AChE)?. Implementation of assay conditions for the use of AChE activity as a biomarker of metal toxicity. Biomarkers, v. 10, p. 360–375. 2005. GASITH, A.; RESH, V. H. Streams in Mediterranean climate regions: abiotic influences and biotic responses to predictable seasonal events. Annual Review of Ecology, Evolution and Systematics, v. 30, p. 51–81. 1999. GITAHI, S.M.; HARPER, D. M.; MUCHIRI, S. M.; TOLE, M. P.; NGANGA, R. N. Organochlorine and organophosphorus pesticide concentrations in water, sediment, and selected organisms in Lake Naivasha (Kenya). Hydrobiologia, v. 488, p. 123–128. 2002. GÓMEZ-GUTIERREZ, A. I.; JOVER, E.; BODINEAU, L.; ALBAIGÉS, J.; BAYONA, J. M. Organic contaminant loads into the Western Mediterranean Sea: Estimate of Ebro River inputs. Chemosphere, v. 65, p. 224–236. 2006. GRANDJEAN, P.; WHITE, R. F.; NIELSEN, A.; CLEARLY, D.; SANTOS, E. C. D. Methylmercury neurotoxicity in Amazonian children downstream from gold mining. Environmental Health Perspectives, v. 107, p. 587–591. 1999. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 29 Capítulo 1 ● Organismos como indicadores de la contaminación GRIMALT, J. O.; SÁNCHEZ-CABEZA, J. A.; PALANQUES, A.; CATALÁN, J. Estudi de la dinàmica dels compostos organoclorats persistents i altres contaminants en els sistemes aquàtics continentals. Barcelona: ACA/CIRIT, 2003. ACA/CIRIT Final Report. HANARI, N.; KANNAN, K.; HORII, Y.; TANIYASU, S.; YAMASHITA, N.; JUDE, D. J.; BERG, M. B. Polychlorinated naphthalenes and polychlorinated biphenyls in benthic organisms of a Great Lakes food chain. Archives of Environmental Contamination and Toxicology, v. 47, p. 84–93. 2004. HEINK, U.; KOWARIK, I. What are indicators? On the definition of indicators in ecology and environmental planning. Ecological Indicators, v. 10, p. 584–593. 2010. HERRERO, A.; MEDINA, V.; BATEMAN, A. Sediment resuspension associated to density currents. In: INTERNATIONAL CONFERENCE ON WATER RESOURCES – CMWR, 2010, Barcelona. Application to Flix reservoir. Barcelona: CMWR, 2010. HIGUERAS, P.; OYARZUN, R.; LILLO, J.; SÁNCHEZ-HERNÁNDEZ, J. C.; MOLINA, J. A.; ESBRÍ, J. M.; LORENZO, S. The Almadén district (Spain): anatomy of one of the world's largest Hg-contaminated sites. Science of the Total Environment, v. 356, p. 112–124. 2006. HINCK, J. E.; BLAZER, V. S.; DENSLOW, N. D.; ECHOLS, K. R.; GROSS, T. S.; MAY, T. W.; ANDERSON, P. J.; COYLE, J. J.; TILLITT, D. E. Chemical contaminants, health indicators, and reproductive biomarker responses in fish from the Colorado River and its tributaries. Science of the Total Environment, v. 378, p. 376–402. 2007. HYNES, H. B. N. The biology of polluted waters. Liverpool: University Press. Liverpool, 1960. 202 p. KINNBERG, K.; KORSGAARD, B.; BJERREGAARD, P.; JESPERSEN, A. Effects of nonylphenol and 17h-estradiol on vitellogenin synthesis and testis morphology in male platyfish Xiphophorus maculatus. Journal of Experimental Biology, v. 203, p. 171– 181. 2000. LACORTE, S.; RALDÚA, D.; MARTÍNEZ, E.; NAVARRO, A.; DIEZ, S.; BAYONA, J. M.; BARCELÓ, D. Pilot survey of a broad range of priority pollutants in sediment and fish from the Ebro river basin (NE Spain). Environmental Pollution, v. 140, p. 471–482. 2006. LAVADO, R.; THIBAUT, R.; RALDÚA, D.; MARTÍN, R.; PORTE, C. First evidence of endocrine disruption in feral carp from the Ebro River. Toxicology and Applied Pharmacology, v. 196, p. 247–257. 2004. LAVADO, R.; UREÑA, R.; MARTIN-SKILTON, R.; TORREBLANCA, A.; DEL RAMO, J.; RALDÚA, D.; PORTE, C. The combined use of chemical and biochemical markers to assess water quality along the Ebro River. Environmental Pollution, v. 139, p. 330–339. 2006. MAURO, J. B. N; GUIMARAES, J. R. D.; HINTELMANN, H.; WATRAS, C. J.; HAACK, E. A.; COELHO-SOUZA, S. A. Mercury methylation in macrophytes, periphyton, and water — comparative studies with stable and radio-mercury additions. Analytical and Bioanalytical Chemistry, v. 374, p. 983–989. 2002. MONTAÑÉS, J. F. C.; RISEBOROUGH, R. W.; LAPPE, B. W.; MARIÑO, M. G.; ALBAIGÉS, J. Estimated inputs of organochlorines from the River Ebro into the Northwestern Mediterranean. Marine Pollution Bulletin, v. 21, p. 518– 523. 1990. NAVARRO, A., QUIRÓS, L.; CASADO, M.; FARIA, M.; CARRASCO, L.; BENEJAM, L.; BENITO, J.; DÍEZ, S.; RALDÚA, D.; BARATA, C.; BAYONA, J. M.; PIÑA, B. Physiological responses to mercury in feral carp populations inhabiting the low Ebro River (NE Spain), a historically contaminated site. Aquatic Toxicology, v. 93, p. 150–157. 2009. NAVARRO, A.; FARIA, M.; BARATA, C.; PIÑA, B. Transcriptional response of stress genes to metal exposure in zebra mussel larvae and adults. Environmental Pollution, v. 59, p. 100–107. 2011. NAVARRO, A.; BACARDIT, M.; CAPUTO, L.; PALAU, t.; ARMENGOL, J. Limnological characterization and flow patterns of a three-coupled reservoir system and their influence on Dreissena polymorpha populations and settlement during the stratification period. Lake and Reservoir Management, v. 22, p. 293–302. 2006a. NAVARRO, A.; TAULER, R.; LACORTE, S.; BARCELÓ, D. Chemometrical investigation of the presence and distribution of organochlorine and polyaromatic compounds in sediments of the Ebro River Basin. Analytical and Bioanalytical Chemistry, v. 385, p. 1020–1030. 2006b. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 30 Capítulo 1 ● Organismos como indicadores de la contaminación NAVARRO-ORTEGA A.; TAULER, R.; LACORTE, S.; BARCELÓ, D. Occurrence and transport of PAHs, pesticides and alkylphenols in sediment samples along the Ebro River Basin. Journal of Hydrology, v. 383, p. 5–17. 2010. NECULITA, C. M.; ZAGURY, G. J.; DESCHENES, L. Mercury speciation in highly contaminated soils from chloralkali plants using chemical extractions. Journal of Environmental Quality, v. 34, p. 255–262. 2005. OLIVARES, A.; QUIRÓS, L.; PELAYO, S.; NAVARRO, A.; BOSCH, C.; GRIMALT, J. O.; FABREGAT, M. D. C.; FARIA, M.; BENEJAM, L.; BENITO, J.; SOLÉ, M.; BARATA, C.; PIÑA, B. Integrated biological and chemical analysis of organochlorine compound pollution and of its biological effects in a riverine system downstream the discharge point. Science of the Total Environment, v. 408, p. 5592–5599. 2010. PEREIRA A. F.; RODRIGUES, J. M. L.; BARATA, C.; RIVA, C.; NUGEGODA, D.; Soares, A. M. V. M. The use of Daphnia magna immobilization tests and soil microcosms to evaluate the toxicity of dredged sediments. Journal of Soils and Sediments, v. 11, p. 373–381. 2011. QUIRÓS L.; PIÑA, B.; SOLÉ, M.; BLASCO, J.; LÓPEZ, M. A.; RIVA, M. C.; BARCELÓ, D.; RALDÚA, D. Environmental monitoring by gene expression biomarkers in Barbus graellsii: Laboratory and field studies. Chemosphere, v. 67, p. 1144–1154. 2007. QUIRÓS, L.; RUIZ, X.; SANPERA, C.; JOVER, L.; PIÑA, B. Analysis of micronucleated erythrocytes in heron nestlings from reference and impacted sites in the Ebro basin (N.E. Spain). Environmental Pollution, v. 155, p. 81–87. 2008. RAINBOW, P. S. Trace metal concentrations in aquatic invertebrates: why and so what? Environmental Pollution, v. 120, p. 497–507. 2002. REGOLI, F.; PRINCIPATO, G. Glutathione, glutathione-dependent and antioxidant enzymes in mussel, Mytilus galloprovincialis exposed to metals under field and laboratory conditions: Implications for the use of biochemical biomarkers. Aquatic Toxicology, v. 31, p. 143–164. 1995. RESH, V. H. Which group is best? Attributes of different biological assemblages used in freshwater biomonitoring programs. Environmental Monitoring and Assessment, v. 138, p. 131–138. 2008. RICHERT, J. C.; SNEDDON, J. Determination of heavy metals in crawfish (Procambrus clarkii) by inductively coupled plasma–optical emission spectrometry: A Study over the season in Southwest Louisiana. Analytical Letters, v. 41, p. 3198–3209. 2008. RICHMAN, L.; SOMERS, K. Can we use zebra and quagga mussels for biomonitoring contaminants in the Niagara River? Water, Air and Soil Pollution, v. 167, p. 155–178. 2005. RIVA, C.; BINELLI, A.; PROVINI, A. Evaluation of several priority pollutants in zebra mussels (Dreissena polymorpha) in the largest Italian subalpine lakes. Environmental Pollution, v. 151, p. 652–662. 2008. ROUSSEL, H.; JOACHIM, S.; LAMOTHE, S.; PALLUEL, O.; GAUTHIER, L.; BONZOM, J. M. A long-term copper exposure on freshwater ecosystem using lotic mesocosms: Individual and population responses of three-spined sticklebacks (Gasterosteus aculeatus). Aquatic Toxicology, v. 82, p. 272–280. 2007. SÁNCHEZ-LÓPEZ F. J.; GIL-GARCÍA, M. M.; MARTÍNEZ-VIDAL, J. L.; AGUILERA, P. A.; GARRIDO FRENICH, A. Assessment of metal contamination in Doñana National Park (Spain) using crayfish (Procamburus clarkii). Environmental Monitoring and Assessment, v. 93, p. 17–29. 2004. SANDERS, R. E.; MILTNER, R. J.; YODER, C. O.; RANKIN, E. T. The use of external deformities, erosion, lesions, and tumors (DELT anomalies) in fish assemblages for characterizing aquatic resources: a case study of seven Ohio streams. In: SIMON, T. P. (Ed.). Assessing the sustainability and biological integrity of water resources using fish communities. Florida: CRC, 1999. p. 225–246. SATO, M.; KONDOH, M. Recent studies on metallothionein: protection against toxicity of heavy metals and oxygen free radicals. Tohoku Journal of Experimental Medicine, v. 196, p. 9–22. 2002. SECOR, C. L.; MILLS, E. L.; HARSHBARGER, J.; KUNTZ, H. T.; GTENMANN, W. H.; LISK, D. J. Bioaccumulationof toxicants, element andnutrient composition, and soft tissue histology of zebra mussels (Dreissena polymorpha) from New York State waters. Chemosphere, v. 26, p. 1559–1579. 1993. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 31 Capítulo 1 ● Organismos como indicadores de la contaminación SICILIANO, S. D.; O'DRISCOLL, N. J.; LEAN, R. D. Microbial reduction and oxidation of mercury in freshwater lakes. Environmental Science and Technology, v. 36, p. 3064–3068. 2002. SOTO, D. X.; ROIG, R.; GACIA, E.; CATALAN, J. Differential accumulation of mercury and other trace metals in the food web components of a reservoir impacted by a chlor-alkali plant (Flix, Ebro River, Spain): implications for biomonitoring. Environmental Pollution, v. 159, p. 1481–1489. 2011. SUÁREZ-SERANO, A.; ALACARAZ, C.; IBÁÑEZ, C.; TROBAJO, R.; BARATA, C. Procambarus clarkii as a bioindicator of heavy metal pollution sources in the lower Ebro River and Delta. Ecotoxicology and Environmental Safety, v. 73, p. 280–286. 2010. SWINDLEHURST, R. J.; JONHSTON, P. A.; TRIINDLE, S.; STRINGER, R. L.; STEPHENSON, A. D.; STONE, I. M. Regulation of toxic chemicals in the Mediterranean: the need for an adequate strategy. The Science of the Total Environment, v. 171, p. 243–264. 1995. VAN DER OOST, R.; PORTE-VISA, C.; VAN DEN BRINK, N. W. Biomarkers in environmental assessment. In: MUNAWAR, M.; DEN BESTEN, P. J. (Eds.). Ecotoxicological testing of marine and freshwater ecosystems. London: Taylor & Francis, 2005. p. 87-152. VAN DER OOST, R.; BEYER, J.; VERMEULEN, N. P. E. Fish bioaccumulation and biomarkers in environmental risk assessment: a review. Environmental Toxicology and Pharmacology, v. 13, p.57–149. 2003. VAN GESTEL, C. A. M.; VAN BRUMMELEN, T. C. Incorporation of the biomarker concept in ecotoxicology calls for a redefinition of terms. Ecotoxicology, v. 5, p. 217-225. 1996. VAN LEEUWEN, C. J.; VERMEIRE, T. G. (Eds). Risk assessment of chemicals: an introduction. 2nd ed. Dordrecht: Springer, 2007. 683 p. VERICAT, D.; BATALLA, R. J. Sediment transport in a highly regulated fluvial system during two consecutive floods (lower Ebro River, NE Iberian Peninsula). Earth Surface Processes and Landforms, v. 30, p. 385–402. 2005. VIOQUE-FERNÁNDEZ, A.; ALMEIDA, E. A.; BALLESTEROS, J.; GARCÍA-BARRERA, T.; GÓMEZ-ARIZA, J. L.; LÓPEZ-BAREA, J. Doñana National Park survey using crayfish (Procambarus clarkii) as bioindicator: esterase inhibition and pollutant levels. Toxicological Letters, v. 168, p. 260–268. 2007. VON DER OHE, P. C.; DE DECKERE, E.; PRÜß, A.; MUÑOZ, I.; WOLFRAM, G.; VILLAGRASA, M.; GINEBREDA, A.; HEIN, M.; BRACK, W. Toward an integrated assessment of the ecological and chemical status of European river basins. Integrated Environmental Assessment and Management, v. 5, p. 50–61. 2009. VOS, J. G.; DYBING, E.; GREIM, H. A.; LADEFOGED, O.; LAMBRE, C. C.; TARAZONA, J. V.; BRANDT, I.; VETHAAK, A. D. Health effects of endocrine-disrupting chemicals on wildlife, with special reference to the European situation. Critical Reviews in Toxicology, v. 30, p. 71–133. 2000. WHYTE, J. J.; JUNG, R. E.; SCHMITT, C. J.; TILLITT, D. E. Ethoxyresorufin-O-deethylase (EROD) activity in fish as a biomarker of chemical exposure. Critical Reviews in Toxicology, v. 30, p. 347–570. 2000. WORLD HEALTH ORGANIZATION (WHO). 2001. Environmental Health Criteria 222: biomarkers in risk assessment: validity and validation. Geneva: World Health Organization, 2001. ZALUPS, R. K. Molecular interactions with mercury in the kidney. Pharmacological Reviews, v. 52, p. 113–143. 2000. Pompêo et al. (Orgs.) Ecologia de reservatórios e interfaces, São Paulo : Instituto de Biociências da Universidade de São Paulo, 2015. 32