Notice: Undefined index
Anuncio

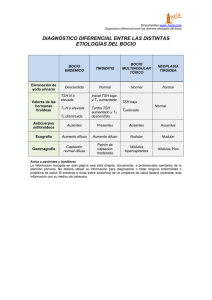
Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. REVISIÓN Posibilidades terapéuticas en la resistencia hipofisaria selectiva a las hormonas tiroideas 209.835 Pedro Iglesiasa y Juan José Díezb a Servicio de Endocrinología. Hospital General. Segovia. Servicio de Endocrinología. Hospital Ramón y Cajal. Madrid. España. b La resistencia hipofisaria selectiva a hormonas tiroideas (RHSHT) es una forma no neoplásica de secreción inadecuada de tirotropina (TSH). La causa de esta resistencia hormonal radica en la presencia de mutaciones inactivantes en el gen del receptor de las hormonas tiroideas (RHT) beta. Estas mutaciones afectan a la zona de unión de la triyodotironina (T3) al RHT. La RHSHT se manifiesta por hipertiroidismo con bocio difuso y ausencia de lesión hipofisaria en las pruebas de imagen. Los datos analíticos muestran elevación de T3 y tiroxina libres, sin supresión de TSH y con un cociente molar de la subunidad alfa de TSH/TSH normal. No se dispone de tratamiento específico para la RHSHT. Se han empleado los bloqueadores betaadrenérgicos, como el atenolol, y los ansiolíticos como tratamiento sintomático. Entre los fármacos con capacidad de reducir la secreción de TSH se encuentran los agonistas del RHT, como el ácido triyodoacético, la D-tiroxina, el ácido 3,5,3’-triyodotiropropiónico y la L-T3. Palabras clave: Hipertiroidismo central. Resistencia hipofisaria. Hormonas tiroideas. Secreción inapropiada de tirotropina.. Therapeutic possibilities in patients with selective pituitary resistance to thyroid hormones Selective pituitary resistance to thyroid hormones (SPRTH) is a nonneoplastic form of inappropriate secretion of thyrotropin (TSH). The etiology of this hormonal resistance is linked to inactivating mutations in the thyroid hormone receptor beta (TR-) gene. These mutations affect critical portions of the receptor’s triiodothyronine (T3)-binding domain. Clinically, SPRTH is characterized by hyperthyroidism with goiter and absence of pituitary mass in the morphologic study. Laboratory data show an elevation of free T3 and free thyroxine concentrations without suppression of TSH, with normal molar subunit alpha/TSH ratio. At this time, there is no specific therapy for SPRHT. Beta blockers, such as atenolol, and benzodiazepines have been used as a symptomatic therapy. Among the drugs with the capacity for reducing TSH secretion are TR agonists, such as triiodothyroacetic acid, D-thyroxine, triiodothyropropionic acid, and L-T3. Key words: Central hyperthyroidism. Pituitary resistance. Thyroid hormones. Inappropriate thyrotropin secretion. El hipertiroidismo central o secundario constituye una causa extremadamente infrecuente de tirotoxicosis. Se desarrolla como consecuencia de la secreción inapropiada de tirotropina (TSH) por la adenohipófisis y la consiguiente estimulación de la glándula tiroidea. La secreción inapropiada de TSH se caracteriza, desde el punto de vista bioquímico, por presentar concentraciones elevadas de tiroxina (T4) libre y triyodotironina (T3) libre, junto con concentraciones normales o elevadas de TSH. Se conocen 2 formas de secreción inapropiada de TSH asociadas a hipertiroidismo clínico: la forma neoplásica, que es la más frecuente (aproximadamente el 75% de los casos) y cuya causa es un adenoma hipofisario productor de TSH (TSHoma), y la forma no neoplásica, debida a resistencia hipofisaria selectiva a las hormonas tiroideas (RHSHT)1-7. Correspondencia: Dr. P. Iglesias. Servicio de Endocrinología. Hospital General. Ctra. de Ávila, s/n. 40002 Segovia. España. Correo electrónico: [email protected] Recibido el 25-5-2007; aceptado para su publicación el 24-7-2007. El diagnóstico diferencial de estas 2 entidades clínicas no siempre es fácil de establecer. En la RHSHT la respuesta de TSH a su hormona liberadora (TRH) es generalmente suprafisiológica, la subunidad alfa es normal y el cociente molar subunidad alfa/TSH es inferior a 1. Por el contrario, en el TSHoma la respuesta de TSH a TRH está reducida, la subunidad alfa está elevada, el cociente molar subunidad alfa/TSH es mayor de 1 y el estudio morfológico demuestra la presencia de una masa hipofisaria6. Mientras que el tratamiento de elección de la secreción inapropiada de TSH por adenoma hipofisario es la adenomectomía por vía transesfenoidal, en el momento actual no hay ningún tratamiento específico de la RHSHT. Hasta la fecha son múltiples las opciones terapéuticas que se han utilizado en la RHSHT con la finalidad de controlar los síntomas de tirotoxicosis6,8. Estos tratamientos están encaminados a reducir la resistencia a la acción inhibitoria de las hormonas tiroideas sobre la secreción de TSH en la célula tirotropa. Por ello, todos los fármacos que sean capaces de inhibir la secreción de la TSH endógena pueden considerarse una opción terapéutica válida en la RHSHT. En la presente revisión se analizan los aspectos más relevantes relacionados con la fisiología de la secreción de la TSH, el mecanismo de resistencia a la acción de las hormonas tiroideas en la RHSHT y las opciones terapéuticas de esta forma de secreción inapropiada de TSH actualmente disponibles. Regulación de la secreción de tirotropina La TSH es una hormona glucoproteica sintetizada y liberada por las células tirotropas adenohipofisarias, cuya secreción depende de factores estimuladores hipotalámicos, como la TRH, e inhibitorios tiroideos, como las hormonas tiroideas, fundamentalmente la T3 (fig. 1). Otros factores hipotalámicos, (–) TRH (–) TSH (+) RTHβ2 (+) Triac (±) RTHα1 (+) RTHβ1 T4, T3 Fig. 1. Efecto del ácido 3,5,3’-triyodotiroacético (Triac) en las isoformas del receptor de las hormonas tiroideas. T3: triyodotironina; T4: tiroxina; TRH: hormona liberadora de tirotropina; TSH: tirotropina. Med Clin (Barc). 2008;130(9):345-50 345 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. IGLESIAS P ET AL. POSIBILIDADES TERAPÉUTICAS EN LA RESISTENCIA HIPOFISARIA SELECTIVA A LAS HORMONAS TIROIDEAS como la somatostatina y la dopamina, también inhiben la secreción de la TSH9,10. Asimismo, el estado nutricional y la leptina influyen en la secreción de la TSH a través de su acción sobre las neuronas productoras de TRH9,10. El estrés también interviene de forma negativa sobre la secreción de TSH, probablemente a través de la acción de los glucocorticoides, citocinas y opioides10. Más recientemente se han descrito otros factores paracrinos que pueden actuar como inhibidores locales de la secreción de TSH, como son la neuromedina B, el péptido liberador de gastrina y la leptina hipotalámica10-13. Hormonas tiroideas Aunque la TRH es el estímulo más importante de la secreción de TSH9, el principal factor implicado en su regulación es el mecanismo de retroalimentación negativa que ejercen las hormonas tiroideas circulantes tanto en el hipotálamo como en la hipófisis10. Las hormonas tiroideas inhiben la expresión del ARN mensajero de TRH en los núcleos hipotalámicos14. En la hipófisis reducen la síntesis de TSH en la célula tirotropa, así como su respuesta a la TRH10,15. Las acciones de las hormonas tiroideas en la TSH se ejercen a través de su unión a receptores específicos nucleares (RHT). El RHT forma parte de un heterodímero que incluye el receptor del retinoide X y secuencias de ADN específicas (elemento de respuesta de la hormona tiroidea). La afinidad de la T3 por los RHT es 15 veces superior a la que presenta la T4. En la hipófisis la T3 procedente tanto de la circulación como de la desyodación del anillo externo de la T4 por acción de la desyodasa tipo 2 se une a la isoforma 2 del RHT (RHT-2)16. La interacción con el receptor da lugar a un cambio conformacional que provoca una disminución del proceso de transcripción del gen de la TSH. Somatostatina La somatostatina inhibe la secreción de TSH y aumenta el efecto inhibitorio de las hormonas tiroideas en la TSH17. La infusión de somatostatina atenúa el pico matutino de TSH y reduce los valores elevados de TSH en el hipotiroidismo primario18. Efectos similares se han descrito con los análogos de la somatostatina. La infusión continua subcutánea de lanreótida, análogo de la somatostatina, disminuye el incremento fisiológico nocturno de TSH en individuos sanos19. Se ha observado además que la administración aguda de acetato de octreotida (análogo de somatostatina de acción corta) en ratas regula el contenido intrahipofisario de las desyodasas y de la neuromedina B, un inhibidor autocrino de la secreción de TSH20. Estos mecanismos podrían intervenir en los efectos inhibitorios de la somatostatina sobre la secreción de TSH y la modulación de la sensibilidad de las células tirotropas a la acción de las hormonas tiroideas20. Dopamina La dopamina inhibe tanto la secreción basal de TSH como sus respuestas a la administración de TRH tanto en individuos sanos como en pacientes hipotiroideos21,22. Asimismo, los agonistas dopaminérgicos, como la bromocriptina, inhiben la secreción de TSH, mientras que los antagonistas dopaminérgicos, como la metoclopramida, estimulan su secreción tanto en individuos eutiroideos como en pacientes hipotiroideos21. Mecanismo de resistencia hipofisaria selectiva a las hormonas tiroideas El ADN de los RHT fue clonado y codificado hace más de 20 años26,27. Los RHT están codificados por 2 loci denominados alfa y beta, que se localizan en diferentes cromosomas, en concreto, en los cromosomas 3 y 17, respectivamente. Estos genes dan lugar a 3 isoformas del RHT: 1, 2 y ␣128. La localización anatómica de estos receptores es diferente. El RHT-␣1 se distribuye fundamentalmente en el sistema nervioso central, corazón y músculo esquelético. El RHT-1 se encuentra en el hígado y riñón, mientras que la isoforma 2 se halla fundamentalmente en la hipófisis y el hipotálamo28,29. La RHSHT se desarrolla como consecuencia de mutaciones puntuales inactivantes en el gen que codifica el RHT-30,31. Hasta la fecha no se han descrito mutaciones en el gen del RHT-␣1. Las mutaciones descritas aparecen en 3 bandas de gran actividad o «calientes» (hot spots) que corresponden a los exones 7, 8, 9 y 10 del RHT-. Estas mutaciones surgen en el dominio de unión al ligando del RHT y, por tanto, alteran la capacidad de unión de T3 con su receptor32. Todo ello conlleva una reducción de la capacidad inhibitoria de la T3 sobre el proceso de transcripción del ARN mensajero de la TSH. Aproximadamente el 15% de los pacientes con RHSHT no presentan mutaciones en el gen del RHT-6,33, por lo que se han considerado otras posibles mutaciones en diferentes localizaciones intranucleares relacionadas con el RHT, tal como se ha descrito en animales de experimentación34,35. Consideraciones clínicas de la resistencia hipofisaria selectiva a las hormonas tiroideas Desde la descripción inicial de la RHSHT por Gershengorn y Weintraub36 en 1975 se han descrito alrededor de 150 familias6. Aunque la mayoría de los casos (66%) de RHSHT corresponde a formas familiares, transmitidas con un patrón autosómico dominante, el 33% son esporádicos. Existe cierto predominio en el sexo femenino (2:1) y los individuos afectados pueden ser identificados a cualquier edad6,8,32. La diferente distribución de las isoformas del RHT puede explicar, al menos en parte, las características clínicas de la RHSHT. Las mutaciones que afectan al gen del RHT- se asocian a resistencia selectiva hipofisaria y hepática a las hormonas tiroideas, como lo demuestra la presencia de concentraciones séricas de TSH no suprimidas y valores normales de la proteína transportadora de esteroides sexuales6. Sin embargo, la ausencia de mutaciones en el RHT-␣ localizado preferentemente en el miocardio y, por tanto, una sensibilidad normal a la acción de las hormonas tiroideas pueden explicar la taquicardia y palpitaciones que con frecuencia se observan en los pacientes con RHSHT. Como resultado de la mutación del gen del RHT-, se reduce el tono inhibitorio de las hormonas tiroideas sobre la síntesis de TSH, se produce una estimulación continuada del tiroides por parte de la TSH y aparece hipertiroidismo secundario. La traducción clínica de estos fenómenos biológicos es un hipertiroidismo clínico, sin imagen en la resonancia magnética cerebral y con presencia de bocio difuso hipercaptante. Analíticamente es característica la elevación de las fracciones libres de T3 y T4, sin supresión de las concentraciones de TSH y con un cociente subunidad alfa/TSH normal5,6,37. Glucocorticoides Los glucocorticoides inhiben la secreción de TSH11. Los posibles mecanismos involucrados podrían ser una reducción de la expresión hipotalámica de TRH23, o bien el incremento del tono somatostatinérgico y dopaminérgico hipotalámico24,25. 346 Med Clin (Barc). 2008;130(9):345-50 Posibilidades terapéuticas en la resistencia hipofisaria selectiva a las hormonas tiroideas No se dispone de ningún tratamiento específico para la RHSHT. El tratamiento ideal debería ser aquel capaz de co- Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. IGLESIAS P ET AL. POSIBILIDADES TERAPÉUTICAS EN LA RESISTENCIA HIPOFISARIA SELECTIVA A LAS HORMONAS TIROIDEAS TABLA 1 Posibilidades terapéuticas en la resistencia hipofisaria selectiva a la acción de las hormonas tiroideas 1. Ansiolíticos 2. Bloqueadores beta 3. Fármacos que actúan en la hipófisis Análogos de hormonas tiroideas Ácido 3,5,3’-triyodotiroacético (Triac) Ácido 3,5,3’-triyodotiropropiónico (Triprop) D-tiroxina L-triyodotironina Agonistas dopaminérgicos Bromocriptina Quinagolida Cabergolina Análogos de somatostatina Octreotida Lanreótida 4. Tratamientos dirigidos al tiroides Fármacos antitiroideos Tratamientos ablativos Radioyodo Tiroidectomía Fármacos que actúan en la hipófisis Los fármacos que tienen la capacidad de actuar en la hipófisis mediante la inhibición o supresión de la secreción de TSH presentan un papel primordial en el control del hipertiroidismo central por RHSHT. Análogos de hormonas tiroideas. El mecanismo de acción de los análogos de hormonas tiroideas se basa en su acción inhibitoria potente y persistente sobre la secreción hipofisaria de TSH, con mínimos efectos sobre los receptores periféricos de las hormonas tiroideas. Por ello, hoy día muchos autores los consideran el tratamiento de elección de la RHSHT. Los principales análogos de las hormonas tiroideas se representan en la figura 2. rregir el defecto funcional que provoca la mutación responsable de la RHSHT. Por ello, el tratamiento inicial en estos pacientes debería ser el tratamiento sintomático y, en función de la respuesta, se podría optar por las diferentes posibilidades terapéuticas que se describen a continuación (tabla 1). Tratamiento sintomático En muchas ocasiones el tratamiento sintomático con bloqueadores beta y ansiolíticos ayuda a controlar adecuadamente a los pacientes con RHSHT. El atenolol es un fármaco muy eficaz para controlar la taquicardia y el temblor asociado al hipertiroidismo, sin afectar a la conversión de la T4 en T3, como lo hace el propranolol. Por tanto, este último no parece una buena opción como bloqueador beta, ya que, debido a su efecto sobre la desyodasa tipo 1, podría reducir el mecanismo de retroalimentación negativa induci- O CH2 CH Ácido triyodotiroacético. Algunos autores han considerado que el análogo de T3, el ácido triyodotiroacético (Triac), es el tratamiento de elección en los pacientes con RHSHT42-45 (fig. 2); sin embargo, se han comunicado casos en los que el tratamiento con Triac se ha mostrado parcialmente eficaz46,47 e incluso ineficaz48,49. Se ha demostrado que el Triac tiene la capacidad de inhibir la secreción de TSH basal y estimulada con TRH tanto en sujetos eutiroideos como en hipotiroideos50. Por otro lado, el Triac se une a los RHT con una mayor afinidad que la T351,52. En efecto, se ha comunicado que el Triac presenta una afinidad 3,5 y 1,5 veces mayor que la T3 para los receptores RHT-1 y RHT-␣1, respectivamente53. Sin embargo, su afinidad por los receptores RHT-1 normal y mutado es similar52. Esta mayor afinidad por el RHT- ha propiciado su empleo en los casos de RHSHT (fig. 1). Son varios los mecanismos de acción propuestos para el Triac en el tratamiento de la RHSHT52. Entre ellos se encuen- HO NH2 HO do por la T3 en el sistema nervioso central38. Los fármacos ansiolíticos como las benzodiacepinas pueden ayudar a controlar los síntomas de nerviosismo que a veces se asocian a la RHSHT39-41. Ácido 3,5,3’-triyodotiroacético (Triac) O NH2 HO NH2 O CH2 COOH COOH 3,5,3’,5’-tetrayodotironina (tiroxina, T4) HO CH2 O CH CH CH2 CH2 COOH D-tiroxina COOH 3,5,3’-triyodotironina (T3) CH2 HO O COOH Ácido 3,5,3’-triyodotiropropiónico (Triprop) Fig. 2. Estructura química de las hormonas tiroideas y sus análogos. Med Clin (Barc). 2008;130(9):345-50 347 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. IGLESIAS P ET AL. POSIBILIDADES TERAPÉUTICAS EN LA RESISTENCIA HIPOFISARIA SELECTIVA A LAS HORMONAS TIROIDEAS tran: a) hiperactivación de la función residual del RHT- normal; b) restauración de la función del RHT- mutado, y c) reducción del efecto dominante negativo del RHT- mutado. Independientemente del mecanismo implicado, el estímulo del RHT- en la hipófisis por parte del Triac simularía el mecanismo de retroalimentación inhibitoria de las hormonas tiroideas sobre la secreción de TSH, reduciendo de esta manera la secreción de TSH por la célula tirotropa y, por consiguiente, la hipersecreción de hormonas tiroideas por el tiroides. Se ha descrito además que el efecto del Triac sobre los marcadores que miden la acción de las hormonas tiroideas en los tejidos periféricos es relativamente pequeño41,44. Entre los mecanismos propuestos para explicar este efecto se encuentran: a) la compensación del efecto tiromimético del Triac sobre los RHT-␣ por la reducción de los valores circulantes de hormonas tiroideas; b) una degradación más rápida del Triac, y c) una afinidad similar o ligeramente superior del Triac por el RHT-␣ y a todas luces mayor por el RHT-1 que la T348,52,53. La administración de Triac en pacientes con RHSHT se acompaña tanto de la reducción del tamaño del bocio como del control clínico de algunos síntomas del hipertiroidismo, debido a la acción de las hormonas tiroideas sobre los tejidos periféricos8,44. Se ha descrito además la normalización de la respuesta de TSH a TRH a los 4 meses de haber iniciado el tratamiento con Triac. Asimismo, el Triac normaliza algunos parámetros bioquímicos que pueden servir como marcadores de la acción de las hormonas tiroideas, como el colesterol total y el colesterol unido a lipoproteínas de baja densidad44. El tratamiento con Triac también se ha mostrado eficaz en el control de los síntomas del hipertiroidismo durante la gestación; sin embargo, en estos casos hay que tener presente que, aunque el feto tenga el mismo defecto genético que la madre, las manifestaciones clínicas y bioquímicas de disfunción tiroidea no tienen por qué ser las mismas54. La dosis habitualmente empleada del Triac oscila entre 2,1 y 3,5 mg/día44,54. La reducción de la dosis a 1 mg/día se asocia a una pérdida de eficacia para controlar la hipersecreción de TSH y evitar el hipertiroidismo secundario44. La administración del Triac en varias dosis a lo largo del día parece que contribuye a aumentar el efecto supresor de la secreción de TSH endógena55. La tolerancia es generalmente buena y puede administrarse a largo plazo43-45. D-tiroxina. La D-tiroxina (D-T4) presenta una acción inhibitoria sobre la secreción de TSH basal y estimulada con TRH tanto en sujetos eutiroideos como en pacientes hipotiroideos56. Para algunos autores este efecto es incluso superior al de la propia levotiroxina57. Se ha considerado que la D-T4 reproduce los efectos hipofisarios y hepáticos de la levotiroxina sin afectar significativamente a la función cardíaca49. Por estos motivos también se ha considerado la D-T4 una opción terapéutica en el manejo de la RHSHT. La administración de D-T4 a 3 pacientes con RHSHT que no habían respondido a antitiroideos y bromocriptina consiguió controlar adecuadamente los síntomas de hipertiroidismo y normalizar las concentraciones séricas de TSH al mes de haber iniciado el tratamiento58. En uno de los casos la normalización de la TSH se consiguió a la semana de haber comenzado el tratamiento. El tratamiento con D-T4 se ha mostrado eficaz en el control a largo plazo (24 meses) de la concentración sérica de TSH, incluso en algún caso de fracaso del tratamiento combinado con Triac y antitiroideos. En un niño de 15 meses el tratamiento con D-T4 en monoterapia se acompañó de la normalización de los valores séricos de TSH y de la respuesta de TSH a TRH. Asimismo, este tratamiento consiguió un estado de eutiroidismo duran- 348 Med Clin (Barc). 2008;130(9):345-50 te 24 meses, con recurrencia del hipertiroidismo tras la retirada del fármaco durante un mes49. Además, se han descrito casos aislados que han mostrado la eficacia terapéutica de la D-T4 a largo plazo. El tratamiento con D-T4 durante 10 años consiguió controlar adecuadamente los valores de TSH, normalizar la concentración de hormonas tiroideas circulantes y evitar el desarrollo de bocio en una niña de 10 años con RHSHT59. Sin embargo, también se han comunicado casos en los que la D-T4 no se ha mostrado eficaz46,60. La dosis habitualmente empleada ha sido de 2-5 mg/día por vía oral49,58. La tolerancia a D-T4 ha sido buena, incluso a la dosis más elevada49. Otros compuestos. En otros casos aislados de pacientes con RHSHT se ha obtenido un control adecuado con otros análogos de hormonas tiroideas e incluso con hormonas tiroideas. El ácido 3,5,3’-triyodotiropropiónico tiene una afinidad por el RHT-1 1,8 veces mayor que la T352. La L-triyodotironina se ha mostrado eficaz en la RHSHT, si bien presenta un efecto limitado debido a que su vida media es corta43,61,62. Además, se ha descrito una escasa tolerancia43. Es posible que el desarrollo de nuevos agonistas y antagonistas de los diferentes receptores de las hormonas tiroideas contribuya a controlar adecuadamente la mayor parte de los pacientes con RHSHT. Análogos de somatostatina. La presencia de receptores de la somatostatina en las células de los TSHoma ha propiciado la utilización de los análogos de somatostatina en el tratamiento de la forma neoplásica de la secreción inapropiada de TSH. La utilización de estos análogos (octreotida y lanreótida) se ha mostrado eficaz para reducir la TSH en más del 90% de los casos de adenoma hipofisario, con la consecuente normalización de las concentraciones de hormonas tiroideas circulantes63-70. Los análogos de somatostatina son de utilidad limitada en la RHSHT debido a que no son capaces de suprimir de forma mantenida la secreción de TSH66,71 e incluso pueden acompañarse de una elevación paradójica de TSH8. La administración aguda de análogos de somatostatina de acción corta (octreotida) provoca una reducción de las concentraciones séricas de TSH tanto en TSHoma como en RHSHT66,72. Esto probablemente se debe a un efecto inhibitorio directo sobre la secreción de la célula tirotropa. Sin embargo, la respuesta inhibitoria sobre la secreción de TSH tras la administración durante 2 meses de análogos de somatostatina de acción prolongada (octreotida-LAR) persiste en los adenomas pero desaparece en RHSHT71. Este hallazgo ha hecho incluso que se contemple este patrón de respuesta como una herramienta útil en el diagnóstico diferencial del hipertiroidismo central de etiología no claramente definida71. Agonistas dopaminérgicos. Los agonistas dopaminérgicos como la bromocriptina se han mostrado eficaces en el tratamiento de algunos pacientes con adenoma hipofisario, si bien no son capaces de suprimir de forma persistente la secreción de TSH en la mayoría de los pacientes63,73,74. La respuesta terapéutica a estos agentes en lo referente al control de la secreción de TSH es pobre y generalmente transitoria en los pacientes con RHSHT42,43,45,75,76. En otros casos la respuesta de la TSH a la bromocriptina ha sido nula después de varios meses de tratamiento45,58,62 e incluso paradójica75. Sin embargo, también se ha descrito algún caso en el que la efectividad de la bromocriptina fue mayor que la del Triac47. La administración de pergolida, derivado ergotamínico de acción prolongada, se ha mostrado eficaz en algunos casos Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. IGLESIAS P ET AL. POSIBILIDADES TERAPÉUTICAS EN LA RESISTENCIA HIPOFISARIA SELECTIVA A LAS HORMONAS TIROIDEAS de hipertiroidismo por secreción inapropiada de TSH para reducir la concentración sérica de TSH y su respuesta a la TRH; sin embargo, no ha sido capaz de normalizar la concentración de hormonas tiroideas circulantes75. En 2001 se describió por primera vez la capacidad de la quinagolida (CV 205-502), agonista dopaminérgico no ergotamínico de acción prolongada, que actúa selectivamente en los receptores D2, para normalizar las concentraciones séricas de hormonas tiroideas a largo plazo en una paciente con RHSHT77. La cabergolina, agonista dopaminérgico ergotamínico de larga duración con elevada afinidad por los receptores D2, se ha utilizado con éxito en algunos casos de tumores hipofisarios mixtos productores de TSH y prolactina78. Sin embargo, su empleo junto a metimazol no ha sido capaz de controlar el hipertiroidismo por RHSHT en un paciente79. El papel terapéutico de otros agonistas dopaminérgicos como la pergolida, lisurida y tergurida está por determinar. Otras posibilidades terapéuticas. Aunque se conoce claramente la capacidad que tienen los glucocorticoides de suprimir la secreción de TSH23-25,80-82, este efecto suele producirse con dosis elevadas, lo que lleva asociada la aparición de efectos adversos. Los agonistas del receptor del retinoide X, como el bexaroteno, son capaces de reducir los valores séricos de TSH y causar hipotiroidismo central83. Esta capacidad para reducir la secreción de TSH ha hecho que se haya propuesto como un fármaco con posibilidades terapéuticas en el tratamiento del síndrome de la secreción inapropiada de TSH84. Hasta el momento se desconoce el posible papel terapéutico de estos compuestos en la RHSHT. Una importante limitación relacionada con su empleo sería la hiperlipemia asociada39. Tratamiento dirigido al tiroides Aunque el hipertiroidismo clínico y bioquímico puede controlarse fácilmente con fármacos antitiroideos, radioyodo y/o cirugía tiroidea, estos procedimientos terapéuticos son incapaces por sí mismos de corregir las concentraciones elevadas de TSH en los pacientes con RHSHT. Los fármacos antitiroideos pueden controlar adecuadamente las concentraciones de hormonas tiroideas en algunos casos; sin embargo, esto suele acompañarse de un incremento de la concentración de TSH y del tamaño del bocio42,49. En los pacientes en los que no se haya diagnosticado adecuadamente la RHSHT y se haya llevado a cabo un tratamiento ablativo frente al tiroides (radioyodo y/o cirugía tiroidea) puede ser necesario el empleo de dosis elevadas de levotiroxina como tratamiento hormonal sustitutivo. La elevación crónica y mantenida de las concentraciones de TSH podría aumentar la probabilidad de la aparición de hiperplasia o adenoma de las células tirotropas8,43. Conclusiones La RHSHT es una forma rara de hipertiroidismo secundario a secreción inadecuada de TSH debida a una mutación inactivante del RHT-. Las consecuencias clínicas de esta resistencia selectiva son un hipertiroidismo sintomático acompañado de bocio difuso y elevación de hormonas tiroideas circulantes, pero carente de supresión de las concentraciones de TSH, como ocurre en el hipertiroidismo primario, y de anomalías morfológicas hipofisarias, como sucede en los casos de TSHoma. No se dispone de tratamiento específico para esta anomalía hormonal. Los procedimientos que actúan sobre el tiroides no modifican la hipersecreción anómala de TSH. Los datos de investigación clínica analizados en esta revisión ponen de manifiesto que los agentes más eficaces para el tratamiento de estos pacientes son los análogos de hormonas tiroideas, como el Triac, del que se dispone de una experiencia más amplia, y la D-T4. No se dispone de evidencia científica suficiente que avale el empleo de otros agentes con capacidad para disminuir la secreción hipofisaria de TSH en estos pacientes. REFERENCIAS BIBLIOGRÁFICAS 1. Wynne AG, Gharib H, Scheithauer BW, Davis DH, Freeman SL, Horvath E. Hyperthyroidism due to inappropriate secretion of thyrotropin in 10 patients. Am J Med. 1992;92:15-24. 2. Refetoff S. Resistance to thyroid hormone: an historical overview. Thyroid. 1994;4:345-9. 3. Refetoff S. Resistance to thyroid hormone. Curr Ther Endocrinol Metab. 1997;6:132-4. 4. Refetoff S. Resistance to thyrotropin. J Endocrinol Invest. 2003;26:770-9. 5. Beck-Peccoz P, Forloni F, Cortelazzi D, Persani L, Papandreou MJ, Asteria C, et al. Pituitary resistance to thyroid hormones. Horm Res. 1992; 38:66-72. 6. Beck-Peccoz P, Persani L, Calebiro D, Bonomi M, Mannavola D, Campi I. Syndromes of hormone resistance in the hypothalamic-pituitary-thyroid axis. Best Pract Res Clin Endocrinol Metab. 2006;20:529-46. 7. McDermott MT, Ridgway EC. Thyroid hormone resistance syndromes. Am J Med. 1993;94:424-32. 8. Olateju TO, Vanderpump MP. Thyroid hormone resistance. Ann Clin Biochem. 2006;43:431-40. 9. Reichlin S. TRH: historical aspects. Ann N Y Acad Sci. 1989;553:1-6. 10. Morley JE. Neuroendocrine control of thyrotropin secretion. Endocr Rev. 1981;2:396-436. 11. Moura EG, Moura CC. Regulation of thyrotropin synthesis and secretion. Arq Bras Endocrinol Metabol. 2004;48:40-52. 12. Brabant G, Ocran K, Ranft U, Von zur MA, Hesch RD. Physiological regulation of thyrotropin. Biochimie. 1989;71:293-301. 13. DeRuyter H, Burman KD, Wartofsky L, Smallridge RC. Thyrotropin secretion in starved rats is enhanced by somatostatin antiserum. Horm Metab Res. 1984;16:92-6. 14. Fliers E, Alkemade A, Wiersinga WM, Swaab DF. Hypothalamic thyroid hormone feedback in health and disease. Prog Brain Res. 2006;153: 189-207. 15. Snyder PJ, Utiger RD. Inhibition of thyrotropin response to thyrotropinreleasing hormone by small quantities of thyroid hormones. J Clin Invest. 1972;51:2077-84. 16. Abel ED, Kaulbach HC, Campos-Barros A, Ahima RS, Boers ME, Hashimoto K, et al. Novel insight from transgenic mice into thyroid hormone resistance and the regulation of thyrotropin. J Clin Invest. 1999;103: 271-9. 17. Woodmansee WW, Gordon DF, Dowding JM, Stolz B, Lloyd RV, James RA, et al. The effect of thyroid hormone and a long-acting somatostatin analogue on TtT-97 murine thyrotropic tumors. Thyroid. 2000;10:533-41. 18. De Rosa G, Corsello SM, Della Casa S, De Rosa E, Raimondo S. Effect of somatostatin on the pituitary-thyroid axis. Ann Endocrinol (Paris). 1983;44:355-60. 19. Sassolas G, Khalfallah Y, Chayvialle JA, Cohen R, Merabet S, Casez JP, et al. Effects of the somatostatin analog BIM 23014 on the secretion of growth hormone, thyrotropin, and digestive peptides in normal men. J Clin Endocrinol Metab. 1989;68:239-46. 20. Curty FH, Lisboa PC, Ortiga-Carvalho TM, Pazos-Moura CC. The somatostatin analogue octreotide modulates Iodothyronine deiodinase activity and pituitary neuromedin B. Thyroid. 2000;10:647-52. 21. Reddy S, Bhansali A, Sialy R, Masoodi S, Dutta P, Bhadada S, et al. Dopaminergic influence on thyrotropin secretion in primary hypothyroidism. Horm Metab Res. 2005;37:286-9. 22. Ridgway EC, Greenspan S, Shupnik M. Hypothalamic regulation of thyrotropin biosynthesis and secretion. Horm Metab Res. 1987;17 Suppl: 78-82. 23. Alkemade A, Unmehopa UA, Wiersinga WM, Swaab DF, Fliers E. Glucocorticoids decrease thyrotropin-releasing hormone messenger ribonucleic acid expression in the paraventricular nucleus of the human hypothalamus. J Clin Endocrinol Metab. 2005;90:323-7. 24. Coiro V, Volpi R, Cataldo S, Capretti L, Caffarri G, Pilla S, et al. Dopaminergic and cholinergic involvement in the inhibitory effect of dexamethasone on the TSH response to TRH. J Investig Med. 2000;48:133-6. 25. Coiro V, Volpi R, Capretti L, Speroni G, Pilla S, Cataldo S, et al. Effect of dexamethasone on TSH secretion induced by TRH in human obesity. J Investig Med. 2001;49:330-4. 26. Sap J, Muñoz A, Damm K, Goldberg Y, Ghysdael J, Leutz A, et al. The cerb-A protein is a high-affinity receptor for thyroid hormone. Nature. 1986;324:635-40. 27. Weinberger C, Thompson CC, Ong ES, Lebo R, Gruol DJ, Evans RM. The c-erb-A gene encodes a thyroid hormone receptor. Nature. 1986;324: 641-6. Med Clin (Barc). 2008;130(9):345-50 349 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. IGLESIAS P ET AL. POSIBILIDADES TERAPÉUTICAS EN LA RESISTENCIA HIPOFISARIA SELECTIVA A LAS HORMONAS TIROIDEAS 28. Lazar MA. Thyroid hormone receptors: multiple forms, multiple possibilities. Endocr Rev. 1993;14:184-93. 29. Yen PM. Molecular basis of resistance to thyroid hormone. Trends Endocrinol Metab. 2003;14:327-33. 30. Refetoff S, Weiss RE, Usala SJ. The syndromes of resistance to thyroid hormone. Endocr Rev. 1993;14:348-99. 31. Adams M, Matthews C, Collingwood TN, Tone Y, Beck-Peccoz P, Chatterjee KK. Genetic analysis of 29 kindreds with generalized and pituitary resistance to thyroid hormone. Identification of thirteen novel mutations in the thyroid hormone receptor beta gene. J Clin Invest. 1994;94: 506-15. 32. McDermott MT, Ridgway EC. Central hyperthyroidism. Endocrinol Metab Clin North Am 1998;27:187-203. 33. McDermott JH, Agha A, McMahon M, Gasparro D, Moeller L, Dumitrescu AM, et al. A case of resistance to thyroid hormone without mutation in the thyroid hormone receptor beta. Ir J Med Sci. 2005;174:60-4. 34. Weiss RE, Xu J, Ning G, Pohlenz J, O’Malley BW, Refetoff S. Mice deficient in the steroid receptor co-activator 1 (SRC-1) are resistant to thyroid hormone. EMBO J. 1999;18:1900-4. 35. Brown NS, Smart A, Sharma V, Brinkmeier ML, Greenlee L, Camper SA, et al. Thyroid hormone resistance and increased metabolic rate in the RXR-gamma-deficient mouse. J Clin Invest. 2000;106:73-9. 36. Gershengorn MC, Weintraub BD. Thyrotropin-induced hyperthyroidism caused by selective pituitary resistance to thyroid hormone. A new syndrome of «inappropriate secretion of TSH». J Clin Invest. 1975;56:633-42. 37. Beck-Peccoz P, Mannavola D, Persani L. Syndromes of thyroid hormone resistance. Ann Endocrinol (Paris). 2005;66:264-9. 38. Perrild H, Hansen JJ, Skovsted L, Christensen LK. Different effects of propranolol, alprenolol, sotalol, atenolol and metoprolol on serum T3 and serum rT3 in hyperthyroidism. Clin Endocrinol (Oxf). 1983;18:139-42. 39. Weiss RE, Refetoff S. Resistance to thyroid hormone. Rev Endocr Metab Disord. 2000;1:97-108. 40. Weiss RE, Refetoff S. Thyroid hormone resistance. Annu Rev Med. 1992;43:363-75. 41. Weiss RE, Refetoff S. Treatment of resistance to thyroid hormone – primum non nocere. J Clin Endocrinol Metab. 1999;84:401-4. 42. Faglia G, Beck-Peccoz P, Piscitelli G, Medri G. Inappropriate secretion of thyrotropin by the pituitary. Horm Res. 1987;26:79-99. 43. Salmela PI, Wide L, Juustila H, Ruokonen A. Effects of thyroid hormones (T4, T3), bromocriptine and Triac on inappropriate TSH hypersecretion. Clin Endocrinol (Oxf). 1988;28:497-507. 44. Beck-Peccoz P, Piscitelli G, Cattaneo MG, Faglia G. Successful treatment of hyperthyroidism due to nonneoplastic pituitary TSH hypersecretion with 3,5,3’-triiodothyroactic acid (TRIAC). J Endocrinol Invest. 1983; 6:217-23. 45. Crino A, Borrelli P, Salvatori R, Cortelazzi D, Roncoroni R, Beck-Peccoz P. Anti-iodothyronine autoantibodies in a girl with hyperthyroidism due to pituitary resistance to thyroid hormones. J Endocrinol Invest. 1992;15: 113-20. 46. Aguilar DM, Escobar-Jiménez L, Fernández Soto ML, García CA, Escobar-Jiménez F. Hyperthyroidism due to familial pituitary resistance to thyroid hormone: successful control with 3, 5, 3’ triiodothyroacetic associated to propranolol. J Endocrinol Invest. 1991;14:663-8. 47. Dulgeroff AJ, Geffner ME, Koyal SN, Wong M, Hershman JM. Bromocriptine and Triac therapy for hyperthyroidism due to pituitary resistance to thyroid hormone. J Clin Endocrinol Metab. 1992;75:1071-5. 48. Kunitake JM, Hartman N, Henson LC, Lieberman J, Williams DE, Wong M, et al. 3,5,3’-triiodothyroacetic acid therapy for thyroid hormone resistance. J Clin Endocrinol Metab. 1989;69:461-6. 49 Hamon P, Bovier-Lapierre M, Robert M, Peynaud D, Pugeat M, Orgiazzi J. Hyperthyroidism due to selective pituitary resistance to thyroid hormones in a 15-month-old boy: efficacy of D-thyroxine therapy. J Clin Endocrinol Metab. 1988;67:1089-93. 50. Medeiros-Neto G, Kallas WG, Knobel M, Cavaliere H, Mattar E. Triac (3,5,3’-triiodothyroacetic acid) partially inhibits the thyrotropin response to synthetic thyrothropin-releasing hormone in normal and thyroidectomized hypothyroid patients. J Clin Endocrinol Metab. 1980;50:223-5. 51. Goslings B, Schwartz HL, Dillmann W, Surks MI, Oppenheimer JH. Comparison of the metabolism and distribution of L-T3 and Triac in the rat: a possible explanation of differential hormone potency. Endocrinology. 1976;98:666-75. 52. Takeda T, Suzuki S, Liu RT, DeGroot LJ. Triiodothyroacetic acid has unique potential for therapy of resistance to thyroid hormone. J Clin Endocrinol Metab. 1995;80:2033-40. 53. Schueler PA, Schwartz HL, Dillmann W, Surks MI, Oppenheimer JH. Binding of 3,5,3’-triiodothyronine (T3) and its analogs to the in vitro translational products of c-erb A protooncogenes: differences in the affinity of the ␣- and -forms for the acetic acid analog and failure of the human testis and kidney ␣-2 products to bind T3. Mol Endocrinol. 1990;4:227-34. 54. Asteria C, Rajanayagam O, Collingwood TN, Persani L, Romoli R, Mannavola D, et al. Prenatal diagnosis of thyroid hormone resistance. J Clin Endocrinol Metab. 1999;84:405-10. 55. Ueda S, Takamatsu J, Fukata S, Tanaka K, Shimizu N, Sakata S, et al. Differences in response of thyrotropin to 3,5,3’-triiodothyronine and 3,5,3’-triiodothyroacetic acid in patients with resistance to thyroid hormone. Thyroid. 1996;6:563-70. 56. Gless KH, Oster P, Hufner M. Influence of D-thyroxine on plasma thyroid hormone levels and TSH secretion. Horm Metab Res. 1977;9:69-73. 350 Med Clin (Barc). 2008;130(9):345-50 57. Gorman CA, Jiang NS, Ellsfson RD, Elveback LR. Comparative effectiveness of dextrothyroxine and levothyroxine in correcting hypothyroidism and lowering blood lipid levels in hypothyroid patients. J Clin Endocrinol Metab. 1979;49:1-7. 58. Dorey F, Strauch G, Gayno JP. Thyrotoxicosis due to pituitary resistance to thyroid hormones. Successful control with D thyroxine: a study in three patients. Clin Endocrinol (Oxf). 1990;32:221-8. 59. Krawczynska H, Wojcik-Musialek K, Llig R. 10 years of successful treatment with dextrothyroxine in a girl with TSH-induced hyperthyroidism. Horm Res. 1991;35:213-6. 60. Schwartz ID, Bercu BB. Dextrothyroxine in the treatment of generalized thyroid hormone resistance in a boy homozygous for a defect in the T3 receptor. Thyroid. 1992;2:15-9. 61. Rosler A, Litvin Y, Hage C, Gross J, Cerasi E. Familial hyperthyroidism due to inappropriate thyrotropin secretion successfully treated with triiodothyronine. J Clin Endocrinol Metab. 1982;54:76-82. 62. Magee B, Sheridan B, Scanlon MF, Atkinson AB. Inappropriate thyrotrophin secretion, increased dopaminergic tone and preservation of the diurnal rhythm in serum TSH. Clin Endocrinol (Oxf). 1986;24:209-15. 63. Beck-Peccoz P, Persani L. Medical management of thyrotropin-secreting pituitary adenomas. Pituitary. 2002;5:83-8. 64. Caron P, Arlot S, Bauters C, Chanson P, Kuhn JM, Pugeat M, et al. Efficacy of the long-acting octreotide formulation (octreotide-LAR) in patients with thyrotropin-secreting pituitary adenomas. J Clin Endocrinol Metab. 2001;86:2849-53. 65. Iglesias P, Díez JJ. Long-term preoperative management of thyrotropinsecreting pituitary adenoma with octreotide. J Endocrinol Invest. 1998;21:775-8. 66. Beck-Peccoz P, Mariotti S, Guillausseau PJ, Medri G, Piscitelli G, Bertoli A, et al. Treatment of hyperthyroidism due to inappropriate secretion of thyrotropin with the somatostatin analog SMS 201-995. J Clin Endocrinol Metab. 1989;68:208-14. 67. Shimatsu A, Murabe H, Kamoi K, Suzuki Y, Nakao K. Treatment of thyrotropin-secreting pituitary adenomas with octreotide. Endocr J. 1999; 46:113-23. 68. Gancel A, Vuillermet P, Legrand A, Catus F, Thomas F, Kuhn JM. Effects of a slow-release formulation of the new somatostatin analogue lanreotide in TSH-secreting pituitary adenomas. Clin Endocrinol. 1994;40:421-8. 69. Gorden P, Comi RJ, Maton PN, Go VL. NIH conference. Somatostatin and somatostatin analogue (SMS 201-995) in treatment of hormone-secreting tumors of the pituitary and gastrointestinal tract and non-neoplastic diseases of the gut. Ann Intern Med. 1989;110:35-50. 70. Comi RJ, Gesundheit N, Murray L, Gorden P, Weintraub BD. Response of thyrotropin-secreting pituitary adenomas to a long-acting somatostatin analogue. N Engl J Med. 1987;317:12-7. 71. Mannavola D, Persani L, Vannucchi G, Zanardelli M, Fugazzola L, Verga U, et al. Different responses to chronic somatostatin analogues in patients with central hyperthyroidism. Clin Endocrinol (Oxf). 2005;62:176-81. 72. Williams G, Kraenzlin M, Sandler L, Burrin J, Law A, Bloom S, et al. Hyperthyroidism due to non-tumoural inappropriate TSH secretion. Effect of a long-acting somatostatin analogue (SMS 201-995). Acta Endocrinol (Copenh). 1986;113:42-6. 73. Ivan G, Szigeti-Csucs N, Olah M, Nagy GM, Goth MI. Treatment of pituitary tumors: dopamine agonists. Endocrine. 2005;28:101-10. 74. Camacho P, Mazzone T. Thyrotropin-secreting pituitary adenoma responsive to bromocriptine therapy. Endocr Pract. 1999;5:257-60. 75. Sriwatanakul K, McCormick K, Woolf P. Thyrotropin (TSH)-induced hyperthyroidism: response of TSH to dopamine and its agonists. J Clin Endocrinol Metab. 1984;58:255-61. 76. Takamatsu J, Mozai T, Kuma K. Bromocriptine therapy for hyperthyroidism due to increased thyrotropin secretion. J Clin Endocrinol Metab. 1984;58:934-6. 77. De Luis DA, Lahera M, Botella MA, Valero C, Varela C. Eficacia de la quinagolida en el tratamiento de un paciente con resistencia hipofisaria a hormonas tiroideas. An Med Interna (Madrid). 2001;18:259-61. 78. Mulinda JR, Hasinski S, Rose LI. Successful therapy for a mixed thyrotropin-and prolactin-secreting pituitary macroadenoma with cabergoline. Endocr Pract 1999;5:76-9. 79. Rivolta CM, Mallea Gil MS, Ballarino C, Ridruejo MC, Miguel CM, Giménez SB, et al. A novel 1297-1304delGCCTGCCA mutation in the exon 10 of the thyroid hormone receptor beta gene causes resistance to thyroid hormone. Mol Diagn. 2004;8:163-9. 80. Samuels MH, McDaniel PA. Thyrotropin levels during hydrocortisone infusions that mimic fasting-induced cortisol elevations: a clinical research center study. J Clin Endocrinol Metab. 1997;82:3700-4. 81. Brabant A, Brabant G, Schuermeyer T, Ranft U, Schmidt FW, Hesch RD, et al. The role of glucocorticoids in the regulation of thyrotropin. Acta Endocrinol (Copenh). 1989;121:95-100. 82. Wilber JF, Utiger RD. The effect of glucocorticoids on thyrotropin secretion. J Clin Invest. 1969;48:2096-103. 83. Sherman SI, Gopal J, Haugen BR, Chiu AC, Whaley K, Nowlakha P, et al. Central hypothyroidism associated with retinoid X receptor-selective ligands. N Engl J Med. 1999;340:1075-9. 84. Golden WM, Weber KB, Hernández TL, Sherman SI, Woodmansee WW, Haugen BR. Single-dose rexinoid rapidly and specifically suppresses serum thyrotropin in normal subjects. J Clin Endocrinol Metab. 2007;92: 124-30.