EL ENLACE QUÍMICO: Un asunto de electrones INTRODUCCIÓN
Anuncio
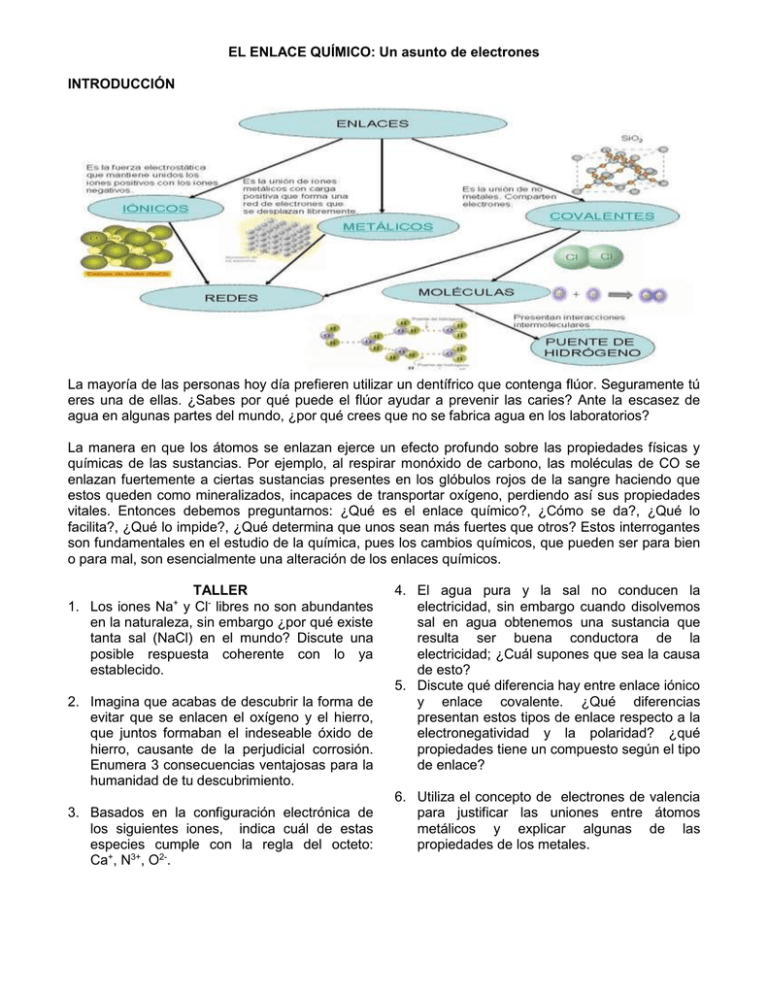
EL ENLACE QUÍMICO: Un asunto de electrones INTRODUCCIÓN La mayoría de las personas hoy día prefieren utilizar un dentífrico que contenga flúor. Seguramente tú eres una de ellas. ¿Sabes por qué puede el flúor ayudar a prevenir las caries? Ante la escasez de agua en algunas partes del mundo, ¿por qué crees que no se fabrica agua en los laboratorios? La manera en que los átomos se enlazan ejerce un efecto profundo sobre las propiedades físicas y químicas de las sustancias. Por ejemplo, al respirar monóxido de carbono, las moléculas de CO se enlazan fuertemente a ciertas sustancias presentes en los glóbulos rojos de la sangre haciendo que estos queden como mineralizados, incapaces de transportar oxígeno, perdiendo así sus propiedades vitales. Entonces debemos preguntarnos: ¿Qué es el enlace químico?, ¿Cómo se da?, ¿Qué lo facilita?, ¿Qué lo impide?, ¿Qué determina que unos sean más fuertes que otros? Estos interrogantes son fundamentales en el estudio de la química, pues los cambios químicos, que pueden ser para bien o para mal, son esencialmente una alteración de los enlaces químicos. TALLER 1. Los iones Na+ y Cl- libres no son abundantes en la naturaleza, sin embargo ¿por qué existe tanta sal (NaCl) en el mundo? Discute una posible respuesta coherente con lo ya establecido. 2. Imagina que acabas de descubrir la forma de evitar que se enlacen el oxígeno y el hierro, que juntos formaban el indeseable óxido de hierro, causante de la perjudicial corrosión. Enumera 3 consecuencias ventajosas para la humanidad de tu descubrimiento. 3. Basados en la configuración electrónica de los siguientes iones, indica cuál de estas especies cumple con la regla del octeto: Ca+, N3+, O2-. 4. El agua pura y la sal no conducen la electricidad, sin embargo cuando disolvemos sal en agua obtenemos una sustancia que resulta ser buena conductora de la electricidad; ¿Cuál supones que sea la causa de esto? 5. Discute qué diferencia hay entre enlace iónico y enlace covalente. ¿Qué diferencias presentan estos tipos de enlace respecto a la electronegatividad y la polaridad? ¿qué propiedades tiene un compuesto según el tipo de enlace? 6. Utiliza el concepto de electrones de valencia para justificar las uniones entre átomos metálicos y explicar algunas de las propiedades de los metales. 7. Consulta, ¿por qué se ha prohibido el uso de pinturas, crayones y otros materiales que contengan plomo en sus estructuras? 14. Haz una tabla comparativa con las características del enlace covalente y del enlace iónico teniendo en cuenta lo siguiente: 8. Explica la polaridad de los enlaces en la molécula de agua, H2O y en la de HCl a. ¿Cómo se forma? b. ¿Qué compuestos lo presentan? c. Propiedades de los compuestos con este tipo de enlace 9. El hidrógeno (H2), cloro (Cl2), oxígeno (O2) y nitrógeno (N2) existen en su estado libre como moléculas diatómicas. el dióxido de carbono (CO2) y para el ácido cianhídrico (HCN). Escribe la estructura de Lewis para cada molécula e identifica el tipo de enlace formado en cada caso y la cantidad de electrones compartidos. 10. Con la ayuda de la Tabla Periódica, completa el siguiente cuadro Sustancia Estructura de Lewis Al S2Ar H2S 15. Dos compuestos, A y B, tienen las siguientes propiedades: Estado físico Punto de fusión Solubilidad en agua Conductividad eléctrica en solución Compuesto Compuesto A B Sólido Sólido 346 ºC 1196 ºC Soluble Soluble No Sí ¿Cuál de los dos compuestos posiblemente iónico y por qué? será más 16. Con base en los valores de electronegatividad indicar si los siguientes pares de elementos forman enlaces iónicos o covalentes (polar o no polar) HClO H2CO3 11. A partir de la utilización del enlace covalente coordinado justifica las fórmulas de los siguientes compuestos: SO3 y H2SO4. 12. Además de las fuerzas que mantienen unidos los átomos en las moléculas, existen fuerzas que mantienen unidas las moléculas llamadas fuerzas intermoleculares Explica a qué se debe que existan sustancias en estado líquido, sólido o gaseoso. Cita ejemplos para cada caso. 13. Cuál es la relación de las fuerzas intermoleculares con propiedades físicas de los líquidos tales como solubilidad, viscosidad, tensión superficial, capilaridad, presión de vapor y punto de ebullición? N-H Ca-F Br-Cl O-P Cu-O S-O O-Na C-P H-S Ba-N O-H I-I Li-F C-S Cs-Br 17. Usando el concepto de valencia para los elementos S, P y Br predice las fórmulas de los compuestos más simples formados por estos elementos y el hidrógeno 18. Para los siguientes pares de elementos: a. Indica si es posible un enlace iónico entre ellos b. Representa o esquematiza sus átomos antes y después de formar el enlace iónico c. Representa la formación del enlace por medias las estructuras de punto electrón o estructura de Lewis. d. Determina la fórmula del compuesto que formarían K-N F-Zn F-Na Mg-O Cl-Br K-O K-Ca Cl-Ca Cl-O Na-Ca 19- A cada uno de los enunciados que se describen a continuación coloque V si es verdadero ó F si es falso. a- Los electrones llamados de valencia son aquellos situados en el último subnivel. ( ) b- Para que se forme un enlace químico siempre debe existir participación de electrones. ( ) c- Los compuestos formados entre los elementos del grupo IA y VIA son iónicos. ( ) d- El agua es un compuesto iónico. ( ) e- El carácter polar de un enlace es independiente de las electronegatividades de los átomos enlazados. ( ) g- Los enlaces iónicos son más polares que los covalentes. ( ) i- La molécula de N2 es no polar. ( ) j- En el HNO3 todos los enlaces son covalentes polares( ) k- El CS2 es un compuesto polar. ( ). 23.En la tabla siguiente se han recogido las propiedades características de tres sustancias sólidas (X, Y, Z) a la temperatura y presión ordinarias. Señala cuál de ellas puede considerarse un compuesto iónico, cuál un metal y cuál un compuesto covalente. Propiedad analizada Sustancia sólida a temperatura y presión ambiente X Y Z 808°C 80°C 1083°C Sí No No 20- Coloque al frente de cada compuesto de la izquierda, el número del enunciado de la derecha. Punto de fusión Solubilidad en agua Solubilidad en benceno Conductividad eléctrica en estado sólido Conductividad eléctrica en disolución o fundida Deformabilidad del sólido a. H2 b. CO2 c. N2 24. De los siguientes compuestos identifique cuales son iónicos y cuales covalentes polar y no polar ( ) ( ) ( ) 1. Enlace simple 2. Enlace doble 3. Enlace triple 21- Dos compuestos, A y B, tienen las siguientes propiedades: Compuesto A Compuesto B Estado físico Punto de fusión Solubilidad en agua Sólido 346 ºC Soluble Sólido 1196 ºC Soluble Conductividad eléctrica en solución No Sí CARACTERISTICA ¿Cuál de los dos compuestos posiblemente iónico y por qué? será más 22. Con base en los valores de electronegatividad indicar si los siguientes pares de elementos forman enlaces iónicos o covalentes (polar o no polar) N-H Ca-F Br-Cl O-P Cu-O S-O O-Na C-P H-S Ba-N O-H I-I Li-F C-S Cs-Br No Sí No No No Sí Sí No Sí Frágil Frágil Sí a. Fluoruro de Bario (BaF2)_______________ b. Cloruro de Potasio (KCl) ________________ c. Sulfuro de Litio (Li2S) __________________ d. O2____________________ e. Metano (CH4) ________________________ f. Oxido de aluminio (Al2O3) ________________ g. N2__________________________________ h. CO2_______________________________ I. C-P _____________________________ j. H-S _____________________________ k. P-O _____________________________ l. Ba-N _____________________________ m. O-H _____________________________ n. F-F _____________________________ o. Li-F _____________________________ Todos no somos muy ignorantes. Lo que ocurre es que no todos ignoramos las mismas cosas. Albert Einstein 1879-1955. Científico nacido en Alemania, nacionalizado estadounidense.