COMPUESTOS BINARIOS. Están formados por átomos de dos
Anuncio
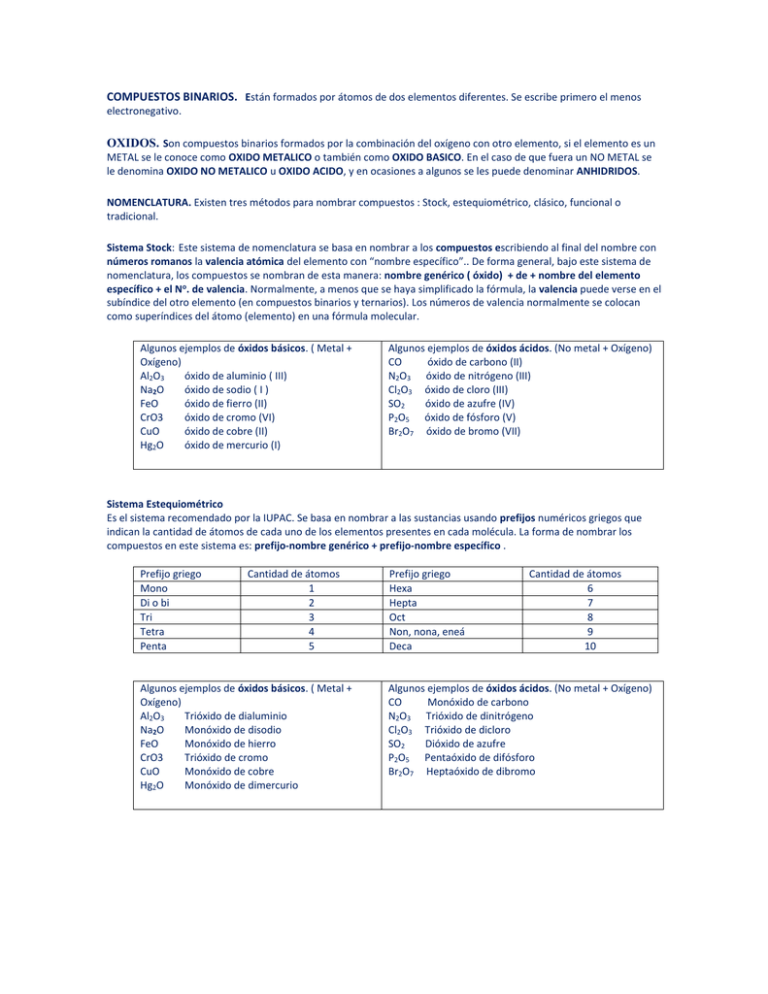
COMPUESTOS BINARIOS. Están formados por átomos de dos elementos diferentes. Se escribe primero el menos electronegativo. OXIDOS. Son compuestos binarios formados por la combinación del oxígeno con otro elemento, si el elemento es un METAL se le conoce como OXIDO METALICO o también como OXIDO BASICO. En el caso de que fuera un NO METAL se le denomina OXIDO NO METALICO u OXIDO ACIDO, y en ocasiones a algunos se les puede denominar ANHIDRIDOS. NOMENCLATURA. Existen tres métodos para nombrar compuestos : Stock, estequiométrico, clásico, funcional o tradicional. Sistema Stock: Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico”.. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico ( óxido) + de + nombre del elemento específico + el No. de valencia. Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular. Algunos ejemplos de óxidos básicos. ( Metal + Oxígeno) Al2O3 óxido de aluminio ( III) Na2O óxido de sodio ( I ) FeO óxido de fierro (II) CrO3 óxido de cromo (VI) CuO óxido de cobre (II) Hg2O óxido de mercurio (I) Algunos ejemplos de óxidos ácidos. (No metal + Oxígeno) CO óxido de carbono (II) N2O3 óxido de nitrógeno (III) Cl2O3 óxido de cloro (III) SO2 óxido de azufre (IV) P2O5 óxido de fósforo (V) Br2O7 óxido de bromo (VII) Sistema Estequiométrico Es el sistema recomendado por la IUPAC. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la cantidad de átomos de cada uno de los elementos presentes en cada molécula. La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico . Prefijo griego Mono Di o bi Tri Tetra Penta Cantidad de átomos 1 2 3 4 5 Algunos ejemplos de óxidos básicos. ( Metal + Oxígeno) Al2O3 Trióxido de dialuminio Na2O Monóxido de disodio FeO Monóxido de hierro CrO3 Trióxido de cromo CuO Monóxido de cobre Hg2O Monóxido de dimercurio Prefijo griego Hexa Hepta Oct Non, nona, eneá Deca Cantidad de átomos 6 7 8 9 10 Algunos ejemplos de óxidos ácidos. (No metal + Oxígeno) CO Monóxido de carbono N2O3 Trióxido de dinitrógeno Cl2O3 Trióxido de dicloro SO2 Dióxido de azufre P2O5 Pentaóxido de difósforo Br2O7 Heptaóxido de dibromo Nomenclatura tradicional, clásica o funcional En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son: Cuando el elemento sólo tiene una valencia, simplemente se coloca el nombre del elemento modificado por el sufijo –ico. K2O óxido potásico. Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico. … -oso cuando el elemento usa la valencia menor … -ico cuando el elemento usa la valencia mayor Cuando el elemento es metal y tiene más de dos números de oxidación, No Aplica este sistema. Cuando tiene más de dos valencias se usan los prefijos y sufijos.(Solamente para Anhídridos) hipo- … -oso (para las valencias 1 y 2) … -oso (para la valencias 3 y 4) … -ico (para la valencias 5 y 6) per- … -ico (para la valencia 7): Hay algunos elementos que al nombrarlos por este sistema debe modificarse la raíz debido a que su nombre se deriva del latín. Entre ellos están: Elemento Cobre ( Cu) Plata ( Ag) Azufre ( S) Nitrógeno ( N) Plomo ( Pb) Hierro ( Fe) Oro (Au) Raíz Cuprum Argentum Sulfurum Nitrium Plumbum Ferrum Aurum Algunos ejemplos de óxidos básicos. ( Metal + Oxígeno) Al2O3 óxido alumínico Na2O óxido sódico FeO óxido ferroso CrO3 No aplica CuO óxido cúprico Hg2O óxido mercurioso Nombre específico Cuproso o cúprico Argéntico Sulfuroso o sulfúrico Nitroso o nítrico Plumboso o plúmbico Ferroso o férrico Auroso o Aúrico Algunos ejemplos de anhídridos. (No metal + Oxígeno) CO2 Anhídrido carbónico N2O3 Anhídrido nitroso Cl2O3 Anhídrido cloroso SO Anhídrido hiposulfuroso P2O5 Anhídrido fosfórico Br2O7 Anhídrido perbrómico Peróxidos : Son compuestos diatómicos en donde participan el grupo peróxido y un metal. La fórmula general de los peróxidos es Metal + (O-1) 2-2. En el sistema tradicional se utiliza el nombre peróxido en lugar de óxido y se agrega el nombre del metal con las reglas generales para los óxidos en esta nomenclatura. En las nomenclaturas Stock y sistemática se nombran los compuestos con las mismas reglas generales para los óxidos. No todos los metales forman peróxidos y habitualmente lo hacen los del grupo 1A y 2A de la tabla periódica (alcalinos y alcalinotérreos). Metal + Grupo peróxido → Peróxido 2Li+1 + (O)2-2 → Li2(O)2 Compuesto Nomenc. Stock Nomenc. tradicional H2O2 peróxido de hidrógeno agua oxigenada CaO2 peróxido de calcio peróxido de calcio Hidruros: Son combinaciones binarias del hidrógeno con los metales, en las que el H tiene número de oxidación -1. Se nombran con las palabras “hidruro de” y el nombre del metal. El número de hidrógenos coincide con el número de oxidación del metal. Compuesto LiH CuH2 AlH3 Stock Hidruro de litio ( I ) Hidruro de cobre (II) Hidruro de aluminio (III) Estequiométrico Monohidruro de litio Dihidruro de cobre Trihidruro de aluminio Funcional Hidruro lítico Hidruro cúprico Hidruro alumínico Ácidos Binarios o hidrácidos. un ácido hidrácido o sencillamente hidrácido es un ácido que no contiene oxígeno, es un compuesto binario formado por hidrógeno (H) y un elemento no-metálico (X), un (halógeno) o (anfígeno). Compuesto HCl H2Se Stock Cloruro de hidrógeno Selenuro de hidrógeno Compuesto HCl (ac) H2 Se (ac) Funcional: solución acuosa Ácido clorhídrico Acido selenhídrico Usos del ácido clorhídrico: La mayoría del ácido clorhídrico producido se consume en la industria química pero tiene aplicaciones difundidas en limpieza, desinfección y tratamiento de aguas. Además se usa en la producción de vinilos y cauchos y en la refinación de metales. Sales binarias: Las sales binarias son compuestos que se forman por la unión de un elemento metálico con un elemento no metálico. Su fórmula general es: Mi Xj donde M es el elemento metálico, i es la valencia del no metal, X es el elemento no metálico y j es la valencia del metal. También pueden formarse sales con dos no metales, en este caso el más electronegativo es el que va a la derecha y a este se le modifica la terminación con el sufijo uro Nomenclatura de las sales binarias Para nombrar las sales binarias, se nombra primero el elemento no metálico añadiendo la terminación –uro, seguido por el elemento metálico. Compuesto LiF CuI2 AlBr3 Stock Fluoruro de litio ( I ) Yoduro de cobre (II) Bromuro de aluminio (III) Estequiométrico Monofluoruro de litio Diyoduro de cobre Tribromuro de aluminio Funcional Fluoruro lítico Yoduro cúprico Bromuro alumínico HOJA DE TRABAJO DE NOMENCLATURA DE BINARIOS Sistema de Stock Escriba el nombre de los siguientes compuestos: 1.Cu2O. 2. RhO 3. Co2 O3 4. NiO 5. PdO2 6. PtO 7. GaH3 8. BeH2 9. KH 10.TiH4 11.CrH6 12. ScH3 13. Mn2S7 14. Ba3N2 15. K3P 16. SCl6 17. AsI3 18. SrSe Escriba la fórmula de los siguientes compuestos: 1. Oxido de cobre (II) 2. Oxido de mercurio (I) 4. Oxido de oro (III) 5. Oxido de thorio (IV) 7. Hidruro de Hafnio(IV) 8. Hidruro de cadmio (II) 10. Fluoruro de calcio(II) 11. Sulfuro de cobalto (III) II. Sistema Estequiométrico : 1. Ni2O3 2. Br2O5 3. Oxido de plata (I) 6. Oxido de cadmio (II) 9. Hidruro de plomo(IV) 12. Selenuro de potasio (I) Escriba el nombre de los siguientes compuestos: 3. CeO2 4. GeO2 5. Bi2O3 6. As2O5 7. AgH 8. CuH2 9. MnH7 10. AlH3 11. RaH2 12. LiH 13. CrI6 14. Ir2Te3 15. AlP 16. Si Br4 17. CCl4 18. AsI3 Escriba la fórmula de los siguientes compuestos: 1. Trióxido de bicerio 2. Oxido de calcio 4. Monóxido de hierro 5. Trióxido de azufre 7. Bihidruro de bario 8. Pentahidruro de bismuto 10. Tetracloruro de renio 11. Pentacloruro de astatinio 3. Pentaóxido de biantimonio 6. Trióxido de bimanganeso 9. Trihidruro de aluminio 12. Pentafluoruro de nitrógeno III Sistema funcional, Tradicional o Clásico: Escriba el nombre de los siguientes compuestos: 1. HgO 2. Ag2O 3. Tl2O 4. Ti O2 5. Fr2 O 6. Na2O2 7. P2O3 8. Br2O3 9. TeO2 10.SO 11. SeO3 12.As2O5 13. PtTe2 14. Cd3P2 15. AlN 16. FeS 17. CuF 18. NaI Escriba la fórmula de los siguientes compuestos: 1. Oxido platinoso 2. Oxido niquélico 5. Anhídrido fosfórico 6. Anhídrido periódico 8. Anhídrido hipobromoso. 9. Hidruro áurico 12. Arsenuro cobáltico 13. Sulfuro bárico 3. Oxido auroso 7. Anhídrido cloroso 10. Hidruro plúmbico 14. Telururo alumínico 4. Oxido tálico 11. Hidruro bárico I. Sistema Tradicional o Clásico Escriba el nombre de los siguientes compuestos: 1. H2Te 2. HCl 3. HI Escriba la fórmula de los siguientes compuestos: 1. Acido selenhídrico 2. Selenuro de hidrógeno 4. H2S 5. HF 3. Acido bromhídrico



