Mecanismo de acción del Cloro para desinfectar El poder
Anuncio

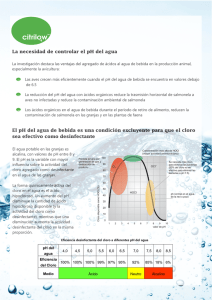
Mecanismo de acción del Cloro para desinfectar El poder desinfectante del cloro o sus compuestos radica en su capacidad de oxidación. En presencia de agua el cloro, bien sea en forma gaseosa (Cl2) o como hipoclorito (NaOCl), reacciona para dar ácido Hipocloroso (HOCl), la forma con mayor potencial de oxido-reducción y más activa como desinfectante, según las reacciones que se presentan. A pH 5 todo el cloro está en forma de Acido Hipocloroso, pero a medida que el pH aumenta éste ácido se disocia en: ClO- + H+ A pH> 7,5 y a una temperatura de 20ºC (o pH>7,8 a 0ªC de temperatura) empiezan a predominar los iones hipoclorito y éstos existen casi eclusivamente a partir de pH 9,5. Obviamente la cloración con cloro gas o hipoclorito es más efectiva a pH ácido. Cuando se añade al agua Cloro, en forma de gas, el valor inicial del pH del agua tiende a disminuir a la vez que se reduce la alcalinidad por neutralización. Por el contrario, cuando se adiciona cloro en forma de hipoclorito sódico o cálcico, el pH inicial del agua tiende a aumentar. No obstante éstas fluctuaciones de pH normalmente quedan amortiguadas por las sales contenidas en el agua responsables de su dureza (carbonatos y bicarbonatos de calcio y magnesio) por lo que las variaciones suelen ser mínimas en la práctica. En el agua, el cloro reacciona rápidamente con las sustancias inorgánicas reductoras del agua y algo más lentamente con las sustancias orgánicas susceptibles de ser oxidadas. Para actuar sobre el microorganismo, en el caso de las bacterias y los microorganisos eucariotas, el agente oxidante debe atravesar la membrana plasmática, que es de naturaleza fosfolipídica y oxidar enzimas respiratorios que contengan grupos sulfhidrilo (-SH). Las moléculas no polares se disuelven mejor en las membranas que las polares, así pues tendrá mayor poder bactericida el ácido hipocloroso que el ion hipoclorito. Una de las enzimas más afectadas es la succinato deshidrogenasa que interviene en el Ciclo de Krebs, cuando ésta enzima se afecta se frenan los mecanismos celulares de obtención de energía. En el caso de los virus parece ser que los agentes oxidantes actuan directamente produciendo oxidaciones sobre los ácidos nucleícos aunque los mecanismos íntimos no están bien estudiados. En resumen, la eficacia de la desinfección con cloro depende del, pH, de la temperatura, de la presencia de partículas en suspensión, dela composición química del agua, de la concentración del desinfectante y del tiempo de contacto. La capacidad de desinfección mejora al aumentar la temperatura, aunque el cloro es más inestable a altas temperaturas y el ácido hipocloroso se disocia algo más rápidamente. Para que la desinfección sea efectiva es necesario que exista un contacto íntimo entre el desinfectante y los microorganismos. Si los microorganismos están asociados a materia particulada, el contacto se dificulta. El tamaño de la partícula tiene una gran importancia en la asociación. Los restos celulares, heces o partículas sólidas comunes en aguas ejercen una protección significativa frente a microorganismos muy pequeños como los virus. El cloro reacciona con las sustancias reductoras (orgánicas o inorgánicas) del agua. Cuanto mayor sea la concentración de estas sustancias más cantidad de desinfectante será necesaria. Como se deduce de la ecuación general CT=K, le eficacia de la desinfección puede aumentarse bien aumentando la concentración del clorógeno o aumentando el tiempo de contacto. El tiempo mínimo de contacto suele ser de 30 minutos para asegurar la corrrecta desinfección de un agua común. Poder germicida de las distintas formas: Cl2 > HOCl > OCl- > NHCl2> NH2Cl > R-NHCl . .. . . . .